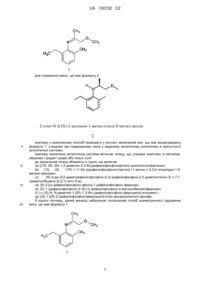
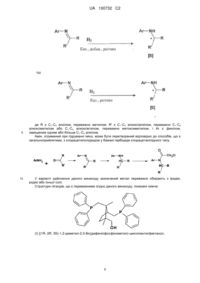
Гідрування імінів
Номер патенту: 100732
Опубліковано: 25.01.2013
Автори: Шрофф Вікам Раджнікант, Шанкер Бірджа, Шрофф Яідев Раджнікант
Формула / Реферат
1. Спосіб асиметричного гідрування іміну, що має формулу 1:
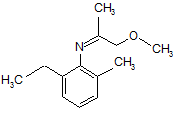 1
1
для одержання аміну, що має формулу 2:
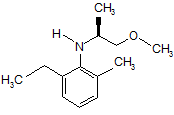 , 2
, 2
причому у зазначеному способі приводять у контакт зазначений імін з воднем при підвищеному тиску в органічному розчиннику в присутності каталітичної системи;
причому зазначена каталітична система включає ліганд, що утворює комплекс із металом, вибраним з іридію і родію або їхньої солі;
де зазначений ліганд вибирають із групи, що включає
a) [(1R,2R,3S)-1,2-диметил-2,3-біс(дифенілфосфінометил)-циклопентил]метанол;
b) (1S,4S,11R)-1,11-біс-[(дифенілфосфаніл)метил]-11-метил-1,2,3,4-тетрагідро-1,4-метанофеназин;
c) (R)-3-ди-(3,5-диметилфеніл)фосфіно-2-(4-дифенілфосфіно-2,5-диметилтієніл-3)-1,7,7-триметилбіцикло[2,2,1]гепт-2-ен;
d) (S)-2-[(о-дифенілфосфіно)феніл]-1-дифенілфосфінофероцен;
e) (S)-1-(дифенілфосфіно)-2-(S)-(о-дифенілфосфіно-α-метоксибензил)фероцен;
f) (+)-(S)-N,N-диметил-1-[(R)-1',2-біс-(дифенілфосфіно)фероценіл]-етиламін; і
g) [(S)-1-[(R)-2-дифенілфосфіно)фероценіл]-етилди(циклогексил)фосфін,
і одержаний амін, який має формулу 2, за необхідності піддають реакції з хлорацетилхлоридом у присутності основи в неполярному розчиннику при температурі від 0 °С до 5 °С для одержання сполуки, що має формулу 3
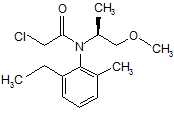 . 3
. 3
2. Спосіб за п. 1, де імін, що має формулу 1, одержують реакцією сполуки формули 4:
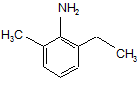 4
4
з метоксіацетоном, що має формулу СН3ОСН2С(О)СН3.
3. Спосіб за п. 1, де зазначений етап, на якому приводять у контакт зазначений імін з воднем при підвищеному тиску, проводять у присутності добавки, вибраної з групи, що включає діадамантилбутилфосфонію гідройодид (А), діадамантилбензилфосфонію гідробромід (В), трифенілфосфонію дийодид (С), ізопропілтрифенілфосфонію йодид (D), трифенілфосфонію дибромід (Е), метилтрифенілфосфонію бромід (F), тетрабутиламонію йодид (G), міді(ІІ) трифлат (Н) і ітербію(II) трифлат (І), трифенілфосфонію дихлорид (J).
4. Спосіб за п. 1, де зазначений етап, на якому приводять у контакт зазначений імін з воднем, проводять в інертному органічному розчиннику, вибраному з групи, що включає толуол, 1,4-діоксан, метанол, тетрагідрофуран, дихлорметан.
5. Спосіб за п. 1, де молярне відношення зазначеного іміну до зазначеної каталітичної системи складає від 200 до 500000.
6. Спосіб за п. 1, де зазначений етап, на якому приводять у контакт зазначений імін з воднем, проводять при температурі від 10 °С до 100 °С.
7. Спосіб за п. 2, де зазначений етап, на якому приводять у контакт зазначений імін з воднем, проводять при підвищеному тиску водню від 5 бар до 150 бар.
8. Спосіб за п. 1, де зазначений імін приводять у контакт із воднем при підвищеному тиску 80 бар при температурі 50 °С у толуолі в присутності каталітичної системи, що включає ліганд, що має формулу [(1R,2R,3S)-1,2-диметил-2,3-біс(дифенілфосфінметил)циклопентил]метанол, що утворює комплекс з металічним іридієм або його сіллю.
9. Спосіб за п. 1, за яким додатково проводять реакцію зазначеного аміну, що має формулу 2, з хлорацетилхлоридом у присутності основи в неполярному розчиннику.
10. Спосіб за п. 9, де імін, що має формулу 1, одержують реакцією сполуки формули 4:
 4
4
з метоксіацетоном, що має формулу СН3ОСН2С(О)СН3.
11. Спосіб за п. 8, де зазначений етап, на якому приводять у контакт зазначений імін з воднем, проводять у присутності добавки, де зазначена добавка є трифенілфосфонію дибромідом.
12. Спосіб за п. 8, де відношення субстрат:каталізатор, тобто зазначеного іміну до зазначеної каталітичної системи, досягає 500000.
Текст
Реферат: Даний винахід стосується способу асиметричного гідрування імінів воднем при підвищеному тиску в присутності каталітичної системи. Зокрема, даний винахід стосується застосування зазначеної каталітичної системи для енантіоселективного гідрування прохіральних кетімінів у асиметричні аміни для подальшого формування гербіцидів. UA 100732 C2 (12) UA 100732 C2 UA 100732 C2 5 10 15 20 25 30 35 40 45 50 55 Галузь винаходу Даний винахід стосується способу асиметричного гідрування імінів воднем при підвищеному тиску в присутності каталітичної системи. Винахід, зокрема, стосується застосування зазначеної каталітичної системи для енантіоселективного гідрування прохіральних кетімінів у асиметричні аміни, що призводить до формування гербіцидів. Передумови винаходу Каталітичне гідрування іміну відомо відносно давно. В органічному синтезі відіграють важливу роль способи каталітичного гідрування, що застосовують або гомогенні каталізатори, або гетерогенні каталізатори. Гетерогенні каталізатори є нерозчинними; таким чином, вони можуть легко відокремлюватися від реакційної суміші і, як правило, мають можливість повторного застосування, тоді як гомогенні каталізатори є розчинними, і таким чином, можуть зустрічатися утруднення при відділенні гомогенного каталізатора, і металів, і супровідних лігандів від продукту. Це представляє проблеми не тільки з чистотою продукту, але також робить повторне застосування гомогенного каталізатора проблематичним. Дані каталізатори, як відомо, показують переваги каталізу реакцій гідрування в синтетичних шляхах для отримання різних гербіцидів з винятковою хімічною особливістю при відносно м'яких умовах. Відповідно, все більше уваги приділяється застосуванню таких каталізаторів в отриманні гербіцидів у комерційному масштабі. Одна така каталітична система, що продемонструвала гарні промислові можливості для гідрування імінів, являє собою гомогенну іридій-ксиліфосну (iridium-xyliphos) каталітичну систему, що знайшла широке застосування для отримання різних гербіцидів, особливо для отримання (S)-2-хлор-N-(2-етил-6-метилфеніл)-N-(2-метокси-1-метилетил)ацетаміду [HansUlrich Blaser, Advanced Synthesis and Catalysis, 2002, 344,17-31]. Дані способи гомогенного каталізу виявилися недешевими. Було відзначено, що у випадку щодо великих партій або у промисловому масштабі такі каталізатори часто мають тенденцію ставати деактивованими в більшій або меншій мірі в залежності від попередника каталізатора, субстрату і лігандів, що застосовують. У багатьох випадках, особливо при підвищених температурах, неможливо досягти повного перетворення; отже, продуктивність каталізатора занадто мала з точки зору рентабельності. Advanced synthesis and catalysis, vol. 34, pp. 17-31 (2000) обговорює гідрування імінів при застосуванні Ir-ксиліфос ліганду, оцтової кислоти як розчинника і йодиду як добавки. Дана публікація розкриває, що в присутності оцтової кислоти і добавки йодиду, каталітична активність іридій-ксиліфосної каталітичної системи збільшується в 10 разів і ЕН (енантіомерний надлишок) збільшується на 5-6 %. Проте, одночасна присутність оцтової кислоти і добавки йодиду потрібна для досягнення істотного перетворення каталітичної системи як такої. При відсутності доданої оцтової кислоти і добавки йодиду каталізатор показує незначну частоту перетворення і енантіомерну селективність. Застосування оцтової кислоти вимагає спеціалізованого устаткування, сконструйованого з корозійностійкого матеріалу, що збільшує витрати. Крім того, оцтова кислота призводить до формування йодоводню та інших солей металів, що ускладнюють подальшу обробку реакційної суміші. Таким чином, бажано досягти способу асиметричного гідрування іміну, що включає каталітичну систему, що не вимагає присутності оцтової кислоти, і все ще досягає істотної частоти перетворення і енантіомерної селективності. Хімія синтезу хірально чистих хімічних речовин, фармацевтичних засобів і агрохімікатів стає все більш складною, часто вимагає багатостадійних реакцій, що включають складні каталітичні системи, такі як, наприклад, дорогі органометалічні каталітичні системи. Отже, існує підвищена увага до розвитку нових каталітичних систем, що мають високу активність і селективність, і які зберігають свою каталітичну активність протягом тривалого періоду часу при бажаних реакційних умовах. Дотепер було зроблено безліч спроб у відомій галузі техніки щодо енантіомерно селективної каталітичної системи для здійснення стехіометрично ефективного асиметричного гідрування імінів. Патент США № 6822118 описує спосіб гідрування імінів воднем при підвищеному тиску, у присутності гомогенних іридієвих каталізаторів із придатним лігандом, у присутності або без інертного розчинника в реакційній суміші, що включає хлорид, бромід або йодид амонію або металу, і додатково кислоту. Каталізатори в даних гомогенних способах не можуть бути відновлені або можуть бути відновлені тільки дорогими способами розділення, що завжди пов'язані з небажаними втратами. Таким чином, у даній галузі техніки залишається потреба в способі асиметричного гідрування імінів, що включає вдосконалену каталітичну систему, що переборює недоліки, пов'язані з даними, відомими дотепер, каталізаторами. 1 UA 100732 C2 5 10 15 20 25 30 35 40 45 50 Chem. Reviews, 2003, 103, 3101-3118 розкриває фероценілфосфінові, ксиліфосні і йосіфосні (josiphos) ліганди для гідрування імінів. Дана Джерела інформації: обговорює застосування йодиду і кислоти як добавки для гідрування імінів. Розкритий спосіб знову вимагає спільної присутності оцтової кислоти і добавки йодиду, щоб досягти істотної частоти перетворення і енантіомерної селективності. Проте, як обговорювалося вище, одночасна присутність оцтової кислоти і добавки йодиду небажана. Патентний документ США 2006/089469, що включений тут посиланням в повному обсязі, розкриває асиметричні хіральні гідроксилдифосфіни і їхнє застосування як каталізаторів для енантіоселективного синтезу. Описані фосфорорганічні сполуки поєднують з металокомплексними попередниками, щоб забезпечити придатну каталітичну систему. Параграф [0025] розкриває особливо переважні каталітичні системи відповідно до розкритого винаходу, що включають комплекси Ru і Rh, що містять описані ліганди. Даний патент викладає отримання ліганду [(1R, 2R, 3S)-1,2-диметил-2,3біс(дифенілфосфінометил)-циклопентил]метанол, у той час як приклад 6 розкриває отримання його Rh комплексу. Приклад 7 розкриває застосування родієвого комплексу, отриманого відповідно до прикладу 6 для різних реакцій гідрування. Встановили, що дана проілюстрована каталітична система не є переважною для асиметричного гідрування іміну. Крім того, всі проілюстровані реакції проводили при кімнатній температурі під тиском водню 1 бар, що суперечить висновку даного винаходу. Далі було відзначено щодо промислового масштабу, що каталітичні системи часто можуть ставати деактивованими в залежності від попередника каталізатора, субстрату і лігандів. Далі було виявлено, що не всі каталітичні системи, відомі в даній галузі техніки, забезпечують повне перетворення вихідних речовин у цільовий продукт із високою енантіомерною селективністю. S-метолахлор являє собою один з найбільш важливих злакових гербіцидів для застосування на сої, кукурудзі та інших різних сільськогосподарських культурах. Рацемічна форма даного гербіциду включає два хіральних елементи, хіральну вісь і стереогенний центр, що призводить до чотирьох стереоізомерів. Пізніше стало відомо, що приблизно 95 % гербіцидної активності метолахлору належить двом 1-S діастереомерам. Це значить, що такий же біологічний ефект може бути виявлений при, приблизно, 65 % рівня застосування рацемічного продукту. Проте, комерційно здійсненний спосіб енантіоселективного виробництва S-метолахлору можна порівняти з рухом у складному лабіринті. Пошук каталізатора для енантіоселективного виробництва S-метолахлору подібний до прогулянки в лабіринті, що огороджує "ЧП-ЕН" (частота обороту-енантіомерний надлишок) простір, тобто пошук каталізатора достатньої стереоспецифічності (більш ніж 74 % енантіомерного надлишку), також як продуктивності (щонайменше, 99 % ефективності перетворення). Таким чином, пошук ефективного і енантіоселективного каталізатора для отримання S-метолахлору був назрілою і перспективною потребою в даній галузі синтезу гербіцидів. Таким чином, в даній галузі техніки існує постійна потреба в способі, що дасть можливість енантіоселективно гідрувати іміни з високим перетворенням, а також з високим енантіомерним надлишком цільового продукту, у якому каталітична система є економічно ефективною. Цілі винаходу Відповідно, метою даного винаходу є забезпечення способу асиметричного гідрування імінів. Ще однією метою даного винаходу є забезпечення способу асиметричного гідрування імінів у присутності каталітичної системи. Ще однією метою даного винаходу є забезпечення способу асиметричного гідрування імінів, у якому каталітична система, що застосовується, включає ліганд і метал або їхню сіль. Ще однією метою даного винаходу є забезпечення способу асиметричного гідрування імінів, що має високу ефективність перетворення і високий енантіомерний надлишок. Ще однією метою даного винаходу є забезпечення способу асиметричного гідрування імінів до аміну, що є корисним для отримання S-метолахлору. Короткий опис винаходу Спосіб асиметричного гідрування іміну, що має формулу 1: 2 UA 100732 C2 для отримання аміну, що має формулу 2: 2-етил-N-[(1S)-2-метокси-1-метил-етил]-6-метил-анілін 2 5 10 15 20 , причому у зазначеному способі приводять у контакт зазначений імін, що має вищенаведену формулу 1, з воднем при підвищеному тиску у заданому органічному розчиннику в присутності каталітичної системи; причому зазначена каталітична система включає ліганд, що утворює комплекс із металом, обраним з іридію і родію або їхньої солі; де зазначений ліганд обирають із групи, що включає (a) [(1R, 2R, 3S)-1,2-диметил-2,3-біс(дифенілфосфінометил)-циклопентил]метанол; (b) (1S, 4S, 11R)-1,11-біс-[(дифенілфосфаніл)-метил]-11-метил-1,2,3,4-тетрагідро-1,4метано-феназин; (c) (R)-3-ди-(3,5-диметилфеніл)фосфіно-2-(4-дифенілфосфіно-2,5-диметилтієніл-3)-1,7,7триметилбіцикло-[2,2,1]-гепт-2-ен; (d) (S)-2-[(o-дифенілфосфіно)-феніл]-1-дифенілфосфіно-фероцен; (e) (S)-1-(дифенілфосфіно)-2-(S)-(o-дифенілфосфіно-α-метоксибензил)фероцен; (f) (+)-(S)-N, N-диметил-1-[(R)-1',2-біс-(дифенілфосфіно)-фероценіл]-етиламін; і (g) [(S)-1-[(R)-2-дифенілфосфіно)фероценіл]-етил-ди(циклогексил)-фосфін. З іншого погляду, даний винахід забезпечує поліпшений спосіб асиметричного гідрування іміну, що має формулу 1: 3 UA 100732 C2 для отримання аміну, що має формулу 2: 2-етил-N-[(1S)-2-метокси-1-метил-етил]-6-метил-анілін 2 5 10 15 , причому у зазначеному способі приводять у контакт зазначений імін, що має вищенаведену формулу 1, з воднем при підвищеному тиску 80 бар при температурі приблизно 50 °C у толуолі у присутності каталітичної системи, що включає ліганд, що має формулу [(1R, 2R, 3S)-1,2диметил-2,3біс(дифенілфосфінметил)-циклопентил]метанол, що утворює комплекс з іридієвим металом або його сіллю. Докладний опис винаходу Отже, в аспекті даний винахід забезпечує спосіб енантіомерного селективного гідрування іміну воднем при підвищеному тиску в присутності каталітичної системи, що включає раніше визначений бідентантний дифосфіновий ліганд, що утворює комплекс з металом у присутності заданого інертного розчинника. Імін переважно включає сполуку, що має формулу 1 , яка асиметрично гідрує у амін, що має наступну формулу 2: 2-етил-N-[(1S)-2-метокси-1-метил-етил]-6-метил-анілін 2 . Дотепер каталітичні системи даного винаходу не застосовували для проведення гідрування іміну, особливо іміну, що має описану вище формулу 1, і тим більше при підвищеному тиску 4 UA 100732 C2 5 10 15 20 водню, переважному згідно даного винаходу. Було несподівано виявлено, що реагування іміну, що має формулу 1, з воднем при підвищеному тиску в інертному розчиннику в присутності каталітичної системи, що включає заданий ліганд, що утворює комплекс із металом, обраним з іридію і родію, має в результаті високу ефективність перетворення і високу підвищену енантіомерну селективність у формуванні аміну формули 2, що утворюється у результаті. Відношення субстрату до каталізатора протягом зазначеної реакції гідрування даного винаходу змінюється від приблизно 200 до приблизно 500000. Заданий ліганд обирають з групи, що включає: (a) [(1R, 2R, 3S)-1,2-диметил-2,3-біс(дифенілфосфінометил)-циклопентил]метанол; (b) (1S, 4S, 11R)-1,11-біс-[(дифенілфосфаніл)-метил]-11-метил-1,2,3,4-тетрагідро-1,4метано-феназин; (c) (R)-3-ди-(3,5-диметилфеніл)фосфіно-2-(4-дифенілфосфіно-2,5-диметилтієнил-3)-1,7,7триметилбіцикло-[2,2,1]-гепт-2-ен; (d) (S)-2-[(o-дифенілфосфіно)-феніл]-1-дифенілфосфіно-фероцен; (e) (S)-1-(дифенілфосфіно)-2-(S)-(o-дифенілфосфіно-α-метоксибензил)фероцен; (f) (+)-(S)-N, N-диметил-1-[(R)-1",2-біс-(дифенілфосфіно)-фероценіл]-етиламін; і (g) [(S)-1-[(R)-2-дифенілфосфіно)фероценіл]-етил-ди(циклогексил)-фосфін. Згодом проводять реакцію сполуки формули 2, описаної вище, з хлорацетилхлоридом у присутності основи в неполярному розчиннику при раніше визначених температурах, для отримання сполуки формули 3. Даний етап реакції переважно проводять при температурі приблизно 0 °C-5 °C. O CH3 Cl O CH3 N CH3 H3C 3 25 30 35 Сполука формули 3, описана вище, являє собою гербіцид відомий як S-метолахлор, що комерційно продається. Сполуку формули 1 можна отримати шляхом реакції сполуки формули 4 (2-етил-6метиланілін) з відповідним кетоном. Наприклад, проводять реакцію сполуки, що має наступну формулу 4: з кетоном, що має формулу CH3OCH2C(O)CH3 (метоксиацетон), для отримання сполуки формули 1. Дана реакція традиційно відома в даній галузі техніки, і її можна провести, застосовуючи, власне кажучи, відомі способи. Незважаючи на те, що вищезгаданий спосіб описаний з посиланням на визначену імінну сполуку формули 1, що може бути легко отримана фахівцем даної галузі техніки, його також легко провести на ариліміні, як зображено нижче. Схематичне зображення хімічної реакції, що проходить протягом реакції гідрування ариліміну відповідно до даної точки зору даного винаходу, наведено нижче: 5 UA 100732 C2 5 10 де R є C1-C4 алкілом, переважно метилом; R' є C1-C4 алкоксіалкілом, переважно C1-C4 алкоксіметилом або C1-C4 алкоксіетилом, переважно метоксиметилом, і Ar є фенілом, заміщеним одним або більше C1-C4 алкілом. Амін, отриманий при гідруванні іміну, може бути перетворений відповідно до способів, що є загальноприйнятими, з хлорацетилхлоридом у бажані гербіциди хлорацетанілідного типу. У варіанті здійснення даного винаходу зазначений метал переважно обирають з іридію, родію або їхньої солі. Структури лігандів, що є переважними згідно даного винаходу, показані нижче: (I) [(1R, 2R, 3S)-1,2-диметил-2,3-біс(дифенілфосфінометил)-циклопентил]метанол, 6 UA 100732 C2 (II) (1S, 4S, метано-феназин, 5 11R)-1,11-біс-[(дифенілфосфаніл)-метил]-11-метил-1,2,3,4-тетрагідро-1,4 (III) (R)-3-ди-(3,5-диметилфеніл)фосфіно-2-(4-дифенілфосфіно-2,5-диметилтієніл-3)-1,7,7триметилбіцикло-[2,2,1]-гепт-2-ен, (IV) (S)-2-[(o-дифенілфосфіно)-феніл]-1-дифенілфосфіно-фероцен, 7 UA 100732 C2 (V) (S)-1-(дифенілфосфіно)-2-(S)-(o-дифенілфосфіно-α-метоксибензил)фероцен, (VI) (+)-(S)-N, N-диметил-1-[(R)-1',2-біс-(дифенілфосфіно)-фероценіл]-етиламін, 5 10 15 (VII) [(S)-1-[(R)-2-дифенілфосфіно)фероценіл]-етил-ди(циклогексил)-фосфін. У варіанті здійснення даного винаходу зазначений заданий розчинник являє собою інертний органічний розчинник, що переважно обраний із групи, що включає толуол, 1,4-діоксан, метанол, тетрагідрофуран і дихлорметан. Вираз "інертний", у даному контексті як органічний розчинник, позначає розчинник, що самостійно не бере участь у реакції і не призначений обмежити обсяг винаходу будь-яким чином. Спосіб даного винаходу додатково може факультативно включати додавання заданої добавки. В переважному варіанті здійснення даного винаходу зазначена добавка є переважно обраною з групи, що включає діадамантилбутилфосфоній гідройодид (A), діадамантилбензилфосфоній гідробромід (B), трифенілфосфоній дийодид (C), ізопропілтрифенілфосфоній йодид (D), трифенілфосфоній дибромід (E), метилтрифенілфосфоній бромід (F), тетрабутиламоній йодид (G), міді(II) трифлат (H), ітербію(II) трифлат (I) і трифенілфосфоній дихлорид (J). 8 UA 100732 C2 5 10 15 20 25 30 Спосіб даного винаходу проводять при підвищеному тиску. Вираз підвищений тиск, що застосовують тут, позначає діапазон тиску від приблизно 5 бар до приблизно 150 бар. У переважному варіанті здійснення спосіб даного винаходу переважно проводять при температурі приблизно 50 °C і при тиску водню приблизно 80 бар. У даному переважному варіанті здійснення каталітична система включає ліганд, що має формулу [(1R, 2R, 3S)-1,2диметил-2,3-біс(дифенілфосфінометил)-циклопентил]метанол, що утворює комплекс з іридієвим металом або його солями. Спосіб даного варіанта здійснення переважно проводять у толуолі в присутності добавки, що має формулу трифенілфосфоній дибромід. Було додатково виявлено відповідно даному варіанту здійснення, що навіть при великому відношенні субстрату до каталізатора, аж до приблизно 500000, отриманий в результаті амін, як було виявлено, зазнає, щонайменше, 99 % перетворення при 76 % енантіомерного надлишку. Таким чином, у переважному варіанті здійснення було відзначено, що коли спосіб даного винаходу проводять, застосовуючи ліганд [(1R, 2R, 3S)-1,2-диметил-2,3біс(дифенілфосфінометил)-циклопентил]метанол, що утворює комплекси з іридієм при відношенні субстрату до каталізатора аж до приблизно 500000 у присутності трифенілфосфоній диброміду в якості переважної добавки у толуолі як переважному розчиннику, отриманий у результаті продукт, як було виявлено, зазнає 100 % перетворення при 76 % енантіомерного надлишку. Було виявлено, що спосіб даного винаходу дає 99 % перетворення і 76 % енантіомерний надлишок навіть при відсутності добавки або кислоти, що, як правило, застосовують при гідруванні іміну, щоб досягти більшого перетворення і більшого енантіомерного надлишку. Ліганди згідно даному винаходу, таким чином, позбавляють від потреби одночасної присутності оцтової кислоти і добавки йодиду, що потрібно у відомому рівні техніки, щоб досягти істотного перетворення, таким чином, рятуючи від потреби в спеціалізованому устаткуванні, сконструйованому з корозійностійких речовин, не піддаючи ризику частоту перетворення і енантіомерну селективність. Таким чином, з іншого погляду, даний винахід забезпечує вдосконалений спосіб асиметричного гідрування іміну, що має формулу 1: для отримання аміну, що має формулу 2: 2-етил-N-[(1S)-2-метокси-1-метил-етил]-6-метил-анілін 2 , причому у зазначеному способі приводять у контакт зазначений імін, що має вищенаведену формулу 1, з воднем при підвищеному тиску 80 бар при температурі приблизно 50 °C у толуолі 9 UA 100732 C2 5 10 15 20 25 30 у присутності каталітичної системи, що включає ліганд, що має формулу [(1R, 2R, 3S)-1,2диметил-2,3-біс(дифенілфосфінметил)-циклопентил]метанол, що утворює комплекс з іридієвим металом або його сіллю. У варіанті здійснення даної точки зору спосіб переважно проводять у присутності заданої добавки, що є трифенілфосфоній дибромідом (E). Винахід має бути описаний з посиланням на характерні приклади. Слід зазначити, що приклад(и), що наводяться нижче, переважно ілюструють, а не обмежують винахід, і фахівець у даній галузі техніки здатний спроектувати багато альтернативних варіантів здійснення, не відходячи від обсягу доданої формули винаходу. На відміну від діючих прикладів, наданих нижче, або, якщо зазначене інше, всі числа, що виражають кількості інгредієнтів або реакційні умови, повинні бути зрозумілі як змінні у всіх випадках під виразом "приблизно". Приклад 1 і) Гідрування 2-етил-N-(1-метоксипропан-2-іліден)-6-метиланіліну, застосовуючи ліганд [(1R, 2R, 3S)-1,2-диметил-2,3-біс(дифенілфосфінометил)-циклопентил]метанол (I), у присутності різних добавок 0,001 ммоль ліганду [(1R, 2R, 3S)-1,2-диметил-2,3-бісдифенілфосфінометил)циклопентил]метанол (I), 0,0005 ммоль [Ir(COD)Cl]2 і 0,004 ммоль відповідної добавки змішують разом в атмосфері аргону в 0,1 мл дихлорметану, і суміш перемішують при кімнатній температурі протягом 20 хвилин. Тим часом 0,1-5 ммоль розчину субстрату у відповідному розчиннику поміщають в автоклав. Розчин каталізатора потім поміщають в автоклав, і автоклав продувають воднем при підвищеному тиску. Реакційну суміш нагрівають на масляній бані до бажаного підвищення температури. Після охолодження і зниження тиску зразок реакційної суміші відбирають з автоклава. Розчинник випаровують, і залишок розчиняють у 200 мкл ізопропанолу і 1 мл н-гексану і фільтрують через короткий шлях стовпчика із силікагелем. Фільтрат аналізують за допомогою ВЕРХ (високоефективна рідинна хроматографія). ii) Гідрування 2-етил-N-(1-метоксипропан-2-іліден)-6-метиланіліну, застосовуючи ліганд ксиліфос, у присутності різних добавок Методики експерименту Прикладу 1 (і), наведеного вище, дотримуються для ліганду {(R)-1[(S)-2-дифенілфосфіно)фероценіл]}етил-ди(3,5-диметил)фосфін (ксиліфос). Ліганд ксиліфос є одним з добре відомих лігандів, що застосовують для гідрування імінів. Результати для кінцевого продукту для перетворення (%) і ЕН (%), що застосовують різні добавки і різні розчинники, у присутності ксиліфос-ліганду і лігандів даного винаходу зведені в супровідну Таблицю 1. Таблиця 1 Добавка: D, С/К* відношення: 200 розчинник: толуол Добавка: B, С/К відношення: 200 розчинник: толуол Ліганд: I Кислота: немає Перетворення ЕН (%) (%) 100 80 100 80 Абс. конф. S S Ліганд: ксиліфос Кислота: оцтова кислота Перетворення ЕН Абс. (%) (%) конф. 100 80 S 100 76 S 35 * Субстрат/Каталізатор 40 45 Спосіб даного винаходу, таким чином, виключає потребу в присутності оцтової кислоти, що вимагає спеціального підйомно-транспортного устаткування, що обумовлено її корозійною природою. Приклад 2 Гідрування 2-етил-N-(1-метоксипропан-2-іліден)-6-метиланіліну, застосовуючи різні ліганди Методики експерименту Прикладу 1, наведеного вище, дотримуються для різних лігандів даного винаходу. Результати для кінцевого продукту для перетворення (%) і ЕН (%), застосовуючи різні добавки і різні розчинники, зведені в супровідну Таблицю 2, де ліганди і добавки такі, як описано раніше. 10 UA 100732 C2 Таблиця 2 Сер. № 10 15 20 25 Розчинник Добавка Перетворення (%) ЕН (%) 1. 2. 3. 4. 5. 5 Ліганд 1 I III VI VI Толуол 1,4-діоксан 1,4-діоксан 1,4-діоксан 1,4-діоксан В В H A H 100 99 100 100 100 80 77 76 76 76 Абс. конф. S S S S S Результати в Таблиці 2 доводять, що спосіб даного винаходу забезпечує високу ефективність перетворення при гідруванні імінів, навіть у відсутності будь-яких кислот, так що спосіб дає можливість, щонайменше, від 99 % до 100 % перетворення вихідної речовини в цільовий продукт, що має ≥76 % енантіомерного надлишку цільового продукту. Приклад 3 Гідрування 2-етил-N-(1-метоксипропан-2-іліден)-6-метиланіліну, застосовуючи ліганд (S)-2[(o-дифенілфосфіно)-феніл]-1-дифенілфосфіно-фероцен (IV) 0,001 ммоль ліганду (IV), 0,0005 ммоль [Ir(COD)Cl]2 і 0,004 ммоль добавки А змішують разом в атмосфері аргону в 0,1 мл дихлорметану, і суміш перемішують при кімнатній температурі протягом 20 хв. Тим часом 0,1 ммоль розчину 2-етил-N-(1-метоксипропан-2-іліден)-6метиланіліну в дихлорметані поміщають в автоклав. Згодом 0,12 мл оцтової кислоти додають в автоклав, і автоклав продувають воднем, і доводять тиск до 50 бар. Реакційну суміш нагрівають при перемішуванні у масляній бані до 50 °C, і реакція продовжується протягом 18 годин. Реакційну суміш охолоджують, і після цього тиск знижують, кінцевий продукт реакційної суміші відбирають з автоклава, розчинник випаровують, і залишок розчиняють у 200 мкл ізопропанолу і 1 мл гексану, і систему фільтрують через короткий шлях силікагелю. Фільтрат аналізують за допомогою ВЕРХ. Перетворення іміну до аміну складає 99 %, що включає 88 % (S)-2-етил-N-(1метоксипропан-2-іл)-6-метиланіліну (ЕН 76 %). Приклад 4 Гідрування 2-етил-N-(1-метоксипропан-2-іліден)-6-метиланіліну, застосовуючи різні ліганди Методики експерименту Прикладу 1, приведеного вище, дотримуються для різних лігандів даного винаходу, де відношення субстрату до каталізатора складає 3000. Результати для кінцевого продукту для перетворення (%) і ЕН (%), застосовуючи різні добавки і різні розчинники, зведено в супровідну Таблицю 3, де ліганди і добавки такі, як описані раніше. Таблиця 3 Сер. № 35 Розчинник Добавка Перетворення (%) 1. 2. 3. 4. 5. 6. 30 Ліганд 1 I I III VI VI Толуол Толуол 1,4-діоксан 1,4-діоксан 1,4-діоксан 1,4-діоксан В D E H A H 100 100 100 100 100 100 ЕН (%) 80 80 76 76 76 76 Абс. конф. S S S S S S Результати в Таблиці 3 доводять, що спосіб даного винаходу забезпечує високу ефективність перетворення при гідруванні імінів, навіть при відношенні субстрату до каталізатора 3000, так що спосіб дає можливість 100 % перетворення вихідної речовини в цільовий продукт, що має ≥76 % енантіомерного надлишку цільового продукту. Приклад 5 Гідрування 2-етил-N-(1-метоксипропан-2-іліден)-6-метиланіліну, застосовуючи ліганд [(1R, 2R, 3S)-1,2-диметил-2,3-біс(дифенілфосфінометил)-циклопентил]метанол (I) Методики експерименту Прикладу 1, наведеного вище, дотримуються для ліганду (I) даного винаходу, де відношення субстрату до каталізатора складає 10000. Результати для кінцевого продукту для перетворення (%) і ЕН (%) зведені в супровідну Таблицю 4. 11 UA 100732 C2 Таблиця 4 Сер. № 1. 5 10 15 20 25 30 35 40 45 50 55 Ліганд 1 Розчинник Толуол Добавка E Перетворення (%) 100 ЕН (%) 76 Абс. конф. S Результати в Таблиці 4 доводять, що спосіб даного винаходу забезпечує високу ефективність перетворення при гідруванні імінів, навіть при відношенні субстрату до каталізатора 10000, так що спосіб дає можливість 100 % перетворення вихідної речовини в цільовий продукт, що має 76 % енантіомерного надлишку цільового продукту. Приклад 6 Гідрування 2-етил-N-(1-метоксипропан-2-іліден)-6-метиланіліну, застосовуючи Rh(COD)2BF4 і (R)-3-ди-(3,5-диметилфеніл)фосфіно-2-(4-дифенілфосфіно-2,5-диметилтієнил-3)-1,7,7триметилбіцикло-[2,2,1]гепт-2-ен (III) 0,67 мг (0,001 ммоль) ліганду (III), 0,41 мг (0,001 ммоль) Rh(COD)2BF4 і 0,24 мг (0,004 ммоль) оцтові кислоти змішують разом в атмосфері аргону в 0,1 мл дихлорметану, і суміш перемішують при кімнатній температурі протягом 20 хв.). Потім додають 41 мг (0,200 ммоль) субстрату 2етил-N-(1-метоксипропан-2-іліден)-6-метиланіліну в метиленхлоридному розчині (0,4 мл 0,5M розчину субстрату в метиленхлориді). Реакційні суміші пізніше поміщають в автоклав, і автоклав продувають воднем. Потім під тиском водню 40 бар реакційну суміш нагрівають при 40 °C протягом 18 годин. Потім охолоджують і знижують тиск, зразок на аналізі показує 99 % перетворення (ГХ (газова хроматографія) аналіз) з енантіомерним надлишком (ЕН) S ізомеру аміну 76 % (хіральна ВЕРХ). Було виявлено, що застосування комерційно менш дорогої ліганд-каталітичної системи у енантіомерно селективному способі гідрування даного винаходу показує високу ефективність перетворення для гідрування імінів, так що спосіб дає можливість 99 % перетворення вихідної речовини в цільовий продукт, що має 76 % енантіомерного надлишку цільового продукту. Каталітична система, що включає ліганди даного винаходу, дає високе перетворення вихідної речовини в цільовий продукт, що має високий енантіомерний надлишок цільового продукту навіть без оцтової кислоти або добавки і без зміни частоти перетворення або енантіомерної селективності каталітичної системи. Приклад 7 Гідрування 2-етил-N-(1-метоксипропан-2-іліден)-6-метиланіліну, застосовуючи ліганд [(1R, 2R, 3S)-1,2-диметил-2,3-біс(дифенілфосфінометил)-циклопентил]метанол (I) 15,10 мг (0,0288 ммоль) ліганду [(1R, 2R, 3S)-1,2-диметил-2,3-біс(дифенілфосфінометил)циклопентил]метанол, 6 мг (0,0089 ммоль) [Ir(COD)Cl]2 і 60 мг (0,142 ммоль) трифенілфосфоній диброміду змішують разом в атмосфері аргону в 10 мл толуолу, і суміш перемішують при кімнатній температурі впродовж 30 хв. Тим часом 25 г (0,122 моль) 2-етил-N-(1-метоксипропан2-іліден)-6-метиланіліну в 20 мл толуолу поміщають в автоклав. Розчин каталізатора потім поміщають в автоклав, і автоклав продувають воднем під тиском 80 бар. Реакційну суміш нагрівають до температури 50 °C. Після того як реакція завершується через 18 годин, масу охолоджують до кімнатної температури, і тиск знижують. Зразок на аналізі показує повне перетворення в амін. Реакційну суміш відбирають з автоклава. Розчинник випаровують, і залишок переганяють під високим вакуумом (1-2 Тор), для отримання 24,3 г блідо-жовтого аміну з 98 % чистотою і 88 % S-ізомеру (ЕН 76 %). Приклад 8 Гідрування 2-етил-N-(1-метоксипропан-2-іліден)-6-метиланіліну, застосовуючи ліганд [(1R, 2R, 3S)-1,2-диметил-2,3-біс(дифенілфосфінометил)-циклопентил]метанол (I) 7,20 мг (0,0137 ммоль) ліганду [(1R, 2R, 3S)-1,2-диметил-2,3-біс(дифенілфосфінометил)циклопентил]метанол, 2,7 мг (0,0040 ммоль) [Ir(COD)Cl]2 і 31 мг (0,073 ммоль) трифенілфосфоній диброміду змішують разом в атмосфері аргону в 10 мл толуолу, і суміш перемішують при кімнатній температурі протягом 30 хв. Тим часом 35 г (0,171 моль) 2-етил-N(1-метоксипропан-2-іліден)-6-метиланіліну в 20 мл толуолу поміщають у 100 мл SS316 автоклав. Розчин каталізатора потім поміщають в автоклав, і автоклав продувають воднем під тиском 80 бар. Реакційну суміш нагрівають до температури 50 °C. Після того як реакція завершується через 18 годин, масу охолоджують до кімнатної температури, і тиск знижують. Зразок на аналізі показує повне перетворення в амін. Реакційну суміш відбирають з автоклава. Розчинник випаровують, і залишок переганяють під високим вакуумом (1-2 Тор), для отримання 34,1 г блідо-жовтого аміну з 99 % чистотою і 89 % S-ізомеру (ЕН 78 %). Приклад 9 12 UA 100732 C2 5 10 15 20 25 30 35 40 45 50 55 60 Гідрування 2-етил-N-(1-метоксипропан-2-іліден)-6-метиланіліну, застосовуючи ліганд [(1R, 2R, 3S)-1,2-диметил-2,3-біс(дифенілфосфінометил)-циклопентил]метанол (I) Методики експерименту Прикладу 7, приведеного вище, дотримуються з наступними кількостями: 5,70 мг (0,0109 ммоль) ліганду [(1R, 2R, 3S)-1,2-диметил-2,3-біс(дифенілфосфінометил)циклопентил]метанол, 2,1 мг (0,0031 ммоль) [Ir(COD)Cl]2 і 70 мг (0,166 ммоль) трифенілфосфоній диброміду змішують разом в атмосфері аргону в 10 мл толуолу, і суміш перемішують при кімнатній температурі протягом 30 хв. Тим часом 58 г (0,283 моль) 2-етил-N(1-метоксипропан-2-іліден)-6-метиланіліну в 5 мл толуолу поміщають у 100 мл SS316 автоклав. Реакцію проводять в точності відповідно до прикладу 7. Зразок на аналізі показує повне перетворення в амін. 56 г продукту одержують, після того, як переганяють під високим вакуумом (1-2 Тор), як блідо-жовту олію з 97 % чистотою і 87 % S-ізомеру (ЕН 74 %). Приклад 10 Гідрування 2-етил-N-(1-метоксипропан-2-іліден)-6-метиланіліну, застосовуючи ліганд [(1R, 2R, 3S)-1,2-диметил-2,3-біс(дифенілфосфінометил)-циклопентил]метанол (I) Методики експерименту Прикладу 7, приведеного вище, дотримуються з наступними кількостями: 2,60 мг (0,005 ммоль) ліганду, [(1R, 2R, 3S)-1,2-диметил-2,3-біс-(дифенілфосфінометил)циклопентил]метанол, 1,10 мг (0,0016 ммоль) [Ir(COD)Cl]2 і 140 мг (0,332 ммоль) трифенілфосфоній диброміду змішують разом в атмосфері аргону в 10 мл толуолу, і суміш перемішують при кімнатній температурі протягом 30 хв. Тим часом 58 г (0,283 моль) 2-етил-N(1-метоксипропан-2-іліден)-6-метиланіліну в 5 мл толуолу поміщають у 100 мл SS316 автоклав. Реакцію проводять у точності відповідно до прикладу 7. Зразок на аналізі показує повне перетворення в амін. 57 г продукту одержують, після того як переганяють під високим вакуумом (1-2 Тор), як блідо-жовту олію з 98 % чистотою і 88 % S-ізомеру (ЕН 76 %). Приклад 11 Гідрування 2-етил-N-(1-метоксипропан-2-іліден)-6-метиланіліну, застосовуючи ліганд [(1R, 2R, 3S)-1,2-диметил-2,3-біс(дифенілфосфінометил)-циклопентил]метанол (I) 9,50 мг (0,0181 ммоль) ліганду [(1R, 2R, 3S)-1,2-диметил-2,3-біс(дифенілфосфінометил)циклопентил]метанол, 4 мг (0,0059 ммоль) [Ir(COD)Cl]2 і 490 мг (1,161 ммоль) трифенілфосфоній диброміду змішують разом в атмосфері аргону в 10 мл толуолу, і суміш перемішують при кімнатній температурі протягом 30 хв. Тим часом 250 г (1,22 моль) 2-етил-N(1-метоксипропан-2-іліден)-6-метиланіліну в 20 мл толуолу поміщають в автоклав місткістю 400 мл. Розчин каталізатора потім поміщають в автоклав, і автоклав продувають воднем під тиском 80 бар. Реакційну суміш нагрівають до температури 50 °C. Після того як реакція завершується через 18 годин, масу охолоджують до кімнатної температури, і тиск знижують. Реакційну суміш відбирають з автоклава. Зразок на аналізі показує повне перетворення в амін. Розчинник випаровують, і залишок переганяютьпід високим вакуумом (1-2 Тор), для отримання 245 г блідо-жовтого аміну з 98,5 % чистотою і 89 % S-ізомеру (ЕН 78 %). Приклад 12 Гідрування 2-етил-N-(1-метоксипропан-2-іліден)-6-метиланіліну, застосовуючи ліганд [(1R, 2R, 3S)-1,2-диметил-2,3-біс(дифенілфосфінометил)-циклопентил]метанол (I) 7,50 мг (0,0143 ммоль) ліганду [(1R, 2R, 3S)-1,2-диметил-2,3-біс(дифенілфосфінометил)циклопентил]метанол, 3 мг (0,0044 ммоль) [Ir(COD)Cl]2 і 290 мг (0,6873 ммоль) трифенілфосфоній диброміду змішують разом в атмосфері аргону в 10 мл толуолу, і суміш перемішують при кімнатній температурі впродовж 30 хв. Тим часом 280 г (1,366 моль) 2-етил-N(1-метоксипропан-2-іліден)-6-метиланіліну у 20 мл толуолу поміщають в автоклав місткістю 400 мл. Розчин каталізатора потім поміщають в автоклав, і автоклав продувають воднем під тиском 80 бар. Реакційну суміш нагрівають до температури 50 °C. Після того, як реакція завершується через 18 годин, масу охолоджують до кімнатної температури, і тиск знижують. Зразок на аналізі показує 99 % перетворення в амін. Речовину вилучають з автоклава, і толуол відганяють. Неочищений продукт переганяють під високим вакуумом (1-2 Тор), для отримання 275 г продукту блідо-жовтого кольору з 98 % чистотою і 89 % S-ізомеру (ЕН 78 %). Усі вищенаведені реакції проводять при заданій температурі 50 °C і заданому тиску 80 бар. Далі експерименти проводять точно з такими ж кількостями як у прикладі 7, крім температури і тиску реакції. Було виявлено, що спосіб даного винаходу показує більший енантіомерний надлишок, 76 %, особливо при температурі 50 °C і тиску 80 бар. Приклад 13 Гідрування 2-етил-N-(1-метоксипропан-2-іліден)-6-метиланіліну, застосовуючи ліганд [(1R, 2R, 3S)-1,2-диметил-2,3-біс(дифенілфосфінометил)-циклопентил]метанол (I) 13 UA 100732 C2 5 10 15 20 25 30 Реакцію проводять в точності з такими ж кількостями як у прикладі 7, крім температури реакції. Температура складала 80 °C. Реакцію завершують через 18 годин, масу охолоджують до кімнатної температури і тиск знимають. Зразок на аналізі показує повне перетворення в амін. Розчинник випаровують, і залишок переганяють під високим вакуумом (1-2 Тор), для отримання 24,1 г блідо-жовтого аміну з 99 % чистотою і 96,5 % виходом з 85 % S-ізомеру (ЕН 70 %). Приклад 14 Гідрування 2-етил-N-(1-метоксипропан-2-іліден)-6-метиланіліну, застосовуючи ліганд [(1R, 2R, 3S)-1,2-диметил-2,3-біс(дифенілфосфінометил)-циклопентил]метанол (I) Реакцію проводять точно з такими ж кількостями як у прикладі 7, крім температури реакції. Температура складала 40 °C. Реакцію завершують через 18 годин, масу охолоджують до кімнатної температури, і тиск знижують. Зразок на аналізі показує 95 % перетворення в амін. Розчинник випаровують, і залишок переганяють під високим вакуумом (1-2 Тор), для отримання 24,0 г блідо-жовтого аміну з 95 % чистотою і 95 % виходом з 88 % S-ізомеру (ЕН 76 %). Приклад 15 Гідрування 2-етил-N-(1-метоксипропан-2-іліден)-6-метиланіліну, застосовуючи ліганд [(1R, 2R, 3S)-1,2-диметил-2,3-біс(дифенілфосфінометил)-циклопентил]метанол (I) Реакцію проводять точно з такими ж кількостями як у прикладі 7, крім тиску водню, що протягом реакції був 100 бар. Реакцію завершують через 18 годин, масу охолоджують до кімнатної температури, і тиск знижують. Зразок на аналізі показує повне перетворення в амін. Розчинник випаровують, і залишок переганяють під високим вакуумом (1-2 Тор), для отримання 24,1 г блідо-жовтого аміну з 98 % чистотою і 96,6 % виходом з 87 % S-ізомеру (ЕН 74 %). Було виявлено, що комерційно менш дорога ліганд-каталітична система, яку застосовують в енантіомерному селективному способі гідрування даного винаходу, показує високу ефективність перетворення для гідрування імінів, так що спосіб дає можливість ≥99 % перетворення вихідної речовини в цільовий продукт, що має ≥76 % енантіомерного надлишку цільового продукту при підвищеному тиску водню. Каталітична система, що включає ліганди даного винаходу, дає високе перетворення вихідної речовини в цільовий продукт, що має високий енантіомерний надлишок цільового продукту навіть без оцтової кислоти і без впливу на продуктивність і активність каталітичної системи. Додатково було виявлено, що ліганд I забезпечує більше число перетворень при бажаному відсотковому відношенні перетворення і енантіоселективності, як показано в Таблиці 5, приведеній нижче, що не призначена обмежити обсяг винаходу будь-яким чином: Таблиця 5 Сер. № 1 2 3 4 5 6 7 8 9 10 35 Параметр 1 Температура 50 (°С) Тиск (бар) 80 Ліганд I Метал Ir Розчинник Толуол Добавка Е Вихід 96,3 Чистота 98 ЕН 76 ЧО 478854 Експериментальні умови 4 5 6 2 3 80 40 80 I Ir Толуол Е 96,5 99 70 19264 80 I Ir Толуол Е 95 95 76 19264 50 a) R-ізомер аміну, отриманий замість S-ізомеру b) Перетворення в амін було тільки 16 % у даному випадку. 1. Спосіб асиметричного гідрування іміну, що має формулу 1: 14 50 100 80 80 I Ксиліфос I Ir Ir Rh Толуол Толуол Толуол Е Е Е 96,6 98 98 98 99 98 74 66 а) 19264 200 200 ФОРМУЛА ВИНАХОДУ 40 50 7 8 50 50 80 I Ir СН2Сl2 Е 69 70,4 60 44456 80 I Ir Толуол J 16 17 b) 75681 UA 100732 C2 CH3 O N CH3 CH3 H3C ,1 для одержання аміну, що має формулу 2: CH3 H O N CH3 CH3 H3C 5 10 15 20 ,2 причому у зазначеному способі приводять у контакт зазначений імін з воднем при підвищеному тиску в органічному розчиннику в присутності каталітичної системи; причому зазначена каталітична система включає ліганд, що утворює комплекс із металом, вибраним з іридію і родію або їхньої солі; де зазначений ліганд вибирають із групи, що включає a) [(1R,2R,3S)-1,2-диметил-2,3-біс(дифенілфосфінометил)-циклопентил]метанол; b) (1S,4S,11R)-1,11-біс-[(дифенілфосфаніл)метил]-11-метил-1,2,3,4-тетрагідро-1,4метанофеназин; c) (R)-3-ди-(3,5-диметилфеніл)фосфіно-2-(4-дифенілфосфіно-2,5-диметилтієніл-3)-1,7,7триметилбіцикло[2,2,1]гепт-2-ен; d) (S)-2-[(о-дифенілфосфіно)феніл]-1-дифенілфосфінофероцен; e) (S)-1-(дифенілфосфіно)-2-(S)-(о-дифенілфосфіно-α-метоксибензил)фероцен; f) (+)-(S)-N,N-диметил-1-[(R)-1',2-біс-(дифенілфосфіно)фероценіл]-етиламін; і g) [(S)-1-[(R)-2-дифенілфосфіно)фероценіл]-етилди(циклогексил)фосфін, і одержаний амін, який має формулу 2, за необхідності піддають реакції з хлорацетилхлоридом у присутності основи в неполярному розчиннику при температурі від 0 °С до 5 °С для одержання сполуки, що має формулу 3 CH3 O Cl O N CH3 CH3 H3C .3 2. Спосіб за п. 1, де імін, що має формулу 1, одержують реакцією сполуки формули 4: NH2 H3 C CH3 25 30 35 4 з метоксіацетоном, що має формулу СН3ОСН2С(О)СН3. 3. Спосіб за п. 1, де зазначений етап, на якому приводять у контакт зазначений імін з воднем при підвищеному тиску, проводять у присутності добавки, вибраної з групи, що включає діадамантилбутилфосфонію гідройодид (А), діадамантилбензилфосфонію гідробромід (В), трифенілфосфонію дийодид (С), ізопропілтрифенілфосфонію йодид (D), трифенілфосфонію дибромід (Е), метилтрифенілфосфонію бромід (F), тетрабутиламонію йодид (G), міді(ІІ) трифлат (Н) і ітербію(II) трифлат (І), трифенілфосфонію дихлорид (J). 4. Спосіб за п. 1, де зазначений етап, на якому приводять у контакт зазначений імін з воднем, проводять в інертному органічному розчиннику, вибраному з групи, що включає толуол, 1,4діоксан, метанол, тетрагідрофуран, дихлорметан. 5. Спосіб за п. 1, де молярне відношення зазначеного іміну до зазначеної каталітичної системи складає від 200 до 500000. 15 UA 100732 C2 5 10 6. Спосіб за п. 1, де зазначений етап, на якому приводять у контакт зазначений імін з воднем, проводять при температурі від 10 °С до 100 °С. 7. Спосіб за п. 2, де зазначений етап, на якому приводять у контакт зазначений імін з воднем, проводять при підвищеному тиску водню від 5 бар до 150 бар. 8. Спосіб за п. 1, де зазначений імін приводять у контакт із воднем при підвищеному тиску 80 бар при температурі 50 °С у толуолі в присутності каталітичної системи, що включає ліганд, що має формулу [(1R,2R,3S)-1,2-диметил-2,3-біс(дифенілфосфінметил)циклопентил]метанол, що утворює комплекс з металічним іридієм або його сіллю. 9. Спосіб за п. 1, за яким додатково проводять реакцію зазначеного аміну, що має формулу 2, з хлорацетилхлоридом у присутності основи в неполярному розчиннику. 10. Спосіб за п. 9, де імін, що має формулу 1, одержують реакцією сполуки формули 4: NH2 H3 C CH3 15 4 з метоксіацетоном, що має формулу СН3ОСН2С(О)СН3. 11. Спосіб за п. 8, де зазначений етап, на якому приводять у контакт зазначений імін з воднем, проводять у присутності добавки, де зазначена добавка є трифенілфосфонію дибромідом. 12. Спосіб за п. 8, де відношення субстрат:каталізатор, тобто зазначеного іміну до зазначеної каталітичної системи, досягає 500000. Комп’ютерна верстка Г. Паяльніков Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 16
ДивитисяДодаткова інформація
Назва патенту англійськоюHydrogenation of imines
Автори англійськоюShroff, Jaidev, Rajnikant, Shroff, Vikram, Rajnikant, Shanker, Birja
Назва патенту російськоюГидрирование иминов
Автори російськоюШрофф Яидев Раджникант, Шрофф Викам Раджникант, Шанкер Бирджа
МПК / Мітки
МПК: B01J 23/40
Мітки: імінів, гідрування
Код посилання
<a href="https://ua.patents.su/18-100732-gidruvannya-iminiv.html" target="_blank" rel="follow" title="База патентів України">Гідрування імінів</a>
Попередній патент: Детекція та підрахунок мікроорганізмів
Наступний патент: Пристрій примусового затримання автотранспорту
Випадковий патент: Реактор газифікації для виробництва со- або н2-вмісного неочищеного газу