Фармацевтичний препарат, що містить фосфатидилхолін, для лікування виразкового коліту
Формула / Реферат
1. Фармацевтичний препарат, що містить:
принаймні один фосфатидилхоліновий продукт (ФХ) формули (І)
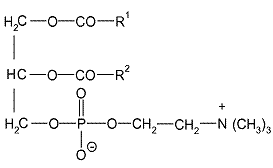 , (I)
, (I)
де:
R1 є залишком насиченої або ненасиченої жирної кислоти з 12-24 атомами вуглецю і R2 є залишком насиченої або ненасиченої жирної кислоти з 12-24 атомами вуглецю, і де фосфатидилхоліновий продукт (ФХ) містить наступні кількості жирних кислот (у вагових відсотках від загальної кількості жирних кислот в ФХ):
55-72 лінолевої кислоти,
10-18 пальмітинової кислоти,
07-15 олеїнової кислоти,
02-08 ліноленової кислоти,
02-08 стеаринової кислоти,
і принаймні один фармацевтично прийнятний наповнювач для уповільненого вивільнення фосфатидилхолінового продукту (ФХ),
де фосфатидилхоліновий продукт (ФХ) означає принаймні 94 % за вагою усіх ліпідних/фосфоліпідних компонентів препарату.
2. Фармацевтичний препарат за п. 1, що містить принаймні один фосфатидилхоліновий продукт (ФХ) формули (І), де:
R1 є залишком насиченої або ненасиченої жирної кислоти з 14-20 атомами вуглецю і R2 є залишком насиченої або ненасиченої жирної кислоти з 14-20 атомами вуглецю, і де фосфатидилхоліновий продукт (ФХ) містить наступні кількості залишків жирних кислот (у вагових відсотках від загальної кількості жирних кислот в ФХ):
59-70 лінолевої кислоти,
12-17 пальмітинової кислоти,
07-15 олеїнової кислоти,
03 - 07 ліноленової кислоти,
02-05 стеаринової кислоти,
і принаймні один фармацевтично прийнятний наповнювач, де фармацевтичний препарат вивільняє принаймні 50 %, зокрема принаймні 70 %, за вагою фосфатидилхолінового продукту (ФХ) в кишечнику.
3. Фармацевтичний препарат за п. 1 або 2, який відрізняється тим, що фармацевтичний препарат містить принаймні один фосфатидилхоліновий продукт (ФХ) формули (І), де більше ніж 78 %, зокрема більше ніж 80 %, за вагою залишків жирних кислот R1 і R2 є ненасиченою жирною кислотою з 18 атомами вуглецю.
4. Фармацевтичний препарат за будь-яким з пп. 1-3, який відрізняється тим, що фармацевтичний препарат містить кишковорозчинну пелету(и), кишковорозчинну капсулу(и), кишковорозчинну гранулу(и) або кишковорозчинну таблетку(и), що містять фосфатидилхоліновий продукт (ФХ) і принаймні один шар кишковорозчинного полімерного покриття, що є стійким до дії кишкових кислот.
5. Фармацевтичний препарат за будь-яким з пп. 1-4, який відрізняється тим, що вагове співвідношення кишковорозчинного полімерного покриття і фосфатидилхолінового продукту (ФХ) складає від 3:1 до 1:3, і де ФХ є дозованою лікарською формою, утвореною множиною відокремлених одиниць.
6. Фармацевтичний препарат за будь-яким з пп. 1-5, що містить кишковорозчинну пелету(и), кишковорозчинну капсулу(и), кишковорозчинну гранулу(и) або кишковорозчинну таблетку(и), що мають кишковорозчинне полімерне покриття товщиною від 10 до 500 мікрометрів.
7. Фармацевтичний препарат за будь-яким з пп. 1-6, що містить фосфатидилхоліновий продукт (ФХ), захищений кишковорозчинним покриттям, яке є стійким до дії шлункових кислот (рН 1) протягом принаймні 120 хвилин, але яке дозволяє принаймні 80 % фосфатидилхолінового продукту (ФХ) вивільнятись з препарату при рН 5,5 або вище протягом 120 хвилин.
8. Фармацевтичний препарат за будь-яким з пп. 1-7, що містить принаймні одне покриття, принаймні з одним кишковорозчинним полімером з групи гомополімерів та кополімерів акрилової кислоти, метакрилової кислоти, акрилових естерів та метакрилових естерів.
9. Фармацевтичний препарат за будь-яким з пп. 1-8, що містить від 20 до 30 % за вагою фосфатидилхолінового продукту (ФХ) формули (І) і від 70 до 80 % за вагою наповнювачів.
10. Фармацевтичний препарат за будь-яким з пп. 1-9, що має довгострокову стабільність, що характеризується кількістю принаймні 95 % за вагою аналізованого ФХ (відносно номінального значення) і менше ніж 5 % за вагою лізо-ФХ (відносно ФХ) після 36 місяців зберігання в холодильнику (5±3 °С).
11. Фармацевтичний препарат за будь-яким з пп. 1-10 для лікування або попередження стану або захворювання, вибраного з виразкового коліту, хвороби Крона, запалення у відключеній кишці, інфекційного ентериту, інфекційного коліту, запалення в результаті опромінення і запалення через хіміотерапевтичні або хімічні речовини, зокрема для лікування виразкового коліту у 5-АSА-резистентних пацієнтів.
12. Препарат за п. 11 для лікування або попередження виразкового коліту, хвороби Крона або виразкового коліту у 5-АSА-резистентних або стероїдрезистентних пацієнтів.
13. Препарат за п. 11 або 12 для лікування або попередження виразкового коліту у 5-АSА-резистентних пацієнтів, де використовується доза від 0,5 до 8 г, зокрема від 2 до 6 г, фосфатидилхолінового продукту (ФХ) формули (І) на добу.
14. Препарат за будь-яким з пп. 11-13 для лікування або попередження виразкового коліту у 5-АSА-резистентних пацієнтів, де добова доза фосфатидилхолінового продукту (ФХ) формули (І) використовується два або три, або чотири рази на добу.
15. Препарат за будь-яким з пп. 11-14 для лікування виразкового коліту у 5-ASA-резистентних пацієнтів, де добова доза від 0,5 до 8 г фосфатидилхолінового продукту (ФХ) формули (І) використовується у формі ФХ-вмісних пелет в упаковці на один прийом.
Текст
Реферат: Винахід стосується фармацевтичного препарату, що містить фосфатидилхоліновий продукт формули (І) , (I) 1 2 де R є залишком насиченої або ненасиченої жирної кислоти з 12-24 атомами вуглецю і R є залишком насиченої або ненасиченої жирної кислоти з 12-24 атомами вуглецю, і де фосфатидилхоліновий продукт (ФХ) містить наступні кількості жирних кислот: 55-72 лінолевої кислоти, 10-18 пальмітинової кислоти, UA 115585 C2 (12) UA 115585 C2 07-15 олеїнової кислоти, 02-08 ліноленової кислоти, 02-08 стеаринової кислоти, і принаймні один наповнювач для уповільненого вивільнення, призначеного для лікування виразкового коліту. UA 115585 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід належить до фармацевтичних препаратів, що містять фосфатидилхолін, для лікування хронічних запальних захворювань, таких як неспецифічний виразковий коліт, і, зокрема виразкового коліту у пацієнтів, що не піддаються лікування ASA. Фосфатидилхоліни (ФХ) є відомим класом продуктів природного походження. Вони можуть виявлятись разом з іншими ліпідними компонентами як один компонент в лецитинах в тваринних та рослинних тканинах. Типовий фосфатидилхолін складається з наступних структурних елементів: фосфорна кислота, холін, жирні кислоти і гліцерол. Композиція жирно кислотних залишків в ФХ має важливий вплив на властивості фосфатидилхоліну. Фосфатидилхоліни можуть бути синтезовані або екстраговані хімічно або механічно з природних джерел, таких як соєві боби інші рослини або яйця. Фосфатидилхоліни як правило є слабкорозчинними у воді, але можуть бути диспергованими у воді. Вони не є особливо стійкими в кислому середовищі. Різні хронічні запальні захворювання, такі як виразковий коліт, вражають дітей і дорослих з тяжкими наслідками. Ці захворювання, такі як виразковий коліт, характеризуються частими нападами водянистої діареї, що супроводжується кров'яними та/або слизовими виділеннями. Інші симптоми включають судоми або спазми, біль у животі, біль у відкритті кишечника, невідкладну і часту потребу у розтині кишечника, відчуття неповного випорожнення кишечника, нудоту, відсутність апетиту, втрату ваги, втому, шкірний висип, виразки ротової порожнини, болі в суглобах і анемію. Хронічні запальні захворювання і неспецифічний виразковий коліт більше ніж товсту кишку вражає лише пряму кишку. Симптоми змінюються залежно від ступеня запалення в кишечнику і того, чи буде вистілка кишечника вкрита виразками. Хронічний виразковий коліт також може викликати зміни в печінці, склерозуючий холангіт і може збільшити ризик розвитку раку кишечника. Кілька способів лікування хронічних запальних захворювань були описані в літературі, однак багато методів не можуть застосовуватися протягом тривалого періоду часу та/або мають серйозні побічні ефекти. Документ WO 1995/18622 описує застосування 2-гідрокси-5-фенілазобензойної кислоти як хіміозахисної речовини для лікування захворювань товстої кишки. В WO 2000/07577 описане використання фосфатидилхоліну для лікування захворювань кишечника. US 6 677 319 розкриває використання фосфатидилхоліну, що містить лецитинову композицію для лікування коліту, проте використовуваний фосфатидилхоліновий продукт має високий вміст фосфатидилетаноламіну (ФЕ) і фосфатидилінозитолу (ФІ). Зазвичай відомі лецитинові продукти можуть містити 30 - 70 % за вагою ФХ, але також містять 18 - 21 % (ФE) і 68 % (ФІ), які часто вносять незначний внесок або не вносять внеску у фармацевтичну або клінічну активність. Крім того, не задовольняє стабільність використовуваного фосфатидилхолінового продукту. В WO 2009/015891 та EP-A 2185158 згадується лікування пацієнтів з стероїд залежним виразковим колітом з застосуванням лецитинового продукту, який, однак, має високий вміст фосфатидилетаноламіну (ФЕ) і фосфатидилінозитолу (ФІ). Збагачена фосфатидилхоліном фосфоліпідна суміш (Centroplex FP) зазвичай містить не менше 30 % ФХ, 18-21 % фосфатидилетаноламіну і 6-8 % фосфатидилінозиту. Лікарські препарати, що містять 43,10 % Centrolex, мікрокристалічну целюлозу, стеарат магнію і гідратований діоксид кремнію, були залиті Eudragit®. Уповільнене вивільнення фосфатидилхоліну для пацієнтів з хронічним активним виразковим колітом описуються W. Stremmel в GUT, British Medical Association (Vol. 54, No. 7, 01 July 2005, pages 966-971). Ці ФХ-препарати містять значні кількості інших фосфоліпідів, препарати уповільненого вивільнення приводять до деяких побічних ефектів, таких як метеоризм. Оскільки ці побічні ефекти можуть спостерігатися з високою частотою, нові препарати необхідні для поліпшення відповідності для пацієнтів. Багата на ФХ фосфоліпідна суміш, що використовувалась W. Stremmel (Sterpur P-30 Granulat; Stern-Lecithin and Soja GmbH, Hamburg, Germany), містила 30 % фосфатидилхоліну, 21 % фосфатидилетаноламіну та 8 % фосфатидилінозитолу. Фосфатидилхолінові гранули уповільненого вивільнення складалися з лецитину (від Stern), залитого Eudragit®, Avicel® PH102 (FMC Company, USA) та Syloid® 244 (кремнезем). Комерційні продукти фосфатидилхоліну/лецитину, такі як Sigma P5638, часто містять лише менше 50 відсотків за вагою ФХ і великі кількості, наприклад, фосфатидилетаноламіну (ФЕ) і фосфатидилінозитолу (ФI). Інші комерційні продукти фосфатидилхоліну/лецитину містять значну кількість неполярних ліпідів і/або похідних фосфатидилетаноламіну. Фосфатидилхоліновий продукт (ФХ) згідно з цим винаходом може бути описаний як "по суті не містить фосфатидилінозитолу (ФI) і фосфатидилетаноламіну (ФЕ)", що відповідає менше, ніж 1 UA 115585 C2 5 10 15 20 25 30 35 40 45 50 55 60 0,1 % за вагою, відповідно, всього ліпідного вмісту продукту. C. Vetter описує різні варіанти лікування запальних захворювань кишечника і нові аспекти для встановлених методів лікування в European Gastroenterology and Hepatology Review 2011 (Vol. 7, No. 2, May 2011, pages 104-107), проте, публікація тільки в загальному описує клінічне дослідження лецитинового продукту, не описуючи використовуваний фармацевтичний препарат. Крім того, W. Stremmel розкриває фосфатидилхолін для стероїд-резистентного виразкового коліту в Annals of Internal Medicine, New York (Vol. 147(9), 06.11.2007), але розкритий фосфатидилхоліновий продукт включає велику кількість фосфатидилетаноламінів та інших фосфоліпідів. Виразковий коліт є загальним хронічним запальним захворюванням кишечника у дорослих і дітей. Він визначається як дифузний запальний стан слизової оболонки товстої кишки, який може поширюватись від прямої кишки до сліпої кишки, викликаючи ерозії слизової оболонки товстої кишки. Під час клінічного перебігу захворювання проксимальне поширення можна спостерігати у багатьох пацієнтів з початково діагностованим проктосигмоїдитом. Основними проявами є панколіт, правобічний коліт, лівобічний коліт, проктит і проктосигмоїдит. У деяких випадках крім ректального та сигмовидного запалення можна спостерігати ізольоване ураження сліпої кишки. Типовими симптомами є кривавий пронос, біль під час дефекації, спазми, лихоманка, анемія, втрата ваги. Етіологія неспецифічного виразкового коліту невідома. На підставі епідеміологічних досліджень, обговорюється, що поруч з генетичною схильністю додаткові фактори, як-то впливи навколишнього середовища, викликають захворювання. Порушений слизовий бар'єр, здається, ініціює фактор захворювання, а наступні атаки з боку умовно-патогенної бактеріальної флори товстого кишечника призводять до запалення слизової оболонки. Як правило, клітини слизової оболонки захищені від подібних атак за допомогою безперервного, гідрофобного і прилеглого шару слизу. Цей шар містить фосфоліпіди, які створені з фосфатидилхоліну і лізофосфатидилхоліну. Класичне лікування виразкового коліту орієнтоване на контроль за спалахом і зменшенням шансів подальших спалахів чи ускладнень. Протягом багатьох років лікарська сполука месалазин (5-аміно-2-гідрокси-бензойна кислота) була стандартною терапією легкого та помірного виразкового коліту. Месалазин і лікарські сполуки сульфалазин, олсалазин, балсалазин разом також називають 5-ASA-сполуками. Однак, спостерігається підвищення кількості пацієнтів, резистентних до ASA. Багато пацієнтів стають 5-ASA-резистентними або не переносять 5-ASA-сполуки, особливо месалазин. Інші методи лікування виразкового коліту і загострень включають терапію стероїдами, використання імунних супресантів, використання TNF-антагоністів і/або хірургічне втручання. Незважаючи на те, що стероїди часто є ефективними в зниженні нападів запалення, несприятливі побічні ефекти пов'язані з довгостроковим використанням стероїдів. ASAрезистентність в контексті даного винаходу означає, що симптоми хвороби неспецифічного виразкового коліту суттєво не поліпшуються за допомогою вказаних вище 5-ASA-сполук і зокрема 5-аміно-2-гідрокси-бензойної кислоти. Даний винахід належить до лікування виразкового коліту за допомогою окремих препаратів окремих продуктів фосфатидилхоліну. Винахід також належить до нових препаратів, як описано у формулі винаходу. Фосфатидилхоліни несуть відповідальність за створення захисної гідрофобної поверхні, відіграючи ключову роль у оборонних процесах слизової оболонки. Пацієнти з виразковим колітом мають значно менше фосфатидилхоліну в своєму кишковому слизі в порівнянні з пацієнтами з хворобою Крона і здоровими людьми. Пошкоджений фосфатидилхоліновий шар може призвести до запалення і виразки. Фосфатидилхолін та інші ліпіди, як було показано в літературі, інгібують прозапальні сигнальні процеси і полегшують протизапальну активність, викликану виразковим колітом. З in vitro та in vivo експериментів на мишах і щурах видно, що фосфатидилхолін активно секретується в клубовій кишці. Фосфатидилхоліни безперервно переміщуються від сліпої кишки в пряму кишку за допомогою товстокишкової активності, пряма кишка є останньою ділянкою, що постачається фосфатидилхоліном. Одним із завдань винаходу є розробка нових фармацевтичних композицій для лікування виразкового коліту, зокрема лікування виразкового коліту у пацієнтів, резистентних до класичного лікування (наприклад, 5-ASA, стероїдами або імуносупресантами). Ці препарати мають підвищену ефективність і/або менш важкі наслідки або побічні ефекти, ніж обмежені можливості лікування наявними відомими класичними препаратами. Крім того, з меншою частотою спостерігаються побічні ефекти (наприклад, метеоризм). Крім того, добова доза ФХ у багатьох випадках може бути низькою, що покращує 2 UA 115585 C2 5 10 15 прихильність пацієнтів до терапії. Ці препарати часто являють собою дозовану лікарську форму, утворену чисельними структурно відокремленими одиницями, присутніми в упаковці лікарського засобу на один прийом, що містить точну кількість препарату для одного введення за один прийом, що робить можливою високу однорідність дозування на відміну від існуючих препаратів, які передбачені в багатодозових контейнерах і дозуються самими пацієнтами за допомогою мірного стаканчика. Оскільки деякі пацієнти мають серйозне прогресування захворювання, навіть при класичному довгостроковому лікуванні стероїдом та/або 5-ASA, для забезпечення кращої терапії також необхідні нові препарати. Інші пацієнти сприятливо не реагують або стають, по суті, несприйнятливими до лікування стероїдами та/або 5-ASA. Для пацієнтів, які мають 5-ASAрезистентне захворювання, може стати необхідним видалення товстої кишки. Даний винахід зокрема стосується фармацевтичного препарату, що містить специфічний фосфатидилхоліновий продукт (ФХ), для полегшення, принаймні, одного симптому виразкового коліту. Зокрема, фосфатидилхоліновий продукт (ФХ) комбінується з певними наповнювачами для затриманого вивільнення препарату, часто як дозована лікарська форма, утворена чисельними структурно відокремленими одиницями, присутніми в упаковці лікарського засобу на один прийом. В одному варіанті втілення, фармацевтичний препарат згідно з винаходом містить: a) принаймні, один фосфатидилхоліновий продукт (ФХ) формули (I), 20 H2C O CO R HC O CO O R H2C O P 1 2 + O 25 30 35 40 45 50 O CH2 CH2 N (CH3)3 (I) В якому: 1 R являє собою залишок насиченої або ненасиченої жирної кислоти з 12 - 24 атомами 2 вуглецю і R являє собою залишок насиченої або ненасиченої жирної кислоти з 12 - 24 атомами 1 2 вуглецю. R та R часто являють собою залишки насиченої або ненасиченої жирної кислоти з 14 - 24 атомами вуглецю. 1 2 Два жирно кислотних ланцюги R та R в формулі (I) часто не збігаються. Відсоток залишків 1 2 ненасичених жирних кислот для R в одному варіанті втілення винаходу є нижчим, ніж для R , 1 2 наприклад, R має менше, ніж 70 % (за вагою) ненасичених жирних кислот, тоді як R має більше, ніж 90 % ненасичених жирних кислот. Фосфатидилхоліновий продукт (ФХ) в цілому містить наступні кількості жирних кислот (у вагових відсотках від загальної кількості жирних кислот в ФХ): 55 - 72 лінолевої кислоти 10 - 18 пальмітинової кислоти 07 - 15 олеїнової кислоти 02 - 08 ліноленової кислоти 02 - 08 стеаринової кислоти. Фосфатидилхоліновий продукт (ФХ) може додатково містити невеликі кількості залишків інших жирних кислот з 12 - 24 атомами вуглецю (наприклад, до 1,5 % за вагою). Фосфатидилхоліновий продукт (ФХ) переважно означає, принаймні, 94 % за вагою всіх ліпідних/фосфоліпідних компонентів препарату. Фосфатидилхоліновий продукт (ФХ) згідно з даним винаходом може також бути описаний як "по суті вільний від фосфатидилінозитолу (ФІ) та фосфатидилетаноламіну (ФЕ)", що відповідає менше, ніж 0,1 ваг./ваг. % фосфатидилінозитолу (ФІ) та фосфатидилетаноламіну (ФЕ)", відповідно, всього ліпідного вмісту продукту. В одному варіанті втілення винаходу, використовуваний фосфатидилхоліновий продукт (ФХ) містить наступні кількості жирних кислот або по суті складається з цих жирних кислот (у вагових відсотках від загальної кількості жирних кислот в ФХ): 59 - 70 лінолевої кислоти 12 - 17 пальмітинової кислоти 3 UA 115585 C2 5 10 15 20 25 30 35 40 45 50 55 60 07 - 15 олеїнової кислоти 03 - 07 ліноленової кислоти 02 - 05 стеаринової кислоти. Часто, використовуваний фосфатидилхоліновий продукт (ФХ) містить від 10 до 15 % залишків олеїнової кислоти, переважно більше, ніж 10 - 12 % залишків олеїнової кислоти. Крім того, фармацевтичний препарат згідно з винаходом містить: b) принаймні, один фармацевтично прийнятний наповнювач (який не є фосфоліпідом). Часто, фармацевтичний препарат згідно з винаходом містить декілька (два або більше) різних наповнювачів. Використовуваний фосфатидилхоліновий продукт (ФХ) може бути одержаний, наприклад, з соєвого лецитину із застосуванням етапів відомих процесів. Різні наповнювачі можуть бути придбаними або можуть бути отриманими фахівцем у цій галузі. ФХ-вмісний препарат часто містить фосфоліпідний компонент, головним чином (≥ 90 %) фосфатидилхолін (ФХ). Часто ліпідні/фосфоліпідні компоненти містять до ≥ 94 % за вагою, часто до ≥ 95 % за вагою фосфатидилхоліну. Як правило, вони містять тільки невеликі кількості інших ліпідних/фосфоліпід них компонентів. Ліпідні компоненти (в ФХ-вмісному препараті) переважно містять інші фосфоліпідні компоненти в кількості меншій, ніж 0,1 % (такі як (ФЕ) та (ФІ)). На додаток до більш високого ступеня збагачення активного ФХ в ФХ-вмісному препараті активний фармацевтичний інгредієнт ФХ набагато краще охарактеризований, ніж відомі лецитинові продукти, включаючи моніторинг складу жирних кислот в дигліцеридфосфатидилхоліні. Винахід зокрема стосується ФХ-препарату з рН-контрольованим вивільненням, який демонструє резистентність до шлункових кислот і гарантує високе вивільнення ФХ в кишечнику. Може бути продемонстровано з допомогою рідинної хроматографії/мас-спектрометричного аналізу (РХ/МС), що ліпідні компоненти, які містяться в композиції, включають до ≥ 94 % за вагою ФХ і містять ≤ 3 % за вагою неполярних ліпідів. Загальні ліпідні компоненти в препараті переважно містять ≤ 2 % за вагою (вільних) тригліцеридів і ≤ 3 % за вагою лізофосфатидилхоліну. Загальні ліпідні компоненти в препараті переважно також містять ≤ 0,1 % за вагою фосфатидилетаноламіну (ФЕ) та ≤ 0,1 % за вагою фосфатидилінозитолу (ФІ). Фармацевтичний препарат в одному варіанті втілення винаходу вивільняє, принаймні, 50 % за вагою, зокрема, принаймні 70 %, переважно, принаймні, 80 %, фосфатидилхолінового продукту (ФХ) в кишечник. Це може бути виміряно згідно зі стандартними in-vitro моделями (див. Європейську Фармакопею 7.6, метод 2.9.3 або подібні методи). Наповнювачі фармацевтичного препарату в переважному варіанті здійснення вибирають таким чином, щоб, принаймні, 50 %, переважно, принаймні, 70 %, більш переважно, принаймні, 80 % за вагою фосфатидилхолінового продукту (ФХ) вивільнялось у кишечник пацієнта, як визначено за допомогою стандартних in vitro моделей. Переважно, наповнювачі фармацевтичного препарату вибирають таким чином, щоб найвищий відсоток (принаймні, 50 %, переважно, принаймні, 70 %) фосфатидилхолінового продукту (ФХ) доставлявся в товсту кишку. Фармацевтичні препарати згідно з винаходом, як описано, переважно є оральними препаратами, але інші шляхи введення, в принципі, також є можливими. Фармацевтичні препарати згідно з винаходом часто передбачені в упаковці на один прийом, такій як саше (наприклад, що містить адекватну кількість ФХ-пелет на один прийом). Винахід також стосується фармацевтичного препарату, що містить, принаймні, один 1 фосфатидилхоліновий продукт (ФХ) формули (I), де R є залишком насиченої або ненасиченої 2 жирної кислоти з 14 - 22, зокрема з 14 - 20 атомами вуглецю, і R є залишком насиченої або ненасиченої жирної кислоти з 14 - 22, зокрема з 14 - 20 атомами вуглецю, і де фосфатидилхоліновий продукт (ФХ) містить наступні кількості жирних кислот (у вагових відсотках від загальної кількості жирних кислот в ФХ): 59 - 70 лінолевої кислоти 12 - 17 пальмітинової кислоти 07 - 15 олеїнової кислоти, (часто > 10 - 12) 03 - 07 ліноленової кислоти 02 - 05 стеаринової кислоти. Як правило, кількості вказаних жирних кислот (у вагових відсотках від загальної кількості жирних кислот в ФХ) складають: 62 - 68 лінолевої кислоти 12 - 15 пальмітинової кислоти 07 - 12 олеїнової кислоти, (часто > 10 - 12) 05 - 07 ліноленової кислоти 4 UA 115585 C2 5 10 02 - 04 стеаринової кислоти. 1 Часто, більше, ніж 78 %, зокрема більше, ніж 80 %, за вагою жирнокислотних залишків R та 2 R фосфатидилхоліну являють собою ненасичену жирну кислоту з 18 атомами вуглецю. Фосфатидилхоліновий продукт (ФХ) переважно одержують із спеціальних природних джерел. Цими джерелами можуть бути, наприклад, рослини, такі як соєві боби. Такими джерелами також можуть бути, наприклад, тварини, такі як яєчний жовток. Фосфатидилхоліновий продукт (ФХ), крім того, може бути також одержаний за допомогою хімічного синтезу. Способи хімічного приготування фосфатидилхолінових продуктів з специфічних жирнокислотних залишків відомі хімікам. ФХ може містити невеликі кількості інших жирнокислотних залишків, наприклад, загальну кількість від 0,1 до 1,5 % (за вагою), зокрема від 0,1 до 1,0 %, переважно менше, ніж 1 % інших насичених або ненасичених жирних кислот, зокрема з 14 - 22 атомами вуглецю. Один процес виробництва певного ФХ-продукту може бути описаний як нижчевказаний, де вихідним матеріалом є соя: 15 20 25 30 35 Винахід також стосується фармацевтичного препарату, що містить, принаймні, один фосфатидилхоліновий продукт (ФХ) формули (I), де, принаймні 75 %, зокрема, принаймні, 80 % 1 2 за вагою, часто більше, ніж 80 % за вагою жирно кислотних залишків R та R є ненасиченою жирною кислотою з 18 атомами вуглецю. Винахід також стосується фармацевтичного препарату, де фармацевтичний препарат складається з або містить кишковорозчинну пелету(и), кишковорозчинну таблетку(и), кишковорозчинну капсулу(и) або кишковорозчинну гранулу(и), що містять фосфатидилхоліновий продукт (ФХ) та, принаймні, один шар, принаймні, одного кишковорозчинного полімеру, що є стійким до шлункових кислот. Стійкий до шлункових кислот означає, що при значенні pH 1 через 2 години менше, ніж 10 відсотків ФХ вивільняється з покритого ФХ-препарату. Винахід, зокрема, стосується фармацевтичного препарату у вигляді дозованої лікарської форми, утвореної множиною структурно відокремлених одиниць (містить декілька кишковорозчинних пелет), присутньої в упаковці на один прийом (такій як саше) і яка містить точну кількість пелет для одного прийому). Винахід також стосується фармацевтичного препарату, в якому вагове співвідношення кишковорозчинного полімерного покриття і фосфатидилхолінового продукту (ФХ) складає від 10:1 до 1:10, часто від 5:1 до 1:5. В деяких варіантах втілення, це співвідношення складає від 3:1 до 1:3, зокрема від 2:1 до 1:2. Фармацевтичний препарат часто має вагове співвідношення кишковорозчинного полімерного покриття і фосфатидилхолінового продукту у (ФХ) від 3:1 до 1:3 і має ФХ-продукт у вигляді дозованої лікарської форми, утвореної множиною структурно відокремлених одиниць. 5 UA 115585 C2 5 10 15 20 25 30 35 Це вагове співвідношення кишковорозчинного полімерного покриття і фосфатидилхолінового продукту (ФХ), як було виявлено, попереджує деякі побічні ефекти, такі як метеоризм. Для деяких варіантів втілення, на додачу до кишковорозчинного полімерного покриття використовуються додаткові наповнювачі (такі як гіпромелоза або амілоза) для того, щоб сформувати ядро разом з ФХ, яке захищає активний інгредієнт. Винахід також стосується фармацевтичного препарату, що містить одну (або декілька) кишковорозчинну пелету(и), або кишковорозчинну капсулу(и), або кишковорозчинну гранулу(и), або кишковорозчинну таблетку(и), що мають кишковорозчинне полімерне покриття товщиною від 10 до 800, зокрема від 10 до 500 мікрометрів. Товщина покриття пелет часто становить від 10 до 300 мікрометрів, товщина покриття капсул часто становить від 50 до 800 мікрометрів. Поєднання певної товщини покриття пелет і консистенції ФХ-продукту призводить до збільшення стабільності. Винахід також стосується фармацевтичного препарату, що містить фосфатидилхоліновий продукт (ФХ), захищений, принаймні, одним кишковорозчинним полімерним покриттям, що є стійким до шлункових кислот (pH 1) протягом, принаймні, 120 хвилин (вивільняє ФХ повільніше, ніж 10 %), але дозволяє, принаймні, 80 % фосфатидилхолінового продукту (ФХ) бути вивільненими з препарату при pH 5,5 або вище протягом 120 хвилин. Винахід також стосується фармацевтичного препарату, що містить, принаймні, один кишковорозчинний полімер з групи гомополімерів та кополімерів акрилової кислоти, метакрилової кислоти, акрилових естерів та метакрилових естерів. Також можуть бути використані суміші гомополімерів та кополімерів. Переважні полімери використання як кишковорозчинних наповнювачів (наприклад, Eudragit® L30 D55-L100-55) будуть описані пізніше. Винахід також стосується фармацевтичного препарату, що містить від 20 до 30 % за вагою фосфатидилхолінового продукту (ФХ) формули (I) та від 70 до 80 % за вагою наповнювачів (в цілому). Вага наповнювачів вимірюється в сухому вигляді. В деяких типах препаратів, таких як покриті капсули, кількість фосфатидилхолінового продукту (ФХ) може бути вищою, такою як, наприклад, до 70 % за вагою. Часто від 35 до 70 % за вагою ФХ комбінується з 55 - 30 % за вагою наповнювачів в цих покритих ФХ-капсулах. Винахід також стосується фармацевтичного препарату, having a long term stability, characterized by the amount of принаймні, 95 % за вагою аналізованого ФХ (відносно номінального значення) і менше, ніж 5 % за вагою лізо-ФХ (відносно ФХ) після 36 місяців зберігання в холодильнику (5 °C плюс/мінус 3 °C). Одним додатковим аспектом згідно з винаходом є спосіб одержання фармацевтичного препарату, як описано вище, що включає операцію приготування пелет або таблеток, або капсул, або гранул, що містять, принаймні, один фосфатилхолін (ФХ) формули (I), H2C O CO R HC O CO O R 1 2 + H2C O P O 40 45 50 1 O CH2 CH2 N (CH3)3 (I) 2 де R і R є такими, як визначено вище, а фосфатидилхоліновий продукт (ФХ) містить наступні кількості жирних кислот (у вагових відсотках від загальної кількості жирних кислот в ФХ): 55 - 72 лінолевої кислоти 10 - 18 пальмітинової кислоти 07 - 15 олеїнової кислоти 02 - 08 ліноленової кислоти 02 - 08 стеаринової кислоти, а потім надання пелет або капсул, або гранул, або таблеток з, принаймні, одним шаром кишковорозчиного покриття. Переважні ФХ-продукти (з точно визначеними залишками жирних кислот) одержують за цим методом, як описано вище. Один додатковий аспект згідно з винаходом стосується препарату, як описано вище, для 6 UA 115585 C2 5 10 15 20 25 30 35 40 45 50 55 60 лікування або попередження стану або захворювання, вибраних з наступних: виразковий коліт, хвороба Крона, запалення у виключеній кишці, інфекційний ентерит, інфекційний коліт, запалення в результаті опромінення і запалення через хіміотерапію або хімічні речовини, зокрема для лікування виразкового коліту у 5-ASA-резистентних пацієнтів. Препарати, зокрема, застосовують для лікування (включаючи підтримання статусу) або попередження виразкового коліту, хвороби Крона або виразкового коліту у 5-ASA-резистентних або стероїдрезистентних пацієнтів. Вони також можуть бути використані для лікування або попередження виразкового коліту у 5-ASA-резистентних пацієнтів, де застосовується доза від 0,5 до 8 г, зокрема від 2 до 6 г, фосфатидилхолінового продукту (ФХ) формули (I) на добу. Ця доза часто застосовується в упаковці на один прийом (наприклад, саше), що містить достатню кількість дозованої лікарської форми, утвореної множиною структурно відокремлених одиниць (наприклад, ФХ-пелети), протягом одного моменту дозування. Для лікування або попередження виразкового коліту у 5ASA-резистентних пацієнтів, добова доза фосфатіділхолінового продукту (ФГ) формули (I) може бути застосована (порціями, часто у рівних долях) два або три рази, або чотири рази на добу, часто три або чотири рази на добу. В одному варіанті втілення, препарат (наприклад, кишковорозчинний препарат), що містить фосфатидилхоліновий продукт (ФХ) формули (I), застосовується пацієнтом з виразковим колітом, при якому терапевтично ефективну кількість фосфатидилхоліну (ФХ) використовують для полегшення, принаймні, одного симптому виразкового коліту. В іншому варіанті втілення даний винахід стосується для полегшення, принаймні, одного симптому виразкового коліту у пацієнтів з 5-ASA-резистентним або стероїд резистентним виразковим колітом. При застосуванні стандартних пероральних препаратів фосфатидилхоліновий продукт або, принаймні, значна частина ФХ вступає в контакт з поверхнею шлунка і буде розкладатися. Щоб звести до мінімуму взаємодію ФХ з шлунком тварини або людини, вивільнення специфічного ФХ може бути спрямоване в малу або товсту кишку, зокрема в товсту кишку. Для направленого вивільнення згідно з даними винаходом може бути застосовано декілька технологій приготування препаратів. Однією окремою технологією приготування препаратів для уповільненого вивільнення є одержання кишковорозчинних препаратів, таких як таблетки з покриттям, капсули з покриттям, пелети з покриттям або гранули з покриттям. Зокрема, кишковорозчинні ФХ-пелети зменшать деградацію ФХ і системне поглинання в шлунку і верхньому шлунково-кишковому тракті. Кишковорозчинний препарат в цьому контексті означає, зокрема, що композиція (наприклад, гранули або пелети, або капсули), що містить ФХ, комбінується, наприклад, з покриттям з матеріалу, що дозволяє фосфатидилхоліну проходити через кислотний шлунок з обмеженим вивільненням або без будь-якого вивільнення ФХ в шлунку. ФХ транспортується в кишечник або в певну частину кишечника до того, як ФХ вивільниться при рН 5,5 або вище. Термін "кишковорозчинний" означає, зокрема, що вивільнення ФХ спрацьовує або в тонкій кишці, або в товстій кишці, або в обох відділеннях. Вибір оптимального сайту вивільнення залежить від передбачуваних локальних концентрацій, заданого часу/профілю концентрації в сайті-мішені (наприклад, товстій кишці) дії ФХ. Термін "наповнювач" означає фармакологічно неактивну речовину, яка використовується як носій для активної речовини та/або конструювання препаратів або лікарських засобів. Термін "наповнювач" включає фармацевтично прийнятний, фармакологічно неактивний інгредієнт, такий як сполучна речовина, наповнювач, сполука, що утворює покриття, пластифікатори для покриттів і сполука, яка маскує запахи. Деякими прикладами додаткових наповнювачів є пігменти, розпушувачі, антиоксиданти, ароматизатори, підсолоджувачі, барвники, речовини, що надають непрозорість, антиадгезиви, консерванти, ковзні речовини, змащувальні речовини, сорбенти і агенти, що утворюють ізолюючий шар. Придатні речовини відомі в даній галузі. Термін "наповнювач", застосовані до фармацевтичних препаратів згідно з винаходом, також стосується розріджувачів або носіїв, з якими вводять активну речовину. Такі фармацевтичні наповнювачі можуть бути тваринного, рослинного або синтетичного походження, також див. A. th R. Gennaro (20 Edition in "Remington: The Science and Practice of Pharmacy", 2001). Термін "капсула" означає фармацевтично прийнятний випадок, що містить дозу однієї активної речовини або комбінацію діючих речовин і один наповнювач або комбінацію наповнювачів, яка покрита полімерною оболонкою, яка, наприклад, в основному складається з желатину, крохмалю або целюлози, або хімічних похідних і комбінацій цих полімерів. Капсули можуть бути м'якими або твердими капсулами. Їх вміст може бути твердим, напівтвердим або рідким. 7 UA 115585 C2 5 10 15 20 25 30 35 40 45 50 55 60 Термін "гранула" означає агрегати частинок, наприклад, частинки порошку, для одержання мультичастинкової одиниці. Згідно з фармацевтичними термінами гранула включає дрібні частинки, зібрані в більші, постійно агрегуючі, в яких все ще можуть бути ідентифіковані оригінальні частинки. Гранули можуть бути отримані в процесі грануляції, в якому частинки порошку злипаються одна з одною за допомогою різноманітних фізичних механізмів. Такі процеси, як термопластичне гранулювання, пот-грануляція на основі водного або органічного розчинника, гранулювання в барабанному змішувачі, гранулювання в грануляторі з псевдозрідженим шаром, гранулювання шляхом розпилювальної сушки або грануляція сухого пресуванням, є відомими в галузі фармацевтичних композицій. Термін "негайне вивільнення" означає швидкість вивільнення, при якій, принаймні, 80 % активної речовини вивільняється через 30 хв. після перорального застосування препарату. Експериментальними умовами для вимірювання вивільнення є умови, визначені у Фармакопеї США, наприклад, USP 35, Method 711 (2012), див. також відповідну Європейську Фармакопею, наприклад, EP 7.6. На відміну від цього визначення, термін "препарат з уповільненим вивільненням" включає дозовану форму, яка вивільняє включену активну речовину з затримкою та/або контрольованим чином, та/або протягом певного періоду часу, як визначено більш докладно. Цей термін охоплює фармацевтичний препарат, що містить терапевтично ефективну кількість активної речовини (або її фармацевтично прийнятну сіль, сольват, поліморфну форму або її ізомер) і, принаймні, один наповнювач для затримки вивільнення. Термін охоплює кишковорозчинні препарати. Термін "дозована лікарська форма, утворена множиною відокремлених одиниць" охоплює дозовану форму, яка складається, принаймні, з двох одиниць, що містять ефективну кількість ФХ. Термін "одинична дозована лікарська форма" охоплює препарат, який складається тільки з однієї одиниці, яка містить ефективну кількість фосфатидилхоліну. Однак, часто кілька одиничних дозованих форм представлені в упаковці на один прийом, наприклад саше, що містить кількість пелет ФХ для одноразового введення. В одному варіанті втілення винаходу, препарат існує у вигляді (Single) саше, що містить від 0,5 до 8,0 г ФХ у формі пелет, зокрема, приблизно 3,2 г або 6,4 г пелет, зокрема для щоденного лікування виразкового коліту. Термін "пелета" означає сферичну частинку, як правило, створену за допомогою спеціальних технологій грануляції. Пелети можуть бути отримані шляхом нашарування активної речовини на вихідні частинки або шляхом екструзії та сферонізації або гранулювання в псевдозрідженому шарі, або за допомогою процесів термічної плавки, формування, охолодження. Пелети також можуть бути отримані шляхом гранулювання наповнювачів з водною дисперсією активного матеріалу з подальшою екструзією, сушінням, покриттям і т.д. Такі процеси для виготовлення пелет відомі в галузі розробки фармацевтичних препаратів. Термін "фармацевтично прийнятний" у зв'язку з речовиною означає інгредієнт або речовину, яка не впливає на безпеку пацієнта та/або добре переноситься пацієнтом після введення. Термін "поліморфна форма" охоплює активну речовину, фармацевтично прийнятну сіль, сольват або її ізомер, що утворюють різні кристалічні структури або кристалічні решітки. Термін "таблетка" означає будь-яку тверду фармацевтичну композицію, що містить активну речовину. Термін охоплює як пресовані препарати, так і непресовані препарати. Непресовані препарати можуть бути виготовлені, наприклад, за допомогою термічних процесів або плавлення. Таблетка може мати будь-яку форму, що є звичною в галузі таблеток, таку як кругла форма, прямокутна форма або овальна форма, або опукла форма, або форму диска або форму валика. Форма може бути нерегулярною. Цей термін також включає в себе термін "мінітаблетка" і "мікротаблетка". Такий термін відомий в галузі фармацевтичних композицій. Таблетка може бути виготовлена з гранул та/або пелет. Обробка гранул або пелет в таблетки є відомою фахівцям у даній галузі. Винахід також належить до фармацевтичних препаратів, що містять, принаймні, один ФХпродукт формули (I), як описано вище, і, принаймні, один наповнювач для уповільненого вивільнення фосфатидилхоліну. Ці ФХ-препарати значно знижують небажане системне поглинання ФХ, знижують деградацію ФХ та роблять можливим високе дозування фосфатидилхоліну, що водиться перорально, для доставки в товсту кишку. Ці фармацевтичні препарати також мають високий ступінь стабільності (впродовж терміну зберігання). Фосфатидилхолін (ФХ) згідно з вищевказаною формулою (I) може вводитись у препараті уповільненого вивільнення один раз на добу, переважно в пероральному препараті уповільненого вивільнення один раз на добу, але два рази на добу, чотири рази на добу і інші препарати можливі. 8 UA 115585 C2 5 10 15 20 25 30 35 40 45 50 55 60 В одному варіанті втілення фосфатидилхолін (ФХ) уповільненого вивільнення є рНзалежним. Залежні від рН препарати уповільненого вивільнення можуть містити один або більше наповнювачів, переважно у формі шару, що оточує ФХ або ядро, яке містить ФХ, що є стійкими до дії шлункових кислот (наприклад, pH 1,0) протягом декількох годин, наприклад, 2 годин або більше. ФХ-вмісні пелети згідно з цим винаходом можуть містити ФХ, описаний вище, і зв'язуючі речовини (такі як целюлоза) і дезінтегранти (такі як двоокис кремнію), а також інші наповнювачі, відомі для приготування таких препаратів. В одному варіанті втілення, pH-залежне покриття містить амілозний компонент, що може руйнуватись, зокрема, за допомогою мікроорганізмів в товстій кишці. продуктивність таких амілозних компонентів в покриттях була продемонстрована в сцинтиграфічному дослідженні Ibekwe (Alimentary Pharmacology & Therapeutics 28, 2008). Капсули з ФХ-ядром або ФХ-пелети з комбінацією Eudragit® (наприклад, L30-D55) і амілозного покриття розпадаються в товстій кишці, як потрібно. В одному варіанті втілення препарат з pH-залежним уповільненим вивільненням ФХ містить, принаймні, один контролюючий вивільнення наповнювач, який є полімером, вибраним з групи: гомополімерів та кополімерів акрилової кислоти, метакрилової кислоти, акрилових естерів та метакрилових естерів. В одному варіанті втілення невеликі кількості (до 10 %) інших мономерів також можуть бути використані в кополімерних композиціях. Також для шару уповільненого вивільнення можуть бути використані суміші гомополімерів і кополімерів. Переважні полімери для використання як кишковорозчинних наповнювачів є комерційними продуктами такого типу, як Eudragit® L-30-D55. В одному варіанті втілення препарат ФХ містить інший наповнювач, наприклад, гідроксипропілметилцелюлозу (гіпромелоза) або полівініловий спирт, або полівінілацетат, або полівініловий спирт, прищеплений до поліетиленгліколю. Додаткові придатні компоненти і полімери для кишковорозчинних препаратів є контролюючими вивільнення і модифікованими ліпідами та восками, наприклад, бджолиним воском або синтетичними моно-, ди- і тригліцеридами середньо ланцюгових і довго ланцюгових жирних кислот. В одному додатковому варіанті втілення препарат ФХ містить шелак як наповнювач. Деякі контролюючі вивільнення наповнювачі, що базуються на поліметакрилаті та/або поліметакрилатних кополімерах, є, наприклад, комерційно доступними під торговими найменуваннями Eudragit® (Evonik Industries, Germany). Наступні полімери можуть бути використані для приготування, наприклад, кишковорозчинних пелет або гранул, що містять ФХ: Eudragit® L та/або Eudragit® S. Типовими марками є, наприклад, Eudragit® L30, Eudragit® L30D55. Іншими марками є Eudragit® S100, Eudragit® FS, Eudragit® RS 30 D, Eudragit® RL 30 D, Eudragit® NE 40 D, Eudragit® RS PO та Eudragit® NE 30 D, Eudragit® SS, Eudragit® L100-55 або комбінація двох чи більше вказаних марок. Eudragit® L30-D55 містить аніонний полімер, що базується на метакриловій кислоті та етилакрилаті. Eudragit® L30-D55 є водною дисперсією, що містить 30 % за вагою кополімеру. Цей покривний матеріал є переважним. Eudragit® S 100 містить аніонний кополімер, що базується на метакриловій кислоті і метилметакрилаті. Eudragit® RL 30 містить від 10,18 до 13,73 % фрагментів мета крилату амонію, виходячи з сухої речовини, визначеної згідно з Європейською Фармакопеєю 2.2.20. Відносна кількість кишковорозчинного покриття, необхідна в ФХ-препаратах для досягнення бажаного характеристик вивільнення, залежить, серед іншого, від вибраного типу та марки полімеру, наявності чи відсутності інших наповнювачів, що впливають на вивільнення активної речовини, та від бажаного навантаження лікарського препарату. Вагове співвідношення кишковорозчинного полімеру (розраховане за сухою вагою) і активної речовини (ФХ), як правило, вибирають з діапазону від 100:1 до 1:100 або від 50:1 до 1:100, або від 10:1 до 1:100. В окремому варіанті втілення, співвідношення полімерного наповнювача і активної речовини складає від 5:1 до приблизно 1:5, часто від 3:1 до приблизно 1:3 (мас./мас.). Наприклад, стійкі до шлункової кислоти (pH 1) речовини можуть містити покриття и носії, такі як полімери/кополімери, що продаються як Eudragit®. Комерційні продукти Eudragit® L та/або Eudragit® S, та/або Eudragit® FS і, особливо, полімер Eudragit® L30 можуть бути використані як наповнювачі. Приклади переважних pH-залежних препаратів тривалого вивільнення містять від 0,5 до 10,0 г пелет на одне саше, що містять фосфатидилхолін (ФХ), покритий полімером, таким як Eudragit® L30-D55 (або Eudragit® S100, Eudragit® FS або сумішшю цих полімерів). В варіантах втілення вказаного вище препарату терапевтично ефективна кількість 9 UA 115585 C2 5 10 15 20 25 30 35 40 45 50 55 60 фосфатидилхолінового продукту (ФХ), що вводиться пацієнтові, складає від 0,5 г до 8 г на добу. Переважний діапазон включає від 2 г до 5 г на добу. В іншому переважному варіанті втілення терапевтично ефективна кількість фосфатидилхоліну, що вводиться пацієнтові, складає від приблизно 3 до 4 г на добу. Згідно з одним варіантом втілення, препарат, що містить фосфатидилхолін, вводять незадовго до прийому їжі, зокрема, принаймні, за 60 хвилин (наприклад, від 60 до 90 хвилин) перед їжею. Частота введення препарату фосфатидилхоліну може складати від 1 до 8 разів на добу, переважною частотою є введення від 2 до 4 разів на добу. Введення препарату може тривати протягом, принаймні, 1 тижня, принаймні, 2 тижнів, принаймні, 2 місяців, принаймні, 3 місяців або так довго, як потрібно впродовж життя пацієнта. В деяких варіантах втілення даного винаходу введення вказаного вище ФХ-препарату може покращити показники індексу якості життя на, принаймні, 25 %, знизити гістологічний індекс на, принаймні, 25 %, покращити індекс ендоскопічної активності на, принаймні, 25 % і покращити індекс клінічної активності на, приблизно, 25 % або, в деяких випадках, припинити клінічну активність виразкового коліту. Інші варіанти втілення даного винаходу стосуються препаратів фосфатидилхоліну (ФХ) для полегшення, принаймні, одного симптому виразкового коліту у пацієнта, ідентифікованого як такого, що має виразковий коліт, несприйнятливий до 5-ASA або стероїдів. У деяких варіантах здійснення вищеописаного препарату фосфатидилхоліновий продукт (ФХ) може бути одержаний у вигляді препарату уповільненого вивільненням для перорального введення, в якому уповільнене вивільненням не залежить від рН, але залежить від часу, наприклад, вивільняючи ФХ тільки через 3 - 4 години після перорального введення. G. Fiorino (Current Medicinal Chemistry, 2010, 17, 1851-1857) описує такий тип покриття для мезалазину. Також L.F.A. Asghar описує мультичасткові препарати для ліків, направлених на товсту кишку (J. Pharm Pharmaceut. Sci, 9 (3), 327-338; 2006). Пероральні препарати з уповільненим вивільненням можуть бути отримані шляхом покривання гранул (або ядер), що містять фосфатидилхолін, одним або декількома шарами полімерів, які є стійкими до шлункової кислоти і вивільняють фосфатидилхолін рН-залежним чином в кишечник, наприклад, в нижній клубовій кишці або товстій кишці. У переважному варіанті здійснення, один або два шари, що містять або складаються з полімерів з рН-залежним уповільненим вивільненням, таких як Eudragit®, застосовуються на ФХ-вмісних ядрах. Зокрема, Eudragit® L 30-55 та/або Eudragit® S використовуються для покриття фосфатидилхолінових гранул (або ядер). В деяких варіантах втілення зовнішнє покриття містить Eudragit® L30-55 та/або Eudragit® L30D. Оральні препарати з pH-залежним уповільненим вивільненням можуть бути виготовлені, наприклад, як пелети, гранули, капсули або таблетки. Деякі лікарські препарати, націлені на товсту кишку, були описані M.K. Chourasia (J. Pharm. Pharmaceut. Sci 6(1); 33-66; 2003). Препарати згідно з даним винаходом можуть додатково містити звичайні фармацевтичні наповнювачі, включаючи сполучні речовини, розріджувачі, речовини-носії, агенти текучості, пігменти, розпушувачі, антиоксиданти, ароматизатори, підсолоджувачі, барвники, агенти, що надають непрозорість, антиадгезиви, консерванти, ковзні речовини, змащувальні речовини, сорбенти та агенти, що утворюють ізолюючий шар. В переважному варіанті здійснення даного винаходу передбачені саше (або інші контейнери), що містять пелети рН-залежного уповільненого вивільнення (або гранули) фосфатидилхоліну (ФХ), наприклад, які містять від 2 до 10 г ФХ-пелет. В іншому варіанті здійснення, фосфатидилхолін формули (I) упаковують у великому об'ємі в желатинові капсули. Желатинові капсули потім покривають, принаймні, одним шаром Eudragit® або іншого акрилатного або метакрилатного полімеру для рН-залежного уповільненого вивільнення. Ці капсули часто містять більш високі кількості ФХ у порівнянні з наповнювачами (наприклад від 65 % до 35 % за вагою), ніж, наприклад, описані пелети. Ефективність препаратів, описаних вище, можуть бути оцінені шляхом моніторингу пролікованих пацієнтів, використовуючи показники для оцінки тяжкості виразкового коліту, які відомі в даній галузі. Ці показники включають індекс клінічної активності (CAI), індекс ендоскопічної активності (EAI), гістологічний індекс (HI), простий клінічний індекс активності коліту (SCCAI), шкалу Майо та індекс якості життя (LQI або IBDQ-D), але не обмежуються ними. Фахівцеві в даній галузі відомі такі показники, що традиційно використовуються для діагностичної оцінки прогресування та/або ефективності лікування виразкового коліту. Простий клінічний індекс активності коліту (SCCAI) записує клінічну активність з урахуванням кількості випорожнень протягом дня і ночі, терміновості дефекації, наявності видимих кривавих виділень в калі, загального самопочуття, болю в животі і позакишкових проявів. Ця оцінка в основному розглядає клінічну активність виразкового коліту, яка корелює з 10 UA 115585 C2 5 10 15 20 25 30 35 40 45 50 55 60 ендоскопічною активністю. Вона може бути виконана дослідником, що опитує пацієнта, або пацієнтом, який заповнює анкету, що включає питання про його хворобу. Шкала Майо, також відома як клінічна шкала Майо або індекс активності хвороби, є відомим інструментом для оцінки неспецифічного виразкового коліту. Вона складається з чотирьох пунктів: частота дефекації, ректальна кровотеча, зовнішній вигляд слизової і загальна оцінка лікаря (PGA). Шкала містить від 0 до 12 балів. За роки використання ця відома шкала змінювалась з метою адаптування до сучасних медичних знань. Ця "модифікована шкала Майо" вже використовується в інших клінічних дослідженнях і продемонструвала, щоб є надійним показником змін у виразковому коліті. Якість життя (QOL) у пацієнтів, які страждають від виразковий коліту, може бути виміряна за допомогою анкети для оцінки запальних захворювань кишечника (IBDQ). Продуктивність препаратів, описаних для лікування виразкового коліту, також може бути оцінена біохімічними методами. Два специфічних біомаркери, калпротектин і S100A12, що належать до сімейства кальційзв'язуючих білків S100, вивільняються у тканиноспецифічний спосіб активованими або пошкодженими клітинами в умовах клітинного стресу і, отже, представляють надійні, неінвазивні маркери запальної активності. Калпротектин, комплекс 2 фагоцитоспецифічних білків S100A8 і S100A9, може бути використаний в клінічних випробуваннях для оцінки запальної активності та реакції на лікування. Калпротектин, як було виявлено, в значній мірі корелює з клінічною та ендоскопічною активностями запальних захворювань кишечника. Він є надійним сурогатним маркером загоєння слизової оболонки і є предиктором рецидиву клінічного спокою виразкового коліту. Інший біомаркер, S100A12, може мати навіть кращу діагностичну точність і більш високу кореляцію з запаленням слизової оболонки, ніж калпротектин. В деяких варіантах втілення описаних препаратів введення фосфатидилхолінового продукту (ФХ) пацієнту з 5-ASA-резистентним виразковим колітом приводить до покращення індексу ендоскопічної активності (EAI) на, принаймні, 10 %, принаймні, 20 %, принаймні, 30 %, принаймні, 40 %, принаймні, 50 %, принаймні, 60 %, принаймні, 70 %, принаймні, 80 %, принаймні, 90 % або 100 %. В деяких варіантах втілення препаратів, описаних в даному документі, введення фосфатидилхолінового продукту формули (I) пацієнту з 5-ASA-резистентним виразковим колітом приводить до зниження гістологічного індексу на, принаймні, 10 %, принаймні, 20 %, принаймні, 30 %, принаймні, 40 %, принаймні, 50 %, принаймні, 60 %, принаймні, 70 %, принаймні, 80 %, принаймні, 90 % або 100 %. В деяких варіантах втілення препаратів, описаних в даному документі, введення фосфатидилхолінового продукту пацієнту з 5-ASA-резистентним виразковим колітом приводить до покращення індексу клінічної активності на, принаймні, принаймні, 10 %, принаймні, 20 %, принаймні, 30 %, принаймні, 40 %, принаймні, 50 %, принаймні, 60 %, принаймні, 70 %, принаймні, 80 %, принаймні, 90 % або 100 %. В деяких варіантах втілення препаратів, описаних в даному документі, введення фосфатидилхоліну пацієнту з 5-ASA-резистентним виразковим колітом приводить до покращення індексу якості життя на, принаймні, 5 %, принаймні, 10 %, принаймні, 15 %, принаймні, 20 %, принаймні, 25 %, принаймні, 30 %, принаймні, 35 %, принаймні, 40 %, принаймні, 45 %, принаймні, 50 %, принаймні, 55 %, принаймні, 60 %, принаймні, 65 %, принаймні, 70 %, принаймні, 75 %, принаймні, 80 %, принаймні, 85 %, принаймні, 90 %, принаймні, 95 % або 100 %. Фосфатидилхолінові продукти (ФХ) формули (I), наприклад, ті, що містять (або по суті складаються з) наступні кількості жирних кислот (у вагових відсотках від загальної кількості жирних кислот в ФХ): 62 - 66 лінолевої кислоти 12 - 15 пальмітинової кислоти >10 - 12 олеїнової кислоти 05 - 07 ліноленової кислоти 02 - 04 стеаринової кислоти, можуть бути легко отримані з високою чистотою у великих кількостях (наприклад, 100 кілограм). Винахід далі ілюструється у формулі винаходу і в наступних прикладах. Приклад 1a (препарат ФХ у формі пелет) Фармацевтичний препарат одержують у формі пелет (діаметр від 0,5 до 1,8 мм), що містять 27 % за вагою спеціального фосфатидилхолінового продукту (ФХ) формули (I), який містить наступні кількості жирних кислот (у вагових відсотках від загальної кількості жирних кислот в 11 UA 115585 C2 5 10 15 20 25 30 35 ФХ): 64 лінолевої кислоти 14 пальмітинової кислоти 11 олеїнової кислоти 06 ліноленової кислоти 04 стеаринової кислоти 01 інші C-14 - C-22 жирні кислоти. Цей фосфатидилхоліновий продукт (ФХ) має високу ступінь чистоти і містить менше, ніж 0,1 % (ФЕ) і (ФI). Цей ФХ-продукт може бути отриманий хімічним шляхом або способом, описаним раніше, з соєвого лецитину і формуватись з наступними наповнювачами в наступних пропорціях (вагових відсотках), де, по-перше, названі компоненти були використані для отримання ФХ-пелети (ядра), і, по-друге, названі наповнювачі були використані для шару уповільненого вивільнення: A) для ФХ-ядра: 26.96 ФХ (включаючи невелику кількість α-токоферолу) 0.03 аскорбілпальмітат (антиоксидант) та/або α-токоферол 34.09 мікрокристалічна целюлоза (Avicel® PH102; зв'язуюче) 4.88 колоїдний гідратований діоксид кремнію (Syloid® 244FP; зв'язуюче) 1,39 колоїдний безводний діоксид кремнію (Carb-O-Sil M5P; дезінтегрант) 2.08 кроскармелоза натрію (Ac-di-Sol; дезінтегрант). B) для покриття: 1.21 гідроксипропілметилцелюлоза (гіпромелоза, Pharmacoat 606) 0.05 поліетиленгліколь (Macrogol 6000; пластифікатор) 2.68 тальк (антиадгезив) 24.16 Eudragit® L 30 D-55 (плівкоутворювач) 2.47 триетилцитрат (пластифікатор). Фосфатидилхоліновий продукт (ФХ) ядра містить, принаймні, 97 % нерозчинної в ацетоні речовини. Ядра пелет містять фосфатидилхолін, описаний вище, у високочистій формі (з менше, ніж 0,1 % за вагою фосфатидилетаноламіну та менше, ніж 0,1 % за вагою фосфатидилінозитолу). Для приготування перорального препарату фосфатидилхоліну пелети покривають шаром акрилатного кополімеру, Eudragit® L30-55, що забезпечує уповільнене вивільнення при рН > 5,5 в тонкій кишці. Пелети, що мають розмір від 0,5 до 1,4 мм (діаметр), попередньо ізолювали шаром, що містить гіпромелозу, а потім покривали аніонним кополімером на основі метакрилової кислоти і етилакрилату (Eudragit® L30-55). Одержані покриті пелети мають діаметр до 1,8 мм. Приклад 1b (одержання партії пелет з діючою речовиною (C103) і плацебо-пелет (C104)) Препарат може бути одержаний, наприклад, в наступному технічному обсязі: Компоненти Склад пелет Фосфатидилхоліновий продукт Аскорбілпальмітат Мікрокристалічна целюлоза Колоїдний гідратований діоксид кремнію Колоїдний діоксид кремнію Кроскармелоза натрію Кросповідон Картопляний крохмаль Рибофлавін 1 Очищена вода пелети з діючою речовиною (CLT-103) [кг/партію] обсяг: 120 кг плацебо-пелети(CLT-104) [кг/партію] обсяг: 250 кг 32,350 0,034 40,906 ----34,717 5,858 17,357 1,667 2,499 3,473 5,207 86,777 26,037 7,500 266,477 37,491 12 UA 115585 C2 Формула партії плівкового покриття для попередньої ізоляції ізоляційним лаком (з початковими кількостями, включаючими 10 % надмір для всіх наповнювачів, необхідних для плівкових покриттів). 1 Очищена вода 37,328 77,767 Гіпромелоза 1,595 3,323 Поліетиленгліколь 6000 0,072 0,150 Тальк 0,715 1,490 Формула партії плівкового покриття з стійким до шлункового соку лаком (дивися вище) Eudragit L 30 D-55 106,322 221,503 Триетилцитрат 3,254 6,780 1 Очищена вода 77,464 161,383 Тальк 2,821 5,877 1 5 10 15 20 25 30 35 40 45 Воду видаляють у процесі виробництва, вона відсутня в кінцевому препараті Приклад 2 (вивільнення ФХ і стабільність) Пелети, що містять специфічний фосфатидилхоліновий продукт (ФХ) згідно з прикладом 1, були випробувані стосовно стабільності при різних умовах. Вивільнення ФХ в кислих умовах (pH 1,0; 0,1N HCl) склало менше, ніж 10 % за вагою через 120 хвилин. Вивільнення через три випробувальні середовища після додаткових 60 хвилин при рН 6,0 і ще після 60 хвилин при рН 7,2 було більшим, ніж 75 % за вагою. Кишковорозчинні пелети з Прикладу 1 запаковували в саше і випробували в класичному дослідженні стабільності. Критерії прийнятності були визначені як 90 - 110 % від аналізованого ФХ (відносно номінального значення) і максимум 5 % лізо-ФХ (відносно ФХ). Перша партія даного препарату досліджувалась через 36 місяців зберігання в холодильнику (5 °C, плюс/мінус 3 °C), пелети виявились стабільними. Були одержані наступні результати випробувань: (аналізований ФХ (відносно номінального значення) = 96 % і лізо-ФХ (відносно ФХ) = 3,35 %. Для іншої партії, після 12 місяців зберігання при кімнатній температурі (25 °C плюс/мінус 2 °C) пелети виявились стабільними. Після12 місяців зберігання такі результати випробувань були виявлені для ключових параметрів вмісту ФХ і лізо-ФХ як його основного продукту розкладання: аналізований ФХ (відносно номінального значення) = 97 % і лізо-ФХ відносно ФХ) = 4,97 % Відомі склади фосфатидилхоліну уповільненого вивільнення (Stremmel et al.) виявилися значно менш стабільними. Після 4 місяців зберігання в холодильнику (5 °C, плюс/мінус 3 °C) гранули показали вміст лізо-ФХ (відносно ФХ) = 13 %. Після 3 і 6 місяців зберігання при кімнатній температурі (25 °C плюс/мінус 2 °C) були виявлені такі результати випробовувань: аналізований ФХ (відносно номінального значення) від 97,8 до 85,9 % і лізо-ФХ (відносно ФХ) від 9,6 до 14,0 %. Приклад 3 (фармакологічне випробовування) Пелети, що містять специфічний фосфатидилхоліновий продукт (ФХ) Прикладу 1, були випробувані у пацієнтів з виразковим колітом, щоб показати ефективність і безпеку ФХ з модифікованим вивільненням при виразковому коліті, несприйнятливому до лікування месалазином. У переважному варіанті втілення було проведене плацебо-контрольоване, паралельне 4-х групове мультицентрове дослідження фази IIb, що включало 156 пацієнтів. У чотирьох незалежно рандомізованих групах були застосовані плацебо і добові дози 0,8 г, 1,6 г і 3,2 г ФХ. Пелети, що містяться в одному саше, мали бути прийняті чотири рази на день перорально з водою або після змішування з водою, соком, молоком, або йогуртом безпосередньо перед введенням. Препарат Прикладу 1 був використаний для всіх дозувань у вигляді покритих пелет уповільненого вивільнення. Кількість пелет однієї дозованої одиниці (саше) склала приблизно 3,2 г пелет. Для більш високого дозування ФХ саше містить лише пелети з активною речовиною, нижчі дози одержують, змішуючи препарати тільки з активною речовиною і плацебо пелети (що містять як наповнюючий ексципієнт кросповідон і картопляний крохмаль замість ФХ-продукту) перед наповненням саше, в той час як ФХ-плацебо саше містить виключно плацебо пелети. Вага вмісту упаковки була ідентичною для всіх препаратів ФХ. Усі пацієнти, що лікувались специфічним фосфатидилхоліновим продуктом (ФХ) або плацебо, давали письмову інформовану згоду на дослідження перед початком випробовування. Це випробовування було розпочато з скринінгового візиту для основного відбору, а рандомізації 13 UA 115585 C2 5 10 15 20 25 30 35 40 45 50 55 60 відбулася після однотижневого періоду, який підходить для визначення основної активності виразкового коліту (відповідно до SCCAI) і з дотриманням всіх інших критеріїв включення/виключення. Пацієнти, які задовольняли всім критеріям, почали лікування в один і той самий день і одержували ФХ для всіх 12 тижнів разом у подвійному сліпому режимі. 12-тижневий період лікування включав 2 проміжні навчальні візити та візит закінчення лікування. Пацієнти, які пройшли повний 12-тижневий курс лікування і пішли на часткову або повну ремісію на час візиту закінчення лікування, потім перевірялись ще впродовж 8 тижнів або до настання рецидиву. Телефонні опитування для оцінки безпеки проводились через 4 тижні після закінчення лікування для всіх пацієнтів, що приймали досліджуваний препарат ФХ, принаймні, один раз. Клінічне випробовування фази IIB проводили з метою демонстрації ефективності і безпеки ФХ, як описано в Прикладі 1. У ході дослідження було дозволене лікування відомим протиколітним препаратом, якщо він продовжував прийматись на вихідному рівні, визначеному як стабільна доза, принаймні, за 4 тижні до початку дослідження. Таким чином, частина пацієнтів отримували месалазин або сульфасалазин (5-ASA) протягом дослідження. Крім того, пацієнтам було також дозволене спільне лікування стероїдами та імунодепресантами, такими як азатіоприн. Клінічні дані показують, що щоденне пероральне введення ФХ добре переноситься і клінічно активне у пацієнтів з виразковим колітом. Специфічний препарат був знайдений більш ефективним при виразковому коліті, ніж колишні препарати фосфатидилхоліну, використовувані в попередніх дослідженнях. Одним з важливих результатів дослідження був спільний великий ефект лікування у всіх групах. Несподівано, ефект лікування в групі з дозуванням 3,2 г/добу ФХ згідно з передвказаною процедурою біометричного аналізу призвів до значно вищого ефекту лікування в порівнянні з плацебо. Активність захворювання в групі з дозуванням 3,2 г/добу ФХ знизилась на 4,3 бали у порівнянні з 3,0 балами в групі плацебо, переводячи в статистично значимий ефект лікування в порівнянні з плацебо (з р-значенням 0,0298). Частота ремісій була вищою в групах лікування ФХ в порівнянні з плацебо. При дозі 3,2 г ФХ/добу кількість пацієнтів, зазнавших повної або часткової ремісії (означає, що клінічний стан пацієнта був в нормі або близьким до норми), склала 30 % в порівнянні з групою плацебо, де тільки 15 % пацієнтів пішли в ремісію. Подальший аналіз показав, що сумісне лікування при виразковому коліті, яке дозволене в ході дослідження, здавалося, впливало на клінічний результат. Особливо група пацієнтів без супутнього лікування 5-ASA (наприклад, месалазином) істотно вигравала в клінічних результатах стосовно відповіді (клінічних показників, ендоскопії, гістології). Вони також правдиво утримували рівні ремісії, які у високій дозі 3,2 г/добу ФХ досягли 60 % в порівнянні з 10 % швидкості відповіді для пацієнтів, які отримували плацебо. Слід зазначити, що стандартний маркер запальної активності, названий С-реактивним білком (CRP), був високим в патологічному діапазоні у всіх пацієнтів на вихідному рівні. На кінець лікування усі пацієнти, які отримували ФХ, мали помітне поліпшення цього лабораторного параметру в порівнянні з пацієнтами, які отримували плацебо, що вказує на зниження запальної активності, викликане лікуванням ФХ. Окрім цих чудових результатів в поліпшенні клінічного стану пацієнтів з виразковим колітом, які отримують лікування ФХ, дуже вражає, що профіль побічних ефектів цього препарату був дуже сприятливим. Не спостерігалось жодних небезпечних даних (життєво важливих функцій, фізичного обстеження, лабораторної безпеки), які були б якимось чином пов'язані з дозуванням. Клінічні дані показують, що щоденне пероральне введення ФХ, як описано в Прикладі 1, добре переноситься і клінічно активне у пацієнтів з виразковим колітом. Як було виявлено, специфічний препарат був дуже ефективний в лікуванні неспецифічного виразкового коліту. Препарат, як описано, показав менше побічних ефектів і кращий профіль стабільності ніж колишні препарати фосфатидилхоліну, використовувані в попередніх дослідженнях. Приклад 4 (препарат ФХ у формі капсул) Як інший препарат контрольованого вивільнення, що містить специфічний ФХ згідно з Прикладом 1 як активний інгредієнт, капсули одержують, використовуючи стандартні комерційно доступні тверді желатинові капсули (стандартні розміри від 0 до 4). Їх наповнюють сумішшю фосфатидилхолінового продукту з Прикладу 1 і жирного наповнювача (Miglyol 812 при ваговому співвідношенні 65 % ФХ/35 % наповнювача) або сумішшю фосфатидилхолінового продукту з Прикладу 1 (65 % за вагою), Tween 80 (17,5 % за вагою) і Myglyol (17,5 % за вагою). Щоб забезпечити уповільнене вивільненням для лікування виразкового коліту, такі желатинові капсули покривають шаром аніонного полімеру на основі метакрилової кислоти і етилакрилату (такі як продукти Eudragit®, описані вище). 14 UA 115585 C2 Приклад 5 (технічний процес виробництва) Компоненти CLT-103 Операції Компоненти CLT-104 нерозфасовані пелети активної речовини нерозфасовані плацебо пелети 5 10 IPC означає управління процесом. Починаючи з операції 3a, процес виробництва нерозфасованих пелет активної речовини (C103), продукту згідно з винаходом, і нерозфасованих плацебо пелет (C104) є ідентичним. Використовується таке технологічне обладнання: 15 UA 115585 C2 Обладнання ваги лопастева мішалка контейнер з нержавіючої сталі Операція 2 гранулювання мішалка з великим зусиллям зсуву Diosna екструдер (NICA E220) Операція 3 екструзія/сферонізація сферонізатор (NICA S700) Операція 4 сушіння GPCG або Aeromatic Fielder Операція 5 сортування сито 1,40 на 0,50 мм лопастева мішалка Операція 6 покривання ізоляційною плівкою контейнер з нержавіючої сталі Aeromatic Fielder лопастева мішалка Операція 7 покривання кишковорозчинною плівкою контейнер з нержавіючої сталі Aeromatic Fielder ручне сито 1,00 мм змішування пелет з активною речовиною або Операція 8 гравітаційний міксер плацебо пелет з тальком контейнер Операція 10 наповнення саше фасувальна машина (LA 300). Операція 1 5 10 15 20 25 30 35 40 Виробничі операції початкове зважування Виробничі операції здійснюють згідно з правилами GMP. Спосіб виробництва складається з наступних загальновідомих операцій: виготовлення грануляційного розчинника, гранулювання, екструзію і сфероїдизацію, сушіння, нанесення плівкового покриття. Згодом, змішування нерозфасованих пелет активної речовини (C103) або нерозфасованих плацебо пелет (C104) з тальком виконується після додавання 2,5 % тальку для отримання кінцевої суміші пелет, придатних для заповнення саше. ФХ-продукт диспергують в контейнер з нержавіючої сталі в теплій воді (40 °C-50 °C) і перемішують протягом певного часу. Після цього додають аскорбілпальмітат і продовжують перемішування. Отриману дисперсію використовують як грануляційний розчин. Суміш мікрокристалічної целюлози, колоїдного гідратованого діоксиду кремнію, колоїдного діоксиду кремнію і кроскармелози натрію поміщають в Diosna і змішують. Згодом додають грануляційний розчин і продовжують перемішування. Час витримки для розчину в цій виробничій операції обмежується дванадцятьма годинами. Після грануляції гранули переносять у контейнер з нержавіючої сталі. Пелети переносять в екструдер, в якому, по-перше, відбувається операція екструзії і наступна сферонізація. Отримані пелети сушать в сушарці з псевдозрідженим шаром для зменшення залишкової вологості. Висушені пелети просівають з метою видалення гранул, більших, ніж 1,40 мм і пелет, менших, ніж 0,50 мм в діаметрі. Визначають вихід отриманої фракції з розміром пелет від 0,50 до 1,40 мм. Після просіювання пелети зберігають при 2 - 8 °C до подальшої обробки. Розподіл розміру пелет визначають за допомогою ситового аналізу, результати повідомляються. Для приготування розчину плівкового покриття для пелет гіпромелозу і поліетиленгліколь 6000 поміщають в очищену воду і перемішують. Потім додають тальк і продовжують перемішувати. Пелети покривають ізоляційним лаком за допомогою нанесення плівкового покриття в псевдозрідженому шарі. Eudragit® L30 D-55 кладуть через сито в контейнер лопастної мішалки. Триетилцитрат додають при постійному перемішуванні, згодом додають очищену воду і продовжують перемішувати належним чином. На завершення додають тальк і продовжують перемішувати одержаний покривний розчин. Попередньо ізольовані пелети потім покривають стійким до шлункового соку лаком в псевдозрідженому шарі. Для пелет з активною речовиною або плацебо пелет додають 2,5 % тальку відносно ваги нерозфасованих пелет і здійснюють перемішування з метою подолання електростатичного заряду нерозфасованих пелет. Після відбору проб для тестування вивільнення фінальних сумішей, суміші нерозфасованих пелет пакують в поліетиленові мішечки, сушильний мішок, світлозахисний мішок і в кутекс на 13 л. Визначають кількість на контейнер. Суміші нерозфасованих пелет зберігають при 2 °C - 8 °C. Суміші нерозфасованих пелет витримують при кімнатній температурі протягом 1 години перед початком заповнення саше. Потім сумішами наповнюють саше при продуванні азотом з 16 UA 115585 C2 5 10 15 ідентичним наповненням за масою для одержання препарату згідно з винаходом, а плацебо саше - відповідно до теоретичної кількості у 800 мг ФХ на саше для препарату з активною речовиною. Цільове заповнення за масою для саше розраховується, виходячи з теоретичного вмісту ФХ в суміші пелет, приймаючи до уваги вміст ФХ і вміст води в партії API ФХ-продукту, використовуваного для виробництва. Як засвідчили ці експерименти, даний винахід належить до композицій для лікування виразкового коліту за допомогою окремих фосфатидилхолінових продуктів, а також з використанням нових препаратів з поліпшеними наповнювачами. Це було несподівано, що за наявності більш високої чистоти ФХ - більше, ніж 94 %, і, наприклад, високого співвідношення (наприклад, 3:1) ФХ і Eudragit®, стабільність препарату може бути збільшена, а ліки демонструють більш низькі побічні ефекти, такі як метеоризм, у порівнянні з відомими ФХпрепаратами. ФОРМУЛА ВИНАХОДУ 1. Фармацевтичний препарат, що містить: принаймні один фосфатидилхоліновий продукт (ФХ) формули (І) 20 25 30 35 40 45 , (I) де: 1 2 R є залишком насиченої або ненасиченої жирної кислоти з 12-24 атомами вуглецю і R є залишком насиченої або ненасиченої жирної кислоти з 12-24 атомами вуглецю, і де фосфатидилхоліновий продукт (ФХ) містить наступні кількості жирних кислот (у вагових відсотках від загальної кількості жирних кислот в ФХ): 55-72 лінолевої кислоти, 10-18 пальмітинової кислоти, 07-15 олеїнової кислоти, 02-08 ліноленової кислоти, 02-08 стеаринової кислоти, і принаймні один фармацевтично прийнятний наповнювач для уповільненого вивільнення фосфатидилхолінового продукту (ФХ), де фосфатидилхоліновий продукт (ФХ) означає принаймні 94 % за вагою усіх ліпідних/фосфоліпідних компонентів препарату. 2. Фармацевтичний препарат за п. 1, що містить принаймні один фосфатидилхоліновий продукт (ФХ) формули (І), де: 1 2 R є залишком насиченої або ненасиченої жирної кислоти з 14-20 атомами вуглецю і R є залишком насиченої або ненасиченої жирної кислоти з 14-20 атомами вуглецю, і де фосфатидилхоліновий продукт (ФХ) містить наступні кількості залишків жирних кислот (у вагових відсотках від загальної кількості жирних кислот в ФХ): 59-70 лінолевої кислоти, 12-17 пальмітинової кислоти, 07-15 олеїнової кислоти, 03-07 ліноленової кислоти, 02-05 стеаринової кислоти, і принаймні один фармацевтично прийнятний наповнювач, де фармацевтичний препарат вивільняє принаймні 50 %, зокрема принаймні 70 %, за вагою фосфатидилхолінового продукту (ФХ) в кишечнику. 3. Фармацевтичний препарат за п. 1 або 2, який відрізняється тим, що фармацевтичний препарат містить принаймні один фосфатидилхоліновий продукт (ФХ) формули (І), де більше 17 UA 115585 C2 1 5 10 15 20 25 30 35 40 2 ніж 78 %, зокрема більше ніж 80 %, за вагою залишків жирних кислот R і R є ненасиченою жирною кислотою з 18 атомами вуглецю. 4. Фармацевтичний препарат за будь-яким з пп. 1-3, який відрізняється тим, що фармацевтичний препарат містить кишковорозчинну пелету(и), кишковорозчинну капсулу(и), кишковорозчинну гранулу(и) або кишковорозчинну таблетку(и), що містять фосфатидилхоліновий продукт (ФХ) і принаймні один шар кишковорозчинного полімерного покриття, що є стійким до дії кишкових кислот. 5. Фармацевтичний препарат за будь-яким з пп. 1-4, який відрізняється тим, що вагове співвідношення кишковорозчинного полімерного покриття і фосфатидилхолінового продукту (ФХ) складає від 3:1 до 1:3, і де ФХ є дозованою лікарською формою, утвореною множиною відокремлених одиниць. 6. Фармацевтичний препарат за будь-яким з пп. 1-5, що містить кишковорозчинну пелету(и), кишковорозчинну капсулу(и), кишковорозчинну гранулу(и) або кишковорозчинну таблетку(и), що мають кишковорозчинне полімерне покриття товщиною від 10 до 500 мікрометрів. 7. Фармацевтичний препарат за будь-яким з пп. 1-6, що містить фосфатидилхоліновий продукт (ФХ), захищений кишковорозчинним покриттям, яке є стійким до дії шлункових кислот (рН 1) протягом принаймні 120 хвилин, але яке дозволяє принаймні 80 % фосфатидилхолінового продукту (ФХ) вивільнятись з препарату при рН 5,5 або вище протягом 120 хвилин. 8. Фармацевтичний препарат за будь-яким з пп. 1-7, що містить принаймні одне покриття, принаймні з одним кишковорозчинним полімером з групи гомополімерів та кополімерів акрилової кислоти, метакрилової кислоти, акрилових естерів та метакрилових естерів. 9. Фармацевтичний препарат за будь-яким з пп. 1-8, що містить від 20 до 30 % за вагою фосфатидилхолінового продукту (ФХ) формули (І) і від 70 до 80 % за вагою наповнювачів. 10. Фармацевтичний препарат за будь-яким з пп. 1-9, що має довгострокову стабільність, що характеризується кількістю принаймні 95 % за вагою аналізованого ФХ (відносно номінального значення) і менше ніж 5 % за вагою лізо-ФХ (відносно ФХ) після 36 місяців зберігання в холодильнику (5±3 °С). 11. Фармацевтичний препарат за будь-яким з пп. 1-10 для лікування або попередження стану або захворювання, вибраного з виразкового коліту, хвороби Крона, запалення у відключеній кишці, інфекційного ентериту, інфекційного коліту, запалення в результаті опромінення і запалення через хіміотерапевтичні або хімічні речовини, зокрема для лікування виразкового коліту у 5-АSА-резистентних пацієнтів. 12. Препарат за п. 11 для лікування або попередження виразкового коліту, хвороби Крона або виразкового коліту у 5-АSА-резистентних або стероїдрезистентних пацієнтів. 13. Препарат за п. 11 або 12 для лікування або попередження виразкового коліту у 5-АSАрезистентних пацієнтів, де використовується доза від 0,5 до 8 г, зокрема від 2 до 6 г, фосфатидилхолінового продукту (ФХ) формули (І) на добу. 14. Препарат за будь-яким з пп. 11-13 для лікування або попередження виразкового коліту у 5АSА-резистентних пацієнтів, де добова доза фосфатидилхолінового продукту (ФХ) формули (І) використовується два або три, або чотири рази на добу. 15. Препарат за будь-яким з пп. 11-14 для лікування виразкового коліту у 5-ASA-резистентних пацієнтів, де добова доза від 0,5 до 8 г фосфатидилхолінового продукту (ФХ) формули (І) використовується у формі ФХ-вмісних пелет в упаковці на один прийом. Комп’ютерна верстка О.Гергіль Міністерство економічного розвитку і торгівлі України, вул. М. Грушевського, 12/2, м. Київ, 01008, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 18
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical formulation comprising phosphatidylcholine for the treatment of ulcerative colitis
Автори англійськоюKeilhauer, Gerhard
Автори російськоюКайлхойер Герхард
МПК / Мітки
МПК: A61K 31/685
Мітки: фосфатидилхолін, містить, препарат, лікування, коліту, виразкового, фармацевтичний
Код посилання
<a href="https://ua.patents.su/20-115585-farmacevtichnijj-preparat-shho-mistit-fosfatidilkholin-dlya-likuvannya-virazkovogo-kolitu.html" target="_blank" rel="follow" title="База патентів України">Фармацевтичний препарат, що містить фосфатидилхолін, для лікування виразкового коліту</a>
























