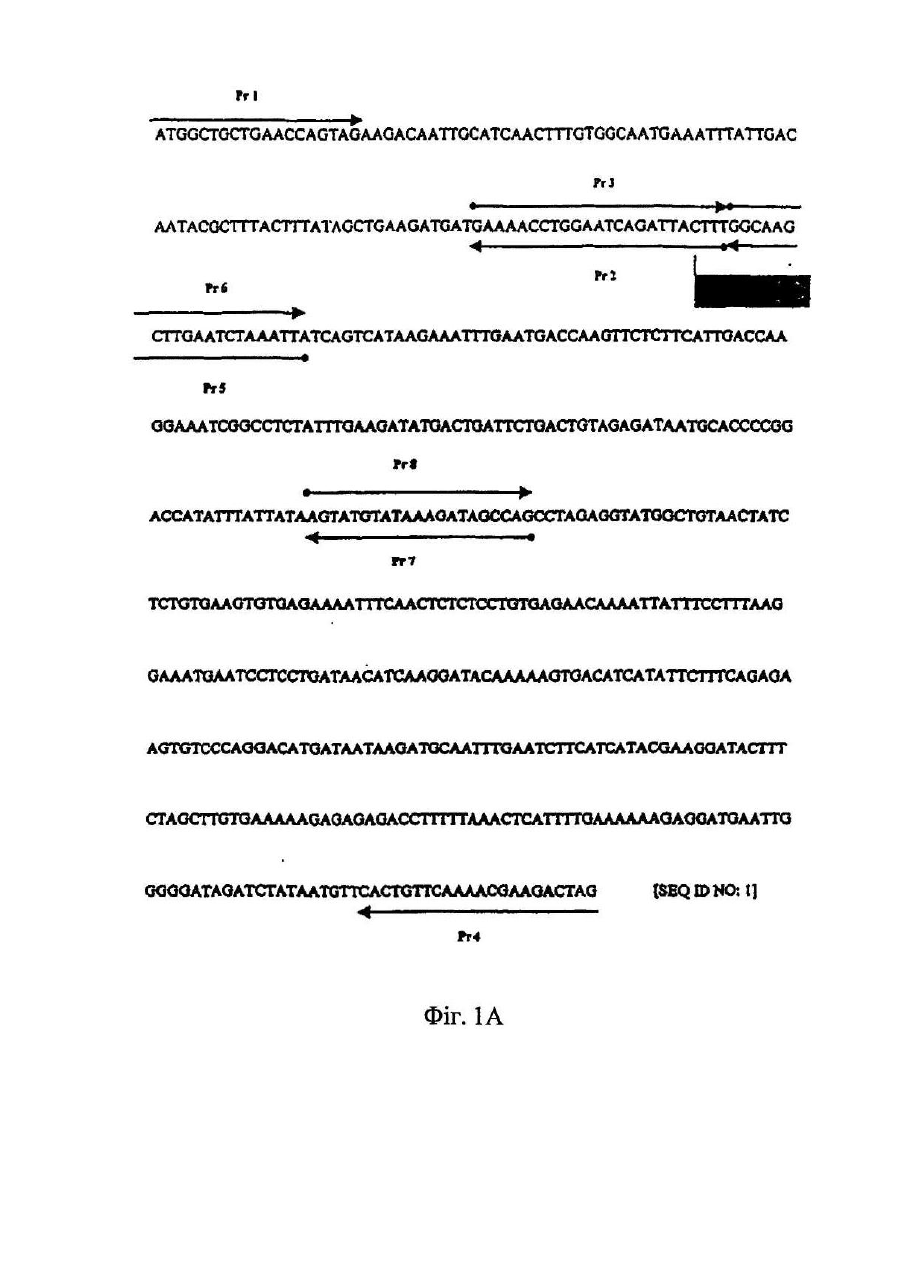
Мутантний поліпептид інтерлейкіну-18, виділена днк, що кодує мутантний поліпептид інтерлейкіну-18, вектор та фармацевтична композиція
Формула / Реферат
1. Мутантний поліпептид IL-18, що включає мутації в одному або декількох амінокислотних залишках, які беруть участь в його взаємодії з IL-18-зв'язуючим білком, де мутації присутні в залишку, вибраному з Glu-42 і Lys-89 попередника IL-18 людини, що кодується кДНК з послідовністю SEQ ID NO:1, і де мутації є неконсервативними замінами.
2. Поліпептид за п.1, де мутація присутня в залишку Glu-42.
3. Поліпептид за п. 2, де мутація присутня в залишку Lys-89.
4. Поліпептид за п. 1, де вказана мутація присутня в залишку Glu-42 і залишку Lys-89.
5. Поліпептид за п.2, де залишок Glu-42 замінений неполярною амінокислотою.
6. Поліпептид за п.5, де залишок Glu-42 замінений залишком Ala.
7. Поліпептид за п.3, де залишок Lys-89 замінений неполярною амінокислотою.
8. Поліпептид за п.7, де залишок Lys-89 замінений залишком Ala.
9. Поліпептид за п.4, де обидва залишки Glu-42 і Lys-89 замінені неполярною амінокислотою.
10. Поліпептид за п.9, де обидва залишки Glu-42 і Lys-89 замінені залишком Ala.
11. Виділена ДНК, що кодує поліпептид за будь-яким з пп.1-10.
12. ДНК за п. 11, де поліпептид має амінокислотну послідовність SEQ ID NO:3.
13. ДНК за п.11, що кодує поліпептид, де кодований поліпептид має амінокислотну послідовність SEQ ID NO:4.
14. ДНК за п.11, що кодує поліпептид, де кодований поліпептид має амінокислотну послідовність SEQ ID NO:5.
15. ДНК за п.11, що кодує поліпептид, де кодований поліпептид має амінокислотну послідовність SEQ ID NO:6.
16. ДНК за п.11, що кодує поліпептид, де кодований поліпептид має амінокислотну послідовність SEQ ID NO:7.
17. ДНК за п.11, що кодує поліпептид, де кодований поліпептид має амінокислотну послідовність SEQ ID NO:8.
18. ДНК за будь-яким з пп. 11, 15, 16 і 17, яка додатково включає послідовність нуклеїнової кислоти, що кодує сигнальний пептид.
19. ДНК за п.18, де вказаним сигнальним пептидом є сигнальний пептид гормону росту.
20. Вектор, що включає ДНК за будь-яким з пп.11-19, де вказаний вектор здатний експресувати поліпептид, що кодується вказаною ДНК у відповідній клітині-хазяїні.
21. Вектор за п.20, де вказаною клітиною-хазяїном є прокаріотична клітина.
22. Вектор за п.21, де вказана ДНК кодує поліпептид, вибраний з групи, яка складається з SEQ ID NO:3, SEQ ID NO:4 і SEQ ID NO:5.
23. Вектор за п.20, де вказаною клітиною-хазяїном є еукаріотична клітина.
24. Вектор за п.23, де вказана ДНК кодує поліпептид, вибраний з групи, яка складається з SEQ ID NO:6, SEQ ID NO:7 і SEQ ID NO:8.
25. Вектор за п.23, що включає ДНК за п.18 або 19.
26. Вектор за п.24, де вказана ДНК лігована з послідовністю, що кодує сигнальний пептид людського гормону росту людини.
27. Фармацевтична композиція, що містить поліпептид за будь-яким з пп.1-10 і фармацевтично прийнятний носій.
28. Фармацевтична композиція за п.27, призначена для лікування раку.
29. Фармацевтична композиція за п.27, призначена для лікування вірусних захворювань.
Текст
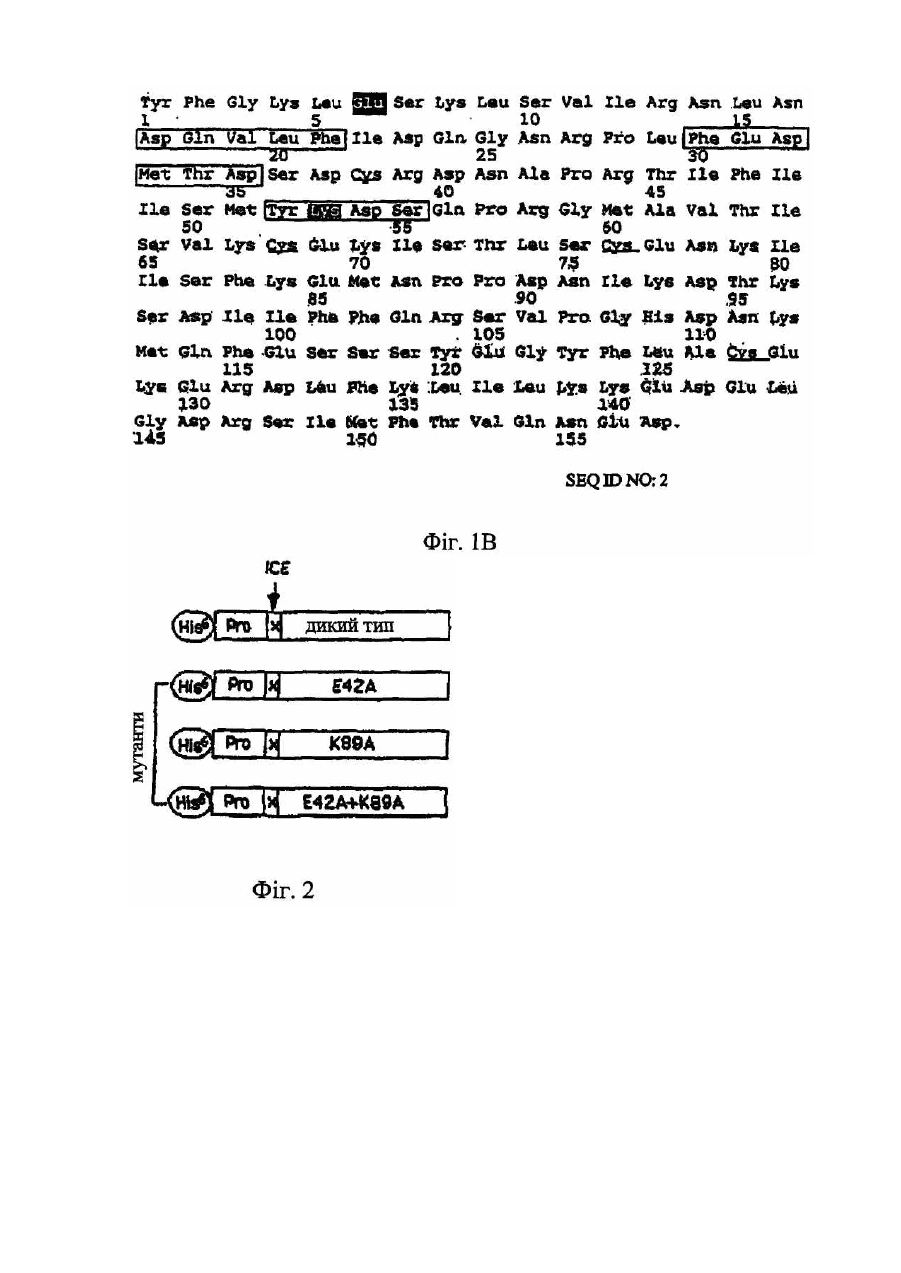
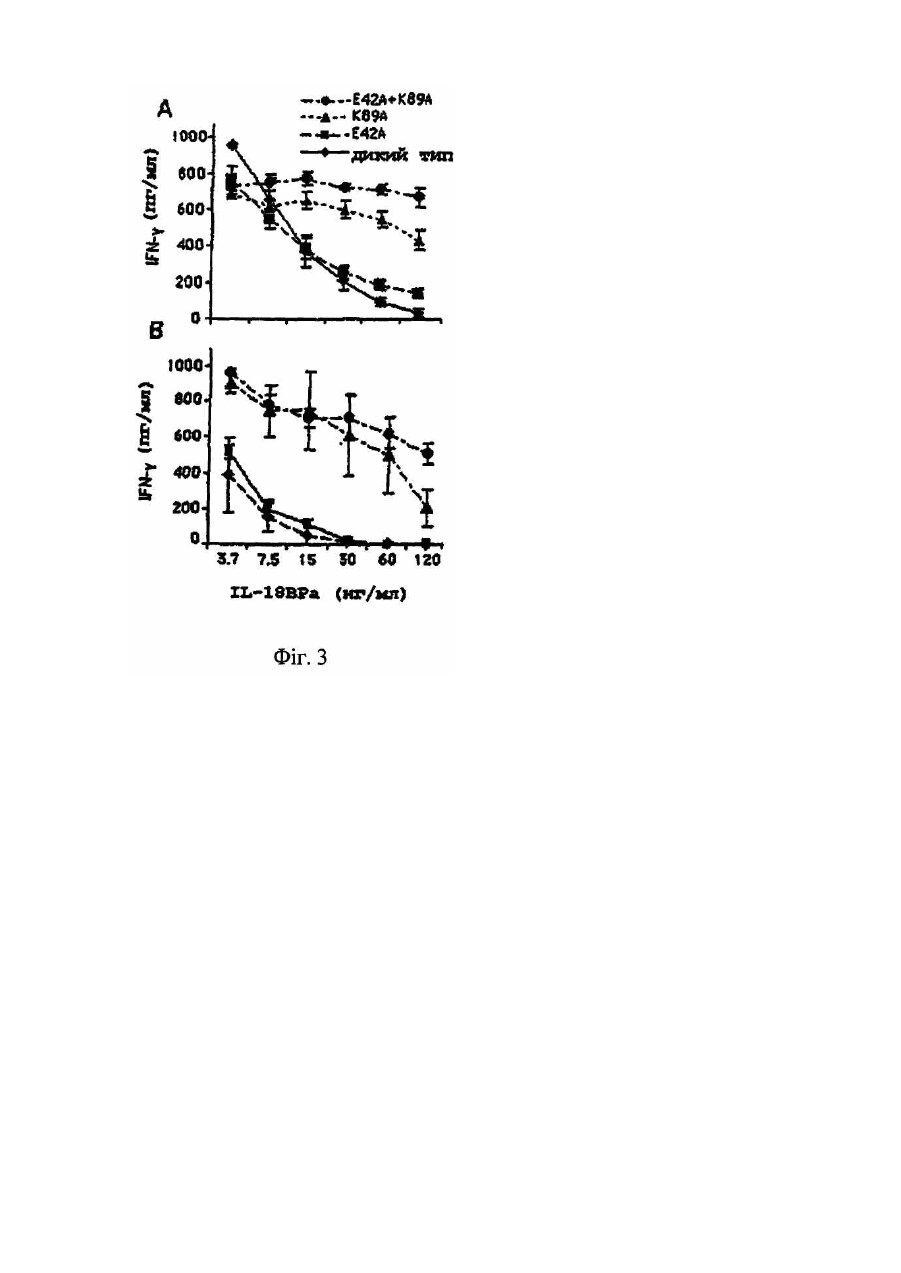
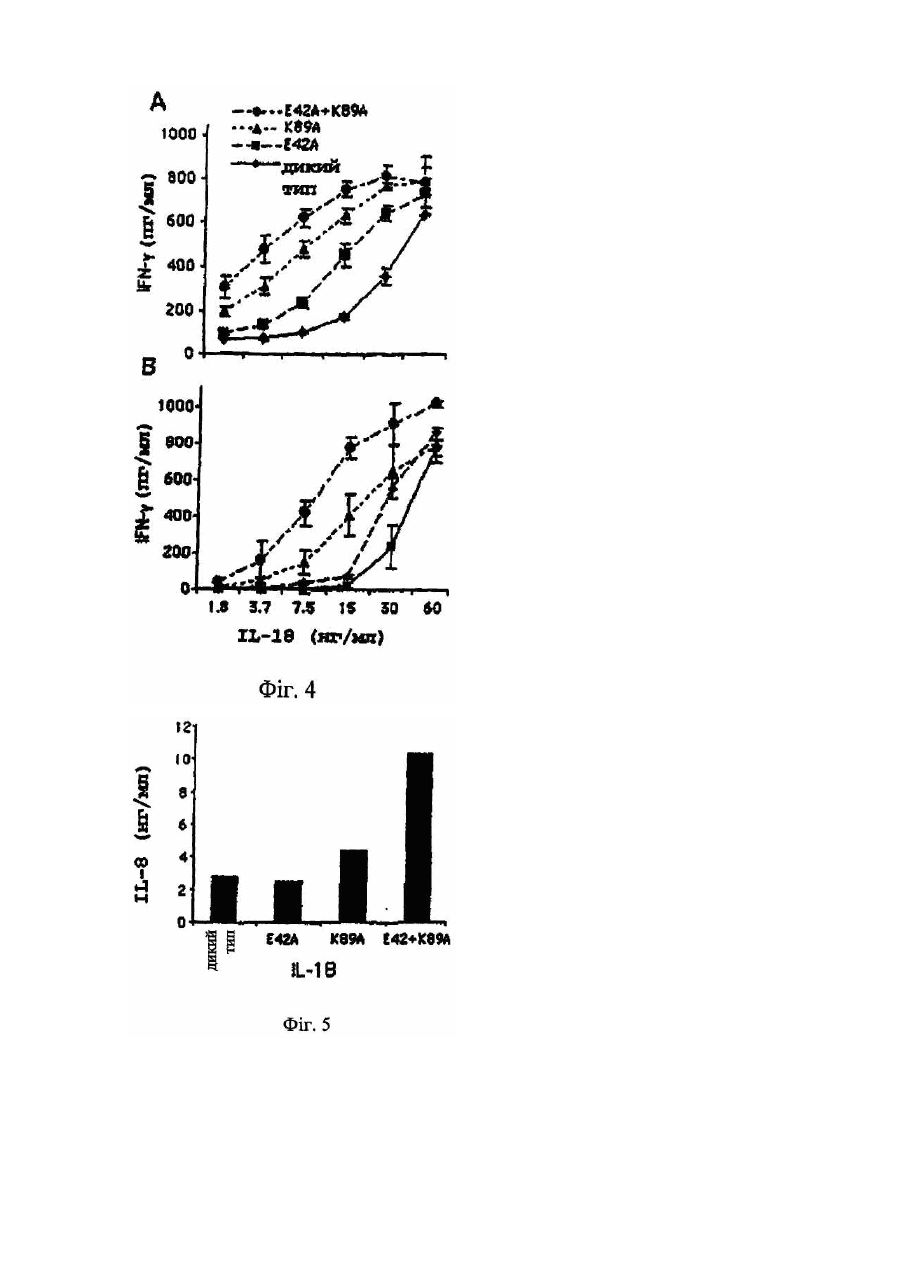
Даний винахід відноситься до мутантів IL-18, що мають підвищену біологічну активність в порівнянні з білком дикого типу. У 1989р. була описана стимульована ендотоксином сироваткова активність, яка індукувала інтерферон-γ (IFN-g), одержаний з клітин мишачої селезінки (Nakamura et al., 1989). Ця сироваткова активність діяла не як прямий індуктор IFN-g, а як ко-стимулятор спільно с IL-2, IFN-α/β, TNF або з мітогенами. В спробі виділити активність з мишачої сироватки, після її стимуляції ендотоксином, був виявлений явно гомогенний білок розміром 50-55кДа (Nakamura et al., 1993). Оскільки інші цитокіни можуть діяти як ко-стимулятори для продукування IFN-g, то було припущено, що відсутність нейтралізуючих антитіл проти IL-1, IL-4, IL-5, IL-6 або TNF, направлених на нейтралізацію сироваткової активності, може слугувати відмітним фактором. У 1995р. ті самі вчені продемонстрували, що індукований ендотоксином ко-стимулятор продукування IFN-g присутній в екстрактах печінки, одержаних від мишей, підданих передтрансплантаційній обробці P.acnes [Okamura et al., 1995]. У вказаній моделі, популяція макрофагів в печінці (клітини Купфера) збільшувалася, і у цих мишей, низька доза бактеріального ліпополісахариду (ЛПС), яка була не летальною для мишей, не підданих передтрансплантаційній обробці, ставала летальною. Фактор, названий IFN-g-індукуючим фактором (IGIF), а пізніше названий інтерлейкіном-18 (IL-18), був очи щений до гомогенності із 1200 грамів мишачої печінки, обробленої P. acnes. Для клонування мишачої кДНК IL-18 були використані вироджені олігонуклеотиди, одержані виходячи з амінокислотних послідовностей очищеного IL-18, [Okamura et al., 1995]. Матричні РНК для IL-18 і інтерлейкіну-12 (IL-12) легко детектувалися в активованих макрофагах. Сам IL-18 не індукує IFN-g, а діє головним чином як ко-стимулятор разом з мітогенами або IL-12. Людська кДНК-послідовність для IL-18 була описана у 1996 (Фіг.1А, SEQ ID NО:1). Інтерлейкін IL-18 і білки сімейства IL-1 мають спільні структурні елементи [Nakamura et al., 1993; Okamura et al., 1995; Ushio et al., 1996; Bazan et al., 1996]. Ha відміну від більшості інших цитокінів, які мають структур у, що складається з чотирьох спіральних ділянок, сполучених тяжами, IL-18 і IL-1β мають β-складчасту стр уктур у (Tsutsui et al., 1996). Аналогічно IL-1β, IL-18 синтезується як біологічно неактивний попередник (пpo-IL-18), в якого відсутній сигнальний пептид [Ushio et al., 1996]. Попередники IL-1β і IL-18 розщеплюються каспазою 1 (IL-Ιβ-конвертуючим ферментом або ICE), який розщеплює ці попередники за залишком аспарагінової кислоти в положенні PL Зрілі цитокіни, що утворюються в результаті, легко вивільняються з клітини [Ghayur et al., 1997 & Gu et al., 1997]. IL-18 є ко-стимулятором для продукування цитокінів (IFN-g, IL-2 і гранулоцитарного-макрофагального колонієстимулюючого фактора) Т-клітинами-хелперами типу І (Th1) [Kohnoet et al., 1997], а також костимулятором опосередкованої лігандом FAS цитотоксичності клітинних клонів мишачих клітин-кілерів [Tsutsui et al., 1996]. Тh1-лімфоцити беруть участь в імунних відповідях проти пухлин [Seki et al., 2000]. Th1-відповіді включають секрецію цитокінів IL-2, IL-12, IL-18 і IFN-g, а також генерування специфічних цитотоксичних Т-лімфоцитів, що розпізнають специфічні пухлинні антигени. Th1-відповідь також є життєво важливим фактором захисту хазяїна від багатьох мікроорганізмів. Однак, Th1-відповідь може бути також асоційована з небажаними ефектами, такими як розвиток деяких аутоімунних захворювань, запалення і відторгнення трансплантованого органу. Спроби експресувати зрілу форму IL-18 в Е.соlі з використанням вектора, що кодує зрілий білок, не привели до одержання повністю активного цитокіну. Ефективна експресійна система для генерування повністю біологічно активного людського IL-18 була розроблена для терапевтичних цілей, наприклад, для лікування злоякісних пухлин або будь-яких станів, при яких бажано індукування IFN-g [WO 00/61768]. У цій системі, сайт розщеплення попередника IL-18 каспазою-1 був замінений на сайт фактора Ха (ІСЕ/Ха), і вектор, що кодує попередник ICE/Xa-IL-18, був використаний для трансформації Е.соlі. Після експресії цього попередника IL-18 в Е.соlі, зрілий IL-18 був генерований шляхом відщеплення фактора Ха in vitro. Цей зрілий IL-18, генерований шляхом розщеплення фактором Ха, був повністю активним. Білки, що зв'язуються з цитокінами (розчинні цитокінові рецептори), звичайно являють собою позаклітинні ліганд-зв'язуючі домени їх відповідних цитокінових рецепторів клітинної поверхні. Вони продукуються або за допомогою альтернативного сплайсингу, або за допомогою протеолітичного розщеплення рецептора клітинної поверхні. Ці розчинні рецептори були описані раніше, наприклад, розчинні рецептори IL-6 і IFN-g [Novick et al., 1989], TNF [Engelmann et al., 1989; Engelmann et al., 1990], IL-1 і IL-4 [Maliszewski et al., 1990], IFN-α/β [Novick et al., 1994; Novick et al., 1992]. Один білок, що зв'язується з цитокіном, названий остеопротегерином (OPG, також відомий як фактор інгібування остеокластів, OCIF), член сімейства TNFR/Fas, є, очевидно, першим прикладом розчинного рецептора, який існує тільки як секретований білок [Anderson et al., 1997; Simonet et al., 1997; Yasuda et al., 1998]. Білок, що зв'язується з IL-18 (IL-18BP), був афінно очищений з сечі на колонці з IL-18 [Novick et al., 1999]. IL-18BP запобігає IL-18-стимульованому індукуванню IFN-g і IL-8, активації NF-kB in vitro і індукуванню IFN in vi vo. IL-18BP являє собою розчинний циркулюючий білок, який конститутивно експресується в селезінці і належить до суперсімейства імуноглобулінів. Ізоформа IL-18BP, що найчастіше зустрічається, ізоформа сплайсованого варіанту, має високу афінність по відношенню до IL-18 з високою швидкістю асоціації і низькою швидкістю дисоціації, і константу дисоціації (Kd), що дорівнює приблизно 400пМ [Kim et al., 1999]. Залишки, що беруть участь у взаємодії IL-18 з IL-18BP, були описані з використанням комп'ютерного моделювання [Kim et al., 1999] і на основі взаємодії IL-1 з IL-1R типу 1 [Vigers et al., 1997]. Було передбачено, що в моделі для IL-18, що зв'язується з IL-18BP, залишок Glu в положенні 42 і залишок Lys в положенні 89 зв'язуються з Lys-І30 і Glu-114 в IL-18BP, відповідно [Kim et al., 1999]. IL-18 постійно присутній в багатьох клітинах [Puren et al., 1999] і в кровотоці здорових людей [Urushihara et al., 2000]. Високий ступінь афінності IL-18BP по відношенню до IL-18, а також висока концентрація IL-18BP, що виявляється в кровотоці (у 20-кратному надлишку в порівнянні з IL-18), являє собою унікальну ситуацію в біології цитокінів. Тому, більшість, якщо не всі, молекули IL-18, присутні в кровотоці, зв'язуються з IL-18BP. Циркулюючий IL-18BP, який конкурує з клітинно-поверхневими рецепторами для IL-18, може діяти як природна протизапальна і імуносупресорна молекула. Вірусні агенти, що кодують ІL-18ВР-подібні білки, наприклад, вірусні білки МС53 і МС54 M.contagiosum володіють значною гомологією з IL-18BP ссавців [Novick et al., 1999]. Білки МС53 і МС54 M.contagiosum володіють здатністю зв'язуватися з людським IL-18 і нейтралізувати його здатність, аналогічно механізму дії IL-18B [Xiang & Moss, 1999]. Білок р13 поксвірусу Ectromelia, який є гомологічним IL-18BP, зв'язується з людським IL-18 і інгібує його активність in vitro. У мишей, інфікованих р13-делеційним вірусним мутантом, виявлялися знижені рівні інфекційності [Born et al., 2000]. Тому, очевидно, що ступінь інфекційності корелює з присутністю IL-18BP. Високі рівні циркулюючого IL-18BP можуть забезпечувати природний захист проти неконтрольованої Th1відповіді на інфекцію і розвитку аутоімунних захворювань. Однак, IL-18 стимулює Th1-відповідь, яка є важливим фактором захисту хазяїна проти пухлин. Тому, IL-18BP може викликати у хазяїна нездатність продукувати цитотоксичні Т-клітини, спрямовані проти пухлинних клітин. Дійсно, очевидно, що у мишей IL-18 стимулює захист хазяїна проти пухлин. Так, наприклад, у сингенних мишей, клітини мишачої карциноми молочної залози, експресуючі мишачий IL-12 або мишачий IL-18, були менш онкогенними і утворювали пухлини більш повільно, ніж контрольні неекспресуючі клітини [Coughlin et al., 1998]. Дослідження по нейтралізації антитілами виявили, що для досягнення протипухлинного ефекту необхідна присутність IFN-g. В іншому дослідженні, системне введення IL-18 експериментальною твариною з меланомою В16, експресуючою В7-1 (CD80), приводило до різкого інгібування утворення меланоми, пухлинного зростання і до значного підвищення рівня виживаності [Cho et al., 2000]. Цитокіни були використані як ад'юванти для підвищення ефективності імунотерапії раку. Так, наприклад, IL-2 вводили в нирково-клітинну карциному або меланому [Gollob et al., 2000]. У більшості випадків, одними з важливих наслідків лікування цитокінами є їх важкі системні токсикологічні профілі. Використання цитокінів, які експресуються самими пухлинними або дендритними клітинами пацієнта, є логічним розв'язанням цієї проблеми. Однак, навіть при місцевому використанні IL-18 як ад'юванту в імунотерапії пухлин ще зберігається здатність конститутивних рівнів IL-18BP нейтралізувати IL-18 в локальному оточенні, а отже, його ефективність значно знижується. Використання не-мієлоабляційних алогенних трансплантатів, так званих мінітрансплантатів для лікування лейкозу і солідних пухлин є значно більш успішним для посилення реакцій "трансплантат проти лейкозу" і "трансплантат проти пухлини" [Slavin S., 2000; Slavin et al., 2000]. Два дослідження, в яких були використані алогенні стовбурові клітини периферичної крові [Childs et al., 2000] або дендритні клітини [Kugler et al., 2000] для лікування пацієнтів з метастазами нирково-клітинної карциноми, мали помітний успіх. Хоча необхідно продовжити і підтвердити ці дослідження, однак, ідея про використання реакції "трансплантат проти пухлини" для протиракової імунотерапії знаходить все більше визнання [Slavin, 2000]. Оскільки, очевидно, що в успішній терапії певну роль грає IL-18, то ще більший успіх може бути досягнутий шляхом запобігання нейтралізуючій дії IL-18BP. Мутанти IL-18 (IFN-g, індикаційний фактор) [описані в ЕР0845530]. Описані мутанти IL-18 являють собою молекули, в яких 1, 2, 3 або всі 4 цистеїнових залишки в IL-18 (Фіг.1В) були замінені сериновими або аланіновими залишками. Ці мутанти містили інтактну консенсусну послідовність (Фіг.1В). Всі виділені мутанти володіли більш високою стабільністю, ніж IL-18 дикого типу. Міра стабільності мутантів прямо пропорційна числу замінених залишків Cys в даній молекулі. [У ЕР0845530] нічого не вказується про здатність IL-18BP до нейтралізації цих мутантів. Тому, генерування і терапевтичне використання повністю активних мутантів IL-18, що не зв'язуються з IL18BP або, що зв'язуються з IL-18BP з низькою афінністю, може дати дуже хороший ефект. Даний винахід відноситься до мутантного поліпептиду IL-18, що включає мутації в одному або декількох амінокислотних залишках, які беруть участь в його взаємодії з білком, що зв'язується з IL-18. Більш конкретно, такими мутаціями є заміни, переважно, неконсервативні заміни, додатки або делеції. Залишки, мутовані у вказаному поліпептиді, можуть бути вибрані з Glu-42, Ilе-85, Met-87, Lys-89, Met-96, Asp-130, Lys-132, Pro-143, Met-149 і Leu-189, а переважно, Glu-42 і Lys-89. В одному з варіантів здійснення винаходу, Glu-42 або Lys-89, або обидва Glu-42 і Lys-89 замінені неполярною амінокислотою, переважно, аланіном. Крім того, даний винахід відноситься до ДНК, що кодує вказаний поліпептид, а переважно, до ДНК, що кодує поліпептид, вибраний з SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7 або SEQ ID NO: 8. В одному з варіантів здійснення даного винаходу, ДНК, що кодує поліпептиди SEQ ID NO: 6, SEQ ID NO: 7 і SEQ ID NO: 8, приєднують до сигнального пептиду, переважно, до сигнального пептиду людського гормону росту (лГР). Крім того, даний винахід також відноситься до вектора, що включає вказану ДНК, здатного експресувати поліпептид, що кодується вказаною ДНК, у відповідній клітині-хазяїні, наприклад, в прокаріотичній або в еукаріотичній клітині-хазяїні. Крім того, даний винахід відноситься до фармацевтичних композицій, що містить вказаний поліпептид і призначеним для лікування захворювань, які можуть попереджатися або послаблюватися Тh1-відповідями, а переважно, для лікування вірусного захворювання або раку. На Фіг.1А показана нуклеотидна послідовність, що кодує попередник IL-18 дикого типу, і локалізація праймерів, що використовуються для конструювання різних мутантних білків IL-18. Широка стрілка вказує на початок послідовності, що кодує зрілий білок IL-18. На Фіг.1В показана амінокислотна послідовність зрілого IL-18. Консенсусна послідовність різних видів IL18 взята в білі рамки. Цистидини підкреслені. Темними рамками окреслені залишки, мутовані в IL-18 даного винаходу. На Фіг.2 схематично показані мутанти IL-18 даного винаходу. His-6 вказує на присутність шести гістидинів, приєднаних в N-кінці про-фрагмента попередника IL-18. Стрілка вказує на сайт ІСЕ-розщеплення, замінений сайтом розщеплення фактора Ха (х). WT означає зрілий IL-18 дикого типу. Е42А означає мутацію із заміною Glu 42 на Ala, K89A означає мутацію із заміною Lys 89 на Ala, а Е42А/K89А означає подвійну мутацію. Виходячи з попередника/x/WT були генеровані три мутанти IL-18 (Е42А, K89А і Е42А-І-K89А) за допомогою двостадійної ПЛР. На Фіг.3А показано індукування IFN-g в клітинах NKO за допомогою IL-18 дикого типу і мутантного білка в концентраціях, представлених по осі x на Фіг.3В, і в присутності IL-12 (0,5нг/мл). На Фіг.3В показано індукування IFN-g в клітинах МКПК за допомогою IL-18 дикого типу і мутантного білка в концентраціях, представлених по осі x і в присутності IL-12 (1,0нг/мл). На Фіг.4А показаний вплив IL-18BP на індукування IFN-g людським IL-18 дикого типу і мутантним білком в клітинах ΝΚΟ. Мутанти і IL-18 дикого типу (30нг/мл) були заздалегідь інкубовані з IL-18BP при концентраціях, показаних по осі x (на Фіг.3В), протягом 1год. при кімнатній температурі, і додані до клітин ΝΚΟ, стимульованих IL-12 (0,5мг/мл). На Фіг.4В показаний вплив IL-18BP на індукування IFN людським IL-18 дикого типу і мутантним білком в клітинах МКПК. Мутанти і IL-18 дикого типу (30нг/мл) були заздалегідь інкубовані з IL-18BP при концентраціях, показаних по осі х, протягом 1год. при кімнатній температурі і додані до клітин МКПК, стимульованих IL-12 (1,0мг/мл). На Фіг.5 показано індукування IL-8 під дією IL-18 дикого типу і мутантного білка. МКПК інкубували з IL-18 дикого типу або з мутантом (30нг/мл). Поліміксин В (1г/мл) змішували з IL-18 протягом 30 хвилин, а потім додавали до МКПК. Через 24 години, супернатанти видаляли і аналізували концентрацію IL-18 з допомогою ЕХЛ (приклад 9). Проілюстрований один з трьох експериментів. Даний винахід відноситься до мутанта IL-18 або до його активного фрагмента або мутеїн у, або до будьякого іншого білка або його пептидного похідного (IL-18М), яке, в порівнянні з білком дикого типу (IL-18WT), є менш чутливим до нейтралізації під дією IL-18BP. Більш конкретно, для генерування активного мутанта IL-18, який є менш чутливим до нейтралізації під дією IL-18BP, одна або декілька амінокислот, переважно, не більше ніж 30, а більш переважно, до 10 амінокислот IL-18 дикого типу можуть бути замінені іншими амінокислотами або еліміновані, або може бути додана одна або декілька амінокислот, переважно, не більше ніж 30, а більш переважно, до 10 амінокислот. Амінокислоти можуть бути замінені іншими амінокислотами; причому, переважними замінами є неконсервативні заміни. Більш конкретно, вказані мутації можуть бути націлені на залишки, які, як передбачається, беруть участь в скріпленні з IL-18BP, такі як Glu-42, Ile-85, Met-87, Lys-89, Met-96, Asp-130, Lys-132, Pro-143, Met-149 і Leu-189, a переважно, Glu-42 і/або Lys-89 [Kim et al., 1999]. IL-18M може бути продукований в еукаріотичних або прокаріотичних експресійних системах, всередині клітини або в периплазматичному просторі, або він може бути секретований в середовище. Продукований IL18M може бути виділений в розчинній або нерозчинній формі (в формі тілець включення). Вектор, що містить кДНК попередника IL-18M, може бути використаний для експресії "правильно" зібраного попередника IL-18M в прокаріотичних системах. Потім, після ІСЕ-розщеплення in vitro, може бути генерований зрілий повністю активний білок. Послідовність ICE в попередникові IL-18M може бути замінена послідовністю, що кодує сайт специфічного розщеплення протеазою, переважно, фактором Ха. Для еукаріотичної експресії і секреції може бути використаний експресуючий вектор, що кодує ефективний сигнальний пептид, а переважно, сигнальний пептид лГР, приєднаний до кДНК зрілого IL-18M. Батьківська кДНК IL-18M, що використовується для конструювання мутантів, може бути вибрана з кДНК миші або людини. Для полегшення очищення, IL-18M може бути помічений в епітопі, переважно, гістидином. Рекомбінантний IL-18M може бути очищений стандартними або афінними методами. Моніторинг кількості продукованого IL18М може бути здійснений з допомогою специфічного ELISA. IL-18M може бути використаний в фармацевтичній композиції для лікування захворювань, які можуть попереджатися або послаблюватися шляхом індукування Th1-відповідей, а більш конкретно, шляхом обробки IL-18, наприклад, для лікування інфекцій, що викликаються мікрооРrанізмами, або раку. Перевага використання цього мутанта замість варіанту білка дикого типу, полягає в його стійкості або резистентності до нейтралізації під дією IL-18BP. Більш конкретно, IL-18M може бути введений системно або місцево як ад'ювант при протипухлинній імунотерапії, спрямованій проти пухлинних антигенів. Пухлинні клітини пацієнта можуть бути виділені і генетично модифіковані для секреції IL-18M, після чого вони можуть бути знов трансплантовані тому самому пацієнту з метою місцевої вакцинації [Coughlin et al., 1998]. Злиття модифікованих пухлинних клітин, експресуючих IL-18M, з алогенними дендритними клітинами (антигенпрезентуючими клітинами) може бути здійснено для додаткового підвищення пухлинної антигенності, а отже, і протипухлинної відповіді. IL-18M може бути введений як ад'ювант при ДНК-вакцинації [Tuting et al., 1998]. Цей спосіб аналогічний описаному раніше способу використання цитокінів IL-12 і IFN. У цьому випадку, чрезшкірна вакцинація пухлинним антигеном може бути здійснена з використанням "пістолета" для вистрілювання генів. Таким чином трансфекція дендритних клітин, присутніх в шкірі, може бути здійснена з використанням ДНК, що кодує як пухлинний антиген, так і IL-18M. Альтернативно, дендритні клітини можуть бути сконструйовані ex vi vo з подальшим адоптивним перенесенням. IL-18M може бути використаний як ад'ювант в протипухлинній терапії, що проводиться за допомогою трансплантації. У цих цілях, раковим пацієнтам можуть бути трансплантовані алогенні стовбурові клітини. Для посилення реакції "трансплантат проти пухлини", індукованої шляхом трансплантації алогенних клітин, IL-18M може бути введений системно або місцево, а переважно, шляхом експресії IL-18M в генетично модифікованих сингенних дендритних клітинах або в пухлинних клітинах,взятих у пацієнта. При цьому, потрібно зазначити, що хоча даний винахід описаний на конкретних переважних варіантах його здійснення, однак, приведений вище опис, а також ілюструючі його приклади не обмежують об'єму винаходу. Для кожного фахівця очевидно, що даний винахід може включати і інші аспекти, переваги і модифікації, що не виходять за рамки об'єму даного винаходу. Приклади Приклад 1 Конструювання векторів для експресії гібридного білка "proIL-18WT-гістидинова мітка", що розщеплюється фактором Ха. Для генерування "правильно" зібраного IL-18 в Е.соlі, сайт розщеплення ферментом ICE в попередникові IL-18 замінювали на сайт розщеплення фактором Ха. Внаслідок цього, розщеплення попередника IL-18 фактором Ха in vitro приводило до генерування активного білка [WO 00/61768]. кДНК-послідовність, що кодує попередник людського IL-18 (proIL18, банк генів, реєстраційний номер D49950, Фіг.1) і що використовується для генерування експресійної плазміди, виділяли як описано в літературі [Ghayur et al., 1997]. Заміну сайту розщеплення для ICE сайтом розщеплення для Ха здійснювали з використанням 2 ПЛРреакцій (див. праймери, що використовуються на Фіг.1). ПЛР-реакція 1: про-фрагмент кДНК IL-18 генерували з використанням смислового праймера (Рr1), що містить EcoRI-сайт, розташований вище (в положенні апстрім) за ОРС, 5'-ATATGAATTCATGGCTGCTGAACCAGTAG (SEQ ID NO: 11), і зворотного праймера (Рr2), сконструйованого для введення ІСЕ-сайгу (33-LESD-36), в якому 6 нуклеотидів були замінені так, щоб вони кодували сайт фактора Ха (33-IEGR-36), S'-AAAGTAACGTCCTTCGATGTTTTC (SEQ ID NO: 12). Ампліфікований ДНК-фрагмент, що кодує зрілий IL-18, генерували з використанням смислового праймера (Рr3), комплементарного Рr2, 5'-GAAAACATCGAAGGACGTTACTTT (SEQ ID NO: 13), і зворотного праймера (Рr4), що містить BamHI-сайт, розташований нижче (в положенні даунстрім) кодуючої послідовності IL-18, 5'ATATGGATCCTAGTCTTCGTTTTGAAC AGTG (SEQ ID NO: 14). Πрο-фрагмент розміром 108п.н. і ДНК зрілого IL-18 розміром 474п.н., виділяли шляхом електрофорезу в 1% агарозі і елюювали за допомогою системи гельекстракції (GIBCO/BRL). ПЛР-реакція 2: два ДНК-фрагменти, одержані в ПЛР-реакції 1, змішували у відношенні 1:1 і використовували разом з праймерами Рrі і Рr4 для генерування кДНК повнорозмірного людського IL-18, в якій сайт ICE замінений сайтом фактора Ха (ІСЕ/Ха). кДНК пpo-IL-18 (ІСЕ/Ха) лігували в плазміду BlueScript (Stratagene) за допомогою рестрикційних EcoRI- і BamHI-сайтів (GIBCO/BRL). Ця плазміда служила для підтвердження послідовності. Передбачена кодована амінокислотна послідовність представлена в SEQ ID NO: 2. Для експресії в Е.соlі, ДНК-вставку, що кодує IL-18, знов лігували у вектор pPROEX HTa (GIBCO/BRL) з використанням EcoRI- і Xbal-сайтів (присутніх в BlueScript). У цьому векторі, одержаний білок був приєднаний своїм N-кінцем до гістидинової мітки. Приклад 2 Конструювання мутантів Е42А. K89А і Е42 А/K89А-м утантів. Мутації в IL-18 були створені в залишках, які, як передбачається, мають важливе значення для зв'язування з інгібітором IL-18BP [Kim et al., 2000]. Були генеровані три мутанти: Е42А, K89А і Е42А/K89А. Ці мутації були створені за допомогою двох ПЛР-реакцій, як описано в прикладі 1, з використанням праймерів і матриць, описаних нижче (праймери показані на Фіг.2). Мутант Е42А ПЛР-реакція 1: Для одержання мутанта Е42А була використана пара праймерів: пара А - праймер Рr1 (приклад 1) і зворотний праймер (Рr5) 5'-ТАА ТТТ AGA TGC AAG СТТ GCC (SEQ ID NO: 15), кодуючий аланін замість глутамінової кислоти (Е42), і пара В - смисловий праймер (Рr6) 5-GGC AAG СТТ GCA ТСТ ААА ТТА (SEQ ID NO: 16), кодуючий аланін замість глутамінової кислоти (GAA GCA), і зворотний праймер Рr4 (приклад 1), з використанням пpo-IL-18 (ІСЕ/Ха) як матриця в ПЛР-реакції. ПЛР-реакція 2: Два фрагменти, одержані в ПЛР-реакціях 1, використали як матриці для другої ПЛРреакції, здійснюваної з допомогою праймерів Рrі і Рr4. Мутант K89А ПЛР-реакція 1: Для одержання мутанта K89А була використана пара праймерів: пара А - праймер Рrі (приклад 1) і зворотний праймер (Pr7) 5'-CTG GCT АТС TGC ATA C AT ACT (SEQ ID NO: 17), кодуючий аланін замість лізину (K89), і пара В - смисловий праймер (Pr8) 5'-AGT ATG TAT GCA GAT AGC C AG (SEQ ID NO: 18), кодуючий аланін замість лізину (ААА®GC A), і зворотний праймер Рr4 (приклад 1), з використанням пpo-IL-18 (ІСЕ/Ха) як матриці для першої ПЛР-реакції. ПЛР-реакція 2: Два фрагменти, одержані в ПЛР-реакції 1, служили як матриці для другої ПЛР-реакції, здійснюваної з використанням праймерів Рrі і Рr4. Мутант Е42А/K89 А Для одержання подвійної мутації Е42А/K89А використали такий самий праймер, як і для одержання мутації Е42А, а кДНК мутанта K89 використали як матрицю в цій реакції. Кожний з трьох мутованих генів IL-18 лігували у вектор BlueScript для підтвердження послідовності. Передбачені амінокислотні послідовності для мутантів попередника IL-18: Е42А, K89А і Е42А/K89А показані в SEQ ID NO: 3, SEQ ID NO: 4 і SEQ ID NO: 5, відповідно. Для експресії в Е.соlі, кожну з трьох ДНК-вставок для IL-18 знов лігували у вектор pPROEX HTa (GIBCO/BRL) з використанням EcoRI- і Xbal-сайтів. Одержаний білок був приєднаний своїм N-кінцем до гістидину (Фіг.1). Приклад 3 Експресія і очищення білка. Попередники мутантів IL-18 були експресовані в Е.соlі і піддані афінному очищенню за допомогою гістидинової мітки, і відповідні зрілі молекули генерували шляхом протеолітичного розщеплення фактором Ха. Кожну з чотирьох плазмід pPROEX HTu/IL-18 (дикого типу і три мутанти) вводили в компетентні клітини Е.соlі штаму DHQ (GIBCO/BRL) і експресували як описано в літературі (11). Нічна культура, 25мл, служила як інокулят для 450мл культури LB, що містить 100мкг/мл ампіциліну, і її культивували до клітинної щільності OD600=0,6-1. Експресію білка індукували шля хом обробки ізопропілтіогалактозидом (IPTG 0,3мМ), і інкубування продовжували при 37°С протягом 3год. при струшуванні. Культивовані бактерійні клітини збирали центрифугуванням (5000´g протягом 15 хвилин при 4°С), і осад суспендували в 30мл буфер у Талона (50мМ NaH2PO4/20мМ Трис-НСІ/100мМ NaCl, pH8). Клітини лізу вали шляхом обробки ультразвуком (імпульси 2´30с) на льоду. Розчинний білок одержували центрифугуванням (4000´g протягом 30 хвилин при 4°С) і наносили на 3мл мініколонку Талона (Clontech). Потім колонку Талона промивали 30 об'ємами шару і елюювали 6мл 100мМ імідазолу в буфері Талона. Елюент діалізували проти буфера, що містить фактор Ха (20мМ ТрисНСІ/150мМ NaCl/2мМ CsCb) при 4°С протягом 20год. 0,2мл афінно очищеного на колонці Талона гібрида пpoIL-18 з міткою His´6 на N-кінці інкубували з 4мкг ферменту фактора Ха (New England Biolabs) протягом 4год. при кімнатній температурі в присутності 2мМ фенілметилсульфонілфториду (GIBCO/BRL). Моніторинг кількості продукованого IL-18 здійснювали за допомогою специфічного ELISA (R&D Systems). Амінокислотні послідовності, передбачені для зрілого IL-18 дикого типу і мутантів Е42А, K89А і Е42А/K89А, показані в послідовностях SEQ ID NO: 6, SEQ ID NO: 7 і SEQ ID NO: 8, відповідно. Приклад 4 Оцінка мутантів білка IL-18: Е42А, K89А і Е42А/K89А за допомогою Вестерн-блот-аналізу. Очи щені мутанти IL-18 піддавали Вестерн-блот-аналізу з використанням поліклонального антитіла і моноклонального антитіла проти зрілого IL-18. Рівні кількості афінно-очищеного на колонці Талона (після розщеплення фактором Ха) попередника IL-18 дикого типу і його мутантних форм, піддавали електрофорезу в П АГ з ДСН (10% акриламід) у відновлювальних умовах. Білки переносили на нітроцелюлозні мембрани, а потім інкубували з "першими" антитілами (кролячим поліклональним антитілом проти людського IL-18 або клоном моноклонального антитіла 8-31-4 (IgG2a), яке було продуковане проти рекомбінантної зрілої форми людського IL-18 [Puren et al., 1999] і яке також розпізнавало попередник IL-18). Після 24-годинного інкубування додавали відповідне "друге" антитіло, козячий антимишачий або ослячий антикролячий імуноглобулін IgG, кон'югований з пероксидазою (Jackson Iimuno Research), і візуалізували за допомогою ЕХЛ (New England Nuclear Life Science Products). Фарбування пpo-IL-18 поліклональним кролячим антитілом проти людського IL-18 було однаково інтенсивним для IL-18 дикого типу і для кожного з його трьох мутантів. Аналогічним чином, сигнали, одержані з використанням зрілих форм IL-18 дикого типу, IL-18 і кожного з його трьох мутантів з використанням поліклональної антисироватки, мали однакову інтенсивність. Уявна молекулярна маса вказувала на те, що різні форми IL-18 мали очікуваний розмір. У протилежність цьому, при використанні моноклонального антитіла, два мутанти K89А і Е42А/K89А мали більш інтенсивне забарвлення, ніж білок дикого типу і мутант Е42А, внаслідок чого було зроблене припущення, що а фінність моноклонального антитіла по відношенню до цих мутантів є більш високою. Ці результати дають основу передбачити, що мутанти K89 А і Е42А/K89А можуть мати іншу конформацію, що приводить до більш високої афінності. Приклад 5 Оцінка біологічної активності мутантів білка IL-18: Е42А. K89 А і Е42 А/K89А. Очищені зрілі форми ІL18ЛСЕ/Ха аналізували на ко-індукування IFN-g в людських природних клітинах-кілерах (NKO, описаних в прикладі 8), в МКПК (описаних в прикладі 7) і на індукування IL-8 в МКПК. IL-18 не індукує IFN-g в цих клітинах, на відміну від IL-12 (або IL-15), і використовувався як ко-стимулятор. Низькі концентрації IL-12 (1-2нг/мл IL-12 (PreproTech Rocky Hill, NJ)) індукують невелику кількість IFN-g, однак, обробка IL-12 разом з IL-18 приводила до значного збільшення продукування IFN-g. Моніторинг продукування IFN-g в клітині проводили як описано в прикладі 9. Було виявлено, що індукування IFN-g в клітинах NKO під дією IL-18 дикого типу (ІСЕ/Ха) і IL-12 було порівнянне з індукуванням IFN-g рекомбінантним зрілим людським IL-18, утвореним внаслідок ІСЕ-процесингу пpo-IL-18 [Gu et ah, 1997] і IL-12. Ці результати показали, що IL-18 має "правильне" збирання в Е.соlі і "правильно" процесується фактором Ха. Для тесту на активність мутованого IL-18, індукцію продукування IFN-g шляхом стимуляції мутантним IL-18 або IL-18 дикого типу разом з IL-12 аналізували в клітинах NKO (статистичні аналізи описані в прикладі 10). Як показано на Фіг.3А, IL-18 дикого типу є активним як індуктор IFN-g, при його використанні, починаючи з концентрації 7,5нг/мл з поступовим її збільшенням до 60нг/мл (найвищої тестованої концентрації). Кожна з трьох мутованих форм IL-18 володіла біологічною активністю, яка була ви ще ніж активність IL-18 дикого типу в цих клітинах. Так, наприклад, білок з однією мутацією Е42А був в два рази більш активним, ніж форма дикого типу при кожній тестованій концентрації. Білок з однією мутацією K89А був в чотири рази більш активним, ніж форма дикого тину при концентрації 7,5нг/мл. IL-18 з подвійною мутацією Е42А/K89А був найбільш активним. Як показано на Фіг.3А, мутований IL-18, E42A, індукував 600пг/мл IFN-g, при цьому, максимальна активність спостерігалася при попередній обробці 60нг/мл IL-18 дикого тину в концентрації 30нг/мл, мутанта K89А в концентрації 15нг/мл і подвійного мутанта, в концентрації 7,5нг/мл. Таким чином, мутанти Е42А, K89А і подвійний мутант були в 2, 4 і 8 разів більш активними, ніж білок дикого тину, відповідно. Аналогічні результати спостерігалися при тестуванні продукування IFN-g в свіжовиділених людських МКПК (приклад 7). У цих клітинах, ко-стимуляція IL-12 і IL-18 приводила до продукування IFN-g, але жоден з двох цитокінів, взятих окремо, не міг індукувати IFN-g. Подвійний мутант Е42А/K89 А був найактивнішим (Фіг.3В). Ці результати показали, що заміна двох заряджених амінокислот Glu42 і/або Lys89 залишками Ala, відповідно, приводить до збільшення біологічної активності IL-18. Відомо, що IL-18 індукує IL-8 в СО14+-клітинах в препаратах МКПК (описаних в прикладі 7). Хоча в цих клітинах, IL-18 індукує продукування IL-8 без допомоги ко-стимулятора IL-12, однак, для індукування IL-8 потрібні більш високі концентрації IL-18, ніж для індукування IFN-g. Тому був проведений тест на індукування IL-8 під дією IL-18 дикого типу і мутантну стимуляцію МКПК. Моніторинг продукування IL-8 проводили в клітинних середовищах шля хом специфічного аналізу, описаного в прикладі 9. На Фіг.4 показано, що хоча дія двох одиночних мутацій на індукування IL-8 була порівнянною з дією білка дикого типу, однак, подвійний мутант IL-18 виявляв набагато більш високий рівень індукування IL-8 (в 3,5 разів), ніж форма дикого типу. Ці результати показали, що подвійний мутант, Е42А/K89А володіє найвищою біологічною активністю. Приклад 6 Нейтралізація мутантів IL-18 під дією IL-18BP. Мутації були створені в залишках, які, як передбачається, грають важливу роль в зв'язуванні IL-18 з інгібітором IL-18BP. Тому був проведений специфічний аналіз на здатність IL-18ВР нейтралізувати біологічну активність IL-18, наприклад, продукування IFN-g (приклад 8). Різні концентрації IL-18BP (ізоформа "а" клітин СНО, продукувала рекомбінантний his 6-мічений людський IL-18BP (що поставляється з Interpharm Laboratories, Ness Ziona, Israel Kim et al., 2000)) заздалегідь інкубували з IL-18 дикого типу або з його мутантними формами (кінцева концентрація 30нг/мл), а потім додавали до клітинних культур. Як показано на Фіг.4А, 50% інгібуюча концентрація IL-18BP для ко-індукування IFN-g під дією IL-18 дикого типу, з клітин NKO, становила приблизно 15нг/мл (що дозволяє передбачити, що при концентрації IL-18BP 3,7нг/мл інгібування не відбувається, і ця величина представляє 100% активність). Одиночна мутація Е42А приводить до аналогічної залежності "доза - інгібуюча концентрація IL-18BP". Однак, при інкубуванні мутанта K89А з IL-18BP, його здатність діяти як ко-індуктор IFN-g в клітинах NKO нейтралізувалася в меншій мірі (Фіг.5А). Статистично значуще зниження активності могло спостерігатися тільки при концентрації 120нг/мл. У протилежність цьому, IL-18BP був нездатний нейтралізувати подвійний мутант IL-18, E42A/K89A. Як показано на Фіг.4В, при тестуванні в клітинах МКПК, замість клітин NKO, IL-18 виявився більш чутли вим до нейтралізації під дією IL-18BP. Кількість IL-18ВР, необхідна для нейтралізації IL-18 дикого типу, становила 3,7нг/мл, тобто, найменшу з концентрацій, що тестуються. IL-18 з однією мутацією Е42А поводиться аналогічно до IL-18 дикого тину, і як було встановлено з спостережень, низькі концентрації IL-18BP нейтралізували його біологічну активність в МКПК. У протилежність цьому, мутант з однією мутацією K89А був нейтралізований при концентрації 120нг/мл. Аналогічно до результатів, одержаних для IL-18BP-нейтралізації мутантів IL-18 в клітинах NKO, IL-18BP здійснював лише незначний вплив на подвійний мутант Е42 А/K89А в клітинах МКПК. Ці результати показали, що мутант Е89А і подвійний мутант Е42А/K89 А був менше схильний до впливу природного інгібітору IL-18BP. Приклад 7 Виділення і культивування мононуклеарних клітин периферичної крові (МКПК) і індук ування IFN-g. Залишкові лейкоцити після тромбоферезу здорових людей-донорів, вимивали з пробірок для взяття крові і піддавали центрифугуванню на апараті Histopaque. МКПК відсмоктували з вн утрішньої поверхні судин, три рази промивали в апірогенному фізіологічному розчині (Baxter Health Care, Mundelein, IL) і ресуспендували при щільності 5´106 клітин на мл в середовищі RPMI 1640, в яке було додано 10% FBS (GIBCO/BRL Grand Island, NY). Клі тини культивували в плоскодонних 96-ямкових планшетах (Becton Dickinson), що містять тільки середовище RPMI 1640 (контроль), різні концентрації рекомбінантного людського IL-18 і IL-18 дикого типу (ІСЕ/Ха) або три мутанти, в присутності 1нг/мл IL-12. У деяких експериментах, препарати IL-18 спочатку були змішані з поліміксином В (1мкг/мл, Sigma), а потім додані до клітин. Клітини інкубували протягом 16-20год. при 37°С в атмосфері повітря з підвищеною вологістю і з 5% СО2, а потім супернатант культури збирали для оцінки рівня IFN-g. Приклад 8 Індукування IFN-g в клітинній лінії NKO. Початкову батьківську клітинну лінію NK92 одержували від Hans Klingerman [Gong et al., 1994]. Людська клітинна лінія NKO, що використовується в даних дослідженнях, являла собою субклон цієї клітинної лінії. Клітини NKO підтримували в середовищі RPMI 1640, в яке були додані 10% FBS, 50пг/мл IL-2 (R&D Systems) і 200пг/мл IL-15 (Pepro Tech). Для аналізів, клітини NKO суспендували при концентрації 0,5´106 клітин на мл в середовищі RPM 1640 і стимулювали (в 0,2мл-об'ємах в 96-ямкових планшетах) 0,5нг/мл IL-12 (Prepro Tech Rocky Hill, NJ) і різними концентраціями рекомбінантного людського IL-18 дикого типу, IL-18 (ІСЕ/Ха) або мутантів IL-18, Е42А, K89 А і Е42А/K89А. Після витримування протягом 16-20год. при 37°С в атмосфері повітря з підвищеною вологістю і з 5% СО2, супернатант культури збирали для оцінки рівнів IFN-g. Приклад 9 Аналіз цитокінів. Для вимірювання IFN-g (13) і IL-8 (12) в середовищі для культивування клітин використали метод електрохемілюмінесценції в рідкій фазі (ЕХЛ). Рівень ЕХЛ визначали з використанням аналізатора Origen Analyzer (Igen, Gaithersburg, MD). Межа детекції IFN-g і IL-8 становила 62пг/мл і 40пг/мл, відповідно. Приклад 10 Статистичний аналіз. Дані виражали як середні ± стандартна помилка середньої. Значення для груп порівнювали за допомогою аналізу ANOVA з використанням найменшої значущої різниці по Фішеру. Статистична значущість була прийнятною в 95% довірчому інтервалі. ANOVA і кореляційний аналіз здійснювали з використанням пакетів статистични х програм STATVIEW 512 + (Brain Power, Calabasas, CA). Приклад 11 Продукування зрілих мутантів IL-18 в клітинах СНО. Для експресії і секреції мутантів IL-18 в клітинах СНО, ДНК-послідовність, що кодує зрілий білок дикого типу і мутантний IL-18BP, лігували з послідовністю ДНК сигнального пептиду лГР за допомогою двох ПЛР-реакцій, аналогічних реакціям, описаним в прикладі 1. Матриця для першої ПЛР-реакції ампліфікації кожного мутанта IL-18 являла собою відповідну конструкцію, описану в прикладі 2 і одержану з використанням смислового праймера (Рr9), який містить послідовності, що перекриваються, IL-18 і сигнального пептиду лГР, і зворотних праймерів (Рr10), що кодують останні 12 нуклеотидів IL-18, стоп-кодон і сайт для рестриктуючого ферменту. Для ампліфікації сигнального пептиду гормону росту, плазміду pXGH використали як матрицю зі смисловим праймером (Pr11), що містить сайт для рестриктуючого ферменту і перших 12 нуклеотидів сигнального пептиду лГР, і із зворотним праймером (Рr12), що містить послідовності сигнального пептиду, що перекриваються, і зрілого білка IL-18. Матриці для другої ПЛР-реакції, здійснюваної з метою ампліфікації фрагмента, що кодує сигнальний пептид лГР, приєднаний до зрілої послідовності IL-18, являли собою очищені ампліфіковані фрагменти, одержані в першій ПЛР-реакції, і праймери Рr10 і Pr11, що містять рестрикційні сайти. Цей гібридний фрагмент очищали, гідролізували відповідними рестриктуючими ферментами і клонували в експресуючий вектор ссавця. Вказані плазміди використали для трансфекції клітин СНО (DHFR-) разом з плазмідою, що містить мишачий ген DHFR як генний маркер. Резистентні клітини виділяли на селективному середовищі і аналізували на продукування IL-18 за допомогою аналізу ELISA. Стабільно трансфіковані клітини піддавали декільком циклам генної ампліфікації із зростаючими концентраціями МТХ. Після закінченні процесу ампліфікації генів, клони виділяли за допомогою лімітуючого розведення. Після субклонування, клон, який виявляв високу специфічну продуктивність і більш високу стабільність продукування, відбирали для подальшого продукування. Бібліографія: 1. Anderson, P.M., Maraskovsky, Ε., Billingsley, W.L., Dougall, W.C., Tometsko, M.E., Roux. E.R., Teepe, M.C., DuBose, R..F, Cosman, D., Galibert, L. (1997) "A homologue of the TNF receptor and its ligand enhance T-cell growth and dendritic-cell function." Nature, 390, 175-179. 2. Bazan, J. R, Timans, J. G. and Kaselein, R. A. (1996) "A newly defined interleukin-1? "Nature 379, 591. 3. Born, T.L,, Morrison, L.A., Esteban, DJ., VandenBos, Т., Thebeau, L.G., Chen, N., Spriggs, M.K., Sims, J.E., Buller, R.M. (2000) "A po xvirus protein that binds to and inactivates IL-18, and inhibits NK cell response." J. Immunol. 164, 3246-54. 4. Childs, R., Chernoff, Α., Contentin, N., Bahceci, E., Schrump, D., Leitman, S., Read, E.J., Tisdale, J., Dunbar, C, Linehan, W.M., Young, N.S., Barrett, A.J. (2000) "Regression of metastatic renal-cell carcinoma after nonmyeloablative allogeneic peripheral-blood stem-cell transplantation." N. Engl. J. Med. 343, 750-8. 5. Cho, D., Kim, T.G., Lee, W., Hwang, Y.I., Cho, H.I., Han, H., Kwon, O., Kim, D., Park, H., Houh, D. (2000) "Interleukin-18 and the costimulatory molecule B7-1 have a synergistic anti-tumor effect on murine melanoma; implication of combined immunotherapy for poorly immunogenic malignancy" J In vest Dermatol, 114, 928-34. 6. Coughlin, СМ., Salhany, K.E., Wysocka, M, Aruga, E., Kurzawa, H., Chang, A.E., Hunter, C.A., Fox, J.C., Trinchieri, G. and Lee, W.M. (1998) "Interleukin-12 and interleukin-18 synergistically induce murine tumor regression which involves inhibition of angiogenesis." J.Clin.Invest., 101, 1441-52. 7. Engelmann, H., Aderka, D., Rubinstein, M., Rotman, D. and Wallach. D. (1989) "A tumor necrosis factorbinding protein purified to homogeneity from human urine protects cells from tumor necrosis factor toxicity" J. Biol. Chem. 264, 11974-11980. 8. Engelmann, H, Novick, D. and Wallach. D. (1990) Two tumor necrosis factor-binding proteins purified from human urine. Evidence for immunological cross-reactivity with cell surface tumor necrosis factor receptors." J. Biol. Chem. 265, 1531-1536. 9. Ghayur, Т., Banerjee, S., Hugunin, M., Butler, D., Herzog, L., Carter, Α., Quintal, L., Sekut, L ., Talanian, R., Paskind, M., Wong, W., Kamen, JR., Tracey, D., and Allen, H. (1997) "Caspase-1 processes IFN-gamma-inducing factor and regulates LPS-induced IFN-gamma production." Nature 386, 619-623. 10. Gollob, J.A., Mier, J.W., Veenstra, K., McDermott, D.F., Clancy, D., Clancy, M., Atkins, MB. (2000) "Phase I trial of twice-weekly intravenous interleukin 12 in patients with metastatic renal cell cancer or malignant melanoma: ability to maintain IFN-gamma induction is associated with clinical response." Clin Cancer Res, 5, 1678-92. 11. Gong, J.H., Maki, G., Klingemann, H. G. (1994) "Characterization of a human cell line (NK-92) withphenotypical and functional characteristics of activated natural killer cells." Leukemia 8:652. 12. Gu, Y., Kuida, K., Tsutsui, H., Ku, G., Hsiao, K., Fleming, Μ.Α., Hayashi, N., Higashino, K., Okamura, H., Nakanishi, K., Kurimoto, M., Tanimoto, Т., Flavell, R. Α., Sato, V., Harding, M. W., Livingston, D.J., and Su, M. S. (1997) "Acti vation of interferon-gamma inducing factor mediated by interleukin-1 beta converting enzyme." Science 275, 206-209. 13. Kim, S.H., Eisenstein, M., Reznikov, L., Fantu zzi, G., Novick, D., Rubinstein, M. and Dinarello, C.A.(2000)" Structural requirements of six naturally occurring isoforms of the IL-18 binding protein to inhibit IL-18." Proc Natl Acad Sci USA, 97, 1190-5. 14. Kohno, K., J. Kataoka, T. Ohtsuki, Y. Suemoto, I. Okamoto, M. Usui, M. Ikceda, and M. Kurimoto. (1997) "IFN-gamma-inducing factor (IGIF) is a costimulatory factor on the acti vation of Thl but not Th2 cells and exerts its effect independently of IL-12." J. Immunol. 158: 1541-1550. 15. Kugler, Α., Stuhler, G., Walden, P., Zoller, G., Zobywalski, Α., Brossart, P., Trefzer, U., Ullrich, S., Muller, C.A., Becker, V., Gross, AJ., Hemmerlein, В., Kanz, L., Muller, G.A., Ringert, R.H.(2000) "Regression of human metastatic renal cell carcinoma after vaccination with tumor cell-dendritic cell hybrids." Nat. Med. 3, 332-6. 16. Nakamura, K., Okamura, H., Wada, M., Nagata, K. and Tamura, T. (1989). "Endotoxin-induced serum factor that stimulates gamma interferon production." Infect. Immun., 57,590-5 issn: 0019-9567. 17. Nakamura, K., Okamura, H., Nagata, K., Komatsu, T. and Tamura, T. (1993) "Purification of a factor which provides a costimulatory signal for gamma interferon production." Infect. Immun. 61, 64-70. 18. Novick, D., Engelmann, H., Wallach, D. and Rubinstein, M. (1989) "Soluble cytokine receptors are present in normal human urine." J. Exp. Med., 170, 1409-14. 19. Novick, D., Cohen, B. and Rubinstein, M. (1992) "Soluble Interferon-alpha Receptor Molecules Are Present in Body Fluids." FEBS Lett, 314, 445-8. 20. Novick, D., Cohen, B. and Rubinstein, M. (1994) "The Human Interferon alpha/beta Receptor Characterization and Molecular Cloning." Cell 77, 391-400. 21. Novick, D., Kim, S., Fantuzzi, G., Rezniko v, L.L., Dinarello, C.A. and Rubinstein, M. (1999) "Interleukin-18 Binding Protein: A No vel Modulator of the Thl Cytokine Response. Immunity 10, 127,36. 22. Okamura, H., Tsutsui, H., Komatsu, Т., Yutsudo, M., Hakura, Α., Tanimoto, Т., Torigoe, K., Okura, Т., Nukada, Y., Hattori, K., Akita, K., Namba, M., Tanabe, F., Konishi, K., Fukuda, S., and Kurimoto, M. (1995) "Cloning of a new cytokine that induces EFN-gamma production by Τ cells." Nature, 378, 88-91. 23. Puren, A.J., Fantuzzi, G., Dinarello, C.A. (1999) "Gene expression, synthesis, and secretion of interleukm 18 and interleukin 1 beta are differentially regulated in human blood mononuclear cells and mouse spleen cells." Proc Natl Acad Sci USA, 962256-61. 24. Seki, S, Habu, Y., Kawamura, Т., Takeda, K., Dobashi, H., Ohkawa, Т., Hiraide, H. (2000)" The liver as a crucial organ in the first line of host defense: the roles of Kupffer cells, natural loiter (NK) cells and NK1.1 Ag+ Τ cells in Τ helper 1 immune responses." Immunol Rev, 174, 35-46. 25. Simonet, W.S., Lacey, D.L., Dunstan, C.R., Kelley, M., Chang, M.S., Luth y, R., Nguyen, H.Q., Wooden, S., Bennett, L., Boone, Т., Shimamoto, G.s DeRose, M., Elliott, R, Colombero, Α., Tan, H.L., Trail, G., Sullivan, J., Davy, E., Bucay, N., Renshaw-Gegg, L., Hughes, T.M., Hill, D., Pattison, W., Campbell, P., Boyle, " Osteoprotegerin: a novel secreted protein involved in the regulation of bone density." Cell, 89, 309-19. 26. Slavin, S. (2000) "Immunotherapy of cancer with alloreactive lymphocytes." N. Engl. J. Med., 343, 802-3. 27. Slavin, S., Or, R., Prighozina, Т., Gurevitch, O., Aker, M., Panighari, S. Shapira, M., Nagle, A. (2000) "Immunotherapy of hematologic malignancies and metastatic solid tumors in experimental animals and man" Bone Marrow Transplant Suppl, 2: S54-7. 28. Tsutsui, H., K. Nakanishi, K. Matsui, K. Higashino, H. Okamura, Y. Miya zawa, and K. Kaneda. (1996) "IFNgamma-inducing factor up-regulates Fas ligand-mediated cytotoxic activity of murine natural killer cell clones." J. Immunol., 157,3967-73 issn: 0022-1767. 29. Tuting, Т., Wilson, C.C., Martin, D.M., Kasamon, Y.L., Rowles, J., Ma, D.I., Slingluff, C.L., Wagner, S. N., van der Bruggen, P., Baar, J., Lotze, M.T., Storkus, WJ. (1998) "Autologous human monocyte-derived dendritic cells genetically modified to express melanoma antigens elicit primary cytoto xic Τ cell responses in vitro: enhancement by cotransfection of genes encoding the Th1-biasing cytokmes IL-12 and IFN-alpha." J. Immunol., 160, 1139-47. 30. Urushihara, N., Iwagaki, H., Yagi, Т., Kohka, H., Kobashi, K., Morimoto, Y., Yoshino, Т., Tanimoto, Т., Kurimoto, M., Tanaka, N. (2000) "Elevation of serum interleukin-18 levels and activation of Kupffer cells in biliary atresia." J. Pediatr. Surg., 35, 446-9. 31. Ushio, S., Namba, M., Okura, Т., Hattori, K., Nukada, Y., Akita, K., Tanabe, F., Konishi, K., Micallef, M., Fujii, M., Torigoe, K., Tanimoto, Т., Fukuda, S., Ikeda, M., Okamura, H., and Kurimoto, M. (1996) J. Immunol., 156, 4274-9. 32. Vigers, G.P., Anderson, L.J., Gaffes, P., Brandhuber, B.J. (1997) "Crystal structure of the type-I interleukin-1 receptor complexed with interleukin-lbeta." Nature, 386, 190-4. 33. Xiang, Y. and Moss, B.(1999)" IL-18 binding and inhibition of interferon gamma induction by human poxvirusencoded proteins." Proc Natl Acad Sci USA, 96, 1537-42. 34. Yasuda, H., Shima, N., Nakagawa, N., Mochizuki, S.I., Yano, K., Fujise, N., Sato, Y., Goto, M., Yamaguchi, K., Kuriyama, M., Kanno, Т., Murakami, Α., Tsuda, E., Morinaga, Т., Higashio, K. (1998)" Identity of osteoclastogenesis inhibitory factor (OCIF) and osteoprotegerin (OPG): a mechanism by which OPG/OCIF inhibits osteoclastogenesis in vitro. "Endocrinology. 139, 1329-37. Роботи, що цитуються вище і по всьому опису винаходу у всій своїй повноті вводяться в даний опис за допомогою посилання.
ДивитисяДодаткова інформація
Назва патенту англійськоюIl-18 mutant polypeptide, extracted dna coded il-18 mutant polypeptide, vector and pharmaceutical composition
Автори англійськоюDinarello Charles, Kim Soo Hyun
Назва патенту російськоюМутантный полипептид интерлейкина-18, выделенная днк, кодирующая мутантный полипептид интерлейкина-18, вектор и фармацевтическая композиция
Автори російськоюДинарелло Чарльз, Ким Соо Хиун
МПК / Мітки
МПК: A61P 35/00, C07K 14/54, C12N 15/24, A61P 31/12, A61K 38/20
Мітки: поліпептид, виділена, інтерлейкіну-18, днк, мутантний, вектор, композиція, кодує, фармацевтична
Код посилання
<a href="https://ua.patents.su/24-79235-mutantnijj-polipeptid-interlejjkinu-18-vidilena-dnk-shho-kodueh-mutantnijj-polipeptid-interlejjkinu-18-vektor-ta-farmacevtichna-kompoziciya.html" target="_blank" rel="follow" title="База патентів України">Мутантний поліпептид інтерлейкіну-18, виділена днк, що кодує мутантний поліпептид інтерлейкіну-18, вектор та фармацевтична композиція</a>
Попередній патент: Фільтр для очистки масла
Наступний патент: Вітродвигун підвищеної потужності конструкції гриценка
Випадковий патент: Спосіб прогнозування зрощення перелому