Антибіотик, що містить міметичне антитіло, спосіб його приготування та застосування
Формула / Реферат
1. Новий антибіотик, що містить міметичне антитіло та коліцин або містить міметичне антитіло і каналоформуючий домен коліцину, де міметичне антитіло ковалентно приєднане до карбоксильного кінця поліпептиду коліцину або каналоформуючого домену коліцину, де коліцин вибирають з групи, яка складається з коліцину E1, Ia, Ib, А, В, N; де вказане міметичне антитіло отримане шляхом злиття двох гіперваріабельних ділянок (CDRs) VHCDR1 та VLCDR3 через когнантну каркасну ділянку (VHFR2) імуноглобуліну; де імуноглобулін специфічно розпізнає поріни бактерій.
2. Новий антибіотик за п. 1, де бактерією є Neisseria meningitides, поріном є РоrА в зовнішній мембрані клітин Neisseria meningitidis.
3. Новий антибіотик за п. 2, де імуноглобулін складається з ковалентно зв'язаного поліпептиду з PUBMED Accession 2MPA_H та поліпептиду з PUBMED Accession 2MPA_L.
4. Новий антибіотик за будь-яким з пп. 1-3, де коліцин являє собою Іа.
5. Пептидна молекула, що містить міметичне антитіло та коліцин або містить міметичне антитіло і каналоформуючий домен коліцину, де міметичне антитіло ковалентно приєднане до карбоксильного кінця поліпептиду коліцину або каналоформуючого домену коліцину, де коліцин вибирають з групи, яка складається з коліцину E1, Ia, Ib, А, В, N; де вказане міметичне антитіло отримане шляхом злиття двох гіперваріабельних ділянок (CDRs) VHCDR1 та VLCDR3 через когнантну каркасну ділянку (VHFR2) імуноглобуліну; де імуноглобулін специфічно розпізнає поріни бактерій.
6. Злита молекула пептиду за п. 5, що відповідає амінокислотній послідовності SEQ ID NO: 6.
7. Молекула нуклеїнової кислоти, що кодує будь-яку із злитих пептидних молекул згідно з п. 5 або п. 6.
8. Молекула нуклеїнової кислоти за п. 7, що відповідає нуклеотидній послідовності SEQ ID NO: 5.
9. Рекомбінантна плазміда, що містить молекулу нуклеїнової кислоти за будь-яким з пп. 7 або 8.
10. Спосіб приготування нового антибіотика за будь-яким з пп. 1-4, де одну з рекомбінантних плазмід за п. 9 трансфікують в експресуючу систему і новий антибіотик відділяють та очищають від експресованого поліпептида.
11. Застосування нового антибіотика за будь-яким з пп. 1-4 для приготування антибактеріального медикаменту.
12. Застосування за п. 11, де антибактеріальний медикамент застосовують для знищення Neisseria meningitidis, ванкоміцинрезистентного Enterococcus faecalis, метицилінрезистентного Staphylococcus aureus або Pseudomonas aeruginosa з множинною лікарською резистентністю.
Текст
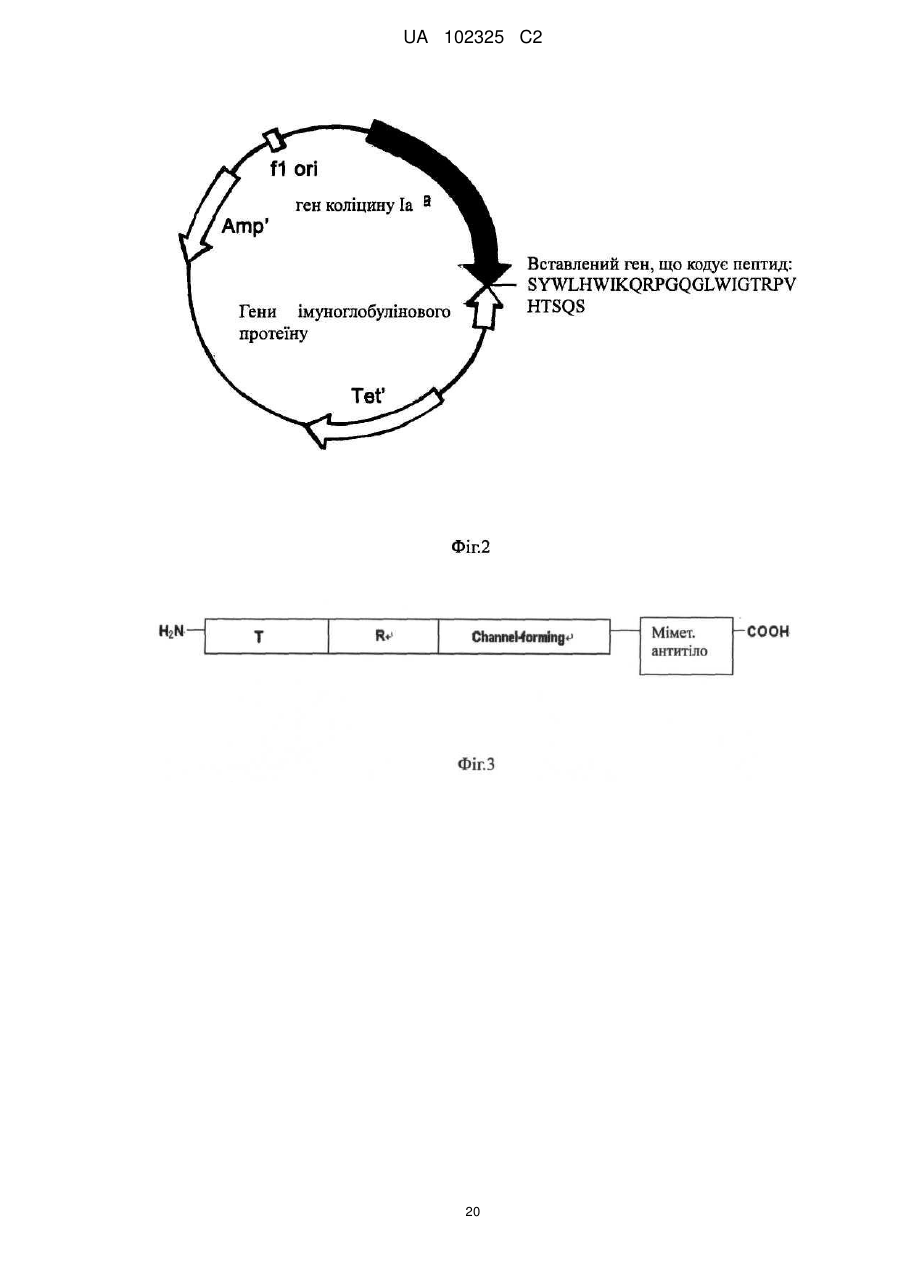
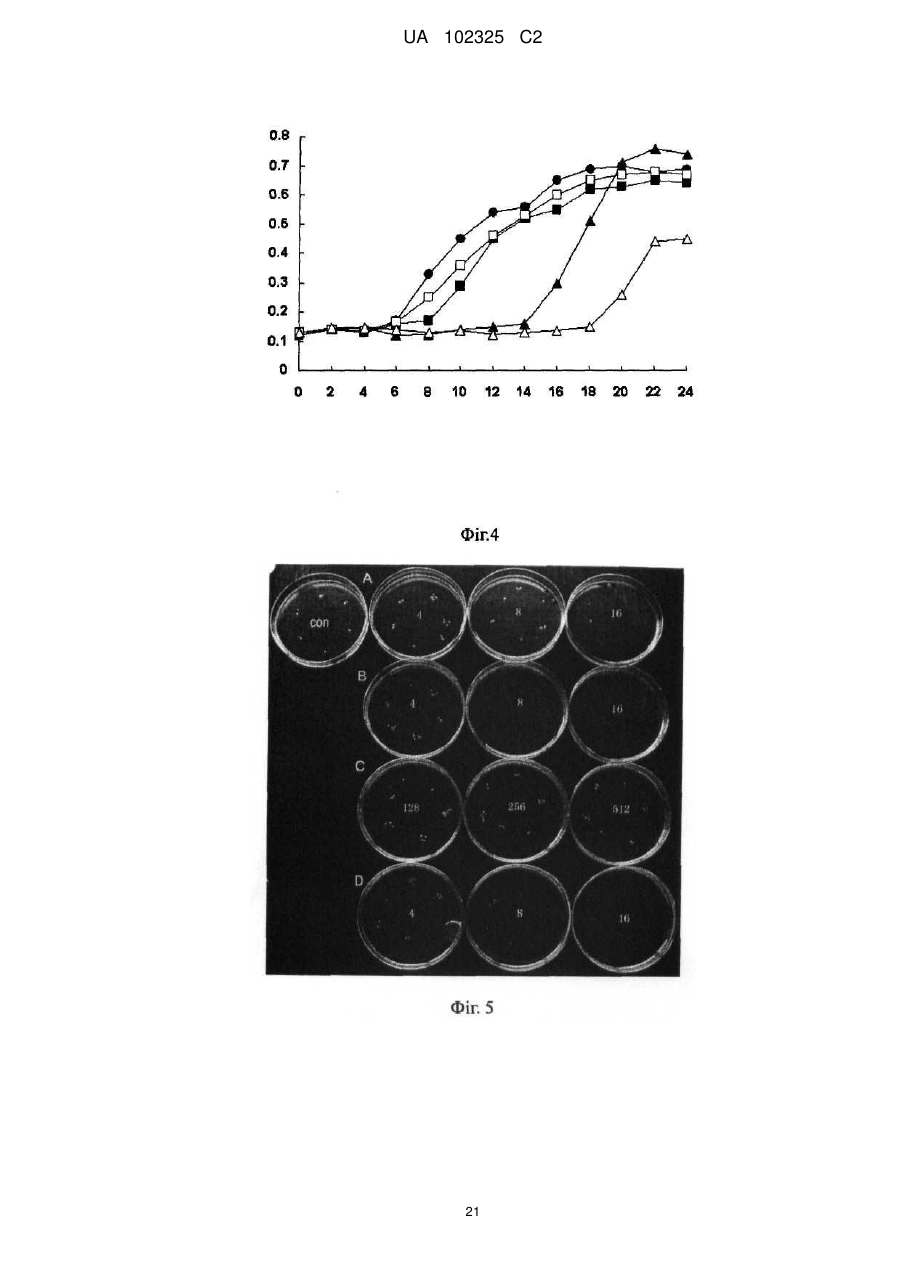
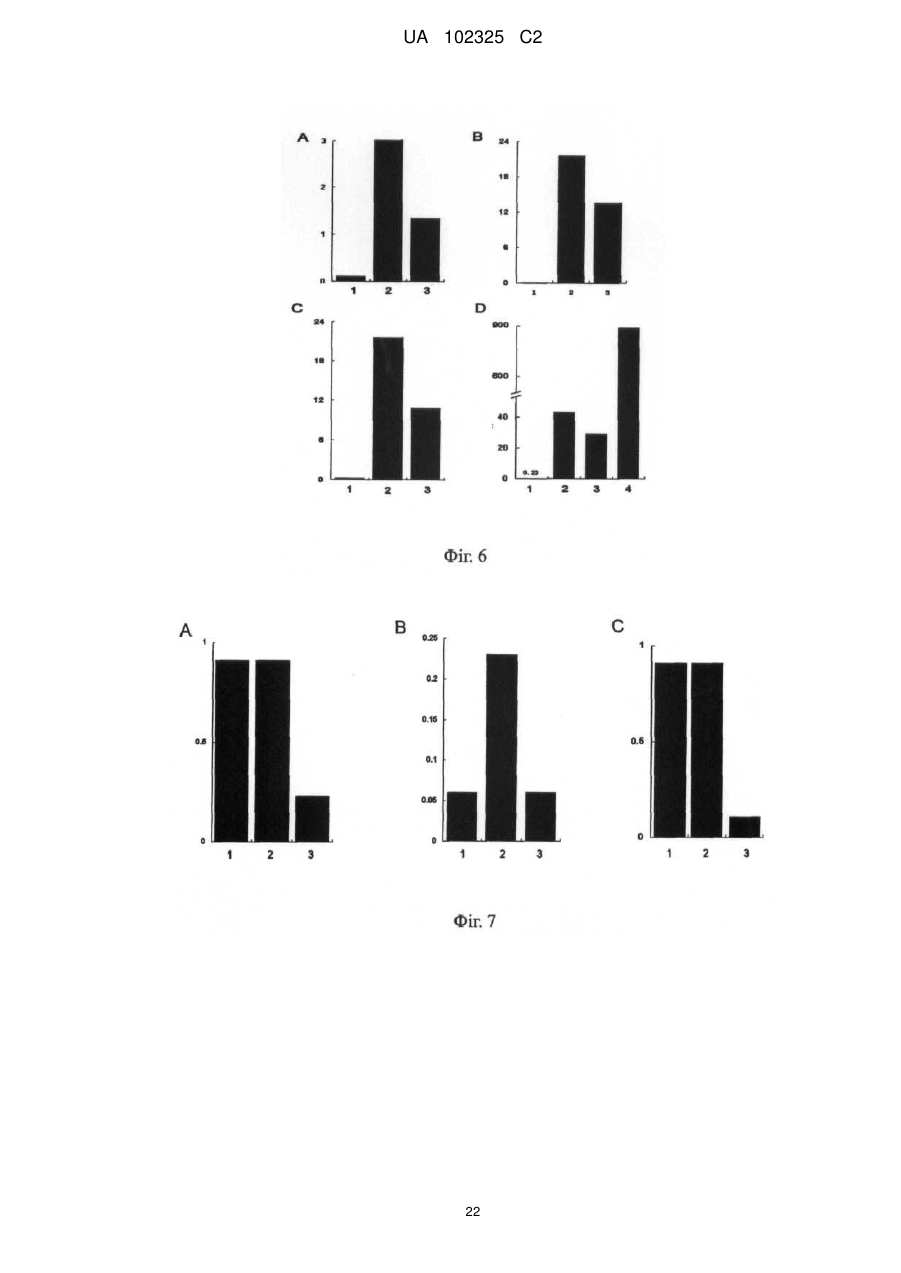
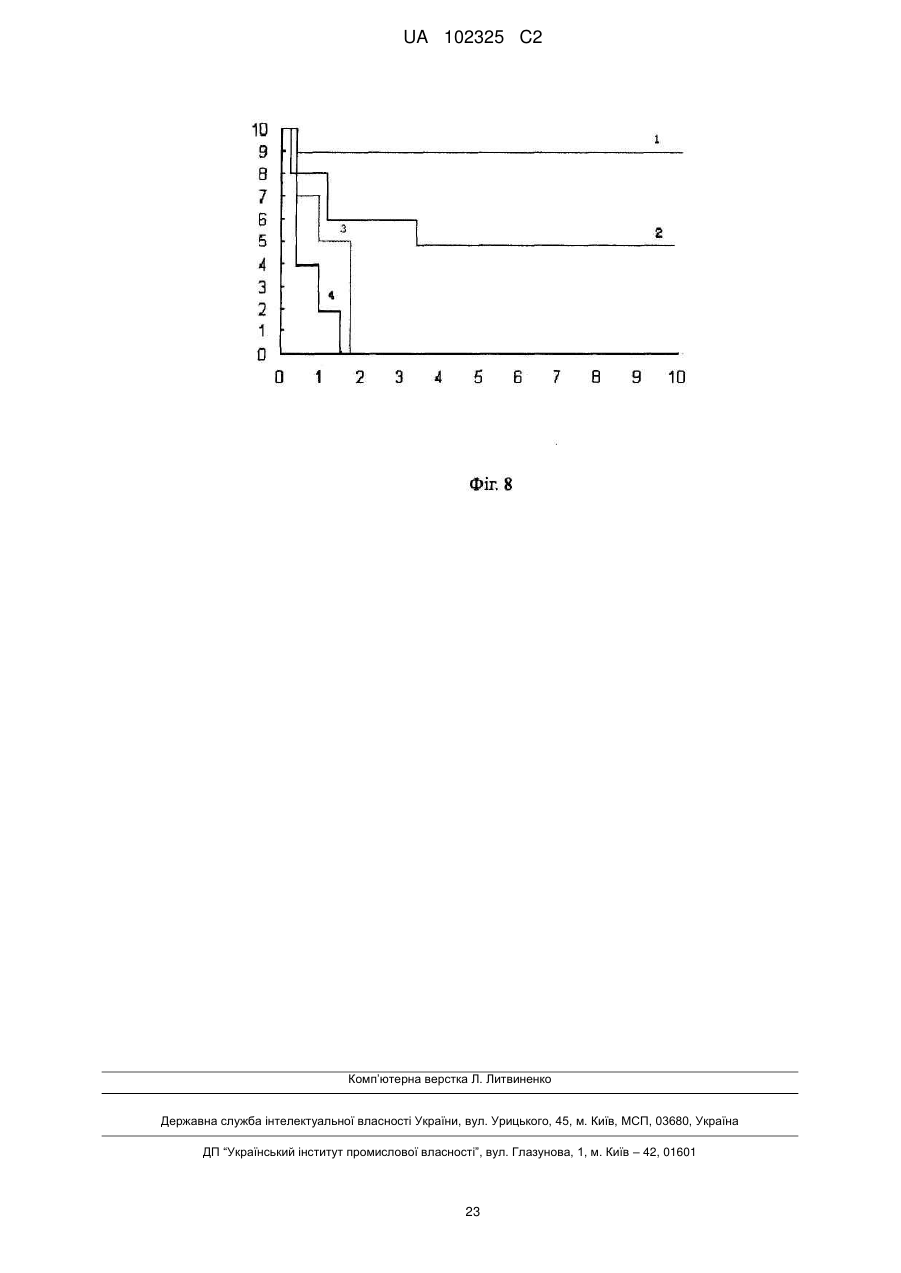
Реферат: Винахід належить до галузі біології, до нового антибіотика, що містить міметичне антитіло, способу його одержання та застосування. Новий антибіотик складається з міметичного антитіла UA 102325 C2 (12) UA 102325 C2 та коліцину або містить міметичне антитіло та каналоформуючий домен коліцину, де міметичне антитіло, ковалентно приєднане до С-кінця пептиду коліцину, або каналоформуючого домену коліцину, де коліцин вибирають з групи, що складається з коліцину E1, Ia, Ib, А, В, N; де вказане міметичне антитіло було одержане злиттям двох гіперваріабельних ділянок (CDRs), VHCDR1 та VLCDR через когнантну каркасну ділянку (VHFR2) імуноглобуліну; де імуноглобулін специфічно розпізнає бактеріальні поріни. Новий антибіотик може бути застосований для виробництва медикаментів для знищення Diplococcus intracellularis, ванкоміцинрезистентних ентерококів, метицилінрезистентних Staphylococcus aureus або мультирезистентних Pseudomonas aeruginosa. UA 102325 C2 5 10 15 20 25 30 35 40 45 50 55 ГАЛУЗЬ ВИНАХОДУ Даний винахід належить до галузі біології та медицини і головним чином стосується нового антибіотика, що містить міметичне антитіло, способів його одержання та застосування. ПЕРЕДУМОВИ СТВОРЕННЯ ВИНАХОДУ З тих пір як пеніцилін та інші антибіотики були введенні в застосування в 1944 році, Diplococcus meningitides, та інші небезпечні для життя хвороботворні бактерії, як наприклад Staphylococcus aureus, Streptococcus pneumoniae, Pseudomonas aeruginosa та Neisseria meningitidis набули резистентності до ліків. Згідно зі звітом, опублікованим Центром контролю за захворюваннями Сполучених Штатів Америки (CDC) в останні роки, схоже, що ці антибіотики повністю втрачають ефективність через 10 або 20 років. Дані антибіотики вбивають патогенні бактерії шляхом гальмування синтезу клітинних стінок, гальмування або втручання в метаболічні шляхи та синтез бактеріальних нуклеїнових кислот та протеїнів. Проте, ці антибіозні методи вірогідно приводять до резистентності до ліків, що закінчується бактеріальною мутацією. Тому вчені спеціалізуються на розвитку нових антибіотиків. Одним з порівняно багатообіцяючих напрямів є імітування взаємокілерного механізму серед гомогенних гетерологічних штамів для розвитку нових антибіотиків. В природі ряд бактеріальних токсинів можуть безпосередньо формувати іонні канали в бактеріальній цитомембрані, щоб вбити бактерію. Типовим зразком є вид бактерійного токсину, секретованого Е.соli, коліцин. Одним з них є коліцин Іа, знайдений в 1952 році Джекобом. Після багатьох зусиль трансмембранна просторова структура коліцину Іа, коли іонні канали відкриваються так само як і закриваються на штучній ліпідній бімолекулярній плівці (Qiu et al., Major transmembrane movement associated with Colicin la channel gating. J. Gen. Physiology, 107: 313-328 (1996)), була відкрита в 1996. Це стало теоретичною основою для конструювання та приготування нових антибіотиків на молекулярному рівні. Як вказано вище, коліцин є видом ідеальної антибіотичної моделі іонних каналів, але коліцин дикого виду може діяти тільки на гомогенні гетерологічні штами. Ми повинні змінити націлювання коліцину таким чином, щоб він був здатним діяти на інші хвороботворні бактерії. Порін, вид порових протеїнів, що існують на зовнішній мембрані бактерій, мітохондрій або хлоропластів, дозволяє більшим молекулам проходити через них. Порін також володіє підвищеною імуногенністю і може індукувати високий рівень експресії моноклональних антитіл в клітинах-хазяїнах. Це може бути ідеальним напрямком розвитку для дослідження антитіл, коли ми можемо конструювати міметичне антитіло з кращою розпізнавальною здатністю, щоб змінити націлювання коліцину, використовуючи специфічність антитіла до порінів в зовнішній мембрані бактерії як прототип міметичного антитіла. КОРОТКИЙ ОПИС ВИНАХОДУ Щоб подолати зазначені вище технічні дефекти та покрити недостачу в рівні техніки, даний винахід забезпечує новий антибіотик. Його антибактеріальна здатність в тисячу разів вища ніж у зазвичай застосовуваних антибіотиків. Завдяки його унікальному механізму дії резистентність до ліків, що виникає внаслідок мутацій, навряд чи може набуватись патогенними бактеріями, а антибіотик не буде спричиняти шкоду нормальним клітинам людини, в той час як вбиватиме патогенні бактерії. Новий антибіотик, що містить міметичне антитіло та коліцин або містить міметичне антитіло та каналоутворюючий домент коліцину, міметичне антитіло, ковалентно приєднане до С-кінця пептиду коліцину, або каналоутворюючого домену коліцину, де коліцин вибирають з групи, що складається з коліцину Е1, Іа, Іb, А, В, N; де вказане міметичне антитіло було одержане злиттям двох гіперваріабельних ділянок (CDRs), VHCDR1 та VLCDR через когнантну каркасну ділянку (VHFR2) імуноглобуліну; де імуноглобулін специфічно розпізнає бактеріальні поріни. В даному описі бактерією є Neisseria meningitides, поріном є РоrА в зовнішній мембрані клітин Neisseria meningitidis. В даному описі імуноглобулін складається з двох ковалентно зв'язаних поліпептидів з PUBMED Accession 2МРА_Н та PUBMED Accession 2MPA_L. В даному описі коліцин є коліцином Іа. Пептидна молекула, що містить міметичне антитіло та коліцин або містить міметичне антитіло та каналоутворюючий домент коліцину, де міметичне антитіло, ковалентно приєднане до С-кінця пептиду коліцину, або каналоутворюючого домену коліцину, де коліцин вибирають з групи, що складається з коліцину Е1, Іа, Іb, А, В, N; де вказане міметичне антитіло було одержане злиттям двох гіперваріабельних ділянок (CDRs), VHCDR1 та VLCDR3 через когнантну каркасну ділянку (VHFR2) імуноглобуліну; де імуноглобулін специфічно розпізнає бактеріальні поріни. 1 UA 102325 C2 5 10 15 20 25 30 35 40 45 50 55 60 Одна з вищевказаних пептидних молекул, її амінокислотна послідовність представлена SEQ ID: 6. Молекула нуклеїнової кислоти, що кодує будь-яку з вищевказаних пептидних молекул. В даному описі молекула нуклеїнової кислоти з нуклеотидною послідовністю представлена SEQ ID: 5. Рекомбінантні плазміди, що містять будь-яку з вищевказаних молекул нуклеїнової кислоти. Спосіб приготування будь-якого з вищевказаних нових антибіотиків, одну з вищевказаних рекомбінантних плазмід трансфікують в в експресійну систему, виділяють та очищують новий антибіотик від експресованого поліпептиду. Будь-який з вищевказаних нових антибіотиків, застосований для приготування антибактеріального медикаменту. В даному описі антибактеріальний медикамент застосовують для знищення Neisseria meningitidis, ванкоміцин-резистентних Enterococcus faecalis, метицилін-резистентних Staphylococcus aureus або мультирезистентних Pseudomonas aeruginosa. Нові антибіотики згідно з винаходом базуються на здатності коліцину формувати іонні канали в мембранах патогену-мішені, що спричиняє витік назовні вмісту патогенної клітини та її загибель. Націлюючою структурою є міметичне антитіло з декількома доменами імуноглобуліну, що специфічно розпізнає поріновий протеїн патогену-мішені. Міметичне антитіло містить дві гіперваріабельні ділянки (CDRs), VHCDR1 та VLCDR3, та когнантну каркасну ділянку (VHFR2) імуноглобуліну; три ділянки ковалентно утворюють лінійну пептидну молекулу як VHCDR1VHFR2-VLDR3 з N-кінця до С-кінця. Загальновідомо, що активні ділянки імуноглобуліну для реакції розпізнавання названі гіперваріабельною ділянкою, яка має тільки приблизно декілька дюжин амінокислот. Міметичне антитіло в новому антибіотику у порівнянні з молекулою природного антитіла або будь-якого презентованого штучного реконструйованого антитіла, такого як seFv та Fab, має меншу молекулярну вагу, кращу проникність тканин та простішу структуру без більшості частин каркасної структури та фрагмента Fc природного антитіла. Дійсно, можна знизити імунну реакцію у пацієнтів та легше провести коліцин, що міститься в новому антибіотику, до інфікованих тканин, та розпізнати патогенну бактерію. При клінічному використанні новий антибіотик направляється до мембрани патогенної бактерії-мішені за допомогою міметичного антитіла, яке він містить, а коліцин, який він містить, формує іонні канали в цитомембрані бактерії-мішені та вбиває бактерію-мішень шляхом виведення назовні її цитоплазми. Антибактеріальна здатність нового антибіотика також застосовна до бактеріальних штамів з резистентністю до ліків. Сайти розпізнавання є унікальними антигенними властивостями бактеріальної поверхні і не локалізуються на цитомембрані людини, тому новий антибіотик є безпечним для людини. У порівнянні з іншими антибіотиками, які легко викликають резистентність до ліків, антибіотик згідно з даним винаходом вбиває патогенну бактерію не через порін, а шляхом дії коліцину на біомембрану патогенної бактерії та формування іонних каналів, що спричиняє витік назовні цитоплазми клітини та її загибель. Для націлювання міметичному антитілу потрібно направити коліцин до патогенної бактерії. Резистентність бактерій до ліків набувається шляхом зміни структури порінів та створення бар'єра для проникнення антибіотика. Для антибіотика згідно з даним винаходом потрібні лише сайти розпізнавання порінового антитіла для того, щоб вбити патогенну бактерію. Нові антибіотики ідентифікують сайти порінів на мембрані бактерії, а коліцин нового антибіотика зв'язує інші сайти та утворює іоні канали, через які вміст бактеріальної клітини виходить назовні і вона гине. Сайтами прикладення дії не є порін. Таким чином, патогенна бактерія навряд чи набуде резистентності до нового антибіотика шляхом мутації, еволюції, викиду або зміни структури поріну, що є необхідним для виживання. Згідно з концепцією даного винаходу новий антибіотик має багато варіантів завдяки варіабельності поріну на бактеріальній поверхні та варіабельності імуноглобулінового розпізнавання порінів. З тих пір, як менінгіт, спричинений Neisseria meningitides, є важкою загрозою для здоров'я немовлят та дітей, резистентність Neisseria meningitidis до ліків є серйозною медичною проблемою. Для пригнічення дії бактерій дози стають все вищими та вищими, що негативним чином впливає на здоров'я пацієнтів. З цієї причини на основі вищевикладеної винахідницької ідеї винахідник реконструював та одержав міметичне антитіло, специфічне до поріну A Neisseria meningitidis. Пептид важкого ланцюга антитіла має інвентарний номер: 2МРА_Н в PubMed Home. Пептид легкого ланцюга має інвентарний номер: 2MPA_L в PubMed Home. Міметичне антитіло, амінокислотна послідовність якого представлена SEQ ID: 2, було приєднане до Скінця пептиду коліцину Іа, для створення нового антибіотика РМС-АМ1 з амінокислотною послідовністю, представленою SEQ ID: 6. Як показано на кривій виживаності мишей на Фіг. 7, рівень виживаності мишей, ін'єкованих смертельною дозою Neisseria meningitides в групі РМС 2 UA 102325 C2 5 10 15 20 25 30 35 40 45 50 55 АМ1 становила 90 % через 8 днів. Це є підтвердженням того, що in vivo антибактеріальна активність та захисна дія нових антибіотиків значною мірою переважала зазвичай застосовувані антибіотики, такі як пеніцилін та гентаміцин. Одночасно був проведений порівняльний тест бактерицидної дії РМС-АМ1, цефтазидиму та ампіциліну щодо Neisseria meningitides, вираженої мінімальною інгібуючою концентрацією (значення МІК). Як показано на Фіг. 6А, значення МІК РМС-АМ1 становило 0,11 наномоль, цефтазидиму - 3,02 наномоль та ампіцилін - 1,35 наномоль. Ці результати означають, що бактерицидна здатність РМС-АМ1 є значно більш сильною ніж у антибіотиків, які застосовують в звичайній медичній практиці для інгібування Neisseria meningitidis. В даному винаході наведено кілька експериментів для тестування бактерицидної дії нового антибіотика РМС-АМ1 на інших патогенах з важливою резистентністю до ліків. Результати показали, що РМС-АМ1 володіє надзвичайно сильною антибактеріальною здатністю щодо мультирезистентних бактерій Pseudomonas aeruginosa, ванкоміцин-резистентних Enterococcus faecalis, метицилін-резистентних Staphylococcus aureus, як показано на Фіг. 5, його антибактеріальна здатність щодо мультирезистентних бактерій Pseudomonas aeruginosa була у 127-3800 разів сильнішою ніж у цефтазидиму, левофлоксацину, гентаміцину і т.д. та, як показано на Фіг. 6В та Фіг. 6С, РМС-АМ1 володіє явною пригнічувальною дією щодо ванкоміцинрезистентних Enterococcus faecalis, метицилін-резистентних Staphylococcus aureus. Новий антибіотик згідно з даним винаходом може бути застосований для приготування антибактеріальних ліків, особливо проти Neisseria meningitidis, Pseudomonas aeruginosa, ванкоміцин-резистентних Enterococcus faecalis або метицилін-резистентних Staphylococcus aureus. Нуклеотидні послідовності, що кодують пептиди нових антибіотиків, можуть бути клоновані у вектор експресії для конструювання рекомбінантних плазмід, які експресують злитий протеїн в клітині-хазяїні. Протеїн нового антибіотика виділяють із експресованого злитого протеїну. Нуклеотидний кодований антибіотик згідно з даним винаходом є регульованим стосовно виродження нуклеотидних кодонів. Фахівець, обізнаний в даній галузі техніки, зможе пристосувати нуклеотидну послідовність відповідно до переваг клітини-хазяїна щодо нуклеотидного кодону. Доки закодований поліпептид не зазнає змін, нуклеотидні послідовності залишаються непорушними в обсязі ідеї даного винаходу. КОРОТКИЙ ОПИС ФІГУР Фіг.1 демонструє структуру рекомбінантної плазміди, що містить ген міметичного антитіла і ген коліцину Іа, названий рВНС-РоrА1. Пептид міметичного антитіла приєднаний до С-кінця коліцину Іа, амінокислотна послідовність міметичного антитіла представлена SEQ ID: 2. Фіг.2 демонструє структуру рекомбінантної плазміди, що містить ген міметичного антитіла і ген коліцину, названий рВНС-РоrА2. Пептид міметичного антитіла приєднаний до С-кінця Іа-пептиду, амінокислотна послідовність міметичного антитіла представлена SEQ ID: 4. В міметичному антитілі VHCDR1 та реверсна VLCDR3 зв'язані через когнантну каркасну ділянку (VHFR2). Фіг. 3 ілюструє конструкцію нового антибіотика, в якій Τ і R є доменами розпізнавання сигналів на N-кінці коліцину Іа. Утворення каналу, а структура домену здатна утворювати іонні канали, розміщене при С-кінці коліцину Іа. AM означає міметичне антитіло. Фіг.4 демонструє результат експерименту інгібувальної здатності нового антибіотика РМСАМ1 щодо Diplococcus intracellularis. На кривій, зліва на право, показаний контроль, 5 мкг/мл ампіциліну, 5 мкг/мл РМС-АМ2, 5 мкг/мл РМС-АМ1, 10 мкг/мл РМС-АМ1. Горизонтальна ордината показує час росту бактерій, виміряний в годинах, вертикальна ордината показує оптичну густину бактеріального середовища при 600 нм, кількісно демонструючи ріст бактерій. Фіг. 5 показує значення мінімальної інгібуючої концентрації (МІК) нового антибіотика, протестовану методом розведення в агарі. В чашках продемонстрована МІК ліків до мультирезистентної Pseudomonas aeruginosa: Con - це холостий контроль, (А) МІК цефтазидиму становив 16 мкг/мл, (В) МІК левофлоксацину становив 8 мкг/мл, (С) МІК гентаміцину становив більше ніж 512 мкг/мл, (D) МІК РМС-АМ1 становив 8 мкг/мл. Фіг.6 демонструє порівняльний експеримент стосовно мінімальної інгібуючої концентрації нового антибіотика згідно з даним винаходом та загально застосовуваних антибіотиків щодо метицилін-резистентного Staphylococcus aureus (АТСС ВАА-42), ванкоміцин-резистентного Enterococcus faecalis (АТСС 700802), мультирезистентної Pseudomonas aeruginosa (виділеної в 3 UA 102325 C2 5 10 15 20 25 30 35 40 45 50 55 60 Госпіталі Західного Китаю, № 13578) та Nesseria meningitidis (№ 29332 бактерії в Центрі збереження Китаю). На цій фігурі горизонтальна ордината показує мінімальну інгібуючу концентрацію (наномоль); А демонструє результат для Nesseria meningitides (1) РМС-АМ1, МІК = 0,11 наномоль, (2) цефтазидим, МІК = 3,02 наномоль, (3) ампіцилін, МІК = 1,35 наномоль; В демонструє результат для ванкоміцин-резистентного Enterococcus faecalis (1) PMC-AM1, МІК = 0,23 наномоль, (2) ванкоміцин, МІК = 21,54 наномоль, (3) ампіцилін, МІК = 10,78 наномоль; С демонструє результат для метицилін-резистентного Staphylococcus aureus: (1) PMC-AM1, МІК = 0,06 наномоль, (2) ампіцилін, МІК = 21,55 наномоль, (3) оксацилін, МІК =14,1 наномоль; D демонструє результат для мультирезистентної Pseudomonas aeruginosa: (1) PMC-AM1, МІК=0,91 наномоль, (2) левофлоксацин, МІК=43,2 наномоль, (3) цефтазидим, МІК=29,3 наномоль, (4) гентаміцин, МІК>889,4 наномоль. Фіг. 7 демонструє криву виживаності, порівнюючи інгібуючу ефективність нового антибіотика, коліцину дикого типу та анти-Staphylococcal aureus поліпептиду, описанного в патенті Китаю ZL 01128836.1, для метицилін-резистентного Staphylococcus aureus (АТСС ВАА-42), ванкоміцинрезистентного Enterococcus faecalis (АТСС 700802), та мультирезистентої Pseudomonas aeruginosa (виділеної в Госпіталі Західного Китаю, № 13578). На цій фігурі горизонтальна ордината показує мінімальну інгібіторну концентрацію (наномоль). А демонструє результат для ванкоміцин-резистентного Enterococcus faecalis: (1) антиStaphylococcus aureus поліпептид, МІК = 0,91 наномоль, (2) коліцин дикого типу Іа, МІК =0,91 наномоль, (3) РМС-АМ1, МІК = 0,23 наномоль; В демонструє результат для метицилін-резистентного Staphylococcus aureus: (1) антиStaphylococcus aureus поліпептид, МІК = 0,06 наномоль, (2) коліцин дикого типу Іа, МІК =0,23 наномоль, (3) РМС-АМ1, МІК = 0,06 наномоль. С демонструє результат для множинної лікарської резистентності Pseudomonas aeruginosa: (1) анти-Staphylococcus aureus поліпептид, МІК = 0.91 наномоль, (2) коліцин дикого типу Іа, МІК =0.91 наномоль, (3) РМС-АМ1,МІК=0.23 наномоль. Фіг. 8 демонструє криву виживаності, одержану в результаті in vivo експерименту щодо захисту тварин, інфікованих Nesseria meningitides, новим антибіотиком. На цій Фігурі горизонтальна ордината показує час виживання мишей, виміряний в днях; а горизонтальна ордината показує кількість тварин, що вижили. 1) РМС-АМ1; 2) Gen означає гентаміцин; 3) PEN означає пеніцилін; 4) Соn. означає холостий контроль. Ін'єкційна концентрація усіх тестових ліків становить 1,5 мкг/кг (вага ліків/вага миші). ПРИКЛАДИ ЗДІЙСНЕННЯ ВИНАХОДУ Винахід далі проілюстрований наступними прикладами, так само як і фігурами. Приклад 1: Конструювання плазмід, що експресують новий антибіотик, та приготування нового антибіотика Оригінальною плазмідою була плазміда pSELECT™-1 (8,3 т.п.н.) з генами коліцину Іа та імунного протеїну. За допомогою технології "Double Strands Oligo nucleotide Point Mutation" (набір QuickChange™, Strategene corporation) гени, що кодують міметичне антитіло, представлене SEQ ID: 1 або 3, були вставлені в амінокислотне положення 626 гену коліцину Іа. Були сконструйовані дві рекомбінантні плазміди, названі в даному описі рВНС-РоrА1 та рВНСРоrА2, показані на Фіг. 1 та Фіг. 2, які були застосовані для приготування нових антибіотиків. Відповідним чином рекомбінантні плазміди були трансфіковані в інженерну бактерію Е.соlі BL21 для експресування нових антибіотиків. Мутаційна процедура була проведена згідно з інструкцією до набору "Strategene Quick Change Site Directed Mutagenesis Kit" (каталог#200518). 1. Реагент для точкової мутації був приготований наступним чином: 5мкл 10Х буферу 2 мкл (10 нанограм) оригінальної плазміди pSELECT™-1 з генами коліцину Іа та імунного протеїну. 1,25 мкл (125 нанограм) штучного 5'-3' олігонуклеотидного праймера (названий нижче олігонуклеотидний праймер) 1,25 мкл (125 нанограм) штучного 3'-5' олігонуклеотидного праймера (названий нижче олігонуклеотидний праймер) 1 мкл dNTP 50 мкл деіонізованої води 1 мкл Рfu 4 UA 102325 C2 5 10 15 20 25 30 35 40 45 50 55 60 (Усі вказані вище ліки були реагентами з медичного набору, за виключенням плазміди, праймера та деіонізованої води). 2. ПЦР-ампліфікація відбувалась за таких ампліфікаційних умов: денатурація при 95 °C протягом 35 секунд, відпал при 53 °C протягом 70 секунд, елонгація при 68 °C протягом 17 хвилин, усього 20 циклів. 3. 1 мкл ендонуклеази Dpn1 був інкорпорований для розщеплення материнського ланцюга ДНК (37 °C, 1 год.); 1 мкл розщепленого продукту поміщали на лід та інкубували з 50 мкл компетентних клітин XL1-Blue протягом 30 хвилин, тепловий шок здійснювали при 42 °C протягом 45 секунд, після цього поміщали в лід на 2 хвилини; 4. додавали 0,5 мл культурального середовища NZY, бактеріальний розчин (реагент кроку 3, тобто, трансформовані клітини з компетентних клітин) зтрушували при 220 об./хв. Та 37 °C протягом 1 години; потім відбирали 50-100 мкл реагента на планку на чашці з реагентом (культуральне середовище LB з 1 % агару та 50 мкг/мл ампіциліну, при 37 °C на всю ніч); 5. Бактерії вилучали через 18 годин культивування, відділяли плазміду та секвенували її для того, щоб вияснити, чи успішною була мутація; 6. 100 нанограм мутованої плазміди поміщали на лід та інкубували з 40 мкл компетентних клітин BL-21 протягом 5 хвилин, тепловий шок здійснювали при 42 °C протягом 30 секунд, а потім ще на 2 хвилини поміщали на лід. Додавали 160 мкл культурального середовища SOC; бактерії зтрушували при 220 об./хв., 37 °C протягом 1 години і поміщали на планку на культуральній чашці (культуральне середовище LB з 1 % агару, 50 мкг/мл ампіциліну, при 37 °C культивували протягом ночі); моноклонні колонії відбирали для більш масштабного репродукування; 7. Бактерії репродукували в культуральному середовищі 8-10L FB при 250 об./хв., 30 °C протягом 3-4 годин, нагрівали до 42 °C при 250 об./хв. протягом 0,5 годин, потім охолоджували до 37 °C при 250 об./хв. протягом 1,5годин. Слойовище центрифугували при 4 °C, 6000 об. протягом 20 хвилин, а потім суспендували в 80-100 мл 50 ммоль буферної рідини борної кислоти (рН 9,0, з ммоль ЕДТК) при 4 °C. Після додавання до 50 мкг PMSF слойовище піддавали дії ультразвуку при 4 °C, 400 Вт протягом 1 хв. та повторювали 4-5 рази з 2-3 хвилинним інтервалом для підтримання температури бактеріального розчину. Роздроблене слойовище центрифугували при 4 °C, 75000 об. протягом 90 хвилин. До супернатанту додавали 5000000 одиниць стрептоміцину сульфату для осадження ДНК (збовтуючи при 4 °C протягом 1 години). Після центрифугування при 10000 об., 4 °C протягом 10 хвилин супернатант поміщали в матерчатий фільтр з молекулярною вагою 15000 та діалізували проти 10 л 50 ммоль буферної рідини борної кислоти протягом ночі при 4 °C; потім центрифугували при 10000 об., 4 °C протягом 10 хвилин. Супернатант поміщали в іоннообмінну колонку CM. Потім іоннообмінну колонку CM ретельно промивали і вимивали новий антибіотик за допомогою 0,3 Μ NaCl+50 ммоль буферної рідини борної кислоти. Відповідно до зазначених вище двох видів рекомбінантних плазмід нові антибіотики були названі РМС-АМ1 та РМС-АМ2, амінокислотні послідовності яких представлені SEQ ID: 6 і SEQ ID: 8, відповідно. AMI є пептидним ланцюгом, що містить пептиди першого гіперваріабельного домену у варіабельній ділянці важкого ланцюга, пептид другої ділянки рамки важкого ланцюга та пептид третього гіперваріабельного домену у варіабельній ділянці легкого ланцюга. Його амінокислотна послідовність представлена SEQ ID: 2. АМ2 є пептидним ланцюгом, що містить пептиди першого гіперваріабельного домену у варіабельній ділянці важкого ланцюга, пептид другої ділянки рамки важкого ланцюга та пептид інвертованого третього гіперваріабельного домену у варіабельній ділянці легкого ланцюга. Його амінокислотна послідовність представлена SEQ ID: 4. РМС-АМ2 був сконструйований як контроль РМС-АМ1 для тестування активності нових антибіотиків згідно з даним винаходом, коли домени, що містять міметичне антитіло, приєднані в різній послідовності. Штучні олігонуклеотидні послідовності для приготування зазначених вище двох мутаційних плазмід відповідно є наступними: 5'-3' (SEQ ID: 9) gcg aat aag ttc tgg ggt att TCTTATTGG CTG CATTGGATTAAA CAG taa ata aaa tat aag аса ggc 3'-5' (SEQ ID: 10) gcc tgt ctt ata ttt tat tta CTG TTTAATCCA ATG CAG CCA ATA AGA aat ace cca gaa ctt att cgc 5'-3' (SEQ ID: 11) tgg ctg cat tgg att aaa cag AGA CCTGGTCAG GGA CTG TGG АТС GGA taa ata aaa tat aag аса ggc 3'-5' (SEQ ID: 12) 5 UA 102325 C2 5 10 15 20 25 30 35 40 45 50 55 60 gcc tgt ctt ata ttt tat tta TCC GAT CCA CAG TCC CTGACCAGG TCT ctg ttt aat cca atg cag cca 5'-3' (SEQ ID: 13) ggt cag gga ctg tgg atc gga TCT CAG TCCACG CATGTG CCGAGA ACC taa ata aaa tat aag аса ggc 3'-5' (SEQ ID: 14) gcc tgt ctt ata ttt tat tta GGTTCTCGG CACATG CGTGGA CTG AGA tec gat cca cag tcc ctg acc pBHC-PorA2 5'-3 '(SEQ ID: 15) gcg aat aag ttc tgg ggt att TCTTATTGG CTG CATTGGATTAAA CAG taa ata aaa tat aag аса ggc 3'-5' (SEQ ID: 16) gcc tgt ctt ata ttt tat tta CTG TTTAAT CCA ATG CAG CCA ATA AGA aat acc cca gaa ctt att cgc 5'-3 '(SEQ ID: 17) tgg ctg cat tgg att aaa cag AGA CCTGGTCAG GGA CTG TGGATC GGA taa ata aaa tat aag аса ggc 3'-5' (SEQ ID: 18) gcc tgt ctt ata ttt tat tta TCC GAT CCA CAG TCC CTGACCAGG TCT ctg ttt aat cca atg cag cca 5'-3' (SEQ ID: 19) ggt cag gga ctg tgg atc gga ACCAGA CCG GTG CATACG TCC CAG TCT taa ata aaa tat aag аса ggc 3'-5 '(SEQ ID: 20) gcc tgt ctt ata ttt tat tta AGA CTG GGA CGTATG CAC CGG TCT GGT tcc gat cca cag tcc ctg acc. Приклад 2: Інгібуюча дія нового антибіотика щодо Nesseria meningitidis. Бактерією був штам № 29332 Nesseria meningitidis Центру зберігання бактерій в Китаї, два 5 мікролітра (мкл) бактеріального розчину (10 колонієутворюючих одиниць (КУО)/мл) додавали до 10 мл кролячого кров'яно-шоколадного середовища (містить 50 мг м'ясного екстракту, 100 мг триптону, 50 мг NaCl, 30 мг К2НРО4 та 0,5-0,8 мл волокон кролячої крові). Було приготовано п'ять груп. Першу групу як контроль додавали до 0,3 Μ NaCl+50 ммоль буферної рідини борної кислоти (тобто, холоста консервуюча рідина для нового антибіотика, в тому самому об'ємі, що й розчин нового антибіотика в експериментальних групах). До другої групи додавали натрієву сіль пеніциліну в кількості 5 мкг/мл. Новий антибіотик РМС-АМ1 в кількості 5 мкг/мл додавали до третьої групи. До четвертої групи додавали 5 мкг/мл нового антибіотика РМС-АМ2. До п'ятої групи додавали 10 мкг/мл нового антибіотика. Реакційне середовище вказаних вище п'яти груп поміщали в конічні колби об'ємом 100 мл та культивували при 37 °C та 200 об./хв. В годину відбирали по 100 мкл культурального середовища та поміщали в 96-поровий планшет для ELISA для вимірювання бактеріальної опалесценції методом спектрометричного порівняння забарвлення (А595 нм). Була побудована крива бактеріального росту, щоб порівняти бактеріостатичну ефективність нових антибіотиків. Як показано на Фіг.4, результат продемонстрував, що Nesseria meningitidis стримувалась лише РМС-АМ1. Приклад 3. Порівняльний експеримент мінімальної інгібуючої концентрації нового антибіотика та нормальних антибіотиків для мультирезистентної Pseudomonas aeruginosa. Тестування мінімальної інгібуючої концентрації (МІК) нового антибіотика методом розведень в агарі. Бактерії інокулювали на поверхні агарової пластинки, що містить різні концентрації ліків, за допомогою багатоточкового інокуляційного інструменту (Deneley A400). Концентрація бактерій 5 на точку становила 10 КУО/мл. Результат спостерігався після інкубування при 37 °C протягом 18-24 годин. Найменша концентрація ліків на середовищі без росту бактерій була мінімальною інгібуючою концентрацією (МІК) ліків для вказаної бактерії. Експериментальним штамом був клінічно ізольований штам Pseudomonas aeruginosa (виділений в Клініці Західного Китаю, № 13578) із застосуванням середовища МН (на 100 мл містить 500 мг м'ясного екстракту, 1,75 г казеїнового кислого гідролізату, 150 мг розчинного крохмалю та 1,7 г агару). В результаті, як показано на Фіг.5, МІК нового антибіотика (D) PMC-AM1 для мультирезистентної Pseudomonas aeruginosa становила 8 мкг/мл, МІК цефтазидиму (А) становила 16 мкг/мл, левофлоксацину (В) становила 8 мкг/мл, та гентаміцину (С) була більшою ніж 512 мкг/мл. Стосовно стандарту молекулярної ваги, МІК РМС-АМ1 для мультирезистентної Pseudomonas aeruginosa становила 0,23 наномоль, МПС цефтазидиму (А) становила 29,3 наномоль, левофлоксацину становила 43,2 наномоль та гентаміцину (С) була більшою ніж 890 наномоль, тобто, антибактеріальний ефект РМС-АМ1 щодо мультирезистентної Pseudomonas aeruginosa був у 127-3800 разів сильнішим ніж у цефтазидиму, левофлоксацину та гентаміцину. 6 UA 102325 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклад 4. Порівняльний in vitro експеримент антибактеріальної активності нового антибіотика згідно з даним винаходом та нормальних антибіотиків. Тестування мінімальної інгібуючої концентрації (МІК) нового антибіотика методом розведень в агарі. Бактерії інокулювали на поверхні агарової пластинки, що містить різні концентрації ліків, за допомогою багатоточкового інокуляційного інструменту (Deneley A400). Концентрація бактерій 5 на точку становила 10 КУО/мл. Результат спостерігався після інкубування при 37 °C протягом 18-24 годин. Найменша концентрація ліків на середовищі без росту бактерій була мінімальною інгібуючою концентрацією (МІК) ліків для вказаної бактерії. Експериментальним штамом був клінічно ізольований штам Pseudomonas aeruginosa (виділений в Клініці Західного Китаю, № 13578) із застосуванням середовища МН (на 100 мл містить 500 мг м'ясного екстракту, 1,75 г казеїнового кислого гідролізату, 150 мг розчинного крохмалю та 1,7 г агару), метицилін-резистентний штам Staphylococcus aureus (АТСС ВАА-42) із застосуванням середовища ВМ (на 100 містить 1 г триптону, 0, 5 г дріжджового порошку, 0,1 г глюкози, 100 мг КН2РО4, 1 г NaCl та 1 г агару), ванкоміцин-резистентний штам Enterococcus faecalis (АТСС 700802) із застосуванням середовища МН; Nesseria meningitidis (№ 29332 Центру зберігання бактерій в Китаї) із застосування того самого середовища, що й в Прикладі 2 (з додаванням 3,9 г колумбійського основного кров'яного агару). Результат показаний на Фіг.6, А демонструє результат для Nesseria meningitidis: (1) PMCAMI, MIK=0,11 наномоль, (2) цефтазидим, МІК=3,02 наномоль, (3) ампіцилін, МІК =1,35 наномоль. В демонструє результат для ванкоміцин-резистентного штаму Enterococcus faecalis: (1) РМС-АМ1, МІК=0,23 наномоль, (2) ванкоміцин, МІК=21,54 наномоль, (3) ампіцилін, МІК= 10,78 наномоль. С демонструє результат для метицилін-резистентного штаму Staphylococcus aureus: (1) PMC-AMI, MIK=0,06 наномоль, (2) ампіцилін МІК=21,55 наномоль, (3) оксацилін, МІК =14,1 наномоль. D демонструє результат для мультирезистентного штаму Pseudomonas aeruginosa: (1) PMC-AMI, МІК=0,91 наномоль, (2) левофлоксацин, МІК=43,2 наномоль, цефтазидим, МІК=29,3 (4) гентаміцин, МІК>889,4 наномоль. Приклад 5. Порівняльний in vitro експеримент антибактеріальної активності нового антибіотика згідно з даним винаходом, анти-Staphylococcal aureus поліпептиду та коліцину Іа дикого типу. Тестування мінімальної інгібуючої концентрації (МІК) нового антибіотика методом розведень в агарі. Найменша концентрація ліків на середовищі без росту бактерій була мінімальною інгібуючою концентрацією (МІК) ліків для вказаної бактерії. Експериментальними штамами були мультирезистентний штам Pseudomonas aeruginosa (виділений в Клініці Західного Китаю, № 13578), метицилін-резистентний штам Staphylococcus aureus (АТСС ВАА-42), ванкоміцин-резистентний штам Enterococcus faecalis (ATCC 700802) із застосуванням середовища МН; штам Nesseria meningitidis (№ 29332 Центру зберігання бактерій в Китаї). Результат показаний на Фіг. 7, А демонструє результат для ванкоміцин-резистентного штаму Enterococcus faecalis: (1) анти-Staphylococcal aureus поліпептид, МІК = 0,91 наномоль, (2) коліцин Іа дикого типу, МІК =0,91 наномоль, (3) РМС-АМ1, МІК = 0,23 наномоль. В демонструє результат для метицилін-резистентного штаму Staphylococcus aureus: (1) amn-Staphylococcal aureus поліпептид, МІК = 0,06 наномоль, (2) коліцин Іа дикого типу, МІК=0,23 наномоль, (3) РМСАМ1, МІК=0,06 наномоль. С демонструє результат для мультирезистентного штаму Pseudomonas aeruginosa: (1) анти-Staphylococcal aureus поліпептид, МІК = 0,91 наномоль, (2) коліцин Іа дикого типу, МІК = 0,91 наномоль, (3) РМС-АМ1, МІК = 0,23 наномоль Приклад 6. In vivo захисні експерименти нових антибіотиків щодо тварин, інфікованих Nessera meningitidis. Експериментальні матеріали. Ліки: РМС-АМ1, гентаміцин, ампіцилін. Експериментальна бактерія Штам Nesseria meningitides (№ 29332 Центру зберігання бактерій в Китаї, тобто, Центру медичних пристроїв Національного інституту контролю фармацевтичних та біологічних продуктів, SDA). Експериментальні методи Як показано на Фіг. 7, 40 мишей розподілили в чотири експериментальні групи, по 10 мишей в кожній групі. Мишам внутрішньоочеревинно вводили глюкозний розчин заліза по 20 мг/кг, через одну годину внутрішньоочеревинно вводили 0,5 мл бактеріальної культури, що містить 1 9 частину розчину Nesseria meningitidis (його КУО становила 2,36 10 /мл) та 1,5 частини 5 % розчину сухих дріжджів. Через одну годину, після того, як була внутрішньоочеревинно введена смертельна доза бактеріальної культури, мишам в експериментальній групі внутрішньовенно 7 UA 102325 C2 5 10 вводили ліки, а мишам в контрольній групі внутрішньовенно вводили нормальний фізіологічний розчин (усі ліки вводили в дозі 1,5 мг/кг), як позитивні результати спостерігали загибель мишей кожні 2 годин протягом 8 днів. На Фіг.7, 1. РМС-АМ1 означає новий антибіотик, одержаний згідно з даним винаходом; 2. Gen означає гентаміцин; 3. PEN означає пеніцилін; 4. Соn. Означає контроль. Результати. Як демонструє крива виживаності на Фіг. 7, після того як мишам внутрішньоочеревинно було введено смертельну дозу розчину Neisseria meningitides, 1). Усі миші в контрольній групі загинули через два дні. 2). Усі миші в пеніциліновій групі загинули через два дні. 3). Миші в гентаміциновій групі мали 50 % рівень виживаності через 8 днів. 4). Миші в РМС-АМ1 групі мали 90 % рівень виживаності через 8 днів. Результати підтверджують, що новий антибіотик РМС-АМ1 згідно з даним винаходом демонструє вищу in vivo захисну активність щодо мишей, інфікованих смертельною дозою Nesseria meningitides, ніж загальнозастосовувані антибіотики. 15 8 UA 102325 C2 9 UA 102325 C2 10 UA 102325 C2 11 UA 102325 C2 12 UA 102325 C2 13 UA 102325 C2 14 UA 102325 C2 15 UA 102325 C2 16 UA 102325 C2 17 UA 102325 C2 18 UA 102325 C2 ФОРМУЛА ВИНАХОДУ 5 10 15 20 25 30 35 1. Новий антибіотик, що містить міметичне антитіло та коліцин або містить міметичне антитіло і каналоформуючий домен коліцину, де міметичне антитіло ковалентно приєднане до карбоксильного кінця поліпептиду коліцину або каналоформуючого домену коліцину, де коліцин вибирають з групи, яка складається з коліцину E1, Ia, Ib, А, В, N; де вказане міметичне антитіло отримане шляхом злиття двох гіперваріабельних ділянок (CDRs) VHCDR1 та VLCDR3 через когнантну каркасну ділянку (VHFR2) імуноглобуліну; де імуноглобулін специфічно розпізнає поріни бактерій. 2. Новий антибіотик за п. 1, де бактерією є Neisseria meningitides, поріном є РоrА в зовнішній мембрані клітин Neisseria meningitidis. 3. Новий антибіотик за п. 2, де імуноглобулін складається з ковалентно зв'язаного поліпептиду з PUBMED Accession 2MPA_H та поліпептиду з PUBMED Accession 2MPA_L. 4. Новий антибіотик за будь-яким з пп. 1-3, де коліцин являє собою Іа. 5. Пептидна молекула, що містить міметичне антитіло та коліцин або містить міметичне антитіло і каналоформуючий домен коліцину, де міметичне антитіло ковалентно приєднане до карбоксильного кінця поліпептиду коліцину або каналоформуючого домену коліцину, де коліцин вибирають з групи, яка складається з коліцину E1, Ia, Ib, А, В, N; де вказане міметичне антитіло отримане шляхом злиття двох гіперваріабельних ділянок (CDRs) VHCDR1 та VLCDR3 через когнантну каркасну ділянку (VHFR2) імуноглобуліну; де імуноглобулін специфічно розпізнає поріни бактерій. 6. Злита молекула пептиду за п. 5, що відповідає амінокислотній послідовності SEQ ID NO: 6. 7. Молекула нуклеїнової кислоти, що кодує будь-яку із злитих пептидних молекул згідно з п. 5 або п. 6. 8. Молекула нуклеїнової кислоти за п. 7, що відповідає нуклеотидній послідовності SEQ ID NO: 5. 9. Рекомбінантна плазміда, що містить молекулу нуклеїнової кислоти за будь-яким з пп. 7 або 8. 10. Спосіб приготування нового антибіотика за будь-яким з пп. 1-4, де одну з рекомбінантних плазмід за п. 9 трансфікують в експресуючу систему і новий антибіотик відділяють та очищають від експресованого поліпептида. 11. Застосування нового антибіотика за будь-яким з пп. 1-4 для приготування антибактеріального медикаменту. 12. Застосування за п. 11, де антибактеріальний медикамент застосовують для знищення Neisseria meningitidis, ванкоміцинрезистентного Enterococcus faecalis, метицилінрезистентного Staphylococcus aureus або Pseudomonas aeruginosa з множинною лікарською резистентністю. 19 UA 102325 C2 20 UA 102325 C2 21 UA 102325 C2 22 UA 102325 C2 Комп’ютерна верстка Л. Литвиненко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 23
ДивитисяДодаткова інформація
Назва патенту англійськоюAntibiotic comprising a mimetic antibody, process for manufacturing and use thereof
Автори англійськоюQiu, Xiaoqing
Назва патенту російськоюАнтибиотик, который содержит миметическое антитело, способ его приготовления и применения
Автори російськоюКью Ксиаоквинг
МПК / Мітки
МПК: A61P 31/04, C12N 15/62, A61K 47/48, A61K 38/16, C12P 21/02, C12N 15/63, C07K 19/00
Мітки: застосування, містить, антитіло, спосіб, антибіотик, приготування, міметичне
Код посилання
<a href="https://ua.patents.su/25-102325-antibiotik-shho-mistit-mimetichne-antitilo-sposib-jjogo-prigotuvannya-ta-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Антибіотик, що містить міметичне антитіло, спосіб його приготування та застосування</a>
Попередній патент: Вакуум-апарат для кристалізації цукрози з цукровмісних розчинів
Наступний патент: Спосіб отримання люмінофору на основі тербій або тербій-ітрій алюмінієвого гранату, активованого іонами церію
Випадковий патент: Пружна муфта