Пристрій для препаративного електрофорезу в гранульованому середовищі
Номер патенту: 64377
Опубліковано: 16.02.2004
Автори: Мамчур Олександр Єгорович, Дмитрук Оксана Олександрівна, Зарицький Микола Макарович
Формула / Реферат
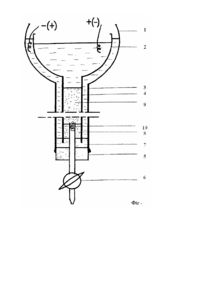
Пристрій для препаративного електрофорезу білків в гранульованому середовищі, який складається із двох скляних посудин з циліндричними відростками, що вкладаються одна на одну, та гумової пробки зі скляним краном, який відрізняється тим, що кран закріплено рухомо з можливістю вертикального переміщення (для регулювання рівня стоку хроматографічної колонки), що забезпечує наявність в системі спеціального простору для внесення тест-зразка в нижній кінець до формування стовпчика гранульованого антиконвекційного середовища.
Текст
Винахід відноситься до біології і сільського господарства. Відомий пристрій, розроблений Поратом (Porath J. In: Methods in Immunology and Immunochemistry (Williams C.A., Chase M.W. eds.), Academic Press, New York, 1968. - Vol.2. - p.62.) Недоліком цього пристрою є сильний електроосмос, який виникає через велику напругу, потрібну для його роботи. Велика напруга необхідна через велику довжину колонки, а та, в свою чергу, потрібна для створення достатніх просторових проміжків між зонами макромолекул. Так як фактори формування зон макромолекул при електрофорезі та адсорбційній хроматографії протинаправлені, зменшити небезпеку змішування зон можна за рахунок спрямування їх міграції в різні напрямки. При звичайній адсорбційній хроматографії зони мігрують в низхідному напрямку під дією сили тяжіння, отже електрофоретичну міграцію слід спрямувати у висхідному напрямку. Для цього досліджений зразок необхідно вносити у нижню частину колонки. Але у прототипі така можливість не передбачена. Другий недолік прототипу - його велика конструктивна та експлуатаційна складність. Пристрій для препаративного електрофорезу білків в гранульованому середовищі, що пропонується, зображений на фіг. Пристрій складається з двох скляних сосудів (1, 2) з циліндричними відростками (3, 4), які вкладаються один в один та закріплюються на хімічному штативі. Сосуди виконують функцію резервуарів для електродних буферних розчинів. Циліндричний відросток зовнішнього сосуда закривається знизу гумовою пробкою (5) зі скляним краном (6), верхній кінець якого вводиться в циліндричний відросток внутрішнього сосуда за його віссю на висоті 3 см. Зовнішній сосуд відділений від внутрішнього пробкою з 10% поліакриламідного гелю (ПААГ) (7), яка виключає можливість контакту між анодним та катодним буферними розчинами, але не порушує електропровідність системи. Одночасно пробка ПААГ править за механічний елемент, який забезпечує достатню жорсткість всієї системи. Циліндричний відросток внутрішнього сосуду являє собою робочий об'єм, в якому формується хроматографічна колонка (9) та відбувається під дією постійного електричного струму розподілення макромолекул на зони за електрофоретичною рухливістю. Як антиконвекційне середовище в пристрої використовується сефадекс. Верхній кінець крану закритий синтетичною ватою (10), щоб запобігти просипанню сефадексу крізь кран в процесі формування колонки. Зразок (8) вноситься на пробку ПААГ в простір між краном та циліндричним відростком внутрішнього сосуда безпосередньо перед формуванням хроматографічної колонки (9). Пристрій працює наступним чином: Внутрішній сосуд 2 вкладається в зовнішній 1 і пристрій закріплюється на штативі. Циліндричний відросток зовнішньої ємності закривається гумовою пробкою з краном 5,6. Попередньо в верхній кінець вводиться синтетична вата. Зазор між гумовою пробкою і нижнім кінцем циліндричного відростка внутрішнього сосуда повинен становити 3-5мм. В зовнішній сосуд заливається розчин мономерів для ПААГ на висоту 10-12мм. Після полімеризації і утворення пробки ПААГ на цю пробку ПААГ наслоюється зразок-проба за допомогою шприца з трубкою через циліндричний відросток внутрішнього сосуда. Формування хроматографічної колонки здійснюється звичайним способом. Після стабілізації колонки кран закривається і в сосуди заливають електродні буферні розчини. Рівень рідини в обох сосудах має бути однаковим, щоб система була гідростатично врівноваженою. В буферні розчини занурюються відповідні електроди. Включається джерело живлення і встановлюється потрібний режим електрофорезу. При необхідності, пристрій може бути розташований в холодильнику. Під дією електричного поля макромолекули і лідируючий барвник, що містяться в зразку-пробі, мігрують в колонку у висхідному напрямку, іде формування електрофоретичних зон. По закінченні процесу електрофорезу кран відкривають та елюють колонку як при звичайній хроматографії. При цьому електрофоретичне розподілення зон доповнюється ефектом молекулярного сита, оскільки швидкість міграції макромолекул в низхідному напрямку прямо пропорційна молекулярній масі. Цим досягається поліпшення в розподілі зон. Полярність і, відповідно, рН буферної системи добираються таким чином, щоб міграція зон здійснювалась у висхідному напрямку. При використанні лужної буферної системи у внутрішній сосуд заливається анодний буфер, кислої катодний. Електрофоретична рухомість макромолекул зворотно пропорційна їх молекулярній масі, тому в колонці формуються зони таким чином, що більші молекули залишаються в нижній частині колонки, а дрібніші переміщуються в верхню. При електрофорезі крупніші молекули відділяються від дрібніших и виходять з колонки під час елюювання її в перших фракціях. За рахунок доповнення електрофоретичного розділення зон ефектом молекулярного сита досягається покращення якісних показників препаратів, які отримуємо. Чистота препаратів співвідносна з чистотою аналогічних препаратів, що отримуються значно більш дорогими методами іонообмінної хроматографії. Приклад 1 Виділення антитіл до вірусу із нативної антисироватки. Підготовка зразка-проби. В нативну вірусоспецифічну антисироватку крові кроля додавали 20% сахарози і 1 краплю 1% розчину бромфенолового синього (БФС). В суміш невеликими порціями вносили сефадекс G-15 до повного поглинання рідини. Підготовка проведення електрофорезу. Одержану пастоподібну масу (зразок-проба) шпателем переносили в шприц об'ємом 20мл з приєднаною до нього гнучкою трубкою. Під дією поршня зразок в об'ємі 5мл через трубку вносили на пробку поліакріламідного гелю в простір між краном та циліндричним відростком внутрішньої посудини. Зверху зразка формували колонку сефадексу G-200 висотою 8см. Електрофорез. Електрофорез проводили в лужній системі буферних розчинів при температурі 20°C, напрузі 300В і силі струму 10мА. Після того, як зона БФС досягала верхнього кінця колонки, струм відключали, відкривали кран і елюювали колонку фракціями по 2мл. Фракції аналізували серологічно і ті, що давали позитивну реакцію, об'єднували і аналізували спектрофотометрично. Результати. В результаті одержали 6мл препарату антитіл до XBK з чітким піком при спектрофотометрії при l=280нм і концентрації білку 6мг/мл. Весь процес електрофоретичного очищення займає 4 години. Тоді як для одержання співвідносного за чистотою препарату антитіл традиційним методом потрібно 48 годин. Приклад 2. Виділення уреази із бобів сої. Підготовка зразка-проби. Водяний екстракт соєвої муки центрифугували 1500 g на протязі 20 хвилин. До супернатанту додавали 20% сахарози і 1 краплю 1% розчину БФС. В суміш невеликими порціями вносили сефадекс G-15 до повного поглинання рідини. Підготовка проведення електрофорезу. Одержану пастоподібну масу (зразок-проба) шпателем переносили в шприц об'ємом 20мл з приєднаною до нього гнучкою трубкою. Під дією поршня зразок в об'ємі 5мл через трубку вносили на пробку поліакріламідного гелю в простір між краном та циліндричним відростком внутрішньої посудини. Зверху зразка формували колонку сефадексу G-200 висотою 8см. Електрофорез. Електрофорез проводили в лужній системі буферних розчинів при температурі 20°C, напрузі 300В і силі струму 10мА на протязі 8 годин. Після того відкривали кран і елюювали колонку фракціями по 5 мл, знесолення проводили на колонці з сефадексом G-50 врівноваженій дистильованою водою. В кожну фракцію додавали 2-3 краплі розчину фенолфталеїну. Ті фракції, в яких проявлялось рожеве забарвлення, відбирали, накопичували та концентрували випаровуванням в термостаті при температурі +30°C. Результати. В результаті одержали 7мг очищеного ферменту з активністю 3000 одиниць.
ДивитисяДодаткова інформація
Назва патенту англійськоюAn apparatus for the preparative electrophoresis in the granulated medium
Назва патенту російськоюУстройство для препаративного электрофореза в гранулированной среде
МПК / Мітки
Мітки: пристрій, препаративного, середовищі, електрофорезу, гранульованому
Код посилання
<a href="https://ua.patents.su/3-64377-pristrijj-dlya-preparativnogo-elektroforezu-v-granulovanomu-seredovishhi.html" target="_blank" rel="follow" title="База патентів України">Пристрій для препаративного електрофорезу в гранульованому середовищі</a>
Попередній патент: Спосіб купірування стану скасування алкоголю
Наступний патент: Спосіб прогнозування ефективності лікування еректильної дисфункції
Випадковий патент: Моноколійний вітроагрегат