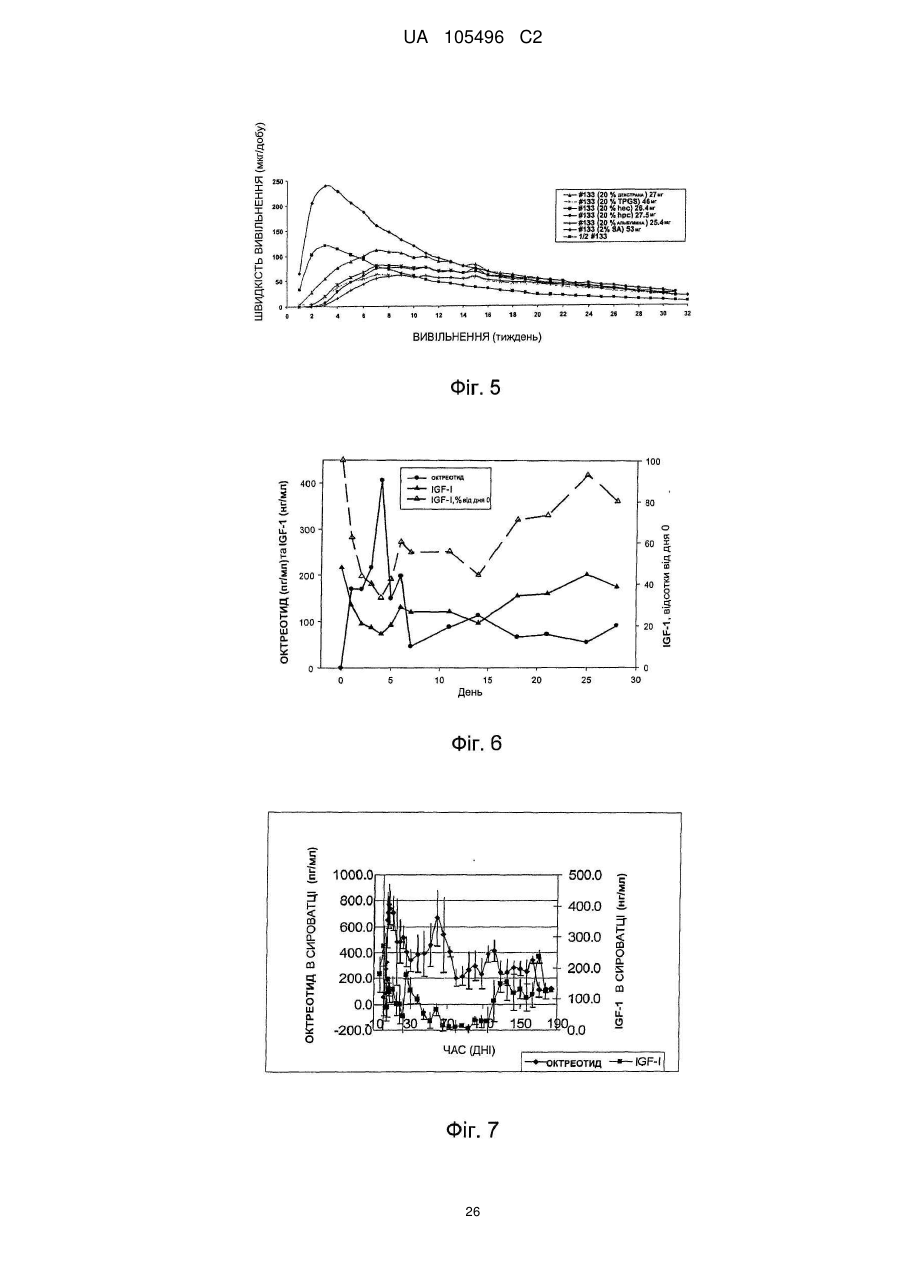
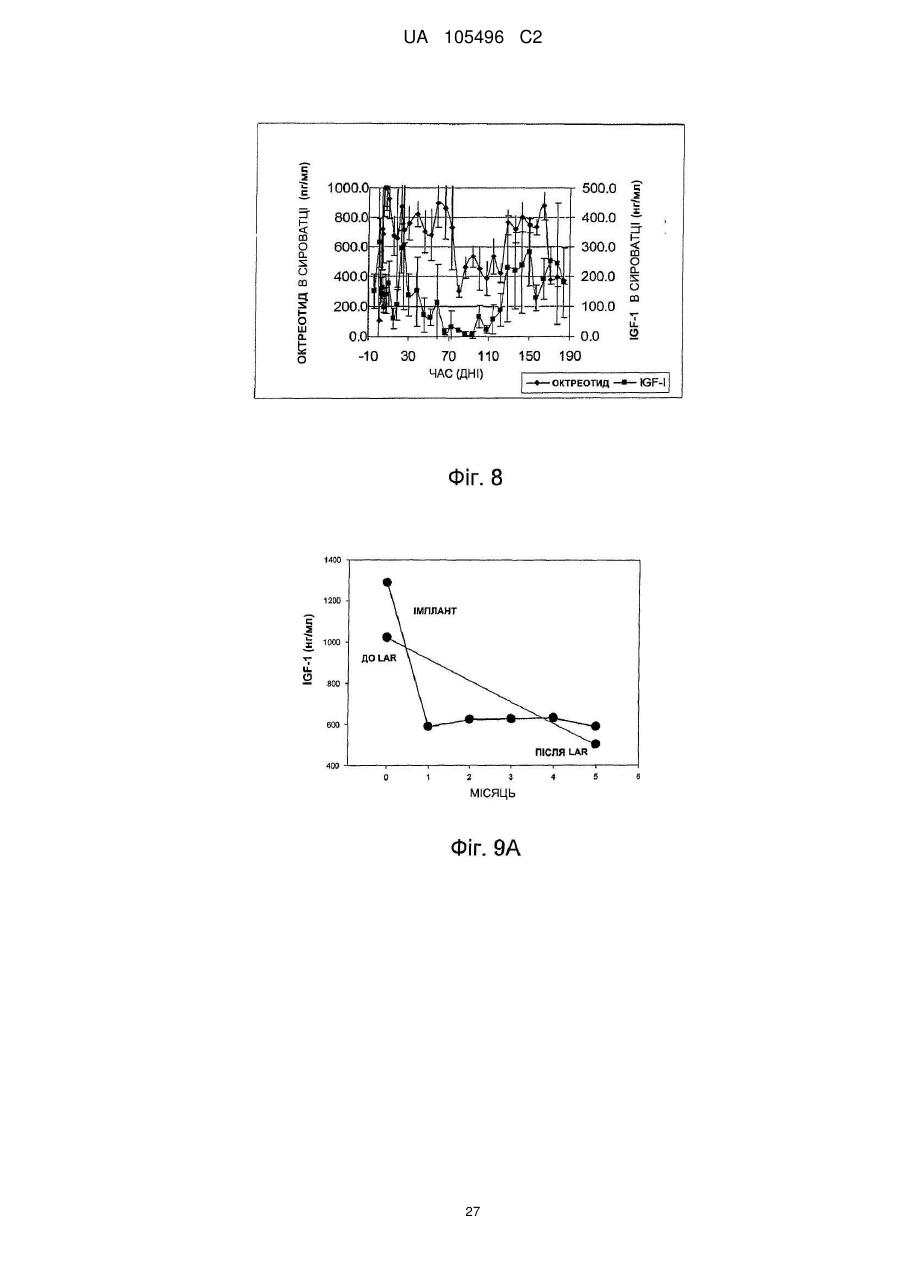
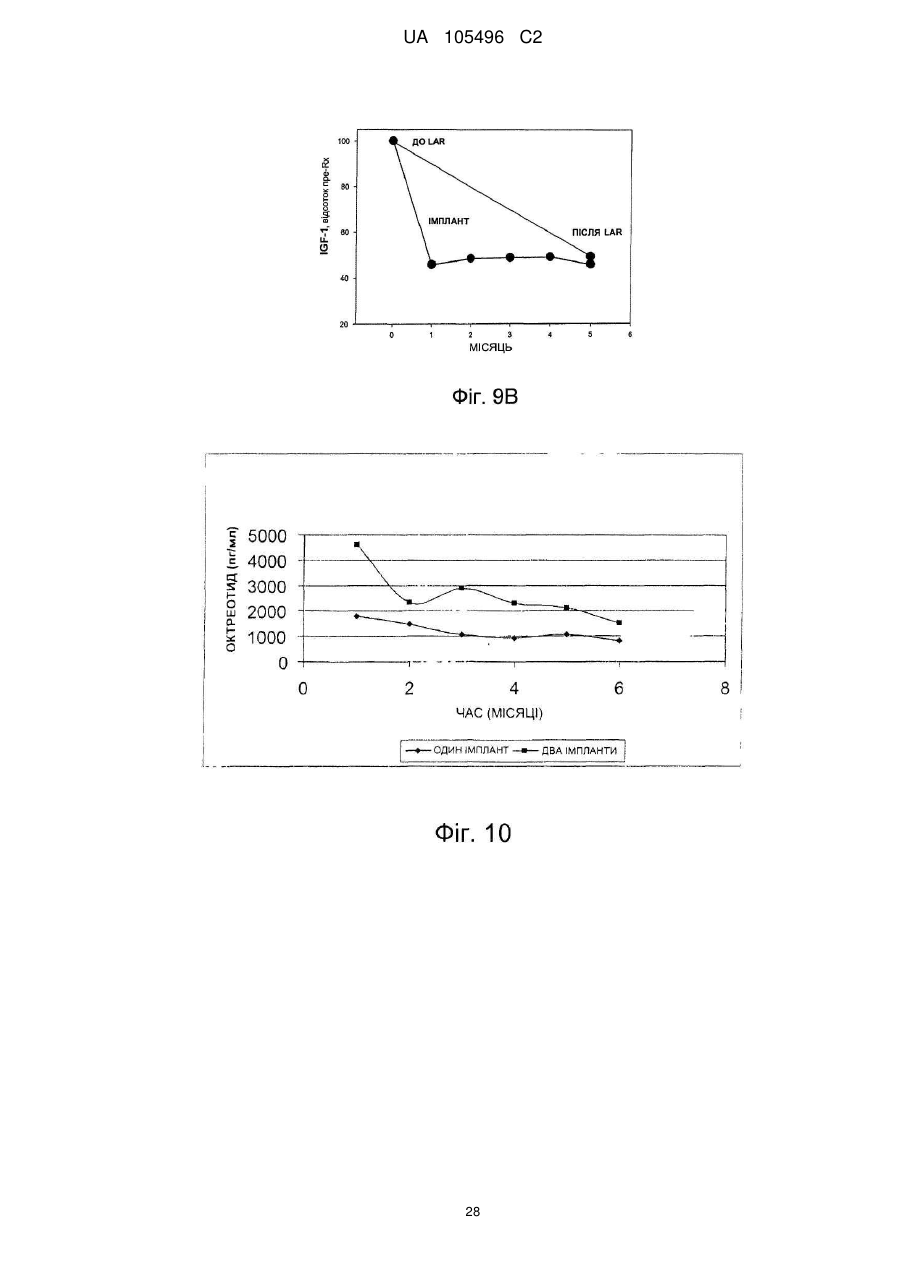
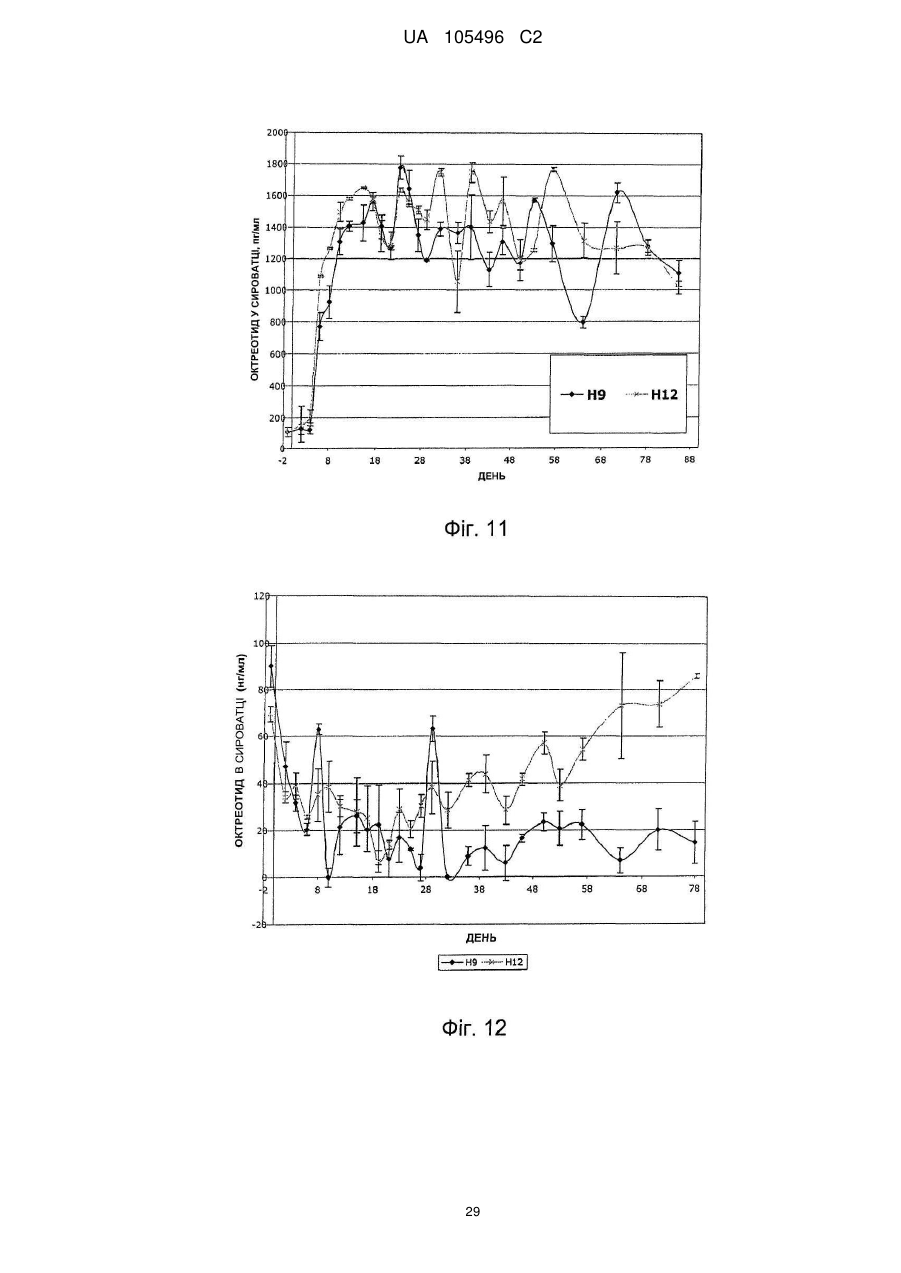
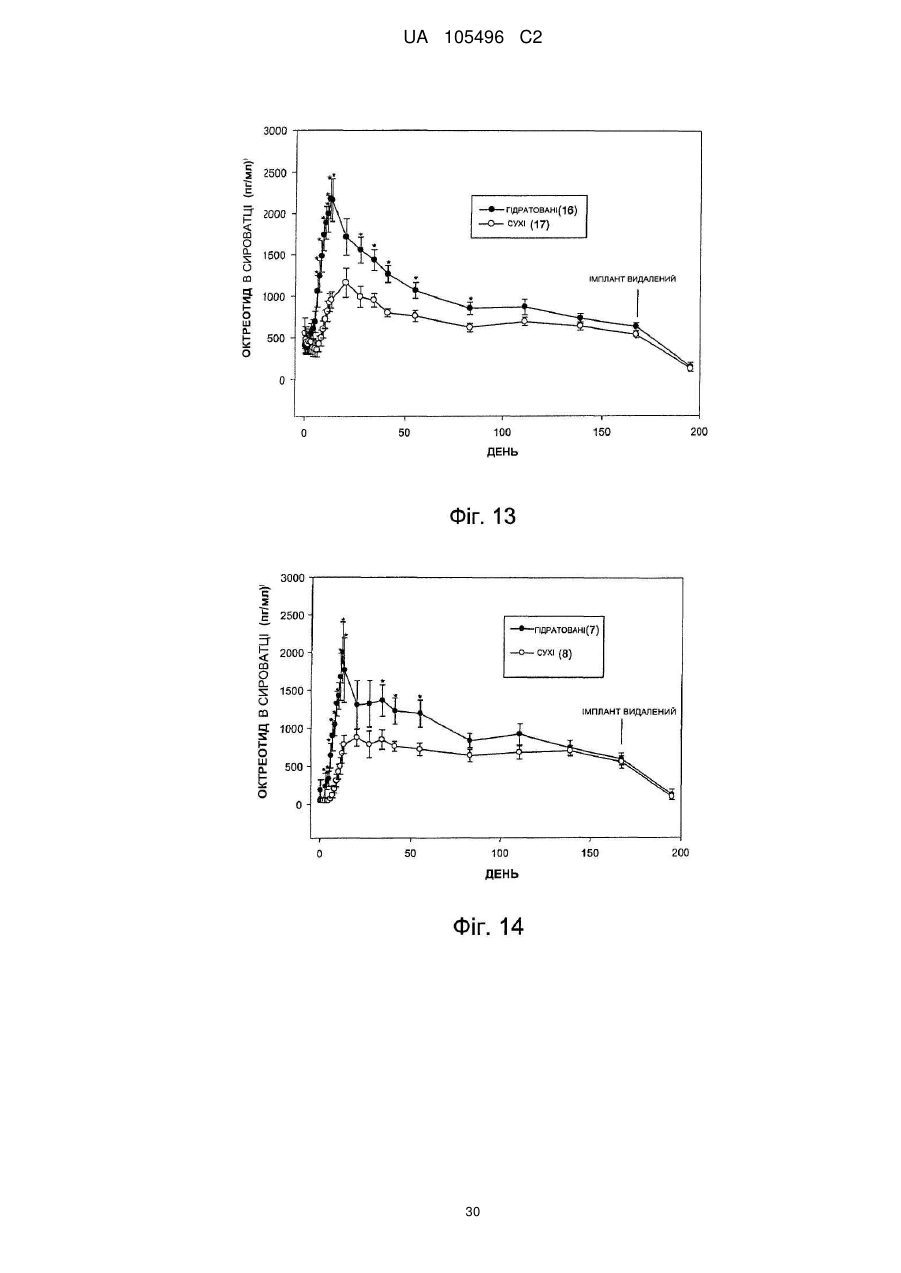
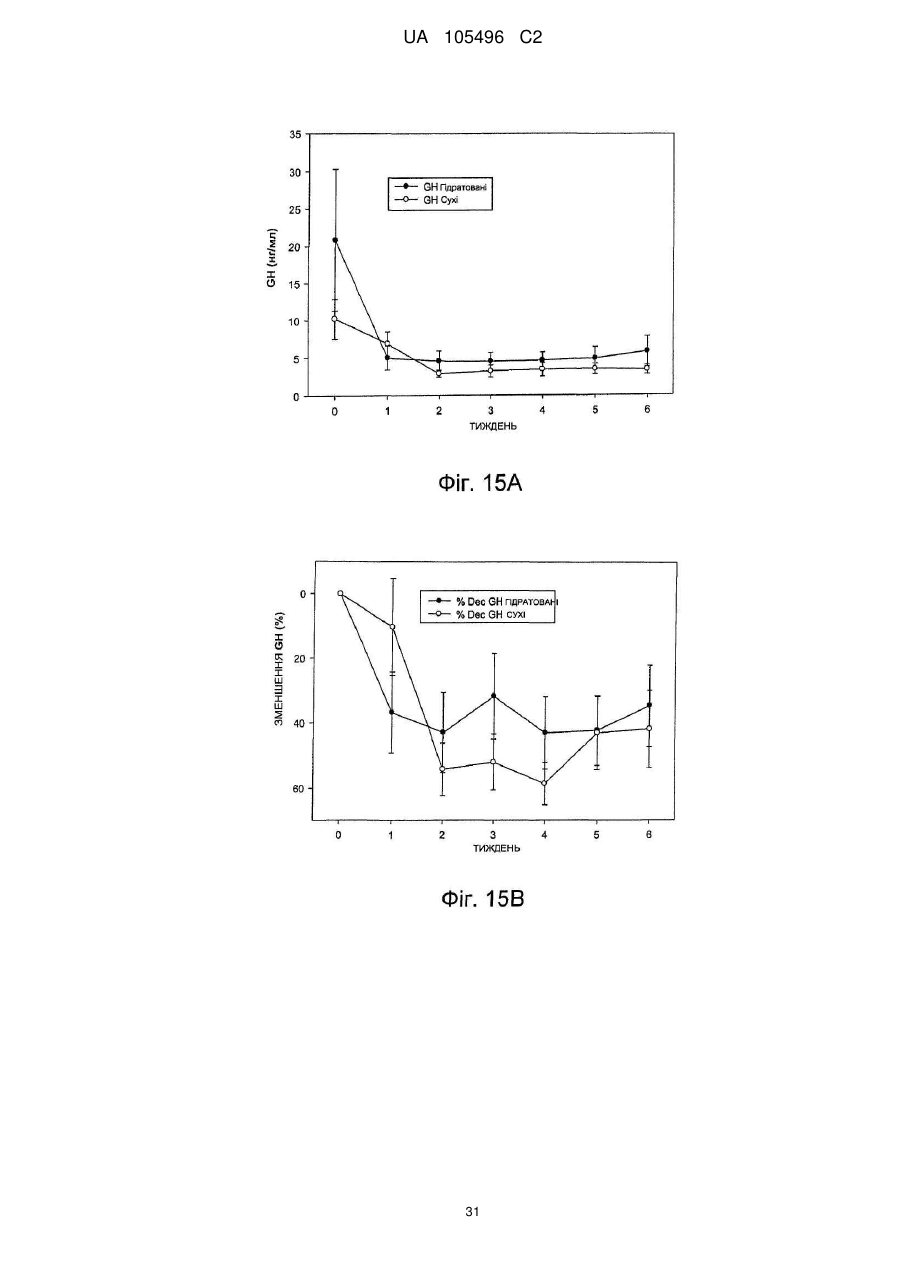
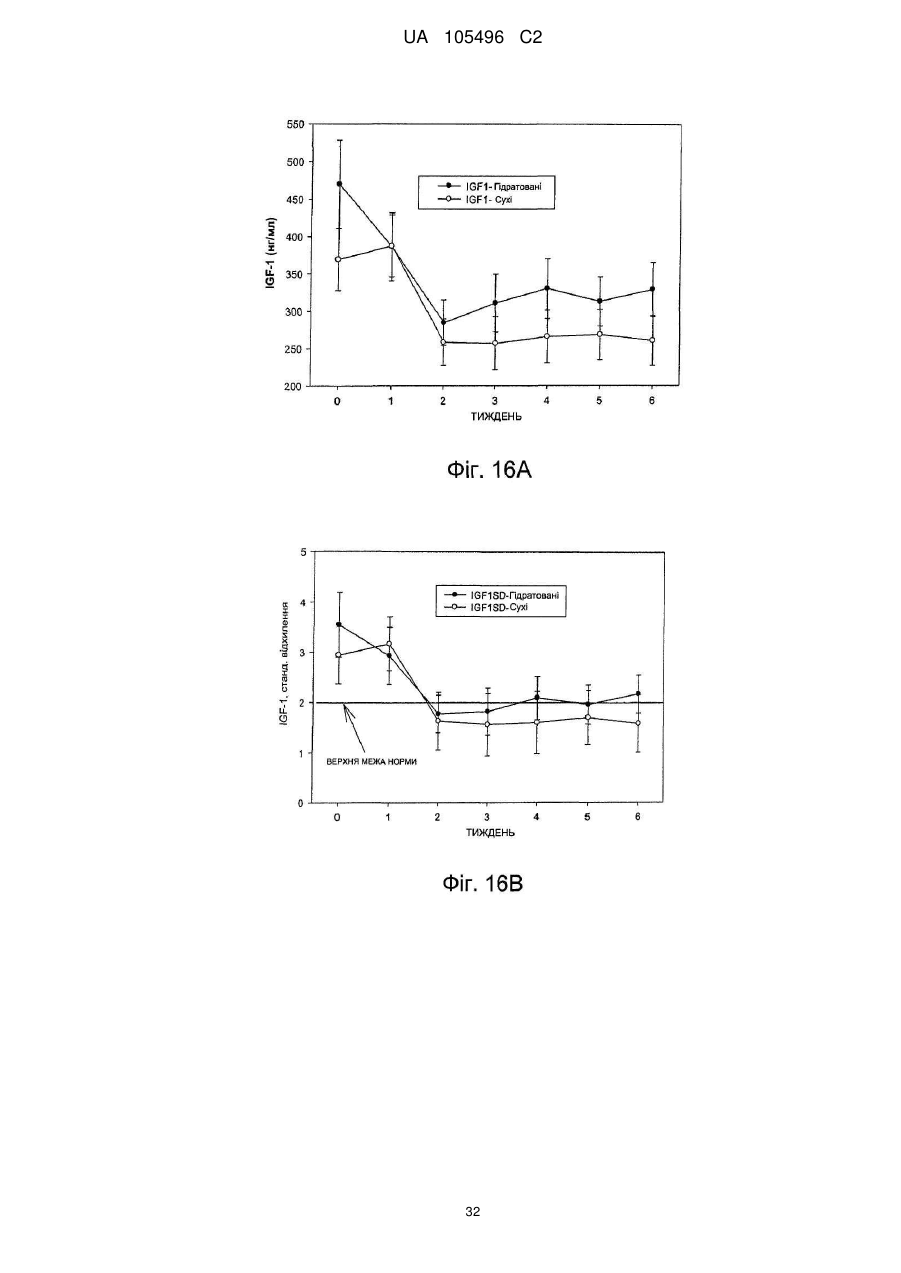
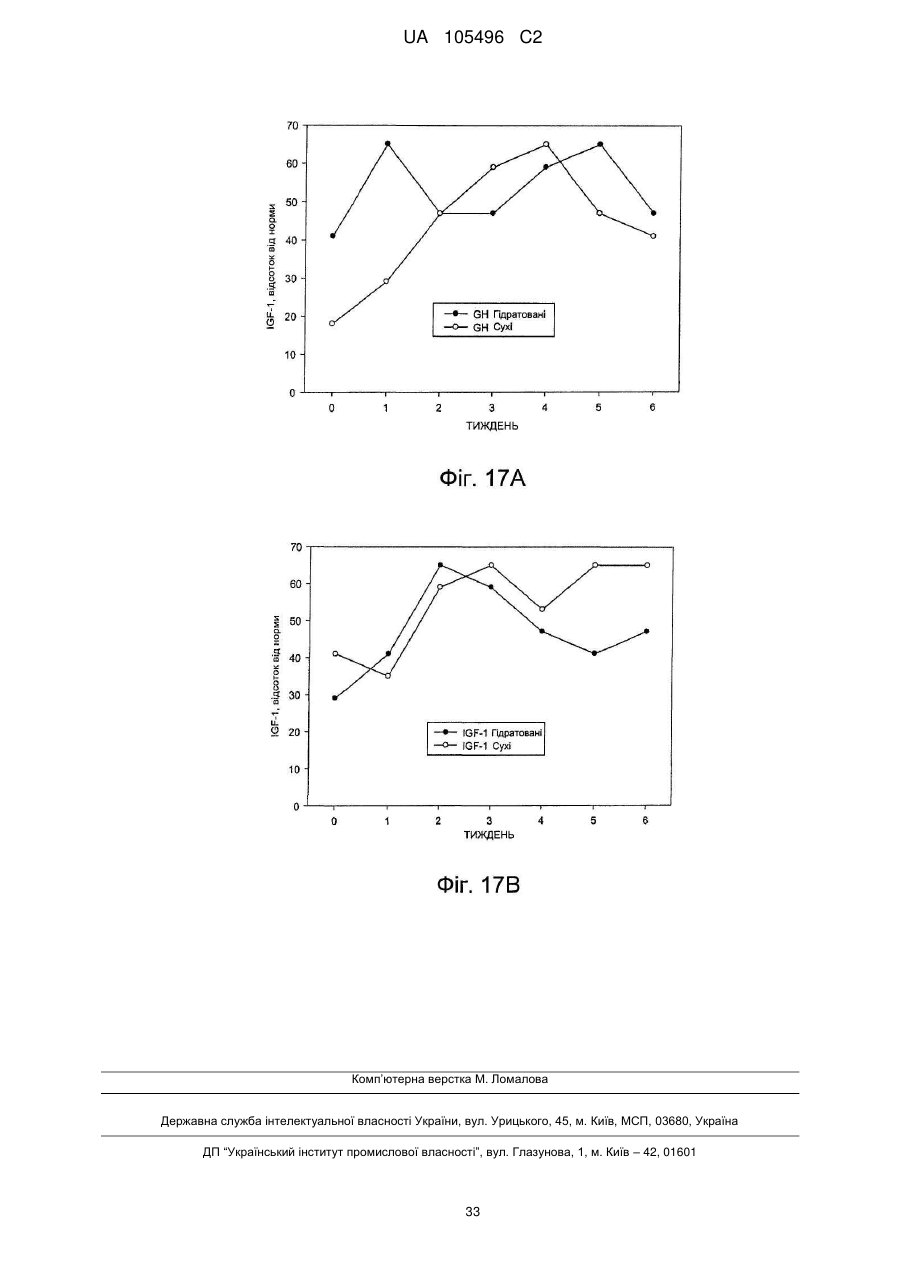
Доставка октреотиду сухими фармакологічними формами
Формула / Реферат
1. Спосіб доставки октреотиду суб'єктові з профілем вивільнення практично нульового порядку протягом тривалого часу, але не менше 6 місяців, при цьому суб'єктом є ссавець, окрім собак, а спосіб передбачає підшкірну імплантацію суб'єктові щонайменше одного імплантованого пристрою, причому даний щонайменше один імплантований пристрій включає композицію, яка містить 84 мг октреотиду ацетату, 9,5 мг гідроксипропілцелюлози та 2 мг стеарату магнію, а композиція розміщена в гідрофільному полімері, виготовленому полімеризацією суміші, що містить 40 % НЕМА, 59,5 % НРМА, 0,5 % ТМРТМА та 1 % вітаміну Е TPGS, і при цьому пристрій, який при цьому імплантується, імплантується в сухому стані так, щоб суб'єкт протягом щонайменше 6 місяців отримував в перерахунку на добову дозу таку кількість октреотиду, яка є ефективною для лікування суб'єкта, але дає меншу концентрацію октреотиду в сироватці в порівнянні з імплантацією імплантованого пристрою, в гідратованому стані.
2. Спосіб за п. 1, який відрізняється тим, що суб'єкт страждає на захворювання або розлад, що реагує на октреотид.
3. Спосіб за п. 1, який відрізняється тим, що суб'єкт страждає на розлад гормону GH або IGF-1 або його симптоми.
4. Спосіб за п. 3, який відрізняється тим, що розлад гормону GH або IGF-1 є акромегалією.
5. Спосіб за п. 1, який відрізняється тим, що суб'єкт отримує октреотид з середньою швидкістю близько 250 мкг на добу протягом 6 місяців.
6. Спосіб за п. 1, який відрізняється тим, що суб'єкт страждає на захворювання, вибране з групи, до складу якої входить карциноїдний синдром, VIP-оми, нейроендокринні пухлини, проліферативна діабетична ретинопатія, червоні вугри, панкреатит, шлунково-кишкові кровотечі, свищі підшлункової залози і кишкові свищі, базедова хвороба (офтальмопатія Грейвса), глаукома і симптоми, пов'язані з хіміотерапією або СНІДом.
7. Імплантований пристрій, який включає композицію з контрольованим вивільненням, яка містить 84 мг октреотиду ацетату, 9,5 мг гідроксипропілцелюлози та 2 мг стеарату магнію, яка міцно розміщена в полімері на основі метакрилату, виготовленому полімеризацією суміші, що містить 40 % НЕМА, 59,5 % НРМА, 0,5 % ТМРТМА та 1 % вітаміну Е TPGS, і пристрій, який при цьому імплантується, виділяє октреотид для суб'єкта з профілем вивільнення практично нульового порядку протягом тривалого часу, але не менше 6 місяців, а суб'єктом є
ссавець, окрім собак, причому імплантований пристрій імплантується суб'єктові в сухому стані.
8. Імплантований пристрій за п. 7, який відрізняється тим, що при імплантації суб'єктові імплантованого пристрою суб'єкт отримує октреотид з середньою швидкістю близько 250 мкг на добу протягом 6 місяців.
9. Імплантований пристрій за п. 1, який відрізняється тим, що розміри імплантованого пристрою складають 3,4 мм х 43 мм.
10. Імплантований пристрій за п. 7, який відрізняється тим, що розміри імплантованого пристрою складають 3,4 мм х 43 мм.
Текст
Реферат: Винахід стосується способів і пристроїв для доставки октреотиду пацієнтам, які передбачають імплантацію пристрою у сухому стані, що включає композицію, яка містить 84 мг октреотиду ацетату, 9,5 мг гідроксипропілцелюлози та 2 мг стеарату магнію, і композиція розміщена в гідрофільному полімері. UA 105496 C2 (12) UA 105496 C2 UA 105496 C2 5 10 15 20 25 30 35 40 45 50 55 60 Рівень техніки Акромегалія є гормональним захворюванням, яке виникає тоді, коли гіпофіз виробляє надто багато гормону росту (GH). Найчастіше вона вражає людей середнього віку і може привести до серйозного захворювання і передчасної смерті. Якщо поставлено діагноз акромегалії, то вона піддається лікуванню у більшості пацієнтів, але внаслідок повільного і часто прихованого розвитку її часто не вдається правильно діагностувати. Найбільш серйозними наслідками акромегалії для здоров'я є цукровий діабет, гіпертензія і підвищений ризик виникнення серцевосудинних захворювань. Хворі акромегалією також піддаються підвищеному ризику виникнення поліпів товстої кишки, які можуть перерости в рак. Якщо пухлина, яка продукує GH з'являється в дитячому віці, то захворювання, яке при цьому виникає називається гігантизмом, а не акромегалією. Після досягнення статевого дозрівання відбувається злиття пластинок росту довгих трубчастих кісток, тому у дорослих при надмірному виділенні GH не відбувається збільшення росту. А тривала дія надмірного рівня GH до злиття пластинок росту викликає посилення росту трубчастих кісток і підвищення зросту. Акромегалія виникає при тривалому надмірному виділенні гормону росту (GH) гіпофізом. Гіпофіз є невеликою залозою в основі мозку, яка виробляє декілька важливих гормонів, які контролюють такі функції організму, як ріст і розвиток, розмноження і метаболізм. GH є частиною каскаду гормонів, які, як це видно з назви, регулюють фізичний ріст організму. Цей каскад починається в тій частині мозку, яка називається гіпоталамус, який виробляє гормони, що регулюють функцію гіпофізу. Один з них – гормон вивільнення гормону росту (GHRH) – стимулює виділення GH гіпофізом. Інший гормон гіпоталамуса – соматостатин – інгібує синтез і виділення GH. Секреція GH з гіпофіза в кровоток викликає виділення іншого гормону – інсуліноподібного фактора росту 1 (IGF-1) в печінці. IGF-1 є фактором, який спричиняє ріст кісток та інших тканин організму. У свою чергу IGF-1 подає сигнал гіпофізу про зменшення виділення GH. Рівні GHRH, соматостатину, GH і IGF-1 в організмі жорстко регулюються один одним, і на них впливають такі зовнішні подразники, як сон, вправи, стрес, їда і рівень цукру в крові. Якщо гіпофіз виробляє GH незалежно від нормальних регуляторних механізмів, то рівень IGF-1 зростатиме, що приведе до росту кісток і збільшення органів. Надлишок GH також викликає зміни метаболізму цукрів і ліпідів і може викликати діабет. У понад 90 % хворих на акромегалію надмірне виділення GH викликається доброякісною пухлиною гіпофіза, яка називається аденомою. Ці пухлини виробляють надлишок GH і у міру їх збільшення здавлюють навколишні тканини мозку, як то зорові нерви. Таке збільшення викликає головні болі і зорові порушення, які часто є симптомами акромегалії. Крім того, здавлення навколишньої нормальної тканини гіпофізу може змінити виділення інших гормонів, що призводить до змін місячних і виділень з молочної залози у жінок та імпотенції у чоловіків. У деяких хворих акромегалія викликається не пухлиною гіпофіза, а пухлиною підшлункової залози, легенів або надниркових залоз. Ці пухлини викликають надлишок GH або тому, що вони самі виробляють GH, або, що зустрічається частіше, тому, що вони виробляють GHRH, тобто гормон, який стимулює виділення GH гіпофізом. У цих хворих фіксується надлишок GHRH в крові, який свідчить, що причиною акромегалії не є дефект гіпофіза. При видаленні цих негіпофізарних пухлин рівень GH падає і симптоми акромегалії зменшуються. Схеми лікування акромегалії включають зменшення продукування GH до нормального рівня, щоб зменшити тиск, з яким пухлина гіпофіза, яка росте, тисне на навколишні зони мозку, зберегти нормальне функціонування гіпофіза і обернути або ослабити симптоми акромегалії. Можливі способи лікування включають хірургічне видалення пухлини, фармакологічну терапію і променеву терапію гіпофіза. Було показано, що октреотид ефективний при лікуванні акромегалії. Рівень GH зазвичай знижується вже через 2 години після підшкірного введення октреотиду. Октреотид призводить до зниження рівнів GH і IGF-1 у більшості пацієнтів з нормалізацією рівня IGF-1 у аж до 60 % пацієнтів, що означає біохімічну ремісію. У більшості пацієнтів спостерігається помітне послаблення симптомів акромегалії, включаючи головні болі, болі в суглобах і потовиділення, відразу ж після початку лікування октреотидом. Зараз октреотид доступний у вигляді Sandostatin LAR® Depot, який після відновлення є суспензією мікросфер, що містять октреотиду ацетат. Sandostatin LAR® Depot є єдиним медикаментом, показаним для тривалої підтримуючої терапії у хворих на акромегалію. Він також показаний для тривалого лікування важкої діареї і гіперемії при метастатичних карциноїдних пухлинах і профузній водянистій діареї при VIPсекретуючих пухлинах. Sandostatin LAR® Depot вводиться шляхом внутрішньом'язової ін'єкції раз на 4 тижні після періоду титрування. Октреотиду ацетат також доступний у формі для негайного вивільнення – розчину Sandostatin® Injection, який потрібно вводити уколом 3 рази на день. 1 UA 105496 C2 5 10 15 20 25 30 35 40 45 50 55 60 У хворих, що не проявляють істотного зниження рівня GH у відповідь на періодичне введення октреотиду, частіше введення октреотиду може привести до більшої клінічної відповіді. Хворим на рефрактерну акромегалію можна вводити октреотид безперервно за допомогою підшкірного насоса, щоб запобігти витоку GH між ін'єкціями. В світлі ефективності октреотиду при лікуванні акромегалії і відсутності способу лікування і фармакологічної форми октреотиду з контрольованим вивільненням існує явна потреба в такій фармакологічній формі і способі введення, які здатні вводити октреотид протягом певного часу з контрольованою швидкістю, щоб уникнути ускладнень для хворих, яким доводиться страждати, наприклад, від багатьох періодичних уколів. Cутність винаходу Даний винахід загалом стосується фармацевтичної композиції октреотиду, яка може застосовуватися для лікування осіб, які страждають на гормональні захворювання. Даний винахід бажано виконується у вигляді форми з контрольованим вивільненням. Зокрема, даний винахід ґрунтується на несподіваному відкритті того, що октреотид може вивільнятися з контрольованою швидкістю з імплантованого пристрою, наприклад, імплантованого пристрою, який не вимагає заправки перед імплантацією. Одне втілення стосується способу доставки октреотиду суб'єктові з профілем вивільнення практично нульового порядку протягом тривалого часу, але не менше 6 місяців, при цьому суб'єктом є ссавець, окрім собак, а спосіб передбачає підшкірну імплантацію суб'єктові щонайменше одного імплантованого пристрою, причому даний щонайменше один імплантований пристрій включає композицію, яка містить октреотид, а сама композиція розміщена в гідрофільний полімер, і при цьому імплантований пристрій імплантується в сухому стані так, щоб суб'єкт протягом щонайменше 6 місяців отримував в перерахунку на добову дозу таку кількість октреотиду, яка є ефективною для лікування суб'єкта. У кращому варіанті втілення гідрофільний полімер включає один або декілька полімерів на основі поліуретану або один або декілька полімерів на основі метакрилату. У кращому варіанті втілення октреотид знаходиться у вигляді вільної речовини, солі або у вигляді комплексу, наприклад, в якому октреотид є ацетатом октреотиду. У кращому варіанті втілення суб'єкт страждає на розлад гормону GH або IGF-1 або його симптомами, наприклад, акромегалії. У кращому варіанті втілення суб'єкт отримує октреотид з середньою швидкістю від 75 мкг на добу до 300 мкг на добу протягом щонайменше 6 місяців. У кращому варіанті втілення дозування октреотиду отриманого суб'єктом, дає рівень октреотиду в сироватці від 0,5 нг/мл до 2 нг/мл, від 0,5 нг/мл до 1,4 нг/мл, від 0,6 нг/мл до 1,2 нг/мл, від 0,8 нг/мл до 1,2 нг/мл або від 0,9 нг/мл до 1,0 нг/мл. У кращому варіанті втілення суб'єкт отримує ефективну кількість октреотиду протягом щонайменше 12 місяців. В цілях визначення рівня в сироватці інтервал може бути вказаний у вигляді середнього за якийсь період часу, наприклад, від 3 днів до 150 днів, від 3 днів до 120 днів, від 5 днів до 100 днів, від 10 днів до 75 днів і так далі. У кращому варіанті втілення дозування октреотиду, отриманого суб'єктом, дає величину Cmax для рівня октреотиду в сироватці менше 1,2 нг/мл. У кращому варіанті втілення дозування октреотиду отриманого суб'єктом, дає величину C max для рівня октреотиду в сироватці менше 1,0 нг/мл. У кращому варіанті втілення вивільнення октреотиду відбувається щонайменше від 3 до 10 днів після імплантації. У кращому варіанті втілення суб'єкт страждає на захворювання, вибране з групи, яка складається з карциноїдного синдрому, VIP-оми, нейроендокринних пухлин, проліферативної діабетичної ретинопатії, червоних вугрів, панкреатиту, шлунково-кишкових кровотеч, свищів підшлункової залози і кишкових свищів, базедової хвороби (офтальмопатії Грейвса), глаукоми і симптомів, пов'язаних з хіміотерапією або СНІДом. Одне втілення стосується імплантованого пристрою, який включає композицію з контрольованим вивільненням, яка містить октреотид і яка міцно поміщена в полімер на основі поліуретану або метакрилату, при цьому імплантований пристрій виділяє октреотид для суб'єкта з профілем вивільнення практично нульового порядку протягом тривалого часу, але не менше 6 місяців, а суб'єктом є ссавець, окрім собак, причому імплантований пристрій, імплантується суб'єктові в сухому стані. У кращому варіанті втілення гідрофільний полімер включає один або декілька полімерів на основі поліуретану. У кращому варіанті втілення октреотид знаходиться у вигляді вільної речовини, солі або у вигляді комплексу, наприклад, ацетату октреотиду. У кращому варіанті втілення при імплантації суб'єктові імплантованого пристрою, суб'єкт отримує октреотид з середньою швидкістю від 75 мкг на добу до 300 мкг на добу протягом щонайменше 6 місяців. У кращому варіанті втілення при імплантації імплантованого пристрою суб'єктові дозування октреотиду, що його отримує суб'єкт, дає рівень октреотиду в сироватці від 0,5 нг/мл до 2 нг/мл. У кращому варіанті втілення при імплантації імплантованого пристрою суб’єктові, дозування октреотиду, що його отримує суб’єкт, дає рівень 2 UA 105496 C2 5 10 15 20 25 30 35 40 45 50 55 октреотиду в сироватці від 0,8 нг/мл до 1,8 нг/мл. У кращому варіанті втілення при імплантації імплантованого пристрою суб’єктові, дозування октреотиду, що його отримує суб’єкт, дає величину Cmax для рівня октреотиду в сироватці менше 1,2 нг/мл. У кращому варіанті втілення при імплантації імплантованого пристрою суб’єктові, дозування октреотиду, що його отримує суб’єкт, дає величину Cmax для рівня октреотиду в сироватці менше 1,0 нг/мл. У кращому варіанті втілення при імплантації імплантованого пристрою суб’єктові, вивільнення октреотиду відбувається щонайменше від 3 до 10 днів після імплантації. Одне втілення стосується застосування октреотиду для виготовлення медикаменту для лікування суб'єкта такого як ссавець, окрім собак, при цьому медикамент є композицією з контрольованим вивільненням, яка міцно поміщена в полімер на основі поліуретану або метакрилату, тим самим утворюючи імплантований пристрій, причому при імплантації суб'єктові імплантований пристрій, виділяє октреотид для суб'єкта з профілем вивільнення практично нульового порядку протягом тривалого часу, але не менше 6 місяців, а суб'єктом є ссавець, окрім собак, причому імплантований пристрій, імплантується суб'єктові в сухому стані. Даний винахід забезпечує терапевтично ефективну кількість октреотиду протягом тривалого часу, бажано щонайменше 2 місяців, краще 6 місяців і аж до 2 років. Даний винахід також передбачає композиції, які забезпечують контрольоване вивільнення октреотиду протягом щонайменше 2 місяців, бажано 6 місяців і аж до 2 років. Втілення даного винаходу стосуються фармацевтичної композиції, яка містить октреотид або його солі, проліки, їх форми або похідні, які можуть застосовуватися при ефективному лікуванні різних захворювань. Короткий опис фігур На Фіг. 1 приведений графік, який представляє лінійну залежність між рівноважним водовмістом і процентним вмістом ланок гідроксипропілметакрилату (HPMA) в зшитих полімерах HEMA/HPMA в стані максимальної гідратації. На Фіг. 2 приведений графік, який представляє вивільнення октреотиду з композиції імпланта даного винаходу. На Фіг. 3 приведений графік, який представляє вивільнення октреотиду з композиції імпланта даного винаходу. На Фіг. 4 приведений графік, який представляє вивільнення октреотиду з композиції імпланта даного винаходу. На Фіг. 5 приведений графік, який представляє вивільнення октреотиду з композиції імпланта даного винаходу. На Фіг. 6 приведений графік, який представляє рівні октреотиду і IGF-1 в сироватці у здорового собаки, якому імплантували композицію октреотиду запропоновану даним винаходом. На Фіг. 7 приведений графік, який представляє рівні октреотиду і IGF-1 в сироватці впродовж 6 місяців в групі з 3 здорових собак, яким імплантували по одній композиції октреотиду даного винаходу. На Фіг. 8 приведений графік, який представляє рівні октреотиду і IGF-1 в сироватці впродовж 6 місяців в групі з 3 здорових собак, яким імплантували по дві композиції октреотиду даного винаходу. На Фіг. 9A і 9B приведені графіки, які представляють рівень IGF-1 в сироватці і його зміни впродовж 6 місяців у 11 суб'єктів з акромегалією, яким імплантували композицію октреотиду запропоновану даним винаходом. На Фіг. 10 приведений графік, який представляє рівень октреотиду в сироватці впродовж 6 місяців у 11 суб'єктів з акромегалією, яким імплантували композицію октреотиду запропоновану даним винаходом. На Фіг. 11 приведений графік, який представляє рівень октреотиду в сироватці впродовж 6 місяців у 2 собак, яким імплантували композицію октреотиду запропоновану даним винаходом. На Фіг. 12 приведений графік, який представляє рівень IGF-1 в сироватці впродовж 6 місяців у 2 собак, яким імплантували композицію октреотиду запропоновану даним винаходом. На Фіг. 13 приведений графік, який представляє рівні октреотиду в сироватці при виділенні його гідратованим імплантом і сухим імплантом (також див. табл. 6). На Фіг. 14 приведений графік, який представляє рівні октреотиду в сироватці при виділенні його гідратованим імплантом і сухим імплантом (також див. табл. 6). На Фіг. 15 приведені графіки, які представляють рівень гормону росту при виділенні октреотиду гідратованими і сухими імплантами (у верхній частині – концентрація GH, в нижній частині – зменшення GH в %). 3 UA 105496 C2 5 10 15 20 25 30 35 40 45 50 55 60 На Фіг. 16 приведені графіки, які представляють рівень інсуліноподібного фактора росту 1 (IGF-1) при виділенні октреотиду гідратованими і сухими імплантами (у верхній частині – концентрація IGF-1, в нижній частині – стандартне відхилення). На Фіг. 17 приведені графіки, які представляють рівень інсуліноподібного фактора росту 1 (IGF-1) при виділенні октреотиду гідратованими і сухими імплантами (у обох частинах представлені дані дослідів, а значення виражені у вигляді % від нормального рівня). Розкриття сутності винаходу Перед описом композицій і способів даного винаходу слід з'ясувати, що даний винахід не обмежується описаними конкретними молекулами, композиціями, методами або методиками, оскільки вони можуть змінюватися. Слід також з'ясувати, що використана при описі термінологія призначається тільки для опису конкретних варіантів або втілень і не призначається для обмеження сфери дії даного винаходу, яка повинна обмежуватися тільки приведеною формулою винаходу. Використані терміни мають значення, визнані і відомі фахівцям, проте, для зручності і повноти, певні терміни та їх значення викладаються нижче. Форми однини включають і значення множини, якщо з контексту чітко не випливає інакше. Якщо не вказано інакше, всі технічні і наукові терміни в даному винаході мають ті ж значення, які зазвичай використовуються пересічними фахівцями в цій галузі. Хоча при виконанні або тестуванні втілень даного винаходу можна застосовувати способи і матеріали, аналогічні або еквівалентні до описаних в ньому, але кращі способи, пристрої і матеріали описані нижче. Всі публікації, приведені у винаході, включені як посилання в тій мірі, в якій вони підтверджують даний винахід. Ніщо в даному винаході не повинне сприйматися як допущення того, що він не може передбачати такий опис за фактом попереднього винаходу. У даному винаході термін "приблизно" означає плюс-мінус 10 % від чисельного значення того числа, до якого він відноситься. Наприклад, приблизно 50 % означає в межах 45-55 %. "Композиція з контрольованим вивільненням" означає композицію, призначену для послідовного вивільнення заданої, терапевтично ефективної кількості препарату або іншого активного агента, як то поліпептиду або синтетичної сполуки, протягом тривалого часу, внаслідок чого зменшується кількість обробок, необхідних для досягнення необхідного терапевтичного ефекту. Композиція з контрольованим вивільненням зменшує кількість обробок, необхідних для досягнення необхідного терапевтичного ефекту, в сенсі зниження рівня гормону росту або зниження рівня IGF-1 або зменшення симптомів, пов'язаних, наприклад, з акромегалією, зокрема аномального росту, карциноїдного синдрому, VIP-оми (аденоми, яка секретує вазоактивний інтестинальний пептид), нейроендокринних пухлин (зокрема лікування симптомів гіперемії і діареї), проліферативної діабетичної ретинопатії, червоних вугрів, панкреатиту, шлунково-кишкових кровотеч, свищів підшлункової залози і кишкових свищів, базедової хвороби (офтальмопатії Грейвса), глаукоми або лікування симптомів при хіміотерапії і СНІД. Композиції з контрольованим вивільненням запропоновані даним винаходом досягають бажаного фармакокінетичного профілю у суб'єкта, переважно починають вивільняти активний засіб практично негайно після розміщення в робочому середовищі з подальшим постійним, безперервним вивільненням активного засобу, бажано нульового або майже нульового порядку. У даному винаході термін "контрольоване вивільнення" позначає заздалегідь встановлене постійне вивільнення активного засобу з дозової форми з такою швидкістю, щоб підтримувався терапевтично корисний рівень активного засобу в крові нижчий від токсичного рівня протягом, наприклад, щонайменше 2 місяців, 6 місяців або більше (наприклад, аж до 2 років). Терміни "пацієнт" або "суб'єкт" охоплюють всіх тварин, включаючи людину. Приклади пацієнтів або суб'єктів включають людей, корів, собак, кішок, кіз, овець і свиней. Термін "фармацевтично прийнятні солі, ефіри, аміди і пролікарські форми" в даному винаході відноситься до тих солей карбонових кислот, солей з амінокислотами, ефірів, амідів і форм проліків сполук даного винаходу, які, в межах здорового медичного глузду, є придатними для застосування у контакті з тканинами пацієнтів без зайвої токсичності, подразнення, алергічних реакцій і тому подібного. Їх застосування відповідає задовільному співвідношенню між користю і ризиком і є ефективним з погляду їх призначення. Цвіттеріонні форми, якщо це можливо, теж є корисними сполуками винаходу. Крім того, сполуки даного винаходу можуть існувати, наприклад, в несольватованих, так само як і сольватованих формах з фармацевтично прийнятними розчинниками, такими, наприклад, як вода, етанол тощо. Загалом, сольватовані форми вважаються еквівалентними до несольватованих форм в цілях даного винаходу. Термін "форма проліків" відноситься до таких сполук, які піддаються швидкому перетворенню in vivo з утворенням початкових сполук вищенаведеної формули, наприклад, при гідролізі в крові. Всебічне обговорення приведене в роботах T. Higuchi and V. Stella, "Pro-drugs as Novel Delivery Systems", Vol. 14 °F the A.C.S. Symposium Series, і Bioreversible Carriers in Drug 4 UA 105496 C2 5 10 15 20 25 30 35 40 45 50 55 Design, ed. Edward B. Roche, American Pharmaceutical Association and Pergamon Press, 1987, які обидві включено у повному обсязі як посилання. Термін "солі" відноситься до порівняно нетоксичних солей сполук даного винаходу з неорганічними і органічними кислотами. Такі солі можуть бути отримані in situ при остаточному виділенні і очищенні сполук або окремо проведенням реакції очищеної сполуки у вигляді вільної основи з придатною органічною або неорганічною кислотою і виділенням утвореної при цьому солі. Приклади солей включають солі ацетату, гідроброміду, гідрохлориду, сульфату, бісульфату, нітрату, ацетату, оксалату, валерату, олеату, пальмітату, стеарату, лаурату, борату, бензоату, лактату, фосфату, тозилату, цитрату, малеату, фумарату, сукцинату, тартрату, нафтилату, мезилату, глюкогептонату, лактобіонату, лаурилсульфонату тощо. Вони можуть включати катіони лужних і лужноземельних металів, такі як катіони натрію, літію, калію, кальцію, магнію тощо, а також нетоксичні катіони амонію, тетраметиламонію, тетраетиламонію, метиламіну, диметиламіну, триметиламіну, триетиламіну, етиламіну тощо (наприклад, див. S.M. Barge et al., "Pharmaceutical Salts", J. Pharm. Sci., 1977, 66:1-19, яку включено як посилання у повному обсязі). "Лікування" означає введення ліків або проведення медичних процедур стосовно пацієнта, або для профілактики, або для лікування захворювання або хвороби у тому випадку, коли пацієнт на нього страждає. "Терапевтично ефективна кількість" є такою кількістю, яка є достатньою для зменшення, запобігання або ослаблення симптомів, пов'язаних з медичним захворюванням. У плані гормональної терапії вона може означати і таку кількість, яка є достатньою для нормалізації функцій організму або рівня гормонів при захворюванні. Наприклад, терапевтично ефективна кількість композиції октреотиду з контрольованим вивільненням є заздалегідь встановленою кількістю, розрахованою на досягнення необхідного ефекту, наприклад, на ефективне зниження рівня гормону росту або IGF-1 у пацієнта. Даний винахід може застосовуватися для лікування цілого ряду гормональних розладів, зокрема акромегалії та інших захворювань, порушень або симптомів, які ефективно лікуються, наприклад, октреотидом, наприклад, карциноїдного синдрому, VIP-оми (аденоми, яка секретує вазоактивний інтестинальний пептид), нейроендокринних пухлин (зокрема лікування симптомів гіперемії і діареї), проліферативної діабетичної ретинопатії, червоних вугрів, панкреатиту, шлунково-кишкових кровотеч, свищів підшлункової залози і кишкових свищів, базедової хвороби (офтальмопатії Грейвса), глаукоми або лікування симптомів при хіміотерапії і СНІДу. Акромегалія характеризується рядом клінічних симптомів, які включають збільшення рук і ніг, зміни обличчя, включаючи збільшення лобних горбів, збільшення нижньої щелепи і відстані між зубами, артралгію, рясне потовиділення, апное уві сні, гіпертензію, цукровий діабет і гіпертрофічну кардіоміопатію. Пухлини, які викликають акромегалію, часто викликають місцеве анатомічне здавлення, яке приводить, наприклад, до обмеження поля зору, головних болів, гіпопітуїтаризму і парезу черепномозкових нервів. При цьому у хворих на акромегалією в 2-5 разів підвищується смертність, в основному внаслідок серцево-судинних і цереброваскулярних захворювань. Також підвищується ступінь злоякісності у зв'язку з акромегалією, причому краще всього вивчений рак товстої кишки. Карциноїдні пухлини зазвичай зустрічаються в апендиксі, бронхіолах, товстому або тонкому кишечнику і секретують хімічні речовини, які викликають розширення кровоносних судин типу серотоніну. Розширення судин може відповідати за симптоми, які зазвичай спостерігаються при карциноїдних пухлинах, таких, наприклад, як діарея, гіперемія і астма. Залежно від гормонів і біохімічних речовин, які секретуються карциноїдними пухлинами, може відмічатися цілий ряд симптомів. Вони збірно відомі як "карциноїдний синдром". У біохімічному відношенні люди з карциноїдними пухлинами схильні виробляти більше серотоніну, виходячи з амінокислоти триптофану, а серотонін далі руйнується в організмі з утворенням 5-гідроксиіндолоцтової кислоти (5-HIAA), яка може бути виявленою в сечі у більшості таких хворих. Діагностичні аналізи крові і сечі показують, що хворі з карциноїдними пухлинами проявляють підвищення рівня 5HIAA в сечі, пониження триптофану в крові, підвищення хромограніну A і серотоніну в крові. Також застосовуються аналізи крові на вміст гістаміну, брадикініну, нейроноспецифічної енолази, кальцитоніну, субстанції P, нейрокініну A і панкреатичного поліпептиду. "ОктреоСкан" позначає скануючий тест для ідентифікації карциноїдних пухлин і нейроендокринних пухлин. У ньому застосовується радіоактивне похідне октреотиду під назвою пентетреотид. Після ін'єкції він концентрується в тканинах, які експресують соматостатиновий рецептор. Нейроендокринні пухлини суперекспресують цей рецептор і можуть бути виявленими при такому тестуванні. 5 UA 105496 C2 5 10 15 20 25 30 35 40 45 У даному винаході термін "октреотид" відноситься взагалі до всіх сполук, які містять приведену структуру, включаючи різноманітні солі. Октреотид включає октапептид з наступною послідовністю амінокислот: L-цистеінамід-D-фенілаланіл-L-цистеініл-L-фенілаланіл-Dтриптофаніл-L-лізил-L-треоніл-N-[2-гідрокси-1-(гідроксиметил)пропіл]-цикло(2→7)дисульфід; [R– (R*,R*)]. Нижче представлена структура октреотиду: Його хімічна формула – C49H66N10O10S2, а молекулярна вага – 1019,3 Да. Терапевтична категорія – шлунковий антисекреторний засіб. Октреотид запропонований даним винаходом може існувати, наприклад, у вигляді вільної речовини, солі або у вигляді комплексу. Солі з кислотами можуть утворюватися, наприклад, з органічними кислотами, полімерними кислотами і неорганічними кислотами. До них відносяться, наприклад, гідрохлориди і ацетати. Комплекси утворюються, наприклад, з октреотиду при додаванні неорганічних речовин, наприклад, неорганічних солей або гідроокисів типу солей Ca і Zn, і/або при додаванні полімерних органічних речовин. Кращою сіллю для композицій даного винаходу є ацетатна сіль. Втіленнями даного винаходу передбачений пристрій для доставки ліків, який може виконувати наступні функції: контрольована швидкість вивільнення (кінетика вивільнення нульового або майже нульового порядку), щоб максимально збільшити терапевтичні ефекти і звести до мінімуму небажані побічні ефекти; зручний спосіб видалення пристрою, якщо потрібно припинити лікування; і підвищення біодосяжності з меншими відхиленнями всмоктування і відсутністю пресистемного метаболізму. Фармацевтична композиція з контрольованим вивільненням, яка містить ацетат октреотиду, може бути частиною гідрогелевого пристрою для контрольованого вивільнення. Композиція даного винаходу здатна забезпечити, при введенні пацієнтові, такий профіль вивільнення октреотиду, який розтягнеться щонайменше на 2 місяці, бажано на 6 місяців або більше, наприклад, аж до 2 років. Октреотид може знаходитися, наприклад, всередині гідрогелю, а композиція виділятиме терапевтично ефективну кількість октреотиду протягом тривалого часу. Гідрогель може включати полімер, обраний з поміж полімерів на основі метакрилату, полімерів на основі поліуретану та їх комбінацій. Терапевтично ефективна кількість є такою кількістю октреотиду, бажано ацетату октреотиду, яка при введенні пацієнтові або суб'єктові послаблює симптоми акромегалії. Композиція може додатково включати фармацевтично прийнятні наповнювачі. При введенні композиції даного винаходу пацієнтам концентрація октреотиду в плазмі пацієнта у часі (профіль вивільнення) може зберігатися протягом щонайменше 2 місяців, бажано 6 місяців і аж до 2 років. Композиції можуть забезпечити середню концентрацію октреотиду в плазмі людини в стаціонарному стані від 0,1 до 9 нг/мл, від 5 до 1 нг/мл, від 1 до 2 нг/мл або від 1,2 до 1,6 нг/мл. Стаціонарний стан – це точка, в якій кількість введеного за даний інтервал препарату дорівнює кількості препарату, який зазнав елімінації за той же самий період. Гідрофільний імплант, який містить композицію октреотиду, може бути сформований з ксерогелю з тим, щоб він добре вбирав воду. У гідратованому стані ксерогель називається гідрогелем. У будь-якій формі, гідратованій або не гідратованій, він є біосумісним і не токсичним для організму і не схильний до біодеградації. Він набрякає, але не розчиняється у воді. Коли гідрогель досягає максимального ступеня гідратації, його водовміст називається "рівноважним водовмістом" (EWC). Відносний водовміст гідрогелю (у будь-якому ступені гідратації) визначається таким чином: 6 UA 105496 C2 вага гідрогелю вага сухого полумеру ксерогелю 100 вага гідрогелю 5 10 15 20 25 30 Гідрогель може бути гомогенним гомополімером або співполімером із заданою величиною рівноважного водовмісту (EWC), утвореної при полімеризації суміші з етиленового ненасиченого мономера A і етиленового ненасиченого мономера B, наприклад, 2гідроксиетилметакрилату (HEMA) і гідроксипропілметакрилату (HPMA). Задану величину EWC можна розрахувати шляхом визначення значень EWC гомополімеру гідрогелю з гідрофільного мономера A (гомополімеру A) і гомополімеру гідрогелю з гідрофільного мономера B (гомополімеру B); визначення залежності значень EWC гомогенних співполімерів AB від хімічного складу даних співполімерів AB; вибору наміченого значення EWC і визначення хімічного складу співполімеру AB з наміченим значенням EWC; складання полімеризованої суміші з мономера A і мономера B в кількостях, достатніх для отримання співполімеру AB з наміченим значенням EWC; і виконання реакції полімеризації, яка дає співполімер AB, який характеризується наміченим значенням EWC. У даному винаході "співполімер AB" або "співполімер AB, який складається в основному з ланок мономера A і ланок мономера B" означає те, що поліприєднання мономера A і мономера B здійснювалося через полімеризований етиленовий зв'язок мономерів. Для прикладу, якщо мономером A є 2-гідроксиетилметакрилат, а мономером B є N-метилакриламід, то співполімер AB містить ланки мономера A, які повторюються і ланки мономера B, які повторюються,. Якщо з контексту не витікає іншого, термін "співполімер" охоплює полімери, отримані при полімеризації суміші щонайменше двох ненасичених етиленових мономерів. У даному винаході "ланка HEMA" означає структуру, яка повторюється, в полімері, отриманому при полімеризації гідрофільного матеріалу, який містить 2-гідроксиетилметакрилат, ("HEMA"). Терміном "ланка HEMA" позначається структура: У даному винаході "ланка HPMA" позначає структуру, яка повторюється, в полімері, отриманому при полімеризації гідрофільного матеріалу, який містить гідроксипропілметакрилат, ("HPMA"). Терміном "ланка HPMA" позначається структура: CH3 C CH2 C= O O C3H6OH 35 40 Рідкі полімеризовані матеріали, які використовуються в гідрофільних продуктах, охоплюють широке коло гідрофільних, ненасичених етиленових полімеризованих сполук, зокрема гідрофільних мономерів, таких, наприклад, як моноефіри акрилової кислоти або метакрилової кислоти з полігідроксисполуками, які містять ефіротвірну гідроксильну групу і щонайменше ще одну гідроксильну групу, як то, наприклад, моноалкіленові і поліалкіленові поліоли метакрилової кислоти і акрилової кислоти, наприклад, 2-гідроксиетилметакрилат і -акрилат, диетиленглікольметакрилат і -акрилат, пропіленглікольметакрилат і -акрилат, 7 UA 105496 C2 5 10 15 20 25 30 35 40 45 50 55 60 дипропіленглікольметакрилат і -акрилат, гліцидилметакрилат і -акрилат, гліцерилметакрилат і акрилат та ін.; 2-алкенаміди, наприклад, акриламід, метакриламід та ін.; N-алкіл- і N,Nдиалкілзаміщені акриламіди і метакриламіди типу N-метилметакриламіду, N,Nдиметилметакриламіду та ін.; N-вінілпіролідон; алкілзаміщені N-вінілпіролідони, наприклад, метилзаміщений N-вінілпіролідон; N-вінілкапролактам; алкілзаміщені N-вінілкапролактами, наприклад, N-вініл-2-метилкапролактам, N-вініл-3,5-диметилкапролактам та ін. У цих композиціях також може використовуватися акрилова і метакрилова кислота. У реакції полімеризації використовуються суміші гідрофільних мономерів. Тип і пропорції мономерів обираються таким чином, щоб отримати гомогенний полімер, бажано зшитий гомогенний полімер, який при гідратації матиме необхідну величину EWC для передбаченого застосування. Таку величину EWC можна визначити заздалегідь шляхом приготування ряду співполімерів з використанням різних співвідношень мономерів, наприклад, сумішей HEMA і HPMA в різних пропорціях; встановлення величини EWC цих співполімерів; і складання графіка залежності відносної величини EWC цих співполімерів від % ланок HPMA (або HEMA) в співполімерах HPMA/HEMA (Фіг. 1). В деяких випадках полімеризація певних сумішей гідрофільних мономерів приводить до утворення таких гомогенних гідрофільних співполімерів, які, в деякій мірі, розчиняються у водному середовищі. У таких випадках в суміш мономерів можна включити невелику кількість, наприклад, до 3 % ненасиченого багатоетиленового зшиваючого реагенту, який співполімеризується, отримуючи гомогенні зшиті співполімери, які є нерозчинними у воді, але набрякають у воді. Малозшиті гомополімери HEMA можуть мати значення EWC, наприклад, близько 38 %. Зшиті співполімери HEMA і HPMA мають значення EWC менше 38 %. З іншого боку, зшиті співполімери HEMA і акриламіду проявляють значення EWC більше 38 %, наприклад, аж до 75 % і вище. Таким чином, залежно від корисної або ефективної швидкості виділення активної сполуки, наприклад, фармакологічного препарату, яка вимагається від системи гідрогелевої доставки для конкретного застосування, фахівець в цій галузі, відповідно до викладених в даному винаході інструкцій, може пристосувати гідрогелеві мембрани з співполімеру для виділення препарату з потрібною швидкістю. Співполімери можуть містити, наприклад, від 15 % до 70 % мас. ланок HEMA і від 85 до 30 % мас. ланок другого етиленового мономера, матимуть задані значення EWC в межах від 20 % до 75 %, бажано близько 25 %. Гомогенні співполімери можуть включати співполімери, зроблені з суміші гідрофільних мономерів, яка містить близько 80 % мас. HPMA і близько 20 % мас. HEMA. У додаткових втіленнях суміш може додатково містити невелику кількість багатоетиленового ненасиченого зшиваючого реагенту, наприклад, триметилолпропантриметакрилату (“TMPTMA”). Різні аспекти винаходу включають гомогенні гідрофільні співполімери, у яких структура гомогенного полімеру утворюється при полімеризації суміші гідрофільних мономерів, описаних раніше; і пристрій для доставки препаратів, в якому використовуються картриджі з гомогенного полімеру в системі доставки. Полімеризація суміші з гідрофільних мономерів і гідрофобних мономерів дає гетерогенні полімери. Якщо в полімері є гідрофобні сегменти, то міжфазна вільна енергія зростає, що підвищує всмоктування білка і мінералізацію після імплантації тварині. При вимірюванні міжфазної вільної енергії у гідрогелів з полі-HEMA, наприклад, вона виявилася близькою до нуля. Відповідно до інтерпретації міжфазної вільної енергії гідрогелі з чисто гідрофільних компонентів повинні виявитися біосумісними з тканинами організму. Малозшитий HEMA є гомогенним гідрофільним гомополімером (не враховуючи порівняно невелику кількість в ньому полімеризованого зшиваючого реагенту) з відносно фіксованими характеристиками або параметрами. Методи зміни "гомополімерного" полі-HEMA для надання йому додаткових характеристик або властивостей є складними, віднімають багато часу і часто призводять до нестійкої їх поведінки. З іншого боку, при полімеризації сумішей HEMA з різною кількістю інших полімеризованих гідрофільних співмономерів можна отримати передбачені гомогенні гідрофільні співполімери із (заданими) нестандартними властивостями. Корисні зшиваючі реагенти, які можна включати в середовище для реакції полімеризації, включають, наприклад, багатоетиленові ненасичені сполуки, які містять щонайменше дві етиленові полімеризовані ділянки, такі як ди-, три- і тетраетиленові ненасичені сполуки, зокрема тричі ненасичені зшиваючі реагенти з двічі ненасиченими зшиваючими сполуками або без них, наприклад, дивінілбензол, етиленглікольдиметакрилат і -диакрилат, пропіленглікольдиметакрилат і -диакрилат, і ди-, три- і тетраакрилові або метакрилові ефіри наступних поліолей: триетаноламіну, гліцерину, пентаеритритолу, 1,1,1-триметилолпропану та ін. Реакція полімеризації може проводитися в масі або з інертним розчинником. Придатні розчинники включають, наприклад, воду, органічні розчинники (наприклад, водорозчинні нижчі 8 UA 105496 C2 5 10 15 20 25 30 35 40 45 50 55 60 аліфатичні одноатомні спирти, а також багатоатомні спирти, наприклад, гліколь, гліцерин, діоксан та ін.; а також їх суміші). Сполуки, які є корисними для каталізу етиленових ненасичених полімеризованих сполук включають вільнорадикальні сполуки і/або ініціатори типу тих, які зазвичай застосовуються при вінільній полімеризації, такі як органічні пероксиди, перкарбонати, гідропероксиди і сульфати лужних металів. Показові приклади включають гідропероксид кумену, трет-бутилгідропероксид, бензоїлпероксид, біс(4-трет-бутилциклогексил)пероксидикарбонат, пероксид водню, 2,4дихлорбензоїлпероксид, ацетилпероксид, ди-н-пропілпероксидикарбонат, ди-третбутилпероксид, ди-втор-бутилпероксидикарбонат, сульфат амонію, сульфат калію і сульфат натрію. Кращим каталізатором є такий, який ефективний за помірно низької температури, такої, наприклад, як 20-80 °C (наприклад, трет-бутилпероктоат, бензоїлпероксид і ди-вторбутилпероксидикарбонат). Також можна використовувати стандартний окислювально-відновний каталізатор полімеризації. Полімеризація етиленових сполук може здійснюватися, наприклад, за допомогою опромінювання, наприклад, ультрафіолетом, рентгенівського опромінювання, гамаопромінювання, мікрохвильового або іншого добре відомого опромінювання. Кращим каталізатором при опромінюванні ультрафіолетом є метиловий ефір бензоїну. Для оптимізації реакції полімеризації каталізатори і/або ініціатори і/або опромінювання застосовуються в каталітично ефективній кількості. Даний винахід спрямовано на використання полімерів, термопластів або термореактивних пластмас на основі поліуретану, на створення імплантованих пристроїв, з препаратами для виділення біологічно активних сполук з контрольованою швидкістю протягом тривалого часу. З поліуретанових полімерів бажано роблять циліндрові порожнисті трубочки з одним або двома відкритими кінцями за допомогою екструзії, (реактивного) литного пресування, прямого формування або відливання з центрифугуванням (наприклад, див. U.S. Pat. Nos. 5,266,325 і 5,292,515, які включені у повному обсязі як посилання), залежно від типу поліуретану. Термопластичний поліуретан можна обробляти за допомогою екструзії, литного пресування або прямого формування. Термореактивний поліуретан можна обробляти за допомогою реактивного литного пресування, прямого формування або відливання з центрифугуванням. Розміри циліндрової порожнистої трубочки можна встановити і точно підігнати. Полімери на основі поліуретану синтезують з багатофункціональних поліолей, ізоціанатів і подовжувачів ланцюга. Характеристики кожного поліуретану визначаються його структурою. Термопластичний поліуретан отримують з макродіолів, диізоціанатів і двофункціональних подовжувачів ланцюга (наприклад, див. U.S. Pat. Nos. 4,523,005 і 5,254,662, які включені у повному обсязі як посилання). Макродіоли складають м'які домени. Диізоціанати і подовжувачі ланцюга складають тверді домени. Тверді домени служать фізичними центрами зшивання для полімерів. Варіювання пропорцій цих двох доменів може змінити фізичні характеристики поліуретану. Термореактивний поліуретан можна отримати з багатофункціональних (більше ніж двофункціональних) поліолів і/або диізоціанатів і/або подовжувачів ланцюга (наприклад, U.S. Pat. Nos. 4,386,039 і 4,131,604, які включені у повному обсязі як посилання). Термореактивний поліуретан також можна отримати шляхом введення ненасичених зв'язків в ланцюзі полімеру і хімічного зшивання за допомогою придатних зшиваючих реагентів і/або ініціаторів (наприклад, U.S. Pat. No. 4,751,133, який включений у повному обсязі як посилання). Контролюючи кількість центрів зшивання і те, як вони розподілені, можна контролювати швидкість вивільнення активних речовин. Залежно від необхідних властивостей, можна ввести різні функціональні групи в полімерні ланцюги поліуретану за допомогою модифікації остову поліолей. Якщо пристрій використовується для доставки водорозчинних препаратів, то в поліолі можна вбудувати гідрофільні бічні групи типу іонних, карбоксильних, ефірних або гідроксильних груп, щоб підвищити гідрофільність полімеру (наприклад, U.S. Pat. Nos. 4,743,673 і 5,354,835, які включені у повному обсязі як посилання). Якщо ж пристрій використовується для доставки гідрофобних препаратів, то в поліоли можна вбудувати гідрофобні бічні групи типу алкільних і силоксанових, щоб підвищити гідрофобність полімеру (наприклад, U.S. Pat. No. 6,313,254, який включений у повному обсязі як посилання). Швидкість вивільнення активних речовин також можна контролювати шляхом зміни гідрофільності/гідрофобності поліуретанових полімерів. Невеликі імпланти циліндрової форми відповідно до винаходу можуть містити всередині октреотид, бажано ацетат октреотиду, і необов'язково фармацевтично прийнятний носій. Товщина мембрани (між внутрішньою і зовнішньою поверхнею) у імпланта практично однакова, і вона служить лімітуючим швидкість бар'єром для вивільнення засобу, що міститься усередині. 9 UA 105496 C2 5 10 15 20 Такі імпланти можна пластифікувати або гідратувати і перетворювати на вироби іншої геометричної форми для різноманітного медичного застосування. При виготовленні форми для імплантації потрібно враховувати декілька факторів. Визначається профіль вивільнення (час затримки, швидкість і тривалість вивільнення); встановлюється гідрофільний полімерний матеріал; і вимірюється дифузивність активного засобу через неї (як мембрана, що лімітує швидкість). Профіль гідратації мембрани, що лімітує швидкість для даного активного засобу можна легко визначити шляхом виготовлення плівки з обраного полімеру і дослідження її на дифузію за допомогою вертикальної скляної кювети з двох відсіків, як це добре відомо в даній галузі. Визначається коефіцієнт дифузії і водовміст, при якому починається дифузія (нижче за які дифузія практично не відбувається – надалі "% Hd"). Готується серія мембран з різних полімерів. Потім мембрани піддають гідратації повністю і вимірюють значення EWC. Повністю гідратовані мембрани поміщають у вертикальні скляні кювети з двох відсіків для вимірювання і будують графік дифузії макромолекулярної композиції через матеріал мембрани при різних значеннях EWC. Рівноважний водовміст найбільш гідратованої мембрани, через яку не відбувається ніякої дифузії (наприклад, ніякій дифузії активного агента в приймаючу комірку), і складає % Hd для тестованої системи. Це здійснюється побудовою графіка залежності проникності від EWC. Дані про проникність (коефіцієнти дифузії) отримують відповідно до першого закону дифузії Фіка за допомогою рівняння: dQ A P Cd dt 1 25 30 35 40 45 50 55 де dQ/dt позначає потік крізь матеріал мембрани (мкг/год.), який вимірюється за нахилом лінійної частини графіка залежності кумулятивного перенесення від часу; A – площа мембрани 2 2 (см ); P – коефіцієнт проникності мембрани (см /год.), тобто DKd, де D означає дифузивність 2 мембрани (см /год.), а Kd – коефіцієнт розподілу між мембраною і донорним розчином; l – товщина мембрани, яка визначається після закінчення експерименту (см); а C d – концентрація 3 донорного розчину (мкг/см ). Потім можна визначити профіль затримки вивільнення. Готується інша серія полімерних мембран, знову ж таки з різною кількістю зшиваючого реагенту і мономерів. Потім ці мембрани піддають гідратації, але тільки частково, наприклад, до водовмісту, меншого або рівнішого величині % Hd. Частково гідратовані мембрани поміщають у вертикальні скляні кювети з двох відсіків для вимірювання і будують графіки дифузії активної сполуки крізь мембрани залежно від часу. Буферні розчини для донорських і приймаючих комірок вибираються таким чином, щоб вони контактували з частково гідратованими мембранами і додатково їх гідратували приблизно з такою ж швидкістю, з якою вони гідратуватимуться в середовищі доставки. Час між початком досліду з визначення дифузії, тобто додаванням активного агента в донорську комірку, і виявленням фармацевтично ефективної концентрації активного агента в приймаючій комірці і складає час затримки вивільнення для цього поєднання полімеру і початкового відсотка гідратації. Для визначення фізичних розмірів пристрою циліндрової форми визначається загальна кількість активного агента,який необхідно доставити. Вона становить добуток необхідної добової дози на тривалість виділення. У кращих втіленнях тривалість виділення складає щонайменше 2 місяці, краще 6 місяців і аж до 2 років. Необхідна добова доза складає, наприклад, від 10 до 1000 мкг октреотиду на добу, бажано від 20 до 800 мкг октреотиду на добу, краще від 30 до 300 мкг октреотиду на добу. 2 Об'єм циліндрового резервуару (серцевини) пристрою циліндрової форми дорівнює πr i ·h, де ri означає радіус резервуару, а h – його висоту. Формула для стаціонарного вивільнення з циліндра така: [dQ/dt] = [2π·h·D·Kd·Cd]/[ln(ro/ri)] де ro позначає зовнішній радіус циліндрового пристрою, а C d – концентрація препарату в донорському розчині, тобто носієві. Стаціонарне вивільнення відбувається тоді, коли C d підтримується на рівні насичення. Отже, товщина мембрани, необхідна для потрібного безперервного вивільнення, складає ro - ri. Кількість використаного активного агента залежатиме не тільки від необхідної добової дози, але і від того, скільки днів потрібно підтримувати цей рівень дози. Хоча цю кількість можна розрахувати емпірично, проте фактична доза, що виділяється, залежить від будь-яких взаємодій з матеріалами і носієм, якщо він застосовується в пристрої. 10 UA 105496 C2 5 10 15 20 25 30 35 40 45 50 55 Як тільки буде вибраний належний поліуретановий полімер, фахівець в цій галузі зможе встановити якнайкращий метод виготовлення імплантів циліндрової форми для досягнення відповідних характеристик доставки, як описано в даному винаході. Для термопластичного поліуретану можна використовувати прецизійну екструзію і литне пресування для отримання порожнистих трубочок з двома відкритими кінцями і відповідними фізичними розмірами. Резервуар можна вільно наповнити відповідними складами, які містять активні речовини і носії, або заповнити виготовленими заздалегідь гранулами, щоб збільшити до максимуму вміст активних речовин. Для закладення двох відкритих кінців можна використовувати дві виготовлені заздалегідь торцеві заглушки. Операція закладення може виконуватися із застосуванням нагрівання або розчинника або іншого засобу для закладення кінців, бажано на постійно. Для термореактивного поліуретану кращим методом є прецизійне реактивне литне пресування або відливання з центрифугуванням, залежно від механізму затвердіння. Реактивне литне пресування застосовується, якщо затвердіння проводиться за допомогою термообробки, а відливання з центрифугуванням застосовується, якщо затвердіння проводиться за допомогою світлової обробки і/або термообробки. Бажано порожнисті трубочки з одним відкритим кінцем роблять методом відливання з центрифугуванням. Бажано порожнисті трубочки з двома відкритими кінцями роблять методом реактивного литного пресування. Резервуар можна заповнювати таким же чином, як і для термопластичного поліуретану. Бажано для закладення відкритого кінця застосовується заповнення відкритого кінця відповідною композицією термореактивного поліуретану, яку піддають світловій і/або термообробці, яка піддається затвердінню за допомогою світла і/або нагрівання. Краще для закладення відкритого кінця можна використовувати виготовлену заздалегідь торцеву заглушку шляхом накладення відповідної композиції термореактивного поліуретану, яка піддається світловій і/або термообробці, на стик між готовою торцевою заглушкою і відкритим кінцем і затвердіння її за допомогою світла і/або нагрівання або іншого засобу для закладення кінців, бажано на постійно. Тверді активні засоби і необов'язкові наповнювачі можна пресувати у вигляді гранул, щоб збільшити до максимуму завантаження активних інгредієнтів. Перед імплантацією імплантовані композиції, можна необов'язково гідратувати або "примірувати" протягом заданого часу. Примірування може сприяти тому, що активний інгредієнт почне проникати в стінки з гідрогелю і насищати їх і може почати просочуватися з гідрогелю ще до імплантації залежно від тривалості примірування імпланта. Примірований імплант почне виділяти активний інгредієнт практично відразу після імплантації, тому максимальне вивільнення препарату може встановитися незабаром після імплантації. Навпаки, слабке примірування або його відсутність може призвести до того, що активний інгредієнт практично не вивільнятиметься після імплантації якийсь час до того, як відбудеться гідратація імпланта і активний інгредієнт почне виділятися, проте ці характеристики примірування залежать від конкретного складу композиції. Так, винахід передбачає спосіб введення композиції октреотиду з контрольованим вивільненням, що включає імплантацію суб'єктові дегідратованої композиції октреотиду. Залежно від типу активного інгредієнта – гідрофільного або гідрофобного – потрібно вибрати відповідні середовища кондиціонування і примірування. Водні середовища є кращими для гідрофільних активних інгредієнтів, а олійні середовища є кращими для гідрофобних активних інгредієнтів. З іншого боку, деякі імпланти винаходу не потребують примірування перед імплантацією. В деяких випадках примірування покращує доставку активного агента контрольованим чином, але в інших випадках примірування перед імплантацією суб'єктові не впливає на доставку так, щоб це виправдовувало витрати часу і праці, необхідних для примірування імпланта. Гідратуюча рідина, яка використовується при практичному застосуванні винаходу, як правило, це рідина, яка нагадує те середовище, в яке виділятиметься активна сполука, наприклад, рідина організму, стерильна вода, слізна рідина, фізіологічний сольовий розчин, розчин фосфатного буфера тощо. Хоча як гідратуюча рідина застосовуються і інші рідини, крім води, проте ступінь гідратації гідрофільної мембрани позначається як її "водовміст". Примірування і кондиціонування пристроїв доставки ліків включає введення активного інгредієнта (препарату) в полімер, оточуючий резервуар, який запобігає втратам активного інгредієнта до фактичного застосування імпланта. Умови, які використовуються для стадії кондиціонування і примірування, залежать від активного агента, температури і середовища, в якому вони проводяться. В деяких випадках умови кондиціонування і примірування можуть бути однаковими. 11 UA 105496 C2 5 10 15 20 25 30 35 40 45 50 55 60 Стадія кондиціонування і примірування в процесі підготовки пристроїв доставки ліків виконується для того, щоб добитися заданої швидкості вивільнення певного препарату. Стадія кондиціонування і примірування імпланта, який містить гідрофільний препарат, бажано виконується у водному середовищі, краще у фізіологічному розчині. Для гідрофобних препаратів середовище може бути середовищем, схожим на плазму, зокрема циклодекстрин. Операції кондиціонування і примірування виконуються з контролем 3 специфічних факторів, а саме: температури, середовища і тривалості. Фахівець в цій галузі повинен розуміти, що на стадію кондиціонування і примірування пристроїв доставки ліків впливає середовище, в яке буде поміщено пристрій. Наприклад, гістрелінові і налтрексонові імпланти можна кондиціонувати і примірувати у фізіологічному розчині, краще кондиціонувати у фізіологічному розчині з 0,9 % NaCl і примірувати у фізіологічному розчині з 1,8 % NaCl. Температура при кондиціонуванні і приміруванні пристроїв доставки ліків може коливатися в широких межах, але в деяких випадках використовують 37 °C. Тривалість кондиціонування і примірування пристроїв доставки ліків може коливатися від одного дня до декількох тижнів залежно від того, яка швидкість вивільнення потрібна для конкретного імпланта або препарату. Фахівець в цій галузі повинен розуміти, що стадії кондиціонування і примірування імплантів, коли це потрібно, служать для оптимізації швидкості вивільнення препарату, імпланта, що міститься усередині. При цьому скорочення тривалості кондиціонування і примірування пристрою доставки ліків може привести, наприклад, до зниження швидкості вивільнення препарату в порівнянні з аналогічним пристроєм доставки ліків, що піддавався тривалішій стадії кондиціонування і примірування. Проте за відсутності примірування несподівано виявилось, що ефективне вивільнення відбувається протягом тривалішого часу (наприклад, 28 тижнів і більше), а менші концентрації активного інгредієнта в сироватці покращують дію. Температура на стадії кондиціонування і примірування також може вплинути на швидкість вивільнення з тим, що зниження температури веде до зниження швидкості вивільнення препарату, який міститься в пристрої доставки ліків, в порівнянні з аналогічним пристроєм доставки ліків, який піддавався обробці за вищої температури. Аналогічним чином у випадку водних розчинів, які в деяких випадках бажано є сольовими розчинами, вміст NaCl в розчині також визначає те, яка швидкість вивільнення буде у пристрої доставки ліків. Зокрема, зниження вмісту NaCl може призвести до підвищення швидкості вивільнення препарату в порівнянні з пристроєм доставки ліків, який піддавався операції кондиціонування і примірування за вищого вмісту NaCl. Для того, щоб встановити локалізацію імпланта, в пристрій доставки може бути включений рентгеноконтрастний матеріал шляхом введення його в резервуар або при виготовленні торцевої заглушки, яка використовується для закладення картриджа. Композиція даного винаходу може містити фармацевтично прийнятний носій, який може включати, наприклад, суспендуючі середовища, розчинники, водні системи і тверді субстрати або матрикси. Суспендуючі середовища і розчинники, які застосовуються як носії, включають, наприклад, олії, як то силіконову олію (особливо медичну), кукурудзяну олію, рицинову олію, арахісову олію і кунжутну олію; продукти конденсації рицинової олії з етиленоксидом; рідкі ефіри тригліцерилу з низькомолекулярними жирними кислотами; нижчі алканоли; гліколі; і поліалкіленгліколі. Водні системи включають, наприклад, стерильну воду, фізіологічний розчин, декстрозу, декстрозу у воді або фізіологічному розчині тощо. Присутність електролітів у водних системах може зменшити розчинність в них макромолекулярних препаратів. Тверді субстрати або матрикси включають, наприклад, крохмаль, желатин, цукри (наприклад, глюкозу), природну камедь (наприклад, гуміарабік, альгінат натрію), карбоксиметилцелюлозу тощо. У кращому варіанті втілення фармацевтична форма додатково містить від 2 % до 20 %, краще 10 % гідроксипропілцелюлози. Крім того, фармацевтичні форми можуть містити і гідроксипропілцелюлозу, гідроксиетилцелюлозу, метилцелюлозу, натрієву карбоксиметилцелюлозу, модифікований крохмаль або зшитий полівінілпіролідон. Носій також може містити допоміжні речовини, як то консерванти, стабілізуючі, зволожуючі і емульгуючі речовини та ін. У одному втіленні фармацевтична форма даного винаходу містить композицію октреотиду ацетату усередині співполімеру з суміші HEMA і HPMA, бажано 20 % HEMA і 80 % HPMA. Фармацевтична форма може містити, наприклад, від 20 до 150 мг октреотиду, краще від 40 до 90 мг. Форма може додатково містити від 2 до 20 % наповнювачів. Форма також може містити близько 10 % гідроксипропілцелюлози і/або 2 % стеарату магнію. 12 UA 105496 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фармацевтична форма даного винаходу може містити композицію з 50 мг октреотиду усередині співполімеру з суміші HEMA і HPMA, бажано 20 % HEMA і 80 % HPMA. У наступному втіленні форма додатково містить близько 10 % гідроксипропілцелюлози і 2 % стеарату магнію разом з ацетатом октреотиду. Фармацевтична форма даного винаходу може містити і композицію з 83 мг октреотиду усередині співполімеру з суміші HEMA і HPMA, бажано 40 % HEMA і 60 % HPMA. У наступному втіленні форма додатково містить близько 10 % гідроксипропілцелюлози і 2 % стеарату магнію разом з ацетатом октреотиду. Фармацевтична форма також може містити стеаринову кислоту, рослинний стеарин, тальк і діоксид кремнію. Фармацевтична форма даного винаходу також може містити композицію від 20 мг до 150 мг, краще від 40 мг до 90 мг октреотиду в ксерогелі, бажано гідрогелі або полімері на основі поліуретану. Передбачений спосіб лікування захворювань, пов'язаних з гормональними порушеннями. Спосіб може передбачати введення октреотиду і підтримування концентрації октреотиду в плазмі в стаціонарному стані від 0,1 нг/мл до 9 нг/мл протягом тривалого часу, бажано щонайменше 2 місяців, краще близько 6 місяців і аж до 2 років. У кращому варіанті втілення концентрація октреотиду в плазмі в стаціонарному стані складає від 1 нг/мл до 2 нг/мл, краще від 1,2 нг/мл до 1,6 нг/мл, протягом тривалого часу. Гормональні порушення включають, наприклад, акромегалію. Винахід також стосується способів зниження рівня GH шляхом введення октреотиду і підтримування стаціонарної концентрації октреотиду в плазмі від 0,1 нг/мл до 9 нг/мл, від 0,5 нг/мл до 1 нг/мл, від 1 нг/мл до 2 нг/мл або від 1,2 нг/мл до 1,6 нг/мл протягом тривалого часу, бажано щонайменше 2 місяців, краще близько 6 місяців і аж до 2 років. Винахід також стосується способів зниження рівня IGF-1 шляхом введення октреотиду і підтримування стаціонарної концентрації октреотиду в плазмі від 0,1 нг/мл до 9 нг/мл, від 0,5 нг/мл до 1 нг/мл, від 1 нг/мл до 2 нг/мл або від 1,2 нг/мл до 1,6 нг/мл протягом тривалого часу, бажано щонайменше 2 місяців, краще близько 6 місяців і аж до 2 років. Винахід також стосується способів лікування акромегалії, які передбачають введення щонайменше одного імпланта даного винаходу, бажано двох імплантів даного винаходу. У цьому способі кожен введений імплант, може містити від 20 до 150 мг октреотиду, краще від 40 до 90 мг октреотиду, краще близько 50 мг октреотиду, і виділяти терапевтично ефективну кількість октреотиду протягом щонайменше 2 місяців, краще близько 6 місяців і аж до 2 років. Винахід також стосується способів лікування симптомів, пов'язаних з карциноїдними пухлинами і VIP-омами. Даний винахід також охоплює способи лікування важкої діареї і епізодів гіперемії у зв'язку з карциноїдними пухлинами шляхом введення імплантованої композиції октреотиду, яка виділяє терапевтично ефективну кількість октреотиду протягом щонайменше 2 місяців, краще близько 6 місяців і аж до 2 років. Даний винахід також охоплює способи лікування розрідженого проносу у зв'язку з VIP-омами шляхом введення імплантованої композиції октреотиду, яка виділяє терапевтично ефективну кількість октреотиду протягом щонайменше 2 місяців, краще близько 6 місяців і аж до 2 років. Фармакологічні форми даного винаходу проявляють специфічний, бажаний профіль вивільнення, який збільшує до максимуму терапевтичний ефект і при цьому зменшує до мінімуму негативні побічні ефекти імпланта. Бажаний профіль вивільнення може бути описаний в термінах максимальної концентрації препарату або активного агента в плазмі (C max) і концентрації препарату або активного агента в плазмі в стаціонарному стані (C ss). Даний винахід також стосується терапевтичних композицій гідрогелю і октреотиду, з якої після імплантації октреотид виділяється з швидкістю, яка забезпечує і/або підтримує величину Css від 0,1 нг/мл до 9 нг/мл, від 0,5 нг/мл до 1 нг/мл, від 1 нг/мл до 2 нг/мл або від 1,2 нг/мл до 1,6 нг/мл. Наступне втілення складає терапевтична композиція гідрогелю і октреотиду, з якої після імплантації октреотид виділяється з швидкістю від 10 мкг до 1000 мкг на добу протягом тривалого часу, бажано від 20 мкг до 800 мкг на добу, краще від 30 мкг до 300 мкг на добу. Октреотид може виділятися протягом щонайменше 2 місяців, близько 6 місяців або аж до 2 років. Гідрогель може включати полімери на основі метакрилату або полімери на основі поліуретану. Наступне втілення представлене фармакологічною формою з контрольованим вивільненням, яка включає октреотид і гідрофільний полімер і яка забезпечує вивільнення октреотиду з швидкістю від 30 мкг до 250 мкг на добу протягом щонайменше 2 місяців, близько 6 місяців або аж до 2 років in vitro. У деяких втіленнях доставка складає від 100 мкг до 130 мкг на добу. У наступному втіленні гідрофільний полімер фармакологічної форми забезпечує вивільнення октреотиду з середньою швидкістю близько 100 мкг на добу in vitro. Гідрофільний 13 UA 105496 C2 5 10 15 20 25 30 35 40 45 50 55 60 полімер може бути вибраний з поміж полімерів на основі поліуретану і полімерів на основі метакрилату. Наступне втілення даного винаходу представлене фармакологічною формою для імплантації, яка містить октреотид, в якій октреотид міститься в гідрофільному полімері, що забезпечує ефективне вивільнення з неї in vitro не більше 20 % октреотиду за 6 тижнів і близько 60 % октреотиду за 6 місяців. Кількість фармацевтично прийнятного октреотиду (наприклад, різних солей, сольватаційних станів або його пролікарських форм), включеного у фармацевтичну композицію даного винаходу, залежатиме від цілого ряду факторів, зокрема, наприклад, від конкретного октреотиду, потрібного рівня дози, типу і кількості гідрогелю і присутності, типу і кількості інших матеріалів, включених в композицію. Кількість октреотиду або його похідних в композиції залежить від бажаної дози для ефективної доставки препарату, молекулярної ваги і активності сполуки. Фактична кількість використовуваного препарату може залежати від віку пацієнта, його ваги, статі, медичного стану, захворювання або інших медичних критеріїв. Фактична кількість препарату визначається відповідно до його медичного призначення відомими методами. Фармацевтична доза у складі форми запропонованої винаходом може вводитися, наприклад, раз на 6 місяців, що встановлюється лікарем, який проводить лікування. Як правило, октреотид входить до складу імпланта або іншої фармацевтичної композиції в кількості від 20 мг до 150 мг, краще від 40 до 90 мг октреотиду, краще від 50 до 85 мг. Для дорослих добова доза при лікуванні акромегалії зазвичай складає від 300 мкг до 600 мг ® октреотиду з негайним вивільненням на добу (100 мкг або 200 мкг Sandostatin ). Кількість октреотиду в композиції можна вибрати, наприклад, таким чином, щоб вивільнялося від 10 мкг до 1000 мкг на добу протягом тривалого часу, від 20 мкг до 800 мкг на добу або від 30 мкг до 300 мкг на добу. Така швидкість вивільнення підтримує необхідний терапевтичний рівень в крові пацієнта від 0,1 до 9 нг/мл протягом тривалого часу. Гідрогелевий пристрій, в якому міститься октреотид, забезпечує контрольоване вивільнення октреотиду в плазму пацієнта. Гідрогелі, придатні для контролю швидкості вивільнення октреотиду з фармацевтичних композицій даного винаходу, включають полімери з гідрофільних мономерів, зокрема HPMA, HEMA та ін. Такі гідрогелі також здатні запобігти деградації і втратам октреотиду з композиції. Фармацевтична форма даного винаходу може містити ацетат октреотиду усередині гідрофільного співполімеру 2-гідроксиетилметакрилату і гідроксипропілметакрилату. Співполімер фармацевтичної форми може містити, наприклад, 20 % HEMA і 80 % HPMA. З іншого боку, співполімер фармацевтичної форми може містити, наприклад, 40 % HEMA і 60 % HPMA. Розмір, форму і площу поверхні імпланта можна модифікувати так, щоб збільшити або зменшити швидкість вивільнення октреотиду з імпланта. Фармацевтична композиція даного винаходу також може містити допоміжні речовини або наповнювачі, наприклад, речовини, які полегшують ковзання, розчинники, поверхнево-активні речовини (ПАР), розріджувачі, зв'язуючі речовини, зокрема низькотемпературні зв'язуючі, дезинтегруючі речовини і/або змащувальні речовини. Розчинники підвищують швидкість розчинення октреотиду з дозової форми і діють шляхом підвищення розчинності октреотиду. Придатні розчинники включають, наприклад, такі органічні кислоти, як лимонна, фумарова, винна, бурштинова, аскорбінова, оцтова, яблучна, глутарова і адипінова кислота, які можна використовувати кожну окремо або в поєднанні. Ці речовини можна також комбінувати з солями кислот, наприклад, цитрат натрію з лимонною кислотою, отримуючи буферну систему. Інші речовини, які можуть змінювати pH мікрооточення при розчиненні і встановлення терапевтично ефективного профілю концентрації октреотиду в плазмі включають солі неорганічних кислот і гідроксид магнію. Інші речовини, які можна використовувати, – це поверхнево-активні речовини (ПАР) та інші солюбілізуючі речовини. Придатні для застосування у фармацевтичних композиціях даного винаходу ПАР включають, наприклад, лаурилсульфат натрію, поліетиленстеарати, жирнокислотні ефіри поліетиленсорбітану, похідні поліоксиетилену з рициновою олією, алкілові ефіри поліоксиетилену, бензилбензоат, цетримід, цетиловий спирт, докозат натрію, гліцерилмоноолеат, гліцерилмоностеарат, гліцерилпальмітостеарат, лецитин, середньоланцюгові тригліцериди, моноетаноламін, олеїнову кислоту, полоксамер, полівініловий спирт і жирнокислотні ефіри сорбітану. Розріджувачі, придатні для застосування у фармацевтичних композиціях даного винаходу, включають, наприклад, такі фармацевтично прийнятні інертні наповнювачі, як мікрокристалічна целюлоза, лактоза, сахароза, фруктоза, глюкоза, декстроза та інші цукри, двоосновний фосфат кальцію, сульфат кальцію, целюлоза, етилцелюлоза, похідна целюлоза, каолін, манітол, 14 UA 105496 C2 5 10 15 20 25 30 35 40 45 50 55 60 лактитол, мальтитол, ксилітол, сорбітол і інші сахароспирти, сухий крохмаль, сахариди, декстрин, мальтодекстрин та інші полісахариди, інозитол або їх суміші. Розріджувач може бути водорозчинним розріджувачем. Приклади розріджувачів включають, наприклад, мікрокристалічну целюлозу типу Avicel PH112, Avicel PH101 і Avicel PH102 фірми FMC Corporation; лактозу типу моногідрату лактози, безводної лактози і Pharmatose DCL 21; двоосновний фосфат кальцію типу Emcompress фірми Penwest Pharmaceuticals; манітол; крохмаль; сорбітол; сахарозу; і глюкозу. Розріджувачі ретельно вибирають так, щоб вони відповідали конкретній композиції, звертаючи увагу на властивості стиснення. Розріджувач бажано застосовується в кількості від 2 % до 80 % за вагою, краще від 20 % до 50 % маси композиції з контрольованим вивільненням. Речовини, які полегшують ковзання використовуються для поліпшення текучості і здатності до зпресовування інгредієнтів під час обробки. Придатними речовинами, які полегшують ковзання є, наприклад, колоїдний діоксид кремнію – надтонкий плавлений кремнезем, який отримують, наприклад, парофазним гідролізом кремнієвих сполук, таких, наприклад, як тетрахлорид кремнію. Колоїдним діоксидом кремнію є надтонкий аморфний порошок, який комерційно доступний з ряду джерел, включаючи Cabot Corporation (під фірмовою назвою Cab® ® O-Sil ); Degussa, Inc. (під фірмовою назвою Aerosil ); і E.I. DuPont & Co. Колоїдний діоксид кремнію також відомий як колоїдний кремнезем, плавлений кремнезем, легка безводна кремнієва кислота, кремнієвий ангідрид і плавлений діоксид кремнію, серед іншого. У одному ® втіленні речовина, яка полегшує ковзання представлена Aerosil 200. Дезинтегруючі речовини, придатні для застосування у фармацевтичних композиціях даного винаходу, включають, наприклад, крохмаль, крохмальний гліколат натрію, кросповідон, кроскармелозу, мікрокристалічну целюлозу, слабозаміщену гідроксипропілцелюлозу, пектин, співполімер метакрилату калію і дивінілбензолу, полівініловий спирт, тиламід, бікарбонат натрію, карбонат натрію, похідні крохмалю, декстрин, бета-циклодекстрин, похідні декстрину, оксид магнію, глини, бентоніт та їх суміші. Активний інгредієнт даного винаходу можна змішувати з тими наповнювачами, які є фармацевтично прийнятними і сумісними з активним інгредієнтом, в кількості, яка є придатною для застосування в терапевтичних способах, описаних в даному винаході. Різні наповнювачі можна однорідно змішувати з октреотидом даного винаходу, як це повинно бути відомо фахівцям. Наприклад, октреотид можна змішувати або комбінувати з такими наповнювачами, як мікрокристалічна целюлоза, колоїдний діоксид кремнію, лактоза. крохмаль, сорбітол, циклодекстрин та їх поєднання. Змащуючі речовини, придатні для застосування у фармацевтичних композиціях даного винаходу, включають реагенти, які впливають на сипучість пресованого порошку, зокрема ® діоксид кремнію, такий, наприклад, як Aerosil 200, тальк; стеаринова кислота, стеарат магнію, стеарат кальцію, гідрогенізовану рослинну олію, бензоат натрію, хлорид натрію, білий вазелін, лаурилсульфат магнію і гліцерилмоностеарат. Винахід також стосується імплантованих дозових форм з контрольованим вивільненням, які містять ефективну кількість октреотиду в гідрогелі, які при введенні пацієнтові або як складова частина режиму лікування забезпечують профіль вивільнення (терапевтично ефективний рівень октреотиду в плазмі крові) з тривалістю щонайменше 2 місяців, близько 6 місяців або аж до 2 років. Дозові форми даного винаходу можуть включати один або декілька фармацевтично прийнятних наповнювачів. У кращих втіленнях дозова форма повинна містити розріджувач і змащувальну речовину разом з одиницею дози октреотиду і полімером, який контролює швидкість. Для цієї мети придатним наповнювачем є стеарат магнію. При використанні цих матеріалів компонент стеарату магнію може складати від 0,5 до 5 % маси дозової форми (наприклад, близько 2 %), а гідрогель і октреотид складають решту частин форми. Іншим придатним наповнювачем є гідроксипропілцелюлоза. При її використанні компонент гідроксипропілцелюлози може складати від 0,5 до 20 % маси дозової форми (наприклад, близько 10 %), а гідрогель і октреотид складають решту частин форми. У одному втіленні форма включає і стеарат магнію, і гідроксипропілцелюлозу, бажано 2 % стеарату магнію і 10 % гідроксипропілцелюлози, а гідрогель і октреотид складають решту частин форми. Композиції даного винаходу можуть застосовуватися для лікування гормональних захворювань, наприклад, акромегалії або її симптомів, які характеризуються підвищенням рівня GH і IGF-1, шляхом введення пацієнтові імплантованої форми запропонованої даним винаходом. Імплант може вводитися, наприклад, раз на 6 місяців і вивільнятиме терапевтично ефективну кількість октреотиду. Імплантована пацієнту композиція виділяє таку концентрацію 15 UA 105496 C2 5 10 15 20 октреотиду, яка на мінімальному терапевтично ефективному рівні послаблює гормональне порушення, але порівняно меншу, ніж максимальна концентрація, щоб збільшити період спокою для пацієнта протягом дня. Композиції можна вводити суб'єктові в такій дозі і на такий термін, які є достатніми для того, щоб суб'єкт переносив дозу, не проявляючи негативних ефектів, а потім, підвищуючи дозу активного агента, якщо потрібно, через окремі проміжки часу, допоки не буде досягнута терапевтична доза у суб'єкта. Активний засіб можна вводити, наприклад, в дозі від 10 мкг до 1000 мкг, від 20 мкг до 800 мкг або від 30 мкг до 300 мкг октреотиду на добу протягом щонайменше 2 місяців, близько 6 місяців або аж до 2 років. Композиції даного винаходу, в яких октреотид є ацетатом октреотиду, придатні для застосування при лікуванні гормональних захворювань, які характеризуються підвищенням рівня GH і IGF-1, наприклад, акромегалії. Октреотиду ацетат відповідно до винаходу також придатний для лікування симптомів, пов'язаних з карциноїдним синдромом і VIP-омами. Інші особливості і втілення даного винаходу розкриваються на наступних необмежуючих прикладах. ПРИКЛАДИ Приклад 1. Швидкість вивільнення октреотиду in vitro Даний приклад ілюструє підготовку імплантованих форм октреотиду запропонованих даним винаходом і вивільнення з них октреотиду in vitro. У даному дослідженні тестували серію імплантів для визначення стійкості і характеристик вивільнення октреотиду in vitro з форм гідрогелевих впродовж 22 тижнів (№ 146), 28 тижнів (№ 136) і 33 тижнів (решта всіх форм). Кожен імплант містив 50 міліграм октреотиду ацетату і 2 % стеаринової кислоти, але полімерні картриджі містили різну кількість HEMA і HPMA, тому вони проявляли різні значення %EWC, приведені в табл. 1. Таблиця 1 Номер форми 146 145 147 133 144 143 142 136 % HEMA % HPMA % EWC Наповнювачі/інші інгредієнти 0 10 15 20 25 30 35 40 99,5 89,5 84,5 79,5 74,5 69,5 64,5 59,5 22,9 23,4 24,4 25,2 25,6 26,1 26,6 27,6 2 % стеаринової кислоти 2 % стеаринової кислоти 2 % стеаринової кислоти 2 % стеаринової кислоти 2 % стеаринової кислоти 2 % стеаринової кислоти 2 % стеаринової кислоти 2 % стеаринової кислоти 25 30 35 40 45 На Фіг. 2, 3 і 4 представлено вивільнення октреотиду з імплантів протягом доби для кожної з форм, приведених вище. Як видно з Фіг. 2, у форми № 136 початкова швидкість була високою, але порівняно швидко падала. Як видно з Фіг. 3, у форми № 146 початкова швидкість вивільнення була порівняно низькою. На Фіг. 4 представлений профіль вивільнення у форм №№ 145, 147, 133, 144, 143 і 142. Як видно з Фіг. 4, початкова швидкість вивільнення проявляла хорошу залежність від %EWC, складаючи від 20 до 450 мкг на добу для значень %EWC від 22,9 до 27,6 %. Проте виникали проблеми у зв'язку з перепадом осмотичного тиску між імплантом і середовищем вимивання. Щоб стабілізувати фармакологічні форми октреотиду, були розроблені експерименти з використанням наповнювачів, які забезпечують велику стійкість за принципом "бажаної гідратації". Приклад 2. Дослідження фармакологічних форм у телячій сироватці Щоб визначити вплив осмотичного тиску на проблему з набряканням, два імпланта даного винаходу, які відповідають формі № 136 і формі № 143, вимивали в телячій сироватці. Зокрема, тестували форму № 136, яка складається з 40 % HEMA і 60 % HPMA і яка містить октреотиду ацетат з 2 % стеаринової кислоти, і форму № 143, яка складається з 30 % HEMA і 70 % HPMA і суміш, яка містить, з 20 % PEG 3300 і 80 % октреотиду ацетату. Через 3 місяці імпланти мали нормальний вигляд – вони були порівняно рівними і лише злегка набряклими. Приклад 3. Дослідження фармакологічних форм Унаслідок перепаду осмотичного тиску імпланти, описані в Прикладі 1, істотно набрякали, що кінець кінцем приводило до розриву імплантів. У даному прикладі приведені форми, розроблені для скринінгу агентів, які застосовувались для стабілізації імплантів октреотиду. Відстежували ряд імплантів, щоб визначити вплив наповнювача на форму і міцність імпланта. 16 UA 105496 C2 Кожен з полімерних картриджів складався з 28 % HEMA, 66,5 % HPMA і 5 % гліцерину. Усередині містився ацетат октреотиду з різними наповнювачами, приведеними в табл. 2. Таблиця 2 Номер зразка 1 2 3 4 5 6 7 8 9 10 5 10 15 Наповнювачі/інші інгредієнти немає 20 % PEG 3300 40 % PEG 3300 2 % стеаринової кислоти (контроль) 10 % гліколевої кислоти 20 % полімолочної кислоти 10 % манітолу 10 % MCC (мікрокристалічної целюлози) 20 % MCC 10 % кунжутної олії Гідрофобні речовини, такі як кунжутна олія і MCC, відділялися від фармакологічної форми і не забезпечували "кращої гідратації", тому вони були гіршими в контексті даного винаходу. Гідрофільні речовини типу PEG 3300 збільшували перепад осмотичного тиску і підсилювали набрякання. Низькомолекулярні добавки типу манітолу і гліколевої кислоти не забезпечували стабілізуючого ефекту і приводили до зменшення цілісності. Жодна з цих речовин не забезпечувала задовільної стабілізації фармакологічних форм октреотиду. Приклад 4. Дослідження фармакологічних форм і швидкості вивільнення октреотиду in vitro Дане дослідження проводилося для оцінки стійкості октреотиду в гідрогелевих імплантах при використанні різних наповнювачів, приведених в табл. 3. Наповнювачі вибиралися так, щоб вони мали велику молекулярну вагу і деяку гідрофільність. Кожен імплант складався з полімерного картриджа, який складається з 20 % HEMA і 80 % HPMA. Відстежували зовнішній вигляд імплантів у фізіологічному розчині і оцінювали впродовж 9 тижнів. Результати представлені в табл. 3. Таблиця 3 Номер форми 133 133 133 133 133 133 133 133 133 20 25 30 Наповнювачі/інші інгредієнти 20 % декстрану 20 % TPGS (похідного вітаміну E) 20 % HEC (гідроксиетилцелюлози) 20 % HPC (гідроксипропілцелюлози) 20 % Альбуміну 20 % пектину 20 % AcDiSol 20 % Carbopol 2 % SA (стеаринової кислоти) - контроль Зовнішній вигляд імпланта через 8 тижнів (див. ключ внизу) 3 2 3 2 2 2 1,5 1 4 Як видно з Фіг. 5, форма, яка містить декстран мала найвищу швидкість вимивання. Форми, які містять пектин, AcDiSol і Carbopol, проявляли далеко не задовільне вивільнення після 2тижневої гідратації і 9-тижневого вимивання. Відповідно, краще втілення з хорошим стабілізуючим ефектом, поєднанням хорошого вимивання і зовнішнього вигляду, було досягнуто з гідроксипропілцелюлозою. Приклад 5. Дослідження за 1-місячною імплантацією на здоровому собаці Даний приклад ілюструє приготування фармакологічних форм даного винаходу і вивільнення з них октреотиду або його фармацевтично прийнятних солей. Здоровому собаці імплантували один підшкірний імплант октреотиду запропонований даним винаходом. Композиція підшкірного імпланта октреотиду мала водовміст 26,6 % і містила 44 мг ацетату октреотиду. Швидкість вивільнення in vitro складала близько 500 мкг на добу в 1-й тиждень і знижувалася до 300 мкг на добу в 4-й тиждень при загальному вивільненні близько 10 мг октреотиду впродовж всього дослідження. Імплант видаляли через 28 днів після імплантації. 17 UA 105496 C2 5 10 15 20 25 30 35 40 45 50 Використовували імплант завдовжки 3,5 см. Для визначення концентрації октреотиду ацетату, IGF-1 і GH в сироватці брали проби крові (1,5 мл) в дні 0, 1-7, 11, 14, 18, 21, 25 і 28 з яремної вени без анестезії і не натщесерце. Клінічні спостереження показали, що композиція імпланта октреотиду добре переноситься, споживання їжі було в нормі і не спостерігалося аномальної поведінки. Аналізи сироватки показали пік октреотиду ацетату на 4-й день і помітні концентрації октреотиду ацетату у всі досліджувані проміжки часу. Концентрація IGF-1 знижувалася після імплантації аж до 4-го дня, а потім поверталася на початковий рівень на 25-й день. Рівень IGF-1 знижувався на 40-90 % від початкового рівня, як це видно з Фіг. 6. Приклад 6. Дослідження за 6-місячною імплантацією на 6 здорових собаках Даний приклад ілюструє приготування фармакологічних форм даного винаходу і вивільнення з них октреотиду або його фармацевтично прийнятних солей. Шість здорових собак розділяли на 2 групи і імплантували їм один або два підшкірних імпланта октреотиду запропонованих даним винаходом, відповідно. Підшкірні імпланти октреотиду мали водовміст 25,2 % і містили 60 міліграм ацетату октреотиду. Імпланти видаляли через 6 місяців після імплантації. Для визначення концентрації октреотиду ацетату, IGF-1 і GH в сироватці брали проби крові (10 мл) разів на добу в перших 7 днів після імплантації, потім 2 рази на тиждень впродовж 3 тижнів, а потім раз на тиждень до закінчення 6-місячного терміну. За 4 дні до імплантації брали початкові зразки сироватки як контроль. Результати показали, що рівень октреотиду в сироватці складав від 200 до 700 мкг/мл у собак, які отримали один імплант, і від 400 до 1000 мкг/мл у собак, які отримали два імпланта. Рівень IGF-1 знижувався на цілих 90 % в обох дослідних групах, як це видно з Фіг. 7 і 8. Вимірювання рівня GH в сироватці припинили після першого місяця дослідження, оскільки рівень GH виявився дуже низьким для виявлення ще більшого зниження. Клінічні спостереження показали, що композиція імпланта октреотиду добре переноситься, споживання їжі було в нормі і не спостерігалося аномальної поведінки. Приклад 7. Дослідження 6-місячної імплантації на людях Даний приклад ілюструє приготування фармакологічних форм даного винаходу і вивільнення з них октреотиду або його фармацевтично прийнятних солей. Проводилося 6місячне дослідження 11 хворих на акромегалію. Імплантували підшкірно один або два імпланти даного винаходу 11 хворим з діагнозом акромегалії, яких раніше лікували комерційно доступним препаратом октреотиду LAR. Вимірювали рівні GH і IGF-1 в початковому стані і кожен місяць після цього впродовж 6 місяців. Кожен імплант містив приблизно 60 мг октреотиду ацетату в співполімері з 20 % HEMA і 79,5 % HPMA із значенням EWC близько 25,2 %. Використовувалися імпланти завдовжки 44 мм в сухому стані і 50 мм в гідратованому стані. Діаметр імплантів складав 2,8 мм в сухому стані і 3,5-3,6 мм в гідратованому стані. Імпланти піддавали гідратації протягом 1 тижня перед імплантацією. Контрольна область значень для GH складає до 2,5 мг/л, незалежно від віку. У табл. 4 приведені рівні GH в міліграмах/л впродовж 6 місяців після імплантації імплантів октреотиду даного винаходу. Пацієнт № 11 не брав участь в дослідженні, оскільки він не задовольняв критеріям відбору. Видно, що на 6-й місяць у 89 % суб'єктів було відмічено нормалізацію рівня гормону росту. Контрольна область значень для IGF-1 складає: (i) у віці 17-24 років – 180-780 нг/мл; (ii)) у віці 25-39 років – 114-400 нг/мл; (iii)) у віці 40-54 років – 90-360 нг/мл; і (iv)) більше 54 років – 70290 нг/мл. У табл. 5 приведені рівні IGF-1 в нг/л впродовж 6 місяців після імплантації імплантів октреотиду даного винаходу. Видно, що на 6-й місяць у 22 % суб'єктів було відмічено нормалізацію рівня IGF-1. На Фіг. 9A і 9B представлене порівняння імпланта октреотиду даного винаходу з комерційно доступною формою октреотиду ацетату. Ефективність імпланта опинилася принаймні не гіршою, ніж у комерційно доступної форми октреотиду LAR. Терапевтичний ефект цих імплантів успішно зберігався впродовж всіх 6 місяців дослідження. 18 UA 105496 C2 Таблиця 4 Візит 2 Візит 3 Візит 4 Візит 5 Візит 6 Візит 7 Рівень Візит 1 (1-й міс) (2-й міс) (3-й міс) (4-й міс) (5-й міс) (6-й міс) К-ть GH при (введення) Пацієнт Вік Рівень Рівень Рівень Рівень Рівень Рівень імплантів відборі Рівень GH GH GH GH GH GH GH (мг/л) (мг/л) (мг/л) (мг/л) (мг/л) (мг/л) (мг/л) (мг/л) 001 39 1 26,0 16,3 0,9 1,5 1,1 1,1 1,1 2,1 002 38 2 17,8 20,7 1,4 0,2 0,3 0,2 0,3 0,48 003 49 1 67,0 55,0 2,8 3,1 3,3 5,0 5,3 5,8 004 47 2 7,9 7,0 2,6 3,8 2,8 3,7 4,0 2,4 005 43 1 10,8 11,0 2,2 1,8 2,2 1,6 2,2 1,3 006 43 1 1,7 1,7 1,8 2,3 1,9 1,7 1,8 1,9 007 30 2 23,3 21,8 2,4 2,2 2,9 2,0 1,1 0,51 008 58 2 1,9 3,2 0,1 0,1 2,0 0,1 0,6 0,11 009 47 2 14,9 14,1 1,4 0,9 1,5 1,1 1,4 1,4 010 78 1 4,0 5,2 0,4 0,2 0,5 0,2 0,3 1,0 012 40 2 21,1 27,8 13,5 13,7 14 11,9 8,9 13,1 Середнє значення: 16,7 2,7 2,7 3,0 2,6 2,7 2,7 Таблиця 5 Рівень Візит 1 Візит 2 Візит 3 Візит 4 Візит 5 Візит 6 Візит 7 IGF-1 К-ть (введення) (1-й міс) (2-й міс) (3-й міс) (4-й міс) (5-й міс) (6-й міс) Пацієнт Вік при імплантів IGF-1 IGF-1 IGF-1 IGF-1 IGF-1 IGF-1 IGF-1 відборі (нг/мл) (нг/мл) (нг/мл) (нг/мл) (нг/мл) (нг/мл) (нг/мл) (нг/мл) 001 39 1 1500 1500 820 600 900 880 790 750 002 38 2 1700 1300 210 180 190 170 130 230 003 49 1 1100 1200 610 550 750 660 850 660 004 47 2 1700 1800 1100 1200 1200 1100 910 990 005 43 1 1100 1000 450 510 480 600 490 430 006 43 1 520 580 470 430 440 480 440 460 007 30 2 1900 1700 440 560 560 600 430 520 008 58 2 1700 1200 220 240 170 260 160 240 009 47 2 2200 1800 590 830 950 930 1100 1100 010 78 1 590 490 270 260 230 310 220 350 012 40 2 1600 1600 1300 1500 1400 1700 1500 1400 Середнє значення: 1288 589 624 661 699 602 648 5 10 15 Рівень IGF-1 знижувався у всіх пацієнтів, при нормалізації у 2 пацієнтів. Зниження спостерігалося вже через 1 місяць терапії, а середній рівень IGF-1 зберігався впродовж наступних 5 місяців. У 8 з 9 пацієнтів можна було провести порівняння із зниженням, що спостерігалося раніше при лікуванні комерційно доступною формою октреотиду LAR. У 6 з 8 пацієнтів відсоток зниження IGF-1 при імпланті опинився більше, ніж при лікуванні комерційно доступною формою октреотиду LAR, тоді як у 2 він був меншим. Після 6 місяців лікування за допомогою імпланта рівень GH у 3 пацієнтів становив 1,5 рази більший від норми); 4) інші лабораторні аналізи, які дослідник або спонсор вважатимуть клінічно значущими; 5) пацієнти з нестабільною стенокардією, стійкою шлуночковою аритмією, серцевою недостатністю (NYHA III і IV) або історією гострого інфаркту міокарду за 3 місяці до відбору; 6) пацієнти з симптомами жовчнокам'яної хвороби; 7) пацієнти з історією зловживання лікарськими засобами або алкоголем за 6 місяців до відбору; 8) пацієнти, які отримували досліджуваний препарат за 1 місяць до відбору; 9) пацієнти, які отримували радіотерапію з приводу пухлини гіпофіза у будь-який час перед відбором; 10) пацієнти, які припинили лікування октреотидом внаслідок проблем неперенесення або неефективності. Визначали рівень октреотиду в сироватці (див. графіки на Фіг. 13 і 14). Ефективність модуляції концентрації цитокіну після введення імпланта октреотиду, в сухому вигляді або після гідратації, представлена на Фіг. 15, 16 і 17. Приклад 11. Лікування пухлин за допомогою октреотиду ® Sandostatin LAR Depot, як вказано на етикетці FDA (повний зміст якої включено як посилання), є дозовою формою тривалої дії, яка складається з мікросфер полімеру крохмалю і глюкози, здатного до біологічного розкладення, співполімеру D, L-молочної і гліколевої кислоти, які містять октреотид. Вона містить всі клінічні і фармакологічні характеристики дозової форми з негайним вивільненням Sandostatin® (октреотиду ацетат) для ін'єкцій на додачу до сповільненого вивільнення октреотиду за місцем ін'єкції, що зменшує необхідність частого введення. Таке сповільнене вивільнення відбувається у процесі біологічного розкладення ® полімеру, головним чином шляхом гідролізу. Sandostatin LAR Depot призначається для внутрішньом'язових ін'єкцій (у сідниці) раз на 4 тижні. Октреотид надає фармакологічну дію, аналогічну до природного гормону – соматостатину. Він є ще сильнішим інгібітором гормону росту, глюкагону і інсуліну, ніж соматостатин. Подібно до соматостатину, він також пригнічує реакцію LH на GNRH, зменшує спланхнічний кровоток та інгібує вивільнення серотоніну, гастрину, вазоактивного інтестинального пептиду, секретину, мотиліну і панкреатичного поліпептиду. Виходячи із такої фармакологічної дії октреотид застосовувався для лікування симптомів, пов'язаних, наприклад, з метастатичними карциноїдними пухлинами (гіперемії і діареї) і аденомами, які секретують вазоактивний інтестинальний пептид (VIP) (рідкої діареї). Октреотид істотно знижує і у багатьох випадках нормалізує рівень гормону росту і/або IGF-1 (соматомедину C) у хворих на акромегалію. Одноразові дози Sandostatin® для ін'єкцій при підшкірному введенні, як виявилось, пригнічують скорочуваність жовчного міхура і зменшують секрецію жовчі у нормальних добровольців. Фармакокінетика у хворих на акромегалію дещо відрізняється від такої у здорових добровольців. Середня максимальна концентрація в 2,8 нг/мл (при дозі в 100 мкг) досягається через 0,7 год. після введення. Об'єм розподілу (Vdss) складає 21,6±8,5 л, а загальний кліренс в організмі зростав до 18 л/год. Середній вміст зв'язаного препарату складав 41,2 %. Напівперіоди ліквідації і елімінації були близькими до норми. Лікування цих пухлин, як правило, включає хірургію як першочергову терапію. При невдалій операції пацієнтам зазвичай вводять октреотид для ін'єкцій (типу S-LAR). Хіміотерапія також може виявитися корисною, як це буває у 30 % пацієнтів. Пацієнтів з карциноїдними пухлинами лікували 6 дозами S-LAR в 10, 20 або 30 мг при внутрішньом'язовому введенні раз на 4 тижні. Концентрації в сироватці склали 1,2, 2,5 і 4,2 нг/мл. Стаціонарний стан досягався після двох доз в 20 або 30 мг і після 3 доз в 10 мг. 22 UA 105496 C2 5 10 15 20 25 30 35 40 45 Лікування за допомогою S-LAR призводило до зниження частоти дефекації до 2–2,5 разів на день, зменшенню середнього числа епізодів гіперемії до 0,5–1 разів на день і зниженню медіани 24-годинного рівня 5-HIAA в сечі на 38-50 %. Слід зазначити, що за всі 6 місяців випробування у 50-70 % пацієнтів, які пройшли випробування, було потрібні додаткові ін'єкції Sandostatin, щоб припинити погіршення симптомів. Хоча даний винахід і було описано достатньо детально відносно деяких кращих його втілень, проте можливі і інші варіанти. Тому сутність і обсяг приведеної формули винаходу, не слід обмежувати описом і кращими варіантами, які містяться в даному описі. ФОРМУЛА ВИНАХОДУ 1. Спосіб доставки октреотиду суб'єктові з профілем вивільнення практично нульового порядку протягом тривалого часу, але не менше 6 місяців, при цьому суб'єктом є ссавець, окрім собак, а спосіб передбачає підшкірну імплантацію суб'єктові щонайменше одного імплантованого пристрою, причому даний щонайменше один імплантований пристрій включає композицію, яка містить 84 мг октреотиду ацетату, 9,5 мг гідроксипропілцелюлози та 2 мг стеарату магнію, а композиція розміщена в гідрофільному полімері, виготовленому полімеризацією суміші, що містить 40 % НЕМА, 59,5 % НРМА, 0,5 % ТМРТМА та 1 % вітаміну Е TPGS, і при цьому пристрій, який при цьому імплантується, імплантується в сухому стані так, щоб суб'єкт протягом щонайменше 6 місяців отримував в перерахунку на добову дозу таку кількість октреотиду, яка є ефективною для лікування суб'єкта, але дає меншу концентрацію октреотиду в сироватці в порівнянні з імплантацією імплантованого пристрою, в гідратованому стані. 2. Спосіб за п. 1, який відрізняється тим, що суб'єкт страждає на захворювання або розлад, що реагує на октреотид. 3. Спосіб за п. 1, який відрізняється тим, що суб'єкт страждає на розлад гормону GH або IGF-1 або його симптоми. 4. Спосіб за п. 3, який відрізняється тим, що розлад гормону GH або IGF-1 є акромегалією. 5. Спосіб за п. 1, який відрізняється тим, що суб'єкт отримує октреотид з середньою швидкістю близько 250 мкг на добу протягом 6 місяців. 6. Спосіб за п. 1, який відрізняється тим, що суб'єкт страждає на захворювання, вибране з групи, до складу якої входить карциноїдний синдром, VIP-оми, нейроендокринні пухлини, проліферативна діабетична ретинопатія, червоні вугри, панкреатит, шлунково-кишкові кровотечі, свищі підшлункової залози і кишкові свищі, базедова хвороба (офтальмопатія Грейвса), глаукома і симптоми, пов'язані з хіміотерапією або СНІДом. 7. Імплантований пристрій, який включає композицію з контрольованим вивільненням, яка містить 84 мг октреотиду ацетату, 9,5 мг гідроксипропілцелюлози та 2 мг стеарату магнію, яка міцно розміщена в полімері на основі метакрилату, виготовленому полімеризацією суміші, що містить 40 % НЕМА, 59,5 % НРМА, 0,5 % ТМРТМА та 1 % вітаміну Е TPGS, і пристрій, який при цьому імплантується, виділяє октреотид для суб'єкта з профілем вивільнення практично нульового порядку протягом тривалого часу, але не менше 6 місяців, а суб'єктом є ссавець, окрім собак, причому імплантований пристрій імплантується суб'єктові в сухому стані. 8. Імплантований пристрій за п. 7, який відрізняється тим, що при імплантації суб'єктові імплантованого пристрою суб'єкт отримує октреотид з середньою швидкістю близько 250 мкг на добу протягом 6 місяців. 9. Імплантований пристрій за п. 1, який відрізняється тим, що розміри імплантованого пристрою складають 3,4 мм х 43 мм. 10. Імплантований пристрій за п. 7, який відрізняється тим, що розміри імплантованого пристрою складають 3,4 мм х 43 мм. 23 UA 105496 C2 24 UA 105496 C2 25 UA 105496 C2 26 UA 105496 C2 27 UA 105496 C2 28
ДивитисяДодаткова інформація
Назва патенту англійськоюDelivery of dry formulations of octreotide
Автори англійськоюKuzma, Petr, Decker, Stefanie
Автори російськоюКузма Петр
МПК / Мітки
МПК: A61K 47/32, A61K 38/31, A61K 47/34, A61K 38/08, A61P 5/08, A61K 9/00, A61M 31/00
Мітки: октреотиду, сухими, формами, доставка, фармакологічними
Код посилання
<a href="https://ua.patents.su/35-105496-dostavka-oktreotidu-sukhimi-farmakologichnimi-formami.html" target="_blank" rel="follow" title="База патентів України">Доставка октреотиду сухими фармакологічними формами</a>
Попередній патент: Ліганд, корисний для лікування захворювань, пов’язаних з msrv
Наступний патент: Спосіб одержання n-алкіл (мет)акриламідів
Випадковий патент: Надпровідний пристрій для запам'ятовування