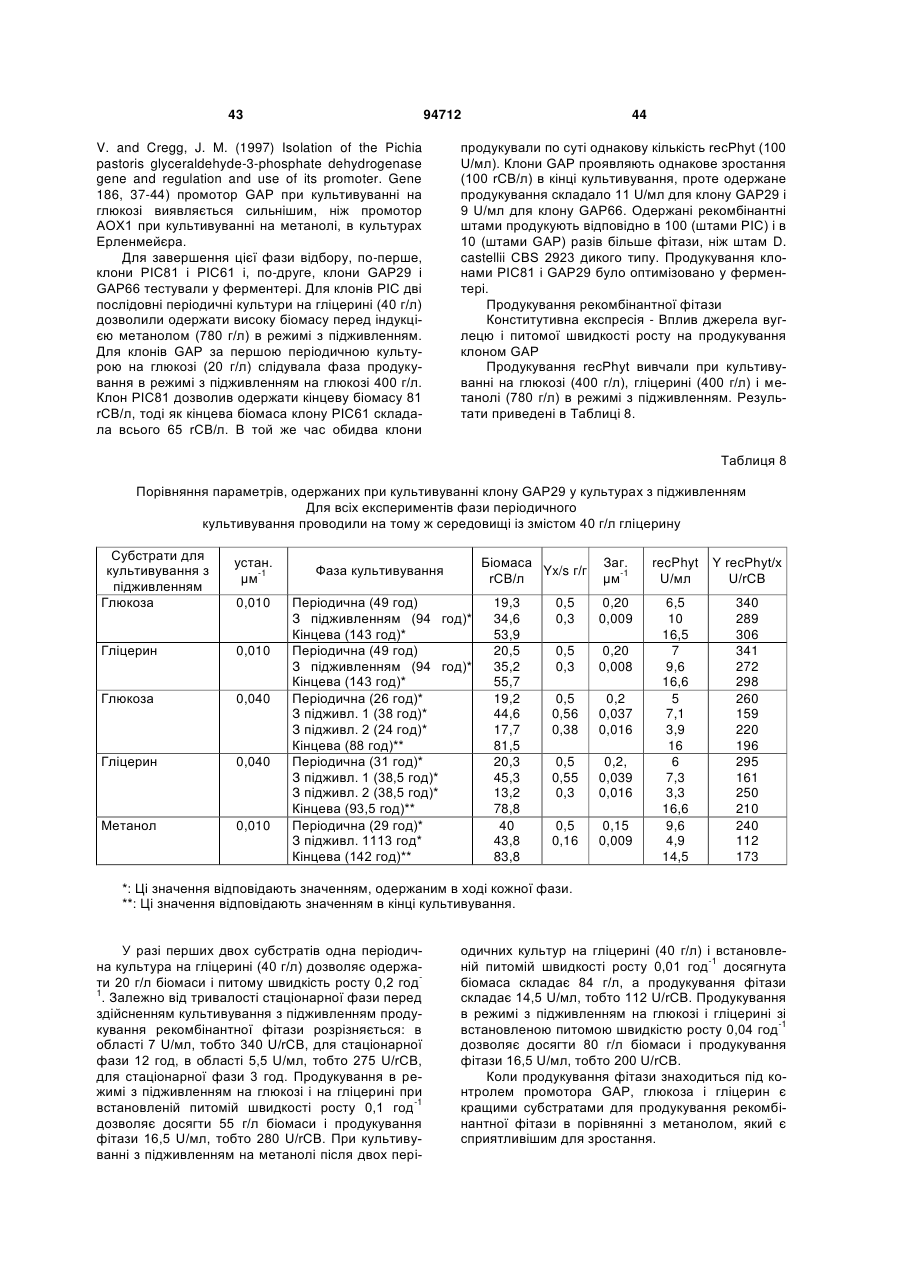
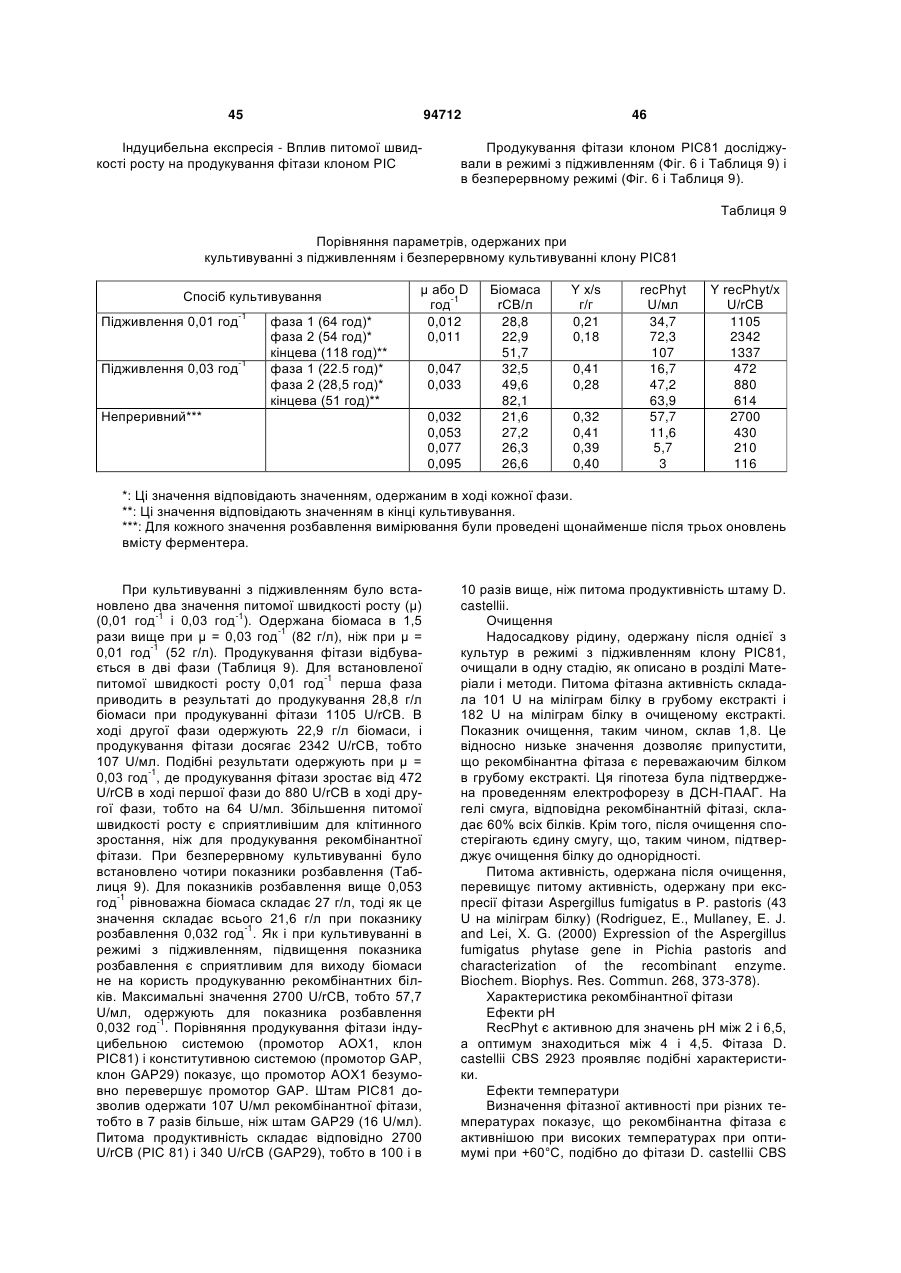
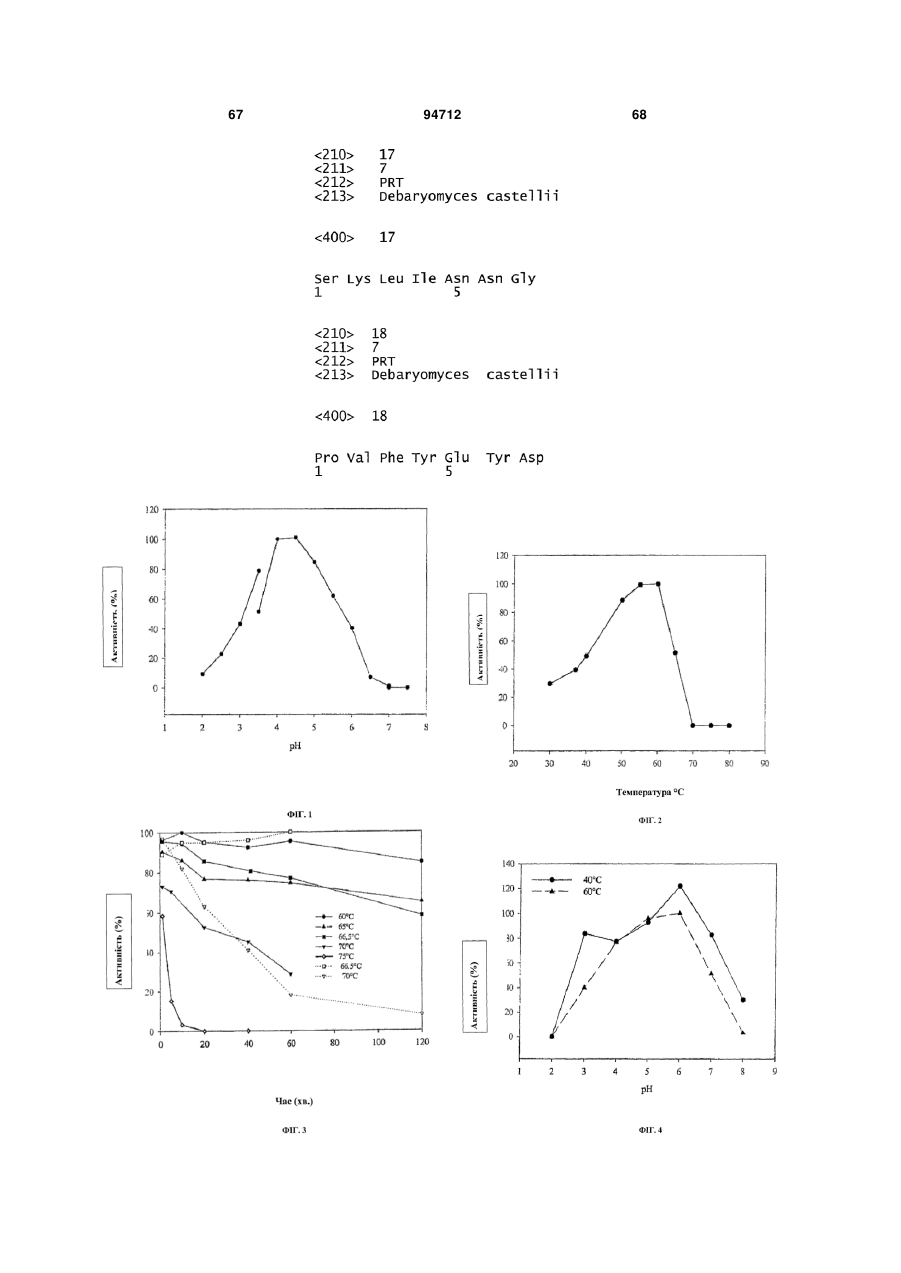
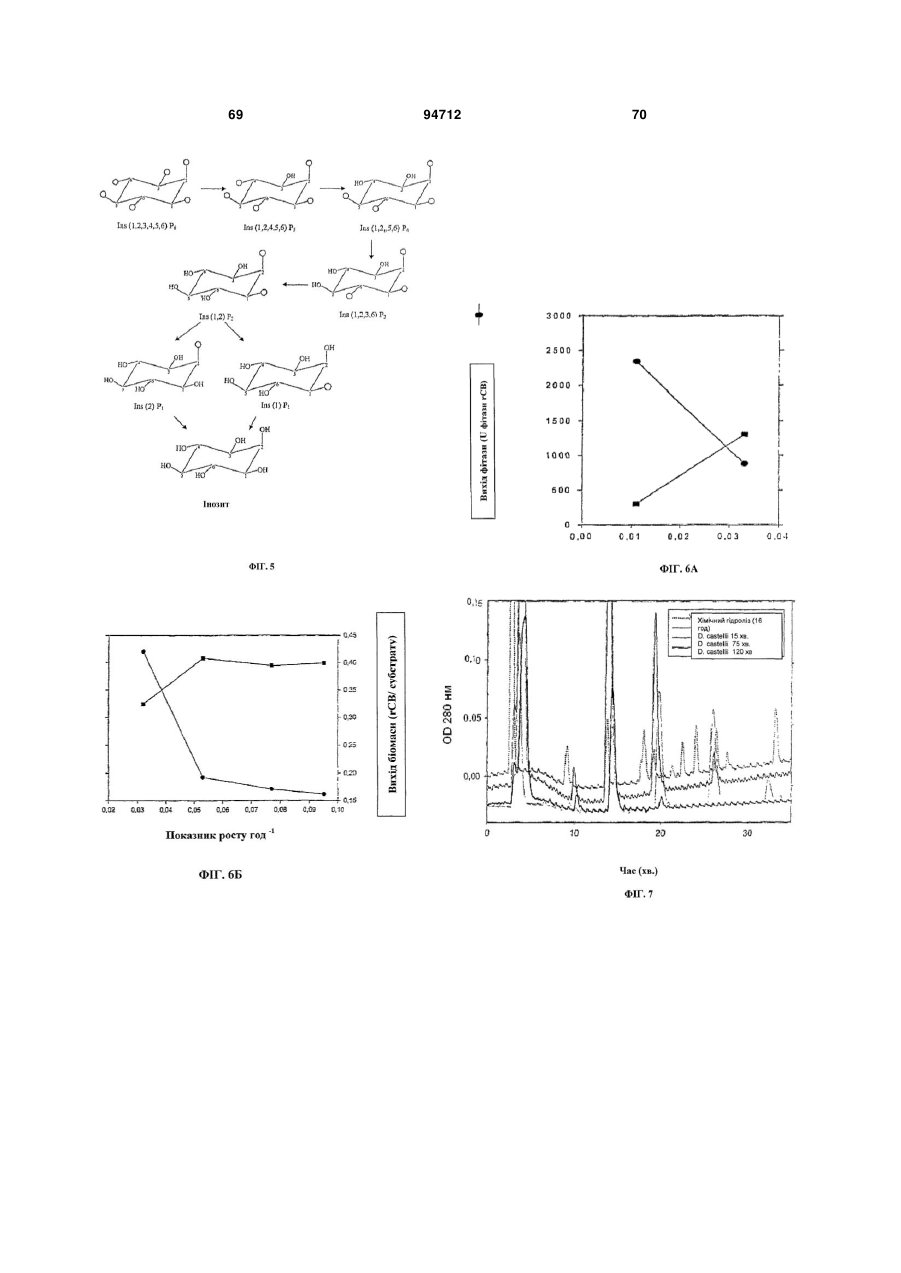
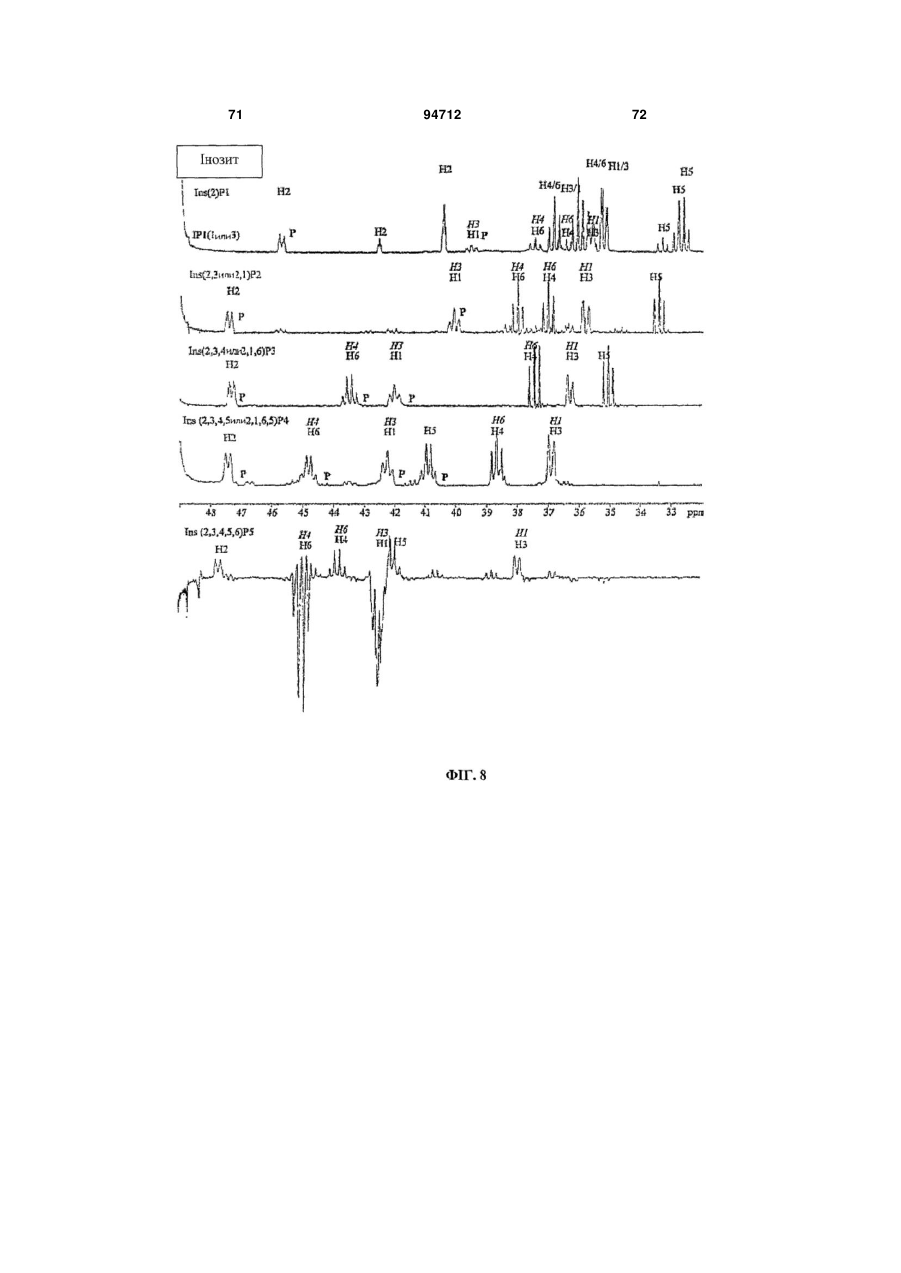
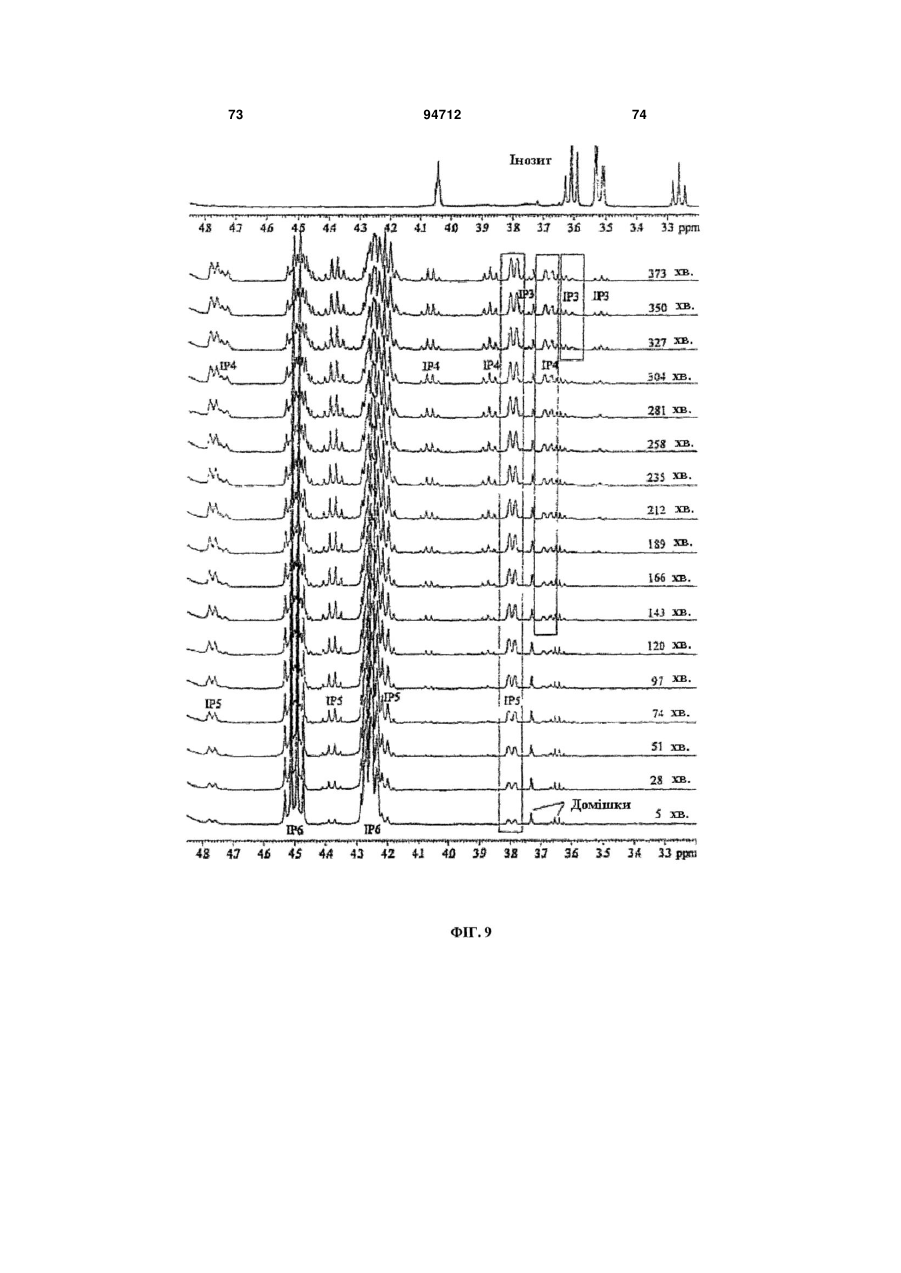
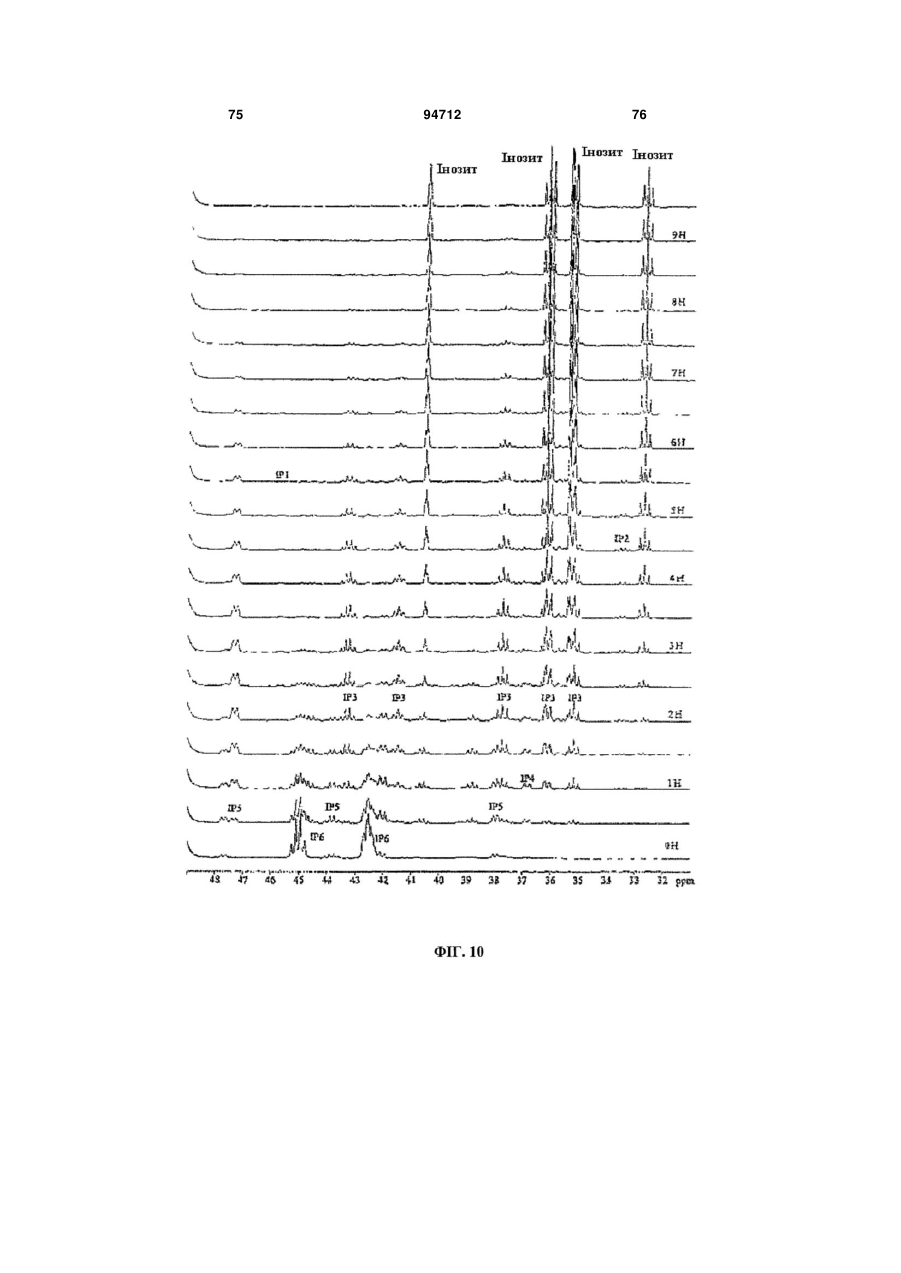
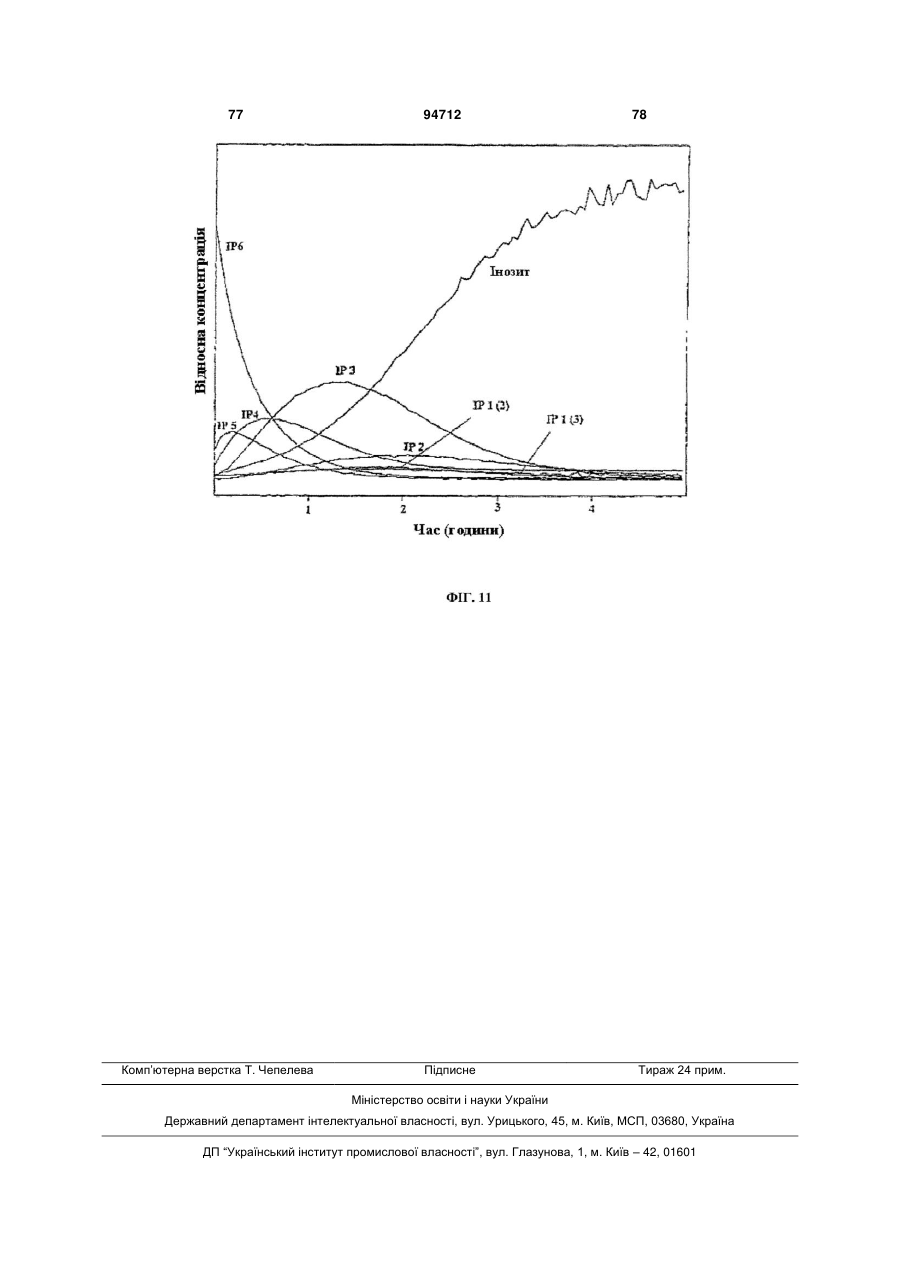
Фітаза debaryomyces castellii
Формула / Реферат
1. Поліпептид, який відрізняється тим, що він включає поліпептид, вибраний з наведених нижче поліпептидів:
поліпептиду SEQ ID No. 2;
фрагмента поліпептиду SEQ ID No. 2, що має фітазну активність;
поліпептиду, що має фітазну активність і що проявляє щонайменше 90 % ідентичності з поліпептидом SEQ ID No. 2.
2. Полінуклеотид, що кодує фітазну активність, який відрізняється тим, що він вибраний з наведених нижче полінуклеотидів:
полінуклеотиду, послідовність якого знаходиться між положенням 1538 і положенням 2923 SEQ ID No. 1;
полінуклеотиду, що кодує поліпептид за п. 1.
3. Полінуклеотид, який відрізняється тим, що він має послідовність SEQ ID No. 1 або послідовність, комплементарну SEQ ID No. 1.
4. Експресійна касета, яка відрізняється тим, що вона містить у напрямі транскрипції:
промотор, який є функціональним в організмі-хазяїні;
полінуклеотид за п. 2; і
термінаторну послідовність, функціональну в тому ж організмі-хазяїні.
5. Вектор, що містить полінуклеотид за будь-яким із пп. 2 і 3 та/або експресійну касету за п. 4.
6. Спосіб інтеграційного перетворення організму-хазяїна в даний організм-хазяїн
принаймні одного полінуклеотиду за пп. 2 та 3;
експресійної касети за п. 4 або
вектора за п. 5, даний організм-хазяїн є Pichia pastoris.
7. Кормова добавка для тварин, яка відрізняється тим, що вона містить поліпептид за п. 1.
8. Кормова добавка для тварин, яка відрізняється тим, що вона містить організм-хазяїн, отриманий способом за п. 6, та/або ферментаційне сусло організму-хазяїна, отриманого способом за п. 6.
9. Кормова добавка для тварин за будь-яким із пп. 7 і 8, яка відрізняється тим, що вона знаходиться в рідкій формі або в порошкоподібній формі.
10. Корм для тварин, який відрізняється тим, що він містить кормову базу для тварин і кормову добавку для тварин за одним із пп. 7-9.
11. Корм для тварин, який відрізняється тим, що містить поліпептид за п. 1, організм-хазяїн, одержаний згідно зі способом за п. 6, та/або ферментаційне сусло, організму-хазяїна, одержаного згідно зі способом за п. 6.
12. Застосування поліпептиду за п. 1 або організму-хазяїна, одержаного згідно зі способом за п. 6, для виготовлення кормової добавки для тварин або корму для тварин.
13. Застосування поліпептиду за п. 1 або організму-хазяїна, одержаного згідно зі способом за п. 6, для гідролізу міоінозитгексакисфосфату до неорганічного монофосфату, до міоінозиту з нижчим ступенем фосфорилування і до вільного міоінозиту.
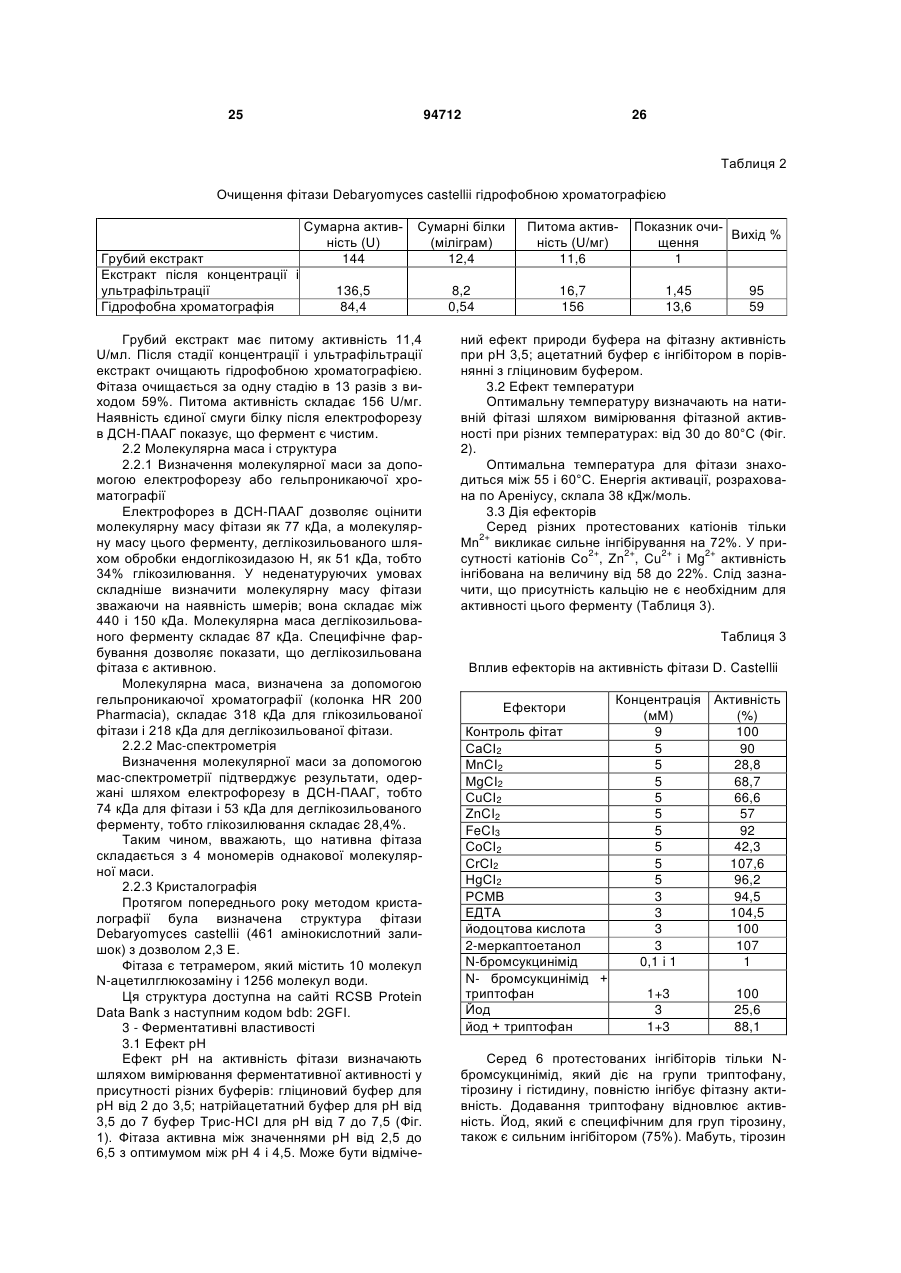
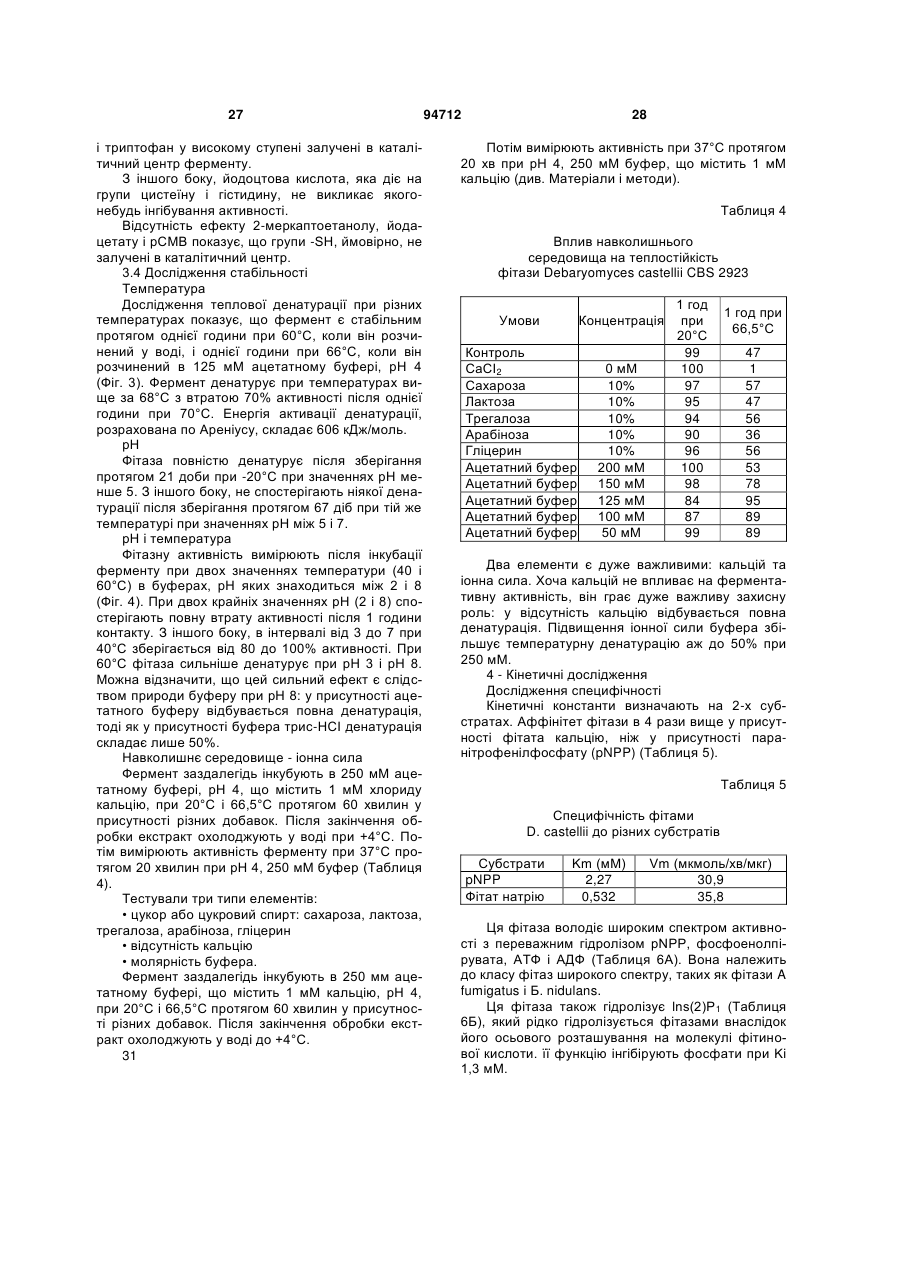
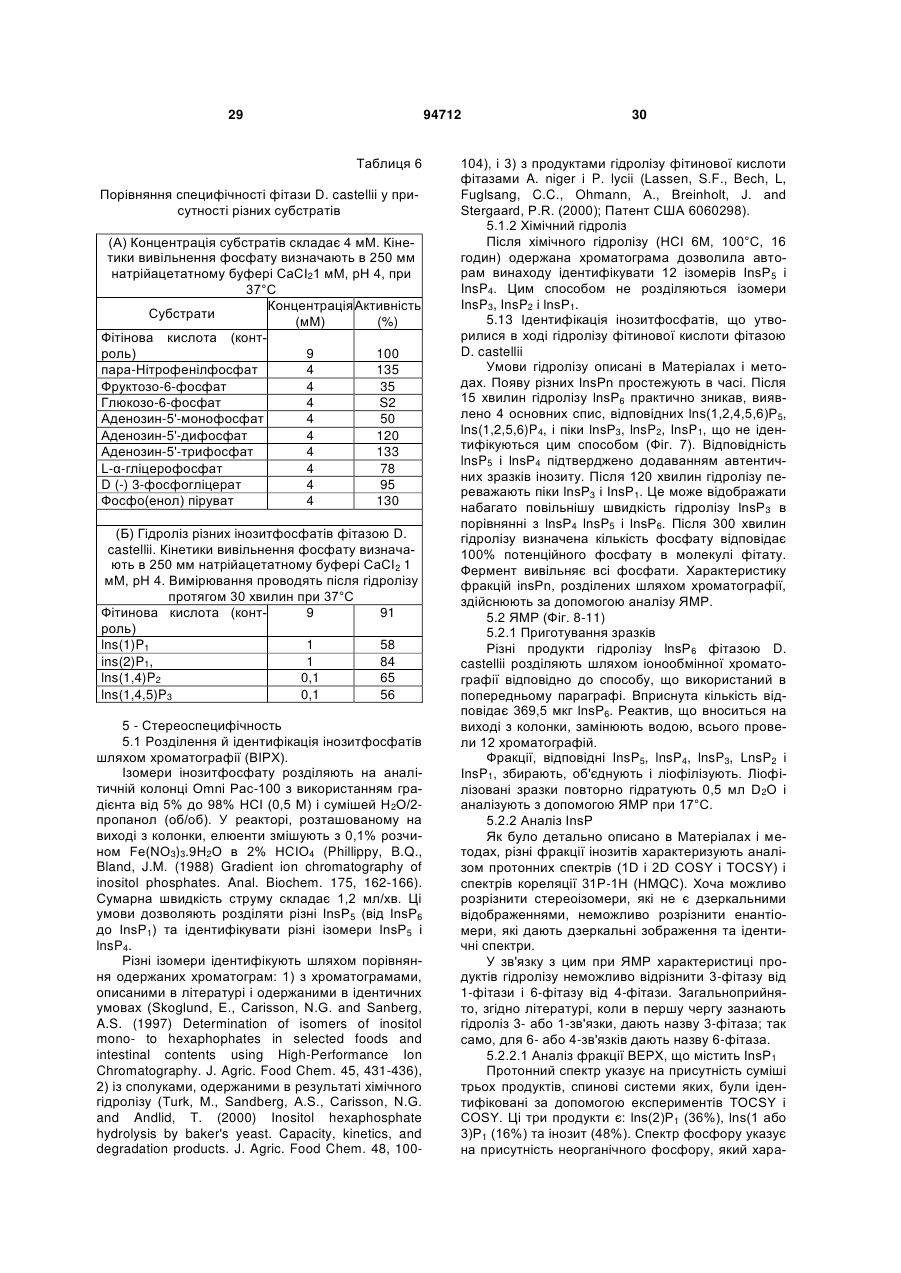
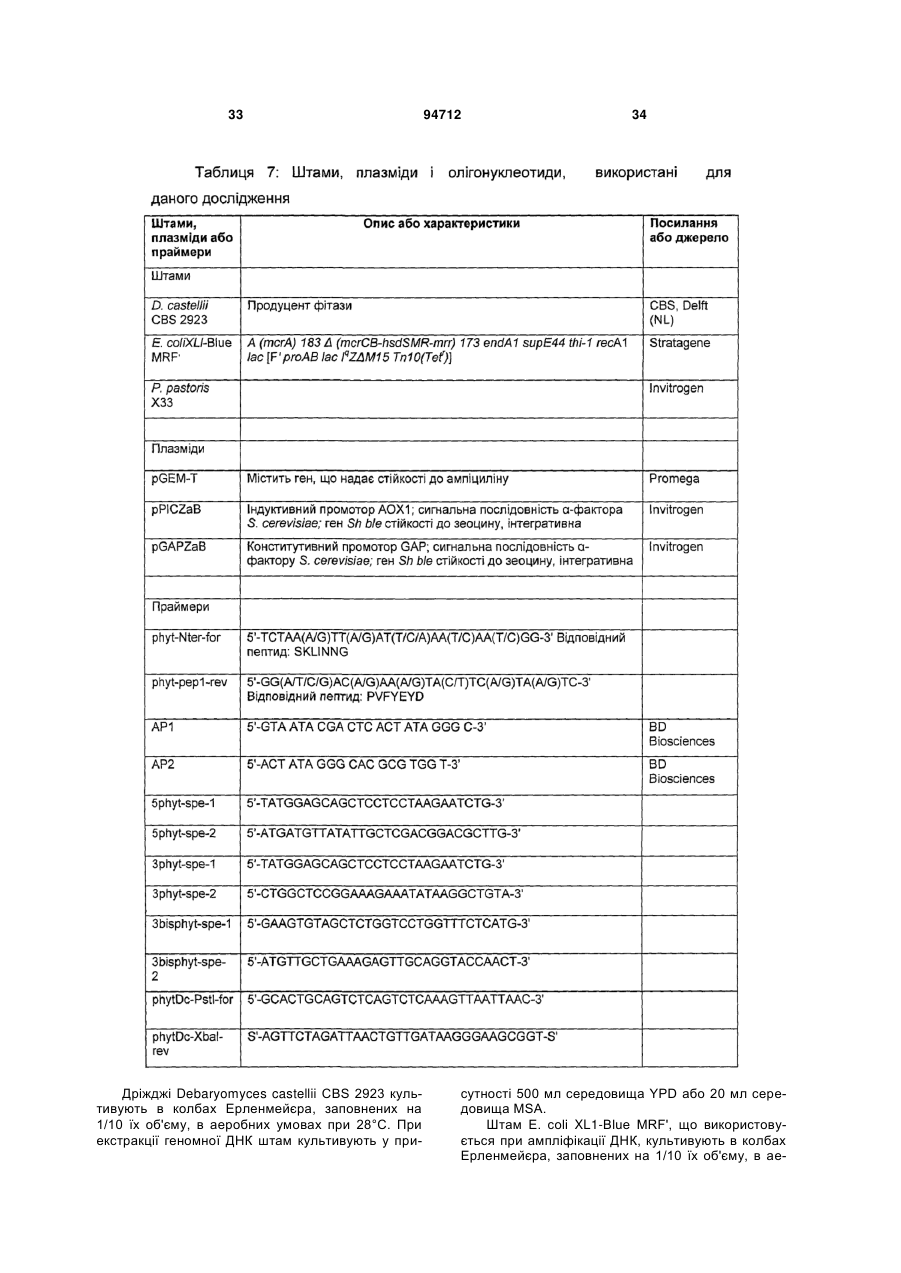
Текст
1. Поліпептид, який відрізняється тим, що він включає поліпептид, вибраний з наведених нижче поліпептидів: поліпептиду SEQ ID No. 2; 2 (19) 1 3 94712 4 11. Корм для тварин, який відрізняється тим, що містить поліпептид за п.1, організм-хазяїн, одержаний згідно зі способом за п.6, та/або ферментаційне сусло, організму-хазяїна, одержаного згідно зі способом за п.6. 12. Застосування поліпептиду за п.1 або організму-хазяїна, одержаного згідно зі способом за п.6, для виготовлення кормової добавки для тварин або корму для тварин. 13. Застосування поліпептиду за п.1 або організму-хазяїна, одержаного згідно зі способом за п.6, для гідролізу міоінозитгексакисфосфату до неорганічного монофосфату, до міоінозиту з нижчим ступенем фосфорилування і до вільного міоінозиту. Винахід відноситься до фітази Debaryomyces castellii, до кодуючого цю фітазу гену, до рекомбінантних організмів-господарів, які експресують цю фітазу, а також до її застосувань, зокрема, в області живлення тварин. Солі фітинової кислоти (міоінозитгексакисфосфат), або фітати (міоінозитгексакис(дигідрофосфат)), є основною формою запасання фосфору в злакових, овочевих і олійних рослинах. Таким чином, вони складають основне джерело фосфору в кормах для тварин на рослинній основі, основної складової раціону тварин з однокамерним шлунком (свійської птиці і свиней). Проте біодоступність цього фосфору у складі кормів є обмеженою для даних тварин. Це пов'язано з тим, що вони не володіють кишковими ферментами, які розщеплюють фітати, в достатній кількості, що дає можливість гідролізу фітатів і, отже, забезпечення тих кількостей неорганічного фосфату, яких вони потребують. Таким чином, дві властивості фітинової кислоти грають важливу роль в контексті живлення тварин: 1) тварини з однокамерним шлунком володіють слабкою здатністю до розщеплювання фітинової кислоти в їх травній системі; 2) фітинова кислота є чинником, що знижує живильну цінність, утворюючи комплекси з 3+ 2+ 2+ 2+ білками та іонами (Fe , Ca , Zn , Mg ) і, таким чином, знижуючи доступність цих елементів. Таким чином, живильні раціони свійської птиці і свиней необхідно забезпечувати неорганічним фосфатом, тоді як фосфор з фітатів виводиться і сприяє евтрофікації поверхневих вод в областях інтенсивного розведення домашніх тварин з однокамерним шлунком. Забезпечення раціонів живлення тварин з однокамерним шлунком ферментами є рішення, вживане в даний час для поліпшення біодоступності фосфору, пов'язаного з фітатами, і для зменшення додавання до кормів неорганічного фосфату і, таким чином, скорочення виведення фосфору в областях інтенсивного тваринництва. Фітази (міоінозитгексакисфосфат-3- і 6фосфогідролази ЄС 3.1.3.8 і 3.1.3.26) складають частину сімейства кислих гістидинових фосфатаз. Вони каталізують гідроліз міоінозитгексакисфосфату (фітинової кислоти lnsP6) до неорганічного монофосфату і міоінозитфосфату з нижчим ступенем фосфорилювання (від lnsP5 до InsP1), а в деяких випадках до вільного міоінозиту. При використанні в якості кормової добавки для тварин ці ферменти дають можливість, поперше, підвищити доступність фітинового фосфору і, по-друге, поліпшити переварюваність кормів. Крім того, вивільнення фітинового фосфату значно знижує витрати за рахунок забезпечення фосфату, а також забруднення, викликане надлишком фосфатів, що виводяться. Фітази продукуються широким рядом організмів: рослинами, тваринами і особливо мікроорганізмами. Серед мікроорганізмів, що продукують фітази, слід згадати, зокрема: гриби родів Aspergillus, РеnісіІІіum, Мuсоr і Rhizopus; бактерії: Pseudomonas sp., Klebsiella sp., Escherichia coll, Enterobacter sp., Bacillus subtilis і дріжджі: Saccharomyces cerevisiae, Candida tropicalis, Torulopsis Candida, Debaryomyces castellii, Debaryomyces occidentalis, Kluyveromyces fragilis і Schwanniomyces castellii. Відносно дріжджів групою авторів Lambrechts et al. (Biotechnology Letters, Vol. 14, no. 1, 61-66, 1992) ідентифіковані різні штами, що володіють фітазною активністю, проте відповідні фітази не були охарактеризовані. Найвища активність зміряна для штаму CBS 2863 Schwanniomyces castellii. Фітазні активності спостерігали також для Candida brumptii CBS 6145, С. tropicalis CBS 5696, Debaryomyces castellii CBS 2923, Kluyveromyces fragilis № 111, K. fragilis CBS 1555, K. fragilis CBS 5795, Saccharomyces cerevisiae CBS 1253, Schwanniomyces castellii CBS 2863, Torulopsis Candida CBS 940, С melibiosica CBS 584, K. lactis CBS 2359, T. bovina CBS 2760 і Zygosaccharomyces fermentati CBS 6772. Так само, групою авторів Nakamura Yoshihiro et al. (Biosci. Biotechnol. Biochem., Vol. 64, no. 4, 841-844, 2000) ідентифіковані різні фітази, але вони не охарактеризовані. Слід також відзначити, що класифікація дріжджів була переглянута. Відповідно до нової класифікації (Nakase Т., Suzuki M., Phaff H.J. and Kurtzman СР., 1998, p 157-167 in С. P. Kurtzman and J.W. Fell (ed), The Yeasts, A taxonomic study, 4th Edition, Elsevier Sci. Publication Amsterdam) штам CBS 2923 відповідає Debaryomyces castellii Capriotti, а штам CBS 2863 відповідає Debaryomyces occidentalis Klocker var. occidentalis; синоніми Schwanniomyces castellii Capriotti і Schwanniomyces occidentalis Klocker. Автори винаходу показали, що вирівнювання послідовності 5 поліпептиду SEQ ID No. 2, тобто послідовності фітази Debaryomyces castellii CBS2923, дає відсоток ідентичності 69,2% з послідовністю фітази Schwanniomyces occidentalis CBS2863. Численні фітази мікроорганізмів вже досліджені і знайшли застосування в різних агропромислових областях. Проте зростаюче застосування фітаз як добавка в різних біотехнологічних застосуваннях, таких як, наприклад, корма для тварин, підвищує перевагу: 1) виділення нових ефективних мікроорганізмів, що продукують фітази; 2) отримання ефективних фітаз, тобто фітаз, які є ефективними при вивільненні фосфатів з корму в травному тракті, які проявляють термостійкість в процесі виготовлення кормів і при зберіганні, і для яких виробничі витрати є низькими. Крім того, більшість фітаз, описаних до теперішнього часу, лише частково гідролізує фітиновую кислоту, а деякі з дуже повільною кінетикою. Більш того, їх гідролітична активність значною мірою залежить від умов їх застосування. В даний час серед дріжджів тільки для фітази дріжджів Schwanniomyces occidentalis описано, що вона гідролізує всі фосфатні групи фітата (ЕР 0699762 і Segueilha L, Lambrechts C, Boze H., Moulin G. and Galzy P. (1992) Purification and properties of a phytase from Schwanniomyces castellii, J. Ferm. Bioeng., 74, 7-11). Проте фітаза Schwanniomyces occidentalis чутлива до катіонів (зокрема ZnCl2 і CuCI2), що не є сприятливим для використання в кормах для тварин, оскільки ці катіони присутні в харчовій грудці (Segueilha et al., 1992). Крім того, цей фермент активний в інтервалі рН від 2,7 до 5 (ЕР 0699762), і рСМВ сильно інгібірує активність фітази Schwanniomyces occidentalis, що дозволяє припустити, що групи SH (дисульфідні містки) залучені в активний центр цього ферменту (Segueilha et al., 1992). Крім того, біосинтез цієї фітази вимагає присутності фітатів і солей кальцію (ЕР 0699762). Таким чином, активність цього ферменту сильно залежить від навколишнього середовища, в якому він знаходиться. Завдання, яке слід вирішити в даному винаході, полягає в розробці фітази, яка гідролізує всі фосфатні групи фітата, і активність якої мало залежить від умов застосування ферменту. Це завдання вирішено за рахунок фітази SEQ ID No. 2. Перевага цієї фітази полягає в тому, що вона здатна гідролізувати всі фосфатні групи фітата аж до вивільнення міоінозиту. Вона також володіє широким спектром активності і, отже, гідролізує різні субстрати. Переважно біосинтез цієї фітази індукується фітатами навіть у відсутність солей кальцію. Переважно ця фітаза активна в розширеному інтервалі рН (рН 3-6,5) і нечутлива до катіонів або рСМВ. Цей фермент також є термостійким аж до 66°С. Таким чином, фермент за даним винаходом є вельми надійним, що є сприятливим для його застосування в кормах для тварин, а також в інших промислових застосуваннях. Даний винахід також відноситься до подібних або гомологічних фітаз, до варіантів і фрагментів фітази SEQ ID No. 2, що зберігають ті ж властивості. Опис послідовностей 94712 6 SEQ ID No. 1: Геномна послідовність гену фітази Debaryomyces castellii CBS 2923. SEQ ID No. 2: Послідовність фітази Debaryomyces castellii CBS 2923. SEQ ID No. 3: Узгоджена послідовність кислих фосфатаз. SEQ ID No. 4: Мотив фітази Debaryomyces castellii, відповідний узгодженій послідовності кислих фосфатаз SEQ ID No. 3. SEQ ID Nos. 5-16: Праймери клонування. SEQ ID Nos. 17-18: Пептиди фітази Debaryomyces castellii, використані для клонування гену. Опис винаходу Об'єктом винаходу є поліпептиди, що включають поліпептид, вибраний з приведених нижче поліпептидів: • поліпептиду SEQ ID No. 2 • фрагмента поліпептиду SEQ ID No. 2, що володіє фітазною активністю • поліпептиду, що володіє фітазною активністю і що проявляє щонайменше 90% ідентичності з поліпептидом SEQ ID No. 2. Об'єктом винаходу є також полінуклеотиди, що кодують фітазну активність, вибрані з приведених нижче полінуклеотидів: • полінуклеотиду, послідовність якого знаходиться між положенням 1538 і положенням 2923 SEQ ID No. 1 • полінуклеотиду, що кодує поліпептид за п.1 формули винаходу. Винахід також відноситься до полінуклеотидів, що мають послідовність SEQ ID No. 1 або послідовність, комплементарну SEQ ID No. 1. Винахід також відноситься до експресійних касет, що містять у напрямі транскрипції: • промотор, який є функціональним в організмі-господарі; • полінуклеотид за винаходом і • послідовність термінатора в тому ж організмігосподарі. Винахід також відноситься до векторів, що містять полінуклеотид за винаходом та/або експресійну касету за винаходом. Іншим об'єктом даного винаходу є організмгосподар, трансформований полінуклеотидом за винаходом, експресійною касетою за винаходом та/або вектором за винаходом. Переважно організм-господар вибраний з дріжджів і міцеліальних грибів. Переважно організм-господар вибраний їх Debaryomyces castellii, Pichia pastoris, Penicillium funiculosum і Schizosaccharomyces pombe. Об'єктом винаходу є кормові добавки для тварин, що містять поліпептид за винаходом. Об'єктом винаходу також є кормові добавки для тварин, що містять організм-господар за винаходом та/або сусло, ферментації організмугосподаря, за винаходом. У одному втіленні винаходу кормова добавка для тварин знаходиться в рідкій формі або в порошкоподібній формі. Винахід відноситься до кормів для тварин, що містять кормову базу для тварин і кормову добавку для тварин за винаходом. 7 Винахід також відноситься до кормів для тварин, що містять поліпептид за винаходом, організм-господар за винаходом та/або сусло, ферментації організму-господаря, за винаходом. Винахід також відноситься до застосування поліпептиду за винаходом або організмугосподаря за винаходом для виготовлення кормової добавки для тварин або корму для тварин. Іншим об'єктом даного винаходу є застосування поліпептиду за винаходом або організмугосподаря за винаходом для гідролізу міоінозитгексакисфосфату до неорганічного монофосфату, до міоінозита з нижчим ступенем фосфорилювання і до вільного міоінозиту. Поліпептиди Даний винахід, таким чином, відноситься до поліпептидів, що володіють фітазною активністю. Переважно ці поліпептиди виділяють з Debaryomyces castellii. Фітаза Debaryomyces castellii CBS 2923 представлена в SEQ ID No.2. Під терміном "фітаза" слід мати на увазі міоінозитгексакисфосфат-3 і 6-фосфогідролази (ЄС 3.1.3.8 і 3.1.3.26). Ці ферменти каталізують гідроліз міоінозитгексакисфосфату (фітинової кислоти lnsP6) до неорганічного монофосфату і до міоінозитфосфату з нижчим ступенем фосфорилювання (від lnsP5 до InsP1), а також для деяких фітаз до вільного міоінозиту. Фітаза Debaryomyces castellii SEQ ID No. 2 є 3фітазою. Крім того, вона володіє примітною здатністю здійснювати гідроліз всіх фосфатних зв'язків фітинової кислоти. Фітаза SEQ ID No. 2 містить мотив RHGERYP (SEQ ID No. 4), відповідний узгодженій послідовності RHGXRXP (SEQ ID No. 3), присутній в активному центрі багатьох кислих фосфатаз. Цей мотив знаходиться при амінокислотах 72-78 SEQ ID No. 2. Фітаза SEQ ID No. 2 також має мотив HD, присутній в багатьох фітазах. Цей мотив знаходиться в С-концевій ділянці при амінокислотах 335-336 SEQ ID No. 2. У переважному втіленні винаходу поліпептиди за винаходом мають мотив RHGERYP або інший мотив, відповідний узгодженій послідовності RHGXRXP. Переважно поліпептиди за винаходом також мають мотив HD. У переважному втіленні поліпептиди за винаходом є глікозильованими. Поліпептид SEQ ID No. 2, зокрема, має передбачувані сайти Nглікозилювання при амінокислотах Asn 97, Asn 158, Asn 189, Asn 249, Asn 303, Asn 314, Asn 387, Asn 439 і Asn 453, а також два передбачувані сайти О-глікозилювання при амінокислотах Thr 165, Ser 168, Thr 360 і Ser 364. У переважному втіленні поліпептид SEQ ID No. 2 глікозильований при одному або більше ніж одному з цих передбачуваних сайтів N-глікозилювання і О-глікозилювання. У одному втіленні поліпептиди за винаходом глікозильовані. Фітаза SEQ ID No. 2 містить також 8 залишків цистеїну, здатних утворити 4 дисульфідних містка: Cys 62, Cys 214, Cys 262, Cys 275, Cys 385, Cys 405, Cys 413 і Cys 435. У одному втіленні поліпеп 94712 8 тиди за винаходом несуть щонайменше один дисульфідний місток. Фітаза Debaryomyces castellii є ферментом, що секретується цим видом дріжджів в позаклітинне середовище. Для експресії і секреції рекомбінантним організмом-господарем фітаза SEQ ID No. 2 може злитися при її N-кінці з сигнальним пептидом, що розпізнається цим організмом-господарем. Винахід також відноситься до фрагментів поліпептиду SEQ ID No. 2, які зберігають фітазну активність. Термін "фрагмент" поліпептиду позначає поліпептид, що містить частину поліпептиду, але не повнорозмірний поліпептид, від якого він утворений. Таким чином, винахід відноситься до поліпептиду, що містить фрагмент щонайменше з 100, 200, 300 або 400 амінокислот поліпептиду SEQ ID No. 2. Цей фрагмент поліпептиду SEQ ID No. 2 зберігає фітазну активність. Таким чином, винахід відноситься до біологічно активних фрагментів поліпептиду SEQ ID No.2. Термін "біологічно активний фрагмент" позначає фрагмент поліпептиду, який зберігає функцію поліпептиду, від якого він утворений. Біологічно активні фрагменти поліпептиду SEQ ID No. 2, таким чином, зберігають каталітичні властивості фітази Debaryomyces castellii SEQ ID No. 2. Способи отримання фрагментів поліпептиду, а також методики вимірювання фітазної активності добре відомі фахівцям в даній області техніки. Об'єктом винаходу є поліпептиди, що володіють фітазною активністю і що проявляють щонайменше 90% ідентичності з поліпептидом SEQ ID No. 2. Об'єктом винаходу також є поліпептиди, що проявляють щонайменше 80%, 90%, 95%, 98% і переважно щонайменше 99% ідентичності з поліпептидом SEQ ID No. 2. Переважно ці поліпептиди володіють такими ж властивостями, зокрема, такими ж каталітичними властивостями, що і поліпептиди SEQ ID No. 2. Переважно ці поліпептиди виділяють з інших штамів Debaryomyces castellii або з інших дріжджів. Альтернативно ці поліпептиди можуть бути одержані, наприклад, за допомогою методик сайтспрямованого мутагенезу. Під терміном "ідентичні амінокислоти" слід мати на увазі амінокислоти, які не варіюють між двома послідовностями. Ці поліпептиди можуть проявляти делецію, додавання або заміну щонайменше однієї амінокислоти в порівнянні з поліпептидом SEQ ID No. 2. Об'єктом винаходу також є поліпептиди, що проявляють щонайменше 80%, 90%, 95%, 98% і переважно щонайменше 99% подібності поліпептиду SEQ ID No. 2. Переважно ці поліпептиди володіють такими ж властивостями, зокрема, такими ж каталітичними властивостями, що і поліпептиди SEQ ID No. 2. Переважно ці поліпептиди виділяють з інших штамів Debaryomyces castellii або з інших дріжджів. Крім того, ці поліпептиди можуть бути одержані, наприклад, за допомогою методик сайт-спрямованого мутагенезу. 9 Під терміном "подібність" слід мати на увазі ступінь схожості між послідовностями білків або нуклеїнових кислот. Ці поліпептиди можуть проявляти делецію, додавання або заміну щонайменше однієї амінокислоти в порівнянні з поліпептидом SEQ ID No. 2. Ступінь подібності між двома послідовностями, що кількісно визначається балом, базується на відсотку ідентичності та/або консервативних замін цих послідовностей. Способи вимірювання та/або ідентифікації ступеня ідентичності і ступеня подібності між поліпептидами відомі фахівцям в даній області техніки. Наприклад, можна використовувати програму вирівнювання Vector NTi 9.1.0, AlignX (алгоритм Clustal W) (Invitrogen INFORMAX http://www.invitrogen.com). Переважно використовують параметри за замовчуванням. Поліпептиди за винаходом виділяють або очищають з їхнього природного навколишнього середовища. Ці поліпептиди можуть бути одержані різними способами. Ці способи, зокрема, полягають в очищенні з природних джерел, таких як клітини, природно експресуючі ці поліпептиди, в продукуванні рекомбінантних поліпептидів відповідними клітинами-господарями з подальшим їх очищенням, в отриманні за допомогою хімічного синтезу або, нарешті, в поєднанні цих різних підходів. Ці різні способи отримання добре відомі фахівцям в даній області техніки. Таким чином, фітази за даним винаходом можна виділити з Debaryomyces castellii. У іншому втіленні фітази за даним винаходом виділяють з рекомбінантних організмів-господарів, що експресують фітазу за винаходом. Об'єктом винаходу є злиті білки, рекомбінантні білки або химерні білки, що містять поліпептиди за винаходом. Термін "поліпептид" також позначає білки і модифіковані поліпептиди. Поліпептиди за даним винаходом володіють фітазною активністю. Переважно ці поліпептиди проявляють активність 3-фітази і володіють здатністю гідролізувати всі фосфатні зв'язки фітинової кислоти. Полінуклеотиди Винахід також відноситься до полінуклеотидів, що кодують фітазу за винаходом. Переважно ці полінуклеотиди кодують фітазу Debaryomyces castellii SEQ ID No. 2. Відповідно до даного винаходу під терміном "полінуклеотид" слід мати на увазі однонитковий нуклеотидний ланцюг, або комплементарний їй ланцюг, або двонитковий нуклеотидний ланцюг, які можуть бути ланцюгами ДНК-типу або РНК-типу. Переважно полінуклеотиди за винаходом є полінуклеотидами ДНК-типу, зокрема, типу двониткової ДНК. Термін "полінуклеотид" також позначає модифіковані полінуклеотиди. Полінуклеотиди за даним винаходом виділяють або очищають з їхнього природного навколишнього середовища. Переважно полінуклеотиди за даним винаходом можуть бути одержані за допомогою загальноприйнятих методик молекулярної біології, як описано в Sambrook et al. (Molecular Cloning: A Laboratory Manual, 1989), або шляхом хімічного синтезу. 94712 10 У першому втіленні винахід відноситься до полінуклеотиду, послідовність якого знаходиться між положенням 1538 і положенням 2923 SEQ ID No. 1. Цей полінуклеотид кодує фітазу Debaryomyces castellii SEQ ID No. 2. Винахід також відноситься до полінуклеотидів, що проявляють щонайменше 80%, 85%, 90%, 95%, 98% і переважно щонайменше 99% ідентичності з полінуклеотидом, послідовність якого знаходиться між положенням 1538 і положенням 2923 SEQ ID No. 1. Ці полінуклеотиди кодують фітазну активність. Переважно ці полінуклеотиди кодують фітазу Debaryomyces castellii. Підтерміном "ідентичні нуклеотиди" слід мати на увазі нуклеотиди, які не варіюють між двома послідовностями. Ці полінуклеотиди можуть проявляти делецію, додавання або заміну щонайменше одного нуклеотида в порівнянні з початковим полінуклеотидом. Винахід також відноситься до полінуклеотидів, що проявляють щонайменше 70%, 75%, 80%, 85%, 90%, 95%, 98% і переважно щонайменше 99% подібності полінуклеотиду, послідовність якого знаходиться між положенням 1538 і положенням 2923 SEQ ID No. 1. Ці полінуклеотиди кодують фітазну активність. Переважно ці полінуклеотиди кодують фітазу Debaryomyces castellii. Під терміном "подібність" слід мати на увазі ступінь схожості між послідовностями білків або нуклеїнових кислот. Ці полінуклеотиди можуть проявляти делецію, додавання або заміну щонайменше одного нуклеотиду в порівнянні з початковим полінуклеотидом. Ступінь подібності між двома послідовностями, що кількісно визначається балом, заснований на відсотку ідентичності та/або консервативних замін цих послідовностей. Способи вимірювання та ідентифікації ступеня ідентичності і ступеня подібності між послідовностями нуклеїнових кислот добре відомі фахівцям в даній області техніки. Наприклад, можна використовувати програму вирівнювання Vector NTi 9.1.0, AlignX (алгоритм Clustal W) (Invitrogen INFORMAX http://www.invitrogen.com). Переважно використовують параметри за замовчуванням. Переважно полінуклеотиди проявляють ступінь ідентичності або ступінь подібності з початковим полінуклеотидом, при якій зберігається функція початкової послідовності. У даному випадку полінуклеотиди кодують фітазну активність. Винахід також відноситься до полінуклеотидів, здатних до виборчої гібридизації з полінуклеотидом, послідовність якого знаходиться між положенням 1538 і положенням 2923 SEQ ID No. 1. Переважно цю виборчу гібридизацію проводять в умовах середньої жВРЗткості, переважніше в умовах високої жВРЗткості. Під виразом "послідовність, здатна до виборчої гібридизації" відповідно до винаходу слід мати на увазі послідовності, які гібридизуються з початковою послідовністю на рівні, що значно перевищує фоновий шум. Рівень сигналу, що утворюється взаємодією між послідовністю, здібною до виборчої гібридизації, і початковими послідовностями, є звичайно в 10 разів, переважно в 100 разів інтенсивнішим, ніж сигнал взаємодії інших послі 11 довностей ДНК, створюючий фоновий шум. ЖВРЗткі умови гібридизації, що дають можливість виборчої гібридизації, добре відомі фахівцям в даній області техніки. Як правило, температура гібридизації і відмивання щонайменше на 5°С нижче, ніж точка плавлення початкової послідовності при даному рН і для даної іонної сили. Типово температура гібридизації складає щонайменше 30°С для полінуклеотиду з 15-50 нуклеотидів і щонайменше 60°С для полінуклеотиду більше ніж з 50 основ. Наприклад, гібридизацію проводять в наступному буфері: 6 × SSC, 50 мМ Трис-НСІ (рН 7,5), 1 мМ ЕДТА, 0,02% ПВП (полівінілпіролідон), 0,02% фікол, 0,02% БСА (бичачий сироватковий альбумін), 500 мкг/мл денатурованої ДНК сперми лосося. Відмивання, наприклад, проводять послідовно при низькій жВРЗткості в буфері 2 × SSC, 0,1% ДСН, при середній жВРЗткості в буфері 0,5х SSC, 0,1% ДСН і при високій жВРЗткості в буфері 0,1 × SSC, 0,1% ДСН. Зрозуміло, гібридизацію можна проводити відповідно до інших звичайних способів, добре відомих фахівцям в даній області техніки (див., зокрема, Sambrook et al., Molecular Cloning: A Laboratory Manual, 1989). Переважно полінуклеотиди, які вибірково гібридизуютея з початковим полінуклеотидом, зберігають функцію початкової послідовності. У даному випадку полінуклеотиди, які вибірково гібридизуютея з полінуклеотидом, послідовність якого знаходиться між положенням 1538 і положенням 2923 SEQ ID No. 1, кодують фітазну активність. Переважно ці полінуклеотиди кодують фітазу Debaryomyces castellii. Винахід в цілому відноситься до полінуклеотидів, що кодують поліпептиди за винаходом. Через виродженість генетичного коду різні полінуклеотиди можуть кодувати один і той же поліпептид. Іншим об'єктом даного винаходу є полінуклеотид, послідовність якого представлена в SEQ ID No. 1. Полінуклеотид SEQ ID No. 1 містить послідовності, що фланкують відкриту рамку прочитування (ВРЗ) гену фітази Debaryomyces castellii. Вони, зокрема, є послідовностями промотора і термінатора цього гену. Цей ген може бути експресований з використанням його гомологічних регуляторних послідовностей, зокрема, з метою гіперекспресії в Debaryomyces castellii або в інших дріжджах. У іншому втіленні цей ген може бути експресований в різних організмах-господарях, таких як, наприклад, бактерії, дріжджі і гриби. Ген, що кодує фітазу SEQ ID No. 2, може бути експресований в організмі-господарі під контролем промотора з SEQ ID No. 1 за даним винаходом або під контролем гетерологичного промотора. Експресійні касети Згідно одного втілення винаходу полінуклеотид, що кодує поліпептид за винаходом, вбудовують в експресійну касету, використовуючи методики клонування, добре відомі фахівцям в даній області техніки. Ця експресійна касета містить елементи, необхідні для транскрипції і трансляції послідовностей, що кодують поліпептиди за винаходом. 94712 12 Переважно ця експресійна касета містить обидва елементи для продукування поліпептиду клітиною-господарем і елементи, необхідні для регуляції цієї експресії. Такі експресійні касети містять у напрямі транскрипції: • промотор, який є функціональним в організмі-господарі; • полінуклеотид за винаходом; • послідовність термінатора в тому ж організмігосподарі. В експресійних касетах за винаходом можна використовувати промоторні послідовності будьякого типу. Вибір промотора залежатиме, зокрема, від організму-господаря, вибраного для експресії гену, що представляє інтерес. Деякі промотори забезпечують конститутивну експресію, тоді як інші промотори, навпаки, є індуцибельними. Серед промоторів, здатних функціонувати в грибах, зокрема, слід згадати промотор гліцеральдегід-3фосфатдегідрогенази Aspergillus nidulans (Roberts et al., Current. Genet. 15: 177-180, 1989). Серед промоторів, здатних функціонувати в бактеріях, зокрема, слід згадати промотор РНК-полімерази бактеріофага Т7 (Studier et al., Methods in enzymology 185: 60-89, 1990). Серед промоторів, здатних функціонувати в дріжджах, зокрема, слід згадати промотор гену Gal1 (Elledge et al., Proc Natl Acad Sciences, USA 88: 1731-1735, 1991) або промотори GAL4 і ADH S. cerevisiae. Всі ці промотори описані в літературі і добре відомі фахівцям в даній області техніки. Для експресії в Реnісіllium funiculosum слід вибрати, наприклад, експресійні касети, що містять промотор гену гістона Н4.В, промотор кислої аспартилпротеази або промотор csl13 (WO 00/68401). Для експресії в дріжджах Pichia pastoris можна вибрати, наприклад, експресійні касети, що містять промотор АОХ1, що індукується метанолом (Tschopp, J. F., Sverlow, G., Kosson, R., Craig, W. and Grinna, L. (1987). High-level secretion of glycosylated invertase in the methylotrophic yeast, Pichia pastoris. Biotechnology 5, 1305-1308) або сильний конститутивний промотор GAP (Waterham, Η. R., Digan, Μ. Ε., Koutz, P. J., Lair, S. V. and Cregg, J. M. (1997) Isolation of the Pichia pastoris glyceraldehyde-3-phosphate dehydrogenase gene and regulation and use of its promoter. Gene 186, 37-44). Для експресії в Schizosacchromyces pombe можна вибрати, наприклад, експресійні касети, що містять регуляторний промотор Nmt1, що пригнічується тіаміном і що активується у відсутності тіаміну (Maundrell, K., (1989) Nmt1 of fission yeast. A highly transcribed gene completely repressed by thiamine. J. Biol. Chem. 265, 10857-10864.) Експресійні касети за винаходом можуть також включати будь-яку іншу послідовність, потрібну для експресії поліпептидів або полінуклеотидів, таку як, наприклад, регуляторні елементи або сигнальні послідовності для секреції поліпептидів, що продукуються організмом-господарем. Зокрема, можна використовувати будь-яку регуляторну послідовність, що дозволяє підвищити рівень експресії кодуючої послідовності, вбудованої в експре 13 сійну касету. Відповідно до винаходу можливо, зокрема, використовувати в поєднанні з промоторною регуляторною послідовністю інші регуляторні послідовності, які розташовані між промотором і кодуючою послідовністю, такі як активатори транскрипції (енхансери). Крім того, експресійні касети за даним винаходом можуть включати будь-яку іншу послідовність, потрібну для секреції поліпептидів, що продукуються організмом-господарем, таку як сигнальні послідовності. Для секреції Pichia pastoris як секреторний сигнал можна, зокрема, використовувати послідовність α-фактору. У експресійних касетах за винаходом можна використовувати широку різноманітність термінаторних послідовностей; ці послідовності забезпечують терминацию транскрипції і поліаденілування мРНК. Можна використовувати будь-яку термінаторну послідовність, яка є функціональною у вибраному організмі-господарі. Для експресії в Реnісіllium funiculosum можна вибрати, наприклад, експресійні касети, що містять термінатор гістону Н4.В, термінатор кислої аспартилпротеази або термінатор csl13 (WO 00/68401). Об'єктом даного винаходу є також полінуклеотид, що містить експресійну касету за винаходом; переважно експресійні касети за даним винаходом вбудовані у вектор. Вектори Таким чином, даний винахід також відноситься до репликативних або експресійних векторів для трансформації організму-господаря, що містять щонайменше один полінуклеотид або одну експресійну касету за даним винаходом. Цей вектор, зокрема, може складатися з плазміди, косміди, бактеріофагу або вірусу, в які вбудовані полінуклеотид або експресійна касета за винаходом. Методики конструювання цих векторів і вбудовування в ці вектори полінуклеотиду за винаходом добре відомі фахівцям в даній області техніки. В цілому можна використовувати будь-який вектор, здібний до підтримки себе, самореплікації або розмноженню в клітині-господарі, для індукції, зокрема, експресії полінуклеотиду або поліпептиду. Фахівці в даній області техніки зможуть вибрати відповідні вектори, зокрема, відповідні організму-господарю, що підлягає трансформації, і відповідні використовуваній методиці трансформації. Вектори за даним винаходом використовують, зокрема, для трансформації організму-господаря з метою реплікації вектора та/або експресії поліпептиду за винаходом в організмі-господарі. Винахід також відноситься до способу отримання поліпептиду за винаходом, що включає наступні стадії: • трансформації організму-господаря експресійним вектором, що містить експресійну касету за винаходом, та/або полінуклеотидом за винаходом; • виділення поліпептидів, що продукуються цим організмом-господарем. Організми-господарі Об'єктом даного винаходу також є спосіб трансформації організму-господаря шляхом інтеграції у вказаний організм-господар щонайменше одного 94712 14 з полінуклеотиду, експресійної касети або вектора за винаходом. Полінуклеотид або може бути інтегрований в геномі організму-господаря, або може стабільно реплікуватися в організмі-господарі. Способи трансформації організмів-господарів добре відомі фахівцям в даній області техніки і широко описані в літературі. Даний винахід також відноситься до організмугосподаря, трансформованого полінуклеотидом, експресійною касетою або вектором за винаходом. Згідно винаходу під терміном "організмгосподар" слід мати на увазі, зокрема, будь-який нижчий або вищий, одноклітинний або багатоклітинний організм, зокрема, вибраний з бактерій, дріжджів, грибів і рослин. Під терміном "організмгосподар" слід мати на увазі організм, відмінний від людини. Дріжджі переважно вибрані з Pichia pastoris, Saccharomyces cerevisiae, Yarrowia lipolytica, Schwanniomyces occidentalis і Schizosaccharomyces pombe. Гриби вибрані з Aspergillus і Penicillium, переважно з Penicillium funiculosum, Trichoderma reesei, Aspergillus niger, Aspergillus awamori, Aspergillus kawachii і Trichoderma koningii. В одному втіленні організмгосподар є штамом Penicillium funiculosum, в якому експресується фітаза за винаходом. У іншому втіленні організм-господар є штамом Debaryomyces castellii, в якому експресується або підвищено експресується фітаза за винаходом. У переважному втіленні винаходу організм-господар є штамом Pichia pastoris або Schizosaccharomyces pombe, в якому експресується фітаза за винаходом. Рослини вибрані, наприклад, з рису (Oryza sativa L), тютюну, сої і пшениці. Відповідно до даного винаходу організмгосподар трансформують полінуклеотидом, вибраним з наступних полінуклеотидів: а) полінуклеотиду, послідовність якого знаходиться між положеннями 1538 і 2923 SEQ ID No. 1 б) полінуклеотиду, що кодує поліпептид, вибраний з наступних поліпептидів: • поліпептиду SEQ ID No. 2 • фрагмента поліпептиду SEQ ID No. 2, що володіє фітазною активністю • поліпептиду, що володіє фітазною активністю і що проявляє щонайменше 90% ідентичності з поліпептидом SEQ ID No. 2. Хоча можливо, щоб організм-господар в стані дикого типу містив визначений вище полінуклеотид, даний винахід відноситься саме до трансформованого організму-господаря. Відповідно до одного втілення даного винаходу організмгосподар трансформований полінуклеотидом за винаходом з метою експресії поліпептиду за даним винаходом. Відповідно до іншого втілення винаходу організм-господар трансформований полінуклеотидом за винаходом з метою гіперекспресії поліпептиду за винаходом. Методики конструювання векторів, трансформації організмів-господарів і експресії гетерологичних білків в цих організмах широко описані в літературі (Ausubel F.M. et al., "Current Protocols in Molecular Biology" Volumes 1 and 2, Greene Publishing Associates and Wiley-lnterscience, 1989; 15 T.Maniatis, E.F.Fritsch, J.Sambrook, Molecular Cloning A laboratory Handbook, 1982). Харчові добавки і корми для тварин Даний винахід також відноситься до харчових добавок, що забезпечують фітазну активність. Забезпечення даного типу ферментативної активності дозволяє поліпшити переварюваність корму і підвищити його живильну цінність. Під терміном "кормова добавка" слід мати на увазі речовину, що навмисно додається до корму, як правило, в малих кількостях, для поліпшення його живильних властивостей або переварюваності. Кормові добавки для тварин можуть, наприклад, містити вітаміни, мінеральні солі, амінокислоти і ферменти. Типово кормові добавки для тварин містять поліпептид за винаходом, організм-господар за винаходом або надосадкову рідину культури/ферментаційне сусло організму-господаря за винаходом. Таким чином, поліпептиди, що володіють фітазною активністю згідно винаходу, можуть бути очищені або виділені з штаму Debaryomyces castellii або з рекомбінантного організму-господаря для виготовлення кормової добавки для тварин. Альтернативно штам Debaryomyces castellii або організм-господар, що продукує фітази за винаходом, можна використовувати безпосередньо для виготовлення кормової добавки для тварин. У переважному втіленні винаходу для виготовлення кормових добавок для тварин використовують надосадкову рідину культури або сусло, ферментації штаму Debaryomyces castellii або організмугосподаря, за винаходом. Дане втілення володіє особливими перевагами, коли фітаза секретується в позаклітинне середовище Debaryomyces castellii або організмом-господарем. Звичайно дану надосадкову рідину культури концентрують або ліофілізують для виготовлення кормової добавки. Таким чином, винахід також відноситься до способу отримання фітази, що включає наступні стадії: а) культивування штаму Debaryomyces castellii або організму-господаря, трансформованого відповідно до винаходу, в умовах індукції експресії фітази б) відділення надосадкової рідини культури, що містить фітазу. Потім таку надосадкову рідину культури або сусло, ферментації, необхідно концентрувати або ліофілізувати для виготовлення препарату харчової добавки або корму для тварин. Цей спосіб може включати додаткові стадії, що полягають в очищенні фітази з надосадкової рідини культури. Якщо організм-господар не секретує фітазу в культуральне середовище, може бути необхідною додаткова стадія, що полягає в руйнуванні клітин і очищенні клітинного екстракту. Кормові добавки за даним винаходом містять щонайменше одну фітазу за винаходом, але можуть також містити інші живильні речовини, такі як вітаміни, амінокислоти або мінеральні солі. Добавки за винаходом підвищують переварюваність кормів, таким чином, вносячи внесок в отримання підвищеної живильної цінності кормових раціонів на основі злаків (пшениці, ячменю, 94712 16 кукурудзи, вівса, їржі і т.д.) і олійних макух (сої, соняшнику, рапсу і т.д.). Даний винахід також відноситься до корму для тварин, що містять кормову базу і кормову добавку за винаходом. Ці корми звичайно знаходяться у формі муки або гранул, до складу яких включені добавки за винаходом. Об'єктом даного винаходу також є корми для тварин, що містять поліпептид за винаходом, організм-господар за винаходом або ферментацію сусла/надосадкову рідину культури організмугосподаря за винаходом. Під терміном "корм" слід мати на увазі все те, що можна використовувати для годування тварин. У одному втіленні винаходу кормові добавки і корми для тварин за винаходом містять комбінацію щонайменше двох фітаз, що володіють комплементарними активностями. Таким чином, ці добавки і корми містять щонайменше одну фітазу за винаходом, комбіновану з іншою фітазою. Фітаза, комбінована з фітазою за винаходом, може, наприклад, бути вибрана з фітаз наступних організмів: Schwanniomyces occidentalis, Aspergillus awamori (фітаза А і фітаза В), Aspergillus niger (фітаза А і фітаза В), Реnісіllium funiculosum, Aspergillus oryzae, Peniophora lycii, Aspergillus ficuum, Aspergillus nidulans, Talaromyces thermophilus, Aspergillus fumigatus і Aspergillus terreus. Фітаза згідно даного винаходу переважно гідролізує всі фосфатні групи фітинової кислоти. Таким чином, її можна, зокрема, використовувати для поліпшення або доповнення активності фітаз, які не гідролізують всі фосфатні групи. Переважно фітазу за винаходом комбінують з фітазою Aspergillus niger (Ullah, A. H.J., and Sethumadhavan, K. (2003) PhyA gene product of Aspergillus ficuum and Peniophora lycii produces dissimilar phytases. Biochemical and Biophysical Research Communications 303: 463-468) або з фітазою штаму Penicillium funiculosum (WO 03/054199, WO 99/57325). Переважно добавки і корми містять фітазу за даним винаходом, комбіновану з фітазою Aspergillus niger або з фітазою Penicillium funiculosum. Для інтенсивного тваринництва корма для тварин звичайно містять кормову базу і кормові добавки. Під терміном "кормова база" слід мати на увазі те, що складає велику частину харчового раціону тварини і складається, наприклад, із суміші злаків, білків і жирів тваринного та/або рослинного походження. Кормові бази для тварин придатні для живлення цих тварин і добре відомі фахівцям в даній області техніки. Звичайно ці кормові бази містять, наприклад, кукурудзу, пшеницю, горох і сою. Ці кормові бази придатні для потреб різних видів тварин, для яких вони призначені. Ці кормові бази можуть вже містити кормові добавки, такі як вітаміни, мінеральні солі і амінокислоти. У переважному втіленні винахід відноситься до кормів для тварин з однокамерним шлунком, зокрема, для свійської птиці і свиней. Свійська 17 птиця, зокрема, включає курей-несучок, курчат на м'ясо, індиків і качок. Свині включають, зокрема, свиней на відгодівлі і дорослих свиней, а також поросят. Опис графічних матеріалів Фіг. 1: Активність фітази D. castellii залежно від рН (рН від 3 до 3,5, 200 мМ гліциновий буфер; рН від 3,5 до 7, 200 мМ Na-ацетатний буфер; рН від 7 до 7,5, 200 мМ буфер Трис-НСІ). Різні значення, одержані при рН 3,5 при використанні двох різних буферів, указують на ефект природи буфера на фітазну активність. Фіг. 2: Активність фітази D. castellii залежно від температури. Активність вимірювали при рН 4 при 37°С протягом 20 хвилин. Фіг. 3: Теплова денатурація фітази D. castellii. Екстракт заздалегідь інкубували при різних температурах протягом 1,10, 20, 40, 60 і 120 хвилин або у воді (суцільні лінії), або в 125 мМ ацетатному буфері рН 4 (пунктирні лінії). Потім активність вимірювали при 37°С протягом 20 хвилин. Фіг. 4: Вивчення рН-стабільності і термостійкості. Активність фітази D. castellii вимірювали після обробки екстракту при різних значеннях рН протягом 1 години при двох значеннях температури (40°С або 60°С). Активність вимірюють при рН 4. Фіг. 5: Схема гідролізу фітинової кислоти фітазою D. castellii. Фіг. 6: Залежність виходу відносно рекомбінантної фітази (кухлі) і біомаси (квадрати) залежно від швидкості росту під час культивування в режимі з підживленням (А) і в безперервному режимі (Б). Фіг. 7: Моніторинг появи різних інозитфосфатів шляхом хроматографії після хімічного гідролізу і ферментативного гідролізу lnsP6 фітазою D. castellii після 15, 75, 120 хв. гідролізу. Фіг. 8: Пристрій і порівняння спектрів 4-х гідролітичних фракцій, що містять InsP1, LnsP2, lnsP3 і insP4. Альтернативні позначення надані курсивом. Для завершення порівняння на шкалі хімічних зрушень представлений також спектр lnsP5, одержаний на основі відмінності на початку кінетичної кривої. Позитивними сигналами є сигнали InsP5, а два негативні сигнали відповідають початковому lnsP6. Ці спектри, характеристичні для різних інозитфосфатів, дозволяють стежити за появою і зникненням різних продуктів в ході кінетики гідролізу. Фіг. 9: Повільна кінетика, що простежується при 500 Мгц і 17°С в розчині 1.7 мМ lnsP6, 10 мМ ацетатного буфера, рН 4,0 (500 мкл H2O/D2O, 16/84 об/об) і 1 мкл розчину ферменту. Період часу між двома спектрами складає 23 хвилини. Після періоду протягом ночі було додано 20 мкл ферменту з метою прискорення реакції. 16 годин опісля гідроліз завершується, і одержують спектр, характеристичний для інозиту (верхній спектр). Ця кінетика ясно показує послідовну появу lnsP5, lnsP4 і lnsP3. Фіг. 10: Швидша кінетика, що дозволяє стежити за повним гідролізом lnsP6 (600 Мгц, 17°С, 500 мкл D2O, 3,8 мМ lnsP6 рН 4,0, 5 мкл ферменту). Спектр записували через кожні 3 хв протягом 20 год (400 спектрів). 10 годин опісля гідроліз практично завершується. Графік спектрів відповідає од 94712 18 ному спектру з 10 (30 хв між двома спектрами). Відмічені деякі характеристичні сигнали. Фіг. 11: Зміна концентрацій різних продуктів за 5 годин в ході гідролізу. Даний графік дозволяє визначити, в який момент досягається оптимальна концентрація кожного з продуктів. Коментарі: висоту сигналу ЯМР, характеристичного для кожної із сполук, використовували для оцінки змін концентрації. Використані сигнали не завжди представляють однакову кількість протонів і не завжди мають однакову мультиплетність. В результаті ці концентрації не можуть бути порівнянні одна з іншою. Приклади Приклад 1: Отримання, біохімічна характеристика і стереоспецифічність фітази Debaryomyces castellii МАТЕРІАЛИ І МЕТОДИ 1. Організм Використаний штам зареєстрований в Centraal bureau voor Schimmelculture [Центральному бюро з культур грибів] (Делфт) під назвою Debaryomyces castellii CBS 2923. 2. Середовища і умови культивування Синтетичне середовище для періодичних культур (MSA-B): глюкоза (10 г/л); фітат натрію С6Н6O24Р6Nа12 (0,4 г/л) Мінеральні солі: (NH4)2SO4 (3 г/л) MnSO4.H2O (7,5 мг/л), KСІ (0,5 г/л), MgSO4.7H2O (0,5 г/л), СаСІ2.2Н2О (0,1 г/л) Мікроелементи: Н3ВО4 (500 мкг/л), CuSO4.5H2O (40 мкг/л), KІ (100 мкг/л), Na2MoO4.2H2O (200 мкг/л), ZnSO4.7H2O (400 мкг/л), FeCI3.6H2O (200 мкг/л). Вітаміни: пантотенат Са (2 мг/л), тіамін (В1) (2 мг/л), міоінозит (2 мг/л), піридоксин (В6) (2 мг/л), нікотинова кислота (РР) (0,5 мг/л), біотин (0,02 мг/л). Синтетичне середовище для безперервних культур (MSA-C): Склад середовища MSA-B, різні компоненти є в 10 разів більш концентрованими. Культура в колбі Ерленмейєра Перше попереднє культивування проводять у присутності середовища YMPG (глюкоза 10 г/л, дріжджовий екстракт 3 г/л, бактопептон 5 г/л, солодовий екстракт 3 г/л). Культивування проводять в колбах Ерленмейєра, заповнених на 1/10 їх об'єму, у присутності середовища MSA-B, забуференної до рН 5,4 0,2 Μ тартратним буфером. Культивування проводять в аеруємому середовищі на вібраційному зворотно-поступальному шюттельапараті (80 коливань на хвилину з амплітудою 7 см) при 28°С. Культура у ферментері Культивування проводять у ферментері Applikon (Нідерланди) (1,5 л корисного об'єму) або у ферментері Braun Biostat Ε (3 л корисного об'єму). рН вимірювали зондом Інгольда. Його доводили додаванням 2 Μ гідроксиду натрію або 1 Μ сірчаної кислоти. Аерацію забезпечують вдуванням 2 v.v.m (об'єм повітря.(об'єм культури) 1 -1 .(хвилини) ) повітря, стерилізованого фільтруванням. Парціальний тиск розчиненого кисню вимірюють з використанням полярографічного зонду Інгольда. Його підтримують при значенні, що пе 19 ревищує 30%, шляхом варіації швидкості перемішування. Температуру підтримують при 28°С. Контроль і збір даних проводять у реальному часі, використовуючи програмне забезпечення для збору даних Bioexpert (Applikon). Аналіз газів, що виходять з ферментера Концентрацію СО2 у газах, що відходять, вимірюють, використовуючи інфрачервоний аналізатор Beckman Industrial 870. Концентрацію О2 вимірюють, використовуючи аналізатор Beckman Industrial 775A, в детекторі якого використаний ефект парамагнітної сприйнятливості молекулярного кисню. Кількісний аналіз джерел вуглецю в ході культивування Субстрати і метаболіти, присутні в культуральному середовищі (глюкоза, ацетат, етанол), розділяють і визначають кількісно шляхом високоефективної рідинної хроматографії (ВЕРХ), використовуючи іонообмінну колонку FFJ (Waters). Рухома фаза є 3 мМ фосфорною кислотою, швидкість струму якої складає 1 мл/хв. Зразки культурального середовища відбирають безперервно кожні дві години і піддають тангенціальному фільтруванню зі стерилізацією (фільтр Millipore 0,22 мкм GV) з використанням фільтраційної приставки A-SEP Applikon і приладу для відбору зразків і фільтрування Waters FAM. Джерела вуглецю виявляють шляхом рефрактометрії (Waters 410). Управління процесом здійснюють за допомогою системи контролю Waters 600 Ε. Хроматограми аналізують, використовуючи програмне забезпечення Millenium (Waters). Стандартні інтервали були одержані для кожного субстрата в масштабі від 1 до 50 г/л. 3. Очищення Ультрафільтрація Надосадкову культуральну рідину, одержану після центрифугування, фільтрують через мембрану з порогом відсікання 0,22 мкм (Millipore), після чого піддають ультрафільтрації на касеті для ультрафільтрації з тангенціальним потоком Filtron 2 (площа поверхні: 836 см ), поріг відсікання якої складає 10 кДа. Концентрат тричі промивають ультрачистою водою (об/об), а потім концентрують в 25 разів. Одержаний екстракт використовують для очищення. Гідрофобна хроматографія Розділення білків проводять при 20°С на колонці НіРгер 16/10 Phenyl FF (Amersham), що має внутрішній діаметр 16 мм і довжину 100 мм (об'єм 20 мл). Перед інжекцією на гель для очищення зразки врівноважують в 2 Μ сульфаті амонію. Суміш залишають на 2-16 годин при 4°С, а потім центрифугують (12000 g, 20 хв) для видалення білків, що випали в осад. Надосадкова рідина є екстрактом, що наноситься на гель. Перш за все гель врівноважують еквівалентом 5 об'ємів колонки, використовуючи буферний розчин 50 мМ Трис-НСІ рН 6,1 і 2 Μ сульфату амонію. Проводять інжекцію від 1 до 5 мл зразка. Незв'язані білки видаляють шляхом промивання еквівалентом 5 об'ємів колонки врівноважуючим буферним розчином сульфату амонію. 94712 20 Елюювання проводять шляхом отримання градієнта з трьох лінійних ділянок: 1) від 2 до 1,7 Μ сульфату амонію за період, еквівалентний 1,5 об'ємам колонки; 2) 1,7 Μ сульфату амонію за період, еквівалентний 4 об'ємам колонки; 3) від 1,7 до 0 Μ сульфату амонію за період, еквівалентний 0,1 об'єму колонки. Фітаза елюює при 1,7 Μ сульфату амонію. Швидкість струму фіксують при 5 мл/хв. На виході з колонки збирають фракції по 4 мл, поглинання вимірюють при 280 нм. Активні фракції об'єднують, промивають проти ультрачистої води і концентрують ультрафільтрацією (мембрана Millipore, поріг відсікання 10 кДа). 4. Електрофорез Електрофорез в денатуруючих і неденатуруючих умовах проводять на заздалегідь залитих гелях, що містять від 4 до 15% акриламіду (Biorad). Білки виявляють Кумассі синім. Специфічну візуалізацію фітаз проводять шляхом інкубації гелів в 100 мл 250 мМ натрійацетатного буферного розчину, рН 5,5, що містить 200 міліграм α-нафтил Ρ (Sigma), 100 міліграм Fast Garnet GBC (Sigma) і 92 міліграм фітата натрію. Після гідролізу α-нафтилу Ρ утворюється комплекс α-нафтил/Fast Garnet GBC коричневого кольору. 5. Гідроліз ендоглікозидазою Η Деглікозилювання: 1000 одиниць ендоглікозидази Η (Biolab Ozyme P0702S) додають до денатурованого зразка, що містить приблизно 20 мкг білків. Цю суміш інкубують протягом 2 годин у водяній лазні при 37°С. 6. Визначення молекулярної маси за допомогою мас-спектрометри Цей аналіз проводять на фітазі, очищеній на ДСН-ПААГ, використовуючи спектрометр MALDL-TOF Biflex III scout 384 (Bruker, Breme, Німеччина). 7. Аналітичні методи 7.1 Визначення сухої речовини Концентрацію клітин одержують шляхом вимірювання оптичної щільності (OD), використовуючи спектрофотометр Beckman DU530. Одна одиниця OD відповідає 0,570 г/л біомаси. 7.2 Кількісний аналіз білків Вміст білків визначають методом Бредфорда (Bradford, M. (1976) A rapid and sensitive method for the quantification of microgram quantities of proteins utilizing the principle of protein-dye binding. Anal. Biochem. 72, 248-254) (Biorad Protein Assay Dye Reagent Concentrate, BIORAD 500-0006), поглинання вимірюють при 595 нм (спектрофотометр ультрафіолетового і видимого світла Beckman DU 530). Калібрування проводять в інтервалі для бичачого сироваткового альбуміну. 7.3 Ферментативний метод Активність фітази вимірюють шляхом спостереження вивільнення неорганічного фосфату за часом. Активність вимірюють у присутності 8 мМ фітата натрію (Sigma), розчиненого в 250 мМ натрійацетатному буфері рН 5,5 або рН 4, що містить 1 мМ СаСІ2, при 37°С (5 об'ємів). Реакцію запускають додаванням ферментативного екстракту (1 об'єм). Реакцію зупиняють підкисленням середовища 20% трихлороцтовою кислотою (на 1 21 об'єм реакційного середовища 1 об'єм кислоти). Кількість вивільненого фосфату визначають після різних періодів інкубації. Одну одиницю ферментної активності (U) визначають як кількість ферменту, яка вивільняє 1 мікромоль неорганічного фосфату в хвилину. Характеристика ферменту Вплив рН на активність фітази визначають, використовуючи приведені нижче буферні розчини: 200 мМ гліцин-НСІ, рН 2-3,5; 200 мМ ацетат натрію - оцтова кислота, рН 3,5-7; і 200 мМ трисНСІ, рН 7-9. Реакції проводять при +37°С, використовуючи фітат як субстрат. Оптимальну температуру визначають шляхом варіювання температури від +30 до +80°С. Реакції проводять при рН 4 (200 мМ натрійацетатний буфер), використовуючи фітат як субстрат. Термостійкість визначають шляхом інкубації зразка ферменту в 125 мМ натрійацетатному буфері рН 4 протягом різних періодів при температурах в інтервалі від +37 до +70°С. Після теплової обробки суміш охолоджують в льоді і визначають фітазну активність, використовуючи фітат як субстрат. Кінетичні параметри визначають при +37°С і при рН 4 для експериментів з фітатом натрію і при рН 5,5 для експериментів з pNPP. 7.4 Кількісний аналіз фосфату Кількість вивільненого фосфату вимірюють шляхом колориметрії. Проявляючий розчин, приготовлений безпосередньо перед використанням, містить сульфат заліза (380 мМ, 1 об'єм) і гептамолібдат амонію (12 мМ, 4 об'єми). Поглинання при 720 нм вимірюють після 30 хв прояву при температурі навколишнього середовища (1 об'єм реакційного середовища + 1 об'єм проявляючого розчину), використовуючи спектрофотометр УФ/видиме світло (Beckman DU 530). Калібрувальну криву будують заздалегідь для дигідрофосфату калію. 7.5 Умови фітазного гідролізу для дослідження стереоспецифічності Пробірка містить 2 об'єми фітата натрію (20 мМ), 2 об'єми ацетатного буфера рН 4 (0,25 М) і 1 об'єм розведеного ферменту (кінцева концентрація 0,6 U/мл). Проби відбирають через різні проміжки часу протягом 6 годин. Реакцію зупиняють нагріванням при 100°С (10 хвилин). 7.6 Визначення інозитфосфатів 7.6.1 Шляхом ВЕІХ Цей метод є методом використання високоефективної іонообмінної хроматографії (ВЕІХ) для розділення і визначення від моно- до гексафосфатів інозиту, одержаних в результаті розщеплювання фітинової кислоти досліджуваними фітазами (Hatzack, F., Hubel, F., Zhang, W., Hansen, P.E. and Rasmussen, S.K. (2001) Inositol phosphates from barley low-phytate grain mutants analysed by metaldye detection HPLC and NMR. Biochem. J. 354, 473480; Skoglund, E., Carlsson, N.G. and Sanberg, A.S. (1997) Determination of isomers of inositol mono-to hexaphophates in selected foods and intestinal contents using High-Performance Ion Chromatography. J. Ague. Food Chem. 45, 431-436; Turk, M., Sandberg, A.S., Carlsson, N.G. and Andlid, 94712 22 T. (2000) Inositol hexaphosphate hydrolysis by baker's yeast. Capacity, kinetics, and degradation products. J. Agric. Food Chem. 48, 100-104). Цей метод включає розділення різних InsPn на іонообмінній колонці шляхом ВЕРХ (високоефективної рідинної хроматографії) з градієнтом елюювання і реакцію на виході з колонки, в ході якої інозитфосфати утворюють комплекси з залізом, і їх виявляють з допомогою УФ світла при 290 нм. Така система дозволяє виявити інозитфосфати ІnsР2 до lnsP6, але різні ізомери можна розділити тільки для lnsP4 і lnsP5. Приготування еталонного зразку Піки ідентифікують після хімічного гідролізу. 50 міліграм фітата натрію поміщають в 5 мл НСІ (6 М) при 100°С на 16 годин. Аліквоти по 25 мкл висушують на приладі Speed Vac, а потім розчиняють в 100 мкл 0,025 Μ НСІ, щоб одержати приблизно 300 нмоль на інжекцію. Аналіз зразків Різні піки розділяють шляхом аніонообмінної хроматографії сильних аніонів на аналітичній колонці Omni Рас РАХ-100 (4 × 250 мм) і захисній попередній колонці РАХ-100 (4 × 50 мм) (Dionex Corp., Sunnyvale, CA). Швидкість струму складає 0,8 мл/хв, контур інжекції складає 100 мкл. InsPn елююють градієнтом 5-98% НСІ (0,5 М) в поєднанні з ультрачистой водою і органічним розчинником (50% 2-пропанолу). Елюенти змішували згідно приведеній нижче в Таблиці 1: Таблиця 1 Час (хв) Т(0) Т(40) Т(45) НСІ (%) 5 98 5 2- пропанолу (%) Вода (%) 2 93 2 0 2 93 Для урівноваження колонки після кожної хроматографії необхідно 15 хвилин. Інозітфосфати виявляють після реакції на виході з колонки шляхом вимірювання поглинання при 290 нм, використовуючи УФ спектрофотометр (Biocad, Sprint). В ході реакції на виході з колонки елюент змішують з 0,1% Fe(NO3)3.9H2O в 2% розчині НСІО4. Швидкість струму реактиву (насос Minipuls 3, Gilson) складає 0,4 мл/хв. Проходження через тефлоновий змійовик (0,25 мм, 4 м) дозволяє утворити комплекс InsPn із залізом для виявлення (Phillippy, B.Q., Bland, J.M. (1988) Gradient ion chromatography of inositol phosphates. Anal. Biochem. 175, 162-166). 7.6.2 Шляхом ЯМР Після ліофілізації різні зразки інозитфосфатів, виділені шляхом ВЕІХ (50-200 мкг), розчиняють в 500 мкл D2O. Протонні спектри реєструють при 500 або 600 Мщ на спектрометрах Bruker Avance, обладнаних кріозондом (1Н, 13С і 15N) і градієнтами по z-oci. Неспарені протонні спектри фосфору і спектри відповідності 1Н-31Р (HMQC) реєструють на спектрометрі Bruker Avance 400 MHz із зондом ТВІ. Залишковий сигнал води видаляють шляхом виборчого попереднього насичення протягом періоду 1 с. Всі спектри реєструють при 17°С. Протонні 23 спектри калібрують проти (триметилсиліл)-3-1 пропіонату натрію-d4 (TSP, 0 млн. ) або проти -1 залишкового сигналу води (4,914 млн. при 17°С). Для співвідношення протонних резонансів реєструють результати експериментів COSY і TOCSY з 512 тимчасовими інкрементами. Час контакту, використовуваний для TOCSY, складає 50 мс. Експерименти HMQC проводять з 64 тимчасовими інкрементами. Співвідношення протонних спектрів здійснюють шляхом аналізу експериментів COSY і TOCSY. Слід зазначити, що для деяких ізомерів, що мають одну площину симетрії, протони Н1 і Н3 і протони Н4 і Н6 не можуть бути диференційовані. В цьому випадку їх відзначають як Н1 (або Н3) і Н4 (або Н6). Як тільки одержано співвідношення, залишається визначити положення фосфорилювання. Ці положення визначають за допомогою двох різних експериментів: по-перше, за допомогою неспареного протонного спектру фосфору, а подруге, за допомогою експерименту HMQC. Порівняння протонного спектру без розпарювання і з розпарюванням фосфору дозволяє ідентифікувати 3 сигнали, що мають константу зв'язку Jhcop 8,5-10 Гц, а також положення фосфорилювання. 1 -31 Експеримент Н Р HMQC за допомогою конс3 HCOP танти зв'язку j дозволяє частково встановити кореляції протон-фосфор. Коли відоме співвідношення протонних резонансів, неспарені спектри фосфору і HMQC дозволяють недвозначно ідентифікувати положення фосфорилювання. Положення фосфатних груп перевіряють також аналізом констант зв'язку протонного спектру. 7.6.3 Кінетика гідролізу, що спостерігається шляхом ЯМР Зразок, використовуваний для дослідження процесу гідролізу при допомозі ЯМР, готують з концентрованого розчину lnsP6/фосфатний буфер, 96/700 мМ в D2O. У типовому випадку 20 мкл цього розчину додають до 480 мкл D2O (розведення в 25 разів) для отримання зразка, що містить 3,8 мМ lnsP6 і 28 мМ натрійацетатного буфера і TSP як внутрішній стандарт. Залежно від бажаної швидкості гідролізу додають більшу або меншу кількість ферменту (від 1 до 20 мкл концентрованого розчину з концентрацією 3 U/мл). Кінетику простежують при 17°С шляхом реєстрації спектру (32 сканування) кожні 3 хв протягом 20 годин (400 спектрів). Використовуючи визначені раніше спектри, характеристичні для різних інозитфосфатів, їх появу і зникнення можна простежувати впродовж всієї кінетики. РЕЗУЛЬТАТИ 1 Дослідження біосинтезу фітази Debaryomyces castellii Біосинтез фітази простежували в періодичній культурі і безперервній культурі в цілях визначен 94712 24 ня оптимальних умов продукування. Культивування проводили на синтетичному середовищі (див. Матеріали і методи). Попереднє дослідження дозволило авторам винаходу визначити оптимальну концентрацію фітата, що становить 0,4 г/л, для отримання 5 г/л біомаси. Ця концентрація необхідна і достатня для забезпечення максимального клітинного зростання і відсутності придушення біосинтезу фітази. Під час культивування відбирали зразки і вимірювали біомасу і фітазну активність. 1.1 Продукування в періодичній культурі Ставлять п'ять періодичних культур при рН 3, 4, 5, 6 і 7 у присутності 10 г/л глюкози і середовища MSA-B. Максимальну біомасу одержують при рН 5, швидкість росту знижується на 20% при рН 3 і при рН 7. Максимальну фітазну активність, виміряну в надосадкових культуральних рідинах, одержують при рН 4, тоді як при рН 3 не виявляють ніякої фітазной активності. Фітазная активність зростає приблизно на 20% через 12 годин після початку стаціонарної фази. Можливо, частина фітази має пристінкову локалізацію і вивільняється в середовище після припинення зростання. Автори винаходу підтвердили, що один і той же рівень індукції був одержаний в присутності або у відсутності солей кальцію. 1.2 Продукування в безперервній культурі Безперервне культивування проводять при рН 4 в середовищі MSA-C у присутності 100 г/л глюкози. Вимірювання біомаси і фітазної активності проводять щонайменше після 3 оновлень ферментера. Вихід біомаси залишається постійним аж до -1 показника розбавлення 0,20 год при виході Yбіомаса/субстрат (г/г), рівному 50%, клітинний мeтаболізм є окислювальним, дихальний коефіцієнт (QR) рівний 1. Продукування фітази зростає з підвищенням показника розбавлення. При показ-1 нику розбавлення (D) 0,25 год швидкість росту знижується на 40%, QR перевищує 1, клітинний метаболізм стає окислювально-ферментативним, відбувається утворення вторинних метаболітів, таких як ацетат і етанол. Продукування фітази також зменшується в 5 разів. Найкраще продукування (1487 U/л) одержують -1 при D=0,20 год . Слід зазначити, що 20% фітази пов'язано з клітинами; зберігання культури при 4°С протягом щонайменше 4 годин дає можливість вивільнення ферменту в культуральне середовище. 2 - Дослідження фітами 2.1 Очищення Різні стадії очищення фітази D. castellii підсумовувані в Таблиці 2. 25 94712 26 Таблиця 2 Очищення фітази Debaryomyces castellii гідрофобною хроматографією Грубий екстракт Екстракт після концентрації і ультрафільтрації Гідрофобна хроматографія Сумарна активність (U) 144 Сумарні білки (міліграм) 12,4 Питома активність (U/мг) 11,6 136,5 84,4 8,2 0,54 16,7 156 Грубий екстракт має питому активність 11,4 U/мл. Після стадії концентрації і ультрафільтрації екстракт очищають гідрофобною хроматографією. Фітаза очищається за одну стадію в 13 разів з виходом 59%. Питома активність складає 156 U/мг. Наявність єдиної смуги білку після електрофорезу в ДСН-ПААГ показує, що фермент є чистим. 2.2 Молекулярна маса і структура 2.2.1 Визначення молекулярної маси за допомогою електрофорезу або гельпроникаючої хроматографії Електрофорез в ДСН-ПААГ дозволяє оцінити молекулярну масу фітази як 77 кДа, а молекулярну масу цього ферменту, деглікозильованого шляхом обробки ендоглікозидазою Н, як 51 кДа, тобто 34% глікозилювання. У неденатуруючих умовах складніше визначити молекулярну масу фітази зважаючи на наявність шмерів; вона складає між 440 і 150 кДа. Молекулярна маса деглікозильованого ферменту складає 87 кДа. Специфічне фарбування дозволяє показати, що деглікозильована фітаза є активною. Молекулярна маса, визначена за допомогою гельпроникаючої хроматографії (колонка HR 200 Pharmacia), складає 318 кДа для глікозильованої фітази і 218 кДа для деглікозильованої фітази. 2.2.2 Мас-спектрометрія Визначення молекулярної маси за допомогою мас-спектрометрії підтверджує результати, одержані шляхом електрофорезу в ДСН-ПААГ, тобто 74 кДа для фітази і 53 кДа для деглікозильованого ферменту, тобто глікозилювання складає 28,4%. Таким чином, вважають, що нативна фітаза складається з 4 мономерів однакової молекулярної маси. 2.2.3 Кристалографія Протягом попереднього року методом кристалографії була визначена структура фітази Debaryomyces castellii (461 амінокислотний залишок) з дозволом 2,3 Е. Фітаза є тетрамером, який містить 10 молекул N-ацетилглюкозаміну і 1256 молекул води. Ця структура доступна на сайті RCSB Protein Data Bank з наступним кодом bdb: 2GFI. 3 - Ферментативні властивості 3.1 Ефект рН Ефект рН на активність фітази визначають шляхом вимірювання ферментативної активності у присутності різних буферів: гліциновий буфер для рН від 2 до 3,5; натрійацетатний буфер для рН від 3,5 до 7 буфер Трис-НСІ для рН від 7 до 7,5 (Фіг. 1). Фітаза активна між значеннями рН від 2,5 до 6,5 з оптимумом між рН 4 і 4,5. Може бути відміче Показник очиВихід % щення 1 1,45 13,6 95 59 ний ефект природи буфера на фітазну активність при рН 3,5; ацетатний буфер є інгібітором в порівнянні з гліциновим буфером. 3.2 Ефект температури Оптимальну температуру визначають на нативній фітазі шляхом вимірювання фітазной активності при різних температурах: від 30 до 80°С (Фіг. 2). Оптимальна температура для фітази знаходиться між 55 і 60°С. Енергія активації, розрахована по Ареніусу, склала 38 кДж/моль. 3.3 Дія ефекторів Серед різних протестованих катіонів тільки 2+ Мn викликає сильне інгібірування на 72%. У при2+ 2+ 2+ 2+ сутності катіонів Со , Zn , Cu і Mg активність інгібована на величину від 58 до 22%. Слід зазначити, що присутність кальцію не є необхідним для активності цього ферменту (Таблиця 3). Таблиця 3 Вплив ефекторів на активність фітази D. Castellii Ефектори Контроль фітат СаСІ2 МnСІ2 МgСІ2 СuСІ2 ZnCI2 FeCI3 СоСІ2 СrСІ2 НgСІ2 РСМВ ЕДТА йодоцтова кислота 2-меркаптоетанол N-бромсукцинімід N- бромсукцинімід + триптофан Йод йод + триптофан Концентрація Активність (мМ) (%) 9 100 5 90 5 28,8 5 68,7 5 66,6 5 57 5 92 5 42,3 5 107,6 5 96,2 3 94,5 3 104,5 3 100 3 107 0,1 i 1 1 1+3 3 1+3 100 25,6 88,1 Серед 6 протестованих інгібіторів тільки Nбромсукцинімід, який діє на групи триптофану, тірозину і гістидину, повністю інгібує фітазну активність. Додавання триптофану відновлює активність. Йод, який є специфічним для груп тірозину, також є сильним інгібітором (75%). Мабуть, тірозин 27 і триптофан у високому ступені залучені в каталітичний центр ферменту. З іншого боку, йодоцтова кислота, яка діє на групи цистеїну і гістидину, не викликає якогонебудь інгібування активності. Відсутність ефекту 2-меркаптоетанолу, йодацетату і рСМВ показує, що групи -SH, ймовірно, не залучені в каталітичний центр. 3.4 Дослідження стабільності Температура Дослідження теплової денатурації при різних температурах показує, що фермент є стабільним протягом однієї години при 60°С, коли він розчинений у воді, і однієї години при 66°С, коли він розчинений в 125 мМ ацетатному буфері, рН 4 (Фіг. 3). Фермент денатурує при температурах вище за 68°С з втратою 70% активності після однієї години при 70°С. Енергія активації денатурації, розрахована по Ареніусу, складає 606 кДж/моль. рН Фітаза повністю денатурує після зберігання протягом 21 доби при -20°С при значеннях рН менше 5. З іншого боку, не спостерігають ніякої денатурації після зберігання протягом 67 діб при тій же температурі при значеннях рН між 5 і 7. рН і температура Фітазну активність вимірюють після інкубації ферменту при двох значеннях температури (40 і 60°С) в буферах, рН яких знаходиться між 2 і 8 (Фіг. 4). При двох крайніх значеннях рН (2 і 8) спостерігають повну втрату активності після 1 години контакту. З іншого боку, в інтервалі від 3 до 7 при 40°С зберігається від 80 до 100% активності. При 60°С фітаза сильніше денатурує при рН 3 і рН 8. Можна відзначити, що цей сильний ефект є слідством природи буферу при рН 8: у присутності ацетатного буферу відбувається повна денатурація, тоді як у присутності буфера трис-НСІ денатурація складає лише 50%. Навколишнє середовище - іонна сила Фермент заздалегідь інкубують в 250 мМ ацетатному буфері, рН 4, що містить 1 мМ хлориду кальцію, при 20°С і 66,5°С протягом 60 хвилин у присутності різних добавок. Після закінчення обробки екстракт охолоджують у воді при +4°С. Потім вимірюють активність ферменту при 37°С протягом 20 хвилин при рН 4, 250 мМ буфер (Таблиця 4). Тестували три типи елементів: • цукор або цукровий спирт: сахароза, лактоза, трегалоза, арабіноза, гліцерин • відсутність кальцію • молярність буфера. Фермент заздалегідь інкубують в 250 мм ацетатному буфері, що містить 1 мМ кальцію, рН 4, при 20°С і 66,5°С протягом 60 хвилин у присутності різних добавок. Після закінчення обробки екстракт охолоджують у воді до +4°С. 31 94712 28 Потім вимірюють активність при 37°С протягом 20 хв при рН 4, 250 мМ буфер, що містить 1 мМ кальцію (див. Матеріали і методи). Таблиця 4 Вплив навколишнього середовища на теплостійкість фітази Debaryomyces castellii CBS 2923 Умови Концентрація Контроль СаСІ2 Сахароза Лактоза Трегалоза Арабіноза Гліцерин Ацетатний буфер Ацетатний буфер Ацетатний буфер Ацетатний буфер Ацетатний буфер 0 мМ 10% 10% 10% 10% 10% 200 мМ 150 мМ 125 мМ 100 мМ 50 мМ 1 год при 20°С 99 100 97 95 94 90 96 100 98 84 87 99 1 год при 66,5°С 47 1 57 47 56 36 56 53 78 95 89 89 Два елементи є дуже важливими: кальцій та іонна сила. Хоча кальцій не впливає на ферментативну активність, він грає дуже важливу захисну роль: у відсутність кальцію відбувається повна денатурація. Підвищення іонної сили буфера збільшує температурну денатурацію аж до 50% при 250 мМ. 4 - Кінетичні дослідження Дослідження специфічності Кінетичні константи визначають на 2-х субстратах. Аффінітет фітази в 4 рази вище у присутності фітата кальцію, ніж у присутності паранітрофенілфосфату (pNPP) (Таблиця 5). Таблиця 5 Специфічність фітами D. castellii до різних субстратів Субстрати pNPP Фітат натрію Km (мМ) 2,27 0,532 Vm (мкмоль/хв/мкг) 30,9 35,8 Ця фітаза володіє широким спектром активності з переважним гідролізом pNPP, фосфоенолпірувата, АТФ і АДФ (Таблиця 6А). Вона належить до класу фітаз широкого спектру, таких як фітази A fumigatus і Б. nidulans. Ця фітаза також гідролізує lns(2)P1 (Таблиця 6Б), який рідко гідролізується фітазами внаслідок його осьового розташування на молекулі фітинової кислоти. її функцію інгібірують фосфати при Kі 1,3 мМ. 29 94712 Таблиця 6 Порівняння специфічності фітази D. castellii у присутності різних субстратів (А) Концентрація субстратів складає 4 мМ. Кінетики вивільнення фосфату визначають в 250 мм натрійацетатному буфері СаСІ21 мМ, рН 4, при 37°С Концентрація Активність Субстрати (мМ) (%) Фітінова кислота (контроль) 9 100 пара-Нітрофенілфосфат 4 135 Фруктозо-6-фосфат 4 35 Глюкозо-6-фосфат 4 S2 Аденозин-5'-монофосфат 4 50 Аденозин-5'-дифосфат 4 120 Аденозин-5'-трифосфат 4 133 L-α-гліцерофосфат 4 78 D (-) 3-фосфогліцерат 4 95 Фосфо(енол) піруват 4 130 (Б) Гідроліз різних інозитфосфатів фітазою D. castellii. Кінетики вивільнення фосфату визначають в 250 мм натрійацетатному буфері СаСІ2 1 мМ, рН 4. Вимірювання проводять після гідролізу протягом 30 хвилин при 37°С Фітинова кислота (конт9 91 роль) lns(1)P1 1 58 ins(2)P1, 1 84 lns(1,4)P2 0,1 65 lns(1,4,5)P3 0,1 56 5 - Стереоспецифічность 5.1 Розділення й ідентифікація інозитфосфатів шляхом хроматографії (ВІРХ). Ізомери інозитфосфату розділяють на аналітичній колонці Omni Pac-100 з використанням градієнта від 5% до 98% НСІ (0,5 М) і сумішей Н2О/2пропанол (об/об). У реакторі, розташованому на виході з колонки, елюенти змішують з 0,1% розчином Fe(NO3)3.9H2O в 2% НСIO4 (Phillippy, B.Q., Bland, J.M. (1988) Gradient ion chromatography of inositol phosphates. Anal. Biochem. 175, 162-166). Сумарна швидкість струму складає 1,2 мл/хв. Ці умови дозволяють розділяти різні InsP5 (від InsP6 до InsP1) та ідентифікувати різні ізомери InsP5 і lnsP4. Різні ізомери ідентифікують шляхом порівняння одержаних хроматограм: 1) з хроматограмами, описаними в літературі і одержаними в ідентичних умовах (Skoglund, Ε., Carisson, N.G. and Sanberg, A.S. (1997) Determination of isomers of inositol mono- to hexaphophates in selected foods and intestinal contents using High-Performance Ion Chromatography. J. Agric. Food Chem. 45, 431-436), 2) із сполуками, одержаними в результаті хімічного гідролізу (Turk, M., Sandberg, A.S., Carisson, N.G. and Andlid, T. (2000) Inositol hexaphosphate hydrolysis by baker's yeast. Capacity, kinetics, and degradation products. J. Agric. Food Chem. 48, 100 30 104), і 3) з продуктами гідролізу фітинової кислоти фітазами A. niger і P. lycii (Lassen, S.F., Bech, L, Fuglsang, C.C., Ohmann, Α., Breinholt, J. and Stergaard, P.R. (2000); Патент США 6060298). 5.1.2 Хімічний гідроліз Після хімічного гідролізу (НСІ 6М, 100°С, 16 годин) одержана хроматограма дозволила авторам винаходу ідентифікувати 12 ізомерів InsP5 і InsP4. Цим способом не розділяються ізомери InsP3, InsP2 і lnsP1. 5.13 Ідентифікація інозитфосфатів, що утворилися в ході гідролізу фітинової кислоти фітазою D. castellii Умови гідролізу описані в Матеріалах і методах. Появу різних InsPn простежують в часі. Після 15 хвилин гідролізу lnsP6 практично зникав, виявлено 4 основних спис, відповідних lns(1,2,4,5,6)P5, lns(1,2,5,6)P4, і піки lnsP3, lnsP2, InsP1, що не ідентифікуються цим способом (Фіг. 7). Відповідність lnsP5 і lnsP4 підтверджено додаванням автентичних зразків інозиту. Після 120 хвилин гідролізу переважають піки lnsP3 і InsP1. Це може відображати набагато повільнішу швидкість гідролізу lnsP3 в порівнянні з lnsP4 lnsP5 і lnsP6. Після 300 хвилин гідролізу визначена кількість фосфату відповідає 100% потенційного фосфату в молекулі фітату. Фермент вивільняє всі фосфати. Характеристику фракцій insPn, розділених шляхом хроматографії, здійснюють за допомогою аналізу ЯМР. 5.2 ЯМР (Фіг. 8-11) 5.2.1 Приготування зразків Різні продукти гідролізу lnsP6 фітазою D. castellii розділяють шляхом іонообмінної хроматографії відповідно до способу, що використаний в попередньому параграфі. Вприснута кількість відповідає 369,5 мкг lnsP6. Реактив, що вноситься на виході з колонки, замінюють водою, всього провели 12 хроматографій. Фракції, відповідні InsP5, lnsP4, lnsP3, LnsP2 і InsP1, збирають, об'єднують і ліофілізують. Ліофілізовані зразки повторно гідратують 0,5 мл D2O і аналізують з допомогою ЯМР при 17°С. 5.2.2 Аналіз InsP Як було детально описано в Матеріалах і методах, різні фракції інозитів характеризують аналізом протонних спектрів (1D і 2D COSY і TOCSY) і спектрів кореляції 31Р-1Н (HMQC). Хоча можливо розрізнити стереоізомери, які не є дзеркальними відображеннями, неможливо розрізнити енантіомери, які дають дзеркальні зображення та ідентичні спектри. У зв'язку з цим при ЯМР характеристиці продуктів гідролізу неможливо відрізнити 3-фітазу від 1-фітази і 6-фітазу від 4-фітази. Загальноприйнято, згідно літературі, коли в першу чергу зазнають гідроліз 3- або 1-зв'язки, дають назву 3-фітаза; так само, для 6- або 4-зв'язків дають назву 6-фітаза. 5.2.2.1 Аналіз фракції ВЕРХ, що містить InsP1 Протонний спектр указує на присутність суміші трьох продуктів, спинові системи яких, були ідентифіковані за допомогою експериментів TOCSY і COSY. Ці три продукти є: lns(2)P1 (36%), lns(1 або 3)Р1 (16%) та інозит (48%). Спектр фосфору указує на присутність неорганічного фосфору, який хара 31 ктеризується чистим сигналом. HMQC підтверджує, що два з цих продуктів є монофосфорильованими, а третій не є фосфорильованим, тобто є інозитом. 5.2.2.2 Аналіз фракції ВЕРХ, що містить lnsP2 Протонний спектр указує на присутність переважаючого продукту (приблизно 90%). Починаючи -1 з сигналу, відповідного протону Н2 (4,741 млн. ' ), COSY дозволяє провести відповідність спектру. Аналіз констант зв'язку показує, що положення 2 і 1 (або 2 і 3) фосфорильовані, і що переважаючий продукт відповідає lns(2,1 або 2,3)Р2. Неспарений спектр 31Ρ і HMQC підтверджують цю відповідність. Мінорні продукти, щонайменше 2, не ідентифіковані. 5.2.2.3 Аналіз фракції ВЕРХ, що містить lnsP3. Протонний спектр указує на присутність практично чистого продукту. Аналіз спектру показує, що він відповідає lns(2,1,6 або 2,3,4)Р3. Фосфорилювання цих трьох послідовних положень підтверджене неспареним спектром 31Ρ і HMQC. 5.2.2.4 Аналіз фракції ВЕРХ, що містить lnsP4. Протонний спектр указує на присутність переважаючого продукту (приблизно 90%), який виявляється lns(2,1,6,5 або 2,3,4,5)Р4. Положення фосфатних груп, виведені на основі аналізу констант 3 HCOP зв'язку ( j = 8-10 Гц), підтверджені експериментами з неспареним спектром 31Ρ і HMQC. Мінорні продукти не ідентифіковані. 5.2.2.5 Характеристика lnsP5 Беручи до уваги, що lnsP5 є першим продуктом гідролізу, і що він негайно розпадається до lnsP 4, авторам винаходу не вдалося виділити його шляхом ВЕРХ в кількості, достатній для його характеристики з допомогою ЯМР. Щоб обійти це утруднення lnsP5 був охарактеризований in situ в ході кінетики гідролізу, що проводиться при 17°С з малою кількістю фітази (див. нижче). У цих умовах можна було одержати протонні спектри (COSY, TOCSY і спектр відмінності 1D) lnsP5. Всі ці спектри дозволяють охарактеризувати lns(1,2,4,5,6)P5, указуючи на те, що положення 3 (або положення 1) є першим положенням, за яким здійснюється дефосфорилювання. Спектр 31Ρ для lnsP5 не був записаний (Фіг. 8). 5.2.3 Кінетика гідролізу lnsP6 Попередні дослідження дали можливість, поперше, показати, що фермент нечутливий до присутності дейтерію і, по-друге, підібрати таку концентрацію ферменту, при якій кінетика реакції не є ні дуже швидкою, ні дуже повільною відносно технічних обмежень спостереження. Залежно від температури (в даному випадку 17°С) і від концентрації ферменту кінетика може 94712 32 бути повільною (1 мкл ферменту), і можна легко спостерігати за появою перших проміжних сполук. Саме в цих умовах були одержані спектральні характеристики InsP5, і чітко видно послідовна поява lnsP5, lnsP4 і lnsP3. Утворення LnsP2, InsP1 та інозиту спостерігають у присутності 5 мкл ферменту. У проміжній фазі сукупність одержаних спектрів свідчить про наявність суміші InsPn. Через 10 годин гідроліз ще не завершений. У присутності 20 мкл ферменту повний гідроліз був одержаний приблизно за 4 години. Результати кінетичних досліджень підтверджують гідроліз 6 фосфатних зв'язків, що спостерігався раніше. Ці результати ясно показують, що гідроліз двох останніх зв'язків явно повільніший, ніж для інших. Вважають, що за це частково є відповідальним ефект фосфату, який накопичується в середовищі, що інгібірує (Фіг. 9,10 і 11). У даному дослідженні автори винаходу описали біохімічні шляхи гідролізу фітинової кислоти фітазою D. castellii. Аналіз за допомогою хроматографії, а також гомо- і гетероядерного ЯМР дозволило недвозначно встановити структуру основних та інших InsP, утворених при цьому: lnsP5, lnsP4, lnsP3, lnsP2 i InsP1. Послідовність дефосфорилювання представлена на Фіг. 5. Вона може бути підсумовувана у формі 3/4/5/6/1,2. Хоча ізомери положення 1 або 3, а також 4 або 6 нерозрізняються шляхом ЯМР, проте, в результаті аналізу ВЕІХ автори винаходу змогли встановити, що фосфатні групи в положенні 3, а потім в положенні 4 є першими двома, по яких відбувається гідроліз. Кінетика, що прослідкувала при допомозі ЯМР, підтверджує це спостереження. Кожен подальший гідроліз відбувається на фосфатній групі, найближчій до гідроксильної групи. Гідроліз двох останніх фосфатних зв'язків в lns(1,2)P2 відбувається одночасно. Проте швидкість гідролізу положення 2 виявляється в два рази слабкішим, ніж в положенні 1 (або в положенні 3). Нарешті, незалежно від використовуваного методу (ферментативний, ВЕРХ або ЯМР) кількісне отримання інозиту в кінці гідролізу показує, що шість фосфатних зв'язків гідролізуються фітазою дріжджів D. castellii. Ця фітаза може бути класифікована як 3-фітаза (ЄС 3.1.3.8) подібно до багатьох фітаз мікроорганізмів. Приклад 2: Кпонування, гіперекспресія та біохімічна характеристика рекомбінантної фітази. МАТЕРІАЛИ І МЕТОДИ Організми, вектори і олігонуклеотидні послідовності Штами, плазміди і праймери, використані в даному дослідженні, описані в Таблиці 7. 33 Дріжджі Debaryomyces castellii CBS 2923 культивують в колбах Ерленмейєра, заповнених на 1/10 їх об'єму, в аеробних умовах при 28°С. При екстракції геномної ДНК штам культивують у при 94712 34 сутності 500 мл середовища YPD або 20 мл середовища MSA. Штам Е. соlі XL1-Blue MRF', що використовується при ампліфікації ДНК, культивують в колбах Ерленмейєра, заповнених на 1/10 їх об'єму, в ае 35 робних умовах при 37°С в середовищі ЛуріяБертані (Sambrook, J., Fritsch, E. F., Maniatis, Т. (1989) Molecular cloning: a laboratory manual. 2nd ed. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, USA) з додаванням ампіциліну (100 мг/л) або в "низькосолевому" середовищі Лурія-Бертані (NaCI 5 г/л), рН якого доводять до 7,5 гідроксидом натрію і до якої додавали зеоцин (25 мг/л). При культивуванні на твердому середовищі, до вищеописаних середовищ додають 15 г/л агару Bacto. Штам дріжджів Pichia pastoris X33 використовують для гетерологічної експресії гену, що кодує фітазу. Трансформанти відбирають в аеробних умовах при 28°С на середовищі YPDS з агаром із додаванням зеоцину (100 мг/л). Вектор pGEM-T (Promega) використовують для клонування в Е. соlі фрагментів, ампліфікованих за допомогою полімеразної ланцюгової реакції (ПЛР), і для секвенування ДНК. Селективним маркером в даній плазміді є ген стійкості до ампіциліну. Використовують два експресійних вектори pPICZaB і pGAPZaB (Таблиця 7). Вектор pPICZaB містить промотор гену алкогольоксидази (метанолоксидази) (АОХ1), який дозволяє одержати високі рівні експресії гену, що представляє інтерес, в P. pastoris; і експресія рекомбінантного білку індукується метанолом (Cereghino, J. L and Cregg, J. M. (2000) Heterologous protein expression in the methylotrophic yeast Pichia pastoris. Ferns Microbiology Reviews 24, 45-66). Вектор pGAPZaB містить промотор гену гліцеральдегід-3фосфатдегідрогенази (GAP), який забезпечує конститутивну експресію високого рівня рекомбінантного білку в P. pastoris (Waterham, H. R., Digan, Μ. Ε., Koutz, P. J., Lair, S. V. and Cregg, J. M. (1997) Isolation of the Pichia pastoris glyceraldehyde-3phosphate dehydrogenase gene and regulation and use of its promoter. Gene 186, 37-44). Ці два вектори несуть також послідовності, необхідні для реплікації в бактеріях. Відбір клонів, трансформованих цими векторами, заснований на селективному маркері зеоцині, і цей відбір можна застосувати як до P. pastoris, так і до Е. соlі. Крім того, рекомбінантні білки експресуються у вигляді злиття з сигнальною послідовністю о> фактору S. cerevisiae. Середовища D. castellii CBS 2923 культивують в присутності середовища YPD (дріжджовий екстракт 10 г/л, пептон 20 г/л, глюкоза 20 г/л) або в середовищі MSAВ (див. Приклад 1, Матеріали і методи), забуференному при рН 5,4 100 мМ фталатним буфером. Після трансформації трансформанти P. pastoris X33 відбирають на твердому середовищі YPDS (дріжджовий екстракт 10 г/л, пептон 20 г/л, глюкоза 20 г/л, сорбіт 1 М, агар Bacto 20 г/л). При відборі клонів-продуцентів на середовище з агаром трансформанти P. pastoris культивують на синтетичному твердому середовищі, що містить глюкозу або метанол в концентрації 0,5%, агар Bacto 20 г/л, солі FM21 100 мл/л (10х FM21: CaSO4.2H2O 1,5 г/л, K2SO4 23,8 г/л, MgSO4.7H2O 19,5 г/л, КОН 6,5 г/л, Н3РО4 85% 3,5% об/об), мікроелементи РТМ1 10 мл/л (100х РТМ1: ZnCI2 2 г/л, Fe(SO4).7H2O 6,5 г/л, CuSO4.5H2O 0,6 г/л, MnSO4.H2O 0,3 г/л, KІ 10 94712 36 мг/л, Н3SО3 2 мг/л, Na2MoO4 20 мг/л, H2SO4 96% 0,2%), (NH4)2SO4 4 г/л, H2PO4NH4 12 г/л і D-біотин 80 мкг/л, забуференному при рН 5,4 200 мМ тартрат-фосфатним буфером. При відборі клонівпродуцентів в рідкому середовищі трансформанти P. pastoris культивують в синтетичному середовищі, що містить джерело вуглеводню (глюкозу 10 г/л, гліцерин 20 г/л або метанол 3,9 г/л), солі FM21 100 мл/л, мікроелементи РТМ1 10 мл/л, (NH4)2SO4 4 г/л, H2PO4NH4 12 г/л і D-біотин 80 мкг/л, забуференному при рН 5,4 200 мМ тартрат-фосфатним буфером. При культивуванні в біореакторі попередні культури отримують в середовищі YMPG (дріжджовий екстракт 3 г/л, солодовий екстракт 3 г/л, пептон 5 г/л, глюкоза 10 г/л), потім в синтетичному середовищі: гліцерин 40 г/л, солі FM21 100 мл/л, мікроелементи РТМ1 10 мл/л, (NH4)2SO4 4 г/л, H2PO4NH4 12 г/л і D-біотин 80 мкг/л, забуференному при рН 5,4 200 мМ тартрат-фосфатним буфером (Klein et al., 1998). Культивування в періодичному режимі проводять в синтетичному середовищі, що містить гліцерин 40 г/л або глюкозу 20 г/л, солі FM21 100 мл/л, мікроелементи РТМ1 10 мл/л і D-біотин 80 мкг/л. При проведенні другого періоду культивування у ферментер додають розчин гліцерину, так щоб кінцева концентрація гліцерину складала 40 г/л. Це додавання проводять після повного споживання початково присутнього гліцерину, що було можливо виявити по різкому зростанню вмісту розчиненого кисню. Культури в режимі з підживленням підживлюють синтетичним середовищем, що містить гліцерин 400 г/л, глюкозу 400 г/л або метанол 780 г/л, мікроелементи РТМ1 50 мл/л та Dбіотин 1 мг/л. Культуру в безперервному режимі підживлюють синтетичним середовищем: метанол 66,67 г/л, солі FM21 50 мл/л, мікроелементи РТМ1 25 мл/л і D-біотин 500 мкг/л. Екстракція геномної ДНК Швидка екстракція геномної ДНК (гДНК) Клітини, що мають походження від культури D. castellii CBS 2923, вирощені на середовищі MSA, збирають після 9 годин культивування, центрифугують (3500хg, 20 хв +4°С) і промивають в 10 мл стерильної води. Потім клітини ресуспендують в 200 мкл лізуючого буферу (Трис-НСІ 10 мМ, рН 8, ЕДТА 1 мМ, NaCI 100 мМ, Тритон Х-100 2% об/об, ДСН 1% масс/об), 200 мкл скляних кульок (діаметр 0,45-0,5 мм) і 200 мкл суміші фенол/хлороформ/ізоаміловий спирт (25/24/1; об/об/об). Лізис клітин здійснюють шляхом інтенсивного перемішування протягом 3 хв, а потім додають 200 мкл буферу ТЕ (Трис-НСІ 10 мМ, ЕДТА 1 мМ, рН 8). Розчин центрифугують (8000хg, 5 хв +4°С). Білки з водної фази екстрагують рівним об'ємом суміші хлороформ/ізоаміловий спирт (24/1; об/об) з подальшим центрифугуванням (8000хg, 2 хв +4°С). Геномну ДНК осаджують 1 мл абсолютного етанолу (-20°С), центрифугують (12000хg, 5 хв +4°С) і знову розчиняють в 370 мкл буфера ТЕ. РНК видаляють шляхом інкубації протягом 15 хв при +37°С у присутності 75 мкг/мл РНКази А. Потім ДНК осаджують абсолютним етанолом (-20°С), ресуспендують в 50 мкл буфера ТІ і зберігають при -20°С. 37 Отримання рідкого препарату високомолекулярної ДНК з дріжджів Клітини, що мають походження від культури, вирощені в 500 мл середовища YPD, збирають під час експоненціальної фази, центрифугують (6000хg, 75 хв +4°С) і промивають в 40 мл стерильної води. Осад повторно розчиняють в 3,5 мл розчину SCE (сорбіт 1 М, цитрат натрію 0,1 М, ЕДТА 60 мМ), що містить 40 мкл 2 Μ дитіотрейтолу і 5 міліграм (5000 U) зимолази 100-Т (ICN Biomedical, 32093) і інкубують протягом 1 год при +37°С. Потім до суспензії додають 7 мл лізуючого розчину (Трис-НСІ 0,5 М, рН 6,5, саркозилат натрію 3,2% масс/об, ЕДТА 0,2 М, протеїназа К 100 мкг/мл (Roche Diagnostics, Meylan, France)) та інкубують її протягом 15 хв при +65°С, а потім швидко охолоджують до температури навколишнього середовища. Градієнт щільності сахарози готують шляхом послідовної заливки в пробірку для ультрацентрофугування 11 мл 20% сахарози масс/об, 11 мл 15% сахарози мас/об і 3 мл 50% сахарози масс/об. Лізовану клітинну суспензію обережно напластовують на градієнт, а потім піддають ультрацентрофугуванню протягом 3 год при 26000 об/хв при +20°С (ультрацентрифуга Centrikon T-1075, Kontron Instrument). ДНК, що утворює хмару в градієнті, витягують піпеткою, осаджують етанолом і ресуспендують в 100 мкл буфера ТІ (Трис-НСІ 10 мМ, ЕДТА 1 мМ, рН 8). РНК видаляють шляхом інкубації протягом 3 год при +37°С у присутності 50 мкг/мл РНКази А. гДНК знову осаджують етанолом, а потім ресуспендують в 200 мкл буфера ТЕ і зберігають при -20°С. Клонування гену фітази Ампліфікація першого фрагменту гена Полімеразну ланцюгову реакцію (ПЛР) проводять з використанням в якості матриці гДНК D. castellii CBS 2923, одержану методом швидкої екстракції геномної ДНК. Пара праймерів phyt-Nterfor/phyt-pep1-rev була сконструйована на основі послідовності білка при обмеженні до максимального ступеня виродженості (Таблиця 7). ДНК ампліфікують Taq полімеразою (Promega), використовуючи термоциклер Minicycler (MJ Research). Після першої денатурації гДНК протягом 3 хв при +94°С ампліфікацію проводять протягом 30 циклів згідно наступній температурній програмі: 1 хв денатурації при +94°С, 1 хв гібридизації при +45°С, потім 1 хв полімеризації при +72°С. За цими циклами слідувало плато протягом 10 хв при +72°С. Клонування повнорозмірної послідовності гену фітази Повнорозмірну послідовність цього гену одержують при використанні методики "прогулянки по геному" (набір Universal Genome Walker Kit, BD Biosciences) відповідно до інструкцій постачальника. гДНК D. castellii CBS 2923 (2,5 мкг), екстраговану методом "отримання рідкого препарату високомолекулярної ДНК дріжджів", переварюють протягом 16 год при +37°С чотирма ферментами рестрикції окремо (50 од. Dral, EcoRV, Pvull або Stul). Таким чином, кожен фрагмент має тупі кінці. Фрагменти очищають екстракцією сумішшю фенол/хлороформ і осаджують етанолом. Потім фра 94712 38 гменти лігують з адаптерами, що поставляються у складі набору для "прогулянки по геному", протягом 16 год при +16°С. Лігування зупиняють нагріванням при +70°С протягом 5 год з подальшим додаванням 9 об'ємів буфера ТІ. Таким чином, сконструювали 4 бібліотеки послідовностей і назвали "бібліотека Dral, EcoRV, Pvull і Stul". Перший цикл прогулянки по геному проводять, використовуючи кожну бібліотеку як матрицю і пару праймерів, що включає праймер АР1, специфічний до адаптера, і праймери 5phyt-spe-1/3phyt-spe-1, специфічні до гена (Таблиця 7). Ефективність цього першого циклу ПЛР перевіряють електрофорезом в 1,5% агарозному гелі LE. Суміш, одержану в результаті першої ПЛР, розводять в 50 разів і використовують як матрицю для другого циклу ПЛР. Цей другий цикл проводять, використовуючи праймер АР2, специфічний до другого адаптера, і праймери 5phyt-spe-2/3phyt-spe-2, специфічні до гену (Таблиця 7). Ампліфіковані таким чином фрагменти розділяють електрофорезом в гелі з 1,2% легкоплавкої агарози, очищають з використанням набору "GeneClean" і клонують у векторі pGEM-T для подальшого секвенування. Другий цикл прогулянки по геному необхідний для отримання повнорозмірної послідовності гену. Для кожної бібліотеки проводять по два цикли ампліфікації ПЛР, як описано вище, з використанням праймерів AP1/3bisphyt-spe-1 для першого циклу і AP2/3bisphyt-spe-2 для другого циклу (Таблиця 7). Конструювання експресійних плазмід Для клонування гену phytDc в P. pastoris з використанням експресійних векторів pPICZaB і pGAPZaB повнорозмірну послідовність гену ампліфікують за допомогою ПЛР. Цю ПЛР проводять з використанням у якості матриці гДНК D. castellii CBS 2923, одержаної методом швидкої екстракції геномної ДНК, використовуючи полімеразу Pfu Turbo (Stratagene). Використана при цій ампліфікації пара праймерів phytDc-Pstl-for і phytDc-Xbalrev (Таблиця 7) дозволила створити сайти рестрикції Pstl і Xbal, відповідно, в положеннях 5' і 3' гену. Після першої денатурації гДНК протягом 2 хв при +95°С ампліфікацію проводять протягом 25 циклів за наступною температурною програмою: 30 з денатурації при +95°С, 30 з гібридизації при +55°С, потім 1,5 хв полімеризації при +72°С. За цими циклами слідувало 10-хвилинне плато при +72°С. Відсутність мутацій перевірена секвенуванням. Трансформація 1 Клітини Е. соlі XL1-blue MRF трансформують методом теплового шоку, як описано Sambrook et al. (Sambrook, J., Fritsch, E. F., and Maniatis, T. (1989) Molecular cloning: a laboratory manual. 2nd ed. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, USA). Клітини P. pastoris X33 трансформують шляхом електропорації (Invitrogen instruction manual pPICZaA, В and C, version Ε або Invitrogen instruction manual pGAPZaA, В and C, version F, Invitrogen Ltd, UK). Трансформацію проводять за допомогою приладу Gene Pulser (Biorad) з установкою напруги 1,5 кВ і місткості 25 мкФ і Pulse Controller (Biorad), відрегульованого на 200 Ом. Синтез і аналіз послідовностей 39 Олігонуклеотиди, використані як праймери для ПЛР, були синтезовані фірмою MWG-Biotech (Німеччина). Мікросеквенування N-кінцевої послідовності і внутрішніх пептидів фітази проводили з використанням мікросеквенатора білків (Beckman/porton LF 3000), використовуючи реактиви і методи, рекомендовані виробником. Мікросеквенатор був безпосередньо сполучений з хроматографічною системою ОФ-ВЕРХ (ВЕРХ з оберненою фазою) (Beckman 125S), з УФ детектором при 268 нм (Beckman 166). Дані обробляли програмою Gold V8.20. Пошук локальних вирівнювань між нуклеотидними або білковими послідовностями і загальними базами даних здійснюють за допомогою програм BLAST2 (Basic Local Alignment Search Tool) і FASTA. Порівняння між двома послідовностями здійснюють для нуклеїнової кислоти або білку за допомогою програм LALIGN і LFASTA з пакету FASTA. Ці програми доступні на сервері Infobiogen (http://www.infobiogen.fr). Прогноз сигнального пептиду і розрахунок теоретичних значень рНі на основі білкових послідовностей проводять за допомогою програми Antheprot 2000 V5.2 випуск 1.1.6. Сайти глікозилювання передбачають, використовуючи сервери NetNGIyc 1.0, DictyOGIyc 1.1 і NetOGIyc 2.0, Center for Biological Sequence Analysis, Technical University of Denmark. Відбір клонів-продуцентів в рідкому середовищі Трансформанти P. pastoris pGAPphyt культивують при +28°С у 5 мл синтетичного мередовища із змістом глюкози 10 г/л. Після 48 год культури центрифугують протягом 5 хв при 1676хg. Надосадкові рідини зберігають при +4°С. Трансформанти P. pastoris pPICphyt культивують при +28°С у 5 мл того ж середовища, що містить 20 г/л гліцерину замість глюкози. Після 48 год культури центрифугують протягом 5 хв при 1676хg. Продукування recPhyt індукують додаванням 2,5 мл того ж середовища, що містить 3,9 г/л метанолу замість глюкози, в пробірки, що містять клітини. Після 24 год індукції культури центрифугують протягом 5 хв при 1676хg. Надосадкові рідини зберігають при +4°С. Це культивування проводять в стерильних пробірках на 13 мл. Продукування рекомбінантної фітази Попереднє культивування в колбах Ерленмейєра Попередні культивування проводять в середовищі YMPG в колбах Ерленмейєра, заповнених на 1/10 їх об'єму. Культури інкубують при +28°С при струшуванні (80 коливань в хвилину, амплітуда 7 см) протягом 24 год. Потім одержували попередні культури в синтетичному середовищі протягом 24 год. Культури в біореакторі Культури в періодичному режимі, режимі з підживленням і безперервному режимі проводять у ферментерах Applikon на 1 л або 3 л (Нідерланди). рН доводять до 4 шляхом автоматичного додавання 16% NH3 (об/об) або 2 н. H2SO4, а температуру підтримують при +28°С. Щоб уникнути піноутворення в ході культивування додають піногасник Biospumex 153K (Cognis Dusseldorf, Germany): 5% (об/об) піногасника для культур з підживленням і 94712 40 1% (об/об) піногасника для безперервних культур. Парціальний тиск розчиненого кисню вимірюють, використовуючи зонд Applisens (Нідерланди) і підтримують при значенні, що перевищує 30%, шляхом регуляції перемішування і аерації. Збір даних і перевірку культур здійснюють, використовуючи програмне забезпечення BioExpert (Applikon). Умови культивування Див. приклад 1, культивування у ферментері. Визначення концентрації біомаси Клітинні концентрації вимірюють по оптичній щільності (OD) з використанням спектрофотометра (DU530, Beckman Instruments Inc., Fullerton, CA, USA) при 600 им. Одна одиниця OD відповідає 0,462 г сухої речовини/л (rСВ/л) на гліцерині, 0,442 rСВ/л на метанолі і 0,491 rСВ/л на глюкозі. Очищення рекомбінантної фітази Див. приклад 1, Матеріали і методи 3. Електрофорез в ДСН-ПААГ Див. приклад 1, Матеріали і методи 4. Визначення концентрації білків Див. приклад 1, Матеріали і методи 7.2. Ферментативні методики Визначення фітазной активності на середовищі з агаром Фітазну активність виявляють, використовуючи метод Kim et al. (Kim, Y. О., Kіm, Н. K., Вае, K. S., Yu, J. Η. and Oh, Т. K. (1998) Purification and properties of a thermostable phytase from Bacillus sp. DS11. Enzyme Microb. Technol. 22, 2-7), модифікований для специфічної візуалізації фосфатаз в поліакриламідному гелі. Трансформанти P. pastoris культивують в аеробних умовах при +30°С на твердому синтетичному середовищі, що містить 0,5% глюкози або метанолу залежно від використовуваного вектору. Ці культури інкубують протягом 3 діб. У разі клонів Р. pastoris, трансформованих модифікованим вектором pPICZaB, під кришки чашок Петрі щодоби, починаючи з третьої доби, додають по 50 мкл метанолу. Проявляючий розчин (агар Bacto 10 г/л, α-нафтилфосфат 2 г/л, FastGarnetGBC 1 г/л, фітат натрію 0,92 г/л, забуференний до рН 5,5 0,25 Μ натрійацетатним буфером) готують безпосередньо перед використанням, охолоджують до 45°С і наливають тонким шаром на колонії. Фарбування клонів-продуцентів фітази (коричневе або темно-червоне) з'являється негайно. Визначення фітазної активності по гідролізу фітата Див. приклад 1, Матеріали і методи 7.3. Визначення фітазної активності по гідролізу пара-нітрофенілфосфата (p-NPP) Активність визначають за допомогою кінетики ферментативних реакцій. Реакційне середовище (сумарно 2 об'єми), забуференне при рН 5,5 (125 мМ натрійацетатний буфер), містить 6 мМ паранітрофенілфосфата, а також розведений або нерозведений ферментний екстракт (1 об'єм). Після різних періодів інкубації при температурі навколишнього середовища реакцію зупиняють додаванням 0,3 н. гідроксиду натрію (1 об'єм) для підлуження середовища і прояву фарбування. 41 Поглинання вимірюють при 450 нм на спектрофотометрі з прочитуючим пристроєм для мікротитраційних планшетів Sanofi Pasteur PR 2100. Одиницю ферментативної активності (U) визначають як кількість ферменту, що вивільнює 1 мікромоль пари-нітрофенолу в хвилину з розчину паранітрофенілфосфату в певних умовах: температура навколишнього середовища, рН 5,5. Заздалегідь будують калібрувальну криву з паранітрофенілфосфатом (0,012-0,12 мкмоль). Кінетичні дослідження Див. приклад 1, 7.5 і 7.6. РЕЗУЛЬТАТИ Характеристика гену фітази Клонування гену фітази D. castellii CBS 2923 Були секвеновані внутрішній пептид і Nкінцевий пептид чистої фітази D. castellii. На основі цих пептидних послідовностей сконструйовані праймери для ПЛР, обмежені максимальним ступенем виродженості (Таблиця 7). ПЛР проводять з використанням в якості матриці гДНК D. castellii CBS 2923. Таким чином, ампліфікується фрагмент завдовжки приблизно 300 пар основ (по). Для клонування повнорозмірної послідовності гену фітази D. castellii CBS 2923 автори винаходу вибрали методику "прогулянки по геному". На основі послідовності фрагменту 300 по, одержаного заздалегідь, синтезовані праймери, відповідні кінцям цього фрагменту і що дозволяють ампліфікувати послідовності, прилеглі до цього фрагменту (Таблиця 7). ПЛР проводять з використанням у якості матриці бібліотек гДНК D. castellii CBS 2923. Перший цикл дозволив ампліфікувати фрагмент завдовжки приблизно 1600 по вище і приблизно 1100 по нижче послідовності 300 по на основі бібліотек EcoRV і Pvull відповідно. Таким чином, автори винаходу змогли відновити фрагмент завдовжки приблизно 3000 по, що містить відкриту рамку зчитування (ВРЗ) завдовжки 1325 по, укорочену з 3'-кінця. Другий цикл ПЛР був проведений з використанням нових праймерів, сконструйованих на основі 3'кінця фрагменту, одержаного в ході першої ПЛР. Ця ПЛР дозволила ампліфікувати фрагмент завдовжки приблизно 100 по на основі бібліотеки EcoRV. Таким чином, автори винаходу змогли відновити відкриту рамку прочитування завдовжки 1386 по. Білкова послідовність, виведена на основі цієї ВРЗ, містить два раніше секвенованих пептиди, що дозволяє підтвердити, що цей ген відповідає гену, який кодує фітазу D. castellii CBS 2923 (див. SEQ ID No.1). Для перевірки послідовності були синтезовані праймери, відповідні кінцям гену (Таблиця 7). Повнорозмірний ген був ампліфікований за допомогою ПЛР, і секвенування підтвердило раніше отримані результати. Аналіз нуклеотидної та білкової послідовностей Завдяки серії експериментів "прогулянка по геному" можна було відновити фрагмент 2990 по. Цей фрагмент містить відкриту рамку прочитування 1386 по, названу "послідовність phytDc". Відповідна білкова послідовність 461 амінокислотний залишок містить декілька мотивів (SEQ ID No. 2). Мотив RHGERYP відповідає узгодженій послідовності RHGXRXP, присутній в активному центрі 94712 42 безлічі високомолекулярних кислих фосфатаз. Ця послідовність також має мотив HD в С-кінцевій ділянці, яка є мотивом, присутнім в багатьох послідовностях фітаз. N-кінцева послідовність починається з другої амінокислоти виведеного білку, що, мабуть, указує на те, що цей білок, хоч і секретуєтся, не містить сигнального пептиду. Це спостереження підтверджується фактом отримання негативного результату при пошуку потенційного сайту відщеплення сигнального пептиду з використанням програми Antheprot. Виведений білок має оціночну молекулярну масу 51,2 кДа, подібну масі, одержаній експериментально (53/55 кДа) за допомогою мас-спектрометрії з використанням білку, експресуємого в D. castellii CBS 2923, очищеного і деглікозильованого ендоглікозидазою Н. Різниця в масі може бути пояснена наявністю залишків Nацетилглюкозаміну або мотивів О-глікозилювання, які не віддаляються ендоглікозидазою Н. Аналіз білкової послідовності показує наявність 9 потенційних сайтів N-глікозилювання і 4 потенційних сайтів О-глікозилювання. рНі цього білку оцінена як 4,3. Пошук гомологій в базах даних показує, що фітаза D. castellii CBS 2923 володіє від 21 до 36% гомології з різними фітазами дріжджового або грибкового походження. Розміри послідовностей цих фітаз є вельми схожими (440-480 амінокислот), але фітаза D. castellii CBS 2923 не вирівнюється точно по всій довжині її послідовності. Послідовність phytDc по всій своїй довжині володіє 69,2% гомології з послідовністю фітази S. occidentalis. Оскільки послідовність гену, що кодує фітазу S. occidentalis, була одержана на основі комплементарної ДНК, це вирівнювання дозволяє авторам винаходу вважати, що ген, що кодує фітазу D. castellii, не містить інтрони. Крім того, ця послідовність проявляє гомології з фосфатазами. Відбір клонів P. pastoris, які є надпродуцентами рекомбінантної фітами Ген phytDc був ампліфікований за допомогою ПЛР і вбудований в експресійні вектори pPICZaB і pGAPZaB. Трансформанти відбирали на середовищі YPDS, що містить зеоцин. Ефективність трансформації склала 102 трансформантів на мікрограм ДНК. Клони, одержані з вектором pPICZaB, були названі "клони РІС", а клони, одержані з вектором pGAPZaB, були названі "клони GAP". Для кожної трансформації були випадково відібрані 100 клонів, і продукування ними рекомбінантної фітази (recPhyt) оцінювали на середовищі з агаром. Після візуалізації клони, які є найвищими продуцентами, проявляють коричневе кільце навколо колонії. 96% клонів РІС і 66% клонів GAP є продуцентами. Серед клонів, які є найвищими продуцентами, 10 клонів GAP і 10 клонів РІС тестували на синтетичному середовищі в колбах Ерленмейєра. Для кожного клону було визначене відношення біомаси (оцінюваної по вимірюванню OD) до фітазної активності в надосадкової культуральній рідині (зміряної по гідролізу p-NPP). Відношення знаходиться в інтервалі від 0 до 0,48 серед клонів РІС і від 1,28 до 6,07 для клонів GAP. У даних умовах культивування клони GAP є кращими продуцентами. Згідно Waterham et al. (Waterham, H. R., Digan, Μ. Ε., Koutz, P. J., Lair, S. 43 94712 V. and Cregg, J. M. (1997) Isolation of the Pichia pastoris glyceraldehyde-3-phosphate dehydrogenase gene and regulation and use of its promoter. Gene 186, 37-44) промотор GAP при культивуванні на глюкозі виявляється сильнішим, ніж промотор АОХ1 при культивуванні на метанолі, в культурах Ерленмейєра. Для завершення цієї фази відбору, по-перше, клони РІС81 і РІС61 і, по-друге, клони GAP29 і GAP66 тестували у ферментері. Для клонів РІС дві послідовні періодичні культури на гліцерині (40 г/л) дозволили одержати високу біомасу перед індукцією метанолом (780 г/л) в режимі з підживленням. Для клонів GAP за першою періодичною культурою на глюкозі (20 г/л) слідувала фаза продукування в режимі з підживленням на глюкозі 400 г/л. Клон РІС81 дозволив одержати кінцеву біомасу 81 rСВ/л, тоді як кінцева біомаса клону РІС61 складала всього 65 rСВ/л. В той же час обидва клони 44 продукували по суті однакову кількість recPhyt (100 U/мл). Клони GAP проявляють однакове зростання (100 rСВ/л) в кінці культивування, проте одержане продукування складало 11 U/мл для клону GAP29 і 9 U/мл для клону GAP66. Одержані рекомбінантні штами продукують відповідно в 100 (штами РІС) і в 10 (штами GAP) разів більше фітази, ніж штам D. castellii CBS 2923 дикого типу. Продукування клонами РІС81 і GAP29 було оптимізовано у ферментері. Продукування рекомбінантної фітази Конститутивна експресія - Вплив джерела вуглецю і питомої швидкості росту на продукування клоном GAP Продукування recPhyt вивчали при культивуванні на глюкозі (400 г/л), гліцерині (400 г/л) і метанолі (780 г/л) в режимі з підживленням. Результати приведені в Таблиці 8. Таблиця 8 Порівняння параметрів, одержаних при культивуванні клону GAP29 у культурах з підживленням Для всіх експериментів фази періодичного культивування проводили на тому ж середовищі із змістом 40 г/л гліцерину Субстрати для культивування з підживленням Глюкоза устан. -1 μм 0,010 Гліцерин 0,010 Глюкоза 0,040 Гліцерин 0,040 Метанол 0,010 Біомаса Yx/s г/г rСВ/л Фаза культивування Періодична (49 год) З підживленням (94 год)* Кінцева (143 год)* Періодична (49 год) З підживленням (94 год)* Кінцева (143 год)* Періодична (26 год)* З підживл. 1 (38 год)* З підживл. 2 (24 год)* Кінцева (88 год)** Періодична (31 год)* З підживл. 1 (38,5 год)* З підживл. 2 (38,5 год)* Кінцева (93,5 год)** Періодична (29 год)* З підживл. 1113 год* Кінцева (142 год)** 19,3 34,6 53,9 20,5 35,2 55,7 19,2 44,6 17,7 81,5 20,3 45,3 13,2 78,8 40 43,8 83,8 Заг. -1 μм recPhyt U/мл Υ recPhyt/x U/rСВ 0,5 0,3 0,20 0,009 0,5 0,3 0,20 0,008 0,5 0,56 0,38 0,2 0,037 0,016 0,5 0,55 0,3 0,2, 0,039 0,016 0,5 0,16 0,15 0,009 6,5 10 16,5 7 9,6 16,6 5 7,1 3,9 16 6 7,3 3,3 16,6 9,6 4,9 14,5 340 289 306 341 272 298 260 159 220 196 295 161 250 210 240 112 173 *: Ці значення відповідають значенням, одержаним в ході кожної фази. **: Ці значення відповідають значенням в кінці культивування. У разі перших двох субстратів одна періодична культура на гліцерині (40 г/л) дозволяє одержати 20 г/л біомаси і питому швидкість росту 0,2 год 1 . Залежно від тривалості стаціонарної фази перед здійсненням культивування з підживленням продукування рекомбінантної фітази розрізняється: в області 7 U/мл, тобто 340 U/rСВ, для стаціонарної фази 12 год, в області 5,5 U/мл, тобто 275 U/rСВ, для стаціонарної фази 3 год. Продукування в режимі з підживленням на глюкозі і на гліцерині при -1 встановленій питомій швидкості росту 0,1 год дозволяє досягти 55 г/л біомаси і продукування фітази 16,5 U/мл, тобто 280 U/rCB. При культивуванні з підживленням на метанолі після двох пері одичних культур на гліцерині (40 г/л) і встановле-1 ній питомій швидкості росту 0,01 год досягнута біомаса складає 84 г/л, а продукування фітази складає 14,5 U/мл, тобто 112 U/rCB. Продукування в режимі з підживленням на глюкозі і гліцерині зі -1 встановленою питомою швидкістю росту 0,04 год дозволяє досягти 80 г/л біомаси і продукування фітази 16,5 U/мл, тобто 200 U/rCB. Коли продукування фітази знаходиться під контролем промотора GAP, глюкоза і гліцерин є кращими субстратами для продукування рекомбінантної фітази в порівнянні з метанолом, який є сприятливішим для зростання. 45 94712 Індуцибельна експресія - Вплив питомої швидкості росту на продукування фітази клоном РІС 46 Продукування фітази клоном РІС81 досліджували в режимі з підживленням (Фіг. 6 і Таблиця 9) і в безперервному режимі (Фіг. 6 і Таблиця 9). Таблиця 9 Порівняння параметрів, одержаних при культивуванні з підживленням і безперервному культивуванні клону РІС81 Спосіб культивування -1 Підживлення 0,01 год -1 Підживлення 0,03 год фаза 1 (64 год)* фаза 2 (54 год)* кінцева (118 год)** фаза 1 (22.5 год)* фаза 2 (28,5 год)* кінцева (51 год)** μ або D -1 год 0,012 0,011 Непреривний*** 0,047 0,033 0,032 0,053 0,077 0,095 Біомаса rСВ/л 28,8 22,9 51,7 32,5 49,6 82,1 21,6 27,2 26,3 26,6 Υ x/s г/г 0,21 0,18 0,41 0,28 0,32 0,41 0,39 0,40 recPhyt U/мл 34,7 72,3 107 16,7 47,2 63,9 57,7 11,6 5,7 3 Υ recPhyt/x U/rСВ 1105 2342 1337 472 880 614 2700 430 210 116 *: Ці значення відповідають значенням, одержаним в ході кожної фази. **: Ці значення відповідають значенням в кінці культивування. ***: Для кожного значення розбавлення вимірювання були проведені щонайменше після трьох оновлень вмісту ферментера. При культивуванні з підживленням було встановлено два значення питомої швидкості росту (μ) -1 -1 (0,01 год і 0,03 год ). Одержана біомаса в 1,5 -1 рази вище при μ = 0,03 год (82 г/л), ніж при μ = -1 0,01 год (52 г/л). Продукування фітази відбувається в дві фази (Таблиця 9). Для встановленої -1 питомої швидкості росту 0,01 год перша фаза приводить в результаті до продукування 28,8 г/л біомаси при продукуванні фітази 1105 U/rCB. В ході другої фази одержують 22,9 г/л біомаси, і продукування фітази досягає 2342 U/rCB, тобто 107 U/мл. Подібні результати одержують при μ = -1 0,03 год , де продукування фітази зростає від 472 U/rCB в ході першої фази до 880 U/rCB в ході другої фази, тобто на 64 U/мл. Збільшення питомої швидкості росту є сприятливішим для клітинного зростання, ніж для продукування рекомбінантної фітази. При безперервному культивуванні було встановлено чотири показники розбавлення (Таблиця 9). Для показників розбавлення вище 0,053 -1 год рівноважна біомаса складає 27 г/л, тоді як це значення складає всього 21,6 г/л при показнику -1 розбавлення 0,032 год . Як і при культивуванні в режимі з підживленням, підвищення показника розбавлення є сприятливим для виходу біомаси не на користь продукуванню рекомбінантних білків. Максимальні значення 2700 U/rCB, тобто 57,7 U/мл, одержують для показника розбавлення -1 0,032 год . Порівняння продукування фітази індуцибельною системою (промотор АОХ1, клон РІС81) і конститутивною системою (промотор GAP, клон GAP29) показує, що промотор АОХ1 безумовно перевершує промотор GAP. Штам РІС81 дозволив одержати 107 U/мл рекомбінантної фітази, тобто в 7 разів більше, ніж штам GAP29 (16 U/мл). Питома продуктивність складає відповідно 2700 U/rСВ (РІС 81) і 340 U/rСВ (GAP29), тобто в 100 і в 10 разів вище, ніж питома продуктивність штаму D. castellii. Очищення Надосадкову рідину, одержану після однієї з культур в режимі з підживленням клону РІС81, очищали в одну стадію, як описано в розділі Матеріали і методи. Питома фітазна активність складала 101 U на міліграм білку в грубому екстракті і 182 U на міліграм білку в очищеному екстракті. Показник очищення, таким чином, склав 1,8. Це відносно низьке значення дозволяє припустити, що рекомбінантна фітаза є переважаючим білком в грубому екстракті. Ця гіпотеза була підтверджена проведенням електрофорезу в ДСН-ПААГ. На гелі смуга, відповідна рекомбінантній фітазі, складає 60% всіх білків. Крім того, після очищення спостерігають єдину смугу, що, таким чином, підтверджує очищення білку до однорідності. Питома активність, одержана після очищення, перевищує питому активність, одержану при експресії фітази Aspergillus fumigatus в P. pastoris (43 U на міліграм білку) (Rodriguez, E., Mullaney, E. J. and Lei, X. G. (2000) Expression of the Aspergillus fumigatus phytase gene in Pichia pastoris and characterization of the recombinant enzyme. Biochem. Biophys. Res. Commun. 268, 373-378). Характеристика рекомбінантної фітази Ефекти рН RecPhyt є активною для значень рН між 2 і 6,5, а оптимум знаходиться між 4 і 4,5. Фітаза D. castellii CBS 2923 проявляє подібні характеристики. Ефекти температури Визначення фітазної активності при різних температурах показує, що рекомбінантна фітаза є активнішою при високих температурах при оптимумі при +60°С, подібно до фітази D. castellii CBS 47 2923. Велика частина цитованих в літературі значень оптимальної температури складає менше +45°С за винятком фітаз деяких грибів і дріжджів, таких як Aspergillus ficuum (+58°C) (Ullah, Α. Η. J. and Gibson, D. M. (1987) Extracellular phytase (ЄС 3.1.3.8) from Aspergillus ficuum NRRL 3135: purification and characterization. Prep. Biochem. 17, 63-91), Aspergillus terreus (+70°C) (Yamada, K., Minoda, Y. and Yamamoto, S. (1968) Phytase from Aspergillus terreus. I. Production, purification and some general properties of the enzyme. Agric. Biol. Chem. 32, 1275-1282) і S. castellii (+77°C) (Segueilha, L, Lambrechts, С, Boze, Η., Moulin, G. and Galzy, P. (1992) Purification and properties of the phytase from Schwanniomyces castellii. J. Ferment. Bioeng. 74, 7-11). Метод Ареніуса дозволяє розрахувати енергію активації реакції, Ε = 37,9 кДж/моль. Дослідження теплової денатурації показує, що рекомбінантна фітаза є стабільною при температурах нижче +67°С і сильно денатурує при температурах вище +70°С. Енергія активації, розрахована по Ареніусу, складає Ε = 794,2 кДж/моль. 94712 48 Фітаза D. castellii CBS 2923 проявляє подібні характеристики термостійкості. Специфічність до субстрату Рекомбінантна фітаза слідує кінетиці Міхаеліса-ментен з Km = 0,24 мМ і Vm = 137,8 U/мг на фітаті натрію і з Km = 2,05 мМ і Vm = 274,6 U/мг на p-NPP (визначено по графіку Лайнвівера-Берка, неопубліковані дані). Таким чином, фермент володіє вищою спорідненістю до фітату. Фітаза D. castellii CBS 2923 має подібні значення Km. Кінетичні дослідження Основними продуктами розщеплювання InsР6 є DL-lns(1,2,4,5,6)P5 і DL-lns(1,2,5,6)P4. Таким чином, рекомбінантна фітаза є 3-фітазою. Крім того, хроматографія показує, що розщеплювання lnsP5, lnsP4, lnsP3 і InsP2 починається навіть раніше виснаження lnsP6, і що відбувається накопичення lnsP3. Це дозволяє припустити, що рекомбінантна фітаза володіє слабкішою спорідненістю до lnsP3, ніж до lnsP4, lnsP5 і InsP6. Фітаза D. castellii CBS 2923 показує такі ж хроматографічні профілі. 49 94712 50 51 94712 52 53 94712 54 55 94712 56 57 94712 58 59 94712 60
ДивитисяДодаткова інформація
Назва патенту англійськоюPhytase of debaryomyces castellii
Автори англійськоюBOZE HELENE, Omelia Andre, MOULIN GUY
Назва патенту російськоюФитаза debaryomyces castellii
Автори російськоюБоз Елен, Омеля Андре, Мулен Ги
МПК / Мітки
МПК: C12N 9/16, A23K 1/165, C12N 1/15, C12N 1/19
Мітки: debaryomyces, castellii, фітаза
Код посилання
<a href="https://ua.patents.su/39-94712-fitaza-debaryomyces-castellii.html" target="_blank" rel="follow" title="База патентів України">Фітаза debaryomyces castellii</a>
Попередній патент: Вібраційна система (варіанти) та спосіб її виготовлення (варіанти), спосіб вібрування пластини (варіанти), система виробництва аерозолю та спосіб лікування пацієнта
Наступний патент: Композиція для стримування метаболізму алкоголю та для зменшення ризику спричинених алкоголем захворювань
Випадковий патент: Вакуумна камера для вакуумного плазмового азотування металевих деталей