Композиція (варіанти) та спосіб (варіанти) лікування вірусного гепатиту с
Номер патенту: 114097
Опубліковано: 25.04.2017
Автори: Хайндіс Роберт Г., Клірі Дерріл Г., Оліяй Реза, Хебнер Крісті М., Беррі Міріам Мішель, Рейнольдс Чарльз Дж., Зія Вехід, Кастіл Мелісса Жан, Пакдаман Ровчанак, Мо Хунмей, Рей Едріен С., Стефанідіс Дімітріос, Сімондс Вільям Т.
Формула / Реферат
1. Фармацевтична композиція, що містить:
а) від приблизно 25 % до приблизно 35 % у масовому відношенні кристалічного GS-7977, що має структуру
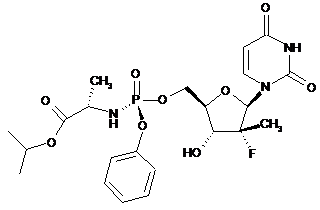 ; та
; та
b) щонайменше одну фармацевтично прийнятну допоміжну речовину,
де кристалічний GS-7977 має характеристичні сигнали порошкової рентгенівської дифракції при кутах 2q (°) приблизно 6,1 та 12,7.
2. Композиція за п. 1, яка відрізняється тим, що кристалічний GS-7977 має характеристичні сигнали порошкової рентгенівської дифракції при кутах 2q (°) приблизно: 6,1, 8,2, 10,4, 12,7, 17,2, 17,7, 18,0, 18,8, 19,4, 19,8, 20,1, 20,8, 21,8 та 23,3.
3. Композиція за п. 1, яка відрізняється тим, що щонайменше одна фармацевтично прийнятна допоміжна речовина включає щонайменше одну з розріджувача, дезінтегруючого агенту, ковзної речовини та змащувальної речовини.
4. Композиція за п. 3, яка відрізняється тим, що щонайменше одна фармацевтично прийнятна допоміжна речовина включає розріджувач, вибраний з групи, що складається з дикальційфосфату, целюлози, пресованих цукрів, двозаміщеного кальцію фосфату дигідрату, лактози, маніту, мікрокристалічної целюлози, крохмалю, трикальційфосфату та їх комбінацій.
5. Композиція за п. 4, яка відрізняється тим, що розріджувач вибраний з групи, що складається з маніту, мікрокристалічної целюлози та їх комбінацій.
6. Композиція за п. 3, яка відрізняється тим, що щонайменше одна фармацевтично прийнятна допоміжна речовина включає дезінтегруючий агент, вибраний з групи, що складається із кроскармелози натрію, кросповідону, мікрокристалічної целюлози, модифікованого кукурудзяного крохмалю, повідону, прежелатинізованого крохмалю, крохмальгліколяту натрію та їх комбінацій.
7. Композиція за п. 6, яка відрізняється тим, що дезінтегруючий агент являє собою кроскармелозу натрію.
8. Композиція за п. 3, яка відрізняється тим, що щонайменше одна фармацевтично прийнятна допоміжна речовина включає ковзну речовину, вибрану із групи, що складається з колоїдного діоксиду кремнію, тальку, крохмалю, похідних крохмалю та їх комбінацій.
9. Композиція за п. 8, яка відрізняється тим, що ковзна речовина являє собою колоїдний діоксид кремнію.
10. Композиція за п. 3, яка відрізняється тим, що щонайменше одна фармацевтично прийнятна допоміжна речовина включає змащувальну речовину, вибрану із групи, що складається зі стеарату кальцію, стеарату магнію, поліетиленгліколю, стеарилфумарату натрію, стеаринової кислоти, тальку та їх комбінацій.
11. Композиція за п. 10, яка відрізняється тим, що змащувальна речовина являє собою стеарат магнію.
12. Композиція за п. 1, що додатково містить покриваючий агент.
13. Композиція за п. 1, яка відрізняється тим, що щонайменше одна фармацевтично прийнятна допоміжна речовина включає:
a) від приблизно 55 % у масовому відношенні до приблизно 65 % у масовому відношенні розріджувача;
b) від приблизно 2,5 % у масовому відношенні до приблизно 7,5 % у масовому відношенні дезінтегруючого агенту;
c) від приблизно 0,25 % у масовому відношенні до приблизно 0,75 % у масовому відношенні ковзної речовини; та
d) від приблизно 1,25 % у масовому відношенні до приблизно 1,75 % у масовому відношенні змащувальної речовини.
14. Композиція за п. 1, яка відрізняється тим, що щонайменше одна фармацевтично прийнятна допоміжна речовина включає:
a) приблизно 30 % у масовому відношенні маніту та приблизно 30 % у масовому відношенні мікрокристалічної целюлози;
b) приблизно 5 % у масовому відношенні кроскармелози натрію;
c) приблизно 0,5 % у масовому відношенні колоїдного діоксиду кремнію; та
d) приблизно 1,5 % у масовому відношенні стеарату магнію.
15. Композиція за п. 1, яка відрізняється тим, що зазначена композиція містить:
a) приблизно 33 % у масовому підношенні кристалічного GS-7977;
b) приблизно 30 % у масовому відношенні маніту та приблизно 30 % у масовому відношенні мікрокристалічної целюлози;
c) приблизно 5 % у масовому відношенні кроскармелози натрію;
d) приблизно 0,5 % у масовому відношенні колоїдного діоксиду кремнію; та
e) приблизно 1,5 % у масовому відношенні стеарату магнію.
16. Стандартна лікарська форма, що містить:
а) приблизно 400 мг кристалічного GS-7977, що має структуру
 ; та
; та
b) щонайменше одну фармацевтично прийнятну допоміжну речовину,
де кристалічний GS-7977 має характеристичні сигнали порошкової рентгенівської дифракції при кутах 2q (°) приблизно 6,1 та 12,7.
17. Стандартна лікарська форма за п. 16, яка відрізняється тим, що кристалічний GS-7977 має характеристичні сигнали порошкової рентгенівської дифракції при кутах 2q (°) приблизно: 6,1, 8,2, 10,4, 12,7, 17,2, 17,7, 18,0, 18,8, 19,4, 19,8, 20,1, 20,8, 21,8 та 23,3.
18. Стандартна лікарська форма за п. 16, яка відрізняється тим, що щонайменше одна фармацевтично прийнятна допоміжна речовина включає щонайменше одну з розріджувача, дезінтегруючого агенту, ковзної речовини та змащувальної речовини.
19. Стандартна лікарська форма за п. 18, яка відрізняється тим, що щонайменше одна фармацевтично прийнятна допоміжна речовина включає розріджувач, вибраний з групи, що складається з дикальційфосфату, целюлози, пресованих цукрів, двозаміщеного кальцію фосфату дигідрату, лактози, маніту, мікрокристалічної целюлози, крохмалю, трикальційфосфату та їх комбінацій.
20. Стандартна лікарська форма за п. 19, яка відрізняється тим, що розріджувач вибраний з групи, що складається з маніту, мікрокристалічної целюлози та їх комбінацій.
21. Стандартна лікарська форма за п. 18, яка відрізняється тим, що щонайменше одна фармацевтично прийнятна допоміжна речовина включає дезінтегруючий агент, вибраний з групи, що складається із кроскармелози натрію, кросповідону, мікрокристалічної целюлози, модифікованого кукурудзяного крохмалю, повідону, прежелатинізованого крохмалю, крохмальгліколяту натрію та їх комбінацій.
22. Стандартна лікарська форма за п. 21, яка відрізняється тим, що дезінтегруючий агент являє собою кроскармелозу натрію.
23. Стандартна лікарська форма за п. 18, яка відрізняється тим, що щонайменше одна фармацевтично прийнятна допоміжна речовина включає ковзну речовину, вибрану із групи, що складається з колоїдного діоксиду кремнію, тальку, крохмалю, похідних крохмалю та їх комбінацій.
24. Стандартна лікарська форма за п. 23, яка відрізняється тим, що ковзна речовина являє собою колоїдний діоксид кремнію.
25. Стандартна лікарська форма за п. 18, яка відрізняється тим, що щонайменше одна фармацевтично прийнятна допоміжна речовина включає змащувальну речовину, вибрану із групи, що складається зі стеарату кальцію, стеарату магнію, поліетиленгліколю, стеарилфумарату натрію, стеаринової кислоти, тальку та їх комбінацій.
26. Стандартна лікарська форма за п. 25, яка відрізняється тим, що змащувальна речовина являє собою стеарат магнію.
27. Стандартна лікарська форма за п. 16, що додатково містить покриваючий агент.
28. Стандартна лікарська форма за п. 16, яка відрізняється тим, що щонайменше одна фармацевтично прийнятна допоміжна речовина включає:
a) від приблизно 660 мг до приблизно 780 мг розріджувача;
b) від приблизно 30 мг до приблизно 90 мг дезінтегруючого агенту;
c) від приблизно 3 мг до приблизно 9 мг ковзної речовини; та
d) від приблизно 15 мг до приблизно 21 мг змащувальної речовини.
29. Стандартна лікарська форма за п. 16, яка відрізняється тим, що стандартна лікарська форма містить:
a) приблизно 400 мг кристалічного GS-7977;
b) приблизно 360 мг маніту та приблизно 356 мг мікрокристалічної целюлози;
c) приблизно 60 мг кроскармелози натрію;
d) приблизно 6 мг колоїдного діоксиду кремнію; та
e) приблизно 18 мг стеарату магнію.
30. Стандартна лікарська форма за п. 16, яка відрізняється тим, що стандартна лікарська форма включає капсулу або таблетку.
31. Спосіб одержання таблетованої композиції стандартної лікарської форми за п. 16, що включає:
змішування внутрішньогранулярної композиції та позагранулярної композиції з одержанням змішаної композиції;
пресування змішаної композиції з одержанням таблетованої композиції; та
можливо, покриття таблетованої композиції;
при цьому
внутрішньогранулярна композиція містить GS-7977, перший внутрішньогранулярний розріджувач, можливо другий внутрішньогранулярний розріджувач,
внутрішньогранулярний дезінтегруючий агент, внутрішньогранулярну ковзну речовину та внутрішньогранулярну змащувальну речовину; та
позагранулярна композиція містить перший позагранулярний розріджувач, можливо другий позагранулярний розріджувач, позагранулярну ковзну речовину, позагранулярний дезінтегруючий агент та позагранулярну змащувальну речовину.
32. Таблетована композиція, що містить приблизно 400 мг GS-7977, отримана у відповідності зі способом за п. 31.
33. Спосіб лікування людини, інфікованої вірусом гепатиту С, що включає введення людині композиції за п. 1.
34. Спосіб за п. 33, який відрізняється тим, що композицію за п. 1 вводять людині у комбінації з рибавірином.
35. Спосіб лікування людини, інфікованої вірусом гепатиту С, що включає введення людині стандартної лікарської форми за п. 16.
36. Спосіб за п. 35, який відрізняється тим, що стандартну лікарську форму вводять людині у комбінації з рибавірином.
37. Спосіб за п. 36, який відрізняється тим, що стандартну лікарську форму вводять людині у комбінації з рибавірином у рамках схеми лікування без застосування інтерферону.
Текст
Реферат: У даній заявці запропонована композиція та стандартна лікарська форма для лікування інфекції вірусу гепатиту С (ВГС), що включає GS-7977 та щонайменше одну фармацевтично прийнятну допоміжну речовину, а також способи одержання зазначеної композиції та стандартної лікарської форми. У даній заявці також запропонований спосіб лікування суб'єкта, переважно людини, інфікованої вірусом гепатиту С, що включає введення суб'єктові протягом деякого періоду часу ефективної кількості GS-7977 та ефективної кількості рибавірину. У одному аспекті зазначений спосіб включає введення суб'єктові схеми лікування без застосування інтерферону, що включає ефективну кількість GS-7977 та ефективну кількість рибавірину. У конкретному аспекті зазначений спосіб є достатнім для досягнення недетектованої кількості РНК ВГС у суб'єкта протягом щонайменше 12 тижнів після закінчення зазначеного періоду часу. UA 114097 C2 (12) UA 114097 C2 UA 114097 C2 5 10 15 20 25 30 35 40 45 50 55 60 ГАЛУЗЬ ТЕХНІКИ У даній заявці запропонована композиція та стандартна лікарська форма для лікування інфекції вірусу гепатиту C (ВГC), що містить GS-7977 та щонайменше одну фармацевтично прийнятну допоміжну речовину, а також способи одержання зазначеної композиції та стандартної лікарської форми. У даній заявці також запропонований спосіб лікування суб'єкта, переважно людини, інфікованої вірусом гепатиту C, що включає введення суб'єктові протягом деякого періоду часу ефективної кількості GS-7977 та ефективної кількості рибавірину. У одному аспекті зазначений спосіб включає застосування відносно суб'єкта схеми лікування без застосування інтерферону, що включає ефективну кількість GS-7977 та ефективну кількість рибавірину. У конкретному аспекті зазначений спосіб є достатнім для досягнення недетектуємої кількості РНК ВГC у суб'єкта протягом щонайменше 12 тижнів після закінчення зазначеного періоду часу. РІВЕНЬ ТЕХНІКИ Інфекція вірусу гепатиту C ("ВГC") являє собою серйозну проблему у галузі охорони здоров'я, що веде до хронічної хвороби печінки, такої як цироз та печінково-клітинна карцинома, у значної кількості інфікованих індивідів, яку Всесвітня організація охорони здоров'я оцінила як приблизно 3 % населення світу (World Health Organization, Hepatitis C (2002)). Згідно даним Центрів контролю та профілактики захворювань у США, ВГC являє собою найпоширенішу у Сполучених Штатах гемоконтактну інфекцію, якою тільки у Сполучених Штатах, згідно з оцінкою, хронічно інфіковано 3,2 мільйони людей (1,8 %). (U.S. Centers For Disease Control and Prevention, Viral Hepatitis Surveillance - United States, 2010; U.S. Centers For Disease Control and Prevention, Morbidity and Mortality Weekly Report 70(17): 537-539 (6 травня 2011 р.)). Приблизно 150-180 мільйонів індивідів хронічно інфіковані ВГC у всьому світі, при цьому щороку інфікується від 3 до 4 мільйонів людей (World Health Organization, Hepatitis C, Fact Sheet No. 164 (липень, 2012 р.); Ghany et al., Hepatology (2009) 49(4): 1335-1374). Після інфікування приблизно 20 % людей позбуваються від вірусу, але у інших ВГC може залишитися до кінця життя. У десяти-двадцяти відсотків хронічно інфікованих індивідів, зрештою, розвиваються руйнуючі печінку цироз або рак (Naggie et al., J. Antimicrob. Chemother. (2010) 65: 2063-2069). Зазначене вірусне захворювання передається парентерально через інфіковану кров та продукти крові, інфіковані голки або статевим шляхом та вертикально від інфікованих матерів або матерівносіїв інфекції до нащадків. Вірион ВГC являє собою укладений у оболонку вірус із позитивно-полярною ниткою РНК, геномна послідовність якого складається з одного олігорибонуклеотиду, що складається із приблизно 9600 основ, який кодує поліпротеїн із приблизно 3010 амінокислот. Білкові продукти гену ВГC складаються зі структурних білків C, E1 та E2 та неструктурних білків NS2, NS3, NS4A та NS4B, і NS5A та NS5B. Вважають, що неструктурні ("NS") білки забезпечують каталітичний апарат для реплікації вірусу. Протеаза NS3 вивільняє РНК-залежну РНК-полімеразу NS5B з ланцюга поліпротеїну. Полімераза NS5B ВГC необхідна для синтезу двониткової РНК по одноланцюговій вірусній РНК, яка служить у якості матриці у циклі реплікації ВГC. Отже, полімеразу NS5B вважають незамінним компонентом реплікативного комплексу ВГC (K. Ishi, et al., Hepatology (1999) 29: 1227-1235; V. Lohmann, et al., Virology (1998) 249: 108-118). Інгібування полімерази NS5B ВГC запобігає утворенню двониткової РНК ВГC і, отже, являє собою перспективний підхід до розробки противірусних препаратів, спрямованих проти ВГC. На даний момент виявлений ряд потенційних молекулярних мішеней для розробки лікарських засобів із прямою противірусною дією, наприклад, лікарських засобів проти ВГC, включаючи, але не обмежуючись перерахованими, аутопротеазу NS2-NS3, протеазу N3, геліказу N3 та полімеразу NS5B. РНК-залежна РНК-полімераза необхідна для реплікації одноланцюгового позитивно-полярного РНК-геному, та даний фермент викликає значний інтерес у фахівців у галузі медичної хімії. Інший допоміжний білок ВГC називають NS5A. Неструктурний білок NS5A являє собою фосфопротеїн без явної ферментативної активності; проте, він діє як багатофункціональний регулятор клітинних шляхів, включаючи ріст клітинихазяїна, імунітет та вроджений імунітет, та реплікацію вірусу (Appel et al., J. Virol. (2005) 79: 3187-3194; Evans et al., Proc. Natl. Acad. Sci. USA (2004) 101: 13038-13043; Gale et al., Nature (2005) 436: 939-945; Gale et al., Virology (1997) 230: 217-227; Ghosh et al., J. Gen. Virol. (1999) 80(Pt 5): 1179-1183; Neddermann et al., J. Virol. (1999) 73: 9984-9991; Polyak et al., Hepatology (1999) 29: 1262-1271; Shimakami et al., J. Virol. (2004) 78: 2738-2748; Shirota et al., J. Biol. Chem. (2002) 277: 11149-11155; і Tan et al., Proc. Natl. Acad. Sci. U. S. A. (1999) 96: 5533-5538). NS5A пов'язаний з мембранами клітини-хазяїна через N-кінцеву амфіпатичну спіраль, де він є частиною реплікативного комплексу (Elazar et al., J. Virol. (2004) 78: 11393-11400 і Penin et al., J. Biol. Chem. (2004) 279: 40835-40843). Нещодавні дослідження дозволяють припустити, що NS5A 1 UA 114097 C2 5 10 15 20 25 30 35 40 45 50 55 60 складається із трьох доменів: перші 213 амінокислот у N-кінцевому домені являють собою домен I та включають цинк-зв'язуючий мотив, дозволяючи припустити, що зазначений білок є цинк-вмісним металопротеїном, а домени II та III розташовані у C-кінцевій області білку (Tellinghuisen et al., J. Biol. Chem. (2004) 279: 48576-48587 і Tellinghuisen et al., Nature (2005) 435: 374-379). Існує дві фосфорильовані форми NS5A: основна форма розміром 56 кДа та гіперфосфорильована форма розміром 58 кДа. Даний білок фосфорилюється кіназами клітинихазяїна у певних сайтах, головним чином, по залишку серіну у доменах II та III (Ide et al., Gene (1997) 201: 151-158; Kaneko et al., Biochem. Biophys. Res. Commun. (1994) 205: 320-326; Katze et al., Virology (2000) 278: 501-513; Reed et al., J. Biol. Chem. (1999) 274: 28011-28018; Reed et al., J. Virol. (1997) 71: 7187-7197; і Tanji et al., J. Virol. (1995) 69: 3980-3986). Спочатку схвалений стандарт клінічної практики ("SOC", англ. standard of care) для лікування хронічної інфекції ВГC являє собою комбіновану терапію пегільованим інтерфероном альфа-2a або пегільованим інтерфероном альфа-2b (що називаються разом "пегінтерфероном" або "ПЕГ"), застосовуваним окремо або у комбінації з рибавірином ("РБВ"). Первинною метою лікування хронічного гепатиту C є стійка вірусологічна відповідь ("СВВ"), яку визначають як недетектуємий рівень РНК ВГC у сироватці, який підтримується протягом деякого періоду часу після лікування. Показники хазяїна, включаючи вік, масу тіла, расу та виражений фіброз, впливають на результат лікування (Dienstag і Mchutchison, Gastroenterology (2006)130: 231-264 і Missiha et al., Gastroenterology (2008) 134: 1699-1714), але є слабкими прогностичними факторами відповіді. Навпаки, показники вірусу, такі як генотип та паттерн відповіді вірусу у процесі лікування, можна використовувати для визначення ймовірності ефективності лікування та індивідуального визначення тривалості лікування, та було доведено, що вони дуже корисні у клінічній практиці (Ge et al., Nature (2009) 461: 399-401). Незважаючи на обнадійливу відповідь деяких пацієнтів на лікування відповідно до SOC, у цілому відповідь на комбіновану терапію пегінтерфероном/рибавірином серед пацієнтів, інфікованих вірусом гепатиту C, становить лише приблизно 50 %. Частота досягнення СВВ становить
ДивитисяДодаткова інформація
Автори англійськоюCleary, Darryl G., Reynolds, Charles J., Berrey, Miriam Michelle, Hindes, Robert G., Symonds, William T., Ray, Adrian S., Mo, Hongmei, Hebner, Christy M., Oliyai, Reza, Zia, Vahid, Stefanidis, Dimitrios, Pakdaman, Rowchanak, Casteel, Melissa Jean
Автори російськоюКлири Деррил Г., Рейнольдс Чарльз Дж., Берри Мириам Мишель, Хайндис Роберт Г., Симондс Вильям Т., Рэй Эдриен С., Мо Хунмей, Хэбнэр Кристи М., Олияй Реза, Зия Вехид, Стефанидис Димитриос, Пакдаман Ровчанак, Кастил Мелисса Жан
МПК / Мітки
МПК: A61K 31/4196, A61K 9/20, A61K 31/513
Мітки: спосіб, вірусного, варіанти, лікування, композиція, гепатиту
Код посилання
<a href="https://ua.patents.su/44-114097-kompoziciya-varianti-ta-sposib-varianti-likuvannya-virusnogo-gepatitu-s.html" target="_blank" rel="follow" title="База патентів України">Композиція (варіанти) та спосіб (варіанти) лікування вірусного гепатиту с</a>
















































