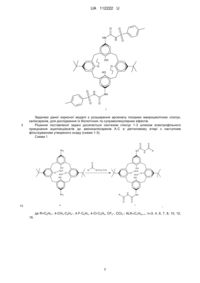
N-ацилуреїдокалікс[4]арени
Номер патенту: 112222
Опубліковано: 12.12.2016
Автори: Родік Роман Васильович, Бойко Вячеслав Іванович, Кальченко Віталій Іванович, Матвєєв Юрій Іванович
Формула / Реферат
N-ацилуреїдокалікс[4]арени 1-3 загальної формули:
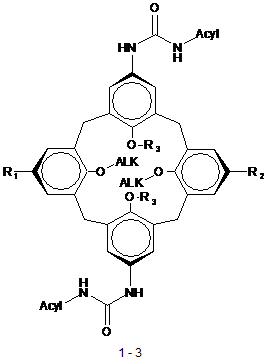 ,
,
де ALK=СnН2n+1, n=3, 4, 6, 7, 8, 10, 12, 16, Acyl=-C(O)-R, де R=С6Н5-, 4-СН3-С6Н4-, 4-F-C6H4, 4-Cl-C6H4, CF3-, CCl3-
R1=R2=t-Bu, R3=H (1);
R1=NH-C(O)-NH-Acyl, R2=t-Bu, R3=H, (2);
R1=R2=NH-C(O)-NH-Acyl, R3=ALK, (3).
Текст
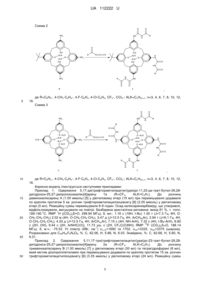
Реферат: N-ацилуреїдокалікс[4]арени 1-3 загальної формули: O HN O R3 ALK O O ALK O R3 R1 Acyl H N N H Acyl R2 NH O 1-3 де ALK=СnН2n+1, n=3, 4, 6, 7, 8, 10, 12, 16, Acyl=-C(O)-R, де R=С6Н5-, 4-СН3-С6Н4-, 4-F-C6H4, 4-ClC6H4, CF3-, CCl3R1=R2=t-Bu, R3=H (1); R1=NH-C(O)-NH-Acyl, R2=t-Bu, R3=H, (2); R1=R2=NH-C(O)-NH-Acyl, R3=ALK, (3). UA 112222 U (54) N-АЦИЛУРЕЇДОКАЛІКС[4]АРЕНИ UA 112222 U UA 112222 U Корисна модель належить до органічної хімії, а саме до нових 1,3-діацилуреїдо-трет-бутилдіалкоксикалікс[4]аренів (1), 1,2,3-триацилуреїдо-трет-бутил-діалкоксикалікс[4]аренів (2) та тетраацилуреїдо-тетраалкоксикалікс[4]аренів (3) загальної формули: O HN O R3 ALK O O ALK O R3 R1 Acyl H N N H Acyl R2 NH O 5 10 15 20 25 1-3 , де ALK=СnН2n+1, n=3, 4, 6, 7, 8, 10, 12, 16, Acyl=-C(O)-R, де R=С6Н5-, 4-СН3-С6Н4-, 4-F-C6H4, 4Cl-C6H4, CF3-, CCl3R1=R2=t-Bu, R3=H (1); R1=NH-C(O)-NH-Acyl, R2=t-Bu, R3=H, (2); R1=R2=NH-C(O)-NH-Acyl, R3=ALK, (3). Запропоновані нові сполуки 1-3, спосіб їх отримання, властивості та застосування в науковій літературі та патентних виданнях не описані. Каліксарени - чашоподібні макроциклічні сполуки, які отримують циклоконденсацією третбутил фенолу з формальдегідом, широко використовуються, як молекулярні платформи для дизайну біологічно активних сполук [1]. Розміщення біофорних груп на макроциклічній каліксареновій платформі в багатьох випадках приводить до суттєвого зростання їх біологічної активності. Зважаючи на потенційну гіпоглікемічну дію багатьох похідних ацилкарбамідів [2, 3], описаний вище ефект каліксаренової платформи нами використано для дизайну 1,3діацилуреїдо-трет-бутил-діалкоксикалікс[4]аренів (1), 1,2,3-триацилуреїдо-трет-бутилдіалкоксикалікс[4]аренів (2) та тетраацилуреїдо-тетраалкоксикалікс[4]аренів (3), які можуть мати гіпоглікемічні властивості. Найближчим структурним аналогом заявлених карбонілуреїдокаліксаренів є сульфонілуреїдокаліксарен І. Як показали дослідження, він проявляє гіпоглікемічну дію в діапазоні концентрацій 0.1-100 мг/кг ваги [4]. 1 UA 112222 U O O N H HN S O OH O O HO O H N S NH O O I 5 Задачею даної корисної моделі є розширення арсеналу похідних макроциклічних сполук, каліксаренів, для дослідження їх біологічних та супрамолекулярних ефектів. Рішення поставленої задачі досягається синтезом сполук 1-3 шляхом електрофільного приєднання ацилізоціанатів до амінокаліксаренів А-С в діетиловому етері з наступним фільтруванням утвореного осаду (схеми 1-3). Схема 1 O O NH2 N H NH R O O OH ALK ALK HO R O N C O O NH2 H N R O ALK HO O NH O 1 A 10 OH ALK , де R=C6H5-, 4-CH3-C6H4-, 4-F-C6H4, 4-Cl-C6H4, CF3-, CCl3-; ALK=CnH2n+1, n=3, 4, 6, 7, 8, 10, 12, 16. 2 UA 112222 U Схема 2 O O NH2 R N H NH O O OH ALK ALK HO N R O O C NH2 O OH ALK H N O ALK HO O HN O R NH2 H N R O NH O 2 B , де R=C6H5-, 4-СН3-С6Н4-, 4-F-C6H4, 4-Cl-C6H4, CF3-, CCl3-; ALK=CnH2n+1, n=3, 4, 6, 7, 8, 10, 12, 5 16. Схема 3 O O NH2 NH N H R R O O H2N O O ALK ALK O ALK O ALK R NH2 NH N C O O N H O O ALK ALK O ALK O ALK H N O HN O R NH2 H N R O NH O 3 C , де R=С6Н5-, 4-СН3-С6Н4-, 4-F-C6H4, 4-Сl-С6Н4, CF3-, ССl3-; ALK=CnH2n+1, n=3, 4, 6, 7, 8, 10, 12, 10 16. 15 20 25 30 Корисна модель ілюструється наступними прикладами: Приклад 1. Одержання 5,17-ди(трифторметилацетил)уреїдо-11,23-ди-трет-бутил-26,28дигідрокси-25,27-дипропоксикалікс[4]арену 1a (R=CF3, ALK=С3Н7). До розчину діамінокаліксарену А (1.00 ммоль) [5] у діетиловому етері (15 мл) при перемішуванні додавали по краплях протягом 5 хв. розчин трифторометилацилізоціанату [6] (2.05 ммоль) у діетиловому етері (5 мл). Реакційну суміш перемішували 6-8 годин. Осад каліксаренкарбаміду, що утворився, відфільтровували, висушували на повітрі. Безбарвна кристалічна речовина: вихід 81 %, т. топл. 1 189-190 °C. ЯМР Н ((CD3)2S=O, 299.94 МГц), δ, мл.: 1.16 с (18Н, t-Bu) 1.30 т (J=7.3 Гц, 6Н, ОСН2-СН2-СН3) 2.02 м (4Н, О-СН2-СН2-СН3), 3.47 д (J=12.5 Гц, 4Н, ArCHeqAr), 3.94 т (J=6.1 Гц, 4Н, О-СН2-СН2-СН3), 4.20 д (J=12.5 Гц, 4Н, АrСНахАr), 7.15 с (4Н, NH-ArH), 7.32 с (4Н, t-Bu-ArH), 8.80 19 с (2Н, ОН), 9.44 с (2Н, ArNHC(O)), 11.73 уш. с (2Н, CF3C(O)NH); ЯМР F ((CD3)2S=O, 188.14 -1 МГц), δ, м.ч.: -75.53. ІЧ спектр (КВr, см ) νC=O=1690 та 1702, νOH=3325, νNH=3375 (широка). Розраховано для C48H54F6N4O8, %: С, 62.06, Н, 5.86, N, 6.03. Знайдено, %: С, 62.68, Н, 5.80, N, 6.31. Приклад 2. Одержання 5,11,17-три(трифторметилацетил)уреїдо-23-трет-бутил-26,28дигідрокси-25,27-дипропоксикалікс[4]арену 2а (R=CF3, ALK=C3H7). До розчину триамінокаліксарену В (1.00 ммоль) [7] у діетиловому етері (30 мл) та тетрагідрофурані (8 мл), який містив діiзопропілетиламін при перемішуванні додавали по краплях протягом 15 хв. розчин трифторометилацетилізоціанату [6] (3.35 ммоль) у діетиловому етері (24 мл). Реакційну суміш 3 UA 112222 U 5 10 15 20 25 30 35 40 45 50 55 перемішували 6-8 годин. Осад каліксаренкарбаміду, що утворився, відфільтровували, висушували на повітрі. Безбарвна кристалічна речовина: вихід 46 %, т. топл. 315-320 °C. 1.13 с (9Н, t-Вu), 1.25 т (J=7.1 Гц, 6Н, О-СН2-СН2-СН3), 2.00 уш м, (4Н, О-СН2-СН2-СН3), 3.47 уш. д (J=12.6 Гц, 4H, ArCHeqAr), 3.93 та 3.95 два уш. м (4Н, О-СН2СН2-СН3), 4.16 та 4.18 два уш. д (J=12.6 Гц, 2Н, ArCHaxAr), 7.13 с (2Н, t-Bu-ArH), 7.11, с (2Н, N-ArH) 7.26 та 7.38 два уш. с (4Н, N19 ArH), 8.63 с (2Н, ОН), 9.41 та 9.47 два с (1Н+2Н, NH), 11.61 та 11.67 два уш. с (3Н, NH). ЯМР F -1 ((CD3)2S=O, 188.14 МГц), δ, м.ч.: -74.5 с (2F), -74.6 с (1F). ІЧ спектр (КВr, см ) νC=O=1695 та 1705, νOH=3330, νNH=3370 (широка). Розраховано для C 47H47F9N6O10, %: С, 54.97, Н, 4.61, N, 8.18. Знайдено, %: С, 52.97, Н, 5.28, N, 7.80. Приклад 3. Одержання 5,11,17,23-тетра(трифторметилацетил)уреїдо-25,26,27,28тетрапропоксикалікс[4]арену 3а (R=CF3, ALK=C3H7). До розчину тетраамінокаліксарену А (1.00 ммоль) [8] у діетиловому етері (15 мл) при перемішуванні додавали по краплях протягом 5 хв. розчин трифторометилацетилізоціанату [6] (4.2 ммоль) у діетиловому етері (5 мл). Реакційну суміш перемішували 6-8 годин. Осад каліксаренкарбаміду, що утворився, відфільтровували та висушували на повітрі. Безбарвна кристалічна речовина: вихід 38 %, т. топл. 189-190 °C. ЯМР 1 Н (CDCl3, 299.94 МГц), δ, м.ч.: 0.91 т (J=7.2 Гц, 12Н, О-СН2-СН2-СН3) 1.85 м (4Н, О-СН2-СН2СН3), 3.09 д (J=13.2 Гц, 4Н, ArCHeqAr), 3.76 т (J=7.4 Гц, 4Н, О-СН2-СН2-СН3), 4.34 д (J=13.2 Гц, 19 4Н, АrСНахАr), 6.71 с (NH-ArH), 9.27 с (2Н, ArNHC(O)), 11.08 с (2Н, CF3C(O)NH); ЯМР F (CDCl3, -1 188.14 МГц), δ, м.ч.: -76.47. ІЧ спектр (КВr, см ) νC=O=1698 та 1708, νNH=3360 (широка). Розраховано для C52H52F12N8O12, %: С, 51.66, Н, 4.34, N, 9.27. Знайдено, %: С, 52.66, Н, 4.84, N, 9.07. Приклад 4. Одержання 5,17-ди(4-хлоробензоїл)уреїдо-11,23-ди-трет-бутил-26,28-дигідрокси25,27-дипропоксикалікс[4]арену 1b (R=4-Cl-C6H4, ALK=C3H7). До розчину діамінокаліксарену А (1.00 ммоль) [5] у діетиловому етері (15 мл) при перемішуванні додавали по краплях протягом 5 хв. розчин 4-хлорбензоїлізоціанату [6] (2.05 ммоль) у діетиловому ефірі (5 мл). Реакційну суміш перемішували 6-8 годин. Осад каліксаренкарбаміду, що утворився, відфільтровували та висушували на повітрі. Безбарвна кристалічна речовина: вихід 84 %, т. топл. 261-265 °C. ЯМР 1 Н ((CD3)2S=O, 299.94 МГц), δ, м.ч.: 1.15 с (18Н, t-Bu) 1.30 т (J=7.0 Гц, 6Н, О-СН2-СН2-СН3) 2.02 м (4Н, О-СН2-СН2-СН3), 3.47 д (J=12.6 Гц, 4Н, ArCHeqAr), 3.93 т (J=6.0 Гц, 4Н, О-СН2-СН2-СН3), 4.19 д (J=12.6 Гц, 4Н, АrСНахАr), 7.18 та 7.38 два с (4Н+4Н, NH-ArH, t-Bu-ArH), 7.61 д (J=8.4 Гц, 4Н, С(О)АrН, мета), 8.00 д (J=8.4 Гц, 4Н, С(О)АrН, орто), 8.82 с (2Н, ОН), 10.45 с (2Н, ArNHC(O)), -1 11.00 с (2Н, C(O)NHC(O)). ІЧ спектр (KBr, cм ) νC=О=1695 та 1720, νОH=3340 (широка), νNН=3280 (широка). Розраховано для C58H62Cl2N4O8, %: С, 68.70, Н, 6.16, Сl, 6.99, N, 5.52. Знайдено, %: С, 68.51, Н, 6.18, Сl, 6.99, N, 5.60. Приклад 5. 5,11,17,23-тетра(4-фторобензоїл)уреїдо-25,26,27,28-тетрапропоксикалікс[4]арену 3с (R=4-F-C6H4, ALK=С3Н7). До розчину тетраамінокаліксарену С (1.00 ммоль) [8] у діетиловому етері (30 мл) при перемішуванні додавали по краплях протягом 10 хв. розчин 4фторбензоїлізоціанату [6] (4.2 ммоль) у діетиловому ефірі (5 мл). Реакційну суміш перемішували 6-8 годин. Осад каліксаренкарбаміду, що утворився, відфільтрували. Відфільтрований осад продукту перемішували 30 хв. в киплячому ацетонітрилі (5мл). Після охолодження до кімнатної температури сполуку 3с відфільтровували та висушували на повітрі. 1 Безбарвна кристалічна речовина: вихід 42 % т. топл. 320-324 °C. ЯМР Н ((CD3)2S=O, 299.94 МГц), δ м.ч.: 0.99 т (J=7.4 Гц, 12Н, О-СН2-СН2-СН3), 1,89 м, (8Н, О-СН2-СН2-СН3), 3.22 д (J=13.1 Гц, 4Н, ArCHeqAr), 3,82 т, (8Н, О-СН2-СН2-СН3), 4,35 д (J=13.1 Гц, 4Н, АrСНaxАr), 6.88 с (8Н, АrН), 7,14 т (J=8.6 Гц, 8Н С(О)АrН мета), 7.91 м (8Н, С(О)АrН орто), 10.36 с (4Н, ArNHC(O)), 10.69 с 19 -1 (4Н, C(O)NHC(O)). ЯМР F, ((CD3)2S=O, 188.14 МГц) δ, м.д.: -107.0 с. ІЧ спектр (КВr, см ) νC=O=1690 та 1710, νNH=3290 (широка). Розраховано для C72H68F4N8O12, %: С, 65.85, Н, 5.22, N, 8.53. Знайдено, %: С, 66.05, Н, 5.12, N, 8.48. Джерела інформації: 1. R.V. Rodik, V.I. Boyko, V.I. Kalchenko Calixarenes in bio-medical researches // Curr. Med. Chem. - 2009 - Vol. 16(13) - P. 1630-1655. 2 Oikonomakos, N.G., Kosmopoulou, M.N., Chrysina, E.D., Leonidas, D.D., Kostas, I.D., Wendt, K.U., Klabunde, Т., DeFossa E. Crystallographic studies on acylureas, a new class of glycogen phosphorylase inhibitors, as potential antidiabetic drugs // Prot. Science-2005. - 14 - P. 1760-1771. 3 DeFossa, E., Kadereit, D., Klabunde, Т., Burger, H.-J., Herling, A., Wendt, K.-U., Von Roedern, E., Schoenafinger, K., Urea-and Urethane-Substituted Acylureas, Process for Their Preparation and Their Use Pat. USA 8247452 B2, 2012. 4 Ярош O.K., Родік Р.В., Денисенко О.М., Соловйов А.І., Бойко В.І., Кальченко B.I. 5,17ді(арилсульфоніл)уреїдо-11,23-ди-трет-бутил-26,28-диігдрокси-25,27-дипропоксикалікс[4]арени, 4 UA 112222 U 5 10 які виявляють гіпоглікемічну активність: пат. України на кор. модель. - заявка 96814 від 25.02.2015, Бюл. № 4. 5 Rodik R.V., Boyko V.І., Danylyuk О.В., Suwinska К., Tsymbal I.F., Slinchenko N.V., Babich L.G., Shlykov S.O., Kosterin S.O., Lipkowski J., Kalchenko V.I. Calix[4]arenesulfonyl-amidines. Synthesis, 2+ structure and influence on Mg , ATP-dependent calcium pumps // Tetrahedron Lett. - 2005. - Vol. 46. - P. 7459-7462. 6 Boyko, V.I., Kliachina, M.A., Kalchenko, V.I. New facile method for preparing acylisosyanates by thermal decomposition of triacylisocyanurates // Журнал Орг. Фарм. Хім. - 2006. - Т. 5, № 1. - С. 7677. 7 Родік Р.В. Синтез та властивості триамінодипропокси-тpет-бутилкаліксарену // Укр. хім. журнал - 2015 - Т 81, № 3-4 - С 40-46. 8 Van Wageningen A.M.A., Snip E., Verboom W., Reinhoudt D.N., Boerrigter H. Synthesis and application of iso(thio)cyanate-functionalised calix[4]arenes // Liebigs Ann. / Recueil. - 1997. P. 2235-2245. 15 ФОРМУЛА КОРИСНОЇ МОДЕЛІ N-ацилуреїдокалікс[4]арени 1-3 загальної формули: O HN O R3 ALK O O ALK O R3 R1 Acyl H N N H Acyl R2 NH O 20 25 1-3 , де ALK=СnН2n+1, n=3, 4, 6, 7, 8, 10, 12, 16, Acyl=-C(O)-R, де R=С6Н5-, 4-СН3-С6Н4-, 4-F-C6H4, 4-ClC6H4, CF3-, CCl3R1=R2=t-Bu, R3=H (1); R1=NH-C(O)-NH-Acyl, R2=t-Bu, R3=H, (2); R1=R2=NH-C(O)-NH-Acyl, R3=ALK, (3). Комп’ютерна верстка Т. Вахричева Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП "Український інститут інтелектуальної власності", вул. Глазунова, 1, м. Київ – 42, 01601 5
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C07C 313/34
Мітки: n-ацилуреїдокалікс[4]арени
Код посилання
<a href="https://ua.patents.su/7-112222-n-aciluredokaliks4areni.html" target="_blank" rel="follow" title="База патентів України">N-ацилуреїдокалікс[4]арени</a>
Попередній патент: Спосіб отримання сушеного напівфабрикату з картоплі зі зниженим вмістом крохмалю
Наступний патент: Гіпоглікемічна активність n-ацилуреїдокалікс[4]аренів
Випадковий патент: Спосіб стереоселективного одержання енантіомера гетеробіциклічного спирту, проміжні сполуки та спосіб їх одержання