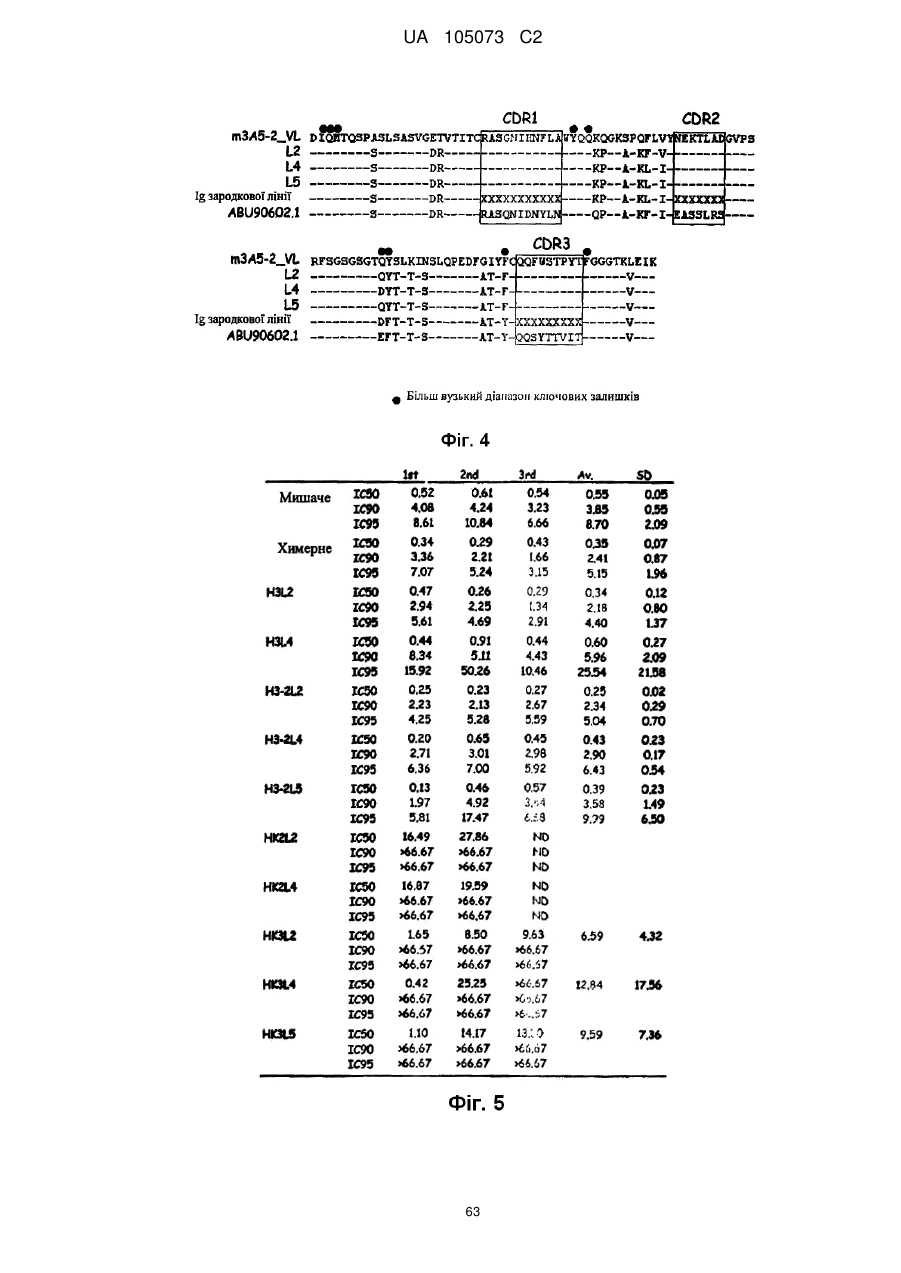
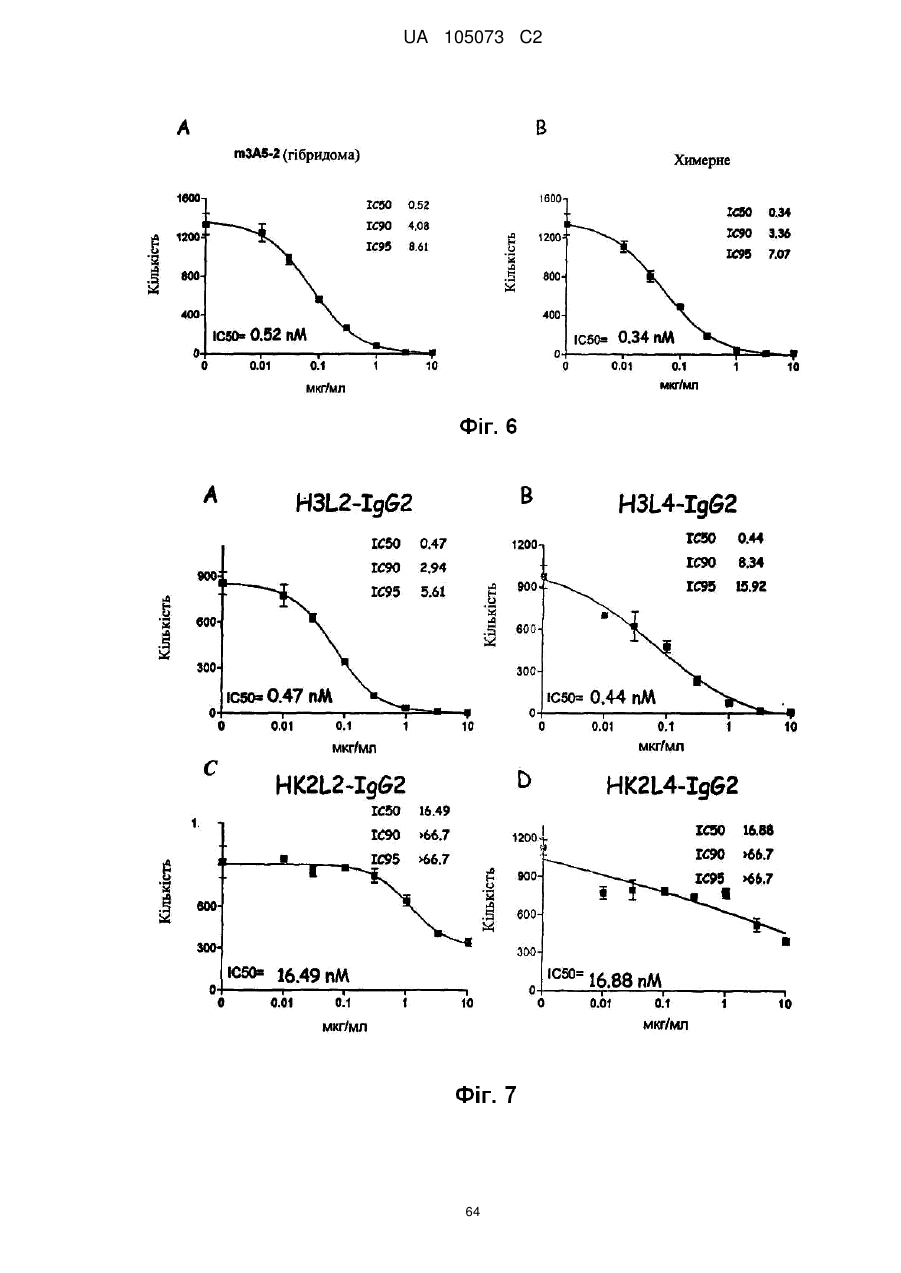
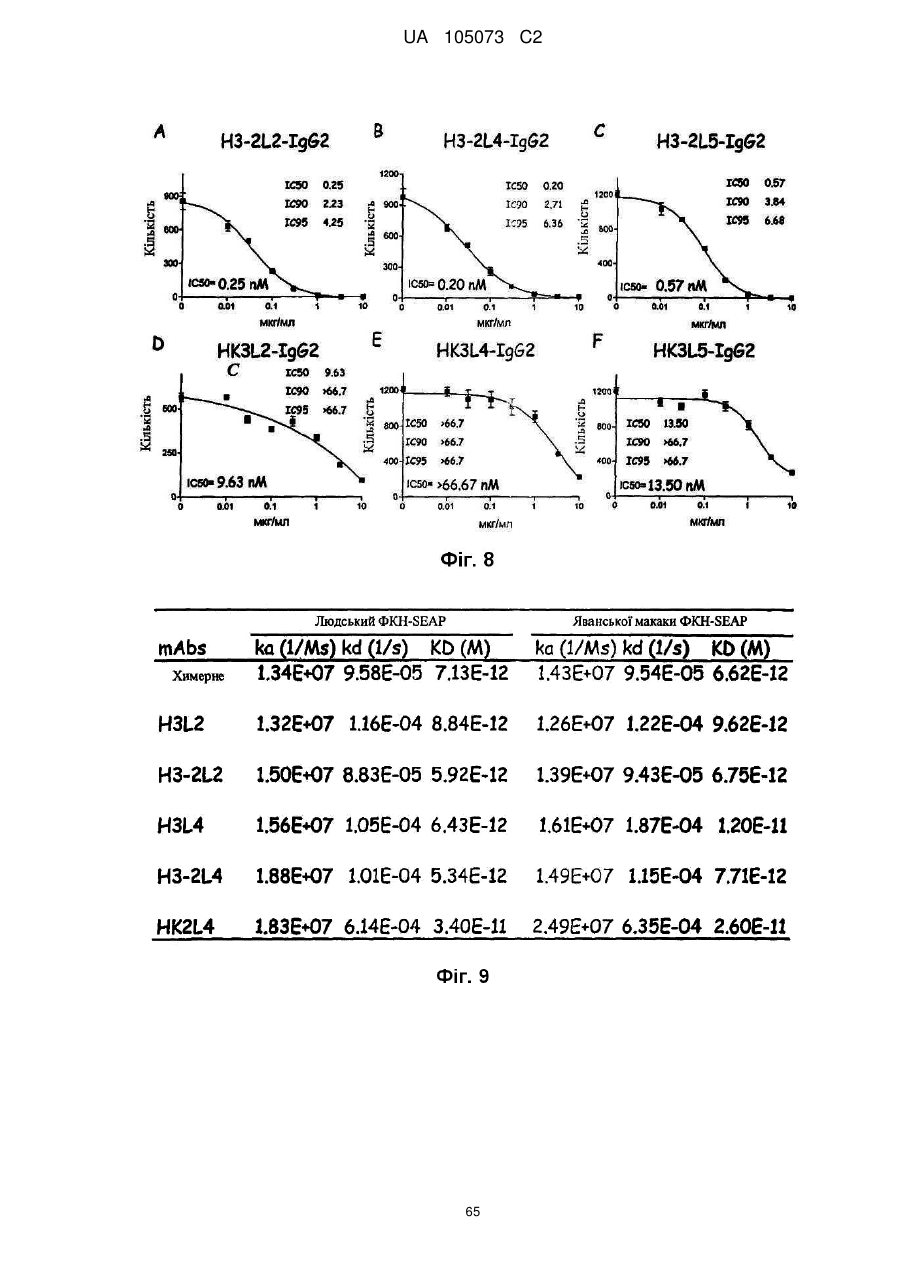
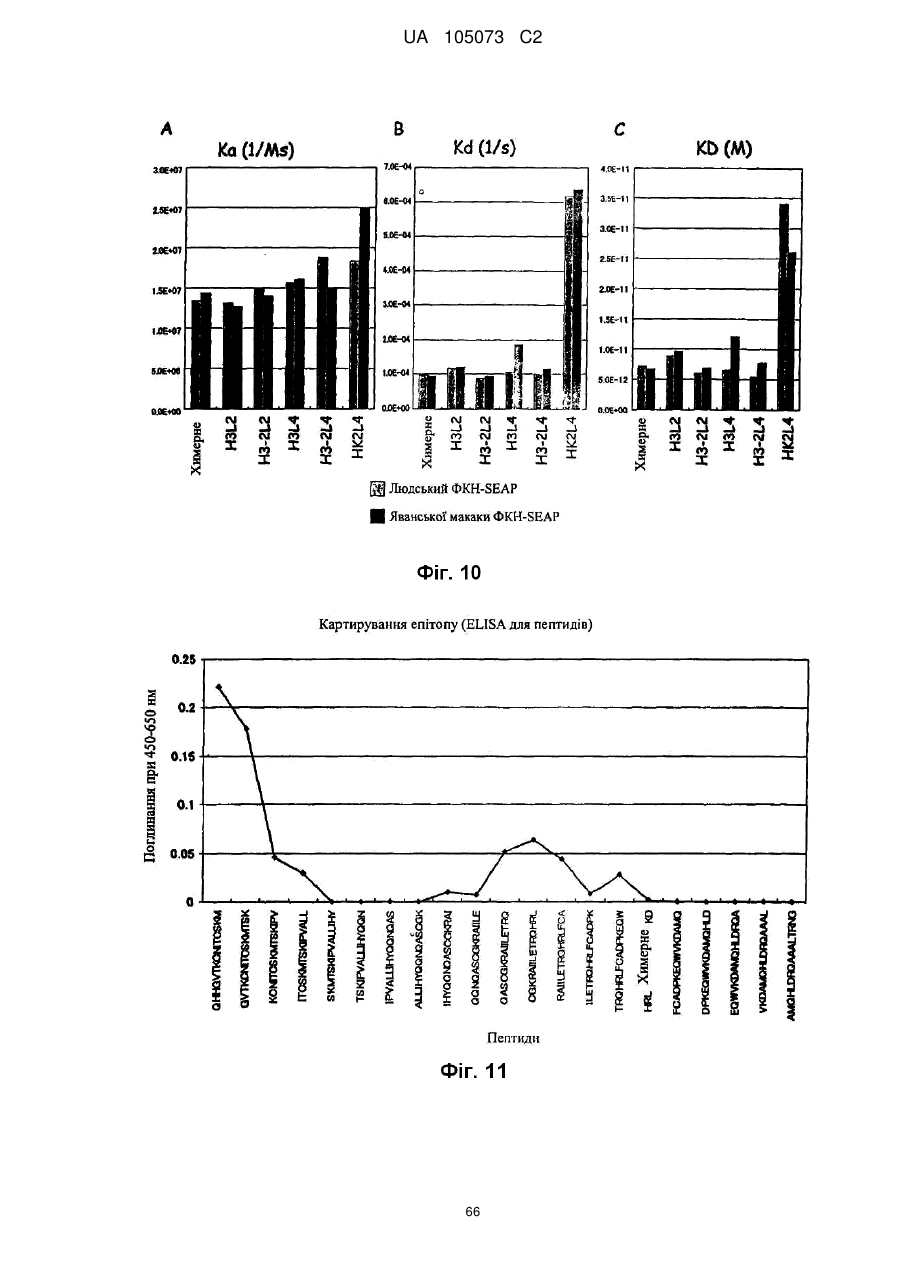
Антитіло проти фракталкіну, композиція і спосіб для лікування запальних порушень
Номер патенту: 105073
Опубліковано: 10.04.2014
Автори: Сакамото Йосімаса, Імаі Тосіо, Кавано Тецу, Нісімура Міюкі
Формула / Реферат
1. Антитіло проти фракталкіну або його фракталкінзв'язуючий фрагмент, де вказане антитіло або його фрагмент містить:
(a) CDR-H1, що містить амінокислотну послідовність SEQ ID NO:28;
(b) CDR-H2, що містить амінокислотну послідовність SEQ ID NO:29;
(c) CDR-H3, що містить амінокислотну послідовність SEQ ID NO:30;
(d) CDR-L1, що містить амінокислотну послідовність SEQ ID NO:31;
(e) CDR-L2, що містить амінокислотну послідовність SEQ ID NO:32; і
(f) CDR-L3, що містить амінокислотну послідовність SEQ ID NO:33.
2. Антитіло за п. 1, де вказане антитіло є інтактним антитілом.
3. Антитіло або його фракталкінзв'язуючий фрагмент за п. 1 або п. 2, де вказане антитіло або фракталкінзв'язуючий фрагмент є гуманізованим.
4. Антитіло або його фракталкінзв'язуючий фрагмент за п. 3, де вказане антитіло містить важкий ланцюг і легкий ланцюг, причому варіабельний домен важкого ланцюга вказаного антитіла або фракталкінзв'язуючого фрагмента містить амінокислотну послідовність SEQ ID NO:36, SEQ ID NO:37, SEQ ID NO:39, SEQ ID NO:42 або SEQ ID NO:43, і причому варіабельний домен легкого ланцюга вказаного антитіла або його фракталкінзв'язуючого фрагмента містить амінокислотну послідовність SEQ ID NO:38, SEQ ID NO:44 або SEQ ID NO:45.
5. Антитіло або його фракталкінзв'язуючий фрагмент за пп. 1, 2, 3 або 4, де вказане антитіло або його фракталкінзв'язуючий фрагмент є химерним.
6. Антитіло або його фракталкінзв'язуючий фрагмент за п. 5, де вказане антитіло містить важкий ланцюг і легкий ланцюг, причому варіабельний домен важкого ланцюга вказаного антитіла містить амінокислотну послідовність SEQ ID NO:26, і причому варіабельний домен легкого ланцюга вказаного антитіла містить амінокислотну послідовність SEQ ID NO:27.
7. Антитіло або його фракталкінзв'язуючий фрагмент за будь-яким одним з пп. 1-6, що містить людську константну ділянку.
8. Антитіло або його фракталкінзв'язуючий фрагмент за п. 7, що містить константну ділянку ізотипу IgG.
9. Антитіло або його фракталкінзв'язуючий фрагмент за п. 8, що містить константну ділянку ізотипу IgG2.
10. Антитіло або його фракталкінзв'язуючий фрагмент за будь-яким одним з пп. 1-9, що містить мутовану Fc-ділянку так, що вказане антитіло має знижену здатність до активації ADCC і/або комплементу.
11. Антитіло або його фракталкінзв'язуючий фрагмент за п. 10, в якому Fc-ділянка є мутованою по одному або більше з: V234, G237, С131 або С219.
12. Антитіло або його фракталкінзв'язуючий фрагмент за будь-яким одним з пп. 1 або 3-9, де вказаний фракталкінзв'язуючий фрагмент вибирають з групи, яка складається з: Fab, Fab', F(ab')2 і Fv, і де вказаний фракталкінзв'язуючий фрагмент зберігає специфічність зв'язування з фракталкіном.
13. Антитіло або його фракталкінзв'язуючий фрагмент за будь-яким одним з пп. 1-12, де вказане антитіло інгібує зв'язування між фракталкіном і CX3CR1.
14. Фармацевтична композиція, що містить антитіло або його фракталкінзв'язуючий фрагмент за будь-яким одним з пп. 1-13.
15. Фармацевтична композиція за п. 14, де вказана композиція додатково містить носій.
16. Фармацевтична композиція за п. 14 або п. 15, де вказана композиція також містить додатковий терапевтичний агент.
17. Нуклеїнова кислота, що кодує антитіло або його фракталкінзв'язуючий фрагмент за будь-яким одним з пп. 1-13.
18. Нуклеїнова кислота за п. 17, де вказана нуклеїнова кислота кодує весь або частину важкого ланцюга вказаного антитіла або його фракталкінзв'язуючого фрагмента.
19. Нуклеїнова кислота за п. 17 або п. 18, де вказана нуклеїнова кислота кодує весь або частину легкого ланцюга вказаного антитіла або його фракталкінзв'язуючого фрагмента.
20. Вектор, що містить нуклеїнову кислоту за будь-яким одним з пп. 17-19.
21. Вектор за п. 20, де вектор являє собою вектор експресії.
22. Клітина-хазяїн, що містить один або більше векторів за п. 20 або п. 21.
23. Клітина-хазяїн за п. 22, де вказана клітина-хазяїн містить перший і другий вектори, причому вказаний перший вектор містить нуклеїнову кислоту, що кодує важкий ланцюг, і вказаний другий вектор містить нуклеїнову кислоту, що кодує легкий ланцюг антитіла або його фракталкінзв'язуючого фрагмента за будь-яким одним з пп. 1-13.
24. Клітина-хазяїн за п. 23, в якій експресія вказаних важкого і легкого ланцюгів у вказаній клітині-хазяїні продукує антитіло або його фракталкінзв'язуючий фрагмент за будь-яким одним з пп. 1-13.
25. Клітина-хазяїн за будь-яким одним з пп. 22-24, де вказана клітина-хазяїн є прокаріотичною.
26. Клітина-хазяїн за будь-яким одним з пп. 22-24, де вказана клітина-хазяїн є еукаріотичною.
27. Клітина-хазяїн за п. 26, де вказана клітина-хазяїн є клітиною ссавця.
28. Клітина-хазяїн за п. 27, де вказана клітина-хазяїн являє собою СНО-клітину або NS0-клітину.
29. Спосіб отримання антитіла проти фракталкіну або його фракталкінзв'язуючого фрагмента, що містить: (а) експресію вектора за п. 20 або п. 21 у відповідній клітині-хазяїні, і (b) виділення антитіла або його фракталкінзв'язуючого фрагмента.
30. Спосіб за п. 29, в якому вказане антитіло або його фракталкінзв'язуючий фрагмент секретується вказаною клітиною-хазяїном в культуральне середовище.
31. Спосіб за п. 30, в якому вказане антитіло або його фракталкінзв'язуючий фрагмент очищають до щонайменше 95 % або більше від вказаного культурального середовища, що містить антитіло.
32. Спосіб лікування запального порушення, що включає введення ефективної кількості антитіла або його фракталкінзв'язуючого фрагмента за будь-яким одним з пп. 1-13 потребуючому такого лікування суб'єкту для лікування таким чином запального порушення, в якому вказане запальне порушення являє собою виразковий коліт, хворобу Крона або ревматоїдний артрит.
33. Антитіло проти фракталкіну або його фракталкінзв'язуючий фрагмент, де вказане антитіло або його фрагмент містить важкий ланцюг, що містить амінокислотну послідовність SEQ ID NO:37, і легкий ланцюг, що містить амінокислотну послідовність SEQ ID NO:44.
34. Антитіло або його фракталкінзв'язуючий фрагмент за будь-яким одним з пп. 1-13 або п. 33 для використання при лікуванні запального порушення, де запальне порушення являє собою виразковий коліт, хворобу Крона або ревматоїдний артрит.
35. Застосування антитіла або його фракталкінзв'язуючого фрагмента за будь-яким одним з пп. 1-13 або п. 33 для виготовлення лікарського препарату для використання при лікуванні запального порушення, де запальне порушення являє собою виразковий коліт, хворобу Крона або ревматоїдний артрит.
Текст
Реферат: Винахід належить до антитіла або його фракталкінзв'язуючого фрагмента, які специфічно зв’язують фракталкін, композиції, що містить антитіло або його фракталкінзв'язуючого фрагмента, способу отримання антитіла або його фракталкінзв'язуючого фрагмента, фармацевтичної композиції, що містить антитіло або його фракталкінзв'язуючий фрагмент, нуклеїнової кислоти, вектора, клітини-хазяїна та застосування для терапевтичних цілей. UA 105073 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки, до якої належить винахід Даний винахід стосується композицій і способів, що відносяться до антитіл, які зв'язують фракталкін. Рівень техніки Фракталкін (FKN) являє собою трансмембранний хемокін, який експресується на поверхні активованих ендотеліальних клітин і зв'язується з рецептором CX3CR1. Зв'язування FKN, пов'язаного з мембраною, з CX3CR1, пов'язаним з мембраною, опосередковує сильну адгезію клітина-клітина без участі селектинів або інтегринів. Секретований FKN, який відділяється від пов'язаного з мембраною FKN, також зв'язується з CX3CR1 і індукує активацію інтегрину і клітинну хемотаксису. Експресія FKN індукується на поверхні ендотеліальних клітин прозапальними цитокінами. + Посилена експресія FKN і накопичення цитостатичних ефекторних лімфоцитів CX3CR1 і макрофагів відмічалися у суб'єктів з численними порушеннями, включаючи запальні і аутоімунні порушення, в тому числі виразковий коліт (ВК), хворобу Крона (ХК), ревматоїдний артрит (РА), аутоімунний гепатит (АІГ), розсіяний склероз (РС), і цукровий діабет. Umehara et al., Arterioscler. Thromb. Vasc. Biol. 24:34-40 (2004) описує роль FKN при атеросклерозі і ураженні судин. Nishimura et al., Ann. NY Acad. Sci. 1173:350-356 (2009) розглядає FKN як потенційну терапевтичну мішень при запальних захворюваннях кишечника, таких як ВК і ХК. Антитіла і FKN-зв'язуючі фрагменти антитіл є бажаними терапевтичними агентами внаслідок своєї специфічності. Антитіла і FKN-зв'язуючі фрагменти можна використати для направленого впливу на специфічні клітини або тканини, мінімізуючи таким чином потенційні побічні ефекти у разі неспецифічного направленого впливу. Існує потреба в ідентифікації і характеристиці терапевтичних антитіл, які можна використати для лікування запальних порушень, включаючи описані тут порушення. Короткий опис винаходу У першому аспекті винахід стосується антитіла проти FKN або його FKN-зв'язуючого фрагмента, де вказане антитіло або його фрагмент містить шість CDR, вибраних з: (a) CDR-H1, що містить амінокислотну послідовність SEQ ID NO:28; (b) CDR-H2, що містить амінокислотну послідовність SEQ ID NO:29; (с) CDR-H3, що містить амінокислотну послідовність SEQ ID NO:30; (d) CDR-L1, що містить амінокислотну послідовність SEQ ID NO:31; (е) CDR-L2, що містить амінокислотну послідовність SEQ ID NO:32; і (f) CDR-L3, що містить амінокислотну послідовність SEQ ID NO:33. Антитіло може являти собою інтактне антитіло. В одному з прикладів антитіло являє собою гуманізоване антитіло. Варіабельний домен важкого ланцюга гуманізованого антитіла може включати амінокислотну послідовність SEQ ID NO:36, SEQ ID NO:37, SEQ ID NO:39, SEQ ID NO:42 або SEQ ID NO:43, а варіабельний домен легкого ланцюга гуманізованого антитіла може включати амінокислотну послідовність SEQ ID NO:38, SEQ ID NO:44 або SEQ ID NO:45. В одному з прикладів антитіло являє собою антитіло проти фракталкіну або його FKNзв'язуючого фрагмента, де вказане антитіло або його фрагмент містить важкий ланцюг з амінокислотною послідовністю SEQ ID NO:37 і легкий ланцюг з амінокислотною послідовністю SEQ ID NO:44. Антитіло також може являти собою химерне антитіло. В одному з прикладів варіабельний домен важкого ланцюга химерного антитіла містить амінокислотну послідовність SEQ ID NO:26, а варіабельний домен легкого ланцюга химерного антитіла містить амінокислотну послідовність SEQ ID NO:27. Також розглядаються FKN-зв'язуючі фрагменти антитіла. FKN-зв'язуючий фрагмент може являти собою Fab, Fab', F(ab')2 або Fv фрагмент, який зберігає специфічність зв'язування з FKN. У деяких прикладах, коли вказане антитіло або його FKN-зв'язуючий фрагмент містять людську константну ділянку, така константна ділянка є IgG ізотипом (наприклад, IgG2 ізотипом). В інших прикладах вказане антитіло або його FKN-зв'язуючий фрагмент містить мутовану Fc ділянку таку, що вказане антитіло володіє зниженою здібністю до активації ADCC і/або комплементу в порівнянні з Fc ділянкою, у якої така мутація відсутня. Наприклад, Fc ділянка може бути мутована по одному або більше кислотним залишкам з наступних: V234, G237, С131 або C219. Бажано, щоб антитіло або FKN-зв'язуючий фрагмент істотно зменшував або інгібував зв'язування FKN зі своїм рецептором, CX3CR1, щонайменше на 50 %, 60 %, 70%, 80 %, 90 % або більше, або істотно інгібував нейтралізований hFKN при оцінці хемотаксису, як розкрито в даному описі. 1 UA 105073 C2 5 10 15 20 25 30 35 40 45 50 55 60 Винахід також стосується фармацевтичної композиції, яка містить антитіло або його FKNзв'язуючий фрагмент за даним винаходом і фармацевтично прийнятний носій або наповнювач. У деяких варіантах здійснення композиція містить один або декілька описаних нижче додаткових терапевтичних агентів. Також розглядається нуклеїнова кислота, що кодує описане вище антитіло або FKNзв'язуючий фрагмент. В одному з варіантів здійснення нуклеїнова кислота кодує всю або частину важкого ланцюга антитіла або його FKN-зв'язуючий фрагмент. В іншому варіанті здійснення нуклеїнова кислота кодує всю або частину легкого ланцюга антитіла або його FKNзв'язуючий фрагмент. Нуклеїнова кислота може знаходитися у векторі (наприклад, векторі експресії). Винахід також стосується клітини хазяїна, яка містить один або декілька векторів за винаходом. В одному з прикладів клітина хазяїн містить два вектори, з яких перший вектор містить нуклеїнову кислоту, що кодує важкий ланцюг, а другий вектор містить нуклеїнову кислоту, що кодує легкий ланцюг описаного тут антитіла або його FKN-зв'язуючого фрагмента. Експресія важкого ланцюга і легкого ланцюга в клітині хазяїні продукує антитіло або FKNзв'язуючий фрагмент. В одному з варіантів здійснення клітина хазяїн є прокаріотичною. В іншому варіанті здійснення клітина хазяїн є еукаріотичною. Ілюстративні клітини ссавців, які можна використати для продукування антитіл і FKN-зв'язуючих фрагментів, являють собою клітини CHO і клітини NS0. Винахід також стосується способу отримання антитіла проти FKN або його FKN-зв'язуючого фрагмента. Спосіб включає: (a) експресію вектора за винаходом у відповідній клітині хазяїні і (b) виділення антитіла. Антитіло або FKN-зв'язуючий фрагмент може секретуватися клітиною хазяїном в культуральне середовище. В одному з прикладів антитіло або його FKN-зв'язуючий фрагмент очищають до щонайменше 95 % або більше чистоти від речовин, що не належать до антитіла. Також розглядаються способи лікування запальних порушень шляхом введення ефективної кількості антитіла проти FKN або FKN-зв'язуючого фрагмента за винаходом. Ілюстративні запальні порушення являють собою запальне захворювання кишечника, хвороба Крона і виразковий коліт. У випадку цих порушень спосіб також може включати введення одного або декількох додаткових терапевтичних агентів. Ілюстративні терапевтичні агенти являють собою опіати, 5-аміносаліцилову кислоту, 6-меркаптопурин, азатіоприн, глюкокортикоїди, метотрексат, циклоспорин і метронідазол. Інші відповідні терапевтичні агенти описані нижче. Запальні порушення, які можуть бути вилікувані введенням ефективної кількості антитіла проти FKN або FKN-зв'язуючого фрагмента за винаходом також включають аутоімунні хвороби печінки і жовчних шляхів (наприклад, аутоімунний гепатит, первинний жовчний цироз печінки або первинний склерозуючий холангіт). У випадку цих порушень спосіб може також включати введення 6-меркаптопурина, урсодезоксихолеву кислоту, азатіоприн, глюкокортикоїд, тіазидний діуретик, антиальдостероновий діуретик, циклоспорин, альбумін або спіронолактон. Ревматоїдний артрит (РА) також можна лікувати шляхом введення ефективної кількості антитіла проти FKN або FKN-зв'язуючого фрагмента за винаходом. При лікуванні РА спосіб може також включати введення нестероїдного протизапального лікарського засобу (НПЛЗ), метотрексату, лефлуноміду, буциламіну, 5-аміносаліцилової кислоти, глюкокортикоїда, гідрохлорохіну, вітаміну D, кальцію або алендронату. Системний червоний вовчак (наприклад, вовчак з ураженням центральної нервової системи або вовчаковий нефрит) також можна лікувати введенням ефективної кількості антитіла проти FKN або FKN-зв'язуючого фрагмента, окремо або в комбінації з одним або декількома додатковими терапевтичними агентами. Ілюстративні додаткові терапевтичні агенти являють собою глюкокортикоїди, циклофосфамід, метотрексат, циклоспорин і такролімус. Розсіяний склероз і нейромієліт зорового нерва також можна лікувати введенням ефективної кількості антитіла проти FKN або FKN-зв'язуючого фрагмента. Лікування також може включати введення одного або більше додаткових терапевтичних агентів, таких як глюкокортикоїд, інтерферон-Р або Копаксон®. Демієлінізуючу полірадікулопатію (наприклад, синдром Гійєна-Баре або хронічну запальну демієлінізуючу полірадікулопатію) також можна лікувати введенням ефективної кількості антитіла проти FKN або FKN-зв'язуючого фрагмента. І в цьому випадку, також розглядається комбінована терапія, і лікування також може включати введення одного або більше додаткових терапевтичних агентів, таких як глюкокортикоїд або внутрішньовенний імуноглобулін. Введення ефективної кількості антитіла проти FKN або FKN-зв'язуючого фрагмента, окремо або в комбінації з додатковим терапевтичним агентом, також може бути корисним при лікуванні нейропатичного болю. Ілюстративні додаткові агенти для лікування нейропатичного болю 2 UA 105073 C2 5 10 15 20 25 30 35 40 45 50 55 60 являють собою ламотригін, топірамат, окскарбазепін, леветирацетам, фентаніл, трамадол, капсаїцин, кларитин, НПЗЗ, амітриптилін, прегабалін, лідокаїн, дулоксетин і карбамазепін. Хворобу Альцгеймера також можна лікувати введенням ефективної кількості антитіла проти FKN або FKN-зв'язуючого фрагмента. Спосіб також може включати введення одного або більше додаткових терапевтичних агентів, таких як такрин гідрохлорид, донепезилу гідрохлорид, ривастигміну тартрат, галантаміну гідробромід, мемантину гідрохлорид, пароксетин, рисперидон, кветіапін або пероспірон. Асоційований з раком вісцеральний біль також можна лікувати введенням ефективної кількості антитіла проти FKN або FKN-зв'язуючого фрагмента, окремо або в комбінації з одним або декількома додатковими терапевтичними агентами, такими як морфій, НПЗЗ, фентаніл, лідокаїн, пентазоцин або клонідин. Атеросклероз також можна лікувати введенням ефективної кількості антитіла проти FKN або FKN-зв'язуючого фрагмента. Спосіб також може включати введення одного або декількох додаткових терапевтичних агентів, таких як простациклін, аспірин, клопідогрель, тиклопідин, лімапрост, простагландин Е1, інгібітор HMG CoA редуктази, безафібрат, лідокаїн, мексилетин, діуретик, дигіталіс, допамін, агоніст β-адренергічний рецептор, ізосорбіду динітрат, нітрогліцерин, натрійуретичний пептид, варфарин, гепарин, активатор плазміногену тканинного типу, урокіназа або прокаїнамід. Васкулопатію (наприклад, вікову м'язову дегенерацію, хворобу Бехчета, хворобу Гарада і саркаїдозний увеїт) також можна лікувати введенням ефективної кількості антитіла проти FKN або FKN-зв'язуючого фрагмента за винаходом. Спосіб також може включати введення одного або декількох додаткових терапевтичних агентів, вибраних з глюкокортикоїдів, циклофосфаміду, пегаптанібу, ранібізумабу, НПЗЗ, колхіцину, хлорамбуцилу, талідоміду і вертепорфіну. Нефропатії (наприклад, вовчаковий нефрит, гломерулонефрит або діабетичну нефропатію) також можна лікувати введенням ефективної кількості антитіла проти FKN або FKN-зв'язуючого фрагмента за винаходом. Способи лікування також можуть включати глюкокортикоїди, сульфонілсечовину, циклофосфамід, глініди, циклоспорин, такролімус, мікофенолату мофетил, мізорибін, діуретики, інсулін, бігуанід, інгібітори α-глюкозидази, блокатори рецепторів ангіотензину, тіазолідиндіон, інгібітори ангіотензин-перетворюючого ферменту (АПФ), блокатори кальцієвих каналів або інгібітори β-адренергічних рецепторів; способи лікування також можуть включати і інгібітори адренергічних рецепторів. Винахід також стосується застосування антитіла проти FKN або FKN-зв'язуючого фрагмента за винаходом при лікуванні будь-якого з описаних тут запальних порушень. Винахід також стосується використання антитіла проти FKN або FKN-зв'язуючого фрагмента за винаходом для отримання лікарського препарату для лікування будь-якого з описаних тут запальних порушень. Винахід також розкриває спосіб інгібування рекрутинга лейкоцитів в ділянці запалення у суб'єкта шляхом введення ефективної кількості антитіла проти FKN або FKN-зв'язуючого фрагмента потребуючому такого лікування суб'єкту, інгібуючи таким чином рекрутинг лейкоцитів на ділянці запалення. З метою терапевтичних застосувань також можуть використовуватися стратегії ex vivo. Стратегії ex vivo включають трансфекцію або трансдукцію отриманих від суб'єкта клітин полінуклеотидом, що кодує антитіло, або фрагмент антитіла. Трансфіковані або трансдуковані клітини потім повертають суб'єкту. Клітини можуть бути будь-якими з широкого діапазону типів клітин, включаючи, без обмеження, гемопоетичні клітини (наприклад, клітини кісткового мозку, макрофаги, моноцити, дендритні клітини, Т-клітини або В-клітини), фібробласти, епітеліальні клітини, ендотеліальні клітини, кератиноцити або м'язові клітини. У контексті даного винаходу використовуються скорочення і терміни, визначення яких наводиться нижче. Термін "антитіло" (що використовується тут взаємозамінно з терміном "імуноглобулін") включає інтактні моноклональні і поліклональні антитіла, мультиспецифічні антитіла (наприклад, біспецифічні антитіла) і фрагменти антитіла, які демонструють необхідну біологічну активність (наприклад, здатність зв'язати FKN і модулювати взаємодію між FKN і CX3CR1). "Інтактні антитіла" являють собою гетеротетрамерні глікопротеїни приблизно 150000 дальтон, що складаються з двох ідентичних легких (L) ланцюгів і двох ідентичних важких (Н) ланцюгів. Кожний легкий ланцюг пов'язаний з важким ланцюгом одним ковалентним дисульфідним зв'язком, при цьому кількість дисульфідних зв'язків у важких ланцюгах різних ізотипів імуноглобулінів розрізнюється. Кожний важкий і легкий ланцюг також має дисульфідні містки, розташовані через регулярні інтервали. Кожний важкий ланцюг має на одному кінці 3 UA 105073 C2 5 10 15 20 25 30 35 40 45 50 55 варіабельний домен (VH), за яким йде декілька константних доменів. Кожний легкий ланцюг має варіабельний домен на одному кінці (VL) і константний домен на іншому кінці. Константний домен легкого ланцюга вирівняний відносно першого константного домену важкого ланцюга, а варіабельний домен легкого ланцюга вирівняний відносно варіабельного домену важкого ланцюга. Передбачається, що конкретні амінокислотні залишки формують область контакту між варіабельними доменами легкого ланцюга і важкого ланцюга. Існує п'ять основних класів імуноглобулінів: IgA, IgD, IgE, IgG і IgM, і деякі з них можна додатково поділити на підкласи (ізотипи), наприклад, IgG1 IgG2, IgG3, IgG4, IgA1 и IgA2. Антитіло може бути частиною великої злитої молекули, утвореною при допомозі ковалентного або нековалентного зв'язку антитіла з одним або декількома іншими білками або пептидами. Антитіло також може бути частиною імунокон'югату, в якому антитіло кон'юговане з другою молекулою (наприклад, токсином, радіоізотоп або міткою). Термін "моноклональне антитіло", що використовується тут, стосується антитіла, отриманого з популяції по суті гомогенних антитіл, тобто, окремі антитіла ідентичні один одному за винятком можливих мутацій, які можуть бути присутніми в незначній кількості. "Гуманізовані" форми надлюдських антитіл являють собою антитіла або їх фрагменти, які містять каркасну ділянку (FR), що має по суті амінокислотну послідовність людського імуноглобуліну, і гіперваріабельну ділянка (CDR), що має по суті амінокислотну послідовність надлюдського імуноглобуліну (тобто, "імпортовану" послідовність). У деяких випадках, залишки каркасної ділянки людського імуноглобуліну замінені відповідними залишками, не характерними для людини. Для очищення антитіла можуть бути виконані додаткові модифікації гуманізованого антитіла. "Гіперваріабельна ділянка" або "CDR" означає одну з трьох гіперваріабельних послідовностей у варіабельних ділянках всередині кожного легкого і важкого ланцюгів імуноглобуліну. "Каркасна ділянка" або "FR" означає послідовності амінокислот, розташовані з кожної з сторін трьох CDR легкого і важкого ланцюгів імуноглобуліну. FR і CDR гуманізованого антитіла не повинні точно відповідати батьківським послідовностям, наприклад, імпортований CDR або консенсусний FR може бути мутований шляхом заміни, вставки або делеції щонайменше одного залишку таким чином, щоб залишок CDR або FR на цій ділянці не відповідав ні консенсусній, ні імпортованій послідовності. Однак такі мутації, як правило, не бувають великими. Звичайно, щонайменше 75 %, 80 %, 85 %, 90 %, 95 % або 99 % залишків гуманізованого антитіла відповідають залишкам батьківських послідовностей. Термін "приблизно", що використовується тут, у випадку величини, що вимірюється, такої як кількість, часова тривалість і т.п., охоплює варіації значень вказаної величини до±20 %, переважно±10 %, більш переважно±5 %, ще більш переважно±2 %, оскільки такі варіації є адекватними для реалізації розкритих способів. Якщо не вказане інше, всі числа, що виражають кількість компонентів, властивості, такі як молекулярна маса, умови проведення реакції і т.д., що використовується в описі і формулі винаходу, потрібно розуміти як змінні у всіх випадках в рамках терміну "приблизно". Відповідно, якщо не вказане інше, числові параметри, наведені в наступному описі і прикладеній формулі винаходу, є наближеннями, які можуть змінюватися в залежності від необхідних властивостей, що підбираються для отримання даного винаходу. У самому крайньому випадку, але не обмежуючи можливості застосування доктрини еквівалентів до об'єму формули винаходу, кожний числовий параметр потрібно розглядати щонайменше з точки зору числа, вираженого значущими цифрами із застосуванням звичайних способів округлення. Під "достатньою кількістю" або "ефективною кількістю" мається на увазі кількість терапевтичного антитіла або його фармацевтичної композиції, необхідна для лікування або полегшення порушення, такого як запальне порушення, клінічно релевантним способом. Достатня кількість терапевтичного антитіла проти FKN, його FKN-зв'язуючого фрагмента або фармацевтичної композиції, що використовується при реалізації даного винаходу на практиці для терапевтичного лікування, наприклад, запального порушення, змінюється в залежності від способу введення, віку і загального стану здоров'я пацієнта. "Спорідненість зв'язування", як правило, стосується сили загальної сумарної кількості нековалентних взаємодій між одиничним сайтом зв'язування молекули (наприклад, антитіла) і його партнером зв'язування (наприклад, антигеном). Спорідненість зв'язування може бути представлена константою дисоціації (Kd). Спорідненість може бути виміряна способами, відомими в даній галузі техніки, включаючи радіоімунологічний аналіз FKN-зв'язування (РІА) або аналіз методом поверхневого плазмонного резонансу (наприклад, BIACORE®). 4 UA 105073 C2 5 10 15 20 25 30 35 40 45 50 55 60 "Химерні" або "химеризовані" антитіла (тобто, імуноглобуліни) належать до антитіл, у яких частина важкого і/або легкого ланцюга є ідентичною або гомологічною відповідним послідовностям в антитілах, отриманих від конкретних видів або, що належать конкретному класу або підкласу антитіл, в той час як інша частина ланцюга(ів) є ідентичною або гомологічною відповідним послідовностям в антитілах, отриманих від іншого різновиду або, що належать іншому класу або підкласу антитіл, а також фрагментам таких антитіл, за умови, що вони виявляють необхідну біологічну активність (Morrison et al., Proc. Natl. Acad. Sci. U.S.A., 81:6851-6855, 1984). "Епітоп" або "антигенна детермінанта" означає амінокислотну послідовність, яка або внаслідок лінійної структури, або внаслідок тривимірної конформації, формує ділянку, зв'язуючу антитіло. Конформаційний епітоп, який може включати уривчасті ділянки амінокислотної послідовності антигену, взаємодіє з антитілом завдяки третинній структурі епітопу. Лінійний епітоп, навпаки, являє собою епітоп, який розпізнається антитілами по його первинній структурі. В одному з варіантів здійснення епітоп фракталкіну, який формує мінімальну область контакту з Fab, включає, наприклад, E66-Q69, W81-Q87, H70-F73 і H88-D90. Терміни "експресувати" і "продукувати" в даному описі використовуються синонімічно і стосуються біосинтезу генного продукту. Ці терміни охоплюють транскрипцію гена в РНК. Ці терміни також охоплюють трансляцію РНК в один або більше поліпептидів, а також охоплюють всі пост-транскрипційні і пост-трансляційні модифікації природного походження. Експресія/продукування антитіла може відбуватися в цитоплазмі клітини і/або у позаклітинному середовищі, такому як середовище зростання для клітинної культури. Під терміном "фракталкін", "FKN", "ФК" або "нейротактин" мається на увазі поліпептид, який є гомологічним поліпептиду, визначеному послідовністю SEQ ID NO:1 (фіг. 1) і який володіє біологічною активністю FKN (наприклад, зв'язується з рецептором CX3CR1; викликає хемотаксис Т-клітин і моноцитів; або сприяє адгезії лейкоцитів до активованих ендотеліальних клітин). Біологічну активність поліпептиду FKN можна оцінювати за допомогою будь-якого стандартного способу. Згідно з визначенням, що використовується тут, FKN також включає будь-який член або ізоморф сімейства FKN. Див., наприклад, патент США № 7390490, WO 2006/046739, і публікацію заявки на патент США № 2006/0233710, які включені в даний опис у вигляді посилання. "FKN-зв'язуючий фрагмент" включає частину інтактного антитіла, що містить його FKNзв'язуючу ділянку і здатний зв'язувати FKN. FKN-зв'язуючі фрагменти можуть являти собою Fab, Fab', F(ab')2 або Fv фрагменти; діатіла; триатіла; тетратіла; міні-антитіла; молекули афітіла; мінітіла; лінійні антитіла; молекули одноланцюжкових антитіл; або поліспецифічні антитіла, утворені з фрагментів антитіл. "Гомологічний" означає будь-який ген або послідовність білка, яка щонайменше на 30 %, 40 %, 50 %, 60 %, 70 %, 80 %, 90 %, 95 %, 99 % або більше гомологічна послідовності відомого гена або білка по довжині послідовності порівняння. "Гомологічний" білок також може володіти щонайменше однією біологічною активністю білка порівняння. Для поліпептидів довжина послідовностей порівняння, як правило, складає щонайменше 15, 20, 25, 35 або більше амінокислот. Для нуклеїнових кислот довжина послідовностей порівняння, як правило, складає щонайменше 50, 60, 75, 100, 125 або більше нуклеотидів. "Гомологія" також може стосуватися значної схожості між епітопом, що використовується для генерації антитіл, і білком або його фрагментом, на який направлені антитіла. У цьому випадку, гомологія стосується схожості, достатньої для продукування антитіл, які можуть специфічно впізнавати представляючий інтерес білок. "Людське антитіло" означає, що антитіло має або виняткове людське походження, або є будь-яким антитілом, в якому послідовності варіабельних і константних доменів являють собою людські послідовності або послідовності людських антитіл. Цей термін охоплює антитіла з послідовностями, отриманими з (тобто, які використовують) людських генів, але які були змінені, наприклад, для зменшення можливої імуногенності, збільшення афінності, видалення цистеїнів, які можуть бути причиною небажаної конформації, і т.д. Цей термін охоплює такі антитіла, продуковані рекомбінантно в нелюдських клітинах, які можуть викликати глікозилування, нетипове для людських клітин. "Гібридома" стосується продукту злиття клітин між неопластичним лімфоцитом культурального походження і примованим В- або Т-лімфоцитом, який експресує специфічний імунний потенціал батьківської клітини. Термін "запальне порушення", що використовується тут, стосується будь-якого захворювання, порушення або стану, при якому імунна система активована аномально. Запальне порушення може являти собою, наприклад, виразковий коліт, хворобу Крона, 5 UA 105073 C2 5 10 15 20 25 30 35 40 45 50 55 60 запальну хворобу кишечника, ревматоїдний артрит, міозит, розсіяний склероз, нейромієліт зорового нерва, атеросклероз, псоріаз, системний червоний вовчак (наприклад, вовчак з ураженням центральної нервової системи або вовчаковий нефрит), нефрит, гломерулонефрит, аутоімунну хворобу печінки і жовчних шляхів (наприклад, аутоімунний гепатит, первинний жовчний цироз печінки або первинний склерозуючий холангіт), реакцію трансплантат проти господаря, атопічний дерматит, астму, нейродегенеративну хворобу (наприклад, Хворобу Альцгеймера), демієлінізуючу полірадікулонейропатію (наприклад, синдром Гійєна-Баре або хронічну запальну демієлінізуючу полірадікулонейропатію), нейропатичний біль, вісцеральний біль при раку, атеросклероз, вікову дегенерацію м'язів, діабетичну нефропатію, саркоїдозний увеїт або цукровий діабет. Альтернативно, захворювання, порушення або стан являє собою захворювання верхніх або нижніх дихальних шляхів, наприклад, лімфоматозний трахеобронхіт; алергічну гіперчутливість або стан гіперсекреції, такий як хронічний бронхіт і кістозний фіброз; легеневий фіброз різної етіології (наприклад, ідіопатичний легеневий фіброз); хронічне обструктивне захворювання легенів (ХОЗЛ); саркоїдоз; алергічний і неалергічний риніт; алергічну або неалергічну кропивницю; пов'язане з шкірою захворювання, що характеризується нерегульованим запаленням, перебудову тканини, ангіогенез і неоплазію; захворювання шлунково-кишкового трактату, таке як хвороба Гіршспрунга, діарею, стан малабсорбції і запальні стани; порушення центральної і периферичної нервової системи, таке як депресія, стан тривоги, хвороба Паркінсона, мігрень і інші форми черепного болю, інсульт і блювання; захворювання імунної системи, таке як в тканинах селезінки і лімфатичних вузлів, аутоімунне захворювання або інше захворювання, пов'язане з імунною системою; захворювання серцево-судинної системи, таке як набряк легенів, гіпертензію, прееклампсію, тип 2 складного регіонального синдрому болю і інсульт; хронічне запальне захворювання, таке як артрит; захворювання, пов'язане з кістками; хронічний біль, такий як фіброміалгія; і інші порушення, в патогенез, патологію, і етіологію яких залучена дія нейролекінів, тахікінінів або інших родинних речовин (наприклад, хемокінінів). Додаткові приклади запальних порушень являють собою звичайні прищі; синдром гострої дихальної недостатності; хворобу Адісона; алергічні внутрішньоочні запальні захворювання; ANCA-асоційований гранулематозний ангіїт; анкілозний спондиліт; аутоімунну гемолітичну анемію; хворобу Бехчета; параліч Бела; булезний пемфігоїд; церебральну ішемію; цироз печінки; синдром Когана; контактний дерматит; синдром Кушінга; дерматоміозит; атрофічну еритему; еозинофільний фасціїт; вузлувату еритему; ексфоліативний дерматит; осередковий гломерулосклероз; осередковий і сегментний гломерулосклероз; сегментний гломерулосклероз; гігантських клітин артеріїт; подагру; подагричний артрит; ручну екзему; пурпуру ШенлейнаГеноха; герпес вагітних; гірсутизм; ідіопатичний цератосклерит; ідіопатичну тромбоцитопенічну пурпуру; імунну тромбоцитопенічну пурпуру, запальні порушення кишечника або шлунковокишкового тракту; запальний дерматоз; червоний плоский лишай; лімфоматозний трахеобронхіт; набряк жовтої плями; міастенію гравіс; неспецифічне фіброзуюче захворювання легенів; остеоартрит; панкреатит; пемфігоїд вагітних; звичайну пухирчатку; періодонтит; вузелковий поліартеріїт; ревматичну поліміалгію; мошонковий зуд; зуд/запалення; псоріатичний артрит; легеневий гістоплазмоз; рецидивуючий поліхондрит; розацеа; саркоїдоз; склеродерму; синдром септичного шоку; плечовий тендиніт або бурсит; синдром Шегрена; хворобу Стіла; хворобу Світа; системний склероз; синдром Такаясу; тимчасовий артеріїт; токсичний епідермальний некроліз; відторгнення трансплантата і синдроми, пов'язані з відторгненням трансплантата; туберкульоз; діабет типу 1; васкуліт; синдром Фогта-Коянаги-Харада (ФКХ); і грануломатоз Вегенера. Термін "ізольований" або "очищений" означають змінений "з участю людини" по відношенню до природного стану. Якщо молекула або композиція зустрічається в природі, її "ізолюють" або "очищають", коли її змінюють або виділяють з її природного навколишнього середовища, або і те і інше. Наприклад, полінуклеотид або поліпептид, природно присутній в живій рослині або тварині, не є "ізольованим" або "очищеним", але той же самий полінуклеотид або поліпептид, відділений від матеріалів, існуючих спільно з ним в його природному стані, є "ізольованим" або "очищеним", згідно з терміном, що використовується в даному описі. Термін "функціонально пов'язаний" або "функціонально введений" означає, що регуляторні послідовності, необхідні для експресії кодуючої послідовності, вміщені в молекулу нуклеїнової кислоти у відповідних положеннях відносно кодуючої послідовності, забезпечуючи таким чином можливість експресії кодуючої послідовності. Як приклад, промотор функціонально пов'язаний з кодуючою послідовністю, якщо промотор здатний керувати транскрипцією або експресією такої кодуючої послідовності. Кодуючі послідовності можуть бути функціонально пов'язані з промотором або регуляторними послідовностями в смисловому або антисмисловому напрямі. 6 UA 105073 C2 5 10 15 20 25 30 35 40 45 50 55 60 Термін "функціонально пов'язаний" іноді застосовується до розташування інших елементів контролю транскрипції (наприклад, енхансерів) у векторі експресії. "Полінуклеотид" який синонімічно називається "молекулою нуклеїнової кислоти" означає будь-який полірибонуклеотид або полідезоксирибонуклеотид, який може являти собою немодифіковану РНК або ДНК або модифіковану РНК або ДНК. "Полінуклеотиди" включають, без обмеження, однониткову і двохниткову ДНК, ДНК, яка являє собою суміш однониткових і двохниткових ділянок, однониткову і двохниткову РНК і РНК, яка являє собою суміш однониткових і двохниткових ділянок, гібридні молекули, що містять ДНК і РНК, які можуть бути однонитковими, або частіше двохнитковими або сумішшю однониткових і двохниткових ділянок. Крім того, "полінуклеотид" стосується трьохниткових ділянок, що містять РНК або ДНК, або як РНК, так і ДНК. Термін полінуклеотид також включає ДНК або РНК, що містять одну або декілька модифікованих основ, і ДНК або РНК з основним ланцюгом, модифікованим з метою отримання стабільності або з іншою метою. "Модифіковані" основи включають, наприклад, тритиловані основи і незвичайні основи, такі як інозин. ДНК і РНК можуть містити множину різних модифікацій; таким чином, термін "полінуклеотид" охоплює хімічно, ферментативно або метаболічно модифіковані форми полінуклеотидів, що звичайно зустрічаються в природі, а також хімічні форми ДНК і РНК, характерні для вірусів і клітин. "Полінуклеотид" також охоплює відносно короткі ланцюги нуклеїнових кислот, які часто називають олігонуклеотидами. "Поліпептид" стосується як коротких ланцюгів, які звичайно називають пептидами, олігопептидами або олігомерами, так і більш довгих ланцюгів, які, як правило, називають білками. Поліпептиди можуть містити інші амінокислоти крім 20 амінокислот, що кодуються геном. "Поліпептиди" включають амінокислотні послідовності, модифіковані або природними процесами, такими як пост-трансляційний процесинг, або методами хімічної модифікації, які відомі в даній галузі техніки. Такі модифікації добре описані в підручниках і більш спеціалізованих монографіях, а також в численній науковій літературі. Модифікації можуть виникати в будь-якому місці поліпептиду, включаючи основний пептидний ланцюг, бічні ланцюги амінокислот і карбоксильні або амінні кінці. Потрібно зазначити, що заданий поліпептид може мати один і той же тип модифікацій, в тій або іншій мірі, на декількох ділянках. Крім того, заданий поліпептид може мати багато типів модифікацій. Поліпептиди можуть розгалужуватися в результаті убіквинтилування і можуть бути циклічними з бічними ланцюгами або без них. Циклічні, розгалужені і розгалужені циклічні поліпептиди можуть бути результатом природних посттрансляційних процесів або можуть бути отримані синтетичними способами. Модифікації включають, наприклад, ацетилування, ацилування, АДФ-рибозилування, амідування, ковалентне приєднання флавіну, ковалентне приєднання гем фрагмента, ковалентне приєднання нуклеотиду або похідних нуклеотиду, ковалентне приєднання ліпіду або похідного ліпіду, ковалентне приєднання фосфатиділінозитолу, поперечне зшивання, циклізацію, утворення дисульфідних зв'язків, деметилування, формування ковалентних поперечних зв'язків, формування цистину, формування піроглутамату, формілування, гамма-карбоксилування, глікозилування, формування GPI якора, гідроксилування, йодинування, метилування, миристоїлування, окислення, протеолітичну обробку, фосфорилування, пренілування, рацемізацію, селеноїлування, сульфатацію, опосрередковане транспортною РНК додання до білків амінокислот, таке як аргінілування, і убіквитинілування (див., наприклад, PROTEINSSTRUCTURE AND MOLECULAR PROPERTIES, 2nd Ed., T.E. Creighton, W.H. Freeman and Company, New York, 1993; Wold, F., Post-translational Protein Modifications: Perspectives and Prospects, 1-12, в POST-TRANSLATIONAL COVALENT MODIFICATION OF PROTEINS, B.C. Johnson, Ed., Academic Press, New York, 1983; Seifter et al, Meth Enzymol, 182, 626-646; and Rattan, et al, Protein Synthesis: Posttranslational Modifications and Aging, Ann. NY Acad. Sci, (1992) 663: 48-62). "Специфічно зв'язує" означає, що антитіло або його фрагмент впізнає і зв'язує антиген (наприклад, FKN або його фрагмент) і при цьому по суті не впізнає і не зв'язує інші молекули в зразку (наприклад, біологічному зразку). "Специфічно" означає відрізняти слабу неспецифічну аглютинуючу здатність, яка іноді може відбуватися між випадковими білками, наприклад, з оголеними гідрофільньними доменами. Це не має на увазі, що антитіло не буде зв'язувати ні з яким іншим білком крім антигену за винаходом. Антитіла можуть вступати в крос-реакцію (і "специфічно зв'язуватися") з будь-яким білком, який містить відповідний епітоп. "Суб'єктом" називається будь-яка тварина, наприклад, ссавець (наприклад, людина). Суб'єкт, який піддається лікуванню, наприклад, запального порушення, являє собою суб'єкт, який був діагностований лікарем або ветеринаром в залежності від обставин, як такий, що має такий стан. Діагноз може бути здійснений будь-якими відповідними засобами. Для фахівця в даній галузі очевидно, що об'єкт за винаходом може бути підданий стандартним тестам або 7 UA 105073 C2 5 10 15 20 25 30 35 40 45 50 55 може бути ідентифікований, без експертизи, як суб'єкт з високим ризиком внаслідок наявності одного або декількох чинників ризику, таких як вік, генетика або анамнез. Клітка "трансформована" або "трансфікована" екзогенними або гетерологічними нуклеїновими кислотами, такими як ДНК, якщо така ДНК введена в клітину. Трансформуюча ДНК може або не може бути інтегрована (наприклад, ковалентно пов'язана) в геном клітини. У прокаріотичних, дріжджових клітинах і клітинах ссавців, наприклад, трансформуюча ДНК може знаходитися в епісомальному елементі, такому як плазміда. Що стосується еукаріотичних клітин, то стабільно трансформована клітина, або "стабільна клітина", являє собою клітину, в якій трансформуюча ДНК інтегрована в хромосому з тим, щоб вона передавалася по спадщині дочірнім клітинам через реплікацію хромосом. Ця стабільність підтверджується здатністю еукаріотичної клітини основувати клітинну лінію або клони, що складаються з популяції дочірніх клітин, що містять трансформуючу ДНК. "Клон" являє собою популяцію клітин, отриманих з однієї клітини або загального предка шляхом мітозу. "Клітинна лінія" являє собою клон первинної клітини, яка здатна до стабільного зростання in vitro протягом багатьох генерацій. Під "лікуванням" мається на увазі введення терапевтичного антитіла або його фармацевтичної композиції для профілактичних і/або терапевтичних цілей. Терміни "лікувати захворювання або порушення" або застосування для "терапевтичного лікування" стосуються застосування лікування до пацієнта, вже страждаючого захворюванням, для поліпшення стану суб'єкта. Даний суб'єкт може бути діагностований як такий, що має запальне порушення, основуючись на ідентифікації будь-якого з характерних симптомів або застосування діагностичних методів, відомих фахівцеві в даній галузі. "Попередити захворювання або порушення" означає профілактичне лікування суб'єкта, який ще не хворий, але сприйнятливий до розвитку конкретного захворювання, або яким-небудь іншим чином схильний до ризику розвитку конкретного захворювання. Суб'єкта визначають, як схильного до ризику розвитку запального порушення, використовуючи діагностичні методи, відомі в даній галузі. "Вектор" являє собою реплікон, такий як плазміда, фаг, космід або вірус, в який може бути функціонально вставлений інший сегмент нуклеїнової кислоти з тим, щоб викликати реплікацію або експресію цього сегмента. Як використовується в даному описі і прикладеній формулі винаходу, форми однини включають посилання на множину, якщо в контексті в явному вигляді не вказане інше. Таким чином, наприклад, вказівка на "клітину" включає комбінацію двох або більше клітини, і т.п. Інші ознаки і переваги винаходу стануть очевидними з докладного опису і формули винаходу. Короткий опис креслень Фіг. 1 ілюструє амінокислотну послідовність людського FKN. Фіг. 2 являє собою таблицю, що демонструє характеристики зв'язування (тобто, нейтралізуючу активність, афінність зв'язування і видову крос-реактивність) моноклональних антитіл проти FKN. Фіг. 3 ілюструє вирівнювання варіабельних ділянок важких ланцюгів гуманізованих послідовностей mAb проти FKN (SEQ ID NO:36-37 і 42-43, відповідно, в порядку появи), послідовності m3A5-2 (SEQ ID NO:26), послідовності Ig зародкової лінії (SEQ ID NO:40) і послідовності AAA68427.1 (SEQ ID NO:34). Фіг. 4 ілюструє вирівнювання варіабельних ділянок важких ланцюгів гуманізованих послідовностей mAb проти FKN (SEQ ID NO:38 і 44-45, відповідно, в порядку появи), послідовність m3A5-2 (SEQ ID NO:27), послідовності Ig зародкової лінії (SEQ ID NO:41) і послідовності ABU90602.1 (SEQ ID NO:35). Фіг. 5 являє собою таблицю, підсумовуючу результати трьох незалежних аналізів хемотаксису. Нейтралізуючу активність гуманізованих mAb проти hFKN аналізували за допомогою аналізу хемотаксису. Всі комбінації H3 і H3-2 з L2 і L4 були успішно гуманізовані, оскільки ці mAb демонструють нейтралізуючу активність, аналогічну активності химерної mAb. Однак HK2, який був отриманий шляхом використання більш вузького діапазону ключових залишків, показав знижену нейтралізуючу активність в комбінації з L2 або L4. На фіг. 6A і фіг. 6B зображені серії графіків, що демонструють нейтралізуючу активність m3A5-2 mAb і химерної mAb. Фіг. 6A являє собою графік, що демонструє нейтралізуючу активність m3A5-2 mAb, визначену аналізом хемотаксису. Фіг. 6В являє собою графік, що демонструє нейтралізуючу активність химерної mAb, визначену аналізом хемотаксису. На фіг. 7A-7D зображені серії графіків, що демонструють нейтралізуючу активність гуманізованих антитіл проти hFKN, визначену аналізом хемотаксису. На фіг. 7А показана нейтралізуюча активність H3L2-IgG2. На фіг. 7B показана нейтралізуюча активність H3-L4-IgG2. 8 UA 105073 C2 5 10 15 20 25 30 35 40 45 50 55 60 На Фіг. 7C показана нейтралізуюча активність HK2L2-IgG2. На фіг. 7D показана нейтралізуюча активність HK2L4-IgG2. На фіг. 8A-8F зображені серії графіків, що демонструють нейтралізуючу активність гуманізованих антитіл проти hFKN, визначену аналізом хемотаксису. На фіг. 8A показана нейтралізуюча активність H3-2L2-IgG2. На фіг. 8B показана нейтралізуюча активність H3-2L4IgG2. На фіг. 8C показана нейтралізуюча активність H3-2L5-IgG2. На фіг. 8D показана нейтралізуюча активність HK3L2-IgG2. На фіг. 8E показана нейтралізуюча активність HK3L4IgG2. На фіг. 8F показана нейтралізуюча активність HK3L5-IgG2. Фіг. 9 являє собою таблицю, підсумовуючу результати аналізу BIACORE®, використаного для вимірювання афінності зв'язування mAb з hFKN і FKN яванської макаки (cynomolgus monkey). На фіг. 10A-10C зображені серії графіків, що демонструють афінність зв'язування химерних і гуманізованих антитіл проти hFKN (H3L2, H3-2L2, H3L4, H3-2L4 і HK2L4) з hFKN-SEAP і FKNSEAP яванської макаки, визначену аналізом BIACORE®. Фіг. 10A являє собою гістограму, що демонструє значення Ka (1/мс). Фіг. 10B являє собою гістограму, що демонструє значення Kd (1/с). Фіг. 10С являє собою гістограму, що демонструє значення KD (M). На фіг. 11 показані результати картирування епітопу за допомогою бібліотек синтетичних пептидів, що перекриваються (SEQ ID NO:115-135, відповідно, в порядку появи) з домену хемокіну FKN. На фіг. 12 показані результати картирування епітопу hFKN методом ELISA. На фіг. 13 показані результати картирування епітопу hFKN методом BIACORE®. На фіг. 14 показані результати експеримента крос-насичення для ідентифікації Fabзв'язуючого сайта фракталкіну. Графік показує, що ділянки FKN E66-Q69, W81-Q87, H70-F73 і H88-D90 містяться в мінімальній області контакту з Fab. Докладний опис винаходу Були розроблені і виділені химерні антитіла проти FKN, гуманізовані антитіла проти FKN і їх FKN-зв'язуючі фрагменти. Описані тут гуманізовані антитіла проти FKN і їх FKN-зв'язуючі фрагменти можуть використовуватися для лікування запальних порушень. Такі антитіла також можуть використовуватися для інгібування рекрутинга лейкоцитів в ділянці запалення. Запальні порушення, які можна лікувати згідно з винаходом, включають виразковий коліт, хворобу Крона, запальну хворобу кишечника, ревматоїдний артрит, міозит, розсіяний склероз, нейромієліт зорового нерва, атеросклероз, псоріаз, системний червоний вовчак (наприклад, вовчак з ураженням центральної нервової системи або вовчаковий нефрит), нефрит, гломерулонефрит, аутоімунну хворобу печінки і жовчних шляхів (наприклад, аутоімунний гепатит, первинний жовчний цироз печінки або первинний склерозуючий холангіт), реакцію трансплантат проти господаря, атопічний дерматит, астму, нейродегенеративну хворобу (наприклад, Хворобу Альцгеймера), демієлінізуючу полірадікулонейропатію (наприклад, синдром Гійєна-Баре або хронічну запальну демієлінізуючу полірадікулонейропатію), нейропатичний біль, вісцеральний біль при раку, атеросклероз, вікову дегенерацію м'язів, діабетичну нефропатію, саркоїдозний увеїт, цукровий діабет, лімфоматозний трахеобронхіт, алергічну гіперчутливість або стан гіперсекреції, такий як хронічний бронхіт і кістозний фіброз, легеневий фіброз різної етіології (наприклад, ідіопатичний легеневий фіброз), хронічне обструктивне захворювання легких (ХОЗЛ), саркоїдоз, алергічний і неалергічний риніт, алергічну або неалергічну кропивницю, пов'язане з шкірою захворювання, що характеризується нерегульованим запаленням, перебудову тканини, ангіогенез і неоплазію, захворювання шлунково-кишкового трактату, таке як хвороба Гіршспрунга, діарею, стан малабсорбції і запальні стани, порушення центральної і периферичної нервової системи, такий як депресія, стан тривоги, хвороба Паркінсона, мігрень і інші форми черепного болю, інсульт і блювання, захворювання імунної системи, такий як в тканинах селезінки і лімфатичних вузлів, аутоімунне захворювання або інше захворювання, пов'язане з імунною системою, захворювання серцево-судинної системи, таке як набряк легенів, гіпертензія, прееклампсія, тип 2 складного регіонального синдрому болю і інсульт, хронічне запальне захворювання, таке як артрит, захворювання, пов'язане з кістками, хронічний біль, такий як фіброміалгія, звичайні прищі, синдром гострої дихальної недостатності, хвороба Адісона, алергічні внутрішньоочні запальні захворювання, ANCA-асоційований гранулематозний ангіїт, анкілозний спондиліт, аутоімунна гемолітична анемія, хвороба Бехчета, параліч Бела, булезний пемфігоїд, церебральну ішемію, цироз печінки, синдром Когана, контактний дерматит, синдром Кушинга, дерматоміозит, атрофічну еритему, еозинофільний фасціїт, вузлувату еритему, ексфоліативний дерматит, осередковий гломерулосклероз, осередковий і сегментний гломерулосклероз, сегментний гломерулосклероз, гігантських клітин артеріїт, подагру, подагричний артрит, ручну екзему, пурпуру Шенлейна-Геноха; герпес вагітних, гірсутизм, 9 UA 105073 C2 5 10 15 20 25 30 35 40 45 50 55 60 ідіопатичний цератосклерит, ідіопатичну тромбоцитопенічну пурпуру, імунну тромбоцитопенічну пурпуру, запальні порушення кишечника або шлунково-кишкового тракту, запальний дерматоз, червоний плоский лишай, лімфоматозний трахеобронхіт, набряк жовтої плями, міастенію гравіс, неспецифічне фіброзуюче захворювання легенів, остеоартрит, панкреатит, пемфігоїд вагітних, звичайну пухирчатку, періодонтит, вузелковий поліартеріїт, ревматичну поліміалгію, мошонковий зуд, зуд/запалення, псоріатичний артрит, легеневий гістоплазмоз, рецидивуючий поліхондрит, розацеа, саркоїдоз, склеродерма, синдром септичного шоку, плечовий тендиніт або бурсит, синдром Шегрена, хвороба Стіла, хвороба Світа, системний склероз, синдром Такаясу, тимчасовий артеріїт, токсичний епідермальний некроліз, відторгнення трансплантата і синдроми, пов'язані з відторгненням трансплантата, туберкульоз, діабет типу 1, васкуліт, синдром Фогта-Коянаги-Харада (ФКХ), і грануломатоз Вегенера. Антитіла Способи отримання і очищення антитіл або їх FKN-зв'язуючих фрагментів відомі в даній галузі. Див., наприклад, Kohler et al., Nature 256:495-497 (1975); Hongo et al., Hybridoma 14:253260 (1995); Harlow et al., Antibodies: А Laboratory Manual (Cold Spring Harbor Laboratory Press), 2nd ed. (1988); Hammerling et al., Monoclonal Antibodies and T-Cell Hybridomas (Elsevier), 563-681 (1981); Ni, Xiandai Mianyixue, 26:265-268 (2006); патенти США №№ 7189826, 7078492 і 7153507; Vollmers and Brandlein, Histology and Histopathology 20:927-937 (2005); Vollmers and Brandlein, Methods and Findings in Experimental and Clinical Pharmacology 27:185-191 (2005); US 2006/258841; US 2006/183887; US 2006/059575; US 2005/287149; US 2005/100546; і US 2005/026229. Химерні антитіла Химерні антитіла і способи їх отримання відомі і використовуються в даній галузі техніки. Термін "химерне антитіло", що використовується тут, означає антитіло або його FKN-зв'язуючий фрагмент, що має щонайменше деяку частину щонайменше одного варіабельного домена, отриманого з амінокислотної послідовності антитіла ссавця, що не стосується людини, гризуна або рептилії, в той час як інші частини антитіла або його FKN-зв'язуючого фрагмент отримані від людини. Наприклад, химерне антитіло може включати антиген-зв'язуючий домен миші з людським Fc або іншим таким структурним доменом. Гуманізовані антитіла Винахід охоплює гуманізовані антитіла проти FKN і їх FKN-зв'язуючі фрагменти, які, наприклад, модулюють взаємодію між FKN і CX3CR1. Гуманізацію можна виконувати способом щеплення гіперваріабельних ділянок (CDR) (Kontermann and Dubel, Antibody Engineering, Springer Lab Manual (2001) and Tsurushita et al., Methods 36:)(69-83 (2005)). Гуманізацію також можна виконувати згідно з способами, відомими в даній галузі техніки (див., наприклад, Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-327 (1988); and Verhoeyen et al., Science 239:1534-1536 (1988)), шляхом заміни послідовностей гіперваріабельних ділянок, відповідних послідовностям людського антитіла. Гуманізовані антитіла звичайно є людськими антитілами, в яких деякі залишки гіперваріабельних ділянок і можливо деякі залишки FR замінені залишками з аналогічних ділянок в надлюдських антитілах. Вибір людських варіабельних доменів, як легкого так і важкого ланцюгів, для використання при створенні гуманізованих антитіл може бути важливим з точки зору зниження антигенності. Згідно з способом "найкращої відповідності" послідовність варіабельного домена антитіла гризуна піддають скринінгу по всій бібліотеці відомих людських послідовностей варіабельних доменів. Людська послідовність, яка є найбільш близькою до послідовності гризуна, потім приймається як людська каркасна ділянка для гуманізованого антитіла. Див., наприклад, Sims et al., J. Immunol. 151:2296-2308 (1993) and Chothia et al., J. Mol. Biol. 196:901-917 (1987). В іншому методі використовується конкретна каркасна ділянка, отримана з консенсусної послідовності всіх людських антитіл конкретної підгрупи легких або важких ланцюгів. Одна і та ж каркасна ділянка може використовуватися для декількох різних гуманізованих антитіл. Див., наприклад, Carter et al., Proc. Natl. Acad. Set USA 89:4285-4289 (1992) and Presta et al., J. Immunol. 151:26232632 (1993). Також бажано, щоб антитіла були гуманізованими із збереженням високої афінності до антигену і інших сприятливих біологічних властивостей. Для досягнення цієї мети, згідно з одним з методів, гуманізовані антитіла отримують шляхом аналізу батьківських послідовностей і різних концептуальних гуманізованих продуктів, використовуючи тривимірні моделі батьківських і гуманізованих послідовностей. Тривимірні моделі імуноглобуліну є загальнодоступними і відомі фахівцям в даній галузі. Доступні комп'ютерні програми, які ілюструють і відображають на екрані вірогідні тривимірні конформаційні структури вибраних послідовностей імуноглобулінукандидата. Вивчення таких відображень дозволяє аналізувати вірогідну роль залишків в 10 UA 105073 C2 5 10 15 20 25 30 35 40 45 50 55 60 функціонуванні послідовності імуноглобуліну-кандидата, тобто, аналізувати залишки, які впливають на здатність імуноглобуліну-кандидата зв'язатися зі своїм антигеном. Таким чином, залишки FR, отримані від реципієнта, можуть бути вибрані і об'єднані, і послідовності можуть бути імпортовані таким чином, щоб отримати бажану характеристику антитіла, таку як збільшену афінність по відношенню до цільовому антигену(ів) (наприклад, FKN або його фрагменту). Як правило, залишки CDR мають безпосередній і найбільш істотний вплив на зв'язування антигена. FKN-зв'язуючі фрагменти У деяких варіантах здійснення винаходу надаються FKN-зв'язуючі фрагменти, які модулюють взаємодію між FKN і CX3CR1. Такі фрагменти можуть являти собою функціональні антиген-зв'язуючі фрагменти інтактних, гуманізованих і/або химерних антитіл, таких як фрагменти Fab, Fab', F(ab')2, Fv або ScFv (див., наприклад, Bird et al., Science 242:423-426 (1998)). Такі фрагменти отримують шляхом протеолітичного розщеплення інтактних антитіл, наприклад, розщепленням папаїном (див., наприклад, WO 94/29348), але можна отримати безпосередньо з рекомбінантно трансформованої клітини хазяїна. FKN-зв'язуючі фрагменти можуть бути отримані за допомогою різних інженерних методик, як описано нижче. Енергія взаємодії між двома ланцюгами фрагментів Fv більш низька, ніж у фрагментів Fab. Для стабілізації асоціації VH і VL доменів фрагменти Fv зв'язували пептидами (див., наприклад, Bird et al., Science 242:423-426 (1998) and Huston et al., PNAS 85:5879-5883 (1998)), дисульфідними містками (див., наприклад, Glockshuber et al., Biochemistry 29:1362-1367 (1990)) і мутаціями "виступ-в-западину" ("knob in hole") (див., наприклад, Zhu et al., Protein Sci. 6:781-788 (1997)). Фрагменти ScFv можуть бути отримані способами, добре відомими фахівцям в даній галузі (див., наприклад, Whitlow et al., Methods Enzymol. 2:97-105 (1991) and Huston et al., Int. Rev. Immunol. 10:195-217 (1993)). ScFv можна продукувати в бактерійних клітинах, таких як Е. coli, але також можна продукувати в еукаріотичних клітинах. Одним з недоліків ScFv є моновалентність продукту, яка перешкоджає підвищеній авідності внаслідок полівалентного зв'язування; іншим недоліком є короткий період напіввиведення фрагментів ScFv. Спроби вирішити ці проблеми включають бівалент (ScFv') 2, отриманий з ScFV, що містить додатковий С-термінальний цистеїн, шляхом хімічного зв'язування (див., наприклад, Adams et al., Cancer Res. 53:4026-4034 (1993) and McCartney et al., Protein Eng. 8:301-314 (1995)) або шляхом спонтанної сайт-специфічної димеризації ScFv, що містить неспарений залишок Стермінального цистеїну (див., наприклад, Kipriyanov et al., Cell. Biophys. 26:187-204 (1995)). Альтернативно, можна ініціювати формування мультимерів з ScFv шляхом укорочення пептидних лінкерів до 3-12 залишків для утворення "діатіл" (див., наприклад, Holliger et al., PNAS 90:6444-6448 (1993)). Більш того укорочення лінкера може дати тримери ScFV, утворюючи "триатіла" (див., наприклад, Kortt et al., Protein Eng. 10:423-433 (1997)) і тетрамери, утворюючи "тетратіла" (див., наприклад, Le Gall et al., FEBS Letters 453:164-168 (1999)). Бівалентні молекули ScFV також можна отримати шляхом генетичного злиття з димеризуючими мотивами білків для формування "мініантитіла" (див., наприклад, Pack et al., Biochemistry 31:1579-1584 (1992)) і "мінітіл" (див., наприклад, Hu et al., Cancer Res. 56:3055-3061 (1996)). Тандеми ScFv-Sc-Fv ((ScFv)2) також можуть бути отримані за допомогою з'єднання двох одиниць ScFv третім пептидним лінкером (див. Kurucz et al J.Immunol. 154, 4576-4582 (1995)). Біспецифічні діатіла можуть бути отримані за допомогою нековалентної асоціації продуктів злиття двох окремих ланцюгів, що містять VH-домен з одного антитіла, з'єднаного за допомогою короткого лінкера з VL-доменом з іншого антитіла (див. Kipriyanov et al, Int. J. Can. 77, 763-772 (1998)). Стабільність таких біспецифічних діатіл можна збільшити шляхом введення дисульфідних містків або мутацій "виступ-в-западину" ("knob in hole"), як описано вище, або шляхом утворення одноланцюжкових діатіл (ScDb), в яких два гібридних ScFv-фрагменти з'єднані за допомогою пептидного лінкера (див. Kontermann et al J.Immunol. Methods 226: 179188 (1999)). Тетравалентні біспецифічні молекули доступні, наприклад, завдяки злиттю ScFvфрагмента з СН3-доменом молекули IgG або з Fab-фрагментом через шарнірну область (див. Coloma et al., Nature Biotechnol. 15: 159-163 (1997)). Альтернативно, тетравалентні біспецифічні молекули отримують шляхом злиття біспецифічних одноланцюжкових діатіл (див. Alt et al, FEBS Lett 454: 90-94 (1999)). Менші тетравалентні біспецифічні молекули також можуть бути утворені шляхом димеризації або тандемів ScFv-ScFv з лінкером, що містить мотив спіраль-петляспіраль (DiBi мінідіатіла, див. Muller et al., FEBS Lett 432: 45-49 (1998)), або одноланцюжкової молекули, що містить чотири варіабельних домена антитіла (VH і VL) в орієнтації, що запобігає внутрішньомолекулярному спаровуванню (тандемне діатіло, див. Kipriyanov et al, J.Mol.Biol. 293: 41-56 (1999)). Біспецифічні F(ab')2 фрагменти можуть бути створені шляхом хімічного зв'язування Fab' фрагментів або шляхом гетеродимеризації за допомогою лейцинових 11 UA 105073 C2 5 10 15 20 25 30 35 40 45 50 55 60 "блискавок" (див. Shalaby et al, J.Exp.Med. 175: 217-225 (1992), and Kostelny et al, J.lmmunol. 148: 1547-1553 (1992)). Також доступні виділені VH і VL домени (див. патенти US 6248516; US 6291158; US 6172197). Фармацевтичні лікарські форми Терапевтичні лікарські форми, що містять антитіло або його FKN-зв'язуючий фрагмент за винаходом, можуть бути об'єднані з фізіологічно прийнятними носіями, наповнювачами або стабілізаторами у вигляді водних або сухих лікарських форм. Прийнятні носії, наповнювачі або стабілізатори включають, наприклад, фізрозчин; буферні розчини, такі як фосфатний, цитратний і інших органічних кислот; антиоксиданти, включаючи аскорбінову кислоту; низькомолекулярні поліпептиди; білки (наприклад, сироватковий альбумін, желатин або імуноглобуліни); гідрофільні полімери, такі як полівінілпіролідон; амінокислоти; монсахариди, дисахариди і інші вуглеводи, включаючи глюкозу, маннозу або декстрини; хелатуючі агенти, такі як ЕДТА; цукрові спирти, такі як маніт або сорбітол; створюючі сіль протиіони, такі як натрій; або неіоногенні поверхнево-активні речовини, такі як ТВІН™, Плюроніки™ або ПЕГ. Антитіла або їх FKN-зв'язуючі фрагменти за винаходом можуть бути укладені в мікрокапсули, в колоїдні системи доставки лікарської речовини (наприклад, ліпосоми, альбумінові мікросфери, мікроемульсії, наночастинки або нанокапсули) або в макроемульсії. У випадку, коли бажане введення антитіла з уповільненим вивільненням в лікарській формі з характеристиками вивільнення, відповідними для лікування будь-якого порушення, що вимагає введення антитіла, можна розглянути мікроінкапсуляцію антитіла. Приклади матриць з уповільненим вивільненням включають складні поліефіри, гідрогелі (наприклад, полі(2гідроксіетилметакрилат) або полі(вініловий спирт)), полілактиди (див., наприклад, U.S. Patent No. 3,773,919), співполімери L-глутаміновой-кислоти і γ-етил-L-глутамату, ацетат етиленвініла, що нерозкладається, співполімери, що розкладаються, молочна кислота-гліколева кислота, такий як LUPRON DEPOT™ (що вводяться ін'єкцією мікросфери, що складаються з співполімера молочна кислота-гліколева кислота і ацетату леупроліду), а також полі-D-(-)-3гідроксимасляну кислоту. Лікарські форми, призначені для використання для введення in vivo, повинні бути стерильними. Це легко досягається за допомогою фільтрації через стерильні фільтраційні мембрани. Методи комбінованої терапії Терапевтичні антитіла або їх FKN-зв'язуючі фрагменти за винаходом в процесі лікування можуть використовуватися або окремо, або в комбінації з іншими композиціями. Наприклад, антитіло за винаходом можна вводити спільно з одним або більше іншими антитілами, протизапальними агентами, цитостатичними агентами, антиангіогенними агентами, цитокінами, інгібуючими зростання агентами або спільно з анти-TNF-α терапією. Такі методи комбінованої терапії включають комбіноване введення (при якому вказані два або більше агентів включені одну і ту ж або окремі лікарські форми) і роздільне введення (наприклад, одночасно або послідовно). При роздільному введенні двох або більше агентів введення антитіла за винаходом можна здійснювати до або після введення допоміжної терапії. Ефективна кількість терапевтичних агентів, що вводяться в комбінації з антитілом проти FKN або його FKN-зв'язуючим фрагментом, призначається на розсуд лікаря. Дозування обчислюється таким чином, щоб досягнути максимального контролю стану, який потрібно вилікувати. Дозування також залежить від таких чинників як тип терапевтичного агента, що використовується, і конкретний суб'єкт лікування. Відповідне дозування може бути занижене внаслідок комбінованої дії (синергії) додаткового терапевтичного агента і антитіла проти FKN або його FKN-зв'язуючого фрагмента. Протизапальні агенти Протизапальну сполуку можна вводити в комбінації з антитілами або їх FKN-зв'язуючими фрагментами за винаходом. Ілюстративні протизапальні агенти включають стероїди, такі як глюкокортикоїд, нестероїдні протизапальні лікарські речовини (наприклад, ібупрофен або такролімус), специфічні інгібітори сциклооксигенази-2, такі як рофекоксиб (Vioxx®) і целекоксиб (Celebrex®), кортикостероїди (наприклад, преднізон або гідрокортизон), специфічні цитокіни, направлені на функцію Т-лимфоцитів, флубіпрофен, диклофенак і кетаролак. Див., наприклад, патенти США №№ 7112578 і 7199119, включені в даний опис у вигляді посилання. Інші агенти Інші терапевтичні агенти, які можна вводити, включають, наприклад, аміносаліцилати (наприклад, 5-аміносаліцилову кислоту), сульфасалазин (наприклад, азуфладин), мезаламін (наприклад, Асакол® або Пентаса®), імуран (наприклад, Імуран®), 6-меркаптопурин (наприклад, Пурінетол®), циклоспорин, метотрексат, інфліксимаб (наприклад, Ремікейд®), 12 UA 105073 C2 5 10 15 20 25 30 35 40 45 50 55 60 інтерферони (наприклад, інтерферон-β), глатирамера ацетат (наприклад, Копаксон®), наталізумаб (Тисабрі®), анти-інтегрин-α4, урсодеоксиходеву кислоту, такрину гідрохлорид, інгібітор редуктази HMG CoA, лідокаїн, сульфонілсечовину, циклофосфамід, внутрішньовенний імуноглобулін, амітриптилін, опіати (наприклад. морфін), дифеноксилат, атропін, вітамін Д, кальцій, ламотригін, кветіапін, простагландин Е1, нітрогліцерин, пегаптаніб, ранібізумаб, ізосорбіду динітрат, пероспірон, топірамат, оксарбазепін, допамін, мікофенолята мофетил, мізорибін, леветирацетам, фентаніл, трамадол, дигіталіс, капсаїцин, натрійуретичний пептид, клоридин, дронати (наприклад, алендронат), безафібрат, мексилетин, глініди (наприклад, натеглінід або репаглінід), донепезилу гідрохлорид, лефлуномід, прегабалін, ривастигміну тартрат, пентаніл, простациклін, прокаїнамід, колхіцин, інгібітори α-глюкозидази, діуретики (наприклад, тіазидні діуретики або антиальдостеронові діуретики), такролімус, мемантину гідрохлорид, пентазоцин, клопідогрель, тканинний активатор плазміногену, талідомід, блокатор рецептора ангіотензину, тіазолідиндіон, метронідазол, спіронолактон, дулоксетин, пароксетин, клонідин, тиклопідин, гепарин, блокатори кальцієвих каналів, інсулін, альбумін, буциламін, карбамазепін, рисперидон, лімапрост, варфарин, вертепорфін, габапентин, галантамін гідробромід, аспірин, урокіназу, хлорамбуцил, інгібітор ангіотензин-перетворюючого ферменту, бігуаніди, інгібітори або агоністик β-адренергічних рецепторів, гідрохлорохін і мітоксантрон. Лікування порушення, розкритого в даному описі (наприклад, запального порушення), може додатково включати застосування інших методів терапії. Наприклад, для лікування, наприклад, синдрому Гійєна-Баре, демієлінізуючої полірадікулопатії (наприклад, хронічної запальної демієлінзуючої полірадікулопатії), тромботичної тромбоцитопенічної пурпури (TTP), хвороби Бехчета, або розсіяного склерозу можна використати плазмаферез (наприклад, плазмообмінну терапію). Дозування і введення Полегшення або лікування запального порушення звичайно включає ослаблення одного або більше симптомів або ускладнення, пов'язані з порушенням. У випадку запальних захворювань терапевтично ефективна кількість терапевтичного антитіла, його FKN-зв'язуючих фрагментів або його фармацевтичної композиції може приводити до одного або комбінації наступних ознак: зменшенню запалення; зменшенню абдомінального болю або судом; зменшенню здуттю живота; зменшенню або усуненню діареї; зменшенню покриття виразками травного трактату; зменшенню лихоманки; зменшенню або ослабленню нудоти; зменшенню втоми; мінімізації втрати ваги; полегшенню болю в суглобах; зменшенню припухлості; зменшенню висипання на шкірі або зуду; усуненню жовтяниці; і/або ослабленню одного або більше симптомів, пов'язаних із запальним порушенням. "Терапевтично ефективна кількість" антитіла, призначена для введення, являє собою мінімальну кількість, необхідну для профілактики, полегшення або лікування запального порушення. Описані тут антитіла, FKN-зв'язуючі фрагменти і фармацевтичну композицію вводять суб'єкту згідно з відомими методами, такими як внутрішньовенне введення у вигляді болюсу або безперервної інфузії протягом деякого часу, топічне, пероральне, підшкірне введення, введення у вигляді ін'єкції в бронх, внутрішньоцеребральне, інтраназальне, трансдермальне, інтраперитонеальне, внутрішньом'язове, внутрішньолегеневе, вагінальне, ректальне, внутрішньосуглобне, внутрішньоартеріальне введення, введення безпосередньо в зону осередку ураження, парентеральне, інтравентрикулярне введення в мозок, або внутрішньоочне введення. Зокрема, може бути бажаним локальне введення, якщо з лікуванням пов'язані значні побічні ефекти або токсичність. Лікарські склади для перорального застосування також можуть надаватися у вигляді жувальних таблеток або у вигляді твердих желатинових капсул, в яких активний інгредієнт змішаний з інертним твердим розріджувачем, або у вигляді м'яких желатинових капсул, в яких активний інгредієнт змішаний з водним або масляним середовищем. Для терапевтичних застосувань також може використовуватися стратегія ex vivo. Стратегія ex vivo включає трансфекцію або трансдукцію отриманих від суб'єкта клітин полінуклеотидом, що кодує антитіло або фрагмент антитіла. Потім трансфіковані або трансдуковані клітини повертають суб'єкту. Клітини можуть бути будь-якого типу в широкому діапазоні, включаючи, без обмеження, гемопоетичні клітини (наприклад, клітини кісткового мозку, макрофаги, моноцити, дендритні клітини, Т-клітини або В-клітини), фібробласти, епітеліальні клітини, ендотеліальні клітини, кератиноцити або м'язові клітини. Дозування і час введення композицій за даним винаходом залежать від різних клінічних чинників, включаючи загальний стан здоров'я суб'єкта і тяжкість симптомів запального порушення. Лікування може продовжуватися від 1 дня до 4 років, 1 дні до 3 років, 1 дні до 2 років, 1 дні до року, 1-100 днів, 1-60 днів, 1-20 днів, 1-10 днів або до вилікування або 13 UA 105073 C2 5 10 15 20 25 30 35 40 45 50 55 60 полегшення запального порушення або симптомів запального порушення. Композиції за даним винаходом можна вводити чотири рази на добу, три рази на добу, два рази на добу, щодня, щотижня, два рази на місяць, щомісяця, раз на два місяці, раз на три місяці або щорічно. Дозування змінюється в залежності від тяжкості стану і підбирається для досягнення стійкої концентрації в сироватці крові від приблизно 1 нг/мл до 10 мкг/мл або від 1 до 500 нг/мл. Кількість антитіла, що вводиться, звичайно знаходиться в діапазоні від приблизно 0,001 до приблизно 30 мг/кг маси суб'єкта (наприклад, від 0,01 до приблизно 10 мг/кг маси суб'єкта). ПРИКЛАДИ Даний винахід проілюстрований наступними прикладами, які жодним чином не призначені для обмеження винаходу. Приклад 1. Отримання мишачих моноклональних антитіл проти людського фракталкіну (hFKN) Мишачі моноклональні антитіла (mAbs) проти hFKN отримували згідно з описаним раніше способом (див., наприклад, патент США № 7390490, включений в даний опис у вигляді посилання). Отримували клони нейтралізуючих mAb 1F3-1, 3A5-2, 1F3, 1G1, 2B2, 3D5, 3H7, 6D1, 7F6 і 5H7-6. Приклад 2. Вибір кандидатного mAb для гуманізації Клони 1F3-1, 3A5-2 і 5H7-6 аналізували за допомогою аналізів хемотаксису для вимірювання нейтралізуючої активності, аналізів BIACORE® для вимірювання афінності зв'язування hFKN, і твердофазних імуноферментних аналізів (ELISA) для вимірювання видової крос-реактивності з FKN яванської макаки. Дані щодо нейтралізуючої активності, афінності зв'язування і видової крос-реактивності з FKN яванської макаки підсумовувані на Фіг. 2. Клон 3A5-2 показав найвищу нейтралізуючу активність і найвищу афінність зв'язування hFKN. Клон 3A5-2 показав однакову реактивність з FKN яванської макаки і hFKN. Тому як кандидат для гуманізації був вибраний клон 3A5-2. Аналіз хемотаксису виконували таким чином. Клітини вміщували у верхні лунки культуральной планшети Трансвелл (планшета MultiScreen-MIC, 5,0 мкм, Millipore, Catalog No. MAMIC 5S10) з лігандом в нижніх лунках. Спочатку рекомбінантний людський FKN (R&D Systems, Catalog No. 362-CX/CF) (кінцева концентрація 33 нг/мл) (Фіг.1) заздалегідь інкубували з очищеними антитілами при різних концентраціях (від 0 до 10 нг/мл) при кімнатній температурі. Композиція містила наступні компоненти: 15 мкл/лунка 10х розчин хемокіну; 15 мкл/лунка 10х очищені mAb; і 120 мкл/лунка 1x буферу для хемотаксису (0,5 % BSA, 0,5 % FBS, 20 мМ HEPES (pH 7,4), 50 мкМ 2-меркаптоетанол в RPMI1640 (Invitrogen)). Через 30 хвилин трансфіковані 5 CX3CR1 клітини B300.19 (2×10 клітин/75 мкл) вносили у верхні лунки і інкубували в 5 % CО2 інкубаторі при 37 °C протягом 4 годин. Після інкубації, відбирали 150 мкл розчину з нижніх лунок, фіксували 50 мкл 4 % PFA/PBS, і 30 мкл зразків використали в клітинному аналізаторі FACSCantoII для підрахунку мігрованих клітин. Аналіз BIACORE® виконували таким чином. Рекомбінантний протеїн А/G (Pierce Chemical) імобілізували на сенсорному чіпі BIACORE® (CM5), який заздалегідь інкубували з амінзв'язуючим реагентами (GE Healthcare). Очищені mAb додавали в сенсорні чіпи з концентрацією 0,2 мкг/мл. Розчинні антигени (розчинний FKN, кон'югований з секретованою лужною фосфатазою (SEAP) або контрольними SEAP протеїнами) додавали в сенсорні чіпи при різних концентраціях (від 0 до 200 нм). Безперервно відстежували асоціацію доданих антигенів з mAb, імобілізованих на сенсорних чіпах, відносну відповідь зв'язування антигенів визначали, використовуючи систему BIACORE A100 (GE Healthcare). ELISA виконували таким чином. Поліклональне антитіло до IgG кролика (Jackson ImmunoResearch Laboratories, Catalog No. 711-005-152) наносили в лунки 96-ти лункової планшети (Nunc, Catalog No. 442402)). Після інкубації протягом ночі при 4 °C лунки блокували 1x Block-Ace (DainipponPharma) протягом 1 години при кімнатній температурі. Після триразового промивання 0,05 % Твін 20/PBS в лунки додавали 10 нМ кролячих поліклональних анти-PLAP антитіл (Biomeda) (50 мкл/лунка). Після інкубації протягом 1 години при кімнатній температурі і триразовому промиванні, як описано вище, в лунки додавали культуральний супернатант, що містить hFKN-SEAP або яванської макаки FKN-SEAP (кінцева концентрація 1 нМ) і інкубували протягом 1 години при кімнатній температурі. Після триразового промивання очищені mAb проти hFKN додавали в лунки при різних концентраціях (від 0 до 10 мкг/мл). Після інкубації протягом 1 години і триразового промивання кон'юговані з пероксидазою хрону антимишачі IgG антитіла (Jackson ImmunoResearch Laboratories, Catalog No. 715-036-151) додавали з концентрацією 0,16 мкг/мл (50 мкл/лунка) і інкубували протягом 1 години при кімнатній температурі. Після триразового промивання в лунки додавали розчин TMB (3,3', 5,5' тетраметилбензидин) і інкубували протягом 15-30 хвилин. У лунки додавали рівний об'єм 14 UA 105073 C2 5 10 15 20 25 30 35 40 45 50 55 розчину (2М H2SO4), що зупиняється, і реєстрували оптичну густину при 450 нм зчитуючим пристроєм для мікропланшетів (Arvo, PerkinElmer). Розчинний hFKN-SEAP отримували таким чином. кДНК, що кодує позаклітинну область hFKN, ампліфікували, використовуючи праймер 5'-SalI-hFKN (CGCGTCGACGCCACCATGGCTCCGATATCTCTGTC; SEQ ID NO:2) і праймер 3'-NotI-hFKN (GCGGGCGGCCGCCCTCCGGGTGGCAGCCTGGG; SEQ ID NO:3) і субклонували у вектор pкДНК3.1(+)dSalI SEAP, що містить кДНК SEAP. Вектор експресії hFKN-SEAP трансфікували в клітини HEK293EBNA (HEK293E) (Invitrogen). Клітини HEK293E інкубували з DMEM (Invitrogen), доповненою 10 % ембріональною бичачою сироваткою, за день до трансфекції. У день трансфекції середовище замінювали на OPTI-MEMII, що не містить сироватку (Invitrogen). Вектор експресії трансфікували TransIT LT1 (TAKARA) згідно з інструкцією виробника. Після 3-х денної інкубації (5 % CO2 при 37 °C) збирали культуральний супернатант. Концентрацію білка SEAP вимірювали, використовуючи набір 2.0 для хемолюмінісценції Great EscAPe SEAPSEAP (Clontech).) Розчинний FKN-SEAP яванської макаки отримували таким чином. кДНК, що кодує позаклітинну область FKN яванської макаки, ампліфікували, використовуючи праймер 5'-XhoIFKN яванської макаки (GCGCTCGAGGCCACCATGGCTCCGATATCTCTGTCGTGG; SEQ ID NO:4) і праймер 3'-NotI-FKN яванської макаки (CGCGGCGGCCGCGGTGGCAGCCTGGGAGTCAGGGAC; SEQ ID NO:5) і субклонували в pENTR1А (Invitrogen), що містить кДНК SEAP. Фрагмент, що кодує FKN яванської макаки і SEAP, трансфікували в пкДНК3.1, що містить касету В, за допомогою системи GATEWAY (Invitrogen). Культуральний супернатант, що містить FKN-SEAP яванської макаки, отримували, як описано вище. Приклад 3. Клонування кДНК варіабельних ділянок важких і легких ланцюгів клона 3A5-2 мишачих mAb проти hFKN кДНК важких і легких ланцюгів клона 3A5-2 ампліфікували методом ЗТ-ПЛР. Сумарну РНК виділяли з гібридоми клона 3A5-2, використовуючи міні-набір RNeasy (QIAGEN). За допомогою повної РНК синтезували кДНК, використовуючи набір для синтезу кДНК (TAKARA), і ампліфікували за допомогою праймера 5'-Mm-HC-Leader1 (GGGATGGRATGSAGCTGKGTMATSCTCTT; SEQ ID NO:6), праймера 5'-Mm-HC-Leader2 (GGGATGRACTTCGGGYTGAGCTKGGTTTT; SEQ ID NO:7) або праймера 5'-Mm-HC-Leader3 (GGGATGGCTGTCTTGGGGCTGCTCTTCT; SEQ ID NO:8) і праймера 3'-Mm-IgG2a-CH3-R (TCATTTACCCGGAGTCCGGGAGAAGCTCTTAGTC; SEQ ID NO:9) для важкого ланцюга і праймера 5'-Mm-LC-Leader1 (GGGATGGAGACAGACACACTCCTGCTAT; SEQ ID NO:10) або праймера 5'-Mm-LC-Leader2 (GGGATGGATTTTCAGGTGCAGATTTTCAG; SEQ ID NO:11) або праймера 5'-Mm-LC-Leader3 (GGGATGRAGTCACAKACYCAGGTCTTYRTA; SEQ ID NO:12) або праймера 5'-Mm-LC-Leader4 (GGGATGAGGKCCCCWGCTCAGYTYCTKGGR; SEQ ID NO:13) або праймера 5'-Mm-LC-Leader5 (GGGATGAAGTTGGCTGTTAGGCTGTTG; SEQ ID NO:14) і праймера 3'-Mm-Ckappa-R (CTAACACTCATTCCTGTTGAAGCTC; SEQ ID NO:15) для легкого ланцюга, відповідно. Ампліфіковані кДНК субклонували у вектор pCR2.1 (Invitrogen). Послідовності аналізували, використовуючи ABI3130XL. Отримували важкий ланцюг повної довжини і 5'-укорочену версію L-ланцюга. Для ампліфікації укороченої ділянки L-ланцюга і ідентифікації точних лідерних послідовностей виконували швидку ампліфікацію 5'-кінців кДНК (5'-RACE). Двохниткову кДНК отримували, використовуючи набір для синтезу кДНК (TAKARA) і додавали 5' адаптер (ad29S; ACATCACTCCGT (SEQ ID NO:16) і as29AS; ACGGAGTGATGTCCGTCGACGTATCTCTGCGTTGATACTTCAGCGTAGCT (SEQ ID NO:17), відпалювали). кДНК ампліфікували, використовуючи праймер 5'PCR1 (GTATCAACGCAGAGATACGTCGACGG; SEQ ID NO:18) для першої ПЛР і праймер 5'-PCR4 (AGCTACGCTGAAGTATCAACGCAGAG; SEQ ID NO:19) для другої ПЛР і 3'HC RACE primer_1 (GTACGGAGTACTCCAAAAATGTTG; SEQ ID NO:20) для першої ПЛР або 3'HC RACE primer_2 (TCTTCAGGCTGCAGGCTGATGATC; SEQ ID NO:21) для другої ПЛР для Н-ланцюга, 3'LC RACE primer_3 (AAATCTTCAGGCTGCAGGCTGTTG; SEQ ID NO:22) для першої ПЛР або 3'LC RACE primer_4 (CTGTTGATCTTGAGAGAATATTGTG; SEQ ID NO:23) для другої ПЛР для L-ланцюга, відповідно. Ампліфіковані кДНК субклонували і секвенували, як описано вище. Ідентифіковані послідовності варіабельних ділянок були наступними. Нуклеотидна послідовність варіабельної ділянки важкого (Н) ланцюга: 15 UA 105073 C2 Нуклеотидна послідовність варіабельної ділянки легкого (L) ланцюга: Амінокислотна послідовність варіабельної ділянки важкого (Н) ланцюга: 5 10 15 20 Амінокислотна послідовність варіабельної ділянки легкого (L) ланцюга: Приклад 4. Конструювання гуманізованих mAb проти FKN з клона 3A5-2 Мишачі mAb проти hFKN, клон 3A5-2, гуманізували способом прищеплювання гіперваріабельних ділянок (CDR) (Kontermann and Dübel, Antibody Engineering, Springer Lab Manual (2001) та Tsurushita et al., Methods 36: 69-83 (2005). Амінокислотні послідовності CDR були наступними. CDR-H1: NYYIH (SEQ ID NO:28) CDR-H2: WIYPGDGSPKFNERFKG (SEQ ID NO:29) CDR-H3: GPTDGDYFDY (SEQ ID NO:30) CDR-L1: RASGNIHNFLA (SEQ ID NO:31) CDR-L2: NEKTLAD (SEQ ID NO:32) CDR-L3: QQFWSTPYT (SEQ ID NO:33) Людські акцепторні каркасні ділянки вибирали серед сегментів людських варіабельних ділянок. Ідентифіковані CDR 3A5-2 прищеплювали у вибрані людські акцепторні каркасні ділянки. Сконструйовані гуманізовані послідовності були наступними. H-ланцюг (позначений як H3: SEQ ID NO:36) H-ланцюг (позначений як H3-2: SEQ ID NO:37) 25 L-ланцюг (позначений як L2; SEQ ID NO:38) 16 UA 105073 C2 H-ланцюг (позначений як H4; SEQ ID NO:39) Послідовності H-ланцюга зародкової лінії (SEQ ID NO:40) 5 Послідовності L-ланцюга зародкової лінії (SEQ ID NO:41) H-ланцюг (позначений як HK2; SEQ ID NO:42) 10 H-ланцюг (позначений як HK3; SEQ ID NO:43) L-ланцюг (позначений як L4; SEQ ID NO:44) 15 20 25 30 35 L-ланцюг (позначений як L5: SEQ ID NO:45) Всі гуманізовані послідовності вирівняні (фіг. 3 і 4). Приклад 5. Конструювання векторів експресії гуманізованих mAbs проти hFKN Для вибору лідерних послідовностей для експресії гуманізованих mAb, проводили пошук сегментів зародкової лінії, основуючись на подібності до AAA68427.1 і ABU90602.1. Сегменти VH1-1-18 і VKI-012 були найбільш подібними до AAA68427.1 і ABU90602.1, відповідно. Їх лідерні послідовності використовували для експресії гуманізованих mAb. Їх лідерні послідовності були наступними. Амінокислотна послідовність H-ланцюга (SEQ ID NO:46) MDWTWSILFLVAAPTGAHS Нуклеотидні послідовності H-ланцюга ATGGACTGGACCTGGAGCATCCTTTTCTTGGTGGCAGCACCAACAGGTGCCCACTCC (для H3 і H3-2; SEQ ID NO:47) ATGGACTGGACATGGTCCATCCTGTTCCTGGTGGCCGCTCCAACTGGCGCACACTCT (для HK2 і HK3; SEQ ID NO:48) Амінокислотна послідовність L-ланцюга (SEQ ID NO:49) MDMRVPAQLLGLLLLWLRGARC Нуклеотидна послідовність L-ланцюга (SEQ ID NO: 50) ATGGACATGAGGGTCCCCGCTCAGCTCCTGGGGCTCCTGCTACTCTGGCTCCGAGGTGCCA GATGT Варіабельні ділянки сконструйованих гуманізованих mAb проти hFKN, до яких приєднували описані вище лідерні послідовності, отримували методом ПЛР, використовуючи наступні праймери. 17 UA 105073 C2 5 10 15 20 25 30 35 40 45 50 55 60 Для H3 важкого ланцюга праймер h3A5-2_VH3-1 (SEQ ID NO:51): ATGGACTGGACCTGGAGCATCCTTTTCTTGGTGGCAGCACCAACAGGTGC праймер h3A5-2_VH3-2R (SEQ ID NO:52): CCAGACTGCACCAGCTGCACCTGGGAGTGGGCACCTGTTGGTGCTGCCAC праймер h3A5-2_VH3-3 (SEQ ID NO:53): GTGCAGCTGGTGCAGTCTGGGGCTGAGGTGAAGAAGCCTGGGGCCTCAGT праймер h3A5-2_VH3-4R (SEQ ID NO:54): GTGTATCCAGAAGCCTTGCAGGAGACCTTCACTGAGGCCCCAGGCTTCTT праймер h3A5-2_VH3-5 (SEQ ID NO:55): TGCAAGGCTTCTGGATACACCTTCACCAACTACTATATACACTGGGTGAA праймер h3A5-2_VH3-6R (SEQ ID NO:56): ATCCACTCAAGCCCTTGTCCAGGGGCCTGCTTCACCCAGTGTATATAGTA праймер h3A5-2_VH3-7 (SEQ ID NO:57): GGACAAGGGCTTGAGTGGATAGGATGGATTTATCCTGGAGATGGTAGTCC праймер h3A5-2_VH3-8R (SEQ ID NO:58): GTCCTGCCCTTGAACCTCTCATTGAACTTAGGACTACCATCTCCAGGATA праймер h3A5-2_VH3-9 (SEQ ID NO: 59): GAGAGGTTCAAGGGCAGGACCACCCTGACCGCAGACAAGTCCACGAACAC праймер h3A5-2_VH3-1 OR (SEQ ID NO:60): GATCTCAGGCTGCTCAGCAACATGTAGGCTGTGTTCGTGGACTTGTCTGC праймер h3A5-2_VH3-11 (SEQ ID NO:61): TTGCTGAGCAGCCTGAGATCTGACGACACGGCCGTGTATTTCTGTGCGAC праймер h3A5-2_VH3-12R (SEQ ID NO:62): TAGTCAAAGTAGTCGCCATCAGTGGGCCCTGTCGCACAGAAATACACGGC праймер h3A5-2 VH3-13 (SEQ ID NO:63): GATGGCGACTACTTTGACTACTGGGGCCAAGGGACCACGGTCACCGTCTC праймер h3A5-2_R (SEQ ID NO:64): GACCGATGGGCCCTTGGTGGAGGCTGAAGAGACGGTGACCGTGGTCCC Для легкого ланцюга L2 праймер h3A5-2_VL2-1 (SEQ ID NO:65): GCCACCATGGACATGAGGGTCCCCGCTCAGCTCCTGGGGCTCCTGCTACTCTGGCTCCGAG GTGCCAGAT праймер h3A5-2_VL2-2R (SEQ ID NO:66): TCCTACAGATGCAGACAGGGAGGATGGAGACTGGGTCATCTGGATGTCACATCTGGCACCT CGGAGCCAG праймер h3A5-2_VL2-3 (SEQ ID NO:67): CCCTGTCTGCATCTGTAGGAGACAGAGTCACCATCACTTGCCGAGCAAGCGGGAATATTCAC AATTTTTT праймер h3A5-2_VL2-4R (SEQ ID NO:68): GAACTTAGGGGCTTTCCCTGGTTTCTGTTGATACCATGCTAAAAAATTGTGAATATTCCCGCT TGCTCGG праймер h3A5-2_VL2-5 (SEQ ID NO:69): CAGGGAAAGCCCCTAAGTTCCTGGTCTATAATGAAAAAACCTTAGCAGATGGGGTCCCATCA AGGTTCAG праймер h3A5-2_VL2-6R (SEQ ID NO:70): GTTGCAGACTGCTGATGGTGAGAGTATATTGTGTCCCAGATCCACTGCCACTGAACCTTGAT GGGACCCC праймер h3A5-2_VL2-7 (SEQ ID NO:71): САССАТСAGCAGTCTGCAACCTGAAGATTTTGCGACCTACTTCTGTCAACAGTTTTGGAGTAC TCCGTAT праймер h3A5-2_VL2-8R (SEQ ID NO:72): TTTGATCTCCACCTTGGTCCCTCCGCCGAACGTATACGGAGTACTCCAAAACTGTTGACAGAA праймер h3A5-2_VL-R (SEQ ID NO:73): GACAGATGGTGCAGCCACAGTTCGTTTGATCTCCACCTTGGTCCCTCC Отримані H3 і L2 ампліфікували методом ПЛР, використовуючи праймер 5'-Eco-Sal-h3A52_VH_F (GCGAATTCGTCGACGCCACCATGGACTGGACCTGGAGCATCCTTTTCTTG; SEQ ID NO:74) і 3'-NheI-h3A5-2_VH_R (CGCGCTAGCTGAAGAGACGGTGACCGTGGTCCC; SEQ ID NO:75) для H3 і праймер 5'-h3A5-2_VL_SalI-kozac_F (GCGGTCGACGCCACCATGGACATGAGGGTCCCC; SEQ ID NO:76) і праймер 3'-h3A5-2_VL-R 18 UA 105073 C2 (GACAGATGGTGCAGCCACAGTTCGTTTGATCTCCACCTTGGTCCCTCC; SEQ ID NO: 77) для L2, відповідно. H4 отримували згідно Genscript USA Inc. Послідовності H4 були наступними. H4 (SEQ ID NO:78): 5 10 15 20 25 30 35 40 45 Варіабельні ділянки HK2 отримували з H4 введенням точкових мутацій, використовуючи метод ПЛР з наступними праймерами. праймер h3A5-2_HKG2_sal24F (SEQ ID NO:79): CGCGTCGACGCCACCATGGACTGGACATGGTCCATCCTG праймер h3A5-2_HKG2_280F (SEQ ID NO:80): ATGACCGCCGATACCTCAACCTCCACAGCTTACATGGAA праймер h3A5-2_HKG2_300R (SEQ ID NO:81): GGTTGAGGTATCGGCGGTCATTGTGGTCCG праймер h3A5-2_HKG2_340F (SEQ ID NO:82): GAGGATACAGCAGTGTATTTCTGTGCCCGGGGGCCAACC праймер h3A5-2_HKG2_370R (SEQ ID NO:83): GGCACAGAAATACACTGCTGTATCCTCAGAGCGCAG праймер h3A5-2_HKG2_Nhe24R (SEQ ID NO:84): CGCGCTAGCACTAGACACGGTCACGGTAGTTCC Варіабельні ділянки HK3 отримували з HK2 введенням точкових мутацій, використовуючи метод ПЛР з наступними праймерами. праймер h3A5-2_HKG2_sal24F (SEQ ID NO:85): CGCGTCGACGCCACCATGGACTGGACATGGTCCATCCTG праймер HKG3_R (SEQ ID NO:86): TTGACTTATCGGCGGTCAGTGTGGTCCGGCCTTTAAACCTTTC праймер HKG3_F (SEQ ID NO:87): ACACTGACCGCCGATAAGTCAACCTCCACAGCTTACATGGAA праймер h3A5-2_HKG2_Nhe24R (SEQ ID NO:88): CGCGCTAGCACTAGACACGGTCACGGTAGTTCC Варіабельну ділянку L4 отримували з L2 введенням точкових мутацій, використовуючи метод ПЛР з наступними праймерами. праймер h3A5-2_VL4_sal24F (SEQ ID NO:89): CGCGTCGACGCCACCATGGACATGAGGGTCCCCGCTCAG праймер h3A5-2_VL4_200R (SEQ ID NO:90): CAGCAGCTTAGGGGCTTTCCCTGGTTTCTG праймер h3A5-2_VL4_190F (SEQ ID NO:91): GGGAAAGCCCCTAAGCTGCTGATCTATAATGAAAAA праймер h3A5-2_VL4_260R (SEQ ID NO:92): TGTCCCAGATCCACTGCCACTGAACCTTGA праймер h3A5-2_VL4_250F (SEQ ID NO:93): AGTGGCAGTGGATCTGGGACAGACTATACTCTCACC праймер h3A5-2_VL4_BsiW24R (SEQ ID NO:94): CGCCGTACGTTTGATCTCCACCTTGGTCCCTCC Варіабельні ділянки L5 отримували з L4 введенням точкових мутацій, використовуючи метод ПЛР з наступними праймерами: праймер h3A5-2_VL4_sal24F (SEQ ID NO:95): CGCGTCGACGCCACCATGGACATGAGGGTCCCCGCTCAG праймер VL5_R (SEQ ID NO:96): 19 UA 105073 C2 5 10 15 20 25 30 35 40 45 50 55 60 GGTGAGAGTATACTGTGTCCCAGATCCACTGCCACTGAAC праймер VL5_F (SEQ ID NO:97): GGATCTGGGACACAGTATACTCTCACCATCAGCAGTCTG 5 h3A5-2_VL4_BsiW24R (SEQ ID NO:98): cgcCGTACGTTTGATCTCCACCTTGGTCCCTCC Константні ділянки IgG2 і Igκ ампліфікували, використовуючи праймер 5'-NheI-IgG2_F (CGCGCTAGCACCAAGGGCCCATCGGTCTTCCCC; SEQ ID NO:99) і праймер 3'-EcoRV-IgG2_R (CGCGATATCTCATTTACCCGGAGACAGGGAGAG; SEQ ID NO:100) для IgG2 і праймер 5'-BsiWIIgK_F (CGCCGTACGGTGGCTGCACCATCTGTCTTCATC; SEQ ID NO:101) і праймер 3'-EcoRVIgK_R (CGCGATATCCTAACACTCTCCCCTGTTGAAGCT; SEQ ID NO:102) для Igκ, відповідно. Ампліфіковані константні ділянки субклонували в pENTR1A dNotI з видаленим NotI. Отримані варіабельні ділянки субклонували в pENTR1A-IgG2 або pENTR1A-Igκ, використовуючи сайти Sall-NheI для важких ланцюгів або сайти Sall-BsiWI для легких ланцюгів, відповідно. У випадку L2, константну ділянку Igκ ампліфікували, використовуючи праймер 5'hIGΚ_F (CGAACTGTGGCTGCACCATCTGTC; SEQ ID NO:103) і праймер 3'-hIGΚ_NotI-R (CGCGCGGCCGCCTAACACTCTCCCCTGTTGAAGCTCTT; SEQ ID NO:104). Ампліфіковану константну ділянку Igκ і отриману L2 об'єднували методом ПЛР і субклонували в pENTR1A. Субклоновані варіабельні ділянки і константні ділянки переносили в pEE6.4 або pEE12.4 (Lonza) для важкого ланцюга і легкого ланцюга, відповідно, використовуючи систему GATEWAY (Invitrogen). H3-2 отримували з pENTR1A-H3-IgG2 введенням точкової мутації, використовуючи систему для сайт-направленого мутагенезу GeneTailor з праймером 5'-h3A5-2_H3-2_300F (TTGCTGAGCAGCCTGAGATCTGAGGACACGGCC; SEQ ID NO: 105) і праймером 3'-h3A5-2_H32_320R (AGATCTCAGGCTGCTCAGCAACATGTAGGC; SEQ ID NO:106). Сайт-направлений мутагенез GeneTailor виконували згідно з інструкціями виробника. Мутовану варіабельну ділянку і константну ділянку переносили в pEE6.4, як описано вище. Приклад 6. Отримання гуманізованих mAb проти hFKN Вектори експресії важкого і легкого ланцюгів гуманізованого mAb проти hFKN трансфікували в клітини HEK293E. У день трансфекції клітини HEK293E інокулювали в DMEM (Invitrogen), доповнену 10 % фетальною бичачою сироваткою. Після інкубування протягом 5 годин суміш векторів експресії важкого і легкого ланцюгів трансфікували, використовуючи ліпофектамін 2000 (Invitrogen), згідно з інструкціями виробника. Наступного дня після трансфекції середовище замінювали на середовище 293 Serum-Free Media (SFM) II (Invitrogen). Після інкубації протягом 5 днів при 37 °C збирали культуральний супернатант. Для аналізів BIACORE використали безпосередньо зібраний супернатант. Для аналізів хемотаксису супернатант очищали, використовуючи колонку з сефарозою, що містить рекомбінатний білок А (Pharmacia). Приклад 7. Отримання химерних мишачих-людських 3A5-2 mAb Варіабельние ділянки важкого ланцюга мишачого 3A5-2 ампліфікували, використовуючи праймер 5'-EcoRI-SalI-3A5-2 VH (GCGGAATTCGTCGACGCCACCATGCGATGGAGCTGGA-TC; SEQ ID NO:107) і 3'-IgG перекриваючий 3A5-2 VH праймер (GACCGATGGGCCCTTGGTGGAGGCTGAGGAGACTGTGAGAGTGGTGCC; SEQ ID NO:108). Людську константну ділянку IgG2 ампліфікували, використовуючи праймер 5'-hIgG2 (GCCTCCACCAAGGGCCCATCGGTCTTCCCCCTGGCGCCCTG; SEQ ID NO:109) і праймер 3'NotI-hIgG2 (CGCGCGGCCGCTCATTTACCCGGAGACAGGGAGAG; SEQ ID NO:110). Ампліфіковані 3A5-2 VH і людську константну ділянку IgG2 об'єднували за допомогою методу ПЛР і субклонували в pCX-IRES-bsr, яка містила стійкий до бластицидину ген, для відбору клітин. Варіабельну ділянку легкого ланцюга мишачого 3A5-2 ампліфікували, використовуючи праймер 5'-3A_VL-SalI-kozac_F (GCGGTCGACGCCACCATGAGTGTGCTCACTCAG; SEQ ID NO:111) і праймер 3'-3A-IgG1,2_VH-R (GACAGATGGTGCAGCCACAGTTCGTTTTATTTCCAGCTTGGTCCCCCCT; SEQ ID NO:112). Людську константну ділянку Igκ ампліфікували, використовуючи праймер 5'-hIGΚ_F (CGAACTGTGGCTGCACCATCTGTC; SEQ ID NO:113) і праймер 3'-hIGΚ_NotI-R (CGCGCGGCCGCCTAACACTCTCCCCTGTTGAAGCTCTT; SEQ ID NO:114). Ампліфіковані 3A5-2 VH і людську константну ділянку IgG2 об'єднували за допомогою методу ПЛР і субклонували в pMX-IRES-puro, яка містила ген стійкості до пуроміцину, для відбору клітин. Вектор експресії химерного легкого ланцюга трансфікували в клітини HEK293E, використовуючи pE-Eco і pGp (TAKARA) для збирання ретровірусу. Клітини HEK293E інокулювали в DMEM (Invitrogen), доповнену 10 % FBS, за день до трансфекції. У день 20 UA 105073 C2 5 10 15 20 25 30 35 40 45 50 55 60 трансфекції вектори трансфікували, використовуючи TranIT LT1 (TAKARA). Після інкубації протягом 3 днів збирали культуральний супернатант, що містить ретровірус, і додавали до клітин B300.19. Після інкубації протягом 8 днів культуральний супернатант видаляли і додавали RPMI1640 (Invitrogen), що містить 10 % FBS. Після культивування протягом 2 днів додавали пуроміцин для відбору інфікованих клітин. Потім відібрані клітини інфікували іншим рекомбінатним ретрвірусом, що несе химерний важкий ланцюг, який отримували методом, аналогічним описаному для легкого ланцюга. Після відбору щодо стійкості до бластицидину двічі відібрані клітини культивували з SF-O (Sanko Junyaku), що містить 8 мМ глутамаксу, 55 мкМ 2-меркаптоетанолу, 1x холестерину (Invitrogen), в Integra CELLine (Integra Bioscience). Культуральний супернатант очищали, використовуючи колонку з сефарозою, що містить рекомбінатний білок А (Pharmacia) для використання в аналізі хемотаксису і аналізі BIACORE. Приклад 8. Аналіз гуманізованих mAb проти hFKN Гуманізовані mAb проти hFKN аналізували за допомогою аналізу хемотаксису для вимірювання нейтралізуючої активності і аналізу BIACOREо для вимірювання афінності зв'язування hFKN і FKN яванської макаки. Репрезентативні дані і результати трьох незалежних аналізів хемотаксису підсумовані на Фіг. 5 і показані на Фіг. 6A-B, 7A-D і 8A-F. Всі комбінації H3 і H3-2 для важкого ланцюга з L2 і L4 для легкого ланцюга були успішно гуманізовані у вигляді цих mAb, демонстрували аналогічну нейтралізуючу активність з химерним mAb. Однак HK2, який був отриманий шляхом використання більш вузького діапазону ключових залишків, продемонстрував знижену нейтралізуючу активність в комбінації з L2 або L4. Результати аналізу BIACORE® підсумовані на фіг. 9 і 10A-C. Всі комбінації H3 і H3-2 для важкого ланцюга з L2 і L4 для легкого ланцюга показали аналогічні рівні афінності в порівнянні з химерним mAb. З одного боку, HK2L4 продемонстрував більш низьку афінність, ніж інші. Ці результати підтверджують, що 3A5-2 не може бути успішно гуманізований звичайним способом шляхом використання звичайної ідентифікації ключових залишків, особливо у випадку важкого ланцюга. Аналіз хемотаксису виконували таким чином. Клітини вміщували у верхні лунки культуральной планшети Трансвелл (MultiScreen-MIC Plate, 5,0 мкм, Millipore, Catalog No. 10 MAMIC 5S10) з лігандом в нижніх лунках. Спочатку в нижні лунки додавали систему з рекомбінантними людськими FKN (R&D Systems, Catalog No. 362-CX/CF) (кінцева концентрація 10 нг/мл) очищеними антитілами з різними концентраціями (від 0 до 10 нг/мл). Композиції містили наступні компоненти: 3x розчин хемокіну, 50 мкл/лунка; 1,5х очищені mAb, 100 мкл/лунка; хемокін і очищені антитіла розбавляли 1x буфером для хемотаксису (описаний 5 вище). У верхні лунки вносили трансфіковані CX3CR1 клітини B300.19 (2×10 клітин/75 мкл) разом з очищеними антитілами при різних концентраціях (від 0 до 10 мкг/мл). Композиції містили наступні компоненти: 3x клітинної суспензії, 25 мкл/лунка; 1,5х розчин очищених mAb, 50 мкл/лунка; клітини і очищені антитіла розбавляли 1x буфером для хемотаксису. Аналіз хемотаксису виконували в 5 %-CO2 інкубаторі при 37 °C протягом 4 годин. Після інкубації збирали 150 мкл з нижніх лунок, фіксували 50 мкл 4 % PFA/PBS і зразки по 30 мкл використали в клітинному аналізаторі FACSCantoII для підрахунку мігрованих клітин. Аналіз BIACORE® виконували описаним вище способом. Однак для гуманізованих і химерних mAb використали антилюдських IgG мишачих mAb (GE Healthcare) як імобілізовані на сенсорному чіпі антитіла. Приклад 9. Картирування епітопу за допомогою синтетичних пептидів з домену хемокіну FKN Картирування епітопу виконували, використовуючи бібліотеки синтетичних пептидів, що перекриваються, з домену хемокіну FKN. Двадцять один вид пептидів, що складаються із 15 залишків, синтезували методом Sigma Genosys. Пептиди розчиняли до 10 мг/мл, використовуючи ДМСО. Ці пептиди (50 мкг/мл) наносили на планшету ELISA (Nunc) і залишали на ніч при 4 °C. Розчини пептидів видаляли, і в кожну лунку додавали розчин PBS, що містить 1 % BlockAce (Dainippon Pharma), інкубували протягом 1 години при кімнатній температурі і промивали забуференним Тріс фізрозчином (pH 7,4), що містить 0,05 % Твін 20 (розчин для промивання). У лунки додавали розчин антитіл H3-10 2L4 (50 мкг/мл) і інкубували протягом 2 годин при кімнатній температурі. Розчин антитіл видаляли і промивали розчином для промивання. У лунки додавали розчин антилюдських IgG антитіл, мічених пероксидазою (Zymed; 400 нг/мл), і інкубували протягом 1 години при кімнатній температурі. Розчин антитіл видаляли і промивали розчином для промивання. У кожну лунку додавали розчин TMBZ (Sigma) і інкубували протягом 10 хвилин при кімнатній температурі. Реакцію зупиняли 1н розчином H2SO4 і вимірювали абсорбцію при 450-650 нм. Результати показані на фіг. 11. Антитіла H3-2L4 реагували з пептидами з N-термінальної і середньої ділянок людського FKN. 21 UA 105073 C2 5 10 15 20 25 30 35 40 45 50 55 Приклад 10. Отримання мутантів з аланіновою або сериновою заміною Мутантів hFKN-SEAP з аланіновою або сериновою заміною отримували таким чином. кДНК, що кодує позаклітинну ділянку FKN, виділяли з вектора експресії hFKN-SEAP, pcDNA3.1(+)hFKN-SEAP, використовуючи ферменти рестрикції Sall/NotI, і субклонували у вектор pENTR1A_dSEAP-(His)10, що містить кДНК SEAP (pENTR1A придбали у компанії Invitrogen). Мутантів з аланіновою або сериновою заміною індукували, використовуючи систему сайтнаправленого мутагенезу GeneTailor (Invitrogen) згідно з інструкціями виробника. Фрагменти кДНК hFKN-SEAP з індукованою мутацією трансфікували у вектор pcDNA3.1(+)_cassette В (касету В придбали у компанії Invitrogen), використовуючи систему Gateway (Invitrogen). Вектори експресії мутантів hFKN-SEAP з аланіновою або сериновою заміною трансфікували в клітини HEK293EBNA (HEK293E) (Invitrogen). Клітини HEK293E інокулювали в DMEM (Invitrogen), доповнену 10 % фетальною бичачою сироваткою, за день перед трансфекцією. Вектор експресії трансфікували, використовуючи TransIT LT1 (Takara), згідно з інструкціями виробника. Через три дні інкубації (5 % CO2 при 37 °C) збирали культуральний супернатант. Концентрацію білків SEAP вимірювали за допомогою набору 2.0 хемілюмінесценції Great EscAPe SEAP (Clontech). Приклад 11. ELISA для картирування епітопу hFKN У всі лунки планшети ELISA (Nunc) наносили анти-hFKN поліклональне антитіло (eBioscience) і H3-2L4 і залишали на ніч при 4 °C. З кожної лунки видаляли розчин антитіла і додавали PBS, що містить 1 % бичачий сироватковий альбумін і інкубували протягом 1 при кімнатній температурі, потім промивали забуференним Тріс фізрозчином (pH 7,4), що містить 0,05 % Твін 20 (розчин для промивання). Мутанти з аланіновою або сериновою заміною розбавляли до 0,13 нМ середовищем PBS, що містить 1 % BSA, і 50 мкл аліквоти додавали в лунки планшети ELISA і інкубували протягом 4 годин при кімнатній температурі. Розчини мутантів видаляли, промивали розчином для промивання. Розчин п-нітрофенілфосфату (Thermo Scientific) додавали в кожну лунку і інкубували протягом 30 хвилин при кімнатній температурі. Реакцію зупиняли розчином 1н NaOH і вимірювали абсорбцію при 405 нм. Результати показані на фіг. 12. Мутант R68A втратив специфічну реактивність з H3-2L4. Інші мутанти, які втратили реактивність з H3-2L4, також втратили реактивність з поліклональним антитілом. Ці результати демонструють, що R68 є критичним епітопом H3-2L4. Приклад 12. Картирування епітопу hFKN за допомогою BIACORE® Антитіло до гістидину-таг (Bethyl) імобілізували на сенсорному чіпі CM5 (GE Healthcare). Чіп завантажували розчинами мутантів з аланіновою або сериновою заміною, розбавленими в 10 разів буфером HBS-EP (GE Healthcare), промивали HBS-EP, і вимірювали рівень зв'язування антигена. Розчин H3-2L4 і поліклональних антитіл проти FKN завантажували в чіп із зв'язаними антигенами, промивали HBS-EP, і вимірювали рівень зв'язування антитіла. Обчислювали [рівень зв'язування антитіла/рівня зв'язування антигена] і значення, обчислені для кожного мутанта, порівнювали зі значенням, отриманим для дикого типу. Результати показані на фіг. 13. Приклад 13. Реактивність інших антитіл з мутантом R68A Мишачі антилюдські FKN моноклональні антитіла (1F3, 1G1, 2B2, 3D5, 6D1, 7F6) і антитіло H3-2L4 наносили на планшету ELISA (Nunc) і залишали на всю ніч при 4 °C. Розчини антитіл видаляли. У кожну лунку додавали розчин PBS, що містить 1 % BSA, і інкубували протягом 1 години при кімнатній температурі, лунку промивала забуференим Тріс фізрозчином (pH 7,4), що містить 0,05 % Твін 20. Розчин антитіл R68A-мутовані FKN-SEAP-His і дикого типу (1, 0,5, 0,25, 0,125 нМ) додавали в лунки і інкубували протягом 2 годин при кімнатній температурі. Розчин антигена видаляли і промивали розчином для промивання. У кожну лунку додавали розчин пнітрофенілфосфату (Thermo Scientific) і інкубували протягом 30 хвилин при кімнатній температурі. Реакцію зупиняли 1н розчином NaOH і вимірювали абсорбцію при 405 нм. Нейтралізуючу активність цих антитіл тестували описаним вище аналізом хемотаксису. 10 нМ людські FKN і різні концентрації цих антитіл додавали в нижні лунки планшети Трансвелл. У верхні лунки планшети додавали клітини, що експресують CX3CR1. Після інкубації протягом 4 годин при 37 °C середовище з нижніх клітин витягували і клітини фіксували 4 % розчином формальдегіду. Кількість клітин обчислювали за допомогою аналізатора FACS. Відношення між нейтралізуючою активністю і реактивністю з мутантом R68A показані в таблиці 1. Антітела, сильно нейтралізуючі активність CTX, втрачали реактивність з мутантом R68A. Ці результати демонструють, що R68 людського FKN є ключовим сайтом впізнавання для антитіл, які можуть ефективно нейтралізувати функцію FKN. 22 UA 105073 C2 Таблиця 1 Відношення між зв'язуванням мутанта R68A і нейтралізуючої активності Антитіло 1F3 1G1 2B2 3D5 3H7 6D1 7F6 H3-2L4 5 10 15 20 25 30 35 40 R68A/дикий тип (%) 131 39 51 0 0 58 56 0 СТХ (IC50, нМ) 12,7 80< 80< 4,09 19,1 80< 80< 0,2 Приклад 14. Картирування епітопу hFKN методом ЯМР Очищення Fab від антитіл H3-2L4 100 мг розчину очищених антитіл H3-2L4 (20 мг/мл розчин PBS) діалізували проти 0,1 M фосфатного буфера (pH 7,0), що містить 2 мМ ЕДТА. Концентрацію антитіла доводили до 15 мг/мл діалізним буфером і додавали 30 мМ цистеїну. До розчину антитіл додавали 0,2 мг папаїну (Sigma) і інкубували протягом 14 годин при 37 °C. До цього розчину додавали йодоацетаміл для зупинки ферментативної реакції. Розчин антитіла, розщепленого папаїном, діалізували проти розчину PBS протягом ночі при 37 °C. Розчин наносили на колонку ProSep vA (Millipore) і збирали проточну фракцію. Цю проточну фракцію наносили на колонку з імобілізованим антилюдським IgG Fc антитілом (Jackson ImmunoResearch Laboratories), і збирали проточну фракцію. Цю проточну фракцію концентрували і наносили на Superose 12 10/300 GL (GE Healthcare), і збирали фракції, що містять фрагмент Fab. Чистоту цих фракцій аналізували, використовуючи SDS PAGE, і об'єднували фракції домінантних Fab. Ідентифікація Fab-зв'язуючого сайта на фракталкіні Для ідентифікації сайта зв'язування Fab на фракталкіні отримували фракталкін, мічений 2 15 2 13 15 стабільними ізотопами ( H, N і H, С, N) (Mizoue, L et al., Biochemistry, 38: 1402-1414 (1999)), 15 і виконували ЯМР експеримент по спостереженню N гетероядерної одноквантової 15 когерентності ( N-Heteronuclear Single Quantum Coherence) (HSQC). ЯМР зразки отримували в 20 мМ ацетатному буфері (pH 5,0) і 80 % D2O (експеримент крос-насичення) або 5 % D2O (інші експерименти). Всі ЯМР експерименти виконували на спектрометрі 700 MHz Bruker Avance, обладнаним кріогенним зондом, при температурі 45 °C. Додання неміченого Fab індукувало спектральну зміну фракталкіну, вказуючи на взаємодію 15 1 між міченим фракталкіном і Fab. Подальше виділення N і HN основного ланцюга фракталкіну в комплексі з Fab отримували з 3D спектра FFNCA. Експеримент крос-насичення є одним з найбільш точних ЯМР методів для визначення зв'язуючої області контакту взаємодії білок-білок (Takahashi, Н et al., Nat. Struct. Mol. Biol., 7: 220-223 (2000)). Внаслідок цього експеримента інтенсивність сигналів декількох залишків поменшала за рахунок селективного випромінювання Fab (фіг. 14). Ці залишки були локалізовані в двох окремих суміжних ділянках. Одна ділянка складається з E66-Q69, а інша ділянка складається з W81-Q87. Більш того на хімічні зсуви цих залишків сильний вплив надає додання Fab, що підтверджує дані крос-насичення (фіг. 14). На основі цих результатів був зроблений висновок, що ці ділянки включені в область контакту з Fab. Інші варіанти здійснення З вищенаведеного опису очевидно, що в розкритому тут винаході можуть бути зроблені зміни і модифікації з метою його адаптації до різних застосувань і умов. Такі варіанти здійснення також входять в об'єм наведеної нижче формули винаходу. Всі згадані в даному описі публікації включені тут шляхом посилання, як якби відносно кожної з цих публікацій або заявки на патент було спеціально і особливо вказано, що вона включена в даний опис у всій своїй повноті шляхом посилання. 23 UA 105073 C2 Перелік послідовностей 24 UA 105073 C2 25 UA 105073 C2 26 UA 105073 C2 27 UA 105073 C2 28
ДивитисяДодаткова інформація
Автори англійськоюNishimura, Miyuki, Sakamoto, Yoshimasa, Kawano, Tetsu, Imai, Toshio
Автори російськоюНисимура Миюки, Сакамото Йосимаса, Кавано Тецу, Имаи Тосио
МПК / Мітки
МПК: C07K 16/28, A61K 39/395, A61P 1/04, C12N 1/19, C12N 15/09, C07K 16/46, A61P 37/06, C12N 5/10, C12P 21/08
Мітки: лікування, композиція, запальних, спосіб, антитіло, фракталкіну, порушень
Код посилання
<a href="https://ua.patents.su/70-105073-antitilo-proti-fraktalkinu-kompoziciya-i-sposib-dlya-likuvannya-zapalnikh-porushen.html" target="_blank" rel="follow" title="База патентів України">Антитіло проти фракталкіну, композиція і спосіб для лікування запальних порушень</a>
Попередній патент: Спосіб визначення ефективності вихорострумових перетворювачів
Наступний патент: Цифровий спосіб вимірювання фазового часу проходження радіоімпульсних сигналів
Випадковий патент: Комплекс установок газоочистки