Спосіб одержання покриття на нерозчинних оксидах і гідроксидах металів наночастинками благородних металів
Номер патенту: 89136
Опубліковано: 25.12.2009
Автори: Волков Сергій Васильович, Арсенін Констянтин Іванович, Буряк Микола Іванович
Формула / Реферат
Спосіб одержання покриття на нерозчинних оксидах і гідроксидах металів наночастинками благородних металів, які одержані шляхом відновлення благородних металів з їх сполук, який відрізняється тим, що відновлення благородних металів з їх сполук здійснюють попередньо переведеними на їх нижчу ступінь окислення металами оксидів і гідроксидів, на які наносять покриття.
Текст
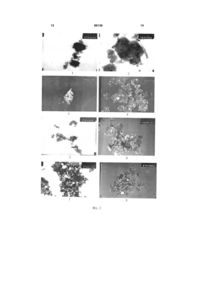
Спосіб одержання покриття на нерозчинних оксидах і гідроксидах металів наночастинками благородних металів, які одержані шляхом відновлення благородних металів з їх сполук, який відрізняється тим, що відновлення благородних металів з їх сполук здійснюють попередньо переведеними на їх нижчу ступінь окислення металами оксидів і гідроксидів, на які наносять покриття. (19) (21) a200811520 (22) 25.09.2008 (24) 25.12.2009 (46) 25.12.2009, Бюл.№ 24, 2009 р. (72) ВОЛКОВ СЕРГІЙ ВАСИЛЬОВИЧ, БУРЯК МИКОЛА ІВАНОВИЧ, АРСЕНІН КОНСТЯНТИН ІВАНОВИЧ (73) ІНСТИТУТ ЗАГАЛЬНОЇ ТА НЕОРГАНІЧНОЇ ХІМІЇ НАН УКРАЇНИ (56) GB 624353 A 02.06.1949 GB 827016 A 27.01.1960 JP 58037166 A 04.03.1983 3 процес відновлення і окиснення обумовлений віддачею електронів одними елементами і їх приєднання іншими елементами. Якщо ступінь окиснення елементу найвища, то теоретично він не може бути відновником, оскільки відсутні електрони, які він міг би віддати. А тому встановлені нами експериментальні факти відновлення благородних металів такими сполуками, в яких елементи знаходяться на найвищому ступені свого окиснення, потребують теоретичного обґрунтування, яке не протирічило б суті відомого явища окиснення відновлення, тобто віддачі і приєднання електронів. Той факт, що гідроксиди і оксиди металів проявляють відновлюючі властивості пояснюється тим, що ці сполуки можуть знаходитись в двох різних формах своєї будови. Одна форма будови оксидів і гідроксидів класична - електровалентна, наприклад: CuO (Cu=O), ZnO (Zn=O), Fe2O3 (O=FeO-Fe=O), ΖrΟ2 (Ο=Ζr=Ο), ТіО2 (О=Ті=О), AІ(OH)3 OH ( Al OH ). В такій формі своєї будови гідроксиди і OH оксиди металів відновниками не можуть бути, так як метали знаходяться на максимальному ступені окиснення. Але для оксидів і гідроксидів металів характерна і інша форма будови - по системі усередненого поля молекули. Вперше така будова молекул була описана в працях [3, 4] на прикладах сполук сульфату та хлориду міді. По системі усередненого поля молекули будову гідроксидів і оксидів металів можна зобразити наступним чином [схеми (II-V)]. 89136 4 При такій будові молекул оксидів і гідроксидів металів метали знаходяться на нульових ступенях свого окиснення, а тому є відновниками, як і всі метали в металічному стані. Експериментальним підтвердженням такої будови оксидів і гідроксидів металів є інфрачервоні спектри (ІЧ), на яких спостерігаються смуги поглинання молекулярного кисню. Слід відмітити, що оксиди металів, які отримують шляхом нагрівання їх гідроксидів, інших сполук цих металів, або самих металів, знаходяться в звичайному електровалентному стані Оксиди металів, які побудовані по системі усередненого поля молекули, можна одержати лише в особливих умовах, наприклад, при нагріванні в матрицях із галогенідів лужних металів, або в інших специфічних умовах. Для прикладу на Фіг.1.1 показаний ІЧ спектр окису міді, одержаний при нагріванні гідроксиду міді [Сu(ОН)2] в чистому стані до 780°С На цьому ІЧ спектрі спостерігаються лише смуги поглинання для зв'язку Сu=О на ділянці 400-1 600см . На всьому проміжку ІЧ спектру від 600 до 4000см-1 немає ніяких смуг поглинання. На Фіг.1.2 показаний ІЧ спектр цього ж оксиду, нагрітого в матриці із броміду калію (КВr) до 780°С. На цьому ІЧ спектрі з'явилися дві смуги поглинання з частотами 1275 і 1388см-1, яких не було на попередньому ІЧ спектрі. Це свідчить про те, що частина оксиду міді перейшла із звичайного електровалентного стану в стан взаємодії по системі усередненого поля молекули і молекулярний кисень дає свої смуги поглинання з вище відміченими частотами. На Фіг.1.3 показаний ІЧ спектр окису міді, одержаний при нагріванні цього ж гідроксиду міді в матриці із броміду калію до 780°С. Окрім смуг поглинання для електровалентного оксиду міді (400-600см-1) на ІЧ спектрі спостерігаються дві смуги поглинання для молекулярного -1 кисню з частотами 1388 та 1275см , як і в попередньому випадку. Це значить, що при нагріванні гідроксиду міді в матриці із бромистого калію до 780°С крім окису міді в електровалентному стані утворився окис міді побудований по системі усередненого поля молекули. При нагріванні сполуки CuBr·Cu(OH)2·H2O в матриці із броміду калію до 300°С одержуємо оксид міді побудований по системі усередненого поля молекули, тоді як оксид міді в звичайному електровалентному стані відсутній, так як немає смуги поглинання для зв'язку Сu=О, а для молекулярного кисню спостерігається інтенсивна смуга -1 поглинання з частотою 1382см (Фіг.1.4). На Фіг.1.5 показаний ІЧ спектр окису заліза, отриманого при нагріванні гідроксиду заліза в матриці із броміду калію до 600°С, на якому видно смуги поглинання молекулярного кисню з частотами 1382 і 1275см-1 поряд з смугами поглинання для звичайного електровалентного оксиду заліза в проміжку -1 300-700см . Це свідчить про те, що отримана суміш двох форм окису заліза: звичайного електровалентного і побудованого по системі усередненого поля молекули (схема III). На Фіг.1.6 показаний ІЧ спектр діоксиду цирконію модифікованого наночастинками платини, для якого присутня форма взаємодії по системі усередненого поля молекули. 5 89136 6 Про це свідчать смуги поглинання молекулярного -1 кисню з частотами 1550, 1490, 1430, 1380см . Смуги поглинання для електровалентної модифікації діоксиду цирконію находяться в проміжку 300800см-1. На Фіг.1.7 показаний ІЧ спектр гідроксиду міді, на якому спостерігаються інтенсивні смуги поглинання для молекулярного кисню з частотами -1 в проміжку 1390-1470см . Той факт, що оксиди металів, будучи в звичайному електровалентному стані являються відновниками обумовлено тим, що при контакті з речовинами які можуть відновлюватися, оксиди металів змінюють свою будову з електровалентної на будову по системі усередненого поля молекули і стають відновниками. Приклад 1 В пробірку поміщаємо 30-40мг гідроксиду алюмінію [АІ(ОН)3], осадженого із АІСІ3·6Н2О розчином гідроксиду калію. Додаємо 3мл 0,00184мол/л розчину (NH4)2PdCl4. При перемішуванні протікає реакція відновлення паладію і останній покриває гідроксид алюмінію у вигляді чорного осаду. Гідроксид алюмінію із білого стає чорним. На Фіг.2.1 показаний знімок покритого таким чином гідроксиду алюмінію наночастинками паладію. На темному фоні поверхні гідроксиду алюмінію покриття із паладію більш світле. Реакцію відновлення паладію гідроксидом алюмінію можна записати так [схема (VI)]. Якщо для відновлення паладію використати гідроксид алюмінію, осаджений гідроксидом калію, із алюмінієвих квасців [KAI(SO4)2·12H2O], то відновлений паладій не чорного, а жовтокоричневого кольору. Приклад 2 В пробірку поміщаємо 20-30мг оксиду алюмінію (АІ2О3) і додаємо 3мл розчину (NH4)2PdCl4. Протікає реакція відновлення паладію і оксид алюмінію із білого стає сірого кольору. На Фіг.2.2 показаний знімок, на якому добре видно відновлений паладій на чорному фоні оксиду алюмінію. Схема реакції відновлення така ж як і для гідроксиду алюмінію (VI). Приклад 3 В пробірку поміщаємо 20-30мг оксиду алюмінію (АІ2О3) і додаємо 3мл 0,001мол/л розчину K2ReCl6 при перемішуванні. Білий оксид алюмінію стає жовтого кольору, що свідчить про відновлення ренію, який осідає на поверхню окису алюмінію. На Фіг.2.3 показаний знімок, на якому добре видно наночастинки ренію світлого кольору, які покривають поверхню гранули окису алюмінію. Реакцію відновлення ренію окисом алюмінію можна записати так [схема (VII)]. Приклад 4 В пробірку поміщаємо 30-40мг діоксиду цирконію (ΖrО2) і додаємо 3мл 0,001мол/л розчину сполуки ренію (K2ReCl6) при перемішуванні. Діоксид цирконію із білого стає жовтуватого кольору, що свідчить про те, що відбувається реакція віднов лення ренію діоксидом цирконію. На Фіг.2.4 показаний знімок діоксиду цирконію, покритого наночастинками ренію світлого кольору. Реакцію відновлення ренію діоксидом цирконію можна записати так [схема (VIII)]. 7 89136 8 Приклад 5 В пробірку поміщаємо 30-40мг діоксиду цирконію (ZrO2) і додаємо 3мл розчину (NH4)2PdCl4 при перемішуванні. Діоксид цирконію стає жовтого кольору, що свідчить про те, що паладій віднов люється діоксидом цирконію. На Фіг.2.5 показаний знімок діоксиду цирконію покритого паладієм. Наночастинки паладію спостерігаються у вигляді темних цяток. Реакцію відновлення паладію діоксидом цирконію можна записати так [(схема (IX)]. Приклад 6 В пробірку поміщаємо 30-40мг діоксиду цирконію, додаємо 1мл 0,06мол/л розчину азотнокислого срібла (AgNO3) підкисленого азотною кислотою. Колір окису цирконію залишається білим. Відфільтровуємо окис цирконію на паперовому фільтрі і при перебуванні його на світлі він поступово стає сірого кольору, що свідчить про те, що окис цирконію покритий наночастинками срібла. Те що темний колір з'являється з часом обумовлено тим, що відновлене срібло білого кольору і лише поступово воно темніє при перебуванні на світлі, при умові, що воно нанесено на якусь речовину. Якщо ж срібло відновити, наприклад, гіпофосфітом натрію (NaH2PO2) і в чистому стані його виділити, то білий колір такого срібла зберігається в необмеженому часі, наприклад, цілий рік. Але якщо таке срібло находиться на якійсь основі, наприклад, на окису цирконію, то з часом воно темніє. Колір відновленого срібла залежить від природи основи, на яку воно нанесено. Якщо на окису цирконію при відновленні воно осідає білим, а з часом стає сірим, то на окису кремнію (SіO2) при відновленні срібла гіпофосфітом натрію воно відразу осідає коричневого кольору, а з часом на світлі біліє. На Фіг.2.6 показаний знімок наночастинок срібла, відновленого діоксидом цирконію. Вони світлого кольору. Колір наночастинок і основи, на яку вони нанесені, залежить від того, на якому фоні зроблений знімок. Якщо він зроблений на темному фоні, то наночастинки світлі, а основа темна. Якщо знімок зроблений на світлому фоні, то наночастинки темні, а основа більш світла (Фіг.2.7) Для порівняння на Фіг.2.8 показаний знімок зроблений на темному фоні із наночастинок срібла відновленого гіпофосфітом натрію і нанесеного на діоксид цирконію, а на Фіг.3.1 показаний цей же знімок зроблений на світлому фоні. І в випадку з гіпофосфітом натрію і при його відсутності знімки подібні, що свідчить про те, що діоксид цирконію відновлює срібло так, як і гіпофосфіт натрію. Реакцію відновлення срібла діоксидом цирконію можна записати так [схема (X)]. Приклад 7 В пробірку поміщаємо 20-30мг окису лантану (Lа2О3) і додаємо 3мл 0,001мол/л розчину К2RеСl6 при перемішуванні Білий окис лантану стає сірого кольору, що свідчить про те, що реній відновлю ється окисом лантану і покриває його поверхню. Знімок окису лантану покритого наночастинками ренію показаний на Фіг.3.2. Наночастинки ренію темного кольору. Реакцію відновлення ренію окисом лантану можна записати так [схема (XI)]. Приклад 8 В пробірку поміщаємо 20-30мг окису магнію, додаємо 3мл 0,00184мол/л розчину (NH4)2PdCl4 при перемішуванні. Окис магнію стає жовтокоричневого кольору, що свідчить про відновлення паладію окисом магнію. На Фіг.3.3 показаний знімок 9 89136 10 окису магнію, покритого наночастинками паладію, які світлого кольору. Реакцію відновлення паладію окисом магнію можна записати так [схема (XII)]. Приклад 9 В вище приведених прикладах наночастинки відновлених металів які осідають на поверхню оксидів і гідроксидів в основному округлої форми. Але є випадки, коли відновлені метали осідають на поверхню відновників у вигляді наночастинок голкоподібної форми. Це спостерігається для наночастинок паладію і деяких оксидів, які являються відновниками. Так, якщо до 20-30мг окису вісмуту додати 3мл розчину (NH4)2PdCl4 при перемішуванні, то Ві2О3 стає жовтокоричневого кольору, що свідчить про відновлення паладію окисом вісмуту. На Фіг.3.4 показаний знімок Ві 2О3 після його обробки розчином солі паладію, на якому добре видно голкоподібні наночастинки паладію, які начебто ростуть із гранул Ві2О3. На Фіг.3.5 показаний знімок Ві2О3 без нанесеного на нього покриття, на якому не видно голкоподібних утворень, що може бути доказом того, що ці голкоподібні утворення є наночастинками паладію. Реакцію відновлення паладію окисом вісмуту можна написати так [схема (XIII)]. Приклад 10 В пробірку поміщаємо 20-30мг окису лантану і додаємо 3мл розчину (NH4)2PdCl4. Білий колір окису лантану змінюється на жовтокоричневий, що може свідчити про те, що паладій відновлюється і осідає на поверхню окису лантану. На Фіг.3.6 показаний знімок окису лантану покритого наночастинками паладію. Ці наночастинки голкоподібні як і у випадку з Ві2О3. Реакцію відновлення паладію окисом лантану можна записати так [схема (XIV)]. Приклад 11 В пробірку поміщаємо 20-30мг окису ніобію (Nb2O5) і додаємо 3мл розчину (NH4)2PdCl4. Білий окис ніобію стає сіроватого кольору, що свідчить про те, що окис ніобію відновлює паладій, який осідає на його поверхню. На Фіг.3.7 показаний знімок окису ніобію, покритого наночастинками паладію, які мають голкоподібну форму. Реакцію відновлення паладію окисом ніобію можна записати так [схема (XV)]. ІЧ спектри записували на спектрометрі SPECORD M80 в проміжку частот від 4000 до -1 200см . Фотознімки виконані на електронному просвічуючому мікроскопі JEOL-100 зі збільшенням 1мм=20нм. Таким чином із приведених прикладів випливає, що нерозчинні гідроксиди і оксиди металів являються відновниками, що обумовлено тим, що ці речовини можуть находитися в двох різних формах будови: звичайної електровалентної, в якій атоми металу знаходяться на вищому ступені оки 11 снення, а тому в такому стані не є відновниками і в моделі взаємодії по системі усередненого поля молекули, в якій атоми металу знаходяться на нульовому ступені окиснення, а тому в цьому стані гідроксиди і оксиди металів є відновниками. При контакті з речовинами, які можуть відновлюватися, оксиди і гідроксиди металів переходять із звичайного електровалентного стану взаємодії в стан взаємодії по системі усередненого поля молекули і стають відновниками. Це дає можливість наносити наночастинки благородних металів на поверхню нерозчинних гідроксидів і оксидів металів без використання спеціальних відновників і таким чином отримувати різні матеріали, які можуть бути використані в різних областях техніки, наприклад, як каталізатори Спосіб виділяється простотою і звичайними умовами проведення експерименту. Фіг.1. ІЧ-спектри: 1 - CuO, одержаний із Сu(ОН)2 при 780°С, 2 - №1, нагрітий в КВr матриці до 780°С, 3 - CuO, одержаний при нагріванні Сu(ОН)2 в КВr матриці до 780°С, 4 - CuO, одержаний із CuBr·Cu(OH)2·H2O при нагріванні до 300°С в КВr матриці, 5 - Fe2O3, одержаний із Fe(OH)3 при нагріванні в КВr матриці до 600°С, 6 - ZrO2, модифікований наночастинками платини, 7 - Сu(ОН)2. Фіг.2. Фотознімки: 1 - Аl(ОН)3, покритий наночастинками паладію, 2 - АІ2О3, покритий наночас 89136 12 тинками паладію, 3 - Аl2О3, покритий наночастинками ренію, 4 - ZrO2, покритий наночастинками ренію, 5 - ZrO2, покритий наночастинками паладію, 6 - ZrO2, покритий наночастинками срібла Знімок зроблений на темному фоні, 7 - №6, знімок зроблений на світлому фоні, 8 - ZrO2, покритий наночастинками срібла, відновленого NaH2PO2. Знімок зроблений на темному фоні. Фіг.3. Фотознімки: 1 - №2, 8 - знімок на світлому фоні, 2 - Lа2О3, покритий наночастинками ренію, 3 - MgO, покритий наночастинками паладію, 4 - Ві2О3, покритий наночастинками паладію, 5 Ві2О3, нічим не покритий, 6 - La2O3, покритий наночастинками паладію, 7 - Nb2O5, покритий наночастинками паладію. Література: 1. Некрасов Б.В. Курс общей химии. Изд. 2-е, СССР. Μ.: 1936. 896с. 2. Патент №77362 Україна. С23С18/44. Спосіб покриття поверхні матеріалів наночатинками платини. Волков С.В., Буряк M.I., Арсенін К.І. 2006. Бюл. №11. 3. Арсенин К.И., Пищай И.Я., Хоменко Б.С. // ЖОХ. 1996. Т.66, №6. С.897-902. 4. Арсенин К.И., Пищай И.Я., Хоменко Б.С. // ЖОХ. 1997. Т.67, №4. С.548-553. 13 89136 14 15 Комп’ютерна верстка А. Рябко 89136 Підписне 16 Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for obtaining of coating on insoluble oxides and hidroxides of metals by nanoparticles of noble metals
Автори англійськоюVolkov Serhii Vasyliovych, Buriak Mykola Ivanovych, Arsenin Konstiantyn Ivanovych
Назва патенту російськоюСпособ получения покрытия на нерастворимых оксидах и гидроксидах металлов наночастичками благородных металлов
Автори російськоюВолков Сергей Васильевич, Буряк Николай Иванович, Арсенин Константин Иванович
МПК / Мітки
МПК: B01J 23/38, C23C 18/16, C23C 18/31, B01J 37/03
Мітки: нерозчинних, покриття, оксидах, наночастинками, благородних, гідроксидах, металів, одержання, спосіб
Код посилання
<a href="https://ua.patents.su/8-89136-sposib-oderzhannya-pokrittya-na-nerozchinnikh-oksidakh-i-gidroksidakh-metaliv-nanochastinkami-blagorodnikh-metaliv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання покриття на нерозчинних оксидах і гідроксидах металів наночастинками благородних металів</a>
Попередній патент: Твердий розчин пірофосфату нікелю(іі)-кобальту(іі)-міді(іі) та спосіб його одержання
Наступний патент: Спосіб очищення промислових стоків, що містять жир, мийні засоби та дезінфікуючі матеріали
Випадковий патент: Леміш