Розчин для інфузії і ін’єкції іпамореліну діацетату
Номер патенту: 104762
Опубліковано: 11.03.2014
Автори: Бідлер Даніел, Вейбел Хелле, Гарсія Рубіо Сільвіна, Бралья Ріккардо
Формула / Реферат
1. Розчин для ін'єкції або інфузії іпамореліну, який містить:
a) іпаморелін, розчинений в двох молярних еквівалентах оцтової кислоти (іпамореліну діацетат) в кількості від 0,001 до 20 %, з розрахунку на масу іпамореліну у вигляді вільної основи;
b) молярний надлишок кислоти, переважно оцтової кислоти, в кількості, достатній для отримання рН від щонайменше 3 до менше ніж 7;
c) від 0,1 до 30 % однієї або декількох допоміжних речовин; і
d) воду q.s. до 100 %; всі проценти приведені з розрахунку на загальну масу розчину, де вказаний розчин містить від 1 до 10 молярних еквівалентів надлишку оцтової кислоти.
2. Розчин за п. 1, що містить надлишок фосфорної кислоти, лимонної кислоти, винної кислоти або молочної кислоти.
3. Розчин за п. 1 або 2, що має рН від 4 до 6,5.
4. Розчин за будь-яким з пп. 1, 2 або 3, що не містить якого-небудь залишкового розчинника, що використовується для осадження іпамореліну діацетату.
5. Розчин за будь-яким з пп. 1, 2, 3 або 4, в якому вказаний іпамореліну діацетат отримують способом, що містить змішування іпамореліну і оцтової кислоти і води, в молярному співвідношенні іпаморелін:оцтова кислота 1:2 і концентрацією іпамореліну від 0,1 до 100 мг/мл.
6. Розчин за будь-яким з пп. 1, 2, 3, 4 або 5, в якому вказаний іпамореліну діацетат отримують способом, що містить змішування іпамореліну і оцтової кислоти і води, в молярному співвідношенні іпаморелін:оцтова кислота 1:2 і концентрацією іпамореліну від 1 до 10 мг/мл, і вказаний іпаморелін являє собою вільну основу, що має дигідратну кристалічну форму.
7. Розчин за будь-яким з пп. 1, 2, 3, 4 або 5, в якому вказаний іпамореліну діацетат отримують способом, що містить змішування іпамореліну і оцтової кислоти і води, в молярному співвідношенні іпаморелін:оцтова кислота 1:2 і концентрацією іпамореліну від 1 до 10 мг/мл, і вказаний іпаморелін являє собою вільну основу, що має кристалічну форму А.
8. Спосіб отримання розчинів для ін'єкції і інфузії іпамореліну діацетату з концентрацією іпамореліну від 0,001 до 20 % без виділення діацетатної солі після її утворення, що містить:
a) змішування вільної основи іпамореліну і оцтової кислоти в молярному співвідношенні 1:2 для утворення водного розчину іпамореліну діацетату;
b) змішування вказаного іпамореліну діацетату з 0,1-30 % однією або декількома допоміжними речовинами без виділення вказаного іпамореліну діацетату в твердій формі; і
c) змішування вказаного іпамореліну діацетату з додатковою водою для отримання кінцевої концентрації іпамореліну від 0,001 до 20 % з розрахунку на загальну масу розчину і масу іпамореліну у вигляді вільної основи;
де стадії (а), (b) і (с) виконують одночасно, послідовно або в будь-якому порядку, де вказані допоміжні речовини містять від 1 до 10 молярних еквівалентів надлишку оцтової або лимонної кислоти відносно вказаного іпамореліну діацетату.
9. Спосіб за п. 8, в якому вказані одна або декілька допоміжних речовин включають рН регулюючий агент, прийнятний для доведення рН розчину до значення від щонайменше 3 до менше ніж 7.
10. Спосіб за п. 8 або 9, в якому вказані одна або декілька допоміжних речовин містять ефективну регулюючу тонічність кількість одного або декількох регулюючих тонічність агентів.
Текст
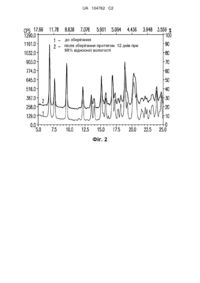
Реферат: Винахід стосується розчину для ін'єкції або інфузії іпамореліну, який містить: а) іпаморелін, розчинений в двох молярних еквівалентах оцтової кислоти (іпамореліну діацетат) в кількості від 0,001 до 20 % з розрахунку на масу іпамореліну у вигляді вільної основи; b) молярний надлишок кислоти, переважно оцтової кислоти, в кількості, достатній для отримання рН від щонайменше 3 до менше ніж 7; с) від 0,1 до 30 % однієї або декількох допоміжних речовин; і d) воду в кількості, необхідній до 100 %; всі проценти приведені з розрахунку на загальну масу розчину, де вказаний розчин містить від 1 до 10 молярних еквівалентів надлишку оцтової кислоти. UA 104762 C2 (12) UA 104762 C2 UA 104762 C2 5 10 ВІДНОШЕННЯ ДО ПОПЕРЕДНІХ ЗАЯВОК Дана заявка заявляє про пріоритет по попередній заявці США 61/186,595, поданій 12 червня 2009 р. ГАЛУЗЬ ТЕХНІКИ, ЯКОЇ СТОСУЄТЬСЯ ВИНАХІД Даний винахід стосується галузі хімії іпамореліну і, зокрема, стосується способів підвищення розчинності іпамореліну у вигляді солі діацетату, переважно в присутності надлишку кислотних залишків для забезпечення оптимальної стабільності і розчинності в розчинах для ін'єкції і інфузії. РІВЕНЬ ТЕХНІКИ Іпаморелін являє собою селективний стимулятор секреції гормону росту, уперше синтезований дослідниками компанії Novo Nordisk в середині 1990-их років і описаний в EP 0736039 В1. Молекула хімічно визначена як α-метилаланін-L-гістидин-D-β-(2-нафтил)-аланін-Dфенілаланін-L-лізинамід або H-Aib-His-β-(2-нафтил)-D-Ala-D-Phe-Lys-NH2 і має наступну хімічну структуру: 15 . 20 25 30 35 40 45 Згідно з опублікованими даними, ця молекула, виділена у вигляді солі трифторацетату, являє собою білий аморфний порошок і має молекулярну масу (у вигляді вільної основи), що дорівнює приблизно 711,9 г/моль. Розчини для ін'єкції іпаморелін трифторацетату, розчинені в фізрозчині, що містить свинячий сироватковий альбумін, описані Raun et ah, EUR. JNL. ENDOCR. (1998) 139:552-561. В EP 0736039 В1 згадуються численні кислі адитивні солі сполук, які по свій структурі належать до іпамореліну, але немає згадки про способи поліпшення розчинності іпамореліну в розчинах для ін'єкцій з одночасним збільшенням стабільності молекули. КОРОТКИЙ ОПИС ВИНАХОДУ Даний винахід надає розчин іпамореліну, розчинений в двох молярних еквівалентах оцтової кислоти (що надалі називається "іпамореліну діацетат"), що використовується як готовий розчин для ін'єкції і інфузії, способи отримання готових до використання розчинів, і нові проміжні продукти і вихідні речовини, що використовуються в способах, які не приводять до підвищеної нестабільності, осадження або деградації іпамореліну. Таким чином, в першому основному варіанті здійснення винахід надає нові розчини для ін'єкції і інфузії іпаморелін діацетату, що містять: а) іпаморелін, розчинений в приблизно двох молярних еквівалентах оцтової кислоти (іпамореліну діацетат) в кількості від 0,001 до 20 % з розрахунку на масу іпамореліну у вигляді вільної основи; b) молярний надлишок кислоти, переважно оцтової кислоти, в кількості, достатній для отримання pH від щонайменше 3 до менше ніж 7; с) необов'язково від 0,1 до 30 % однієї або декількох допоміжних речовин; і d) воду q.s. до 100 %; всі проценти, приведені з розрахунку на загальну масу розчину. Даний винахід також стосується способу отримання розчинів для ін'єкції і інфузії іпаморелін діацетату in situ при концентрації іпамореліну від 0,001 до 20 % без виділення діацетатної солі після її отримання, що включає: а) змішування іпамореліну у вигляді вільної основи і оцтової кислоти в молярному співвідношенні приблизно 1:2 для утворення водного розчину іпаморелін діацетату; b) змішування вказаного іпаморелін діацетату з 0,1-30 % однією або декількома допоміжними речовинами, що необов'язково включають одну або декілька надлишкових кислот, без виділення вказаного іпаморелін діацетату у вигляді твердої речовини; і 1 UA 104762 C2 5 10 15 20 25 30 35 40 45 50 55 60 с) необов'язкове змішування вказаного іпаморелін діацетату з додатковою водою для доведення кінцевої концентрації іпамореліну до від 0,001 до 20 % з розрахунку на загальну масу розчину і масу іпамореліну у вигляді вільної основи. У цьому контексті термін "змішування" має широке значення, таке, що стадії (a), (b) і (с) можуть виконуватися одночасно, послідовно або в будь-якому порядку. У особливо переважному варіанті здійснення одна або декілька допоміжних речовин містять ефективну регулюючу тонічність кількість одного або декількох регулюючих тонічність агентів. У іншому переважному варіанті здійснення одна або декілька допоміжних речовин містять рН регулюючі агенти в кількості, достатній для отримання заданого pH. У іншому варіанті здійснення винахід надає іпамореліну діацетат. Винахід також стосується проміжних продуктів, що використовуються для отримання фармацевтичних розчинів за даним винаходом. Таким чином, в іншому варіанті здійснення винахід надає проміжний розчин іпамореліну, розчиненого в оцтовій кислоті, в якому молярне співвідношення іпаморелін:кислота становить приблизно 1:2. У порівнянні з раніше відомими розчинами для ін'єкції розчини іпамореліну за винаходом мають перевагу, яка полягає в поліпшеній стабільності при тривалому зберіганні. Подібним чином, способи отримання, а також проміжні продукти і вихідні речовини, що використовуються в цих способах, гарантують стабільність іпамореліну протягом терміну придатності продукту. Додаткові варіанти здійснення і переваги винаходу частково представлені в приведеному нижче описі і частково очевидні з опису або можуть бути виявлені при здійсненні винаходу. Варіанти здійснення і переваги винаходу можуть бути реалізовані і отримані за допомогою елементів і комбінацій, які, зокрема, вказані в прикладеній формулі винаходу. Потрібно врахувати, що і попередній загальний опис і подальший докладний опис приведені тільки з метою ілюстрації і пояснення і не призначені для обмеження заявленого винаходу. ОПИС КРЕСЛЕНЬ Прикладені креслення, які включені в опис і є його частиною, ілюструють декілька варіантів здійснення винаходу і разом з описом служать для пояснення принципів винаходу. Фіг. 1 являє собою двовимірний графік, що ілюструє вплив pH на розчинність іпамореліну у вигляді вільної основи. Фіг. 2 являє собою зразок дифракційної рентгенограми іпамореліну у вигляді вільної основи, дигідратної кристалічної форми, до і після зберігання при 98 %-ій відносній вологості протягом дванадцяти днів. Фіг. 3 являє собою зразок дифракційної рентгенограми іпамореліну у вигляді вільної основи, безводна кристалічна форма А, з нагріванням зразка. ДОКЛАДНИЙ ОПИС ВИНАХОДУ Приведений нижче докладний опис переважних варіантів здійснення винаходу і приклади, що містяться в них, забезпечують більш повне розуміння даного винаходу. Визначення і використання термінів Використовувана в даному описі і прикладеній формулі винаходу форма однини також включає форму множини, якщо з контексту в явному вигляді не виходить інше. Таким чином, наприклад, посилання на "компонент" включає суміші компонентів, посилання на "активний фармацевтичний агент" включає більше ніж один активний фармацевтичний агент і т. п. Якщо в описі не визначено інше, проценти, що використовуються в даному документі, являють собою проценти по масі, а маса або процент іпамореліну або його солей приведена з розрахунку на масу іпамореліну у вигляді вільної основи, обчисленої для безводної основи без урахування води, що міститься в гідраті. Термін "фармацевтично прийнятний" означає використовуваний при приготуванні фармацевтичної композиції, звичайно безпечний, нетоксичний і який не є небажаним як з біологічної точки зору, так і яким-небудь іншим чином, і включає значення: прийнятний для ветеринарного використання і для фармацевтичного використання людиною. Обговорення Як указано в даному описі, даний винахід надає готові до застосування рідкі розчини для ін'єкції і інфузії іпамореліну. Винахід також надає способи отримання готових розчинів і нові проміжні продукти і вихідні речовини, що використовуються в цих способах, які не приводять до підвищеної деградації іпамореліну. Розчини для ін'єкції і інфузії за винаходом містять активну речовину іпаморелін в концентрації від 0,001 до 20 %, переважно від 0,005 до 10 % і найбільш переважно від 0,01 до 1 %. Для лікарських форм для підшкірного введення, особливо переважною концентрацією є концентрація від 0,1 до 10 %. Згідно з приведеною в даному документі вказівкою, ці проценти вказані з розрахунку на загальну масу розчину і масу іпамореліну у вигляді вільної основи. 2 UA 104762 C2 5 10 15 20 25 30 35 40 45 50 55 60 Хоча послідовність змішування може змінюватися, іпаморелін переважно спочатку розчиняють у водному розчині оцтової кислоти в молярному співвідношенні приблизно 1:2 (іпаморелін:ацетат), отримуючи таким чином сіль, що називається тут діацетатом іпамореліну, або іпаморелін діацетатом. Концентрація іпамореліну в цьому проміжному водному розчині переважно варіює від 0,1 до 100 мг/мл або від 0,5 до 20 мг/мл. Потім іпаморелін діацетату розчиняють в присутності молярного надлишку фармацевтично прийнятної кислоти. Молярний надлишок переважно складає кількість, необхідну для отримання розчину, що має pH від щонайменше 3 або 4 до менше ніж 7, переважно від 3 до 6,5; від 4 до 6,5; від 4,5 до 6,5; від 3,5 до 4,5; від 4,5 до 5,5; від 5,5 до 6,5; від 3 до 4; від 4 до 5; від 5 до 6; або від 6 до 7. Хоча для стабілізації іпаморелін діацетату можуть бути використані різні кислоти, в тому числі лимонна кислота, соляна кислота, метансульфонова кислота, етансульфонова кислота, пропіонова кислота, сукцинова кислота, глутарова кислота, аскорбінова кислота, фосфорна кислота, винна кислота, молочна кислота і їх суміші, в переважному варіанті здійснення іпаморелін діацетату стабілізують надлишком оцтової кислоти. Оцтова кислота переважно присутня в розчині в 0,1-30 молярному надлишку відносно іпаморелін діацетату. Таким чином, наприклад, якщо розчин містить 1 моль іпаморелін діацетату, цей розчин буде додатково містити від 0,1 до 30 молей надлишку оцтової кислоти. У переважних варіантах здійснення молярний надлишок варіює від 1 до 10, від 2 до 5 або від 5 до 8. Хоча як розріджувач переважно використати виключно воду для отримання готових і проміжних розчинів, з водою для ін'єкції можуть бути об'єднані інші рідкі розріджувачі, включаючи етанол, гліцерин, пропіленгліколь, поліетиленгліколь і триетиленгліколь. У переважному варіанті здійснення pH буферна система забезпечується в готовій лікарській формі шляхом введення солі лужного металу прийнятної органічної кислоти, яка переважно відповідає надлишку кислотного компонента (тобто ацетату натрію або цитрату натрію). Прийнятні концентрації буферної системи знаходяться в межах приблизно від 5 до 20 або 40 мМ. Таким чином, наприклад, якщо використовується ацетатна буферна система, надлишок іонів ацетату в розчині, виключаючи будь-який ацетат іпаморелін діацетату, буде знаходитися в межах від 5 до 20 або 40 мМ. Осмоляльність водних розчинів переважно становить 200-900 мОсм/кг, більш переважно, 260-390 мОсм/кг. Ізотонічні умови розчину можна регулювати шляхом додавання регулюючого тонічність агента, вибраного з NaCl, глюкози, фруктози, гліцерину, сорбітолу, маніту, сахарози або ксиліту, або суміші цих речовин. Також можна використати допоміжні речовини, такі як загусники (наприклад, серед інших метилцелюлозу, гідроксіетилцелюлозу, гідроксипропілцелюлозу, натрій карбоксиметилцелюлозу, полівінілпіролідон і желатин), абсорбенти, легкі стабілізатори, уповільнювачі кристалізації, комплексоутворювачі (наприклад, серед інших, Na-ЕДТА, фосфати, нітрати, ацетату і цитрати), антиоксиданти (серед інших, аскорбінову кислоту, сульфітні сполуки, L-цистеїн, тіодипропіонову кислоту, тіомолочну кислоту, монотіогліцерин і пропілгалат) і консерванти (серед інших, складні ефіри PHB, фенол і похідні, хлорбутанол, бензиловий спирт, етанол, бутанол, бутан-1,3-діол, солі хлоргексидину, бензойну кислоту і її солі і сорбінову кислоту). Розчини для ін'єкції або інфузії за винаходом переважно отримують, використовуючи виділений іпаморелін у вигляді вільної основи з високим ступенем чистоти. Іпаморелін у вигляді безводної основи, без урахування води, переважно має чистоту, що перевищує 90, 95 або навіть 98 ваг. %. Незважаючи на те, що будь-яка кристалічна або аморфна форма іпамореліну є прийнятною, вихідна речовина переважно являє собою кристалічну форму іпамореліну у вигляді дигідрату, на противагу аморфній або кристалічній формам А і В, як показано на Фіг. 2 і 3. Альтернативно, іпаморелін може знаходитися в кристалічній формі, що містить від 1,5 до 2,0 або 2,5 молів води на 1 моль іпамореліну. Такі гідратні форми іпамореліну переважно отримують осадженням вільної основи з суміші вода/метанол. Гідратаційна вода випаровується після нагрівання при температурі приблизно 110-110 °C, згідно з даними диференціальної скануючої калориметрії (DSC). Безводна форма А може бути отримана шляхом осадження вільної основи в ацетонітрилі. Безводна форма В є енантіотропною формою А, і отримується при нагріванні форми А вище ніж приблизно 110 °C. Потім отримують солі, переважно безпосередньо в розчині шляхом об'єднання іпамореліну з оцтовою кислотою в кількості, необхідній для розчинення і утворення солі. Розчинення можна прискорити, здійснюючи процес при температурі від 30 до 60 °C, при цьому розчини можна отримувати в атмосфері азоту для мінімізації окиснення. 3 UA 104762 C2 5 10 15 20 25 30 35 40 45 50 55 Потім можна отримувати готовий розчин шляхом попереднього виділення солі іпамореліну в твердій формі або без такого виділення. У випадку виділення діацетатної солі, її переважно виділяють і зберігають в аморфному стані, переважно зчистотою, що перевищує 90, 95 або 98 ваг. % (з розрахунку на безводну основу без урахування води). Після утворення солі іпамореліну з оцтовою кислотою, її можна об'єднувати з іншими допоміжними речовинами або водою для ін'єкції для отримання необхідної концентрації в готовій лікарській формі. При отриманні розчину без попереднього виділення солі іпамореліну, розчин не буде містити ніякі залишкові розчинники, які звичайно зберігаються під час осадження солі з розчинника. Таким чином, в іншому варіанті здійснення винахід надає розчини за даним винаходом, в яких відсутні залишкові розчинники, що використовуються для осадження солі іпамореліну. Хоча можна використати і інші способи видалення таких залишкових речовин, цей спосіб in situ виявився особливо переважним. Відсутність залишкового розчинника може бути підтверджено вмістом залишкових речовин, що знаходиться за межами чутливості відомих способів, що використовуються для виявлення розчинників і їх кількісного визначення. Таким чином можна отримувати будь-які готові до застосування розчини активної речовини, налиті у прийнятні контейнери, наприклад, в ампули, флакони для ін'єкції, бутлі для інфузії, шприци, або вихідні продукти, прийнятні для приготування таких розчинів, наприклад, концентрати або ліофілізовані продукти. Заповнені препаратом контейнери можуть бути виготовлені з скла або пластику, який є прийнятним для виготовлення контейнерів матеріалом, що включає речовини, які надають контейнеру специфічного захисту, наприклад, захисту від світла або кисню. Після приготування, розчин може бути безпосередньо, без додаткового відновлення, введений пацієнту, який потребує лікування іпамореліном, у вигляді ін'єкції або інфузії. ПРИКЛАДИ Приготування розчинів в приведених нижче прикладах можна виконувати в порційній посудині з використанням теплообмінника або без нього. У випадку використання посудини, що не обігрівається, у разі необхідності, можна використати попередньо підігріту воду. У загальному випадку, основний об'єм розчинника вводять в посудину і розчиняють в ньому окремі компоненти, хоча також можливе додавання розчинника до твердої речовини. Інші компоненти потім розчиняють або вводять в препарат до або після охолоджування при перемішуванні. Після доведення до потрібного об'єму залишком розчинника лікарський склад може бути стерилізований фільтруванням через фільтри, затримуючі бактерії, і/або стерилізований нагріванням. ПРИКЛАД 1: Ілюстративні продукти лікарської речовини і їх стабільність Приготування базового розчину 3 л 5,0 мг/мл базового розчину іпрамореліну Готували три препарати по 1000 мл, що містять 5,01256, 5,01767 і 5,01252 грам іпамореліну (API), відповідно. Кожний розчин містив 800 мкл крижаної оцтової кислоти і був доведений до потрібного об'єму водою Milli-Q. Ці три розчини об'єднували в одну посудину і ретельно перемішували, отримуючи кінцевий базовий розчин іпамореліну. 12 л 18 мг/мл базовий розчин NaCl 4000 мл отримували шляхом додавання у воду Milli-Q 72,0 г NaCl і перемішування до повного розчинення. 100 мМ ацетат натрію, pH 5 1000 мл отримували, використовуючи 1,71 мл крижаної оцтової кислоти і 9,574 г ацетату натрію. Кінцевий pH буфера становив 5,41. 100 мМ ацетат натрію, pH 6 1000 мл отримували, використовуючи 0,14 мл крижаної оцтової кислоти і 13,262 г ацетату натрію. Кінцевий pH буфера становив 6,26. 100 мМ цитрат натрію, pH 5 1000 мл отримували, використовуючи 8,614 г моногідрату лимонної кислоти і 17,352 г цитрату натрію. Кінцевий pH буфера становив 4,99. 100 мМ цитрату натрію, pH 6 1000 мл отримували, використовуючи 3,992 г моногідрату лимонної кислоти і 24,410 г цитрату натрію. Кінцевий pH буфера становив 5,58. 100 мМ цитрату натрію, pH 7 1000 мл отримували, використовуючи 29,410 г цитрату натрію з вихідним pH 8,81, який і доводили 0,1 н соляною кислотою до 7,33. 100 мМ фосфат натрію, 20 мМ ЕДТ, pH 6 4 UA 104762 C2 5 10 15 20 25 30 35 40 100 мл отримували, використовуючи 5,382 г моноосновного натрію фосфат моногідрату, 16352 г цитрату натрію і 7,445 г динатрій етилендіамінтетраацетату. Кінцевий pH буфера становив 5,98. Отримання продуктів лікарської речовини Контроль: 0,5 мг/мл іпамореліну в 2х еквівалентах 9 мг/мл оцтової кислоти, pH 7,5 1000 мл отримували, використовуючи 500 мл 2х хлориду натрію, 100 мл 10х базового розчину іпамореліну (API) з вихідним pH 6,95, які доводили до pH 7,53 додаванням шести крапель 1 н гідроксиду натрію. Змішували шляхом перевертання 15 разів і фільтрували через Millipore мембранний фільтр 0,22 мкм Durapore. Розподіляли по 10 мл аліквоти за допомогою дозатора-репітера Eppendorf і 50 мл наконечників Combitip Biopur. DP#1: 0,5 мг/мл іпаморелін, 10 мМ ацетат натрію, pH 5 і 9 мг/мл NaCl 900 мл лікарської форми отримували шляхом змішування 100 мл 10х базового розчину ацетату натрію (рН~5) з 500 мл базового розчину NaCl зі 100 мл 5 мг/мл базового розчину іпамореліну (API) в 200 мл води Milli-Q. У практично повному об'ємі вихідний pH 5,18 доводили до 5,01 крижаною оцтовою кислотою. DP#4: 1,0 мг/мл іпаморелін, 10 мМ ацетат натрію, pH 6 і 9 мг/мл NaCl 900 мл лікарської форми отримували шляхом змішування 100 мл 10х базового розчину ацетату натрію (рН~6) з 500 мл базового розчину NaCl з 200 мл 5 мг/мл базового розчину іпамореліну (API) в 200 мл води Milli-Q. У практично повному об'ємі вихідний pH 6,79 доводили до 5,96 крижаною оцтовою кислотою. DP#5: 0,5 мг/мл іпаморелін, 10 мМ цитрат натрію, pH 5 і 9 мг/мл NaCl 900 мл лікарської форми отримували шляхом змішування 100 мл 10х базового розчину цитрату натрію (рН~5) з 500 мл базового розчину NaCl зі 100 мл 5 мг/мл базового розчину іпамореліну (API) в 200 мл води Milli-Q. У практично повному об'ємі вихідний pH 4,75 доводили до 5,00 гідроксидом натрію. DP#8: 1,0 мг/мл іпаморелін, 10 мМ цитрат натрію, pH 6 і 9 мг/мл NaCl 900 мл лікарської форми отримували шляхом змішування 100 мл 10х базового розчину цитрату натрію (рН~6) з 500 мл базового розчину NaCl з 200 мл 5 мг/мл базового розчину іпамореліну (API) в 200 мл води Milli-Q. У практично повному об'ємі вихідний pH 5,67 доводили до 6,02 гідроксидом натрію. DP#10: 1,0 мг/мл іпаморелін, 10 мМ цитрат натрію, pH 7 і 9 мг/мл NaCl 900 мл лікарської форми отримували шляхом змішування 100 мл 10х базового розчину цитрату натрію (рН~7) з 500 мл базового розчину NaCl з 200 мл 5 мг/мл базового розчину іпамореліну (API) в 200 мл води Milli-Q. У практично повному об'ємі вихідний pH 7,16 доводили до 7,02 1 н соляною кислотою. DP#15: 0,5 мг/мл іпаморелін, 10 мМ фосфат натрію, 2 мМ Na-ЕДТА, pH 6 і 9 мг/мл NaCl 900 мл лікарської форми отримували шляхом змішування 100 мл 10х фосфату натрію, базового розчину ЕДТА (pH~6) з 500 мл базового розчину NaCl, зі 100 мл 5 мг/мл базового розчину, іпамореліну (API) в 200 мл води Milli-Q. У практично повному об'ємі вихідний pH 6,06 доводили до 6,00 соляною кислотою. Таблиця 1 Сумарні результати рН через 6 місяців тестування стабільності С 1 4 5 8 10 15 Склад 0,5 мг/мл іпаморелін, 2 еквіваленти оцтової кислоти, рН 7,5, і 9 мг/мл NaCl 0,5 мг/мл іпаморелін, 10 мМ ацетату натрію, рН 5 і 9 мг/мл NaCl 1,0 мг/мл іпаморелін, 10 мМ ацетату натрію, рН 6 і 9 мг/мл NaCl 0,5 мг/мл іпаморелін, 10 мМ цитрату натрію, рН 5 і 9 мг/мл NaCl 1,0 мг/мл іпаморелін, 10 мМ цитрату натрію, рН 6 і 9 мг/мл NaCl 1,0 мг/мл іпаморелін, 10 мМ ацетату натрію, рН 7 і 9 мг/мл NaCl 0,5 мг/мл іпаморелін, 10 мМ фосфату натрію, 2 мМ Na-ЕДТА, рН 65 і 9 мг/мл NaCl 5 Температура рН 40 °С 7,5 40 °С 40 °С 40 °С 40 °С 40 °С 5,0 6,0 5,0 6,1 7,1 40 °С 6,0 UA 104762 C2 Таблиця 2 Сумарні результати активності і загальної чистоти Теоретична, Вміст діючої % % чистота (визначена за допомогою мг/мл речовини (мг/мл) відновлення прогр. пакету Empower) Контроль 40С 0,5 0,449 90 92,28 DP#140С 0,5 0,470 94 98,68 DP#140С 1,0 0,945 94 97,96 DP#140С 0,5 0,473 95 98,01 DP#140С 1,0 0,943 94 97,39 DP#140С 1,0 0,899 90 93,06 DP#140С 0,5 0,460 92 95,31 5 10 15 20 ПРИКЛАД 2: Розчинність як функція pH Розчинність іпамореліну у вигляді вільної основи при різних значеннях pH показана на графіку на Фіг. 1. При значеннях pH нижче ніж приблизно 10 лікарська речовина має дуже хорошу розчинність у водних середовищах (> 100 мг/мл). У районі значення pH, що дорівнює 10, спостерігається різка зміна розчинності вільної основи іпамореліну і його діацетатної солі в чистій воді. Діацетатна сіль швидко розчиняється: здатна утворювати розчини з концентрацією більшою ніж 100 мг/мл, кінцевий pH становить приблизно 7,5. Вільна основа має значно меншу розчинність; в насиченому розчині концентрація, згідно з вимірюваннями, становить тільки приблизно 1,5 мг/мл, pH 9,83. Однак можна отримати розчини істотно вищій концентрації шляхом простого доведення pH до приблизно нейтрального значення розчином HCl або аналогічної кислоти. ПРИКЛАД 3: рентгенівська дифракція (XRD) Результати XRD дослідження кристалічних форм іпамореліну у вигляді вільної основи при кімнатній температурі показані на Фіг. 2 і 3. Досліджування проводили на порошковому рентгенівському дифрактометрі Scintag XDS 2000 при наступних умовах вимірювання: Тип гоніометра: тета/тета Радіус гоніометра: 250 мм енергодисперсійний германієвий детектор, Датчик: що охолоджується рідким азотом Напруга: 45 КВ Струм: 40 мА Фільтр: без фільтра Випромінювання лінії Випромінювання: CuKα1 (λ=1,540598 Å) Розмір мішені: 1,0×10 мм Безперервне сканування, величина кроку: 0,02° Швидкість: 1 град./хв Щілина, що забезпечує розхідність: 2 мм Вхідна щілина: 0,2 мм Щілина розсіювання, що забезпечує розхідність 4 мм Щілина розсіювання: 0,5 мм Профілі XRD вимірювали при кімнатній температурі. Пристрій для обертання зразка не використовувався. Все дифрактограми вимірювали при 2-40 градусах 2-тета. Для досліджень XRD з нагріванням приблизно 40 мг речовини вміщували на тримач для зразків (20 мм діаметр×0,2 мм глибина), який був прикріплений до змінюючого температуру пристрою на рентгенівському дифрактометрі Scintag XDS 2000. Температуру підвищували або знижували з швидкістю 1 град./хв із паузами на заздалегідь вибраних температурах для 6 UA 104762 C2 5 10 забезпечення можливості отримання дифрактограми. Дифрактограми вимірювали при кутах 2тета 2-30 градусах. У даній заявці приводяться посилання на різні публікації. Розкриття цих публікацій включені в дану заявку у всій їх повноті у вигляді посилання для більш повного розкриття рівня техніки, до якого належить даний винахід. Для фахівців в даній галузі очевидно, що в даному винаході можуть бути зроблені різні модифікації і зміни, не виходячи за об'єм і не змінюючи суті даного винаходу. Інші варіанти здійснення винаходу стануть очевидними фахівцям в даній галузі після вивчення даного опису і практичної реалізації розкритого тут винаходу. Потрібно зазначити, що даний опис і приклади приведені виключно з метою ілюстрації винаходу, істинний об'єм і суть якого визначена приведеною нижче формулою винаходу. ФОРМУЛА ВИНАХОДУ 15 20 25 30 35 40 45 50 1. Розчин для ін'єкції або інфузії іпамореліну, який містить: a) іпаморелін, розчинений в двох молярних еквівалентах оцтової кислоти (іпамореліну діацетат) в кількості від 0,001 до 20 %, з розрахунку на масу іпамореліну у вигляді вільної основи; b) молярний надлишок кислоти, переважно оцтової кислоти, в кількості, достатній для отримання рН від щонайменше 3 до менше ніж 7; c) від 0,1 до 30 % однієї або декількох допоміжних речовин; і d) воду q.s. до 100 %; всі проценти приведені з розрахунку на загальну масу розчину, де вказаний розчин містить від 1 до 10 молярних еквівалентів надлишку оцтової кислоти. 2. Розчин за п. 1, що містить надлишок фосфорної кислоти, лимонної кислоти, винної кислоти або молочної кислоти. 3. Розчин за п. 1 або 2, що має рН від 4 до 6,5. 4. Розчин за будь-яким з пп. 1, 2 або 3, що не містить якого-небудь залишкового розчинника, що використовується для осадження іпамореліну діацетату. 5. Розчин за будь-яким з пп. 1, 2, 3 або 4, в якому вказаний іпамореліну діацетат отримують способом, що містить змішування іпамореліну і оцтової кислоти і води, в молярному співвідношенні іпаморелін:оцтова кислота 1:2 і концентрацією іпамореліну від 0,1 до 100 мг/мл. 6. Розчин за будь-яким з пп. 1, 2, 3, 4 або 5, в якому вказаний іпамореліну діацетат отримують способом, що містить змішування іпамореліну і оцтової кислоти і води, в молярному співвідношенні іпаморелін:оцтова кислота 1:2 і концентрацією іпамореліну від 1 до 10 мг/мл, і вказаний іпаморелін являє собою вільну основу, що має дигідратну кристалічну форму. 7. Розчин за будь-яким з пп. 1, 2, 3, 4 або 5, в якому вказаний іпамореліну діацетат отримують способом, що містить змішування іпамореліну і оцтової кислоти і води, в молярному співвідношенні іпаморелін:оцтова кислота 1:2 і концентрацією іпамореліну від 1 до 10 мг/мл, і вказаний іпаморелін являє собою вільну основу, що має кристалічну форму А. 8. Спосіб отримання розчинів для ін'єкції і інфузії іпамореліну діацетату з концентрацією іпамореліну від 0,001 до 20 % без виділення діацетатної солі після її утворення, що містить: a) змішування вільної основи іпамореліну і оцтової кислоти в молярному співвідношенні 1:2 для утворення водного розчину іпамореліну діацетату; b) змішування вказаного іпамореліну діацетату з 0,1-30 % однією або декількома допоміжними речовинами без виділення вказаного іпамореліну діацетату в твердій формі; і c) змішування вказаного іпамореліну діацетату з додатковою водою для отримання кінцевої концентрації іпамореліну від 0,001 до 20 % з розрахунку на загальну масу розчину і масу іпамореліну у вигляді вільної основи; де стадії (а), (b) і (с) виконують одночасно, послідовно або в будь-якому порядку, де вказані допоміжні речовини містять від 1 до 10 молярних еквівалентів надлишку оцтової або лимонної кислоти відносно вказаного іпамореліну діацетату. 9. Спосіб за п. 8, в якому вказані одна або декілька допоміжних речовин включають рН регулюючий агент, прийнятний для доведення рН розчину до значення від щонайменше 3 до менше ніж 7. 10. Спосіб за п. 8 або 9, в якому вказані одна або декілька допоміжних речовин містять ефективну регулюючу тонічність кількість одного або декількох регулюючих тонічність агентів. 7 UA 104762 C2 8 UA 104762 C2 Комп’ютерна верстка Л. Ціхановська Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 9
ДивитисяДодаткова інформація
Назва патенту англійськоюIpamorelin diacetate injection and infusion solutions
Автори англійськоюGarcia Rubio, Silvina, Beidler, Daniel, Weibel, Helle, Braglia, Riccardo
Автори російськоюГарсия Рубио Сильвина, Бидлер Даниел, Вейбель Хелле, Бралья Риккардо
МПК / Мітки
МПК: A61K 47/12, A61K 9/08, A61K 38/25, A61P 1/00
Мітки: інфузії, діацетату, ін'єкції, розчин, іпамореліну
Код посилання
<a href="https://ua.patents.su/11-104762-rozchin-dlya-infuzi-i-inehkci-ipamorelinu-diacetatu.html" target="_blank" rel="follow" title="База патентів України">Розчин для інфузії і ін’єкції іпамореліну діацетату</a>
Попередній патент: Спосіб надлишкових вимірювань лінійних розмірів нанооб’єктів
Наступний патент: Електрична машина
Випадковий патент: Спосіб одержання цукеркової пралінової маси