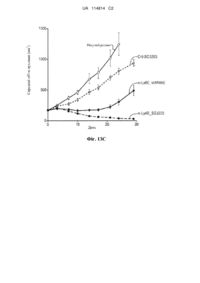
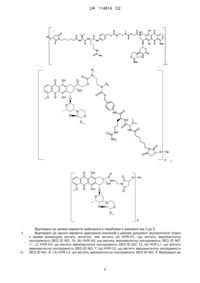
Виділене антитіло, яке зв’язується з ly6e
Формула / Реферат
1. Виділене антитіло, яке зв'язується з Ly6E, причому антитіло містить
(а) HVR-H1, що містить амінокислотну послідовність SEQ ID NO:10; (b) HVR-H2, що містить амінокислотну послідовність SEQ ID NO:11; c) HVR-H3, що містить амінокислотну послідовність SEQ ID NO:12; (d) HVR-L1, що містить амінокислотну послідовність SEQ ID NO:7; (e) HVR-L2, що містить амінокислотну послідовність
SEQ ID NO:8, і (f) HVR-L3, що містить амінокислотну послідовність SEQ ID NO:9.
2. Антитіло за п. 1, яке являє собою моноклональне антитіло.
3. Антитіло за п. 1, яке являє собою гуманізоване або химерне антитіло.
4. Антитіло за п. 1, причому антитіло інтерналізовано в експресуючих Ly6E клітинах при зв'язуванні.
5. Антитіло за п. 1, яке являє собою фрагмент антитіла, що зв'язується з епітопом у межах амінокислот 21-131 в SEQ ID NO:1.
6. Антитіло за п. 1, яке додатково містить послідовність FR2 каркасної області варіабельного домену легкого ланцюга SEQ ID NO:20 або FR3 каркасної області варіабельного домену легкого ланцюга SEQ ID NO:21, або FR1 каркасної області варіабельного домену важкого ланцюга SEQ ID NO:23 або FR2 каркасної області варіабельного домену важкого ланцюга SEQ ID NO:24.
7. Антитіло за п. 1, яке містить (а) послідовність VH, що характеризується ідентичністю послідовності, яка становить щонайменше 95 % стосовно до амінокислотної послідовності SEQ ID NO:5; (b) послідовність VL, що характеризується ідентичністю послідовності, яка становить щонайменше 95 % стосовно до амінокислотної послідовності SEQ ID NO:3; або (с) послідовність VH в (а) і послідовність VL в (b).
8. Антитіло за п. 1, яке містить послідовність VH SEQ ID NO:5.
9. Антитіло за п. 1, яке містить послідовність VL SEQ ID NO:3.
10. Виділене антитіло, яке зв'язується з Ly6E, причому антитіло містить послідовність VH SEQ ID NO:5 і послідовність VL SEQ ID NO:3.
11. Антитіло за будь-яким із пп. 1-10, причому антитіло є антитілом зі сконструйованим цистеїном.
12. Антитіло за п. 11, причому антитіло зі сконструйованим цистеїном містить заміщений цистеїн в константному домені легкого ланцюга.
13. Антитіло за п. 11, причому антитіло зі сконструйованим цистеїном містить заміщений цистеїн в константному домені важкого ланцюга.
14. Антитіло за п. 1, яке являє собою IgG1, IgG2a або IgG2b.
15. Виділена нуклеїнова кислота, яка кодує антитіло за будь-яким із пп. 1-14.
16. Виділена клітина-хазяїн, яка містить нуклеїнову кислоту за п. 15.
17. Спосіб одержання антитіла, який включає культивування клітини-хазяїна за п. 16 з одержанням антитіла.
18. Імунокон’югат, який містить антитіло за будь-яким із пп. 1-14 і цитотоксичний засіб.
19. Імунокон’югат за п. 18, який характеризується формулою Ab-(LD)р, де:
(а) Ab являє собою антитіло;
(b) L являє собою лінкер;
(с) D являє собою лікарський засіб, вибраний з майтанзиноїду, ауристатину, каліхеаміцину, піролобензодіазепіну та похідної неморубіцину; і
(d) р знаходиться в межах від 1-8.
20. Імунокон’югат за п. 18, у якому цитотоксичний засіб являє собою ауристатин.
21. Імунокон’югат за п. 19, у якому D характеризується формулою DE
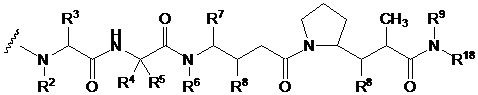 DE,
DE,
де R2 і R6 кожний являє собою метил, R3 і R4 кожний являє собою ізопропіл, R5 являє собою H, R7 являє собою втор-бутил, кожний R8 незалежно вибирають з СН3, O-СН3, ОН і Н; R9 являє собою Н і R18 являє собою -C(R8)2-C(R8)2-арил.
22. Імунокон’югат за п. 18, у якому цитотоксичний засіб являє собою ММАЕ.
23. Імунокон’югат за п. 19, у якому D являє собою піролобензодіазепін формули A:
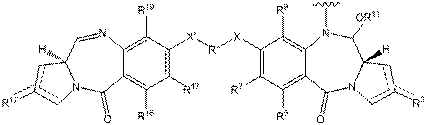 A,
A,
де пунктирні лінії вказують на необов'язкову присутність подвійного зв'язку між C1 і C2 або С2 і С3;
R2 незалежно вибирають з Н, ОН, =O, =СН2, CN, R, OR, =СН-RD, =C(RD)2, O-SO2-R, CO2R і COR, і необов'язково додатково вибирають з галогену або дигалогену, причому RD незалежно вибирають з R, CO2R, COR, CHO, CO2H і галогену;
R6 і R9 незалежно вибирають з Н, R, OH, OR, SR, SH, NH2, NHR, NRR', NO2, Me3Sn і галогену;
R7 незалежно вибирають з Н, R, OH, OR, SR, SH, NH2, NHR, NRR', NO2, Me3Sn і галогену;
Q незалежно вибирають з О, S і NH;
R11 являє собою або H, або R, або, де Q являє собою О, SO3M, де М являє собою катіон металу;
R і R' кожний незалежно вибирають з необов'язково заміщеного C1-8 алкілу, С3-8 гетероциклічних і C5-20 арильних груп, і, необов'язково, стосовно до групи NRR', R і R' разом із атомом азоту, до якого вони приєднані, утворюють необов'язково заміщене
4-, 5-, 6- або 7-членне гетероциклічне кільце;
R12, R16, R19 і R17 являють собою теж, що визначено для R2, R6, R9 і R7, відповідно;
R" являє собою С3-12 алкіленову групу, ланцюг якої може бути перерваний одним або декількома гетероатомами й/або ароматичними кільцями, які являють собою необов'язково заміщені; і
X і X' незалежно вибрані з O, S і N(H).
24. Імунокон’югат за п. 23, у якому D характеризується структурою:
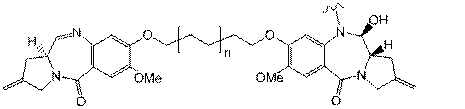 ,
,
в якій n становить 0 або 1.
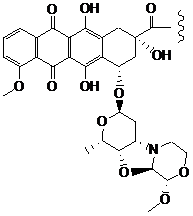
25. Імунокон’югат за п. 18, у якому цитотоксичний засіб являє собою похідну неморубіцину.
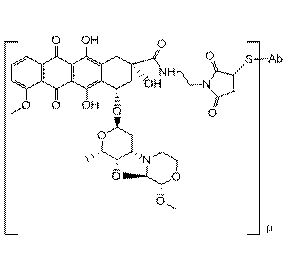
26. Імунокон’югат за п. 19, у якому D характеризується структурою, вибраною з:
 і
і
 .
.
27. Імунокон’югат за будь-яким із пп.19, 21, 23, 24 і 26, у якому лінкер розщеплюється за допомогою протеази.
28. Імунокон’югат за п. 27, у якому лінкер містить дипептид валін-цитрулін, дипептид аланін-фенілаланін, дипептид фенілаланін-лізин, дипептид фенілаланін-гомолізин або дипептид N-метил-валін-цитрулін.
29. Імунокон’югат за будь-яким із пп. 19, 21, 23, 24 і 26 у якому лінкер являє собою кислотолабільний.
30. Імунокон’югат за п. 29, у якому лінкер містить гідразон.
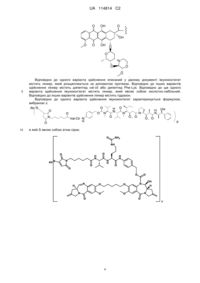
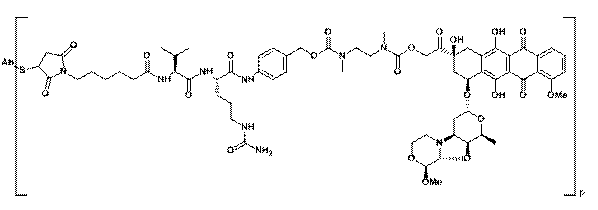
31. Імунокон’югат, який характеризується формулою:
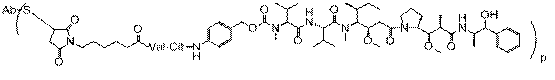 , в якій S являє собою атом сірки; Ab являє собою антитіло за будь-яким з пунктів 1-14, а р знаходиться в межах від 1-8.
, в якій S являє собою атом сірки; Ab являє собою антитіло за будь-яким з пунктів 1-14, а р знаходиться в межах від 1-8.
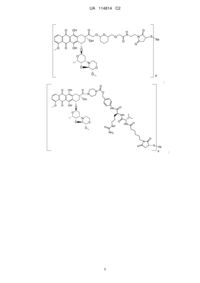
32. Імунокон’югат за п. 31, в якому антитіло містить послідовність VH
SEQ ID NO:5 і послідовність VL SEQ ID NO:3.
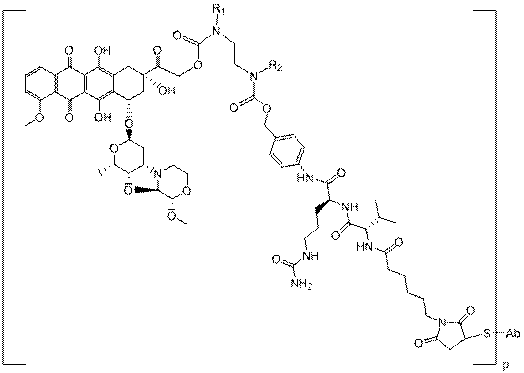
33. Імунокон’югат за п. 24, який характеризується формулою:
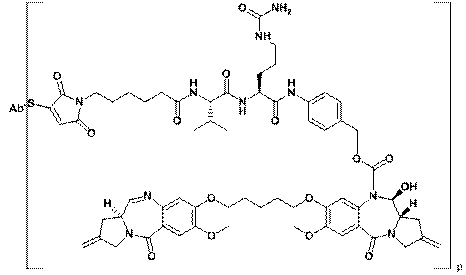 .
.
34. Імунокон’югат за п. 26, який характеризується формулою, вибраною з:
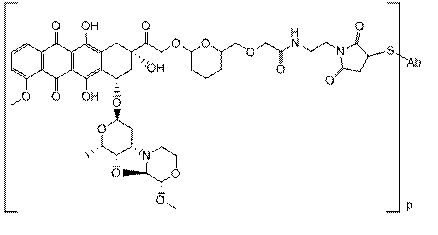 ,
,
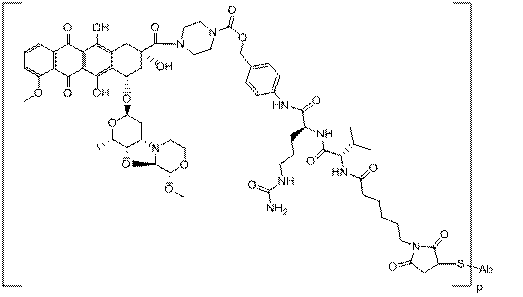 ,
,
 ,
,
де R1 і R2 незалежно вибрані з H і С1-С6алкілу; і
 .
.
35. Імунокон’югат за будь-яким із пп. 19, 21, 23, 24 і 26-34, у якому р знаходиться в діапазоні від 2 до 5.
36. Імунокон’югат за будь-яким із пп. 18-31 і 33-35, який містить антитіло за п. 10.
37. Фармацевтичний склад, який містить імунокон’югат за будь-яким із
пп. 18-36, і фармацевтично прийнятний носій.
38. Фармацевтичний склад за п. 37, який додатково містить додатковий терапевтичний засіб.
39. Фармацевтичний склад за п. 38, у якому додатковий терапевтичний засіб являє собою комплекс платини.
40. Спосіб лікування індивідуума з Ly6E-позитивною формою раку, який включає введення індивідууму ефективної кількості імунокон’югату за будь-яким із пп. 18-36.
41. Спосіб за п. 40, при якому Ly6E-позитивний рак вибирають з раку молочної залози, раку підшлункової залози, раку товстої кишки, раку товстої та прямої кишок, меланоми, раку яєчників, недрібноклітинного раку легенів, раку голови та шиї і раку шлунка.
42. Спосіб за п. 41, який додатково включає введення додаткового терапевтичного засобу індивідууму.
43. Спосіб за п. 42, при якому додатковий терапевтичний засіб являє собою комплекс платини.
44. Спосіб інгібування проліферації в Ly6E-позитивній клітині, який включає вплив на клітину імунокон’югатом за будь-яким із пп. 18-36 в умовах, що дозволяють зв'язування імунокон’югату з Ly6E на поверхні клітини, тим самим інгібуючи проліферацію клітини.
45. Спосіб за п. 44, при якому клітина являє собою злоякісну клітину молочної залози, підшлункової залози, товстої кишки, товстої та прямої кишок, меланоми, яєчників, недрібноклітинного раку легенів, раку голови та шиї або шлунка.
46. Антитіло за будь-яким із пп. 1-14, кон’юговане з міткою.
47. Антитіло за п. 46, в якому мітка являє собою позитронний емітер.
48. Антитіло за п. 47, в якому позитронний емітер являє собою 89Zr.
49. Спосіб виявлення Ly6E людини в біологічному зразку, який включає контактування біологічного зразка з антитілом до Ly6E за будь-яким із пп. 1-14 в умовах, що дозволяють зв'язування антитіла до Ly6E з природним Ly6E людини, і виявлення того, чи утворюється комплекс між антитілом до Ly6E і природним Ly6E людини в біологічному зразку.
50. Спосіб за п. 49, при якому антитіло до Ly6E являє собою антитіло за п. 10.
51. Спосіб за п. 50, при якому біологічний зразок являє собою зразок раку молочної залози, зразок раку підшлункової залози, зразок раку товстої кишки, зразок раку товстої та прямої кишок, зразок меланоми, зразок раку яєчників, зразок недрібноклітинного раку легенів, зразок раку голови та шиї або зразок раку шлунка.
52. Спосіб виявлення Ly6E-позитивної злоякісної пухлини, який включає (i) введення міченого антитіла до Ly6E суб'єкта, що характеризується наявністю або з підозрою на наявність Ly6E-позитивної злоякісної пухлини, причому мічене антитіло до Ly6E містить антитіло до Ly6E за будь-яким із пп. 1-14, і (ii) виявлення міченого антитіла до Ly6E у суб'єкта, причому виявлення міченого антитіла до Ly6E вказує на Ly6E-позитивну злоякісну пухлину в суб'єкта.
53. Спосіб за п. 52, при якому мічене антитіло до Ly6E являє собою антитіло за п. 10, що являє собою мічене антитіло.
54. Спосіб за п. 52 або п. 53, при якому мічене антитіло до Ly6E містить антитіло до Ly6E, кон’юговане з позитронним емітером.
55. Спосіб за п. 54, при якому позитронний емітер являє собою 89Zr.
Текст
Реферат: Винахід стосується виділеного антитіла, яке зв’язується з Ly6E, виділеної нуклеїнової кислоти, що його кодує, клітини-хазяїна, способу одержання даного антитіла. Винахід також стосується імуноконюгата, який містить заявлене антитіло, фармацевтичного складу, способу лікування індивідуума з Ly6E-позитивною формою раку, способу інгібування проліферації в Ly6Eпозитивній клітині, способу виявлення Ly6E людини в біологічному зразку та способу виявлення Ly6E-позитивної злоякісної пухлини. UA 114814 C2 (12) UA 114814 C2 UA 114814 C2 5 10 15 20 25 30 35 40 45 50 55 60 ОПИС Посилання на родинні заявки Дана заявка претендує на пріоритет відповідно до попередньої заявки на патент США з серійним номером 61/649775, поданої 21 травня 2012 р., повний зміст якої включено в даний документ за допомогою посилання. Область техніки Даний винахід відноситься до антитіл й імунокон'югатів до Ly6E та способів їх застосування. Рівень техніки Комплекс 6 антигену лімфоцитів, локус Е (Ly6E), також відомий як індукований ретиноєвою кислотою ген Е (RIG-E) й антиген 2 стовбурних клітин (SCA-2). Він являє собою пов'язаний з GPI, що становить у довжину 131 амінокислоту, розміром ~ 8,4 кДа білок з невідомою функцією без яких-небудь відомих партнерів по зв'язуванню. Спочатку він був ідентифікований як транскрипт, що експресується у незрілому тимоциті, тимусних серцевинних епітеліальних клітинах у мишей. RIG-E, людський гомолог сімейства Ly-6 миші, індукується ретиноєвою кислотою при диференціації клітини гострої промієлоцитарної лейкемії. Mao M., Yu M., Tong J.H., Ye J., Zhu J., Huang Q.-H., Fu G., Yu L., Zhao S.-Y., Waxman S., Lanotte M., Wang Z.-Y., Tan J.Z., Chan S.-J., Chen Z. Proc. Natl. Acad. Sci. U.S.A. 93:5910-5914 (1996). У даній області техніки існує необхідність у засобах, які націлено впливають на Ly6E для діагностики та лікування пов'язаних з Ly6E станів, таких як злоякісна пухлина. Даний винахід задовольняє цій потребі та забезпечує інші переваги. Сутність винаходу Даний винахід відноситься до антитіл, імунокон'югатів до Ly6E та способів їх застосування. Відповідно до деяких варіантів здійснення передбачене виділене антитіло, що зв'язується з Ly6E. Відповідно до інших варіантів здійснення антитіло, що зв'язується з Ly6E, зв'язується з епітопом у межах амінокислот 21-131 в SEQ ID NO: 1. Відповідно до іншого варіанта здійснення таке антитіло зв'язується з Ly6E з афінністю ≤ 4 нМ, виміряною за допомогою аналізу Скетчарда. Відповідно до іншого варіанта здійснення таке антитіло зв'язується з Ly6E з афінністю ≤ 7 нМ, виміряною за допомогою поверхневого плазмонного резонансу (SPR). Відповідно до ще одного варіанта здійснення таке антитіло застосовують як лікарський засіб. Відповідно до одного варіанта здійснення антитіло, що зв'язується з епітопом у межах амінокислот 21-131 в SEQ ID NO: 1, зв'язується з афінністю ≤ 4 нМ, виміряною за допомогою аналізу Скетчарда, або зв'язується з Ly6E з афінністю ≤ 7 нМ, виміряною за допомогою SPR, являє собою моноклональне антитіло. Відповідно до іншого варіанта здійснення таке антитіло являє собою людське, гуманізоване або химерне антитіло. Відповідно до одного варіанта здійснення антитіло, що зв'язується з епітопом у межах амінокислот 21-131 в SEQ ID NO: 1, зв'язується з афінністю ≤ 4 нМ, виміряною за допомогою аналізу Скетчарда, і інтерналізується в експресуючі Ly6E клітини при зв'язуванні із зазначеним епітопом у межах амінокислот 21-131 в SEQ ID NO: 1. Відповідно до іншого варіанта здійснення антитіло, що зв'язується з епітопом у межах амінокислот 21-131 в SEQ ID NO: 1, зв'язується з Ly6E з афінністю ≤ 7 нМ, виміряною за допомогою SPR, і інтерналізується в експресуючі Ly6E клітини при зв'язуванні із зазначеним епітопом у межах амінокислот 21-131 в SEQ ID NO: 1. Відповідно до одного варіанта здійснення антитіло, що зв'язується з епітопом у межах амінокислот 21-131 в SEQ ID NO: 1, зв'язується з афінністю ≤ 4 нМ, виміряною за допомогою аналізу Скетчарда, або зв'язується з Ly6E з афінністю ≤ 7 нМ, виміряною за допомогою SPR, причому антитіло містить (а) HVR-H3, що містить амінокислотну послідовність SEQ ID NO: 12, (b) HVR-L3, що містить амінокислотну послідовність SEQ ID NO: 9, і (с) HVR-H2, що містить амінокислотну послідовність SEQ ID NO: 11. Відповідно до іншого варіанта здійснення таке антитіло містить (а) HVR-H1, що містить амінокислотну послідовність SEQ ID NO: 10, (b) HVRH2, що містить амінокислотну послідовність SEQ ID NO: 11, і (с) HVR-H3, що містить амінокислотну послідовність SEQ ID NO: 12. Відповідно до ще одного варіанта здійснення описане вище антитіло додатково містить (а) HVR-L1, що містить амінокислотну послідовність SEQ ID NO: 7; (b) HVR-L2, що містить амінокислотну послідовність SEQ ID NO: 8; і (с) HVR-L3, що містить амінокислотну послідовність SEQ ID NO: 9. Відповіднодо ще одного варіанта здійснення таке антитіло містить (а) HVR-L1, що містить амінокислотну послідовність SEQ ID NO: 7; (b) HVR-L2, що містить амінокислотну послідовність SEQ ID NO: 8; і (с) HVR-L3, що містить амінокислотну послідовність SEQ ID NO: 9. Відповідно до одного варіанта здійснення антитіло, яке містить (а) HVR-H1, що містить амінокислотну послідовність SEQ ID NO: 10, (b) HVR-H2, що містить амінокислотну послідовність SEQ ID NO: 11, і (c) HVR-H3, що містить амінокислотну послідовність SEQ ID NO: 12, і (d) HVR-H1, що містить амінокислотну послідовність SEQ ID NO: 10, (е) HVR-H2, що містить 1 UA 114814 C2 5 10 15 20 25 30 35 40 амінокислотну послідовність SEQ ID NO: 11, і (f) HVR-H3, що містить амінокислотну послідовність SEQ ID NO: 12, додатково містить послідовність FR2 каркасної області варіабельного домена легкого ланцюга в SEQ ID NO: 20, або FR3 каркасної області варіабельного домена легкого ланцюга в SEQ ID NO: 21, або FR1 каркасної області варіабельного домена важкого ланцюга або SEQ ID NO: 23, або FR2 каркасної області варіабельного домена важкого ланцюга в SEQ ID NO: 24. Відповідно до одного варіанта здійснення антитіло, що зв'язується з епітопом у межах амінокислот 21-131 в SEQ ID NO: 1, зв'язується з афінністю ≤ 4 нМ, виміряною за допомогою аналізу Скетчарда, або зв'язується з Ly6E з афінністю ≤ 7 нМ, виміряною за допомогою SPR, і містить (а) послідовність VH, що характеризується щонайменше 95 % ідентичністю послідовності стосовно амінокислотної послідовності SEQ ID NO: 5; (b) послідовність VL, що характеризується щонайменше 95 % ідентичністю послідовності стосовно амінокислотної послідовності SEQ ID NO: 3; або (с) послідовність VH, як в (а) і послідовність VL, як в (b). Відповідно до іншого варіанта здійснення таке антитіло містить послідовність VH SEQ ID NO: 5. Відповідно до ще одного варіанта здійснення таке антитіло додатково містить послідовність VL SEQ ID NO: 3. Відповідно до одного варіанта здійснення антитіло, що зв'язується з епітопом у межах амінокислот 21-131 в SEQ ID NO: 1, зв'язується з афінністю ≤ 4 нМ, виміряною за допомогою аналізу Скетчарда, містить послідовність VH SEQ ID NO: 5 і послідовність VL SEQ ID NO: 3. Відповідно до іншого варіанта здійснення антитіло, що зв'язується з епітопом у межах амінокислот 21-131 в SEQ ID NO: 1, зв'язується з афінністю ≤ 7 нМ, виміряною за допомогою SPR, містить послідовність VH в SEQ ID NO: 5, і послідовність VL в SEQ ID NO: 3. Відповідно до одного варіанта здійснення антитіло, що зв'язується з епітопом у межах амінокислот 21-131 в SEQ ID NO: 1, зв'язується з афінністю ≤ 4 нМ, виміряною за допомогою аналізу Скетчарда, що являє собою IgG1, IgG2a або IgG2b. Відповідно до одного варіанта здійснення антитіло, що зв'язується з епітопом у межах амінокислот 21-131 в SEQ ID NO: 1, зв'язується з афінністю ≤ 7 нМ, виміряною за допомогою SPR, що являє собою IgG1, IgG2a або IgG2b. Відповідно до одного варіанта здійснення передбачені виділені нуклеїнові кислоти, що кодують описане в даному документі антитіло. Відповідно до іншого варіанта здійснення також передбачена клітина-хазяїн, що містить таку виділену нуклеїнову кислоту. Відповідно до ще одного варіанта здійснення також передбачений спосіб одержання антитіла, що включає культивування клітини-хазяїна, що містить описану в даному документі виділену нуклеїнову кислоту, у такий спосіб одержуючи антитіло. Відповідно до одного варіанта здійснення передбачений імунокон'югат, що містить описане в даному документі антитіло та цитотоксичний засіб. Відповідно до іншого варіанта здійснення такий імунокон'югат характеризується формулою Ab-(LD)р, де: (а) Ab являє собою описане в даному документі антитіло, (b) L являє собою лінкер; (с) D являє собою лікарський засіб, вибраний з майтанзиноїду, ауристатину, каліхеаміцину, піролобензодіазепіну та похідної неморубіцину; і (d) р перебуває в межах від 1 до 8. Відповідно до деяких варіантів здійснення такий імунокон'югат містить як D ауристатин. Відповідно до інших варіантів здійснення, такий імунокон'югат містить D, що характеризується формулою DE: R3 R7 O CH3 H N N N R2 N N O R4 R5 R6 R8 6 R8 O R18 O DE 5 де R і R кожний являє собою метил, R і R кожний являють собою ізопропіл, R являє 7 8 9 собою H, R являє собою втор-бутил, кожний R незалежно вибраний з СН3, O-СН3, ОН і Н; R 18 8 8 являє собою Н і R являє собою -C(R )2-C(R )2-арил. Відповідно до інших варіантів здійснення описаний у даному документі імунокон'югат містить як свій лікарський засіб MMAE, що характеризується структурою: 2 45 R9 3 H N N O 4 O H N N N O O 2 O O OH UA 114814 C2 Відповідно до одного варіанта здійснення описаний у даному документі імунокон'югат містить D, що являє собою піролобензодіазепін, який характеризується: Формулою A: 5 10 15 20 A; де пунктирні лінії вказують на необов'язкову присутність подвійного зв'язку між C1 і C2 або 2 D D С2 і С3; R незалежно вибирають з Н, ОН, =O, =СН2, CN, R, OR, =СН-R , =C(R )2, O-SO2-R, D CO2R і COR, і необов'язково додатково вибирають з галогену або дигалогену, причому R 6 9 незалежно вибирають з R, CO2R, COR, CHO, CO2H і галогену; R і R незалежно вибирають з Н, R, OH, OR, SR, SH, NH2, NHR, NRR', NO2, Me3Sn і галогену; R7 незалежно вибирають з Н, R, OH, 11 OR, SR, SH, NH2, NHR, NRR', NO2, Me3Sn і галогену; Q незалежно вибирають з О, S і NH; R являє собою або H, або R, або, де Q являє собою О, SO3M, де М являє собою катіон металу; R і R' кожний незалежно вибирають з необов'язково заміщеного C1-8 алкілу, С3-8 гетероциклічних і C5-20 арильних груп, і, необов'язково, стосовно групи NRR', R і R' разом із атомом азоту, до якого вони приєднані, утворюють необов'язково заміщене 4-, 5-, 6- або 7-членне гетероциклічне 12 16 19 17 2 6 9 7 кільце; R , R , R і R являють собою те саме, що визначено для R , R , R і R , відповідно; R" являє собою С3-12 алкіленову групу, ланцюг якої може бути перерваний одним або декількома гетероатомами й/або ароматичними кільцями, які являють собою необов'язково заміщені; і X і X' незалежно вибрані з O, S і N(H). Відповідно до деяких варіантів здійснення D описаного в даному документі імунокон'югату характеризується структурою: де n дорівнює 0 або 1. Відповідно до одного варіанта здійснення D описаного в даному документі імунокон'югату являє собою похідну неморубіцину. Відповідно до іншого варіанта здійснення D характеризується структурою, вибраною з: O NH O N OH OH OH O O OH O O N O O O 25 3 і UA 114814 C2 O OH O OH O O OH O O N O O O 5 10 . Відповідно до одного варіанта здійснення описаний у даному документі імунокон'югат містить лінкер, який розщеплюється за допомогою протеази. Відповідно до інших варіантів здійснення лінкер містить дипептид val-cit або дипептид Phe-Lys. Відповідно до ще одного варіанта здійснення імунокон'югат містить лінкер, який являє собою кислотно-лабільний. Відповідно до інших варіантів здійснення лінкер містить гідразон. Відповідно до одного варіанта здійснення імунокон'югат характеризується формулою, вибраною з: в якій S являє собою атом сірки; 4 UA 114814 C2 ; ; 5 UA 114814 C2 ;і 5 10 . Відповідно до деяких варіантів здійснення р перебуває в діапазоні від 2 до 5. Відповідно до одного варіанта здійснення описаний у даному документі імунокон'югат згідно з даним винаходом містить антитіло, яке містить (а) HVR-H1, що містить амінокислотну послідовність SEQ ID NO: 10, (b) HVR-H2, що містить амінокислотну послідовність SEQ ID NO: 11, (c) HVR-H3, що містить амінокислотну послідовність SEQ ID NO: 12, (d) HVR-L1, що містить амінокислотну послідовність SEQ ID NO: 7; (е) HVR-L2, що містить амінокислотну послідовність SEQ ID NO: 8; і (f) HVR-L3, що містить амінокислотну послідовність SEQ ID NO: 9. Відповідно до 6 UA 114814 C2 5 10 15 20 25 30 35 40 45 50 55 60 іншого варіанта здійснення описаний у даному документі імунокон'югат згідно з даним винаходом містить послідовність VH SEQ ID NO: 5 і послідовність VL SEQ ID NO: 3. Відповідно до одного варіанта здійснення передбачений фармацевтичний склад, що містить описаний у даному документі імунокон'югат згідно з даним винаходом, і фармацевтично прийнятний носій. Відповідно до деяких варіантів здійснення фармацевтичний склад додатково містить додатковий терапевтичний засіб. Відповідно до деяких варіантів здійснення додатковий терапевтичний засіб являє собою хіміотерапевтичний засіб, такий як, наприклад, комплекс платини. Відповідно до одного варіанта здійснення передбачені способи лікування індивідуума, що характеризується наявністю Ly6E-позитивного раку. Відповідно до деяких варіантів здійснення такі способи включають введення фармацевтичної композиції, яка містить описаний у даному документі імунокон'югат згідно з даним винаходом, що містить антитіло, яке зв'язується з Ly6E, наприклад, як описано в даному документі. Відповідно до інших варіантів здійснення Ly6Eпозитивний рак вибирають з раку молочної залози, раку підшлункової залози, раку товстої кишки, раку товстої та прямої кишок, меланоми, раку яєчників, не дрібноклітинного раку легені або раку шлунка. Відповідно до деяких варіантів здійснення спосіб згідно з даним винаходом включає введення індивідуумові додаткового терапевтичного засобу. Відповідно до деяких варіантів здійснення додатковий терапевтичний засіб являє собою хіміотерапевтичний засіб, такий як, наприклад, комплекс платини. Відповідно до деяких варіантів здійснення передбачені способи інгібування проліферації Ly6E-позитивних клітин. Відповідно до одного варіанта здійснення такі способи включають експонування Ly6E-позитивних клітин з описаним у даному документі імунокон'югатом згідно з даним винаходом, що містить антитіло, яке зв'язується з Ly6E в умовах, що дозволяють зв'язування імунокон'югату з Ly6E на поверхні клітини. Відповідно до деяких варіантів здійснення антитіло, що зв'язується з Ly6E, являє собою описане в даному документі антитіло. Відповідно до деяких варіантів здійснення проліферація Ly6E-позитивної клітини, таким чином, інгібується. Відповідно до деяких варіантів здійснення клітина являє собою злоякісну клітину молочної залози, злоякісну клітину підшлункової залози, злоякісну клітину товстої кишки, злоякісну клітину товстої та прямої кишок, клітину меланоми, злоякісну клітину яєчника, клітину не дрібноклітинного раку легені або злоякісну клітину шлунка. Відповідно до одного варіанта здійснення описане в даному документі антитіло, що зв'язується з Ly6E, кон'юговане з міткою. Відповідно до деяких варіантів здійснення, така мітка являє собою позитронний емітер. Відповідно до деяких варіантів здійснення позитронний емітер 89 являє собою Zr. Відповідно до деяких варіантів здійснення передбачений спосіб виявлення людського Ly6E у біологічному зразку. Відповідно до деяких варіантів здійснення такий спосіб включає контактування біологічного зразка з антитілом до Ly6E в умовах, що дозволяють зв'язування антитіла до Ly6E з людським Ly6E, що зустрічається у природі, і виявлення того, чи утвориться комплекс між антитілом до Ly6E і людським Ly6E, що зустрічається у природі, у біологічному зразку. Відповідно до деяких варіантів здійснення антитіло до Ly6E являє собою описане в даному документі антитіло. Відповідно до деяких варіантів здійснення біологічний зразок являє собою зразок раку молочної залози, зразок раку підшлункової залози, зразок раку товстого кишечнику, зразок раку товстої та прямої кишок, зразок меланоми, зразок раку яєчників, зразок не дрібноклітинного раку легені або зразок раку шлунка. Відповідно до одного варіанта здійснення передбачений спосіб виявлення Ly6E-позитивного раку. Відповідно до таких варіантів здійснення спосіб включає (i) введення міченого антитіла до Ly6E суб'єкта, який характеризується наявністю або можливою наявністю Ly6E-позитивного раку, і (ii) виявлення міченого антитіла до Ly6E у суб'єкта, причому виявлення міченого антитіла до Ly6E вказує на наявність Ly6E-позитивного раку в суб'єкта. Відповідно до деяких варіантів здійснення антитіло до Ly6E являє собою описане в даному документі антитіло. Відповідно до інших варіантів здійснення Ly6E-позитивний рак вибирають з раку молочної залози, раку підшлункової залози, раку товстого кишечнику, раку товстої та прямої кишок, меланоми, раку яєчників, не дрібноклітинного раку легені або раку шлунка. Відповідно до одного варіанта здійснення описаного в даному документі способу описане в даному документі антитіло, що зв'язується з Ly6E, кон'югують з міткою. Відповідно до деяких варіантів здійснення, така мітка являє собою позитронний емітер. Відповідно до деяких варіантів здійснення позитронний емітер 89 являє собою Zr. Відповідно до деяких варіантів здійснення передбачене виділене антитіло, що зв'язується з Ly6E, для використання як лікарський засіб. Відповідно до інших варіантів здійснення винаходу антитіло, що зв'язується з Ly6E, зв'язується з епітопом у межах амінокислот 21-131 в SEQ ID 7 UA 114814 C2 5 10 15 20 25 30 35 40 45 50 55 60 NO: 1. Відповідно до іншого варіанта здійснення таке антитіло зв'язується з Ly6E з афінністю ≤ 4 нМ, вимірюваної за допомогою аналізу Скетчарда. Відповідно до іншого варіанта здійснення таке антитіло зв'язується з Ly6E з афінністю ≤ 7 нМ, вимірюваної за допомогою SPR. Відповідно до ще одного варіанта здійснення таке антитіло використовується для лікування Ly6Eпозитивного раку. Відповідно до деяких варіантів здійснення таке антитіло використовують для інгібування проліферації в клітині Ly6E-позитивного раку. Відповідно до деяких варіантів здійснення клітина Ly6E-позитивного раку являє собою клітину раку молочної залози, клітину раку підшлункової залози, клітину раку товстого кишечнику, клітину раку товстої та прямої кишок, клітини меланоми, клітину раку яєчника, клітину не дрібноклітинного раку легені або клітину раку шлунка. Відповідно до деяких варіантів здійснення використання такого описаного в даному документі антитіла застосовується у виробництві лікарського засобу. Відповідно до іншого варіанта здійснення таке застосування для лікарського засобу використовується для лікування Ly6E-позитивного раку. Відповідно до ще одного варіанта здійснення винаходу таке застосування використовується для інгібування проліферації в клітині Ly6E-позитивного раку. Відповідно до деяких варіантів здійснення клітина Ly6E-позитивного раку являє собою злоякісну клітину молочної залози, злоякісну клітину підшлункової залози, злоякісну клітину товстої кишки, злоякісну клітину товстої та прямої кишок, клітину меланоми, злоякісну клітину яєчника, клітину не дрібноклітинного раку легені або злоякісну клітину шлунка. Короткий опис креслень На фіг.1 показане порівняння вирівнювання послідовностей ортологів Ly6E від видів людини (SEQ ID NO:1), макаки (SEQ ID NO:2), макаки-резусу (SEQ ID NO:35), миші (SEQ ID NO:36) та пацюка (SEQ ID NO:37). Показано, що відсоток ідентичності на амінокислотному рівні між цими послідовностями у позаклітинному домені (ECD) становить ~ 96 % між Ly6E людини та макаки і ~ 52 % між Ly6E людини та пацюка. На фіг. 2 показаний профіль Genelogic експресії мРНК Ly6E, як додатково описано у прикладі 1. Вимірювання проводилися на чипі Affymetrix U133P і виражаються як розходження масштабованих середніх в експресії Ly6E у тканинах людини. Кожна точка представляє нормальний (зелений), пухлинний (червоний) або патологічний не пухлинний (синій) зразок тканини людини. Прямокутники охоплюють діапазон від 25 до 75 процентилей для кожного розподілу. WBC = лейкоцити. Надекспресія Ly6E видна при раку молочної залози, підшлункової залози, товстої та прямої кишок, легенів, меланоми й яєчників, серед інших. На фіг. 3a зображена відносна кратна зміна ПЛР у реальному часі експресії транскрипта Ly6E, нормована до експресії контрольного гена RPL19 у панелі нормальних тканин людини та вибраних клітинних ліній і тканин злоякісних пухлин, як описано у прикладі 2. Отримані результати свідчать про те, що експресія транскрипта Ly6E у нормальних тканинах низька, у порівнянні з експресією Ly6E при раку молочної залози та підшлункової залози. На фіг. 4 показане вирівнювання послідовності варіабельного домена легкого ланцюга гуманізованого антитіла до Ly6E (hu9B12.v12), у порівнянні з химерним антитілом до Ly6E (xLy6E mu9B12) і консенсусною послідовністю каппа I людини (Kappa I consensus). Положення амінокислот, які відрізняються від людських консенсусних кістяків, зафарбовані сірим кольором. Області, які були передані для утворення щеплення CDR, обведені. Положення нумеруються відповідно до Kabat. На фіг. 5 показане вирівнювання послідовності варіабельного домена важкого ланцюга гуманізованого антитіла до Ly6E (hu9B12.v12), у порівнянні з химерним антитілом до Ly6E (xLy6E mu9B12) і консенсусною послідовністю VH2 людини (VH2 consensus). Положення амінокислот, які відрізняються від людських консенсусних кістяків, зафарбовані сірим кольором. Області, які були передані для утворення щеплення CDR, обведені. Положення нумеруються відповідно до Kabat. На фіг. 6 показане вирівнювання послідовності варіабельного домена важкого ланцюга гуманізованого антитіла до Ly6E (hu9B12.v12), у порівнянні з химерним антитілом до Ly6E (xLy6E mu9B12) і консенсусною послідовністю VH3 людини (VH3 consensus). Положення амінокислот, які відрізняються від людських консенсусних кістяків, зафарбовані сірим кольором. Області, які були передані для утворення щеплення CDR, обведені. Положення нумеруються відповідно до Kabat. На фіг. 7 показана ефективність in vivo ADC до Ly6E у ксенотрансплантній мишачій моделі, як описано у прикладі 7. На панелі А показані підшкірні пухлини, встановлені в імунодефіцитних мишей, щеплених клітинами HCC1569 × 2 раку молочної залози. Коли об'єми пухлин досягали 3 приблизно 100-250 мм (день 0), тваринам вводили однократну ін'єкцію IV або контрольних ADC (контроль-vc-MMAE), або гуманізованих ADC (MC-VC-PAB-ММАЕ) до Ly6E (V12) hu9B12 у зазначених дозах. Середні об'єми пухлин зі стандартними відхиленнями були визначені від 9 8 UA 114814 C2 5 10 15 20 25 30 35 40 45 50 55 60 тварин на групу (зазначено на графіку). На панелі В показана поверхнева експресія білка Ly6E у живих клітинах HCC1569 × 2, як видно за допомогою проточної цитометрії, де сірий пік показує клітини, оброблені тільки вторинним реагентом для виявлення, а чорний пік показує клітини, оброблені з 3 мкг/мл Ly6E антитіла (hu9B12 v12) ADC з наступною обробкою з Alexafluor 488, кон'югованим з IgG людини як вторинний реагент виявлення. Експресія Ly6E як значення GeoMean відображається у правій частині гістограми. На панелі С показана загибель клітин за допомогою титрування ADC hu9B12 v12 для клітинної лінії HCC1569 × 2 раку молочної залози. Зазначені концентрації ADC hu9B12 v12, контрольних IgG-vc-MMAE або еквівалентна кількість контрольного несучого розчину PBS інкубували з клітинами протягом 5 днів, і відносну життєздатність клітин (у-вісь) оцінювали з використанням CellTiter-Glo. На фіг. 8 показана ефективність in vivo ADC до Ly6E у ксенотрансплантній мишачій моделі. На панелі А показані підшкірні пухлини, встановлені в імунодефіцитних мишей, щеплених клітинами злоякісної пухлини підшлункової залози SU.86.86. Коли об'єми пухлин досягали 3 приблизно 100-250 мм (день 0), тваринам вводили однократну ін'єкцію IV або контрольних ADC (контроль-vc-MMAE), або ADC у зазначених дозах. Середні об'єми пухлин зі стандартними відхиленнями були визначені від 9 тварин на групу (зазначено на графіку). На панелі В показане порівняння загальної білкової експресії Ly6E у клітинних лізатах HCC1569 × 1 і SU.86.86 за допомогою імуноблоттингу. Білковий вміст усього β-актину вимірювали у паралелі для забезпечення контролів, що вводять. На панелі С показана загибель клітин за допомогою титрування ADC Ly6E для клітинної лінії раку підшлункової залози SU.86.86. Зазначені концентрації ADC до Ly6E, контрольних IgG-VC-MMAE або еквівалентну кількість контрольного несучого розчину PBS інкубували з клітинами протягом 5 днів, і відносну життєздатність клітин (у-вісь) оцінювали з використанням CellTiter-Glo. На панелі D показане фарбування 1+Ly6E на клітинному осаді SU.86.86 за допомогою імуногістохімії. На фіг. 9 показана ефективність in vivo ADC до Ly6E у первинній ксенотрансплантній моделі раку молочної залози HBCx-9, установлена на XenTech (Evry, Франція). На панелі А показані підшкірні пухлини, встановлені в імунодефіцитних мишей з імплантованим пухлинним матеріалом від пацієнта з раком молочної залози. Коли об'єми пухлин досягали приблизно 1003 250 мм (день 0), тваринам вводили однократну ін'єкцію IV або контрольних ADC (контроль-vcMMAE), або ADC до Ly6E у зазначених дозах. Середні об'єми пухлин зі стандартними відхиленнями визначали від 9 тварин на групу (зазначено на графіку). На панелі В показане порівняння загальної білкової експресії Ly6E у різних первинних пухлинних моделях XenTech й у клітинних лізатах HCC1569 × 1 і SU.86.86 за допомогою імуноблоттингу. Білковий вміст усього β-актину вимірювали у паралелі для забезпечення контролів, що вводять. На панелі С показане фарбування Ly6E на пухлинах HBCx-9 за допомогою імуногістохімії. Незалежне фарбування множинних зразків пухлин показало гетерогенні паттерни фарбування. Зазначено відсоток фарбування пухлинних клітин на рівні 1+ для Ly6E. На фіг. 10 показана ефективність in vivo ADC до Ly6E у первинній ксенотрансплантній моделі раку молочної залози HBCx-8, установлена на XenTech (Evry, Франція). На панелі А показані підшкірні пухлини, встановлені в імунодефіцитних мишей з імплантованим пухлинним матеріалом від пацієнта з раком молочної залози. Коли об'єми пухлин досягали приблизно 1003 250 мм (день 0), тваринам вводили однократну ін'єкцію IV або контрольних ADC (контроль-vcMMAE), або ADC до Ly6E у зазначених дозах. Середні об'єми пухлин зі стандартними відхиленнями визначали від 10 тварин на групу (зазначено на графіку). На панелі В показане порівняння загальної білкової експресії Ly6E у різних первинних пухлинних моделях XenTech й у клітинних лізатах HCC1569 × 1 і SU.86.86 за допомогою імуноблоттингу. Білковий вміст усього β-актину вимірювали у паралелі для забезпечення контролів, що вводять. На панелі С показане фарбування Ly6E на пухлинах HBCx-8 за допомогою імуногістохімії. Незалежне фарбування множинних зразків пухлин показало гетерогенні паттерни фарбування. Зазначено відсоток фарбування пухлинних клітин на рівні 1+ або 2+. На фіг. 11 показана ефективність in vivo ADC до Ly6E у первинній ксенотрансплантній моделі раку молочної залози MAXF-1162, установлена на Oncotest Gmb (Freiburg, Germany). На панелі А показані підшкірні пухлини, встановлені в імунодефіцитних мишей з імплантованим пухлинним матеріалом від пацієнта з раком молочної залози. Коли об'єми пухлин досягали 3 приблизно 100-250 мм (день 0), тваринам вводили однократну ін'єкцію IV або контрольних ADC (контроль-vc-MMAE), або ADC до Ly6E у зазначених дозах. Середні об'єми пухлин зі стандартними відхиленнями визначали від 10 тварин на групу (зазначено на графіку). На панелі В показане порівняння загальної білкової експресії Ly6E у різних первинних пухлинних моделях Oncotest й у клітинних лізатах за допомогою імуноблоттингу. Білковий вміст усього GAPDH вимірювали у паралелі для забезпечення контролю завантаження. На панелі С показане 9 UA 114814 C2 5 10 15 20 25 30 35 40 45 50 55 60 фарбування Ly6E на пухлинах MAXF-1162 за допомогою імуногістохімії. Незалежне фарбування множинних зразків пухлин показало гетерогенні паттерни фарбування. Зазначено відсоток фарбування пухлинних клітин на рівні 1+ або 2+ для Ly6E. На фіг. 12 показана ефективність in vivo ADC до Ly6E у первинній ксенотрансплантній моделі раку підшлункової залози PAXF-1657, установлена на Oncotest Gmb (Freiburg, Germany). На панелі А показані підшкірні пухлини, встановлені в імунодефіцитних мишей з імплантованим пухлинним матеріалом від пацієнта зі злоякісною пухлиною підшлункової залози. Коли об'єми 3 пухлин досягали приблизно 100-250 мм (день 0), тваринам вводили однократну ін'єкцію IV або контрольних ADC (контроль-vc-MMAE), або ADC до Ly6E у зазначених дозах. Середні об'єми пухлин зі стандартними відхиленнями визначали від 10 тварин на групу (зазначено на графіку). На панелі В показане порівняння загальної білкової експресії Ly6E у різних первинних пухлинних моделях Oncotest й у клітинних лізатах за допомогою імуноблоттингу. Білковий вміст усього GAPDH вимірювали у паралелі для забезпечення контролів, що вводять. На панелі С показане фарбування Ly6E на пухлинах PAXF-1657 за допомогою імуногістохімії. Незалежне фарбування множинних зразків пухлин показало гетерогенні паттерни фарбування. Зазначено відсоток фарбування пухлинних клітин на дуже слабкому (+/-) рівні для Ly6E. На фіг. 13 показане порівняння ефективності in vivo різних кон'югатів ADC до Ly6E у мишачій ксенотрансплантній моделі. На всіх панелях A, B і C показані підшкірні пухлини, встановлені в імунодефіцитних мишей з клітинною лінією злоякісної пухлини підшлункової залози SU.86.86. 3 Коли об'єми пухлин досягали приблизно 100-250 мм (день 0), тваринам вводили однократну ін'єкцію IV 1mpk або контрольних ADC (контроль-vc-MMAE), або ADC до Ly6E, як показано на графіках. Середні об'єми пухлин зі стандартними відхиленнями були визначені від 10 тварин на групи (зазначено на графіку). На панелі D показане фарбування Ly6E 1+ на клітинному осаді SU.86.86 за допомогою імуногістохімії. Докладний опис винаходу I. Визначення "Акцепторна каркасна область людини" для цілей даного винаходу являє собою каркасну область, що містить амінокислотну послідовність каркасної області варіабельного домена легкого ланцюга (VL) або каркасної області варіабельного домена важкого ланцюга (VH), отриманої з каркасної області людського імуноглобуліну або консенсусної каркасної області людини, як це визначено нижче. Акцепторна каркасна область людини "отримана з" каркасної області людського імуноглобуліну або консенсусної каркасної області людини, може містити ту саму амінокислотну послідовність або вона може містити зміни амінокислотної послідовності. Відповідно до деяких варіантів здійснення кількість амінокислотних змін становить 10 або менше, 9 або менше, 8 або менше, 7 або менше, 6 або менше, 5 або менше, 4 або менше, 3 або менше, або 2 або менше. Відповідно до деяких варіантів здійснення акцепторна каркасна область людини VL ідентична по послідовності VL послідовності каркасної області людського імуноглобуліну або послідовності консенсусної каркасної області людини. "Афінність" відноситься до сили сукупності всіх не ковалентних взаємодій між одним сайтом зв'язування молекули (наприклад, антитілом) і його партнером по зв'язуванню (наприклад, антигеном). Якщо не зазначено інше, використовувана в даному документі "афінність зв'язування" відноситься до внутрішньої афінності зв'язування, що відображає взаємодію 1:1 між представниками єднальної пари (наприклад, антитілом й антигеном). Афінність молекули X до свого партнера Y у загальному випадку може бути представлена константою дисоціації (Kd). Афінність може бути виміряна за допомогою звичайних методів, відомих у даній області техніки, у тому числі за допомогою тих, які описані в даному документі. Конкретні ілюстративні та зразкові варіанти здійснень для вимірювання афінності зв'язування описані нижче. Антитіло з "дозрілою афінністю" відноситься до антитіла з одним або декількома змінами в одній або декількох гіперваріабельних областях (HVR), у порівнянні з вихідним антитілом, що не має такі зміни, такі зміни призводять до поліпшення афінності антитіла до антигену. Терміни "антитіло до Ly6E" й "антитіло, що зв'язується з Ly6E" відносяться до антитіла, яке здатне зв'язуватися з Ly6E з достатньою афінністю, такою, що антитіло являє собою застосовне в якості діагностичного та/або терапевтичного засобу для цілеспрямованого впливу на Ly6E. Відповідно до одного варіанта здійснення ступінь зв'язування антитіла до Ly6E з неспорідненим не-Ly6E білком становить менше ніж приблизно 10 % від зв'язування антитіла з Ly6E, що виміряне, наприклад, за допомогою радіоімуноаналізу (RIA) або аналізу Скетчарда, або за допомогою поверхневого плазмонного резонансу, такого як, наприклад, Biacore. Відповідно до деяких варіантів здійснення антитіло, яке зв'язується з Ly6E, характеризується константою дисоціації (Kd) ≤1 мкМ, ≤100 нМ, ≤ 10 нМ, ≤1 нМ, ≤ 0,1 нМ, ≤0,01 нМ, або ≤0,001 нМ (наприклад, -8 -8 -13 -9 -13 10 М або менш, наприклад, від 10 М до 10 М, наприклад, від 10 М до 10 М). Відповідно 10 UA 114814 C2 5 10 15 20 25 30 35 40 45 50 55 60 до деяких варіантів здійснення антитіло до Ly6E зв'язується з епітопом Ly6E, що являє собою консервативний серед Ly6E від різних видів. Термін "антитіло" у даному документі використовується в самому широкому сенсі й охоплює різні структури антитіл, що включають у себе без обмеження моноклональні антитіла, поліклональні антитіла, мультиспецифічні антитіла (наприклад, біспецифічні антитіла) і фрагменти антитіл за умови, що вони проявляють бажану антигенсполучну активність. Використовуваний у даному документі термін "кон'югат антитіла з лікарським засобом" (ADC) еквівалентний терміну "імунокон'югат". "Фрагмент антитіла" відноситься до молекули, відмінної від інтактного антитіла, що містить частину інтактного антитіла, що зв'язується з антигеном, з яким зв'язується інтактне антитіло. Приклади фрагментів антитіл містять у собі без обмеження Fv, Fab, Fab', Fab'-SH, F(аb')2; діатіла; лінійні антитіла; одноланцюгові молекули антитіл (наприклад, scFv) і мультиспецифічні антитіла, утворені з фрагментів антитіл. "Антитіло, що зв'язується з тим самим епітопом" як еталонне антитіло відноситься до антитіла, що блокує зв'язування еталонного антитіла зі своїм антигеном у конкурентному аналізі на 50 % або більше, і, навпаки, еталонне антитіло блокує зв'язування антитіла з його антигеном у конкурентному аналізі на 50 % або більше. Ілюстративний конкурентний аналіз передбачений у даному документі. Терміни "злоякісна пухлина" та "злоякісний" відносяться або описують фізіологічний стан у ссавців, що зазвичай характеризується нерегульованим клітинним ростом/проліферацією. Приклади злоякісної пухлини містять у собі без обмеження карциному, лімфому (наприклад, хворобу Ходжкіна та неходжкінську лімфому), бластому, саркому та лейкоз. Більш конкретні приклади таких злоякісних пухлин містять у собі злоякісну пухлину, при якій відбувається надекспресія Ly6E, що може містити в собі, наприклад, рак молочної залози і/або метастатичний рак молочної залози, у тому числі Her2-негативний рак молочної залози і/або потрійний негативний рак молочної залози, рак підшлункової залози, рак товстої кишки, рак товстої та прямої кишок, меланому, рак яєчників, не дрібноклітинний рак легені (або плоскоклітинний і/або не плоскоклітинний), рак шлунка, плоскоклітинний рак, дрібноклітинний рак легенів, аденокарциному легенів, плоскоклітинний рак легенів, рак черевної порожнини, гепатоцелюлярний рак, рак шлунково-кишкового тракту, гліому, рак шийки матки, рак печінки, рак сечового міхура, гематому, карциному ендометрію або матки, карциному слинних залоз, рак нирок, рак печінки, рак передміхурової залози, рак вульви, рак щитовидної залози, карциному печінки, лейкоз і інші лімфопроліферативні порушення, а також різні типи раку голови та шиї. Термін "химерне" антитіло відноситься до антитіла, в якому частина важкого та/або легкого ланцюга походить з певного джерела або виду, у той час як частина, що залишилася, важкого та/або легкого ланцюга походить від іншого джерела або виду. Використовуваний у даному документі термін "цитотоксичний засіб" відноситься до речовини, що інгібує або запобігає клітинній функції та/або викликає загибель клітин або руйнування. Цитотоксичні засоби містять у собі без обмеження радіоактивні ізотопи (наприклад, 211 131 125 90 186 188 153 212 32 212 At , I , I , Y , Re , Re , Sm , Bi , Р , Pb і радіоактивні ізотопи Lu); хіміотерапевтичні засоби або лікарські засоби (наприклад, метотрексат, адріаміцин, алкалоїди барвінку (вінкристин, вінбластин, етопозид), доксорубіцин, мелфалан, мітоміцин C, хлорамбуцил, даунорубіцин або інші інтеркалуючі засоби); інгібуючі ріст засоби; ферменти та їх фрагменти, такі як нуклеолітичні ферменти; антибіотики; такі токсини, як низькомолекулярні токсини або ферментативно активні токсини бактеріального, грибного, рослинного або тваринного походження, що включають у себе їхні фрагменти та/або їхні варіанти; і різні протипухлинні або протиракові засоби, описані нижче. "Ефекторні функції" означають ті біологічні активності, що відносяться до Fc-області антитіла, які змінюються з ізотипом антитіл. Приклади ефекторних функцій антитіла містять у собі: зв'язування C1q і комплемент-залежну цитотоксичність (CDC); зв'язування Fc рецептора; антитіло-залежну клітинно-опосередковану цитотоксичність (ADCC); фагоцитоз; понижуючу регуляцію рецепторів клітинної поверхні (наприклад, рецепторів В-клітин) й активацію В-клітин. Термін "ефективна кількість" засобу, наприклад, фармацевтичної композиції, відноситься до кількості, ефективній в дозах і протягом періодів часу, необхідних для досягнення бажаного терапевтичного або профілактичного результату. Термін "епітоп" відноситься до конкретного сайту на молекулі антигену, з яким зв'язується антитіло. Термін "Fc-область" у даному документі використовується для визначення С-кінцевої області важкого ланцюга імуноглобуліну, що містить щонайменше частину константної області. Цей термін містить у собі нативну послідовність Fc областей і варіантні Fc області. Відповідно 11 UA 114814 C2 5 10 15 20 25 30 35 40 45 50 55 60 до одного варіанта здійснення Fc-область важкого ланцюга IgG людини простягається від Cys226 або від Pro230 до карбоксильного кінця важкого ланцюга. Проте, С-кінцевий лізин (Lys447) області Fc може бути присутнім чи ні. Якщо в даному документі не зазначено інше, нумерація амінокислотних залишків в області Fc або в константній області відповідає системі нумерації EU, також називаній як індекс EU, як описано в Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD, 1991. "Каркасна область" або "FR" відноситься до залишків варіабельного домена, відмінним від залишків гіперваріабельної області (HVR). FR варіабельного домена, як правило, складається з чотирьох доменів FR: FR1, FR2, FR3 і FR4. Відповідно, послідовності HVR і FR, як правило, з'являються у наступній послідовності в VH (або VL): FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4. Терміни "повнорозмірне антитіло", "інтактне антитіло" та "ціле антитіло" використовуються в даному документі взаємозамінно для позначення антитіла, що характеризується структурою, по суті аналогічній структурі нативного антитіла, або містить важкі ланцюги, які містять певну в даному документі Fc-область. Терміни "клітина-хазяїн", "клітинна лінія-хазяїн" і "клітинна культура-хазяїн" використовуються взаємозамінно та відносяться до клітин, у які вводять екзогенну нуклеїнову кислоту, що включають у себе потомство таких клітин. Клітини-хазяїни містять у собі "трансформанти" і "трансформовані клітини", які містять у собі первинні трансформовані клітини та потомство, отримане від них, незалежно від числа пасажів. Потомство може не бути повністю ідентичним за вмістом нуклеїнових кислот стосовно батьківської клітини, але може містити мутації. Мутантне потомство, що характеризується наявністю тієї самої функції або біологічної активності, як піддане скринінгу або вибране у первісно трансформованій клітині, включено в даний документ. "Людське антитіло" являє собою те, яке має амінокислотну послідовність, що відповідає такій антитіла, продукованого в організмі людини або клітині людини, або отриманого з відмінного від людського джерела, який використовує репертуар антитіл людини або інші кодуючі антитіла людини послідовності. Це визначення людського антитіла спеціально виключає гуманізоване антитіло, що містить відмінні від людини антигенсполучні залишки. "Консенсусна каркасна область людини" являє собою каркасну область, що являє собою амінокислотні залишки, що найбільше часто зустрічаються, у виборі послідовностей каркасної області VL або VH імуноглобуліну людини. Як правило, вибір послідовностей VL або VH імуноглобуліну людини походить з підгрупи послідовностей варіабельного домена. Взагалі, підгрупа послідовностей являє собою підгрупу, як в Kabat et al., Sequences of Proteins of Immunological Interest, Fifth Edition, NIH Publication 91-3242, Bethesda MD (1991), vols. 1-3. Відповідно до одного варіанта здійснення для VL підгрупа являє собою підгрупу каппа I, як в Kabat et al., вище. Відповідно до одного варіанта здійснення для VH підгрупа являє собою підгрупу III, як в Kabat et al., вище. "Гуманізоване" антитіло відноситься до химерного антитіла, що містить амінокислотні залишки з відмінних від людських HVR й амінокислотні залишки від людських FR. Відповідно до деяких варіантів здійснення гуманізоване антитіло буде містити по суті всі з щонайменше одного, а зазвичай двох варіабельних доменів, у яких всі або по суті всі з HVR (наприклад, CDR) відповідають таким з відмінного від людського антитіла, і всі або по суті всі FR відповідають таким з людського антитіла. Гуманізоване антитіло необов'язково може містити щонайменше частину константної області антитіла, отриманої від людського антитіла. "Гуманізована форма" антитіла, наприклад, відмінна від людського антитіла, відноситься до антитіла, що піддалося гуманізації. Використовуваний у даному документі термін "гіперваріабельна область" або "HVR" відноситься до кожної з областей варіабельного домена антитіла, які являють собою гіперваріабельні у послідовності й/або утворюють структурно визначені петлі ("гіперваріабельні петлі"). Як правило, нативні чотириланцюгові антитіла включають шість HVR; три в VH (H1, H2, H3) і три в VL (L1, L2, L3). HVR зазвичай містять амінокислотні залишки від гіперваріабельних петель і/або з "визначальних компліментарність областей" (CDR), причому останні характеризуються найвищою мінливістю послідовності та/або беруть участь у розпізнаванні антигену. Ілюстративні гіперваріабельні петлі відбуваються в амінокислотних залишках 26-32 (L1), 50-52 (L2), 91-96 (L3), 26-32 (H1), 53-55 (Н2) і 96-101 (Н3), (Chothia and Lesk, J. Mol. Biol. 196:901-917 (1987)). Ілюстративні CDR (CDR-L1, CDR-L2, CDR-L3, CDR-H1, CDR-H2 і CDR-H3) відбуваються в амінокислотних залишках 24-34 в L1, 50-56 в L2, 89-97 в L3, 31-35B у Н1, 50-65 у Н2, 95-102 у Н3. (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991).) За винятком CDR1 в VH, CDR, як 12 UA 114814 C2 5 10 15 20 25 30 35 40 45 50 55 60 правило, містять амінокислотні залишки, які утворюють гіперваріабельні петлі. CDR також містять "залишки, що визначають специфічність" або "SDR", які являють собою залишки, які контактують з антигеном. SDR містяться в областях CDR, називаних скорочено CDR або а-CDR. Ілюстративні а-CDR (aCDR-L1-,a-CDR-L2,a-CDR-L3,a-CDR-H1,a-CDR-H2 й a-CDR-H3) відбуваються в амінокислотних залишках 31-34 в L1, 50-55 в L2, 89-96 в L3, 31-35B у Н1, 50-58 у Н2 і 95-102 у Н3. (Дивитеся Almagro and Fransson, Front. Biosci. 13:1619-1633 (2008).). Якщо не зазначено інше, залишки HVR й інші залишки у варіабельному домені (наприклад, залишки FR) нумеруються в даному документі відповідно до Kabat et al., вище. "Імунокон'югат" являє собою антитіло, кон'юговане з однією або декількома гетерологічними молекулами, що включають у себе без обмеження цитотоксичний засіб. Імунокон'югат являє собою синонімом терміна "кон'югат антитіла з лікарським засобом" (ADC). "Індивідуум" або "суб'єкт" являє собою ссавця. Ссавці містять у собі без обмеження свійських тварин (наприклад, корів, овець, кішок, собак і коней), приматів (наприклад, людиноподібних і не людиноподібних приматів, таких як мавпи), кроликів і гризунів (наприклад, мишей і пацюків). Відповідно до деяких варіантів здійснення індивідуум або суб'єкт являє собою людину. "Виділене" антитіло являє собою антитіло, що було відділено від компонента його природного навколишнього середовища. Відповідно до деяких варіантів здійснення антитіло очищають більш ніж на 95 % або на 99 % чистоти, як визначено, наприклад, електрофоретично (наприклад, за допомогою СДС-ПААГ, ізоелектричного фокусування (ІЕФ), капілярного електрофорезу) або хроматографічно (наприклад, за допомогою іонообмінної або зворотнофазової ВЕРХ). Для огляду способів оцінки чистоти антитіл, дивитеся, наприклад, Flatman et al., J. Chromatogr. B 848:79-87 (2007). "Виділена" нуклеїнова кислота відноситься до молекули нуклеїнової кислоти, що була відділена від компонента її природного навколишнього середовища. Виділена нуклеїнова кислота містить у собі молекулу нуклеїнової кислоти, що міститься в клітинах, які зазвичай містять молекулу нуклеїнової кислоти, але молекула нуклеїнової кислоти присутня поза хромосомою або в хромосомній локації, яка відрізняється від своєї природної хромосомної локації. "Виділена нуклеїнова кислота, що кодує антитіло до Ly6E" відноситься до однієї або декількох молекул нуклеїнової кислоти, що кодує важкі та легкі ланцюги антитіл (або їхні фрагменти), що включають у себе таку молекулу(и) нуклеїнової кислоти в одному векторі або окремих векторах, і така молекула(и) нуклеїнової кислоти присутня в одній або декількох локаціях у клітині-хазяїні. Використовуваний у даному документі термін "Ly6E" відноситься до будь-якому нативному, зрілому Ly6E, що виходить у результаті процесингу білка-попередника Ly6E у клітині. Цей термін містить у собі Ly6E з будь-якого джерела хребетних, що включають у себе таких ссавців, як примати (наприклад, людиноподібні й макаки або макаки-резуси) і гризуни (наприклад, миші та пацюки), якщо не зазначено інше. Термін також містить у собі варіанти Ly6E, що зустрічаються у природі, наприклад, сплайс-варіанти або алельні варіанти. Амінокислотна послідовність ілюстративного білка-попередника Ly6E людини з сигнальною послідовністю (амінокислоти 1-20=сигнальної послідовності) показана в SEQ ID NO: 1. Амінокислотна послідовність ілюстративного дозрілого людського Ly6E показана в SEQ ID NO: 38. Послідовність амінокислот 1-131 ілюстративного Ly6E макака показана в SEQ ID NO: 2. Амінокислотна послідовність ілюстративного дозрілого Ly6E макака показана в SEQ ID NO: 39. Амінокислотна послідовність для ілюстративного попередника Ly6E пацюка (з сигнальною послідовністю, амінокислоти 1-26) і дозрілі послідовності показані в SEQ ID NO: 37 і 42, відповідно. Амінокислотні послідовності для ілюстративного попередника Ly6E миші (з сигнальною послідовністю, амінокислоти 1-26) і дозрілі послідовності показані в SEQ ID NO: 36 і 41, відповідно. Термін "Ly6E-позитивний рак" відноситься до форми раку, що містить клітини, які експресують Ly6E на своїй поверхні. Для цілей визначення того, чи експресує клітина Ly6E на поверхні, експресію мРНК Ly6E розглядають як корелюючу з експресією Ly6E на поверхні клітини. Відповідно до деяких варіантів здійснення експресію мРНК Ly6E визначають способом, вибраним із гібридизації in situ й ЗТ-ПЛР (у тому числі кількісну ЗТ-ПЛР). Альтернативно, експресія Ly6E на клітинній поверхні може бути визначена, наприклад, з використанням антитіл до Ly6E у такому способі, як імуногістохімія, FACS і т.п. Відповідно до деяких варіантів здійснення Ly6E-позитивний рак означає рак молочної залози, метастатичний рак молочної залози, що включає в себе Her2 негативний рак молочної залози і/або потрійний негативний рак молочної залози, рак підшлункової залози, рак товстої кишки, рак товстої та прямої кишок, 13 UA 114814 C2 5 10 15 20 25 30 35 40 45 50 55 60 меланому, рак яєчників, не дрібноклітинний рак легені (або плоскоклітинний і/або не плоскоклітинний) або рак шлунка, кожний з яких демонструє високий рівень експресії Ly6E. Термін "Ly6E-позитивні клітини" відноситься до клітини злоякісної пухлини, що експресує Ly6E на своїй поверхні. Використовуваний у даному документі термін "моноклональне антитіло" відноситься до антитіла, отриманого з популяції по суті гомогенних антитіл, тобто індивідуальні антитіла, що містять популяцію, являють собою ідентичні та/або зв'язують один і той самий епітоп, за винятком можливих варіантних антитіл, наприклад, що містять мутації, що зустрічаються у природі, або виникаючі у процесі виробництва препарату моноклональних антитіл, такі варіанти, як правило, є присутніми у незначних кількостях. На відміну від препаратів поліклональних антитіл, які, як правило, включають різні антитіла, спрямовані проти різних детермінант (епітопів), кожне моноклональне антитіло препарату моноклонального антитіла спрямоване проти однієї детермінанти на антигені. Таким чином, "моноклональний" модулятор указує на характер антитіла як отриманого по суті з гомогенної популяції антитіл, і не повинне бути витлумачене як потребуюче одержання антитіла яким-небудь конкретним способом. Наприклад, моноклональні антитіла, які будуть використовуватися відповідно до даного винаходу, можуть бути виготовлені за допомогою різних технік, що включають у себе без обмеження способи гібридом, способи рекомбінантних ДНК, способи фагового дисплея, а також способи, що використовують трансгенних тварин, що містять всі або частину локусів людського імуноглобуліну, такі способи й інші ілюстративні способи одержання моноклональних антитіл описуються в даному документі. "Голе антитіло" відноситься до антитіла, що не кон'юговане з гетерологічним фрагментом (наприклад, цитотоксичним фрагментом) або радіоактивною міткою. Голі антитіла можуть бути присутніми у фармацевтичному складі. "Нативні антитіла" відносяться до молекул, що зустрічаються у природі, імуноглобуліну з різними структурами. Наприклад, нативні антитіла IgG являють собою гетеротетрамірні глікопротеїни розміром приблизно 150000 дальтон, що складаються з двох ідентичних легких ланцюгів і двох ідентичних важких ланцюгів, які зв'язані дисульфідним містком. Від N- до С-кінця кожний важкий ланцюг містить варіабельну ділянку (VH), також називану варіабельним важким доменом або варіабельним доменом важкого ланцюга, а потім три константних домена (CH1, CH2 і CH3). Аналогічним чином, від N- до С-кінця кожний легкий ланцюг містить варіабельну ділянку (VL), також називану варіабельним легким доменом або варіабельним доменом легкого ланцюга, з наступним константним легким доменом (CL). Легкий ланцюг антитіла може бути віднесений до одного з двох типів, називаних каппа (κ) і лямбда (λ) на підставі амінокислотної послідовності їх константного домена. Термін "листок-вкладиш" використовується для позначення інструкцій, терапевтичних продуктів, що включають зазвичай в комерційні впакування, які містять інформацію про показання, використання, дозування, введення, комбіновану терапію, протипоказання та/або попередження, що стосуються використання таких терапевтичних засобів. "Відсоток (%) ідентичності амінокислотної послідовності" стосовно еталонної послідовності поліпептиду визначається як відсоток амінокислотних залишків у кандидатній послідовності, які ідентичні амінокислотним залишкам в еталонній поліпептидній послідовності після вирівнювання послідовностей і введення пробілів, якщо це необхідно, щоб досягти максимального відсотка ідентичності послідовностей, і без обліку будь-яких консервативних замін як частини ідентичності послідовності. Вирівнювання з метою визначення відсотка ідентичності амінокислотних послідовностей може бути досягнуто різними способами, які відомі фахівцям у даній області техніки, наприклад, з використанням загальнодоступного комп'ютерного програмного забезпечення, такого як BLAST, BLAST-2, ALIGN або програмне забезпечення Megalign (DNASTAR). Фахівці в даній області техніки можуть визначити відповідні параметри для вирівнювання послідовностей, що включають у себе будь-які алгоритми, необхідні для досягнення максимального вирівнювання повної довжини порівнюваних послідовностей. Для цілей даного винаходу, однак, значення % ідентичності амінокислотних послідовностей одержують з використанням комп'ютерної програми порівняння послідовностей ALIGN-2. Комп'ютерна програма порівняння послідовностей ALIGN-2 була розроблена Genentech, Inc., і вихідний код був поданий з користувальницькою документацією в US Copyright Office, Washington DC, 20559, де він зареєстрований під U.S. Copyright Registration No. TXU510087. Програма ALIGN-2 загальнодоступна від Genentech, Inc., South San Francisco, California, або може бути складена з вихідного коду. Програма ALIGN-2 повинна бути складена для використання на операційній системі UNIX, що включає в себе цифрову UNIX V4.0D. Всі параметри порівняння послідовностей встановлюються програмою ALIGN-2 і не змінюються. У 14 UA 114814 C2 5 10 15 20 25 30 35 40 45 50 55 60 ситуації, коли ALIGN-2 використовується для порівняння амінокислотних послідовностей, % ідентичності амінокислотної послідовності даної амінокислотної послідовності A у порівнянні з або стосовно послідовності B наведені амінокислоти (які альтернативно можуть бути сформульовані як дана амінокислотна послідовність А, що містить певний % ідентичності амінокислотної послідовності у порівнянні з або стосовно даної амінокислотної послідовності B) розраховують у такий спосіб: 100 кратна фракція X/Y, де X являє собою кількість амінокислотних залишків, оцінених як ідентичні збіги програмою вирівнювання послідовностей ALIGN-2 у вирівнюванні цією програмою А і В, і де Y являє собою загальну кількість амінокислотних залишків у B. Зрозуміло, що, коли довжина амінокислотної послідовності A не дорівнює довжині амінокислотної послідовності B, % ідентичності амінокислотної послідовності А до В не буде дорівнювати % ідентичності амінокислотної послідовності В до А. Якщо спеціально не зазначено інше, всі значення % ідентичності амінокислотної послідовності, використовувані в даному описі, отримані, як описано у попередньому параграфі, з використанням комп'ютерної програми ALIGN-2. Термін "фармацевтичний склад" відноситься до препарату, що перебуває в такій формі, щоб дозволити біологічній активності активного інгредієнта, що міститься в ньому, бути ефективним, і який не містить додаткових компонентів, які неприйнятно токсичні для суб'єкта, якому склад буде вводитися. "Фармацевтично прийнятний носій" відноситься до інгредієнта у фармацевтичному складі, відмінному від активного інгредієнта, що нетоксичний для суб'єкта. Фармацевтично прийнятний носій містить у собі без обмеження буфер, наповнювач, стабілізатор або консервант. Використовуваний у даному документі "комплекс платини" відноситься до протиракових хіміотерапевтичних лікарських засобів, таких як, наприклад, але без обмеження, цисплатин, оксаліплатин, карбоплатин, іпроплатин, сатраплатин, CI-973, AZ0473, DWA2114R, недаплатин і спріоплатин, які роблять ефективність проти пухлин на основі їхньої здатності ковалентно зв'язуватися з ДНК. Використовуване в даному документі "лікування" (і такі граматичні варіанти, як "лікувати" або "лікування") відноситься до клінічної інтервенції в спробі змінити природний хід індивідуума, якого лікують, і може бути виконане або для профілактики, або у процесі клінічної патології. Бажані ефекти лікування містять у собі без обмеження запобігання виникнення або повторення захворювання, ослаблення симптомів, зменшення будь-яких прямих або непрямих патологічних наслідків захворювання, запобігання метастазування, зменшення швидкості прогресування захворювання, поліпшення або тимчасове полегшення патологічного стану та ремісію або поліпшення прогнозу. Відповідно до деяких варіантів здійснення антитіла згідно з даним винаходом використовуються для затримки розвитку захворювання або вповільнення прогресування захворювання. Термін "варіабельна область" або "варіабельний домен" відноситься до домену антитіла важкого або легкого ланцюга, що бере участь у зв'язуванні антитіла з антигеном. Варіабельні домени важкого ланцюга та легкого ланцюга (VH і VL, відповідно) нативного антитіла, як правило, характеризуються аналогічними структурами, при цьому кожен домен містить чотири консервативні каркасні області (FR) і три гіперваріабельні області (HVR). (Дивитеся, наприклад, Kindt et al. Kuby Immunology, 6th ed., W.H. Freeman and Co., page 91 (2007)). Єдиного домена VH або VL може бути досить для надання антигенсполучної специфічності. Крім того, антитіла, які зв'язуються з конкретним антигеном, можуть бути виділені з використанням доменів VH або VL з антитіла, що зв'язується з антигеном для скринінгу бібліотеки комплементарних доменів VL або VH, відповідно. Дивитеся, наприклад, Portolano et al., J. Immunol. 150:880-887 (1993); Clarkson et al., Nature 352:624-628 (1991). Використовуваний у даному документі термін "вектор" відноситься до молекули нуклеїнової кислоти, здатної до поширення іншої нуклеїнової кислоти, з якою вона зв'язана. Цей термін містить у собі вектор як самореплікуючу структуру нуклеїнових кислот, а також вектор включений у геном клітини-хазяїна, в яку він був уведений. Певні вектори здатні регулювати експресію нуклеїнових кислот, з якими вони функціонально зв'язані. Такі вектори називаються в даному документі "експресуючі вектори". Термін "алкіл" означає C1-C18 вуглеводень, що містить нормальні, вторинні, третинні або циклічні атоми вуглецю. Приклади являють собою метил (Me, -CH3), етил (Et, -CH2CH3), 1-пропіл (n-Pr, н-пропіл, -CH2CH2CH3), 2-пропіл (i-Pr, ізопропіл, -СН(СН3)2), 1-бутил (n-Bu, н-бутил, CH2CH2CH2CH3), 2-метил-1-пропіл (i-Bu, ізобутил, -CH2CH(CH3)2), 2-бутил (s-Bu, втор-бутил, СН(СН3)СН2СН3), 2-метил-2-пропіл (t-Bu, трет-бутил, -С(СН3)3), 1-пентил (н-пентил, CH2CH2CH2CH2CH3), 2-пентил (-СН(СН3)СН2СН2СН3), 3-пентил (-СН(СН2СН3)2), 2-метил-2-бутил 15 UA 114814 C2 5 10 15 20 25 30 35 40 45 50 55 (-С(СН3)2CH2CH3), 3-метил-2-бутил (-СН(СН3)СН(СН3)2), 3-метил-1-бутил (-CH2CH2CH(CH3)2), 2метил-1-бутил (-СН2СН(СН3)СН2СН3), 1-гексил (-CH2CH2CH2CH2CH2CH3), 2-гексил (СН(СН3)CH2CH2CH2CH3), 3-гексил (-СН(СН2СН3)(СН2СН2СН3)), 2-метил-2-пентил (С(СН3)2CH2CH2CH3), 3-метил-2-пентил (-СН(СН3)СН(СН3)СН2СН3), 4-метил-2-пентил (СН(СН3)CH2CH(CH3)2), 3-метил-3-пентил (-С(СН3)(СН2СН3)2), 2-метил-3-пентил (СН(СН2СН3)СН(СН3)2), 2,3-диметил-2-бутил (-С(СН3)2CH(CH3)2), 3,3-диметил-2-бутил (СН(СН3)С(СН3)3. Використовуваний у даному документі термін "C 1-C8 алкіл" відноситься до прямого або розгалуженого ланцюга, насиченого або ненасиченого вуглеводня, що містить від 1 до 8 атомів вуглецю. Типові "C1-C8 алкільні" групи містять у собі без обмеження -метил, -етил, н-пропіл, нбутил, н-пентил, н-гексил, н-гептил, н-октил, н-ноніл і н-децил; у той час як розгалужені C1-C8алкіли містять у собі без обмеження -ізопропіл, втор-бутил, -ізобутил, трет-бутил, -ізопентил, 2метилбутил, ненасичені C1-C8 алкіли містять у собі без обмеження -вініл, -аліл, -1-бутеніл, -2бутеніл, -ізобутеніл, -1-пентеніл, -2-пентеніл, 3-метил-1-бутеніл, -2-метил-2-бутеніл, -2,3диметил-2-бутеніл, 1-гексил, 2-гексил, 3-гексил, -ацетиленіл, -пропініл, -1-бутиніл, -2-бутиніл, -1пентиніл, -2-пентиніл, -3-метил-1-бутиніл. Алкільна група C1-C8 може бути не заміщеною або заміщеною однією або декількома групами, що включають у себе без обмеження -C1-C8-алкіл, O-(C1-C8-алкіл), арил, -C(O)R', -OC(O)R', -C(O)OR', -C(O)NH2, -C(O)NHR', -C(O)N(R')2-NHC(O)R', SO3R', -S(O)2R', -S(O)R', -OH, галоген, -N3, -NH2, -NH(R'), -N(R')2 і -CN; де кожний R' незалежно вибирають з H, -C1-C8-алкілу й арилу. Використовуваний у даному документі термін "C 1-C12 алкіл" відноситься до прямого або розгалуженого ланцюга, насиченого або ненасиченого вуглеводня, що містить від 1 до 12 атомів вуглецю. C1-C12 алкільна група може бути не заміщеною або заміщеною однією або декількома групами, що включають у себе без обмеження -C1-C8-алкіл, -O-(C1-C8-алкіл), арил, C(O)R', -OC(O)R', -C(O)OR', -C(O)NH2, -C(O)NHR', -C(O)N(R')2-NHC(O)R', -SO3R', -S(O)2R', S(O)R', -OH, галоген, -N3, -NH2, -NH(R'), -N(R')2 і -CN; де кожний R' незалежно вибраний з H, -C1C8 алкілу й арилу. Використовуваний у даному документі термін "C 1-C6 алкіл" відноситься до прямого або розгалуженого ланцюга, насиченого або ненасиченого вуглеводня, що містить від 1 до 6 атомів вуглецю. Типові "C1-C6 алкільні" групи містять у собі без обмеження -метил, -етил, -н-пропіл, -нбутил, -н-пентил і –н-гексил; у той час як розгалужені C1-C6 алкіли містять у собі без обмеження -ізопропіл, втор-бутил, -ізобутил, -трет-бутил, -ізопентил і 2-метилбутил; ненасичені C1-C6 алкіли містять у собі без обмеження -вініл, -аліл, -1-бутеніл, -2-бутеніл і -ізобутеніл, -1-пентеніл, -2пентеніл, -3-метил-1-бутеніл, -2-метил-2-бутеніл, -2,3-диметил-2-бутеніл, 1-гексил, 2-гексил і 3гексил. C1-C6 алкільна група може бути не заміщеною або заміщеною однією або декількома групами, як описано вище для С1-C8-алкільної групи. Використовуваний у даному документі термін "C 1-C4 алкіл" відноситься до прямого або розгалуженого ланцюга, насиченого або ненасиченого вуглеводня, що містить від 1 до 4 атомів вуглецю. Типові "C1-C4 алкільні" групи містять у собі без обмеження -метил, -етил, -н-пропіл, -нбутил; у той час як розгалужені C1-C4-алкіли містять у собі без обмеження -ізопропіл, -вторбутил, -ізобутил, -трет-бутил; ненасичені C1-C4-алкіли містять у собі без обмеження -вініл, -аліл, -1-бутеніл, -2-бутеніл і -ізобутеніл. C1-C4-алкільна група, може бути не заміщеною або заміщеною однією або декількома групами, як описано вище для С1-C8-алкільної групи. Термін "алкокси" являє собою алкільну групу, окремо приєднану до атома кисню. Ілюстративні алкоксигрупи містять у собі без обмеження метокси (OCH3) і етокси (-OCH2CH3). "C1-C5алкокси" являє собою алкоксигрупу, що містить від 1 до 5 атомів вуглецю. Алкоксигрупи можуть бути не заміщеними або заміщеними однією або декількома групами, як описано вище для алкільних груп. Термін "алкеніл" являє собою С2-С18 вуглеводень, що містить нормальні, вторинні, третинні або циклічні атоми вуглецю щонайменше з одним сайтом не насиченості, тобто з вуглець2 вуглецевим, sp подвійним зв'язком. Приклади містять у собі без обмеження: етилен або вініл (CH=CH2), аліл (-CH2CH=CH2), циклопентеніл (-C5H7), і 5-гексеніл (-СН2CH2CH2CH2CH=CH2). "С2С8 алкеніл" являє собою вуглеводень, що містить від 2 до 8 нормальних, вторинних, третинних або циклічних атомів вуглецю щонайменше з одним сайтом не насиченості, тобто з вуглець2 вуглецевим, sp подвійним зв'язком. Термін "алкініл" являє собою С2-С18 вуглеводень, що містить нормальні, вторинні, третинні або циклічні атоми вуглецю щонайменше з одним сайтом не насиченості, тобто з вуглецьвуглецевим, sp потрійним зв'язком. Приклади містять у собі без обмеження: ацетилен (-C≡CH) і пропаргіл (-CH2C≡CH). " С2-С8 алкініл" являє собою вуглеводень, що містить від 2 до 8 16 UA 114814 C2 5 10 15 20 25 30 35 нормальних, вторинних, третинних або циклічних атомів вуглецю щонайменше з одним сайтом не насиченості, тобто з вуглець-вуглецевим, sp потрійним зв'язком. "Алкілен" відноситься до насиченого, розгалуженого або прямого ланцюга або циклічного вуглеводневого радикалу, що містить 1-18 атомів вуглецю, і містить два одновалентних радикальних центри, отриманих шляхом видалення двох атомів водню з того самого або двох різних атомів вуглецю вихідного алкану. Типові алкіленові радикали містять у собі без обмеження: метилен (-CH2-) 1,2-етил (-CH2CH2-), 1,3-пропіл (-СН2СН2СН2-), 1,4-бутил (CH2CH2CH2CH2-) і тому подібне. "C1-C10-алкілен" являє собою прямий ланцюг, насичену вуглеводневу групу з формулою (CH2)1-10-. Приклади C1-C10 алкілену містять у собі метилен, етилен, пропілен, бутилен, пентилен, гексилен, гептилен, оцитилен, нонілен і декален. "Алкенілен" відноситься до ненасиченого, розгалуженого або прямого ланцюга або циклічного вуглеводневого радикалу з 2-18 атомів вуглецю, і містить два одновалентних радикальних центри, отриманих видаленням двох атомів водню з того самого або двох різних атомів вуглецю вихідного алкену. Типові алкеніленові радикали містять у собі без обмеження: 1,2-етилен (-CH=CH-). "Алкінілен" відноситься до ненасиченого, розгалуженого або прямого ланцюга або циклічного вуглеводневого радикалу з 2-18 атомів вуглецю, і містить два одновалентних радикальних центри, отриманих шляхом видалення двох атомів водню з того самого або двох різних атомів вуглецю вихідного алкіну. Типові алкініленові радикали містять у собі без обмеження: ацетилен (-C≡C-), пропаргіл (-CH2C≡C) і 4-пентиніл (-CH2CH2CH2C≡C-). Термін "арил" відноситься до карбоциклічної ароматичної групи. Приклади арильних груп містять у собі без обмеження феніл, нафтил й антраценіл. Карбоциклічна ароматична група або гетероциклічна ароматична група може бути не заміщеною або заміщеною однією або декількома групами, що включають у себе без обмеження -C1-C8 алкіл, -O-(C1-C8 алкіл), арил, С(О)R', -OC(O)R', -C(O)OR', -C(O)NH2, -C(O)NHR', -C(O)N(R')2-NHC(O)R', -S(O)2R', -S(O)R', -OH, галоген, -N3, -NH2, -NH(R'), -N(R')2 і -CN; де кожний R' незалежно вибирають з H, -C1-C8 алкілу й арилу. "C5-C20 арил" являє собою арильну групу з 5-20 атомами вуглецю в карбоциклічних ароматичних кільцях. Приклади C5-C20 арильних груп містять у собі без обмеження феніл, нафтил й антраценіл. C5-C20 арильна група може бути заміщеною або не заміщеною, як описано вище для арильних груп. "С5-С14 арил" являє собою арильну групу з 5-14 атомами вуглецю в карбоциклічних ароматичних кільцях. Приклади С5-С14 арильних груп містять у собі без обмеження феніл, нафтил й антраценіл. С5-С14 арильна група може бути заміщеною або не заміщеною, як описано вище для арильних груп. "Арилен" являє собою арильну групу, що містить два ковалентні зв'язки та може бути в орто, мета- або пара-конфігурації, як показано на наступних структурах: , 40 45 50 55 , , у яких фенільна група може бути не заміщеною або заміщеною до чотирьох груп, містячи в собі без обмеження -C1-C8 алкіл, -O-(C1-C8 алкіл), -арил, -C(O)R', -OC(O)R', -C(O)OR', -C(O)NH2, C(O)NHR', -C(O)N(R')2-NHC(O)R', -S(O)2R', -S(O)R', -OH, галоген, -N3, -NH2, -NH(R'), -N(R')2 і -CN; де кожний R' незалежно вибирають з H, -C1-C8 алкілу й арилу. "Арилалкіл" відноситься до ациклічного алкільного радикалу, в якому один із атомів водню, пов'язаних із атомом вуглецю, зазвичай кінцевим або sp3 атомом вуглецю, заміщений арильним радикалом. Типові арилалкільні групи містять у собі без обмеження бензил, 2-фенілетан-1-іл, 2фенілетен-1-іл, нафтилметил, 2-нафтилетан-1-іл, 2-нафтилетен-1-іл, нафтобензил, 2нафтофенілетан-1-іл і тому подібне. Арилалкільна група містить від 6 до 20 атомів вуглецю, наприклад, алкільний фрагмент, що включає в себе алканільні, алкенільні або алкінільні групи, арилалкільна група становить від 1 до 6 атомів вуглецю й арильний фрагмент становить від 5 до 14 атомів вуглецю. "Гетероарилалкіл" відноситься до ациклічного алкільного радикалу, в якому один із атомів водню, пов'язаних із атомом вуглецю, зазвичай термінальним або sp3 атомом вуглецю, заміщений гетероарильним радикалом. Типові гетероарилалкільні групи містять у собі без обмеження 2-бензімідазолілметил, 2-фурилетил і тому подібне. Гетероарилалкільна група містить від 6 до 20 атомів вуглецю, наприклад, алкільний фрагмент, що включає в себе алканільну, алкенільну або алкінільну групи, гетероарилалкільна група становить від 1 до 6 17 UA 114814 C2 5 10 15 20 25 30 35 40 45 50 55 60 атомів вуглецю та гетероарильний фрагмент становить від 5 до 14 атомів вуглецю та від 1 до 3 гетероатомів, вибраних із N, O, P і S. Гетероарильний фрагмент гетероарилалкільної групи можуть являти собою моноцикл, що містить від 3 до 7 членів у кільці (від 2 до 6 атомів вуглецю) або біцикл, що містить від 7 до 10 членів у кільці (від 4 до 9 атомів вуглецю та від 1 до 3 гетероатомів, вибраних із N, O, P, і S), наприклад: біцикло [4,5], [5,5], [5,6] або [6,6] система. Термін "заміщений алкіл", "заміщений арил" і "заміщений арилалкіл" означає алкіл, арил й арилалкіл, відповідно, в яких один або декілька атомів водню, кожний незалежно замінений замісником. Типові замісники містять у собі без обмеження -X, -R, -О , -OR, -SR, -S, -NR2, -NR3, =NR, -CX3, -CN, -OCN, -SCN, -N=C=O, -NCS, -NO, -NO2, =N2, N3, NC(=O)R, -C(=O)R, -C(=O)NR2, SO3 , -SO3H, -S(=O)2R, -OS(=O)2or, -S(=O)2NR, -S(=O)R, -OP(=O)(OR)2, -P(=O)(OR)2, -PO3, -PO3H2, -C(=O)R, -С(=O)X, -C(=S)R, -CO2R, -CO2 , -C(=S)OR, -C(=O)SR, -C(=S)SR, -C(=O)NR2, -C(=S)NR2, -C(=NR)NR2, де кожний Х незалежно являє собою галоген: F, Cl, Br або I; і кожний R незалежно являє собою Н, С2-С18 алкіл, С6-С20 арил, С3-С14 гетероцикл, захисну групу або фрагмент проліків. Описані вище алкіленова, алкеніленова й алкініленова групи можуть також бути заміщені аналогічно. Термін "гетероарил" і "гетероцикл" відноситься до кільцевої системи, в якій один або декілька атомів у кільці являють собою гетероатом, наприклад азот, кисень та сірку. Гетероциклічний радикал містить від 3 до 20 атомів вуглецю та від 1 до 3 гетероатомів, вибраних із N, O, P і S. Гетероцикл може являти собою моноцикл, що містить від 3 до 7 членів у кільці (від 2 до 6 атомів вуглецю та від 1 до 3 гетероатомів, вибраних із N, О, Р, і S), або біцикл, що містить від 7 до 10 членів у кільці (від 4 до 9 атомів вуглецю та від 1 до 3 гетероатомів, вибраних із N, О, Р і S), наприклад: біцикло [4,5], [5,5], [5,6] або [6,6] система. Ілюстративні гетероцикли описані, наприклад, в Paquette, Leo A., "Principles of Modern Heterocyclic Chemistry" (W.A. Benjamin, New York, 1968), зокрема, у главах 1, 3, 4, 6, 7 і 9; "The Chemistry of Heterocyclic Compounds, A series of Monographs" (John Wiley & Sons, New York, 1950 to present), in particular Volumes 13, 14, 16, 19, and 28; and J. Am. Chem. Soc. (1960) 82:5566. Приклади гетероциклів містять у собі як приклад без обмеження піридил, дигідропіридил, тетрагідропіридил (піперидил), тіазоліл, тетрагідротіофеніл, окислений сіркою тетрагідротіофеніл, піримідиніл, фураніл, тієніл, піроліл, піразоліл, імідазоліл, тетразоліл, бензофураніл, тіанафталеніл, індоліл, індоленіл, хінолініл, ізохінолініл, бензімідазоліл, піперидиніл, 4-піперидоніл, піролідиніл, 2-піролідоніл, піролініл, тетрагідрофураніл, бістетрагідрофураніл, тетрагідропіраніл, біс-тетрагідропіраніл, тетрагідрохіноліл, тетрагідроізохінолініл, декагідрохінолініл, октагідроізохінолініл, азоциніл, триазиніл, 6Н-1,2,5тіадіазиніл, 2Н, 6Н-1,5,2-дитіазиніл, тієніл, тіантреніл, піраніл, ізобензофураніл, хроменіл, ксантеніл, феноксатиніл, 2Н-піроліл, ізотіазоліл, ізоксазоліл, піразиніл, піридазиніл, індолізиніл, ізоіндоліл, 3Н-індоліл, 1H-індазоліл, пуриніл, 4Н-хінолізиніл, фталазиніл, нафтиридиніл, хіноксалініл, хіназолініл, циннолініл, птеридиніл, 4аН-карбазоліл, карбазоліл, β-карболініл, фенантридиніл, акридиніл, піримідиніл, фенантролініл, феназиніл, фенотіазиніл, фуразаніл, феноксазиніл, ізохроманіл, хроманіл, імідазолідиніл, імідазолініл, піразолідиніл, піразолініл, піперазиніл, індолініл, ізоіндолініл, хінуклідиніл, морфолініл, оксазолідиніл, бензотриазоліл, бензизоксазоліл, оксіндоліл, бензоксазолініл й ізатиноїл. Як приклад і без обмеження зв'язані з вуглецем гетероцикли приєднані у положенні 2, 3, 4, 5 або 6 піридину, у положенні 3, 4, 5 або 6 піридазину, у положенні 2, 4, 5 або 6 піримідину, у положенні 2, 3, 5 або 6 піразину, у положенні 2, 3, 4 або 5 фурану, тетрафурану, тіофурану, тіофену, піролу або тетрагідропіролу, у положенні 2, 4 або 5 оксазолу, імідазолу або тіазолу, у положенні 3, 4 або 5 ізоксазолу, піразолу або ізотіазолу, у положенні 2 або 3 азиридину, у положенні 2, 3 або 4 азетидину, у положенні 2, 3, 4, 5, 6, 7 або 8 хіноліну або у положенні 1, 3, 4, 5, 6, 7 або 8 ізохіноліну. Ще більш типово гетероцикли, з'єднані з вуглецем, містять у собі 2піридил, 3-піридил, 4-піридил, 5-піридил, 6-піридил, 3-піридазиніл, 4-піридазиніл, 5-піридазиніл, 6-піридазиніл, 2-піримідиніл, 4-піримідиніл, 5-піримідиніл, 6-піримідиніл, 2-піразиніл, 3-піразиніл, 5-піразиніл, 6-піразиніл, 2-тіазоліл, 4-тіазоліл або 5-тіазоліл. Як приклад і без обмеження зв'язані з азотом гетероцикли приєднані у положенні 1 азиридину, азетидину, піролу, піролідину, 2-піроліну, 3-піроліну, імідазолу, імідазолідину, 2імідазоліну, 3-імідазоліну, піразолу, піразоліну, 2-піразоліну, 3-піразоліну, піперидину, піперазину, індолу, індоліну, 1H-індазолу, у положенні 2 ізоіндолу або ізоіндоліну, у положенні 4 морфоліну та положенні 9 карбазолу або β-карболіну. Ще більш типово, зв'язані з азотом гетероцикли містять у собі 1-азиридил, 1-азетедил, 1-піроліл, 1-імідазоліл, 1-піразоліл і 1піперидиніл. "С3-C8 гетероцикл" відноситься до ароматичного або не ароматичного С 3-C8 карбоциклу, в якому від одного до чотирьох атомів вуглецю в кільці незалежно заміщені гетероатомом із 18 UA 114814 C2 5 10 15 20 25 30 35 40 45 50 55 групи, що складається з О, S і N. Репрезентативні приклади С 3-C8 гетероциклу містять у собі без обмеження бензофураніл, бензотіофен, індоліл, бензопіразоліл, кумариніл, ізохінолініл, піроліл, тіофеніл, фураніл, тіазоліл, імідазоліл, піразоліл, триазоліл, хінолініл, піримідиніл, піридиніл, піразиніл, піридоніл, піридазиніл, ізотіазоліл, ізоксазоліл і тетразоліл. С3-C8 гетероцикл може бути не заміщеним або заміщеним аж до семи груп, містячи в собі без обмеження -C1-C8 алкіл, O-(C1-C8 алкіл), -арил, -C(O)R', -OC(O)R', -C(O)OR', -C(O)NH2, -C(O)NHR', -C(O)N(R')2-NHC(O)R', -S(O)2R', -S(O)R', -OH, галоген, -N3, -NH2, -NH(R'), -N(R')2 і -CN; де кожний R' незалежно вибирають з H, -C1-C8 алкілу й арилу. "С3-C8 гетероцикло" відноситься до визначеної вище С 3-C8 гетероциклічної групи, в якій один із атомів водню гетероциклічної групи заміщений зв'язком. С3-C8 гетероцикло може бути не заміщеним або заміщеним аж до шести груп, містячи в собі без обмеження -C1-C8 алкіл, -O-(C1C8 алкіл), -арил, -C(O)R', -OC(O)R', -C(O)OR', -C(O)NH2, -C(O)NHR', -C(O)N(R')2-NHC(O)R', S(O)2R', -S(O)R', -OH, галоген, -N3, -NH2, -NH(R'), -N(R')2 і -CN; де кожний R' незалежно вибирають з H, -C1-C8 алкілу й арилу. "С3-С20 гетероцикл" відноситься до ароматичного або не ароматичного С 3-C8 карбоциклу, в якому від одного до чотирьох атомів вуглецю в кільці незалежно заміщені гетероатомом із групи, що складається з О, S і N. С3-С20 гетероцикл може бути не заміщеним або заміщеним аж до семи груп, містячи в собі без обмеження -C1-C8 алкіл, -O-(C1-C8 алкіл), -арил, -C(O)R', OC(O)R', -C(O)OR', -C(O)NH2, -C(O)NHR', -C(O)N(R')2-NHC(O)R', -S(O)2R', -S(O)R', -OH, галоген, N3, -NH2, -NH(R'), -N(R')2 і -CN; де кожний R' незалежно вибирають з H, -C1-C8 алкілу й арилу. "С3-С20 гетероцикло" відноситься до визначеної вище С 3-С20 гетероциклічної групи, в якій один із атомів водню гетероциклічної групи замінений зв'язком. "Карбоцикл" означає насичене або ненасичене кільце, що містить від 3 до 7 атомів вуглецю як моноцикл або від 7 до 12 атомів вуглецю в якості біцикла. Моноциклічні карбоцикли містять від 3 до 6 кільцевих атомів, ще більш типово від 5 до 6 атомів у кільці. Біциклічні карбоцикли містять від 7 до 12 атомів у кільці, наприклад, розташовані як біцикло [4,5], [5,5], [5,6] або [6,6] система або 9, або 10 кільцевих атомів, розташовані як біцикло [5,6] або [6,6] система. Приклади моноциклічних карбоциклів містять у собі циклопропіл, циклобутил, циклопентил, 1циклопент-1-еніл, 1-циклопент-2-еніл, 1-циклопент-3-еніл, циклогексил, 1-циклогекс-1-еніл, 1циклогекс-2-еніл, 1-циклогекс-3-еніл, циклогептил і циклооктил. "С3-C8 карбоцикл" являє собою 3-, 4-, 5-, 6-, 7- або 8-членне насичене або ненасичене неароматичне карбоциклічне кільце. Репрезентативні С3-C8 карбоцикли містять у собі без обмеження -циклопропіл, -циклобутил, -циклопентил, -циклопентадієніл, -циклогексил, циклогексеніл, -1,3-циклогексадієніл, -1,4-циклогексадієніл, -циклогептил, -1,3-циклогептадієніл, -1,3,5-циклогептатриєніл, -циклооктил і -циклооктадієніл. С3-C8 карбоциклічна група може бути не заміщеною або заміщеною однією або декількома групами, що включають в себе без обмеження -C1-C8 алкіл, -O-(C1-C8 алкіл), арил, -C(O)R', -OC(O)R', -C(O)OR', -C(O)NH2, C(O)NHR', -C(O)N(R')2-NHC(O)R', -S(O)2R', -S(O)R', -OH, галоген, -N3, -NH2, -NH(R'), -N(R')2 і -CN; де кожний R' незалежно вибирають з H, -C1-C8 алкілу й арилу. "С3-C8 карбоцикло" відноситься до визначеної вище С3-C8 карбоциклічної групи, в якій один із атомів водню карбоциклічних груп заміщений зв'язком. "Лінкер" відноситься до хімічного фрагмента, що містить ковалентний зв'язок або ланцюг атомів, які ковалентно прикріплюють антитіло до фрагмента лікарського засобу. Відповідно до різних варіантів здійснення лінкери містять у собі такий двовалентний радикал, як алкілдіїл, арилдіїл, гетероарилдіїл, такі фрагменти, як: -(CR2)nО(CR2)n, що повторюються одиниці алкілокси (наприклад поіетиленокси, ПЕГ, поліетилененокси) і алкіламіно (наприклад TM поліетиленаміно, Jeffamine ); і складні ефіри й аміди двоосновних кислот, що включають у себе сукцинат, сукцинамід, дигліколеву кислоту, малонову кислоту та капроамід. Відповідно до різних варіантів здійснення лінкери можуть містити один або декілька амінокислотних залишків, таких як валін, фенілаланін, лізин, і гомолізин. Термін "хіральний" відноситься до молекул, які мають властивість несумісності дзеркального зображення партнера, у той час як термін "ахіральний" відноситься до молекул, які сполучаються з їхнім дзеркальним відображенням партнера. Термін "стереоізомери" відноситься до сполук, які характеризуються однаковим хімічним складом, але відрізняються відносно розташування атомів або груп у просторі. "Діастереомер" відноситься до стереоізомера з двома або більше центрами хіральності, і чиї молекули не являють собою дзеркальні відображення один одного. Діастереомери характеризуються різними фізичними властивостями, наприклад, точками плавлення, точками кипіння, спектральними властивостями й реактивностями. Суміші діастереомерів можна 19 UA 114814 C2 5 10 15 20 25 30 35 40 45 50 55 розділити за допомогою аналітичних процедур із високим дозволом, таких як електрофорез і хроматографія. "Енантіомери" відносяться до двох стереоізомерів сполуки, які не являють собою дзеркальні відбиття один одного. Стереохімічні визначення й угоди, які використовують в даному документі, як правило, випливають з S. P. Parker, Ed., McGraw-Hill Dictionary of Chemical Terms (1984) McGraw-Hill Book Company, New York; і Eliel, E. and Wilen, S., Stereochemistry of Organic Compounds (1994) John Wiley & Sons, Inc., New York. Багато органічних сполук існують в оптично активних формах, тобто вони мають здатність обертати площину плоскополяризованого світла. В описі оптично активної сполуки префікси D і L або R і S використовуються для позначення абсолютної конфігурації молекули відносно її хірального центра (центрів). Префікси d і l або (+) і (-) використовуються для позначення знака обертання плоскополяризованого світла сполукою, причому (-) або 1 означає, що сполука є лівообертальною. Сполука з префіксом (+) або d є правообертальною. Для даної хімічної структури ці стереоізомери характеризуються ідентичністю, за винятком того, що вони являють собою дзеркальні відбиття один одного. Конкретний стереоізомер може також згадуватися як енантіомер, і суміш таких ізомерів часто називають енантіомерною сумішшю. Суміш енантіомерів 50:50 називають рацемічною сумішшю або рацематом, яка може бути там, де не було стереоселекції або стереоспецифічності в хімічній реакції або процесі. Терміни "рацемічна суміш" і "рацемат" відносяться до еквімолярної суміші двох енантіомерних видів, позбавлених оптичної активності. "Заміщувана група" відноситься до функціональної групи, яка може бути замінена іншою функціональною групою. Деякі заміщувані групи, добре відомі в даній області техніки, і приклади містять у собі без обмеження галогенід (наприклад, хлорид, бромід, йодид), метансульфонілхлорид (мезил), п-толуолсульфоніл (тозил), трифторметилсульфоніл (трифлат) і трифторметилсульфонат. Термін "захисна група" відноситься до замісника, який зазвичай використовують для блокування або захисту конкретної функціональності у процесі взаємодії інших функціональних груп на сполуці. Наприклад, "аміно-захисна група" являє собою замісник, приєднаний до аміногрупи, який блокує або захищає функціональну аміногрупу в сполуці. Підходящі амінозахисні групи містять у собі без обмеження ацетил, трифторацетил, трет-бутоксикарбоніл (ВОС), бензилоксикарбоніл (CBZ) і 9-флуоренілметиленоксикарбоніл (Fmoc). Для загального опису захисних груп та їх використання дивитеся T. W. Greene, Protective Groups in Organic Synthesis, John Wiley & Sons, New York, 1991, або більш пізніше видання. II. Композиції та способи Відповідно до одного аспекту даний винахід заснований, частково, на антитілах, які зв'язуються з Ly6E, і імунокон'югатах, що містять такі антитіла. Антитіла й імунокон'югати згідно з даним винаходом застосовні, наприклад, для діагностики або лікування Ly6E-позитивних злоякісних пухлин. А. Приклади антитіл до Ly6E Відповідно до деяких варіантів здійснення в даному винаході передбачені виділені антитіла, які зв'язуються з Ly6E. Відповідно до деяких варіантів здійснення антитіло до Ly6E характеризується наявністю щонайменше однієї або декількох із наступних характеристик у будь-якій комбінації: (а) зв'язується з епітопом у межах амінокислот 21-131 в SEQ ID NO: 1 і (b) зв'язується з Ly6E з афінністю ≤ 7 нМ або ≤ 6 нМ, або ≤ 5 нМ, або ≤ 4 нМ, або ≤ 3 нМ, або ≤ 2 нМ, або ≤ 1 нМ, і, необов'язково, ≥ 0,0001 нМ, або ≥ 0,001 нМ, або ≥ 0,01 нМ, що виміряне за допомогою аналізу або SPR, або Скетчарда. Не обмежуюче ілюстративне антитіло згідно з даним винаходом являє собою мишаче 9B12, як показано на фіг. 4-6, і такі його гуманізовані варіанти, як, наприклад, hu9B12.v12, як показано на фіг. 4-6. Відповідно до деяких варіантів здійснення Ly6E являє собою людський Ly6E. Відповідно до деяких варіантів здійснення Ly6E вибирають з Ly6E людини, макаки, макакирезусу, миші або пацюка. Відповідно до деяких варіантів здійснення антитіло до Ly6E зв'язується з епітопом у межах амінокислот 21-131 в SEQ ID NO: 1. Відповідно до деяких таких варіантів здійснення даного винаходу антитіло до Ly6E зв'язується з Ly6E з афінністю ≤ 7 нМ, або ≤ 6 нМ, або ≤ 5 нМ, або ≤ 4 нМ, або ≤ 3 нМ, або ≤ 2 нМ, або ≤ 1 нМ, і, необов'язково, ≥ 0,0001 нМ або ≥ 0,001 нМ, або ≥ 0,01 нМ, що виміряне за допомогою аналізу або SPR, або Скетчарда. Не обмежуюче ілюстративне антитіло згідно з даним винаходом являє собою мишаче 9B12, як показано на фіг. 4-6, і такі його гуманізовані варіанти, як, наприклад, hu9B12.v12, як показано на фіг. 4-6. 20 UA 114814 C2 5 10 15 20 25 30 35 40 45 50 55 60 Відповідно до деяких варіантів здійснення Ly6E являє собою людський Ly6E. Відповідно до деяких варіантів здійснення Ly6E являє собою людський Ly6E або Ly6E макаки. Відповідно до одного аспекту в даному винаході передбачене антитіло до Ly6E, що містить щонайменше одну, дві, три, чотири, п'ять або шість HVR, вибраних із: (а) HVR-H1, що містить амінокислотну послідовність SEQ ID NO: 10; (b) HVR-H2, що містить амінокислотну послідовність SEQ ID NO: 11; (c) HVR-H3, що містить амінокислотну послідовність SEQ ID NO: 12; (d) HVR-L1, що містить амінокислотну послідовність SEQ ID NO: 7; (е) HVR-L2, що містить амінокислотну послідовність SEQ ID NO: 8; і (f) HVR-L3, що містить амінокислотну послідовність SEQ ID NO: 9. Відповідно до одного аспекту в даному винаході передбачене антитіло, яке містить щонайменше одну, щонайменше дві або всі три послідовності HVR VH, вибрані з: (а) HVR-H1, що містить амінокислотну послідовність SEQ ID NO: 10; (b) HVR-H2, що містить амінокислотну послідовність SEQ ID NO: 11; і (с) HVR-H3, що містить амінокислотну послідовність SEQ ID NO: 12. Відповідно до одного варіанта здійснення антитіло містить HVR-H3, що містить амінокислотну послідовність SEQ ID NO: 12. Відповідно до іншого варіанта здійснення антитіло містить HVR-H3, що містить амінокислотну послідовність SEQ ID NO: 12, і HVR-L3, що містить амінокислотну послідовність SEQ ID NO: 9. Відповідно до додаткового варіанта здійснення антитіло містить HVR-H3, що містить амінокислотну послідовність SEQ ID NO: 12, HVR-L3, що містить амінокислотну послідовність SEQ ID NO: 9, і HVR-H2, що містить амінокислотну послідовність SEQ ID NO: 11. Відповідно до додаткового варіанта здійснення антитіло містить (а) HVR-H1, що містить амінокислотну послідовність SEQ ID NO: 10; (b) HVR-H2, що містить амінокислотну послідовність SEQ ID NO: 11; і (с) HVR-H3, що містить амінокислотну послідовність SEQ ID NO: 12. Відповідно до іншого аспекту в даному винаході передбачене антитіло, яке містить щонайменше одну, щонайменше дві або всі три послідовності HVR VL, вибрані з: (а) HVR-L1, що містить амінокислотну послідовність SEQ ID NO: 7; (b) HVR-L2, що містить амінокислотну послідовність SEQ ID NO: 8; і (с) HVR-L3, що містить амінокислотну послідовність SEQ ID NO: 9. Відповідно до одного варіанта здійснення антитіло містить (а) HVR-L1, що містить амінокислотну послідовність SEQ ID NO: 7; (b) HVR-L2, що містить амінокислотну послідовність SEQ ID NO: 8; і (с) HVR-L3, що містить амінокислотну послідовність SEQ ID NO: 9. Відповідно до іншого аспекту антитіло згідно з даним винаходом містить (а) домен VH, що містить щонайменше одну, щонайменше дві або всі три послідовності HVR VH, вибрані з (i) HVR-H1, що містить амінокислотну послідовність SEQ ID NO: 10, (ii) HVR-H2, що містить амінокислотну послідовність SEQ ID NO: 11, і (iii) HVR-H3, що містить амінокислотну послідовність, вибрану з SEQ ID NO: 12; і (b) домен VL, що містить щонайменше одну, щонайменше дві або всі три послідовності HVR VL, вибрані з (i) HVR-L1, що містить амінокислотну послідовність SEQ ID NO: 7, (ii) HVR-L2, що містить амінокислотну послідовність SEQ ID NO: 8, і (с) HVR-L3, що містить амінокислотну послідовність SEQ ID NO: 9. Відповідно до іншого аспекту в даному винаході передбачене антитіло, яке містить (а) HVRH1, що містить амінокислотну послідовність SEQ ID NO: 10; (b) HVR-H2, що містить амінокислотну послідовність SEQ ID NO: 11; (c) HVR-H3, що містить амінокислотну послідовність SEQ ID NO: 12; (d) HVR-L1, що містить амінокислотну послідовність SEQ ID NO: 7; (е) HVR-L2, що містить амінокислотну послідовність SEQ ID NO: 8; і (f) HVR-L3, що містить амінокислотну послідовність, вибрану з SEQ ID NO: 9. Відповідно до деяких варіантів здійснення будь-яка одна або декілька амінокислот передбаченого вище антитіла до Ly6E заміщається в наступних положеннях HVR: Відповідно до будь-якого зі зазначених вище варіантів здійснення антитіло до Ly6E є гуманізованим. Відповідно до одного варіанта здійснення антитіло до Ly6E містить HVR, як у будь-якому зі зазначених вище варіантів здійснення, і додатково містить акцепторну каркасну область людини, наприклад, каркасну область імуноглобуліну людини або консенсусну каркасну область людини. Відповідно до іншого варіанта здійснення антитіло до Ly6E містить HVR, як у будь-якому зі зазначених вище варіантів здійснення, і воно додатково містить послідовність FR2 каркасної області варіабельного домена легкого ланцюга SEQ ID NO: 20 або FR3 каркасної області варіабельного домена легкого ланцюга SEQ ID NO: 21, або FR1 каркасної області варіабельного домена важкого ланцюга SEQ ID NO: 23, або FR2 каркасної області варіабельного домена важкого ланцюга SEQ ID NO: 24. Відповідно до іншого аспекту антитіло до Ly6E містить послідовність варіабельного домена (VH) важкого ланцюга, що характеризується ідентичністю послідовності, рівною щонайменше 90 %, 91 %, 92 %, 93 %, 94 %, 95 %, 96 %, 97 %, 98 %, 99 % або 100 %, стосовно амінокислотної послідовності SEQ ID NO: 5. Відповідно до деяких варіантів здійснення послідовність VH, що 21 UA 114814 C2 5 10 15 20 25 30 35 40 45 50 55 60 характеризується ідентичністю, рівною щонайменше 90 %, 91 %, 92 %, 93 %, 94 %, 95 %, 96 %, 97 %, 98 % або 99 %, містить заміни (наприклад, консервативні заміни), вставки або делеції, стосовно еталонної послідовності, але антитіло до Ly6E, що містить таку послідовність, зберігає здатність зв'язуватися з Ly6E. Відповідно до деяких варіантів здійснення в цілому від 1 до 10 амінокислот замінені, вставлені та/або вилучені в SEQ ID NO: 5. Відповідно до деяких варіантів здійснення заміни, вставки або делеції відбуваються в областях поза HVR (тобто в FR). Необов'язково, антитіло до Ly6E містить послідовність VH в SEQ ID NO: 5, у тому числі посттрансляційні модифікації цієї послідовності. Відповідно до конкретного варіанта здійснення VH містить одну, дві або три HVR, вибрані з: (а) HVR-H1, що містить амінокислотну послідовність SEQ ID NO: 10, (b) HVR-H2, що містить амінокислотну послідовність SEQ ID NO: 11, і (с) HVR-H3, що містить амінокислотну послідовність SEQ ID NO: 12. Відповідно до іншого аспекту передбачене антитіло до Ly6E, причому антитіло містить варіабельний домен (VL) легкого ланцюга, що характеризується ідентичністю послідовності, що становить щонайменше 90 %, 91 %, 92 %, 93 %, 94 %, 95 %, 96 %, 97 %, 98 %, 99 %, або 100 %, стосовно амінокислотної послідовності SEQ ID NO: 3. Відповідно до деяких варіантів здійснення послідовність VL, що характеризується ідентичністю, що становить щонайменше 90 %, 91 %, 92 %, 93 %, 94 %, 95 %, 96 %, 97 %, 98 % або 99 %, містить заміни (наприклад, консервативні заміни), вставки або делеції, стосовно еталонної послідовності, але антитіло до Ly6E, що містить таку послідовність, зберігає здатність зв'язуватися з Ly6E. Відповідно до деяких варіантів здійснення в цілому від 1 до 10 амінокислот замінені, вставлені та/або вилучені в SEQ ID NO: 3. Відповідно до деяких варіантів здійснення заміни, вставки або делеції відбуваються в областях поза HVR (тобто в FR). Необов'язково, антитіло до Ly6E містить послідовність VL в SEQ ID NO: 3, у тому числі посттрансляційні модифікації цієї послідовності. Відповідно до конкретного варіанта здійснення VL містить одну, дві або три HVR, вибрані з (а) HVR-L1, що містить амінокислотну послідовність SEQ ID NO: 7; (b) HVR-L2, що містить амінокислотну послідовність SEQ ID NO: 8; і (с) HVR-L3, що містить амінокислотну послідовність SEQ ID NO: 9. Відповідно до іншого аспекту передбачене антитіло до Ly6E, причому антитіло містить VH, як у будь-якому з наведених вище варіантів здійснення, і VL, як у будь-якому з наведених вище варіантів здійснення. Відповідно до одного варіанта здійснення антитіло містить послідовності VH і VL в SEQ ID NO: 5 і SEQ ID NO: 3, відповідно, що включають у себе посттрансляційні модифікації цих послідовностей. Відповідно до додаткового аспекту в даному винаході передбачене антитіло, що зв'язується з тим самим епітопом, що й представлене в даному документі антитіло до Ly6E. Наприклад, відповідно до деяких варіантів здійснення передбачене антитіло, що зв'язується з тим самим епітопом, що й антитіло до Ly6E, що містить послідовність VH в SEQ ID NO: 5 і послідовність VL в SEQ ID NO: 3. Відповідно до деяких варіантів здійснення передбачене антитіло, що зв'язується з епітопом у межах фрагмента Ly6E, що складається з амінокислот 21-131 в SEQ ID NO: 1. Відповідно до додаткового аспекту антитіло до Ly6E відповідно до будь-якого зі зазначених вище варіантів здійснення являє собою моноклональне антитіло, що включає в себе химерне, гуманізоване або людське антитіло. Відповідно до одного варіанта здійснення антитіло до Ly6E являє собою фрагмент антитіла, наприклад, Fv, Fab, Fab', scFv, діатіло або F(аb') 2-фрагмент. Відповідно до іншого варіанта здійснення антитіло являє собою повнорозмірне антитіло, наприклад, інтактне антитіло IgG1 або антитіло іншого класу або ізотипу, як визначено в даному документі. Відповідно до додаткового аспекту антитіло до Ly6E відповідно до будь-якого зі зазначених вище варіантів здійснення може включати будь-яку з ознак окремо або в комбінації, як описано в розділах 1-7 нижче. Аналізи Щоб визначити, чи зв'язується антитіло до Ly6E з епітопом у межах амінокислот 21-131 в SEQ ID NO: 1, Ly6E поліпептиди з N- і С-кінцевими делеціями експресують у клітинах 293 і зв'язування антитіла з усіченими поліпептидами перевіряють за допомогою FACS, причому істотне зниження (зниження ≥ 70 %) або усунення зв'язування антитіла з усіченим поліпептидом стосовно зв'язування з повнорозмірним Ly6E, експресованим у клітинах 293, указує на те, що антитіло не зв'язується з цим усіченим поліпептидом. Визначення того, що антитіло до Ly6E "зв'язується з афінністю ≤ 6 нМ або ≤ 5 нМ, або ≤ 4 нМ, або ≤ 3 нМ, або ≤ 2 нМ, або ≤ 1 нМ" проводять відповідно до аналізу Скетчарда, як описано в даному документі у прикладі 4. Альтернативно, афінність антитіла до Ly6E може бути визначена у відповідності, наприклад, з аналізом BIAcore. Зокрема, Kd вимірюють з використанням поверхневого плазмонного резонансу з використанням Biacore®-3000 (BIAcore, 22 UA 114814 C2 5 10 15 20 25 30 35 40 45 50 55 60 Inc., Piscataway, NJ). Чипи CM5 класу дослідження BIAcore™ активуються з реагентами 1-етил3-(3-диметиламінопропіл) карбодіімід (EDC) і N-гідроксисукцинімід (NHS) відповідно до інструкцій постачальника. Козячі IgG до людських Fc приєднують до чипів, щоб досягти приблизно 10000 одиниць відгуку (RU) у кожному осередку потоку. Непрореагувавші з'єднані групи блокуються 1М етаноламіном. Для вимірів кінетики антитіла до Ly6E захоплюються для досягнення приблизно 300 RU. Дворазові серійні розведення людського Ly6E (наприклад, амінокислоти 21-131, злиті з Fc-His, експресовані в системі бакуловірусу, або амінокислоти 21131, злиті з Fc, експресовані в клітинах СНО; від 125 нМ до 0,49 нМ) вводять у буфер HBS-Р (0,01 М HEPES рН 7,4, 0,15 М NaCl, 0,005 % поверхнево-активна речовина Р20) при 25 °C зі швидкістю потоку 30 мкл/хв. Швидкості асоціації (k on) і швидкості дисоціації (koff) розраховуються з використанням моделі зв'язування Ленгмюра 1:1 (програмне забезпечення оцінка BIAcore™ версії 3.2). Рівноважна константа дисоціації (Кd) розраховується як відношення k off/kon. Якщо 6 -1 -1 швидкість асоціації перевищує 10 М с , визначена за допомогою аналізу поверхневого плазмонного резонансу вище, тоді швидкість асоціації може бути визначена за допомогою техніки гасіння флуоресценції, що вимірює збільшення або зменшення інтенсивності випромінювання флуоресценції (порушення =295 нм; емісія =340 нм, смуга пропущення 16 нм) при 25 °C 20 нМ антитіла до антигену (Fab-форма) в PBS, рН 7,2, у присутності зростаючих концентрацій антигену, що виміряне на спектрофотометрі, такому як спектрофотометр із зупинкою потоку (Aviv Instruments) або спектрофотометр 8000-й серії SLM-Aminco® (ThermoSpectronic) з кюветою, що перемішує. У будь-якому зі зазначених вище варіантів здійснення антитіло до Ly6E є гуманізованим. Відповідно до одного варіанта здійснення антитіло до Ly6E містить HVR, як у будь-якому зі зазначених вище варіантів здійснення, і додатково містить акцепторну каркасну область людини, наприклад, каркасну область імуноглобуліну людини або консенсусну каркасну область людини. Відповідно до деяких варіантів здійснення акцепторна каркасна область людини являє собою людську консенсусну VL каппа IV каркасну область (VLKIV) і/або VH каркасну область VH1. Відповідно до додаткового аспекту даного винаходу антитіло до Ly6E відповідно до будьякого зі зазначених вище варіантів здійснення являє собою моноклональне антитіло, у тому числі химерне, гуманізоване або людське антитіло. Відповідно до одного варіанта здійснення антитіло до Ly6E являє собою фрагмент антитіла, наприклад, Fv, Fab, Fab', scFv, діатіло, або F(аb')2-фрагмент. Відповідно до іншого варіанта здійснення антитіло являє собою, по суті, повнорозмірне антитіло, наприклад, антитіло IgG1 або антитіло іншого класу або ізотипу, як визначено в даному документі. Відповідно до додаткового аспекту антитіло до Ly6E відповідно до будь-якого зі зазначених вище варіантів здійснення може включати будь-яку з ознак, окремо або в комбінації, як описано в розділах 1-7 нижче. Відповідно до додаткового аспекту даного винаходу антитіло до Ly6E відповідно до будьякого зі зазначених вище варіантів здійснення являє собою моноклональне антитіло, що включає в себе людське антитіло. Відповідно до одного варіанта здійснення антитіло до Ly6E являє собою фрагмент антитіла, наприклад, Fv, Fab, Fab', scFv, діатіло або F(аb') 2-фрагмент. Відповідно до іншого варіанта здійснення антитіло являє собою, по суті, повнорозмірне антитіло, наприклад, антитіло IgG2a або антитіло іншого класу або ізотипу, як визначено в даному документі. Відповідно до додаткового аспекту антитіло до Ly6E відповідно до будь-якого зі зазначених вище варіантів здійснення може включати будь-яку з ознак, окремо або в комбінації, як описано в розділах 1-7 нижче. 1. Афінність антитіл Відповідно до деяких варіантів здійснення передбачене в даному документі антитіло характеризується константою дисоціації (Kd), що становить ≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ, -13 -8 ≤0,1 нМ, ≤0,01 нМ або ≤0,001 нМ, і, необов'язково, що становить ≥ 10 М. (наприклад, 10 М -8 -13 -9 -13 або менше, наприклад, від 10 М до 10 М, наприклад, від 10 М до 10 М). Відповідно до одного варіанта здійснення Kd вимірюють за допомогою аналізу зв'язування радіоактивно міченого антигену (RIA), виконаного з версією Fab антитіла, що представляє інтерес, і його антигену, за допомогою описаного наступного аналізу. Афінність зв'язування в розчині Fab для антигену вимірюється шляхом врівноважування Fab з мінімальною 125 концентрацією ( I) міченого антигену в присутності серії титрування неміченого антигену, а потім захоплення зв'язаного антигену на покритій антитілом до Fab пластини (дивитеся, наприклад, Chen et al., J. Mol. Biol. 293:865-881(1999)). Щоб створити умови для аналізу, мульти-луночні планшети MICROTITER® (Thermo Scientific) покривають на ніч захоплюючим антитілом до Fab у кількості 5 мкг/мл (Cappel Labs) в 50 мМ карбонату натрію (рН 9,6), а потім 23 UA 114814 C2 5 10 15 20 25 30 35 40 45 50 55 блокують 2 % (маса/об'єм) бичачим сироватковим альбуміном в PBS протягом від двох до п'яти годин при кімнатній температурі (приблизно 23 °C). На не адсорбуючому планшеті (Nunc 125 #269620) 100 пМ або 26 пМ [ I] антигену змішують з серійними розведеннями Fab, що представляє інтерес (наприклад, відповідно до оцінки антитіла до VEGF, Fab-12, в Presta et al., Cancer Res. 57:4593-4599 (1997)). Fab, що представляє інтерес, потім інкубують протягом ночі; однак, інкубація може тривати протягом більш тривалого періоду (наприклад, близько 65 годин), щоб гарантувати досягнення рівноваги. Після цього суміші переносять на захоплюючі планшети для інкубації при кімнатній температурі (наприклад, протягом однієї години). Потім розчин видаляють, і планшет промивають вісім разів з 0,1 % полісорбатом 20 (TWEEN-20®) у PBS. ТМ Коли пластини висихають, додають 150 мкл/лунку сцинтилятору (MICROSCINT-20 ; Packard), і TM планшети розраховують на гамма-лічильнику TOPCOUNT (Packard) протягом десяти хвилин. Концентрації кожного Fab, які дають менше або рівне 20 % від максимального зв'язування, вибирають для використання в аналізах конкурентного зв'язування. Відповідно до іншого варіанта здійснення Kd вимірюють з використанням аналізу Скетчарда, як описано у прикладі 4. Відповідно до іншого варіанта здійснення Kd вимірюють з використанням аналізу поверхневого плазмонного резонансу з використанням BIACORE®-2000 або BIACORE®-3000 (BIAcore, Inc., Piscataway, NJ) при 25 °C з чипами з іммобілізованим антигеном CM5 при ~ 10 одиницях відгуку (RU). Коротенько, карбоксиметильовані декстранові біосенсорні чипи (СМ5, BIACORE, Inc.) активуються з N-етил-N'(3диметиламінопропіл)карбодіімідом (EDC) і N-гідроксисукцинімідом (NHS) відповідно до інструкцій постачальника. Антиген розбавляють ацетатом натрію в концентрації 10 мМ, рН 4,8, до 5 мкг/мл (~ 0,2 мкм) перед введенням при швидкості потоку 5 мкл/хвилину для досягнення приблизно10 одиниць відгуку (RU) зв'язаного білка. Після введення антигену 1М етаноламін впорскується для блокування непрореагувавших груп. Для вимірів кінетики дворазові серійні розведення Fab (0,78 нМ до 500 нМ) вводять у PBS з 0,05 % полісорбатом 20 (TWEEN-20ТМ) поверхнево-активною речовиною (PBST) при 25 °C при швидкості потоку приблизно 25 мкл/хв. Швидкості асоціації (kon) і швидкості дисоціації (k off) розраховуються з використанням моделі зв'язування Ленгмюра 1:1 (програмне забезпечення оцінка BIAcore™ версії 3.2), одночасно використовуючи припасування сенсограм асоціації та дисоціації. Рівноважна константа дисоціації (Кd) розраховується як відношення koff/kon. Дивитеся, наприклад, Chen et al., J. Mol. 6 -1 -1 Biol. 293:865-881 (1999). Якщо швидкість асоціації перевищує 10 М с , визначена за допомогою аналізу поверхневого плазмонного резонансу вище, тоді швидкість асоціації може бути визначена за допомогою техніки гасіння флуоресценції, що вимірює збільшення або зменшення інтенсивності випромінювання флуоресценції (порушення =295 нм; емісія =340 нм, смуга пропущення 16 нм) при 25 °C 20 нМ антитіла до антигену (Fab-форма) в PBS, рН 7,2, у присутності зростаючих концентрацій антигену, що виміряне в спектрометрі, такому як спектрофотометр із зупинкою потоку (Aviv Instruments) або спектрофотометр 8000-й серії SLMAminco® (ThermoSpectronic) з кюветою, що перемішує. 2. Фрагменти антитіл Відповідно до деяких варіантів здійснення передбачене в даному документі антитіло являє собою фрагмент антитіла. Фрагменти антитіл містять у собі без обмеження Fab, Fab', Fab'-SH, F(аb')2, Fv і scFv фрагменти, а також інші фрагменти, описані нижче. Для огляду деяких фрагментів антитіл дивитеся Hudson et al. Nat. Med. 9:129-134 (2003). Для огляду фрагментів scFv, дивитеся, наприклад, Pluckthün, in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., (Springer-Verlag, New York), pp. 269-315 (1994); дивитеся також WO 93/16185 і патент США № 5571894 і 5587458. Для обговорення фрагментів Fab і F(аb') 2, що містять сполучні рецептор реутилізації залишки епітопу та характеризуються збільшеним періодом напівжиття in vivo, дивитеся патент США № 5869046. Діатіла являють собою фрагменти антитіл із двома антигенсполучними сайтами, які можуть бути бівалентними або біспецифічними. Дивитеся, наприклад, EP 404097; WO 1993/01161; Hudson et al., Nat. Med. 9:129-134 (2003); і Hollinger et al., Proc. Natl. Acad. Sci. USA 90: 64446448 (1993). Триатіла та тетратіла також описані в Hudson et al., Nat. Med. 9:129-134 (2003). Однодоменні антитіла являють собою фрагменти антитіл, що містять всі або частину варіабельного домена важкого ланцюга або всі або частину варіабельного домена легкого ланцюга антитіла. Відповідно до деяких варіантів здійснення однодоменне антитіло являє собою людське однодоменне антитіло (Domantis, Inc., Waltham, MA; дивитеся, наприклад, патент США № 6248516 У1). Фрагменти антитіл можуть бути отримані за допомогою різних технік, що включають у себе без обмеження протеолітичне розщеплення інтактного антитіла, а також одержання за 24 UA 114814 C2 5 10 15 20 25 30 35 40 45 50 55 допомогою рекомбінантних клітин-хазяїнів (наприклад, E.coli або фага), як описано в даному документі. 3. Химерні та гуманізовані антитіла Відповідно до деяких варіантів здійснення передбачене в даному документі антитіло являє собою химерне антитіло. Деякі химерні антитіла описані, наприклад, у патенті США № 4816567; Morrison et al., Proc. Nail. Акад. Sci. США, 81: 6851-6855 (1984)). В одному прикладі химерне антитіло містить відмінну від людської варіабельну область (наприклад, варіабельну область, отриману від миші, пацюка, хом'яка, кролика або не людиноподібного примата, такого як мавпа) і людську константну область. У додатковому прикладі, химерне антитіло являє собою антитіло "з перемиканням класу", в якому клас або підклас був змінений стосовно такому у вихідного антитіла. Химерні антитіла містять у собі їх антигенсполучні фрагменти. Відповідно до деяких варіантів здійснення химерне антитіло являє собою гуманізоване антитіло. Як правило, відмінне від людського антитіло являє собою гуманізоване, щоб зменшити імуногенність для людини, зберігаючи при цьому специфічність й афінність вихідного відмінного від людського антитіла. Як правило, гуманізоване антитіло містить один або декілька варіабельних доменів, у яких HVR, наприклад, CDR (або їх частини) походять від відмінного від людського антитіла, і FR (або їх частини) походять від послідовностей людського антитіла. Гуманізоване антитіло необов'язково також буде містити щонайменше частину людської константної області. Відповідно до деяких варіантів здійснення деякі залишки FR у гуманізованому антитілі заміщені на відповідні залишки від відмінного від людського антитіла (наприклад, антитіла, від якого беруть походження залишки HVR), наприклад, для відновлення або поліпшення специфічності або афінності антитіла. Гуманізовані антитіла та способи їх одержання розглядаються, наприклад, в Almagro and Fransson, Front. Biosci. 13:1619-1633 (2008), і більш докладно описані, наприклад, в Riechmann et al., Nature 332:323-329 (1988); Queen et al., Proc. Nat'l Acad. Sci. USA 86:10029-10033 (1989); патенті США № 5821337, 7527791, 6982321 і 708,409; Kashmiri et al., Methods 36:25-34 (2005) (опис трансплантації SDR (а-CDR)); Padlan, Mol. Immunol. 28: 489-498 (1991) (опис "зміни поверхні"); Dall'Acqua et al., Methods 36:43-60 (2005) (опис "перестановки FR"); і Osbourn et al., Methods 36:61-68 (2005) and Klimka et al., Br. J. Cancer, 83:252-260 (2000) (опис підходу "спрямованого відбору" до перестановки FR). Людські каркасні області, які можуть бути використані для гуманізації, містять у собі без обмеження: каркасні області, вибрані з використанням способу "найкращої відповідності" (дивитеся, наприклад, Sims et al. J. Immunol. 151:2296 (1993)); каркасні області, отримані з консенсусної послідовності антитіл людини конкретної підгрупи варіабельних областей легких або важких ланцюгів (дивитеся, наприклад, Carter et al. Proc. Natl. Acad. Sci. USA, 89:4285 (1992); and Presta et al. J. Immunol., 151:2623 (1993)); людські дозрілі (соматично мутували) каркасні області або каркасні області зародкової лінії людини (дивитеся, наприклад, Almagro and Fransson, Front. Biosci. 13:1619-1633 (2008)); і каркасні області, що беруть походження від скринінгу бібліотек FR (дивитеся, наприклад, Baca et al., J. Biol. Chem. 272:10678-10684 (1997) і Rosok et al., J. Biol. Chem. 271:22611-22618 (1996)). 4. Людські антитіла Відповідно до деяких варіантів здійснення передбачене в даному документі антитіло являє собою людське антитіло. Людські антитіла можуть бути отримані з використанням різних відомих у даній області техніки. Людські антитіла описані в цілому в van Dijk and van de Winkel, Curr. Opin. Pharmacol. 5: 368-74 (2001) і Lonberg, Curr. Opin. Immunol. 20:450-459 (2008). Людські антитіла можуть бути отримані шляхом введення імуногена в трансгенну тварину, яка була модифікована, для виробництва інтактних людських антитіл або інтактних антитіл з людськими варіабельними областями у відповідь на антигенну стимуляцію. Такі тварини, як правило, містять всі або частину локусів імуноглобуліну людини, які заміщають ендогенні локуси імуноглобуліну або які присутні поза хромосомою або інтегровані у випадковому порядку в хромосоми тварини. У таких трансгенних мишах ендогенні локуси імуноглобуліну, як правило, інактивовані. Для огляду способів одержання людських антитіл із трансгенних тварин, дивитеся Lonberg, Nat. Biotech. 23:1117-1125 (2005). Дивитеся також, наприклад, патенти США № TM 6075181 і 6150584, що описують технологію XENOMOUSE ; патент США № 5770429, що описує технологію HUMAB®; патент США № 7041870, що описує технологію K-M MOUSE®, і попередню заявку на патент США № US2007/0061900, що описує технологію VELOCIMOUSE®). Варіабельні області людини від інтактних антитіл, вироблені такими тваринами, можуть бути додатково модифіковані, наприклад, шляхом об'єднання з іншою людською константною областю. 25 UA 114814 C2 5 10 15 20 25 30 35 40 45 50 55 Людські антитіла можуть також бути отримані заснованими на гібридомі способами. Були описані клітинні лінії мієломи людини та гетеромієломи миші-людини для одержання людських моноклональних антитіл. (Дивитеся, наприклад, Kozbor J. Immunol., 133: 3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987); і Boerner et al., J. Immunol., 147: 86 (1991)). Людські антитіла, отримані за допомогою технології B-клітинних гібридом людини, також описані в Li et al., Proc. Natl. Acad. Sci. USA, 103:3557-3562 (2006). Додаткові способи містять у собі ті, які описані, наприклад, у патенті США № 7189826 (описує виробництво моноклональних антитіл IgМ людини з гібридомних клітинних ліній) і Ni, Xiandai Mianyixue, 26(4):265-268 (2006) (описує гібридоми людина-людина). Технологія людських гібридом (технологія триоми) також описана у Vollmers and Brandlein, Histology and Histopathology, 20(3):927-937 (2005) і Vollmers and Brandlein, Methods and Findings in Experimental and Clinical Pharmacology, 27(3):185-91 (2005). Людські антитіла можуть також бути отримані шляхом виділення послідовностей варіабельного домена Fv-клону, вибраних із бібліотек фагового дисплея людського походження. Такі послідовності варіабельного домена можуть бути потім об'єднані з бажаною людською константною областю. Техніки відбору антитіл людини з бібліотек антитіл описані нижче. 5. Отримані з бібліотек антитіла Антитіла згідно з даним винаходом можуть бути виділені шляхом скринінгу комбінаторних бібліотек антитіл з бажаною активністю або активностями. Наприклад, у даній області техніки відомі різні способи для виробництва бібліотек фагового дисплея та скринінгу таких бібліотек на антитіла, що мають бажані характеристики зв'язування. Такі способи розглядаються, наприклад, в Hoogenboom et al. in Methods in Molecular Biology 178:1-37 (O'Brien et al., ed., Human Press, Totowa, NJ, 2001) і додатково описані, наприклад, в McCafferty et al., Nature 348:552-554; Clackson et al., Nature 352: 624-628 (1991); Marks et al., J. Mol. Biol. 222: 581-597 (1992); Marks and Bradbury, in Methods in Molecular Biology 248:161-175 (Lo, ed., Human Press, Totowa, NJ, 2003); Sidhu et al., J. Mol. Biol. 338(2): 299-310 (2004); Lee et al., J. Mol. Biol. 340(5): 1073-1093 (2004); Fellouse, Proc. Natl. Acad. Sci. USA 101(34): 12467-12472 (2004); і Lee et al., J. Immunol. Methods 284(1-2): 119-132(2004). У деяких способах фагового дисплея репертуари генів VH і VL окремо клонують за допомогою полімеразної ланцюгової реакції (ПЛР) і рекомбінують у випадковому порядку у фагових бібліотеках, які потім можуть бути піддані скринінгу на антиген-сполучний фаг, як описано у Winter et al., Ann. Rev. Immunol., 12: 433-455 (1994). Фаги, як правило, відображають фрагменти антитіл або як одноланцюгові фрагменти Fv (scFv), або як фрагменти Fab. Бібліотеки з імунізованих джерел забезпечують високоафіннні антитіла до імуногена без необхідності побудови гібридом. Альтернативно, наївний репертуар може бути клонований (наприклад, від людини), щоб забезпечити єдине джерело антитіл до широкого спектра невласних, а також власних антигенів без імунізації, як описано Griffiths et al., EMBO J, 12: 725734 (1993). Нарешті, наївні бібліотеки також можуть бути отримані синтетично шляхом клонування нереаранжированих сегментів V-гена зі стовбурних клітин, і з використанням ПЛРпраймерів, що містять випадкову послідовність для кодування високо варіабельних областей CDR3 і для виконання перестановки in vitro, як описано Hoogenboom and Winter, J. Mol. Biol., 227: 381-388 (1992). Патентні публікації, що описують людські фагові бібліотеки антитіл містять у собі, наприклад: патент США № 5750373 й опублікований патент США № 2005/0079574, 2005/0119455, 2005/0266000, 2007/0117126, 2007/0160598, 2007/0237764, 2007/0292936, і 2009/0002360. Антитіла або фрагменти антитіл, виділені з бібліотек антитіл людини, вважаються в даному документі людськими антитілами або фрагментами людських антитіл. 6. Мультиспецифічні антитіла Відповідно до деяких варіантів здійснення передбачене в даному документі антитіло являє собою мультиспецифічне антитіло, наприклад, біспецифічне антитіло. Мультиспецифічні антитіла являють собою моноклональні антитіла, які мають специфічність зв'язування щонайменше з двома різними сайтами. Відповідно до деяких варіантів здійснення одна зі специфічностей зв'язування призначена для Ly6E, а інша – для будь-якого іншого антигену. Відповідно до деяких варіантів здійснення одна зі специфічностей зв'язування призначена для Ly6E, а інша – для CD3. Дивитеся, наприклад, патент США № 5821337. Відповідно до деяких варіантів здійснення біспецифічні антитіла можуть зв'язуватися з двома різними епітопами Ly6E. Біспецифічні антитіла можуть бути також використані для локалізації цитотоксичних засобів у клітини, які експресують Ly6E. Біспецифічні антитіла можуть бути отримані у вигляді повнорозмірних антитіл або фрагментів антитіл. 26 UA 114814 C2 5 10 15 20 25 30 35 Техніки одержання мультиспецифічних антитіл містять у собі без обмеження рекомбінантну коекспресію двох пар важкого ланцюга-легкого ланцюга імуноглобуліну, що характеризуються різними специфічностями (дивитеся Milstein and Cuello, Nature 305: 537 (1983)), WO 93/08829 і Traunecker et al., EMBO J. 10: 3655 (1991)), і конструювання "виступ-в-западину" (дивитеся, наприклад, патент США № 5731168). Мультиспецифічні антитіла також можуть бути отримані шляхом конструювання з використанням електростатичної взаємодії для одержання молекули Fc-гетеродимерних антитіл (WO 2009/089004A1); зшивання двох або більше антитіл або фрагментів (дивитеся, наприклад, патент США № 4676980 і Brennan et al., Science, 229: 81 (1985)); з використанням лейцинових блискавок для виробництва біспецифічних антитіл (дивитеся, наприклад, Kostelny et al., J. Immunol., 148(5):1547-1553 (1992)); з використанням технології "діатіло" для фрагментів біспецифічних антитіл (дивитеся, наприклад, Hollinger ін, Proc Natl Acad Sci USA, 90: 6444-6448 (1993)); і з використанням одноланцюгових Fv (sFv) димерів (дивитеся, наприклад, Gruber et al., J. Immunol., 152:5368 (1994)); і підготовку триспецифічних антитіл, як описано, наприклад, у Татт ін. J. Immunol. 147:60 (1991). Також у даний документ включені сконструйовані антитіла з трьома або більше функціональними антигенсполучними сайтами, що включають у себе "антитіла восьминоги" (дивитеся, наприклад, US 2006/0025576A1). Антитіло або його фрагмент у даному документі також містить у собі "Fab з подвійною дією" або "DAF", що містить антигенсполучний сайт, що зв'язується з Ly6E, а також з іншим, відмінним антигеном (дивитеся, US 2008/0069820, наприклад). 7. Варіанти антитіл Відповідно до деяких варіантів здійснення розглядаються варіанти амінокислотних послідовностей передбачених у даному документі антитіл. Наприклад, може бути вимагатися поліпшення афінності зв'язування й/або інші біологічні властивості антитіла. Варіанти амінокислотних послідовностей антитіла можуть бути отримані шляхом внесення відповідних модифікацій у нуклеотидну послідовність, що кодує антитіло, або шляхом пептидного синтезу. Такі модифікації містять у собі, наприклад, делеції та/або вставки в і/або заміни залишків в амінокислотних послідовностях антитіла. Будь-яка комбінація делеції, вставки та заміни може бути зроблена для досягнення кінцевого конструкта, за умови, що кінцевий конструкт має бажані характеристики, наприклад, антигенсполучні. а) Варіанти замін, вставок і делецій Відповідно до деяких варіантів здійснення передбачені варіанти антитіл, що містять одну або декілька амінокислотних замін. Сайти, що представляють інтерес, для замісного мутагенезу містять у собі HVR і FR. Консервативні заміни показані в таблиці 1 під заголовком "переважні заміни". Більш істотні зміни наведені в таблиці 1 під заголовком "ілюстративні заміни" і, як додатково описано нижче, з посиланням на класи бічних ланцюгів амінокислот. Амінокислотні заміни можуть бути введені в антитіло, що представляє інтерес, а також продукти, піддані скринінгу на бажану активність, наприклад, збережене/поліпшене зв'язування антигену, зменшену імуногенність або поліпшені ADCC або CDC. 40 Таблиця 1 Оригінальний залишок Ala (A) Arg (R) Asn (N) Asp (D) Cys (C) Gln (Q) Glu (E) Gly (G) His (H) Ile (I) Leu (L) Lys (K) Met (M) Phe (F) Pro (P) Ser (S) Thr (T) Ілюстративні заміни Val; Leu; Ile Lys; Gln; Asn Gln; His; Asp, Lys; Arg Glu; Asn Ser; Ala Asn; Glu Asp; Gln Ala Asn; Gln; Lys; Arg Leu; Val; Met; Ala; Phe; Норлейцин Norleucine; Ile; Val; Met; Ala; Phe Arg; Gln; Asn Leu; Phe; Ile Trp; Leu; Val; Ile; Ala; Tyr Ala Thr Val; Ser 27 Переважні заміни Val Lys Gln Glu Ser Asn Asp Ala Arg Leu Ile Arg Leu Tyr Ala Thr Ser UA 114814 C2 Оригінальний залишок Ілюстративні заміни Trp (W) Tyr; Phe Tyr (Y) Trp; Phe; Thr; Ser Val (V) Ile; Leu; Met; Phe; Ala; Норлейцин 5 10 15 20 25 30 35 40 45 50 55 Переважні заміни Tyr Phe Leu Амінокислоти можуть бути згруповані відповідно до загальних властивостей бічних ланцюгів: (1) гідрофобні: норлейцин, Met, Ala, Val, Leu, Ile; (2) нейтральні гідрофільні: Cys, Ser, Thr, Asn, Gln; (3) кислотні: Asp, Glu; (4) основні: His, Lys, Arg; (5) залишки, що впливають на орієнтацію ланцюга: Gly, Pro; (6) ароматичні: Trp, Tyr, Phe. Неконсервативні заміни спричинять заміну представника одного з цих класів на інший клас. Один тип варіанта замін містить у собі заміну одного або декількох залишків гіперваріабельної області вихідного антитіла (наприклад, гуманізованого або людського антитіла). Як правило, отриманий у результаті варіант(и), вибраний для подальшого вивчення, буде містити модифікації (наприклад, поліпшення) певних біологічних властивостей (наприклад, збільшену афінність, знижену імуногенність) щодо вихідного антитіла та/або буде характеризуватися по суті збереженими певними біологічними властивостями вихідного антитіла. Ілюстративний варіант із замінами являє собою антитіло з дозрілою афінністю, яке може бути легко створено, наприклад, з використанням заснованих на фаговому дисплеї технік дозрівання афінності, таких як ті, які описані в даному документі. Коротко, один або декілька залишків HVR мутують, і варіантні антитіла відображаються на фаге та піддаються скринінгу на конкретну біологічну активність (наприклад, афінність зв'язування). Зміни (наприклад, заміни) можуть бути зроблені в HVR, наприклад, для поліпшення афінності антитіл. Такі зміни можуть бути внесені в "гарячі точки" HVR, тобто, залишки, кодовані кодонами, які піддаються мутації на високій частоті протягом соматичного процесу дозрівання (дивитеся, наприклад, Chowdhury, Methods Mol. Biol. 207:179-196 (2008)), і/або SDR (a-SDR), з отриманим у результаті варіантним VH або VL, досліджуваним на афінність зв'язування. Дозрівання афінності шляхом побудови та повторного відбору з вторинних бібліотек було описано, наприклад, в Hoogenboom et al. in Methods in Molecular Biology 178:1-37 (O'Brien et al., ed., Human Press, Totowa, NJ, (2001).) Відповідно до деяких варіантів здійснення дозрівання афінності, розмаїтість вводиться у варіабельні гени, вибрані для дозрівання, за допомогою будь-якого з множини способів (наприклад, ПЛР, що допускає помилки, перестановкою ланцюгів або олігонуклеотид-спрямованим мутагенезом). Потім створюється вторинна бібліотека. Потім цю бібліотеку піддають скринінгу, щоб ідентифікувати будь-які варіанти антитіл з бажаною афінністю. Інший спосіб введення розмаїтості містить у собі HVR-спрямовані підходи, в яких декілька залишків HVR (наприклад, 4-6 залишків одночасно) рандомізовані. HVR залишки, що беруть участь у зв'язуванні антигену, можуть бути специфічно ідентифіковані, наприклад, з використанням скануючого аланіном мутагенезу або моделювання. CDR-H3 і CDR-L3, зокрема, часто стають мішенню. Відповідно до деяких варіантів здійснення заміни, вставки або делеції можуть відбуватися в межах одного або декількох HVR доти, поки такі зміни істотно не зменшують здатність антитіла зв'язувати антиген. Наприклад, консервативні зміни (наприклад, передбачені в даному документі консервативні заміни), які істотно не знижують афінність зв'язування, можуть бути зроблені в HVR. Такі зміни можуть бути поза "гарячими точками" HVR або SDR. Відповідно до деяких варіантів здійснення передбачених вище послідовностей варіантних VH і VL, кожний HVR або не змінюється, або містить не більше ніж одну, дві або три амінокислотні заміни. Застосовний спосіб для ідентифікації залишків або областей антитіла, які можуть бути націлені для мутагенезу, називається "скануючий аланіном мутагенез", описаний Cunningham and Wells (1989) Science, 244:1081-1085. У цьому способі залишок або групу залишків-мішеней (наприклад, заряджені залишки, такі як Arg, Asp, Lys, His і Glu) ідентифікують і заміщають нейтральною або негативно зарядженою амінокислотою (наприклад, аланіном або поліаланіном), щоб визначити, чи впливає це на взаємодію антитіла з антигеном. Подальші заміни можуть бути введені в амінокислотні локації, що показують функціональну чутливість до початкових замін. Альтернативно або додатково, кристалічна структура комплексу антигенантитіло використовується для ідентифікації точок контакту між антитілом й антигеном. Такі контактні залишки та сусідні залишки можуть бути націлені або ліквідовані як кандидати на 28
ДивитисяДодаткова інформація
Назва патенту англійськоюAnti-ly6e antibodies and immunoconjugates and methods of use
Автори англійськоюChang, Peter, Sakanaka, Chie
Автори російськоюЧанг Питэр, Саканака Чие
МПК / Мітки
МПК: C07K 16/28, A61K 39/395
Мітки: виділене, зв'язується, антитіло, яке
Код посилання
<a href="https://ua.patents.su/111-114814-vidilene-antitilo-yake-zvyazuehtsya-z-ly6e.html" target="_blank" rel="follow" title="База патентів України">Виділене антитіло, яке зв’язується з ly6e</a>
Попередній патент: Спосіб друку із застосуванням фарби для глибокого друку із закріпленням окисненням та фарб для глибокого друку із закріпленням за допомогою уф-видимого випромінювання
Наступний патент: Система для підготовки стовбурових клітин жирової тканини
Випадковий патент: Спосіб регулювання тиску при постачанні газу споживачам з можливістю обмеження витрати