Детектування та підрахунок мікроорганізмів
Формула / Реферат
1. Спосіб детектування та підрахунку життєздатних мікроорганізмів у пробі, що потенційно містить вказані мікроорганізми, що включає
(1) контактування вказаних мікроорганізмів вказаної проби із щонайменше однією
- сполукою відновлення, що включає піровиноградну кислоту або її солі, та
- живильним середовищем, та
(2) інкубацію продукту стадії (1), та
(3) детектування та кількісне визначення вказаних життєздатних мікроорганізмів, де мікроорганізми належать до виду Legionella pneumophila, та де сполука відновлення безпосередньо або опосередковано викликає вплив на метаболізм для зменшення оксидативного стресу мікроорганізму.
2. Спосіб за п. 1, в якому сполука відновлення є сполукою, що інгібує утворення та/або розкладає ROS.
3. Спосіб за будь-яким з пп. 1 або 2, в якому стадія (1) включає контактування вказаної проби із згаданою сполукою відновлення, що міститься у середовищі відновлення, переважно, у неселективному середовищі відновлення, та настурпне приведення її у контакт із живильним середовищем, переважно, селективним живильним середовищем.
4. Спосіб за п. 3, в якому середовище відновлення являє собою рідину, переважно бульйон.
5. Спосіб за будь-яким з попередніх пунктів, в якому стадія (1) включає контактування вказаної проби із живильним середовищем, переважно, неселективним живильним середовищем, та наступне приведення її в контакт із вказаною сполукою відновлення, що міститься у середовищі відновлення.
6. Спосіб за п. 3, в якому живильне середовище являє собою живильне середовище, переважно тверде, та більш переважно селективне агарове живильне середовище.
7. Спосіб за будь-яким з попередніх пунктів, в якому стадія (1) включає контактування вказаної проби із живильним середовищем, що містить вказану сполуку відновлення.
8. Спосіб за будь-яким з попередніх пунктів, в якому живильне середовище являє собою буферний екстракт дріжджів деревного вугілля (BCYE) або GVPC агарове живильне середовище.
9. Спосіб за будь-яким з попередніх пунктів, в якому сполука відновлення додатково містить тіогліколеву кислоту (або її сіль).
10. Спосіб за будь-яким з пп. 1-9, в якому сполука відновлення додатково містить глютамінову кислоту (або її сіль).
11. Спосіб за будь-яким з попередніх пунктів, в якому середовище відновлення та/або живильне середовище містять кетокислоту та/або фермент, що уловлює відновлений кисень.
12. Набір для детектування та підрахунку життєздатних мікроорганізмів виду Legionella pneumophila у пробі, що потенційно містить вказані мікроорганізми, що містить:
(1) щонайменше одну сполуку відновлення, що включає піровиноградну кислоту або її солі,
(2) живильне середовище,
(3) засоби інкубації,
(4) засоби детектування та кількісного визначення мікроорганізмів,
де мікроорганізми належать до виду Legionella pneumophila, та де сполука відновлення безпосередньо або опосередковано викликає вплив на метаболізм для зменшення оксидативного стресу мікроорганізму.
Текст
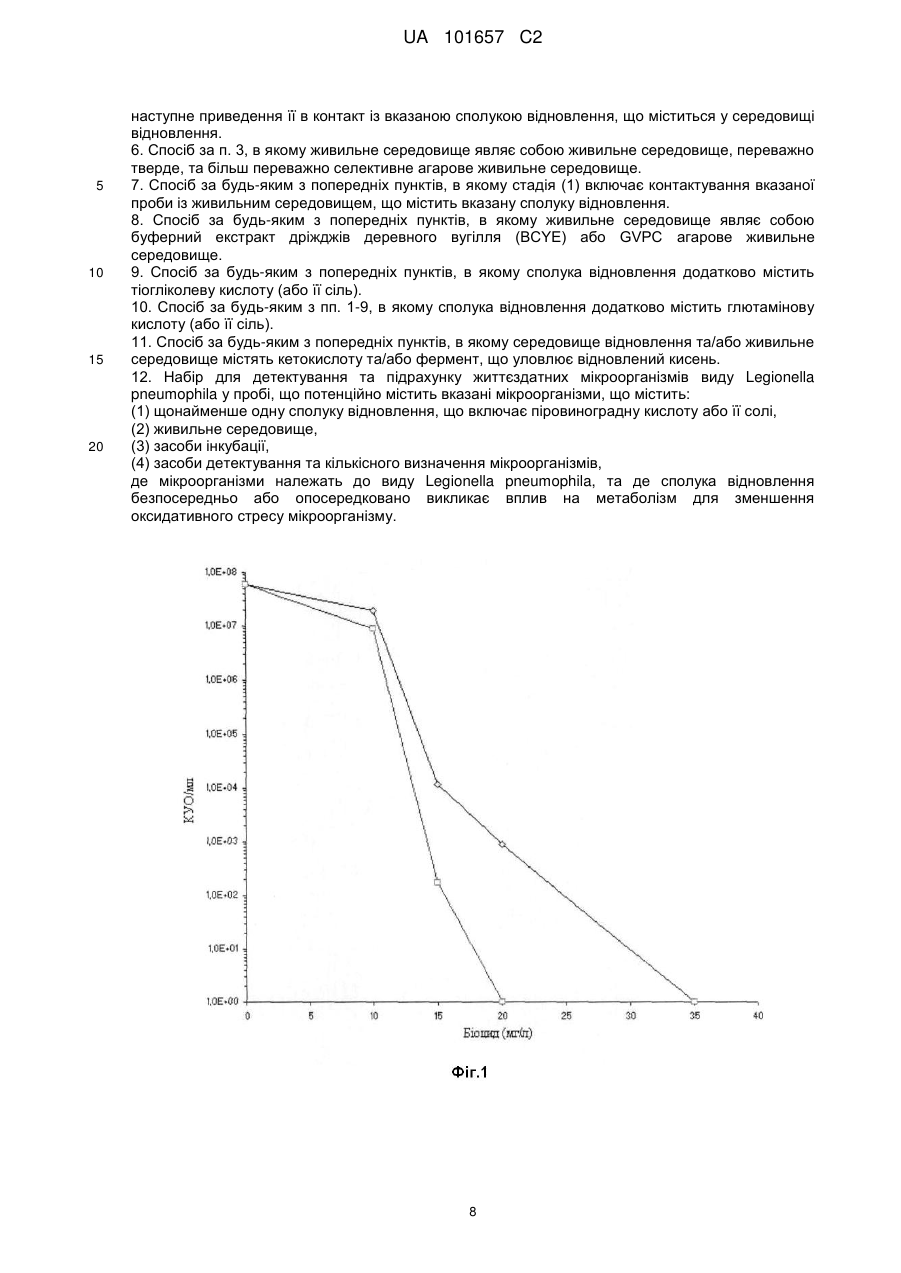
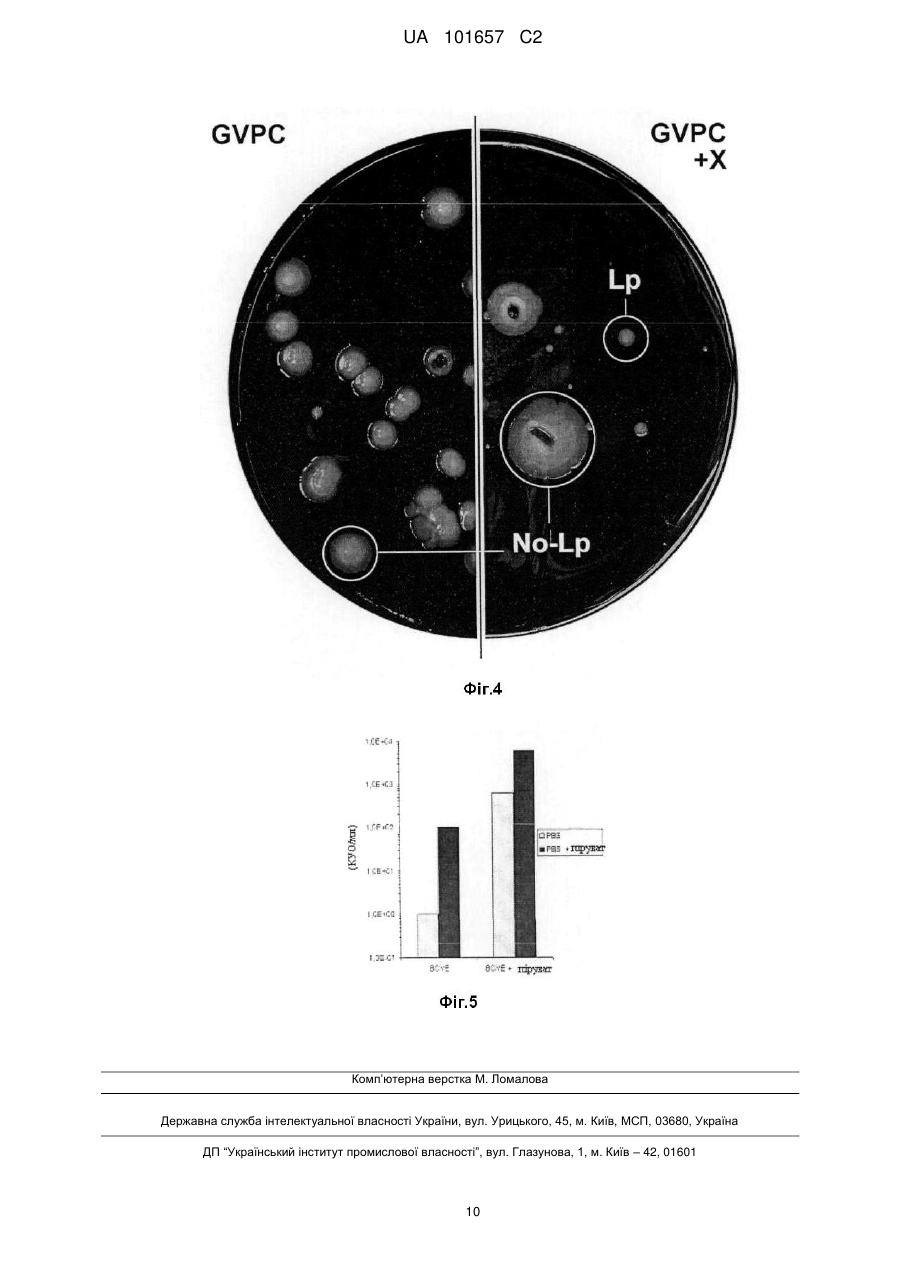
Реферат: Винахід стосується способу детектування та підрахунку життєздатних мікроорганізмів у пробі, що потенційно містить вказані мікроорганізми, що включає (1) контактування вказаних мікроорганізмів вказаної проби із щонайменше однією сполукою відновлення, що включає піровиноградну кислоту або її солі, та живильним середовищем, та (2) інкубацію продукту стадії (1), та (3) детекцію та кількісне визначення вказаних життєздатних мікроорганізмів, де мікроорганізми належать до виду Legionella pneumophila. UA 101657 C2 (12) UA 101657 C2 UA 101657 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід належить до способу детекції та підрахунку життєздатних мікроорганізмів виду Legionella pneumophila у пробі. Даний винахід також включає комплект, придатний для застосування у вказаному способі. Даний спосіб та комплект дозволяють більш швидке визначення життєздатних мікроорганізмів. Бактерії Legionella є убіквітарними у мокрих або вологих середовищах, таких, як грунт та не морські водні середовища. Вони можуть також зустрічатися в водопроводах теплої та холодної води, стояках водяного охолодження систем кондиціонування повітря та зволожувачів повітря. Legionella, особливо Legionella pneumophila, є патогенами, що можуть спричиняти гострі бактеріальні пневмонії, загальновідомі як "хвороба легіонерів", яка часто є летальною для інфікованих осіб. Традиційно детекцію та підрахунок Legionella pneumophila здійснюють шляхом культивування клітин. Цей спосіб може бути реалізований шляхом вимірювання бактерій, які можуть бути культивовані, за допомогою підрахунку шляхом висівання на чашках Петрі або вимірювання мікроколоній із застосуванням способу фільтрувальних мембран. Ці способи оцінюють здатність життєздатних бактерій утворювати колонію або мікроколонію. На жаль, такі способи зазвичай потребують від 3 до 10 днів для того, щоб дозволити утворення колоній або мікроколоній. У разі експлуатації водопроводів існує неприйнятний ризик інфікування людей протягом цього часу. Інші способи детекції загальної кількості мікроорганізмів Legionella включають методи ПЛР (полімеразної ланцюгової реакції) ПЛР застосовує ДНК полімеразу для ампліфікації частини ДНК за допомогою ферментної реплікації in vitro. Протягом розвитку методу генеровану ДНК застосовують як темплату для реплікації, що запускає ланцюгову реакцію, в якій темплата ДНК експоненційно ампліфікується ПЛР дозволяє ампліфікацію однієї або декількох копій частин ДНК шляхом генерування мільйонів або більше копій частин ДНК. Типово такий спосіб описано у Diederen та інші, J Med Microbiol 2007 Jan, 56 (Pt 1):94-101. Проте недолік ПЛР полягає у тому, що проби мають тенденцію до вмісту інгібіторів реакції полімеризації та тому не забезпечують відповідні кількісні результати. Додатково, метод засновано на стадії попереднього очищення ДНК, що може призвести до втрати ДНК з наступною недостатньою оцінкою наявних Legionella. Деякою мірою такі недоліки долають ПЛР у режимі реального часу, що є кількісною. Проте такий метод не може розрізняти життєздатні клітини та нежиттєздатні клітини. Іншим методом є флуоресцентна гібридизація in situ (FISH), в якій олігонуклеотидний зонд, мічений флуоресцентною речовиною, проникає у клітини бактерій. Якщо рибосомні нуклеїнові кислоти (рРНК) мають послідовність, що відповідає зонду відому як мішень, то зонд приєднається до своєї мішені та не буде видалений жодною наступною стадією промивання. Бактерії, в яких зонд зафіксовано, будуть потім випромінювати флуоресцентний сигнал. Цей флуоресцентний сигнал може бути потім кількісно оцінений за допомогою таких методів, як проточна цитометрія, твердофазна цитометрія або епіфлуоресцентна мікроскопія. Типову методику FISH описано у Dutil S та інші J АррІ Місrobiol 2006 May; 100(5):955-63. Проте, при застосуванні методу FISH окремо може бути детектована загальна кількість життєздатних Legionella pneumophila, проте, на жаль, цей спосіб не може ідентифікувати виключно такі бактерії Legionella pneumophila, що здатні ділитися та у результаті утворювати колонію. Додатковий спосіб підрахунку життєздатних Legionella pneumophila включає ChemChrome V6 та описано Delgado-Viscogliosi та інші АррІ Environ Microbiol. 2005 Jul; 71(7):4086-96. Даний спосіб дозволяє кількісне визначення Legionella pneumophila, a також диференціацію життєздатних та нежиттєздатних бактерій. Він сполучає специфічну детекцію клітин Legionella із застосуванням антитіл та маркеру бактеріальної життєздатності (ChemChrome V6) та задіє епіфлуоресцентну мікроскопію для підрахунку. Проте, хоча даний метод розрізнює життєздатні та нежиттєздатні бактерії, він не здатний окремо ідентифікувати такі колонієутворюючі бактерії. US 20070218522 описує способи та композиції детекції та кількісного визначення життєздатних Legionella та інших гетеротрофних аеробних бактерій, де спосіб включає застосування дипслайдів, що містять поглинаюче середовище, речовини, що сприяють зростанню та селективні ростові речовини для швидкої детекції та кількісного визначення мікроколоній Legionella. Цей метод не підраховує уражені бактерії. ЕР 1329515 відноситься до способу аналізу наявності мікроорганізмів у газоподібному середовищі, що містить пероксид водню, шляхом приведення у контакт газоподібного оточення із ростовим агаровим середовищем, що містить сіль піровиноградної кислоти та дозволяє розвиток колоній мікроорганізмів. Методи, що включають зростання колоній у ростовому середовищі, такому, як живильна агарова пластинка, загалом, вважають більш точними. Відповідно, спосіб підрахунку шляхом 1 UA 101657 C2 5 10 15 20 25 30 35 40 45 50 55 60 висівання на пластинку залишається переважним вибором способу одержання загальної кількості життєздатності. Це загалом означає нанесення проби, що потенційно може містити мікроорганізм, на пластинку, що містить тверде живильне джерело або ростове середовище. Такий метод загалом має назву висівання на пластинку. Під загальною кількістю життєздатності ми маємо на увазі загальну кількість бактерій, здатних до продукування популяції, яку може розрізняти спостерігач. Типово це означатиме видиму колонію на поверхні ростового середовища, такого, як живильна агарова пластинка. Проте, такі мікроорганізми, як Legionella pneumophila у середовищі можуть бути піддані одному або більше стресам, що попереджає зростання та розмноження мікроорганізмів в оточенні середовища. Такі піддані стресу мікроорганізми не будуть ділитися взагалі або формувати видиму колонію за нормальних умов культивування. У такому середовищі частина клітин мікроорганізмів буде, загалом, піддана стресу, викликаному умовами оточуючого середовища, такими, як, голодування, наявність біоциду, тепловий шок та виснаження. Додатково, ці клітини можуть бути у чутливому фізіологічному стані, в якому метод висівання на пластинки мікроорганізмів може загострювати стрес таких вже підданих стресу клітин мікроорганізмів через наявність атмосферного кисню. Додатково, це може призвести до штучної смерті підданих стресу бактерій, що призводить до недооцінки загальної кількості життєздатності. Додатково, недооцінювання життєздатних Legionella pneumophila способом висівання на пластинки може стати небезпечною у тому, що стосується її патогенності. З 1970-х років повідомлялося, що уловлювачі активних форм кисню (ROS) мають бути використані для обмеження впливу оксидативного стресу протягом процесу висівання на пластинки. Про це було повідомлено у Speck та інші, repair and enumeration of injured coliforms by a plating procedure, Appl Microbiol 29, 549-50 (1975); Martin та інші Catalase: its effect on microbial enumeration. Appl Environ Microbiol 32, 731-4 (1976); Brewer та інші Beneficial effects of catalase or pyruvate in a most-probable-number technique for the detection of Staphylococcus aureus. Appl Environ Microbiol 34, 797-800 (1977); McDonald та інші, Enhanced recovery of injured Escherichia coli by compounds that degrade hydrogen peroxide or block its formation. Appl Environ Microbiol 45, 360-5 (1983), Marthi та інші) Resuscitation effects of catalase on airborne bacteria Appl Environ Microbiol 57, 2775-6 (1991); Busch and Donnelly Development of a repair-enrichment broth for resuscitation of heat-injured Listena monocytogenes and Listena innocua. Appl Environ Microbiol 58, 14-20 (1992), та Dukan та інші, Oxidative stress defense and deterioration of growth-arrested Eschenchia coli cells. J Biol Chem 274, 26027-32 (1999). Проте, винахідники даного винаходу вважають, що в усіх вищезгаданих випадках ROS буде знижено за прямим маршрутом, в якому сполуки хімічно реагують із ROS. Bérubé та інші, "Rapid detection and identification of Legionella pneumophila by membrane immunoassay", Applied and Environmental Microbiology, 1989, 55, 1640-1641 описує детекцію та ідентифікацію Legionella pneumophila за допомогою моноклонального антитіла. Для вирішення проблеми уражених бактерій не передбачено жодних засобів. У статті Pine та інші (Role of keto acids and reduced-oxygen-scavenging enzymes in the growth of Legionella species J Chn Microbiol 23, 33-42 (1986)) описано необхідність додавання кетокислот та ферменту, що уловлює відновлений кисень, для оптимізації росту Legionella pneumophila, та передбачено застосування таких речовин у середовищі, що використовують для стандартного підрахунку такого мікроорганізму. Проте застосування кетокислот та ферменту, що уловлює відновлений кисень, окремо, є недостатнім для відновлення підданих стресу клітин Legionella pneumophila та для точного вимірювання. Це особливо проявляється при застосуванні специфічного ростового середовища для Legionella pneumophila, такого, як агарне середовище буферного екстракту дріжджів деревного вугілля (BCYE). Фактично, відсутні дані щодо оптимізації стандартного середовища, корисного для точного підрахунку Legionella pneumophila. Тому ціллю даного винаходу є пошук способу точного підрахунку Legionella pneumophila. Це особливо стосується стандартного способу підрахунку за допомогою методу висівання на пластинці. Тому відповідно до даного винаходу, ми забезпечуємо спосіб детекції та підрахунку життєздатних мікроорганізмів у пробі, що потенційно може містити вказані мікроорганізми, що включає: (1) контактування вказаних мікроорганізмів вказаної проби зі щонайменше однією сполукою відновлення та ростовим середовищем, та (2) інкубацію продукту стадії (1), та (3) детекцію та кількісне визначення вказаних життєздатних мікроорганізмів, 2 UA 101657 C2 5 10 15 20 25 30 35 40 45 50 55 де мікроорганізми є мікроорганізмами виду Legionella pneumophila, та де сполука відновлення безпосередньо або опосередковано викликає вплив на метаболізм для зниження оксидативного стресу мікроорганізму. Під оксидативним стресом ми маємо на увазі дисбаланс між концентрацією ROS (ендогенне продукування або екзогенну аддукцію) та здатність мікроорганізмів до легкої детоксикації реакційноздатних проміжних сполук або ефективного відновлення пошкодження, що виникає у результаті. Таке порушення нормальних метаболічних процесів у мікроорганізмі може викликати токсичні впливи внаслідок утворення вільних радикалів та агентів окиснення, таких, як пероксиди, що може призвести до пошкодження компонентів клітин мікроорганізмів, наприклад, ДНК, протеїнів або ліпідів. Спричинення впливу на метаболізм мікроорганізму означає спричинення змін природних внутрішніх хімічних процесів у клітині мікроорганізму. Посилання на ендогенність означає зміни, викликані всередині клітини мікроорганізму для відновлення оксидативного стресу. Це можуть бути, наприклад, зміни метаболічних процесів всередині мікроорганізму Вони можуть також включати видалення ROS всередині клітини мікроорганізму. Бажано, щоб сполука відновлення являла собою або могла містити щонайменше одну сполуку, що інгібує утворення та/або розкладає ROS. Загалом, це може бути досягнуто шляхом модифікації метаболізму. Проте, сполука відновлення може являти собою або може містити щонайменше одну сполуку, що опосередковано інгібує утворення та/або розкладає ROS. Така сполука, що викликає опосередкований вплив на ROS, може здійснювати це шляхом перешкоджанню метаболізму мікроорганізму. Така сполука може розглядатися як так, що опосередковано ендогенно зменшує ROS, наприклад, протягом аеробного дихання. Ми знайшли, що спосіб за даним винаходом включає відновлення підданих стресу клітин Legionelia pneumophila та таким чином більш точно забезпечує підрахунок загальної життєздатності. Неочікувано ми також знайшли, що даний спосіб зменшує кількість необхідного часу інкубації. Загалом, ми знайшли, що даний спосіб може зменшувати час інкубації на декілька годин та у деяких випадках щонайменше на один день. У деяких випадках спосіб за даним винаходом може зменшувати час інкубації на період до декількох днів, наприклад, до п'яти днів, порівняно із традиційним способом. Неочікувано ми знайшли, що спосіб за даним винаходом може викликати зменшення кількості перешкоджаючих мікроорганізмів, тобто, мікроорганізмів, що відрізняються від Legionelia pneumophila. Спосіб за даним винаходом, бажано, включає контактування підданих стресу клітин мікроорганізму Legionelia pneumophila зі щонайменше однією сполукою, що інгібує утворення та/або зменшує кількість та/або видаляє ROS, та має тенденцію до викликання відновлення підданих стресу клітин. Мікроорганізм Legionelia pneumophila може бути приведений у безпосередній контакт із сполукою відновлення після збору проби. Таким чином, контейнер, в який збирають пробу води, вважають таким, що містить мікроорганізм, може вже містити сполуку відновлення. Альтернативно, після збору проби води, що містить Legionella pneumophila, вона може бути розведена водою розведення, що містить сполуку для аналітичних цілей. У додатковій альтернативі, проба, необов'язково розведена, може бути приведена у контакт з ростовим середовищем, що містить сполуку відновлення, або сполука відновлення може бути нанесено після контактування мікроорганізму із ростовим середовищем. Одна форма даного винаходу бажано включає контактування вказаної проби із середовищем відновлення, переважно, неселективним середовищем відновлення, що містить вказану сполуку відновлення та потім її контактування із ростовим середовищем, переважно, селективним ростовим середовищем. Переважно середовище відновлення є рідким та більш переважно воно є бульйоном. Якщо середовище відновлення є рідким, то спосіб має прийнятну назву рідкого способу відновлення. Типово, у рідкому способі відновлення пробу спочатку вводять у рідке середовище, що містить сполуку відновлення. В ідеалі рідкий спосіб відновлення дозволяє підданим стресу бактеріям відновлюватися у неселективному рідкому середовищі. Переважно, рідкий спосіб відновлення задіє бульйон як рідке середовище. Загалом, рідке середовище, що містить мікроорганізми, буде перенесено до ростового середовища. Піддані стресу мікроорганізми будуть відновлені до переносу у ростове середовище, або будуть відновлені після контактування із ростовим середовищем. Більш переважно, ростове середовище є селективним ростовим середовищем. Типово, рідке 3 UA 101657 C2 5 10 15 20 25 30 35 40 45 50 55 60 середовище, що містить мікроорганізми, буде висіяне на пластинку із селективним ростовим середовищем, таким, як пластинка із селективним агаровим ростовим середовищем. В альтернативній формі стадія (1) включає контактування проби з ростовим середовищем, переважно неселективним ростовим середовищем, а потім приведення її у контакт із ростовим середовищем, що також містить дану сполуку відновлення. Переважно, середовище відновлення є неселективним ростовим середовищем, більш переважно твердим, та особливо переважно селективним агаровим ростовим середовищем. Якщо середовище відновлення є твердим, це може мати назву твердого способу відновлення. Типово твердий спосіб відновлення включатиме контактування проби із неселективним ростовим середовищем, що містить сполуку відновлення. Відповідно вона може бути приведена у контакт із селективним ростовим середовищем, що містить сполуку відновлення. У такій формі селективні інгредієнти та сполука або сполуки, що попереджають утворення, зменшують кількість або видаляють ROS, будуть дифундувати через неселективне середовище. Бажано, неселективне ростове середовище може бути неселективним агаровим ростовим середовищем. Придатно у такій формі проба може бути висіяна на будь-який неселективний агар та потім селективне агарове ростове середовище, що містить сполуку або сполуки, що попереджають утворення, зменшують кількість або видаляють ROS, наносять на неселективне агарове ростове середовище. У додатковій альтернативній формі проба може бути нанесена на селективне ростове середовище, що вже містить сполуку відновлення. Таке селективне ростове середовище може бути селективним агаровим ростовим середовищем. Висівання проби на пластинку може бути здійснено таким чином, як описано раніше. У додатковій альтернативній формі проба може бути зібрана з води у вигляді аерозолю. Типово аерозоль може бути розміщений в стояку водяного охолодження або повітряному кондиціонері. Бажано, воду конденсують з аерозолю перед проведенням аналізу відповідно до способу за даним винаходом. В альтернативній переважній формі стадія (1) включає контактування вказаної проби з аерозолю з водою розведення, що містить середовище відновлення, переважно неселективне середовище відновлення, що містить вказану сполуку відновлення, а потім приведення її у контакт із ростовим середовищем, що також містить вказану сполуку відновлення. В усіх вищезазначених формах даного винаходу ростове середовище має бути придатним для зростання Legionella pneumophila. Придатні види ростового середовища задокументовані у літературі та є добре відомими фахівцям у цій галузі. Зазвичай, ростове середовище має містити активоване вугілля та цистеїн. Переважним є, щоб селективне ростове середовище було селективним агаровим ростовим середовищем, та більш переважно - агаровим ростовим середовищем з буферним екстрактом дріжджів деревного вугілля (BCYE). Ростове середовище BCYE стане селективним шляхом додавання антибіотичної добавки. Високобажане ростове середовище BCYE з антибіотиком відомо як GVPC (гліцин, ванкоміцин, поліксимін В, циклогексимід). Спосіб висівання на пластинку задокументовано у літературі та він добре відомий фахівцю у цій галузі. Типово спосіб включатиме нанесення кількості даних проб води на агаровий гель, що був розміщений у чашці Петрі. Цей спосіб може мати назву способу чашки Петрі або спосіб висівання на агарову пластинку. Метою висівання на агарову пластинку є розбризкування аліквоти, типово 100 мкл води, що потенційно може містити мікроорганізм, під назвою бактеріальна суспензія, на тверде середовище у чашці Петрі. Для розбризкування агарової суспензії на агаровій пластинці можуть бути використані скляні кульки або клітинний скрепер. Після розбризкування, більша частина рідини адсорбується агаром та тонкий шар із бактеріями залишається на поверхні агару і. Шляхом інкубування, бактеріальне зростання у формі колоній розвивається на поверхні агару. Інкубація відбуватиметься при температурі, що найкраще придатна для мікроорганізму, що добре задокументовано у літературі та відомо фахівцям у цій галузі. Типово температура становитиме від 30 °C до 50 °C, наприклад, приблизно 37 °C. Сполука відновлення має бути додана у кількості, що є ефективною для зменшення оксидативного стресу мікроорганізму. Переважно, це буде кількість, ефективна для зменшення або істотного видалення ROS у клітині мікроорганізму. В одній переважній формі даного винаходу сполука відновлення включає щонайменше тіогліколеву кислоту або її сіль. Бажано, щоб тіогліколева кислота була у формі тіогліколату та звичайно у формі натрієвої солі. Тіогліколева кислота або її солі екзогенно уловлюють ROS. Переважно тіогліколева кислота або солі за даним винаходом у середовищі присутні при концентрації від 0,01 до 1 % за масою (у розрахунку на тіогліколат). В іншій переважній формі даного винаходу сполука відновлення включає щонайменше одну сполуку, вибрану з групи, що складається з каталази, аскорбінової кислоти (або її солі), 4 UA 101657 C2 5 10 15 20 25 30 35 40 45 50 55 60 метабісульфонової кислоти (або її солі), диметилсульфоксиду (ДМСО), 3,3'-тіодипропіонової кислоти (TDPA) (або її солі) та піровиноградної кислоти (або її солі). Було знайдено, що усі ці сполуки зменшують кількість або видаляють ROS. При застосуванні аскорбінової кислоти та піровиноградної кислоти, вони переважно присутні у середовищі при концентрації від 0,01 до 1 % за масою у розрахунку на натрієву сіль. ДМСО переважно застосовують при концентрації від 0,01 до 0,1 % за масою та каталаза бажано присутня при концентрації в діапазоні від 0,001 до 0,1 % за масою. Піровиноградна кислота, особливо піруват натрію, є особливо переважними. У більш переважній формі даного винаходу середовище відновлення або ростове середовище міститимуть як тіогліколеву кислоту (або її сіль), так і щонайменше одну сполуку, з групи, що вибирають з каталази, аскорбінової кислоти (або її солі), метабісульфонової кислоти (або її солі), диметилсульфоксиду (ДМСО), 3,3'-тіодипропіонової кислоти (TDPA) (або її солі) та піровиноградної кислоти (або її солі). Комбінація тіогліколату та пірувату натрію є особливо переважними. У випадку, коли сполука відновлення може являти собою або може включати щонайменше одну сполуку, що опосередковано інгібує утворення та/або розкладає ROS, вказана сполука може спричиняти зменшені рівні ROS шляхом перешкоджання метаболізму мікроорганізму. Типово такі сполуки включатимуть амінокислоти або їх солі. Особливо переважною сполукою є глютамінова кислота або глютаматна сіль. У ще одній додатковій переважній формі даного винаходу сполука відновлення включатиме глютамінову кислоту або глютаматну сіль, особливо натрієву сіль. Загалом, кількість глютамінової кислоти або глютамату становитиме від 0,01 до 5 % за масою у розрахунку на натрієву сіль. Особливо переважним є, щоб сполука відновлення включала піровиноградну кислоту або піруват (особливо натрієву сіль) разом із глютаміновою кислотою або глютаматом (особливо у вигляді натрієвої солі). Така комбінація піровиноградної кислоти або пірувату із глютаміновою кислотою або глютаматом, здається, індукує синергічний ефект, що полягає у тому, що він дозволяє більш надійну оцінку (та тому більш точну оцінку) Legionella, що можуть бути культивовані, ніж інші сполуки, що відповідно застосовують окремо. Додатково нами було знайдено, що така комбінація викликає додаткове скорочення лаг-фази протягом розвитку Legionella pneumophila, зокрема у рідкому середовищі. Таке скорочення лаг-фази у рідкому середовищі призводить до скорочення часу, необхідного для одержання видимої колонії на агаровій пластинці. Бажано, щоб кількість пірувату та глютамату були такими, як вказано раніше. Особливо переважним є, щоб співвідношення глютамату до пірувату знаходилося у діапазоні від 1:1 до 50:1, особливо від 5:1 до 20:1 та більш особливо від 7:1 до 15:1. Глютамат невідомий як антиоксидант. Проте, вважають, що опосередковано глютамат може зменшувати ендогенне продукування ROS, що природно формується протягом росту або протягом їх послідовностей у макромолекулах (окиснення). Не будучи обмеженими теорією, вважають, що глютамінова кислота змінює метаболізм Legionella для підвищення впливу пірувату, та що таке перешкоджання метаболізму Legionella опосередковано інгібує утворення та/або розкладає внутрішньомолекулярний ROS. Також може бути бажаним, щоб до середовища відновлення та/або ростового середовища були включені кетокислота та/або фермент, що уловлює відновлений кисень. Кетокислота та/або фермент, що уловлює відновлений кисень не розглядають як такі, що відновлюють сполуку за даним винаходом. Тим не менш, може бути корисним включення однієї або обох таких сполук з будь-якими зі вказаних вище сполук відновлення або їх комбінацій. Детекція та кількісне визначення життєздатних мікроорганізмів можуть бути проведені будьякими відомими методами, що задокументовані у літературі. Типово, це означатиме підрахунок видимих колоній поверхні ростового середовища, такого, як живильна агарова пластинка. Спосіб за даним винаходом сприяє точному кількісному визначенню наявності Legionella pneumophila. Додатково може бути значно зменшений час інкубації. Спосіб є придатним для детекції Legionella pneumophila у пробах, одержаних з будь-якої групи, вибраної з промислових охолоджуючих груп, питних вод та природних вод. Даний винахід також включає комплект для більш точної детекцій та підрахування життєздатних мікроорганізмів виду Legionella pneumophila у пробі, що потенційно містить вказані мікроорганізмі, що містить: (1) щонайменше одну сполуку відновлення, (2) ростове середовище (3) засоби інкубації (4) засоби детекції та кількісного визначення мікроорганізмів, 5 UA 101657 C2 5 10 15 20 25 30 35 40 45 50 55 60 де сполука відновлення безпосередньо або опосередковано викликає вплив на метаболізм для зменшення оксидативного стресу мікроорганізму, де мікроорганізми належать до виду Legionella pneumophila, та де сполука відновлення безпосередньо або опосередковано викликає вплив на метаболізм для зменшення оксидативного стресу мікроорганізму. Комплект може також містити будь-яке зі втілень, описаних стосовно першого аспекту даного винаходу. Комплект є придатним для застосування у способі за даним винаходом та дозволяє більш точний підрахунок Legionella pneumophila. Даний винахід проілюстровано наступними прикладами. Приклад 1 Суспензію Legionella pneumophila додавали до 5 колб, що містили 50 мл стерильного 8 фосфатного буфера (PBS) при кінцевій концентрації 10 бактерій/мл. Біоцидний розчин додавали для одержання кінцевих концентрацій у діапазоні 10-30 мг/л. Одну колбу використовували для паралельного експерименту та вона слугувала контрольною та не містила біоцид. Використаним біоцидом був THPS (тетракіс(гідроксиметил)фосфоній сульфат). Після гомогенізації, усі суспензії інкубували при 37±1 °C, у темряві та при перемішуванні протягом 60 хвилин. Біоцид видаляли шляхом 2 промивань у фосфатно-буферному середовищі (PBS) (5,000 х g, 10 хвилин) перед підрахунком бактерій. Після виконання послідовного розведення та розміщення 2 аліквот по 100 мкл з одного й того ж розведення на агарову пластинку BCYE, до BCYE додавали 0.1 % пірувату. Результати наведено на Фігурі 1. На Фігурі 1 показано підрахунок Legionella Pneumophila, що мають бути культивовані після обробки біоцидами середовища BCYE (квадрати) та середовища BCYE плюс 0.1 % пірувату (ромби). Біоцид був присутній для початку струсу мікроорганізму. Результати вказують на те, що у разі наявності пірувату досягають значно більш точного підрахунку мікроорганізмів та мікроорганізми мають стрес. У разі відсутності біоциду стрес у мікроорганізмів відсутній. У цьому разі можна побачити, що наявність або відсутність пірувату призводять до аналогічного результату. Це вказує на те, що наявні мікроорганізми Legionella pneumophila, що піддані стресу під дією пірувату, є відновленими, та тому забезпечено більш точне зчитування. Приклад 2 Суспензію Legionella pneumophila додавали до 1 колби, що містила 50 мл стерильного 8 фосфатного буфера (PBS) при кінцевій концентрації 10 бактерій/мл. Біоцидний розчин додавали для одержання кінцевих концентрацій 15 мг/л. Використаним біоцидом був THPS (тетракіс(гідроксиметил)фосфоній сульфат). Після гомогенізації, суспензію інкубували при 37±1 °C, у темряві та при перемішуванні протягом 60 хвилин. Біоцид видаляли шляхом 2 промивань у фосфатно-буферному середовищі (PBS) (5,000 х g, 10 хвилин) перед підрахунком бактерій. Після виконання послідовного розведення та розміщення 2 аліквот по 100 мкл з одного й того ж розведення на агарову пластинку BCYE, до BCYE додавали 0.1 % пірувату, та 1 % глютамінової кислоти. Результати наведено на Фігурі 2. На Фігурі 2 наведено співвідношення між кількістю Legionella, що можуть бути культивовані, одержаних у стандартному середовищі (BCYE) та кількістю Legionella, що можуть бути культивовані, одержаних у середовищі із додаванням 2 сполук, описаних у цьому патенті (піровиноградна та глютамінова кислоти). Додавання пірувату до стандартного середовища (BCYE) призводить до збільшення Legionella, що можуть бути культивовані, що були детектовані після біоцидної обробки (кількість Legionella, що можуть бути культивовані на "BCYE + піруват" у 45 разів перевищує кількість Legionella, що можуть бути культивовані у стандартному середовищі). Додавання глютамінової кислоти окремо у стандартне середовище (BCYE) призводить до зменшення Legionella, що можуть бути культивовані, що були детектовані після біоцидної обробки (х 0,2). Несподівано, додавання пірувату та глютамінової кислоти призводить до збільшення кількості Legionella, що можуть бути культивовані, більш, ніж спостерігається при додаванні окремої сполуки. Це вказує на те, що наявні мікроорганізми Legionella pneumophila, піддані стресу під дією пірувату, є більш відновленими при додаванні глютамінової кислоти та тому забезпечено більш точне зчитування. Приклад 3 Суспензію Legionella pneumophila додавали до 1 колби, що містила 1 літр стерильного 2 фосфатного буферного розчину (PBS) при кінцевій концентрації 3×10 бактерій/л. Після концентрування шляхом фільтрування, 2 аліквоти по 100 мкл з кожної аліквоти поміщали на GVPC агарову пластинку (GVPC), GVPC із додаванням 0,1 % пірувату та 1 % глютамінової 6 UA 101657 C2 5 10 15 20 25 30 35 40 45 50 55 60 кислоти (GVPC+X). Кількість колоній рахували на 0, 3, 5 та 10 дні після інкубування при 37 °C результати наведено на Фігурі 3. На 3 день інкубації, видимі колонії були відсутні у середовищі GVPC, тоді як 300 колоній могли вже бути підраховані у середовищі із додаванням GVPC. На 5 та 10 дні інкубації, 100 колоній могли бути підраховані у GVPC, де 300 могли бути підраховані у середовищі із додаванням GVPC. Шляхом застосування середовища із добавками, колонії могли бути детектовані щонайменше за 2 дня до підрахунку у стандартному GVPC. Приклад 4 Пробу середовища, що містила Legionella, що можуть бути культивовані, концентрували шляхом фільтрування. З концентрату, 2 аліквоти по 100 мкл з однієї тієї ж суспензії поміщали на агарову пластинку GVPC (GVPC), до GVPC додавали 0,1 % пірувату та 1 % глютамінової кислоти (GVPC+X). Кількість колоній рахували через 5 днів після інкубації при 37 °C. У цьому разі, жодні Legionella колонії не можуть бути підраховані у стандартному середовищі (GVPC), де 17 колоній, що не відносилися до Legionella, могли бути підраховані. Навпаки, щонайменше 10 колоній Legionella могли бути підраховані у середовищі із добавками (GVPC+X), де було тільки 2 колони, що не відносилися до Legionella. Це наведено на Фігурі 4. Приклад 5 Суспензію Legionella pneumophila додавали до 1 колби, що містила 50 мл стерильного 8 фосфатного буферного розчину (PBS) при кінцевій концентрації 10 бактерій/мл. Біоцидний розчин додавали для одержання кінцевої концентрації 15 мг/л. Біоцидом, що застосовували, був THPS (тетракіс(гідроксиметил)фосфоній сульфат). Після гомогенізації, суспензію інкубували при 37±1 °C, у темряві та при перемішуванні протягом 60 хвилин. Біоцид видаляли шляхом 2 промивань у фосфатно-буферному розчині (PBS) (5,000 х g, 10 хвилин) перед підрахунком бактерій. Послідовне розведення проводили або у PBS, або у PBS із додаванням 0,5 % пірувату. З кожного буферу розведення (з додаванням або без додавання пірувату), 2 аліквоти по 100 мкл з одного й того ж розведення поміщали на агарову пластинку BCYE, BCYE із додаванням 0,1 % пірувату. Результати наведено на Фігурі 5. На Фігурі 5 показано кількість Legionella pneumophila, що можуть бути культивовані, які були одержані у стандартному середовищі (BCYE), та кількість Legionella pneumophila, що можуть бути культивовані, які були одержані у стандартному середовищі із додаванням пірувату після розведення у PBS (штрихована планка) або PBS + піруват (темна планка). Як вже спостерігали, додавання пірувату у стандартне середовище (BCYE) призводить до збільшення кількості Legionella pneumophila, що можуть бути культивовані, які були детектовані після біоцидної обробки, при застосуванні тільки PBS для розведення розчину. Несподівано, додавання пірувату у буфер розведення, призводить до збільшення кількості Legionella pneumophila, що можуть бути культивовані, які були детектовані у стандартному середовищі (BCYE), але також у стандартному середовищі із додаванням пірувату. Це демонструє, що наявність пірувату у буфері розведення дозволяє більше відновлення підданих стресу L. pneumophila. ФОРМУЛА ВИНАХОДУ 1. Спосіб детектування та підрахунку життєздатних мікроорганізмів у пробі, що потенційно містить вказані мікроорганізми, що включає (1) контактування вказаних мікроорганізмів вказаної проби із щонайменше однією - сполукою відновлення, що включає піровиноградну кислоту або її солі,та - живильним середовищем, та (2) інкубацію продукту стадії (1), та (3) детектування та кількісне визначення вказаних життєздатних мікроорганізмів, де мікроорганізми належать до виду Legionella pneumophila, та де сполука відновлення безпосередньо або опосередковано викликає вплив на метаболізм для зменшення оксидативного стресу мікроорганізму. 2. Спосіб за п. 1, в якому сполука відновлення є сполукою, що інгібує утворення та/або розкладає ROS. 3. Спосіб за будь-яким з пп. 1 або 2, в якому стадія (1) включає контактування вказаної проби із згаданою сполукою відновлення, що міститься у середовищі відновлення, переважно, у неселективному середовищі відновлення, та настурпне приведення її у контакт із живильним середовищем, переважно, селективним живильним середовищем. 4. Спосіб за п. 3, в якому середовище відновлення являє собою рідину, переважно бульйон. 5. Спосіб за будь-яким з попередніх пунктів, в якому стадія (1) включає контактування вказаної проби із живильним середовищем, переважно, неселективним живильним середовищем, та 7 UA 101657 C2 5 10 15 20 наступне приведення її в контакт із вказаною сполукою відновлення, що міститься у середовищі відновлення. 6. Спосіб за п. 3, в якому живильне середовище являє собою живильне середовище, переважно тверде, та більш переважно селективне агарове живильне середовище. 7. Спосіб за будь-яким з попередніх пунктів, в якому стадія (1) включає контактування вказаної проби із живильним середовищем, що містить вказану сполуку відновлення. 8. Спосіб за будь-яким з попередніх пунктів, в якому живильне середовище являє собою буферний екстракт дріжджів деревного вугілля (BCYE) або GVPC агарове живильне середовище. 9. Спосіб за будь-яким з попередніх пунктів, в якому сполука відновлення додатково містить тіогліколеву кислоту (або її сіль). 10. Спосіб за будь-яким з пп. 1-9, в якому сполука відновлення додатково містить глютамінову кислоту (або її сіль). 11. Спосіб за будь-яким з попередніх пунктів, в якому середовище відновлення та/або живильне середовище містять кетокислоту та/або фермент, що уловлює відновлений кисень. 12. Набір для детектування та підрахунку життєздатних мікроорганізмів виду Legionella pneumophila у пробі, що потенційно містить вказані мікроорганізми, що містить: (1) щонайменше одну сполуку відновлення, що включає піровиноградну кислоту або її солі, (2) живильне середовище, (3) засоби інкубації, (4) засоби детектування та кількісного визначення мікроорганізмів, де мікроорганізми належать до виду Legionella pneumophila, та де сполука відновлення безпосередньо або опосередковано викликає вплив на метаболізм для зменшення оксидативного стресу мікроорганізму. 8 UA 101657 C2 9 UA 101657 C2 Комп’ютерна верстка М. Ломалова Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 10
ДивитисяДодаткова інформація
Назва патенту англійськоюDetecting and enumerating microorganisms
Автори англійськоюFovet, Yannick, Ducret, Adrien, Dukan, Sam
Назва патенту російськоюДетектирование и подсчет микроорганизмов
Автори російськоюФове Янник, Дюкре Адриен, Дюкон Сем
МПК / Мітки
МПК: C12Q 1/06, G01N 33/50
Мітки: підрахунок, детектування, мікроорганізмів
Код посилання
<a href="https://ua.patents.su/12-101657-detektuvannya-ta-pidrakhunok-mikroorganizmiv.html" target="_blank" rel="follow" title="База патентів України">Детектування та підрахунок мікроорганізмів</a>
Попередній патент: Пристрій для вимірювання пульсацій швидкості потоку електропровідної рідини
Наступний патент: Спосіб і пристрій для виготовлення сорбенту для видалення арсену з питної води
Випадковий патент: Шкала для контролювання друкарського процесу