2,5-двозаміщена 3-меркаптопентанова кислота
Формула / Реферат
1. Сполука формули (І):
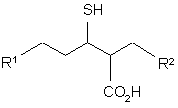 , (I)
, (I)
де:
R1 - феніл {як варіант, заміщений групою: галоген, гідрокси, ціано, С1-4алкіл (що сам, як варіант, монозаміщений групою: ціано, гідрокси або феніл), С1-4алкоксил (що сам, як варіант, заміщений тетрагідрофуранілом), СF3, ОСF3, метилендіокси, C(O)R3, S(O)2R4, феніл (що сам, як варіант, заміщений галогеном), феноксил (що сам, як варіант, заміщений галогеном) або тетрагідрофуранілоксил}, нафтил, піридиніл, 1,2,3,4-тетрагідропіримідин-2,4-діоніл (як варіант заміщений С1-4алкілом) або тетрагідротієніл;
R2 - амінопіридиніл, амінотіазоліл або 3-азабіцикло[3,2,1]октил;
R3 - гідрокси, С1-4алкокси (що сам, як варіант, заміщений фенілом (що сам, як варіант, заміщений галогеном) або піридинілом), NR5R6 або N-зв'язаний п'яти- або шестичленний гетероцикл {незаміщений або монозаміщений групою: гідрокси, оксо, С1-4алкіл (що сам, як варіант, заміщений гідроксилом або NНфенілом), СО2(С1-4алкіл) або феніл (що сам, як варіант, заміщений галогеном)};
R4 - NR7R8 або N-зв'язаний п'яти- або шестичленний гетероцикл {незаміщений; монозаміщений групою: гідрокси, оксо, С1-4алкіл (що сам, як варіант, заміщений гідроксилом або NНфенілом), СО2(С1-4алкіл) або феніл (що сам, як варіант, заміщений галогеном); або конденсований з бензольним кільцем, яке, як варіант, заміщене С1-4алкоксилом};
R5, R6, R7 та R8 незалежно представляють гідроген, С1-4алкіл {як варіант, заміщений групою: галоген, ціано, гідрокси, феніл (що сам, як варіант, заміщений галогеном або ме-тилендіоксилом), піридиніл, CO2H або СО2(С1-4алкіл)} або С2-4алкеніл;
за умови, що якщо R2 - 6-амінопіридин-3-іл, то R1 - заміщений феніл, нафтил, піридиніл, 1,2,3,4-тетрагідропіримідин-2,4-діоніл (як варіант, заміщений С1-4алкілом) або тетрагідротієніл;
або її фармацевтично прийнятна сіль або сольват, або сольват такої солі.
2. Сполука формули (І) за п. 1, де R1 - феніл (як варіант, заміщений групою: галоген, гідрокси, ціано, С1-4алкіл (що сам, як варіант, монозаміщений ціано- або гідроксигрупою), С1-4алкокси, СF3, ОСF3, метилендіокси, С(O)NH2, S(O)2NН2 або феніл (що сам, як варіант, заміщений галогеном)}, піридиніл або тетрагідротієніл.
3. Сполука формули (І) за п. 1, де R1 - феніл {як варіант, заміщений групою: галоген, гідрокси, ціано, С1-4алкіл (що сам, як варіант, монозаміщений групою: ціано, гідрокси або феніл), С1-4алкокси, СF3, ОСF3, метилендіокси, фенокси (що сам, як варіант, заміщений галогеном), тетрагідрофуранілокси або тетрагідрофуранілметокси}, нафтил, піридиніл або тетрагідротієніл.
4. Сполука формули (І) за п. 1, де R1 - феніл {заміщений групою: галоген, гідрокси, ціано, С1-4алкіл (що сам, як варіант, монозаміщений ціаногрупою або гідроксилом), С1-4алкокси, СF3 або метилендіокси} або тетрагідротіофеніл.
5. Сполука формули (І) за будь-яким з пп. 1, 2, 3 або 4, де R2 - 6-амінопіридин-3-іл, 2-амінотіазол-5-іл або 3-азабіцикло[3,2,1]окт-8-ил.
6. Сполука формули (І) за будь-яким з пп. 1, 2, 3 або 4, де R2 - 6-амінопіридин-3-іл.
7. Спосіб одержання сполуки формули (І), що полягає у реакції сполуки формули (II):
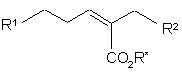 , (II)
, (II)
де R1 визначено в п. 1 або охоплює групу, що може далі реагувати, утворюючи групу R1, R* - придатна захисна група, а R2 визначено у п. 1, або амінофункціональна група R2, може бути захищеною тіолом формули L-SH, де L є придатною захисною групою, у присутності придатного каталізатора та у придатному розчиннику, з утворенням сполуки формули (III):
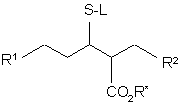 , (III)
, (III)
та, як варіант, у реакції функціональної групи на R1, та потім, якщо необхідно, у видаленні захисної групи.
8. Фармацевтична композиція, яка містить, як активну складову сполуку за будь-яким одним з пп. від 1 до 6 у поєднанні з фармацевтично прийнятним ад’ювантом, розріджувачем або носієм.
9. Застосування сполуки за п. 1 у терапії.
10. Застосування сполуки за п. 1 у виробництві медикаменту для інгібування карбоксипептидази U.
11. Спосіб лікування або профілактики станів, де інгібування карбоксипептидази U є корисним, спосіб полягає у призначенні ссавцю, включаючи людину, що потребує такого лікування, ефективної кількості сполуки за п. 1.
12. Фармацевтична композиція для застосування у лікуванні або профілактиці станів, де інгібування карбоксипептидази U є корисним, яка містить сполуку за п. 1 у поєднанні з фармацевтично прийнятним ад’ювантом, розріджувачем або носієм.
Текст
1. Сполука формули (І): SH 2 (19) 1 3 78042 4 локси або тетрагідрофуранілметокси}, нафтил, S-L піридиніл або тетрагідротієніл. 4. Сполука формули (І) за п. 1, де R 1 - феніл {заR1 міщений групою: галоген, гідрокси, ціано, С1-4алкіл R2 (що сам, як варіант, монозаміщений ціаногрупою CO2R* або гідроксилом), С1-4алкокси, СF3 або метиленді, (III) окси} або тетрагідротіофеніл. та, як варіант, у реакції функціональної групи на 5. Сполука формули (І) за будь-яким з пп. 1, 2, 3 R1, та потім, якщо необхідно, у видаленні захисної або 4, де R2 - 6-амінопіридин-3-іл, 2-амінотіазол-5групи. іл або 3-азабіцикло[3,2,1]окт-8-ил. 8. Фармацевтична композиція, яка містить, як ак6. Сполука формули (І) за будь-яким з пп. 1, 2, 3 тивну складову сполуку за будь-яким одним з пп. 2 або 4, де R - 6-амінопіридин-3-іл. від 1 до 6 у поєднанні з фармацевтично прийнят7. Спосіб одержання сполуки формули (І), що поним ад’ювантом, розріджувачем або носієм. лягає у реакції сполуки формули (II): 9. Застосування сполуки за п. 1 у терапії. R1 R2 CO2R* , (II) де R1 визначено в п. 1 або охоплює групу, що може далі реагувати, утворюючи групу R1, R* - придатна захисна група, а R2 визначено у п. 1, або амінофункціональна група R2, може бути захищеною тіолом формули L-SH, де L є придатною захисною групою, у присутності придатного каталізатора та у придатному розчиннику, з утворенням сполуки формули (III): Представлений винахід стосується нових сполук, та їх фармацевтично прийнятних, солей які інгібують основні карбоксипептидази, більш особливо карбоксипептидазу U, і, таким чином, можуть застосовуватися у попередженні та лікуванні хвороб, де інгібування карбоксипептидази U є благотворним, як-то тромбозу та підвищеної здатності до коагуляції у крові та тканині, атеросклерозу, рубцевих зрощень, дермального рубцювання, раку, фіброзних станів, запальних хвороб та тих станів, яким корисне підтримання або підвищення рівня брадикініну у тілі. Згідно з наступними аспектами винахід стосується сполук винаходу для застосування у терапії, способів одержання таких нових сполук, фармацевтичних композицій, що містять, принаймні, одну сполуку винаходу, або й фармацевтично прийнятну сіль як активну складову, та застосування активних сполук у виробництві медикаментів для вказаного вище медичного застосування. Фібриноліз є результатом ряду ферментних реакцій, що призводять до розщеплення фібрину плазміном Активація плазміногену є головним процесом у фібринолізі. Розщеплення плазміногену до плазміну здійснюється активаторами плазміногену, активатором плазміногену тканинного типу (т-АП) або активатором плазміногену урокіназного типу (у-АП). Початкове розщеплення фібрину у плазмі створює карбокси-термінальні лізинові залишки, що є ділянками з високою спорідненістю до зв'язування плазміногену. Оскільки плазміноген, зв'язаний з фібрином, набагато легше активується до плазміну, ніж вільний плазміноген, цей меха 10. Застосування сполуки за п. 1 у виробництві медикаменту для інгібування карбоксипептидази U. 11. Спосіб лікування або профілактики станів, де інгібування карбоксипептидази U є корисним, спосіб полягає у призначенні ссавцю, включаючи людину, що потребує такого лікування, ефективної кількості сполуки за п. 1. 12. Фармацевтична композиція для застосування у лікуванні або профілактиці станів, де інгібування карбоксипептидази U є корисним, яка містить сполуку за п. 1 у поєднанні з фармацевтично прийнятним ад’ювантом, розріджувачем або носієм. нізм забезпечує регуляцію фібринолізу з позитивним зворотним зв'язком. Один з ендогенних інгібіторів фібринолізу є карбоксипептидазою U(КПU) КПUІ також відома як карбоксипептидаза В плазми, активний інгібітор здатного до активації тромбіном фібринолізу, (ІАТФ), карбоксипептидаза R та індуцибельна карбоксипептидазна активність КПU утворюється протягом коагуляції та фібринолізу з її попереднику проКПU під дією протеолітичних ферментів, як-то тромбіну, тромбін-тромбомодулінового комплексу або плазміну. КПU відщеплює основні амінокислоти на карбокси-закінченні фібринових фрагментів. Втрата карбокси-термінапьних лізинів і тим самим ділянок зв'язування лізину з плазміногеном далі сприяє інгібуванню фібринолізу. Припускають, що інгібуванням втрати ділянок зв'язування лізину з плазміногеном і тим самим зменшенням швидкості утворення плазміну, ефективні інгібітори карбоксипептидази U сприятимуть фібринолізу. Відомо, що 2-меркаптометил-3гуанідиноетилтюпропанова кислота є інгібітором карбоксипептидази N. Недавно показано, що ця сполука інгібує КПU, [Hendnks, D. et al., Biochimica et Biophysica Acta, 1034 (1990) 86-92]. Відомо, що гуанідиноетилмеркаптобурштинова кислота, - інгібітор карбоксипептидази N. Недавно показано, що ця сполука інгібує КПU, [Eaton, D. L., et al., Journal of Biological Chemistry, 266 (1991) 21833-21838]. Інгібітори КПU розкриті у WO 00/66550, WO 00/66557, WO 03/013526 та WO 03/027128 і фармацевтичний склад, що містить інгібітор КПU та 5 78042 6 інгібітор тромбіну, розкриті у WO 00/66152. Інгібівинаходу. тори карбоксипептидази В плазми розкриті у WO Термін С 1-4алкіл означає лінійну або розгалу01/19836. Інгібітори ІАТФ розкриті у WO 02/14285. жену алкільну груп у, що має у ланцюгу від 1 до 4 Тепер знайдені особливо ефективні сполуки атомів карбону. Приклади алкілу охоплюють меформули (І), як інгібітори карбоксипептидази U, які, тил, етил, н-пропіл, ізо-пропіл, н-бутил, ізо-бутил, таким чином, корисні, як медикаменти для лікувтор-бутил та трет-бутил. вання або профілактики станів, де інгібування карТермін С 1-4алкоксил означає алкіл-О-групу, де боксипептидази U є благотворним. алкіл має лінійний або розгалужений ланцюг, приТаким чином, представлений винахід стосуклади охоплюють метоксил та етоксил. ється сполук формули (І): Галоген охоплює флуор, хлор, бром та йод (але є, наприклад, флуором або хлором). N-зв'язаним п'яти- або шестичленним гетероциклом є, наприклад, піролідиніл, піперидиніл або піперазиніл. Згідно з одним конкретним аспектом представлений винахід стосується сполуки формули (І), де R1 - феніл {як варіант, заміщений групою: галоген, де: гідрокси, ціано, С1-4алкіл (що сам, як варіант, моноR1 - феніл {як варіант, заміщений групою: газаміщений ціано або гідрокси), С1-4алкокси, CF3, логен, гідрокси, ціано, С1-4алкіл (що сам, як варіант OCF3, метилендіокси, C(O)NH2, S(O)2NH2 або фемоно-заміщений групою: ціано, гідрокси або феніл (що сам, як варіант, заміщений галогеном)}, ніл), С1-4алкоксил (що сам, як варіант, заміщений піридиніл або тетрагідротієніл; R2- амінопіридиніл, тетрагідрофуранілом), CF3, OCF 3, метилендіокси, амінотіазоліл або 3-азабіцикло[3,2,1]октил; за умоC(O)R3, S(O) 2R4, феніл (що сам, як варіант, заміви, що коли R2 - 6-амінопіридин-3-іл, то R1 - заміщений галогеном), феноксил (що сам, як варіант, щений феніл, піридиніл або тетрагідротієніл; заміщений галогеном) або тетрагідрофуранілокабо її фармацевтично прийнятної солі, або сосил}, нафтил, піридиніл, 1,2,3,4львату, або сольвату такої солі. тетрагідропіримідин-2,4-діон-іл (як варіант, заміЗгідно з іншим аспектом винахід стосується щений С1-4алкілом) або тетрагідротієніл; сполуки формули (І), де R1 - феніл {як варіант, 2 R - амінопіридиніл, амінотіазоліл або 3заміщений (наприклад, несучий 1 або 2 замісника) азабіцикло[3,2,1]октил; групою: галоген, гідрокси, ціано, С1-4алкіл (що сам, R3 - гідрокси, С1-4алкоксил (що сам, як варіант, як варіант, моно-заміщений ціано, гідрокси або заміщений фенілом (що сам, як варіант, заміщефенілом), С1-4алкокси, CF3, OCF3, метилендіокси, ний галогеном) або піридинілом), NR5R6 або Nфенокси (що сам, як варіант, заміщений галогезв'язане п'яти- або шестичленне гетероциклічне ном), тетрагідрофуранілокси або тетрагідрофуракільце {незаміщене або моно-заміщене групою: нілметокси}, нафтил, піридиніл або тетрагідротієгідрокси, оксо, С1-4алкіл (що сам, як варіант, замініл. щений гідрокси або NНфенілом), СО2(С1-4алкіл) Згідно з іншим аспектом представлений винаабо феніл (що сам, як варіант, заміщений галогехід стосується сполук формули (І), де R1 - феніл ном)}; {заміщений (наприклад, моно-заміщений) групою: R4 - NR7R8 або N-зв'язаний п'яти- або шестигалоген, гідрокси, ціано, С1-4алкіл (що сам, як варічленний гетероцикл {незаміщений; моноант, моно-заміщений ціано або гідрокси), С1заміщений групою: гідрокси, оксо, С1-4алкіл (що 4алкоксил (наприклад, метоксил), CF3 або метисам, як варіант, заміщений гідрокси або лендіоксил} або тетрагідротієніл. NНфенілом), СО2(С1-4алкіл) або феніл (що сам, як Згідно з ще одним аспектом представлений варіант, заміщений галогеном); або конденсований винахід стосується сполуки формулі- (І), де R1 з бензольним кільцем, що, як варіант, заміщене С 1феніл {монозаміщений групою: галоген (напри4алкокси}; клад, хлор або флуор), гідрокси, ціано, С1-4алкіл 5 6 7 8 R , R , R та R , незалежно, - гідроген, С1(монозаміщений ціаногрупою), CF3 або метиленді4алкіл {як варіант, заміщений групою: галоген, ціаоксил} або тетрагідротієніл. но, гідрокси, феніл (що сам, як варіант, заміщений Амінопіридинілом, наприклад, є 6групою: галоген або метилендіокси), піридиніл, амінопіридин-3-іл. Амінотіазолілом, наприклад, є СО2Н або СО2(С1-4алкіл)} або С 2-4алкеніл; 2-амінотіазол-5-іл. 3-азабіцикло[3,2,1]октилом, за умови, що коли R1 - 6-амінопіридин-3-іл, то наприклад, є 3-азабіцикло[3,2,1]окт-8-ил. 2 R - заміщений феніл, нафтил, піридиніл, 1,2,3,4Згідно з наступним аспектом представлений тетрагідропіримідин-2,4-діон-іл (як варіант заміщевинахід стосується сполуки формули (І), де R2 ний С1-4алкілом) або тетрагідротієніл; амінопіридин (наприклад, 6-амінопіридин-3-іл). або її фармацевтично прийнятна сіль або соСполуки представленого винаходу можна льват, або сольват такої солі. одержувати способами, описаними у літературі Сполуки формули (І) існують в ізомерних фо[наприклад, WO 00/66557], або способами з Прирмах, і представлений винахід стосується усіх такладів 1, 26 або 51, наведених нижче. Необхідно ких форм та їх сумішей в усі х пропорціях. Як чисті взяти до уваги, що функціональні групи проміжних енантіомери, так і рацемічні суміші та рівні та нерісполук у способах із літератури або із Прикладів 1, вні суміші двох енантіомерів охоплені рамками 26 або 51, необхідно захищати захисними групами представленого винаходу. Зрозуміло, що усі можОдержання деяких інтермедіатів представлено у ливі діастереоізомерні форми охоплені рамками Схемах 1 та 2. 7 78042 8 Наприклад, сполуку формули (І) одержують ві медикаменту для лікування або профілактики реакцією сполуки формули (II) тромбозу. Відомо, що підвищена здатність до коагуляції може привести до тромбо-емболічних хвороб. Стани, асоційовані з підвищеною здатністю до коагуляції та тромбо-емболічних хвороб, які можна навести, охоплюють резистентність стосовно білку С та спадковий або набутий дефіцити антитромбі1 де R визначена вище або охоплює групу, що ну III, білку С, білку S та гепаринового кофактору 1 може далі реагувати з утворенням групи R , R* є II. Відомо, що інші стани, асоційовані з підвищеною придатною захисною групою (як-то С1-6алкіл (наздатністю до коагуляції та тромбо-емболічних хво2 приклад, трет-бутил)), a R визначена вище, або роб, охоплюють кровоносний та септичний шок, 2 аміно-функціональна група R може бути захищециркулюючі антифосфоліпідні антитіла, гипергоною (наприклад, трет-бутоксикарбонілом), з тіолом моцистеїнемію, індуковану гепарином тромбоциформули L-SH, де L - придатна захисна група (натопенію та дефекти фібринолізу. Сполуки винахоприклад 4-метоксибензил), у присутності придатду, таким чином, показані у терапевтичному та/або ного каталізатору (наприклад, гідриду натрію) та у профілактичному лікуванні цих станів. придатному розчиннику (наприклад, Ν,ΝІнші хворобливі стани, які можна навести, оходиметилформаміді) з утворенням сполуки формуплюють терапевтичне та/або профілактичне лікули (III): вання тромбозу вен та емболії легенів, тромбозу артерій (наприклад, у мікроінфаркті, нестабільній стенокардії, інсульті від тромбозу та тромбозі периферичних артерій) системної емболії, звичайно від передсердя при фібриляції передсердя або від лівого шлуночка після трансмурального інфаркту міокарда. Сполуки винаходу подалі необхідні у лікуванні та, як варіант реакцією функціональної групи станів, де є небажаний надлишок проКПU/КПU. на R1 (наприклад, R1 може охоплювати кислотну Більш того, сполуки винаходу, як очікувано, груп у, яку можна сполучати з функціональною амікорисні у профілактиці реоклюзії та рестенозу ногрупою з утворенням аміду у присутності каталі(тобто тромбозу) після тромболізу, підшкірного затору (як-то HATU)), а далі видаленням захисної транслюмінального втручання (ПТВ) та після опегрупи, якщо необхідно. Функціональні групи, необрацій коронарного шунтування; попередженні похідні для захисту, охоплюють гідроксильні, карбоквторного тромбозу після мікрохірургії та загальної сильні та аміногрупи. Придатні захисні групи для судинної хір ургії. пдроксигруп охоплюють триалкілсиліл або діариПодалі показання охоплюють терапевтичне лал-кілсиліл (наприклад, трет-бутилдиметилсиліл, та/або профілактичне лікування синдрому диссетрет-бутилдифенілсиліл або триметилсиліл), тетмінованої внутрішньосудинної коагуляції, обумоврапдропіраніл, метоксиметил, бензилоксиметил та леної бактеріями, складною травмою, інтоксикаці4-метоксибензил. Придатні захисні групи для карєю або деяким іншим механізмом, фібринолітичне боксигруп охоплюють етилові, трет-бутилові і бенлікування, коли кров є у контакті зі сторонніми позилові естери. Придатні захисні групи для аміноверхнями в тілі, як-то судинними трансплантатагруп охоплюють трет-бутилоксикарбоніл, 2,4,6ми, судинними стентами, судинними катетерами, триметоксибензил та бензилоксикарбоніл Застомеханічними та біологічними штучними клапанами сування захисних гр уп описано в [Protective Groups або деякими іншими медичними пристроями, та in Organic Synthesis', третє видання, Τ. W. Greene фібринолітичне лікування, коли кров у контакті з & Ρ.G.Μ Wutz, Wiley-lnterscience (1999)]. медичними пристроями поза тілом, як-то у серцеЗахисною групою може також бути полімерна во-судинній хірургії з застосуванням апарату "серсмола, як-то смола Ванга або 2-хлортритильна де-легені" або у гемодіалізі. хлоридна смола. Крім того, сполуки винаходу, як очікують, коСполуки винаходу є інгібіторами карбоксипеприсні у профілактиці розвитку атеросклерозу та тидази U, тому припускають, що вони корисні у відторгнення пересадженого пацієнтові органа, таких станах, де інгібування карбоксипептидази U наприклад, пересадженої нирки. є бажаним, як-то у лікуванні або профілактиці Сполуки винаходу також, як очікують, корисні у тромбозу та підвищеної здатності до коагуляції у інгібуванні розвитку та прогресування пухлини. крові та тканинах, атеросклерозу, рубцеви х зроБільш того, сполуки винаходу, як очікують, кощень, дермального рубцювання, раку, фіброзних рисні у лікуванні будь-якого стану, у якому фіброз станів, запальних хвороб та таких станів, при яких є сприятливим фактором. Такі фіброзні стани оховигідне підтримання або підвищення рівню брадиплюють кістозний фіброз, легеневу фіброзну хвокініну у тілі ссавців, як-то людей. робу, наприклад, хронічну обструктивну хворобу Згідно з наступним аспектом винаходу сполука легенів (ХОХЛ), респіраторний дистрес-синдром формули (І), або її фармацевтично прийнятну сіль, дорослих (РДСД), фіброзном'язову дисплазію, або сольват, або сольват такої солі, застосовують фіброзну хворобу легенів та недостатність фібриу лікуванні або профілактиці тромбозу. Згідно з ну в очах при офтальмологічній хірургії. іншим аспектом винаходу сполуку формули (І), або Сполуки винаходу також, як очікують, корисні у її фармацевтично прийнятну сіль, або сольват, лікуванні запалення. Зокрема, винахід застосовуабо сольват такої солі, застосовують у виробницт 9 78042 10 ють для лікування або попередження запальних певтичне" та "терапевтично" треба розуміти відпохвороб, як-то астми, артриту, ендометріозу, запавідно. льних кишкових хвороб, псоріазу та атопічного Винахід також стосується способу лікування дерматиту. стану, де інгібування карбоксипептида-зи U є блаСполуки винаходу також, як очікують, корисні у готворним для ссавців, що потерпають від назвалікуванні нейродегенеративних хвороб, як-то Ального стану або при його ризику, який полягає у цгеймера та Паркінсона. призначенні ссавцям терапевтично ефективної Сполуки винаходу також, як очікують, корисні у кількості сполуки формули (І), або її фармацевтилікуванні станів, для яких відома корисність від чно прийнятної солі, або сольвату, або сольвату підтримання або підвищення рівню брадикініну. такої солі, як визначено вище. Такі стани охоплюють гіпертензію, стенокардію, Для вищезгаданого терапевтичного застосусерцеву недостатність, легеневу гіпертензію, нирвання призначене дозування потрібно змінювати кову недостатність та недостатність органу. відповідно застосованій сполуці, способу признаСполуки винаходу також комбінують та/або чення, потребам лікування та вказаному розладу. співзастосовують з деякими антитромботичними Сполуки формули (І) та їх фармацевтично засобами різного механізму дії, як-то антикоагуляприйнятні солі, сольвати або сольвати їх солей нтами (наприклад, антагоністом вітаміну К, нефраможна застосовувати окремо, але їх звичайно, кціонованим або низької молекулярної маси гепазастосовують у ви гляді фармацевтичної композирином, синтетичним гепариновим фрагментом, якції, в якій сполука формули (І), сіль, сольват або то фондапаринуксом, інгібітором тромбіну, інгібісольват солі (активна складова) об'єднана з фартором фактору Ха або іншим інгібітором фактомацевтично прийнятним ад'ювантом, розріджувару/ферменту коагуляції, фактору рекомбінантної чем або носієм. Залежно від способу призначення, коагуляції, як-то рекомбінантного активованого фармацевтична композиція, наприклад, містить білку С людини) або антитромбоцитарними засоактивну складову у кількості від 0,05 до 99мас%, бами (як-то ацетилсаліциловою кислотою, дипірияк-то від 0,05 до 80мас%, наприклад, від 0,10 до дамолом, тиклопідином, клопідогрелом або іншим 70мас%, як-то від 0,10 до 50мас%, усі проценти антагоністом АДФ-рецептору [як-то P2Y12 або віднесені до загальної маси композиції. P2Y1], рецептором тромбоксану та/або інгібітором Представлений винахід також передбачає фасинтетази, антагоністом рецептору фібриногену, рмацевтичну композицію, що містить сполуку фоміметиком простацикліну або інгібітором фосфодірмули (І) або її фармацевтично прийнятну сіль, естерази). Сполуки винаходу подалі комбінують або сольват, або сольват такої солі, як визначено та/або співзастосовують із тромболітиками, як-то вище, у поєднанні з фармацевтично прийнятним тканинним, активатором плазміногену (натуральад'ювантом, розріджувачем або носієм. ним, рекомбінантим або модифікованим), стрептоВинахід подалі передбачає спосіб отримання кіназою, урокіназою, проурокіназою, анізоїлованим фармацевтичної композиції винаходу, яка містить плазміноген-стрептокіназним активаційним комсуміш сполуки формули (І) або π фармацевтично плексом (АПСАК), активаторами плазміногену прийнятної солі або сольвату, або сольвату такої слинної залози тварин та аналогічними, у лікуванні солі, які визначено вище, з фармацевтично прийнтромботичних хвороб, особливо, інфаркту міокарятним ад'ювантом, розріджувачем або носієм. да, ішемічного інсульту та тяжкої легеневої ембоВинахід охоплює похідні сполук формули (І), лії. що мають біологічну функцію сполук формули (І), Сполуки винаходу повинні мати перевагу за як-то проліки. Проліки - це, наприклад, (півалоілокселективністю до карбоксипептидази U порівняно си)метил-естери та [іетосикарбоніл)окси]метилз карбоксипептидазою N більше 100:1, наприклад, естери карбонових кислот. більше 1000:1, застосовуючи аналіз, описаний Винахід ілюструють наступні приклади. нижче. Приклади Інгібувальна дія сполук представленого винаЗагальна експериментальна методика. ходу визначена за допомогою аналізу, описаного Мас-спектри регістрували на мас-спектрометрі у: [Dirk Hendriks, Simon Scharpe та Marc van Sande, VG Platform II або на мас-спектрометрі Micromass Clinical Chemistry, 31,1936-1939 (1985); та Wei ZQ з електророзпилювальним інтерфейсом (РХWang, Dirk F. Hendriks, Simon S. Scharpe, Journal of МС) Мас-спектри високого розділення регіструваBiological Chemistry, 269, 15937-15944 (1994)]. ли на мас-спектрометрі Micromass LCT з електроТаким чином, представлений винахід стосурозпилювальним інтерфейсом (МС-ВР-ЕРІ) (РХється сполуки формули (І), або її фармацевтично МС-ВР). ЯМР 1Н вимірювали на спектрометрі прийнятної солі, або сольвату, або сольвату такої Varian UNITY plus 400, 500, 600 на 1Н-частотах солі, як визначено вище, для застосування у тера400, 500 і 600Мгц відповідно. Спектри ЯМР регістпії. рували у ДМСО, D2O, CD3CN, або в їх сумішах. Згідно з наступним аспектом, представлений Хімічні зсуви наведені в млн-1, з розчинником, як винахід стосується застосування сполуки формули внутрішнім стандартом. (І), або й фармацевтично прийнятної солі, або соДля хроматографічного розділення застосовульвату, або сольвату такої солі, як визначено вивали силікагель Mere 60 (0,063-0,200мм). Нижчеще, у виробництві медикаменту для застосування наведені сполуки названі, застосовуючи у терапії. ACD/Name version 6,06/11 червня 2002, зареєстУ контексті представленого винаходу, термін рованої, як корпорація сучасного розвитку хімії, "терапія" охоплює "профілактику", якщо немає Канада. особливої вказівки про протилежне. Термін "тераПриклад 1 11 78042 12 Цей приклад ілюструє одержання 2-[(6MeCN, що містить 0,15% трифлуороцтової кислоамінопіридин-3-іл)метил]-5-(1,1'-дифеніл-3-іл)-3ти) після висушування виморожуванням дає меркаптопентанової кислоти (0,342g, 68%) названої діастереоізомерної сполуки (a) 3-(1,1'-дифеніл-3-іл)пропаналь у вигляді трифлуорацетату. 1 До розчину 3-йод-1,1'-дифенілу (0,964г, Н ЯМР (400МГц, CD3CN/D2O): d 7,70 (dd, 3,44ммол) та тетрабутиламоній хлориду (0,956g, J=2,1, 9,2Гц, 0,5Н), 7,66 (dd, J=2,1, 9,2Гц, 0,5 Гц), 3,44ммол) у сухому ДМФ (3мл) додають аліловий 7,61-7,58 (m, 2H), 7,53-7,51 (m, 1H), 7,46-7,41 (m, спирт (0,351мл, 5,16ммол), гідрокарбонат натрію 4H), 7,38-7,32 (m, 2H), 7,22-7,16 (m, 1H), 6,88 (d, (0,723г, 8,60ммол), та ацетат паладію(ІІ) (31мг, J=9,1Гц, 0,5Н), 6,84 (d, J=9,1Гц, 0,5Н), 3,10-2,74 (m, 0,14ммол), суміш перемішують при кімнатній тем6H), 2,17-2,04 (m, 1H), 1,91-1,78 (m, 1H). 13C ЯМР пературі протягом 18год, Реакційну суміш потім (101МГц, CD3CN/D2O): d 175,3, 174,9, 153,0, 146,0, розріджують ЕtOАс та тверду речовину відфільт145.8, 142,3, 141,1, 140,9, 134,0, 133,9, 129,4, ровують (Целіт). Фільтрат промивають три рази 129,2, 127,9, 127,9, 127,8, 127,3, 127,2, 127,1, водою, висушують (Na2SO4) та концентрують. 124,9, 124,8, 124,4, 124,1, 113,9, 113,8, 53,6, 53,0, Флеш-хроматографія залишку (гептан/трет41,3, 40,5, 37,9, 33,1, 33,0, 31,2, 30,3. ΜC-ΒΡ (ЕРІ) бутилметиловий етер, 4:1) дає 3-(1,1'-дифеніл-3розраховано для C23H25N2O 2S 393,1637 (M+H)+, іл)пропаналь (0,601г, 83%). знайдено 393,1650. (b) трет-Бутил 5-(1,1'-дифеніл-3-іл)-2-((6-третПриклад 2 бутоксикарбоніл)аміно1піридин-3-іл)метил)-пент-22-[(6-амінопіридин-3-іл)метил]-3-меркапто-5-(Іеноат нафтил)пентанова кислота синтезована способом Розчин трет-бутил 3-{6-[(третіз прикладу 1. 1 бутоксикарбоніл)аміно]піридин-3-іл}-2Н ЯМР (400МГц, CDCI3): d 8,14-8,10 (d, 1H), (діетоксифосфорил)пропаноату (1,058г, 2,31ммол) 7,93-7,89 (d, 1H), 7,80-7,54 (m, 1H), 7,67-7,35 (m, у сухому ТГФ (4мл) додають до розчину гідриду 6H), 6,83-6,77 (m, 1H), 3,52-3,35(m, 1H), 3,22-3,12 натрію (0,111г, 60% у мінеральному маслі, (m, 2H), 2,90-2,80 (m, 3Н), 2,25-2,13 (m, 1H), 2,052,77ммол) у сухому ТГФ (3мл) при 0°С та суміш 1,87 (m, 1H). MC-BP (ЕРІ) розраховано для перемішують при 0°С 60хв. До цієї суміші додають C21H23N2 O2S 367,1480 (М+Н)+, знайдено 367,1497. розчин 3-(1,1'-дифеніл-3-іл)пропаналю (0,582г, Приклад 3 2,77ммол) у сухому ТГФ (3мл), та реакційній суміші 2-[(6-амінопіридин-3-іл)метил]-5-(3дозволяють досягати кімнатної температури проціанофеніл)-3-меркаптопентанова кислота є синтягом 22год. Потім додають ЕtOАс, і органічну фатезована способом із прикладу 1. 1 зу промивають насиченим водним NH4CI та воН ЯМР (400МГц, CD3CN/D2O): d 7,73 (dd, дою, висушують (Na2SO4) та концентрують. ФлешJ=2,2, 9,3Гц, 0,5Н), 7,70 (dd, J=2,2, 9,3Гц, 0,5Н), хроматографія залишку (толуол/ЕtOАс, 15:1) дає 7,58-7,40 (m, 5H), 6,90 (d, J=9,1Гц, 0,5Н), 6,88 (d, трет-бутил 5-(1,1'-дифеніл-3-іл)-2-({6-[(третJ=9,3Гц, 0,5Н), 2,99-2,88 (m, 2H), 2,82-2,71 (m, 4H), бутоксикарбоніл)аміно]піридин-3-іл}метил)пент-22,12-2,00 (m, 1H), 1,88-1,74 (m, 1H). 13 еноат (1,105г, 93%) як суміш E/Z-ізомерів. C ЯМР (101 МГц, CD3CN/D2O): d 175,5, 174,9, (c) трет-Бутил 5-(1,1'-ди феніл-3-іл)-2-({6-трет153,0, 146,0, 145,8, 143,1, 133,9, 132,4,132 3, 130,3, бутоксикарбоніл)аміно]піридин-3-іл} метил)-3-[(4130,3, 129,8,124,3, 124,0, 119,4, 113,9, 113,9, 111,6, метоксибензил)тіо]пентаноат 53,8, 52,8, 41,1, 40,2, 37,4, 32,5, 32,5, 31,1, 30,5. До розчину 4-метокси-a-толуолтіолу (0,58мл, МС-ВР (ЕРІ) розраховано для C18H22N3O2S 4,17ммол) у сухому, дегазованому ДМФ (2мл) до342,1276 (М+Н)+, знайдено 342,1277 дають каталітичну кількість гідриду натрію при Приклад 4 кімнатній температурі (60% у мінеральному маслі) 5-[3-(амінокарбоніл)феніл]-2-[(6-амінопіридинта розчин трет-бутил 5-(1,1'-дифеніл-3-іл)-2-({63-іл)метил]-3-меркаптопентанова кислота синте[(трет-бутоксикарбоніл)аміно]піридин-3зована способом із прикладу 1, починаючи з 3іл}метил)пент-2-еноату (1,073г, 2,08ммол) у сухойод-N-(2,4,6-триметоксибензил)бензаміду. 3-йодму, дегазованому ДМФ (5мл). Після 20год. при N-(2,4,6-триметоксибензил)бензамід синтезований кімнатній температурі реакційну суміш розріджуз 3-йодбензойної кислоти, застосовуючи стандарють ЕtOАс та три рази промивають водою. Органітні процедури. 1 чний шар висушують (Na2SO4), концентрують, та Н ЯМР (400МГц, CD3CN/D2O): d 7,72-7,67 (m, за допомогою флеш-хроматографії (гептан/ЕtOАс, 1H), 7,65-7,61 (m, 2H), 7,52-7,49 (m, 1H), 7,42-7,35 3:1 та толуол/ЕtOАс 12:1) отримують трет \-бутил (m, 2H), 6,89 (d, J=9,3Гц, 0,7Н), 6,85 (d, J=9,1Гц, 5-(1,1'-дифеніл-3-іл)-2-({6-[(трет0,3Н), 3,00-2,87 (m, 2H), 2,81-2,72 (m, 4H), 2,13бутоксикарбоніл)аміно]піридин-3-іл}метил)-3-[(42,00 (m, 1H), 1,90-1,86 (m, 1H). 13 метоксибензил)тіо]пентаноат (1,251г, 90%) C ЯМР(101МГц, CD3CN/D2O): d 175,7, 175,1, (d) 2-[(6-амінопіридин-3-іл)метил1-5-(1,1'171,5, 161,7, 161,4, 153,0, 146,0, 145,8,142,1, 142,0, дифеніл-3-іл)-3-меркаптопентанова кислота 133,9, 133,4, 132,7, 129,1, 127,8, 127,7, 125,5, трет-Бутил 5-(1,1'-дифеніл-3-іл)-2-({6-[(трет124,3, 124,0, 114,0, 113,9, 53,7, 52,6, 41,0, 39,9, бутоксикарбоніл)аміно]піридин-3-іл}метил)-3-[(437,7, 37,6, 32,8, 32,7, 31,0, 30,4. МС-ВР (ЕРІ) розметоксибензил)тіо]пентаноат (0,669г, 1,00ммол) раховано для C18H22N3O3S 360,1382 (M+H)+, знайрозчиняють у тріетилсилані (0,75мл) та трифлуодено 360,1378. роцтовій кислоті (6,0мл). Розчин нагрівають до Приклад 5 60°С 3год, та потім концентрують. Очищення за2-[(6-амінопіридин-3-іл)метил]-5-[2-флуор-4лишку реверсивно-фазовою ВЕРХ (колонка С-8, (трифлуорметил)феніл]-3-меркаптопентанова кислінійний градієнт 40%-> 100% MeCN у 5% водному лота синтезована способом із прикладу 1. 13 78042 14 1 Н ЯМР (400МГц, CD3CN/D2O): d 7,75-7,71 (m, Н ЯМР (500МГц, CD3eN/D 2O): d 7,99(dd, 0,5Н), 1H), 7,56 (d, J=1,6Н, 1H), 7,47-7,35 (m, 3Н), 6,91 (d, 7,96 (dd, 0,5Н), 7,81 (d, 0,5Н), 7,80 (d, 0,5Н), 7,56J=9,3Гц, 1H), 3,04-2,91 (m, 1H), 2,88-2,74 (m, 4H). 7,46 (m, 4H), 7,17 (d, 0,5Н), 7,15 (d, 0,5Н), 4,11 (s, 13 2H), 3,26-2,97 (m, 6H), 2.40-2,25 (m, 1Н), 2,17-2,02 C ЯМР (101МГц, CD3CN/D2O): d 175,4, 174,9, (m, 1Н). МС (ЕРІ) 356,2 (М+Н)+. 162,0, 161,4, 159,6, 153,0, 146,0, 145,9, 134,0, Приклад 12 133,2, 133,0, 129,9, 124,2, 124,0, 121,4, 114,0, 2-[(6-амінопіридин-3-іл)метил]-5-(2113,9, 112,8, 112,6, 53,8, 53,0, 41,5, 40,8, 36,3, 36,2, гідроксифеніл)-3-меркаптопентанова кислота син31,2, 30,6, 26,5. МС-ВР (ЕРІ) розраховано для тезована способом із прикладу 1, починаючи із 1C18H19F 4N2O 2S 403,1103 (М+Н)+, знайдено йод-2-[(4-метоксибензил)окси]бензолу. 1-йод-2-[(4403,1137. метоксибензил)окси]бензол синтезований з 2Приклад 6 йодфенолу, застосовуючи стандартні процедури. 2-[(6-амінопіридин-3-іл)метил]-5-(31 хлорфеніл)-3-меркаптопентанова кислота синтеН ЯМР (500МГц, 90% CD3CN/D2O) d млн-1 зована способом із прикладу 1. 1,72-1,87 (m, 1Η), 2,00-2,15 (m, 1Η), 2,60-2 75 (m, 1 1Η), 2,77-2,94 (m, 4,6Η), 3,06-3,11 (m, 0,4Н), 6,75Н ЯМР (500МГц, CD3CN/D2O): d 7,75 (dd, 6,81 (m, 2Η), 6,90-6,94 (m, 1Η), 7 02-7,13 (m, 2Η), 0,5Н), 7,72 (dd, 0,5Η), 7,56 (d, 0,5Н), 7 54 (d, 0,5Η), 7,30-7,10 (m, 4H), 6,92 (d, 0,5Н), 6,91 (d, 0,5Н), 7,56 (d, 0,6Η), 7,57 (d, 0,4Η), 7,75 (dd, 0,6Η), 7,77 (dd, 0,4Η). МС (ЕРІ) 333,2 (М+Н)+. 3,02-2,65 (m, 6H), 2,10-2,00 (m, 1H), 1,88-1,74 (m, + Приклад 13 1H). MC (ЕРІ) 351,1 (М+Н) . 2-[(6-амінопіридин-3-іл)метил]-5-[4Приклад 7 (аміносульфоніл)феніл]-3-меркаптопентанова кис2-[(6-амінопіридин-3-іл)метил]-5-(1,3бензодіоксол-5-іл)-3-меркаптопентанова кислота лота синтезована способом із прикладу 1, починаючи з 4-йод-N-(2,4,6синтезована способом із прикладу 1. 1 триметоксибензил)бензолсульфонаміду. 4-йод-NН ЯМР (400МГц, CD3CN/D2O): d 7,72(dd, 1H), (2,4,6-триметоксибензил)-бензолсульфонамід син7,69 (d, 0,5Н), 7,55 (s, 0,5Н), 7,53 (s, 0,£Н), 6,89 (m, тезований з 4-йодбензолсульфоніл хлориду, за1H), 6,77-6,60 (m, 3Н), 5,88(s, 2H), 3,0-2,70 (m, 5H), стосовуючи стандартні процедури. 2,58-2,68 (m, 1H), 1,92-2,08 (m, 1Η), 1,69-1,81 (m, 1 Н ЯМР (500МГц, 75% CD3CMD2O) d млн -1 1Η). МС-ВР (ЕРІ) розраховано для C18H20N2O4S + 1,79-1,92 (m, 1Η), 2,04-2,18 (m, 1Η), 2,76-2,88 (m, 361,1222 (М+Н) , знайдено 361,1236. 4Η), 2,90-3,07 (m, 2Η), 6,92 (d, 0,5Η), 6,93 (d, 0,5Η), Приклад 8 7,40 (d, 1Η), 7,42 (d, 1Η), 7,57 (d, 0,5Η), 7,58 (d, 2-[(6-амінопіридин-3-іл)метил]-3-меркапто-50,5Η), 7,72-7,81 (m, 3Η). МС (ЕРІ) 396,1 (М+Н)+. піридин-2-ілпентанова кислота синтезована споПриклад 14 собом із прикладу 1, починаючи з 3-піридин-22-[(6-амінопіридин-3-іл)метил]-3-меркапто-5-(4ілпропаналю. 1 метоксифеніл)пентанова кислота синтезована Н ЯМР (600МГц, D2O) d млн -1 1,90-2,37 (m, способом із прикладу 1. 2Η), 2,70-2,98 (m, 3Η), 3,05-3,11 (m, 1Η), 3,12-3,24 1 Н ЯМР (500МГц, 75% CD3CN/D2O) d млн-1 (m, 1Η), 3,32-3,41 (m, 1Η), 6,89 (d, 1Η), 7,57 (s, 1Η), 1,73-1,85 (m, 1Η), 1,99-2,11 (m, 1Η), 2,61-2,72 (m, 7,75 (dd, 1Η), 7,80-7,85 (m, 1Η), 7,88 (d, 1Η), 8,391Η), 2,75-2,95 (m, 4,5Η), 2,98-3,04 (m, 0,5Η), 3,75 8,46 (m, 1Η), 8,54-8,60 (m, 1Η). МС (ЕРІ) 318,2 (s, 1,5Η), 3,76 (s, 1,5Η), 6,82-6,88 (m, 2Η), 6,92 (d, (М+Н)+ Приклад 9 0,5Η), 6,93 (d, 0,5Η), 7,12 (d, 0,5Η), 7,15 (d, 0,5Η), 20 7,56 (s, 0,5Η), 7,58 (s, 0,5), 7,72-7,78 (m, 1Η). МС 2-[(6-амінопіридин-3-іл)метил]-3-меркапто-5(ЕРІ) 347,2 (М+Н)+. (3,4,5-тріметоксифеніл)пентанова кислота синтеПриклад 15 зована способом із прикладу 1. 1 2-[(6-амінопіридин-3-іл)метил]-5-(4Н ЯМР (600МГц, CD3CN/D2O) d млн -1 1,71гідроксифеніл)-3-меркаптопентанова кислота син1,87 (m, 1H), 1,98-2,10 (m, 1H), 2,58-5 2,70 (m, 1Н), тезована з 2-[(6-амінопіридин-3-іл)метил]-32,73-2,87 (m, 4Н), 2,90 (d, 0,5Н), 2,88-3,02 (m, меркапто-5-(4-метоксифеніл)пентанової кислоти, 0,5Н), 3,65 (s, 3Н), 3,75 (s, 3Н), 3,75 (s, 3Н), 6,48 (s, застосовуючи стандартні умови для гідролізу ме1H), 6,49 (s, 1H), 6,88 (d, 0,5Н), 6,89 (d, 0,5Н), 7,52 токсил групи (концентрована водна гідрохлоридна (d, 1H), 7,67-7,72 (m, 1Н). МС (ЕРІ) 407,2 (М+Н)+. кислота під зворотним холодильником в аргоні Приклад 10 24год.). 2-[(6-амінопіридин-3-іл)метил]-3-меркапто-51 Н ЯМР (500МГц, 25% CD3CN у D2 O) d млн -1 піридин-3-ілпентанова кислота синтезована спо1,73-1,85 (m, 1Η), 1,94-2,09 (m, 1Η), 2,59-2,68 (m, собом із прикладу 1, починаючи з 3-піридин-31Η), 2,75-2,87 (m, 4Η), 2,90 (d, 0,5Η), 2,98-3,03 (m, ілпропаналю. 1 0,5Η), 6,71-6,76 (m, 2Η), 6,90-6,95 (m, 1Η), 7,00Н ЯМР (600МГц, CD3CN/D2O) d млн -1 1,787,07 (m, 2Η), 7,54-7,57 (m, 1Η), 7,71-7,76 (m, 1Η). 1,90 (m, 1H), 2,03-2,19 (m, 1H), 2,71-2,78 (m, 1H), МС (ЕРІ) 333,2 (М+Н)+. 2,78-3,02 (m, 4H), 3,07-3,18 (m, 1H), 6,90 (d, 1H), Приклад 16 7,56 (s, 1H), 7,73-7,76 (m, 1H), 7,91-7,95 (m, 1H), 2-[(6-амінопіридин-3-іл)метил]-3-меркапто-5-[48,40-8,44 (m, 1H), 8,55-8,59 (m, 2H). МС (ЕРІ) (трифлуорметокси)феніл]-пентанова кислота син318,2(М+Н)+. тезована способом із прикладу 1. Приклад 11 1 Н ЯМР (500МГц, CD3CN/D2O) d млн -1 1,762-[(6-амінопіридин-3-іл)метил]-5-[41188 (m, 1Η), 2,01-2,14 (m, 1Η), 2,66-5 3,07 (m, 6Η), (ціанометил)феніл]-3-меркаптопентанова кислота синтезована способом із прикладу 1. 6,94 (d, 1Η), 7,16-7,25 (m, 2Η), 7,26-7,34 (m, 2Η), 7,59 (d, 1Η), 7,78 (dd, 1Η). МС (ΕΡΙ) 401,3 (Μ+Η)+. 1 15 78042 16 Приклад 17 Приклад 23 2-[(6-амінопіридин-3-іл)метил]-5-(1,3-диметил2-[(6-амінопіридин-3-іл)метил]-5-(42,4-діоксо-1,2,3,4-тетрагідропіримідин-5-іл)-3бензилфеніл)-3-меркапртопентанова кислота синмеркаптопентанова кислота синтезована спосотезована способом із прикладу 1, починаючи з (4бом із прикладу 1. йодфеніл)(феніл)метанону. 1 1 Н ЯМР (500МГц, CD3CN/D2O) d млн -1 1,57Н ЯМР (500МГц, 80% CD3CN/D2O) d млн-1 1,76 (m, 1Η), 1,92-2,06 (m, 1Η), 2,31-2,45 (m, 1Η), 1,72-1,82 (m, 1Η), 2,00-2,10 (m, 1Η), 2,72-2,62 (m, 2,53-2,63 (m, 1Η), 2,75-3,07 (m, 4Η), 3,22 (s, 1,5Η), 1Η), 2,78-3,04 (m, 5Η), 3,9 (s, 2Η), 6,90 (d, Η), 7,083,23 (s, 1,5Η) 3,30 (s, 1,5H), 3,30 (s, 1,5Η), 6,94 (d, 7,29 (m, 9H), 7,55 (d, 1Η), 7,73 (dd, 1Η). МС-ВР 1Η), 7,30 (s, 0,5Η), 7,32 (s, 0,5Η), 7,59-7,64 (m, 1Η), (ЕРІ) розраховано для C24H27N2O2S 407,1793 15 7,80 (ad, 1Η). МС (ЕРІ) 379,2 (М+Н)+. (М+Н)+, знайдено 407,1804. Приклад 18 Приклад 24 2-[(6-амінопіридин-3-іл)метил]-3-меркапто-52-[(2-аміно-1,3-тіазол-5-іл)метил]-3-меркапто(тетрагідро-2-тієніл)пентанова кислота синтезова5-фенілпентанова кислота синтезована способом на способом із прикладу 1, починаючи з 3-тіен-2із прикладу 1, починаючи із mpem-бутил 3-{2ілпропаналю. [(трет-бутоксикарбоніл)аміно]-1,3-тіазол-5-іл}-21 (діетоксифосфорил)пропаноат. Трет-бутил 3-{2Н ЯМР (500МГц, 90% CD3CN/D2O) d млн-1 [(трет-бутоксикарбоніл)аміно]-1,3-тіазол-5-іл}-21,48-1,60 (m, 3Η), 1,70-1,90 (m, 3Η), 2,00-2,10 (m, (діетоксифосфорил)пропаноат синтезований згід2Η), 2,70-3,10 (m, 6Η), 3,25-3,33 (m, 1Η), 6,92 (d, но схеми 1. 1Η), 7,59 (s, 1Η), 7,78 (dd, 1Η). МС (ЕРІ) 327,3 1 (М+Н)+. Н ЯМР (500МГц, 90% CD3CN/D2O) d млн-1 Приклад 19 1,78-1,90 (m, 1H), 2,00-2,11 (m, 1H), 2,68-2,77 (m, 2-[(6-амінопіридин-3-іл)метил]-5-[31Н), 2,78-3,2 (m, 4,5Н), 3,05-3,11 (m, 0,5Н), 6,85(гідроксиметил)феніл]-3-меркаптопентанова кис6,88 (m, 1Η), 7,16-7,33 (m, 5Η). МС (ЕРІ) 323,2 лота синтезована способом із прикладу 1, почи(М+Н)+. наючи із 1-йод-3-{[(4Приклад 25 метоксибензил)окси]метил}бензолу. 1-йод-3-{[(42-(3-азабіцикло[3,2,1]окт-8-ил метил)-3метоксибензил)окси]метил}бензол синтезований з меркапто-5-фенілпентанова кислота синтезована (3-йодфеніл)метанолу, застосовуючи стандартні способом із прикладу 1, починаючи із трет-бутил процедури. 8-[3-трет-бутокси-2-(діетоксифосфорил)-31 оксопропіл]-3-азабіцикло[3,2,1]октан-3Н ЯМР (500МГц, CD3CN/D2O) d млн -1 1,942,10 (m, 1Η), 2,21-2,37 (m, 1Η), 2,78-3,24 (m, 6Η), карбоксилат. Трет-бутил 8-[3-трет-бутокси-2(діетоксифосфорил)-3-оксопропіл]-34,77 (s, 1Η), 4,78 (s, 1Η), 7,09 (d, 0,5Η), 7,12 (d, азабіцикло[3,2,1]октан-3-карбоксилат синтезова0,5Η), 7,34-7,44 (m, 3Η), 7,48-7,54 (m, 1Η), 7,73 (d, ний, як показано у схемі 2. 0,5Н), 7,74 (d, 0,5Н), 7,91 (dd, 0,5Н), 7,96 (dd, 0,5Н). 1 МС (ЕРІ) 347,3 (М+Н)+. Н ЯМР (400МГц, CD3CN/D2O): d 7,90-7,80 (m, Приклад 20 2H), 7,80-7,70 (m, 3Н), 3,80-3,60 (m, 2H), 3,60-3,35 2-[(6-амінопіридин-3-іл)метил]-5-[2-(2,4(m, 4H), 3,35-3,18 (m, 1H), 3,18-3,00 (m, 1H), 2,90дихлорфенокси)феніл)-3-меркаптопентанова кис1,80 (m, 11Н). МС (ЕСІ) 333,5 (М+Н)+. лота синтезована способом із прикладу 1. Приклад 26 1 Цей приклад ілюструє одержання 2-[(6Н ЯМР (400МГц, CDCI3): d 7,64 (d, 1H), 7,51 амінопіридин-3-іл)метил]-3-меркапто-5-(3(d, 1Η), 7,40 (d, 1H), 7,27 (m, 1H), 7,18-7,04 (m, 3Н), {[метил(27,78-7,69 (m, 3Н), 3,15-2,92 (m, 2H), 2,87-2,65 (m, фенілетил)аміно]карбоніл}феніл)пентанової кис4H),2,21-2,08 (m, 1H), 1,89-1,75 (m, 1Η). MC-BP лоти. (ЕРІ) розраховано для C23H22CI2N2O3S 477,0806 КОН (5мл 1М розчину в етанолі) додають до (М+Н)+, знайдено 477,0170. розчину етил 3-{5-трет-бутокси-4-({6-[(третПриклад 21 бутоксикарбоніл)аміно]піридин-3-іл}метил)-3-[(42-[(6-амінопирідин-3-іл)метил]-5-(3,5метоксибензил)тіо]-5-оксопентил}бензоату (0,27г, диметилфеніл)-3-меркаптопентанова кислота син0,406ммол, синтезованого способом із прикладу 1) тезована способом із прикладу 1. 1 в етанолі (2мл), та суміш перемішують при кімнатН ЯМР (500МГц, CD3CN/D2O) d млн -1 1,72ній температурі 2год. і потім при 50°С 2год. Реак1,85 (m, 1Η), 1,97-2,11(m, 1Η), 2,23 (s, 3Η), 2,24 (s, ційну суміш потім розріджують діетиловим етером 3Η), 2,57-2,66 (m, 1Η), 2,75-2,87 (m, 4Η), 2,90 (d, та водою. Органічну фазу екстрагують 0,1Μ вод0,5Η), 2,99-3,05 (m, 0,5Η), 6,78-6,85 (m, 3Η), 6,88ним КОН та об'єднану водну фазу підкислюють 6,94 (m, 1Η), 7,54 (d, 0,5Η), 7,56 (d, 0,5Η), 7,71 (dd, (рН 5), застосовуючи 3Μ водну НСІ. Потім водну 0,5Η), 7,73 (d, 0,5Η) МС (ЕРІ) 345,2 (М+Н)+. фазу екстрагують діетиловим етером і органічному Приклад 22 фазу промивають розсолом, висушують та конце2-[(6-амінопіридин-3-іл)метил]-3-меркапто-5-(4нтрують. Очищення залишку реверсивно-фазовою пропілфеніл)пентанова кислота синтезована споВЕРХ (колонка С-8, лінійний градієнт 40%® 100% собом із прикладу 1. 1 MeCN в 5% водному MeCN, що містить 0,1Μ ацеН ЯМР (500МГц, CD3CN/D2O) d млн -1 0,84 (t, тат амонію) дає залишок, що розчиняють у толуолі 3Η), 1,49-1,58 (m, 2Η), 1,70-1,81 (m, 1Η), 1,96-2,04 й воді та концентрують з утворенням 3-{5-трет(m, 1Η), 2,50 (t, 2Η), 2,60-2,70 (m, 1Η), 2,71-2,93 (m, бутокси-4-({6-[(трет4Η), 2,93-3,01 (m, 1Η), 6,88 (d, 1Η), 7,07-7,10 (m, бутоксикарбоніл)аміно]піридин-3-іл}метил)-3-[(44Η), 7,54 (d, 1Η), 7,71 (dd, 1Η). МС (ЕРІ) 359,2 метоксибензил)тіо]-5-оксопентил}бензойної кисло(М+Н)+. 17 78042 18 ти (0,12г, 54%). Приклад 29 (b) трет-бутил 2-({6-трет2-[(6-амінопіридин-3-іл)метил]-5-{3-[(6,7бутоксикарбоніл)аміно]піридин-3-іл)метил)-3-[(4диметокси-3,4-дигідроізохінолін-2(1Н)метоксибензил)тіо]-5-(3-{[метил(2ілкарбоніл]феніл}-3-меркаптопентанова кислота фенілетил)амінокарбоніл)феніл)пентаноат синтезована способом із прикладу 26. 1 N-метилфенетиламін (20мкл, 0,14ммол), Н ЯМР (400МГц, CD3CN/D2O): d 7,68 (m, 1H), HATU (55мг, 0,15ммол) та iPr2EtN (46мкл, 7,49 (s, 1H), 7,38-7,22 (m, 4H), 6,90-6,72 (m, 2,5Н), 0,26ммол) додають до розчину 3-{5-трет-бутокси6,47 (s, 0,5Н), 4,69 (s, 1H), 4,44 (s, 1H), 3,96-3,46 4-({6-[(трет-бутоксикарбоніл)аміно]піридин-3(m, 8H), 3,01-2,59 (m, 8H), 2,17-1,67 (m, 2H). MC-BP іл}метил)-3-[(4-метоксибензил)тіо]-5(ЕРІ) розраховано для C29H33N3O5S 536,2219 оксопентил}бензойної кислоти (84мг, 0,132ммол) у (М+Н)+, знайдено 536,2248. ДМФ (2мл) в аргоні при 0°С. Реакційну суміш пеПриклад 30 ремішують 2год. і потім охолоджують льодом. До2-[(6-амінопіридин-3-іл)метил]-3-меркапто-5-{3дають діетиловий етер та воду і водну фазу екст[(2-піридин-2-ілетокси)карбоніл]феніл}пентанова рагують діетиловим етером. Об'єднану органічну кислота синтезована способом із прикладу 26. 1 фазу висушують та концентрують. ФлешН ЯМР (400МГц, CD3CN/D2O): d 8,64 (d, 1H), хроматографія (гептан/ЕtOАс, 3:1) дає трет-бутил 8,46 (dd, 1H), 7,98 (d, 1H), 7,88 (dd, 1H), 7,77-7,64 2-({6-[(трет-бутоксикарбоніл)аміно]піридин-3(m, 3Н), 7,58-7-31 (m, 3Н), 6,89 (dd, 1H), 4,65 (t, іл}метил)-3-[(4-метоксибензил)тіо]-5-(3-{[метил(22H), 3,50 (t, 2H), 2,99-2,62 (m, 6H), 2,03 (m, 1H), фенілетил)аміно]карбоніл}феніл)пентаноат (81мг, 1,79 (m, 1H). MC-BP (ЕРІ) розраховано для 81,4%). C25H27N3 O4S 466,1803 (М+Н)+, знайдено 466,1813. (с) 2-(6-амінопіридин-3-іл)метил]-3-меркапто-5Приклад 31 (3-{[метил(22-[(6-амінопіридин-3-іл)метил]-5-(3-{[2-(2,6фенілетил)аміно]карбоніл)феніл)пентанова кислодихлорфеніл)етокси]карбоніл}феніл)-3та меркаптопентанова кислота синтезована спосотрет-бутил 2-({6-[(третбом із прикладу 26. 1 бутоксикарбоніл)аміно]піридин-3-іл}метил)-3-[(4Н ЯМР (400МГц, CD3CN/D2O): d 7,69 (m, 3Н), метоксибензил)тіо]-5-(3-{[метил(27,51 (s, 1H), 7,38-7,28 (m, 4H), 7,12 (m, 1H), 6,84 фенілетил)аміно]карбоніл}феніл)пентаноат (80мг, (m, 1H), 4,48 (m, 2H), 3,62 (m, 0,5Н), 3,31 (m, 2H), 0,106ммол) розчиняють у тріетилсилані (0,4мл) та 3,10 (m, 0,5Н), 2,98-2,53 (m, 5H), 2,0 (m, 1H), 1,75 трифлуороцтовій кислоті (3,0мл). Розчин нагріва(m, 1H). MC-BP (ЕРІ) розраховано для ють до 60°С 1год. та потім концентрують. ОчиC26H26CI 2N2O 4S 533,1069 (М+Н)+, знайдено щення залишку реверсивно-фазовою ВЕРХ (коло533,1071. нка С-8, лінійний градієнт 20%-> 100% MeCN у 5% Приклад 32 водному MeCN, що містить 0,15% трифлуороцтову 2-[(6-амінопіридин-3-іл)метил]-5-[3кислоту) після висушування .виморожуванням дає (етоксикарбоніл)феніл]-3-меркаптопентанова кисназвану діастереоізомерну сполуку у вигляді трилота синтезована способом із прикладу 26, почифлуорацетату (64мг, 100 %). наючи з етил 3-{5-трет-бутокси-4-({6-[(трет1 Н ЯМР (400МГц, CD3CN/D2O): d 7,76-6,63 (m, бутоксикарбоніл)аміно]піридин-3-іл}метил)-3-[(412Η), 3,71 (m, 1H), 3,40 (m, 1H), 3,21-2,54 (m, 11Н), метоксибензил)тіо]-5-оксопентил}бензоату. 1 2,12-1,63 (m, 2H). MC-BP (ЕРІ) розраховано для Н ЯМР (500МГц, CD3CN/D2O): d 7,90(d, 1H), + C27H31N3 O3S 478,2164 (М+Н) , знайдено 478,2133. 7,87 (s, 1H), 7,74 (d, 1H), 7,58 (s, 1H), 7,53 (d, 1H), Приклад 27 7,48 (t, 1H), 6,91 (d, 1H), 4,41 (q, 2H), 2,95-3,03 (m, 3-[5-(6-амінопіридин-3-іл)-4-карбокси-31H), 2,95-2,82 (m, 4H), 2,75-2,80 (m, 1H), 2,14-2,23 меркаптопентил]бензойна кислота синтезована (m, 1H), 1,95-2,03 (m, 1H), 1,41 (t, 3Н). MC-BP (ЕРІ) способом із прикладу 26, починаючи з 3-{5-третрозраховано для C20H25N2O 4S 389,1535 (М+Н)+, бутокси-4-({6-[(бутоксикарбоніл)аміно]піридин-3знайдено 389,1555. іл}метил)-3-[(4-метоксибензил)тіо]-5-оксопентил}Приклад 33 бензойної кислоти. 2-[(6-амінопіридин-3-іл)метил]-5-(3-{[(21 Н ЯМР (400МГц, D2O): d 8,05-8,01 (dd, 1H), флуоретил)аміно]карбоніл}феніл)-38,01-7,99 (s, 1H), 7,90-7,86 (dd, 1H), 7,73-7,70 (s, меркаптопентанова кислота синтезована спосо1H), 7,68-7,58 (m, 2H), 7,08-7,04 (d, 1H), 3,18-3,08 бом із прикладу 26. 1 (m, 1H), 3,06-2,90 (m, 5H), 2,36-2,26 (m, 1H), 2,14Н ЯМР (500МГц, 10% CD3CN у D2O): d 7,95 2,04 (m, 1H). MC-BP (ЕРІ) розраховано для (dd, 0,5Н), 7,90 (dd, 0,5Η), 7,86-7,81 (m, 2Η), 7,75 + C18H20N2 O4S 361,1222 (М+Н) , знайдено 361,1212. (dd, 0,5Н), 7,73 (dd, 0,5Н), 7,70-7,60 (m, 2H), 7,13 Приклад 28 (d, 0,5Н), 7,07 (d, 0,5Н), 4,89-4,86 (m, 1H), 4,8-4,76 2-[(6-амінопіридин-3-іл)метил]-5-[3-(3,4(m, 1H), 3,91-3,94 (m, 1H), 3,85-3,89 (m, 1H), 3,25дигідроізохінолін-2(1H)-ілкарбоніл)феніл]-33,12 (m, 2,5Н), 3,11-2,98 (m, 3Н), 2,92-2,97 (m, меркаптопентанова кислота синтезована спосо0,5Н), 2,41-2,24 (m, 1Н), 2,21-2,01 (m, 1Н). MC-BP бом із прикладу 26. (EРІ) розраховано для C20H25FN3 O3S 406,1600 1 Н ЯМР (500МГц, CD3CN/D2O): d 7,73 (m, 1H), (М+Н)+, знайдено 406,1560. 7,52 (s, 1H), 7,44-7,11 (m, 8H), 6,90 (m, 1H), 4,81 (s, Приклад 34 1H), 4,54 (s, 1H), 3,89 (br, 1H), 3,57 (br, 1H), 2,992-[(6-амінопіридин-3-іл)метил]-5-{32,65 (m, 8H), 2,09 (m, 1H), 1,85 (m, 1 Η). MC-BP [(флуоретил)карбоніл]феніл}-3(ЕРІ) розраховано для C27H29N3O3S 476,2008 меркаптопентанова кислота синтезована спосо(М+Н)+, знайдено 476,2002. бом із прикладу 26. 19 78042 20 Приклад 40 Н ЯМР (500МГц, 5% CD3CN/D2O): d 7,77 (dd, 2-[(6-амінопіридин-3-іл)метил]-5-(3-{[4-(40,5Н), 7,72 (dd, 0,5Н), 7,52-7,54 (m, 1H), 7,45-7,32 (m, 2H), 7,25-7,29 (m, 2H), 6,91 (d, 0,5Н), 6,93 (d, хлорфеніл)піперазин-1-іл]карбоніл}феніл)-3меркаптопентанова кислота синтезована спосо0,5Н), 3,07 (s, 3Н), 15 2,95 (два s, 3Н), 3,05-2,71 (m, бом із прикладу 26. 6Н), 2,19-2,0 (m, 1Н), 1,99-1,82 (m, 1Н). MC-BP 1 (ЕРІ) розраховано для C20H26N3O3S 388,1695 Н ЯМР (400МГц, CD3CN): d 7,75-7,67 (m, 1Η), + (М+Н) , знайдено 388,1683. 7,52-7,47 (dd, 1Η), 7,40-7,28 (m, 5H), 7,12-7,07 (m, Приклад 35 3Н), 6,90-6,84 (m, 1H), 4,00-3,50 (m, 4H), 3,40-3,20 2-[(6-амінопіридин-3-іл)метил]-3-меркапто-5-{3(m, 4H), 3,03-2,90 (m, 1H), 2,87-2,70 (m, 5H), 2,17[(вініламіно)карбоніл]феніл}пентанова кислота 2,03 (m, 1H),1,97-1,89 (m, 1H). МС-ВР (ЕРІ) розрасинтезована способом із прикладу 26. ховано для C28H31CIN4O3S 539,1884 (М+Н)+, знай1 дено 539,1868. Н ЯМР (500МГц, 10% CD3CN/D2O): d 7,71 (два Приклад 41 dd, 1H), 7,53 (два dd, 0,5Н), 6,89 (m, 1Н), 6,77-6,60 2-[(6-амінопіридин-3-іл)метил]-5-(3(m, ЗН), 5,88(s, 2H), 3,0-2,70 (m, 5H), 2,62 (m, 1H), {[бензил(метил)аміно]карбоніл}феніл)-32,00 (m, 1H), 1,75(m, 1H). МС-ВР (ЕРІ) розраховамеркаптопентанова кислота, синтезована спосоно для C20H24N3O 3S 386,1538 (М+Н)+, знайдено бом із прикладу 26. 386,1470. 1 Приклад 36 Н ЯМР (400МГц, CD3CN): d 7,75-7,18 (m, 11H), 2-[(6-амінопіридин-3-іл)метил]-5-[3-({[2-(1,36,88-6,80 (d, 1H), 4,80-4,70 (s, 1H), 4,53-4,45 (s, бензодіоксол-5-іл)етил]аміно}карбоніл)-феніл]-31Н), 3,00-2,95 (m, 1Н), 2,93-2,90 (s, ЗН), 2,88-2,78 меркаптопентанова кислота синтезована спосо(m, 5H), 2,05-2,00 (m, 1H), 1,99-1,94 (m, 1Н). МС-ВР бом із прикладу 26. (ЕРІ) розраховано для C26H29N3O3S 464,2008 1 (М+Н)+, знайдено 464,1972. Н ЯМР (500МГц, 20% CD3CN/D2O) d млн-1 Приклад 42 1,88-2,06 (m, 1Η), 2,10-2,27 (m, 1Η), 2,79-3,11 (m, 2-[(6-амінопіридин-3-іл)метил-3-меркапто-5-[38Η), 3,68 (t, 2Η), 6,00 (s, 2Η), 6,85 (m, 1Η), 6,90 (m, (піролідин-1-ілкарбоніл)феніл]пентанова кислота 2Η), 6,96 (d, 0,7Η), 7,01 (d, 0,3Η), 7,47 (m, 1,2Н), 7,51 (m, 0,6Η), 7,56 (s, 0,7Η), 7,58 (s, 0,3Η), 7,62 (s, синтезована способом із прикладу 26. 1 2Η), 7,76 (d, 0,7Η), 7,81 (d, 0,3Η). МС-ВР (ЕРІ) розН ЯМР (500МГц, 95% CD3CN у D2O): d 7,75 + раховано для C27H29N3O5S 508,1906 (М+Н) , знай(dd, 0,5Н), 7,69 (dd, 0,5Η), 7,51-7,54 (m, 1H), 7,44дено 508,1935. 7,30 (m, 4H), 6,91 (d, 0,5Н), 6,87 (d, 0,5Н), 3,53 (t, Приклад 37 2H), 3,30-3,40 (m, 2H), 3,00-2,79 (m, 5,5Н), 2,672-[(6-амінопіридин-3-іл)метил]-5-{32,74 (m, 0,5Н), 2,18-1,8 (m, 6H). МС-ВР (ЕРІ) роз[(дибензиламіно)карбоніл]феніл}-3раховано для C22H28N3O3S 414,1851 (М+Н)+, знаймеркаптопентанова кислота, синтезована спосодено 414,1837, бом із прикладу 26. Приклад 43 1 2-[(6-амінопіридин-3-іл)метил]-5-(3-{[4Н ЯМР (500МГц, 50% CD3CN/D2O) d млн-1 (етоксикарбоніл)піперидин-1-іл]карбоніл}феніл)-32,28-2,40 (m, 1Η), 2,52-2,63 (m, 1Η), 3,25-3,53 (m, меркаптопентанова кислота синтезована спосо6Η), 4,99 (s, 2Η), 5,23 (s, 2Η), 7,46 (d, 0,4Η), 7,48 (d, бом із прикладу 26. 0,6Η), 7,71 (d, 2Η), 7,83-8,00 (m, 12Η), 8,08 (s, 1Η), 1 8,25 (dd, 0,4Η), 8,28 (dd, 0,6Η). МС-ВР (ЕРІ) розраН ЯМР (500МГц, CD3CN/D2O): d 1,28 (t, 3Н), ховано для C32H33N3O 3S 540,2321 (М+Н)+, знайде1,59-1,79 (m, 2H),1,86-1,96 (m, 2Н), 2,0-2,22 (m, но 540,2340. 2H), 2,68-2,75 (m, 1H), 2,80-3,12 (m, 7H), 3,13-3,25 Приклад 38 (m, 1H), 3,65 (d, 1H), 4,18 (q, 2H), 4,40-4,48 (m, 1H), 2-[(6-амінопіридин-3-іл)метил]-5-(3-{[(26,95-7,00 (m, 1H), 7,27-7,31 (m, 2H), 7,36-7,48 (m, гідроксіетил)(метил)аміно]карбоніл}феніл)-32H), 7,60 (s, 1H), 7,78 (dd, 0,5Н), 7,82 (dd, 0,5Н). меркаптопентанова кислота синтезована спосоМС-ВР (ЕРІ) розраховано для C26H34N3O5S бом із прикладу 26. 500,2219 (М+Н)+, знайдено 500,2233. 1 -1 Приклад 44 Н ЯМР (500МГц, 50% CD3CN/D2O) d млн 2-[(6-амінопіридин-3-іл)метил]-5-(3-{[41,71-2,11 (m, 2Η), 2,67-2,96 (m, 6Η), 2,89 (s, 1,5Η), (гідроксиметил)піперидин-1-іл]карбоніл}феніл)-33,01 (s, 1,5Η), 3,34 (q, 1Η), 3,52-3,57 (m, 1Η), 3,59 (t, 1Η), 3,77 (t, 1Η), 6,74-6,86 (m, 1Η), 7,12-7,41 (m, меркаптопентанова кислота синтезована способом із прикладу 26. 4Η), 7,45 (s, 1Η) 7,58-7,63 (m, 0,5Η), 7,65-7,69 (m, 1 0,5Η). МС-ВР (ЕРІ) розраховано для C21H28N3O4S Н ЯМР (400МГц, CD3CN): d 7,65-7,71 (dd, 1H), + 418,1800 (М+Н) , знайдено 418,1752. 7,49-7,52 (d, 1H), 7,18-7,36 (m, 4H), 6,82-6,85 (dd, Приклад 39 1H), 3,41-3,47 (m, 4H), 2,77-3,10 (m, 7H), 2,0-2,1 (m, 2-[(6-амінопіридин-3-іл)метил]-5-{3-[(32H), 1,68-1,92 (m, 5H). MC-ВР(ЕР/) розрахована гідроксипіролідин-1-іл)карбоніл]феніл}-3для C24H32N3O 4S 458,2114 (М+Н)+, знайдено меркаптопентанова кислота, синтезована спосо458,2097. бом із прикладу 26. Приклад 45 1 2-[(6-амінопіридин-3-іл)метил]-3-меркапто-5-{3Н ЯМР (400МГц, CD3CN/D2O): d 8,35-8,15 (m, [(3-оксопіперазин-1-іл)карбоніл]феніл}пентанова 1H), 8,05 (br s, 1H), 8,00-7,75 (m, 4H), 7,50-7,35 (m, кислота синтезована способом із прикладу 26. 1H), 6,16 (br m, 0,5Н), 6,02 (brm, 0,5H), 5,02 (br m, 1 0,5H), 4,88 (br m, 0,5H), 4,50-3,60 (m, 4H), 3,55-3,20 Н ЯМР (500МГц, CD3CN/D2O): d млн -1 1,77(m, 7H), 3,0-2,2 (m, 4H). МС-ВР (ЕРІ) розраховано 1,90 (m, 1H), 1,99-2,12 (m, 1H), 2,75-3,0 (m, 6H), для C22Η28Ν3O 4 430,1829 (Μ+Η)+, знайдено 3,25-3,58 (m, 4H), 3,80-4,10 (m, 1H), 4,2 (s, 1H), 430,1801. 6,89 (d, 0,5Н), 6,91 (d, 0,5Н), 7,24-7,29 (m, 2Н), 1 21 78042 22 7,31-7,42 (m, 2H), 7,32 (s, 1H), 7,71 (dd, 0,4Н), 7,74 Приклад 50 (dd, 0,6Н). МС-ВР (ЕРІ) розраховано для 2-[(6-амінопіридин-3-іл)метил]-3-меркапто-5-(3C22H27N4 O4S 443,1753 (М+Н)+, знайдено 443,1766. {[метил(2Приклад 46 фенілетил)аміно]сульфоніл}феніл)пентанова кис2-[(6-амінопіридин-3-іл)метил]-5-(3-{[бензил(3лота синтезована способом із прикладу 1, почиетокси-3-оксопропіл)аміно]карбоніл}феніл)-3наючи з 3-йод-N-метил-N-(2меркаптопентанова кислота синтезована спософенілетил)бензолсульфонаміду. 3-йод-N-метил-Nбом із прикладу 26. (2-фенілетил)бензолсульфонамід синтезовано з 31 йодбензолсульфоніл хлориду, застосовуючи станН ЯМР (500МГц, CD3CN/D2O): d млн -1 1,06 (t, дартні процедури. 1H), 1,19 (t, 2H), 1,67-1,88 (m, 1H), 1 90-2,15 (m, 1 1H), 2,40-3,0 (m, 8H), 3,40-3,58 (m, 0,7Н), 3,58-3,66 Н ЯМР (400МГц, CDCI3): d 7,64 (s, 1H), 7,54(m, 1,3Н), 3,91 (q, 0,7Н), 4,07 (q, 1,3Н), 4,47 (s, 7,57 (d, 3Н), 7,39-7,40 (d, 3Н), 7,24-7,27 (t, 3Н), 1,3Н), 4,69 (s, 0,7Н), 6,80-6,92 (m, 1H), 7,1-7,4 (m, 7,14-7,20 (m, 3Н), 6,75 (s, 2H), 3,23-3,27 (t, 2H), 9H), 7,46 (s, 0,7Н), 7,50 (s, 0,3Н), 7,60-7,74 (m, 1H). 2,96-3,03 (m, 3Н), 2,80-2,84 (t, 3Н), 2,72 (s, 3Н), МС-ВР (ЕРІ) розраховано для C30H36N3O5S 2,07 (s, 1H), 1,69-1,80 (dd, 1H), 1,53-1,55 (d, 1H). 550,2376 (М+Н)+, знайдено 550,2361. MC (ЕРІ) 514,3 (M+H)+. Приклад 47 Приклад 51 2-[(6-амінопіридин-3-іл)метил]-5-(3Цей Приклад ілюструє одержання 2-[(6{[(ціанометил)(метил)аміно]-сульфоніл}феніл)-3амінопіридин-3-іл)метил]-3-меркапто-5-[3меркаптопентанова кислота синтезована спосо(тетрагідрофуран-3-ілокси)феніл]пентанова кислобом із прикладу 1, починаючи з N-(ціанометил)-3та. йод-N-метилбензолсульфонаміду. N-5 (ціаноме(а) трет-бутил(3-йодфенокси)диметилсилан тил)-3-йод-N-метилбензолсульфонамід синтезоІмідазол (7,8г, 115ммол) додають до розчину вано з 3-йодбензолсульфоніл хлориду, застосо3-йодфенолу (12,7г, 58ммол) та третвуючи стандартні процедури. бутил(хлор)диметилсилану (9,9г, 65ммол) у дих1 лорметані (80мл) при 0°С. Реакційну суміш переН ЯМР (500МГц, CD3CN/D2O): d 7,79 (dd, мішують при кт протягом ночі. Суспензію проми0,5Н), 7,76 (dd, 0,5Н), 7,74-7,69 (m, 2Н), 7,64-7,54 вають три рази водою та один раз розсолом, (m, 3Н), 6,95 (d, 0,5Н), 6,94 (d, 0,5Н), 4,29 (s, 2H), висушують і концентрують до одержання сирого 3,11-3,00 (m, 2H), 2,86 (s, 3Н), 2,98-2,78 (m, 4H), трет-бутил(3-йодфенокси)диметилсилану (20г, 2,20-2,09 (m, 1H), 1,95-1,83 (m, 1H). МС-ВР (ЕРІ) 93%). розраховано для C20H25N2O4S 2 449,1317 (М+Н)+, (b) трет-бутил 2-({6-[(третзнайдено 449,1329. бутоксикарбоніл)аміно]піридин-3-іл}метил-5-(3Приклад 48 гідроксифеніл)-3-(4-метоксибензил)тіо]пентаноат 2-[(6-амінопіридин-3-іл)метил]-5-(3-{[(2S)-2Крижану оцтову кислоту (190мл, 3,3ммол) до(анілінометил)піролідин-1-іл]сульфоніл}-феніл)-3дають до розчину трет-бутил 2-({6-[(третмеркаптопентанова кислота синтезована способутоксикарбоніл)аміно]піридин-3-іл}метил)-5-(3бом із прикладу 1, починаючи з N-({(2S)-1-[(3{[трет-бутил(диметил)силіл]окси}феніл)-3-[(4йодфеніл)сульфоніл]піролідин-2-іл}метил)аніліну. метоксибензил)тіо]пентаноату (800мг, 0,89ммол), N-({(2S)-1-[(3-йодфеніл)-сульфоніл]піролідин-2синтезованого способом із прикладу 1, починаючи іл}метил)анілін синтезовано з 3із трет-бутил(3-йодфенокси)диметилсилану) у суйодбензолсульфоніл хлориду, застосовуючи станхому ТГФ (10мл). Додають тетрабутиламонійфлудартні процедури. 1 орид тригідрат (489мг, 1,5ммол) та суміш переміН ЯМР(500МГц, CD3OD): d 7,71 (dd, J=2,1, шують 12год. при кімнатній температурі. Додають 9,1Гц, 1H), 7,59-7,45 (m, 7H), 7,31-7,29 (m, 3Н), EtOAc (150мл) та розчин промивають насиченим 6,89 (d, J=9,3Гц, 1H), 3,83-3,75 (m, 1H), 3,53 (ddd, водним NaHCO3, водою та розсолом, висушують J=3,1, 6,0, 13,0Гц, 14), 3,44-3,36 (m, 2H), 3,26-3,18 та концентрують. Флеш-хроматографія (m, 1H), 3,00-2,70 (m, 6H), 2,05-1,97 (m, 1H), 1,82(СН2СІ2/ЕtOАс, 10:1) дає трет-бутил 2-({6-[(трет1,65 (m, 3H), 1,57-1,50 (m, 1H), 1,42-1,32 (m, 1H). бутоксикарбоніл)аміно]піридин-3-іл}метил)-5-(3МС-ВР (ЕРІ) розраховано для C28H34N4O 4S2 гідроксифеніл)-3-[(4-метоксибензил)тіо]пентаноат 555,2100 (M+H)+, знайдено 555,2032. (660мг, 98%). Приклад 49 (с) трет-бутил 2-({6-[(трет2-[(6-амінопіридин-3-іл)метил]-3-меркапто-5-{3бутоксикарбоніл)аміно]піридин-3-іл)метил)-3-[(4[(метиламіно)сульфоніл]-феніл}пентанова кислота метоксибензил)тіо]-5-[3-(тетрагідрофуран-3синтезована способом із прикладу 1, починаючи з ілокси)феніл]пентаноат N-(2-фурилметил)-3-йод-N1,1'-азобіс(N,N-диметилформамід) (134мг, метилбензолсульфонаміду. N-(2-фурилметил)-30,78ммол) додають до розчину трі-н-бутилфосфіну йод-N-метилбензолсульфонамід синтезовано з 3(221мл, 0,89ммол) у толуолі (2мл). Поступово дойодбензолсульфоніл хлориду, застосовуючи стандають тетрагідрофуран-3-ол (36мл, 44ммол) та дартні процедури. 1 mpem-бутил 2-({6-[(третН ЯМР (500МГц, CD3 OD): d 7,85 (dd, J=2,1, бутоксикарбоніл)аміно]піридин-3-іл}метил)-5-(39,1Гц, 1Н), 7,69-7,65 (m, 3Н), 7,51-7,50 (m, 2Н), гідроксифеніл)-3-[(4-метоксибензил)тіо]пентаноат 6,94 (dd, J=0,5, 9,1Гц, 1Н), 3,12-3,07 (m, 2H), 3,00(154мг, 0,25ммол). Реакційну суміш перемішують 2,96 (m, 1H), 2,93-2,77 (m, 3Н), 2,51(s, 3Н), 2,1612год. при 80°С. Додають толуол (100мл) і суміш 2,10 (m, 1H), 1,91-1,83 (m, 1H). МС-ВР (ЕРІ) розра+ промивають розсолом, висушують та концентруховано для C18H23N 3O4S 2 410,1208 (М+Н) , знайють. Флеш-хроматографія (толуол/ЕtOАс, від дено 410,1207. 23 78042 24 100:0 до 70:30) дає трет-бутил 2-({6-[(третбутоксикарбоніл)аміно]піридин-3-іл}метил)-3-[(4Таблиця метоксибензил)тіо]-5-[3-(тетрагідрофуран-3ілокси)феніл]пентаноат (75мг, 35%). Приклад № ІК50 (d) 2-[(6-амінопіридин-3-іл)метил]-3-меркапто6 0,8мкМ 5-[3-(тетрагідрофуран-3-ілокси))феніл]пентанова 7 0,8мкМ кислота 11 0,8мкМ 2-[(6-амінопіридин-3-іл)метил]-3-меркапто-5-[318 1,0мкМ (тетрагідрофуран-3-ілокси)феніл]пентанова кисло24 6,3мкМ та синтезована способом із прикладу 1, починаю25 4,0мкМ чи із трет-бутил 2-({6-[(трет28 0,8мкМ бутоксикарбоніл)аміно]піридин-3-іл}метил)-3-[(4метоксибензил)тіо]-5-[3-(тетрагідрофуран-3Приклад № IC50 ілокси)феніл]пентаноат. 1 31 0,6мкМ Н ЯМР (500МГц, CD3CN/D2O (1:1): d 7,72 (dd, 33 0,6мкМ 1H), 7,53 (d, 1H), 7,22 (dd, 1H), 6,90 (d, 1H), 6,83 (d, 41 0,6мкМ 1H), 6,76-6,72 (m, 2H), 4,98 (m, 1H), 3,93-3,79 (m, 42 0,6мкМ 4H), 2,99-2,84 (m, 3Н), 2,83-2,66 (m, 3Н), 2,27-2,18 (m, 1H), 2,07-1,96 (m, 2H), 1,83-1,73 (m, 1H). MC-BP 43 2,0мкМ (ЕРІ) розраховано для C21H27N2O4S 403,1692 47 1,0мкМ (М+Н)+, знайдено 403,1698. Приклад 52 Скорочення 2-[(6-амінопіридин-3-іл)метил]-3-меркапто-5-[3НОАс = оцтова кислота (тетрагідрофуран-3-ілметокси)-феніл]пентанова МеОН = метанол кислота синтезована способом із прикладу 51. хв. = хвилини 1 Н ЯМР (400МГц, CD3CN): d 7,75-7,69 (d, 1H), кт = кімнатна температура 7,58-7,56 (s, 1H), 7,25-7,18 (m, 1H), 6,88-6,75 (m, ДМФ = диметилформамід TFA = трифлуороц4H), 3,98-3,58 (m, 6H), 3,10-3,00 (m, 1H), 2,95-2,82 това кислота (m, 3Н), 2,74-2,65 (m, 2H), 2,13-2,03 (m, 1H), 1,98DMSO = диметилсульфоксид ТГФ = тетрагід1,66 (m, 4H). MC (ЕРІ) 417,9 (М+Н)+. рофуран Приклад 53 EtOAc = е тилацетат год. = година Дієвість у випробовуваннях деяких Прикладів, DBU = 1,8-діазабіцикло[5,4,0]ундец-7-ен описаних у: [Dirk Hendriks, Simon Scharpe та Marc HATU = О-(7-азабензотр1азол-1-1л)-N,N,N',N'van Sande, Clinical Chemistry, 31,1936-1939 (1985)], тетраметилуронiй гексафлуорфосфат представлена нижче в Таблиці. Комп’ютерна в ерстка О. Гапоненко Підписне Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською2,5-bisubstituted 3-mercaptopentanoic acid
Автори англійськоюPolla Magnus
Назва патенту російською2,5-двухзамещенная 3-меркаптопентановая кислота
Автори російськоюПолла Магнус
МПК / Мітки
МПК: A61P 9/10, C07D 401/06, A61P 11/00, C07D 213/76, C07D 277/42, C07D 221/22, A61P 7/02, C07D 405/12, A61K 31/44, C07D 409/06, C07D 211/34, A61P 17/00, C07D 277/20, C07D 277/40, A61K 31/426, A61P 35/00, C07D 401/12, C07D 213/73, A61P 1/16, C07D 409/12, C07D 405/06, A61P 43/00, A61P 29/00, A61K 31/506, A61K 31/435
Мітки: 3-меркаптопентанова, 2,5-двозаміщена, кислота
Код посилання
<a href="https://ua.patents.su/12-78042-25-dvozamishhena-3-merkaptopentanova-kislota.html" target="_blank" rel="follow" title="База патентів України">2,5-двозаміщена 3-меркаптопентанова кислота</a>
Попередній патент: Спосіб роботи шахтного підземного азотно-компресорного холодильного комплексу
Наступний патент: З’єднувальна тяга, що руйнується, з амортизатором і упором, що запобігає реверсивному руху
Випадковий патент: Інфрачервоний опалювальний пристрій












