Кон’югат білок-полімер та спосіб лікування за його допомогою
Формула / Реферат
1. Кон'югат білок-полімер формули І:
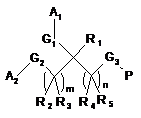 ,
,
Формула І
в якій кожний з R1, R2, R3, R4 і R5 незалежно являє собою Н, С1-5 алкіл, С2-5 алкеніл, С2-5 алкініл, арил, гетероарил, С3-8 циклоалкіл або С3-8 гетероциклоалкіл;
кожний з А1 і А2 незалежно являє собою полімерний фрагмент;
кожний з G1, G2 і G3 незалежно являє собою зв'язок або лінкерну функціональну групу;
Р являє собою білковий фрагмент, який відрізняється від природної форми тим, що включає 1-4 додаткових амінокислотних залишки на N-кінці;
m дорівнює 0 або цілому числу 1-10; і
n дорівнює цілому числу 1-10,
при цьому G3 являє собою зв'язок, приєднаний до аміногрупи N-кінця білкового фрагмента.
2. Кон'югат за п. 1, в якому кожний з А1 і А2 являє собою фрагмент mPEG з молекулярною масою 10-30 кДа.
3. Кон'югат за п. 2, в якому кожний з G1 і G2 являє собою
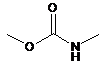 ,
,
де О зв'язаний з А1 або А2, a NH зв'язаний з атомом вуглецю, як показано у формулі І.
4. Кон'югат за п. 3, в якому Р являє собою фрагмент модифікованого інтерферону, що містить 1-4 додаткових амінокислотних залишки на N-кінці.
5. Кон'югат за п. 4, в якому n дорівнює 2.
6. Кон'югат за п. 5, що являє собою
 ,
,
де молекулярна маса mPEG становить 20 кДа, a IFN являє собою фрагмент інтерферону-α2b.
7. Кон'югат за п. 1, в якому кожний з А1 і А2 являє собою фрагмент mPEG з молекулярною масою 12-30 кДа.
8. Спосіб лікування інфекції вірусу гепатиту С або інфекції вірусу гепатиту В, що включає введення суб'єкту, який потребує цього, ефективної кількості кон'югату білок-полімер формули І:
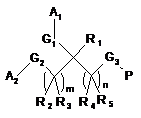 ,
,
Формула І
в якій
кожний з R1, R2, R3, R4 і R5 незалежно являє собою H, С1-5 алкіл, С2-5 алкеніл, С2-5 алкініл, арил, гетероарил, С3-8 циклоалкіл або С3-8 гетероциклоалкіл;
кожний з А1 і А2 незалежно являє собою полімерний фрагмент;
кожний з G1, G2 і G3 незалежно являє собою зв'язок або лінкерну функціональну групу;
Р являє собою білковий фрагмент, який відрізняється від природної форми тим, що включає 1-4 додаткових амінокислотних залишки на N-кінці;
m дорівнює 0 або цілому числу 1-10; і
n дорівнює цілому числу 1-10,
при цьому G3 являє собою зв'язок, приєднаний до аміногрупи N-кінця білкового фрагмента.
9. Спосіб за п. 8, в якому кожний з G1 і G2 являє собою
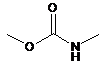 ,
,
де О зв'язаний з А1 або А2, a NH зв'язаний з атомом вуглецю, як показано у формулі І.
10. Спосіб за п. 9, в якому кон'югат являє собою
 ,
,
де молекулярна маса mPEG становить 20 кДа, a IFN являє собою фрагмент інтерферону-α2b.
Текст
Реферат: Даний винахід стосується кон'югатів білок-полімер, розкритих в описі. Крім того, описаний спосіб одержання кон'югату білок-полімер і його застосування для лікування інфекції вірусу гепатиту С або вірусу гепатиту В. UA 103158 C2 (12) UA 103158 C2 UA 103158 C2 5 10 15 20 25 30 35 40 45 Перехресне посилання на споріднену заявку У даній заявці заявлений пріоритет відповідно попередньої заявки США № 60/956273, поданої 16 серпня 2007, зміст якої включений в опис шляхом посилання у всій своїй повноті. Рівень техніки Прогрес у клітинній біології і технологіях рекомбінантних білків привів до розвитку білкової терапії. Проте, усе ще існують великі складності. Більшість білків чуттєві до протеолітичного розщеплення і, отже, мають короткий час напівжиття в циркуляційній системі. Інші недоліки включають низьку розчинність у воді і стимулювання нейтралізуючих антитіл. Зв’язування полімеру, наприклад, поліетиленгліколю (PEG), з білком утруднює доступ протеолітичних ферментів до остову білка, приводячи до підвищеної стабільності білка. Крім того, це може також підвищити розчинність у воді і звести до мінімуму імуногенність. Таким чином, існує потреба в ефективних способах зв’язування полімеру з білками. Короткий опис Один з аспектів даного винаходу стосується по суті чистого (80% чистоти) кон’югату, що містить один або більше полімерних фрагментів, білковий фрагмент і лінкер. У кон’югаті полімерний фрагмент або фрагменти зв’язані з лінкером; атом азоту N-кінця білкового фрагмента зв’язаний з лінкером; лінкер являє собою ковалентний зв’язок, С 1-10 алкілен, С2-10 алкенілен або С2-10 алкінілен; і білковий фрагмент являє собою фрагмент інтерферону-, фрагмент людського гормону росту або фрагмент еритропоетину. Переважно, чистота кон’югату становить 90% або вище. Даний кон’югат має несподівано тривалий час напівжиття in vivo. Інший аспект даного винаходу стосується кон’югатів білок-полімер формули I: Формула I в якій кожний з R1, R2, R3, R4 і R5 незалежно являє собою Н, С1-5 алкіл, С2-5 алкеніл, С2-5 алкініл, арил, гетероарил, С3-8 циклоалкіл або С3-8 гетероциклоалкіл; кожний з А1 і А2 незалежно являє собою полімерний фрагмент; кожний з G1, G2 і G3 незалежно являє собою зв’язок або лінкерну функціональну групу; Р являє собою білковий фрагмент; m дорівнює 0 або цілому числу 1-10; і n дорівнює цілому числу 1-10. Посилаючись на наведену вище формулу, кон’югат білок-полімер може мати одну або більше наступних ознак: G3 являє собою зв’язок, а Р являє собою білковий фрагмент, в якому аміногрупа на N-кінці зв’язана з G3; А1 і А2 являють собою поліалкіленоксидні групи з молекулярною масою 2-100 кДа (переважно 10-30 кДа), кожний з G1 і G2 являє собою (де О зв’язаний з А1 або А2, а NH зв’язаний з атомом вуглецю, як показано у формулі I) або кожний з G1 і G2 являє собою сечовину, сульфонамід або амід (в якому N зв’язаний з атомом вуглецю, як показано у формулі I), m дорівнює 4, n дорівнює 2, кожний з R 1, R2, R3, R4 і R5 являє собою Н; і Р являє собою фрагмент інтерферону або фрагмент модифікованого інтерферону, що містить 1-4 додаткових амінокислотних залишки. Термін «алкіл» стосується одновалентного лінійного або розгалуженого вуглеводневого радикалу. Приклади алкільних груп включають метил, етил, н-пропіл, ізопропіл, трет-бутил і нпентил. Аналогічним чином, термін «алкеніл» або «алкініл» стосується одновалентного лінійного або розгалуженого вуглеводневого радикалу, що містить один або більше С=С подвійних зв’язків, або один або більше С≡С потрійних зв’язків. Термін «алкілен» стосується двовалентного лінійного або розгалуженого вуглеводневого радикалу. Аналогічним чином, термін «алкенілен» або «алкінілен» стосується двовалентного лінійного або розгалуженого вуглеводневого радикалу, що містить один або більше С=С 1 UA 103158 C2 5 10 15 20 25 30 35 40 45 50 55 подвійних зв’язків, або один або більше С≡С потрійних зв’язків. Термін «арил» стосується вуглеводневої кільцевої системи (моноциклічної або біциклічної), що містить щонайменше одне ароматичне кільце. Приклади арильних груп включають, але не обмежуються ними, феніл, нафтил і піреніл. Термін «гетероарил» стосується вуглеводневої кільцевої системи (моноциклічної або біциклічної), що має щонайменше одне ароматичне кільце, яке містить щонайменше один гетероатом, такий як O, N або S, як частина кільцевої системи, а інші атоми є атомами вуглецю. Приклади гетероарильних груп включають, але не обмежуються ними, фурил, піроліл, тієніл, оксазоліл, імідазоліл, тіазоліл, піридиніл, піримідиніл, хіназолініл й індоліл. Термін «циклоалкіл» стосується частково або повністю насиченої моноциклічної або біциклічної кільцевої системи, що містить в кільці тільки атоми вуглецю. Приклади включають, але не обмежуються ними, циклопропаніл, циклопентаніл і циклогексаніл. Термін «гетероциклоалкіл» стосується частково або повністю насиченої моноциклічної або біциклічної кільцевої системи, що містить, крім атомів вуглецю, один або більше гетероатомів (наприклад, O, N або S) як атоми кільця. Приклади включають, але не обмежуються ними, піперидин, піперазин, морфолін, тіоморфолін і 1,4-оксазепан. Згадані в даному описі алкіл, алкеніл, алкініл, арил, гетероарил, циклоалкіл і гетероциклоалкіл включають як заміщені, так і незаміщені групи. Приклади замісників включають С1-С10 алкіл, С2-С10 алкеніл, С2-С10 алкініл, С3-С8 циклоалкіл, С5-С8 циклоалкеніл, С1С10 алкокси, арил, арилокси, гетероарил, гетероарилокси, аміно, С 1-С10 алкіламіно, С1-С20 діалкіламіно, ариламіно, діариламіно, гідроксіаміно, алкоксіаміно, С 1-С10 алкілсульфонамід, арилсульфонамід, гідрокси, галоген, тіо, С1-С10 алкілтіо, арилтіо, ціано, нітро, ацил, ацилокси, карбоксил і ефір карбонової кислоти. Термін «поліалкіленоксидна група» стосується одновалентного радикала, одержаного з лінійного, розгалуженого або зіркоподібного поліалкіленоксиду. Молекулярна маса поліалкіленоксидної групи може становити 2-100 кДа. Поліалкіленоксидна група є або насиченою, або ненасиченою. Приклади поліалкіленоксидної групи включають, але не обмежуються ними, поліетиленоксид, поліетиленгліколь, поліізопропіленоксид, полібутиленоксид і їх співполімери. Для заміни поліалкіленоксидної групи можна також використовувати інші полімери, такі як декстран, полівінілові спирти, або поліакриламіди полімери на основі вуглеводів, якщо вони не є антигенними, токсичними або такими, що викликають імунну реакцію. Поліалкіленоксидна група є або насиченою, або ненасиченою. Наприклад, вона може являти собою поліетиленгліколь з кінцевою метоксигрупою (mPEG). Термін «білкова група» стосується одновалентного радикала, одержаного або з природного білка, або з модифікованого білка. Природний білок може являти собою інтерферон-, інтерферон-, людський гормон росту, еритропоетин і гранулоцитарний колоноєстимулюючий фактор або антитіло. Модифікований білок може являти собою, наприклад, білок, що містить інтерферон- і 1-4 додаткових амінокислотних залишків на N-кінці інтерферону. Прикладом такого модифікованого інтерферону є при цьому IFN являє собою групу інтерферону2b, аміногрупа на N-кінці якого зв’язана з карбонільною групою. Термін «інтерферон-α» стосується сімейства високогомологічних видоспецифічних білків, які інгібують вірусну реплікацію і клітинну проліферацію і модулюють імунну реакцію. Див. Bonnem et al., J. Biol. Response Mod., 1984, 3(6):580-598 і Finter, J. Hepatol., 1986, 3 Suppl 2:S157-160. Багато видів білків інтерферону-α є комерційно доступними, включаючи інтерферон Intron-A, наданий Schering Corporation, Kenilworth, N. J., інтерферон Roferon, наданий Hoffmann-La Roche, Nutley, N. J., інтерферон Berofor альфа 2, наданий Boehringer Ingelheim Pharmaceutical, Inc., Ridgefield, Conn., Sumiferon, наданий Sumimoto, Japan, й інтерферон Wellferon альфа-n1 (INS), наданий Glaxo-Wellcome Ltd., London, Great Britain. Нижче перераховані амінокислотні послідовності п’яти наведених як приклад білків інтерферону- людини, або у формі попередника, або в зрілій формі: maltfallva llvlsckssc svgcdlpqth slgsrrtlml laqmrrislf scl kdrhdfg fpqeefgnqf qkaetipvlh emiqqifnlf stkdssaawd etlldkfyte lyqqlndlea cviqgvgvte tplmkedsil avrkyfqrit lylkekkysp cawevvraei mrsfslstnl qeslrske (див. Krasagakis et al, Cancer Invest. 26 (6), 562-568, 2008) cdlpqthslg srrtlmllaq mrkislfscl kdrhdfgfpq eefgnqfqka etipvlhemi qqifnlfstk dssaawdetl ldkfytelyq qlndleacvi qgvgvtetpl mkedsilavr kyfqritlyl kekkyspcaw evvraeimrs fslstnlqes lrske (Див. Klaus, et al, J. Mol. Biol. 274 (4), 661-675, 1997) 2 UA 103158 C2 5 10 15 20 25 30 35 40 45 50 55 60 mcdlpqthsl gsrrtlmlla qmrrislfsc lkdrhdfgfp qeefgnqfqk aetipvlhem iqqifnlfst kdssaawdet lldkfytely qqlndleacv iqgvgvtetp lmkedsilav rkyfqritly lkekkyspca wevvraeimr sfslstnlqe slrske (Див. GenBank Accession Number AAP20099, the 30-APR-2003 version.) mallfpllaa lvmtsyspvg slgcdlpqnh gllsrntlvl lhqmrrispf lclkdrrdfr fpqemvkgsq lqkahvmsvl hemlqqifsl fhterssaaw nmtlldqlht elhqqlqhle tcllqvvgeg esagaisspa ltlrryfqgi rvylkekkys dcawevvrme imkslflstn mqerlrskdr dlgss (Див. Capon et al, J. Mol. Cell. Biol. 5 (4):768-779, 1985) lsyksicslg cdlpqthslg nrralillaq mgrispfscl kdrhdfglpq eefdgnqfqk tqaisvlhem iqqtfnlfst edssaaweqs llekfstely qqlnnleacv iqevgmeetp lmnedsilav rkyfqritly ltekkyspca wevvraeimr slsfstnlqk rlrrkd (див. Lund et al, J. Interferon Res. 5 (2), 229-238, 1985) В одному з прикладів білок інтерферон-α, використовуваний для одержання кон’югату за даним винаходом, має амінокислотну послідовність щонайменше на 80% (наприклад, 85%, 90%, 95% або 99%) ідентичну одній з перерахованих вище амінокислотних послідовностей або її фрагменту, що відповідає зрілому інтерферону альфа. Термін «людський гормон росту» стосується природного людського гормону росту, або у формі попередника, або в зрілій формі, і його функціональних варіантів, тобто що має амінокислотну послідовність щонайменше на 80% (наприклад, 85%, 90%, 95% або 99%) ідентичну природному людському гормону росту, і що має таку ж фізіологічну активність цього людського гормону росту. Амінокислотні послідовності природного людського гормону росту (у формі попередника й у зрілій формі) наведені нижче: matgsrtsll lafgllclpw lqegsafpti plsrlfdnam lrahrlhqla fdtyqefeea yipkeqkysf lqnpqtslcf sesiptpsnr eetqqksnle llrisllliq swlepvqflr svfanslvyg asdsnvydll kdleegiqtl mgrledgspr tgqifkqtys kfdtnshndd allknyglly cfrkdmdkve tflrivqcrs vegscgf (попередник) fptiplsrlf dnamlrahrl hqlafdtyqe feeayipkeq kysflqnpqt slcfsesipt psnreetqqk snlellrisl lliqswlepv qflrsvfans lvygasdsnv ydllkdleeg iqtlmgrled gsprtgqifk qtyskfdtns hnddallkny gllycfrkdm dkvetflriv qcrsvegscg f (зріла форма) Еритропоетин (ЕРО), що виробляється або печінкою, або нирками, являє собою глікопротеїновий гормон, який регулює еритропоез або вироблення еритроцитів. Див. патент США 5621080. Амінокислотні послідовності ЕРО людини (у формі попередника й у зрілій формі) наведені нижче: mgvhecpawl wlllsllslp lglpvlgapp rlicdsrvle rylleakeae nittgcaehc slnenitvpd tkvnfyawkr mevgqqavev wqglallsea vlrgqallvn ssqpweplql hvdkavsglr slttllralg aqkeaisppd aasaaplrti tadtfrklfr vysnflrgkl klytgeacrt gdr (попередник) apprlicdsr vlerylleak eaekittgca ehcslnekit vpdtkvnfya wkrmevgqqa vevwqglall seavlrgqal lvkssqpwep lqlhvdkavs glrslttllr algaqkeais ppdaasaapl rtitadtfrk lfrvysnflr gklklytgea crtgdr (зріла форма) Еритропоетиновий білок, використовуваний для одержання кон’югату за даним винаходом, може являти собою будь-який ЕРО білок, або у формі попередника, або в зрілій формі, що виробляється прийнятними видами, наприклад, людський, мишачий, свинячий і бичачий. В одному з прикладів еритропоетиновий білок має амінокислотну послідовність щонайменше на 80% (наприклад, 85%, 90%, 95% або 99%) ідентичну одній з наведених вище амінокислотних послідовностей. «Процентну ідентичність» двох амінокислотних послідовностей визначають, використовуючи алгоритм Karlin and Altschul Proc. Natl. Acad. Sci. USA 87:2264-68, 1990, модифікований, як у публікації Karlin and Altschul Proc. Natl. Acad. Sci. USA 90:5873-77, 1993. Такий алгоритм включений у програми NBLAST і XBLAST (версія 2.0) Altschul, et al. J. Mol. Biol. 215:403-10, 1990. Дослідження білка BLAST можна здійснити з використанням програми XBLAST, шкала = 50, довжина слова = 3, для одержання амінокислотних послідовностей, гомологічних молекулам білка за даним винаходом. При наявності проміжків між двома послідовностями можна використовувати Gapped BLAST, як описано в публікації Altschul, et al., Nucleic Acids Res. 25(17):3389-3402, 1997. Застосовуючи програми BLAST і Gapped BLAST, можна використовувати значення параметрів за замовчуванням для відповідних програм (наприклад, XBLAST і NBLAST). Термін «лінкерна функціональна група» стосується двовалентної функціональної групи, один з кінців якої зв’язаний з полімерним фрагментом, а інший кінець зв’язаний з білковим фрагментом. Приклади включають, але не обмежуються ними, -O-, -S-, карбоксіефірну, карбонільну, карбонатну, амідну, карбаматну, сечовинну, сульфонільну, сульфінільну, аміно, іміно, гідроксіаміно, фосфонатну або фосфатну групу. Описаний вище кон’югат білок-полімер може знаходитися у вільній формі або у формі солі, якщо це застосовно. Наприклад, сіль може бути утворена аніоном і позитивно зарядженою 3 UA 103158 C2 5 10 групою (наприклад, аміно) у кон’югаті білок-полімер за даним винаходом. Прийнятні аніони включають хлорид, бромід, йодид, сульфат, нітрат, фосфат, цитрат, метансульфонат, трифторацетат і ацетат. Аналогічним чином, сіль може бути також утворена катіоном і негативно зарядженою групою (наприклад, карбоксилатною) у кон’югаті білок-полімер за даним винаходом. Прийнятні аніони включають іон натрію, іон калію, іон магнію, іон кальцію і катіон амонію, такий як іон тетраметиламонію. Крім того, кон’югат білок-полімер може містити один або більше подвійних зв’язків, або один або більше асиметричних центрів. Такий кон’югат може існувати у вигляді рацематів, рацемічних сумішей, індивідуальних енантіомерів, індивідуальних діастереомерів, діастереомерних сумішей і ізомерних форм з цис- або транс-, або E- або Z-подвійним зв’язком. Приклад кон’югату білок-полімер за даним винаходом наведений нижче: де молекулярна маса mPEG становить 20 кДа, а IFN являє собою фрагмент інтерферону 15 2b. Ще один з аспектів даного винаходу стосується сполук, які прийнятні для одержання кон’югатів білок-полімер. Дані сполуки мають формулу II: 20 25 30 35 40 45 Формула II в якій Х є реакційноздатною групою; кожний з А1 і А2 незалежно являє собою полімерний фрагмент; або один з А1 і А2 являє собою полімерний фрагмент, а інший є реакційноздатною групою; кожний з G1, G2 і G3 незалежно являє собою зв’язок або лінкерну функціональну групу; кожний з R1, R2, R3, R4 і R5 незалежно являє собою Н, С1-5 алкіл, С2-5 алкеніл, С2-5 алкініл, арил, гетероарил, С3-8 циклоалкіл, С3-8 гетероциклоалкіл або -G4-X', при цьому G4 являє собою зв’язок або лінкерну функціональну групу, а X' є реакційноздатною групою; кожен m і n незалежно дорівнює 0 або цілому числу 1-10; за умови, що якщо -G3-X являє собою -СО(О)-N-сукцинімідил, то n дорівнює цілому числу 1-10. В одному з варіантів здійснення X, X', А1, А2, G1, G2, G3, G4, R1, R2, R3, R4, R5 і m визначені вище, а n дорівнює цілому числу 1-10. Деякі сполуки формули II мають одну або більше наступних ознак: полімерний фрагмент може містити одну або більше реакційноздатних груп; G 3 являє собою зв’язок, а Р являє собою білковий фрагмент, в якому аміногрупа на N-кінці зв’язана з G3; А1 і А2 являють собою поліалкіленоксидні групи з молекулярною масою 2-100 кДа (переважно 12-30 кДа), кожний з G1 і G2 являє собою де О зв’язаний з А1 або А2, а NH зв’язаний з атомом вуглецю, як показано у формулі I; m дорівнює 4; n дорівнює 1; кожний з R 1, R2, R3, R4 і R5 являє собою Н; і Х являє собою СН(=О) або Х являє собою відхідну групу, (наприклад, сукцинімідил або пнітрофенокси). Термін «реакційноздатна група» стосується функціональної групи, що може взаємодіяти з іншою функціональною групою таким чином, що вона або замінюється іншою функціональною групою, або зв’язується з іншою функціональною групою. Реакційноздатна група може бути відхідною групою, нуклеофільною групою, або альдегідом рецептором Міхаеля. Термін «відхідна група» стосується функціональної групи, яка здатна відщеплюватися при безпосередньому заміщенні або іонізації з парою електронів від одного із своїх ковалентних 4 UA 103158 C2 rd 5 10 зв’язків (див., наприклад, F. A. Carey and R. J. Sunberg, Advanced Organic Chemistry, 3 Ed. Plenum Press, 1990). Приклади відхідної групи, включають, але не обмежуються ними, метансульфонат, трифлат, п-толуолсульфонат, йодид, бромід, хлорид, трифторацетат, сукцинімідил («Su»), п-нітрофенокси і піридин-2-ілокси. Термін «нуклеофільна група» стосується багатої електронами функціональної групи, яка взаємодіє з групою, що приймає електрони, такою як електрофіл, за рахунок передачі електронної пари. Термін «електрофільна група» стосується збідненої електронами функціональної групи, яка взаємодіє з групою, що є донором електронів, такою як нуклеофіл, за рахунок акцептування електронної пари. Рецептори Міхаеля являють собою підклас електрофільних груп. При контакті з нуклеофілом вони піддаються реакції Міхаеля. Типовий рецептор Міхаеля містить α,βненасичену кетонну групу. Приклади сполук формули II наведені нижче: 15 20 25 30 35 У ще одному аспекті даний винахід стосується способу одержання кон’югатів білок-полімер формули I, де аміногрупа на N-кінці білкового фрагмента Р зв’язана з лінкерною функціональною групою G3. Цей спосіб включає конденсацію вільного N-кінця білка Н-Р з розгалуженою молекулою диполімеру, що має формулу, яка аналогічна наведеній вище формулі II, за винятком того, що Х є відхідною групою. Вільний N-кінець білка Н-Р стосується білка, в якому атом азоту термінальної аміногрупи білкового фрагмента Р зв’язаний з атомом водню Н. Іншими словами, Н-Р містить термінальну первинну або вторинну аміногрупу. Альтернативно, даний спосіб включає (1) конденсацію тільки що згаданого вільного N-кінця білка Н-Р з розгалуженою молекулою диполімеру, що має формулу, яка аналогічна наведеній вище формулі II, за винятком того, що G3 являє собою зв’язок, n дорівнює 0 або цілому числу 19, а Х являє собою СНО; і (2) відновлення продукту конденсації з утворенням кон’югату білокполімер. Інтерферон являє собою імуномодулювальний засіб для лікування інфекції вірусу гепатиту В (HBV) або інфекції вірусу гепатиту С (HCV). Крім того, інтерферон (наприклад, інтерферон-α) можна використовувати для лікування неходжкинської лімфоми, волосяно-клітинного лейкозу, хронічної мієлогенної лейкемії, СНІД-асоційованої саркоми Капоши, фолікулярної лімфоми, злоякісної меланоми і гострої кондиломи. Таким чином, наступний аспект даного винаходу стосується способу лікування кожного зі згаданих вище порушень за допомогою описаного в даному документі кон’югату інтерферон-полімер. Крім того, в обсяг даного винаходу входить композиція, що містить кон’югат інтерферон 5 UA 103158 C2 5 10 15 20 25 30 35 полімер для застосування при кожному зі згаданих вище порушень, а також дане терапевтичне застосування і використання даного кон’югату для одержання лікарського засобу для лікування одного з цих порушень. Подробиці одного або більше варіантів здійснення винаходи представлені в наведеному нижче описі. Інші ознаки, об’єкти і переваги винаходу будуть ясні з опису і формули винаходу. Докладний опис Кон’югати білок-полімер за даним винаходом можна одержати методами синтезу, добре відомими в галузі хімії. Наприклад, лінкерну молекулу можна зв’язати, одночасно або послідовно, з двома полімерними молекулами, а потім зв’язати молекулу білка з лінкерною молекулою з утворенням кон’югату білок-полімер за даним винаходом. В обсяг даного винаходу входять також сполуки формули (II). Дані сполуки застосовні для одержання тільки що описаних кон’югатів білок-полімер. Їх можна одержати методами синтезу, добре відомими в галузі хімії. Ілюстративна схема синтезу і реальний приклад наведені нижче. На схемі 1 показаний приклад одержання кон’югатів білок-полімер за даним винаходом. Сполуку діаміну 1, яка містить ацетальну групу, піддають взаємодії з Nгідроксисукцинімідилкарбонатом mPEG (тобто сполукою 2), одержуючи ди-пегильовану сполуку 3, яку потім перетворять в альдегід 4. Дану альдегідну сполуку піддають взаємодії з білком, що містить вільну аміногрупу, шляхом відбудовного алкілування, одержуючи кон’югат білок-полімер за даним винаходом. Схема 1 Синтезований таким чином кон’югат білок-полімер можна додатково очистити таким способом, як іонообмінна хроматографія, гель-фільтраційна хроматографія, електрофорез, діаліз, ультрафільтрація або ультрацентрифугування. Описані вище хімічні реакції включають використання розчинників, реагентів, каталізаторів, реагентів для введення захисної групи і зняття захисної групи і певні умови реакцій. Вони можуть додатково включати стадії, або до або після конкретно описаних тут стадій, для введення або видалення прийнятних захисних груп, щоб, у кінцевому рахунку, забезпечити можливість синтезу кон’югату білок-полімер. Крім того, для одержання бажаних кон’югатів білокполімер різні стадії синтезу можна здійснити в іншій послідовності або іншому порядку. Синтетичні хімічні перетворення і методики для захисних груп (введення і зняття захисту), прийнятні для синтезу застосовних кон’югатів білок-полімер, відомі в даній галузі і включають, наприклад, перетворення і методики, описані в публікаціях R. Larock, Comprehensive Organic Transformations, VCH Publishers (1989); T. W. Greene and P. G. M. Wuts, Protective Groups in Organic Synthesis, 2d. Ed., John Wiley and Sons (1991); L. Fieser and M. Fieser, Fieser and Fieser’s Reagents for Organic Synthesis, John Wiley and Sons (1994); and L. Paquette, ed., Encyclopedia of 6 UA 103158 C2 5 10 15 20 25 30 35 40 45 50 55 60 Reagents for Organic Synthesis, John Wiley and Sons (1995) і їх наступні видання. Кон’югат за винаходом має дуже високу чистоту. А саме, у 80% або більше молекул кон’югату полімерний фрагмент зв’язаний з тим самим атомом азоту на N-кінці того самого білкового фрагмента. Іншими словами щонайменше у 80% молекул кон’югату білковий фрагмент ідентичний у всіх аспектах, включаючи його послідовність і його положення зв’язування з полімерним фрагментом. Кон’югат за винаходом може бути фармацевтично активним у формі кон’югату. Альтернативно, він може вивільняти фармацевтично активний білок in vivo (наприклад, при гідролізі) за рахунок ферментативного розщеплення зв’язку між білковим фрагментом і полімерним фрагментом. Приклади ферментів, що беруть участь у розщепленні зв’язків in vivo, включають окисні ферменти (наприклад, пероксидази, аміноксидази, або дегідрогенази), відбудовні ферменти (наприклад, кеторедуктази) і гідролітичні ферменти (наприклад, протеази, естерази, сульфатази або фосфатази). Таким чином, один з аспектів даного винаходу стосується способу введення ефективної кількості одного або більше описаних вище кон’югатів білок-полімер для лікування захворювання (наприклад, інфекцій HBV або HCV). Конкретно, захворювання можна лікувати введенням суб’єкту одного або більше кон’югатів білок-полімер в ефективній кількості. Такий суб’єкт може бути виявлений фахівцем в галузі охорони здоров’я на підставі результатів будьякого прийнятного діагностичного методу. Як використовується в даному описі, термін «лікувати» або «лікування» визначають як застосування або введення композиції, що містить кон’югат білок-полімер, суб’єкту (людині або тварині), що має порушення, симптом захворювання, захворювання або порушення, вторинне стосовно захворювання, або схильність до захворювання з метою лікування, полегшення, ослаблення або усунення порушення, симптому захворювання, захворювання або порушення, вторинного стосовно захворювання, або схильність до захворювання. «Ефективна кількість» стосується кількості кон’югату білок-полімер, яка чинить терапевтичний ефект на суб’єкта, що підлягає лікуванню. Терапевтичний ефект може бути об’єктивним (тобто, що визначається за допомогою деяких тестів або маркерів) або суб’єктивним (тобто суб’єкт виявляє ознаку або відчуває ефект). В обсяг даного винаходу також входить фармацевтична композиція, що містить ефективну кількість щонайменше одного з описаних вище кон’югатів білок-полімер і фармацевтично прийнятний носій. Крім того, даний винахід включає спосіб введення ефективної кількості одного або більше кон’югатів білок-полімер пацієнту з одним або більше захворюваннями. Ефективні дози будуть змінюватися, як визнають фахівці в даній галузі, наприклад, в залежності від швидкості гідролізу кон’югату білок-полімер, типів захворювань, що підлягають лікуванню, шляху введення, використання ексципієнту і можливості спільного використання з іншим терапевтичним лікуванням. Для здійснення на практиці способу за даним винаходом композицію, що містить одну або більше зі згаданих вище сполук, можна вводити парентерально, перорально, назально, ректально, місцево або букально. Використовуваний в описі термін «парентерально» стосується підшкірної, внутрішньошкірної, внутрішньовенної, внутрішньом’язової, внутрішньосуглобної, внутрішньоартеріальної, інтрасиновіальної, внутрішньогрудинної, інтратекальної, внутрішньорубцевої, внутрішньочеревинної, інтратрахеальної або внутрішньочерепної ін’єкції, а також будь-якого прийнятного інфузійного способу. Стерильна композиція для ін’єкцій може являти собою розчин або суспензію в нетоксичному, парентерально застосовному розріджувачі або розчиннику, наприклад, розчин в 1,3-бутанолі. У число прийнятних носіїв і розчинників, які можна використовувати, входять маніт, вода, розчин Рингера й ізотонічний розчин хлориду натрію. Крім того, як розчинник або суспендуюче середовище зручно використовувати жирні олії (наприклад, синтетичні моно- або дигліцериди). Для одержання ін’єкційних препаратів прийнятна жирна кислота, така як олеїнова кислота і її гліцеридні похідні, як природні фармацевтично прийнятні олії, такі як оливкова олія або касторова олія, особливо в їх поліоксіетильованих варіантах. Дані розчини або суспензії в олії можуть також містити розріджувач або диспергатор на основі довголанцюгового спирту або карбоксиметилцелюлозу, або аналогічну диспергуючу речовину. Для мети препарату можна використовувати інші звичайно використовувані поверхнево-активні речовини, такі як Tween або Span, або інші аналогічні емульгатори, або підсилювачі біодоступності, які звичайно використовують при виробництві фармацевтично прийнятних твердих, рідких або інших лікарських форм. Композиція для перорального введення може являти собою будь-яку перорально прийнятну лікарську форму, включаючи капсули, таблетки, емульсії і водяні суспензії, дисперсії і розчини. 7 UA 103158 C2 5 10 15 20 25 30 У випадку таблеток звичайно використовувані носії включають лактозу і кукурудзяний крохмаль. Також звичайно додають мастильну речовину, таку як стеарат магнію. Для перорального введення у формі капсули прийнятні розріджувачі включають лактозу і сухий кукурудзяний крохмаль. Якщо водяні суспензії або емульсії вводять перорально, то активний інгредієнт може бути суспендований або розчинений у масляній фазі в поєднанні з емульгуючими або суспендуючими агентами. За бажанням можна додати підсолоджувальні, смакові або забарвлювальні агенти. Назальна аерозольна або інгаляційна композиція може бути одержана відповідно до методики, яка добре відома в галузі фармацевтичних складів. Наприклад, таку композицію можна приготувати у вигляді розчину в сольовому розчині, використовуючи бензиловий спирт або інші прийнятні консерванти, підсилювачі абсорбції для підвищення біодоступності, фторвуглеці і/або інші солюбілізуючі або диспергуючі агенти, відомі в даній галузі. Композицію, що містить одну або більше з описаних вище сполук, можна також вводити у вигляді супозиторіїв для ректального введення. За стандартною методикою фармацевтично прийнятний носій використовують з однією або більше активними сполуками, згаданими вище. Носій у фармацевтичній композиції повинен бути «прийнятним» в сенсі його сумісності з активним інгредієнтом композиції (і, переважно, здатності стабілізувати активний інгредієнт) і не бути небезпечним для суб’єкта, що підлягає лікуванню. Як фармацевтичні ексципієнти для доставляння згаданої вище сполуки можна використовувати один або більше солюбілізуючих агентів. Приклади інших носіїв включають колоїдний оксид кремнію, стеарат магнію, целюлозу, лаурилсульфат натрію і D&C Yellow # 10. Для попередньої оцінки ефективності описаних вище кон’югатів для інгібування вірусу гепатиту В або вірусу гепатиту С можна використовувати прийнятні аналізи in vitro. Кон’югати можна додатково досліджувати на предмет їх ефективності для лікування інфекції вірусу гепатиту В або вірусу гепатиту С за допомогою аналізів in vivo. Наприклад, їх можна вводити тварині (наприклад, на мишачій моделі) або людині з інфекцією вірусу гепатиту В або вірусу гепатиту С, а потім оцінити їх терапевтичні ефекти. Виходячи з цих результатів, можна також визначити діапазони доз і шляхи введення. Наведений нижче приклад варто витлумачувати лише як ілюстративний, а не обмежуючий яким би то ні було чином частину опису, що залишилася. Без додаткової доробки передбачається, що на підставі наведеного опису фахівець у даній галузі використовує даний винахід в його найбільш повній мірі. Усі цитовані в даному описі публікації включені шляхом посилання у всій своїй повноті. Одержання ди-PEG альдегіду 35 40 45 PEGO(C=O)OSu 20 кДа одержували з mPEGOH 20 кДа, придбаного в (SunBio Inc., CA, США), за методикою, описаною в Bioconjugate Chem. 1993, 4, 568-569. Розчин 6-(1,3-діоксолан-2-іл)гексан-1,5-діаміну в дихлорметані (11,97 г розчину, що містить 9,03 мг діаміну, 47,8 мкмоль) додавали в колбу, що містить PEGO(C=O)OSu 20 кДа (1,72 г, 86,0 мкмоль). Після повного розчинення PEGO(C=O)OSu додавали N,N-діізопропілетиламін (79 мкл, 478 мкмоль). Реакційну суміш перемішували при кімнатній температурі протягом 24 год, а потім додавали по краплях при перемішуванні метил-трет-бутиловий ефір (200 мл). Одержаний осад збирали і сушили у вакуумі, одержуючи ди-PEG ацеталь (1,69 г, 98%) у вигляді твердої речовини білого кольору. 1 H ЯМР (400 МГц, d6-ДМСО) 7,16 (т, J=5,2 Гц, 1H), 7,06 (д, J=8,8 Гц, 1H), 4,76 (т, J=4,8 Гц, 1H), 4,10-3,95 (м, 4H), 1,80-1,65 (м, 1H), 1,65-1,50 (м, 1H), 1,48-1,10 (м, 6H). 50 Ди-PEG ацеталь (4,0 г, 0,2 ммоль) суспендували в буфері з рН 2,0 (лимонна кислота, 40 мл). 8 UA 103158 C2 5 Реакційну суміш перемішували при 35°C протягом 24 год, а потім екстрагували дихлорметаном (3×50 мл). Об’єднані органічні шари сушили над сульфатом магнію, концентрували, а потім повторно розчиняли в дихлорметані (20 мл). Даний розчин додавали по краплях при перемішуванні до метил-трет-бутилового ефіру (400 мл). Одержаний осад збирали і сушили при зниженому тиску, одержуючи ди-PEG альдегід (3,8 г, 95%) у вигляді твердої речовини білого кольору. 1 H ЯМР (400 МГц, d6-ДМСО) 9,60 (с, 1H), 7,24 (д, J=8,4 Гц, 1H), 7,16 (т, J=5,2 Гц, 1H), 4,103,95 (м, 4H), 3,95-3,80 (м, 1H), 3,00-2,85 (м, 2H), 2,58-2,36 (м, 2H), 1,46-1,15 (м, 6H). Одержання модифікованого інтерферону 10 15 20 25 30 35 40 45 50 55 Модифікований рекомбінантний людський інтерферон-2b клонували методом ПЦР із використанням геномної ДНК людини як матрицю. Олігонуклеотиди синтезували, виходячи з фланкуючих послідовностей людського інтерферону-2b (№ доступу в GenBank J00207, 8 січня 2008 року). Одержані продукти ПЦР субклонували у вектор pGEM-T (Promega). Варіант IFN знову ампліфікували ПЦР за допомогою клонів pGEM-T, а потім субклонували у вектор експресії білка рЕТ-24а (Novagen), вектор, керований промотором T7 РНК полімерази, з використанням NdeІ/BamHI як сайтів клонування. Потім вектор рЕТ-24а трансформували в штам E. coli BL21CodonPlus (DE 3)-RIL (Stratagene). Клони з високою експресією відбирали, підтримуючи трансформований E. coli BL21-CodonPlus (DE 3)-RIL в присутності караміцину (50 мкг/мл) і хлорамфенікалу (50 мкг/мл). Для розмноження E. coli BL21-CodonPlus (DE 3)-RIL з Pro-IFN геном використовували бульйонне середовище Terrific (BD, 200 мл) у колбі на 1000 мл. Колбу струшували при 37C і при 230 об/хв протягом 16 год. Ферментацію в періодичному режимі й у періодичному режимі з підживленням проводили в 5-літровому вібраційному ферментері (Bioflo 3000; New Brunswick Scientific Co., Edison, NJ). При ферментації в періодичному режимі використовували 150 мл прекультури для посіву, що стояла протягом ночі, і 3 л бульйонного середовища Terrific з караміцином (50 мкг/мл), хлорамфенікалом (50 мкг/мл), 0,4% гліцерину і 0,5% (об./об.) слідових елементів (10 г/л FeSO4·7H2O, 2,25 г/л ZnSO4·7H2O, 1 г/л CuSO4·5H2O, 0,5 г/л MnSO4·H2O, 0,3 г/л H3BO3, 2 г/л CaCl2·2H2O, 0,1 г/л (NH4)6Mo7O24, 0,84 г/л EDTA, 50 мл HCl). Концентрацію розчиненого кисню регулювали на рівні 35%, а рН підтримували при 7,2 доданням 5 н. водяного розчину NaOH. Готували поживний розчин, що містить 600 г/л глюкози і 20 г/л MgSO 4·7H2O. Якщо значення рН перевищувало контрольну величину, то додавали відповідну кількість поживного розчину для збільшення концентрації глюкози в культуральному бульйоні. Експресію гена Prо-IFN індукували, додаючи IPTG до кінцевої концентрації 1 мМ, і збирали клітини з культурального бульйону після інкубування протягом 3 год. Зібрані клітинні гранули повторно суспендували в TEN буфері (50 мМ Tris-HCl (рН 8,0), 1 мМ EDTA, 100 мМ NaCl) у відповідному співвідношенні 1:10 (маса у вологому стані г/мл) і дробили за допомогою мікрофлюїдизатора, а потім центрифугували при 10000 об/хв протягом 20 хв. Гранули, що містять тільце включення (IB), двічі промивали TEN буфером і центрифугували, як описано вище. Потім гранули, що містять IB, суспендували в 150 мл 4 М водяного розчину гуанідинію×HCl (GuHCl) і центрифугували при 20000 об/хв протягом 15 хв. Після цього IB солюбілізували в 50 мл 6 М розчину GuHCl. Солюбілізований у GuHCl продукт центрифугували при 20000 об/хв протягом 20 хв. Рефолдинг ініціювали розчиненням денатурованого IB у 1,5 л свіжоприготовленого рефолдингового буфера (100 мМ Tris-HCl (рН 8,0), 0,5 М L-аргініну, 2 мМ EDTA), який перемішували тільки під час додання. Рефолдингову реакційну суміш залишали для інкубування протягом 48 годин без перемішування. Рекомбінантний людський інтерферон2b (тобто Pro-IFN), який піддали рефолдингу діалізували проти 20 мМ Tris буфера (з 2 мМ EDTA і 0,1 М сечовини, рН 7,0) для додаткового очищення методом колонкової хроматографії на Q-Sepharose. Рекомбінантний людський білок Pro-IFN, який піддали рефолдингу завантажували в колонку з Q-Sepharose (GE Amersham Pharmacia, Pittsburg, PA). Колонку попередньо врівноважували і промивали 20 мм Tris-HCl буфером (рН 7,0). Продукт елюювали сумішшю 20 мМ Tris-HCl буфера (рН 7,0) і 200 мМ NaCl. Фракції, що містять Pro-IFN, збирали, виходячи з їх поглинання при 280 нм. Концентрацію Pro-IFN визначали за допомогою набору для аналізу білків з 9 UA 103158 C2 використанням методу Бредфорда (Pierce, Rockford, IL). Одержання кон’югату білок-полімер 5 10 15 20 До розчину одержаного вище ди-PEG альдегіду (1,2 г, 0,03 ммоль) у воді (72 мл) додавали буфер 2 М фосфату натрію (рН 4,0, 5 мл) і Pro-IFN (200 мг у 22,2 мл буфера з рН 7,0, що містить 20 мМ Tris-HCl і 0,2 М NaCl, 0,01 ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 10 хв, потім додавали водяний розчин ціаноборгідриду натрію (400 мм, 1,25 мл, 0,5 ммоль). Реакційну суміш перемішували в темряві протягом 16 год і очищали методом хроматографії SP XL на Sepharose. Фракції, що містять необхідний кон’югат полімербілок, збирали, виходячи з їх часу втримання і поглинання при 280 нм. Концентрацію кон’югату визначали за допомогою набору для аналізу білків з використанням методу Бредфорда (Pierce, Rockford, IL). Вихід виділеного кон’югату становив приблизно 40% або більше. Інші варіанти здійснення Всі ознаки, наведені в даному описі, можуть бути об’єднані в будь-якій комбінації. Кожна ознака, наведена в даному описі, може бути замінена на альтернативну ознаку, що служить тій же, еквівалентній або подібній меті. Таким чином, якщо спеціально не зазначене інше, кожна описана ознака є лише прикладом загального ряду еквівалентних або подібних ознак. З наведеного вище опису фахівець у даній галузі легко зможе установити основні характеристики даного винаходу і, не виходячи за межі його сутності й обсягу, зможе зробити різні зміни і модифікації даного винаходу, щоб пристосувати його до різних галузей застосування й умов. Таким чином, інші варіанти здійснення також входять в обсяг наступної формули винаходу. 25 ФОРМУЛА ВИНАХОДУ 1. Кон'югат білок-полімер формули І: A1 G1 R1 G3 G2 A2 m n P R2 R3 R4 R5 30 35 40 , Формула І в якій кожний з R1, R2, R3, R4 і R5 незалежно являє собою Н, С1-5 алкіл, С2-5 алкеніл, С2-5 алкініл, арил, гетероарил, С3-8 циклоалкіл або С3-8 гетероциклоалкіл; кожний з А1 і А2 незалежно являє собою полімерний фрагмент; кожний з G1, G2 і G3 незалежно являє собою зв'язок або лінкерну функціональну групу; Р являє собою білковий фрагмент, який відрізняється від природної форми тим, що включає 1-4 додаткових амінокислотних залишки на N-кінці; m дорівнює 0 або цілому числу 1-10; і n дорівнює цілому числу 1-10, при цьому G3 являє собою зв'язок, приєднаний до аміногрупи N-кінця білкового фрагмента. 2. Кон'югат за п. 1, в якому кожний з А1 і А2 являє собою фрагмент mPEG з молекулярною масою 10-30 кДа. 3. Кон'югат за п. 2, в якому кожний з G1 і G2 являє собою O O 45 N H , де О зв'язаний з А1 або А2, a NH зв'язаний з атомом вуглецю, як показано у формулі І. 4. Кон'югат за п. 3, в якому Р являє собою фрагмент модифікованого інтерферону, що містить 14 додаткових амінокислотних залишки на N-кінці. 10 UA 103158 C2 5. Кон'югат за п. 4, в якому n дорівнює 2. 6. Кон'югат за п. 5, що являє собою O IFN O O mPEGO mPEGO 5 NH N H N , де молекулярна маса mPEG становить 20 кДа, a IFN являє собою фрагмент інтерферону-α2b. 7. Кон'югат за п. 1, в якому кожний з А1 і А2 являє собою фрагмент mPEG з молекулярною масою 12-30 кДа. 8. Спосіб лікування інфекції вірусу гепатиту С або інфекції вірусу гепатиту В, що включає введення суб'єкту, який потребує цього, ефективної кількості кон'югату білок-полімер формули І: A1 G1 R1 G3 G2 A2 n m P R2 R3 R4 R5 10 15 20 , Формула І в якій кожний з R1, R2, R3, R4 і R5 незалежно являє собою H, С1-5 алкіл, С2-5 алкеніл, С2-5 алкініл, арил, гетероарил, С3-8 циклоалкіл або С3-8 гетероциклоалкіл; кожний з А1 і А2 незалежно являє собою полімерний фрагмент; кожний з G1, G2 і G3 незалежно являєсобою зв'язок або лінкерну функціональну групу; Р являє собою білковий фрагмент, який відрізняється від природної форми тим, що включає 1-4 додаткових амінокислотних залишки на N-кінці; m дорівнює 0 або цілому числу 1-10; і n дорівнює цілому числу 1-10, при цьому G3 являє собою зв'язок, приєднаний до аміногрупи N-кінця білкового фрагмента. 9. Спосіб за п. 8, в якому кожний з G1 і G2 являє собою O O N H , де О зв'язаний з А1 або А2, a NH зв'язаний з атомом вуглецю, як показано у формулі І. 10. Спосіб за п. 9, в якому кон'югат являє собою O IFN O O mPEGO 25 mPEGO N H NH N , де молекулярна маса mPEG становить 20 кДа, a IFN являє собою фрагмент інтерферону-α2b. Комп’ютерна верстка В. Мацело Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 11
ДивитисяДодаткова інформація
Назва патенту англійськоюProtein-polymer conjugates
Автори російськоюLin, Ko-Chung
МПК / Мітки
МПК: A61K 47/48, A61P 31/12
Мітки: білок-полімер, допомогою, кон'югат, лікування, спосіб
Код посилання
<a href="https://ua.patents.su/13-103158-konyugat-bilok-polimer-ta-sposib-likuvannya-za-jjogo-dopomogoyu.html" target="_blank" rel="follow" title="База патентів України">Кон’югат білок-полімер та спосіб лікування за його допомогою</a>
Попередній патент: Пентаспецифічне антитіло
Наступний патент: Спосіб здійснення персонального сеансу зв’язку між користувачами мережі телекомунікацій
Випадковий патент: Спосіб очищення благородних металів і їх сплавів












