Композиція для ін’єкцій
Формула / Реферат
1. Композиція, яка придатна для формування in situ внутрішньом'язового імплантата з вмістом біорозкладаного термопластичного полімеру молочної кислоти (PLA), диметилсульфоксиду (DМSО) і інгібітора ароматази, який являє собою летрозол або анастрозол, окремо або у поєднанні, причому композиція твердне і утворює твердий або гелевий імплантат in situ при контакті з водною рідиною або з рідиною організму, яка відрізняється тим, що інгібітор ароматази знаходиться в суспензії у розчині, який містить DМSО і PLA, і вміст інгібітора ароматази складає від 15 до 50 % від загальної маси композиції.
2. Композиція за п. 1, в якій інгібітор ароматази знаходиться в суспензії у розчині, що містить DМSО і PLA, і вміст інгібітора ароматази складає від 20 до 30 % від загальної маси композиції.
3. Композиція за п. 1 або п. 2, в якій інгібітор ароматази знаходиться в суспензії у розчині, що містить DМSО і PLA, і вміст інгібітора ароматази складає 25 % від загальної маси композиції.
4. Композиція за п. 1, в якій інгібітор ароматази має наступний розподіл частинок за розмірами:
• <10 % частинок менше 20 мкм,
• <10 % частинок більше 350 мкм,
• d 0,5 в діапазоні 70-200 мкм.
5. Композиція за п. 1, в якій розчин містить DМSО і PLA, причому вміст PLA складає 40-43 % маси (100 % молочної), а DМSО - 57-60 % маси.
6. Композиція за п. 1, в якій кінцева група PLA є ефіром.
7. Композиція за пп. 1-6, в якій склад піддається опроміненню максимальною дозою 35 кГр.
8. Композиція за п. 1, в якій співвідношення DМSО та інгібітора ароматази знаходиться в діапазоні від 0,5 до 3,7.
9. Композиція за п. 1, в якій співвідношення DМSО та інгібітора ароматази знаходиться в діапазоні від 1,7 до 1,8.
10. Композиція за п. 1, в якій в'язкість розчину, що містить DМSО та PLA, знаходиться в діапазоні від 0,8 до 1,8 Па·с.
11. Композиція за п. 1, в якій максимальний об'єм композиції складає 2 мл, і композиція містить 500 мг летрозолу для внутрішньом'язової ін'єкції.
12. Композиція за п. 1, в якій площа AUC викиду ароматази за перші 30 днів після введення ін’єкції повинна складати менше 10 % від загальної площі AUC і не більше 50 % загальної площі AUC.
13. Застосування композиції, описаної в пп. 1-12, як засобу для лікування раку молочної залози.
14. Набір, придатний для приготування in situ композиції, описаної в пп. 1-12, який містить інгібітор ароматази, полімер і DМSО в двох окремих контейнерах, вміст яких об’єднують для отримання in situ композиції імплантата.
15. Набір за п. 14, в якому інгібітор ароматази і полімер знаходяться в одному контейнері в твердій формі, а DМSО знаходиться в другому окремому контейнері.
16. Набір за п. 15, де полімер є ліофілізованим.
17. Набір за п. 14, в якому інгібітор ароматази в твердій формі знаходитьсяв одному контейнері, а DМSО та полімер знаходяться в другому окремому контейнері у вигляді розчину.
18. Набір за п. 14, в якому інгібітор ароматази, полімер та DМSО знаходяться в одному й тому ж контейнері у формі суспензії.
Текст
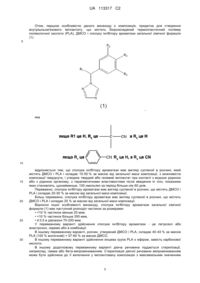
Реферат: Даний винахід стосується лікарського складу, придатного для формування внутрішньом'язового імплантата, що містить біорозкладаний термопластичний полімер полімолочної кислоти (PLA), диметилсульфоксид (DМSО) та сполуку інгібітора ароматази, що є відповідним набором для приготування лікарського складу in situ і його використання як лікарського засобу при лікуванні раку молочної залози. UA 113317 C2 (12) UA 113317 C2 UA 113317 C2 5 10 15 20 25 30 35 40 45 50 55 60 ГАЛУЗЬ ТЕХНІКИ ТА МЕТА ВИНАХОДУ Дана заявка на видачу патенту стосується лікарських композицій, корисних при лікуванні раку. Зокрема, даний винахід стосується лікарської композиції, придатної для формування внутрішньом'язового імплантату, що містить біорозкладаний термопластичний полімер полімолочної кислоти (PLA), диметилсульфоксид (ДМСО) та сполуку інгібітору ароматази, що є відповідним набором для приготування лікарського складу in situ і його використання як лікарського засобу при лікуванні раку молочної залози. ВИХІДНІ ДАНІ Безсумнівно, існує необхідність у розробці методів лікування раку і не лише нових молекулярних субстанцій, але й фармакологічних препаратів для покращення якості життя пацієнтів. З цього погляду розробка технології виробництва лікарського препарату пролонгованого вивільнення є далекоглядним рішенням, оскільки вона дає можливість знизити загальну кількість доз, збільшити тривалість дії кожної дози та кількість прийому і тим самим створити позитивний вплив на емоційний стан пацієнта. Враховуючи це, для даного винаходу були вибрані активні речовини летрозолу і анастрозолу як можливі фармацевтичні препарати для цього типу технології виробництва лікарських препаратів пролонгованого вивільнення, оскільки вони є діючими речовинами першої лінії в ад'ювантній терапії жінок в постменопаузі з позитивним рецептором гормону поширеного раку молочної залози, для яких не існує альтернативної терапії, окрім щоденного прийому таблеток. Летрозол (4,4'-(1,2,4-триазол-1-ілметил)дибензонітрил) і анастрозол (2,2'-[5-(1H-1,2,4триазол-1-ілметил)-1,3-фенілен]біс(2-метилпропаннітрил)) належать до класу лікарських препаратів, які називають нестероїдними інгібіторами ароматази, а механізм їхньої дії полягає в скороченні кількості естрогену в організмі. Такий механізм дії може уповільнити або зупинити ріст багатьох видів ракових клітин у молочній залозі, що потребують естроген для росту. На сьогоднішній день на ринку не існує технології виробництва летрозолу, щоб забезпечила можливість контролювання вивільнення лікарського засобу протягом тривалого періоду часу. Фармацевтичний препарат летрозол на даний час є доступним лише у вигляді таблеток для щоденного перорального застосування. Склад летрозолу, описаний в даному документі, дозволяє отримати терапевтичні рівні концентрації препарату в крові від самого початку і постійно протягом трьох місяців, усуваючи необхідність у режимах щоденного прийому препарату, тим самим покращуючи якість життя пацієнта. При лікуванні раку молочної залози, так само як і при лікуванні раку в цілому, психологічний стан пацієнта відіграє важливу роль; тому розробка складу летрозолу і/або анастрозолу з механізмом 3-місячного терміну дії означає значне покращення якості їхнього життя, зниження впливу від щоденної терапії. У свою чергу, медичні огляди, що проводяться під час моніторингу захворювання, зазвичай проводять кожні 3 і 6 місяців протягом перших кількох років терапії, отже прийом препарату може збігатися з відвідуванням лікаря для консультацій. Аналогічні міркування призвели до появи на ринку таких лікарських композицій, як Золадекс®, готового імплантату гозереліну для підшкірного 3-місячного застосування при лікуванні раку передміхурової залози, і Імпланон®, готового імплантату етоногестрелу, що використовується як контрацептив. Проте, ці готові імплантати характеризуються рядом недоліків, в тому числі: - отримання готових імплантатів методом екструзії вимагає використання високих температур, що може призвести до деградації діючої речовини і генерації потенційно токсичних домішок; - низький рівень однорідності отриманого імплантату, якщо застосовувати діючу речовину в низьких дозах; - потреба в хірургічних процедурах імплантації або ін'єкції імплантату за допомогою голки великого діаметру. Крім того, в літературі можна знайти деякі публікації стосовно імплантованих композицій летрозолу і/або анастрозолу. Наприклад, в WO 2008/041245 описуються імплантовані композиції, що містять широкий спектр діючих речовин, таких як деякі інгібітори ароматази, в тому числі анастрозол, в найрізноманітніших лікарських формах - від форм з готовими мікрочастинками, завислими у водному носії, до форм, які перетворюються в желе in situ. Хоча видається сумнівним можливість описати в даному документі всі комбінації діючих речовин і можливі лікарські форми, що можуть застосовуватись, приклади завжди відносяться до готових мікрочастинок, тобто ніколи не описують системи формування імплантатів безпосередньо in situ. Нарешті, слід 1 UA 113317 C2 5 10 15 20 25 30 35 40 45 50 55 60 зазначити, що в жодному з прикладів не говориться про тривалість дії більше 60 днів. В WO 2010/065358 A1 описані композиції для прийому лікарських препаратів, що містять тестостерон та інгібітори ароматази, для безперервного прийому тестостерону та запобігання його перетворенню в естрадіол. Хоча опис стосується можливості того, що способом прийому може бути імплантат, як єдиний приклад способу прийому наведено гранули. Крім того, в WO 2012/074883 A1 описано біорозкладані композиції для прийому фармацевтичних препаратів. Ці композиції вимагають використання розчинників, що не розчиняються у воді, таких як бензилбензоат або бензиловий спирт, щоб підтримувати імплантат в рідкому або напівтвердому стані. Раніше було доведено, що такі розчинники вирізняються раптовим вивільненням і, таким чином, не придатні для тривалого вивільнення композицій даного винаходу. Нарешті, в US 2008/0206303 А1 описані композиції тривалого вивільнення анастрозолу, що містять полімер PLA або PLGA, що може супроводжуватися широким спектром розчинників; однак, у варіантах втілення винаходу використовуваними розчинниками є бензиловий спирт і нметил-2-піролідон (NMP), розчинники, які викликають дуже суттєвий "вибух" з подальшим, майже нульовим, вивільненням. Насправді, вибух, який був прийнятним для винахідників в даному документі, становив 25-30 % протягом одного дня, що є дуже високим показником, і через це жоден з їхніх прикладів не тривав більше 60 днів; зокрема у собак, тварин, схожих за фізіологією до людей, вивільнення тривало не довше ніж 35 днів. Нарешті, немає жодних згадок в цьому документі стосовно розміру частинок летрозолу чи важливості цього чинника для властивостей лікарської форми. Таким чином, було б бажано отримати композицію летрозолу і/або анастрозолу з механізмом дії протягом трьох місяців для ад'ювантної терапії першої лінії раку молочної залози у жінок в постменопаузі з позитивним рецептором гормону. З цієї причини, технологія імплантатів винаходу, які формуються в умовах in situ, відміняє більшість недоліків, що характеризують сучасні композиції на основі готових імплантатів. Дана технологія пропонує альтернативну практичну та ефективну терапію для пацієнта, який досяг терапевтичних профілів тривалістю щонайменше 60 днів. ОПИС КРЕСЛЕНЬ Наступні креслення наведені з метою допомогти під час інтерпретації об'єкта даного винаходу, але не передбачають будь-які обмеження. ФІГУРА 1. На фіг. 1 наведено рівні концентрації летрозолу в плазмі (в нг/мл), отримані після внутрішньом'язового введення новозеландським білим кроликам композицій, описаних у прикладі 1. Наведені значення відповідають середнім рівням концентрації в плазмі, отриманим у трьох тварин з кожної групи. ФІГУРА 2. На фіг. 2 наведені рівні концентрації летрозолу в плазмі (в нг/мл), отримані після внутрішньом'язового введення новозеландським білим кроликам композицій, описаних у прикладі 2. Наведені значення відповідають середнім рівням концентрації в плазмі, отриманим у трьох тварин з кожної групи. ФІГУРА 3. На фіг. 3 наведено рівні концентрації летрозолу в плазмі (в нг/мл), отримані після внутрішньом'язового введення новозеландським білим кроликам композицій, описаних у прикладі 3. Наведені значення відповідають середнім рівням концентрації в плазмі, отриманим у трьох тварин з кожної групи. ДЕТАЛЬНИЙ ОПИС ВИНАХОДУ Для композиції, яка є метою даного винаходу, термін початкового "вибуху" означає співвідношення площі під кривою рівнів концентрації діючої речовини в плазмі живих тварин, отриманих протягом перших 72 годин після внутрішньом'язового введення препарату, до загальної площі під кривою (або AUC), отриманої після ін'єкції летрозолу або анастрозолу. Для того, щоб отримати пролонговане вивільнення діючої речовини, яке б відповідало меті даного винаходу, площа під кривою вибуху повинна бути меншою ніж 10 % у порівнянні із загальною AUC, а в ідеалі - меншою 5 %. Аналогічно, отримання рівноваги профілю тривалого вивільнення інгібітору ароматази протягом щонайменше 60 днів вимагає, щоб показник не більше 50 % площі під кривою рівнів концентрації у плазмі, був отриманий протягом перших 30 днів після ін'єкції. Тобто, для мети даного винаходу бажаним показником тривалого вивільнення діючої речовини є показник площі під кривою вибуху, що становить менше 10 % від загальної AUC і не перевищує 50 % від загальної AUC протягом перших 30 днів після ін'єкції. Для мети даного винаходу використовуються наступні терміни без чіткого визначення: "PLA"; "біорозкладаний термопластичний полімер полімолочної кислоти"; "молочна полікислота" і "полімолочна кислота". "ДМСО" і "диметилсульфоксид". 2 UA 113317 C2 Отже, першою особливістю даного винаходу є композиція, придатна для створення внутрішньом'язового імплантату, що містить біорозкладаний термопластичний полімер полімолочної кислоти (PLA), ДМСО і сполуку інгібітору ароматази загальної хімічної формули (1): 5 , яка 10 15 20 25 30 відрізняється тим, що сполука інгібітору ароматази має вигляд суспензії в розчині, який містить ДМСО і PLA і складає 15-50 % за масою від загальної маси композиції, з можливістю композиції тверднути, і утворює твердий або гелевий імплантат при контакті з водною рідиною або з рідиною організму, з терапевтичними властивостями після введення in vivo, показники яких становлять, щонайменше, 100 нмоль/мл за період більше ніж 60 днів. Переважно, сполука інгібітору ароматази має вигляд суспензії в розчині, що містить ДМСО і PLA і складає 20-30 % за масою від загальної маси композиції. Більш переважно, сполука інгібітору ароматази має вигляд суспензії в розчині, що містить ДМСО і PLA і складає 25 % за масою від загальної маси композиції. Відносно іншої особливості винаходу, сполука інгібітору ароматази загальної хімічної формули (1) має наступний розподіл частинок за розмірами: •
ДивитисяДодаткова інформація
Назва патенту англійськоюInjectable compositions comprising letrozole or anastrozole
Автори англійськоюFranco Rodriguez, Guillermo, Gutierro Aduriz, Ibon
Автори російськоюФранко Родригес Гильермо, Гутьерро Адурис Ибон
МПК / Мітки
МПК: A61K 47/20, A61K 47/34, A61K 31/4196, A61K 9/10, A61K 9/00
Мітки: композиція, ін'єкцій
Код посилання
<a href="https://ua.patents.su/14-113317-kompoziciya-dlya-inehkcijj.html" target="_blank" rel="follow" title="База патентів України">Композиція для ін’єкцій</a>