Спосіб одержання монодисперсних наночастинок
Формула / Реферат
1. Спосіб одержання наночастинок металів, сплавів металів, оксидів металів і оксидів декількох металів, що включає наступні стадії:
і) стадію, на якій здійснюють реакцію солі металу, розчиненої у воді, із сіллю лужного металу карбонової кислоти С4-25, розчиненої в першому розчиннику, що вибирають із групи, що складається з аліфатичного вуглеводню С5-10 і ароматичного вуглеводню С6-10, з одержанням карбоксилатного комплексу металу; і
іі) стадію, на якій здійснюють нагрівання зазначеного карбоксилатного комплексу металу, розчиненого в другому розчиннику, що вибирають із групи, що складається з ароматичної сполуки С6-25, простого ефіру С6-25, аліфатичного вуглеводню С6-25 і аміну С6-25 з одержанням наночастинок.
2. Спосіб за п. 1, який відрізняється тим, що зазначений метал вибирають із групи, що складається з Fe, Co, Ті, V, Cr, Mn, Ni, Cu, Zn, Y, Zr, Mo, Ru, Rh, Pd, Ag, Cd, Ce, Pt, Au, Ba, Sr, Pb, Hg, Al, Ga, In, Sn та Ge, а зазначений лужний метал вибирають із групи, що складається з Li, Na і К.
3. Спосіб за п. 1, який відрізняється тим, що зазначену сіль металу вибирають із групи, що складається з хлориду заліза (III) (FеСl3), хлориду заліза (II) (FeCl2), броміду заліза (II) (FeBr2), сульфату заліза (II) (FeSO4), нітрату заліза (III) (Fе(NО3)3), стеарату заліза (II) (Fe(O2C18H35)2), ацетату заліза (II) (FeOOCCH3)2, хлориду кобальту (III) (СоСl3), хлориду кобальту (II) (СоСl2), нітрату кобальту (III) ((Со(NO)3)3), сульфату нікелю (II) (NiSO4), хлориду нікелю (II) (NiCl2), нітрату нікелю (II) (N(NO3)2, тетрахлориду титану (TiCl4), тетрахлориду цирконію (ZrCl4), гідрогексахлорплатинату (IV) (H2PtCl6), гідрогексахлорпаладіату (IV) (Н2РdСl6), хлориду барію (ВаСl2), сульфату барію (BaSO4), хлориду стронцію (SrCl2), сульфату стронцію (SrSO4), ацетату цинку (Zn(ООСН3)2), ацетату магнію (Mn(ООСН3)2), гідрату ацетату церію (III) ((СН3СОО)3Се·xН2O), гідрату броміду церію (III) (СеВr3·xH2О), гептагідрату хлориду церію (III) (СеСl3·7Н2О), гідрату карбонату церію (III) (Се2(СО3)3·xН2O), гідрату фториду церію (III) (Се3·хН2О), 2-етилгексаноату церію (III) (СН3(СН2)3СН(С2Н5)СO2)3Се, йодиду церію (III) (СеI3), гексагідрату нітрату церію (III) (Се(NO3)3·6H2O), гідрату оксалату церію (III) (Се2(С2O4)3·хН2O), перхлорату церію (IIІ) (Се(С1O4)3), гідрату сульфату церію (III) (Се2(SO4)3·хН2O), ацетилацетонату заліза (Fe(асас)2), ацетилацетонату кобальту (Со(асас)3), ацетилацетонату нікелю (Ni(acac)2), ацетилацетонату міді (Сu(асас)2), ацетилацетонату барію (Ва(асас)2), ацетилацетонату стронцію (Sr(acac)2), гідрату ацетилацетонату церію (III) ((асас)3Се·xН2O), ацетилацетонату платини (Pt(acac)2), ацетилацетонату паладію (Pd(acac)2), тетраізопропоксиду титану (Ti(iOC3H7)4) і тетрабутоксиду цирконію (Zr(OC4H9)4).
4. Спосіб за п. 1, який відрізняється тим, що зазначену сіль металу вибирають із групи, що складається з гідратованого хлориду заліза (III) (FеСl3·6H2O), гідратованого хлориду заліза (II) (FeCl2·4H2O), гідратованого хлориду кобальту (III) (СоСl3·6H2О), гідратованого хлориду кобальту (II) (СоCl2·4H2O), гідратованого хлориду хрому (III) (СrСl3·6Н2О) і гідратованого хлориду марганцю (II) (МnСl2·4H2O).
5. Спосіб за п. 1, який відрізняється тим, що зазначену сіль лужного металу карбонової кислоти C4-25 вибирають із групи, що складається з олеату натрію, стеарату натрію, лаурату натрію, олеату калію, стеарату калію, лаурату калію, додецилсульфату натрію і додецилбензилсульфонату натрію.
6. Спосіб за п. 1, який відрізняється тим, що зазначений перший розчинник вибирають із групи, що складається з гептану гексану, пентану, октану, гексадекану, октадекану, ксилолу, толуолу і бензолу.
7. Спосіб за п. 1, який відрізняється тим, що зазначений другий розчинник вибирають із групи, що складається з октадекану, ейкозану, гексадекану, ейкозену, фенантрену, пентацену, антрацену, дифенілу, диметилдифенілу, фенілового ефіру, октилового ефіру, децилового ефіру, бензилового ефіру, триоктиламіну, гектадециламіну та октадециламіну.
8. Спосіб за п. 1, який відрізняється тим, що перед початком стадії ii) у зазначений карбоксилатний комплекс металу, розчинений у другому розчиннику, додають карбонову кислоту C4-25.
9. Спосіб за п. 8, який відрізняється тим, що зазначену карбонову кислоту С4-25 вибирають із групи, що складається з олеїнової кислоти, стеаринової кислоти, лауринової кислоти, пальмітинової кислоти, октенової кислоти і деканової кислоти.
10. Спосіб за п. 1, який відрізняється тим, що зазначена вода на стадії і) містить етанол та/або метанол.
11. Спосіб за п. 1, який відрізняється тим, що зазначений розчин карбоксилатного комплексу металу на стадії іі) нагрівають до температури між 200 °С і температурою кипіння зазначеного другого розчинника.
12. Спосіб за п. 1, який відрізняється тим, що зазначену температуру підтримують протягом 1 хвилини - 24 годин.
13. Спосіб за п. 1, який відрізняється тим, що зазначений розчин карбоксилатного комплексу металу нагрівають до зазначеної температури зі швидкістю нагрівання 1-200 °С/хв.
Текст
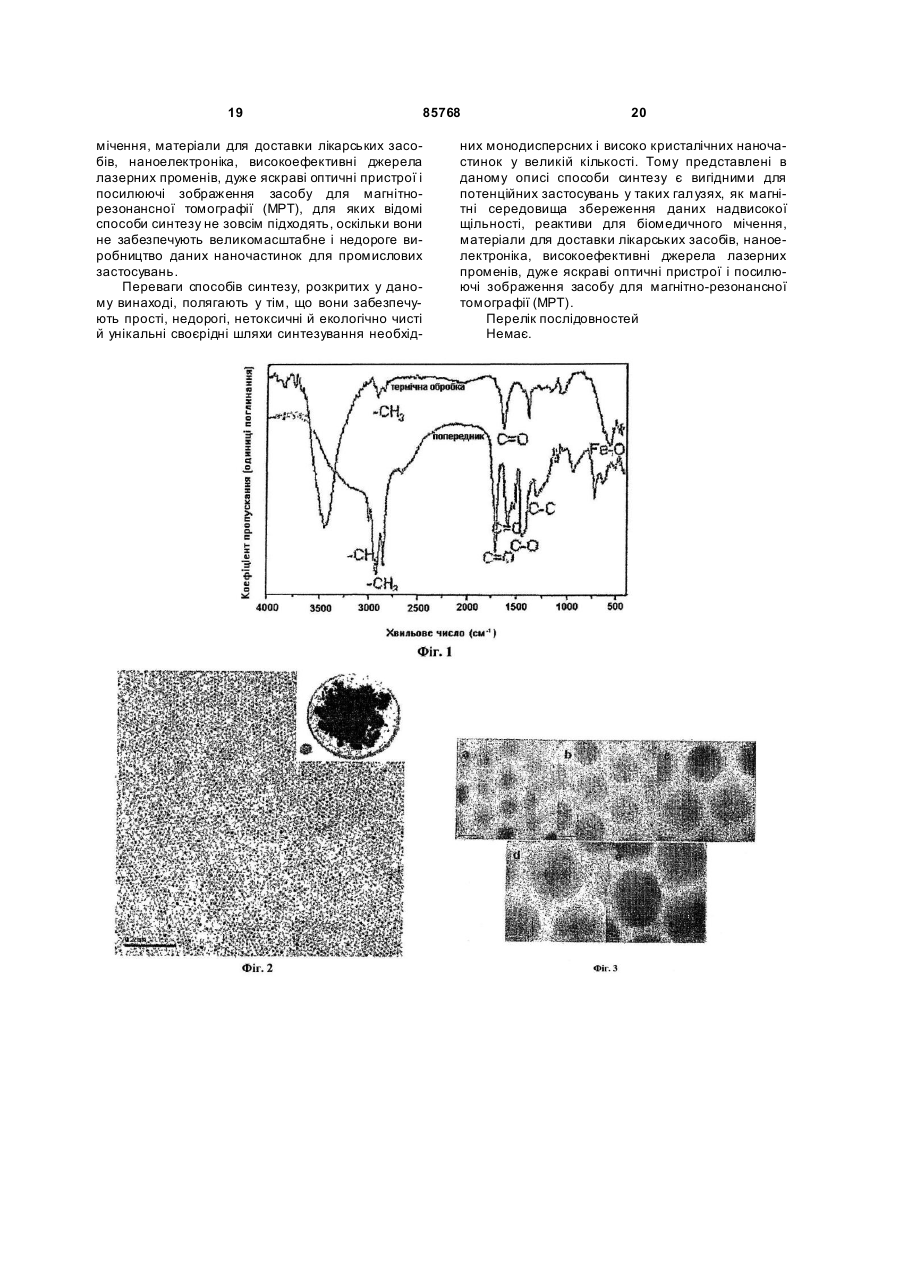
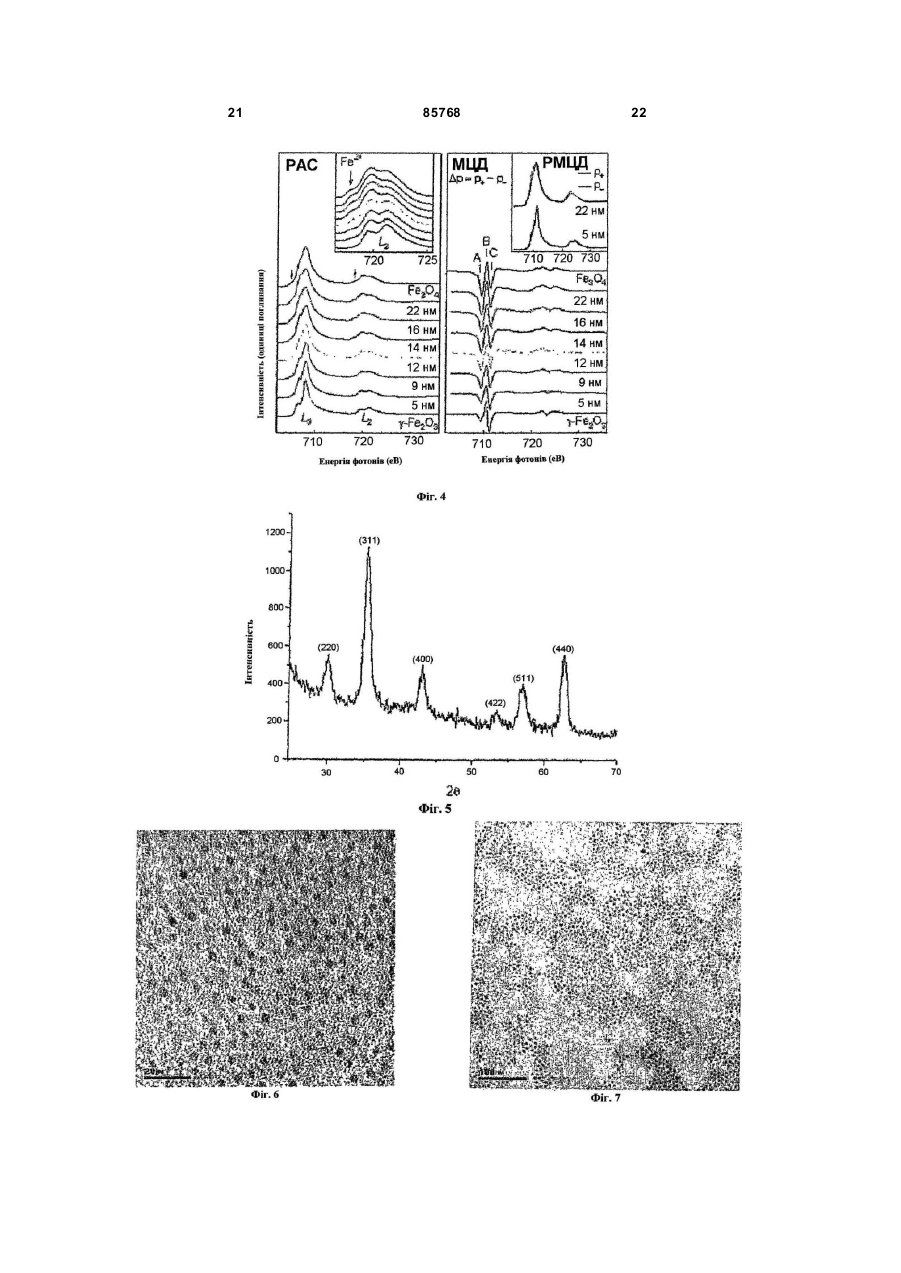
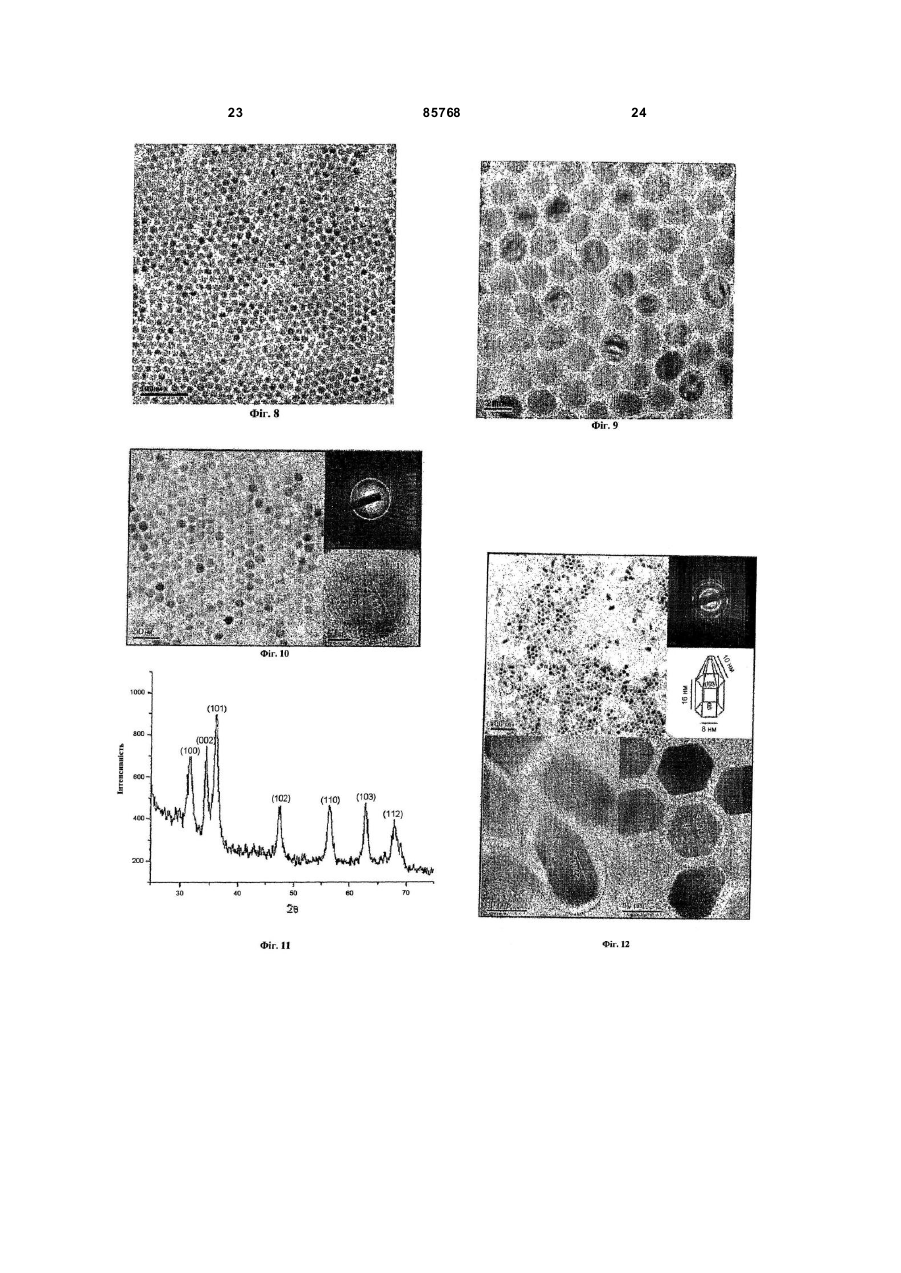
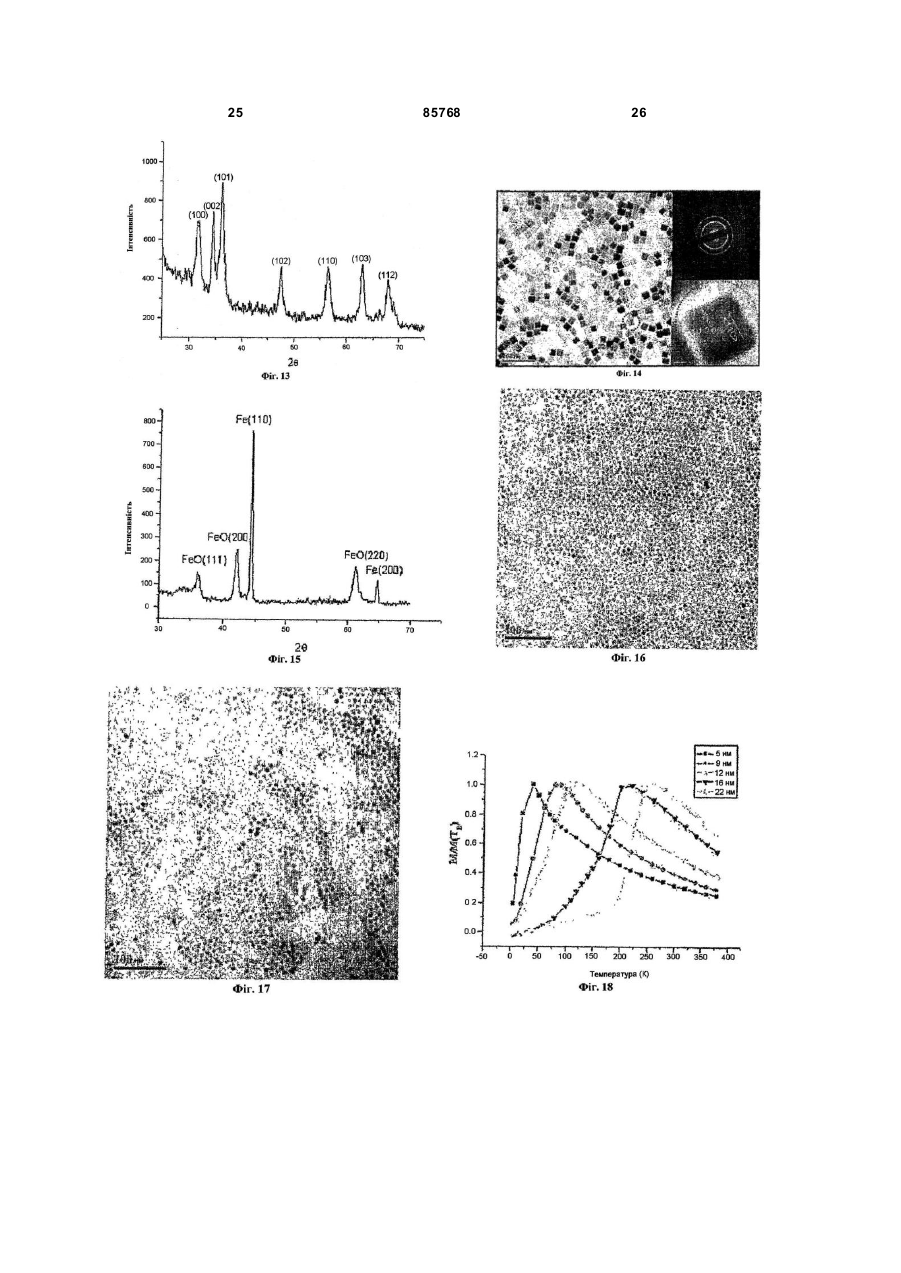
1. Спосіб одержання наночастинок металів, сплавів металів, оксидів металів і оксидів декількох металів, що включає наступні стадії: і) стадію, на якій здійснюють реакцію солі металу, розчиненої у воді, із сіллю лужного металу карбонової кислоти С4-25, розчиненої в першому розчиннику, що вибирають із групи, що складається з аліфатичного вуглеводню С5-10 і ароматичного вуглеводню С 6-10, з одержанням карбоксилатного комплексу металу; і іі) стадію, на якій здійснюють нагрівання зазначеного карбоксилатного комплексу металу, розчиненого в другому розчиннику, що вибирають із групи, що складається з ароматичної сполуки С 625, простого ефіру С 6-25 , аліфатичного вуглеводню С6-25 і аміну С 6-25 з одержанням наночастинок. 2. Спосіб за п. 1, який відрізняється тим, що зазначений метал вибирають із групи, що складається з Fe, Co, Ті, V, Cr, Mn, Ni, Cu, Zn, Y, Zr, Mo, Ru, Rh, Pd, Ag, Cd, Ce, Pt, Au, Ba, Sr, Pb, Hg, Al, Ga, In, Sn та Ge, а зазначений лужний метал вибирають із групи, що складається з Li, Na і К. 3. Спосіб за п. 1, який відрізняється тим, що зазначену сіль металу вибирають із групи, що складається з хлориду заліза (III) (FеСl3), хлориду заліза (II) (FeCl2), броміду заліза (II) (FeBr2), сульфату заліза (II) (FeSO4), нітрату заліза (III) (Fе(NО3)3), стеарату заліза (II) (Fe(O2C18H35)2), ацетату заліза (II) (FeOOCCH 3)2, хлориду кобальту (III) (СоСl3), хлориду кобальту (II) (СоСl2), нітрату кобальту (III) ((Со(NO)3)3), сульфату нікелю (II) (NiSO4), хлориду нікелю (II) (NiCl2), нітрату нікелю (II) (N(NO3)2, тетрахлориду титану (TiCl4), тетрахлориду цирконію (ZrCl4), гідрогексахлорплатинату (IV) (H2PtCl6), гід 2 (19) 1 3 85768 4 7. Спосіб за п. 1, який відрізняється тим, що зазначений другий розчинник вибирають із групи, що складається з октадекану, ейкозану, гексадекану, ейкозену, фенантрену, пентацену, антрацену, дифенілу, диметилдифенілу, фенілового ефіру, октилового ефіру, децилового ефіру, бензилового ефіру, триоктиламіну, гектадециламіну та октадециламіну. 8. Спосіб за п. 1, який відрізняється тим, що перед початком стадії ii) у зазначений карбоксилатний комплекс металу, розчинений у другому розчиннику, додають карбонову кислоту C4-25. 9. Спосіб за п. 8, який відрізняється тим, що зазначену карбонову кислоту С 4-25 вибирають із групи, що складається з олеїнової кислоти, стеаринової кислоти, лауринової кислоти, пальмітинової кислоти, октенової кислоти і деканової кислоти. 10. Спосіб за п. 1, який відрізняється тим, що зазначена вода на стадії і) містить етанол та/або метанол. 11. Спосіб за п. 1, який відрізняється тим, що зазначений розчин карбоксилатного комплексу металу на стадії іі) нагрівають до температури між 200°С і температурою кипіння зазначеного другого розчинника. 12. Спосіб за п. 1, який відрізняється тим, що зазначену температур у підтримують протягом 1 хвилини - 24 годин. 13. Спосіб за п. 1, який відрізняється тим, що зазначений розчин карбоксилатного комплексу металу нагрівають до зазначеної температури зі швидкістю нагрівання 1-200°С/хв. Даний винахід відноситься до способу великомасштабного виробництва монодисперсних наночастинок. Зокрема, даний винахід відноситься до способу одержання наночастинок металів, сплавів металу, оксидів металів і оксидів декількох металів, що включає стадії, на яких здійснюють реакцію солі металу, розчиненої у воді, із сіллю лужного металу карбонової кислоти С 4-25, розчиненої в першому розчиннику, який вибирають із групи, що складається з аліфатичного вуглеводню С5-10 та ароматичного вуглеводню С 6-10, з одержанням карбоксилатного комплексу металу, і нагрівання карбоксилатного комплексу металу, розчиненого в другому розчиннику, який вибирають із групи, що складається з ароматичної сполуки С6-25, простого ефіру С6-25 , аліфатичного вуглеводню С6-25або аміну С6-25 з одержанням наночастинок. Передумови винаходу Муррей (Murray) та ін. розкрили в документі US 6262129 В1 спосіб синтезування наночастинок перехідних металів шляхом реакції попередників металів при високій температурі, у якому процедура вибору розмірів для досягнення однорідності розмірів безумовно вимагала контролю необхідних характеристик; цей спосіб зв'язаний з великими витратами і є складним для його застосування для масового виробництва монодисперсних наночастинок, що перешкоджає великомасштабному виробництву базового матеріалу даним способом. Монодисперсні золоті наночастинки були синтезовані шляхом дигестивного дозрівання одвічно полідисперсних наночастинок [Стоева С. та ін. «Грамовий синтез монодисперсних колоїдів золота методом дисперсії сольватованих атомів металу і їхня організація в двох- і тривимірні структури» (Stoeva, S. et al. «Gram-Scale Synthesis of Monodisperse Gold Colloids by the Solvated Metal Atom Dispersion Method and Their Organization into Two- and Three-Dimensional Structures», J. Am. Chem. Soc. 2002, 124,2305)]. Однак тривалий час витримування, а також труднощі, зв'язані з контролем однорідності розмірів, є факторами, що перешкоджають великомас штабному синтезу монодисперсних золотих наночастинок. Хайон Т. (Hyeon, T.) та ін. розкрили спосіб синтезу, без процесу вибору розмірів, монодисперсних магнітних наночастинок оксиду заліза шляхом термічного розкладання комплексу заліза з олеатом, отриманого реакцією пентакарбоніла заліза та олеїнової кислоти [Хайон Т. «Синтез високо кристалічних і монодисперсних нанокристалитів магтеміта без процесу вибору розмірів» (Нуеоn, Т. «Synthesis of Highly-Crystalline and Monodisperse Maghemite Nanocrystallites without a Size-Selection Process», J. Am. Chem. Soc. 2001, 123, 12798)]. Однак, використовуваний у якості попередника, пентакарбоніл заліза є вкрай токсичним, і даний спосіб не придатний для великомасштабного виробництва монодисперсних наночастинок. Пантс В. (Puntes, V.) та ін. описали спосіб синтезу монодисперсних кобальтових наночастинок шляхом термічного розкладання октакарбоніла дикобальта (Со2(СО)8) у присутності поверхневоактивних речовин [Пантс В. та ін. «Контроль форми і розміру колоїдних нанокристалів: випадок кобальту» (Puntes, V. et al. «Colloidal Nanocrystal Shape and Size Control: The Case of Cobalt», Science 2001, 291, 2115)]. Однак використання дорогого і високотоксичного октакарбоніла дикобальта є чинником, що перешкоджає синтезуванню монодисперсних наночастинок у великій кількості. Сан С (Sun, S.) та ін. повідомили про синтез монодисперсних наночастинок феритів металів (MFe2 O4 , де Μ =Fe, Co або Μn) шляхом термічного розкладання суміші ацетатів металів у присутності олеїнової кислоти (Сан С. та ін. «Монодисперсні наночастинки MFe2O 4 (Μ =Fe, Co, Μn)» (Sun, S. et al. «Monodisperse MFe2O4 (Μ =Fe, Co, Mn) Nanoparticles», J. Am. Chem. Soc. 2004, 126, 273); Сан С. та ін. «Синтез магнетитових наночастинок з контролем розмірів» [Sun, S. et al., «Size-Controlled Synthesis of Magnetite Nanoparticles», J. Am. Chem. Soc. 2002, 124, 8204)]. Використання дорогих ацетатів металів перешкоджає синтезуванню монодисперсних наночастинок у великій кількості. 5 85768 Яна Н. та ін. (Jana, N. et al.) розкрили просту та узагальнену реакційну систему для синтезування наночастинок оксидів металів шляхом піролізу солей металів жирних кислот (Яна Н. та ін. «Наночастинки магнітних (Cr, Mn, Fe, Co, Ni) оксидів з контрольованими розміром і формою при простому і загальному підході» (Jana, N. et al. «Size- and Shape-Controlled Magnetic (Cr, Mn, Fe, Co, Ni) Oxide Nanoparticles via a Simple and General Approach», Chem. Mater. 2004,16,3931)). Хоча даний спосіб синтезу має деякі переваги над відомими технічними рішеннями, згаданими вище, у тім, що використовуються відносно безпечні і недорогі солі металів жирних кислот, недолік даного способу полягає в дуже важких і віднімаючих багато часу, стадіях нейтралізації й очищення, що здійснюють з використанням реакції в одному казані суміші солі металу, жирної кислоти і NaOH для одержання солей металів жирних кислот. Даний недолік утр удняє синтезування монодисперсних наночастинок у великій кількості. Крім того, Ю, У. та ін. (Yu, W. et al.) повідомили про спосіб виробництва монодисперсних магнетитових наночастинок шляхом термічного розкладання солей металів жирних кислот з використанням дуже простого способу, такого як у Яна та ін. (Jana et al.), описаного вище, (Ю, У. та ін. «Синтез монодисперсних наночастинок оксиду заліза шляхом термічного розкладання солей карбоксилату заліза» (Yu, W. et al. «Synthesis of Monodisperse Iron Oxide Nanoparticles by Thermal Decomposition of Iron Carboxylate Salts», Chem. Comm. 2004,2306)). Для того щоб усун ути недоліки відомих технічних рішень, був досліджений новий спосіб синтезування монодисперсних наночастинок у великій кількості з використанням недорогих і нетоксичних солей металів як поверхнево-активних речовин, що дозволяє синтезувати монодисперсні наночастинки в кількості до 100 грам за одну реакцію з використанням 500мл розчинника без процесу вибору розмірів. Більш того, розмір монодисперсної наночастинки контролюється просто - шляхом зміни умов синтезу. Результатом досліджень став новий спосіб одержання монодисперсних наночастинок різних перехідних металів, сплавів металів, оксидів металів і оксидів декількох металів і їхніх варіантів. Таким чином, основною метою даного винаходу є створення нового способу одержання монодисперсних наночастинок металів, сплавів металів, оксидів металів і оксидів декількох металів у великій кількості з недорогих і нетоксичних солей металів без процесу вибору розмірів. Опис винаходу Останнім часом активно ведуться розробки різних наночастинок, названих також нанокристалами, оскільки вони можуть бути матеріалами для нової галузі, що з'являється, названою нанотехнологією,у таких областях застосування, як магнітні середовища збереження даних надвисокої щільності, реактиви для біомедичного мічення, наномасштабна електроніка, матеріали для високоефективних джерел лазерних променів і дуже яскраві оптичні пристрої. 6 Для такої широкої сфери застосування спосіб синтезування монодисперсних наночастинок з коливаннями розмірів менш 5% є дуже важливим ключовим фактором у контролюванні основних характеристик базових матеріалів, оскільки властивості даних наночастинок у великому ступені залежать від розміру наночастинок. Наприклад, визначальним фактором для різкості кольору оптичних пристроїв на базі нанокристалів у напівпровіднику є, у першу чергу, однорідність розмірів наночастинок, і такі монодисперсні магнітні наночастинки є критичним базовим матеріалом для застосування в такій галузі, як магнітні середовища збереження даних надвисокої щільності. Оскільки такі монодисперсні наночастинки можна використовувати в широкій сфері застосування, описаної вище, вкрай бажано розробити спосіб виробництва базового матеріалу наночастинок у великій кількості. На жаль, відомі дотепер способи синтезу для одержання монодисперсних наночастинок обмежуються кількостями менш грама. Поставлена основна мета даного винаходу досягається завдяки створенню способу, що включає наступні стадії: і) стадію, на якій здійснюють реакцію солі металу, розчиненої у воді, із сіллю лужного металу карбонової кислоти С 4-25, розчиненої в першому розчиннику, що вибирають із групи, що складається з аліфатичного вуглеводню С5-10 і ароматичного вуглеводню С 6-10, з одержанням карбоксилатного комплексу металу, та іі) стадію, на якій здійснюють нагрівання карбоксилатного комплексу металу, розчиненого в другому розчиннику, що вибирають із групи, що складається з ароматичної сполуки С 6-25, простого ефіру С6-25, аліфа тичного вуглеводню С 6-25 і аміну С6-25 з одержанням наночастинок. Відповідно до даного винаходу, солі металів для синтезування карбоксилатних комплексів металів включають іони та аніони металів, причому іони металів вибирають із групи, що складається з Fe, Co, Ті, V, Сr, Mn, Ni, Cu, Zn, Y, Zr, Mo, Ru, Rh, Pd, Ag, Cd, Ce, Pt, Аu, Ba, Sr, Pb, Hg, Al, Ga, In, Sn або Ge, а аніони вибирають із групи, що складається з карбонових кислот С 4-25· Солі металів, що використовують для приготування карбоксилатних комплексів металів, вибирають із групи, що складається з гідратованого хлориду заліза (III) (FeCl3×6H2O), гідратованого хлориду заліза (II) (FeCl2×4H2O), гідратованого хлориду кобальту (III) (CoCl 3×6H2O), гідратованого хлориду кобальту (II) (СоСl2×4Н2О), гідратованого хлориду хрому (III) (СгСl3×6Н2О), гідратованого хлориду марганцю (ll) (ΜnΟ2×4Η2O), хлориду заліза (III) (FeCl3), хлориду заліза (II) (FeCl2), броміду заліза (II) (FeBr2), сульфа ту заліза (II) (FeSO4), нітрату заліза (III) (Fe(NO3)3), стеарату заліза (II) (Fe(O2C18H35)2), ацетату заліза (II) (FeOOCCH3)2, хлориду кобальту (III) (СоСl3), хлориду кобальту (II) (СоСl2), нітрату кобальту (III) (Co(NO3) 3), сульфату нікелю (II) (NiSO4), хлориду нікелю (II) (NiCl2), нітрату нікелю (II) (Ni(NO3)2), тетрахлориду титану (ТіСl4), тетра хлориду цирконію (ZrCl4), гідрогексахлорплатинату (IV) (H2PtCl6), гідрогексахлорпаладі 7 85768 ату (IV) (H2PdCl6), хлориду барію (ВаСl2), сульфату барію (BaSO4), хлориду стронцію (SrCl2), сульфату стронцію (SrSO4), ацетату цинку (Zn(OOCH3)2), ацетату магнію (Мn(ООСН3)2), гідрату ацетату церію (III) ((СН3СОО)3Се×хН2О), гідрату броміду церію (III) (СеВr3×хН2 О), гептагідрату хлориду церію (III) (СеСl3×7Н2О), гідрату карбонату церію (III) (Се2(СО3)3×хН2О), гідрату фториду церію (III) (CeF3×xH2 O), 2-етілгексаноату церію (III) (СН3(СН2)3СН(С2Н5)СО2)3Се, йодиду церію (III) (СеІ3), гексагідрату нітрату церію (III) (Ce(NO3)3×6H2O), гідрату оксалату церію (III) (Се2(С2О4)3×хН2 О), перхлорату церію (III) (Се(СlO4)3), гідрату сульфату церію (III) (Ce2(SO4)3×xH2 O), ацетілацетонату заліза (Fe(acac)3), ацетілацетонату кобальту (Со(асас)3), ацетілацетонату нікелю (Ni(acac)2), ацетілацетонату міді (Сu(асас)2), ацетілацетонату барію (Ва(асас)2), ацетілацетонату стронцію (Sr(acac)2), гідрату ацетілацетонату церію (III) ((асас)3Се×хН2О), ацетілацетонату платини (Pt(acac)2), ацетілацетонату паладію (Pd(acac)2), тетраізопропоксиду титану (Ті(iОС3Н7)4) і тетрабутоксиду цирконію (Zr(OC4H9)4). Відповідно до даного винаходу, при синтезуванні монодисперсних наночастинок сплавів і оксидів декількох металів в якості солі металів використовують два або більш з ви щевказаних сполук. Для того щоб одержати розчин карбоксилатного комплексу металів на стадії іі) даного винаходу, для розчинення карбоксилатних комплексів металів використовують наступні розчинники: прості ефіри, тобто, октиловий ефір, бутиловий е фір, гексиловий ефір, бензиловий ефір, феніловийефір і дециловий ефір, і ароматичні сполуки, тобто, толуол, ксилол, мезитілен і бензол, і спирти, тобто, октиловий спирт, деканол, гексадеканол, етиленгліколь, 1,2-октандіол, 1,2-додекандіол і 1,2гексадекандіол, і вуглеводні, тобто, гептан, октан, декан, додекан, тетрадекан, ейкозен, октадецен, гексадекан, диметілсульфоксид (ДМСО) і диметілформамід (ДМФ), і алкіламіни, тобто, олеїламін, гексадециламін триоктиламін і октиламін. Відповідно до даного винаходу, розчин карбоксилатного комплексу металу нагрівають до температури між 200°С і температурою кипіння другого розчинника. Крім того, розчин карбоксилатного комплексу металу нагрівають зі швидкістю нагрівання 1-200°С/хв. Відповідно до даного винаходу, розчин карбоксилатного комплексу металу витримують при температурі між 200°С і температурою кипіння другого розчинника, переважніше, між 300°С і температурою кипіння другого розчинника, протягом 1 хвилини - 24 годин, переважніше, протягом 1 хвилини -1 години. Відповідно до даного винаходу, розмір і форму монодисперсних наночастинок металів, оксидів металів, сплавів і оксидів декількох металів легко контролюють шляхом зміни реакційних параметрів кількості поверхнево-активних речовин, зміною розчинників, температури витримування і швидкості нагрівання. Крім того, відповідно до даного винаходу, розмір монодисперсних наночастинок металів, окси 8 дів металів, сплавів і оксидів декількох металів контролюють шляхом зміни відносини карбоксилатного комплексу металу до поверхнево-активної речовини, причому молярне відношення карбоксилатного комплексу металу до поверхневоактивної речовини вибирають у межах 1:0,1 - 1:100, переважніше, 1:0,1 - 1:20. Відповідно до даного винаходу, розмір монодисперсних наночастинок металів, оксидів металів, сплавів і оксидів декількох металів далі контролюють шляхом зміни других розчинників з різними точками кипіння (т.к.). Наприклад, якщо комплекс заліза з олеатом витримували в 1гексадецені (т.к. = 274°С), октиловому ефірі (т.к.=287°С), 1-октадецені (т.к. = 317°С), 1-ейкозені (т.к. = 330°С) і тріоктиламіні (т.к. = 365°С) у якості розчинників, одержували монодисперсні наночастинки оксиду заліза з різними діаметрами приблизно 5, 9, 12, 16 і 22нм відповідно. Відповідно до даного винаходу, монодисперсні наночастинки металів, оксидів металів, сплавів і оксидів декількох металів витягають шляхом додавання пластівців для їхнього осадження з розчину з наступним центрифугуванням, причому пластівці являють собою розчинник, що е фективно не диспергує наночастинки і викликає осадження наночастинок з розчину. Серед наночастинок, синтезованих відповідно до даного винаходу, магнітні наночастинки оксиду заліза і наночастинки заліза виявляють характеристики типового суперпарамагнетизму, як показано на Фіг.18. Крім того, магнітні наночастинки діаметром більш 16нм виявляють властивості феромагнетизму при кімнатній температурі з високим магнітним моментом, достатнім для їхнього використання як магнітне середовище збереження даних, і, отже, потенційно можуть знайти широке промислове застосування. Пропонуються способи великомасштабного синтезу для виробництва однорідних наночастинок металів, сплавів, оксидів металів і оксидів декількох металів без процесу вибору розмірів, якими одержують зазначені наночастинки, в основному, однорідними за розміром, а також формою, причому в результаті одержують однорідні наночастинки, що володіють необхідними властивостями для різних вищезгаданих випадків застосування. Основною метою даного винаходу є створення простого й екологічно чистого способу одержання монодисперсних наночастинок металів, сплавів, оксидів металів і оксидів декількох металів, яким наночастинки одержують у великій кількості на рівні приблизно 100г. Наночастинки, що одержують пропонованим способом, можуть повторно диспергуватися без агрегації, і, крім того, ці наночастинки можуть збиратися в 2-мірні або 3-мірні зверхрешітки з далекою упорядкованістю завдяки повільному випару, оскільки однорідність розміру і форми дозволяє наночастинкам утворювати зверхрешітки шляхом самозборки. У результаті, наночастинки, синтезовані пропонованим способом, є потенційними кандидатами 9 85768 для застосувань у магнітних запам'ятовуючих пристроях високої щільності порядку (терабіти/кв. дюйм), а також для біомедичних застосувань, наприклад, як контрастні засоби для магнітнорезонансної томографії (МРТ) і для системи доставки лікарських засобів. Короткий опис графічного матеріалу Зазначені вище цілі та інші переваги даного винаходу стан уть очевидними з докладного опису його кращого приклада з посиланнями на прикладений графічний матеріал. На Фіг.1 представлені спектри інфрачервоної спектроскопії з перетворенням Фур'є комплексу заліза з олеатом (безперервна лінія) і того ж комплексу після нагрівання при температурі 380°С (пунктирна лінія), що свідчать, що пропонованим способом отримані оксиди заліза. На Фіг.2 представлене отримане за допомогою ТЕМ зразкове зображення сферичних наночастинок оксиду заліза діаметром 12нм, синтезованих у варіанті здійснення 2 у великій кількості. Вставка у верхньому правому куті - це фо тознімок, на якому показані 40м монодисперсних наночастинок оксиду заліза в чаші Петрі. На Фіг.3а, 3b, 3с, 3d, 3е представлені отримані за допомогою високороздільного ТЕМ зразкові зображення наночастинок оксиду заліза різного розміру діаметром (а) 5нм, (b) 9нм, (с) 12нм, (d) 16нм і (e) 22нм, синтезованих у прикладах 3, 4, 2, 5 і 6 відповідно. На Фіг.4 представлені два графіки РеL2,3крайових рентгенівських абсорбційних спектрів (РАС) (лівий графік) і рентгенівських спектрів магнітного циркулярного дихроїзму (МЦД) (правий графік) наночастинок оксиду заліза діаметром 5нм, 9нм, 12нм, 16нм і 22нм, синтезованих у прикладах 3, 4, 2, 5 і 6 відповідно, причому для порівняння показані також РАС і рентгенівські спектри МЦД е талонних насипних матеріалів g-Fe2O3 і Fe3O4 . На вставках Фіг.4 показані також збільшені спектри РАС зони L2 і рентгенівські спектри МЦД (РМЦД) наночастинок діаметром 5 і 22нм відповідно. На Фіг.5 представлена зразкова порошкова рентгенограма сферичних наночастинок оксиду заліза діаметром 12нм, синтезованих у варіанті здійснення 2. На Фіг.6 представлене отримане за допомогою ТЕМ зразкове зображення сферичних наночастинок оксиду заліза діаметром 5нм, синтезованих у великій кількості у варіанті здійснення 3. На Фіг.7 представлене отримане за допомогою ТЕМ зразкове зображення сферичних наночастинок оксиду заліза діаметром 9нм, синтезованих у великій кількості у варіанті здійснення 4. На Фіг.8 представлене отримане за допомогою ТЕМ зразкове зображення сферичних наночастинок оксиду заліза діаметром 16нм, синтезованих у великій кількості у варіанті здійснення 5. На Фіг.9 представлене отримане за допомогою ТЕМ зразкове зображення сферичних наночастинок оксиду заліза діаметром 22нм, синтезованих у великій кількості у варіанті здійснення 6. На Фіг.10 представлене отримане за допомогою ТЕМ зразкове зображення наночастинок у 10 вигляді куба оксиду марганцю діаметром 12нм, синтезованих у варіанті здійснення 7, де вставки у верхньому правому і нижньому правом кутах - це електронограма й отримане за допомогою високороздільного ТЕМ зображення наночастинок Μn відповідно. На Фіг.11 представлена зразкова порошкова рентгенограма наночастинок у вигляді куба оксиду марганцю діаметром 12нм, синтезованих у варіанті здійснення 7. На Фіг.12 представлене отримане за допомогою ТЕМ зразкове зображення, показане у верхньому лівому куті, наночастинок у вигляді олівця оксиду кобальту (СоО), синтезованих у варіанті здійснення 8, і вставки у вер хньому правому куті і всередині праворуч - це електронограми і схематична модель цих же наночастинок відповідно. У нижньому лівому і нижньому правому кута х показані отримані за допомогою високороздільного ТЕМ зображення, що проектуються в напрямках і , відповідно. На Фіг.13 представлена зразкова порошкова рентгенограма наночастинок у вигляді олівця оксиду кобальту (СоО), синтезованих у варіанті здійснення 8. На Фіг.14 представлене отримане за допомогою ТЕМ зразкове зображення наночастинок у вигляді куба заліза (Fe) діаметром 20нм, синтезованих у варіанті здійснення 9, а вставки у верхньому правому і нижньому правом кута х - це електронограма й отримане за допомогою високороздільного ТЕМ зображення тих же самих наночастинок Fe відповідно. На Фіг.15 представлена зразкова порошкова рентгенограма наночастинок у вигляді куба заліза (Fe) діаметром 20нм, синтезованих у варіанті здійснення 9. На Фіг.16 представлене отримане за допомогою ТЕМ зразкове зображення сферичних наночастинок фериту кобальту (CoFe2O4) діаметром 8нм, синтезованих у варіанті здійснення 10. На Фіг.17 представлене отримане за допомогою ТЕМ зразкове зображення сферичних наночастинок фериту марганцю (MnFe2O4) діаметром 9нм, синтезованих у варіанті здійснення 11. На Фіг.18 представлена крива намагнічування сферичних наночастинок оксиду заліза діаметром 5, 9, 12, 16 і 22нм, обмірюваного після процесу охолодження при нульовому полі, що показує залежність від температури; у даному випадку сферичні наночастинки оксиду заліза п'яти різних діаметрів 5, 9, 12, 16 і 22нм синтезовані в прикладах 3, 4, 2, 5 і 6 відповідно. На Фіг.19 представлене отримане за допомогою ТЕМ зразкове зображення сферичних наночастинок оксиду цинку (ZnO) діаметром 5нм, синтезованих у великій кількості у варіанті здійснення 13. На Фіг.20 представлене отримане за допомогою ТЕМ зразкове зображення сферичних наночастинок оксиду церію (СеО2) діаметром 2нм, синтезованих у варіанті здійснення 14. Нижче описуються реалізації і відповідні процедури найкращих варіантів здійснення даного винаходу. Однак представлені реалізації і відпові 11 85768 дні процедури є лише ілюстративними прикладами реалізації ідей, що лежать в основі даного винаходу. Приведені нижче зразкові варіанти здійснення не призначені ні для вичерпної ілюстрації основних ідей і процедур, ні для обмеження обсягу даного винаходу. Крім того, фа хівцям повинно бути легко винайти варіанти і модифікації ідей, що лежать в основі даного винаходу, і свої варіанти його здійснення. Варіант здійснення 1. Синтез комплексу заліза з олеатом Як перший зразковий варіант здійснення для демонстрації пропонованого способу синтезування монодисперсних наночастинок, 10,8г хлориду заліза (FeCl3×6H2O, 40моль) і 36,5г олеату натрію (120моль) розчинили в суміші розчинників, що містить 80мл етанолу, 60мл дистильованої води і 140моль гексану, після чого отриману суміш нагріли до температури 70°С і витримували при цій температурі протягом 4 годин для одержання комплексу заліза з олеатом. Протягом цього процесу первісний яскраво-червоний колір водяної фази став прозорим, а спочатку прозора органічна фаза знайшла яскраво-червоний колір, що вказувало на те, що комплекс заліза з олеатом успішно синтезувався. Після завершення реакції верхній органічний шар, що містив комплекс заліза з олеатом, відокремився, після чого гексан випарувався, і утворилася віскоподібна тверда форма. На Фіг.1 спектр інфрачервоної спектроскопії з перетворенням Фур'є о триманого комплексу заліза з олеатом має витягнутий пік С=О при хвильовому числі 1700см -1, що є унікальною характеристикою для комплексу заліза з олеатом. Варіант здійснення 2. Синтез монодисперсних сферичних наночастинок оксиду заліза у великій кількості (А) Як перший зразковий варіант здійснення великомасштабного синтезу монодисперсних сферичних наночастинок оксиду заліза у великій кількості відповідно до даного винаходу, 36г комплексу заліза з олеатом, синтезованого у варіанті здійснення 1, додали в суміш, що містить 200г дегідратованого октадекану і 5,7г олеїнової кислоти, в інертній атмосфері при кімнатній температурі. Отриману суміш нагріли до 320°С і потім витримували протягом 30 хвилин, підтримуючи при тій же температурі. Протягом цього процесу протікала сильна реакція, і первісний прозорий розчин став коричнювато-чорним, указуючи на те, що комплекс заліза з олеатом цілком розклався й утворилися наночастинки оксиду заліза. Отриманий розчин, що містив наночастинки, остудили до кімнатної температури, додали в нього в надлишок етанол, що привів до випадання чорного осаду, і сепарували центрифугуванням. Після цього надосадову рідину, що утворилася, злили. Даний процес промивання повторювали не менш трьох разів, після чого етанол, що містився в залишку, видалили вакуумним сушінням. Отриманий продукт легко повторно диспергувався в гексані з утворенням необхідних наночастинок заліза. Нижче представлені результати спостереження й аналізу даних для отриманих наночастинок заліза діаметром 12нм. 12 На Фіг.2 представлене отримане за допомогою трансмісійного електронного мікроскопа (ТЕМ) зображення отриманих сферичних наночастинок заліза. Дане зображення є отриманим за допомогою ТЕМ зразковим зображенням сферичних наночастинок оксиду заліза діаметром 12нм. Воно показує, що отримані наночастинки мають сферичну форму, і що їхні розміри є монодисперсними. На Фіг.3с представлене отримане за допомогою високороздільного трансмісійного електронного мікроскопа (ВРТЕМ) зображення монодисперсних сферичних наночастинок оксиду заліза (магнетиту) діаметром 12нм. Як видно на даній фігурі, отримані наночастинки є високо кристалічними. На Фіг.4 представлені РАС (ліворуч) і рентгенівські спектри МЦД (праворуч) наночастинок оксиду заліза діаметром 12нм разом із двома еталонними матеріалами - насипного g-Fe2O3 (маггеміт) і Fe3O4 (магнетит) - для порівняння, що мають майже таку ж шпінельну кристалічну структуру лише з відмінністю приблизно на 1% постійної кубічної решітки. За даними РАС і рентгенівських спектрів МЦД виконали кількісну оцінку сполук для наночастинок оксиду заліза у вигляді (g-Fе2O3) 1-x(Fе3O 4) х, а саме: для наночастинок діаметром 12нм x = 0,68. На Фіг.5 представлена зразкова порошкова рентгенограма сферичних наночастинок оксиду заліза діаметром 12нм, синтезованих у варіанті здійснення 2. Рентгенограма отриманих наночастинок магнетиту (Fe 3O 4) показує, що наночастинки є високо кристалічними. Варіант здійснення 3. Синтез монодисперсних сферичних наночастинок оксиду заліза у великій кількості (У) Для того щоб синтезува ти монодисперсні сферичної форми наночастинки оксиду заліза відповідно до даного винаходу, виконали процедуру, аналогічну процедурі у варіанті здійснення 2, описаному вище; 18г комплексу заліза з олеатом додали в суміш, що містить 100г дегідратованого октадекану і 5,7г олеїнової кислоти, в інертній атмосфері, і отриману суміш нагріли до 280°С, і потім суміш витримували протягом 1 години при температурі флегми з одержанням колоїдальних наночастинок оксиду заліза діаметром 5нм. Отриманий розчин остудили до кімнатної температури. Потім для промивання додали етанол, що привів до випадання чорного осаду, після чого виконали центрифугування з частотою обертання 2000об/хв, за допомогою якого витягли осілі наночастинки. Після цього процес промивання повторювали не менш трьох разів, етанол видалили вакуумним сушінням з одержанням необхідних наночастинок оксиду заліза сферичної форми. Отримані наночастинки легко повторно диспергувалися у неполярних органічних розчинниках, таких, як гексан або толуол. На Фіг.6 представлене отримане за допомогою ТЕМ зображення отриманих наночастинок, на якому видно, що отримані сферичні наночастинки оксиду заліза діаметром 5нм, синтезовані в даному варіанті здійснення, є майже монодисперсними в частині розміру частинок. 13 85768 Отримане за допомогою високороздільного трансмісійного електронного мікроскопа (ВРТЕМ) зображення монодисперсних сферичних наночастинок оксиду заліза (магнетиту) діаметром 5нм, представлене на Фіг.3а, показує, що дані наночастинки є високо кристалічними. На Фіг.4 представлені РАС (ліворуч) і рентгенівські спектри МЦД (праворуч) наночастинок оксиду заліза діаметром 5нм у порівнянні з двома еталонними матеріалами - насипного g-Fe2O3 (маггеміт) і Fe3O4 (магнетит) - які показують, що отримані наночастинки мають майже таку ж шпінельну кристалічну стр уктуру, що й еталони, лише з відмінністю приблизно на 1% постійної кубічної решітки. РАС і рентгенівські спектри МЦД отриманих наночастинок діаметром 5нм майже аналогічні цим спектрам еталона g-Fe2O3, що містить тільки Fe3+. За даними РАС і рентгенівських спектрів МЦД виконали кількісну оцінку сполук для отриманих наночастинок оксиду заліза у вигляді (gFe2O3) 1-x(Fe3O 4) x, у результаті якої одержали x= 0,20 для отриманих наночастинок діаметром 5нм. Виходячи з цього, прийшли до висновку, що фаза g-Fe2O3 є домінантною фазою результуючих наночастинок оксиду заліза діаметром 5нм. Варіант здійснення 4. Синтез монодисперсних сферичних наночастинок оксиду заліза у великій кількості (С) Монодисперсні сферичні наночастинки оксиду заліза діаметром 9нм синтезували за тих самих умов реакції, що й описані у варіанті здійснення 3, за винятком того, що використовуваний розчинник замінили октиловим ефіром, і температур у остаточного витримування установили рівної 300°С. Отримане за допомогою ТЕМ зображення отриманих монодисперсних сферичних наночастинок оксиду заліза діаметром 9нм представлено на Фіг.7, на якому видно, що сферичні наночастинки оксиду заліза є монодисперсними за розміром частинок. Отримане за допомогою високороздільного трансмісійного електронного мікроскопа (ВРТЕМ) зображення отриманих монодисперсних сферичних наночастинок оксиду заліза (магнетиту) діаметром 9нм, представлене на Фіг.3b, показує, що дані наночастинки є високо кристалічними. На Фіг.4 представлені РАС (на лівому графіку) і рентгенівські спектри МЦД (на правому графіку) отриманих наночастинок оксиду заліза діаметром 9нм, а також спектри двох еталонних матеріалів насипного g-Fe2O3 (маггеміт) і Fe3O4 (магнетит) для порівняння, на яких отримані наночастинки мають майже таку ж шпінельну кристалічну структуру, що й еталонні матеріали, лише з відмінністю приблизно на 1% постійної кубічної решітки. За даними РАС і рентгенівських спектрів МЦД виконали кількісну оцінку сполук для отриманих наночастинок оксиду заліза у вигляді (g-Fe2O3) 1-x(Fe3O 4) x, у результаті якої одержали x= 0,57 для отриманих наночастинок діаметром 9нм. Варіант здійснення 5. Синтез монодисперсних сферичних наночастинок оксиду заліза у великій кількості (D) 14 Монодисперсні сферичні наночастинки оксиду заліза діаметром 16нм синтезували за тих самих умов реакції, що й описані у варіанті здійснення 3, за винятком того, що використовуваний розчинник замінили 1-ейкозеном, і температуру остаточного витримування установили рівної 330°С. Отримане за допомогою ТЕМ зразкове зображення монодисперсних сферичних наночастинок оксиду заліза діаметром 16нм, синтезованих відповідно до даного винаходу, представлено на Фіг.8, на якому видно, що сферичні наночастинки оксиду заліза є монодисперсними за розміром частинок. Отримане за допомогою високороздільного трансмісійного електронного мікроскопа (ВРТЕМ) зображення отриманих монодисперсних сферичних наночастинок оксиду заліза (магнетиту) діаметром 16нм, представлене на Фіг.3d, показує високо кристалічний характер структури наночастинок. На Фіг.4 представлені РАС і рентгенівські спектри МЦД синтезованих наночастинок оксиду заліза діаметром 16нм, а також спектри двох еталонних матеріалів - насипного g-Fe2O3 (маггеміт) і Fe3O4 (магнетит) - для порівняння, на яких показано, що отримані наночастинки мають майже таку ж шпінельну кристалічну структур у лише з відмінністю приблизно на 1% постійної кубічної решітки. За даними РАС і рентгенівських спектрів МЦД виконали кількісну оцінку сполук для отриманих наночастинок оксиду заліза у вигляді (g-Fe2O3) 1-x(Fe3O 4) x, у результаті якої одержали x=0,86 для синтезованих наночастинок діаметром 16нм. Варіант здійснення 6. Синтез монодисперсних сферичних наночастинок оксиду заліза у великій кількості (Е) Монодисперсні сферичні наночастинки оксиду заліза діаметром 22нм синтезували за тих самих умов реакції, що й описані у варіанті здійснення 3, за винятком того, що використовуваний розчинник замінили триоктиламіном, і температуру остаточного витримування установили рівної 360°С. Отримане за допомогою ТЕМ зразкове зображення монодисперсних сферичних наночастинок оксиду заліза діаметром 22нм, синтезованих відповідно до даного винаходу, представлено на Фіг.9, на якому видно, що сферичні наночастинки оксиду заліза діаметром 22нм є монодисперсними за розміром частинок. Отримане за допомогою високороздільного трансмісійного електронного мікроскопа (ВРТЕМ) зображення отриманих монодисперсних сферичних наночастинок оксиду заліза (магнетиту) діаметром 22нм, представлене на Фіг.3е, показує високо кристалічний характер наночастинок діаметром 22нм. На Фіг.4 представлені результати вимірів РАС і рентгенівських спектрів МЦД наночастинок оксиду заліза діаметром 22нм, а також спектрів двох еталонних матеріалів - насипного g-Fe2O3 (маггеміт) і Fe3O4 (магнетит) - для порівняння, на яких видно, що синтезовані сферичні наночастинки оксиду заліза діаметром 22нм мають майже таку ж шпінельну кристалічну стр уктур у, що й еталонні матеріали, лише з відмінністю приблизно на 1% 15 85768 постійної кубічної решітки. За даними РАС і рентгенівських спектрів МЦД виконали кількісну оцінку сполук для отриманих наночастинок оксиду заліза у вигляді (g-Fe2O3) 1- x(Fe3O 4) x, у результаті якої одержали x= 1,00 для наночастинок діаметром 22нм, що свідчило про те, що синтезовані наночастинки діаметром 22нм є чисто магнетитовими. Варіант здійснення 7. Синтез монодисперсних сферичних наночастинок оксиду марганцю Монодисперсні наночастинки кубічної форми оксиду марганцю (МnО) діаметром 12нм синтезували відповідно до даного винаходу з дотриманням процедури, аналогічної описаній у варіанті здійснення 2 вище; 1,24г олеату марганцю додали в розчин, що містить 10г дегідратованого 1октадецену, в інертній атмосфері; отриману суміш нагріли до 320°С і витримували протягом 1 години при температурі флегми з одержанням коричнювато-чорних колоїдальних наночастинок марганцю. На Фіг.10 представлене отримане за допомогою ТЕМ зразкове зображення наночастинок оксиду марганцю кубічної форми діаметром 12нм, синтезованих відповідно до даного винаходу, на якому видно, що наночастинки дуже однорідні за розміром частинок. На Фіг.11 представлена зразкова порошкова рентгенограма наночастинок оксиду марганцю кубічної форми діаметром 12нм, на якій видно, що після процедури за варіантом здійснення 7 синтезували наночастинки МnО форми гранецентрованого куба (ГЦК). Варіант здійснення 8. Синтез монодисперсних наночастинок оксиду кобальту (СоО) Монодисперсні кулеобразні наночастинки оксиду кобальту (СоО) синтезували відповідно до даного винаходу з використанням процесу, аналогічного процедурі, описаної у варіанті здійснення 2 вище; 1,25г олеату кобальту додали в розчин, що містить 10г дегідратованого 1-октадецену, в інертній атмосфері, і отриману суміш нагріли до 320°С і витримували протягом 1 години при температурі флегми з одержанням блідо-коричневих колоїдальних наночастинок кобальту. У випадку оксиду кобальту відомо, що він має власну кристалічну анізотропію, і, як видно, наночастинки оксиду кобальту ростуть переважно уздовж осі «с». На Фіг.12 представлений приклад отриманого за допомогою ТЕМ зображення кулеобразних наночастинок оксиду кобальту, синтезованих відповідно до даного винаходу, і їхня 2-мірна структура. Як видно з отриманого за допомогою ТЕМ зображення на Фіг.12, кулеобразні наночастинки оксиду кобальту є монодисперсними й утворюють вуликообразні і самозібрані структури надрешітки. Крім того, як видно на електронограмі, показаної у верхньому правому куті на Фіг.12, синтезовані кулеобразні наночастинки оксиду кобальту мають структуру кристала вюртциту. Крім того, як видно на отриманому за допомогою високороздільного ТЕМ зображення кулеобразних наночастинок оксиду кобальту, показаному внизу Фіг.12, ці наночастинки є високо кристалічними. На Фіг.13 представлена зразкова порошкова рентгенограма наночастинок у вигляді олівця ок 16 сиду кобальту, на якій видно також, що ці наночастинки оксиду кобальту мають структур у кристала вюртциту, аналогічну структурі ZnO. Варіант здійснення 9. Синтез монодисперсних наночастинок заліза Монодисперсні наночастинки оксиду заліза кубічної форми розміром 20нм синтезували відповідно до даного винаходу з використанням процедури, аналогічної описаній у варіанті здійснення 2 вище; 1,24г комплексу заліза з олеатом додали в розчин, що містить 5г дегідратованої олеїнової кислоти, у колбі з круглим дном ємністю 50мл, в інертній атмосфері, отриману суміш нагріли до 370°С і витримували протягом 1 години при тій же температурі з одержанням чорних колоїдальних наночастинок заліза. Слід зазначити, що коли термічне розкладання комплексу заліза з олеатом відбувалося при більш високій температурі 350°С, наприклад, у даному винаході, наночастинки самовідновлювалися в залізо. На Фіг.14 представлений приклад отриманого за допомогою ТЕМ зображення наночастинок у вигляді куба заліза діаметром 20нм, синтезованих відповідно до даного винаходу, на якому видно, що дані наночастинки дуже однорідні за діаметром. На електронограмі, показаної на вставці у верхньому правому куті Фіг.14, видно, що синтезовані наночастинки заліза діаметром 20нм мають об'ємно центровану кубічну (ОЦК) кристалічну стр уктуру. Крім того, на отриманому за допомогою високороздільного ТЕМ зображенні наночастинок заліза діаметром 20нм, показаному на вставці в нижньому правому куті Фіг.14, видно, що отримані наночастинки є високо кристалічними, і поверхня наночастинок заліза діаметром 20нм пасивована тонким шаром FeO. На Фіг.15 представлена зразкова порошкова рентгенограма наночастинок у вигляді куба заліза діаметром 20нм, на якій видно, високо кристалічна об'ємно центрована кубічна (ОЦК) серцевина заліза пасивована тонким поверхневим шаром FeO. Варіант здійснення 10. Синтез монодисперсних сферичних наночастинок фериту кобальту (CoFe2O4) Після процедури синтезу, описаної у варіанті здійснення 1 вище, 1,22г комплексу залізо / олеат кобальту, що синтезували шля хом реакції 5,4г FeCl3×6H2O і 2,4г СоСl2×6Н2О з 24,36г натрієвої солі олеїнової кислоти в суміші, що містила 40мл етанолу, 30мл Н 2О і 70мл гексану, додали в розчинник, що містив 10г дегідратованого 1-октадецену, в інертній атмосфері, отриману суміш нагріли до температури 320°С і протягом 30 хвилин витримували при цій же температурі. Протягом даного процесу попередники цілком термічно розклалися, і утворилися біметалічні феритові наночастинки. Після цього розчин остудили до кімнатної температури. Для того щоб видалити надлишок поверхнево-активних речовин і побічні продукти, додали безводний і дегазований етанол, що викликав випадання коричнювато-чорного осаду, після чого поверхнево-активну речовину видалили зціджуванням або центрифугуванням. Даний процес промивання повторили три або більш рази, 17 85768 і етанол видалили вакуумним сушінням. Отримані сферичні наночастинки фериту кобальту (CoFe2O4) діаметром 8нм легко повторно диспергувалися у гексані. На отриманому за допомогою ТЕМ зображенні наночастинок фериту кобальту, синтезованих відповідно до даної процедури, представленому на Фіг.16, видно, що отримані сферичні наночастинки фериту кобальту (CoFe2O4) діаметром 8нм є монодисперсними. Варіант здійснення 11. Синтез монодисперсних сферичних наночастинок фериту марганцю (MnFe2O 4) Монодисперсні сферичні наночастинки фериту марганцю (MnFe2O4) синтезували при умовах реакції, аналогічних варіанту здійснення 10; 1,8г олеату заліза і 0,62г олеату марганцю додали в розчинник, що містив 10г дегідратованого 1октадецену, в інертній атмосфері, отриману суміш нагріли до температури 320°С і протягом 30 хвилин витримували при цій же температурі. Шляхом такого ж процесу промивання, що і варіанті здійснення 9, синтезували сферичні наночастинки фериту марганцю (MnFe2O 4) діаметром 9нм. На отриманому за допомогою ТЕМ зображенні наночастинки фериту марганцю (MnFe2O4), синтезованих відповідно до описаного вище процедурою, представленому на Фіг.17, видно, що сферичні наночастинки фериту марганцю діаметром 9нм є монодисперсними. Варіант здійснення 12. Магнітні властивості сферичних наночастинок оксиду заліза Залежність намагнічування від температури вимірювали після охолодження при нульовому магнітному полі (ОНП), використовуючи 100Ое в температурному інтервалі 5-380К, для сферичних наночастинок оксиду заліза діаметром 5, 9, 12, 16 і 22нм, синтезованих відповідно до варіантів здійснення 2, 3, 4, 5 і 6, використовуючи надпровідний квантовий інтерференційний датчик (НКВІД). Графік отриманих даних про залежність намагнічування від температури з ОНП представлений на Фіг.18 і дуже схожий із графіком для сферичних наночастинок оксиду заліза діаметром 5, 9, 12, 16 і 22нм. Як випливає з графіка на Фіг.18, обмірюваними блокуючими температурами (БТ) для сферичних наночастинок оксиду заліза діаметром 5, 9, 12, 16 і 22нм були 30, 80, 125, 230 і 260К відповідно. При температурах ви ще блокуючих температур усі зразки оксиду заліза виявляють властивості суперпарамагнетизму, і при збільшенні діаметра наночастинок БТ безупинно зростає. Варіант здійснення 13. Синтез монодисперсних сферичних наночастинок оксиду цинку (ZnO) Після процедури синтезу, описаної у варіанті здійснення 1, 12г комплексу цинк олеат, що синтезували шляхом реакції 5,45г ZnCk з 24,36г натрієвої солі олеїнової кислоти в суміші, що містила 40мл етанолу, 30мл Н2О і 70мл гексану, додали в стабілізуючий координуючий розчинник, що містив 60г триоктилфосфіноксиду, в інертній атмосфері, і отриману суміш нагріли до температури 330°С і протягом 1 години витримували при цій же температурі. 18 Протягом даного процесу попередники цілком термічно розклалися, і утворилися наночастинки оксиду цинку. Після цього розчин остудили до кімнатної температури. Для того щоб видалити надлишок поверхнево-активних речовин і побічні продукти, додали безводний і дегазований етанол, що викликав випадання білого осаду. Поверхневоактивну речовину видалили зціджуванням або центрифугуванням. Цей процес промивання повторили три або більш рази, і етанол видалили вакуумним сушінням. Отримані сферичні наночастинки ZnO діаметром 5нм легко повторно диспергувалися у гексані. На отриманому за допомогою ТЕМ зображенні наночастинок ZnO, синтезованих відповідно до даного варіанта здійснення 13, представленому на Фіг.19, видно, що отримані сферичні наночастинки ZnO діаметром 5нм є монодисперсними. Варіант здійснення 14. Синтез монодисперсних сферичних наночастинок церію (СеО2) Після процедури синтезу, описаної у варіанті здійснення 1,20г комплексу церій олеат, що синтезували шляхом реакції 7,45г СеСl3×7Н2О з 18,27г натрієвої солі олеїнової кислоти в суміші, що містила 40мл етанолу, 30мл Н 2О і 70мл гексану, додали в стабілізуючий координуючий розчинник 200мл олеїламіну, в інертній атмосфері, і отриману суміш нагріли до температури 320°С і протягом 2 годин витримували при цій же температурі. Протягом даного процесу попередники цілком термічно розклалися, і утворилися наночастинки церію. Після цього розчин остудили до кімнатної температури. Для того щоб видалити надлишок поверхнево-активних речовин і побічні продукти, додали безводний і дегазований етанол, що викликав випадання білого осаду. Надосадову рідину видалили зціджуванням або центрифугуванням. Даний процес промивання повторили три або більш рази, і етанол видалили вакуумним сушінням. Отримані сферичні наночастинки церію діаметром 2нм легко повторно диспергувалися у гексані. На отриманому за допомогою ТЕМ зображенні наночастинок церію, синтезованих відповідно до даного варіанта здійснення 14, представленому на Фіг.20, видно, що отримані сферичні наночастинки церію діаметром 2нм є монодисперсними. Здійснення винаходу Пропонованим способом монодисперсні наночастинки металів, оксидів металів, сплавів і оксидів декількох металів синтезують у великій кількості, причому дані наночастинки виявляють відмінні магнітні властивості для застосувань як магнітні середовища збереження даних, і ці властивості продемонстровані шляхом виміру залежності намагнічування від температури для різних розмірів синтезованих наночастинок оксидів металів. Останнім часом активно ведеться розробка монодисперсних і високо кристалічних наночастинок металів, сплавів, оксидів металів і оксидів декількох металів не тільки для інтересів фундаментальної науки, але і для багатьох потенційних технічних і практичних застосувань у таких галузях, як магнітні середовища збереження даних надвисокої щільності, реактиви для біомедичного 19 85768 мічення, матеріали для доставки лікарських засобів, наноелектроніка, високоефективні джерела лазерних променів, дуже яскраві оптичні пристрої і посилюючі зображення засобу для магнітнорезонансної томографії (МРТ), для яких відомі способи синтезу не зовсім підходять, оскільки вони не забезпечують великомасштабне і недороге виробництво даних наночастинок для промислових застосувань. Переваги способів синтезу, розкритих у даному винаході, полягають у тім, що вони забезпечують прості, недорогі, нетоксичні й екологічно чисті й унікальні своєрідні шляхи синтезування необхід 20 них монодисперсних і високо кристалічних наночастинок у великій кількості. Тому представлені в даному описі способи синтезу є вигідними для потенційних застосувань у таких галузях, як магнітні середовища збереження даних надвисокої щільності, реактиви для біомедичного мічення, матеріали для доставки лікарських засобів, наноелектроніка, високоефективні джерела лазерних променів, дуже яскраві оптичні пристрої і посилюючі зображення засобу для магнітно-резонансної томографії (МРТ). Перелік послідовностей Немає. 21 85768 22 23 85768 24 25 85768 26 27 Комп’ютерна в ерстка Л.Литв иненко 85768 Підписне 28 Тираж 28 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for making monodisperse nanoparticles
Автори англійськоюHyeon Taeghwan, Park Jongnam
Назва патенту російськоюСпособ получения монодисперсных наночастиц
Автори російськоюХиэон Таэгхван, Парк Джонгнам
МПК / Мітки
Мітки: наночастинок, спосіб, монодисперсних, одержання
Код посилання
<a href="https://ua.patents.su/14-85768-sposib-oderzhannya-monodispersnikh-nanochastinok.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання монодисперсних наночастинок</a>
Попередній патент: Бездимна сигарета
Наступний патент: Спосіб отримання харчового порошку та установка для його здійснення
Випадковий патент: Спосіб комплексної оцінки ризику негативного впливу на організм людини пестицидів при їх вимиванні у воду