Антитіло проти gdf8 людини
Формула / Реферат
1. Виділене антитіло людини або його антигензв'язувальний фрагмент, що специфічно зв'язується зі зрілим білком GDF8 людини дикого типу, який містить SEQ ID NO: 340, або блокує його біологічну активність, але не зв'язується з химерною конструкцією GDF8/TGFβ-l, у якій амінокислоти 48-72 зрілого білка GDF8 людини замінені відповідною амінокислотною послідовністю TGFβ-1, де химерна конструкція GDF8/TGFβ-l містить амінокислотну послідовність SEQ ID NO: 352, і де антитіло або антигензв'язувальний фрагмент містить: (а) три CDR важкого ланцюга (HCDR1, HCDR2 і HCDR3) з амінокислотними послідовностями, що вибрані з SEQ ID NO: 116/118/120, 362/364/366 або 378/380/382; і (b) три CDR легкого ланцюга (LCDR1/LCDR2/LCDR3) з амінокислотними послідовностями, що вибрані з SEQ ID NO: 124/126/128, 370/372/374 або 386/388/390.
2. Виділене антитіло або його антигензв'язувальний фрагмент за п. 1, що містить (а) CDR важкого ланцюга (НCDR1, HCDR2 і HCDR3) варіабельної області важкого ланцюга з амінокислотною послідовністю, вибраною з групи, що складається з SEQ ID NO: 114, 360 і 376; і (b) CDR легкого ланцюга (LCDR1, LCDR2 і LCDR3) варіабельної області легкого ланцюга з амінокислотною послідовністю, вибраною з групи, що складається з SEQ ID NO: 122, 368 і 384.
3. Виділене антитіло людини або його антигензв'язувальний фрагмент, що специфічно зв'язується зі зрілим білком GDF8 людини дикого типу, який містить SEQ ID NO: 340, причому антитіло або його антигензв'язувальний фрагмент містить (а) CDR важкого ланцюга (HCDR1, HCDR2 і HCDR3) варіабельної області важкого ланцюга з амінокислотною послідовністю, вибраною з SEQ ID NО: 114, 360 або 376; і (b) CDR легкого ланцюга (LCDR1, LCDR2 і LCDR3) варіабельної області легкого ланцюга з амінокислотною послідовністю, вибраною з SEQ ID NO: 122, 368 або 384.
4. Виділене антитіло або його антигензв'язувальний фрагмент за будь-яким з попередніх пунктів, що містить амінокислотні послідовності CDR важкого і легкого ланцюгів (HCDR1/HCDR2/HCDR3/LCDR1/LCDR2/LCDR3), вибрані з групи, яка складається з SEQ ID NO: 116/118/120/124/126/128, 362/364/366/370/372/374 і 378/380/382/386/388/390.
5. Виділене антитіло або його антигензв'язувальний фрагмент за будь-яким з попередніх пунктів, містить пару амінокислотних послідовностей варіабельних доменів важкого і легкого ланцюгів (HCVR/LCVR), вибрану з групи, що складається з SEQ ID NO: 114/122, 360/368 і 376/384.
6. Виділене антитіло або його антигензв'язувальний фрагмент за будь-яким з попередніх пунктів, де антитіло аби його антигензв'язувальний фрагмент не зв'язується з лінійним епітопом всередині зрілого білка GDF8 дикого типу (SEQ ID NO: 340).
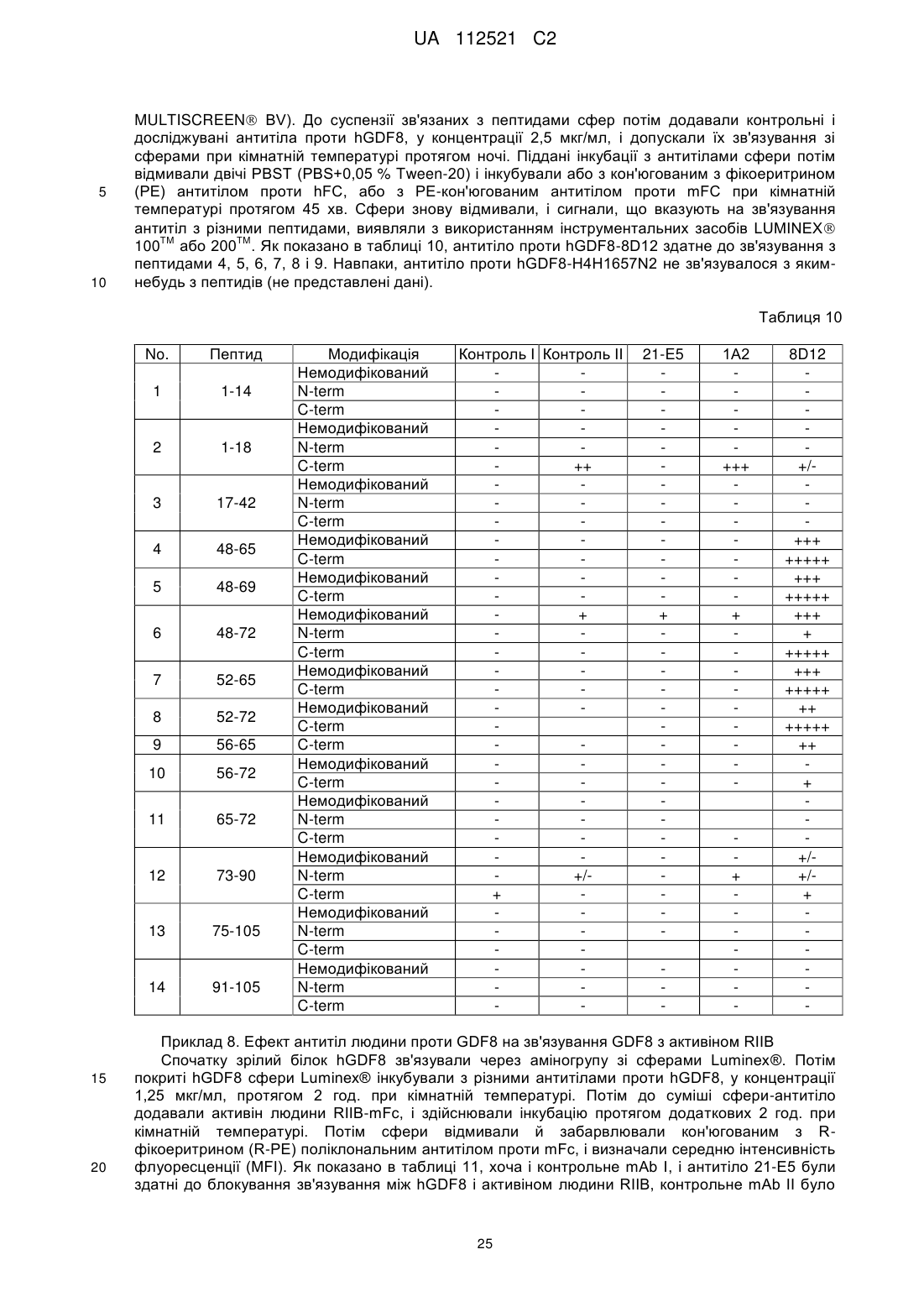
7. Виділене антитіло або його антигензв'язувальний фрагмент за будь-яким з попередніх пунктів, де антитіло або його антигензв'язувальний фрагмент не зв'язується з виділеними пептидами GDF8, які мають амінокислотні послідовності з амінокислот 1-14, 1-18, 17-42, 48-65, 48-69, 48-72, 52-65, 52-72, 56-65, 56-72, 65-72, 73-90, 75-105 і 91-105 SEQ ID NO: 340.
8. Виділене антитіло людини або його антигензв'язувальний фрагмент, що зв'язується з тим же епітопом зрілого білка GDF8 людини дикого типу (SEQ ID NO: 340), що і контрольне виділене антитіло або антигензв'язувальний фрагмент за будь-яким з пп. 1-7, де вказане виділене людське антитіло або антигензв'язувальний фрагмент містить: (а) HCDRl/HCDR2/HCDR3 амінокислотні послідовності, вибрані з групи, яка складається з SEQ ІD NО: 116/118/120; 362/364/366 і 378/380/382; і (b) LCDR1/LCDR2/LCDR3 амінокислотні послідовності, вибрані з групи, яка складається з SEQ ID NO: 124/126/128; 370/372/374 і 386/388/390.
9. Виділене антитіло людини або його антигензв'язувальний фрагмент, що конкурує за зв'язування зі зрілим білком GDF8 людини дикого тину (SEQ ID NO: 340) з контрольним виділеним aнтитілом або антигензв'язувальним фрагментом за будь-яким з пп. 1-7, де вказане виділене людське антитіло або антигензв'язувальний фрагмент містить: (а) HCDR1/HCDR2/НCDR3 амінокислотні послідовності, вибрані з групи, яка складається з SEQ ID NО: 116/118/120; 362/364/366 і 378/380/382; і (b) LCDR1/LCDR2/LCDR3 амінокислотні послідовності, вибрані з групи, яка складається з SEQ ID NO: 124/126/128; 370/372/374 і 386/388/390.
10. Фармацевтична композиція, яка містить антитіло або антигензв'язувальний фрагмент за будь-яким з пп. 1-9 і фармацевтично прийнятний носій або розріджувач.
11. Виділене антитіло або антигензв'язувальний фрагмент за будь-яким з пп. 1-9, або фармацевтична композиція за п. 10, для застосування в медицині.
12. Виділене антитіло або антигензв'язувальний фрагмент за будь-яким з пп. 1-9, або фармацевтична композиція за п. 12, що використовується для лікування пацієнта, який страждає на захворювання або порушення, що піддається лікуванню за допомогою інгібування активності GDF8, у якого діагностоване таке захворювання або порушення, або який має ризик виникнення такого захворювання або порушення.
13. Виділене антитіло або антигензв'язувальний фрагмент, або фармацевтична композиція за п. 12, де захворюванням або порушенням, що піддається лікуванню за допомогою інгібування активності GDF8, є захворювання або порушення, вибране із групи, яка складається із саркопенії, кахексії, м'язової атрофії внаслідок недовантаження або знерухомлення, м'язового виснаження, м'язової атрофії, раку, артриту, розсіяного склерозу, бічного аміотрофічного склерозу, хвороби Паркінсона, остеопорозу, остеоартриту, остеопенії, переломів кісток, включаючи перелом тазостегнового суглоба, метаболічних синдромів, гомеостазу глюкози і чутливості до інсуліну.
14. Застосування виділеного антитіла або антигензв'язувального фрагмента за будь-яким з пп. 1-9, або фармацевтичної композиції за п. 10, для одержання лікарського засобу для лікування пацієнта, який страждає на захворювання або порушення, що піддається лікуванню за допомогою інгібування активності GDF8, у якого діагностоване таке захворювання або порушення, або який має ризик розвитку такого захворювання або порушення.
15. Застосування за п. 14, де захворюванням або порушенням, що піддається лікуванню за допомогою інгібування активності GDF8, є захворювання або порушення, вибране з групи, яка складається із саркопенії, кахексії, м'язової атрофії внаслідок недовантаження або знерухомлення, м'язового виснаження, м'язової атрофії, раку, артриту, розсіяного склерозу, бічного аміотрофічного склерозу, хвороби Паркінсона, остеопорозу, остеоартриту, остеопенії, переломів кісток, включаючи перелом тазостегнового суглоба, метаболічних синдромів,
гомеостазу глюкози і чутливості до інсуліну.
16. Терапевтичний спосіб інгібування активності GDF8 у пацієнта, який включає введення потребуючому цього пацієнту виділеного антитіла або антигензв'язувального фрагмента за будь-яким з пп. 1-9, або фармацевтичної композиції за п. 10.
17. Спосіб за п. 16, де пацієнт страждає на захворювання або порушення, що вибране із групи, яка складається із саркопенії, кахексії, м'язової атрофії внаслідок недовантаження, знерухомлення, м'язового виснаження, м'язової атрофії, раку, артриту, розсіяного склерозу, бічного аміотрофічного склерозу, хвороби Паркінсона, остеопорозу, остеоартриту, остеопенії, переломів кісток, включаючи перелом тазостегнового суглоба, метаболічних синдромів, гомеостазу глюкози і чутливості до інсуліну.
Текст
Реферат: Винахід стосується виділених антитіл людини або гуманізованих антитіл, або їх антигензв'язувальних фрагментів, що специфічно зв'язуються з фактором 8 росту і диференціації (GDF8) і блокують активність GDF8, терапевтичних способів лікування станів або порушень, які послабляються або поліпшуються в результаті інгібування GDF8. UA 112521 C2 (12) UA 112521 C2 UA 112521 C2 5 10 15 20 25 30 35 40 45 50 55 60 ГАЛУЗЬ ТЕХНІКИ Даний винахід стосується антитіл і їх антигензв'язувальних фрагментів, які є специфічними відносно фактора 8 росту і диференціації (GDF8). ПЕРЕДУМОВИ СТВОРЕННЯ ВИНАХОДУ Фактор 8 росту і диференціації (GDF8), також відомий як міостатин, є членом суперсімейства факторів росту TGFβ. GDF8 є негативним регулятором маси скелетних м'язів, високою мірою експресованим у ході розвитку, і скелетних м'язів дорослих. GDF8 є високо консервативним для видів, і амінокислотні послідовності GDF8 миші і людини є ідентичними (нуклеотидна послідовність і амінокислотна послідовність GDF8 людини представлені в SEQ ID NO:338-339) (McPherron et al. 1977, Nature, 387:83-90). Ряд захворювань людини, наприклад м'язова дистрофія, м'язова атрофія, синдром виснаження м'язової маси, саркопенія і кахексія, супроводжуються зменшенням або ушкодженням м'язової тканини, і інгібітори GDF8 можуть використовуватися для лікування цих захворювань або порушень. Антитіла проти GDF8 і способи лікування описані, наприклад, у патентах США №№ 6096506, 7320789 і 7807159, у заявках WO 2007/047112 і WO 2005/094446, у заявці на патент США № 2007/0087000, у патенті США № 7261893 і в заявці WO 2010/070094. КОРОТКИЙ ВИКЛАД СУТІ ВИНАХОДУ Даний винахід стосується антитіл людини або гуманізованих антитіл і антигензв'язувальних фрагментів антитіл людини або гуманізованих антитіл, що специфічно зв'язуються з фактором 8 росту і диференціації (GDF8). Ці антитіла характеризуються зв'язуванням з GDF8 з високою афінністю і здатністю до нейтралізації активності GDF8. Антитіла можуть бути повнорозмірними (наприклад, антитілом IgG1 або IgG4) або можуть містити тільки антигензв'язувальну частину (наприклад, Fab-, F(ab')2- або scFv-фрагмент), і можуть бути модифіковані для надання впливу на виконувані функції, наприклад, для виключення залишкових ефекторних функцій (Reddy et al. (2000), J. Immunol. 164: 1925-1933). В одному з варіантів здійснення антитіло за даним винаходом містить амінокислотну послідовність варіабельної області важкого ланцюга (HCVR), вибрану з групи, що складається з SEQ ID NO:2, 18, 34, 50, 66, 82, 98, 114, 130, 146, 162, 178, 194, 210, 226, 242, 258, 274, 290, 306, 360 і 376, або значною мірою ідентичну їй послідовність. В одному з варіантів здійснення антитіло за даним винаходом містить амінокислотну послідовність варіабельної області легкого ланцюга (LCVR), вибрану з групи, що складається з SEQ ID NO:10, 26, 42, 58, 74, 90, 106, 122, 138, 154, 170, 186, 202, 218, 234, 250, 266, 282, 298, 314, 322, 368 і 384, або значною мірою ідентичну їй послідовність. В одному з варіантів здійснення антитіло за даним винаходом містить амінокислотну послідовність HCVR і амінокислотну послідовність LCVR, причому послідовності пар HCVR/LCVR вибрані з групи, що складається з SEQ ID NO:2/10, 18/26, 34/42, 50/58, 66/74, 82/90, 98/106, 114/122, 130/138, 146/154, 162/170, 178/186, 194/202, 210/218, 226/234, 242/250, 258/266, 274/282, 290/298, 306/314, 114/322, 360/368 і 376/384. Відмітною ознакою даного винаходу є також антитіло людини або гуманізоване антитіло або антигензв'язувальний фрагмент антитіла, що містить амінокислотну послідовність ділянки 3, що визначає компліментарність, важкого ланцюга (HCDR3) і амінокислотну послідовність CDR3 легкого ланцюга (LCDR3), причому амінокислотна послідовність HCDR3 вибрана з групи, що складається з SEQ ID NO:8, 24, 40, 56, 72, 88, 104, 120, 136, 152, 168, 184, 200, 216, 232, 248, 264, 280, 296, 312, 366 і 382, або значною мірою ідентичної їй послідовності, а амінокислотна послідовність LCDR3 вибрана з групи, що складається з SEQ ID NO:16; 32, 48, 64, 80, 96, 112, 128, 144, 160, 176, 192, 208, 224, 240, 256, 272, 288, 304, 320, 328, 374 і 390, або значною мірою ідентичної їй послідовності. В іншому варіанті здійснення антитіло або його фрагмент містить пару амінокислотних послідовностей HCDR3/LCDR3, вибрану з групи, що складається з SEQ ID NO:8/16, 24/32, 40/48, 56/64, 72/80, 88/96, 104/112, 120/128, 136/144, 152/160, 168/176, 184/192, 200/208, 216/224, 232/240, 248/256, 264/272, 280/288, 296/304, 312/320, 120/328, 366/374 і 382/390. У відповідному варіанті здійснення антитіло або його фрагмент, крім того, містить амінокислотні послідовності CDR1 важкого ланцюга (HCDR1) і CDR2 важкого ланцюга (HCDR2) і амінокислотні послідовності CDR1 легкого ланцюга (LCDR1) і CDR2 легкого ланцюга (LCDR2), причому амінокислотна послідовність HCDR1 вибрана з групи, що складається з SEQ ID NO:4, 20, 36, 52, 68, 84, 100, 116, 132, 148, 164, 180, 196, 212, 228, 244, 260, 276, 292, 308, 362 і 378, або значною мірою ідентичної їй послідовності; амінокислотна послідовність HCDR2 вибрана з групи, що складається з SEQ ID NO:6, 22, 38, 54, 70, 86, 102,118, 134, 150, 166, 182, 198, 214, 230, 246, 262, 278, 294, 310, 364 і 380, або значною мірою ідентичної їй послідовності; 1 UA 112521 C2 5 10 15 20 25 30 35 40 45 50 55 60 амінокислотна послідовність LCDR1 вибрана з групи, що складається з SEQ ID NO:12, 28, 44, 60, 76, 92, 108, 124, 140, 156, 172, 188, 204, 220, 236, 252, 268, 284, 300, 316, 324, 370 і 386, або значною мірою ідентичної їй послідовності; а амінокислотна послідовність LCDR2 вибрана з групи, що складається з SEQ ID NO:14, 30, 46, 62, 78, 94, 110, 126, 142, 158, 174, 190, 206, 222, 238, 254, 270, 286, 302, 318, 326, 372 і 388, або значною мірою ідентичної їй послідовності. В іншому варіанті здійснення HCDR1, HCDR2 і HCDR3 вибрані з групи, що складається з SEQ ID NO:36/38/40, 116/118/120, 228/230/232, 362/364/366 і 378/380/382; а LCDR1, LCDR2 і LCDR3 вибрані з групи, що складається з SEQ ID NO:44/46/48, 124/126/128, 236/238/240, 370/372/374 і 386/388/390. Проте, в іншому варіанті здійснення CDR важкого і легкого ланцюгів вибрана з групи, що складається з SEQ ID NO:36/38/40/44/46/48 (наприклад, 21-E5), 116/118/120/124/126/128 (наприклад, 8D12), 228/230/232/236/238/240 (наприклад, 1A2), 362/364/366/370/372/374 (наприклад, H4H1657N2) і 378/380/382/386/388/390 (наприклад, H4H1669P). У відповідному варіанті здійснення даний винахід включає антитіло або антигензв'язувальний фрагмент антитіла, що специфічно зв'язується з GDF8, причому антитіло або фрагмент містить CDR-домени важкого і легкого ланцюгів, які містяться усередині послідовностей варіабельних доменів важкого і легкого ланцюгів, вибраних із групи, що складається з SEQ ID NO:2/10, 18/26, 34/42, 50/58, 66/74, 82/90, 98/106, 114/122, 130/138, 146/154, 162/170, 178/186, 194/202, 210/218, 226/234, 242/250, 258/266, 274/282, 290/298, 306/314, 114/322, 360/368 і 376/384. Способи і методи ідентифікації CDR усередині амінокислотних послідовностей HCVR і LCVR добре відомі в даній галузі і можуть використовуватися для ідентифікації CDR усередині зазначених амінокислотних послідовностей HCVR і/або LCVR, розкритих у даному описі. Правила, що наводяться як приклад, які можуть використовуватися для визначення границь CDR, включають, наприклад, визначення по Kabat, визначення по Chothia і визначення у випадку AbМ. Загалом, визначення по Kabat ґрунтується на варіабельності послідовностей, визначення по Chothia ґрунтується на місцезнаходженні структурних петльових ділянок, а визначення у випадку AbМ є компромісом між підходами Kabat і Chothia. Див., наприклад, Kabat, "Sequences of Proteins of Immunological Interest, " National Institutes of Health, Bethesda, Md. (1991); AI-Lazikani et al. J. Mol. Biol. 273:927-948 (1997); і Martin et al. Proc. Natl. Acad. Sci. USA, 86:9268-9272 (1989). Наявні також загальнодоступні бази даних для ідентифікації послідовностей CDR усередині антитіла. Даний винахід також стосується молекул нуклеїнових кислот, що кодують антитіла або антигензв'язувальні фрагменти за даним винаходом. Даний винахід також стосується рекомбінантних експресійних векторів, які несуть кодуючі антитіла нуклеїнові кислоти за даним винаходом, і клітини-хазяїни, у які такі вектори були введені, так само як і способи одержання антитіл за даним винаходом шляхом культивування клітин-хазяїнів за даним винаходом. В одному з варіантів здійснення антитіло за даним винаходом містить HCVR, кодовану нуклеотидною послідовністю, вибраною з групи, що складається з SEQ ID NO:1, 17, 33, 49, 65, 81, 97, 113, 129, 145, 161, 177, 193, 209, 225, 241, 257, 273, 289, 305, 359 і 375, або значною мірою подібною з нею послідовністю, гомологічною їй принаймні на 95 %. В одному з варіантів здійснення антитіло за даним винаходом містить LCVR, кодовану нуклеотидною послідовністю, вибраною з групи, що складається з SEQ ID NO:9, 25, 41, 57, 73, 89, 105, 121, 137, 153, 169, 185, 201, 217, 233, 249, 265, 281, 297, 313, 321, 367 і 383, або значною мірою подібною з нею послідовністю, гомологічною їй принаймні на 95 %. В одному з варіантів здійснення антитіло за даним винаходом містить амінокислотну послідовність HCVR і амінокислотну послідовність LCVR, причому послідовності пар HCV/LCVR кодуються парами молекул нуклеїнових кислот, вибраними з групи, що складається з SEQ ID NO:1/9, 17/25, 33/41, 49/57, 65/73, 81/89, 97/105, 113/121, 129/137, 145/153, 161/169, 177/185, 193/201, 209/217, 225/233, 241/249, 257/265, 273/281, 289/297, 305/313, 113/321, 359/367 і 375/383. Відмітною ознакою даного винаходу є також антитіло людини або гуманізоване антитіло або фрагмент антитіла, що містить HCDR3, кодовану нуклеотидною послідовністю, вибраною з групи, що складається з SEQ ID NO:7, 23, 39, 55, 71, 87, 103, 119, 135, 151, 167, 183, 199, 215, 231, 247, 263, 279, 295, 311, 365 і 381, або значною мірою подібною з нею послідовністю, гомологічною їй на принаймні 95 %, і LCDR3, кодовану нуклеотидною послідовністю, вибраною з групи, що складається з SEQ ID NO:15, 31, 47, 63, 79, 95, 111, 127, 143, 159, 175, 191, 207, 223, 239, 255, 271, 287, 303, 319, 327, 373 і 389, або значною мірою подібною з нею послідовністю, гомологічною їй на принаймні 95 %. В одному з варіантів здійснення сукупність HCDR3/LCDR3 кодується парою нуклеотидних послідовностей, вибраною з групи, що складається з SEQ ID NO:7/15, 23/31, 39/47, 55/63, 71/79, 87/95, 103/111, 119/127, 135/143, 151/159, 167/175, 183/191, 2 UA 112521 C2 5 10 15 20 25 30 35 40 45 50 55 60 199/207, 215/223, 231/239, 247/255, 263/271, 279/287, 295/303, 311/319, 119/327, 365/373 і 381/389. У відповідному варіанті здійснення антитіло або фрагмент антитіла, крім того, містить HCDR1 і HCDR2 і LCDR1 і LCDR2, причому HCDR1 кодується нуклеотидною послідовністю, вибраною з групи, що складається з SEQ ID NO:3, 19, 35, 51, 67, 83, 99, 115, 131, 147, 163, 179, 195, 211, 227, 243, 259, 275, 291, 307, 361 або 377, або значною мірою подібною з нею послідовністю, гомологічною їй на принаймні 95 %, HCDR2 кодується нуклеотидною послідовністю, вибраною з групи, що складається з SEQ ID NO:5, 21, 37, 53, 69, 85, 101, 117, 133, 149, 165, 181, 197, 213, 229, 245, 261, 277, 293, 309, 363 і 379, або значною мірою подібною з нею послідовністю, гомологічною їй на принаймні 95 %, LCDR1 кодується нуклеотидною послідовністю, вибраною з групи, що складається з SEQ ID NO:11, 27, 43, 59, 75, 91, 107, 123, 139, 155, 171, 187, 203, 219, 235, 251, 267, 283, 299, 315, 323, 369 і 385, або значною мірою подібною з нею послідовністю, гомологічною їй принаймні на 95 %, а LCDR2 кодується нуклеотидною послідовністю, вибраною з групи, що складається з SEQ ID NO:13, 29, 45, 61, 77, 93, 109, 125, 141, 157, 173, 189, 205, 221, 237, 253, 269, 285, 301, 317, 325, 371 і 387, або значною мірою подібною з нею послідовністю, гомологічною їй на принаймні 95 %. В одному з варіантів здійснення антитіло або фрагмент антитіла містить CDR важкого і легкого ланцюгів, кодовані сукупностями послідовностей нуклеїнових кислот SEQ ID NO:35/37/39/43/45/47, 115/117/119/123/125/127, 227/229/231/235/237/239, 361/363/365/369/371/373 або 377/379/381/385/387/389. Відмітною ознакою даного винаходу служить також виділене антитіло або фрагмент антитіла, що специфічно зв'язується з GDF8, яке(ий) містить CDR важкого і легкого ланцюгів, вибрані з групи, що складається з (a) HCDR1, що містить амінокислотну послідовність формули 1 2 3 4 5 6 7 8 1 2 3 X -X -X -X -X -X -X -X (SEQ ID NO:329), де X являє собою Gly; X являє собою Phe; X являє 4 5 6 7 собою Thr; X являє собою Phe; X являє собою Ser; X являє собою Ala або Ser; X являє 8 собою Phe або Tyr; X являє собою Gly або Ala; (b) HCDR2, що містить амінокислотну 1 2 3 4 5 6 7 8 1 2 послідовність формули X -X -X -X -X -X -X -X (SEQ ID NO:330), де X являє собою Ile; X являє 3 4 5 собою Gly або Ser; X являє собою Tyr або Gly; X являє собою Ser або Asp; X являє собою Gly; 6 7 8 X являє собою Gly; X являє собою Ser або Asn; а X являє собою Ala або Glu; (c) HCDR3, що 1 2 3 4 5 6 7 8 9 10 11 12 13 14 містить амінокислотну послідовність формули X -X -X -X -X -X -X -X -X -X -X -X -X -X (SEQ 1 2 3 ID NO:331), де X являє собою Ser або Ala; X являє собою Thr або Lys; X являє собою Asp або 4 5 6 7 Ile; X являє собою Gly або Ser; X являє собою Ala або His; X являє собою Trp або Tyr; X 8 9 10 являє собою Lys або Asp; X являє собою Met або Ile; X являє собою Ser або Leu; X являє 11 12 13 собою Gly або Ser; X являє собою Leu або Gly; X являє собою Asp або Met; X являє собою 14 Val або Asp; X являє собою Val або відсутній; і (d) LCDR1, що містить амінокислотну 1 2 3 4 5 6 1 2 послідовність формули X -X -X -X -X -X (SEQ ID NO:332), де X являє собою Gln; X являє 3 4 5 6 собою Asp або Gly; X являє собою Ile; X являє собою Ser; X являє собою Asp або Asn; а X 1 2 3 являє собою Tyr або Trp; (e) LCDR2, що містить амінокислотну послідовність формули X -X -X 1 2 3 (SEQ ID NO:333), де X являє собою Thr або Ala; X являє собою Thr або Ala; а X являє собою 1 2 3 4 5 6 7 Ser; і (f) LCDR3-ділянки, що містить амінокислотну послідовність формули X -X -X -X -X -X -X 8 9 1 2 3 X -X (SEQ ID NO:334), де X являє собою Gln; X являє собою Lys або Gln; X являє собою Ala 4 5 6 7 або Tyr; X являє собою Asp або Asn; X являє собою Ser; X являє собою Ala або Phe; X являє 8 9 собою Pro; X являє собою Leu; і X являє собою Thr. Методика визначення вищевказаних консенсусних послідовностей (SEQ ID NO:329-334) показана на фіг. 4A і 4B. Відмітною ознакою даного винаходу є також повністю людське антитіло або гуманізоване антитіло або фрагмент антитіла, що зв'язується з CDF8 з афінністю (що виражається у виді константи дисоціації, "KD"), яка складає приблизно 1 нМ або менше, як визначено за допомогою TM аналізу з використанням поверхневого плазмонного резонансу (наприклад, BIACORE ). У деяких варіантах здійснення антитіло за даним винаходом демонструє KD, що складає приблизно 700 пМ або менше; приблизно 500 пМ або менше; приблизно 320 пМ або менше; приблизно 160 пМ або менше; приблизно 100 пМ або менше; приблизно 50 пМ або менше; приблизно 10 пМ або менше або приблизно 5 пМ або менше. В одному з варіантів здійснення даний винахід стосується повністю людського антитіла або гуманізованого моноклонального антитіла (mAb), яке специфічно зв'язується з GDF8 людини і інгібує його, і демонструє IC50, що складає менше або дорівнює приблизно 10 нМ; приблизно 5 нМ або менше; приблизно 3 нМ або менше; приблизно 2 нМ або менше; приблизно 1 нМ або менше; приблизно 500 пМ або менше або приблизно 200 пМ або менше, як визначено за допомогою дослідження індукованої GDF8 люциферазної активності. Як показано в експериментальній частині нижче, деякі з антитіл проти GDF8 за даним винаходом блокують 3 UA 112521 C2 5 10 15 20 25 30 35 40 45 50 55 60 активність близькоспоріднених білків, таких як GDF11, з набагато більшою IC 50, ніж GDF8, у біологічному дослідженні люциферазної активності. В одному з варіантів здійснення даний винахід стосується антитіла або антигензв'язувального фрагмента антитіла, що демонструє IC 50 у випадку блокування активності GDF11, яка перевищує в принаймні приблизно 10 разів, принаймні приблизно 50 разів, принаймні приблизно 100 разів, принаймні приблизно 200 разів, принаймні приблизно 500 разів, принаймні приблизно 1000 разів або принаймні приблизно 1500 разів таку у випадку блокування активності GDF8. Даний винахід стосується антитіла проти GDF8, яке характеризується зміненим профілем глікозилування. У варіантах використання може бути ефективною модифікація для видалення небажаних сайтів глікозилування, або антитіло, у якому відсутня складова у вигляді фукози, що присутня в олігосахаридному ланцюзі, наприклад, для посилення функції антитілозалежної клітинно-опосередкованої цитотоксичності (ADCC) (див. Shield et al. (2002), JBC, 277:26733). У випадку інших варіантів використання можна змінити галактозилювання для зміни комплементзалежної цитотоксичності (CDC). Даний винахід стосується антитіл проти GDF8, які зв'язуються зі специфічними епітопами GDF8 і здатні до блокування біологічної активності GDF8. У першому варіанті здійснення антитіло за даним винаходом зв'язується з епітопом зрілого білка GDF8 (SEQ ID NO:340) у межах амінокислот з приблизно 1 до приблизно 109; з приблизно 1 до приблизно 54; з приблизно 1 до приблизно 44; з приблизно 1 до приблизно 34; з приблизно 1 до приблизно 24 і з приблизно 1 до приблизно 14. В другому варіанті здійснення антитіло за даним винаходом зв'язується з одним або більше епітопами зрілого білка GDF8 (SEQ ID NO:340) у межах амінокислот з приблизно 35 до приблизно 109; з приблизно 45 до приблизно 109; з приблизно 55 до приблизно 109; з приблизно 65 до приблизно 109; з приблизно 75 до приблизно 109; з приблизно 85 до приблизно 109; з приблизно 92 до приблизно 109 або з приблизно 95 до приблизно 109. У третьому варіанті здійснення антитіло або антигензв'язувальний фрагмент антитіла зв'язується в епітопі зрілого білка GDF8 людини з приблизно амінокислотного залишку 48 до приблизно 72; з приблизно 48 до приблизно 69; з приблизно 48 до приблизно 65; з приблизно 52 до приблизно 72; з приблизно 52 до приблизно 65 або з приблизно 56 до приблизно 65. У відповідному варіанті здійснення даний винахід стосується антитіла або його антигензв'язувального фрагмента, що конкурує за специфічне зв'язування з GDF8 з іншим антитілом, яке містить комбінацію амінокислотних послідовностей HCDR1/HCDR2/HCDR3/LCDR1/LCDR2/LCDR3-SEQ ID NO:36/38/40/44/46/48, 116/118/120/124/126/128, 228/230/232/236/238/240, 362/364/366/370/372/374 або 378/380/382/386/388/390. В одному з варіантів здійснення антитіло або антигензв'язувальний фрагмент за даним винаходом конкурує за специфічне зв'язування з GDF8 з іншим антитілом, яке містить пари амінокислотних послідовностей HCVR/LCVR-SEQ ID NO:2/10, 18/26, 34/42, 50/58, 66/74, 82/90, 98/106, 114/122, 130/138, 146/154, 162/170, 178/186, 94/202, 210/218, 226/234, 242/250, 258/266, 274/282, 290/298, 306/314, 114/322, 360/368 або 376/384. Проте, в іншому пов'язаному з цим варіанті здійснення даний винахід стосується антитіла або його антигензв'язувального фрагмента, що розпізнає епітоп GDF8, який розпізнається іншим антитілом, що містить комбінацію амінокислотних послідовностей HCDR/LCDR-SEQ ID NO:36/38/40/44/46/48, 116/118/120/124/126/128, 228/230/232/236/238/240, 362/364/366/370/372/374 або 378/380/382/386/388/390. В одному з варіантів здійснення антитіло або антигензв'язувальний фрагмент за даним винаходом розпізнає епітоп GDF8, який розпізнається іншим антитілом, що містить пари амінокислотних послідовностей HCVR/LCVRSEQ ID NO:2/10, 18/26, 34/42, 50/58, 66/74, 82/90, 98/106, 114/122, 130/138, 146/154, 162/170, 178/186, 194/202, 210/218, 226/234, 242/250, 258/266, 274/282, 290/298, 306/314, 114/322, 360/368 або 376/384. Даний винахід також стосується композиції, яка містить рекомбінантне антитіло людини або гуманізоване антитіло проти GDF8 людини і прийнятний носій. Даний винахід, крім того, стосується векторів і клітин-хазяїнів, що містять вектори, які містять молекули нуклеїнових кислот, що кодують антитіло людини проти GDF8 за даним винаходом, а також способів одержання цих нових антитіл, які включають вирощування клітини-хазяїна, яка містить нуклеїнову кислоту, що кодує антитіло проти GDF8 за даним винаходом або фрагмент антитіла, в умовах, що дають можливість одержати білок і виділити одержаний таким чином білок. Даний винахід також стосується способів інгібування активності GDF8 з використанням антитіла або його антигензв'язувальної частини за даним винаходом. В одному з варіантів здійснення спосіб включає введення антитіла або фрагмента антитіла за даним винаходом людині, що страждає на порушення, яке ослабляється в результаті інгібування активності GDF8. 4 UA 112521 C2 5 10 15 20 25 30 35 40 45 50 55 60 У переважних варіантах здійснення людина, що одержує лікування антитілом або фрагментом антитіла за даним винаходом, має потребу в поліпшення гомеостазу глюкози, зменшенні жирової маси, збільшенні чутливості до інсуліну, поліпшенні функціонування нирок і/або зменшенні жирового відкладення. Антитіло або фрагмент антитіла за даним винаходом можна використовувати для лікування, профілактики або пригнічення захворювання або стану, що характеризується зменшенням кісткової маси, який включає остеопороз, остеопенію, остеоартрит і переломи кістки, лікування метаболічного синдрому, протидії виснаженню м'язової маси в результаті тривалого введення глюкокортикоїду або стероїдного гормону або зменшенню м'язової маси, пов'язаному з м'язовою дистрофією, м'язовою атрофією, синдромом виснаження м'язової маси, саркопенією і кахексією. Інші варіанти і переваги стануть очевидними в результаті ознайомлення з наступним докладним описом. КОРОТКИЙ ОПИС КРЕСЛЕНЬ Фіг. 1. Імуноблот обмеженого протеолізу GDF8 людини за допомогою протеїнази K. Гелі являли собою 18 % SDS-ПААГ для електрофорезу в невідновних умовах із завантаженням 0,2 мкг GDF8 на кожну доріжку і використанням 2 мкг/мл будь-якого з антитіл - контролю I (A), 1A2 (B) або 21-E9 (C). Доріжка 1: час розщеплення - 10 хв., 1 мкг GDF8, 0 мкг протеїнази K; доріжка 2: час розщеплення - 10 хв., 1 мкг GDF8, 1 мкг протеїнази K; доріжка 3: час розщеплення - 10 хв., 1 мкг GDF8, 6 мкг протеїнази K; доріжка 4: час розщеплення - 45 хв., 1 мкг GDF8, 0 мкг протеїнази K; доріжка 5: час розщеплення - 45 хв., 1 мкг GDF8, 1 мкг протеїнази K; доріжка 6: час розщеплення - 45 хв., 1 мкг GDF8, 6 мкг протеїнази K. Фіг. 2. Імуноблот обмеженого протеолізу GDF8 людини з використанням великих доз протеїнази K. Гелі являли собою 18 % SDS-ПААГ для електрофорезу в невідновних умовах із завантаженням 0,2 мкг GDF8 на кожну доріжку і використанням 2 мкг/мл будь-якого з антитіл контролю I (A) або 1A2 (B). Доріжка 1: час розщеплення - 16 год., 0 мкг GDF8, 96 мкг протеїнази K; доріжка 2: час розщеплення - 16 год., 4 мкг GDF8, 0 мкг протеїнази K; доріжка 3: час розщеплення - 16 год., 4 мкг GDF8, 24 мкг протеїнази K; доріжка 4: час розщеплення - 16 год., 4 мкг GDF8, 96 мкг протеїнази K; доріжка 5: час розщеплення - 1 год., 4 мкг GDF8, 24 мкг протеїнази K; доріжка 6: час розщеплення - 1 год., 4 мкг GDF8, 96 мкг протеїнази K; доріжка 7: час розщеплення - 10 хв., 0 мкг GDF8, 0 мкг протеїнази K; доріжка 8: час розщеплення - 10 хв., 4 мкг GDF8, 24 мкг протеїнази K. Фіг. 3A і 3B. Графіки, що демонструють відсоток від вихідних рівнів глюкози в динаміці за часом у мишей, підданих перевірці на чутливість до інсуліну до (фіг. 3A) і після (фіг. 3B) лікування антитілом. Фіг. 4A і 4B. Сполучення амінокислотних послідовностей CDR важкого ланцюга (фіг. 4A) і CDR легкого ланцюга (фіг. 4B) антитіл, що наводяться як приклад, проти GDF8 H4H1657N2 і H4H1669P, що демонструє консенсусні послідовності, загальні для цих послідовностей. ДОКЛАДНИЙ ОПИС ЗА ДАНИМ ВИНАХОДОМ Перед описом способів за даним винаходом слід зазначити, що даний винахід не обмежується описуваними конкретними способами й експериментальними умовами, і такі способи й умови можуть змінюватися. Також варто розуміти, що використовувана в даному описі термінологія служить для опису конкретних варіантів здійснення і не призначена для обмеження, оскільки обсяг даного винаходу обмежений лише прикладеною формулою винаходу. Використовувані в цьому описі винаходу і прикладеній формулі винаходу форми однини включають вказування на множину, якщо тільки контекст явно не має на увазі інше. Таким чином, наприклад, вказування на "спосіб" включає один або більше способів і/або одну або більше операцій типу, описуваного в даному документі, і/або які стануть очевидні кваліфікованим у даній галузі фахівцям після прочитання цього опису винаходу. Якщо не зазначене інше, усі технічні і наукові терміни, використовувані в даному описі, мають значення, однакове з тим, у якому вони звичайно розуміються середнім фахівцем в галузі, до якої належить даний винахід. Використовуваний термін "приблизно", при використанні стосовно конкретного викладеного числового значення, означає, що це значення може відрізнятися від викладеного значення на більше ніж 1 %. Наприклад, використовуваний в даному описі вираз "приблизно 100" включає 99 і 101, і всі значення між ними (наприклад, 99,1, 99,2, 99,3, 99,4 і т. д.). Хоча будь-які способи і матеріали, аналогічні розкритим в даному описі способами або матеріалами або еквівалентні їм, можуть використовуватися при здійсненні на практиці або здійсненні даного винаходу, нижче описані переважні способи і матеріали. Визначення 5 UA 112521 C2 5 10 15 20 25 30 35 40 45 50 55 60 "Фактор 8 росту і диференціації людини", "GDF8" і "міостатин" використовуються взаємозамінно для позначення білка, кодованого послідовністю нуклеїнової кислоти SEQ ID NO:338, і білка з амінокислотною послідовністю SEQ ID NO:339 (пропептид) і 340 (зрілий білок). Використовуваний у даному описі термін "антитіло", як передбачається, стосується молекул імуноглобулінів, що містять чотири поліпептидних ланцюги, два важкі (H) ланцюги і два легкі (L) ланцюги, зв'язані за допомогою дисульфідних зв'язків, а також їх мультимерів (наприклад, IgM). Кожен важкий ланцюг містить варіабельну область важкого ланцюга (у даному описі скорочено HCVR або VH) і константну область важкого ланцюга. Константна область важкого ланцюга містить три домени, CH1, CH2 і CH3. Кожен легкий ланцюг містить варіабельну область легкого ланцюга (у даному описі скорочено LCVR або VL) і константну область легкого ланцюга. Константна область легкого ланцюга містить один домен (C L1). VH- і VL-області можна, крім того, підрозділити на ділянки гіперваріабельності, називані ділянками, що визначають комплементарність (CDR), які чергуються з областями, що є більш консервативними, називаними каркасними областями (FR). Кожна VH і VL складається з трьох CDR і чотирьох FR, з розташуванням від амінокінця до карбоксильного кінця в наступному порядку: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. У різних варіантах здійснення даного винаходу FR антитіла проти GDF8 (або його антигензв'язувальної частини) можуть бути ідентичні послідовностям зародкової лінії людини, або вони можуть бути природно або штучно модифікованими. Амінокислотну консенсусну послідовність можна визначити на основі одночасного аналізу двох або більше CDR. Використовуваний у даному описі термін "антитіло" також включає антигензв'язувальні фрагменти повнорозмірних молекул антитіла. Використовувані в даному описі терміни "антигензв'язувальна частина" антитіла, "антигензв'язувальний фрагмент" антитіла і т. п. включають поліпептид або глікопротеїн, що зустрічається в природі, ферментативно одержуваний, синтетичний або одержаний за допомогою методів генетичної інженерії, який специфічно зв'язується з антигеном з утворенням комплексу. Антигензв'язувальні фрагменти антитіла можна одержати, наприклад, з повнорозмірних молекул антитіл, використовуючи будьякі придатні стандартні способи, такі як протеолітичне розщеплення або способи генетичної інженерії для створення рекомбінантних молекул, що включають маніпулювання ДНК, яка кодує варіабельні і необов'язково константні домени, і її експресію. Така ДНК відома і/або легкодоступна, наприклад, з комерційних джерел, бібліотек ДНК (що включають, наприклад, бібліотеки антитіл у фагах), або її можна синтезувати. ДНК можна піддати секвенуванню і хімічному маніпулюванню або маніпулюванню з використанням способів молекулярної біології, наприклад, з метою приведення одного або більше варіабельних і/або константних доменів у придатну конфігурацію або з метою введення кодонів, створення залишків цистеїну, модифікування, додавання або делетування амінокислот і т. д. Необмежувальні приклади антигензв'язувальних фрагментів включають: (i) Fab-фрагменти; (ii) F(ab')2-фрагменти; (iii) Fd-фрагменти; (iv) Fv-фрагменти; (v) одноланцюжкові Fv (scFv) молекули; (vi) dAb-фрагменти; і (vii) мінімальні рекогніційні одиниці, які складаються з амінокислотних залишків, що імітують гіперваріабельну ділянку антитіла (наприклад, виділену ділянку, що визначає комплементарність (CDR)). У використовуваний в даному описі вираз "антигензв'язувальний фрагмент" також включені інші сконструйовані молекули, такі як діатіла, триатіла, тетратіла і міні-тіла. Антигензв'язувальний фрагмент антитіла, як правило, містить принаймні один варіабельний домен. Варіабельний домен може бути будь-якого розміру або з будь-яким складом амінокислот і буде, як правило, містити принаймні одну CDR, що розташована поруч або в рамці зчитування з однією або більше послідовностями каркасних областей. В антигензв'язувальних фрагментах, що містять VH-домен, зв'язаний з VL-доменом, VH- і VL-домени можуть розташовуватися один відносно одного в будь-якому придатному порядку. Наприклад, варіабельна область може бути димерною і містити димери VH-VH, VH-VL або VL-VL. Альтернативно, антигензв'язувальний фрагмент антитіла може містити мономерний VH- або VL-домен. У деяких варіантах здійснення антигензв'язувальний фрагмент антитіла може містити принаймні один варіабельний домен, ковалентно зв'язаний із принаймні одним константним доменом. Необмежувальні конфігурації варіабельних і константних доменів, що наводяться як приклад, які можна знайти в антигензв'язувальному фрагменті антитіла за даним винаходом, включають: (i) VH-CH1; (ii) VH-CH2; (iii) VH-CH3; (iv) VH-CH1-CH2; (v) VH-CH1-CH2-CH3; (vi) VH-CH2CH3; (vii) VH-CL; (viii) VL-CH1; (ix) VL-CH2; (x) VL-CH3; (xi) VL-CH1-CH2; (xii) VL-CH1-CH2-CH3; (xiii) VLCH2-CH3 і (xiv) VL-CL. У випадку будь-якої конфігурації варіабельних і константних доменів, у тому числі будь-якої з перерахованих вище конфігурацій, що наводяться як приклад, варіабельні і константні домени можуть бути зв'язані один з одним або безпосередньо, або за 6 UA 112521 C2 5 10 15 20 25 30 35 40 45 50 55 60 допомогою повнорозмірної або часткової шарнірної або лінкерної області. Шарнірна область може складатися з принаймні 2 (наприклад, 5, 10, 15, 20, 40, 60 або більше) амінокислот, що приводять до гнучкого або напівтвердого з'єднання між сусідніми варіабельними і/або константними доменами в одній поліпептидній молекулі. До того ж, антигензв'язувальний фрагмент антитіла за даним винаходом може включати гомодимер або гетеродимер (або інший мультимер) будь-якої з перерахованих вище конфігурацій варіабельних і константних доменів у нековалентному з'єднанні з одним іншим мономерним VH- або VL-доменом і/або з одним або більше мономерними VH- або VL-доменами (наприклад, за допомогою дисульфідного зв'язку(ів)). Як і у випадку повнорозмірних молекул антитіл, антигензв'язувальні фрагменти можуть бути моноспецифічними або поліспецифічними (наприклад, біспецифічними). Поліспецифічний антигензв'язувальний фрагмент антитіла, як правило, містить принаймні два різних варіабельних домени, причому кожен варіабельний домен здатний до специфічного зв'язування з окремим антигеном або з відмінним епітопом одного і того ж антигену. Будь-який формат поліспецифічного антитіла, у тому числі формати біспецифічного антитіла, що наводяться як приклад, розкриті в даному описі, можна пристосувати для застосування в ситуації антигензв'язувального фрагмента антитіла за даним винаходом, використовуючи стандартні способи, наявні в даній галузі. Антитіла за даним винаходом можуть функціонувати в ході комплементзалежної цитотоксичності (CDC) або антитілозалежної клітинно-опосередкованої цитотоксичності (ADCC). "Комплементзалежна цитотоксичність" (CDC) стосується лізису експресуючих антиген клітин під дією антитіла за даним винаходом в присутності комплементу. "Антитілозалежна клітинноопосередкована цитотоксичність" (ADCC) стосується клітинно-опосередкованої реакції, у ході якої неспецифічні цитотоксичні клітини, експресуючі рецептори Fc (FcR) (наприклад, клітини, що є природними кілерами (NK), нейтрофіли і макрофаги), розпізнають антитіло, що зв'язалося, на поверхні клітини-мішені й у зв'язку з цим приводять до лізису клітини-мішені. CDC і ADCC можна визначити, використовуючи дослідження, що добре відомі і наявні в даній галузі (див., наприклад, патенти США №№ 5500362 і 5821337, і Clynes et al. Proc. Natl. Acad. Sci. (USA) 95:652-656 (1998)). Термін "специфічно зв'язується", або тому подібний, означає, що антитіло або його антигензв'язувальний фрагмент утворює комплекс з антигеном, що є відносно стабільним у фізіологічних умовах. Специфічне зв'язування може характеризуватися константою дисоціації, -6 що складає 1×10 M або менше. Способи визначення того, чи зв'язуються дві молекули специфічно, добре відомі в даній галузі і включають, наприклад, рівноважний діаліз, поверхневий плазмонний резонанс і т. п. Наприклад, антитіло, що "специфічно зв'язується" з GDF8 людини, як використовується в рамках за даним винаходом, включає антитіла, що зв'язуються з GDF8 людини або його частиною (наприклад, пептидом, що містить принаймні 6 амінокислот, що ідуть одна за одною, SEQ ID NO:340), з KD, що складає менше ніж приблизно 1000 нМ, менше ніж приблизно 500 нМ, менше ніж приблизно 300 нМ, менше ніж приблизно 200 нМ, менше ніж приблизно 100 нМ, менше ніж приблизно 90 нМ, менше ніж приблизно 80 нМ, менше ніж приблизно 70 нМ, менше ніж приблизно 60 нМ, менше ніж приблизно 50 нМ, менше ніж приблизно 40 нМ, менше ніж приблизно 30 нМ, менше ніж приблизно 20 нМ, менше ніж приблизно 10 нМ, менше ніж приблизно 5 нМ, менше ніж приблизно 4 нМ, менше ніж приблизно 3 нМ, менше ніж приблизно 2 нМ, менше ніж приблизно 1 нМ або менше ніж приблизно 0,5 нМ, як визначено в дослідженні з використанням поверхневого плазмонного резонансу (див., наприклад, приклад 3, у даному описі). Виділене антитіло, що специфічно зв'язується з GDF8 людини, може, однак, мати перехресну реактивність з іншими антигенами, такими як молекули GDF8 інших видів. Термін антитіло з "високою афінністю" стосується таких антитіл, що здатні до зв'язування з -8 -9 GDF8 з константою дисоціації (KD), що складає приблизно 10 M або менше, приблизно 10 M -10 -11 -12 або менше, приблизно 10 M або менше, приблизно 10 M або менше або приблизно 10 M або менше, як визначено за допомогою поверхневого плазмонного резонансу, наприклад TM BIACORE , або ELISA для визначення афінності в розчині. Під терміном "повільна швидкість дисоціації" або "Koff" мається на увазі, що антитіло -3 -1 піддається дисоціації від GDF8 з константою швидкості, що складає 1×10 сек. або менше, -4 -1 переважно 1×10 сек. або менше, як визначено за допомогою поверхневого плазмонного TM резонансу, наприклад BIACORE . "Нейтралізуюче" або "блокуюче" антитіло, як передбачається, стосується антитіла, зв'язування якого з GDF8 приводить до інгібування біологічної активності GDF8. Це інгібування біологічної активності GDF8 можна оцінити за допомогою визначення одного або більше 7 UA 112521 C2 5 10 15 20 25 30 35 40 45 50 55 індикаторів біологічної активності GDF8. Оцінку цих індикаторів біологічної активності GDF8 можна здійснити за допомогою одного або більше з декількох стандартних in vitro або in vivo досліджень, відомих у даній галузі (дивіться приклади нижче). Повністю людські антитіла проти GDF8, розкриті в даному описі, можуть містити одну або більше замін, вставок і/або делецій амінокислот у каркасних областях і/або CDR-ділянках варіабельних доменів важкого і легкого ланцюгів у порівнянні з відповідними послідовностями зародкової лінії. Такі мутації можна легко визначити за допомогою порівняння амінокислотних послідовностей, розкритих у даному описі, з послідовностями зародкової лінії, доступними, наприклад, із загальнодоступних баз даних, що стосуються послідовностей антитіл. Даний винахід включає антитіла і їх антигензв'язувальні фрагменти, які одержують, виходячи з будьякої з розкритих у даному описі амінокислотних послідовностей, причому одну або більше амінокислот в одній або більше каркасних областях і/або CDR-ділянках піддають зворотній мутації до відповідного залишку(ів) послідовності зародкової лінії або до консервативної амінокислотної заміни (природної або неприродної) відповідного залишку(ів) послідовності зародкової лінії (такі зміни послідовності називають у даному описі "зворотними мутаціями до послідовності зародкової лінії"). Середній фахівець у даній галузі, виходячи з послідовностей варіабельних областей важкого і легкого ланцюгів, розкритих у даному описі, може легко створити численні антитіла й антигензв'язувальні фрагменти, що містять одну або більше окремих зворотних мутацій до послідовності зародкової лінії або їх комбінації. У деяких варіантах здійснення всі залишки каркасних областей і/або CDR у V H і/або VL-доменах піддають зворотним мутаціям до послідовності зародкової лінії. В інших варіантах здійснення лише деякі залишки піддають зворотним мутаціям до послідовності зародкової лінії, наприклад лише мутовані залишки, що виявляються в межах перших 8 амінокислот FR1 або в межах останніх 8 амінокислот FR4, або лише мутовані залишки, що виявляються усередині CDR1, CDR2 або CDR3. Крім того, антитіла за даним винаходом можуть містити будь-яку комбінацію з двох або більше зворотних мутацій до послідовності зародкової лінії усередині каркасних областей і/або CDR-ділянок, тобто, в яких деякі окремі залишки піддані зворотним мутаціям до послідовності зародкової лінії, у той час як деякі інші залишки, що відрізняються від послідовності зародкової лінії, збережені. Після одержання антитіла й антигензв'язувальні фрагменти, що містять одну або більше зворотних мутацій до послідовності зародкової лінії, можна легко перевірити на предмет наявності однієї або більше бажаних властивостей, таких як збільшена специфічність зв'язування, збільшена афінність зв'язування, поліпшені або посилені антагоністичні або агоністичні біологічні властивості (виходячи з конкретної ситуації), зменшена імуногенність і т. д. Антитіла й антигензв'язувальні фрагменти, одержані цим загальним способом, включені в даний винахід. Даний винахід також стосується антитіл проти GDF8, які містять варіанти будь-якої з розкритих у даному описі амінокислотних послідовностей HCVR, LCVR і/або CDR, що містять одну або більше консервативних замін. Наприклад, даний винахід стосується антитіл проти GDF8, які містять амінокислотні послідовності HCVR, LCVR і/або CDR, наприклад, з 10 або менше, 8 або менше, 6 або менше, 4 або менше і т. д. консервативними амінокислотними замінами відносно будь-якої з розкритих у даному описі амінокислотних послідовностей HCVR, LCVR і/або CDR. В одному з варіантів здійснення антитіло містить HCVR, що має амінокислотну послідовність, вибрану з SEQ ID NO:360 і 376, з 8 або менше консервативними амінокислотними замінами. В іншому варіанті здійснення антитіло містить HCVR, що має амінокислотну послідовність, вибрану з SEQ ID NO:360 і 376, з 6 або менше консервативними амінокислотними замінами. В іншому варіанті здійснення антитіло містить HCVR, що має амінокислотну послідовність, вибрану з SEQ ID NO:360 і 376, з 4 або менше консервативними амінокислотними замінами. В іншому варіанті здійснення антитіло містить HCVR, що має амінокислотну послідовність, вибрану з SEQ ID NO:360 і 376, з 2 або менше консервативними амінокислотними замінами. В одному з варіантів здійснення антитіло містить LCVR, що має амінокислотну послідовність, вибрану з SEQ ID NO:368 і 384, з 8 або менше консервативними амінокислотними замінами. В іншому варіанті здійснення антитіло містить LCVR, що має амінокислотну послідовність, вибрану з SEQ ID NO:368 і 384, з 6 або менше консервативними амінокислотними замінами. В іншому варіанті здійснення антитіло містить LCVR, що має амінокислотну послідовність, вибрану з SEQ ID NO:368 і 384, з 4 або менше консервативними амінокислотними замінами. В іншому варіанті здійснення антитіло містить LCVR, що має амінокислотну послідовність, вибрану з SEQ ID NO:368 і 384, з 2 або менше консервативними амінокислотними замінами. 8 UA 112521 C2 5 10 15 20 25 30 35 40 45 50 55 60 У деяких варіантах здійснення антитіло або фрагмент антитіла за даним винаходом може бути кон'юговане(ий) з терапевтичною складовою ("імунокон'югат"), такою як цитотоксин, хіміотерапевтичний лікарський засіб і імунодепресант або радіоізотоп. "Виділене антитіло", як використовується в даному описі, означає антитіло, яке було ідентифіковане і виділене і/або відділене від принаймні одного компонента його природного оточення. Наприклад, антитіло, яке було виділене або відділене від принаймні одного компонента організму, тканини або клітини, у якому(ій) антитіло існує в природі або продукується в природі, є "виділеним антитілом" у рамках даного винаходу. Виділене антитіло також містить антитіло in situ у рекомбінантній клітині, а також антитіло, яке було піддане принаймні одній стадії очищення або виділення. Відповідно до деяких варіантів здійснення виділене антитіло може по суті не містити інший клітинний матеріал і/або інші хімічні речовини. Використовуваний у даному описі термін "поверхневий плазмонний резонанс" стосується оптичного явища, яке дозволяє досліджувати біоспецифічні взаємодії в реальному часі за допомогою виявлення змін концентрацій білка в матриці біосенсора, використовуючи, TM наприклад, систему BIACORE (Pharmacia Biosensor AB, Uppsala, Швеція і Piscataway, N.J.). Використовуваний у даному описі термін "KD", як передбачається, стосується рівноважної константи дисоціації конкретної взаємодії антитіло-антиген. Термін "епітоп" включає будь-яку детермінанту, переважно поліпептидну детермінанту, здатну до специфічного зв'язування з імуноглобуліном або T-клітинним рецептором. У деяких варіантах здійснення епітопи містять хімічно активні поверхневі угруповання молекул, такі як амінокислоти, цукрові бічні ланцюги, фосфорильні групи або сульфонільні групи, і в деяких варіантах здійснення можуть мати специфічні характеристики тривимірної структури і/або специфічні зарядні характеристики. Епітоп являє собою район антигену, який зв'язується антитілом. У деяких варіантах здійснення говорять, що антитіло специфічно зв'язується з антигеном, якщо воно, переважно, розпізнає антиген, який є його мішенню, у складній суміші білків і/або макромолекул. Наприклад, говорять, що антитіло специфічно зв'язується з -8 -9 антигеном, якщо KD складає менше або дорівнює 10 M, складає менше або дорівнює 10 M -10 або складає менше або дорівнює 10 M. Білок або поліпептид є "по суті чистим", "по суті гомогенним" або "значною мірою очищеним", коли принаймні приблизно 60-75 % зразка демонструє один вид поліпептиду. Поліпептид або білок може бути мономерним або мультимерним. По суті чистий поліпептид або білок, як правило, містить приблизно 50, 60, 70, 80 або 90 % у ваговому відношенні зразка білка, звичайно приблизно 95 %, і переважно характеризується ступенем чистоти, що складає понад 99 %. Про чистоту білка або його гомогенність може свідчити ряд способів, добре відомих у даній галузі, таких як електрофорез у поліакриламідному гелі зразка білка з наступною візуалізацією єдиної поліпептидної смуги після забарвлення гелю барвною речовиною, добре відомою у даній галузі. Для деяких цілей можна забезпечити велику розрізнювальну здатність, використовуючи HPLC або інші способи, добре відомі в даній галузі для очищення. Використовуваний у даному описі термін "аналог або варіант поліпептиду" стосується поліпептиду, який складається із сегмента принаймні з 25 амінокислот, що по суті ідентичний частині амінокислотної послідовності, і який має принаймні одну з наступних властивостей: (1) специфічне зв'язування з GDF8 у придатних умовах зв'язування, або (2) здатність до блокування біологічної активності GDF8. Як правило, аналоги або варіанти поліпептиду містять консервативну амінокислотну заміну (або вставку, або делецію) відносно послідовності, що зустрічається в природі. Характерна довжина аналогів складає принаймні 20 амінокислот, принаймні 50, 60, 70, 80, 90, 100, 150 або 200 амінокислот або більше, і вони часто можуть бути розміром з повнорозмірний поліпептид, що зустрічається в природі. Переважними амінокислотними замінами є заміни, які: (1) зменшують схильність до протеолізу, (2) зменшують схильність до окислювання, (3) змінюють афінність зв'язування відносно утворення білкових комплексів, (4) змінюють афінності зв'язування, і (5) надають таким аналогам інші фізико-хімічні або функціональні властивості або змінюють їх. Аналоги можуть включати різні мутації послідовності, відмінні від пептидної послідовності, що зустрічається в природі. Наприклад, одну або множину амінокислотних замін (переважно консервативних амінокислотних замін) можна здійснити в послідовності, що зустрічається в природі (переважно у частині поліпептиду, що знаходиться за межами домену(ів), що утворює міжмолекулярні контакти). Консервативна амінокислотна заміна не повинна значною мірою змінювати структурні характеристики вихідної послідовності (наприклад, амінокислота заміни не повинна виявляти тенденцію до руйнування спіралі, що зустрічається у вихідній послідовності, або порушення інших типів вторинної структури, що характеризують вихідну послідовність). Приклади прийнятих у даній галузі вторинних і третинних структур поліпептидів описані в Proteins, 9 UA 112521 C2 5 10 15 20 25 30 35 40 45 50 55 60 Structures and Molecular Principles (Creighton 1984, W. H. Freeman and Company, New York); Introduction to Protein Structure (Branden & Tooze, eds., 1991, Garland Publishing, NY); і Thornton et al. 1991, Nature, 354:105. Непептидні аналоги звичайно використовуються у фармацевтичній промисловості як лікарські засоби, що мають властивості, аналогічні таким матричного пептиду. Ці типи непептидної сполуки називають "міметиками пептидів" або "пептидоміметиками" (див., наприклад, Fauchere (1986), J. Adv. Drug Res. 15:29; і Evans et al. (1987), J. Med. Chem. 30:1229). Методичне заміщення однієї або більше амінокислот консенсусної послідовності Dамінокислотою того ж типу (наприклад, D-лізином замість L-лізину) може також використовуватися для створення більш стабільних пептидів. Крім того, пептиди з обмеженнями, що містять консенсусну послідовність або варіант, по суті ідентичний консенсусній послідовності, можна створити за допомогою відомих у даній галузі способів (Rizo et al. (1992), Ann. Rev. Biochem. 61:387), наприклад, за допомогою додавання внутрішніх залишків цистеїну, здатних утворювати внутрішньомолекулярні дисульфідні містки, що приводять до циклізації пептиду. Термін "відсоток ідентичності послідовностей" застосовно до послідовностей нуклеїнових кислот стосується залишків у двох послідовностях, що є однаковими після суміщення для максимальної відповідності. Ділянка порівняння для визначення ідентичності послідовностей може бути більше, ніж ділянка з принаймні приблизно дев'яти нуклеотидів або більше, звичайно принаймні приблизно 18 нуклеотидів, звичайніше принаймні приблизно 24 нуклеотиди, як правило принаймні приблизно 28 нуклеотидів, як правило принаймні приблизно 32 нуклеотиди і переважно принаймні приблизно 36, 48 або більше нуклеотидів. У даній галузі відомий ряд різних алгоритмів, які можуть використовуватися для визначення ідентичності нуклеотидних послідовностей. Наприклад, полінуклеотидні послідовності можна порівняти, використовуючи FASTA, Gap або Bestfit, які є програмами в пакеті Wisconsin версії 10.0, Genetics Computer Group (GCG), Madison, Wis. FASTA, що містить, наприклад, програми FASTA2 і FASTA3, забезпечує сполучення і відсоток ідентичності послідовностей ділянок найкращого сполучення між послідовностями запиту і пошуку (Pearson (1990), Methods Enzymol. 183:63-98 and (2000), Methods Mol. Biol. 132:185-219). Крім особливо обговорених випадків, використовують параметри за замовчуванням для конкретної програми або алгоритму. Наприклад, відсоток ідентичності між послідовностями нуклеїнових кислот можна визначити, використовуючи FASTA разом з параметрами за замовчуванням для неї (розмір слова - 6 і опція NOPAM для матриці замін) або використовуючи Gap разом з параметрами за замовчуванням для неї, наданої в GCG версії 6.1. Посилання на послідовність нуклеїнової кислоти включають її комплемент, крім особливо обговорених випадків. Таким чином, посилання на молекулу нуклеїнової кислоти, що має конкретну послідовність, як варто розуміти, включає комплементарний їй ланцюг, з комплементарною їй послідовністю. Як правило, терміни "відсоток ідентичності послідовностей", "відсоток подібності послідовностей" і "відсоток гомології послідовностей" використовуються в даній галузі взаємозамінно. У даній заявці ці терміни мають таке ж значення стосовно послідовностей нуклеїнових кислот. Термін "значна подібність" або "значна подібність послідовностей", при посиланні на нуклеїнову кислоту або її фрагмент, означає, що, після оптимального суміщення з використанням відповідних вставок або делецій нуклеотидів з іншою нуклеїновою кислотою (або комплементарним їй ланцюгом), у принаймні приблизно 90 %, принаймні приблизно 95 %, принаймні приблизно 96 %, принаймні приблизно 97 %, принаймні приблизно 98 % або принаймні приблизно 99 % основ нуклеотидів існує ідентичність нуклеотидних послідовностей, визначувана за допомогою будь-якого широко відомого алгоритму ідентичності послідовностей, такого як FASTA, BLAST або Gap, що обговорювалися вище. Стосовно поліпептидів, термін "значна ідентичність" або "значною мірою ідентичні" означає, що дві пептидні послідовності, після оптимального суміщення, наприклад, за допомогою програм GAP або BESTFIT з використанням значень для пропусків за замовчуванням, мають ідентичність послідовностей, що складає принаймні приблизно 80 %, принаймні приблизно 90 %, принаймні приблизно 95 %, принаймні приблизно 98 % або принаймні приблизно 99 %. Переважно, коли відмінностями положень залишків, що не є ідентичними, є консервативні амінокислотні заміни. "Консервативною амінокислотною заміною" є заміна, у випадку якої амінокислотний залишок замінений іншим амінокислотним залишком, що має бічний ланцюг (групу R), що має схожі хімічні властивості (наприклад, заряд або гідрофобність). Звичайно консервативна амінокислотна заміна не буде значною мірою змінювати функціональні властивості білка. У тих випадках, коли відмінностями однієї від одної двох або більше 10 UA 112521 C2 5 10 15 20 25 30 35 40 45 50 55 60 амінокислотних послідовностей є консервативні заміни, відсоток ідентичності послідовностей або ступінь подібності може бути збільшений для внесення поправки на консервативну природу заміни. Способи здійснення цього коректування добре відомі кваліфікованим у даній галузі фахівцям. Дивіться, наприклад, Pearson (1994), Methods Mol. Biol. 24:307-331. Приклади груп амінокислот, що мають бічні ланцюги зі схожими хімічними властивостями, включають 1) аліфатичні бічні ланцюги: гліцин, аланін, валін, лейцин і ізолейцин; 2) аліфатичні гідроксильні бічні ланцюги: серин і треонін; 3) амідовмісні бічні ланцюги: аспарагін і глютамін; 4) ароматичні бічні ланцюги: фенілаланін, тирозин і триптофан; 5) основні бічні ланцюги: лізин, аргінін і гістидин; і 6) сірковмісні бічні ланцюги: цистеїн і метіонін. Переважними групами консервативних амінокислотних замін є: валін-лейцин-ізолейцин, фенілаланін-тирозин, лізин-аргінін, аланінвалін, глютамат-аспартат і аспарагін-глютамін. Альтернативно, консервативною заміною є будьяка заміна з позитивним значенням у матриці логарифмічної правдоподібності PAM250, розкритій в Gonnet et al. (1992), Science, 256:1443-45. "Помірно консервативною" заміною є будь-яка заміна з ненегативним значенням у матриці логарифмічної правдоподібності PAM250. Подібність послідовностей поліпептидів, яку також називають ідентичністю послідовностей, як правило, визначають, використовуючи програмне забезпечення для аналізу послідовностей. Програмне забезпечення для аналізу білків зіставляє схожі послідовності, використовуючи показники подібності, задані для різних замін, делецій і інших модифікацій, у тому числі консервативних амінокислотних замін. Наприклад, GCG містить такі програми, як "Gap" і "Bestfit", що можуть використовуватися разом з параметрами за замовчуванням для визначення гомології послідовностей або ідентичності послідовностей між близькоспорідненими поліпептидами, такими як гомологічні поліпептиди різних видів організмів, або між білком дикого типу і його мутеїном. Див., наприклад, GCG версії 6.1. Поліпептидні послідовності можна також порівняти, використовуючи FASTA з використанням параметрів за замовчуванням або рекомендованих параметрів, програму в GCG версії 6.1. FASTA (наприклад, FASTA2 і FASTA3) забезпечує суміщення і відсоток ідентичності послідовностей ділянок найкращого суміщення між послідовностями запиту і пошуку (Pearson (2000), вище). Іншим переважним алгоритмом при порівнянні послідовності за даним винаходом з базою даних, що містить велику кількість послідовностей різних організмів, є комп'ютерна програма BLAST, особливо blastp або tblastn, з використанням параметрів за замовчуванням. Див., наприклад, Altschul et al. (1990), J. Mol. Biol. 215:403-410; і Altschul et al. (1997), Nucleic Acids Res. 25:3389 402. Розмір поліпептидних послідовностей, порівнюваних на предмет гомології, як правило, складає принаймні приблизно 16 амінокислотних залишків, принаймні приблизно 20 залишків, принаймні приблизно 24 залишків, принаймні приблизно 28 залишків або принаймні приблизно 35 залишків. При переборі бази даних, що містить послідовності великої кількості різних організмів, переважним є порівняння амінокислотних послідовностей. Термін "ефективна кількість" означає концентрацію або кількість антитіла або антигензв'язувального фрагмента антитіла, що приводить до досягнення конкретної заданої мети. "Ефективну кількість" антитіла проти GDF8 або його антигензв'язувального фрагмента можна визначити емпірично. Крім того, "терапевтично ефективна кількість" являє собою концентрацію або кількість антитіла проти GDF8 або його антигензв'язувального фрагмента, що є ефективною для досягнення заданого терапевтичного ефекту. Цю кількість можна також визначити емпірично. Одержання антитіл людини Способи створення моноклональних антитіл, у тому числі повністю людських моноклональних антитіл, добре відомі в даній галузі. Будь-які такі відомі способи можуть використовуватися в рамках даного винаходу для одержання антитіл людини, які специфічно зв'язуються з GDF8. TM Використовуючи технологію VELOCIMMUNE або будь-який інший відомий спосіб створення моноклональних антитіл, спочатку виділяють химерні антитіла проти GDF8, що мають високу афінність, які містять людську варіабельну область і мишачу константну область. Як і в експериментальній частині нижче, одержують характеристики антитіл і здійснюють відбір антитіл відносно бажаних характеристик, що включають афінність, селективність, епітоп і т. д. Мишачі константні області заміняють бажаною людською константною областю для створення повністю людські антитіла за даним винаходом, наприклад IgG1 або IgG4 дикого типу або модифікованого IgG1 або IgG4. Тоді як вибрана константна область може змінюватися відповідно до конкретного застосування, характеристики, що стосуються високоафінного зв'язування з антигеном і специфічності відносно мішені, властиві варіабельній області. Звичайно антитіла за даним винаходом мають дуже високу афінність, як правило мають K D, -12 -9 що складає від приблизно 10 по приблизно 10 M, при визначенні за допомогою зв'язування з 11 UA 112521 C2 5 10 15 20 25 30 35 40 45 50 55 антигеном, який або іммобілізований на твердій фазі, або знаходиться в рідкій фазі. Мишачі константні області заміняють бажаними людськими константними областями для створення повністю людських антитіл за даним винаходом, наприклад IgG1 дикого типу (SEQ ID NO:335) або IgG4 дикого типу (SEQ ID NO:336), або модифікованого IgG1 або IgG4 (наприклад, SEQ ID NO:337). Тоді як вибрана константна область може змінюватися відповідно до конкретного застосування, характеристики, що стосуються високоафінного зв'язування з антигеном і специфічності відносно мішені, властиві варіабельній області. Біоеквіваленти Антитіла проти GDF8 і фрагменти антитіл за даним винаходом включають білки з амінокислотними послідовностями, які відрізняються від таких описаних антитіл, але які зберігають здатність до зв'язування з GDF8 людини. Такі варіанти антитіл і фрагментів антитіл містять одне або більше додавань, делецій або замін амінокислот у порівнянні з вихідною послідовністю, але виявляють біологічну активність, що по суті еквівалента такій описаних антитіл. Точно так само, кодучі антитіла проти GDF8 послідовності ДНК за даним винаходом включають послідовності, які містять одне або більше додавань, делецій або замін нуклеотидів у порівнянні з розкритою послідовністю, але які кодують антитіло проти GDF8 або фрагмент антитіла, яке(ий) по суті біоеквівалентне(ий) антитілу проти GDF8 або фрагменту антитіла за даним винаходом. Приклади таких варіантів амінокислотних і ДНК послідовностей обговорюються вище. Два антигензв'язувальних білки, або антитіла, вважаються біоеквівалентними, якщо, наприклад, вони є фармацевтичними еквівалентами або фармацевтичним варіантами, швидкість і ступінь абсорбції яких не відрізняються значно після введення в однаковій молярній дозі, або в однократній дозі, або в багаторазовій дозі, у схожих експериментальних умовах. Деякі антитіла будуть вважатися еквівалентами або фармацевтичними варіантами, якщо вони є еквівалентними по ступеню їх абсорбції, але не по швидкості їх абсорбції, і усе ще можуть вважатися біоеквівалентними, оскільки такі відмінності у швидкості абсорбції є навмисними і знаходять відображення при віднесенні до визначеної категорії, не є суттєвими для досягнення ефективних концентрацій лікарського засобу в організмі, наприклад при постійному застосуванні, і вважаються терапевтично незначущими для конкретного досліджуваного лікарського продукту. В одному з варіантів здійснення два антигензв'язувальних білки є біоеквівалентними, якщо немає клінічно значимих відмінностей у їх безпеці, ступені чистоти й ефективності. В одному з варіантів здійснення два антигензв'язувальних білки є біоеквівалентними, якщо пацієнта можна перевести один або більше разів з контрольного продукту на біологічний продукт без очікуваного збільшення ризику несприятливих ефектів, що включають клінічно значиму зміну імуногенності, або зменшення ефективності, у порівнянні з триваючою терапією без такого переведення. В одному з варіантів здійснення два антигензв'язувальних білки є біоеквівалентними, якщо вони обидва функціонують за загальним механізмом або механізмами дії для визначеного стану або станів, у випадку, якщо такі механізми відомі. Біоеквівалентність може бути показана способами in vivo і in vitro. Показники біоеквівалентності включають, наприклад, (a) in vivo дослідження на людях або інших ссавцях, у ході якого визначають концентрацію антитіла або його метаболітів у крові, плазмі, сироватці або іншій біологічній рідині залежно від часу; (b) in vitro дослідження, яке було погоджене з даними, що стосуються in vivo біодоступності у людей, і коректно прогнозує їх; (c) in vivo дослідження на людях або інших ссавцях, у ході якого визначають відповідний короткочасний фармакологічний ефект антитіла (або його мішені) залежно від часу; і (d) повністю контрольоване клінічне випробування, у ході якого встановлюється безпека, ефективність, біодоступність або біоеквівалентність антитіла. Біоеквівалентні варіанти антитіл проти GDF8 за даним винаходом можна сконструювати за допомогою, наприклад, здійснення різних замін залишків або послідовностей або делетування кінцевих або внутрішніх залишків або послідовностей, що не вимагаються для біологічної активності. Наприклад, залишки цистеїну, що не є необхідними для біологічної активності, можна делетувати або замінити іншими амінокислотами для запобігання утворенню непотрібних або неправильних внутрішньомолекулярних дисульфідних містків при ренатурації. В інших ситуаціях біоеквівалентні антитіла можуть включати варіанти антитіл проти GDF8, які містять амінокислотні заміни, що змінюють особливості глікозилування антитіл, наприклад мутації, що виключають або усувають глікозилування. Епітопне картування і споріднені технології 12 UA 112521 C2 5 10 15 20 25 30 35 40 45 50 55 60 Для скринінгу на предмет знаходження антитіл, що зв'язуються з конкретним епітопом (наприклад, ті, котрі блокують зв'язування IgE зі своїм високоафінним рецептором), може бути виконаний звичайний перехресний конкурентний аналіз, такий як той, що описаний у Harlow and Lane (1990), вище. Інші способи включають скануючий аланіном мутагенез, блоти пептидів (Reineke (2004), Methods Mol. Biol. 248:443-463) або аналіз розщеплення пептидів. Крім того, можуть використовуватися такі способи, як виключення епітопа, видалення епітопа і хімічна модифікація антигенів (Tomer (2000), Protein Science, 9:487-496). Термін "епітоп" стосується ділянки антигену, на яку реагують B- і/або T-клітини. B-клітинні епітопи можуть бути утворені з розташованих поруч амінокислот або з не розташованих поруч амінокислот, що стали сусідніми в результаті згортання білка в третинну структуру. Епітопи, утворені з розташованих поруч амінокислот, звичайно зберігаються при піддаванні впливу денатуруючих розчинників, тоді як епітопи, утворені в результаті згортання в третинну структуру, звичайно втрачаються при обробці денатуруючими розчинниками. Епітоп звичайно містить принаймні 3, звичайно принаймні 5 або 8-10 амінокислот в унікальній просторовій конформації. Виконуваний за допомогою модифікацій аналіз профілю (MAP), також відомий як аналіз профілю антитіл на основі структури антигену (ASAP), є способом розподілу по категоріях великих кількостей моноклональних антитіл (mAb), спрямованих проти того самого антигену, згідно з подібностями профілю зв'язування кожного антитіла з хімічно або ферментативно модифікованими поверхнями антигену (US 2004/0101920). Кожна категорія може відображати унікальний епітоп, який або явно відмінний від епітопа, представленого іншою категорією, або частково перекривається з ним. Ця технологія дозволяє швидко відфільтрувати генетично ідентичні антитіла, так що зняття характеристик може бути зосереджене на генетичних відмінних антитілах. У випадку використання для скринінгу гібридом MAP може сприяти ідентифікації рідких гібридомних клонів, що продукують mAb з бажаними характеристиками. MAP може використовуватися для розподілу антитіл проти GDF8 за даним винаходом по групах антитіл, що зв'язуються з різними епітопами. Даний винахід стосується антитіл проти GDF8 і антигензв'язувальних фрагментів антитіл, що зв'язуються зі специфічними епітопами GDF8 людини (SEQ ID NO:340) і здатні до блокування біологічної активності GDF8. В одному з варіантів здійснення антитіло або його антигензв'язувальний фрагмент зв'язується в епітопі, що містить амінокислотні залишки 1-109; 1-54; 1-44; 1-34; 1-24 і 1-14. В іншому варіанті здійснення антитіло або його антигензв'язувальний фрагмент зв'язується в епітопі, що містить амінокислотні залишки 65-72; 35-109; 45-109; 55-109; 65-109; 75-109; 85-109; 92-109 або 95-109. В іншому варіанті здійснення антитіло або його антигензв'язувальний фрагмент зв'язується в епітопі, що містить амінокислотні залишки 48-72; 48-69; 48-65; 52-72; 52-65 або 56-65. В особливих варіантах здійснення антитіло або його антигензв'язувальний фрагмент може зв'язуватися в 2 або більше епітопах. Даний винахід також стосується антитіл і їх антигензв'язувальних фрагментів, що зв'язуються зі зрілим білком GDF8 дикого типу (SEQ ID NO:340), але не зв'язуються з виділеними пептидами, що мають менше ніж повнорозмірну амінокислотну послідовність SEQ ID NO:340. Наприклад, даний винахід стосується антитіл проти GDF8, що зв'язуються зі зрілим білком GDF8 дикого типу (SEQ ID NO:340), але не зв'язуються з виділеними пептидами, що складаються з 10-40 амінокислот SEQ ID NO:340, що ідуть одна за одною. Даний винахід також стосується антитіл проти GDF8, що не зв'язуються з якими-небудь лінійними епітопами зрілого білка GDF8 дикого типу. У деяких варіантах здійснення за даним винаходом антитіла проти GDF8 зв'язуються зі зрілим білком GDF8 дикого типу, що містить SEQ ID NO:340, але не зв'язуються з одним або більше виділеними пептидами GDF8, що мають амінокислотну послідовність, вибрану з групи, що складається з 1-14, 1-18, 17-42, 48-65, 48-69, 48-72, 52-65, 52-72, 56-65, 56-72, 65-72, 73-90, 75-105 і 91-105 SEQ ID NO:340. У деяких варіантах здійснення антитіла проти GDF8 не зв'язуються з будь-якими з вищезгаданих пептидів GDF8. Способи визначення того, чи здатне це антитіло до зв'язування з конкретним пептидом GDF8, відомі середнім фахівцям у даній галузі. У прикладі 7 показаний один приклад способу, у якому пептиди GDF8 приєднують до мікросферичних частинок, до мікросферичних частинок з кон'югованими пептидами додають антитіла і після стадій промивання виявляють мікросферичні частинки зі зв'язаними антитілами. Відсутність зв'язаних антитіл означає, що антитіла не зв'язуються з конкретними досліджуваними пептидами. Даний винахід також стосується виділених антитіл людини або їх антигензв'язувальних фрагментів, що специфічно зв'язуються зі зрілим білком GDF8 людини дикого типу (наприклад, білком або поліпептидом, що містить SEQ ID NO:340), але не зв'язуються з химерною 13 UA 112521 C2 5 10 15 20 25 30 35 40 45 50 55 конструкцією CDF8, у якій деякі амінокислоти GDF8 замінені відповідною амінокислотною послідовністю(ями) з неідентичного, але спорідненого білка, такого як TGFβ-1. В одному з прикладів химерною конструкцією є химера GDF8/TGFβ-1, у якій амінокислоти 48-72 зрілого білка GDF8 замінені відповідною амінокислотною послідовністю TGFβ-1 (наприклад, амінокислотами 49-76 TGFβ-1). SEQ ID NO:352 являє собою приклад однієї такої химери (див. приклади 4 і 6 у даному описі). Таким чином, у деяких варіантах здійснення антитіла за даним винаходом специфічно зв'язуються зі зрілим білком GDF8 людини дикого типу (SEQ ID NO:340), але не зв'язуються з химерною конструкцією GDF8/TGFβ-1 з SEQ ID NO:352, що вказує на те, що епітоп, з яким зв'язуються такі антитіла, включає або містить амінокислоти, локалізовані в межах залишків 48-72 SEQ ID NO:340. Біоаналізи блокування, такі як аналіз, викладений у прикладі 4 у даному описі, можуть також використовуватися для непрямого визначення, чи зв'язується антитіло зі зрілим білком GDF8 людини дикого типу (SEQ ID NO:340), і чи не зв'язується воно з химерною конструкцією GDF8/TGFβ-1, наприклад конструкцією з SEQ ID NO:352. Наприклад, антитіло, що блокує біологічну активність зрілого білка GDF8 людини дикого типу, але не блокує біологічну активність химерної конструкції GDF8/TGFβ-1, як вважають, зв'язується з частиною GDF8, що замінена відповідною послідовністю TGFβ-1 у химерній конструкції. Точно так само, даний винахід також стосується виділених антитіл людини або їх антигензв'язувальних фрагментів, що блокують опосередковану зрілим білком GDF8 дикого типу активність у біоаналізі, але не блокують активність химерної конструкції GDF8 (наприклад, химери GDF8/TGFβ-1, у якій амінокислоти 48-72 зрілого білка GDF8 замінені відповідною амінокислотною послідовністю TGFβ-1 (наприклад, SEQ ID NO:352)). Біоаналізом GDF8, що наводиться як приклад, який може використовуватися в рамках цього аспекту даного винаходу, є дослідження індукованої GDF8 люциферазної активності, викладене в прикладі 4 у даному описі, хоча в даному описі також передбачаються інші схожі біоаналізи, за допомогою яких можна визначити клітинну активність GDF8. Даний винахід стосується антитіл проти GDF8, що зв'язуються з одним і тим же епітопом, як і будь-які з конкретних антитіл, що наводяться як приклад, розкритих у даному описі. Точно так само, даний винахід також стосується антитіл проти GDF8, що перехресно конкурують за зв'язування з GDF8 або фрагментом GDF8 з будь-яким з конкретних антитіл, що наводяться як приклад, розкритих у даному описі. Можна легко визначити, чи зв'язується антитіло з тим же епітопом, що і контрольне антитіло проти GDF8, або чи конкурує антитіло за зв'язування з контрольним антитілом, використовуючи звичайні способи, відомі в даній галузі. Наприклад, для визначення того, чи зв'язується досліджуване антитіло з тим же епітопом, що і контрольне антитіло проти GDF8 за даним винаходом, допускають зв'язування контрольного антитіла з білком або пептидом GDF8 в умовах насичення. Потім оцінюють здатність досліджуваного антитіла до зв'язування з молекулою GDF8. Якщо досліджуване антитіло здатне до зв'язування з GDF8 після зв'язування в умовах насичення з контрольним антитілом проти GDF8, можна зробити висновок, що досліджуване антитіло зв'язується з епітопом, відмінним від такого для контрольного антитіла проти GDF8. З іншого боку, якщо досліджуване антитіло не здатне до зв'язування з молекулою GDF8 після зв'язування в умовах насичення з контрольним антитілом проти GDF8, то досліджуване антитіло може зв'язуватися з епітопом, однаковим з епітопом, з яким зв'язується контрольне антитіло проти GDF8 за даним винаходом. Можна також провести додаткове рутинне експериментування (наприклад, мутаційний аналіз пептидів і аналіз зв'язування пептидів) для підтвердження, чи дійсно відмічена відсутність зв'язування досліджуваного антитіла обумовлена зв'язуванням з епітопом, однаковим з таким для контрольного антитіла, або чи відповідальне за відсутність спостережуваного зв'язування стеричне блокування (або інше явище). Експерименти такого типу можна виконати, використовуючи ELISA, RIA, Biacore, проточну цитометрію або будь-які інші кількісні або якісні аналізи зв'язування антитіл, наявні в даній галузі. Відповідно до деяких варіантів здійснення за даним винаходом два антитіла зв'язуються з одним і тим же (або тим, що перекривається) епітопом, якщо, наприклад, 1-, 5-, 10-, 20- або 100-кратна надлишкова кількість одного антитіла інгібує зв'язування іншого антитіла на принаймні 50 %, але переважно на 75 %, 90 % або навіть 99 %, що визначено в конкурентному аналізі зв'язування (див., наприклад, Junghans et al. Cancer Res. 1990:50:14951502). Альтернативно, вважають, що два антитіла зв'язуються з одним і тим же епітопом, якщо по суті всі мутації амінокислот в антигені, які зменшують або виключають зв'язування одного антитіла, зменшують або виключають зв'язування іншого антитіла. Вважають, що антитіла зв'язуються з "епітопами, що перекриваються", якщо лише підмножина мутацій амінокислот, що 14 UA 112521 C2 5 10 15 20 25 30 35 40 45 50 55 60 зменшують або виключають зв'язування одного антитіла, зменшують або виключають зв'язування іншого антитіла. Для визначення того, чи конкурує антитіло за зв'язування з контрольним антитілом проти GDF8, описану вище методику зв'язування виконують у двох установках. У першій установці допускають зв'язування контрольного антитіла з молекулою GDF8 в умовах насичення з наступною оцінкою зв'язування досліджуваного антитіла з молекулою GDF8. В другій установці допускають зв'язування досліджуваного антитіла з молекулою GDF8 в умовах насичення з наступною оцінкою зв'язування контрольного антитіла з молекулою GDF8. Якщо, в обох установках, лише перше (використовуване для насичення) антитіло здатне до зв'язування з молекулою GDF8, то роблять висновок, що досліджуване антитіло і контрольне антитіло конкурують за зв'язування з GDF8. Як це буде зрозуміло середньому фахівцю в даній галузі, антитіло, що конкурує за зв'язування з контрольним антитілом, може необов'язково зв'язуватися з тим же епітопом, що і контрольне антитіло, але може стерично блокувати зв'язування контрольного антитіла в результаті зв'язування з епітопом, що перекривається або розташований поруч. Видова селективність і міжвидова перехресна реактивність Відповідно до деяких варіантів здійснення за даним винаходом антитіла проти GDF8 зв'язуються з GDF8 людини, але не з GDF8 інших видів. Альтернативно, антитіла проти GDF8 за даним винаходом, у деяких варіантах здійснення, зв'язуються з GDF8 людини і з GDF8 одного або більше видів, що не є людиною. Наприклад, антитіла проти GDF8 за даним винаходом можуть зв'язуватися з GDF8 людини і можуть зв'язуватися або можуть не зв'язуватися, залежно від конкретного випадку, з одним або більше GDF8 миші, щура, морської свинки, хом'ячка, піщанки, свині, кішки, собаки, кролика, кози, вівці, корови, коня, верблюда, яванського макака, мавпи, макаки-резус або шимпанзе. Імунокон'югати Даний винахід стосується антитіла людини або гуманізованого моноклонального антитіла проти GDF8, кон'югованого з терапевтичною складовою ("імунокон'югат"), такою як цитотоксин, хіміотерапевтичний лікарський засіб, імунодепресант або радіоізотоп. Цитотоксичні агенти включають будь-який агент, що є шкідливим для клітин. Приклади придатних цитотоксичних агентів і хіміотерапевтичних засобів для утворення імунокон'югатів відомі в даній галузі, див., наприклад, WO 05/103081. Поліспецифічні антитіла Антитіла за даним винаходом можуть бути моноспецифічними, біспецифічними або поліспецифічними. Поліспецифічні антитіла можуть бути специфічними для різних епітопів одного поліпептиду-мішені або можуть містити антигензв'язувальні домени, специфічні для більше ніж одного поліпептиду-мішені. Див., наприклад, Tutt et al., 1991, J. Immunol. 147:60-69; Kufer et al., 2004, Trends Biotechnol. 22:238-244. Антитіла проти GDF8 за даним винаходом можна зв'язати або коекспресувати з іншою функціональною молекулою, наприклад іншим пептидом або білком. Наприклад, антитіло або його фрагмент можна функціонально зв'язати (наприклад, за допомогою хімічного зв'язку, генетичного злиття, нековалентного зв'язку або іншого) з однією або більше іншими молекулярними структурами, такими як інше антитіло або фрагмент антитіла, з метою одержання біспецифічного або поліспецифічного антитіла з другою специфічністю зв'язування. Наприклад, даний винахід стосується біспецифічних антитіл, при цьому одне плече імуноглобуліну є специфічним для GDF8 людини або його фрагмента, а інше плече імуноглобуліну є специфічним для другої терапевтичної мішені або кон'юговане з терапевтичною складовою. Формат біспецифічного антитіла, що наводиться як приклад, який можна використовувати в рамках даного винаходу, включає використання СН3-домену першого імуноглобуліну (Ig) і СН3домену другого Ig, причому СН3-домени першого і другого Ig відрізняються один від одного принаймні однією амінокислотою, і причому відмінність в принаймні одній амінокислоті зменшує зв'язування біспецифічного антитіла з білком A у порівнянні з біспецифічним антитілом, у якому відсутня відмінність в амінокислоті. В одному з варіантів здійснення С Н3-домен першого Ig зв'язується з білком A, а СН3-домен другого Ig містить мутацію, яка зменшує або анулює зв'язування з білком A, таку як модифікації H95R (відповідно до нумерації екзонів IMGT; H435R відповідно до нумерації ЕU). Другий СН3 може, крім того, містити модифікацію Y96F (відповідно до IMGT; Y436F відповідно до ЕU). Додаткові модифікації, які можна знайти в другому C H3, включають: D16E, L18M, N44S, K52N, V57M і V82I (відповідно до IMGT; D356E, L358M, N384S, K392N, V397M і V422I відповідно до ЕС) у випадку антитіл IgG1; N44S, K52N і V82I (IMGT; N384S, K392N і V422I відповідно до ЕС) у випадку антитіл IgG2; і Q15R, N44S, K52N, V57M, R69K, E79Q і V82I (відповідно до IMGT; Q355R, N384S, K392N, V397M, R409K, E419Q і V422I 15 UA 112521 C2 5 10 15 20 25 30 35 40 45 50 55 60 відповідно до ЕС) у випадку антитіл IgG4. Варіації у форматі біспецифічного антитіла, описані вище, передбачаються такими, що знаходяться в обсязі даного винаходу. Терапевтичне введення і препарати Даний винахід стосується терапевтичних композицій, які містять антитіла або їх антигензв'язувальні фрагменти за даним винаходом. Введення терапевтичних композицій відповідно до даного винаходу здійснюється разом із придатними носіями, наповнювачами й іншими агентами, що містяться в препаратах, для забезпечення поліпшеного перенесення, доставки, переносимості і т. п. Множину відповідних препаратів можна знайти у фармакологічному довіднику, відомому усім фармакохімікам: Remington's Pharmaceutical Sciences, Mack Publishing Company, Easton, PA. Ці препарати включають, наприклад, порошки, пасти, мазі, гелі, воски, олії, ліпіди, везикули, що містять ліпіди (катіонні або аніонні) (такі як TM LIPOFECTIN ), ДНК-кон'югати, безводні пасти з абсорбційними властивостями, емульсії типу "масло-в-воді" або "вода-в-маслі", карбовакс (поліетиленгліколі з різними молекулярними масами), напівтверді гелі і напівтверді суміші, що містять карбовакс. Будь-яка з вищезгаданих сумішей може бути придатною для лікувань і терапій відповідно до даного винаходу за умови, що препарат не інактивує активний інгредієнт, і препарат є фізіологічно сумісним і переносимим при використанні визначеного шляху введення. Див. також Powell et al. "Compendium of excipients for parenteral formulations" PDA (1998), J. Pharm. Scien. Technol. 52:238-311. Доза може змінюватися залежно від віку і маси тіла індивіда, якому її вводять, хворобимішені, станів, шляху введення і т. п. Якщо антитіло за даним винаходом використовують для лікування різних станів і захворювань, пов'язаних з GDF8, наприклад м'язової дистрофії, м'язової атрофії, синдрому виснаження м'язової маси, саркопенії і кахексії, у дорослого пацієнта, то переважним є внутрішньовенне введення антитіла за даним винаходом, яке звичайно проводять у однократній дозі, що складає від приблизно 0,01 до приблизно 20 мг/кг ваги тіла, від приблизно 0,1 до приблизно 10 мг/кг ваги тіла або від приблизно 0,1 до приблизно 5 мг/кг ваги тіла. Частоту введення і тривалість лікування можна регулювати залежно від тяжкості стану. У випадку іншого парентерального введення і перорального введення антитіло можна вводити в дозі, що відповідає наведеній вище дозі. Коли стан є особливо важким, дозу можна збільшити відповідно до стану аж до кількості, що викликає значні побічні ефекти, якщо це має місце. Для введення фармацевтичної композиції за даним винаходом різні системи доставки відомі і можуть використовуватися, наприклад інкапсуляція в ліпосоми, мікрочастинки, мікрокапсули, рекомбінантні клітини, здатні експресувати мутантні віруси, рецептор-опосередкований ендоцитоз (див., наприклад, Wu et al. (1987), J. Biol. Chem. 262:4429-4432). Способи введення включають, але без обмеження, внутрішньошкірний, внутрішньом'язовий, внутрішньоочеревинний, внутрішньовенний, підшкірний, інтраназальний, епідуральний і пероральний шляхи. Композицію можна вводити будь-яким зручним шляхом, наприклад за допомогою інфузії або болюсної ін'єкції, за допомогою абсорбції через епітеліальні або шкірнослизові вистілки (наприклад, слизову оболонку ротової порожнини, слизову оболонку прямої кишки і кишечнику і т. д.), і її можна вводити разом з іншими біологічно активними агентами. Введення може бути системним або місцевим. Фармацевтичну композицію можна також доставити у везикулі, зокрема ліпосомі (див. Langer (1990), Science, 249:1527-1533). Фармацевтичну композицію за даним винаходом можна доставити підшкірно або внутрівенно за допомогою стандартної голки і шприца. Крім того, що стосується підшкірної доставки, пристрій для доставки у вигляді ручки широко використовують для доставки фармацевтичної композиції за даним винаходом. Такий пристрій для доставки у вигляді ручки може бути багаторазового або одноразового використання. У пристрої для доставки у вигляді ручки багаторазового використання, як правило, використовується замінний картридж, що містить фармацевтичну композицію. Після того, як уся фармацевтична композиція, що знаходиться в картриджі, введена, і картридж є порожнім, порожній картридж можна з легкістю видалити і замінити новим картриджем, що містить фармацевтичну композицію. Пристрій для доставки у вигляді ручки можна потім знову використовувати. У випадку одноразового пристрою для доставки у вигляді ручки замінного картриджа немає. Точніше, одноразовий пристрій для доставки у вигляді ручки постачається попередньо наповненим фармацевтичною композицією, що міститься в резервуарі усередині пристрою. Після використання, оскільки резервуар не містить фармацевтичну композицію, порожній пристрій викидають. Численні пристрої для доставки у вигляді ручок і автоінжекторів багаторазового використання застосовують для підшкірної доставки фармацевтичної композиції за даним TM винаходом. Приклади включають, але без обмеження, AUTOPEN (Owen Mumford, Inc., 16 UA 112521 C2 TM 5 10 15 20 25 30 35 40 45 50 55 60 Woodstock, UK), ручку DISETRONIC (Disetronic Medical Systems, Bergdorf, Швейцарія), ручку TM TM TM HUMALOG MIX 75/25 , ручку HUMALOG , ручку HUMALIN 70/30 (Eli Lilly and Co., TM TM Indianapolis, IN), NOVOPEN I, II і III (Novo Nordisk, Copenhagen, Данія), NOVOPEN JUNIOR TM (Novo Nordisk, Copenhagen, Данія), ручку BD (Becton Dickinson, Franklin Lakes, NJ), TM TM TM TM OPTIPEN , OPTIPEN PRO , OPTIPEN STARLET і OPTICLIK (Sanofi-Aventis, Frankfurt, Німеччина), а також інші. Приклади одноразових пристроїв для доставки у вигляді ручок, застосовуваних для підшкірної доставки фармацевтичної композиції за даним винаходом, TM TM включають, але без обмеження, ручку SOLOSTAR (Sanofi-Aventis), FLEXPEN (Novo Nordisk) TM TM TM і KWIKPEN (Eli Lilly), автоінжектор SURECLICK (Amgen, Thousand Oaks, CA), PENLET TM (Haselmeier, Stuttgart, Німеччина), EPIPEN (Dey, L.P.) і ручку HUMIRA (Abbott Labs, Abbott Park IL), а також інші. У деяких ситуаціях фармацевтична композиція може доставлятися в системі контрольованого вивільнення, наприклад, з використанням насоса або полімерних матеріалів. В іншому варіанті здійснення систему контрольованого вивільнення можна помістити поблизу мішені композиції, тим самим приводячи до необхідності лише частини системної дози. Приклади композиції для перорального введення включають тверді або рідкі лікарські форми, особливо таблетки (у тому числі драже і покриті оболонкою таблетки), пігулки, гранули, порошкоподібні препарати, капсули (у тому числі м'які капсули), сироп, емульсії, суспензії і т. д. Таку композицію одержують за допомогою загальновідомих способів, і вона містить носій, розріджувач або наповнювач, звичайно використовуваний в галузі фармацевтичних препаратів. Прикладами носія або наповнювача для таблеток є лактоза, крохмаль, сахароза, стеарат магнію і т. п. Ін'єктовані препарати можуть включати лікарські форми для внутрішньовенних, підшкірних, внутрішньошкірних і внутрішньом'язових ін'єкцій, краплинних інфузій і т. д. Ці ін'єктовані препарати можна одержати за допомогою загальновідомих способів. Наприклад, ін'єктовані препарати можна одержати, наприклад, за допомогою розчинення, суспендування або перетворення в емульсію антитіла або його солей, описаних вище, у стерильному водному середовищі або масляному середовищі, звичайно використовуваному для ін'єкцій. Як водне середовище для ін'єкцій застосовують, наприклад, фізіологічний сольовий розчин, ізотонічний розчин, що містить глюкозу й інші допоміжні засоби, і т. д., що можуть використовуватися в сполученні з відповідним солюбілізатором, таким як спирт (наприклад, етиловий спирт), поліспирт (наприклад, пропіленгліколь, поліетиленгліколь), неіонна поверхнево-активна речовина [наприклад, полісорбат 80, HCO-50 (продукт приєднання поліоксіетилену (50 моль) до гідрогенізованої рицинової олії)], і т. д. Як масляне середовище використовують, наприклад, кунжутну олію, соєву олію і т. д., що можуть використовуватися в сполученні з відповідним солюбілізатором, таким як бензилбензоат, бензиловий спирт і т. д. Ін'єкційним розчином, одержаним таким чином, переважно, наповнюють придатну ампулу. Переважно, фармацевтичні композиції для перорального або парентерального застосування, описані вище, одержують у лікарських формах у стандартній дозі, що відповідає дозі активних інгредієнтів. Такі лікарські форми в стандартній дозі включають, наприклад, таблетки, пігулки, капсули, ін'єкційні розчини (ампули), супозиторії і т. д. Кількісний вміст раніше зазначеного антитіла складає, як правило, приблизно 5-500 мг у кожній лікарській формі в стандартній дозі, особливо у формі ін'єкційного розчину; переважно, коли раніше зазначене антитіло міститься в кількості, що складає приблизно 5-100 мг і приблизно 10-250 мг, у випадку інших лікарських форм. Терапевтичні застосування антитіл Антитіла за даним винаходом можна використовувати, крім іншого, для лікування, профілактики і/або ослаблення будь-якого захворювання або порушення, пов'язаного з активністю GDF8. Конкретніше, антитіла за даним винаходом можуть використовуватися для лікування будь-якого стану або хвороби, які можна поліпшити за допомогою збільшення м'язової сили і/або м'язової маси, і/або функціонування м'язів у індивідуума, або за допомогою позитивної зміни метаболізму (вуглеводного, ліпідного і процесування білків) у результаті блокування активності GDF8. Захворювання, порушення і стани, що наводяться як приклад, лікування яких можна проводити антитілами проти GDF8 за даним винаходом, включають, але ними не обмежуються, саркопенію, кахексію (або ідіопатичну, або на фоні інших станів, наприклад раку, хронічної ниркової недостатності або хронічного обструктивного захворювання легень), травму м'яза, виснаження м'язової маси і м'язову атрофію, наприклад м'язову атрофію або виснаження м'язової маси, викликані недовантаженням, знерухомленням, постільним режимом, травмою, терапевтичним лікуванням або хірургічним втручанням (наприклад, переломом тазостегнового суглоба, заміщенням тазостегнового суглоба, заміщенням колінного 17 UA 112521 C2 5 10 15 20 25 30 35 40 45 50 55 60 суглоба і т. д.) або необхідністю механічної вентиляції, або пов'язані з ними. Антитіла проти GDF8 за даним винаходом можуть також використовуватися для лікування, профілактики і/або ослаблення таких захворювань, як рак, ожиріння, діабет, артрит, розсіяний склероз, м'язова дистрофія, бічний аміотрофічний склероз, хвороба Паркінсона, остеопороз, остеоартрит, остеопенія, метаболічні синдроми (що включають, але без обмеження, діабет, ожиріння, порушення харчування, атрофію органів, хронічне обструктивне захворювання легень і анорексію). Даний винахід стосується терапевтичних схем введення, які включають введення антитіла проти GDF8 за даним винаходом в сполученні з принаймні одним додатковим терапевтично активним компонентом. Необмежувальні приклади таких додаткових терапевтично активних компонентів включають інші антагоністи GDF8 (наприклад, інгібітори GDF8 у вигляді невеликих молекул або інші антитіла проти GDF8 або молекули, що зв'язуються з GDF8), інгібітори факторів росту, імунодепресанти, протизапальні засоби, інгібітори метаболізму, інгібітори ферментів і цитотоксичні/цитостатичні агенти. Додатковий терапевтично активний компонент(и) можна вводити до введення антитіла проти GDF8 за даним винаходом, одночасно з ним або після такого введення. Застосування антитіл для діагностування Антитіла проти GDF8 за даним винаходом можуть також використовуватися для виявлення і/або вимірювання GDF8 у зразку, наприклад, з діагностичною метою. Наприклад, антитіло проти GDF8, або його фрагмент, можна використовуватися для діагностування стану або захворювання, що характеризується аберантною експресією (наприклад, надекспресією, недостатньою експресією, відсутністю експресії і т. д.) GDF8. Діагностичні дослідження GDF8, що наводяться як приклад, можуть включати, наприклад, приведення зразка, одержаного від пацієнта, у контакт з антитілом проти GDF8 за даним винаходом, при цьому антитіло проти GDF8 помічене виявлюваною міткою або молекулою репортера. Альтернативно, у випадку застосувань для діагностування немічене антитіло проти GDF8 може використовуватися в сполученні з другим антитілом, що саме є виявлюваним чином міченим. Виявлюваною міткою 3 14 32 35 125 або молекулою репортера може бути радіоізотоп, такий як H, C, P, S або I; флуоресцентна або хемілюмінесцентна складова, така як флуоресцеїнізотіоціанат або родамін; або фермент, такий як лужна фосфатаза, β-галактозидаза, пероксидаза хрону або люцифераза. Конкретні дослідження, що наводяться як приклад, які можуть використовуватися для виявлення або вимірювання GDF8 у зразку, включають імуноферментний твердофазний аналіз (ELISA), радіоімуноаналіз (RIA) і клітинний сортинг з активацією флуоресценції (FACS). Зразки, які можуть використовуватися в діагностичних дослідженнях GDF8 відповідно до даного винаходу, містять будь-який зразок тканини або рідини, який можна одержати від пацієнта, що містить виявлювані кількості білка GDF8, або його фрагментів, у нормальних або патологічних умовах. Як правило, будуть визначатися рівні GDF8 у конкретному зразку, одержаному від здорового пацієнта (наприклад, пацієнта, не ураженого захворюванням або станом, пов'язаним з анормальними рівнями або активністю GDF8), для встановлення на початку вихідного, або стандартного, рівня GDF8. Цей вихідний рівень GDF8 можна потім зіставити з рівнями GDF8, визначеними в зразках, одержаних від індивідуумів з підозрою на наявність пов'язаного з GDF8 захворювання або стану. ПРИКЛАДИ Приклад 1. Створення антитіл людини проти GDF8 людини Мишей можна піддати імунізації будь-яким способом, відомим у даній галузі (див., наприклад, Harlow і Lane, вище). В одному з варіантів здійснення антиген GDF8 вводять безпосередньо, разом з ад'ювантом для стимуляції імунної відповіді, миші VELOCIMMUNE®, що містить ДНК, яка кодує варіабельні області важкого ланцюга і легкого ланцюга каппа Ig людини. Придатні ад'юванти містять повний і неповний ад'ювант Фрейнда, ад'ювантну систему MPL+TDM (Sigma) або RIBI (мурамілдипептиди) (дивіться О'Hаgаn, 2000, Vaccine Adjuvant, by Human Press, Totawa, NJ). Гуморальну відповідь відслідковують за допомогою стандартного, специфічного відносно антигену імуноаналізу. Після досягнення бажаної імунної відповіді, в одному з варіантів здійснення, експресуючі антитіла B-клітини одержують і зливають із клітинами мієломи миші для збереження їх життєздатності й утворення ліній гібридомних клітин. Лінії гібридомних клітин піддають скринінгу і відбору для ідентифікації ліній клітин, що одержують специфічні відносно антигену антитіла. Альтернативно, специфічні відносно антигену гібридомні клітини можна виділити за допомогою проточної цитометрії. Коротко, після злиття з клітинами мієломи об'єднані гібридомні клітини вирощують протягом 10 днів у середовищі HAT. Потім клітини збирають і піддають забарвленню міченим біотином GDF8 у концентрації 2 мкг/мл протягом однієї години, з 18 UA 112521 C2 5 10 15 20 наступним додаванням фікоеритрину-стрептавідину. Флуоресцентно мічені клітини сортують за допомогою проточної цитометрії (одну клітину в кожну ямку 96-ямкового планшета, що містить середовище для вирощування гібридоми), культивують протягом 8-10 днів, і кондиціоновані середовища скринують на предмет присутності функціонально бажаних моноклональних антитіл. В іншому варіанті здійснення антитіла проти GDF8 одержують через пряме виділення спленоцитів. Специфічні відносно антигену антитіла виділяють безпосередньо з антигенімунізованих B-клітин без злиття з клітинами мієломи, як описано в заявці на патент США № 2007/0280945A1. Стабільні лінії рекомбінантних, експресуючих антитіла клітин CHO установлюють, виходячи з виділених специфічних рекомбінантів. Приклад 2. Аналіз використання генів З метою аналізу структури продукованих антитіл були клоновані і секвеновані нуклеїнові кислоти, що кодують варіабельні області антитіл. Виходячи з послідовності нуклеїнової кислоти і передбаченої амінокислотної послідовності антитіл, було визначене використання генів для кожного ланцюга антитіла. У таблиці 1 викладене використання генів для вибраних антитіл відповідно до даного винаходу. Ідентифікатори антитіл (HCVR/LCVR): 21-E5 (SEQ ID NO:34/42); 21-B9 (SEQ ID NO:18/26); 21-E9 (SEQ ID NO:98/106); 21-A2 (SEQ ID NO:2/10); 22-D3 (SEQ ID NO:50/58); 22-E6 (SEQ ID NO:66/74); 22-G10 (SEQ ID NO:82/90); 1A2 (SEQ ID NO:226/234); 20B12 (SEQ ID NO:274/282); 58C8 (SEQ ID NO:242/250); 19F2 (SEQ ID NO:258/266); 8D12-1 (SEQ ID NO:114/122); 4E3-7 (SEQ ID NO:194/202); 9B11-12 (SEQ ID NO:162/170); 4B9 (SEQ ID NO:226/234); 1H4-5 (SEQ ID NO:210/218); 9B4-3 (SEQ ID NO:178/186); 3E2-1 (SEQ ID NO:290/298); 4G3-25 (SEQ ID NO:306/314); 4B6-6 (SEQ ID NO:130/138); H4H1657N2 (SEQ ID NO:360/368); H4H1669P (SEQ ID NO:376/384). Таблиця 1 Антитіло 21-Е5 21-В9 21-Е9 21-А2 22-D3 22-Е6 22-G10 1А2 20В12 58С8 19F2 8D12-1 4ЕЗ-7 9В11-12 4В9 1Н4-5 9В4-3 ЗЕ2-1 ЗА4-3 4G3-25 4В6-6 H4H1657N2 Н4Н1669Р Варіабельна область важкого ланцюга VH 4-39 4-39 4-39 3-23 3-21 4-39 2-5 3-23 3-23 3-23 3-30 3-30 3-23 3-23 3-23 3-30 3-23 4-34 3-21 3-30 3-30 3-23 3-33 0 3-22 3-22 3-22 1-7 5-5 3-22 1-7 1-7 6-13 1-7 1-26 1-7 1-7 1-7 1-7 6-13 1-7 4-4 5-5 3-3 1-7 2-21 3-9 JH 5 5 5 4 4 5 4 3 6 3 4 4 4 3 3 6 4 4 4 4 4 6 6 Варіабельна область легкого ланцюга VK JK 1-17 1 1-17 1 1-17 1 3-15 4 1-17 2 1-17 1 1-16 4 3-15 4 3-15 4 3-15 2 2-28 3 2-137* 5* 3-15 4 3-15 4 3-15 4 3-15 4 3-15 4 1-9 4 1-17 1 2-28 5 2-137* 5* 1-27 4 1-12 4 25 30 Контрольні конструкції, використовувані в наступних прикладах З метою порівняння в наступні експерименти були включені різні контрольні конструкції (антитіла проти GDF8 і інші антагоністи GDF8). Розроблено наступні контрольні конструкції: контроль I: антитіло людини проти GDF8, що містить варіабельні області важкого і легкого ланцюгів, які мають амінокислотні послідовності відповідних доменів "Myo29" (тобто SEQ ID NO:16 і 18), розкрите в патенті США № 7261893; контроль II: антитіло людини проти GDF8, що 19 UA 112521 C2 5 10 15 20 містить варіабельні області важкого і легкого ланцюгів, які мають амінокислотні послідовності відповідних доменів "2_112_K" (тобто SEQ ID NO:118 і 120), розкрите в заявці на патент США № 2006/0263354; контроль III: злита конструкція ActRIIB-Fc, що має амінокислотну послідовність SEQ ID NO:391; і контроль IV: злита конструкція варіант ActRIIB-Fc, ідентична контролю III за виключенням того, що аланін у положенні 64 SEQ ID NO:391 [A64] замінений аргініном [R64] (не всі контрольні конструкції використовувалися в кожному прикладі). Приклад 3. Визначення афінності зв'язування з антигеном Рівноважні константи дисоціації (значення KD) для зв'язування антигену з вибраними антитілами були визначені відповідно до кінетики поверхневих явищ, використовуючи аналіз за допомогою поверхневого плазмонного резонансу в режимі реального часу з використанням TM біосенсора (BIACORE 2000). Кожне вибране антитіло фіксували або на поверхні з козячими поліклональними антитілами проти IgG миші, або на поверхні з козячими поліклональними антитілами проти Fc людини (hFc) (Jackson ImmunoResearch Lab.), утвореній завдяки прямому TM хімічному зв'язку з чипом BIACORE для утворення поверхні з фіксованими антитілами. Гомодимер GDF8 людини, гомодимер hGDF11 або гомодимер hGDF5 у концентрації 25 нМ подавали з використанням ін'єкції по поверхнях з фіксованими антитілами, і стежили за зв'язуванням антигену з антитілом і їх дисоціацією в режимі реального часу при кімнатній температурі. Виконували кінетичний аналіз для розрахунку KD, констант швидкостей дисоціації (kd), констант швидкостей асоціації (ka) інапівперіоду дисоціації комплексу антиген/антитіло (таблиця 2). Таблиця 2 Антитіло 21-Е5 21-В9 21-Е9 21-А2 22-D3 22-Е6 22-G10 1А2 20B12 58C8 19F2 8D12-1 4E3-7 9B11-12 4B9 1H4-5 9B4-3 3E2-1 3A4-3 4G3-25 4B6-6 Контроль І Контроль II 25 GDF8 KD (нМ) 0.26 0.12 0.14 0.40 1.23 0.26 0.250 0.32 0.86 0.62 0.50 0.66 1.89 1.45 0.55 0.95 1.18 2.55 1.07 3.90 0.95 0.05 0.3 GDF11 T1/2 (хв.) 138 126 155 78 34 148 71 60 39 56 38 95 27 39 55 54 50 45 137 25 121 191 41 KD (нМ) 0.12 0.064 0.07 0.90 1.09 0.12 0.73 0.30 2.08 0.44 1.87 1.33 1.41 1.09 1.48 1.08 0.70 0.51 1.41 0.55 0.08 T1/2 (хв.) 116 133 221 21 21 87 50 28 2 30 23 29 29 34 24 32 79 71 39 82 136 Вищевикладений експеримент також проводили з GDF8, що наноситься по поверхні з фіксованими антитілами - антитілами-кандидатами H4H1669P або H4H1657N2. Попередні дані виявили дуже повільну швидкість дисоціації для обох антитіл, що означає KD, яка складає 1-2 пМ або менше. Значення KD для зв'язування антигену з вибраними антитілами також визначали, як описано вище, з використанням модифікованого рухомого буфера, що не містить BSA. 20 UA 112521 C2 Таблиця 3 Антитіло 1A2-mlgG 1A2-hlgG 8D12 Контроль І Контроль II 5 10 15 GDF8 KD (нМ) 0.018 0.006 0.016 0.002 0.071 GDF11 T1/2 (хв.) 152 340 840 1301 62 KD (нМ) 0,926 0.640 NB 0.001 1.580 T1/2 (хв.) 1 6 105 7 Були проведені додаткові експерименти по зв'язуванню антигену, у яких GDF8 і GDF11 наносили по поверхні вибраних антитіл проти GDF8 і контрольних антитіл при 25ºC і 37ºC. Рівноважні константи дисоціації (значення KD) для зв'язування антигену з вибраними антитілами були визначені відповідно до кінетики поверхневих явищ, використовуючи аналіз за допомогою поверхневого плазмонного резонансу в режимі реального часу з використанням біосенсора TM (BIACORE T100). Кожне вибране антитіло і контроль фіксували на поверхні з козячими поліклональними антитілами проти hFc (Jackson ImmunoResearch Lab., каталожний # 109-005TM 098), утвореній завдяки прямому хімічному зв'язку з чипом біосенсора BIACORE CM5 для утворення поверхні з фіксованими антитілами. Різні концентрації (2,5-0,625 нМ, 2-кратні розведення) гомодимеру hGDF8 або гомодимеру hGDF11 (або в деяких експериментах, активіну A) подавали з використанням ін'єкції по поверхнях з фіксованими антитілами, і стежили за зв'язуванням антигену з антитілом і їх дисоціацією в режимі реального часу. Виконували кінетичний аналіз для розрахунку KD, констант швидкостей дисоціації (kd), констант швидкостей асоціації (ka) і напівперіоду дисоціації комплексу антиген/антитіло. Результати підсумовані в таблиці 4 (NB - немає зв'язування). Таблиця 4 25 °С Досліджуваний Інгібітор антиген GDF8 Н4Н1669Р GDF11 GDF8 H4H1657N2 GDF11 Активін А GDF8 1A2-hlgG1 GDF11 GDF8 Контроль І (Муо29) GDF11 Активін А GDF8 Контроль III (ActRIlB-hFc GDF11 [A64]) Активін А GDF8 Контроль IV (ActRIlBGDF11 hFc [R64]) Активін А GDF8 Підібране по ізотопу антитіло як негативний GDF11 контроль Активін А 20 25 37 °C KD(M) T1/2 (хв.) 3.93Н-11 NB 2.83Е-11 NB NB 6.23Е-11 NB 1.03Е-11 1.46Ε-11 NB 3.07Е-11 2.38Е-11 8.50Е-12 2.13Е-11 3,00Е-12 3.00Е-І2 NB NB NB 131 NB 202 NB NB 96 NB 273 221 NB 111 132 196 238 231 439 NB NB NB KD(M) T1/2 (хв.) 5.84E-11 40 NB NB 3.79E-11 91 NB NB He визначено 4.62E-11 39 NB NB 2.44E-11 70 2.74E-11 56 He визначено 6.40E-12 104 9.92E-12 53 He визначено He визначено NB NB NB NB He визначено Як продемонстровано вище, всі антитіла H4H1669P, H4H1657N2 і 1A2-hIgG1 за даним винаходом виявляли сильне зв'язування з GDF8, але не з GDF11. Навпаки, контрольні молекули продемонстрували зв'язуванні і з GDF8, і з GDF11. Приклад 4. Блокування антитілами реакції відповіді Smad2/люцифераза Аналіз GDF8-індукованої люциферазної активності. Був розроблений біоаналіз для визначення здатності вибраних антитіл проти GDF8 до нейтралізації GDF8-опосередкованої або GDF11-опосередкованої клітинної функції in vitro, використовуючи створену лінію клітин A204 21 UA 112521 C2 5 (клітин рабдоміосаркоми людини, ATCC), що містить реагуючий на GDF8 або GDF11 промотор, який запускає експресію люциферази. Інгібування GDF8- або GDF11-індукованої люциферазної активності визначали наступним чином. Клітини засівали в 96-ямковий планшет у кількості 4 2×10 клітин/ямку в середовищах і інкубували протягом ночі при 37ºC, 5 % CО2. Білок антитіла (у послідовних розведеннях, починаючи з 25 нМ у середовищах для клітин) додавали в ямки з клітинами A204/Smad2 у трьох повторах у двох планшетах; у кожну ямку додавали GDF8 або GDF11 (0,8 нМ). Планшети інкубували при 37ºC, 5 % CО2 протягом 6 годин. Люциферазну активність визначали за допомогою додавання субстрату BRIGHT-GLO (Promega), і визначали значення IC50 (таблиця 5). 10 Таблиця 5 ІС50 (нМ) Антитіло GDF8 8.50 0.62 0.99 9.70 >20 2.20 10.50 0.80 >20 1.80 >20 2.40 10.40 5.50 0.47 3.10 >25 0.62 21-Е5 21-В9 21-Е9 21-А2 22-D3 22-Е6 22-G10 1А2 20В12 58С8 19F2 8D12-1 4ЕЗ-7 9В11-12 4В9 3А4-3 4G3-25 Контроль І GDF11 35 1.2 1.2 >10 >25 22.4 >25 1400 >25 >25 >25 >25 >25 >1000 >25 >20 >25 0.94 Здатність вибраних антитіл проти GDF8 до нейтралізації GDF8-опосередкованої або GDF11опосередкованої клітинної функції, крім того, досліджували, як описано вище, з використанням різних концентрацій GDF8 або GDF11 (таблиця 6) (NB = немає зв'язування). 15 Таблиця 6 ІС50 (нМ) Антитіло 1А2 8D12 21-Е5 H4H1657N2 Н4Н1669Р Контроль І Контроль II 20 25 GDF8 0,5 нМ 0.1963.11 2.34 0.78 0.90 0.172 1.6 GDF11 1 нМ 0.363 5.55 2.98 Не визначено Не визначено 0.398 4.15 0,4 нМ ~600 > 1000 6.9 NB NB 0.255 > 1000 0,8 нМ ~800 > 1000 10.5 Не визначено Не визначено 0.459 > 1000 Описаний вище біоаналіз повторювали, використовуючи химерну конструкцію GDF8/TGFβ-1 як активуючий пептид. Зокрема, у цьому експерименті була використана химера, що складається зі зрілого білка GDF8, у якому амінокислоти 48-72 були замінені відповідними амінокислотами TGFβ-1 (SEQ ID NO:352, також називана в даному описі "GDF8/TGFβ[48-72]"). Ця конструкція була створена, виходячи з експресійної конструкції, яка кодує повнорозмірний попередник GDF8 людини з послідовністю TGFβ-1 людини, що заміщає відповідну послідовність GDF8. Біоактивність досліджували в кондиціонованому середовищі, одержаному в результаті транзиторної трансфекції конструкції GDF8/TGFβ[48-72] у клітини CHO. Експресію і процесування оцінювали за допомогою Вестерн-блотингу. Кондиціоноване середовище 22 UA 112521 C2 5 10 концентрували в 20 разів, нагрівали до 80 °C протягом 5 хвилин для інактивації зв'язаного пропептиду GDF8, і активність у ньому оцінювали при послідовному розведенні в біоаналізі. Хоча точна концентрація химерного білка не була визначена в цих експериментах, характерна концентрація знаходилася в діапазоні 1-10 мкг/мл до концентрування. Як описано вище, клітини, які містять реагуючий на GDF8 промотор, що запускає експресію люциферази, засівали в 96-ямковий планшет. Вибрані антитіла (у послідовних розведеннях, починаючи з 100 нМ, у середовищах для клітин) додавали до кількості кондиціонованого середовища з химерним білком GDF8/TGFβ[48-72], що, як установлено, дає максимальну реакцію відповіді. Цю суміш попередньо інкубували протягом 45 хвилин і додавали до клітин-репортерів. Визначали люциферазну активність, і розраховували приблизні значення IC 50, представлені в таблиці 7 нижче. (NB = немає блокування). Таблиця 7 Блокування антитілами біоактивності GDF8/TGFβ[48-72] Антитіло 1A2-hFc 8D12-mFc H2M1657N2 Н1Н1669Р Контроль 1 15 20 25 30 35 40 45 ІС50 (нМ) 0.357 NB NB NB 0.402 Химерна конструкція GDF8/TGFβ[48-72] була здатна активувати експресію люциферази в цьому аналізі, а 1A2-hFc і контроль I були здатні блокувати біоактивність цієї конструкції. Однак антитіла H2M1657N2 і H1H1669P не блокували біоактивність химерної конструкції GDF8/TGFβ[48-72]. Оскільки було встановлено, що ці два антитіла блокують біоактивність GDF8 дикого типу в цій системі аналізу (див. таблицю 6), можна зробити висновок, що H2M1657N2 і H1H1669P імовірно виявляють свої біологічні ефекти в результаті взаємодії з епітопом, що знаходиться в межах амінокислот 48-72 GDF8. Приклад 5. Імуноблотинг фрагментів hGDF8, утворених в результаті розщеплення протеїназою K Аналіз за допомогою Вестерн-блотингу використовували для визначення імунореактивності досліджуваних і контрольних mAb з GDF8 людини, підданим протеолітичному розщепленню протеїназою K. Ферментативні реакції, що містять 1 мкг GDF8 людини і 0, 1 або 6 мкг протеїнази K, інкубували протягом або 10, або 45 хв. у буфері для розщеплення. Рівні аліквоти, що містять 20 % від кількості GDF8, присутнього у реакційній суміші (200 нг), вносили в 3 окремих 18 % SDS-ПААГ для електрофорезу в неденатуруючих умовах і піддавали перенесенню під дією електричного струму на мембрани PVDF. Кожну мембрану інкубували з першим антитілом у концентрації 2 мкг/мл, а потім з відповідним другим антитілом, кон'югованим з HRP. Результуюча імунореактивність для mAb у вигляді контролю I, mAb 1A2 і mAb 21-E9, відповідно, представлена на фіг. 1С. Результати вказують на втрату реактивності з GDF8 у випадку контрольного mAb (A) на доріжках 3 і 6. З очевидною відмінністю від цього, антитіло 1A2 зберігає імунореактивність з більш маленьким фрагментом GDF8 з молекулярною масою, що складає приблизно 17-19 кДа (фіг. 1B). Експеримент повторювали з використанням періодів часу розщеплення аж до 10 хв., 1 год. або 16 год., у присутності 0 або 4 мкг GDF8 і 0, 24 або 96 мкг протеїнази K. Результати (фіг. 2AB) показують, що за відсутності протеїнази K як контрольне mAb, так і mAb 1A2 мали імунореактивність з повнорозмірним зрілим (нерозщепленим) білком GDF8 (дивіться фіг. 2A-B, доріжки 2 і 7). У присутності протеїнази K імунореактивність втрачається у випадку mAb у вигляді контролю I в усі моменти часу. З очевидною відмінністю від цього, mAb 1A2 залишалося імунореактивним із фрагментом підданого розщепленню GDF8 людини (фіг. 2B, доріжки 3-6 і 8). Ці результати вказують на те, що mAb 1A2 має імунореактивність з більш маленьким фрагментом GDF8, що залишається інтактним у присутності протеїнази K, тоді як контрольне mAb втрачає імунореактивність з більш маленьким фрагментом (17-19 кДа). Модифікований аналіз за допомогою Вестерн-блотингу використовували, щоб далі визначити епітоп hGDF8 для вибраних антитіл проти hGDF8. Модифікація полягає в тому, що до інкубації специфічного для hGDF8 першого антитіла з мембраною кожне антитіло проти hGDF8 попередньо інкубували з 1000-кратним або 50-кратним молярним надлишком пептидних 23 UA 112521 C2 5 фрагментів hGDF8, що складаються з амінокислот 1-14, 17-42, 48-72 або 75-105. Результати вказують на те, що попередня інкубація пептидного фрагмента з амінокислот 48-72 у 50-кратній молярній надлишковій кількості була здатна блокувати зв'язування антитіла 8D12 з hGDF8. Приклад 6. Зв'язування антитіл з химерами GDF8 Було створено дванадцять химерних пробілків GDF8. У таблиці 8 представлені структури зрілих химерних білків GDF8. Химерні білки GDF8 включали дві сукупності: одна сукупність, що має різні заміни послідовностей GDF8 послідовностями BMP2, інша сукупність, що має різні заміни послідовностей GDF8 послідовностями TGFβ-1. Ці химерні білки використовували для перевірки зв'язування з антитілами і визначення місця такого зв'язування. 10 Таблиця 8 Назва химери В1 Т1 В17 Т17 В48 Т48 В65 Т65 В75 Т75 В91 Т91 15 20 Фрагмент зрілого GDF8 з замінами 1-15 1-15 17-42 17-42 48-72 48-72 65-72 65-72 75-105 75-105 91-105 91-105 Структура зрілого химерного білка GDF8 BMP2.1-13.GDF8.16-109 TGFb1.1-15.GDF8.16-109 GDF8.1-16.BMP2.15-42.GDF8.43-109 GDF8.1-16,TGFβ1.17-43.GDF8.43-109 GDF8.1-47.BMP2.48-77.GDF8.73-109 GDF8.1-47.TGFβ1.49-76.GDF8.73-109 GDF8.1-64.BMP2.68-77GDF8.73-109 GDF8.1-64.TGFβ1.69-76.GDF8.73-109 GDF8.1-74.BMP2.80-110DGF8.106-109 GDF8.1-74.ΤGFβ1.79-108.GDF8.106-109 GDF8.1-90.BMP2.96-110.GDF8.106-109 GDF8.1-90.TGFβ1.95-10GDF8.106-109 SEQ ID NO: 347 348 349 350 351 352 353 354 355 356 357 358 Різні химерні пробілки GDF8 транзиторно трансфікували в створену стабільну лінію клітин CHO.hFurin. Аналіз за допомогою Вестерн-блотингу, схожий з описаним вище аналізом, використовували для виявлення зв'язування різних антитіл проти hGDF8 з кожним з химерних білків GDF8. Коротко, 10 мкг супернатанту культури клітин CHO вносили на кожну доріжку SDSПААГ (для електрофорезу в неденатуруючих або денатуруючих умовах) і піддавали перенесенню під дією електричного струму на мембрану PVDF. Потім мембрану інкубували з антитілом проти GDF8 у концентрації 2 мкг/мл з наступним піддаванням впливу відповідного другого антитіла, кон'югованого з HRP. Як показано в таблиці 9, антитіло 8D12 було нездатне зв'язуватися ні з B48, ні з T48. Цей результат означав, що амінокислоти 48-72 зрілого GDF8 беруть участь у зв'язуванні антитіла 8D12 з GDF8. Таблиця 9 Білок GDF8 GDF8 дикого типу B48 B65 B91 T48 T65 25 30 Контроль І + + + + + + Неденатуруючі умови 8D12 Контроль II + + + + + + + + + + 1А2 + + + + + + Денатуруючі умови 4А7 8D2 + + + + + + + + + + Приклад 7. Зв'язування антитіл з пептидами hGDF8 Чотирнадцять пептидів (таблиця 10) було утворено зі зрілого білка hGDF8 (SEQ ID NO:340). Немодифіковані пептиди, біотинільовані з N-кінця пептиди (N-term) або біотинільовані з C-кінця пептиди (C-term) були використані для перевірки зв'язування з антитілами і визначення місця такого зв'язування. Кожний з повнорозмірного hGDF8, hGDF11 і немодифікованих пептидів по окремості зв'язували через аміногрупу з мікросферичними частинками (або сферами) xMAP® Multi-Analyte COOH. Кожний з біотинільованих пептидів зв'язували з мікросферичними частинками xMAP Multi-Analyte LumAvidin. Суспензію зв'язаних з пептидами сфер потім змішували з рівним об'ємом буфера для блокування (PBS, 1 % BSA, 0,05 % Tween-20, 0,05 % азиду натрію), а потім розподіляли по 96-ямковому планшету з фільтрами (Millipore, 24 UA 112521 C2 5 10 MULTISCREEN BV). До суспензії зв'язаних з пептидами сфер потім додавали контрольні і досліджувані антитіла проти hGDF8, у концентрації 2,5 мкг/мл, і допускали їх зв'язування зі сферами при кімнатній температурі протягом ночі. Піддані інкубації з антитілами сфери потім відмивали двічі PBST (PBS+0,05 % Tween-20) і інкубували або з кон'югованим з фікоеритрином (PE) антитілом проти hFC, або з PE-кон'югованим антитілом проти mFC при кімнатній температурі протягом 45 хв. Сфери знову відмивали, і сигнали, що вказують на зв'язування антитіл з різними пептидами, виявляли з використанням інструментальних засобів LUMINEX TM TM 100 або 200 . Як показано в таблиці 10, антитіло проти hGDF8-8D12 здатне до зв'язування з пептидами 4, 5, 6, 7, 8 і 9. Навпаки, антитіло проти hGDF8-H4H1657N2 не зв'язувалося з якимнебудь з пептидів (не представлені дані). Таблиця 10 No. Пептид 1 1-14 2 1-18 3 17-42 4 48-65 5 48-69 6 48-72 7 52-65 8 52-72 9 56-65 10 56-72 11 65-72 12 13 20 75-105 14 15 73-90 91-105 Модифікація Немодифікований N-term C-term Немодифікований N-term C-term Немодифікований N-term C-term Немодифікований C-term Немодифікований C-term Немодифікований N-term C-term Немодифікований C-term Немодифікований C-term C-term Немодифікований C-term Немодифікований N-term C-term Немодифікований N-term C-term Немодифікований N-term C-term Немодифікований N-term C-term Контроль І Контроль II ++ + +/+ 21-E5 + 1А2 +++ + + 8D12 +/+++ +++++ +++ +++++ +++ + +++++ +++ +++++ ++ +++++ ++ + +/+/+ Приклад 8. Ефект антитіл людини проти GDF8 на зв'язування GDF8 з активіном RIIB Спочатку зрілий білок hGDF8 зв'язували через аміногрупу зі сферами Luminex®. Потім покриті hGDF8 сфери Luminex® інкубували з різними антитілами проти hGDF8, у концентрації 1,25 мкг/мл, протягом 2 год. при кімнатній температурі. Потім до суміші сфери-антитіло додавали активін людини RIIB-mFc, і здійснювали інкубацію протягом додаткових 2 год. при кімнатній температурі. Потім сфери відмивали й забарвлювали кон'югованим з Rфікоеритрином (R-PE) поліклональним антитілом проти mFc, і визначали середню інтенсивність флуоресценції (MFI). Як показано в таблиці 11, хоча і контрольне mAb I, і антитіло 21-E5 були здатні до блокування зв'язування між hGDF8 і активіном людини RIIB, контрольне mAb II було 25 UA 112521 C2 здатне лише до часткового блокування зв'язування. Антитіло 1A2 не було здатне до блокування зв'язування hGDF8 зі своїм рецептором, активіном RIIB (таблиця 11, n=3). Таблиця 11 Антитіло Негативний контроль Контрольне мАт І Контрольне мАт II 1A2-hlgG 21-E5-hlgG 5 10 MFI 4,560 58 1,653 4,037 275 Приклад 9. Варіанти антитіла 8D12 Варіанти антитіла 8D12 з модифікованою LCVR були створені за допомогою модифікування однієї або більше з наступних амінокислот LCVR 8D12: A7S або T, A8P, 9PL, S18P, V19A, M21I, K27Q, F41Y, V42L, R44K, R55L або T, M56G або L, N58Y, L59R, A75D, R79K, A105G, L109V і L111I. Афінність зв'язування (KD) варіантів антитіл відносно hGDF8 визначали, використовуючи аналіз за допомогою поверхневого плазмонного резонансу в режимі реального часу з TM використанням біосенсора (BIACORE 3000), як описано вище, у модифікованому рухомому буфері, що не містить BSA (таблиця 12). Таблиця 12 Антитіло 8D12 8D12-v2 8D12-v3 KD (нМ) 0.071 0.520 0.380 T1/2 (хв.) 139 25 46 15 20 25 30 Також перевіряли зв'язування між варіантами антитіла і пептидами hGDF8, як описано вище в прикладі 7. Варіанти антитіла 8D12-v2 і 8D12-v3 продемонстрували сильне зв'язування з біотинільованими з C-кінця пептидами 4, 5, 7 і 10. Приклад 10. Ефект антитіл проти GDF8 на масу скелетної мускулатури Ефективність вибраних mAb проти GDF8 відносно викликання гіпертрофії скелетної мускулатури була визначена in vivo. Коротко, 20 самців мишей CB17 SCID, віком приблизно 9 тижнів, поділяли нарівно відповідно до ваги тіла на 4 групи. Вибране mAb (контроль I, 1A2, 21E5, 8D12, 1A2-hIgG або контроль II) вводили в трьох збільшуваних дозах, що складають 2,5 мг/кг/дозу, 5 мг/кг/дозу і 10 мг/кг/дозу. Як негативний контроль використовували Fc-фрагмент IgG людини. Антитіла вводили внутрішньоочеревинно двічі протягом першого тижня й один раз на тиждень протягом наступних трьох тижнів. У день 28 мишей піддавали евтаназії і зважували, і передні великогомілкові (TA) м'язи, литкові (GA) м'язи і чотириголові (Quad) м'язи, серце, селезінку і нирку висікали і зважували. Тканини приводили до вихідної ваги тіла і розраховували зміну ваги у відсотках у порівнянні з негативним контролем. Були повторені шість окремих експериментів з використанням антитіл: контролю I, 1A2, 21-E5, 8D12, 1A2-hIgG і контролю II (таблиці 13-18). Крім того, був також повторений експеримент із використанням більш високих збільшуваних доз антитіла у вигляді контролю I, що складають 10 мг/кг/дозу, 30 мг/кг/дозу і 50 мг/кг/дозу (таблиця 19). Результати представляли у вигляді збільшення у відсотках у порівнянні з негативним контролем середньоквадратичне відхилення. 35 26 UA 112521 C2 Таблиця 13 Доза Вага тіла Передній великогомілковий м'яз Литковий м'яз Чотириголовий м'яз Серце Нирка Селезінка 2.5 мг/кг 7.66 ± 1.37 Контроль 1 5 мг/кг 9.92 ± 1.82 10 мг/кг 13.99± 1.21 Негативний контроль 10 мг/кг 0.00 ± 1.41 13.84 ± 2.23 16.99 ± 2.16 13.68 ± 0.96 0.00 ± 2.71 10.58 ± 1.67 14.79 ± 1.55 2.05 ± 3.04 3.53 ± 1.39 39.82 ± 6.78 11.31 ± 2.44 15.99 ± 2.72 2.96 ± 2.96 3.56 ± 3.51 45.26 ± 19.10 12.90 ± 3.0 20.84±2.09 7.55 ± 1.61 5.66 ± 4.59 9.02 ± 3.08 0.00 ± 3.36 0.00 ± 1.84 0.00 ± 2.45 0.00 ± 2.82 0.00 ± 5.47 Таблиця 14 Доза Вага тіла Передній великогомілковий м'яз Литковий м'яз Чотириголовий м'яз Серце Нирка Селезінка 2.5 мг/кг 6.08 ± 1.08 1А2 5 мг/кг 9.96 ± 1.32 10 мг/кг 9.92 ± 1.09 Негативний контроль 10 мг/кг 0.00 ± 1.76 15.56 ± 1.54 18.24 ± 4.49 20.69 ± 3.13 0.00 ± 4.47 20.49 ± 1.84 26.92 ± 3.07 3.70 ± 1.31 1.28 ± 2.89 -8.07 ± 5.75 21.36 ± 2.79 30.15 ± 3.56 6.37 ± 2.27 2.89 ± 3.30 -10.00 ± 4.68 24.36 ± 3.46 33.09 ± 4.46 12.42 ± 2.70 5.31 ± 3.29 9.68 ± 9.19 0.00 ± 3.59 0.00 ± 4.05 0.00 ± 4.10 0.00 ± 4.39 0.00 ± 6.84 Таблиця 15 2.5мг/кг 4.16 ± 0.87 5 мг/кг 4.14 ± 2.82 10 мг/кг 5.21 ± 1.58 Негативний контроль 10 мг/кг 0.00 ± 1.15 13.86 ± 1.66 14.01 ± 2.41 10.32 ± 2.54 0.00 ± 1.65 7.70 ± 1.86 8.64 ± 1.31 -7.11 ± 1.00 -6.8 ± 2.83 29.81 ± 9.83 12.94 ± 1.10 13.57 ± 1.79 -7.14 ± 3.17 -3.2 ± 3.57 49.76 ± 7.86 8.13 ± 2.36 8.46 ± 3.22 . -5.51 ± 1.58 -0.32 ± 2.07 10.85 ± 6.63 0.00 ± 1.41 0.00 ± 1.94 0.00 ± 2.23 0.00 ± 3.93 0.00 ± 5.76 21-Е5 Доза Вага тіла Передній великогомілковий м'яз Литковий м'яз Чотириголовий м'яз Серце Нирка Селезінка Таблиця 16 2.5мг/кг 10.06 ± 0.86 5 мг/кг 12.76 ± 1.01 10 мг/кг 11.41 ± 1.35 Негативний контроль 10 мг/кг 0.00 ± 0.66 17.99 ± 1.53 21.30 ± 2.06 22.11 ± 3.20 0.00 ± 1.85 21.14 ± 1.19 26.74 ± 1.53 -1.61 ± 2.06 -1.06 ± 2.02 4.33 ± 6.34 23.10 ± 0.99 31.00 ± 1.61 3.63 ± 1.93 -4.26 ± 2.25 -9.04 ± 2.64 23.40 ± 3.72 28.80 ± 2.72 3.42 ± 2.52 -5.52 ± 3.83 -1.85 ± 6.26 0.00 ± 1.44 0.00 ± 0.94 0.00 ± 1.08 0.00 ± 3.66 0.00 ± 4.25 Антитіло 8D12 Доза Вага тіла Передній великогомілковий м'яз Литковий м'яз Чотириголовий м'яз Серце Нирка Селезінка 5 27 UA 112521 C2 Таблиця 17 Доза Вага тіла Передній великогомілковий м'яз Литковий м'яч Чотириголовий м'яч Серце Нирка Селезінка Антитіло 1A2hlgG 2.5 мг/кг 6.73 ± 1.51 5 мг/кг 3.84 ± 2.32 10 мг/кг 7.45 ± 2.91 10 мг/кг 0.00 ± 0.76 15.62 ± 2.4 12.09 ± 1.81 10.91 ± 3.33 0.00 ± 2.80 16.29 ± 1.02 19.39 ± 2.92 5.91 ± 3.81 1.70 ± 4.01 -15.44 ± 5.6 15.20 ± 2.54 20.03 ± 2.54 5.39 ± 2.77 1.20 ± 1.73 -30.08 ± 6.63 15.67 ± 3.60 19.73 ± 3.83 3.52 ± 3.16 1.39 ± 3.70 -23.90 ± 2.36 0.00 ± 2.13 0.00 ± 1.98 0.00 ± 3.14 0.00 ± 3.27 0.00 ± 11.32 Негативний контроль Таблиця 18 Контроль ІІ Доза Вага тіла Передній великогомілковий м'яз Литковий м'яч Чотириголовий м'яч Серце Нирка Селезінка 2.5 мг/кг 10.19 ± 1.20 5 мг/кг 10.83 ± 1.58 Негативний контроль 5 мг/кг 0.00 ± 1.17 14.70 ± 3.28 13.44 ± 4.13 0.00 ± 3.87 19.44 ± 2.08 14.35 ± 3.36 0.00 ± 1.80 18.92 ± 4.86 2.78 ± 5.09 1.84 ± 2.65 12.32 ± 5.60 13.00 ± 2.18 2.71 ± 6.72 0.41 ± 3.04 8.41 ± 3.38 0.00 ± 2.03 0.00 ± 0.69 0.00 ± 2.12 0.00 ± 4.31 Таблиця 19 Доза Вага тіла Передній великогомілковий м'яз Литковий м'яч Чотириголовий м'яч Серце Нирка Селезінка 5 10 10 мг/кг 9.20 ± 0.73 Контроль 1 30 мг/кг 13.62 ± 1.38 50 мг/кг 12.55 ± 1.71 Негативний контроль 10 мг/кг 0.00 ± 1.18 18.16 ± 1.51 25.58 ± 3.14 23.03 ± 2.00 0.00 ± 3.81 16.91 ± 2.08 23.72 ± 3.14 24.68 ± 2.73 0.00 ± 3.58 20.77 ± 1.01 1.55 ± 3.07 3.09 ± 1.90 8.22 ± 5.80 26.54 ± 3.68 3.11 ± 2.58 10.38 ± 5.08 6.90 ± 5.87 25.67 ± 3.32 2.11 ± 2.23 8.89 ± 3.59 -0.74 ± 1.85 0.00 ± 4.63 0.00 ± 1.96 0.00 ± 1.35 0.00 ± 7.38 Схожий експеримент був проведений, використовуючи антитіла H4H1657N2 і H4H1669P і контролі, що вводяться мишам SCID. Зокрема, самцям мишей SCID у віці 10 тижнів вводили підшкірно антитіло в дозі 10 мг/кг згідно з наступною схемою введення доз: 2 рази на тижні 1 і 1 раз на тиждень на тижнях 2 і 3. Загальний період часу лікування складав 28 днів. У випадку цього експерименту 5 мишам вводили підібране по ізотипу антитіло як негативний контроль; 5 мишам вводили контроль I (Myo29); 6 мишам вводили H4H657N2; і 6 мишам вводили H4H1669P. Результати підсумовані в таблиці 20 і представлені у вигляді збільшення у відсотках у порівнянні з негативним контролем середньоквадратичне відхилення. 28
ДивитисяДодаткова інформація
Назва патенту англійськоюAntibodies to human gdf8
Автори англійськоюStitt, Trevor, Latres, Esther
Автори російськоюСтитт Трэвор, Латрес Эстер
МПК / Мітки
МПК: A61P 3/00, A61P 21/00, C07K 16/22, A61K 39/395
Код посилання
<a href="https://ua.patents.su/140-112521-antitilo-proti-gdf8-lyudini.html" target="_blank" rel="follow" title="База патентів України">Антитіло проти gdf8 людини</a>
Попередній патент: Спосіб підвищення стійкості рослин
Наступний патент: Спосіб терапії злоякісної пухлини
Випадковий патент: Горілка особлива "рівненська"