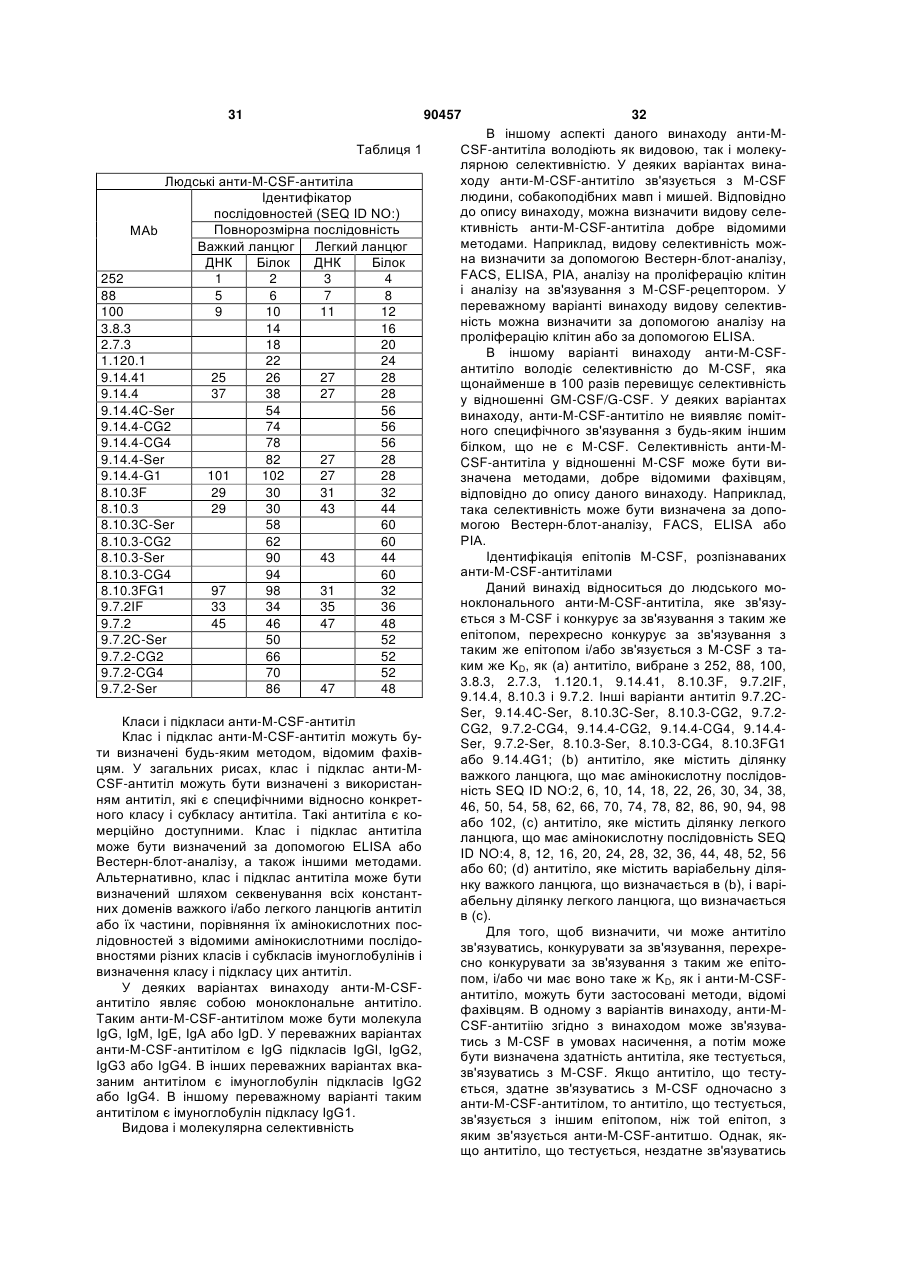
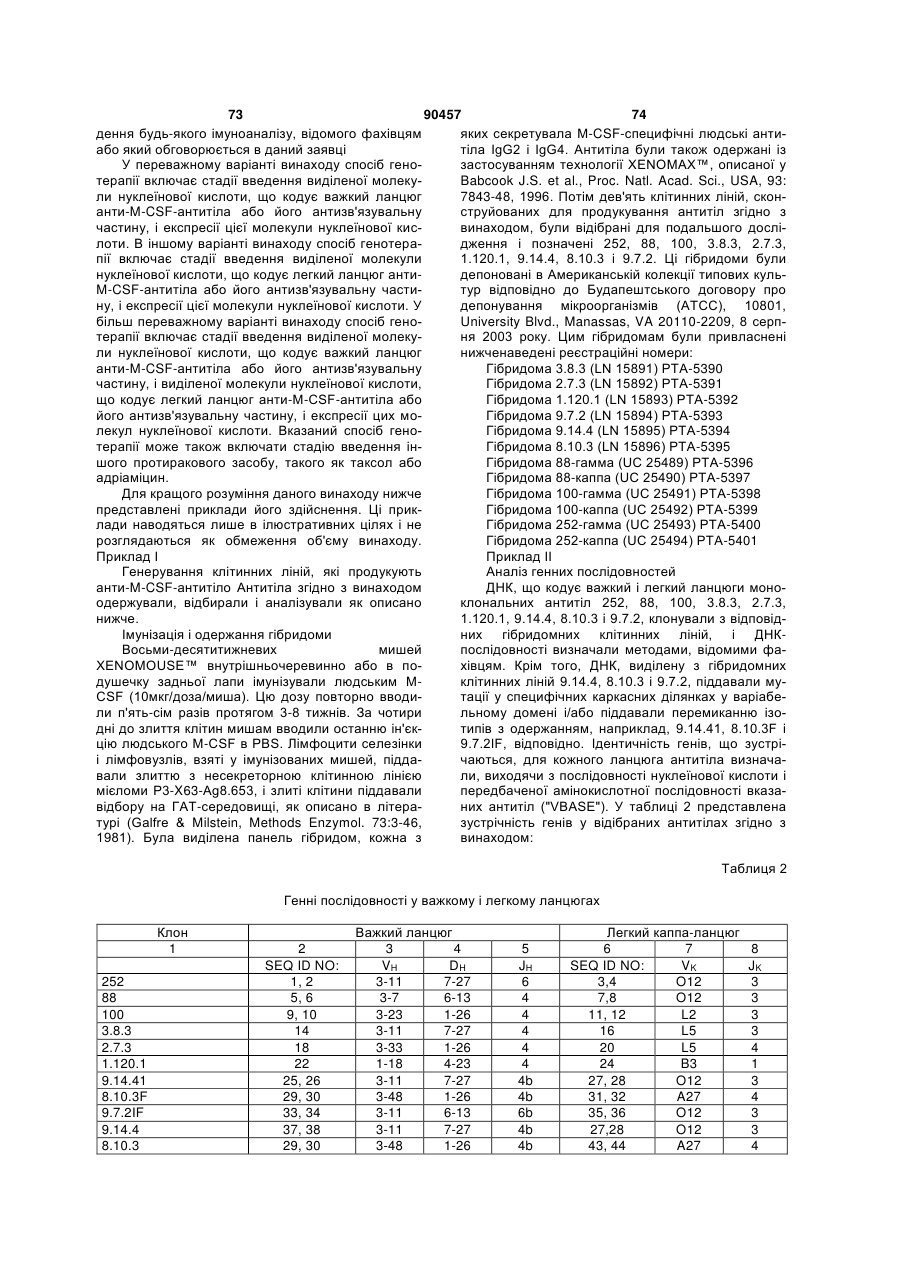
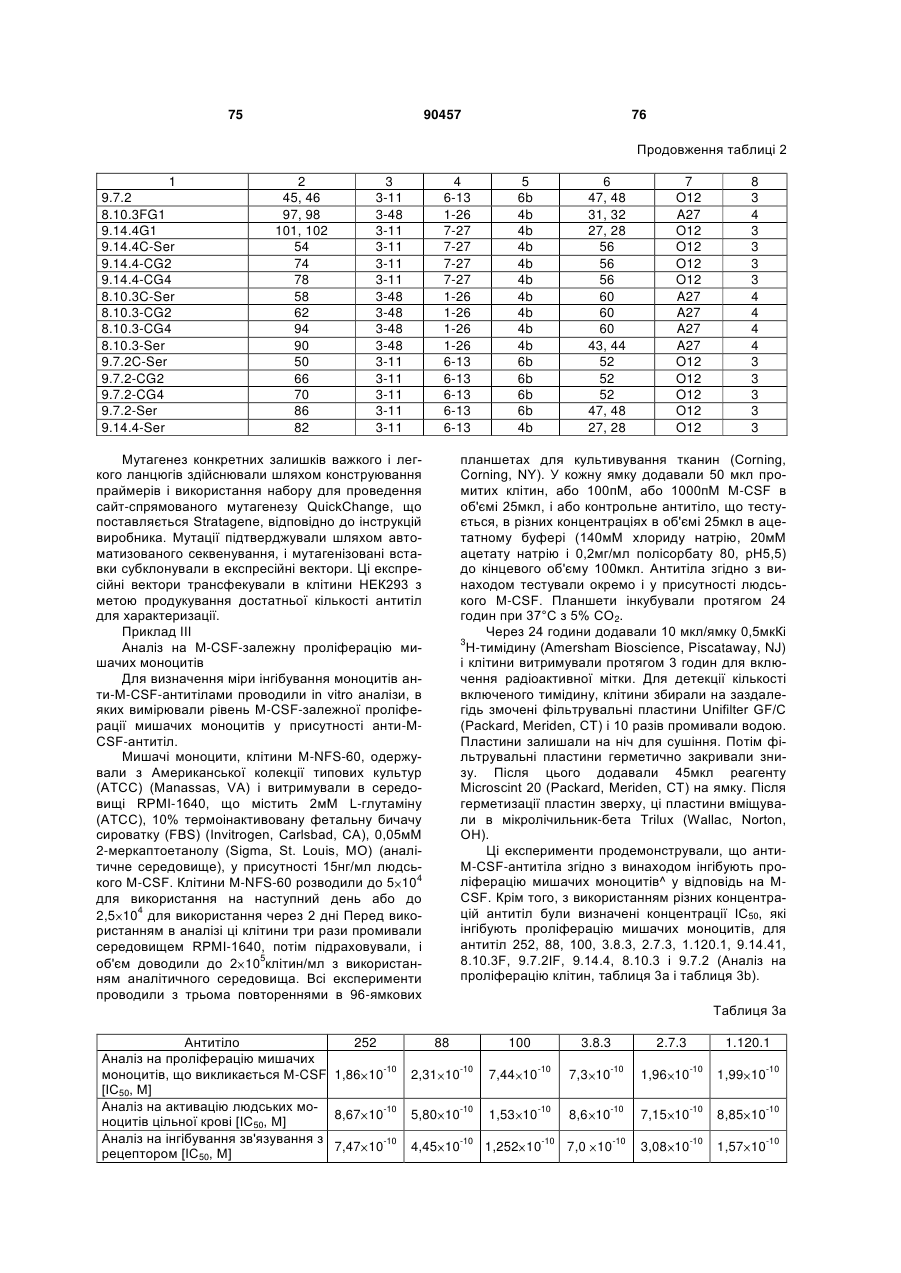
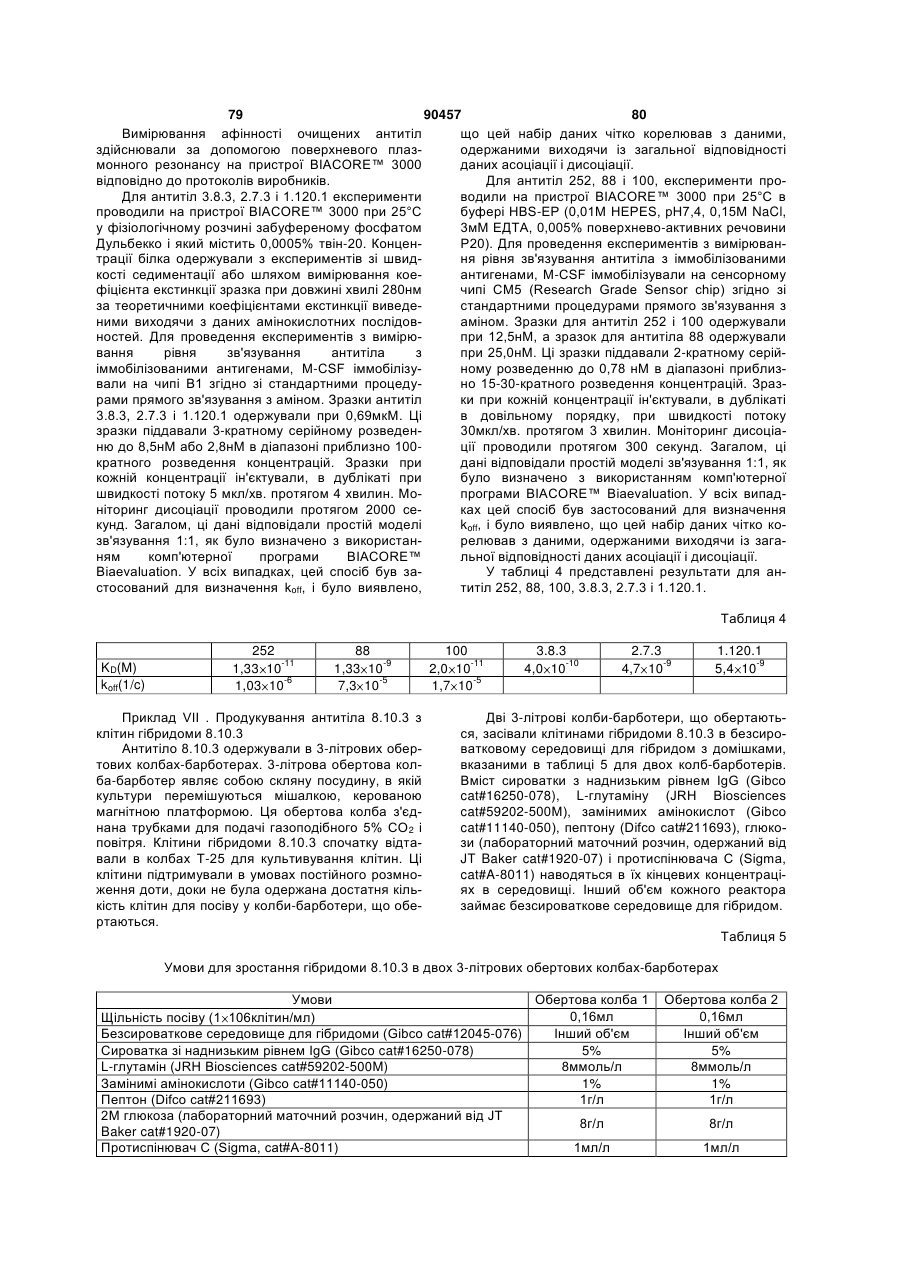
Людське моноклональне антитіло, яке специфічно зв’язується з m-csf людини та блокує зв’язування m-csf з c-fms
Номер патенту: 90457
Опубліковано: 11.05.2010
Автори: Хаак-Френдшо Мері, Моблі Джеймс Леслі, Девалараджа Мадхав Нарасімха, Келлєрманн Зірід-Аймеє, Фолтц Ян, Бедіан Вахе, Лоу Джозеф Едвін
Формула / Реферат
1. Людське моноклональне антитіло, яке специфічно зв'язується з M-CSF людини і блокує зв'язування M-CSF з c-fms, або його антигензв'язувальна частина, де антитіло містить амінокислотну послідовність варіабельного домену важкого ланцюга (VН) і амінокислотну послідовність варіабельного домену легкого ланцюга (VL), у вказаному порядку:
a) SEQ ID NO:2 і 4;
b) SEQ ID NO:6 і 8;
c) SEQ ID NO:10 і 12;
d) SEQ ID NO:14 і 16;
e) SEQ ID NO:18 і 20;
f) SEQ ID NO:22 і 24;
g) SEQ ID NO:26 і 28;
h) SEQ ID NO:38 і 28;
i) SEQ ID NO:54 і 56;
j) SEQ ID NO:74 і 56;
k) SEQ ID NO:78 і 56;
l) SEQ ID NO:82 і 28;
m) SEQ ID NO:102 і 28;
n) SEQ ID NO:30 і 32;
o) SEQ ID NO:30 і 44;
p) SEQ ID NO:58 і 60;
q) SEQ ID NO:62 і 60;
r) SEQ ID NO:90 і 44;
s) SEQ ID NO:94 і 60;
t) SEQ ID NO:98 і 32;
u) SEQ ID NO:34 і 36;
v) SEQ ID NO:46 і 48;
w) SEQ ID NO:50 і 52;
x) SEQ ID NO:66 і 52;
y) SEQ ID NO:70 і 52; або
z) SEQ ID NO:86 і 48.
2. Моноклональне антитіло або антигензв'язувальна частина за п. 1, де антитіло вибране із групи, що складається з
а) антитіла, що містить амінокислотну послідовність важкого ланцюга, представлену в SEQ ID NO:2, і амінокислотну послідовність легкого ланцюга, представлену в SEQ ID NO:4, без сигнальних послідовностей;
b) антитіла, що містить амінокислотну послідовність важкого ланцюга, представлену в SEQ ID NO:6, і амінокислотну послідовність легкого ланцюга, представлену в SEQ ID NO:8, без сигнальних послідовностей;
с) антитіла, що містить амінокислотну послідовність важкого ланцюга, представлену в SEQ ID NO:10, і амінокислотну послідовність легкого ланцюга, представлену в SEQ ID NO:12, без сигнальних послідовностей;
d) антитіла, що містить амінокислотну послідовність важкого ланцюга, представлену в SEQ ID NO:14, і амінокислотну послідовність легкого ланцюга, представлену в SEQ ID NO:16, без сигнальних послідовностей;
е) антитіла, що містить амінокислотну послідовність важкого ланцюга, представлену в SEQ ID NO:18, і амінокислотну послідовність легкого ланцюга, представлену в SEQ ID NO:20, без сигнальних послідовностей;
f) антитіла, що містить амінокислотну послідовність важкого ланцюга, представлену в SEQ ID NO:22, і амінокислотну послідовність легкого ланцюга, представлену в SEQ ID NO:24, без сигнальних послідовностей;
g) антитіла, що містить амінокислотну послідовність важкого ланцюга, представлену в SEQ ID NO:26, і амінокислотну послідовність легкого ланцюга, представлену в SEQ ID NO:28, без сигнальних послідовностей;
h) антитіла, що містить амінокислотну послідовність важкого ланцюга, представлену в SEQ ID NO:38, і амінокислотну послідовність легкого ланцюга, представлену в SEQ ID NO:28, без сигнальних послідовностей;
i) антитіла, що містить амінокислотну послідовність важкого ланцюга, представлену в SEQ ID NO:54, і амінокислотну послідовність легкого ланцюга, представлену в SEQ ID NO:56, без сигнальних послідовностей;
j) антитіла, що містить амінокислотну послідовність важкого ланцюга, представлену в SEQ ID NO:74, і амінокислотну послідовність легкого ланцюга, представлену в SEQ ID NO:56, без сигнальних послідовностей;
k) антитіла, що містить амінокислотну послідовність важкого ланцюга, представлену в SEQ ID NO:78, і амінокислотну послідовність легкого ланцюга, представлену в SEQ ID NO:56, без сигнальних послідовностей;
l) антитіла, що містить амінокислотну послідовність важкого ланцюга, представлену в SEQ ID NO:82, і амінокислотну послідовність легкого ланцюга, представлену в SEQ ID NO:28, без сигнальних послідовностей;
m) антитіла, що містить амінокислотну послідовність важкого ланцюга, представлену в SEQ ID NO:102, і амінокислотну послідовність легкого ланцюга, представлену в SEQ ID NO:28, без сигнальних послідовностей;
n) антитіла, що містить амінокислотну послідовність важкого ланцюга, представлену в SEQ ID NO:30, і амінокислотну послідовність легкого ланцюга, представлену в SEQ ID NO:32, без сигнальних послідовностей;
о) антитіла, що містить амінокислотну послідовність важкого ланцюга, представлену в SEQ ID NO:30, і амінокислотну послідовність легкого ланцюга, представлену в SEQ ID NO:44, без сигнальних послідовностей;
р) антитіла, що містить амінокислотну послідовність важкого ланцюга, представлену в SEQ ID NO:58, і амінокислотну послідовність легкого ланцюга, представлену в SEQ ID NO:60, без сигнальних послідовностей;
q) антитіла, що містить амінокислотну послідовність важкого ланцюга, представлену в SEQ ID NO:62, і амінокислотну послідовність легкого ланцюга, представлену в SEQ ID NO:60, без сигнальних послідовностей;
r) антитіла, що містить амінокислотну послідовність важкого ланцюга, представлену в SEQ ID NO:90, і амінокислотну послідовність легкого ланцюга, представлену в SEQ ID NO:44, без сигнальних послідовностей;
s) антитіла, що містить амінокислотну послідовність важкого ланцюга, представлену в SEQ ID NO:94, і амінокислотну послідовність легкого ланцюга, представлену в SEQ ID NO:60, без сигнальних послідовностей;
t) антитіла, що містить амінокислотну послідовність важкого ланцюга, представлену в SEQ ID NO:98, і амінокислотну послідовність легкого ланцюга, представлену в SEQ ID NO:32, без сигнальних послідовностей;
u) антитіла, що містить амінокислотну послідовність важкого ланцюга, представлену в SEQ ID NO:34, і амінокислотну послідовність легкого ланцюга, представлену в SEQ ID NO:36, без сигнальних послідовностей;
v) антитіла, що містить амінокислотну послідовність важкого ланцюга, представлену в SEQ ID NO:46, і амінокислотну послідовність легкого ланцюга, представлену в SEQ ID NO:48, без сигнальних послідовностей;
w) антитіла, що містить амінокислотну послідовність важкого ланцюга, представлену в SEQ ID NO:50, і амінокислотну послідовність легкого ланцюга, представлену в SEQ ID NO:52, без сигнальних послідовностей;
x) антитіла, що містить амінокислотну послідовність важкого ланцюга, представлену в SEQ ID NO:66, і амінокислотну послідовність легкого ланцюга, представлену в SEQ ID NO:52, без сигнальних послідовностей;
y) антитіла, що містить амінокислотну послідовність важкого ланцюга, представлену в SEQ ID NO:70, і амінокислотну послідовність легкого ланцюга, представлену в SEQ ID NO:52, без сигнальних послідовностей; і
z) антитіла, що містить амінокислотну послідовність важкого ланцюга, представлену в SEQ ID NO:86, і амінокислотну послідовність легкого ланцюга, представлену в SEQ ID NO:48, без сигнальних послідовностей.
3. Моноклональне антитіло або антигензв'язувальна частина за п. 1, що містить амінокислотні послідовності CDR1, CDR2 і CDR3 в SEQ ID NO:32, і амінокислотні послідовності CDR1, CDR2 і CDR3 в SEQ ID NO:30.
4. Моноклональне антитіло або антигензв'язувальна частина за п. 1, що містить амінокислотні послідовності CDR1, CDR2 і CDR3 в SEQ ID NO:28 і амінокислотні послідовності CDR1, CDR2 і CDR3 в SEQ ID NO:26.
5. Моноклональне антитіло за п. 2, що містить амінокислотну послідовність важкого ланцюга SEQ ID NO:30 без сигнальної послідовності й амінокислотну послідовність легкого ланцюга SEQ ID NO:32 без сигнальної послідовності.
6. Моноклональне антитіло за п. 2, що містить амінокислотну послідовність важкого ланцюга SEQ ID NO:26 без сигнальної послідовності й амінокислотну послідовність легкого ланцюга SEQ ID NO:28 без сигнальної послідовності.
7. Моноклональне антитіло або антигензв'язувальна частина за будь-яким з пп. 1-6, де С-кінцевий лізин важкого ланцюга антитіла або частини відсутній.
8. Застосування моноклонального антитіла або антигензв'язувальної частини за будь-яким з пп. 1-7 для виготовлення фармацевтичної композиції для лікування стану, вибраного із групи, яка складається з артриту, псоріатичного артриту, анкілозувального спондиліту, синдрому Рейтера, ревматоїдного артриту, подагри, травматичного артриту, коревого артриту й гострого синовіту, і інших артритних станів, сепсису, септичного шоку, ендотоксичного шоку, сепсису, викликаного грам-негативними бактеріями, синдрому токсичного шоку, хвороби Альцгеймера, інсульту, нейротравми, астми, респіраторного дистрес-синдрому у дорослих, церебральної малярії, хронічного запального захворювання легень, силікозу, саркоїдозу легень, резорбції кістки, остеопорозу, рестенозу, реперфузійного ураження серця й нирок, тромбозу, гломерулонефриту, діабету, реакції "трансплантат проти хазяїна", відторгнення алотрансплантату, запального захворювання кишечнику, хвороби Крона, виразкового коліту, розсіяного склерозу, дегенерації м'язів, екземи, контактного дерматиту, псоріазу, сонячних опіків і гострого кон'юнктивіту у об'єктів, що потребують цього.
9. Застосування за п. 8, де вказаним станом є ревматоїдний артрит.
10. Застосування за п. 8, де моноклональне антитіло містить SEQ ID NO:30 і 32 без сигнальної послідовності або SEQ ID NO:26 і 28 без сигнальної послідовності.
11. Виділена клітинна лінія, яка продукує моноклональне антитіло або антигензв'язувальну частину за будь-яким з пп. 1-7
12. Виділена клітинна лінія за п. 11, яка продукує моноклональне антитіло, що включає
a) SEQ ID NO:2 і 4 без сигнальної послідовності;
b) SEQ ID NO:6 і 8 без сигнальної послідовності;
c) SEQ ID NO:10 і 12 без сигнальної послідовності;
d) SEQ ID NO:14 і 16 без сигнальної послідовності;
e) SEQ ID NO:18 і 20 без сигнальної послідовності;
f) SEQ ID NO:22 і 24 без сигнальної послідовності;
g) SEQ ID NO:26 і 28 без сигнальної послідовності;
h) SEQ ID NO:38 і 28 без сигнальної послідовності;
i) SEQ ID NO:54 і 56 без сигнальної послідовності;
j) SEQ ID NO:74 і 56 без сигнальної послідовності;
k) SEQ ID NO:78 і 56 без сигнальної послідовності;
l) SEQ ID NO:82 і 28 без сигнальної послідовності;
m) SEQ ID NO:102 і 28 без сигнальної послідовності;
n) SEQ ID NO:30 і 32 без сигнальної послідовності;
o) SEQ ID NO:30 і 44 без сигнальної послідовності;
p) SEQ ID NO:58 і 60 без сигнальної послідовності;
q) SEQ ID NO:62 і 60 без сигнальної послідовності;
r) SEQ ID NO:90 і 44 без сигнальної послідовності;
s) SEQ ID NO:94 і 60 без сигнальної послідовності;
t) SEQ ID NO:98 і 32 без сигнальної послідовності;
u) SEQ ID NO:34 і 36 без сигнальної послідовності;
v) SEQ ID NO:46 і 48 без сигнальної послідовності;
w) SEQ ID NO:50 і 52 без сигнальної послідовності;
x) SEQ ID NO:66 і 52 без сигнальної послідовності;
y) SEQ ID NO:70 і 52 без сигнальної послідовності; або
z) SEQ ID NO:86 і 48 без сигнальної послідовності.
Текст
1. Людське моноклональне антитіло, яке специфічно зв'язується з M-CSF людини і блокує зв'язування M-CSF з c-fms, або його антигензв'язувальна частина, де антитіло містить амінокислотну послідовність варіабельного домену важкого ланцюга (VН) і амінокислотну послідовність варіабельного домену легкого ланцюга (VL), у вказаному порядку: a) SEQ ID NO:2 і 4; b) SEQ ID NO:6 і 8; c) SEQ ID NO:10 і 12; d) SEQ ID NO:14 і 16; e) SEQ ID NO:18 і 20; f) SEQ ID NO:22 і 24; g) SEQ ID NO:26 і 28; h) SEQ ID NO:38 і 28; i) SEQ ID NO:54 і 56; j) SEQ ID NO:74 і 56; k) SEQ ID NO:78 і 56; l) SEQ ID NO:82 і 28; m) SEQ ID NO:102 і 28; n) SEQ ID NO:30 і 32; o) SEQ ID NO:30 і 44; p) SEQ ID NO:58 і 60; 2 (19) 1 3 90457 4 g) антитіла, що містить амінокислотну послідовt) антитіла, що містить амінокислотну послідовність важкого ланцюга, представлену в SEQ ID ність важкого ланцюга, представлену в SEQ ID NO:26, і амінокислотну послідовність легкого ланNO:98, і амінокислотну послідовність легкого ланцюга, представлену в SEQ ID NO:28, без сигнальцюга, представлену в SEQ ID NO:32, без сигнальних послідовностей; них послідовностей; h) антитіла, що містить амінокислотну послідовu) антитіла, що містить амінокислотну послідовність важкого ланцюга, представлену в SEQ ID ність важкого ланцюга, представлену в SEQ ID NO:38, і амінокислотну послідовність легкого ланNO:34, і амінокислотну послідовність легкого ланцюга, представлену в SEQ ID NO:28, без сигнальцюга, представлену в SEQ ID NO:36, без сигнальних послідовностей; них послідовностей; i) антитіла, що містить амінокислотну послідовv) антитіла, що містить амінокислотну послідовність важкого ланцюга, представлену в SEQ ID ність важкого ланцюга, представлену в SEQ ID NO:54, і амінокислотну послідовність легкого ланNO:46, і амінокислотну послідовність легкого ланцюга, представлену в SEQ ID NO:56, без сигнальцюга, представлену в SEQ ID NO:48, без сигнальних послідовностей; них послідовностей; j) антитіла, що містить амінокислотну послідовw) антитіла, що містить амінокислотну послідовність важкого ланцюга, представлену в SEQ ID ність важкого ланцюга, представлену в SEQ ID NO:74, і амінокислотну послідовність легкого ланNO:50, і амінокислотну послідовність легкого ланцюга, представлену в SEQ ID NO:56, без сигнальцюга, представлену в SEQ ID NO:52, без сигнальних послідовностей; них послідовностей; k) антитіла, що містить амінокислотну послідовx) антитіла, що містить амінокислотну послідовність важкого ланцюга, представлену в SEQ ID ність важкого ланцюга, представлену в SEQ ID NO:78, і амінокислотну послідовність легкого ланNO:66, і амінокислотну послідовність легкого ланцюга, представлену в SEQ ID NO:56, без сигнальцюга, представлену в SEQ ID NO:52, без сигнальних послідовностей; них послідовностей; l) антитіла, що містить амінокислотну послідовy) антитіла, що містить амінокислотну послідовність важкого ланцюга, представлену в SEQ ID ність важкого ланцюга, представлену в SEQ ID NO:82, і амінокислотну послідовність легкого ланNO:70, і амінокислотну послідовність легкого ланцюга, представлену в SEQ ID NO:28, без сигнальцюга, представлену в SEQ ID NO:52, без сигнальних послідовностей; них послідовностей; і m) антитіла, що містить амінокислотну послідовz) антитіла, що містить амінокислотну послідовність важкого ланцюга, представлену в SEQ ID ність важкого ланцюга, представлену в SEQ ID NO:102, і амінокислотну послідовність легкого лаNO:86, і амінокислотну послідовність легкого ланнцюга, представлену в SEQ ID NO:28, без сигнацюга, представлену в SEQ ID NO:48, без сигнальльних послідовностей; них послідовностей. n) антитіла, що містить амінокислотну послідов3. Моноклональне антитіло або антигензв'язуваність важкого ланцюга, представлену в SEQ ID льна частина за п. 1, що містить амінокислотні NO:30, і амінокислотну послідовність легкого ланпослідовності CDR1, CDR2 і CDR3 в SEQ ID цюга, представлену в SEQ ID NO:32, без сигнальNO:32, і амінокислотні послідовності CDR1, CDR2 і них послідовностей; CDR3 в SEQ ID NO:30. о) антитіла, що містить амінокислотну послідов4. Моноклональне антитіло або антигензв'язуваність важкого ланцюга, представлену в SEQ ID льна частина за п. 1, що містить амінокислотні NO:30, і амінокислотну послідовність легкого ланпослідовності CDR1, CDR2 і CDR3 в SEQ ID NO:28 цюга, представлену в SEQ ID NO:44, без сигнальі амінокислотні послідовності CDR1, CDR2 і CDR3 них послідовностей; в SEQ ID NO:26. р) антитіла, що містить амінокислотну послідов5. Моноклональне антитіло за п. 2, що містить аміність важкого ланцюга, представлену в SEQ ID нокислотну послідовність важкого ланцюга SEQ ID NO:58, і амінокислотну послідовність легкого ланNO:30 без сигнальної послідовності й амінокислоцюга, представлену в SEQ ID NO:60, без сигнальтну послідовність легкого ланцюга SEQ ID NO:32 них послідовностей; без сигнальної послідовності. q) антитіла, що містить амінокислотну послідов6. Моноклональне антитіло за п. 2, що містить аміність важкого ланцюга, представлену в SEQ ID нокислотну послідовність важкого ланцюга SEQ ID NO:62, і амінокислотну послідовність легкого ланNO:26 без сигнальної послідовності й амінокислоцюга, представлену в SEQ ID NO:60, без сигнальтну послідовність легкого ланцюга SEQ ID NO:28 них послідовностей; без сигнальної послідовності. r) антитіла, що містить амінокислотну послідов7. Моноклональне антитіло або антигензв'язуваність важкого ланцюга, представлену в SEQ ID льна частина за будь-яким з пп. 1-6, де С-кінцевий NO:90, і амінокислотну послідовність легкого ланлізин важкого ланцюга антитіла або частини відсуцюга, представлену в SEQ ID NO:44, без сигнальтній. них послідовностей; 8. Застосування моноклонального антитіла або s) антитіла, що містить амінокислотну послідовантигензв'язувальної частини за будь-яким з пп. 1ність важкого ланцюга, представлену в SEQ ID 7 для виготовлення фармацевтичної композиції NO:94, і амінокислотну послідовність легкого ландля лікування стану, вибраного із групи, яка склацюга, представлену в SEQ ID NO:60, без сигнальдається з артриту, псоріатичного артриту, анкілоних послідовностей; зувального спондиліту, синдрому Рейтера, ревматоїдного артриту, подагри, травматичного артриту, 5 90457 6 коревого артриту й гострого синовіту, і інших артa) SEQ ID NO:2 і 4 без сигнальної послідовності; ритних станів, сепсису, септичного шоку, ендотокb) SEQ ID NO:6 і 8 без сигнальної послідовності; сичного шоку, сепсису, викликаного грамc) SEQ ID NO:10 і 12 без сигнальної послідовності; негативними бактеріями, синдрому токсичного d) SEQ ID NO:14 і 16 без сигнальної послідовності; шоку, хвороби Альцгеймера, інсульту, нейротравe) SEQ ID NO:18 і 20 без сигнальної послідовності; ми, астми, респіраторного дистрес-синдрому у f) SEQ ID NO:22 і 24 без сигнальної послідовності; дорослих, церебральної малярії, хронічного запаg) SEQ ID NO:26 і 28 без сигнальної послідовності; льного захворювання легень, силікозу, саркоїдозу h) SEQ ID NO:38 і 28 без сигнальної послідовності; легень, резорбції кістки, остеопорозу, рестенозу, i) SEQ ID NO:54 і 56 без сигнальної послідовності; реперфузійного ураження серця й нирок, тромбоj) SEQ ID NO:74 і 56 без сигнальної послідовності; зу, гломерулонефриту, діабету, реакції "трансплаk) SEQ ID NO:78 і 56 без сигнальної послідовності; нтат проти хазяїна", відторгнення алотрансплантаl) SEQ ID NO:82 і 28 без сигнальної послідовності; ту, запального захворювання кишечнику, хвороби m) SEQ ID NO:102 і 28 без сигнальної послідовноКрона, виразкового коліту, розсіяного склерозу, сті; дегенерації м'язів, екземи, контактного дерматиту, n) SEQ ID NO:30 і 32 без сигнальної послідовності; псоріазу, сонячних опіків і гострого кон'юнктивіту у o) SEQ ID NO:30 і 44 без сигнальної послідовності; об'єктів, що потребують цього. p) SEQ ID NO:58 і 60 без сигнальної послідовності; 9. Застосування за п. 8, де вказаним станом є реq) SEQ ID NO:62 і 60 без сигнальної послідовності; вматоїдний артрит. r) SEQ ID NO:90 і 44 без сигнальної послідовності; 10. Застосування за п. 8, де моноклональне антиs) SEQ ID NO:94 і 60 без сигнальної послідовності; тіло містить SEQ ID NO:30 і 32 без сигнальної посt) SEQ ID NO:98 і 32 без сигнальної послідовності; лідовності або SEQ ID NO:26 і 28 без сигнальної u) SEQ ID NO:34 і 36 без сигнальної послідовності; послідовності. v) SEQ ID NO:46 і 48 без сигнальної послідовності; 11. Виділена клітинна лінія, яка продукує моноклоw) SEQ ID NO:50 і 52 без сигнальної послідовності; нальне антитіло або антигензв'язувальну частину x) SEQ ID NO:66 і 52 без сигнальної послідовності; за будь-яким з пп. 1-7 y) SEQ ID NO:70 і 52 без сигнальної послідовності; 12. Виділена клітинна лінія за п. 11, яка продукує або моноклональне антитіло, що включає z) SEQ ID NO:86 і 48 без сигнальної послідовності. У цій заявці запитується пріоритет попередньої заявки США 60/502163, поданої 10 вересня 2003 року. Макрофагальний колонієстимулюючий фактор (M-CSF) є членом сімейства білків, названих колонієстимулюючими факторами (CSF). M-CSF являє собою секретований глікопротеїн або глікопротеїн клітинної поверхні що складається з двох субодиниць, пов'язаних дисульфідним зв'язком, і що має загальну молекулярну масу в межах від 40 до 90кДа (Stanley E.R., et al., Моl. Reprod. Dev., 46: 410 (1997)). Аналогічно іншим CSF, M-CSF продукується макрофагами, моноцитами і клітинами тканини людських суглобів, такими як хондроцити і синовіальні фібробласти, у відповідь на вплив білків, таких як інтерлейкін-1 або фактор некрозу пухлини - альфа. M-CSF стимулює утворення колоній макрофагів з плюрипотентних гемопоетичних стовбурових клітин-попередників (Stanley E.R., et al., Моl. Reprod. Dev., 46: 4-10 (1997)). M-CSF звичайно зв'язується зі своїм рецептором, c-fms, в результаті чого продукується біологічний ефект, c-fms містить п'ять позаклітинних доменів Ig, один трансмембранний домен і один внутрішньоклітинний домен з двома кіназними доменами. Після зв'язування M-CSF з c-fms, цей рецептор утворює гомодимер та ініціює каскад реакцій шляхом передачі сигналу, включаючи шляхи JAK/STAT, РІ3K і ERK. M-CSF є важливим регулятором функції, активації і виживання моноцитів/макрофагів. Використовуючи тварин з різними моделями захворювання, підтвердили роль M-CSF в розвитку різних захворювань, включаючи ревматоїдний артрит (РА) і рак. Макрофаги відіграють роль ключових ефекторних клітин при РА. Було показано, що ступінь інфільтрації макрофагів в синовіальну рідину при РА тісно корелює з рівнем деструкції суглобів. M-CSF, ендогенно продукований моноцитами/макрофагами, фібробластами і ендотеліальними клітинами в суглобі ураженому ревматоїдним артритом, діє на клітини, що диференціюються в напрямку моноцитів/макрофагів, стимулюючи їх виживання і диференціювання в остеокласти, що руйнують кістку, і посилюючи прозапальні клітинні функції, такі як цитотоксичність, продукування супероксиду, фагоцитоз, хемотаксис і продукування вторинних цитокінів. Наприклад, M-CSF-обробка щурів з моделлю експериментального артриту, що викликається Streptococcus agalactiae та індукованого ультразвуком, приводить до посилення патології (Abd, A.H., et al., Lymphokine Cytokine Res. 10: 43-50 (1991)). Аналогічним чином, підшкірні ін'єкції M-CSF мишам з колаген-індукованим артритом (КІА), який є моделлю РА, приводить до значного загострення симптомів захворювання PA (Campbell I.K., et al., J. Leuk. Biol. 68: 144-150 (2000)). Крім того, у мишей MRL/lpr, які у високій мірі чутливі до РА та інших аутоімунних захворювань, спостерігались підвищені базальні концентрації M-CSF в сироватці (Yui M.A., et al., Am. J. Pathol. 139: 255-261 (1991)). Необхідність присутності ендогенного M-CSF для підтримання КІА була продемонстрована значним зниженням тяжкості встановленого захворювання під дією M-CSFнейтралізуючого мишачого моноклонального антитіла (Campbell І.K., et al., J. Leuk. Biol. 68: 144150 (2000)). Що стосується раку, то інгібування 7 90457 8 колонієстимулюючих факторів під дією антисмиссигналу M-CSF за допомогою антитіла, направлелових олігонуклеотидів приводить до придушення ного проти його рецептора c-fms, значною мірою зростання пухлини в ембріональних ксенотранспінгібує локальну акумуляцію макрофагів у мишей в лантатах і в кишкових пухлинних ксенотранспланпроцесі ниркової запальної відповіді індукованої татах у мишей шляхом уповільнення руйнування експериментальною односторонньою обструкцією ЕСМ, опосередкованого макрофагами сечоводу. (Seyedhossein Α., et al., Cancer Research, 62: 5317Хвороба Кавазакі (ХК) являє собою гострий 5324 (2002)). лихоманковий васкуліт у дітей невідомої етіології. Зв'язування M-CSF з c-fms і подальша активаЦі найбільш поширені і серйозні ускладнення урація моноцитів/макрофагів грають важливу роль в жають коронарну судинну сітку і виявляються у розвитку різних патологічних станів. Крім РА і раку, формі аневризматичної дилатації. У гострій фазі іншими прикладами захворювань, асоційованих з хвороби Кавазакі рівень M-CSF в сироватці значно M-CSF, є остеопороз, деструктивний артрит, атезбільшується і нормалізується після лікування рогенез, гломерулонефрит, хвороба Кавазакі та шляхом внутрішньовенного введення імуноглобуінфекції^ що викликаються ВІЛ-1, в розвитку яких ліну. Гігантоклітинний артрит (ГКА) являє собою певну роль грають моноцити/макрофаги і спорідзапальну васкулопатію, що розвивається в основнені клітини. Наприклад, остеокласти подібні макному у немолодих людей, у яких Т-клітини і макрофагам і частково регулюються M-CSF. Сигнали рофаги інфільтрують стінки середньої і великої зростання і диференціювання, індуковані M-CSF в артерій, що приводить до клінічних ускладнень, до початкових стадіях дозрівання остеокластів, грасліпоти та інсульту в результаті артеріальної ють важливу роль в подальшій активності остеококлюзії. Активна участь макрофагів в розвитку ластів в кістці ГКА, очевидно, зумовлена присутністю підвищених Опосередкований остеокластами остеопороз у рівнів макрофагальних медіаторів запалення в формі як локальної ерозії, так і більш дифузного ділянці ураження судин. Повідомлялось, що Mнавколосуглобного остеопорозу, являє собою одну CSF підвищує сприйнятливість макрофагів, які з головних невирішених проблем, пов'язаних з РА. походять від людських моноцитів, до ВІЛ-1Наслідками остеопорозу є деформація суглобів, інфекції in vitro. У нещодавно проведених дослівтрата працездатності підвищений ризик перелодженнях було встановлено, що M-CSF підвищує мів кістки і збільшення смертності M-CSF грає вичастоту інфікування макрофагів, що походять від ключно важливу роль в остеокластогенезі і експелюдських моноцитів, а також збільшує рівень риментальна блокада цього цитокіну на тваринних мРНК ВІЛ, що експресується на одну клітину, яка моделях артриту з успіхом запобігає деструкції інфікується, і рівень провірусної ДНК, що експресуглоба. Відомо, що аналогічні шляхи деструкції сується на одну культуру, яка інфікується. діють і при інших формах деструктивного артриту, Враховуючи роль M-CSF у різних захворювантакого як псоріатичний артрит, і можуть являти нях, було б бажано розробити спосіб інгібування собою ділянки аналогічної дії. активності M-CSF. Постклімактеричний остеопороз виникає внаТому необхідність в одержанні терапевтичних слідок дефектного ремоделювання кістки, що виантитіл проти M-CSF залишається надто актуалькликається порушенням остеогенезу в результаті ною. резорбції кістки, опосередкованої надмірною кільДаний винахід відноситься до виділених людкістю остеокластів, зумовленою дефіцитом естроських антитіл або до їх антигензв'язувальних часгенів. Було показано, що нейтралізація in vivo Mтин, які специфічно зв'язуються з людським M-CSF CSF у мишей з використанням блокуючого антитіі діють як антагоністи M-CSF, а також до композила повністю запобігає збільшенню числа остеокцій, які містять вказане антитіло або його частину. ластів, посиленню резорбції кістки і тим самим, Даний винахід також відноситься до композирозвитку остеопорозу, індукованого оварієектоміцій, що містять важкий і/або легкий ланцюги, їх єю. варіабельні ділянки або антигензв'язувальні часІснує декілька точок зору відносно центральної тини анти-М-CSF-антитіла, або молекули нуклеїролі M-CSF в розвитку атерогенезу і проліфератинової кислоти, що кодують антитіло, ланцюг антивної гіперплазії вистилання судин після механічної тіла або його варіабельну ділянку згідно з травми стінки артерій. Було показано, що клітини винаходом, які є ефективними для лікування завсіх головних типів, що беруть участь в атерохворювань, і фармацевтично прийнятний носій. У склеротичних ураженнях, експресують M-CSF, деяких варіантах винаходу вказані композиції моякий потім активується під дією окисленого ліпопжуть також містити інший компонент, такий як теротеїну. Блокування передачі сигналу М-CSF срапевтичний засіб або діагностичний засіб. Даний fms-нейтралізуючим антитілом приводить до знивинахід також відноситься до діагностичних і тераження акумуляції пінистих клітин, що походять від певтичних способів. У деяких варіантах винаходу макрофагів, в основі аорти у дефіцитних по аполівказані композиції застосовуються у терапевтично попротеїну Ε мишей, які одержували корм з висоефективній кількості необхідній для лікування або ким вмістом жиру. попередження конкретного захворювання або стаБуло виявлено, що при експериментальному ну. гломерулонефриті і гломерулонефриті людини Даний винахід також відноситься до способів експресія гломерулярного M-CSF асоціюється з лікування або попередження різних захворювань і локальною акумуляцією, активацією і проліферастанів, таких як, але не обмежуються ними, запацією макрофагів і корелює з мірою гломерулярного лення, рак, атерогенез, неврологічні розлади і ураження і протеїнурією. Блокування передачі хвороби серця, з використанням ефективної кіль 9 90457 10 кості aнти-M-CSF-aнтитіла згідно з винаходом або Пунктиром позначена відсутність змін у порівнянні його антизв'язувальною частиною; нуклеїнових із зародковою лінією. Підкреслені послідовності в кислот, що кодують вказане антитіло або його вакожному вирівнюванні являють собою, зліва нажкий і/або легкий ланцюг, варіабельні ділянки або право, послідовності FR1, CDR1, FR2, CDR2, FR3, антизв'язувальні частини. CDR3 і FR4. Даний винахід відноситься до виділених кліНа Фіг.4А показано вирівнювання первинних тинних ліній, таких як гібридоми, які продукують структур для порівняння передбаченої амінокисанти-М-СSF-антитша і/або їх антизв'язувальні часлотної послідовності варіабельної ділянки легкого тини. ланцюга антитіла 252 (залишки 21-127 SEQ ID Даний винахід також відноситься до молекул NO:4) з послідовністю VKO12, JK3 зародкової лінії нуклеїнової кислоти, що кодують важкі і/або легкі (SEQ ID NO:103). ланцюги анти-М-СSF-антитіл, їх варіабельні ділянНа Фіг.4В показано вирівнювання первинних ки або антизв'язувальні частини. структур для порівняння передбаченої амінокисДаний винахід відноситься до векторів і до клілотної послідовності варіабельної ділянки легкого тин-хазяїнів, що містять молекули нуклеїнової кисланцюга антитіла 88 (залишки 21-127 SEQ ID лоти, а також до способів рекомбінантного продуNO:8) з послідовністю VK012, JK3 зародкової лінії кування поліпептидів, що кодуються молекулами (SEQ ID NO:103). нуклеїнової кислоти. На Фіг.4С показано вирівнювання первинних Крім того, даний винахід відноситься до трансструктур для порівняння передбаченої амінокисгенних тварин, що не походять від людини і екслотної послідовності варіабельної ділянки легкого пресують важкі і/або легкі ланцюги або антизв'язуланцюга антитіла 100 (залишки 21-127 SEQ ID вальні частини aнти-M-CSF-антитіл. NO:12) з послідовністю VKL2, JK3 зародкової лінії На Фіг.1А і 1В представлені графіки, на яких (SEQ ID NO:107). проілюстровано, що анти-М-CSF-антитіла забезНа Фіг.4D показано вирівнювання первинних печують дозозалежне зниження загального числа структур для порівняння передбаченої амінокисмоноцитів у самців і самиць мавп в залежності від лотної послідовності варіабельної ділянки легкого часу. Число моноцитів визначали за розсіюванням ланцюга антитіла 3.8.3 (залишки 23-130 SEQ ID світла з використанням діагностичної системи NO:16) з послідовністю VKL5, JK3 зародкової лінії Abbott Diagnostics Inc. Cell Dyn. Моніторинг числа (SEQ ID NO:109). моноцитів проводили через 24 години і протягом На Фіг.4Е показано вирівнювання первинних подальших 3 тижнів після введення носія або анструктур для порівняння передбаченої амінокиститіла 8.10.3 в дозі 0, 0,1, 1 або 5мг/кг в об'ємі лотної послідовності варіабельної ділянки легкого 3,79мл/кг протягом приблизно 5 хвилин. ланцюга антитіла 2.7.3 (залишки 23-130 SEQ ID На Фіг.1А наведені дані для самців мавп. NO:20) з послідовністю VKL5, JK4 зародкової лінії На Фіг.1В наведені дані для самиць мавп. (SEQ ID NO:117). На Фіг.2А і 2В представлені графіки, на яких На Фіг.4F показано вирівнювання первинних проілюстровано, що обробка aнти-M-CSFструктур для порівняння передбаченої амінокисантитілом приводила до зниження процента лотної послідовності варіабельної ділянки легкого СD14+СD16+-моноцитів у самців і самиць мавп. ланцюга антитіла 1.120.1 (залишки 21-134 SEQ ID Моніторинг проводили в дні 0-21 після введення NO:24) з послідовністю VKB3, JK1 зародкової лінії носія або антитіла 8.10.3 в дозі 0, 0,1, 1 або 5мг/кг (SEQ ID NO:112). в об'ємі 3,79мл/кг протягом приблизно 5 хвилин. На Фіг.4G показано вирівнювання первинних Для кожної мавпи, що тестується, процент моноструктур для порівняння передбаченої амінокисцитів серед CD14+CD16+-субпопуляції визначали лотної послідовності варіабельної ділянки важкого після кожного збирання крові в дні 1, 3, 7, 14 і 21 ланцюга антитіла 252 (залишки 20-136 SEQ ID після ін'єкції антитіла 8.10.3. NO:2) з послідовністю VH3-11, DH7-27, JH6 зародНа Фіг.2А наведені дані для самців мавп. кових лінії (SEQ ID NO:106). На Фіг.2В наведені дані для самиць мавп. На Фіг.4Н показано вирівнювання первинних На Фіг.3А і 3В представлені графіки, на яких структур для порівняння передбаченої амінокиспоказано, що обробка анти-М-CSF-антитілом прилотної послідовності варіабельної ділянки важкого водить до зниження процентної зміни загального ланцюга антитіла 88 (залишки 20-138 SEQ ID числа моноцитів при всіх дозах антитіла 8.10.3F і NO:6) з послідовністю VH-7, DH-13, JH4 зародкових антитіла 9.14.41 у порівнянні із заздалегідь протелінії (SEQ ID NO:105). стованими рівнями моноцитів. На Фіг.41 показано вирівнювання первинних На Фіг.3А наведені дані одержані з експериместруктур для порівняння передбаченої амінокиснтів з використанням антитіла 8.10.3F. лотної послідовності варіабельної ділянки важкого На Фіг.3В наведені дані одержані з експеримеланцюга антитіла 100 (залишки 20-141 SEQ ID нтів з використанням антитіла 9.14.41. NO:10) з послідовністю VH3-23, DH1-6, JH4 зародНа Фіг.4 показано вирівнювання первинних кових лінії (SEQ ID NO:104). структур для порівняння амінокислотних послідовНа Фіг.4J показано вирівнювання первинних ностей варіабельних ділянок легкого і важкого ластруктур для порівняння передбаченої амінокиснцюгів двадцяти шести анти-М-СSF-антитіл з амілотної послідовності варіабельної ділянки важкого нокислотними послідовностями відповідних генів ланцюга антитіла 3.8.3 (залишки 20-135 SEQ ID варіабельних ділянок зародкової лінії. Відмінності NO:14) з послідовністю VH3-11, DH7-27, JH4 зародміж послідовностями антитіл і послідовностями кових лінії (SEQ ID NO:108). генів зародкової лінії показані жирним шрифтом. 11 90457 12 На Фіг.4K показано вирівнювання первинних На Фіг.4V показано вирівнювання первинних структур для порівняння передбаченої амінокисструктур для порівняння передбаченої амінокислотної послідовності варіабельної ділянки важкого лотної послідовності варіабельної ділянки важкого ланцюга антитіла 2.7.3 (залишки 20-137 SEQ ID ланцюга антитіла 8.10.3F (залишки 20-141 SEQ ID NO:18) з послідовністю VH3-33, DHl-26, JH4 зародNO:30) з послідовністю VH3-48, DH1-26, JH4b зарокових лінії (SEQ ID NO:110). дкової лінії (SEQ ID NO:113). На Фіг.4L показано вирівнювання первинних На Фіг.4W показано вирівнювання первинних структур для порівняння передбаченої амінокисструктур для порівняння передбаченої амінокислотної послідовності варіабельної ділянки важкого лотної послідовності варіабельної ділянки легкого ланцюга антитіла 1.120.1 (залишки 20-139 SEQ ID ланцюга антитіла 9.7.2IF (залишки 23-130 SEQ ID NO:22) з послідовністю VH1-18, DH4-23, JH4 зародNO:36) з послідовністю VKO12, JK3 зародкової лінії кових лінії (SEQ ID NO:111). (SEQ ID NO:103). На Фіг.4М показано вирівнювання первинних На Фіг.4Х показано вирівнювання первинних структур для порівняння передбаченої амінокисструктур для порівняння передбаченої амінокислотної послідовності варіабельної ділянки легкого лотної послідовності варіабельної ділянки важкого ланцюга антитіла 8.10.3 (залишки 21-129 SEQ ID ланцюга антитіла 9.7.2IF (залишки 20-136 SEQ ID NO:44) з послідовністю VKA27, JK4 зародкової лінії NO:34) з послідовністю VH3-11, DH6-13, JH6b заро(SEQ ID NO:114). дкової лінії (SEQ ID NO:115). На Фіг.4N показано вирівнювання первинних На Фіг.4Y показано вирівнювання первинних структур для порівняння передбаченої амінокисструктур для порівняння передбаченої амінокислотної послідовності варіабельної ділянки важкого лотної послідовності варіабельної ділянки легкого ланцюга антитіла 8.10.3 (залишки 20-141 SEQ ID ланцюга антитіла 9.7.2C-Ser (залишки 23-130 SEQ NO:30) з послідовністю VH3-48, DHl-26, JH4b зародID NO:52) з послідовністю VKO12, JK3 зародкової кової лінії (SEQ ID NO:113). лінії (SEQ ID NO:103). На Фіг.40 показано вирівнювання первинних На Фіг.4Z показано вирівнювання первинних структур для порівняння передбаченої амінокисструктур для порівняння передбаченої амінокислотної послідовності варіабельної ділянки легкого лотної послідовності варіабельної ділянки важкого ланцюга антитіла 9.14.4 (залишки 23-130 SEQ ID ланцюга антитіла 9.7.2C-Ser (залишки 20-136 SEQ NO:28) з послідовністю VKO12, JK3 зародкової лінії ID NO:50) з послідовністю VH3-11, DH6-13, JH6b (SEQ ID NO:103). зародкової лінії (SEQ ID NO:115). На Фіг.4Р показано вирівнювання первинних На Фіг.4АА показано вирівнювання первинних структур для порівняння передбаченої амінокисструктур для порівняння передбаченої амінокислотної послідовності варіабельної ділянки важкого лотної послідовності варіабельної ділянки легкого ланцюга антитіла 9.14.4 (залишки 20-135 SEQ ID ланцюга антитіла 9.14.4C-Ser (залишки 23-130 NO:38) з послідовністю VH3-11, DH7-27, JH4b зароSEQ ID NO:56) з послідовністю VKO12, JK3 зароддкової лінії (SEQ ID NO:116). кової лінії (SEQ ID NO:103). На Фіг.4Q показано вирівнювання первинних На Фіг.4ВВ показано вирівнювання первинних структур для порівняння передбаченої амінокисструктур для порівняння передбаченої амінокислотної послідовності варіабельної ділянки легкого лотної послідовності варіабельної ділянки важкого ланцюга антитіла 9.7.2 (залишки 23-130 SEQ ID ланцюга антитіла 9.14.4C-Ser (залишки 20-135 NO:48) з послідовністю VKO12, JK3 зародкової лінії SEQ ID NO:54) з послідовністю VH3-11, DH7-27, (SEQ ID NO.103). JH4b зародкової лінії (SEQ ID NO:116). На Фіг.4R показано вирівнювання первинних На Фіг.4СС показано вирівнювання первинних структур для порівняння передбаченої амінокисструктур для порівняння передбаченої амінокислотної послідовності варіабельної ділянки важкого лотної послідовності варіабельної ділянки легкого ланцюга антитіла 9.7.2 (залишки 20-136 SEQ ID ланцюга антитіла 8.1O.3C-Ser (залишки 21-129 NO:46) з послідовністю VH3-11, DH6-13, JH6b зароSEQ ID NO:60) з послідовністю VKA27, JK4 зароддкової лінії (SEQ ID NO:115). кової лінії (SEQ ID NO:114). На Фіг.4S показано вирівнювання первинних На Фіг.4DD показано вирівнювання первинних структур для порівняння передбаченої амінокисструктур для порівняння передбаченої амінокислотної послідовності варіабельної ділянки легкого лотної послідовності варіабельної ділянки важкого ланцюга антитіла 9.14.41 (залишки 23-130 SEQ ID ланцюга антитіла 8.10.3C-Ser (залишки 20-141 NO:28) з послідовністю VKO12, JK3 зародкової лінії SEQ ID NO:58) з послідовністю VH3-48, DH1-26, (SEQ ID NO:103). JH4b зародкової лінії (SEQ ID NO:113). На Фіг.4Т показано вирівнювання первинних На Фіг.4ЕЕ показано вирівнювання первинних структур для порівняння передбаченої амінокисструктур для порівняння передбаченої амінокислотної послідовності варіабельної ділянки важкого лотної послідовності варіабельної ділянки легкого ланцюга антитіла 9.14.41 (залишки 20-135 SEQ ID ланцюга антитіла 8.10.3-CG2 (залишки 21-129 NO:26) з послідовністю VH3-11, DH7-27, JH4b зароSEQ ID NO:60) з послідовністю VKA27, JK4 зароддкової лінії (SEQ ID NO:116). кової лінії (SEQ ID NO:114). На Фіг.4U показано вирівнювання первинних На Фіг.4FF показано вирівнювання первинних структур для порівняння передбаченої амінокисструктур для порівняння передбаченої амінокислотної послідовності варіабельної ділянки легкого лотної послідовності варіабельної ділянки важкого ланцюга антитіла 8.10.3F (залишки 21-129 SEQ ID ланцюга антитіла 8.10.3-CG2 (залишки 23-141 NO:32) з послідовністю VKA27, JK4 зародкової лінії SEQ ID NO:62) з послідовністю VH3-48, DH1-26, (SEQ ID NO:114). JH4b зародкової лінії (SEQ ID NO:113). 13 90457 14 На Фіг.4GG показано вирівнювання первинних На Фіг.4RR показано вирівнювання первинних структур для порівняння передбаченої амінокисструктур для порівняння передбаченої амінокислотної послідовності варіабельної ділянки легкого лотної послідовності варіабельної ділянки важкого ланцюга антитіла 9.7.2-CG2 (залишки 23-130 SEQ ланцюга антитіла 9.7.2-Ser (залишки 20-136 SEQ ID NO:52) з послідовністю VKO12, JK3 зародкової ID NO:86) з послідовністю VH3-11, DH6-13, JH6b лінії (SEQ ID NO:103). зародкової лінії (SEQ ID NO:115). На Фіг.4НН показано вирівнювання первинних На Фіг.4SS показано вирівнювання первинних структур для порівняння передбаченої амінокисструктур для порівняння передбаченої амінокислотної послідовності варіабельної ділянки важкого лотної послідовності варіабельної ділянки легкого ланцюга антитіла 9.7.2-CG2 (залишки 20-136 SEQ ланцюга антитіла 8.10.3-Ser (залишки 21-129 SEQ ID NO:66) з послідовністю VH3-11, DH6-13, JH6b ID NO:44) з послідовністю VKA27, JK4 зародкової зародкової лінії (SEQ ID NO:115). лінії (SEQ ID NO:114). На Фіг.4II показано вирівнювання первинних На Фіг.4ТТ показано вирівнювання первинних структур для порівняння передбаченої амінокисструктур для порівняння передбаченої амінокислотної послідовності варіабельної ділянки легкого лотної послідовності варіабельної ділянки важкого ланцюга антитіла 9.7.2-CG4 (залишки 23-130 SEQ ланцюга антитіла 8.10.3-Ser (залишки 20-141 SEQ ID NO:52) з послідовністю VKO12, JK3 зародкової ID NO:90) з послідовністю VH3-48, DH1-26, JH4b лінії (SEQ ID NO:103). зародкової лінії (SEQ ID NO:113). На Фіг.4JJ показано вирівнювання первинних На Фіг.4UU показано вирівнювання первинних структур для порівняння передбаченої амінокисструктур для порівняння передбаченої амінокислотної послідовності варіабельної ділянки важкого лотної послідовності варіабельної ділянки легкого ланцюга антитіла 9.7.2-CG4 (залишки 20-135 SEQ ланцюга антитіла 8.10.3-CG4 (залишки 21-129 ID NO:70) з послідовністю VH3-11, DH6-13, JH6b SEQ ID NO:60) з послідовністю VKA27, JK4 зародзародкової лінії (SEQ ID NO:115). кової лінії (SEQ ID NO:114). На Фіг.4КК показано вирівнювання первинних На Фіг.4VV показано вирівнювання первинних структур для порівняння передбаченої амінокисструктур для порівняння передбаченої амінокислотної послідовності варіабельної ділянки легкого лотної послідовності варіабельної ділянки важкого ланцюга антитіла 9.14.4-CG2 (залишки 23-130 ланцюга антитіла 8.10.3-CG4 (залишки 20-141 SEQ ID NO:56) з послідовністю VKO12, JK3 зародSEQ ID NO:94) з послідовністю VH3-48, DH1-26, кової лінії (SEQ ID NO:103). JH4b зародкової лінії (SEQ ID NO:113). На Фіг.4LL показано вирівнювання первинних На Фіг.4WW показано вирівнювання первинних структур для порівняння передбаченої амінокисструктур для порівняння передбаченої амінокислотної послідовності варіабельної ділянки важкого лотної послідовності варіабельної ділянки легкого ланцюга антитіла 9.14.4-CG2 (залишки 20-135 ланцюга антитіла 9.14.4G1 (залишки 23-130 SEQ SEQ ID NO:74) з послідовністю VH3-11, DH7-27, ID NO:28) з послідовністю VKO12, JK3 зародкової JH4b зародкової лінії (SEQ ID NO:116). лінії (SEQ ID NO:103). На Фіг.4ММ показано вирівнювання первинних На Фіг.4ХХ показано вирівнювання первинних структур для порівняння передбаченої амінокисструктур для порівняння передбаченої амінокислотної послідовності варіабельної ділянки легкого лотної послідовності варіабельної ділянки важкого ланцюга антитіла 9.14.4-CG4 (залишки 23-130 ланцюга антитіла 9.14.4G1 (залишки 20-135 SEQ SEQ ID NO:56) з послідовністю VKO12, JK3 зародID NO:102) з послідовністю VH3-11, DH7-27, JH4b кової лінії (SEQ ID NO:103). зародкової лінії (SEQ ID NO:116). На Фіг.4NN показано вирівнювання первинних На Фіг.4YY показано вирівнювання первинних структур для порівняння передбаченої амінокисструктур для порівняння передбаченої амінокислотної послідовності варіабельної ділянки важкого лотної послідовності варіабельної ділянки легкого ланцюга антитіла 9.14.4-CG4 (залишки 20-135 ланцюга антитіла 8.10.3FG1 (залишки 21-129 SEQ SEQ ID NO:78) з послідовністю VH3-11, DH7-27, ID NO:32) з послідовністю VKA27, JK4 зародкової JH4b зародкової лінії (SEQ ID NO:116). лінії (SEQ ID NO:114). На Фіг.400 показано вирівнювання первинних На Фіг.4ZZ показано вирівнювання первинних структур для порівняння передбаченої амінокисструктур для порівняння передбаченої амінокислотної послідовності варіабельної ділянки легкого лотної послідовності варіабельної ділянки важкого ланцюга антитіла 9.14.4-Ser (залишки 23-130 SEQ ланцюга антитіла 8.10.3FG1 (залишки 20-141 SEQ ID NO:28) з послідовністю VKO12, JK3 зародкової Ю N0:98) з послідовністю VH3-48, DH1-26, JH4b лінії (SEQ ID NO:103). зародкової лінії (SEQ ID NO:113). На Фіг.4РР показано вирівнювання первинних Визначення і загальні методи структур для порівняння передбаченої амінокисЯкщо не указано особливо, всі наукові і технілотної послідовності варіабельної ділянки важкого чні терміни, що використовуються в даному виналанцюга антитіла 9.14.4-Ser (залишки 20-135 SEQ ході мають загальноприйняті значення, відомі фаID NO:82) з послідовністю VH3-11, DH7-27, JH4b хівцеві Крім того, якщо це не треба з контексту зародкової лінії (SEQ ID NO:116). опису, то термін, який вказує даний об'єкт в одниНа Фіг.4QQ показано вирівнювання первинних ні, включає в себе цей об'єкт і у множині і навпаки, структур для порівняння передбаченої амінокистермін, який вказує даний об'єкт у множині вклюлотної послідовності варіабельної ділянки легкого чає цей об'єкт і в однині У загальних рисах, номенланцюга антитіла 9.7.2-Ser (залишки 23-130 SEQ клатура, що використовується в описі методів куID NO:48) з послідовністю VKO12, JK3 зародкової льтивування клітин і тканин і методів молекулярної лінії (SEQ ID NO:103). біології^ імунології, мікробіології, генетики і хіміч 15 90457 16 них методів одержання білків і нуклеїнових кислот, ним. По суті чистий поліпептид або білок звичайно а також методів гібридизації^ добре відома і широскладає приблизно 50%, 60%, 70%, 80% або 90% ко застосовується фахівцями. за масою всього білка зразка, а звичайно його чисСпособи і процедури згідно з винаходом звитота складає приблизно 95%, а переважно більше чайно здійснюють згідно зі стандартною добре 99%. Чистота або гомогенність білка може бути відомою методикою, яка описана в різних загальвизначена різними добре відомими методами, них і більш спеціальних керівництвах, що цитуютьтакими як електрофорез зразка білка в поліакрися і обговорюються в даному описі якщо це не ламідному гелі з подальшою візуалізацією однієї обумовлено особливо. Дивіться, наприклад, керівполіпептидної смуги після фарбування гелю добре ництво Sambrook et al., Molecular Cloning: A відомим барвником. Для деяких цілей може бути Laboratory Manual 2d ed., Cold Spring Harbor досягнуте більш високе розділення із застосуванLaboratory Press, Cold Spring Harbor, N.Y. (1989), і ням ВЕРХ або інших методів очищення, добре Ausubel et al., Current Protocols in Molecular Biology, відомих фахівцям. Greene Publishing Associates (1992) and Harlow & Термін "поліпептидний фрагмент", що викориLane Antibodies: A Laboratory Manual, Cold Spring стовується тут, відноситься до поліпептиду, який Harbor Laboratory Press, Cold Spring Harbor, N.Y. має амінокінцеву і/або карбоксикінцеву делецію, (1990), яке включене в даний опис за допомогою але в якому інша амінокислотна послідовність у посилання. Ферментативні реакції і очищення провідповідних положеннях амінокислот ідентична водять відповідно до інструкцій виробників в осноприродній амінокислотній послідовності У деяких вному відомими методами або методами, описаваріантах винаходу фрагменти мають довжину ними в даний заявці Номенклатура, що щонайменше 5, 6, 8 або 10 амінокислот. В інших використовується в описаних тут лабораторних варіантах винаходу фрагменти мають довжину процедурах, а також в методах аналітичної хімії, щонайменше 14, щонайменше 20, щонайменше 50 хімії органічного синтезу і в медичній і фармацевабо щонайменше 70, 80, 90, 100, 150 або 200 амітичній хімії, добре відома і широко застосовується нокислот. фахівцями. Проведення хімічного синтезу і хімічТермін "поліпептидний аналог", що використоних аналізів, одержання фармацевтичних препавується тут, означає поліпептид, який містить сегратів і композицій і їх доставку пацієнтам, а також мент, по суті ідентичний частині амінокислотної лікування пацієнтів здійснюють стандартними мепослідовності і який володіє щонайменше однією з тодами. нижченаведених властивостей, а саме, він (1) спеТерміни, що використовуються тут, якщо це не цифічно зв'язується з M-CSF у відповідних умовах обумовлено особливо, мають наступні значення: зв'язування; і (2) може інгібувати M-CSF. Термін "поліпептид" охоплює природні або Звичайно поліпептидні аналоги, у порівнянні з штучні білки, фрагменти білків і поліпептидні анаприродною послідовністю, містять консервативну логи послідовності білка. Поліпептид може бути амінокислотну заміну (інсерцію або делецію). Звимономерним або полімерним. чайно аналоги мають довжину щонайменше 20 Термін "виділений білок", "виділений поліпепабо 25 амінокислот, переважно щонайменше 50, тид" або "виділене антитіло" означає білок, полі60, 70, 80, 90, 100, 150 або 200 амінокислот або пептид або антитіло, які за своїм походженням або більше, а частіше за все вони мають таку ж довджерелом одержання, володіють однією з чотижину, як і повнорозмірний природний поліпептид. рьох нижченаведених властивостей, а саме, вони У деяких варіантах винаходу амінокислотними (1) не асоціюються з компонентами, з якими вони замінами в антитілі або в його антизв'язувальній звичайно асоціюються в природі (2) не містять частині є заміни, які приводять (1) до зниження інших білків, що походять від організму того ж сачутливості до протеолізу, (2) до зниження чутлимого виду, (3) експресуються клітиною іншого виду вості до окислення, (3) до зміни афінності зв'язуабо (4) не існують в природі Таким чином, поліпепвання для утворення білкових комплексів або (4) тид, який синтезований хімічними методами або до надання таким аналогам інших фізико-хімічних синтезується клітинною системою, яка відрізняєтьабо функціональних властивостей або модифікації ся від клітини, в якій він звичайно продукується в властивостей, що вже є. Аналогами можуть бути природі розглядається як поліпептид, "ізольоварізні мутеїни з послідовністю, відмінною від прироний" від звичайно асоційованих з ним компонентів. дної пептидної послідовності Наприклад, в прироБілок, який по суті не містить асоційованих з ним дну послідовність, а переважно, в ту частину поліприродних компонентів, може бути також виділепептиду, яка розташована за межами ний із застосуванням техніки очищення білків, додоменоутворювальних міжмолекулярних контактів, бре відомої фахівцям. можуть бути внесені одна або множина амінокисПрикладами виділених антитіл є анти-М-СSFлотних замін (переважно консервативних амінокиантитіло, яке було афінно очищене з використанслотних замін). ням M-CSF; анти-М-СSF-антитіло, яке було синтеКонсервативна амінокислотна заміна не позоване з використанням гібридоми або іншої клівинна значно впливати на структурні властивості тинної лінії in vitro; і людське анти-M-CSF-антитіло, батьківської послідовності, наприклад, амінокисщо походить від трансгенної миші. лотна заміна не повинна приводити до зміни антиБілок або поліпептид є "в основному чистим", паралельної β-складчастої структури, яка утворює "по суті гомогенним" або "по суті очищеним", якщо зв'язувальний домен імуноглобуліну, присутній в щонайменше приблизно 60-75% зразка включає в батьківській послідовності, або до руйнування втосебе поліпептид одного виду. Вказаний поліпептид ринної структури інших типів, що характеризує або білок може бути мономерним або мультимербатьківську послідовність. У загальних рисах, в 17 90457 18 антипаралельній β-складчастій структурі не потиду здібності до специфічного зв'язування з антивинні бути присутніми гліцинові і пролінові аналогеном. ги. Приклади відомих вторинних і третинних струкЗрілі варіабельні домени легкого і важкого латур поліпептиду описані в роботах Protein, нцюгів, від їх N-кінця і до С-кінця, містять ділянки Structures and Molecular Principles (Creighton ed., FR1, CDR1, FR2, CDR2, FR3, CDR3 і FR4. ПривлаW.H. Freeman and Company, New York 1984); снення амінокислот кожному домену здійснюється Introduction to Protein Structure (Branden С & Tooze відповідно до нумерації по Кебату, Sequences of J. eds., Garland Publishing, New York, Ν, Υ. 1991) і у Protein of Immunological Interest (National Institutes Thornton et al., Nature 354:105 (1991), кожна з яких of Health, Bethesda, Md. (1987 and 1991)), Chothia & включена в даний опис за допомогою посилання. Lesk, J. Моl. Biol. 196: 901-917 (1987) & Chothia et Непептидні аналоги звичайно використовуal., Nature 342: 878-883 (1989). ються у фармацевтичній промисловості як лікар"Антитіло", що використовується тут, позначаські засоби з властивостями, аналогічними власється так само, як і моноклональне антитіло, одетивостям матричного пептиду. Непептидні сполуки ржане з гібридоми, що має таке ж позначення. цього типу називаються "пептидоміметиками", або Наприклад, моноклональне антитіло 3.8.3 являє "пептидоміметиками". Дивіться роботи Fauchere, J. собою антитіло, одержане з гібридоми 3.8.3. Adv. Drag. Res. 15:29 (1986); Veber & Freidinger, Термін "Fd-фрагмент", що використовується TINS p.392 (1985) і Evans et al., J. Med. Chem. 30: тут, означає фрагмент антитіла, який складається 1229 (1987), які включені в даний опис за допомоз доменів VH і СH1; Fv-фрагмент складається з VL- і гою посилання. Такі сполуки часто виявляють за VH-доменів одного сегмента антитіла; а dAbдопомогою комп'ютерної програми молекулярного фрагмент (Ward et al., Nature 341: 544-546 (1989) моделювання. Пептидоміметики, структурно схожі складається з VH-домену. з терапевтично цінними пептидами, можуть бути У деяких варіантах винаходу вказаним антитівикористані для досягнення еквівалентного тералом є одноланцюгове антитіло (scFv), в якому VL- і певтичного або профілактичного ефекту. Звичайно УН-домени є спареними і утворюють одновалентні пептидоміметики за своєю структурою схожі з ремолекули за допомогою синтетичного лінкера, презентативним поліпептидом (тобто з поліпептиякий забезпечує утворення цих молекул у вигляді дом, який володіє потрібними біохімічними власодного ланцюга білка. (Bird et al., Science 242: 423тивостями або фармакологічною активністю), 426 (1988) & Huston et al., Proc.Natl. Acad. Sci., таким як людське антитіло, але вони мають один USA, 85: 5879-5883 (1988)). В деяких варіантах або декілька пептидних зв'язків, необов'язково винаходу вказаними антитілами є диантитіла, тобзамінених зв'язком, вибраним з групи, яка складато двовалентні антитіла, в яких VH- і VL-домени ється з -CH2NH-, -CH2S-, -СН2-СН2-, -СН=СН- (цисекспресуються на одному поліпептидному ланцюі транс-), -СОСН2-, -СН(ОН)СН2- і -CH2SO-, відпогу, але за допомогою лінкера, який є дуже коротвідно до добре відомих методів. Системна заміна ким для того, щоб відбувалось спаровування між однієї або декількох амінокислот консенсусної подвома доменами на одному і тому ж ланцюгу, що слідовності D-амінокислотою того ж типу (напризмушує ці домени спаровуватись з комплементарклад, заміна L-лізину на D-лізин) може бути виконими доменами іншого ланцюга і утворювати два ристана для продукування більш стабільних антизв'язувальних сайти. (Дивіться, наприклад, пептидів. Крім того, пептиди з конформаційними Holliger P. et al., Proc.Natl. Acad. Sci., USA, 90: обмеженнями, які містять консенсусну послідов6444-6448 (1993) & Poljak R.J. et al., Structure 2: ність або варіант послідовності в основному іден1121-1123 (1994)). В деяких варіантах винаходу тичний консенсусній послідовності можуть бути одна або декілька ділянок CDR антитіла згідно з одержані відомими методами (Rizo & Gierasch, винаходом можуть бути, ковалентно або нековаAnn. Rev. Biochem. 61:387 (1992); ця публікація лентно, введені в молекулу імуноадгезину, який включена в даний опис за допомогою посилання), специфічно зв'язується з M-CSF. У таких варіантах наприклад, шляхом приєднання внутрішніх цистеївинаходу одна або декілька CDR можуть бути нових залишків, здатних утворювати внутрішньовведені у вигляді частини більш великого поліпепмолекулярні дисульфідні містки, які циклізують тидного ланцюга, або вони можуть бути ковалентданий пептид. но пов'язані з іншим поліпептидним ланцюгом, або Термін "антитіло" означає інтактне антитіло вони можуть бути введені за допомогою нековалеабо його антизв'язувальний фрагмент, який конкунтного зв'язку. рує з інтактним антитілом за специфічне зв'язуУ варіантах, що мають один або декілька сайвання. У загальних рисах, дивіться монографію тів зв'язування, такі сайти зв'язування можуть бути Fundamental Immunology, Ch. 7 (Paul W. ed., 2nd ідентичними або різними. ed. Raven Press, (яка у всій своїй повноті включена Термін "людське антитіло", що використовув даний опис за допомогою посилання). Антизв'яється тут, означає будь-яке антитіло, в якому посзувальні фрагменти можуть бути одержані метолідовності варіабельного і константного доменів є дами рекомбінантних ДНК або шляхом ферменталюдськими. Цей термін включає в себе антитіла, тивного або хімічного гідролізу інтактних антитіл. У які мають послідовності що походять від людських деяких варіантах винаходу антизв'язу вальними генів, але які були змінені так, що вони володіють фрагментами є Fab, Fab', F(ab')2, Fd, Fv, dAb фрапотенційно зниженою імуногенністю і підвищеною гменти гіперваріабельної ділянки (CDR), одноланафінністю і не містять цистеїнів, які можуть привоцюгові антитіла (scFv), химерні антитіла, диантитідити до небажаної просторової упаковки і т. п. Цей ла і поліпептиди, які містять щонайменше частину термін також включає в себе антитіла, які були антитіла, достатню для надання даному поліпеппродуковані рекомбінантними методами в кліти 19 90457 20 нах, що не є клітинами людини, які можуть негатиа також специфічні зарядові характеристики. Епівно впливати на глікозилування, нетипове для топ може бути "лінійним" або "конформаційним". У людських клітин. Ці антитіла можуть бути одержані лінійному епітопі всі ділянки взаємодії між білком і різними методами, описаними нижче. взаємодіючою молекулою (такою як антитіло) розТермін "химерне антитіло", що використовуташовані по всій довжині первинної амінокислотється тут, означає антитіло, яке містить ділянки, ної послідовності білка. У конформаційному епітопі що походять від двох або більше різних антитіл. В ділянки взаємодії знаходяться в амінокислотних одному з варіантів винаходу одна або декілька залишках, які розташовані на білці один проти одділянок CDR походять від людського анти-М-CSFного і відділені один від одного. Вважається, що антитіла. В іншому варіанті винаходу всі CDR поантитіло специфічно зв'язується з антигеном, якщо ходять від людського анти-M-CSF-антитіла. В інконстанта дисоціації становить 1мМ, переважно шому варіанті винаходу CDR, що походять від бі100нМ, а найбільш переважно 10нМ. У деяких льше ніж одного з людських aнти-M-CSF-антитіл, варіантах винаходу Ко складає від 1пМ до 500пМ. утворюють химерне антитіло. Наприклад, химерне В інших варіантах KD складає від 500пМ до 1мкМ. антитіло може містити CDR1 легкого ланцюга В інших варіантах KD складає від 1мкМ до 100нМ. "першого" людського анти-M-CSF-антитіла, CDR2 В інших варіантах KD складає від 100мМ до 10нМ. легкого ланцюга "другого" людського анти-М-СSFПісля визначення потрібного епітопу на антигені антитіла і CDR3 легкого ланцюга "третього" людможна продукувати антитіла проти цього епітопу, ського анти-М-СSF-антитіла, a CDR важкого ланнаприклад, за допомогою техніки, описаної в дацюга можуть походити від одного або декількох ному винаході Альтернативно, в процесі виявленінших анти-M-CSF-антитіл. Крім того, каркасні діня епітопу, генерування і характеризація антитіл лянки можуть походити від одного з анти-M-CSFможе дати необхідну інформацію про потрібні епіантитіл, від яких походять одна або декілька вкатопи. Потім, виходячи з такої інформації можна заних CDR, або від одного або декількох інших провести одночасний скринінг антитіл на зв'язулюдських антитіл. вання з одним і тим же епітопом. Один з підходів Фрагменти або аналоги молекул антитіл або для досягнення цієї мети полягає в проведенні імуноглобулінів можуть бути легко одержані будьперехресно-конкурентних досліджень для виявяким фахівцем, виходячи з опису винаходу. Перелення антитіл, які конкурентно зв'язуються одне з важні аміно-і карбоксикінцеві фрагменти або анаодним, наприклад, антитіл, які конкурують за зв'ялоги розташовані майже на стиках функціональних зування з антигеном. Високоефективний спосіб доменів. Структурні і функціональні домени мо"накопичення інформації" про антитіла, виходячи з жуть бути ідентифіковані шляхом порівняння даїх перехресної конкуренції, описаний в Міжнародних нуклеотидних і/або амінокислотних послідовній патентній заявці №WO 03/48731. ностей із загальнодоступними або приватними Двадцять головних амінокислот, що викорисбазами даних. Для ідентифікації мотивів послідовтовуються тут, мають загальноприйняті скороченностей або доменів білків з передбаченою конфоня. Дивіться монографію Immunology - A Synthesis рмацією, які присутні в інших білках з відомою (2nd Edition, E.S. Golub & D.R. Gren Eds., Sinauer структурою і/або функцією, переважно застосовуAssociates, Sunderland, Mass. (1991)), яка включеються методи комп'ютерного порівняння. Методи на в даний опис за допомогою посилання. ідентифікації послідовностей білка, який має просТермін "полінуклеотид", що використовується торову упаковку, яка утворює відому трьохмірну тут, означає полімерну форму нуклеотидної посліструктуру, добре відомі фахівцям. Дивіться Bowie довності довжиною щонайменше в 10 нуклеотидів, et al., Science 253: 164(1991). рибонуклеотидів або дезоксинуклеотидів послідоТермін "поверхневий плазмонний резонанс", вності або модифіковану форму, що складається з що використовується тут, означає оптичне явище, нуклеотидів будь-якого типу. Цей термін також яке дозволяє провести аналіз біоспецифічних взавключає в себе одноланцюгові і дволанцюгові поємодій в режимі реального часу шляхом детекції лімерні форми. зміни концентрацій білка в біосенсорній матриці Термін "виділений полінуклеотид", що викоринаприклад, із застосуванням системи BIACORE™ стовується тут, означає полінуклеотид геномної (Pharmacia Biosensor АВ, Uppsala, Sweden and ДНК, кДНК або синтезованої ДНК або їх деякі комPiscataway, N.J.). Додатковий опис можна знайти, бінації, де "виділений полінуклеотид" за своїм понаприклад, у Johnsson U. et al., Ann. Biol. Clin. 51: ходженням або джерелом одержання володіє од19-26 (1993); Johnsson U. et al., Biotechniques 11: нією з трьох нижченаведених властивостей, а 620-627 (1991); Johnsson B. et al., J. Моl. Recognit. саме, (1) не асоціюється з всіма полінуклеотидами 8: 125-131 (1995) і Johnsson B. et al., Anal. або з частиною полінуклеотидів, з якими цей "виBiochem. 198: 268-277 (1991). ділений полінуклеотид" звичайно асоціюється у Термін "KD" означає константу рівноважної природі (2) функціонально приєднаний до полінукдисоціації конкретної взаємодії "антитіло-антиген". леотиду, з яким він не пов'язаний у природі або (3) Термін "епітоп" означає детермінанту будьвідсутній у природі як частина більш великої посякого білка, здатну специфічно зв'язуватись з імулідовності ноглобуліном або з Т-клітинним рецептором або Термін "олігонуклеотид", що використовується як-небудь інакше взаємодіяти з даною молекулою. тут, означає природні і модифіковані нуклеотиди, Епітопні детермінантати звичайно складаються з пов'язані один з одним природними або неприродхімічно активних поверхневих груп молекул, таких ними олігонуклеотидними зв'язками. Олігонуклеояк амінокислоти або цукрові бічні ланцюги, і в остиди являють собою полінуклеотидну підпослідовновному мають специфічну трьохмірну структуру, ність, що звичайно містить 200 або менше 21 90457 22 нуклеотидів. Переважно, щоб олігонуклеотиди ність яких є бажаною, наприклад, лідерні послідомали в довжину 10-60 нуклеотидів, а найбільш вності і послідовності-партнери зі зв'язування. переважно - 12, 13, 14, 15, 16, 17, 18, 19 або 20-40 Термін "вектор", що використовується тут, нуклеотидів. Звичайно олігонуклеотиди є однолаозначає молекулу нуклеїнової кислоти, здатну пенцюговими, наприклад, олігонуклеотиди, що викоренести іншу нуклеїнову кислоту, до якої вона ристовуються для праймерів і зондів, хоча вони приєднана. У деяких варіантах винаходу таким можуть бути і дволанцюговими, наприклад, оліговектором є плазміда, тобто кільцева дволанцюгонуклеотиди, що використовуються для конструюва ДНК-петля, в яку можуть бути ліговані додаткові вання генного мутанта. Олігонуклеотиди згідно з ДНК-сегменти. У деяких варіантах винаходу таким винаходом можуть бути смисловими або антисмивектором є вірусний вектор, де додаткові ДНКсловими. сегменти можуть бути ліговані у вірусний геном. У Термін "природні нуклеотиди", що використодеяких варіантах винаходу такі вектори здатні аввується тут, означає дезоксирибонуклеотиди і ритономно реплікуватись в клітині-хазяїні в яку вони бонуклеотиди. Термін "модифіковані нуклеотиди", вбудовуються (наприклад, бактеріальні вектори, що використовується тут, означає нуклеотиди з які мають бактеріальний оріджин реплікації і епімодифікованими або із заміщеними цукровими сомні вектори ссавців). В інших варіантах винахогрупами і т.п. Термін "олігонуклеотидні зв'язки", що ду такі вектори (наприклад, неепісомні вектори використовується тут, включає в себе такі олігонуссавців) можуть бути інтегровані в геном клітиниклеотидні зв'язки як фосфортіоат, фосфордитіоат, хазяїна після введення в цю клітину-хазяїна, а фосфорселеноат, фосфордиселеноат, фосфоратому вони можуть реплікуватись разом з геномом нілотіоат, фосфоранілідат, фосфорамідат і т. п. хазяїна. Крім того, деякі вектори здатні регулювати Дивіться, наприклад, роботи LaPlanche et al., Nucl. експресію генів, до яких вони функціонально приєAcids. Res. 14:9081 (1986); Stec et al., J. Am. Chem. днані Такі вектори називаються тут "рекомбінантSoc. 106: 6077 (1984); Stein et al., Nucl. Acids. Res. ними експресуючими векторами" (або просто "екс16: 3209 (1988); Zon et al., Anti-Cancer Drug Design пресуючими векторами"). 6: 539 (1991); Zon et al., Oligonucleotides and Термін "рекомбінантна клітина-хазяїн", що виAnalogues: A Practical Approach, pp.87-108 користовується тут, (або просто "клітина-хазяїн") (F.Eckstein Ed., Oxford University Press, Oxford означає клітину, в яку був введений рекомбінантEngland (1991)); Stec et al., патент США ний експресуючий вектор. Потрібно зазначити, що №5151510; Uhlmann & Peyman Chemical Reviews, терміни "рекомбінантна клітина-хазяїн" і "клітина90:543 (1990), які включені в даний опис за допохазяїн" означають не тільки клітину конкретного могою посилання. Якщо необхідно, олігонуклеотид індивіда, але також і її потомство. Оскільки в поможе включати в себе мітку для детекції. дальших генераціях можуть бути присутніми деякі "Функціонально приєднані" послідовності модифікації, викликані або мутацією, або впливом включають в себе послідовності регуляції експренавколишнього середовища, то таке потомство сії, які є суміжними з геном, який представляє інфактично не може бути ідентичним батьківській терес, і послідовності регуляції експресії, які здійсклітині але при цьому воно все ж входить в об'єм нюють регуляцію експресії гена, який представляє терміну "клітина-хазяїн", що використовується тут. інтерес, діючи in trans або на відстані від нього. Термін "селективна гібридизація", що викорисТермін "послідовність регуляції експресії", що витовується тут, відноситься до детектованого і спекористовується тут, означає полінуклеотидні посцифічного зв'язування. Полінуклеотиди, олігонуклідовності які необхідні для здійснення експресії і леотиди і їх фрагменти згідно з винаходом процесингу кодуючих послідовностей, з якими воселективно гібридизуються з ланцюгами нуклеїнони ліговані. Послідовностями регуляції експресії є вої кислоти у таких умовах гібридизації і промивідповідні послідовності ініціації транскрипції, тервання, які значно мінімізують рівень детектованого мінації транскрипції, промоторні та енхансерні позв'язування з неспецифічними нуклеїновими кисслідовності; ефективні сигнали процесингу РНК, лотами. Для досягнення селективної гібридизації, такі як сигнали сплайсингу і поліаденілування; повідомої фахівцям і що обговорюється в даній заяслідовності що стабілізують цитоплазматичну вці можуть бути використані умови "високої жорстмРНК; послідовності що підвищують ефективність кості", або "у високій мірі жорсткі" умови. Одним з трансляції (тобто консенсусна послідовність Козаприкладів умов "високої жорсткості", або "у високій ка); послідовності що підвищують стабільність білмірі жорстких" умов, є інкубування полінуклеотиду ка, і якщо це необхідне, послідовності що посилюз іншим полінуклеотидом, де один полінуклеотид ють секрецію білка. Природа таких регуляторних може бути фіксований на твердій поверхні такій як послідовностей варіює в залежності від організмумембрана, в буфері для гібридизації, що містить хазяїна; наприклад, у прокаріотів такі регуляторні 6х SSPE або SSC, 50% формамід, 5х реагент Денпослідовності звичайно включають в себе промохардта, 0,5% ДСН, 100мкг/мл денатурованої фратор, сайт зв'язування з рибосомою і послідовність гментованої ДНК сперми лосося, при температурі термінації транскрипції, а у еукаріотів такі регулягібридизації 42°С протягом 12-16 годин, з подальторні послідовності звичайно включають в себе шим двократним промиванням при 55°С у промипромотори і послідовність термінації транскрипції. вальному буфері шо містить їх SSC, 0,5% ДСН. Термін "регуляторні послідовності" включає в сеДивіться, також Sambrook et al., дивіться вище, бе, як мінімум, всі компоненти, присутність яких pp.9.50-9.55. необхідна для експресії і процесингу, і може також Термін "процент ідентичності послідовностей", включати в себе додаткові компоненти, присутщо відноситься до послідовностей нуклеїнової кислоти, означає процент залишків при порівнянні 23 90457 24 і вирівнюванні першої безперервної послідовності Термін "по суті ідентичний", що використовуна максимальну відповідність з другою безперервється по відношенню до поліпептидів, означає, що ною послідовністю. Довжина послідовності що видві пептидних послідовності при їх оптимальному користовується для визначення ідентичності може вирівнюванні наприклад, за допомогою програм становити щонайменше приблизно дев'ять нуклеGAP або BESTFIT з використанням "ваги" пропусотидів, а звичайно - щонайменше приблизно 18 ків за умовчанням, встановлених в цих програмах, нуклеотидів, або щонайменше приблизно 24 нукмають щонайменше 70%-, 75% - або 80%-ну іденлеотиди або приблизно 28 нуклеотидів, частіше за тичність, переважно щонайменше 90%- або 95%все - щонайменше приблизно 32 нуклеотиди, а ну ідентичність, а більш переважно щонайменше переважно щонайменше приблизно 36, 48 або 97%-, 98%- або 99%-ну ідентичність. У деяких вабільше нуклеотидів. Для визначення ідентичності ріантах винаходу положення залишків, які не є нуклеотидних послідовностей можуть бути викоідентичними, відрізняються за своїми консерватиристані різні алгоритми, відомі фахівцям. Напривними амінокислотними замінами. Термін "консерклад, полінуклеотидні послідовності можна поріввативна амінокислотна заміна" означає заміну нювати за допомогою програм FASTA, Gap або одного амінокислотного залишку іншим амінокисBestfit, які входять в пакет програм Wisconsin лотним залишком, що має групу R бічного ланцюга Package Version 10.0, Genetics Computer Group з аналогічними хімічними властивостями (напри(GCG), Madison, Wisconsin. Програма FASTA, в яку клад, зарядом або гідрофобністю). У загальних входять, наприклад, програми FASTA2 і FASTA3, рисах, консервативна амінокислотна заміна не дозволяє провести вирівнювання послідовностей і впливає значного чином на функціональні властивизначати процент ідентичності послідовностей вості білка. У випадках, коли дві або більше амінодля ділянок з найкращим перекриттям між послікислотних послідовності відрізняються одна від довностями, що запитуються, і послідовностями одної консервативними замінами, процент ідентипошуку (Pearson, Methods Enzymol. 183: 63-98 чності послідовностей може бути скоригований з (1990); Pearson, Methods Моl. Biol. 132: 185-219 розрахунку на консервативну природу такої замі(2000); Pearson, Methods Enzymol. 266: 227-258 ни. Методи здійснення такої корекції добре відомі (1996); Pearson, J. Моl. Biol. 276: 71-84 (1998), фахівцям. Дивіться, наприклад, Pearson, Methods включені в даний винахід за допомогою посиланМоl. Biol. 243: 307-31 (1994). Прикладами груп аміня). Якщо це не обумовлене особливо, то викоринокислот, які мають бічні ланцюги з аналогічними стовуються параметри за умовчанням, встановлехімічними властивостями, є 1) амінокислоти з аліні для даної програми або алгоритму. Наприклад, фатичними бічними ланцюгами: гліцин, аланін, процент ідентичності послідовностей нуклеїнових валін, лейцин і ізолейцин; 2) амінокислоти з алікислот може бути визначений за допомогою профатичними-гідроксильними бічними ланцюгами: грами FASTA з параметрами за умовчанням (розсерин і треонін; 3) амінокислоти з амідовмісними мір слова 6 і фактор NOPAM для оціночної матрибічними ланцюгами: аспарагін і глутамін; 4) аміноці) або за допомогою програми Gap з її кислоти з ароматичними бічними ланцюгами: фепараметрами за умовчанням, яка постачається в нілаланін, тирозин і триптофан; 5) амінокислоти з GCG Version 6.1 і яка включена в даний опис за основними бічними ланцюгами: лізин, аргінін і гісдопомогою посилання. тидин; 6) амінокислоти з кислотними бічними ланЯкщо особливо не обумовлено, термін "нуклецюгами: аспарагінова кислота і глутамінова кислоотидна послідовність" охоплює і комплементарну та; і 7) амінокислоти з сірковмісними бічними їй послідовність. Таким чином, мається на увазі що ланцюгами: цистеїн і метіонін. Консервативними термін "нуклеїнова кислота, яка має конкретну амінокислотними замінами є заміни в межах таких послідовність", повинен охоплювати її комплеменгруп, як валін-лейцин-ізолейцин, фенілаланінтарний ланцюг разом з її комплементарною послітирозин, лізин-аргінін, аланін-валін, глутаматдовністю. аспартат і аспарагін-глутамін. Термін "процент ідентичності послідовностей" Альтернативно, консервативною заміною є означає відношення, що виражається як процент будь-яка заміна, що має позитивну величину в числа ідентичних залишків у порівнянні з числом матриці логарифмічної правдоподібності РАМ250, всіх залишків, що порівнюються. як описано в роботі Gonnet et al., Science 256: Термін "значна схожість", або "значна схожість 1443-45 (1992), яка включена в даний опис за допослідовностей", що відноситься до нуклеїнової помогою посилання. Термін "помірно консервативкислоти або до її фрагмента, означає, що при опна" заміна означає будь-яку заміну, що має ненетимальному зіставленні шляхом вирівнювання гативну величину в матриці логарифмічної відповідних нуклеотидних вставок або делецій з правдоподібності РАМ250. відповідними вставками або делеціями іншої нукІдентичність поліпептидних послідовностей леїнової кислоти (або комплементарного їй ланцюзвичайно визначають за допомогою комп'ютерної га), ідентичність нуклеотидів в нуклеотидних поспрограми для аналізу послідовностей. Комп'ютерлідовностях складає щонайменше приблизно 85%, ний аналіз білків проводять для встановлення відпереважно щонайменше приблизно 90%, а більш повідності послідовностей з використанням "ціни" переважно щонайменше приблизно 95%, 96%, схожості що приписується замінам, делеціям та 97%, 98% або 99%, як було визначено за допомоіншим модифікаціям, включаючи консервативні гою будь-якого з добре відомих алгоритмів для амінокислотні заміни. Наприклад, GCG включає визначення ідентичності послідовностей, такого як програми, такі як "Gap" і "Bestfit", які можуть бути FASTA, BLAST або Gap, вказаних вище. використані з параметрами за умовчанням, встановленими в цих програмах, для визначення го 25 90457 26 мології послідовностей або ідентичності послідовдомени, епітопні мітки), магнітні речовини, такі як ностей між близькоспорідненими поліпептидами, гадолінієві хелатні комплекси; токсини, такі як коктакими як гомологічні поліпептиди від організмів люшний токсин; таксол; цитохалазин В; граміцирізних видів, або між білком дикого типу і його мудин D; етидійбромід; еметин; мітоміцин; етопозид; теїном. Дивіться, наприклад, GCG Version 6.1. Потенопозид; вінкристин; вінбластин; колхіцин; докліпептидні послідовності можуть бути також піддасорубіцин; даунорубіцин; дигідроксіантрациндіон; ні порівнянню за допомогою програми FASTA з мітоксантрон; мітраміцин; актиноміцин D; 1використанням параметрів за умовчанням або дегідротестостерон; глюкокортикоїди; прокаїн; рекомендованих параметрів, дивіться GCG тетракаїн; лідокаїн; пропранолол; пуроміцин і їх Version 6.1 (University of Wisconsin WI). Програма аналоги або гомологи. У деяких варіантах здійсFASTA (наприклад, FASTA2 і FASTA3) дозволяє нення винаходу, мітки приєднують за допомогою провести зіставлення послідовностей і визначати спейсерних груп різної довжини для зменшення процент ідентичності послідовностей для ділянок з можливого стеричного ускладнення. найкращим перекриттям між послідовностями, що В описі винаходу і в формулі винаходу слово запитуються, і послідовностями пошуку (Pearson, "містити" або його варіанти, такі як "містить" або Methods Enzymol. 183: 63-98 (1990); Pearson, "що містить", потрібно розуміти як включення певMethods Моl. Biol. 132: 185-219 (2000)). Іншим пеного елемента або групи елементів, але не виклюреважним алгоритмом для порівняння послідовночення будь-якого іншого елемента або групи елесті згідно з винаходом з послідовністю бази даних, ментів. що містить велике число послідовностей, які похоАнтитіла проти людського M-CSF і їх характедять від різних організмів, є комп'ютерна програма ристики BLAST, а зокрема, blastp або tblastn, з параметраВ одному з варіантів даний винахід відноситьми за умовчанням, встановленими в таких програся до гуманізованих анти-М-CSF-антитіл. В іншому мах. Дивіться, наприклад, Altschul et al., J. Моl. варіанті даний винахід відноситься до антитіл проBiol. 215: 403-410 (1990); Altschul et al., Nucleic ти людського M-CSF. У деяких варіантах винаходу Acids Res. 25: 3389-402 (1997). антитіла проти людського M-CSF продукують шляДовжина поліпептидних послідовностей, що хом імунізації трансгенної тварини, що не віднопорівнюються для визначення їх гомології, звичайситься до людини, наприклад, гризуна, геном яконо складає щонайменше приблизно 16 амінокисго містить гени людського імуноглобуліну, так, щоб лотних залишків, звичайно - щонайменше приблиу цього гризуна продукувались людські антитіла. зно 20 залишків, частіше за все щонайменше Анти-М-СSF-антитіло згідно з винаходом може приблизно 24 залишки або приблизно 28 залишків, містити людський легкий каппа- або лямбдаа переважно - більш ніж приблизно 35 залишків. ланцюг або амінокислотну послідовність, яка поПри пошуку бази даних, що містить послідовності ходить від нього. У деяких варіантах винаходу, що від великого числа різних організмів, переважно відносяться до легкого каппа-ланцюга, варіабельпорівнювати амінокислотні послідовності. ний домен легкого ланцюга (VL) частково кодуєтьТерміни "мітка" або "мічений", що використося людським геном VKO12, VKL2, VKL5, VKA27 або вуються тут, відноситься до включення іншої моVKB3 і геном JK1, JK2, JK3 або JK4. У конкретних лекули в антитіло. В одному варіанті винаходу варіантах винаходу варіабельний домен легкого вказаною міткою є детектований маркер, наприланцюга кодується геном VKO12/JK3, VKL2/JK3, клад, радіоактивно мічена амінокислота, включенVKL5/JK3, VKL5/JK4, VKA27/JK4 або VKB3/JK1. ня якої в поліпептид біотинільної молекули або її У деяких варіантах винаходу VL анти-М-СSFприєднання до поліпептиду біотинільної молекули антитіла містить одну або декілька амінокислотних може бути детектовано за міченим авідином (назамін у порівнянні з амінокислотною послідовністю приклад, стрептавідином, що містить флуоресцензародкової лінії У деяких варіантах винаходу VL тний маркер або ферментативну активність, яка анти-М-СSF-антитіпа містить 1, 2, З, 4, 5, 6, 7, 8, 9 може бути детектована оптичними або колориметабо 10 амінокислотних замін у порівнянні з аміноричними методами). В іншому варіанті вказана кислотною послідовністю зародкової лінії. У деяких мітка або маркер можуть також володіти терапевваріантах винаходу одна або декілька таких замін, тичними властивостями, наприклад, вони можуть у порівнянні із зародковою лінією, присутні в ділябути кон'югованими з лікарським засобом або токнках CDR легкого ланцюга. У деяких варіантах сином. При цьому можуть бути використані різні винаходу заміни в амінокислотній послідовності у методи мічення поліпептидів і глікопротеїнів, добпорівнянні з амінокислотною послідовністю зародре відомі фахівцям. Прикладами міток, що викорикової лінії, присутні в одному або декількох полостовуються для поліпептидів, є, не обмежуючись женнях, відповідних положенням послідовності в ними, радіоізотоп або радіонукліди (наприклад, 3Н, будь-якому одному або декількох VL антитіл 252, 14 С, 15N, 35S, 90Y, 94Тс, 111In, 125І, 131І), флуоресцент88, 100, 3.8.3, 2.7.3, 1.120.1, 9.14.41, 8.10.3F, ні мітки (наприклад, ФІТЦ, родамін, комплекс "лан9.7.2IF, 9.14.4, 8.10.3, 9.7.2, 9.7.2C-Ser, 9.14.4Cтанід-фосфор"), ферментативні мітки (наприклад, Ser, 8.10.3C-Ser, 8.10.3-CG2, 9.7.2-CG2, 9.7.2-CG4, пероксидаза хрону, β-галактозидаза, люцифераза, 9.14.4-CG2, 9.14.4-CG4, 9.14.4-Ser, 9.7.2-Ser, лужна фосфатаза), хемілюмінесцентні мітки, біо8.10.3-Ser, 8.10.3-CG4, 8.10.3FG1 або 9.14.4G1. тинільні групи, поліпептидні епітопи, що заздалеНаприклад, VL анти-М-СSF-антитіло, у порівнянні гідь визначаються, розпізнавані вторинною репоріз зародковою лінією, може містити одну або декітерною молекулою (наприклад, двокомпонентні лька амінокислотних замін, присутніх в VL антитіла послідовності лейцинової блискавки, сайти зв'язу88, та інші амінокислотні заміни, присутні в VL анвання для "других" антитіл, металозв'язувальні титіла 252, в якому VL кодується таким же геном 27 90457 28 VK, як в антитілі 88. У деяких варіантах винаходу амінокислотних замін. В інших варіантах винаходу амінокислотні заміни присутні в одному або деківказаний легкий ланцюг анти-M-CSF-антитіла молькох тих же самих положеннях, але, на відміну же містити ділянки CDR1, CDR2 або CDR3 легкого від вихідного антитіла, викликають іншу мутацію. ланцюга, кожна з яких незалежно вибрана з діляУ деяких варіантах винаходу амінокислотні нок CDR1, CDR2 і CDR3 антитіла, яке має варіазаміни, у порівнянні із зародковою лінією, присутні бельну ділянку легкого ланцюга, яка містить амів одному або декількох положеннях, аналогічних нокислотну послідовність VL-ділянки, вибраної з положенням в будь-кому з VL антитіл 252, 88, 100, SEQ ID NO:4, 8, 12, 16, 20, 24, 28, 32, 36, 44, 48, 3.8.3, 2.7.3, 1.120.1, 9.14.41, 8.10.3F, 9.7.2IF, 52, 56 або 60, або кодовану молекулою нуклеїно9.14.4, 8.10.3, 9.7.2, 9.7.2C-Ser, 9.14.4C-Ser, вої кислоти, що кодує VL-ділянку і вибраної з SEQ 8.10.3C-Ser, 8.10.3-CG2, 9.7.2-CG2, 9.7.2-CG4, ID NO:3, 7, 11, 27, 31, 35, 43 або 47. Легкий ланцюг 9.14.4-CG2, 9.14.4-CG4, 9.14.4-Ser, 9.7.2-Ser, анти-М-СSF-антитіла може включати в себе ділян8.10.3-Ser, 8.10.3-CG4, 8.10.3FG1 або 9.14.4G1, ки CDR1, CDR2 або CDR3 антитіла, яке містить але ці заміни можуть бути консервативними аміноамінокислотну послідовність VL-ділянки і вибранокислотними замінами в положеннях, які відповідаго з 252, 88, 100, 3.8.3, 2.7.3, 1.120.1, 9.14.41, ють положенням амінокислот у вихідному антитілі 8.10.3F, 9.7.2IF, 9.14.4, 8.10.3, 9.7.2, 9.7.2C-Ser, Наприклад, якщо в конкретному положенні в од9.14.4C-Ser, 8.10.3C-Ser, 8.10.3-CG2, 9.7.2-CG2, ному з вказаних антитіл є заміна, у порівнянні із 9.7.2-CG4, 9.14.4-CG2, 9.14.4-CG4, 9.14.4-Ser, зародковою лінією, і якщо в такому положенні при9.7.2-Ser, 8.10.3-Ser, 8.10.3-CG4, 8.10.3FG1 або сутній глутамат, то він може бути замінений аспар9.14.4G1, або амінокислотну послідовність SEQ ID татом в цьому положенні Аналогічним чином, якщо NO:4, 8, 12, 16, 20, 24, 28, 32, 36, 44, 48, 52, 56 або в даному положенні амінокислоти, що замінюєть60. ся, присутній серин, то, у порівнянні із зародковою У деяких варіантах винаходу вказаний легкий лінією, цей серин може бути замінений треоніном. ланцюг містить ділянки CDR1, CDR2 або CDR3 Консервативні амінокислотні заміни обговорюютьантитіла, незалежно вибраного з 252, 88, 100, ся вище. 3.8.3, 2.7.3, 1.120.1, 9.14.41, 8.10.3F, 9.7.2IF, У деяких варіантах винаходу легкий ланцюг 9.14.4, 8.10.3, 9.7.2, 9.7.2C-Ser, 9.14.4C-Ser, людського анти-М-СSF-антитіла містить амінокис8.10.3C-Ser, 8.10.3-CG2, 9.7.2-CG2, 9.7.2-CG4, лотну послідовність, аналогічну амінокислотній 9.14.4-CG2, 9.14.4-CG4, 9.14.4-Ser, 9.7.2-Ser, послідовності Vl антитіла 252 (SEQ ID NO:4), 88 8.10.3-Ser, 8.10.3-CG4, 8.10.3FG1 або 9.14.4G1, (SEQ ID NO:8), 100 (SEQ ID NO:12), 3.8.3 (SEQ ID або вказані ділянки CDR, кожна з яких має менше NO:16), 2.7.3 (SEQ ID NO:20), 1.120.1 (SEQ ID 4 або менше 3 консервативних амінокислотних NO:24), 9.14.41 (SEQ ID NO:28), 8.10.3F (SEQ ID замін і/або всього три або менше неконсервативNO:32), 9.7.2IF (SEQ ID NO:36), 9.14.4 (SEQ ID них амінокислотних замін. NO:28), 8.10.3 (SEQ ID NO:44), 9.7.2 (SEQ ID Що стосується важкого ланцюга, то в деяких NO:48), 9.7.2C-Ser (SEQ ID NO:52), 9.14.4C-Ser варіантах винаходу варіабельна ділянка амінокис(SEQ ID NO:56), 8.1O.3C-Ser (SEQ ID NO:60), лотної послідовності важкого ланцюга частково 8.10.3-CG2 (SEQ ID NO:60), 9.7.2-CG2 (SEQ ID кодується людським геном VH3-11, VH3-23, VH3-7, NO:52), 9.7.2-CG4 (SEQ ID NO:52), 9.14.4-CG2 VH1-18, VH3-33, VH3-48 і геном JH4, JH6, JH4b або (SEQ ID NO:56), 9.14.4-CG4 (SEQ ID NO:56), JH6b. У конкретному варіанті винаходу, варіабель9.14.4-Ser (SEQ ID NO:28), 9.7.2-Ser (SEQ ID на ділянка важкого ланцюга кодується геном VH3NO:48), 8.10.3-Ser (SEQ ID NO:44), 8.10.3-CG4 11/DH7-27/JH6, VH3-7/DH6-13/JH4, VH3-23/DH1(SEQ ID NO:60), 8.10.3FG1 (SEQ ID NO:32) або 26/JH4, VH3-11/DH7-27/JH4, VH3-33/DH1-26/JH4, VH19.14.4G1 (SEQ ID NO:28), або вказану амінокисло18/DH4-23/JH4, VH3-11/DH7-27/JH4b, VH3-48/DH1тну послідовність, що має 1, 2, 3, 4, 5, 6, 7, 8, 9 або 26/JH4b, VH3-11/DH6-13/JH6b, VH3-11/DH7-27/JH4b, 10 консервативних амінокислотних замін і/або VH3-48/DH1-6/JH4b або VH3-11l/DH6-13/JH6b. У деусього від 1 до 3 неконсервативних амінокислотяких варіантах винаходу VH анти-М-СSF-антитіла, них замін. У деяких варіантах винаходу легкий у порівнянні з амінокислотною послідовністю заланцюг будь-кого з вищезгаданих антитіл містить родкової лінії, містить одну або декілька амінокисамінокислотну послідовність, що починається з лотних замін, делецій або інсерцій (додатків). У ділянки CDR1 і закінчується ділянкою CDR3. деяких варіантах винаходу варіабельний домен У деяких варіантах винаходу легкий ланцюг важкого ланцюга, у порівнянні з амінокислотною анти-М-СSF-антитіла містить щонайменше CDR1, послідовністю зародкової лінії, містить 1, 2, 3, 4, 5, CDR2 або CDR3 легкого ланцюга послідовності 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17 або 18 мутазародкової лінії або послідовності антитіла, описацій. У деяких варіантах винаходу вказаною(ими) ного в даний заявці В іншому варіанті винаходу мутацією(ями), у порівнянні з амінокислотною посвказаний легкий ланцюг може містити ділянки лідовністю зародкової лінії, є неконсервативна(і) CDR1, CDR2 або CDR3 антитіла, незалежно вибзаміна(и). У деяких варіантах винаходу вказані раного з 252, 88, 100, 3.8.3, 2.7.3, 1.120.1, 9.14.41, мутації знаходяться в ділянках CDR важкого лан8.10.3F, 9.7.2IF, 9.14.4, 8.10.3, 9.7.2, 9.7.2C-Ser, цюга. У деяких варіантах винаходу амінокислотні 9.14.4C-Ser, 8.10.3C-Ser, 8.10.3-CG2, 9.7.2-CG2, заміни введені в одне або декілька положень, 9.7.2-CG4, 9.14.4-CG2, 9.14.4-CG4, 9.14.4-Ser, аналогічних положенням мутацій в зародковій лінії 9.7.2-Ser, 8.10.3-Ser, 8.10.3-CG4, 8.10.3FG1 або в будь-якому одному або декількох VL антитіл 252, 9.14.4G1, або ділянки CDR, кожна з яких має мен88, 100, 3.8.3, 2.7.3, 1.120.1, 9.14.41, 8.10.3F, ше 4 або менше 3 консервативних амінокислотних 9.7.2IF, 9.14.4, 8.10.3, 9.7.2, 9.7.2C-Ser, 9.14.4Cзамін і/або всього 3 або менше неконсервативних Ser, 8.10.3C-Ser, 8.10.3-CG2, 9.7.2-CG2, 9.7.2-CG4, 29 90457 30 9.14.4-CG2, 9.14.4-CG4, 9.14.4-Ser, 9.7.2-Ser, яких незалежно вибрана з ділянок CDR1 і CDR2 8.10.3-Ser, 8.10.3-CG4, 8.10.3FG1 або 9.14.4G1. В варіабельної ділянки важкого ланцюга, що містить інших варіантах винаходу амінокислотні заміни амінокислотну послідовність VH-ділянки, вибрану з присутні в одному або декількох аналогічних поSEQ ID NO:2, 6, 10, 14, 18, 22, 26, 30, 34, 38, 46, ложеннях, але, на відміну від вихідного антитіла, 50, 54, 58, 62, 66, 70, 74, 78, 82, 86, 90, 94, 98 або викликають іншу мутацію. 102, або кодовану послідовністю нуклеїнової кисУ деяких варіантах винаходу важкий ланцюг лоти, що кодує VH-ділянку, вибрану з SEQ ID NO:1, містить амінокислотну послідовність варіабельно5, 9, 25, 29, 33, 37, 45, 97 або 101. В іншому варіаго домену (VH) антитіла 252 (SEQ ID NO:2), 88 нті винаходу вказане антитіло містить легкий і ва(SEQ ID NO:6), 100 (SEQ ID NO:10), 3.8.3 (SEQ ID жкий ланцюги, описані вище. NO:14), 2.7.3 (SEQ ID NO:18), 1.120.1 (SEQ ID Одним з типів амінокислотних замін, які моNO:22), 9.14.41 (SEQ ID NO:26), 8.10.3F (SEQ ID жуть бути введені в антитіло, є заміна одного або NO:30), 9.7.2IF (SEQ ID NO:34), 9.14.4 (SEQ ID декількох цистеїнів, які можуть бути хімічно реакNO:38), 8.10.3 (SEQ ID NO:30), 9.7.2 (SEQ ID ційноздатними, іншими залишками, такими як NO:46), 9.7.2C-Ser (SEQ ID NO:50), 9.14.4C-Ser але не обмежуючись ними - аланін або серии. В (SEQ ID NO:54), 8.10.3C-Ser (SEQ ID NO:58), одному з варіантів винаходу розглядається заміна 8.10.3-CG2 (SEQ ID NO:62), 9.7.2-CG2 (SEQ ID неканонічного цистеїну. Така заміна може бути NO:66), 9.7.2-CG4 (SEQ ID NO:70), 9.14.4-CG2 присутньою в каркасній ділянці варіабельного до(SEQ ID NO:74), 9.14.4-CG4 (SEQ ID NO:78), мену або в константній ділянці антитіла. В іншому 9.14.4-Ser (SEQ ID NO:82), 9.7.2-Ser (SEQ ID варіанті винаходу цей цистеїн знаходиться в некаNO:86), 8.10.3-Ser (SEQ ID NO:90), 8.10.3-CG4 нонічній ділянці антитіла. (SEQ ID NO:94), 8.10.3FG1 (SEQ ID NO:98) або Іншим типом амінокислотної заміни, яка може 9.14.4G1 (SEQ ID NO:102), або вказану амінокисбути введена в антитіло, є видалення будь-яких лотну послідовність, що має 1, 2, 3, 4, 5, 6, 7, 8, 9 потенційних протеолітичних сайтів, присутніх в або 10 консервативних амінокислотних замін і/або антитілі а зокрема, сайтів, які присутні в ділянці всього від 1 до 3 неконсервативних амінокислотCDR або в каркасній ділянці варіабельного домену них замін. У деяких варіантах винаходу важкий або в константній ділянці антитіла. Заміна цистеїланцюг будь-якого з вищезгаданих антитіл містить нових залишків і видалення протеолітичних сайтів амінокислотну послідовність, що починається з може знижувати ризик, пов'язаний з будь-якою ділянки CDR1 і закінчується ділянкою CDR3. гетерогенністю продукту антитіла, і тим самим, У деяких варіантах винаходу вказаний важкий збільшувати його гомогенність. Іншим типом аміланцюг містить ділянки CDR1, CDR2 або CDR3 нокислотної заміни є елімінація пар аспарагінантитіла 252, 88, 100, 3.8.3, 2.7.3, 1.120.1, 9.14.41, гліцин, які можуть утворювати сайти деамідування, 8.10.3F, 9.7.2IF, 9.14.4, 8.10.3, 9.7.2, 9.7.2C-Ser, шляхом модифікації одного або обох залишків. 9.14.4C-Ser, 8.10.3C-Ser, 8.10.3-CG2, 9.7.2-CG2, У деяких варіантах винаходу С-кінцевий лізин 9.7.2-CG4, 9.14.4-CG2, 9.14.4-CG4, 9.14.4-Ser, важкого ланцюга анти-M-CSF-антитіла згідно з 9.7.2-Ser, 8.10.3-Ser, 8.10.3-CG4, 8.10.3FG1 або винаходом відсутній (Lewis D.A. et al., Anal. Chem. 9.14.4G1, або вказані ділянки CDR, кожна з яких 66(5): 585-95 (1994). В різних варіантах даного має менше ніж 8, менше ніж 6, менше ніж 4 або винаходу, важкий і легкий ланцюги анти-M-CSFменше ніж 3 консервативних амінокислотних замін антитіл можуть, але необов'язково, включати сигі/або всього три або менше неконсервативних амінальну послідовність. нокислотних замін. В одному зі своїх аспектів даний винахід відУ деяких варіантах винаходу вказаний важкий носиться до інгібування людських моноклональних ланцюг містить вищеописану ділянку CDR3 зародантитіл проти M-CSF і клітинних ліній, сконструйокової лінії або описаного вище антитіла, і може ваних таким чином, що вони продукують ці антитітакож містити ділянки CDR1 і CDR2 послідовності ла. У таблиці 1 перераховані ідентифікатори посзародкової лінії, або вона може містити ділянки лідовностей (SEQ ID NO) нуклеїнових кислот, які CDR1 і CDR2 послідовності антитіла, кожна з яких кодують варіабельну ділянку важкого і легкого ланезалежно вибрана з ділянок антитіла, яке містить нцюгів, і відповідні передбачені амінокислотні посважкий ланцюг антитіла, вибраного з 252, 88, 100, лідовності моноклональних антитіл 252, 88, 100, 3.8.3, 2.7.3, 1.120.1, 9.14.41, 8.10.3F, 9.7.2IF, 3.8.3, 2.7.3, 1.120.1, 9.14.41, 8.10.3F, 9.7.2IF, 9.14.4, 8.10.3, 9.7.2, 9.7.2C-Ser, 9.14.4C-Ser, 9.14.4, 8.10.3 і 9.7.2. Інші варіанти антитіл 9.7.2C8.10.3C-Ser, 8.10.3-CG2, 9.7.2-CG2, 9.7.2-CG4, Ser, 9.14.4C-Ser, 8.10.3C-Ser, 8.10.3-CG2, 9.7.29.14.4-CG2, 9.14.4-CG4, 9.14.4-Ser, 9.7.2-Ser, CG2, 9.7.2-CG4, 9.14.4-CG2, 9.14.4-CG4, 9.14.48.10.3-Ser, 8.10.3-CG4, 8.10.3FG1 або 9.14.4G1. В Ser, 9.7.2-Ser, 8.10.3-Ser, 8.10.3-CG4, 8.10.3FG1 іншому варіанті винаходу вказаний важкий ланцюг або 9.14.4G1 можуть бути одержані методами, містить CDR3 описаної тут послідовності антитіла і відомими фахівцям. може також містити ділянки CDR1 і CDR2, кожна з 31 90457 Таблиця 1 Людські анти-M-CSF-антитіла Ідентифікатор послідовностей (SEQ ID NO:) Повнорозмірна послідовність ΜAb Важкий ланцюг Легкий ланцюг ДНК Білок ДНК Білок 252 1 2 3 4 88 5 6 7 8 100 9 10 11 12 3.8.3 14 16 2.7.3 18 20 1.120.1 22 24 9.14.41 25 26 27 28 9.14.4 37 38 27 28 9.14.4C-Ser 54 56 9.14.4-CG2 74 56 9.14.4-CG4 78 56 9.14.4-Ser 82 27 28 9.14.4-G1 101 102 27 28 8.10.3F 29 30 31 32 8.10.3 29 30 43 44 8.10.3C-Ser 58 60 8.10.3-CG2 62 60 8.10.3-Ser 90 43 44 8.10.3-CG4 94 60 8.10.3FG1 97 98 31 32 9.7.2IF 33 34 35 36 9.7.2 45 46 47 48 9.7.2C-Ser 50 52 9.7.2-CG2 66 52 9.7.2-CG4 70 52 9.7.2-Ser 86 47 48 Класи і підкласи анти-М-СSF-антитіл Клас і підклас анти-М-СSF-антитіл можуть бути визначені будь-яким методом, відомим фахівцям. У загальних рисах, клас і підклас анти-МСSF-антитіл можуть бути визначені з використанням антитіл, які є специфічними відносно конкретного класу і субкласу антитіла. Такі антитіла є комерційно доступними. Клас і підклас антитіла може бути визначений за допомогою ELISA або Вестерн-блот-аналізу, а також іншими методами. Альтернативно, клас і підклас антитіла може бути визначений шляхом секвенування всіх константних доменів важкого і/або легкого ланцюгів антитіл або їх частини, порівняння їх амінокислотних послідовностей з відомими амінокислотними послідовностями різних класів і субкласів імуноглобулінів і визначення класу і підкласу цих антитіл. У деяких варіантах винаходу анти-М-СSFантитіло являє собою моноклональне антитіло. Таким анти-М-СSF-антитілом може бути молекула IgG, IgM, IgE, IgA або IgD. У переважних варіантах анти-М-СSF-антитілом є IgG підкласів IgGl, IgG2, IgG3 або IgG4. В інших переважних варіантах вказаним антитілом є імуноглобулін підкласів IgG2 або IgG4. В іншому переважному варіанті таким антитілом є імуноглобулін підкласу IgG1. Видова і молекулярна селективність 32 В іншому аспекті даного винаходу анти-МСSF-антитіла володіють як видовою, так і молекулярною селективністю. У деяких варіантах винаходу анти-М-CSF-антитіло зв'язується з M-CSF людини, собакоподібних мавп і мишей. Відповідно до опису винаходу, можна визначити видову селективність анти-М-CSF-антитіла добре відомими методами. Наприклад, видову селективність можна визначити за допомогою Вестерн-блот-аналізу, FACS, ELISA, РІА, аналізу на проліферацію клітин і аналізу на зв'язування з M-CSF-рецептором. У переважному варіанті винаходу видову селективність можна визначити за допомогою аналізу на проліферацію клітин або за допомогою ELISA. В іншому варіанті винаходу анти-М-СSFантитіло володіє селективністю до M-CSF, яка щонайменше в 100 разів перевищує селективність у відношенні GM-CSF/G-CSF. У деяких варіантах винаходу, анти-М-СSF-антитіло не виявляє помітного специфічного зв'язування з будь-яким іншим білком, що не є M-CSF. Селективність aнти-MCSF-антитілa у відношенні M-CSF може бути визначена методами, добре відомими фахівцям, відповідно до опису даного винаходу. Наприклад, така селективність може бути визначена за допомогою Вестерн-блот-аналізу, FACS, ELISA або РІА. Ідентифікація епітопів M-CSF, розпізнаваних анти-М-СSF-антитілами Даний винахід відноситься до людського моноклонального анти-M-CSF-антитіла, яке зв'язується з M-CSF і конкурує за зв'язування з таким же епітопом, перехресно конкурує за зв'язування з таким же епітопом і/або зв'язується з M-CSF з таким же KD, як (а) антитіло, вибране з 252, 88, 100, 3.8.3, 2.7.3, 1.120.1, 9.14.41, 8.10.3F, 9.7.2IF, 9.14.4, 8.10.3 і 9.7.2. Інші варіанти антитіл 9.7.2CSer, 9.14.4C-Ser, 8.10.3C-Ser, 8.10.3-CG2, 9.7.2CG2, 9.7.2-CG4, 9.14.4-CG2, 9.14.4-CG4, 9.14.4Ser, 9.7.2-Ser, 8.10.3-Ser, 8.10.3-CG4, 8.10.3FG1 або 9.14.4G1; (b) антитіло, яке містить ділянку важкого ланцюга, що має амінокислотну послідовність SEQ ID NO:2, 6, 10, 14, 18, 22, 26, 30, 34, 38, 46, 50, 54, 58, 62, 66, 70, 74, 78, 82, 86, 90, 94, 98 або 102, (с) антитіло, яке містить ділянку легкого ланцюга, що має амінокислотну послідовність SEQ ID NO:4, 8, 12, 16, 20, 24, 28, 32, 36, 44, 48, 52, 56 або 60; (d) антитіло, яке містить варіабельну ділянку важкого ланцюга, що визначається в (b), і варіабельну ділянку легкого ланцюга, що визначається в (с). Для того, щоб визначити, чи може антитіло зв'язуватись, конкурувати за зв'язування, перехресно конкурувати за зв'язування з таким же епітопом, і/або чи має воно таке ж KD, як і анти-М-СSFантитіло, можуть бути застосовані методи, відомі фахівцям. В одному з варіантів винаходу, анти-МСSF-антитіію згідно з винаходом може зв'язуватись з M-CSF в умовах насичення, а потім може бути визначена здатність антитіла, яке тестується, зв'язуватись з M-CSF. Якщо антитіло, що тестується, здатне зв'язуватись з M-CSF одночасно з анти-М-СSF-антитілом, то антитіло, що тестується, зв'язується з іншим епітопом, ніж той епітоп, з яким зв'язується анти-М-СSF-антитшо. Однак, якщо антитіло, що тестується, нездатне зв'язуватись 33 90457 34 з M-CSF одночасно з анти-М-СSF-антитілом, то тах винаходу вказане антитіло зв'язується з Mантитіло, що тестується, зв'язується з тим же саCSF при koff 2,0 10-5с-1 або koff 2,0 10-6с-1 або мемим епітопом, з епітопом, що перекривається, або нше. У деяких варіантах винаходу koff є в основноз епітопом, який знаходиться в безпосередній блиму таким же, як і koff описаного тут антитіла, такого зькості до епітопу, пов'язаного з людським анти-Мяк антитіло, вибране з 252, 88, 100, 3.8.3, 2.7.3, СSF-антитілом. Цей експеримент може бути про1.120.1, 9.14.41, 8.10.3F, 9.7.2IF, 9.14.4, 8.10.3, ведений за допомогою ELISA, РІА або FACS. У 9.7.2, 9.7.2C-Ser, 9.14.4C-Ser, 8.10.3C-Ser, 8.10.3переважному варіанті винаходу, такий експериCG2, 9.7.2-CG2, 9.7.2-CG4, 9.14.4-CG2, 9.14.4мент проводять з використанням BIACORE™. CG4, 9.14.4-Ser, 9.7.2-Ser, 8.10.3-Ser, 8.10.3-CG4, Афінність зв'язування анти-М-СSF-антитіл з M8.10.3FG1 або 9.14.4G1. У деяких варіантах винаCSF ходу вказане антитіло зв'язується з M-CSF в осноУ деяких варіантах винаходу анти-М-СSFвному з таким же koff, як і антитіло, яке містить (a) антитіла зв'язуються з M-CSF з високої афінністю. CDR3 і може, але необов'язково, містити CDR1 У деяких варіантах винаходу анти-М-СSF-антитіло і/або CDR2 важкого ланцюга антитіла, вибраного з зв'язується з M-CSF при KD 1 10-7 Μ або менше. В 252, 88, 100, 3.8.3, 2.7.3, 1.120.1, 9.14.41, 8.10.3F, інших переважних варіантах винаходу вказане 9.7.2IF, 9.14.4, 8.10.3, 9.7.2, 9.7.2С-Ser, 9.14.4CSer, 8.10.3C-Ser, 8.10.3-CG2, 9.7.2-CG2, 9.7.2-CG4, антитіло зв'язується з M-CSF при KD 1 10-8М, 1 109 9.14.4-CG2, 9.14.4-CG4, 9.14.4-Ser, 9.7.2-Ser, М, 1 10-10М, 1 10-11М, 1 10-12М або менше. У де8.10.3-Ser, 8.10.3-CG4, 8.1O.3FG1 або 9.14.4G1; яких варіантах винаходу KD складає від 1пМ до або (b) CDR2 і може, але необов'язково, містити 500пМ. В інших варіантах винаходу KD складає від CDR1 і/або CDR3 легкого ланцюга антитіла, виб500пМ до 1мкМ. В інших варіантах винаходу KD раного з 252, 88, 100, 3.8.3, 2.7.3, 1.120.1, 9.14.41, складає від 1мкМ до 100нМ. В інших варіантах 8.10.3F, 9.7.2IF, 9.14.4, 8.10.3, 9.7.2, 9.7.2C-Ser, винаходу KD складає від 100мМ до 10нМ. У ще 9.14.4C-Ser, 8.10.3C-Ser, 8.10.3-CG2, 9.7.2-CG2, більш переважному варіанті вказане антитіло зв'я9.7.2-CG4, 9.14.4-CG2, 9.14.4-CG4, 9.14.4-Ser, зується з M-CSF в основному при такому ж KD, як і 9.7.2-Ser, 8.10.3-Ser, 8.10.3-CG4, 8.10.3FG1 або антитіло, вибране з 252, 88, 100, 3.8.3, 2.7.3, 9.14.4G1. У деяких варіантах винаходу антитіло 1.120.1, 9.14.41, 8.10.3F, 9.7.2IF, 9.14.4, 8.10.3, зв'язується з M-CSF в основному з таким же koff, як 9.7.2, 9.7.2С-Ser, 9.14.4C-Ser, 8.10.3C-Ser, 8.10.3і антитіло, яке містить варіабельну ділянку важкого CG2, 9.7.2-CG2, 9.7.2-CG4, 9.14.4-CG2, 9.14.4ланцюга, що має амінокислотну послідовність SEQ CG4, 9.14.4-Ser, 9.7.2-Ser, 8.10.3-Ser, 8.10.3-CG4, ID NO:2, 6, 10, 14, 18, 22, 26, 30, 34, 38, 46, 50, 54, 8.10.3FG1 або 9.14.4G1. В іншому переважному 58, 62, 66, 70, 74, 78, 82, 86, 90, 94, 98 або 102, варіанті вказане антитіло зв'язується з M-CSF в або яке містить варіабельну ділянку легкого ланосновному при такому ж KD, як і антитіло, яке місцюга, що має амінокислотну послідовність SEQ ID тить CDR2 легкого ланцюга і/або CDR3 важкого NO:4, 8, 12, 16, 20, 24, 28, 32, 36, 44, 48, 52, 56 або ланцюга антитіла, вибраного з 252, 88, 100, 3.8.3, 60. В іншому переважному варіанті винаходу вка2.7.3, 1.120.1, 9.14.41, 8.10.3F, 9.7.2IF, 9.14.4, зане антитіло зв'язується з M-CSF в основному з 8.10.3, 9.7.2, 9.7.2C-Ser, 9.14.4C-Ser, 8.10.3C-Ser, таким же koff, як і антитіло, яке містить CDR2, і мо8.10.3-CG2, 9.7.2-CG2, 9.7.2-CG4, 9.14.4-CG2, же, але необов'язково, містити CDR1 і/або CDR3 9.14.4-CG4, 9.14.4-Ser, 9.7.2-Ser, 8.10.3-Ser, варіабельної ділянки легкого ланцюга, що має 8.10.3-CG4, 8.10.3FG1 або 9.14.4G1. У ще одному амінокислотну послідовність SEQ ID NO:4, 8, 12, переважному варіанті антитіло зв'язується з M16, 20, 24, 28, 32, 36, 44, 48, 52, 56 або 60, або яке CSF в основному при такому ж Ко, як і антитіло, містить CDR3 і може, але необов'язково, містити яке містить варіабельну ділянку важкого ланцюга, CDR1 і/або CDR2 варіабельної ділянки важкого що має амінокислотну послідовність SEQ ID NO:2, ланцюга, що має амінокислотну послідовність SEQ 6, 10, 14, 18, 22, 26, ЗО, 34, 38, 46, 50, 54, 58, 62, ID NO:2, 6, 10, 14, 18, 22, 26, 30, 34, 38, 46, 50, 54, 66, 70, 74, 78, 82, 86, 90, 94, 98 або 102, або яке 58, 62, 66, 70, 74, 78, 82, 86, 90, 94, 98 або 102. містить варіабельну ділянку легкого ланцюга, що Афінність зв'язування анти-М-СSF-антитіла з має амінокислотну послідовність SEQ ID NO:4, 8, M-CSF і швидкість дисоціації такого антитіла мо12, 16, 20, 24, 28, 32, 36, 44, 48, 52, 56 або 60. В жуть бути визначені методами, відомими фахівіншому переважному варіанті винаходу вказане цям. Афінність зв'язування може бути визначена антитіло зв'язується з M-CSF в основному при таза допомогою конкурентних ELISA, РІА, поверхнекому ж KD, як і антитіло, яке містить CDR2, і може, вого плазмонного резонансу (наприклад, із застоале необов'язково, містити CDR1 і/або CDR3 варісуванням технології BIACORE™). Швидкість дисоабельної ділянки легкого ланцюга, що має аміноціації може бути виміряна із застосуванням кислотну послідовність VL-ділянки SEQ ID NO:4, 8, поверхневого плазмонного резонансу. Переважно, 12, 16, 20, 24, 28, 32, 36, 44, 48, 52, 56 або 60, або афінність зв'язування і швидкість дисоціації виміяке містить CDR3 і може, але необов'язково, місрюють за допомогою поверхневого плазмонного тити CDR1 і/або CDR2 варіабельної ділянки важрезонансу. Більш переважно, афінність зв'язуванкого ланцюга, що має амінокислотну послідовність ня і швидкість дисоціації вимірюють із застосуванVH-ділянки SEQ ID NO:2, 6, 10, 14, 18, 22, 26, 30, ням технології BIACORE™. У прикладі VI описаний 34, 38, 46, 50, 54, 58, 62, 66, 70, 74, 78, 82, 86, 90, репрезентативний спосіб визначення констант 94, 98 або 102. афінностей моноклональних анти-М-CSF-антитіл У деяких варіантах винаходу анти-М-СSFіз застосуванням технології BIACORE™. антитіло має низьку швидкість дисоціації. У деяких Інгібування активності M-CSF-aнти-M-CSFваріантах винаходу анти-М-СSF-антитіло має koff антитілом 2,0 10-4с-1 або менше. В інших переважних варіан 35 90457 36 Інгібування зв'язування M-CSF з c-fms шляхом імунізації антигеном M-CSF транс генних В іншому варіанті винаходу даний винахід відтварин, що не є людиною, які мають людський носиться до анти-M-CSF-антитіла, яке інгібує зв'ялокус імуноглобуліну. Такі тварини можуть бути зування M-CSF з рецептором c-fms і блокує або створені методами, описаними у вищезгаданих попереджає активацію c-fms. У переважному варідокументах. Методи, описані в цих документах, анті винаходу M-CSF являє собою людський Mможуть бути модифіковані як описано у патенті CSF. В іншому переважному варіанті винаходу США 5994619. У патенті США 5994619 описані вказаним анти-M-CSF-антитілом є людське антитіметоди продукування нових клітин і клітинних ліній ло. ІС50 може бути визначена за допомогою аналікультуральної внутрішньої клітинної маси (СІСМ), зів ELISA і РІА, а також клітинних аналізів, таких як одержаних від свиней і корів, і трансгенних клітин аналіз на проліферацію клітин, аналіз на зміну СІСМ, в які була введена гетерологічна ДНК. Траформи моноцитів цільної крові або аналіз на зв'янсгенні клітини СІСМ можуть бути використані для зування з рецептором. В одному з варіантів винапродукування клонованих трансгенних ембріонів, ходу, антитіло або його частина інгібують проліплоду і потомства. У патенті 5994619 також описані методи створення трансгенних тварин, які здатні ферацію клітин при ІС50 не більше ніж 8,0 10-7М, передавати потомству гетерологічну ДНК. У перепереважно, не більше ніж 3 10-7М, або більш певажних варіантах винаходу тваринами, що не відреважно, не більше ніж 8 10-7М, як було виміряно носяться до людини, є щури, вівці свині кози, веза допомогою аналізу на проліферацію клітин. В лика рогата худоба або коні. іншому варіанті винаходу ІС50, виміряна за допоУ мишей XENOMOUSE™ продукується репермогою аналізу на зміну форми моноцитів, складає туар повнорозмірних людських антитіл, подібний не більше ніж 2 10-6М, переважно, не більше ніж тому, який звичайно продукується у дорослої лю9,0 10-7М, або більш переважно, не більше ніж дини, і генеруються антигенспецифічні людські 9,0 10-8М. В іншому переважному варіанті винахоантитіла. У деяких варіантах винаходу миші ду ІС50, виміряна за допомогою аналізу на зв'язуXENOMOUSE™ звичайно містять приблизно 80% вання з рецептором, складає не більше ніж 2 10 генів V, що кодують репертуар людських антитіл, 6 -7 М, переважно, не більше ніж 8,0 10 М, або більш завдяки введенню цим мишам фрагментів дріж-8 переважно, не більше ніж 7,0 10 М. У прикладах джової штучної хромосоми (YAC), що мають мегаIII, IV і V проілюстровані аналізи різних типів. нуклеотиди певної довжини і конфігурацію зародВ іншому аспекті винаходу анти-М-СSFкової лінії, і що знаходяться в локусах важкого антитіла згідно з винаходом інгібують проліфераланцюга і легкого каппа-ланцюга людських антицію моноцитів/макрофагів у відповідь на вплив Mтіл. В іншому варіанті винаходу миша CSF щонайменше на 20%, а більш переважно, на XENOMOUSE™, крім того, містить майже весь 40%, 45%, 50%, 55%, 60%, 65%, 70%, 80%, 85%, локус легкого лямбда-ланцюга. Дивіться, Mendez 90%, 95% або 100% у порівнянні з проліферацією et al., Nature Genetics 16: 146-156 (1997), Green & клітин за відсутності антитіла. Jakobovits, J.Exp. Med. 188: 483-495 (1998) і WO Способи продукування антитіл і антитілопро98/24893, які включені в даний опис за допомогою дукуючих клітинних ліній посилання. Імунізація У деяких варіантах винаходу тваринами, що У деяких варіантах винаходу людські антитіла не є людиною і що містять гени людського імуногпродукують шляхом імунізації антигеном M-CSF лобуліну, є тварини, які мають "мінілокуси" людсьтварини, що не є людиною і що містить в своєму кого імуноглобуліну. У підході основаному на мінігеномі деякі або всі локуси важкого і легкого ланлокусах, екзогенний локус Ig імітується за цюгів людського імуноглобуліну. В переважному допомогою включення окремих генів локусу Ig. варіанті винаходу, вказаною твариною, що не є Таким чином, конструкція для введення тварині людиною, є тваринна XENOMOUSE™ (Abgenix утворюється з одного або декількох генів VH, одноInc., Fremont, CA). Іншою твариною, яка може бути го або декількох генів DH, одного або декількох використана в даному винаході і яка відноситься генів JH, константного домену ти і другого констандо людини, є трансгенна миша, продукована тного домену (переважно, константного домену Medarex (Medarex, Inc., Princeton, NJ). гамма-ланцюга). Цей підхід описаний, inter alia, в Миші XENOMOUSE™ являють собою генетичпатентах США 5545807, 5545806, 5569825, но сконструйовані види мишей, які містять великі 5625126, 5633425,5661016, 5770429, 5789650, фрагменти локусів важкого і легкого ланцюгів 5814318, 5591669, 5612205, 5721367, 5789215 і людського імуноглобуліну і є дефіцитними за про5643763, які включені в даний опис за допомогою дукуванням мишачого антитіла. Дивіться, наприпосилання. клад, Green et al., Nature Genetics 7: 13-21 (1994) і В іншому своєму аспекті даний винахід віднопатенти США 5916771, 5939598, 5985615, ситься до способу одержання aнти-M-CSF-антитіл. 5998209, 6075181, 6091001, 6114598, 6130364, У деяких варіантах винаходу вказаних тварин, що 6162963 і 6150584. Дивіться також WO 91/10741, не є людиною, імунізують антигеном M-CSF як WO 94/02602, WO 96/34096, WO 96/33735, WO описано нижче в умовах, що дозволяють продуку98/16654, WO 98/24893, WO 98/50433, WO вати антитіло. Антитіло-продукуючі клітини виді99/45031, WO 99/53049, WO 00/09560 і WO ляють з цих тварин, піддають злиттю з мієломами 00/037504. для продукування гібридом і виділяють нуклеїнові В іншому своєму аспекті даний винахід віднокислоти, що кодують важкий і легкий ланцюги анситься до способу одержання aнти-M-CSF-антитіл ти-М-СSF-антитіла, яке представляє інтерес. Повід тварин, що не є людиною і що не є мишею, тім ці нуклеїнові кислоти модифікують відомими 37 90457 38 методами генної терапії і методами, детально кування клітин онкогенним вірусом, культивування описаними нижче, з метою зменшення розміру в умовах відбору на іморталізовані клітини, обробнадлюдської послідовності, тобто з метою "гуманіку цих клітин канцерогенними або мутуючими спозації" антитіла для зниження імунної відповіді у луками, злиття цих клітин з іморталізованою клітилюдини. ною, наприклад, з мієломною клітиною, та У деяких варіантах винаходу антигеном M-CSF інактивацію клітин геном-супресором пухлини. є виділений і/або очищений M-CSF. У переважноДивіться вище, наприклад, Harlow & Lane. Якщо му варіанті винаходу вказаним антигеном M-CSF є застосовується злиття з мієломними клітинами, то, людський M-CSF. У деяких варіантах винаходу переважно, щоб мієломні клітини не секретували вказаним антигеном M-CSF є фрагмент М-CSF. У поліпептиди імуноглобуліну (не секреторна клітиндеяких варіантах винаходу вказаним фрагментом на лінія). Іморталізовані клітини скринують з викоM-CSF є позаклітинний домен M-CSF. У деяких ристанням M-CSF або його частини, або клітини, варіантах винаходу вказаний фрагмент M-CSF яка експресу є M-CSF. У переважному варіанті містить щонайменше один епітоп M-CSF. В інших винаходу попередній скринінг здійснюють за доваріантах винаходу вказаним антигеном M-CSF є помогою імуноферментного аналізу (ELISA) або клітина, яка експресує або надекспресує M-CSF радіоімуноаналізу. Приклад ELISA-скринінгу навоабо його імуногенний фрагмент на поверхні клітидиться в заявці WO 00/37504, яка включена в дани. У деяких варіантах винаходу вказаним антигений опис за допомогою посилання. ном M-CSF є гібридний білок M-CSF. M-CSF може Клітини, які продукують aнти-M-CSF-антитілo, бути виділений з природних джерел відомими менаприклад, гібридоми, відбирають, клонують, а тодами. Рекомбінантний M-CSF є комерційно доспотім скринують на потрібні властивості включаютупним. чи стійке зростання, продукування антитіл на виІмунізація тварин може бути проведена будьсокому рівні і з потрібними властивостями, як деяким методом, відомим фахівцям. Дивіться, натально обговорюється нижче. Гібридоми можуть приклад, Harlow & Lane, Antibodies: A Laboratory бути розмножені in vivo у сингенних тварин, у тваManual, New York: Cold Spring Harbor Press, 1990. рин з відсутністю імунної системи, наприклад, у Методи імунізації тварин, що не відносяться до безтимусних ("голих") мишей або в клітинній кульлюдини, таких як щури, вівці кози, свині велика турі in vitro. Методи відбору, клонування і розмнорогата худоба і коні добре відомі фахівцям. Диження гібридом добре відомі фахівцеві в даній віться, наприклад, Harlow & Lane, дивіться вище і області патент США №5994619. У переважному варіанті У переважному варіанті винаходу імунізовавинаходу антиген M-CSF вводять разом з ад'юваною твариною, що не відноситься до людини, є нтом для стимуляції імунної відповіді Прикладами тварина, у якої експресуються гени людських імуад'ювантів є повний або неповний ад'ювант Фрейноглобулінів; і В-клітини селезінки цієї тварини нда, RIBI (мурамілдипептиди) або ISCOM (імуноспіддають злиттю з мієломною клітинною лінією, тимулюючі комплекси). Такі ад'юванти можуть завзятою у тварини того ж самого виду, що не є люхищати поліпептид від швидкого диспергування диною. У більш переважному варіанті винаходу шляхом його ізолювання в локальній ділянці, або імунізованою твариною є тварина XENOMOUSE™, вони можуть містити речовини, стимулюючі секреа мієломною клітинною лінією є несекреторна мицію факторів, які є хемотаксичними для макрофашача мієлома. У ще більш переважному варіанті гів та інших компонентів імунної системи, з органівинаходу вказаною мієломною клітинною лінією є зму-хазяїна. При введенні поліпептиду схема P3-X63-AG8-653. Дивіться, наприклад, приклад І. імунізації; переважно, включає два або більше Таким чином, в одному з своїх варіантів даний введень даного поліпептиду за період часу в деківинахід відноситься до способів одержання клілька тижнів. У прикладі І проілюстрований метод тинної лінії, яка продукує людське моноклональне продукування моноклональних анти-М-СSFантитіло або його фрагмент проти M-CSF, де вкаантитіл у мишей XENOMOUSE™. зані способи включають: (а) імунізацію описаної Продукування антитіл і антитілопродукуючих тут трансгенної тварини, що не є людиною, фактоклітинних ліній Після імунізації тварини антигеном ром M-CSF, частиною M-CSF або клітиною або M-CSF, у цієї тварини можуть продукуватись антитканиною, яка експресує M-CSF; (b) стимуляцію тіла і/або антитілопродукуючі клітини. У деяких вироблення у трансгенної тварини імунної відповіваріантах винаходу сироватку, що містить анти-Мді на M-CSF; (с) виділення В-лімфоцитів з трансСSF-антитіло, одержують від тварини шляхом генної тварини; (d) іморталізацію В-лімфоцитів; (е) взяття крові або після її умертвіння. Ця сироватка створення окремих моноклональних популяцій може бути використана в тому вигляді в якому іморталізованих В-лімфоцитів; і (f) скринінг іморвона була одержана від тварини, або з цієї сироталізованих В-лімфоцитів для ідентифікації антиватки може бути одержана імуноглобулінова фратіла проти M-CSF. кція, або з неї можуть бути виділені анти-М-CSFВ іншому своєму аспекті даний винахід відноантитіла. ситься до гібридом, які продукують людське aнтиУ деяких варіантах винаходу антитілопродуM-CSF-антитілo. У переважному варіанті винаходу куючі іморталізовані клітинні лінії одержують з клівказаними гібридомами є мишачі гібридоми, опитин, виділених з імунізованої тварини. Після імунісані вище. В інших варіантах винаходу вказані зації тварину умертвляють, і В-клітини лімфовузлів гібридоми продукуються тваринами, що не відноі/або селезінки піддають іморталізації. Методи сяться до людини і миші такими як щури, вівці іморталізації клітин включають, але не обмежусвині кози, велика рогата худоба або коні В іншому ються ними, трансфекцію клітин онкогенами, інфі 39 90457 40 варіанті здійснення винаходу вказаними гібридоможуть приводити до підвищення афінності вихідмами є людські гібридоми. ного виділеного антитіла. В іншому переважному варіанті винаходу траВ іншому своєму аспекті даний винахід віднонсгенну тварину імунізують М-CSF; потім первинні ситься до гібридом, які продукують людські aнтиклітини, наприклад, клітини селезінки або перифеM-CSF-антитілa. У переважному варіанті винаходу ричної крові виділяють з імунізованої трансгенної вказаними гібридомами є мишачі гібридоми, опитварини, та ідентифікують окремі клітини, які просані вище. В іншому варіанті винаходу вказані гібдукують антитіла проти потрібного антигену. З ридоми продуковані у тварин, що не відносяться кожної окремої клітини виділяють поліаденіловану до людини і миші таких як щури, вівці свині кози, мРНК і проводять полімеразні ланцюгові реакції з велика рогата худоба або коні В іншому варіанті оберненою транскриптазою (ОТ-ПЛР) з викорисздійснення винаходу вказаними гібридомами є танням смислових праймерів, які гібридизуються з людські гібридоми. послідовностями варіабельних ділянок, наприНуклеїнові кислоти, вектори, клітини-хазяїни і клад, з використанням вироджених праймерів, що рекомбінантні методи одержання антитіл розпізнають більшість або всі ділянки FR1 генів Нуклеїнові кислоти варіабельних ділянок людського важкого і легкого Даний винахід також охоплює молекули нуклеланцюгів, і антисмислових праймерів, які гібридиїнових кислот, що кодують анти-М-СSF-антитіла. У зуються з послідовностями константних ділянок і деяких варіантах винаходу різні молекули нуклеїділянок стику. Потім кДНК варіабельних ділянок нових кислот кодують важкий і легкий ланцюги важкого і легкого ланцюгів клонують і експресують імуноглобуліну проти M-CSF. В іншому варіанті в будь-якій відповідній клітині-хазяїні наприклад, в винаходу ті ж самі молекули нуклеїнових кислот мієломній клітині у вигляді химерних антитіл з відкодують важкий і легкий ланцюги імуноглобуліну повідними константними ділянками імуноглобуліпроти M-CSF. В одному з варіантів винаходу нукну, такими як константні домени важкого ланцюга і леїнова кислота кодує анти-М-СSF-антитіло згідно к- або λ-ланцюга. Дивіться, наприклад, роботу з винаходом. Babcook J.S. et al., Proc. Natl. Acad. Sci. USA 93: У деяких варіантах винаходу молекула, що ко7843-48, 1996, яка включена в даний опис за додує варіабельний домен легкого ланцюга, містить помогою посилання. Потім анти-М-СSF-антитіла ген VKL5, 012, L2, В3, А27 і ген JK1, JK2, JK3 або ідентифікують і виділяють як описано в даний заяJK4. вці. У деяких варіантах винаходу молекула нуклеїВ іншому варіанті винаходу може бути викоринової кислоти, що кодує легкий ланцюг, кодує амістана техніка фагового представлення для ствонокислотну послідовність, що містить 1, 2, 3, 4, 5, рення бібліотек, що містять репертуар антитіл з 6, 7, 8, 9 або 10 мутацій у порівнянні з амінокислорізними афінностями по відношенню до M-CSF. тною послідовністю зародкової лінії. У деяких ваДля продукування такого репертуару В-клітини, ріантах винаходу молекула нуклеїнової кислоти виділені з імунізованої тварини, не повинні бути містить нуклеотидну послідовність, що кодує аміобов'язково іморталізовані Навпаки, більш перенокислотну послідовність VL, що містить 1, 2, 3, 4, важно використати первинні В-клітини безпосере5, 6, 7, 8, 9 або 10 неконсервативних амінокислотдньо як джерело ДНК. Суміш ДНК, одержаних з Вних замін і/або 1, 2 або 3 неконсервативних замін у клітини, наприклад, з клітини селезінки, викориспорівнянні з послідовністю зародкової лінії Такі товують для одержання експресійної бібліотеки, заміни можуть бути зроблені в ділянках CDR, в наприклад, бібліотеки фагового представлення, каркасних ділянках або в константному домені. трансфекованої в Е. соїі. Одержані клітини тестуУ деяких варіантах винаходу молекула нуклеїють на імунореактивність з M-CSF. Методи іденнової кислоти кодує амінокислотну послідовність тифікації високоафінних людських антитіл з таких VL, що містить, у порівнянні з послідовністю зародбібліотек описані наприклад, Griffiths et al., EMBO кової лінії, один або декілька варіантів, ідентичних J. 13: 3245-3260 (1994); Nissim et al, ibid., pp.692варіантам, присутнім в VL одного з антитіл 252, 88, 698 і Griffiths et al, ibid, 12: 725-734. І нарешті з да100, 3.8.3, 2.7.3, 1.120.1, 9.14.41, 8.10.3F, 9.7.2IF, ної бібліотеки ідентифікують клони, що мають пот9.14.4, 8.10.3, 9.7.2, 9.7.2C-Ser, 9.14.4C-Ser, рібні значення афінностей зв'язування з антиге8.10.3C-Ser, 8.10.3-CG2, 9.7.2-CG2, 9.7.2-CG4, ном, потім виділяють ДНК, що кодує продукт, 9.14.4-CG2, 9.14.4-CG4, 9.14.4-Ser, 9.7.2-Ser, відповідальний за таке зв'язування, і цю ДНК мо8.10.3-Ser, 8.10.3-CG4, 8.10.3FG1 або 9.14.4G1. дифікують для здійснення експресії рекомбінантУ деяких варіантах винаходу дана молекула них продуктів. Бібліотеки фагового представлення нуклеїнової кислоти кодує щонайменше три аміноможуть бути також сконструйовані з використанкислотних мутації у порівнянні з послідовністю ням заздалегідь модифікованих нуклеотидних позародкової лінії, що виявляється в VL одного з анслідовностей і скриновані аналогічним чином. Взатитіл 252, 88, 100, 3.8.3, 2.7.3, 1.120.1, 9.14.4, галі кажучи, кДНК, що кодують важкі і легкі 8.10.3 або 9.7.2. ланцюги, одержують або незалежно одна від одУ деяких варіантах винаходу молекула нуклеїної, або приєднують одна до одної з утворенням нової кислоти містить нуклеотидну послідовність, Fv-аналогів для продукування фагової бібліотеки. яка кодує амінокислотну послідовність VL монокПотім фагову бібліотеку скринують на антитілонального антитіла 252 (SEQ ID NO:4), 88 (SEQ ла, яке мають найбільш високі афінності по відноID NO:8), 100 (SEQ ID NO:12), 3.8.3 (SEQ ID шенню до M-CSF, і з відповідного клону виділяють NO:16), 2.7.3 (SEQ ID NO:20), 1.120.1 (SEQ ID генетичний матеріал. Подальші раунди скринінгу NO:24), 9.14.41 (SEQ ID NO:28), 8.10.3F (SEQ ID NO:32), 9.7.2IF (SEQ ID NO:36), 9.14.4 (SEQ ID 41 90457 42 NO:28), 8.10.3 (SEQ ID NO:44), 9.7.2 (SEQ ID молекулу нуклеїнової кислоти, що кодує легкий NO:48), 9.7.2C-Ser (SEQ ID NO:52), 9.14.4C-Ser ланцюг, який містить мутацію. (SEQ ID NO:56), 8.10.3C-Ser (SEQ ID NO:60), В іншому переважному варіанті здійснення 8.10.3-CG2 (SEQ ID NO:60), 9.7.2-CG2 (SEQ ID даного винаходу молекула нуклеїнової кислоти NO:52), 9.7.2-CG4 (SEQ ID NO:52), 9.14.4-CG2 кодує варіабельний домен важкого ланцюга (VH), і (SEQ ID NO:56), 9.14.4-CG4 (SEQ ID NO:56), містить послідовність людського гена VH 1-18, 39.14.4-Ser (SEQ ID NO:28), 9.7.2-Ser (SEQ ID 33, 3-11, 3-23, 3-48 або послідовність гена 3-7, або NO:48), 8.10.3-Ser (SEQ ID NO:44), 8.10.3-CG4 послідовність, яка походить від них. У різних варі(SEQ ID NO:60), 8.10.3FG1 (SEQ ID NO:32) або антах винаходу молекула нуклеїнової кислоти 9.14.4G1 (SEQ ID NO:28) або її частину. У деяких включає людський ген VH1-18, людський ген DH4варіантах винаходу вказана частина містить що23 і людський ген JH4; людський ген VH3-33, люднайменше ділянку CDR2. У деяких варіантах винаський ген DH1-26 і людський ген JH4; людський ген ходу нуклеїнова кислота кодує амінокислотну посVH3-11, людський ген DH7-27 і людський ген JH4; лідовність CDR легкого ланцюга вказаного людський ген VH3-11, людський ген DH7-27 і людантитіла. У деяких варіантах винаходу вказана ський ген JH6; людський ген VH3-23, людський ген частина складається з суміжних залишків і містить DH1-26 і людський ген JH4; людський ген VH3-7, CDR1-CDR3. людський ген DH6-13 і людський ген JH4; людський У деяких варіантах винаходу молекула нуклеїген VH3-11, людський ген DH7-27 і людський ген нової кислоти містить нуклеотидну послідовність, JH4b; людський ген VH3-48, людський ген DH1-26 і що кодує одну з наступних амінокислотних послілюдський ген JH4b; людський ген VH3-11, людський довностей легкого ланцюга SEQ ID NO:4, 8, 12, 16, ген DH6-13 і людський ген JH6b або послідовність, 20, 24, 28, 32, 36, 44, 48, 52, 56 або 60. У деяких що походить від вказаних людських генів. переважних варіантах винаходу молекула нуклеїУ деяких варіантах винаходу молекула нуклеїнової кислоти містить нуклеотидну послідовність нової кислоти кодує амінокислотну послідовність, легкого ланцюга SEQ ID NO:3, 7, 11, 27, 31, 35, 43 що містить 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, або 47 або її частину. 15, 16, 17 або 18 мутацій у порівнянні з амінокисУ деяких варіантах винаходу молекула нуклеїлотною послідовністю зародкової лінії, що кодунової кислоти кодує амінокислотну послідовність ється людськими генами V, D або J. В деяких варіVL, яка щонайменше на 70%, 75%, 80%, 85%, 90%, антах винаходу вказані мутації присутні в VH95%, 97%, 98% або 99% ідентична амінокислотній ділянки. У деяких варіантах винаходу вказані мупослідовності VL, поданій на Фіг.1, або амінокислотації присутні в ділянках CDR. тним послідовностям VL будь-якого одного з наУ деяких варіантах винаходу молекула нуклеїступних антитіл 252, 88, 100, 3.8.3, 2.7.3, 1.120.1, нової кислоти, у порівнянні з послідовністю нуклеї9.14.41, 8.10.3F, 9.7.2IF, 9.14.4, 8.10.3, 9.7.2, нової кислоти зародкової лінії, кодує одну або де9.7.2C-Ser, 9.14.4C-Ser, 8.10.3C-Ser, 8.10.3-CG2, кілька амінокислотних мутацій, ідентичних 9.7.2-CG2, 9.7.2-CG4, 9.14.4-CG2, 9.14.4-CG4, амінокислотним мутаціям, присутнім в VH монок9.14.4-Ser, 9.7.2-Ser, 8.10.3-Ser, 8.10.3-CG4, лонального антитіла 252, 88, 100, 3.8.3, 2.7.3, 8.10.3FG1 або 9.14.4G1, або амінокислотної послі1.120.1, 9.14.41, 8.10.3F, 9.7.2IF, 9.14.4, 8.10.3, довності будь-якої з наступних послідовностей 9.7.2, 9.7.2C-Ser, 9.14.4C-Ser, 8.10.3C-Ser, 8.10.3SEQ ID NO:4, 8, 12, 16, 20, 24, 28, 32, 36, 44, 48, CG2, 9.7.2-CG2, 9.7.2-CG4, 9.14.4-CG2, 9.14.452, 56 або 60. Молекулами нуклеїнової кислоти CG4, 9.14.4-Ser, 9.7.2-Ser, 8.10.3-Ser, 8.10.3-CG4, згідно з винаходом є нуклеїнові кислоти, які гібри8.10.3FG1 або 9.14.4G1. У деяких варіантах винадизуються в умовах високої жорсткості описаних ходу нуклеїнова кислота, у порівнянні з послідоввище, з послідовністю нуклеїнової кислоти, що ністю зародкової лінії, кодує щонайменше три амікодує амінокислотну послідовність легкого ланцюнокислотних мутації, які ідентичні щонайменше га SEQ ID NO:4, 8, 12, 16, 20, 24, 28, 32, 36, 44, 48, трьом амінокислотним мутаціям, присутнім в од52, 56 або 60, або амінокислотну послідовність ному з вищеперелічених моноклональних антитіл. легкого ланцюга SEQ ID NO:3,7, 11,27, 31,35, 43 У деяких варіантах винаходу молекула нуклеїабо 47. нової кислоти містить нуклеотидну послідовність, В іншому варіанті винаходу нуклеїнова кислояка кодує щонайменше частину амінокислотної та кодує повнорозмірний легкий ланцюг антитіла, послідовності VH антитіла 252 (SEQ ID NO:4), 88 вибраного 252, 88, 100, 3.8.3, 2.7.3, 1.120.1, (SEQ ID NO:8), 100 (SEQ ID NO:12), 3.8.3 (SEQ ID 9.14.41, 8.10.3F, 9.7.2IF, 9.14.4, 8.10.3, 9.7.2, NO:16), 2.7.3 (SEQ ID NO:20), 1.120.1 (SEQ ID 9.7.2C-Ser, 9.14.4C-Ser, 8.10.3C-Ser, 8.10.3-CG2, NO:24), 9.14.41 (SEQ ID NO:28), 8.10.3F (SEQ ID 9.7.2-CG2, 9.7.2-CG4, 9.14.4-CG2, 9.14.4-CG4, NO:32), 9.7.2IF (SEQ ID NO:36), 9.14.4 (SEQ ID 9.14.4-Ser, 9.7.2-Ser, 8.10.3-Ser, 8.10.3-CG4, NO:28), 8.10.3 (SEQ ID NO:44), 9.7.2 (SEQ ID 8.10.3FG1 або 9.14.4G1, або легкий ланцюг, що NO:48), 9.7.2C-Ser (SEQ ID NO:52), 9.14.4C-Ser містить амінокислотну послідовність SEQ ID NO:4, (SEQ ID NO:56), 8.10.3C-Ser (SEQ ID NO:60), 8, 12, 16, 20, 24, 28, 32, 36, 44, 48, 52, 56 або 60 і 8.10.3-CG2 (SEQ ID NO:60), 9.7.2-CG2 (SEQ ID константну ділянку легкого ланцюга, або легкий NO:52), 9.7.2-CG4 (SEQ ID NO:52), 9.14.4-CG2 ланцюг, що містить мутацію. Крім того, вказана (SEQ ID NO:56), 9.14.4-CG4 (SEQ ID NO:56), нуклеїнова кислота може містити нуклеотидну по9.14.4-Ser (SEQ ID NO:28), 9.7.2-Ser (SEQ ID слідовність легкого ланцюга SEQ ID NO:3, 7, 11, NO:48), 8.10.3-Ser (SEQ ID NO:44), 8.10.3-CG4 27, 31, 35, 43 або 47 і нуклеотидну послідовність, (SEQ ID NO:60), 8.10.3FG1 (SEQ ID NO:32) або що кодує константну ділянку легкого ланцюга, або 9.14.4G1 (SEQ ID NO:28), або вказана послідовність має консервативні амінокислотні мутації і/або 43 90457 44 має всі три або менше неконсервативних амінокизана мРНК може бути використана з метою продуслотних замін. У різних варіантах винаходу вказакування кДНК для проведення полімеразної ланна послідовність кодує одну або декілька ділянок цюгової реакції (ПЛР) або для кДНК-клонування CDR, переважно, ділянку CDR3, всі три ділянки генів антитіла. У переважному варіанті винаходу CDR, безперервну частину, що включає CDR1молекулу нуклеїнової кислоти виділяють з гібриCDR3, або повнорозмірну ділянку VH. доми, яка має, як один з партнерів по злиттю, кліУ деяких варіантах винаходу молекула нуклеїтину, яка продукує людський імуноглобулін і похонової кислоти включає нуклеотидну послідовність дить від трансгенної тварини, що не є людиною. У важкого ланцюга, яка кодує амінокислотну посліще більш переважному варіанті винаходу клітину, довність однієї з SEQ ID NO:2, 6, 10, 14, 18, 22, 26, яка продукує людський імуноглобулін, виділяють з 30, 34, 38, 46, 50, 54, 58, 62, 66, 70, 74, 78, 82, 86, тварини XENOMOUSE™. В іншому варіанті вина90, 94, 98 або 102. У деяких варіантах винаходу ходу клітина, яка продукує людський імуноглобумолекула нуклеїнової кислоти містить щонайменлін, походить від трансгенної тварини, що не є ше частину нуклеотидної послідовності важкого людиною і мишею, як описано вище. В іншому ланцюга SEQ ID NO:1, 5, 9, 25, 29, 33, 37, 45, 97 варіанті винаходу нуклеїнову кислоту виділяють з або 101. У деяких варіантах винаходу вказана часнетрансгенної тварини, що не є людиною. Молетина кодує VH-ділянку, ділянку CDR3, всі три ділякули нуклеїнової кислоти, виділені з нетрансгенної нки CDR або безперервну частину, що включає тварини, що не є людиною, можуть бути викорисCDR1-CDR3. тані наприклад, для гуманізації антитіл. У деяких варіантах винаходу молекула нуклеїУ деяких варіантах винаходу нуклеїнова киснової кислоти кодує амінокислотну послідовність лота, що кодує важкий ланцюг анти-М-СSFVH, яка щонайменше на 70%, 75%, 80%, 85%, 90%, антитіла згідно з винаходом, може містити нуклео95%, 97%, 98% або 99% ідентична амінокислоттидну послідовність, що кодує VН-домeн згідно з ним послідовностям VH, поданим на Фіг.4, аміновинаходом, приєднану, із збереженням рамки зчикислотної послідовності VH будь-якої однієї з SEQ тування, до нуклеотидної послідовності що кодує ID NO:2, 6, 10, 14, 18, 22, 26, 30, 34, 38, 46, 50, 54, константний домен важкого ланцюга, який похо58, 62, 66, 70, 74, 78, 82, 86, 90, 94, 98 або 102. дить від будь-якого джерела. Аналогічним чином, Молекули нуклеїнової кислоти згідно з винаходом молекула нуклеїнової кислоти, що кодує легкий включають нуклеїнові кислоти, які гібридизуються ланцюг aнти-M-CSF-aнтитіло згідно з винаходом, в умовах високої жорсткості описаних вище, з нукможе містити нуклеотидну послідовність, що кодує леотидною послідовністю, що кодує амінокислотну VL-домeн згідно з винаходом, приєднану, зі зберепослідовність важкого ланцюга SEQ ID NO:2, 6, 10, женням рамки зчитування, до нуклеотидної послі14, 18, 22, 26, 30, 34, 38, 46, 50, 54, 58, 62, 66, 70, довності що кодує константний домен легкого ла74, 78, 82, 86, 90, 94, 98 або 102, або має нуклеонцюга, який походить від будь-якого джерела. тидну послідовність SEQ ID NO:1, 5, 9, 25, 29, 33, В іншому аспекті даного винаходу молекули 37, 45, 97 або 101. нуклеїнової кислоти, що кодують варіабельний В іншому варіанті винаходу нуклеїнова кислодомен важкого (VH) і легкого (VL) ланцюгів, "перетта кодує повнорозмірний важкий ланцюг антитіла, ворюють" в повнорозмірні гени антитіла. В одному вибраного з 252, 88, 100, 3.8.3, 2.7.3, 1.120.1, з варіантів винаходу молекули нуклеїнової кисло9.14.41, 8.10.3F, 9.7.2IF, 9.14.4, 8.10.3, 9.7.2, ти, що кодують VH або VL-домeни перетворюють в 9.7.2C-Ser, 9.14.4C-Ser, 8.10.3C-Ser, 8.10.3-CG2, повнорозмірні гени антитіла шляхом їх інсерції в 9.7.2-CG2, 9.7.2-CG4, 9.14.4-CG2, 9.14.4-CG4, експресійний вектор, який вже кодує константний 9.14.4-Ser, 9.7.2-Ser, 8.10.3-Ser, 8.10.3-CG4, домен (СH) важкого ланцюга або константний до8.10.3FG1 або 9.14.4G1, або важкий ланцюг, що мен (CL) легкого ланцюга, відповідно, так, щоб в має амінокислотну послідовність SEQ ID NO:2, 6, даному векторі VH-сегмент був функціонально 10, 14, 18, 22, 26, 30, 34, 38, 46, 50, 54, 58, 62, 66, приєднаний до СH-сегменту(ів), а VL-сeгмeнт був 70, 74, 78, 82, 86, 90, 94, 98 або 102 і константну функціонально приєднаний до CL-сегменту. В інділянку важкого ланцюга, або важкий ланцюг, що шому варіанті винаходу молекули нуклеїнової кисмістить мутацію. Крім того, вказана нуклеїнова лоти, що кодують VH і/або VL-домeни, перетворюкислота може містити нуклеотидну послідовність ють в повнорозмірні гени антитіла шляхом важкого ланцюга SEQ ID NO:1, 5, 9, 25, 29, 33, 37, з'єднання, наприклад, шляхом лігування молекули 45, 97 або 101 і нуклеотидну послідовність, що нуклеїнової кислоти, що кодує VH і/або VL-домeни, кодує константну ділянку легкого ланцюга, або з молекулою нуклеїнової кислоти, що кодує СH молекулу нуклеїнової кислоти, що кодує важкий і/або CL-домeн, згідно зі стандартними методами ланцюг, який містить мутацію. молекулярної біології. Нуклеотидні послідовності Молекула нуклеїнової кислоти, що кодує важгенів константного домену важкого і легкого ланкий ланцюг або повнорозмірний легкий ланцюг цюгів людського імуноглобуліну відомі фахівцям. анти-М-СSF-антитіл або його частини, може бути Дивіться, наприклад, Kabat et al., Sequences of виділена з будь-якого джерела, яке продукує таке Proteins of Immunological Interest, 5th Ed., NIH Publ. антитіло. У різних варіантах винаходу молекули No.91-3242, 1991. Молекули нуклеїнової кислоти, нуклеїнової кислоти виділяють з В-клітини, одерщо кодують повнорозмірні важкі ланцюги і/або жаної від тварини, імунізованого M-CSF, або з імолегкі ланцюги, можуть бути потім експресовані в рталізованих клітин, що походять від В-клітини, клітині в яку вони були введені з подальшим видіяка експресує aнти-M-CSF-aнтитіло. Методи виділенням анти-М-СSF-антитіла. лення мРНК, що кодує антитіло, добре відомі фаМолекули нуклеїнової кислоти можуть бути вихівцям. Дивіться, наприклад, Sambrook et al. Вкакористані для рекомбінантної експресії великих 45 90457 46 кількостей aнти-M-CSF-aнтитіл. Молекули нуклеїтор. Ці гени антитіла вбудовують в експресійний нової кислоти можуть бути також використані для вектор стандартними методами (наприклад, шляпродукування химерних антитіл, біспецифічних хом лігування комплементарних рестрикційних антитіл, одноланцюгових антитіл, імуноадгезинів, сайтів з фрагментом гена антитіла і з вектором, диантитіл, мутованих антитіл і похідних антитіл, або шляхом лігування із затупленням кінців, якщо детально описаних нижче. Якщо молекули нуклеїрестрикційні сайти відсутні). нової кислоти походять від нетрансгенної тварини, Відповідним вектором є вектор, що кодує фунщо не є людиною, то такі молекули нуклеїнової кціонально повну послідовність Сн або CL людськислоти можуть бути використані для гуманізації кого імуноглобуліну з відповідними рестрикційними антитіла, як описано нижче. сайтами, сконструйованими так, що будь-яка VHВ іншому варіанті винаходу молекула нуклеїабо VL-послідовність може бути легко вбудована і нової кислоти згідно з винаходом використовуєтьекспресована як описано вище. У таких векторах, ся як зонд або ПЛР-праймер для специфічної поссплайсинг звичайно відбувається між сайтом долідовності антитіла. Наприклад, нуклеїнова норного сплайсингу у вбудованій J-ділянці і сайтом кислота може бути використаний як зонд в діагноакцепторного сплайсингу, що знаходиться перед стичних методах, або як ПЛР-праймер для амплілюдським С-доменом, а також в ділянках сплайсифікації ділянок ДНК, які можуть бути використані нгу, які знаходяться в людських СН-екзонах. Посліinter alia для виділення додаткових молекул нукледовності поліаденілування і термінації транскрипїнової кислоти, які кодують варіабельні домени ції розташовані в нативних хромосомних сайтах, анти-М-СSF-aнтитіл. У деяких варіантах винаходу що знаходяться нижче кодуючих ділянок. Рекомбімолекулами нуклеїнової кислоти є олігонуклеотинантний експресійний вектор може також кодувати ди. У деяких варіантах винаходи такі олігонуклеосигнальний пептид, який полегшує секрецію лантиди походять від високоваріабельних ділянок цюга антитіла, яке походить від клітини-хазяїна. важкого і легкого ланцюгів антитіла, яке представГен ланцюга антитіла може бути клонований у ляє інтерес. У деяких варіантах винаходу вказані вектор так, щоб сигнальний пептид був приєднаолігонуклеотиди кодують всі CDR або частину одний, із збереженням рамки зчитування, до амінокінієї або декількох CDR антитіл 252, 88, 100, 3.8.3, нця імуноглобулінового ланцюга. Таким сигналь2.7.3, 1.120.1 або їх варіантів, описаних в даний ним пептидом може бути імуноглобуліновий заявці. сигнальний пептид або гетерологічний сигнальний Вектори пептид (тобто сигнальний пептид, що походить від Даний винахід відноситься до векторів, що білка, що не є імуноглобуліном). мстять молекули нуклеїнової кислоти, які кодують Крім генів ланцюга антитіла, рекомбінантні важкий ланцюг анти-М-СSF-антитіл згідно з винаекспресійні вектори згідно з винаходом несуть реходом або його антизв'язу вального фрагмента. гуляторні послідовності які регулюють експресію Даний винахід також відноситься до векторів, що генів ланцюга антитіла в клітині-хазяїні. Для фахімістять молекули нуклеїнової кислоти, які кодують вця в цій ділянці очевидно, що конструювання екслегкий ланцюг таких антитіл згідно з винаходом пресійного вектора, включаючи вибір регуляторабо його антизв'язувального фрагмента. Крім того, них послідовностей, може бути здійснене в даний винахід відноситься до векторів, що містять залежності від таких факторів, як вибір клітинимолекули нуклеїнової кислоти, які кодують гібридні хазяїна, що трансформується, рівня експресії потбілки, модифіковані антитіла, фрагменти антитіл і рібного білка і т.п. Переважними регуляторними їх зонди. послідовностями для експресії в клітині-хазяїні У деяких варіантах винаходу анти-М-СSFссавця є вірусні елементи, регулюючі високі рівні антитіла або їх антизв'язувальні частини згідно з експресії білка в клітинах ссавця, такі як промотовинаходом експресуються внаслідок вбудовування ри і/або енхансери, що походять від ретровірусних ДНК, що кодують неповні або повнорозмірні легкі і LTR, цитомегаловірусу (CMV) (такі як промоважкі ланцюги і одержаних як описано вище, в тор/енхансер CMV), мавпячого вірусу 40 (SV40) експресіні вектори так, щоб ці гени були функціо(такі як промотор/енхансер SV40), аденовірусу нально приєднані до потрібних послідовностей (наприклад, головний пізній промотор аденовірусу регуляції експресії, таких як послідовності регуля(AdMLP)), промотори поліоми і сильні промотори ції транскрипції і трансляції. Експресійними вектоссавців, такі як промотори нативного імуноглобулірами є плазміди, ретровіруси, аденовіруси, аденону і актину. Більш докладний опис вірусних регуасоційовані віруси (AAV), віруси рослини, такі як ляторних елементів і їх послідовностей можна вірус мозаїки цвітної капусти, вірус мозаїки тютюзнайти, наприклад, у патенті США №5168062, пану, косміди, YAC, епісоми, що походять від EBV і тенті США №4510245 і у патенті США №4968615. т.п. Ген антитіла лігують у вектор так, щоб в даноМетоди експресії антитіл в рослинах, включаючи му векторі послідовності регуляції транскрипції і опис промоторів і векторів, а також трансформація трансляції виконували властиву їм функцію регурослин, відомі фахівцям. Дивіться, наприклад, ляції транскрипції і трансляції гена антитіла. Експатент США №6517529, який включений в даний пресійний вектор і послідовності регуляції експреопис за допомогою посилання. Методи експресії сії вибирають так, щоб вони були сумісні з поліпептидів в бактеріальних клітинах або в клітиклітиною-хазяїном, що використовується для екснах грибів, наприклад, в дріжджових клітинах, тапресії Ген легкого ланцюга антитіла і ген важкого кож добре відомі фахівцям. ланцюга антитіла можуть бути вбудовані в окремі Крім генів ланцюга антитіла і регуляторних повектори. У переважному варіанті винаходу обидва слідовностей, рекомбінантні експресійні вектори гени вбудовують в один і той же експресійний векзгідно з винаходом можуть містити додаткові пос 47 90457 48 лідовності такі як послідовності які регулюють репсередовище, в якому були культивовані ці клітинилікацію вектора в клітинах-хазяїнах (наприклад, хазяїни. Антитіла можуть бути виділені з культураоріджин реплікації), і селективні маркерні гени. льного середовища стандартними методами очиСелективний маркерний ген полегшує відбір кліщення білків. Клітинами рослин-хазяїнів є, напритин-хазяїнів, в які був вбудований вектор (дивітьклад, клітини Nicotiana (тютюну), Arabidopsis ся, наприклад, патенти США №№4399216, (гусимця Таля), ряски, кукурудзи, пшениці картоплі 4634665 і 5179017). Наприклад, звичайно селектиі т.п. Бактеріальними клітинами-хазяїнами є Е. соlі вний маркерний ген повідомляє клітині-хазяїну, в і види Streptomyces. Дріжджовими клітинамияку був введений даний вектор, резистентність до хазяїнами є Schizosaccharomyces pombe, лікарських засобів, таких як G418, гігроміцин або Saccharomyces cerevisiae i Pichia pastoris. метотрексат. Переважними селективними маркерКрім того, експресія антитіл згідно з винаходом ними генами є ген дегідрофолат-редуктази (DHFR) (або інших молекул, які походять від них) в клітин(що використовується в dhfr-клітинах хазяїнах для них лініях-продуцентах може бути посилена різнивідбору на метотрексат або для ампліфікації), ген ми відомими методами. Наприклад, система ексрезистентності до неоміцину (для відбору на пресії гену глутамін-синтетази (система GS) G418) і ген глутамат-синтетази. найчастіше використовується для підвищення рівНегібридомні клітини-хазяїни і методи рекомня експресії в певних умовах. Повне або часткове бінантного продукування білка Молекули нуклеїобговорення системи GS можна знайти в європейнової кислоти, що кодують анти-М-СSF-aнтитілa і ських патентах №№0216846, 0256055 і 0323997 і в вектори, що мстять ці молекули нуклеїнової кислоєвропейській патентній заявці №89303964.4. ти, можуть бути використані для трансфекції відАнтитіла, експресовані різними клітинними ліповідних клітин-хазяїнів ссавців, рослин, бактерій ніями або експресовані в трансгенних тваринах, або дріжджів. Трансформація може бути здійснена можуть мати різний характер глікозилування. Одбудь-яким відповідним методом введення полінукнак всі антитіла, яке кодуються описаними тут молеотидів в клітину-хазяїна. Методи введення гетелекулами нуклеїнової кислоти або містять описані рологічних поліпептидів в клітини ссавців добре тут амінокислотні послідовності є частиною даного відомі фахівцям, і такими методами є опосередковинаходу, незалежно від статусу або характеру вана декстраном трансфекція; преципітація фосглікозилування або від модифікації антитіл. фатом кальцію; опосередкована полібреном транТрансгенні тварини або рослини сфекція, злиття протопластів; електропорація; Aнти-M-CSF-антитіла згідно з винаходом таінкапсуляція полінуклеотиду(ів) в ліпосоми; і пряма кож можуть бути трансгенно продуковані шляхом мікроінжекція ДНК в ядро. Крім того, молекули нустворення ссавця або рослини, що є трансгенним клеїнової кислоти можуть бути введені в клітини за послідовностями важкого і легкого ланцюгів ссавців за допомогою вірусних векторів. Методи імуноглобуліну, що представляє інтерес, і за протрансформації клітин добре відомі фахівцям. Дидукуванням антитіла у формі, яка може бути потім віться, наприклад, патенти США №№4399216, виділена з цього ссавця або рослини. Що стосу4912040, 4740461 і 4959455 (які включені в даний ється трансгенного продукування в ссавцях, то опис за допомогою посилання). Методи трансфоанти-M-CSF-антитіла можуть бути продуковані в рмації клітин рослин добре відомі фахівцям, і тамолоці кіз, корів або інших ссавців, і виділені з цьокими методами є, наприклад, трансформація, опого молока. Дивіться, наприклад, патенти США середкована Agrobacterium, біобалістична №№5827690, 5756687, 5750172 і 5741957. У детрансформація, пряма ін'єкція, електропорація і яких варіантах винаходу трансгенні тварини, що трансформація вірусом. Методи трансформації не є людиною і містять локуси людського імуногбактеріальних і дріжджових клітин також добре лобуліну, були імунізовані M-CSF або його імуновідомі фахівцям. генною частиною, як описано вище. Методи одерКлітинні лінії ссавців, відповідні для експресії, жання антитіл в рослинах, дріжджах або в добре відомі фахівцям і такі лінії включають многрибах/водоростях описані наприклад, в патентах жину іморталізованих клітинних ліній, що є в АмеСША №№6046037 і 5959177. риканській колекції типових культур (АТСС). Ці У деяких варіантах винаходу трансгенні твалінії включають, inter alia, клітини яєчника китайсьрини, що не є людиною, або трансгенні рослини кого хом'ячка (СНО), клітини NSO, клітини SP2, продукують шляхом введення вказаній тварині або клітини HeLa, клітини нирки дитини хом'ячка (ВНК), рослині однієї або декількох молекул нуклеїнової клітини нирки мавпи (COS), клітини людської гепакислоти, що кодують анти-M-CSF-антитіло згідно з тоцелюлярної карциноми (наприклад, Hep G2), винаходом, стандартними методами генної інжеклітини А549 і різні інші клітинні лінії. При цьому нерії. Дивіться вище, Hogan і патент США 6417429. особливо переважно вибирати клітинні лінії, які Трансгенними клітинами, що використовуються забезпечують високі рівні експресії Іншими клітиндля створення трансгенної тварини, можуть бути ними лініями, які можуть бути використані є клістовбурові ембріональні клітини або соматичні тинні лінії комах, такі як клітини Sf9. Після введенклітини. Трансгенними організмами, що не є люня в клітини-хазяїни ссавців рекомбінантних диною, можуть бути химерні і нехимерні гетерозиекспресійних векторів, що містять гени антитіла, ці готи і нехимерні гомозиготи. Дивіться, наприклад, антитіла продукують шляхом культивування вкаHogan et al., Manipulating the Mouse Embryo: A заних клітин-хазяїнів протягом періоду часу, досLaboratory Manual 2ed., Cold Spring Harbor Press татнього для здійснення експресії такого антитіла (1999); Jackson et al., Mouse Genetics and в клітинах-хазяїнах, або, більш переважно, шляTransgenics: A Practical Approach, Oxford University хом секреції вказаного антитіла в культуральне Press (2000); і Pinkert, Transgenic Animal 49 90457 50 Technology: A Laboratory Handbook, Academic Bio/Technology 9: 1370-1372 (1991); Hay et al., Press (1999). У деяких варіантах винаходу трансHum. Antibod. Hybridomas 3: 81-85 (1992); Huse et генні тварини, що не є людиною, мають спеціальal., Science 246: 1275-1281 (1989); McCafferty et al., но введену дизрупцію і заміну за допомогою консNature 348: 552-554 (1990); Griffiths et al., EMBO J. трукції яка націлена на відповідну мішень, і яка 12:725-734 (1993); Hawkins et al., J. Моl. Biol. кодує важкий і/або легкий ланцюг, який представ226:889-896 (1992); Clackson et al., Nature 352: ляє інтерес. У переважному варіанті винаходу 624-628 (1991); Gram et al., Proc.Natl. Acad. Sci., трансгенні тварини містять і експресують молекуUSA, 89: 3576-3580 (1992); Garrad et al., ли нуклеїнової кислоти, що кодують важкі і легкі Bio/Technology 9: 1373-1377 (1991); Hoogenboom et ланцюги, які специфічно зв'язуються з M-CSF, пеal., Nuc. Acid Res. 19: 4133-4137 (1991) і Barbas et реважно, з людським M-CSF. У деяких варіантах al., Proc.Natl. Acad. Sci., USA, 88: 7978-7982 (1991). винаходу трансгенні тварини містять молекули В одному з варіантів винаходу для виділення нуклеїнової кислоти, що кодують модифіковане людських анти-М-СSF-антитіл з потрібними власантитіло, таке як одноланцюгове антитіло, химертивостями спочатку використовують описане тут не антитіло або гуманізоване антитіло. Анти-Млюдське анти-М-CSF-антитіло для відбору посліСSF-aнтитілa можуть бути продуковані у будь-якої довностей людських важких і легких ланцюгів, що трансгенної тварини. У переважному варіанті виволодіють аналогічною активністю зв'язування з находу вказаними тваринами, що не відносяться M-CSF, де такий відбір здійснюють методами епідо людини, є миші щури, вівці свині кози, велика топного імпринтингу, описаними в публікації заяврогата худоба або коні У трансгенних тварин, що ки РСТ №WO 93/06213. Бібліотеками антитіл, що не є людиною, вказані кодовані поліпептиди ексвикористовуються в цих методах, є, переважно, пресуються в крові молоці сечі слині сльозах, слибібліотеки scFv, одержані і скриновані як описано в зу та в інших фізіологічних рідинах. публікації РСТ №WO 92/01047, McCafferty et al., Бібліотеки фагового представлення Nature 348: 552-554 (1990); і Griffiths et al., EMBO J. Даний винахід відноситься до способу проду12: 725-734 (1993). Бібліотеки scFv антитіл, перекування анти-М-СSF-антитіла або його антизв'язу важно, скринують з використанням людського Mвальної частини, що включає стадії синтезу бібліоCSF як антигену. теки людських антитіл на фагу; скринінгу бібліотеПісля попереднього відбору людських VL- і VHки за допомогою M-CSF або його частини; видідомeнів проводять експерименти зі "змішування і лення фаза, який зв'язується з M-CSF; і сумісності", в яких різні пари заздалегідь відібраодержання антитіла з цього фагу. Як приклад моних VL- і VH-сeгмeнтів скринують на зв'язування з же служити один метод одержання бібліотеки анM-CSF для відбору переважних комбінацій пар титіл, яка може бути використана в способах фаVL/VH. Крім того, для поліпшення якості антитіла, гового представлення, де вказаний метод включає VL- і VH-сегменти переважних пар VL/VH можуть стадії імунізації тварини, що не є людиною і місбути неспецифічно мутовані переважно, в ділянки тить локуси людського імуноглобуліну, фактором CDR3 VH і/або VL способом, аналогічним соматичM-CSF або його антигенною частиною для виробному процесу мутації in vivo, відповідальному за лення імунної відповіді; екстрагування антитілопдозрівання афінності антитіл під час вироблення родукуючих клітин з вказаної імунізованої тварини; природної імунної відповіді Таке in vitro дозрівання виділення РНК з екстрагованих клітин; оберненої афінності антитіл може бути здійснене шляхом транскрипції РНК з одержанням кДНК; ампліфікації ампліфікації VH- і VL-доменів з використанням кДНК з використанням праймера; і вбудовування ПЛР-праймерів, комплементарних VH CDR3 або VL кДНК у вектор фагового представлення так, щоб в CDR3, відповідно, де вказані праймери були "процьому фагу експресувались дані антитіла. Таким низані" довільною сумішшю чотирьох нуклеотидчином можуть бути одержані рекомбінантні антиних основ в певних положеннях так, щоб одержані М-СSF-антитіла згідно з винаходом. ПЛР-продукти кодували VH- і VL-сегменти з введеРекомбінантні анти-М-СSF-антитіла згідно з ними в них, а саме в їх VH і/або VL CDR3-ділянки, винаходом можуть бути виділені шляхом скринінгу випадкові мутації. Ці довільно мутовані VH- і VLрекомбінантної комбінаторної бібліотеки антитіл. сeгмeнти можуть бути знов скриновані на зв'язуПереважною бібліотекою є бібліотека фагового вання з M-CSF. представлення scFv, генерована з використанням Після скринінгу і виділення анти-М-СSFкДНК людських VL і VH, одержані з мРНК, виділеної aнтитілa згідно з винаходом з бібліотеки предстаз В-клітин. Методика одержання і скринінгу таких влення рекомбінантних імуноглобулінів, нуклеїнові бібліотек відома фахівцям. Існують комерційно кислоти, що кодують відібране антитіло, можуть доступні набори для генерування бібліотек фагобути виділені з пакувального вектора представвого представлення (наприклад, система для фалення (наприклад, з фагового геному) і субклоногового представлення рекомбінантних антитіл вані в інші експресійні вектори методами рекомбіPharmacia Recombinant Phage Antibody System, нантних ДНК. Якщо це необхідне, то нуклеїнова catalog no.27-9400-01; і набір для фагового предкислота може бути додатково модифікована для ставлення Stratagene SurfZAP™, catalog створення інших форм згідно з винаходом, як опиno.240612). Для генерування і скринінгу бібліотек сано нижче. Для експресії рекомбінантного людсьпредставлення антитіл існують також й інші метокого антитіла, виділеного шляхом скринінгу комбіди і реагенти (Дивіться, наприклад, патент США наторної бібліотеки, ДНК, що кодує антитіло, №5223409; публікації РСТ №№WO 92/18619, WO клонують в рекомбінантний експресійний вектор і 91/17271, WO 92/20791, WO 92/15679, WO вводять в клітини-хазяїни ссавців, як описано ви93/01288, WO 92/01047, WO 92/09690; Fuchs et al., ще. 51 90457 52 Переключення класів М-СSF-антитіл. Ці антитіла можуть бути мутовані у В іншому своєму аспекті, даний винахід відноваріабельних доменах важкого і/або легкого ланситься до способу конверсії класу або підкласу цюгів, наприклад, для зміни зв'язувальних властианти-М-СSF-антитіла в інший клас або підклас. У востей антитіла. Наприклад, така мутація може деяких варіантах винаходу VL- або VН-кодуючу бути зроблена в одній або декількох CDR-ділянках молекулу нуклеїнової кислоти, яка не включає якідля збільшення або зниження KD антитіла проти небудь нуклеотидні послідовності що кодують CL M-CSF, для збільшення або зниження koff або для або СН, виділяють добре відомими методами. Позміни специфічності зв'язування вказаного антитітім цю молекулу нуклеїнової кислоти функціонала. Методи сайт-спрямованого мутагенезу добре льно приєднують до послідовності нуклеїнової відомі фахівцям. Дивіться вище, наприклад, кислоти, що кодує CL або СН від імуноглобуліну Sambrook et al., і Ausubel et al. У переважному вапотрібного класу або підкласу. Це може бути досяріанті винаходу, амінокислотний залишок, у порівгнуте з використанням вектора або молекули нукнянні із залишком в зародковій лінії, як відомо, має леїнової кислоти, що містить CL- або СН-ланцюг, мутацію у варіабельної ділянки анти-М-СSFописані вище. Наприклад, вихідне анти-М-СSFантитіла. В іншому варіанті винаходу амінокислотантитіло, яке спочатку має клас IgM, може бути ні залишки, у порівнянні із залишком в зародковій переключене на клас IgG. Крім того, переключення лінії, мають одну або декілька мутацій в ділянці класів може застосовуватись для перетворення CDR або в каркасній ділянці варіабельного домеIgG одного підкласу в IgG іншого підкласу, наприну, або в константній ділянці моноклонального клад, IgG1 в IgG2. Інший спосіб продукування анантитіла 252, 88, 100, 3.8.3, 2.7.3, 1.120.1, 9.14.41, титіла згідно з винаходом, що має потрібний ізо8.10.3F, 9.7.2IF, 9.14.4, 8.10.3, 9.7.2, 9.7.2C-Ser, тип, включає стадії виділення нуклеїнової кислоти, 9.14.4C-Ser, 8.10.3C-Ser, 8.10.3-CG2, 9.7.2-CG2, що кодує важкий ланцюг анти-М-СSF-антитіла, і 9.7.2-CG4, 9.14.4-CG2, 9.14.4-CG4, 9.14.4-Ser, нуклеїнової кислоти, що кодує легкий ланцюг анти9.7.2-Ser, 8.10.3-Ser, 8.10.3-CG4, 8.10.3FG1 або М-СSF-антитіла; виділення послідовності що кодує 9.14.4G1. В іншому варіанті винаходу амінокислоVH-ділянку; лігування послідовності VH з послідовтний залишок, у порівнянні із залишком в зародконістю, що кодує константний домен важкого ланвій лінії, має одну або декілька мутацій в ділянці цюга потрібного ізотипу; експресії гену легкого CDR або в каркасній ділянці варіабельного домену ланцюга і конструкції важкого ланцюга в клітині; і важкого ланцюга, що має амінокислотну послідовзбирання анти-М-СSF-aнтитіла, яке має потрібний ність, вибрану з SEQ ID NO:2, 6, 10, 14, 18, 22, 26, ізотип. 30, 34, 38, 46, 50, 54, 58, 62, 66, 70, 74, 78, 82, 86, У деяких варіантах винаходу в анти-М-СSF90, 94, 98 або 102, або має нуклеотидну послідовантитілах згідно з винаходом, серии в положенні ність, представлену в SEQ ID NO:1, 5, 9, 25, 29, 33, 228 (відповідно до Європейської угоди про нуме37, 45, 97 або 101. В іншому варіанті винаходу рацію) важкого ланцюга замінений проліном. Відамінокислотний залишок, у порівнянні із залишком повідно до цього, підпослідовність CPSC в Fcв зародковій лінії, має одну або декілька мутацій в ділянці IgG4 перетворюється в СРРС, яка являє ділянці CDR або в каркасній ділянці варіабельного собою підпослідовність, присутню в IgG1. домену легкого ланцюга, що має амінокислотну (Aalberse R.C. & Schuurman, J. Immunology, 105: 9послідовність, вибрану з SEQ ID NO:4, 8, 12, 16, 19 (2002)). Наприклад, серин в положенні 243 SEQ 20, 24, 28, 32, 36, 44, 48, 52, 56 або 60, або має ID NO:46 (яке відповідає залишку 228 відповідно нуклеотидну послідовність, представлену в SEQ до Європейської угоди про нумерацію) повинен ID NO:3, 7, 11, 27, 31, 35, 43 або 47. стати проліном. Аналогічним чином, серин в полоВ одному з варіантів винаходу каркасну ділянженні 242 SEQ ID NO:38 (яке відповідає залишку ку піддають мутації так, щоб одержана в результа228 відповідно до Європейської угоди про нумераті каркасна ділянка мала амінокислотну послідовцію) повинен стати проліном. У деяких варіантах ність, відповідну амінокислотній послідовності винаходу каркасна ділянка антитіла IgG4 може зародкової лінії. Ця мутація може бути введена в бути піддана оберненій мутації з одержанням каркаркасну ділянку або в константний домен для касної послідовності зародкової лінії. Деякі варіанзбільшення часу півжиття анти-М-СSF-aнтитілa. ти винаходу включають обернену мутацію каркасДивіться, наприклад, публікацію заявки РСТ №WO ної ділянки і заміну серину проліном в Fc-діпянці. 00/09560, яка включена в даний опис за допомоДивіться, наприклад, SEQ ID NO:54 (антитіло гою посилання. Мутація в каркасній ділянці або в 9.14.4 C-Ser) і SEQ ID NO:58 (антитіло 8.10.3 Cконстантному домені може бути зроблена з метою Ser) в таблиці 1. зміни імуногенності антитіла, з метою введення "Деімунізовані" антитіла сайту для ковалентного або нековалентного зв'яІншим способом продукування антитіл зі знизування з іншою молекулою, або з метою зміни женою імуногенністю є "деімунізація" антитіл. В таких властивостей, як фіксація комплементу, іншому аспекті даного винаходу антитіла можуть зв'язування з FcR і антитілозалежною клітиноопобути "деімунізовані" способами, описаними в пубсередкованою цитотоксичністю (ADCC). Відповідлікації заявок РСТ WO98/52976 і WO00/34317 (які но до даного винаходу одне антитіло може мати у всій своїй повноті включені в даний опис за домутації в одній або декількох ділянках CDR або в помогою посилання). каркасних ділянках варіабельного домену або конМутовані антитіла стантного домену. В іншому варіанті винаходу молекули нуклеїУ деяких варіантах винаходу мутоване антинової кислоти, вектори і клітини-хазяїни можуть М-СSF-антитіло, у порівнянні з aнти-M-CSFбути використані для одержання мутованих антиaнтитілом зародкової лінії до його мутації, має 1-8, 53 90457 54 включаючи будь-яке число в даному інтервалі аміСSF-антитіло. Наприклад, "каппа-антитіпа" (I11 et нокислотних мутацій або в домені VH, або в домені al. Protein Eng. 10: 949-57 (1997)), "мініантитіла" VL. У будь-якому з вищезгаданих варіантів, ці му(Martin et al, EMBO J. 13: 5303-9 (1994)), "диантитітації можуть бути присутніми в одній або в декільла" (Holliger et al, Proc. Natl. Acad. Sci, USA, 90: кох ділянках CDR. Крім того, будь-які такі мутації 6444-6448 (1993)) або "янусити" (Janusins) можуть бути консервативними амінокислотними (Traunecker et al, EMBO J. 10: 3655-3659 (1991) & замінами. У деяких варіантах винаходу в констанTraunecker et al. Int. J. Cancer (Suppl.)7: 51-52 тних доменах присутні не більше ніж 5, 4, 3, 2 або (1992)) можуть бути одержані стандартними мето1 амінокислотних замін. дами молекулярної біології; описаними в даний Модифіковані антитіла заявці. В іншому варіанті винаходу гібридне антитіло Біспецифічні антитіла або антизв'язувальні або імуноадгезин можуть бути сконструйовані так, фрагменти можуть бути одержані різними методащоб вони містили повнорозмірне aнти-M-CSFми, включаючи метод злиття з одержанням гібриaнтитіло згідно з винаходом, приєднане до іншого дом або приєднання Fab'-фрагментів. Дивіться, поліпептиду, або його частину. У переважному наприклад, Songsivilai & Lachmann, Clin. Exp. варіанті винаходу до вказаного поліпептиду приєImmunol. 79: 315-321 (1990), Kostelny et al, J. днані тільки варіабельні домени aнти-M-CSFImmunol. 148: 1547-1553 (1992). Крім того, біспеaнтитілa. В іншому переважному варіанті винаходу цифічні антитіла можуть бути одержані у вигляді VН-домeн анти-М-CSF-антитіла приєднаний до "диантитіл" або "янусинів" (Janusins). У деяких першого поліпептиду, а VL-домeн анти-M-CSFваріантах винаходу вказане біспецифічне антитіло антитіла приєднаний до другого поліпептиду, який зв'язується з двома різними епітопами M-CSF. У пов'язаний з першим поліпептидом так, що VH- і деяких варіантах винаходу біспецифічне антитіло VL-домeни можуть взаємодіяти один з одним з має перший важкий ланцюг і перший легкий ланутворенням зв'язувального сайту антитіла. В інцюг моноклонального антитіла 252, 88, 100, 3.8.3, шому переважному варіанті винаходу VH-домeн 2.7.3, 1.120.1, 9.14.41, 8.10.3F, 9.7.2IF, 9.14.4, відділений від VL-домeну лінкером, в результаті 8.10.3 або 9.7.2 і додаткові важкий ланцюг і легкий чого VH- і VL-домeни можуть взаємодіяти один з ланцюг антитіла. У деяких варіантах винаходи одним (дивіться нижче розділ "Одноланцюгові андодаткові важкий ланцюг і легкий ланцюг походять титіла"). Потім антитіло "VH-лінкер-VL" приєднують також від одного з ідентифікованих вище моноклодо поліпептиду, який представляє інтерес. Таке нальних антитіл, але відрізняються від першого гібридне антитіло може бути використане для важкого ланцюга і першого легкого ланцюга. прямої доставки поліпептиду в клітину або в ткаУ деяких варіантах винаходу описані вище нину, яка експресує M-CSF. Вказаним поліпептимодифіковані антитіла одержують з використандом може бути терапевтичний засіб, такий як токням одного або декількох варіабельних доменів син, фактор росту або інший регуляторний білок, або ділянок CDR, що походять від описаного тут або вказаним поліпептидом може бути діагностичлюдського моноклонального анти-М-СSF-антитіла, ний засіб, такий як фермент, який може бути легко від амінокислотної послідовності вказаного моноквізуалізований, наприклад, пероксидаза хрону. лонального антитіла, або від важкого ланцюга або Крім того, можуть бути сконструйовані гібридні легкого ланцюга, що кодується послідовністю нукантитіла, в яких два (або більше) одноланцюгових леїнової кислоти, що кодує вказане моноклональантитіла приєднані одне до одного. Це може бути не антитіло. здійснене, якщо необхідно створити двовалентне Дериватизоване і мічене антитіла або полівалентне антитіло на одному поліпептидAНТИ-M-CSF-антитіло або його антизв'язу ваному ланцюгу, або якщо необхідно створити бісльна частина згідно з винаходом можуть бути депецифічне антитіло. риватизовані або приєднані до іншої молекули Для створення одноланцюгового антитіла (наприклад, до іншого пептиду або білка). У зага(scFv), VН- і VL-кодуючі фрагменти ДНК функціональних рисах, антитіла або їх частини дериватизульно приєднують до іншого фрагмента, що кодує ють так, щоб така дериватизація або мічення не гнучкий лінкер, наприклад, що кодує амінокислотвпливали негативним чином на зв'язування з Mну послідовність (Gly4-Ser)3, так, що послідовності CSF. Відповідно до цього, антитіла або їх частини VH і VL можуть експресуватись як безперервний згідно з винаходом конструюють так, щоб вони одноланцюговий білок, що має VL- і VН-домени, включали як інтактні так і модифіковані форми з'єднані гнучким лінкером. Дивіться, наприклад, описаних тут людських анти-М-СSF-антитіл. НаBird et al., Science 242: 423-426 (1988); Huston et приклад, антитіло або його частина згідно з винаal., Proc. Natl. Acad. Sci., USA, 85: 5879-5883 ходом можуть бути функціонально приєднані (1988); McCafferty et al. Nature 348: 552-554 (1990). (шляхом хімічного зв'язування, генетичного зчепОдноланцюгове антитіло може бути одновалентлення, нековалентного зв'язування або як-небудь ним, якщо використовується тільки один VH або VL, інакше) до однієї або декількох інших молекулам, двовалентним, якщо використовується обидва Vh і таких як інше антитіло (наприклад, біспецифічне Vl, або полівалентним, якщо використовуються антитіло або диантитіло), детектуючий агент, цибільше двох VH і VL. Можуть бути генеровані біспетотоксичний агент, фармацевтичний засіб і/або цифічні або полівалентні антитіла, які специфічно білок або пептид, який може опосередкувати зв'язв'язуються з M-CSF або з іншою молекулою. зування антитіла або його частини з іншою молеВ іншому варіанті винаходу інші модифіковані кулою (такий як стрептавідинова корова ділянка антитіла можуть бути одержані з використанням або полігістидинова мітка). молекул нуклеїнової кислоти, що кодують анти-М 55 90457 56 Дериватизоване антитіло одного типу продужиття в сироватці або для збільшення рівня зв'якують шляхом перехресного зшиття двох або декізування в тканині. лькох антитіл (того ж самого типу або різних типів, Фармацевтичні композиції і набори наприклад, для одержання біспецифічних антитіл). Даний винахід також відноситься до композиВідповідними перехреснозшиваючими агентами є цій, що містять людське анти-М-CSF-антитілоагенти, які являють собою гетеробіфункціональні антагоніст і застосовуються для лікування індивіагенти, що мають дві різних реакційноздатних грудів, страждаючих ревматоїдним артритом, остеопи, розділених відповідним спейсером (наприклад, порозом або атеросклерозом. У деяких варіантах м-малеімідобензоіл-N-гідроксисукцинімідоефіром), винаходу вказаним індивідом, що піддається лікуабо гомобіфункціональні агенти (наприклад, дисуванню, є людина. В інших варіантах винаходу такцинімідилсуберат). Такі лінкери постачаються ким індивідом є тварина. Гіперпроліферативні рофірмою Pierce Chemical Company, Rockford, III. злади, в розвитку яких певну роль грають Дериватизованим антитілом іншого типу є мімоноцити, і які можуть бути піддані лікуванню чене антитіло. Відповідними детектуючими агенaнти-M-CSF-aнтитілом-aнтагоністом згідно з винатами, за допомогою яких може бути дериватизоходом, можуть включати рак, меланоми, лімфоми, ване антитіло або його антизв'язувальна частина лейкоз або множинні мієломи будь-яких тканин згідно з винаходом, є флуоресцентні сполуки, або органів, якими є, але не обмежуються ними, включаючи флуоресцеїн, флуоресцеїнізотіоціанат, головний мозок, легені лускаті клітини, сечовий родамін, 5-диметиламін-1міхур, шлунок, підшлункова залоза, молочна залонафталінсульфонілхлорид, фікоеритрин, лантанідза, голова, шия, печінка, нирки, яєчник, передміхуфосфор і т.п. Антитіло може бути також помічено рова залоза, пряма і товста кишка, стравохід, жіферментами, які використовують для детекціі£ ночі статеві органи, носоглотка або щитовидна наприклад, такі як пероксидаза хрону, βзалоза. Зокрема, людські анти-M-CSF-антитілагалактозидаза, люцифераза, лужна фосфатаза, антагонсти згідно з винаходом можуть бути викоглюкозооксидаза і т.п. Якщо антитіло мітять детекристані для лікування або попередження карцином тованим ферментом, то його детектують шляхом молочної залози, передміхурової залози, прямої додавання додаткових реагентів, у присутності кишки і легень. яких даний фермент продукує реакційний продукт, Даний винахід також відноситься до композиякий може бути ідентифікований. Наприклад, у цій для лікування стану, вибраного з групи, яка присутності ферменту пероксидази хрону, додаскладається з артриту, псоріатичного артриту, вання пероксиду водню і діамінобензидину привосиндрому Рейтера, подагри, травматичного артридить до фарбування реакційного детектованого ту, коревого артриту, гострого синовіту, ревматоїпродукту. Антитіло може бути також помічене біодного артриту, ревматоїдного спондиліту, анкілотином і детектоване шляхом посереднього вимізуючого спондиліту, остеоартриту, подагричного рювання рівня зв'язування з авідином або стрепартриту та інших артритних станів, сепсису, септитавідином. Антитіло може бути також помічене чного шоку, ендотоксичного шоку, сепсису, виклизаздалегідь визначеним поліпептидним епітопом, каного грамнегативними бактеріями, синдрому розпізнаваним вторинним репортером (наприклад, токсичного шоку, хвороби Альцгеймера, інсульту, двохкомпонентними послідовностями лейцинової нейротравми, астми, гострого респіраторного дисблискавки, сайтами зв'язування для "других" антитрес-синдрому, церебральної малярії, хронічного тіл, металозв'язувальними доменами, епітопними запального захворювання легень, силікозу, саркомітками). У деяких варіантах винаходу мітки приєїдозу легень, резорбції кістки, остеопорозу, рестеднують за допомогою спейсерних груп різної довнозу, реперфузійного ураження серця і нирок, жини для зменшення можливого стеричного тромбозу, гломерулонефриту, діабету, реакції ускладнення. "трансплантат проти хазяїна", відторгнення алоAнти-M-CSF-aнтитіло може бути також помічетрансплантату, запального захворювання кишечне радіоактивно міченою амінокислотою. Радіоакнику, хвороби Крона, виразкового коліту, розсіянотивно мічене анти-М-СSF-антитіло може бути виго склерозу, дегенерації м'язів, екземи, користане як в діагностичних, так і в контактного дерматиту, псоріазу сонячних опіків терапевтичних цілях. Наприклад, радіоактивно або гострого кон'юнктивіту у ссавців, включаючи мічене aнти-M-CSF-aнтитілo може бути використалюдину, де вказані композиції включають певну не для детекції M-CSF-експресуючих пухлин за кількість людського моноклонального анти-М-СSFдопомогою рентгенівської або іншої діагностичної aнтитілa згідно з винаходом, ефективну для такого апаратури. Крім того, радіоактивно мічене анти-Млікування, і фармацевтично прийнятний носій. СSF-антитіло може бути використане в терапевтиЛікування може передбачати введення одного чних цілях як токсин для ракових клітин або пухабо декількох моноклональних анти-М-СSFлин. Прикладами міток, що використовуються для антитіл-антагоністів згідно з винаходом або їх анполіпептидів, є, але не обмежуються ними, радіоітизв'язувальних фрагментів, окремо або разом з зотоп або радіонукліди 3Н, 14С, 15N, 35S, 90Y, 99Тс, фармацевтично прийнятним носієм. Термін "фар111 125 131 Іn, І i І. мацевтично прийнятний носій", що використовуAнти-M-CSF-aнтитіло може бути також дериється тут, означає будь-який і всі розчинники, дисватизоване хімічною групою, такою як поліетиленперсійні середовища, агенти для покриттів, гліколь (ПЕГ), метильна або етильна група або антибактеріальні і протигрибкові агенти, ізотонічні вуглеводна група. Ці групи можуть бути викорисагенти, агенти, що уповільнюють абсорбцію і т. п., тані для поліпшення біологічних властивостей анякі є фізіологічно сумісними. Деякими прикладами титіла, наприклад, для збільшення його часу півфармацевтично прийнятних носіїв є вода, фізіоло 57 90457 58 гічний розчин, забуферений фосфатом фізіологічзом з одним з перерахованих вище інгредієнтів ний розчин, декстроза, гліцерин, етанол і т. п., а або з їх комбінацією, якщо це необхідне, і з податакож їх комбінації. У багатьох випадках, в компольшою стерилізацією шляхом фільтрації. У загазицію переважно включати ізотонічні агенти, нальних рисах, дисперсії одержують шляхом вклюприклад, цукор, поліспирти, такі як маніт і сорбіт, чення активної сполуки у стерильний носій, що або хлорид натрію. Іншими прикладами фізіологічмістить основне дисперсійне середовище й інші но прийнятних речовин є змочувальні агенти або необхідні інгредієнти з числа вищеперелічених невеликі кількості домішок, таких як змочувальні інгредієнтів. У випадку стерильних порошків, що або емульгуючі агенти, консерванти або буфери, використовуються для приготування стерильних які підвищують термін зберігання або ефективність розчинів для ін'єкцій, переважними методами таданого антитіла. кого приготування є вакуумне сушіння і ліофілізаAнти-M-CSF-aнтитіло згідно з винаходом і ція з одержанням порошку, що містить активний композиції, які містять їх, можуть бути введені в інгредієнт і будь-який інший потрібний інгредієнт, із комбінації з одним або декількома іншими терапезаздалегідь стерилізованого-відфільтрованого втичними, діагностичними або профілактичними розчину. Потрібну текучість розчину можна підтзасобами. Додатковими терапевтичними засобами римувати, наприклад, шляхом використання агенє інші антинеопластичні, протипухлинні антиангіота для нанесення покриттів, такого як лецитин; генні або хіміотерапевтичні засоби. Такі додаткові шляхом одержання частинок потрібного розміру у засоби можуть бути включені в одну і ту ж комповипадку дисперсії, і шляхом використання поверхзицію, або вони можуть бути введені окремо. У нево-активних речовин. Пролонгована абсорбція деяких варіантах винаходу одне або декілька інгіін'єктованих композицій може бути досягнута шлябуючих анти-М-СSF-антитіл згідно з винаходом хом включення в дану композицію агента, що упоможуть бути використані як вакцина або як ад'ювільнює абсорбцію, наприклад, моностеаратних ванти для вакцин. солей і желатину. Композиції згідно з винаходом можуть бути Антитіла згідно з винаходом можуть бути ввеприготовані в різних формах, наприклад, в рідкій, дені різними відомими способами, хоча для баганапівтвердій або в твердій лікарських формах, тьох терапевтичних застосувань, переважним таких як рідкі розчини (наприклад, розчини для шляхом/спосіб введення є підшкірна, внутрішньоін'єкцій та інфузій), дисперсії або суспензія, таблем'язова або внутрішньовенна інфузія. Як очевидно тки, драже, порошки, ліпосоми і супозиторії. Передля фахівців в даній галузі такий шлях і/або спосіб важна форма залежить від способу введення і від введення варіюється в залежності від бажаних терапевтичного застосування. Типові переважні результатів. композиції приготовляють у формі розчинів для У деяких варіантах винаходу активна сполука, ін'єкцій або інфузій, таких як композиції аналогічні що входить до складу композицій антитіла, може композиціям, що використовуються для пасивної бути приготована в комбінації з носієм, який буде імунізації людини. Переважним способом введензахищати антитіло від швидкого вивільнення, і ня є парентеральне (наприклад, внутрішньовенне, такими композиціями є препарати з регульованим підшкірне, внутрішньочеревинне, внутрішньом'явивільненням, включаючи імплантати, черезшкірні зове) введення. У переважному варіанті винаходу пластири і мікроінкапсульовані системи для доставказане антитіло вводять шляхом внутрішньовенвки. При цьому можуть бути використані біологічної інфузії або ін'єкції. У іншому переважному ванорозкладані біосумісні полімери, такі як етиленвіріанті винаходу вказане антитіло вводять шляхом нілацетат, поліангідриди, полігліколева кислота, внутрішньом'язової або підшкірної ін'єкції. В іншоколаген, поліортоефіри і полімолочна кислота. му своєму варіанті даний винахід відноситься до Багато які методи одержання таких композицій способу лікування індивіда, потребуючого такого запатентовані або, по суті відомі фахівцям. Дилікування, із застосуванням антитіла або його анвіться, наприклад, Sustained and Controlled тизв'язувальної частини, яка специфічно зв'язуRelease Drug Delivery Systems (J.R. Robinson, ed., ється з M-CSF, де вказаний спосіб включає стадії: Marcel Dekker, Inc., New York, 1978). (а) введення ефективної кількості виділеної молеУ деяких варіантах винаходу анти-М-СSFкули нуклеїнової кислоти, що кодує важкий ланцюг антитіло згідно з винаходом може бути введене або його антизв'язувальну частину; виділеної моперорально, наприклад, разом з інертним розрілекули нуклеїнової кислоти, що кодує легкий ланджувачем або з харчовим наповнювачем, що добцюг або його антизв'язувальну частину, або молере засвоюється. Сполука (й інші інгредієнти, якщо кул нуклеїнової кислоти, що кодують легкий це необхідне) може бути також взята в тверду або ланцюг і важкий ланцюг або їх антизв'язувальні м'яку желатинову капсулу, спресована в таблетки частини, і (Ь) експресії вказаної молекули нуклеїабо введена безпосередньо в їжу індивіда. Для нової кислоти. перорального терапевтичного застосування антиТерапевтичні композиції повинні бути стериМ-СSF-антитіла можуть бути введені разом з нальними і стабільними в умовах їх одержання і збеповнювачами і можуть бути використані у формі рігання. Така композиція може бути приготована у таблеток для проковтування, таблеток для розчивигляді розчину, мікроемульсії, дисперсії, ліпосоми нення в щічній кишені пастилок, капсул, еліксирів, або іншої впорядкованої структури, придатної для суспензій, сиропів, облаток і т. п. Для введення приготування лікарського засобу високої концентсполуки згідно з винаходом непарентеральним рації. Стерильні розчини для ін'єкцій можуть бути способом, може виявитись необхідним покриття одержані шляхом включення aнти-M-CSF-антитілa даної сполуки матеріалом, що попереджає її інаку необхідній кількості у відповідний розчинник ра 59 90457 60 тивацію, або введення даної сполуки разом з вка(наприклад, терапевтичної або профілактичної заним матеріалом. відповіді). Наприклад, може бути введена одна У композиції можуть бути також включені й інударна доза, або може бути введено декілька ші активні сполуки. У деяких варіантах винаходу дробових доз протягом певного періоду часу, або анти-М-СSF-антитіло згідно з винаходом приготодозу можна пропорційно знижувати або збільшувляють разом з одним або декількома додатковивати в залежності від складності даної терапевтими терапевтичними засобами і/або вводять разом чної ситуації. Для полегшення введення дози і з цими засобами. Такими засобами є антитіла, які рівномірності такого введення, особливо переважзв'язуються з іншими мішенями, антинеопластичні ними є парентеральні композиції одержані у визасоби, протипухлинні засоби, хіміотерапевтичні гляді уніфікованої лікарської форми. Термін "уніфізасоби, пептидні аналоги, які інгібують M-CSF, кована лікарська форма", що використовується розчинні c-fms, які можуть зв'язуватись з M-CSF, тут, означає фізично дискретні одиниці приготоваодин або декілька хімічних агентів, інгібуючих Mні у вигляді доз на один прийом для лікування ссаCSF, протизапальні засоби, антикоагулянти, агенвців; при цьому, кожна з цих уніфікованих доз місти, що знижують кров'яний тиск (тобто інгібітори тить заздалегідь розраховану кількість активної ангіотензин-конвертуючого ферменту (АКФ)). Така сполуки, ефективну для продукування потрібного комбінована терапія дозволяє вводити менші дози терапевтичного ефекту, в поєднанні з потрібним aнти-M-CSF-aнтитіло, а також агентів, які вводятьфармацевтичним носієм. Технічні вимоги для одеся спільно, що дає можливість уникнути небажаної ржання уніфікованих лікарських форм згідно з витоксичної дії або ускладнень, асоційованої з різнаходом визначаються або безпосередньо заленими монотерапіями. жать від них, (а) унікальними властивостями aнтиІнгібуючі анти-М-СSF-aнтитілa згідно з винахоM-CSF-aнтитіло або його частини і терапевтичного дом і композиції які їх містять, можуть бути також або профілактичного ефекту, що конкретно досявведені в комбінації з іншими терапевтичними гається і (b) обмеженнями, з якими стикаються схемами лікування, а зокрема, в комбінації з профахівці при приготуванні такого антитіла для усуменевою терапією раку. Сполуки згідно з винахонення підвищеної чутливості у індивідів. дом можуть бути також використані в комбінації з Як приклад необмежувальні інтервали терапепротираковими засобами, такими як ендостатин і втично або профілактично ефективних кількостей ангіостатин, або цитотоксичними лікарськими заантитіла або частин антитіла згідно з винаходом собами, такими як адріаміцин, дауноміцин, цисскладають від 0,025 до 50мг/кг, переважно, від 0,1 платин, етопозид, таксол, таксотер і алкалоїди, до 50мг/кг, а більш переважно, 0,1-25, 0,1-10 або такі як вінкристин, інгібітори фарнезилтрансфера0,1-3мг/кг. Потрібно зазначити, що ці величини доз зи, інгібітори VEGF і антиметаболіти, такі як метоможуть варіюватись в залежності від типу і тяжкотрексат. сті стану, що піддається лікуванню. Крім того, потСполуки згідно з винаходом можуть бути також рібно зазначити, що для будь-якого індивіда конквикористані в комбінації з противірусними засобаретні схеми введення доз повинні бути скориговані ми, такими як вірасепт, АЗТ, ацикловір і фамцикв залежності від часу, і відповідно до індивідуальловір, і з антисептиками, такими як валант. них потреб і призначення лікаря, провідного ввеКомпозиції згідно з винаходом можуть включадення або спостереження за введенням композити "терапевтично ефективну кількість" або "профіцій, а тому вказані тут інтервали доз наводяться лактично ефективну кількість" антитіла або його лише для ілюстрації і не обмежують об'єму пракантизв'язувальної частини згідно з винаходом. тичного застосування заявленої композиції. Термін "терапевтично ефективна кількість" ознаВ іншому своєму аспекті даний винахід відночає кількість, яка при певних дозах і протягом неситься до наборів, що містять aнти-M-CSFобхідного періоду часу є ефективною для досягантитілo або антизв'язувальну частину антитіла нення потрібного терапевтичного результату. згідно з винаходом або композицію, що включає Терапевтично ефективна кількість антитіла або таке антитіло або його частину. Такий набір, крім його частини може варіюватись в залежності від антитіла або композиції, може включати діагноститаких факторів, як патологічний стан, вік, стать і чні або терапевтичні агенти. Набір може також маса індивіда, а також від здатності такого антитівключати інструкції зі здійснення методу діагносла або частини антитіла виробляти потрібну відтики або терапії. У переважному варіанті цей набір повідь у даного індивіда. Терапевтично ефективна включає антитіло або композицію, яка містить йокількість також означає кількість, при якій терапевго, і діагностичний агент, який може бути використично корисна дія антитіла або частини антитіла таний в описаному нижче методі В іншому перезначно перевершує його токсичну або небажану важному варіанті винаходу, вказаний набір дія. "Профілактично ефективна кількість" означає включає антитіло або композицію, яка містить йокількість, яка, при певних дозах, і протягом необго, і один або декілька терапевтичних засобів, які хідного періоду часу є ефективною для досягнення можуть бути використані в описаному нижче метопотрібного профілактичного результату. Оскільки ді В одному зі своїх варіантів, даний винахід віднопрофілактичну дозу звичайно вводять індивіду до ситься до набору, що містить контейнер, інструкції розвитку захворювання або на ранній стадії його з введення aнти-M-CSF-антитіла людині страждарозвитку, то така профілактично ефективна кільючій запальним захворюванням, або інструкції з кість звичайно менше ніж терапевтично ефективна вимірювання числа СD14+СD16+-моноцитів в біокількість. логічному зразку і рівня aнти-M-CSF-антитілa. Схеми введення доз можуть бути скориговані Даний винахід також відноситься до композидля досягнення оптимальної потрібної відповіді цій, які інгібують аномальне зростання клітин у
ДивитисяДодаткова інформація
Назва патенту англійськоюHuman monoclonal antibody that specifically binds to human m-csf
Автори англійськоюBedian Vahe, Devalaraja Madhav Narasimha, Low Joseph Edwin, Mobley James Leslie, Kellermann Sirid-Aimee, Foltz Ian, Haak-Frendscho Mary
Назва патенту російськоюЧеловеческое моноклональное антитело, которое специфически связывается с м-csf человека и блокирует связывание м-csf с с-fms
Автори російськоюБедиан Вахе, Девалараджа Мадхав Нарасимха, Лоу Джозеф Эдвин, Мобли Джеймс Лесли, Келлерманн Зирид-Аймее, Фолтц Ян, Хаак-Френдшо Мери
МПК / Мітки
МПК: A61P 37/00, A61P 25/00, A61K 39/395, C07K 16/22
Мітки: антитіло, m-csf, зв'язується, специфічно, людське, яке, людини, блокує, c-fms, зв'язування, моноклональне
Код посилання
<a href="https://ua.patents.su/140-90457-lyudske-monoklonalne-antitilo-yake-specifichno-zvyazuehtsya-z-m-csf-lyudini-ta-blokueh-zvyazuvannya-m-csf-z-c-fms.html" target="_blank" rel="follow" title="База патентів України">Людське моноклональне антитіло, яке специфічно зв’язується з m-csf людини та блокує зв’язування m-csf з c-fms</a>
Попередній патент: Розширений канал підтвердження і керування швидкістю
Наступний патент: Механічний яс
Випадковий патент: Спосіб одержання дисперсного вуглецевого волокна