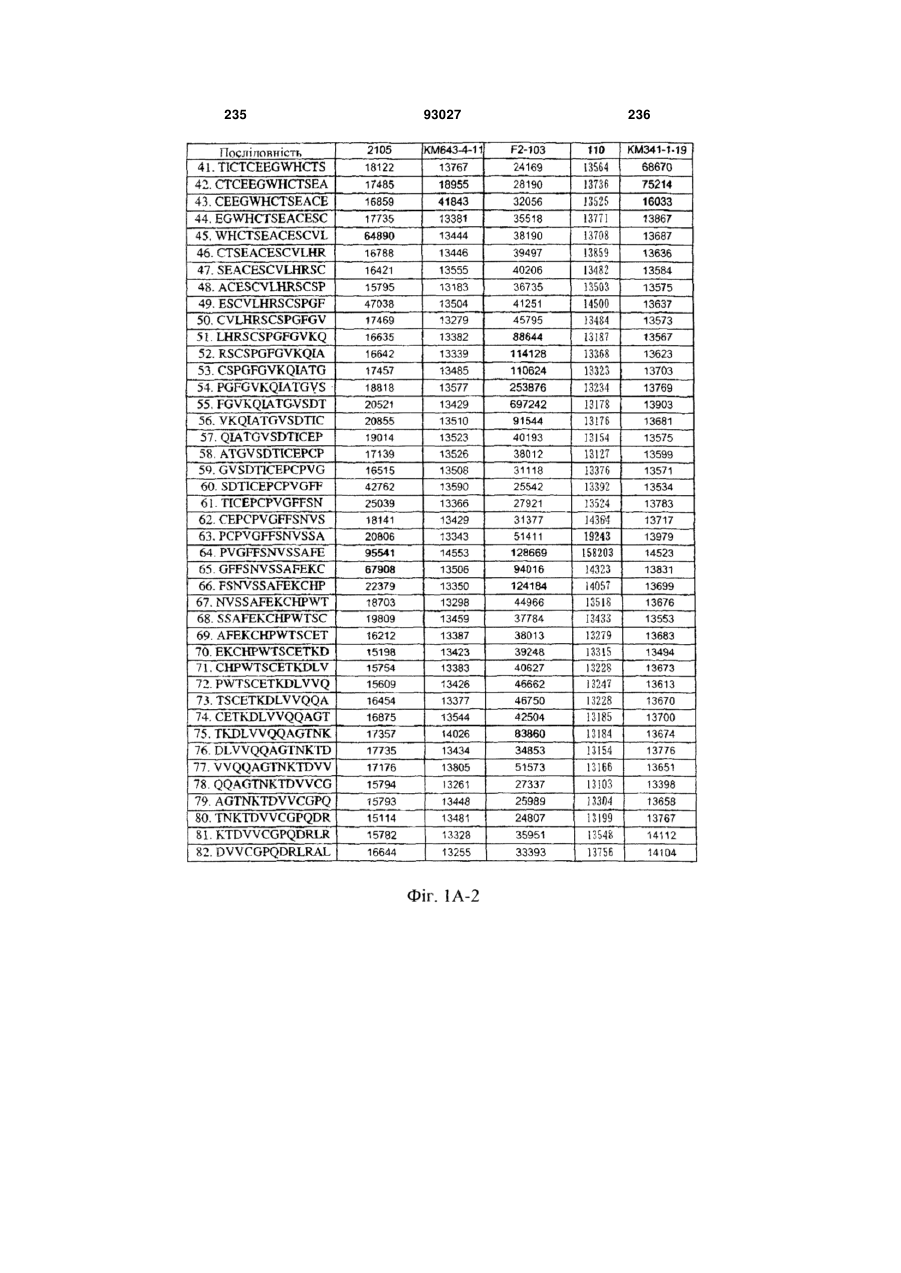
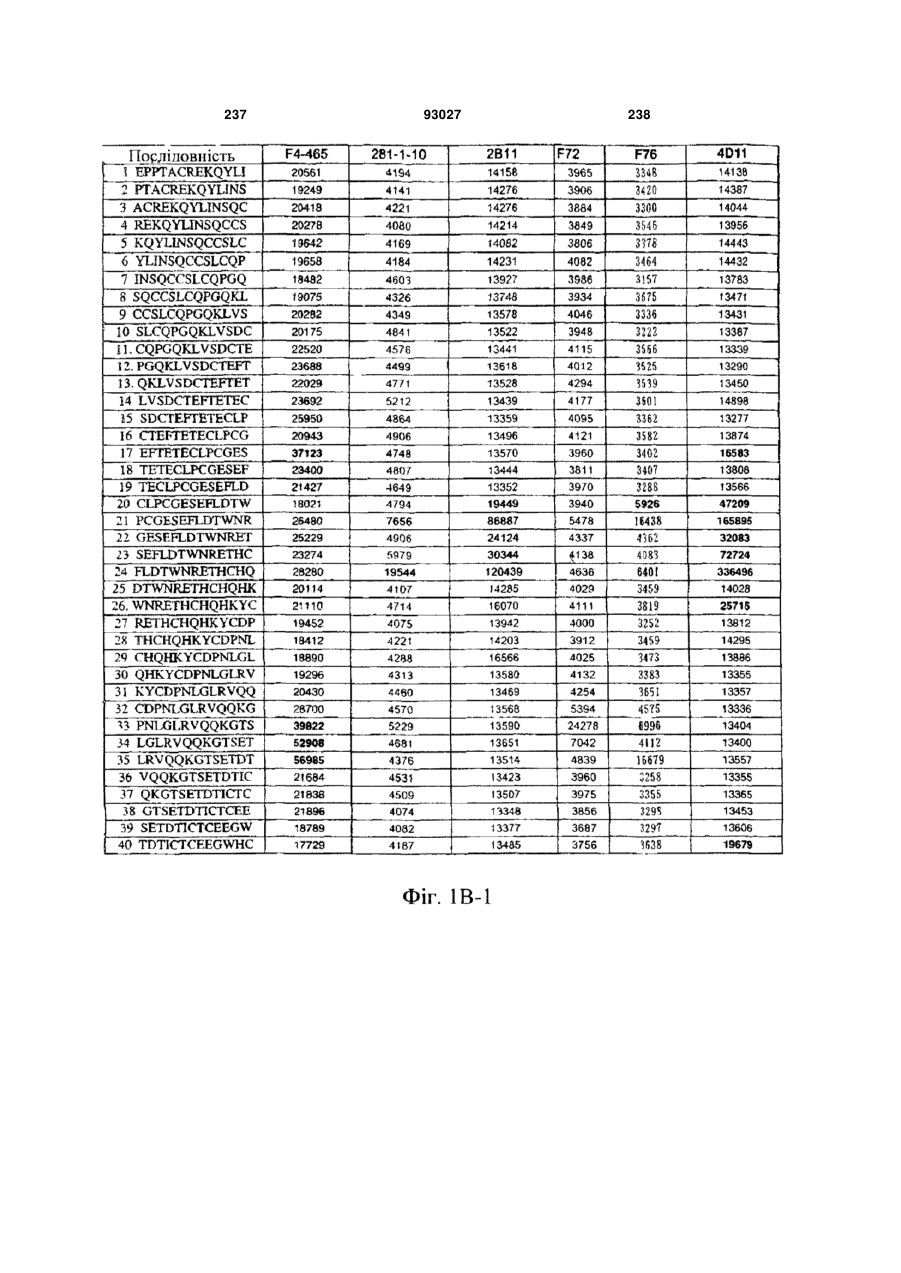
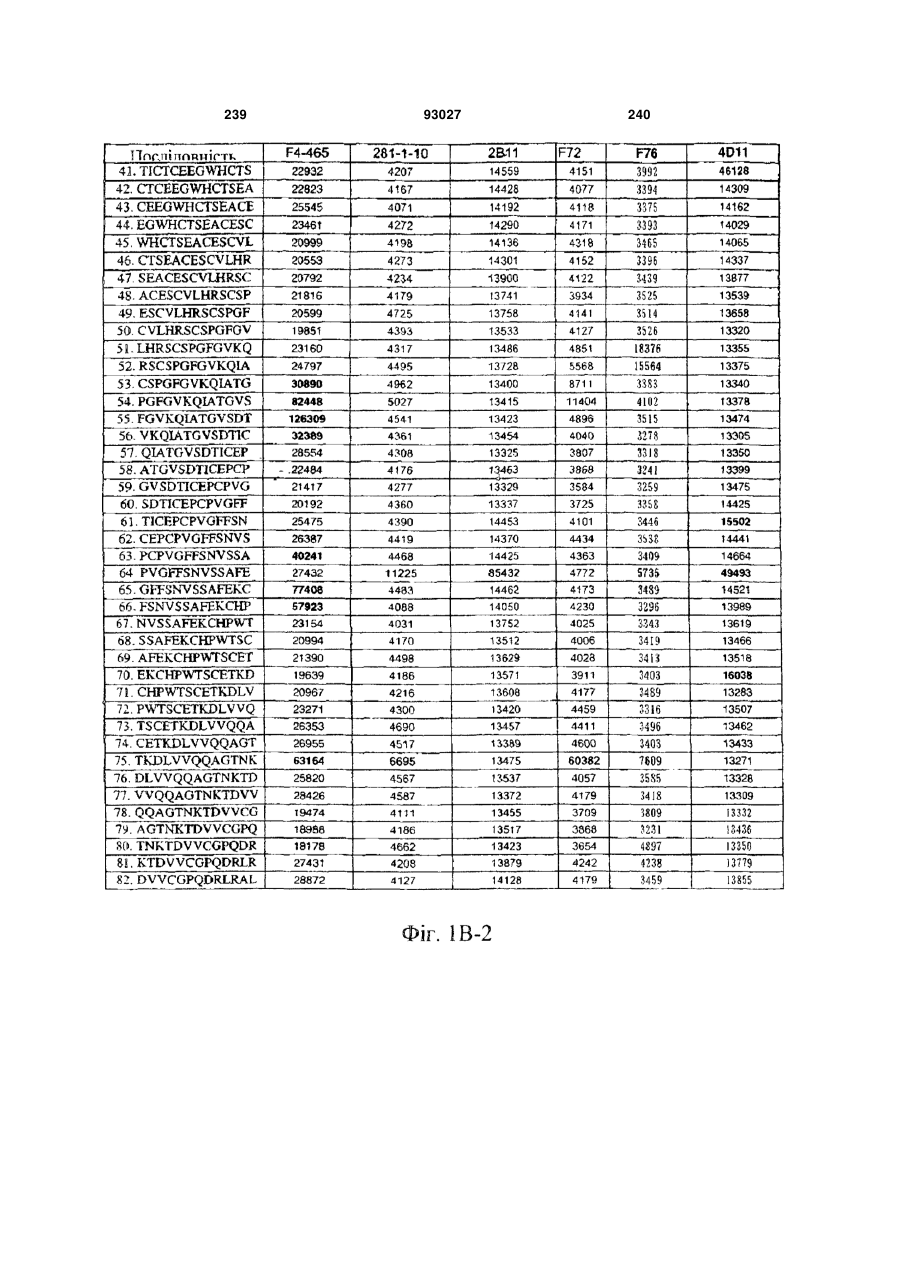
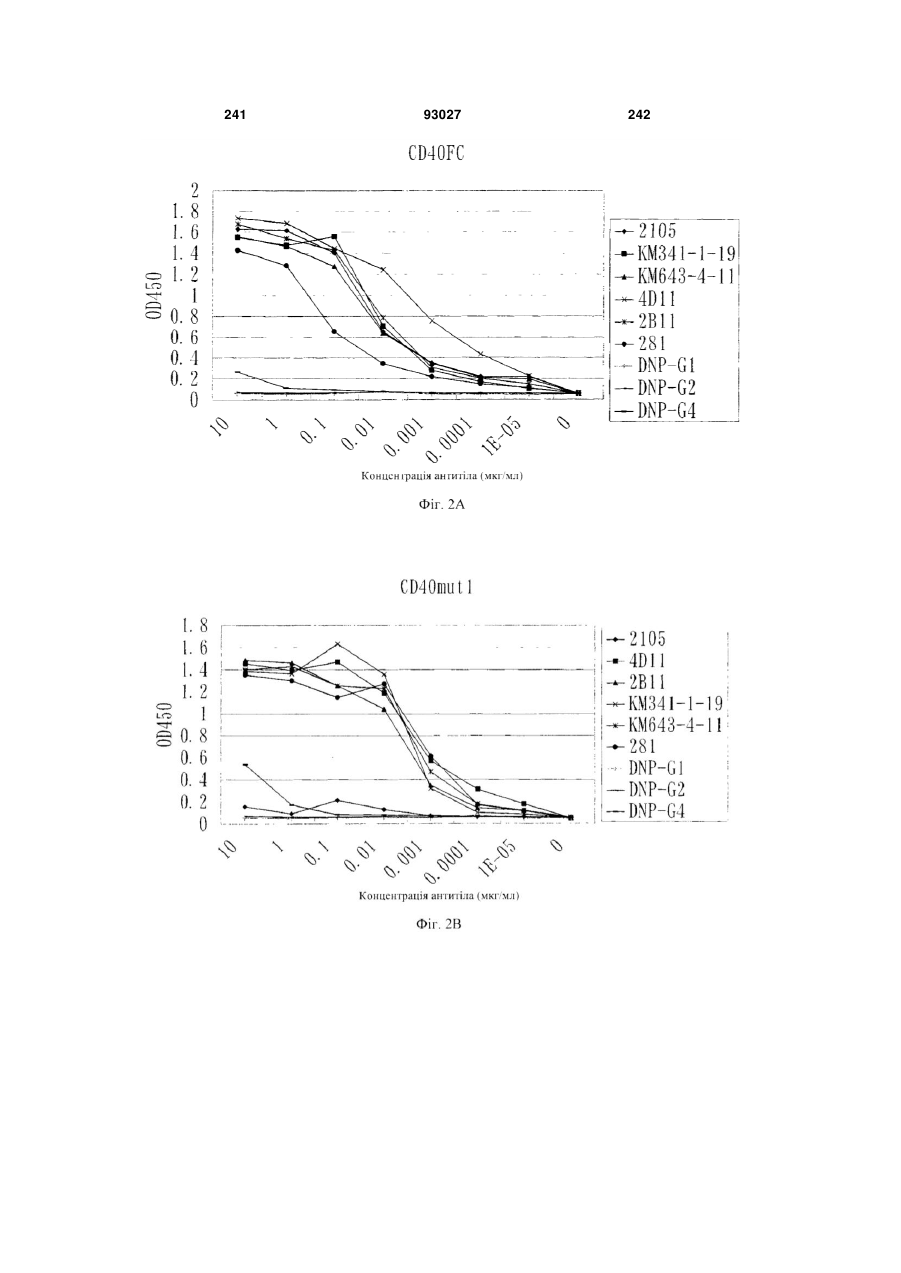
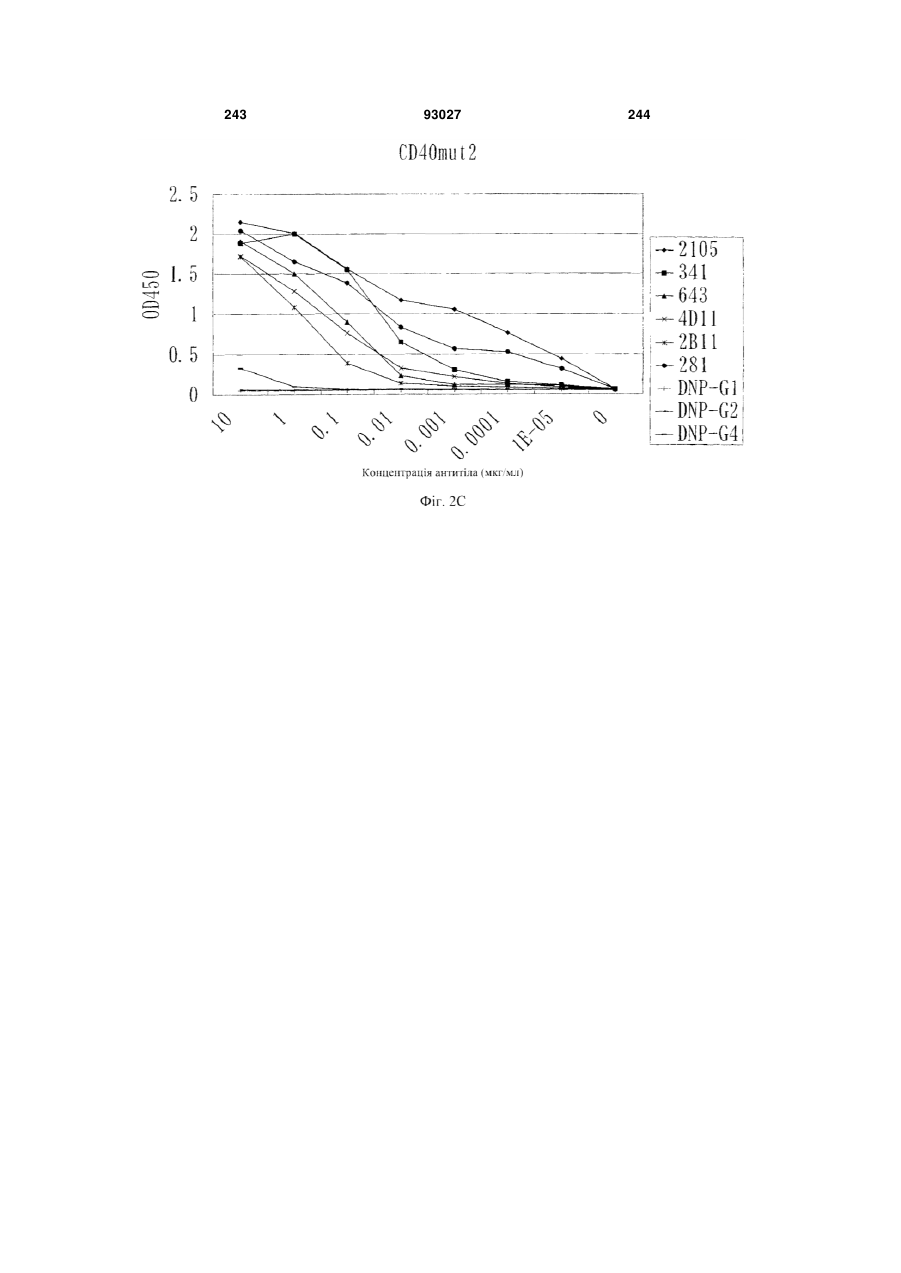
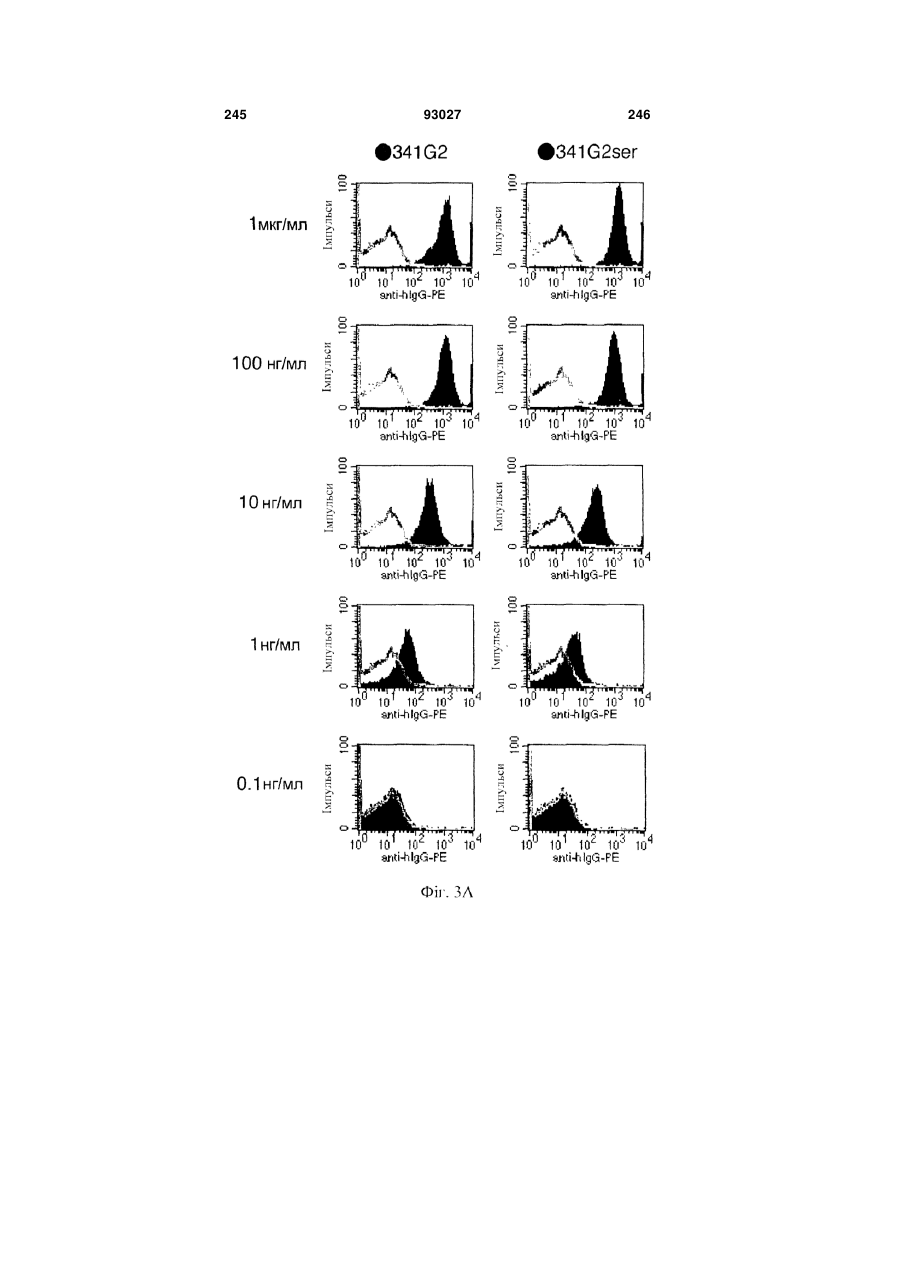
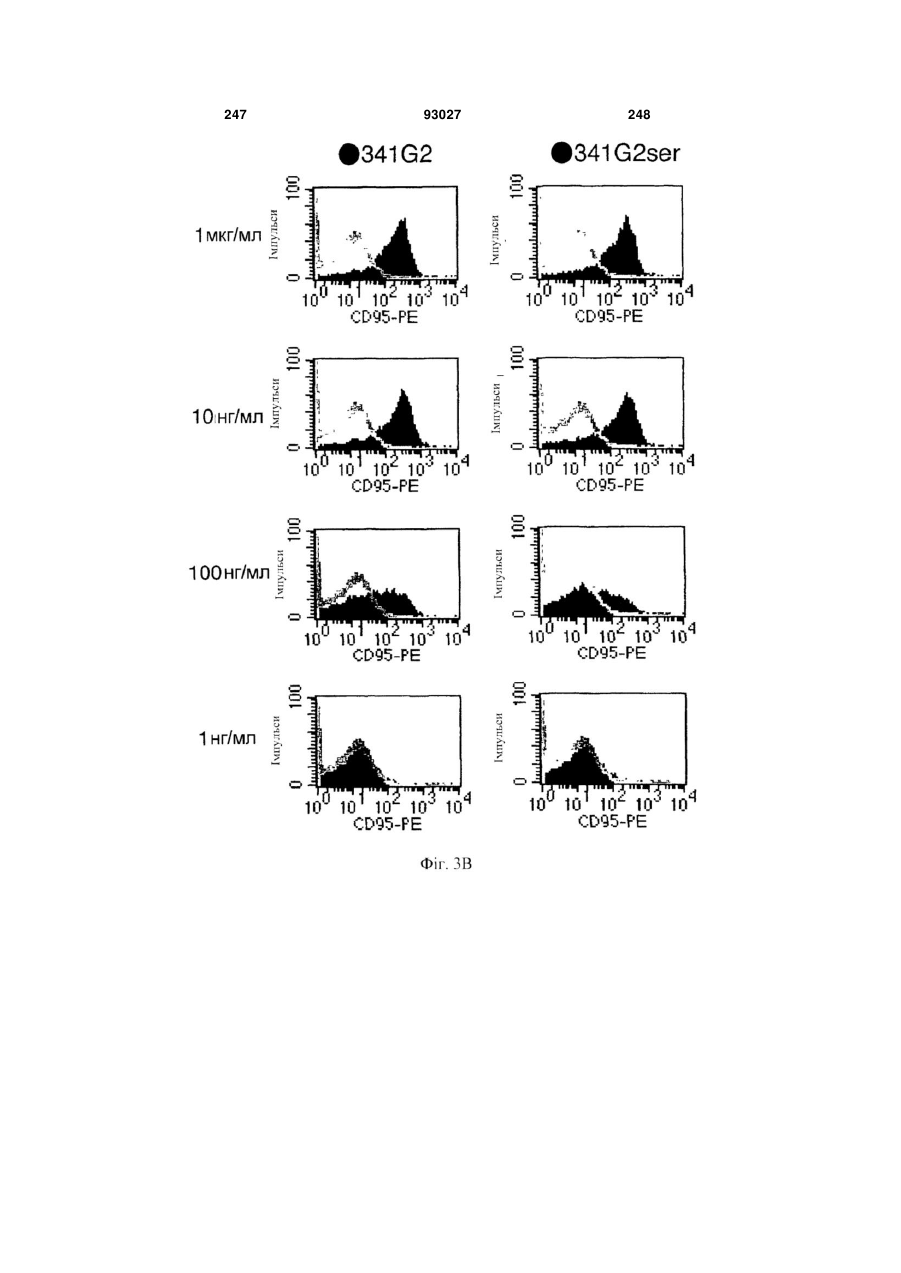
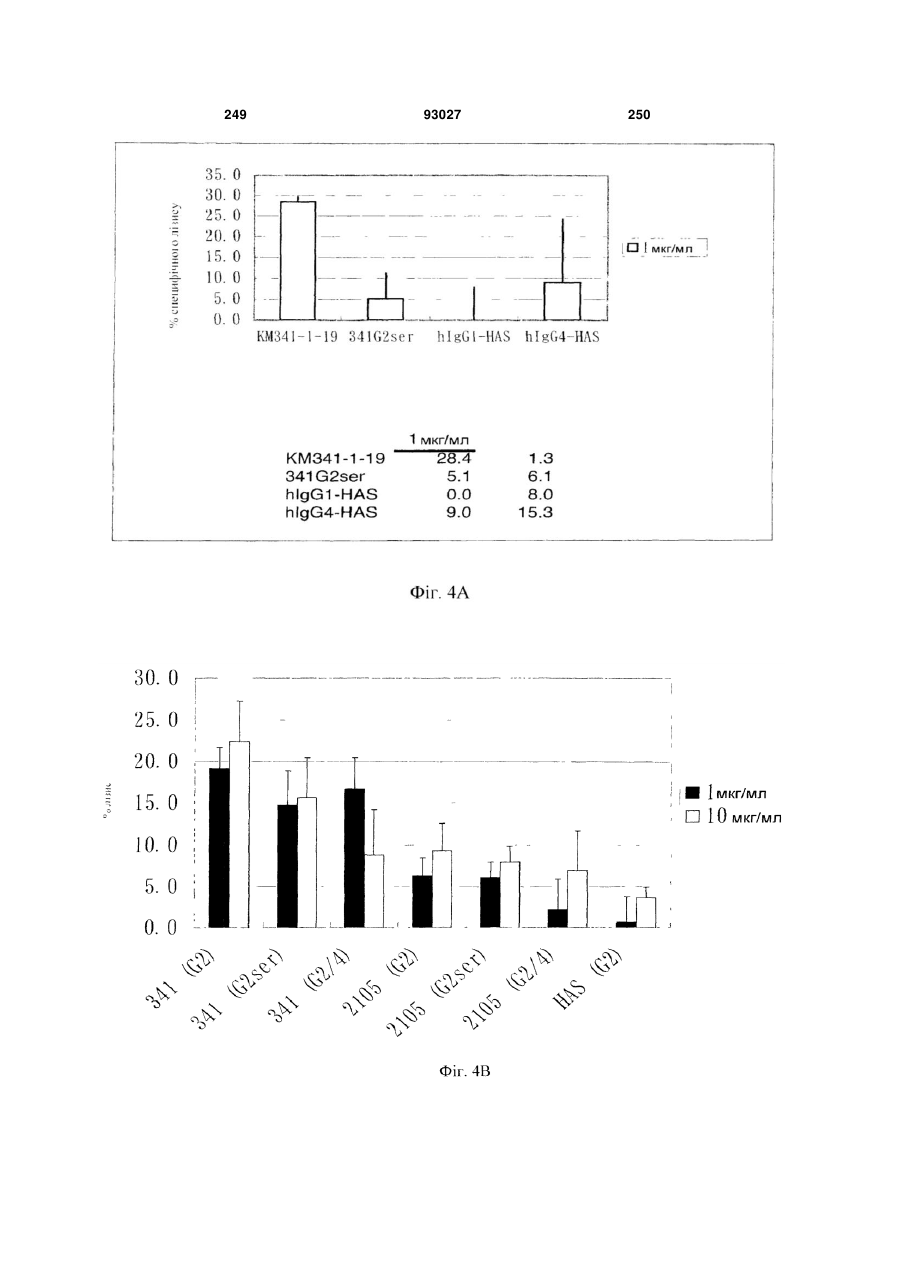
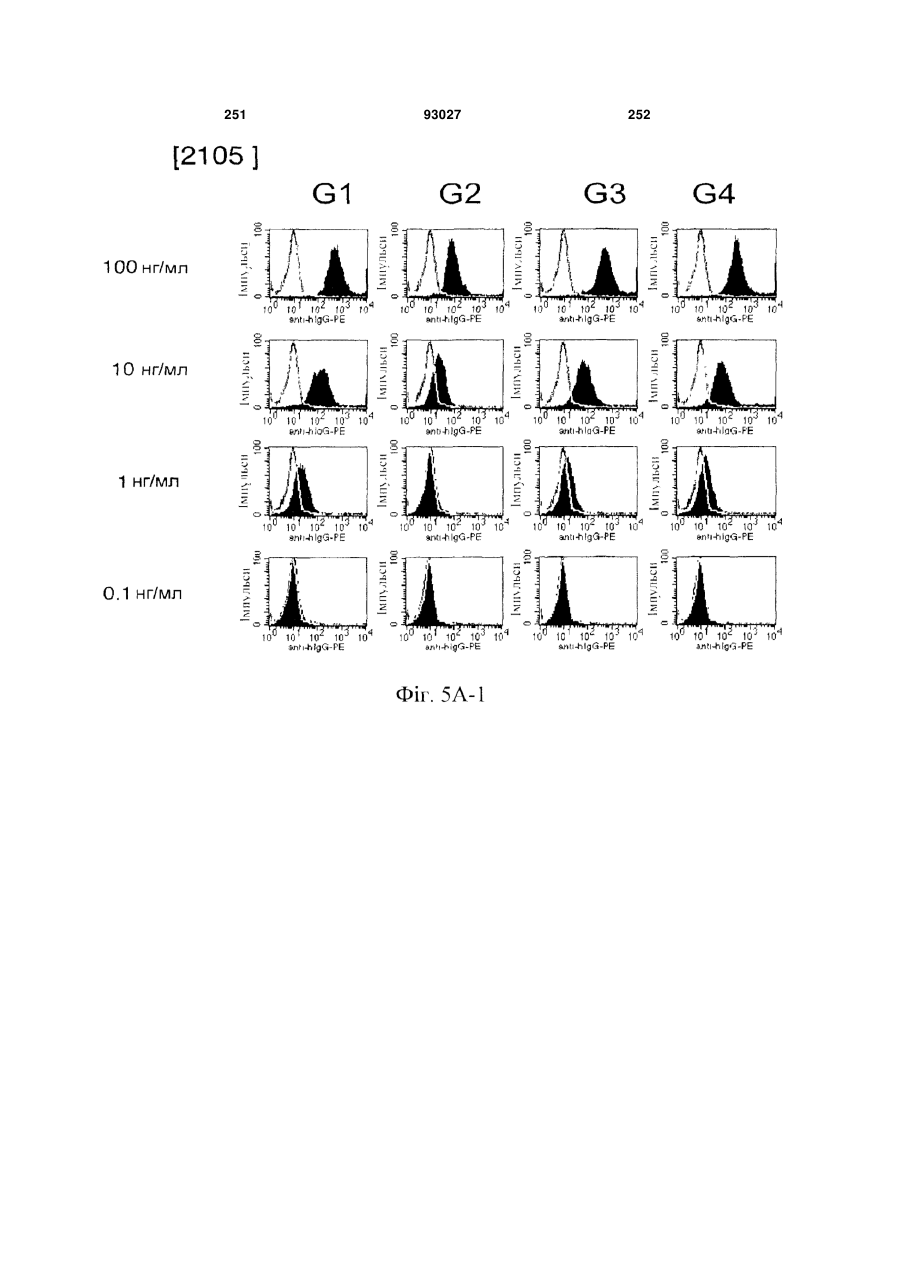
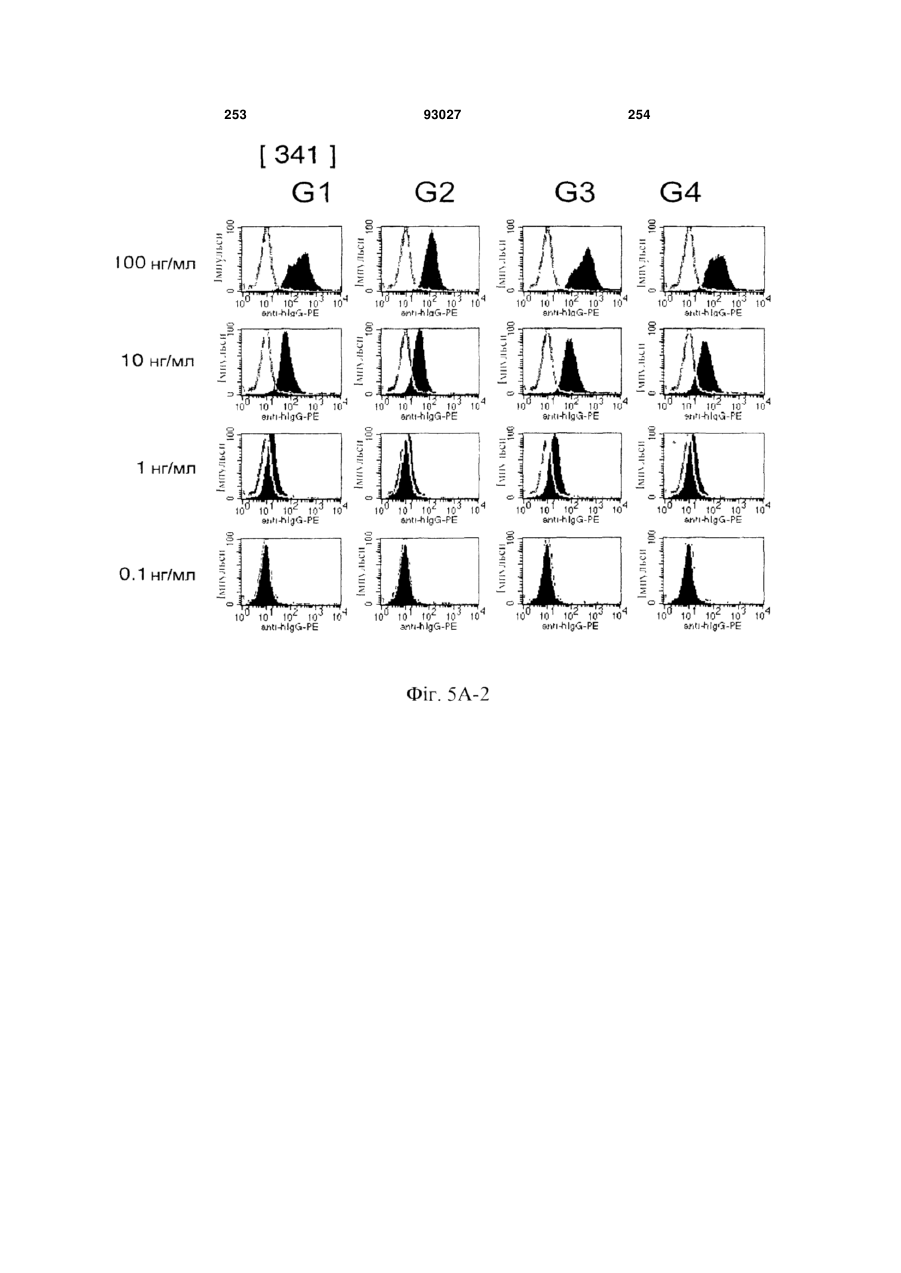
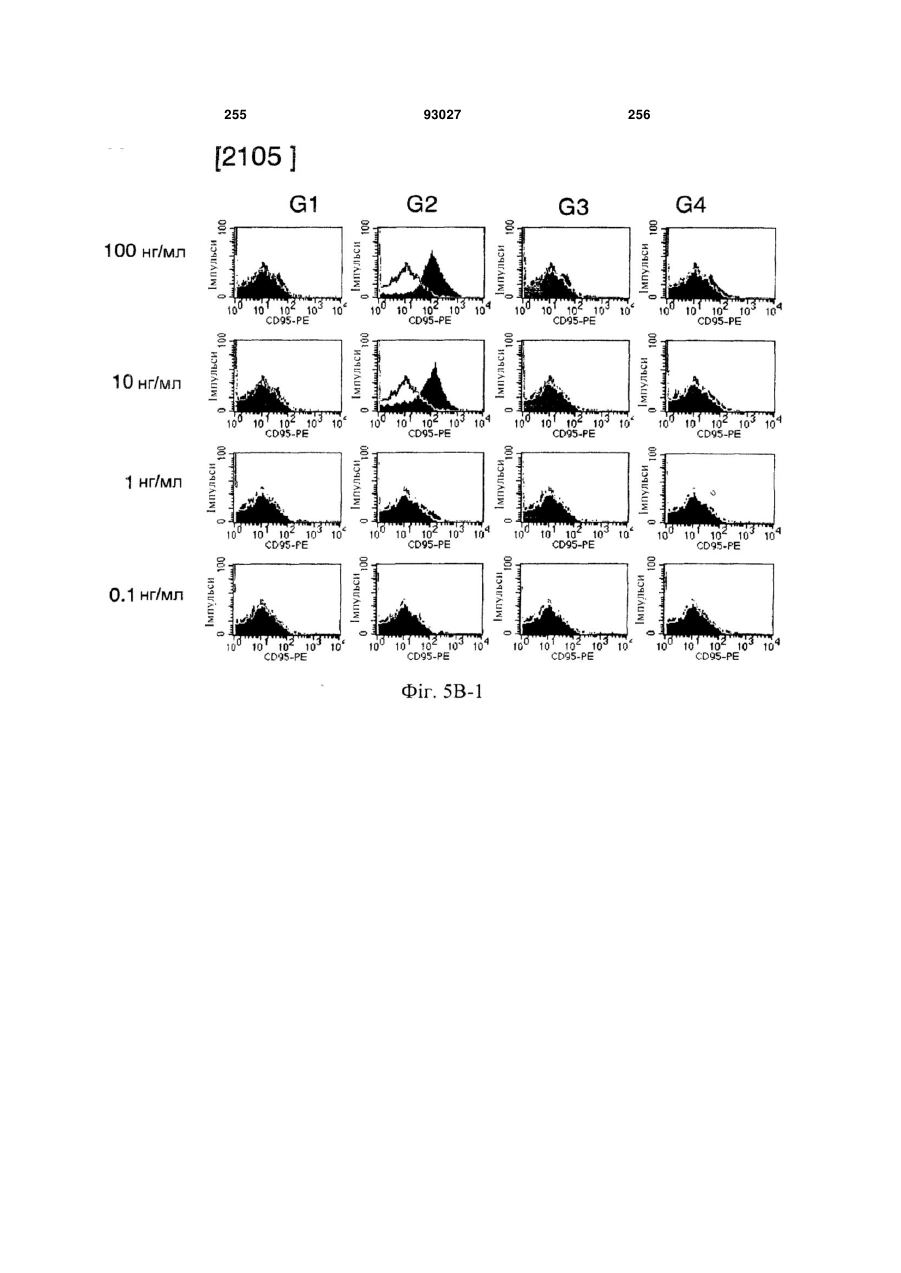
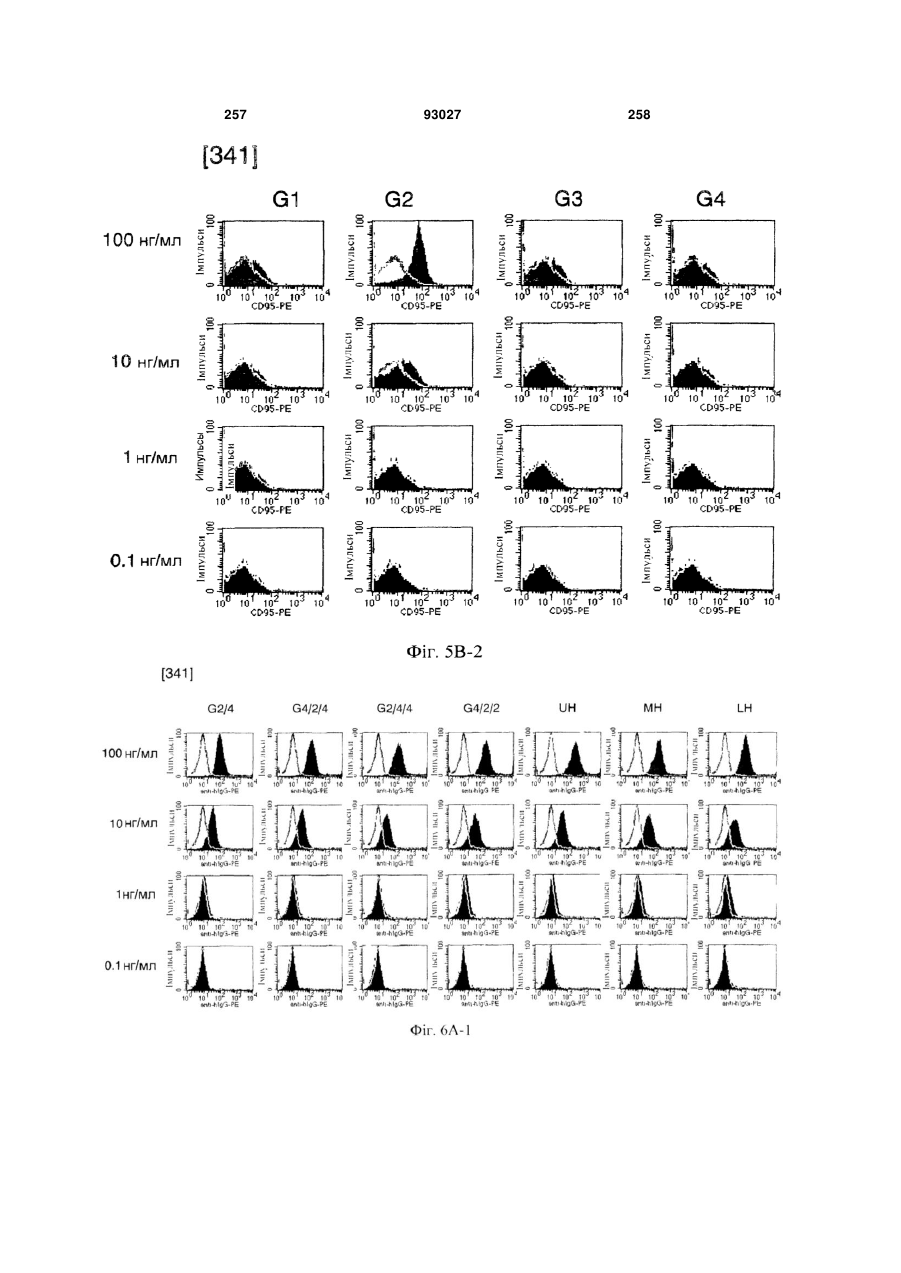
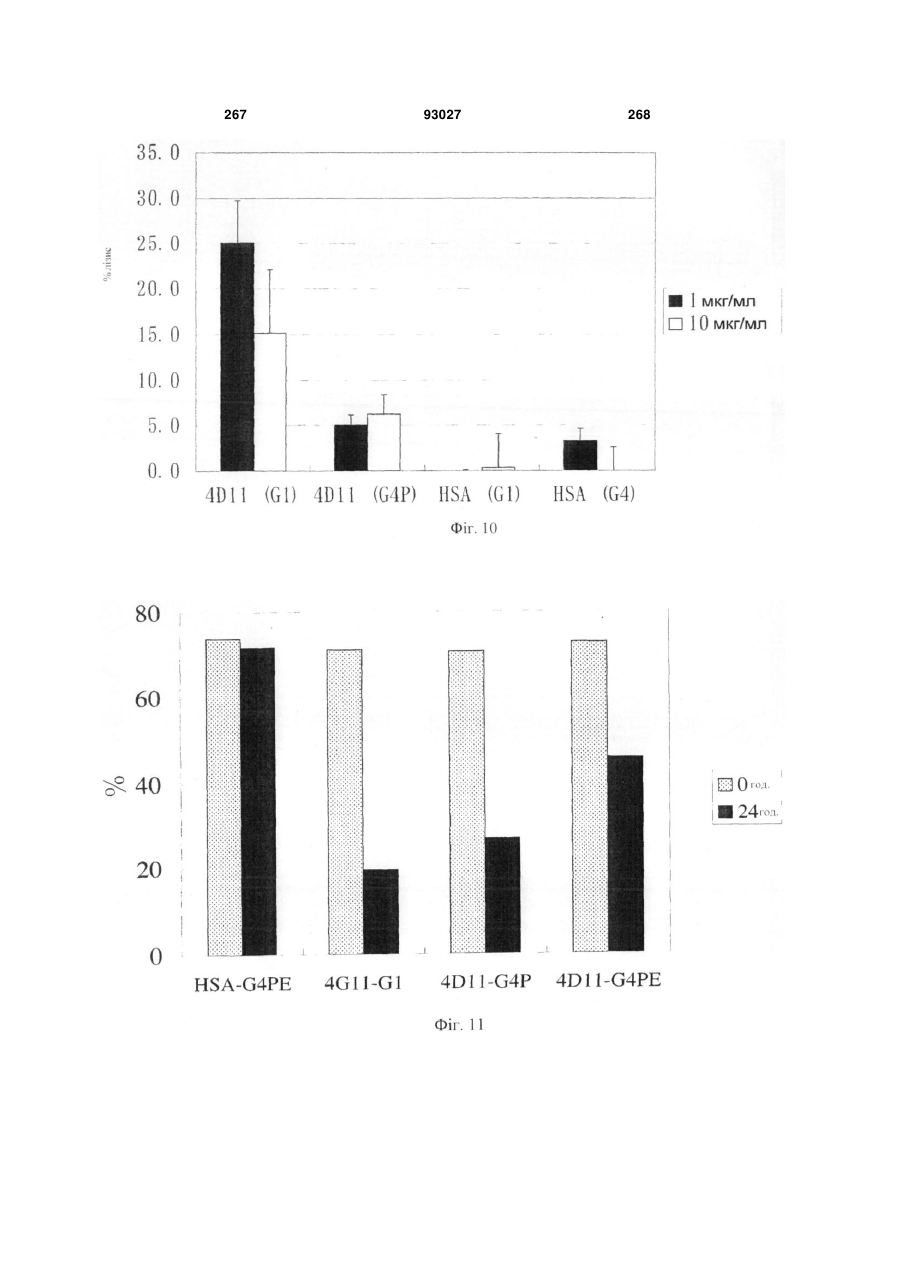
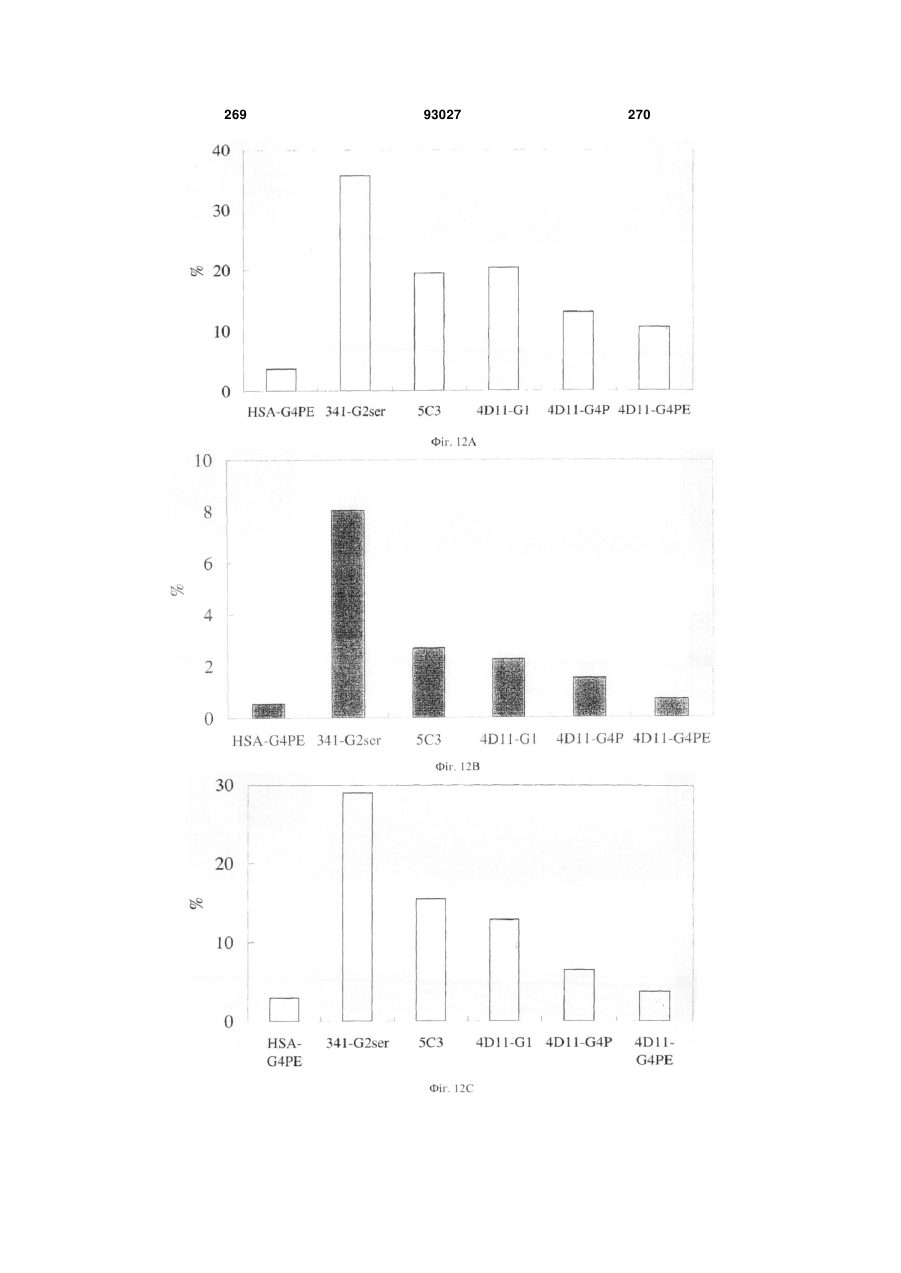
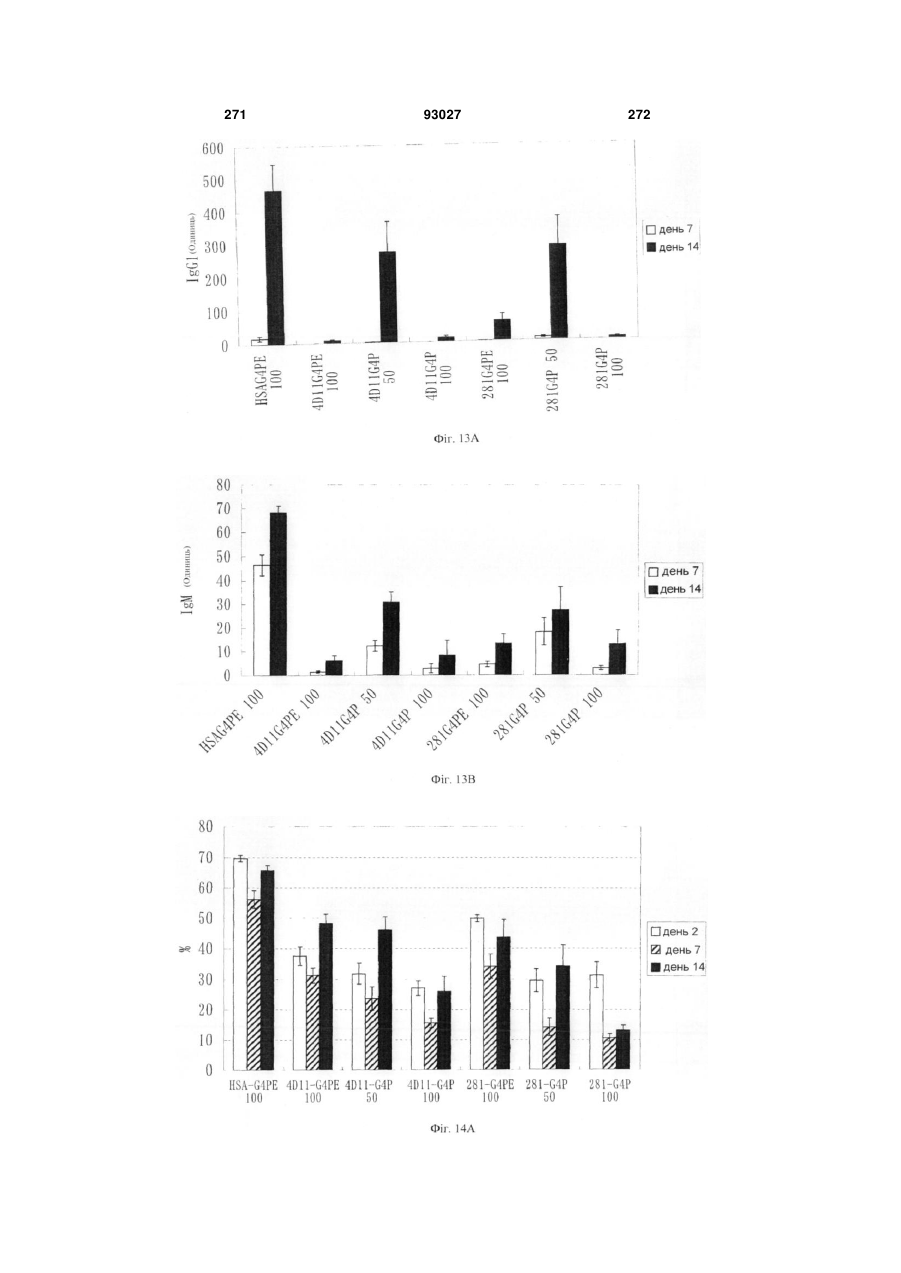
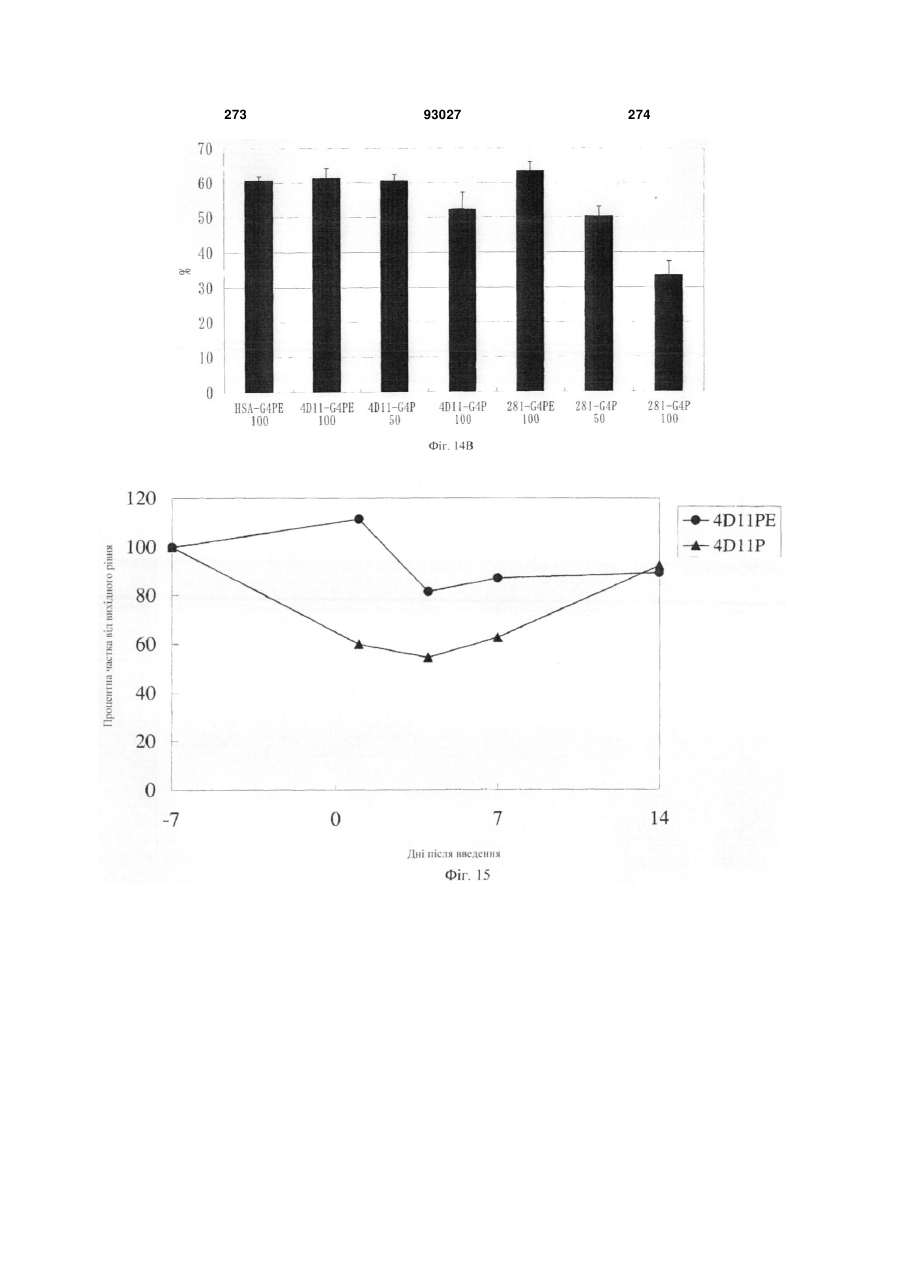
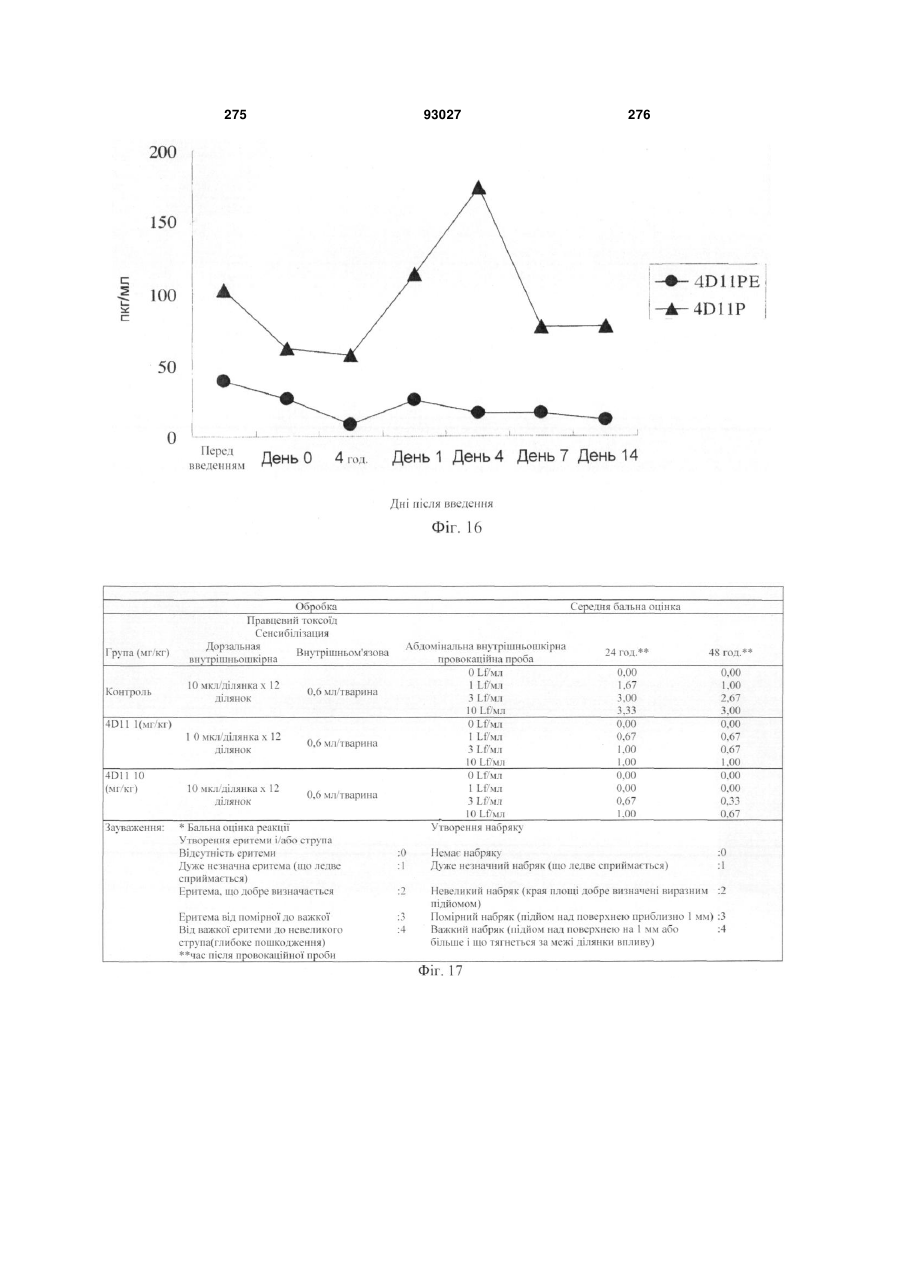
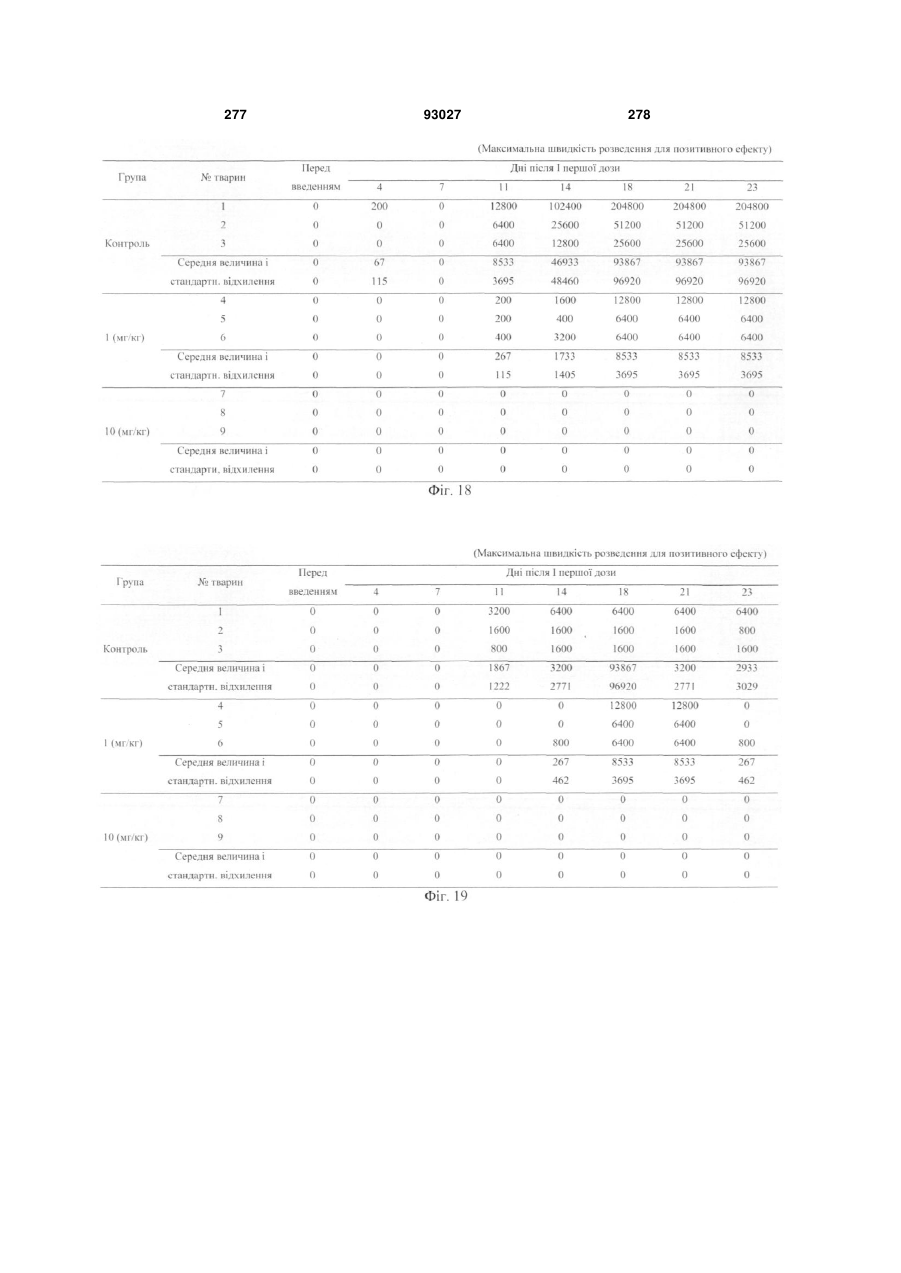
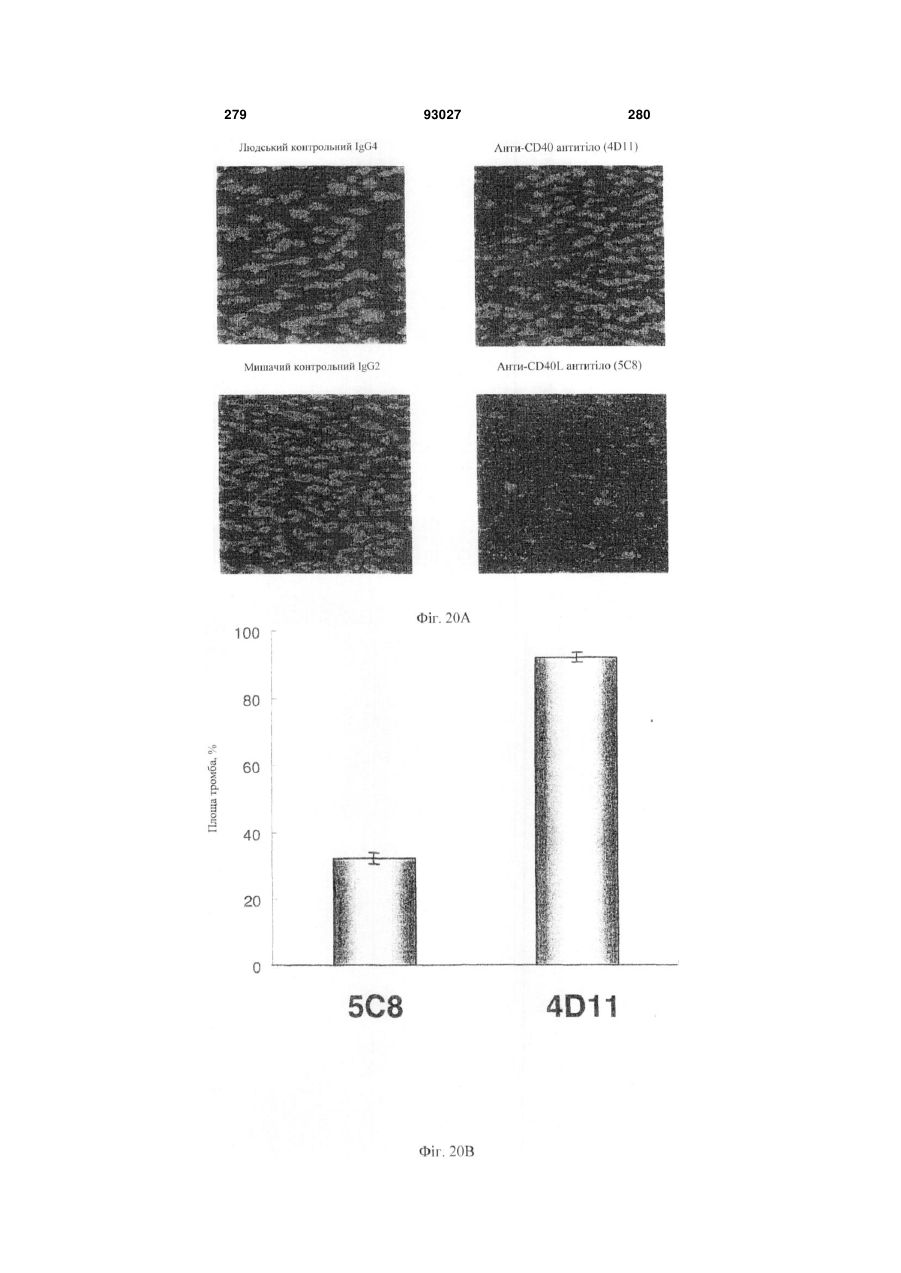
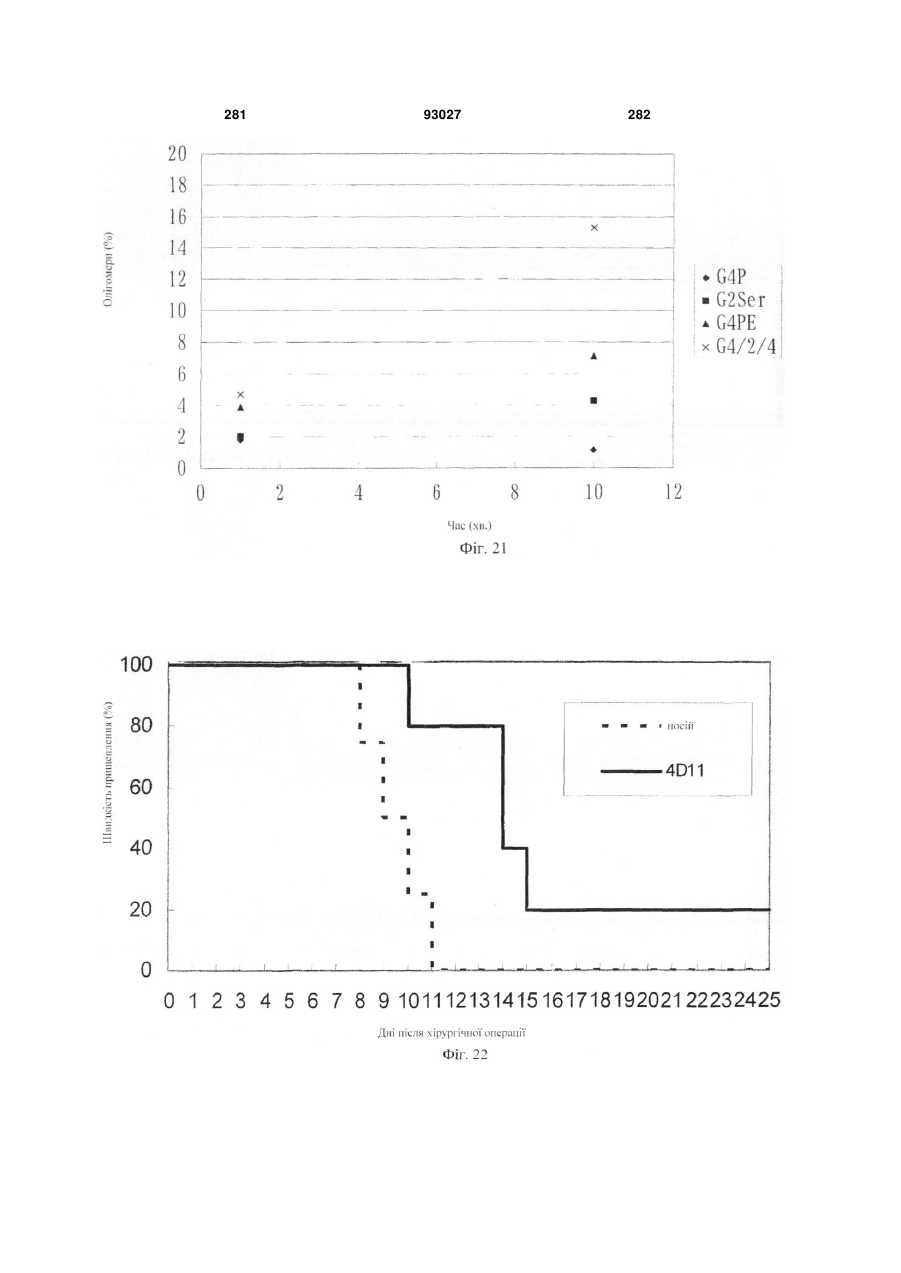
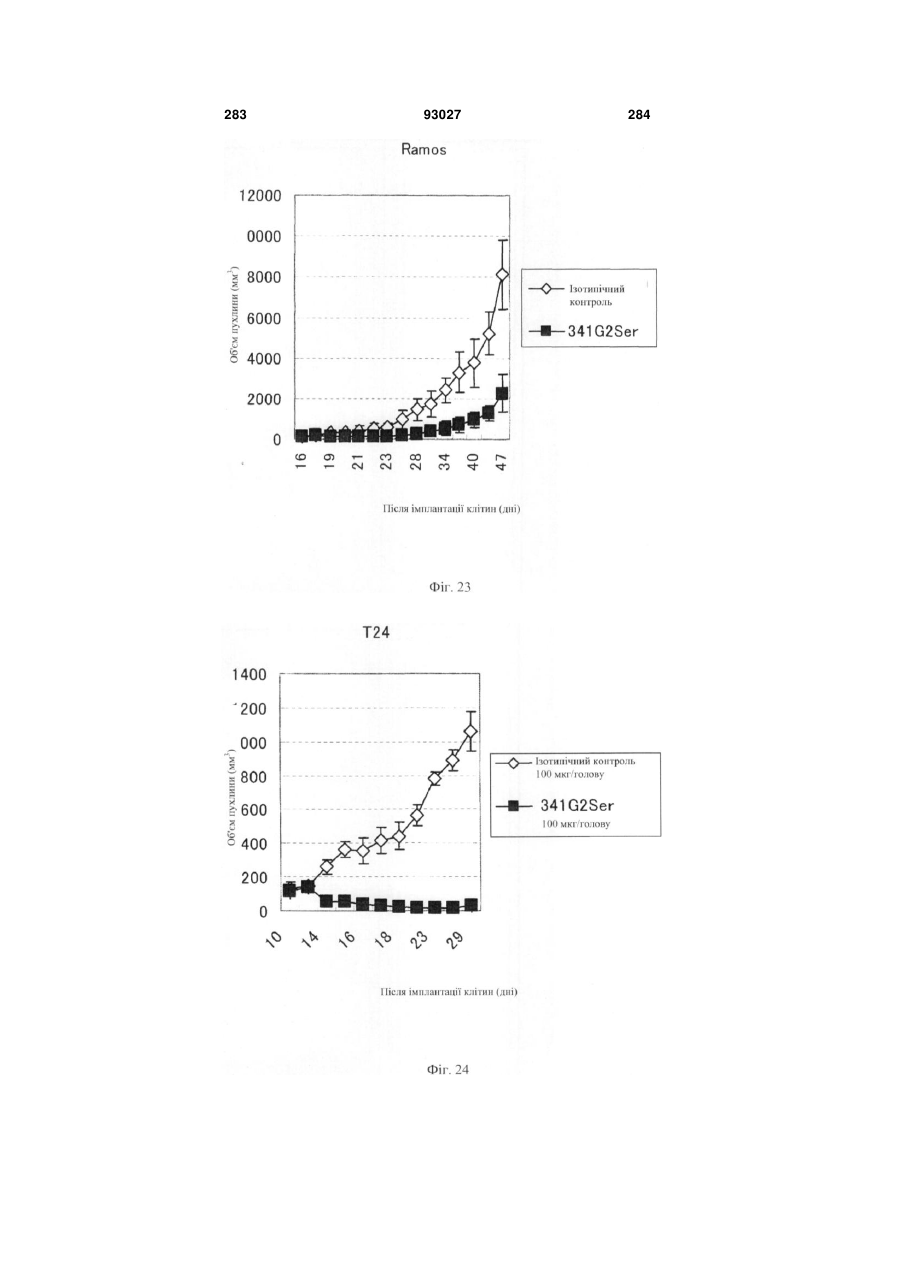
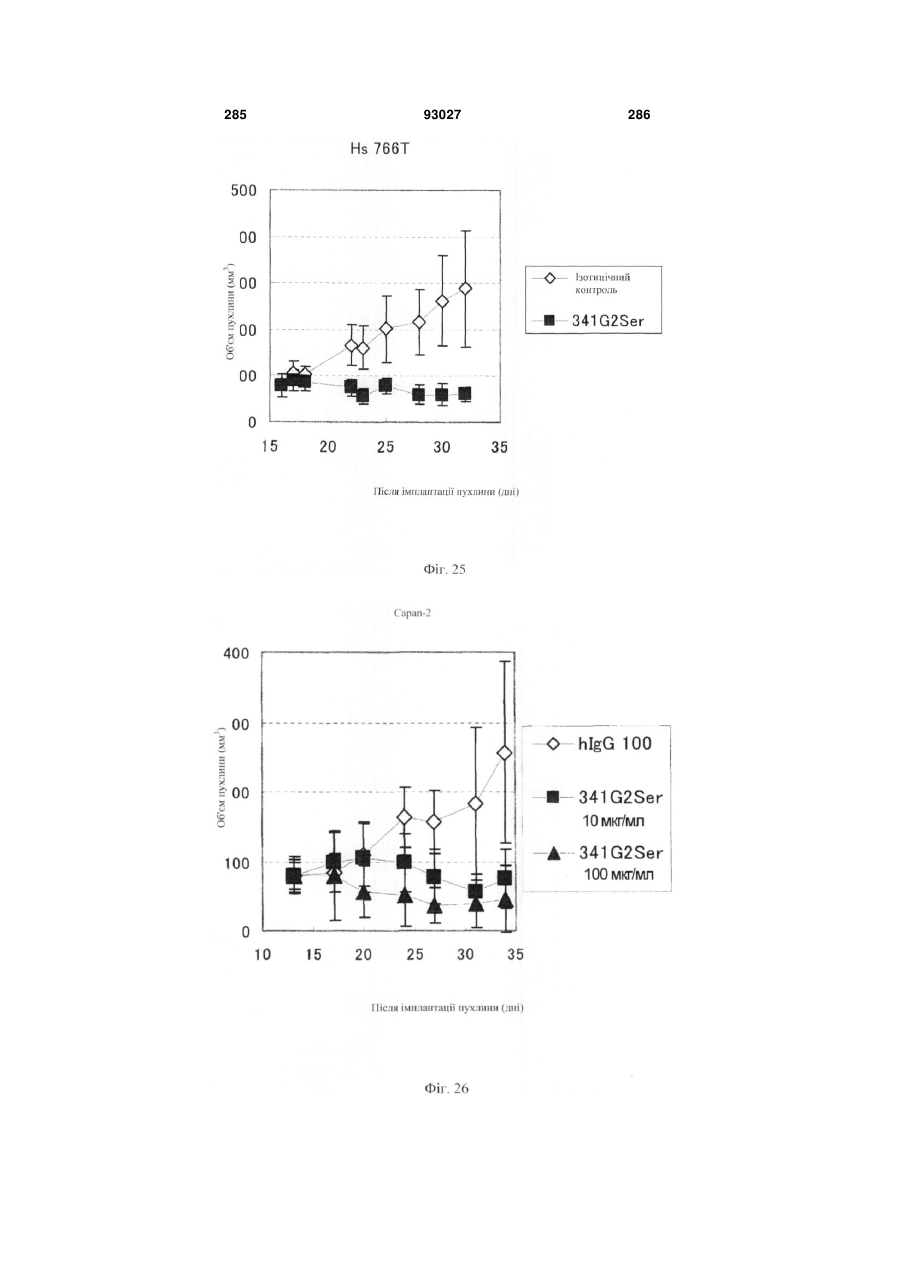
Мутантне антитіло, яке специфічно зв’язується з cd40
Номер патенту: 93027
Опубліковано: 10.01.2011
Автори: Такахасі Нобуакі, Міура Тору, Кітагава Йосінорі, Хірано Акі
Формула / Реферат
1. Моноклональне антитіло, яке специфічно зв’язується з CD40, що складається з (i) двох важких ланцюгів, кожний з яких містить константну область, одержану з IgG4 людини, із заміщенням серину проліном у положенні 228 і заміщенням лейцину глутаміновою кислотою в положенні 235 відповідно до індексу EU, запропонованого Kabat et al, і варіабельну область із важкого ланцюга моноклонального антитіла, продукованого гібридомою 4D11 (№ доступу FERM BP-7758), і (ii) двох легких ланцюгів, кожен з яких містить варіабельну область із легкого ланцюга моноклонального антитіла, продукованого гібридомою 4D11 (№ доступу FERM BP-7758).
2. Моноклональне антитіло, яке специфічно зв’язується з CD40, що складається з (i) двох важких ланцюгів, кожен з яких містить константну область, одержану з IgG4 людини, із заміщенням серину проліном у положенні 228 і заміщенням лейцину глутаміновою кислотою в положенні 235 відповідно до індексу EU, запропонованого Kabat et al, і варіабельну область, представлену амінокислотною послідовністю в діапазоні від Q у положенні 27 до S у положенні 147 в SEQ ID NO: 46, і (ii) двох легких ланцюгів, кожен з яких містить варіабельну область, представлену амінокислотною послідовністю в діапазоні від А в положенні 23 до К в положенні 128 в SEQ ID NO: 48.
3. Моноклональне антитіло, яке специфічно зв’язується з CD40, що складається із двох важких ланцюгів, кожен з яких представлений амінокислотною послідовністю в діапазоні від Q у положенні 27 до К в положенні 474 в SEQ ID NO: 140, і двох легких ланцюгів, кожен з яких представлений амінокислотною послідовністю в діапазоні від А в положенні 23 до С у положенні 235 в SEQ ID NO: 142.
4. Молекула полінуклеотиду, що кодує антитіло за п.3, яка містить важкий ланцюг з сигнальною послідовністю, представлений SEQ ID NO:139, та легкий ланцюг з сигнальною послідовністю, представлений в SEQ ID NO:141.
5. Полінуклеотид, представлений послідовністю в діапазоні від С у положенні 79 до А в положенні 1425 в SEQ ID NO: 139, що кодує важкий ланцюг антитіла за п. 3.
6. Вектор експресії для одержання антитіла за п. 3, що має полінуклеотид, представлений SEQ ID NO: 139, і полінуклеотид, представлений SEQ ID NO: 141.
7. Клітина-хазяїн, що містить вектор експресії за п. 6, для одержання антитіла за п. 3.
8. Спосіб одержання моноклонального антитіла за п. 3, що передбачає стадії культивування хазяїна за п. 7 у культуральному середовищі й одержання моноклонального антитіла з культури і/або хазяїна.
9. Фармацевтична композиція, що містить моноклональне антитіло за будь-яким з пп. 1-3 як активний інгредієнт.
10. Фармацевтична композиція за п. 9, що використовується для профілактики або лікування відторгнення трансплантата, аутоімунних захворювань, алергії або інгібування фактора VIII згортання крові.
11. Застосування моноклонального антитіла за будь-яким з пп. 1-3 для одержання фармацевтичної композиції, використовуваної для профілактики або лікування відторгнення трансплантата, аутоімунних захворювань, алергії або інгібування фактора VIII згортання крові.
Текст
1. Моноклональне антитіло, яке специфічно зв’язується з CD40, що складається з (i) двох важких ланцюгів, кожний з яких містить константну область, одержану з IgG4 людини, із заміщенням серину проліном у положенні 228 і заміщенням лейцину глутаміновою кислотою в положенні 235 відповідно до індексу EU, запропонованого Kabat et al, і варіабельну область із важкого ланцюга моноклонального антитіла, продукованого гібридомою 4D11 (№ доступу FERM BP-7758), і (ii) двох легких ланцюгів, кожен з яких містить варіабельну область із легкого ланцюга моноклонального антитіла, продукованого гібридомою 4D11 (№ доступу FERM BP-7758). 2. Моноклональне антитіло, яке специфічно зв’язується з CD40, що складається з (i) двох важких ланцюгів, кожен з яких містить константну область, одержану з IgG4 людини, із заміщенням серину проліном у положенні 228 і заміщенням лейцину глутаміновою кислотою в положенні 235 відповідно до індексу EU, запропонованого Kabat et al, і варіабельну область, представлену амінокислотною послідовністю в діапазоні від Q у положенні 27 до S у положенні 147 в SEQ ID NO: 46, і (ii) двох легких ланцюгів, кожен з яких містить варіабельну область, представлену амінокислотною послідовністю в діапазоні від А в положенні 23 до К в положенні 128 в SEQ ID NO: 48. 3. Моноклональне антитіло, яке специфічно зв’язується з CD40, що складається із двох важких 2 (19) 1 3 Галузь техніки Даний винахід відноситься до анти-CD40 антитіла, яке розпізнає CD40, що являє собою тип молекул клітинної мембрани, пов'язаних з імунітетом. Крім того, даний винахід відноситься до антитіла з мутацією в константній області людського антитіла або з підкласом, що має його частину, заміщену для зменшення активності ADCC і/або CDC, із збереженням в той же самий час агоністичної або антагоністичної активності. Опис попереднього рівня техніки 1. CD40 CD40 являє собою антиген, що має молекулярну масу 50 кДа, який присутній на поверхні клітинної мембрани, і експресований в В клітинах, дендритних клітинах (DC), деяких типах ракових клітин і тимусних епітеліальних клітин. Відомо, що CD40 грає важливу роль в проліферації і диференціації В клітин і DC. CD40 був ідентифікований як антиген, експресований на поверхні людських В клітин (E.A.Clark et al., Proc. Natl. Acad. Sci. USA 83: 4494, 1986; і l.Stamenkovic et al., EMBO J. 8: '403, 1989), і вважався членом сімейства рецепторів TNF, яке включає рецептори NGF з низькою афінністю, рецептори TNF, CD27, ОХ40 і CD30. Недавно були клоновані ліганди (CD40L) до людських і мишачих CD40, і було виявлено, що вони являють собою мембранні білки типу II, що експресуються в активованих клітинах CD4+T. Було також виявлено, що CD40L вводить сильні сигнали для активації в людські і мишачі В клітини. Спостерігалося, що в дендритних клітинах CD40 більш високо експресований, ніж в В клітинах, і стало ясно, що CD40 грає важливу роль в дендритних клітинах. Зв'язування CD40 з CD40L активує антиген-презентуючі клітини (АРС), тобто, експресує спільно стимулюючі молекули, такі як CD80 (В7-1) і CD86 (В7-2), або посилює продукцію IL-2 (Caux, С, et al.: Activation of human dendritic cells through CD40 cross-linking. J. Exp. Med., 180: 1263, 1994; і Shu, U., et al.: Activated Τ cells induce interleukin-12 production by monocyte via CD40 CD40 ligand interaction. Eur. J. Immunol., 25: 1125, 1995). Дендиртні клітини володіють високою антиген-презентуючою здатністю і високою здатністю активації хелперних Т (Th) клітин. Вважається, що дендритні клітини також регулюють диференціацію нативних клітин Th в клітини Th1 або Th2. Коли моноцити периферичної крові, які являють собою мієлоїдні дендритні клітини, культивуються в присутності GM-CSF і IL-4, і дозрівають під впливом CD40L, отримані в результаті доспілі дендритні клітини (DC1) можуть продукувати IL-12 in vitro, і стимулюють і активують алогенні клітини, що не зазнавали ніякого впливу Th для індукції Τ клітин, що продукують IFN (тобто, сприяння їх диференціації в Th1). Ця дія інгібується антитілом проти IL12 і, отже, на нього можна впливати за допомогою IL-12. З іншого боку, коли плазмацитоїдні Τ клітини, які присутні в лімфоїдних Τ областях і периферичній крові, культивуються в присутності IL-3 І ліганду CD40, показане, що отримані лімфоїдні 93027 4 дендритні клітини (DC2) нездатні продукувати IL12 і стимулювати і активувати алогенні клітини, що не зазнавали ніякого впливу Th для індукції Τ клітин, які продукують IL-4, що вказує на стимуляцію їх диференціацію в Th2. Вважається, що клітини Th1 беруть участь в активації клітинного імунітету, в той час як клітини Th2 пов'язані з посиленням гуморального імунітету, а також обмеженням клітинного імунітету. Коли цитотоксичні Τ клітини (CTL) активуються за допомогою клітин Th1, вони можуть усунути патогени (ряд типів вірусів, лістерій, туберкульозних бактерій, токсоплазматичних найпростіших і т.д.), що ростуть в цитоплазмі і пухлинних клітинах. Було продемонстровано, що моноклональні анти-CD40 антитіла, які розпізнають CD40, експресовані на поверхні мембрани, мають види біологічної активності, відмінні від В клітин. Моноклональні анти-CD40 антитіла загалом класифікуються на агоністичні або антагоністичні антитіла проти взаємодії між CD40 і CD40L. 2. Агоністичні антитіла Відомо, що агоністичні антитіла активують В клітини. Наприклад, повідомляється, що антиCD40 антитіла індукують клітинну адгезію (Barrett et al., J. Immunol. 146: 1722, 1991; і Gordon et al., J. Immunol. 140: 1425, 1998), збільшують розмір клітин (Gordon et al., J. Immunol. 140: 1425, 1998; і Valle et al., Eur. J. Immunol. 19: 1463, 1989), індукують клітинний розподіл В клітин, активованих тільки анти-IgM антитілом, анти-CD20 антитілом або складним форболовим ефіром (Clark і Ledbetter, Proc. Natl. Acad. Sci. USA 83: 4494, 1986; Gordon et al., LEUCOCYTE TYPING III. Oxford University Press. Oxford, p.426; and Paulie et al., J. Immunol. 142: 590, 1989), індукують клітинний розподіл В клітин в присутності IL4 (Valle et al., Eur. J. Immunol. 19: 1463, 1989; і Gordon et al., Eur. J. Immunol. 17: 1535, 1987), індукують експресію IgE культивованими клітинами, стимульованими IL-4, і позбавленими Τ клітин (Jabara et al., J. Exp. Med. 172: 1861, 1990; і Gascan et al., J. Immunol. 147: 8, 1991), індукують експресію IgG і IgM цими культивованими клітинами (Gascan et al., Immunol. 147: 8, 1991), секретують розчинний CD23/FceRII з клітин за допомогою IL-4 (Gordon and Guy, Immunol. Today 8: 39, 1987; і Caims et al., Eur. J. Immunol. 18: 349, 1988), посилюють експресію розчинного CD23/FceRII на клітинах за допомогою IL-4 (Challa A., Allergy, 54: 576, 1999), і сприяють продукції IL-6 (Clark and Shu, J. Immunol. 145: 1400, 1990). Крім того, повідомляється, що додання IL-4 і анти-CD40 антитіла в людську первинну культуру В клітин в присутності CDw32 + адгезивних клітин привело до встановлення клонованих В клітин, що відбуваються з них (Bancherauet et al.. Science 241: 70. 1991), і апоптоз клітин зародкового центра інгібувався за допомогою CD40, незалежно від того, чи був його антигенний рецептор активним або неактивним (Liu et al., Nature 342: 929, 1989). Як описано вище, CD40 був ідентифікований у вигляді антигена, eкспресованого на поверхні людських В 5 клітин, і. отже, більшість виділених антитіл оцінювали як показник, головним чином використовуючи їх здатність індукувати проліферацію і/або диференціацію людських В клітин, або їх індукційну активність у відношенні здатності викликати загибель ракових клітин (Katira, A. et al., LEUKOCYTE TYPING V. S. F. Schlossossman, et. al. eds. p. 547. Oxford University Press. Oxford; W. C. Flansow et. al., LEUKOCYTE TYPING V. S. F. Schlossossman, et. al. eds. p. 555. Oxford University Press. Oxford; і J. D. Pound et. al.. International Immunology, 11: 11, 1999). Було продемонстровано, що анти-CD40 антитіло спричиняє дозрівання DC (Ζ.Η. Zhou et al., Hybridoma, 18: 471, 1999). Крім того, повідомлялося, що роль CD4 Τ клітин в примуванні антигенспецифічних CD8 Τ клітин являє собою активацію DC за допомогою передачі сигналів CD40-CD40L, і було виявлено, що анти-CD40 моноклональне антитіло (mAb) здатне замінити CD40 хелперні Τ клітини при активації дендритних клітин (DC) (Shoenberger, S. P., et. al.: T-cell help for cytotoxic Τ lymphocytes is mediated by CD40 - CD40L interactions. Nature, 480, 1998). Було також виявлено, що введення анти-CD40 антитіла мишам здатне захистити організм тварини від пухлинних клітин, що експресують CD-40, а також пухлинних клітин, що не експресують CD40 (French, R. R., et. al.: CD40 antibody evokes a cytotoxic T-cell response that eradicates lymphoma and bypasses T-cell help. Nature Medicine, 5, 1999). Очікується, що агоністичні анти-CD40 антитіла ефективні для лікування інфекційних захворювань, викликаних бактеріями, вірусами і т.д., раку і інших захворювань, на основі їх функцій, описаних вище. Анти-CD40 антитіла з перевершуючими агоністичними активностями описані в WO 02/088186. Ілюстрованими прикладами цих агоністичних антитіл є антитіла КМ341-1-19 і 2105. Гібридома КМ341-119, що продукує КМ341-1-19 антитіло, і гібридома 2105, що продукує 2105 антитіло, були представлені відповідно 27 вересня 2001 г і 17 квітня 2002 г для міжнародного депонування відповідно до Будапештського договору в Міжнародний депозитарій патентних організмів в Національному інституті просуненої промислової науки і технології (central 6, 1-1. Higashi I, Tsukuba, Ibaraki. Japan). їх номерами доступу с FERM BP-7759 (KM341-1-19) і FERMBP-8024(2105). 3. Антагоністичні антитіла З одного боку, враховуючи, що, як указано вище. CD40 грає важливу роль в імунологічних реакціях, очікується, що інгібування зв'язування CD40 з його лігандами привело б до розробки терапевтичних засобів для придушення імунітету при трансплантації органів і аутоімунних захворюваннях. Sawada, Hase і інші повідомляли, що периферична кров пацієнтів, страждаючих хворобою Крона, має більш високий процентний вміст моноцитів з високою експресією CD40. Однак ще не було досить відомо, що такі антитіла інгібують зв'язування CD40 з його лігандами. Ці інгібіторні антитіла були б корисні при функціональному аналізі CD40 і лікуванні захворювань, які вимагають активації CD40. Передбачається, що інгібіторні 93027 6 антитіла до CD40 лігандів також ефективні проти захворювань, що включають зв'язування CD40 з лігандами CD40. Однак повідомлялося, що CD40L експресований в активованих тромбоцитах (V. Henn et al., Nature 391: 591, 1998), і якщо антиCD40L антитіло використовується як терапевтичний засіб, за повідомленнями, може відбуватися утворення тромбів (Т. Kawai et al., Nat. Med. 6: 114, 2000). З цієї точки зору, очікується, що антитіла до CD40 безпечніше, ніж анти-CD40L антитіла, як терапевтичний засіб у вигляді антитіл для інгібування зв'язування CD40 з його лігандами. AнтиCD40 антитіла були б потрібні для інгібування зв'язування CD40L з CD40, але без активації самого CD40. Такі антагоністичні анти-CD40 антитіла можна використати для лікування аутоімунних захворювань і придушення імуногенних відторгнень трансплантатів органів, кісткового мозку, і т.д., в зв'язку з їх описаними вище функціями. Анти-CD40 антитіла з перевершуючою антагоністичною активністю описані в WO 02/088186. Ілюстративним прикладом цих антагоністичних антитіл є антитіло 4D11. Гібридома 4D11, що продукує антитіло 4D11, була представлена 27 вересня 2001 г для міжнародного депонування відповідно до Будапештського договору в Міжнародний депозитарій патентних організмів в Національному інституті просуненої промислової науки і технології (central 6, 1-1, Higashi 1, Tsukuba, Ibaraki, Japan). Номером доступу с FERM BP-7758. Патентний документ 1 WO 02/088186 Опис винаходу Метою винаходу є створення мутантів з потенційно терапевтичних анти-CD40 антитіл, розкритих в WO 02/088186, причому мутанти оптимально сконструйовані для використання як терапевтичні засоби. Внаслідок екстенсивних і інтенсивних досліджень, заявники успішно розробили нові мутанти агоністичних і антагоністичних антитіл, причому мутанти можуть надавати більш виражений терапевтичний ефект проти захворювань, ніж відомі анти-CD40 антитіла, і на їх основі створили даний винахід. Основний задум модифікації анти-CD40 антитіл відповідно до даного винаходу буде детально описаний нижче. Даний опис включає текст опису і/або креслення заявки на патент Японії (Kоkаі) № 2003431408, яка є основою пріоритету даної заявки. Короткий опис креслень На Фіг. 1А-1 показані пептиди сайта зв'язування, отримані на основі послідовності CD40, з якими зв'язуються анти-CD40 агоністичні антитіла; На Фіг. 1А-2 показані пептиди сайта зв'язування, отримані на основі послідовності CD40, з якими зв'язуються анти-CD40 агоністичні антитіла (продовження Фіг. 1А-1); На Фіг. 1В-1 показані пептиди сайта зв'язування, отримані на основі послідовності CD40, з якими зв'язуються анти-CD40 антагоністичні антитіла; На Фіг. 1В-2 показані пептиди сайта зв'язування, отримані на основі послідовності CD40, з якими зв'язуються анти-CD40 антагоністичні антитіла (продовження Фіг. 1В-1); 7 Фіг. 2А ілюструє зв'язування анти-CD40 антитіл з мутантом CD40; Фіг. 2В ілюструє зв'язування анти-CD40 антитіл з мутантом CD40; Фіг. 2С ілюструє зв'язування анти-CD40 антитіл з мутантом CD40; На Фіг. 3А показані графіки, вказуючі на те, що антитіло КМ341-1-19, що має мутацію P331S, також активне як вихідне антитіло КМ341-1-19, відносно зв'язування з клітинами Ramos; На Фіг. 3В показані графіки, вказуючі на те, що антитіло КМ341-1-19, що має мутацію P331S, також активне як вихідне антитіло КМ341-1-19, відносно посилення експресії CD95 клітинами Ramos; На Фіг. 4А показані графіки, вказуючі на те, що антитіло КМ341-1-19, що має мутацію P331S, володіє більш низькою активністю CDC за допомогою кролячого комплементу; На Фіг. 4В показані графіки, вказуючі на те, що антитіло G2/4 має більш низьку активність комплементу при використанні людського комплементу; На Фіг. 5А-1 показані графіки, вказуючі на те, що перетворення підкласу антитіла 2105 з IgG2 в інші підкласи не надає ефекту на його зв'язування з клітинами Ramos; На Фіг. 5А-2 показані графіки, вказуючі на те, що перетворення підкласу антитіла RV341-1-19 з lgG2 в інші підкласи не надає ефекту на його зв'язування з клітинами Ramos; На Фіг. 5В-1 показані графіки, вказуючі на те, що перетворення підкласу антитіла 2105 з IgG2 в інші підкласи знижує активність для посилення експресії CD95 клітинами Ramos; На Фіг. 5В-2 показані графіки, вказуючі на те, що перетворення підкласу антитіла КМ341-1-19 з IgG2 в інші підкласи знижує активність для посилення експресії CD95 клітинами Ramos; На Фіг. 6А-1 показані графіки, вказуючі на те, що здатність зв'язування антитіл КМ341-1-19 з клітинами Ramos незалежна від структури шарнірної області, що міняється; На Фіг. 6А-2 показані графіки, вказуючі на те, що здатність зв'язування антитіл 2105 з клітинами Ramos незалежна від структури шарнірної області, що міняється; На Фіг. 6В-1 показані графіки, вказуючі на те, що верхній і середній шарніри шарнірної області важливі для активності антитіл КМ341-1-19 для посилення експресії CD95 клітинами Ramos; На Фіг. 6В-2 показані графіки, вказуючі на те, що верхній і середній шарніри шарнірної області важливі для активності антитіл 2105 для посилення експресії CD95 клітинами Ramos; На Фіг. 7А показані графіки, вказуючі на те, що перетворення підкласу антитіла F72 в IgG2 не надає ефекту на його зв'язування з клітинами Ramos; На Фіг. 7В показані графіки, вказуючі на те, що перетворення підкласу антитіла F72 в IgG2 підвищує активність для посилення експресії CD95 клітинами Ramos; На Фіг. 8А показані графіки, вказуючі на те, що перетворення підкласу антитіла 4D11 з lgG1 в 93027 8 IgG4 не надає ефекту на його зв'язування з клітинами Ramos; На Фіг. 8В показані графіки, вказуючі на те, що перетворення підкласу антитіла 4D11 з lgG1 в IgG4 інгібує посилення лігандом CD40 експресії CD95 клітинами Ramos в такій же мірі як і в інших випадках; На Фіг. 9 показані графіки, вказуючі на те, що перетворення підкласу антитіла 4D11 з lgG1 в IgG4 або IgG4PE знижує активність ADCC; На Фіг. 10 показані графіки, вказуючі на те, що перетворення підкласу антитіла 4D11 з lgG1 в IgG4P знижує активність CDC; Фіг. 11 ілюструє зміну кількості в клітин в крові (В220-позитивні клітини серед лімфоцитів периферичної крові) з течією часу після введення 4D11G1, 4D11G4P, або 4D11G4PE мишам, трансгенним у відношенні людського CD40; Фіг. 12 ілюструє більш високу експресію CD23 В клітин селезінки (CD23-позитивні клітини серед В клітин селезінки) після того як кожне анти-CD40 антитіло було введено мишам, трансгенним у відношенні людського CD40; Фіг. 12В ілюструє більш високу експресію CD86 В клітинами селезінки (CD86-позитивні клітини серед В клітин селезінки) після того як кожне анти-CD40 антитіло було введено мишам, трансгенним у відношенні людського CD40; Фіг. 12С ілюструє більш високу експресію CD95 В клітинами селезінки (CD95-позитивні клітини серед В клітин селезінки) після того як кожне анти-CD40 антитіло було введено мишам, трансгенним у відношенні людського CD40; Фіг. 13А ілюструє переважну активність 4D11 і 281-1-10 відносно продукції антиген-специфічних антитіл (lgG1) у мишей, трансгенних у відношенні людського CD40; Фіг. 13В ілюструє переважну активність 4D11 і 281-1-10 відносно продукції антиген-специфічних антитіл (IgM) у мишей, трансгенних у відношенні людського CD40; Фіг. 14А ілюструє кількість В клітин в крові (В220-позитивні клітини серед лімфоцитів периферичної крові) під час аналізу придушення активності продукції антиген-специфічних антитіл; Фіг. 14В ілюструє кількість В клітин селезінки (В220-позитивні клітини серед лімфоцитів селезінки) під час аналізу придушення активності продукції антиген-специфічних антитіл; Фіг. 15 ілюструє зміну кількості В клітин в крові (В220-позитивні клітини серед лімфоцитів периферичної крові) з течією часу після введення 4D11G4P або 4D11G4PE зеленим мавпам в дозі 30 мг/кг; Фіг. 16 ілюструє рівні IL-2 в крові під час аналізу, показаного на Фіг. 15; На Фіг. 17 показаний переважний вилив 4D11G4PE на DTH мавпи (гіперчутливість уповільненого типу у самців зелених мавп); На Фіг. 18 показані титри IgG проти правцевого токсину під час аналізу з результатами, показаними на Фіг. 17; На Фіг. 19 показані титри IgM проти правцевого токсину під час аналізу з результатами, показаними на Фіг. 17; 9 Фіг. 20А ілюструє відповідні впливи 4D11G4PE і 5С8 (антитіло проти ліганда CD40) на агрегацію тромбоцитів; На Фіг. 20В показані відповідні впливи 4D11G4PE і 5С8 (антитіло проти ліганда CD40) на агрегацію тромбоцитів; Фіг. 21 ілюструє зміни вмісту олігомера 4D11G4P, 4D11G4PE, 4DllG2Ser або 4D11G4/2/4 з течією часу після його інкубації при рН 2,7 і 37°С; Фіг. 22 ілюструє придушення відторгання шкіряних трансплантатів анти-CD40 антагоністичним антитілом; Фіг. 23 ілюструє зміну об'єму пухлини з течією часу після імплантації клітин у випадку, коли 341G2Ser був введений ураженим пухлиною мишам з імплантованими в них клітинами Ramos; Фіг. 24 ілюструє зміну об'єму пухлини з течією часу після імплантації клітин у випадку, коли 341G2Ser був введений ураженим пухлиною мишам з імплантованими в них клітинами Т24; Фіг. 25 ілюструє зміну об'єму пухлини з течією часу після імплантації клітин у випадку, коли 341G2Ser був введений ураженим пухлиною мишам з імплантованими в них клітинами Hs 766T; і Фіг. 26 ілюструє зміну об'єму пухлини з течією часу після імплантації клітин у випадку, коли 341G2Ser був введений ураженим пухлиною мишам з імплантованими в них клітинами Сараn-2. Кращий спосіб здійснення винаходу 1. Модифікація агоністичних антитіл Антитіла являють собою по суті молекули, які функціонують для захисту живих організмів проти чужорідних тіл, таких як мікроорганізми і віруси і рак, і, отже, вони можуть знищувати і виводити такі клітини, зв'язуючи їх з собою. Летальна активність складена з двох різних видів активності, які називаються антитіло-залежна клітинна цитотоксичність (що далі скорочено означається ADCC) і комплемент-залежна цитотоксичність (що далі скорочено означається CDC). ADCC відноситься до того типу цитотоксичності, яка індукується активацією макрофагів, клітин NK (природних кілeрів), нейтрофільних клітин і т.д., які розпізнають клітини-мішені зв'язуванням з константною областю антитіла за допомогою Fc рецепторів, що експресуються на їх поверхні. Навпаки, CDC відноситься до того типу цитотоксичності, яка індукується активацією системи комплементу, яка відбувається за допомогою зв'язування антитіла з антигеном. Відомо, що ці види активності варіюються в залежності від підкласу антитіла, що було виявлено внаслідок структурної відмінності константної області антитіл (Charles A. Janeway et al., Immunology, 1997, Current Biology Ltd./Garland Publishing Inc.)· Анти-CD40 агоністичні антитіла повинні бути більш переважними як терапевтичний засіб, якщо вони не володіють видами активності ADCC і/або CDC, які можуть викликати загибель клітин, що експресують CD40, з точки зору механізму імуноактивної дії. Якщо клітини, що експресують CD40, пошкоджені видами активності ADCC і/або CDC, може виникнути імуносупресія, а не бажана імуноактивація, що приводить до загострення захворювання. Крім того, у пацієнтів, страждаючих інфек 93027 10 ційними захворюваннями, можуть бути більш висока активність ADCC і/або CDC. Тому, коли такі антитіла застосовуються при інфекційних захворюваннях, необхідно більш уважно оцінити їх в плані безпеки, наприклад, використовуючи більш активні кролячі комплемента, чим ті, які присутні в сироватці або периферичній крові здорових людей, і які можуть не бути ефективними для виявлення вказаних вище видів активності в цій ситуації. Відповідно, були створені мутанти і рекомбінанти, які не володіли активністю ADCC або CDC, і були досліджені для виявлення їх активності. Оскільки відомо, що активності ADCC і/або CDC варіюються в залежності від підкласу цікавлячого антитіла, перетворення підкласу може знизити активність ADCC і/або CDC. Наприклад, для підкласів людського IgG, загалом відомо, що IgG4 являє собою підклас з низькою активністю і ADCC, і CDC, і повідомляється, що IgG2 володіє активністю CDC, але слабо активний в ADCC, в той час як lgG1 високо активний і в ADCC, і в CDC (Charles A. Janeway et al., Immunologi, 1997, Current Biology Ltd./Garland Publishing Inc.). Відбір певного підкласу шляхом використання переваги вказаних вище характеристик може створити менш цитотоксичне антитіло з вихідного антитіла. Комбінація специфічного підкласу антитіла з такою крапковою мутацією, як описано нижче, може створити антитіло з необхідною активністю. Крім того, за повідомленнями, зниження активності ADCC і/або CDC антитіла досягається включенням мутації з його константну область. Наприклад, L235, D265, D270, K322, Р331 і Р329 (кожна алфавітна буква означає амінокислоту однобуквеним кодом, а кожне число означає індекс EU, запропонований Kabat et al. (Kabat et al., Sequences of proteins of Immunological Interest, 1991 Fifth edition); такі позначення будуть використовуватися далі) можуть грати важливу роль в активації комплементу людським IgG, і заміщення однієї з цих дільниць іншою амінокислотою може знизити активність CDC. Esohe E. Idusogie et. al. J. Immunol. 2000, 164:4178-4184, Yuanyuan Xu et. al. J. Biol. Chem. 1994, 269:34693474, Brekke, O. H. et. al. Eur. J. Immunol. 1994, 24:2542, Morgan, Α., et. al., Immunology 1995, 86:319, Lund, J., et. al., J. Immunol, 1996, 157:4963, Tao, M. H., et. al., J. Exp. Med. 1993, 178:661). Зокрема, заміщення D270, K322, P329 або P331 на А може знизити активність CDC. Заміщення Р331 на S або G може також викликати те ж саме. Вважають, що (Glu233-Ser239, Gly316-Lys338, Lys274-Arg301, Tyr407-Arg416, Asn297, Glu318, Leu234-Ser239, Asp265-Glu269, Asn297-Thr299 і Аlа327-Іlе332 беруть участь в зв'язуванні IgG з FcR (Duncan, A. R., Woof, J. M., Partridge, L. J., Burton, D. R., and Winter, G. (1988) Nature 332, 563-564, Gessner, J. E., Heiken, H., Tamm, Α., and Schmidt, R. E. (1998) Ann. Hematol. 76, 231-248, Gavin, Α., Hulett, M, and Hogarth. P. M. (1998) in The Immunoglobulin Receptors and Their Physiological and Pathological Roles in Immunity (van de Winkel, pp. 11-35, Kluwer Academic Publishers Group, Dordrecht, The Netherlands, Sautes, C. (1997) in Cell-mediated Effects of Immunoglobulins (Fridman, 11 W. H., and Sautes, C, eds), pp. 29-66, R. G. Landes Co., Austin, TX, Da'ron, M. (1997) Annu. Rev. Immunol. 15, 203-234, Canfield, S. M., and Morrison, S. L. (1991) J. Exp. Med. 173, 1483-1491, Chappel, M. S., Isenman, D. E., Everett, M., Xu, Y.-Y., Dorrington, K. J., and Klein, M. H. (1991) Proc. Natl. Acad. Sci. U.S.A. 88, 9036-9040, Woof, J. M., Partridge, L. J., Jefferis, R., and Burton, D. R. (1986) Моl. Immunol. 23, 319-330. Wines, B. D., Powell, M. S., Parren, Imunol. 164, 5313-5318), і, таким чином, включення мутації в одну з цих областей може знизити активність ADCC. Зокрема, заміщення L235 на Ε або G237 на А може знизити зв'язування IgG з FcR. Антитіло відповідно до даного винаходу має, щонайменше, одну мутацію амінокислот для зниження активності ADCC і/або CDC, переважно, 120, 1-17, 1-16, 1-15, 1-14, 1-13, 1-12, 1-11, 1-10, 1-9, 1-8, 1-7, 1-6, 1-5, 1-4, 1-3 або 1 або 2 мутації. Даний винахід виявив, що в деяких анти-CD40 антитілах шарнірна область IgG2 важлива в експресії їх високих агоністичних активностей. Очікується, що заміщення варіабельної області або константної області, за винятком шарнірної області, двійником з будь-якого іншого підкласу або включення в них точкової мутації не тільки спричинить зміну активності ADCC і/або CDC, але також збільшить продуктивність антитіла, його стійкість під час очищення і зберігання і його кінетику в крові. Для продукції препарату антитіла дуже важлива стійкість антитіла під час очищення і зберігання. Оскільки розроблені до цього часу антитіла відносяться головним чином до підкласу lgG1, то перетворення варіабельної області або константної області, крім шарнірної області, в послідовність, що походить з підкласу lgG1, буде також ефективна для поліпшення фізичних властивостей описаних вище анти-CD40 агоністичних антитіл. Даний винахід надає наступні мутанти агоністичних анти-CD40 антитіл і інших: 1) Важкий ланцюг моноклонального антитіла, що володіє агоністичною активністю, яке зв'язується з CD40, причому важкий ланцюг містить верхній шарнір і середній шарнір, отриманий з людського IgG2, і константну область, щонайменше, з однією амінокислотою, підданою делеції або заміщенню, або, щонайменше, з однією амінокислотою, доданою до неї, причому вказана делеція, заміщення або додання здатні збільшити або зменшити ADCC і/або CDC. 2) Важкий ланцюг за п.1, де константна область отримана з людського IgG. 3) Важкий ланцюг за п.2, де людський IgG являє собою людський lgG1. 4) Важкий ланцюг за п.2. де людський IgG являє собою людський IgG2. 5) Важкий ланцюг за п.2, де людський IgG являє собою людський IgG3. 6) Важкий ланцюг за п.2, де людський IgG являє собою людський IgG4. 7) Важкий ланцюг за будь-яким з пп.3-5, де вказане заміщення амінокислот в константній області являє собою заміщення проліну серином в 93027 12 положенні 331, яке позначене індексом EU, як у Kabat et al. 8) Моноклональне антитіло, що містить важкий ланцюг відповідно до будь-якого з пп.1-7. 9) Важкий ланцюг за будь-яким з пп.1-7, де важкий ланцюг містить варіабельну область з важкого ланцюга моноклонального антитіла, що продукується гібридомою КМ341-1-19 (№ доступу FERM ВР-7759). 10) Моноклональне антитіло, що складається з важкого ланцюга за п.9 і легкого ланцюга, що містить варіабельну область з легкого ланцюга моноклонального антитіла, що продукується гібридомою КМ341-1-19 (№ доступу FERM ВР-7759). 11) Важкий ланцюг за будь-яким з пп.1-7, де важкий ланцюг містить варіабельну область поліпептиду, представленого SEQ ID NO: 38. 12) Моноклональне антитіло, що складається з важкого ланцюга за п.11 і легкого ланцюга моноклонального антитіла, де легкий ланцюг містить варіабельну область поліпептиду, представленого SEQ ID NO: 40. 13) Важкий ланцюг за п.1, де важкий ланцюг складається з частини, що залишилася, отриманої видаленням сигнальної послідовності поліпептиду, представленої SEQ ID NO: 132. 14) Моноклональне антитіло, що складається з важкого ланцюга за п.13 і легкого ланцюга моноклонального антитіла, де легкий ланцюг складається з частини, що залишилася, отриманої видаленням сигнальної послідовності поліпептиду, представленої SEQ ID NO: 134. 15) Важкий ланцюг за п.1, де важкий ланцюг продукується хазяїном, що містить вектор експресії, що має иолінуклеотид, представлений SEQ ID NO: 131. 16) Моноклональне антитіло за п.8, де моноклональне антитіло продукується хазяїном, що містить вектор експресії, який має полінуклеотид, представлений SEQ ID NO: 131, і полінуклеотид, представлений SEQ ID NO: 133. 17) Важкий ланцюг за будь-яким з пп.1-7, де важкий ланцюг містить варіабельну область з важкого ланцюга моноклонального антитіла, що продукується гібдридомою 2105 (№ доступу FERM BP-8024). 18) Моноклональне антитіло, що складається з важкого ланцюга за п.17 і легкого ланцюга, що містить варіабельну область з легкого ланцюга моноклонального антитіла, що продукується гібридомою 2105 (№ доступу FERM ВР-8024). 19) Важкий ланцюг за будь-яким з пп.1-7, де важкий ланцюг містить варіабельну область поліпептиду, представленого SEQ ID NO: 42. 20) Моноклональне антитіло, що складається з важкого ланцюга за п.19 і легкого ланцюга моноклонального антитіла, де легкий ланцюг містить варіабельну область поліпептиду, представленого SEQ ID NO: 44. 21) Важкий ланцюг за п.1, де важкий ланцюг складається з частини, що залишилася, отриманої видаленням сигнальної послідовності поліпептиду, представленої SEQ ID NO: 136. 22) Моноклональне антитіло, що складається з важкого ланцюга за п.21 і легкого ланцюга монок 13 лонального антитіла, де легкий ланцюг складається з частини, що залишилася, отриманої видаленням сигнальної послідовності поліпептиду, представленої SEQ ID NO: 138. 23) Важкий ланцюг за п.1, де важкий ланцюг продукується хазяїном, що містить вектор експресії, що має полінуклеотид, представлений SEQ ID NO: 135. 24) Моноклональне антитіло за п.8, де моноклональне антитіло продукується хазяїном, що містить вектор експресії, що має полінуклеотид, представлений SEQ ID NO: 135, і полінуклеотид, представлений SEQ ID NO: 137. 25) Полінуклеотид, представлений SEQ ID NO: 131. 26) Полінуклеотид, представлений SEQ ID NO: 133. 27) Вектор експресії, що має полінуклеотид за п.25. 28) Вектор експресії, що має полінуклеотид за п.26. 29) Вектор експресії, що має полінуклеотиди по пп.25 і 26. 30) Хазяїн, що містить вектор експресії за п.27. 31) Хазяїн, що містить вектор експресії за п.28. 32) Хазяїн, що містить вектор експресії за п.29. 33) Спосіб отримання важкого ланцюга моноклонального антитіла, що передбачає стадії культивування хазяїна за п.30 в культуральному середовищі і отримання важкого ланцюга мопоклонального антитіла з культури і/або хазяїна. 34) Спосіб отримання моноклонального антитіла, що передбачає стадії культивування хазяїна за п.32 в культуральному середовищі і отримання моноклонального антитіла з культури і/або хазяїна. 35) Полінуклеотид, представлений SEQ ID NO: 135. 36) Полінуклеотид, представлений SEQ ID NO: 137. 37) Вектор експресії, що має полінуклеотид за п.35. 38) Вектор експресії, що має полінуклеотид за п.36. 39) Вектор експресії, що має полінуклеотиди за пп.35 і 36. 40) Хазяїн, що містить вектор експресії за п.37. 41) Хазяїн, що містить вектор експресії за п.38. 42) Хазяїн, що містить вектор експресії за п.39. 43) Спосіб отримання важкого ланцюга моноклонального антитіла, що передбачає стадії культивування хазяїна за п.40 в культуральному середовищі і отримання важкого ланцюга моноклонального антитіла з культури і/або хазяїна. 44) Спосіб отримання моноклонального антитіла, що передбачає стадії культивування хазяїна за п.42 в культуральному середовищі і отримання моноклонального антитіла з культури і/або хазяїна. 45) Спосіб отримання важкого ланцюга моноклонального антитіла, що має агоністичну активність, здатного зв'язувати CD40, що передбачає стадію заміщення верхнього шарніра і середнього 93027 14 шарніра антитіла, які не є ні верхнім шарніром, ні середнім шарніром, отриманим з людського IgG2, верхнім шарніром і середнім шарніром, отриманим відповідно з людського IgG2. 46) Спосіб отримання важкого ланцюга моноклонального антитіла, що містить варіабельну область і верхній шарнір і середній шарнір, отримані з людського IgG2, що передбачає стадію ідентифікації поліпептиду, створюючого варіабельну область, яка походить з важкого ланцюга моноклонального антитіла, здатного зв'язувати CD40. 47) Спосіб отримання моноклонального антитіла, що має агоністичну активність, здатного зв'язувати CD40, що передбачає стадію заміщення верхнього шарніра і середнього шарніра антитіла, які не є ні верхнім шарніром, ні середнім шарніром, отриманим з людського IgG2, верхнім шарніром і середнім шарніром, отриманим відповідно з людського IgG2. 48) Спосіб отримання моноклонального антитіла, що містить варіабельну область і верхній шарнір і середній шарнір, отримана з людського IgG2, що передбачає стадію ідентифікації поліпептиду, створюючого варіабельну область, яка відбувається з важкого ланцюга моноклонального антитіла, здатного зв'язуватися з CD40. 49) Фармацевтична композиція, що містить моноклональне антитіло за п.8, 10, 12, 14, 16, 18, 20, 22 або 24 як активний інгредієнт. 50) Фармацевтична композиція за п.49, що використовується для профілактики або лікування злоякісних пухлин, захворювань, викликаних патогенами або аутоімунних захворювань. 51) Спосіб профілактики або лікування злоякісних пухлин, захворювань, викликаних патогенами або аутоімунних захворювань, що передбачає введення ссавцеві фармацевтичної композиції за п.49. 52) Застосування моноклонального антитіла за пп.8, 10, 12, 14, 16, 18, 20, 22 або 24 для отримання фармацевтичної композиції, що використовується для профілактики або лікування злоякісних пухлин, захворювань, викликаних патогенами або аутоімунних захворювань. 89) Полінуклеотид, що отримується видаленням частини, що кодує сигнальну послідовність з полінуклеотиду. представленого SEQ ID NO: 131. 90) Полінуклеотид, що отримується видаленням частини, що кодує сигнальну послідовність з полінуклеотиду, представленого SEQ ID NO: 133. 91) Полінуклеотид, що отримується видаленням частини, що кодує сигнальну послідовність з полінуклеотиду, представленого SEQ ID NO: 135. 92) Полінуклеотид, що отримується видаленням частини, що кодує сигнальну послідовність з полінуклеотиду, представленого SEQ ID NO: 137. Даний винахід надає антитіло, отримане модифікацією агоністичного анти-CD40 антитіла, що відноситься до людського IgG2, причому модифіковане антитіло являє собою мутант, що має константну область, виключаючи верхній і середній шарніри, заміщену послідовністю, отриманою з іншого підкласу. Цей підклас являє собою переважно lgG1. Даний винахід надає антитіло, отримане модифікацією агоністичного анти-CD40 антитіла, 15 що відноситься до людського IgG2, причому модифіковане антитіло являє собою мутант, що має константну область, виключаючи область шарніра, заміщену послідовністю, отриманою з іншого підкласу. Цей підклас являє собою переважно lgG1. У даному описі зниження активностей ADCC і CDC означає зниження цих видів активності, в порівнянні з відповідними активностями антиCD40 моноклонального антитіла, відмінного від описаних вище мутантів, наприклад, в порівнянні з відповідною активністю моноклонального антитіла, що продукується гібридомою КМ341-1-19 (№ доступу FERM ВР-7759) або 2105 (№ доступу FERM ВР-8024). Активності ADCC і CDC можна оцінити будь-яким відомим способом, наприклад, способом, описаним тут в розділі «Приклади». Нижче будуть представлені послідовності варіабельних областей у важкому і легкому ланцюгах моноклонального антитіла, які продукуються гібридомою КМ341-1-19 (№ доступу FERM ВР-7759) або 2105 (№ доступу FERM ВР-8024). Нижче буду представлена ДНК, що кодує варіабельні області в легкому і важкому ланцюгах антитіла КМ341-1-19, і амінокислотні послідовності важкого і легкого ланцюгів. У нуклеотидній послідовності важкого ланцюга (SEQ ID NO: 37) антитіла КМ341-1-19 сигнальна послідовність починається з аденіну (А) в положенні 50. Кордон між сигнальною послідовністю і варіабельною областю розташований між «аденіном» [А] в положенні 109 і цитозином (С) в положенні 110, а кордон між варіабельною областю і константною областю розташований між аденіном (А) в положенні 493 і гуаніном (G) в положенні 494 (використали програмне забезпечення генного прогнозування (Signal Ρ ver.2). В амінокислотній послідовності важкого ланцюга (SEQ ID NO: 38) антитіла КМ341-1-19 кордон між сигнальною послідовністю і варіабельною областю розташована між серином (S) в положенні 20 і глутаміном (Q) в положенні 21, а кордон між 93027 16 варіабельною областю і константною областю розташований між серином (S) в положенні 148 і аланіном (А) в положенні 149. Відповідно, варіабельна область у важкому ланцюгу антитіла КМ341-1-19 має нуклеотидну послідовність в діапазоні від цитозину (С) в положенні 110 до аденіну (А) в положенні 493, як видно в SEQ ID NO: 37. Крім того, варіабельна область у важкому ланцюгу антитіла КМ341-1-19 має амінокислотну послідовність в діапазоні від глутаміну (Q) в положенні 21 до серину (S) в положенні 148, як видно в SEQ ID NO: 38. У нуклеотидної послідовності легкого ланцюга (SEQ ID NO: 39) антитіла КМ341-1-19 сигнальна послідовність починається з аденіну (А) в положенні 29. Кордон між сигнальною послідовністю і варіабельною областю розташований між «аденіном» [А] в положенні 88 і гуаніном (G) в положенні 89, а кордон між варіабельною областю і константною областю розташований між аденіном (А) в положенні 400 і «цитозином» (С) в положенні 401 (використали програмне забезпечення генного прогнозування (Signal Ρ ver.2). В амінокислотній послідовності легкого ланцюга (SEQ ID NO: 40) антитіла КМ341-1-19 кордон між сигнальною послідовністю і варіабельною областю розташовується між гліцином (G) в положенні 20 і глутаміновою кислотою (Е) в положенні 21, а кордон між варіабельною областю і константною областю розташований між лізином (К) в положенні 124 і «аргініном» [(R)] в положенні 125. Відповідно, варіабельна область в легкому ланцюгу антитіла КМ341-1-19 має нуклеотидну послідовність в діапазоні від гуаніну (G) в положенні 89 до аденіну (А) в положенні 400, як видно в SEQ ID NO: 39. Крім того, варіабельна область в легкому ланцюгу антитіла КМ341-1-19 має амінокислотну послідовність в діапазоні від глутамінової кислоти (Е) в положенні 21 до лізину (К) в положенні 124, як видно в SEQ ID NO: 40. 17 93027 18 19 Нижче буде представлена ДНК, що кодує варіабельні області в легкому і важкому ланцюгах антитіла 2105, і амінокислотні послідовності важкого і легкого ланцюгів. У нуклеотидній послідовності важкого ланцюга (SEQ ID NO: 41) антитіла 2105 сигнальна послідовність починається з аденіну (А) в положенні 70. Кордон між сигнальною послідовністю і варіабельною областю розташований між «тимином» [Т] в положенні 126 і гуанином (G) в положенні 127, а кордон між варіабельною областю і константною областю розташований між аденіном (А) в положенні 495 і гуаніном (G) в положенні 496 (використали програмне забезпечення генного прогнозування (Signal Ρ ver.2). В амінокислотній послідовності важкого ланцюга (SEQ ID NO: 42) антитіла 2105 кордон між сигнальною послідовністю і варіабельною областю розташований між цистеїном (С) в положенні 19 і глутаміновою кислотою (Е) в положенні 20, а кордон між варіабельною областю і константною областю розташований між серином (S) в положенні 142 і аланіном (А) в положенні 143. Відповідно, варіабельна область у важкому ланцюгу антитіла 2105 має нуклеотидну послідовність в діапазоні від гуаніну (G) в положенні 127 до аденіну (А) в положенні 495, як видно в SEQ ID NO: 41. Крім того, варіабельна область у важкому ланцюгу антитіла 2105 має амінокислотну послідовність в діапазоні від глутамінової кислоти (Е) в положенні 20 до серину (S) в положенні 142, як видно в SEQ ID NO:42. 93027 20 У нуклеотидній послідовності легкого ланцюга (SEQ ID NO: 43) антитіла 2105 сигнальна послідовність починається з аденіну (А) в положенні 28. Кордон між сигнальною послідовністю і варіабельною областю розташований між «аденіном» ([А]) в положенні 87 і гуаніном (G) в положенні 88, а кордон між варіабельною областю і константною областю розташований між аденіном (А) в положенні 405 і «цитозином» [(С)] в положенні 406 (використали програмне забезпечення генного прогнозування (Signal Ρ ver.2). В амінокислотній послідовності легкого ланцюга (SEQ ID NO: 44) антитіла 2105 кордон між сигнальною послідовністю і варіабельною областю розташований між гліцином (G) в положенні 20 і глутаміновою кислотою (Е) в положенні 21, а кордон між варіабельною областю і константною областю розташований між лізином (К) в положенні 126 і «аргініном» [(R)] в положенні 127. Відповідно, варіабельна область в легкому ланцюгу антитіла 2105 має нуклеотидну послідовність в діапазоні від гуаніну (G) в положенні 88 до аденіну (А) в положенні 405, як видно в SEQ ID NO: 43. Крім того, варіабельна область в легкому ланцюгу антитіла 2105 має амінокислотну послідовність в діапазоні від глутамінової кислоти (Е) в положенні 21 до лізину (К) в положенні 126. як видно в SEQ ID NO:44. Нуклеотидна послідовність важкого ланцюга (SEQ ID NO: 41) антитіла 2105: 21 У нуклеотидній послідовності важкого ланцюга (SEQ ID NO: 131) 341G2Ser кордон між сигнальною послідовністю і варіабельною областю розташований між «аденіном» ([А]) в положенні 60 і цитозином (С) в положенні 61, а кордон між варіабельною областю і константною областю розташований між аденіном (А) в положенні 444 і гуаніном (G) в положенні 445 (використали програмне забезпечення генного прогнозування (Signal Ρ ver.2). В амінокислотній послідовності важкого ланцюга (SEQ ID NO: 132) 341G2Ser кордон між сигнальною послідовністю і варіабельною областю розташований між серином (S) в положенні 20 і 93027 22 глутаміном (Q) в положенні 21, а кордон між варіабельною областю і константною областю розташований між серином (S) в положенні 148 і аланіном (А) в положенні 149. Відповідно, варіабельна область у важкому ланцюгу 341G2Ser має нуклеотидну послідовність в діапазоні від цитозину (С) в положенні 61 до аденіну (А) в положенні 444, як видно в SEQ ID NO: 131. Крім того, варіабельна область у важкому ланцюгу 341G2Ser має амінокислотну послідовність в діапазоні від глутаміну (Q) в положенні 21 до серину (S) в положенні 148, як видно в SEQ ID NO: 132. 23 У нуклеотидній послідовності легкого ланцюга (SEQ ID NO: 133) 341G2Ser кордон між сигнальною послідовністю і варіабельною областю розташований між «аденіном» ([А]) в положенні 60 і гуаніном (G) в положенні 61, а кордон між варіабельною областю і константною областю розташований між аденіном (А) в положенні 372 і «цитозином» ([С]) в положенні 373 (використали програмне забезпечення генного прогнозування (Signal Ρ ver.2). В амінокислотній послідовності легкого ланцюга (SEQ ID NO: 134) 341G2Ser кордон між сигнальною послідовністю і варіабельною областю розташований між гліцином (G) в положенні 20 і 93027 24 глутаміновою кислотою (Е) в положенні 21, а кордон між варіабельною областю і константною областю розташований між лізином (К) в положенні 124 і «аргініном» ([R]) в положенні 125. Відповідно, варіабельна область в легкому ланцюгу 341G2Ser має нуклеотидну послідовність в діапазоні від гуаніну (G) в положенні 61 до аденіну (А) в положенні 372, як видно в SEQ ID NO: 133. Крім того, варіабельна область в легкому ланцюгу 341G2Ser має амінокислотну послідовність в діапазоні від глутамінової кислоти (Е) в положенні 21 до лізину (К) в положенні 124, як видно в SEQ ID NO: 134. 25 У нуклеотидній послідовності важкого ланцюга (SEQ ID NO: 135) 2105G2Ser кордон між сигнальною послідовністю і варіабельною областю розташований між «тиміном» ([Т]) в положенні 57 і гуаніном (G) в положенні 58, а кордон між варіабельною областю і константною областю розташований між аденіном (А) в положенні 426 і гуаніном (G) в положенні 427 (використали програмне забезпечення генного прогнозування (Signal Ρ ver.2). В амінокислотній послідовності важкого ланцюга (SEQ ID NO: 136) 2105G2Ser кордон між сигнальною послідовністю і варіабельною областю розташований між цистеїном (С) в положенні 93027 26 19 і глутаміновою кислотою (Е) в положенні 20, а кордон між варіабельною областю і константною областю розташований між серином (S) в положенні 142 і аланіном (А) в положенні 143. Відповідно, варіабельна область у важкому ланцюгу 2105G2Ser має нуклеотидну послідовність в діапазоні від гуаніна (G) в положенні 58 до аденіну (А) в положенні 426, як видно в SEQ ID NO: 135. Крім того, варіабельна область у важкому ланцюгу 2105G2Ser має амінокислотну послідовність в діапазоні від глутамінової кислоти (Е) в положенні 20 до серину (S) в положенні 142, як видно в SEQ1DN0: 136. 27 У нуклеотидній послідовності легкого ланцюга (SEQ ID NO: 137) 2105G2Ser кордон між сигнальною послідовністю і варіабельною областю розташований між «аденіном» ([А]) в положенні 60 і гуаніном (G) в положенні 61, а кордон між варіабельною областю і константною областю розташований між аденіном (А) в положенні 378 і «цитозином» ([С]) в положенні 379 (використали програмне забезпечення генного прогнозування (Signal Ρ ver.2). В амінокислотній послідовності легкого ланцюга (SEQ ID NO: 138) 2105G2Ser кордон між сигнальною послідовністю і варіабельною областю розташований між гліцином (G) в положенні 93027 28 20 і глутаміновою кислотою (Е) в положенні 21, а кордон між варіабельною областю і константною областю розташований між лізином (К) в положенні 126 і «аргініном» ([R]) в положенні 127. Відповідно, варіабельна область в легкому ланцюгу 2105G2Ser має нуклеотидну послідовність в діапазоні від гуаніну (G) в положенні 61 до аденіну (А) в положенні 378, як видно в SEQ ID NO: 137. Крім того, варіабельна область в легкому ланцюгу 2105G2Ser має амінокислотну послідовність в діапазоні від глутамінової кислоти (Е) в положенні 21 до лізину (К) в положенні 126, як видно в SEQ ID NO: 138. 29 2. Модифікація антагоністичних антитіл Анти-CD40 антагоністичні антитіла будуть більш переважні як терапевтичний засіб, також як агоністичні антитіла, якщо з точки зору механізму дії вони не будуть володіти активністю ADCC і/або CDC. Крім того, важливо, щоб анти-CD40 антагоністичні антитіла не володіли активністю індукції сигналів їх поперечною зшивкой in vivo через рецептори Fc, навіть якщо активність ADCC не можна виявити. Іншими словами, необхідно підтвердити, що вони не активують імунітет, і такі активні антитіла можуть бути бажані як фармацевтичний засіб. Анти-CD40 антагоністичні антитіла перспективні як терапевтичні засоби для лікування аутоімунних захворювань або придушення відторгнення при трансплантації органів. Якщо вони індукують агоністичну активність внаслідок деякого ефекту після їх введення пацієнтам, навіть якщо вона слаба, на відміну від бажаного лікувального ефекту, симптоми можуть посилитися. Таким чином, антитіло без агоністичиої активності більш переважне як фармацевтичний засіб. У даному винаході було продемонстровано, що включення точкової мутації L235E (означає заміщення L в положенні 235 на Е; аналогічні позначення будуть використовуватися надалі) в IgG4 ефективне для зниження агоністичної активності in vivo в тесті на тваринах з використанням мавп. Хоч IgG4 являє собою підклас з низькою активністю ADCC і CDC, повідомляється, що коли робилася спроба експресувати IgG4 у вигляді рекомбінантного білка в клітинах, подібних до СНО, то секретувалися його напівмолекули внаслідок неміцного S-S зв'язування між важкими ланцюгами (Rob С. Aalberse et al., 93027 30 Immunology, 105, 9-19, 2002). Для подолання цієї проблеми включення мутації в константну область антитіл, за повідомленнями, успішно сприяє формуванню S-S зв'язування. Тому, цей тип мутації також оцінювали для визначення можливого його використання. Зокрема, була включена мутація, що полягає в заміщенні S в положенні 228 на Ρ (S. Angal et al., Molecyular Immunology, vol.30, no.1. 105-108, 1993). Для антагоністичних антитіл, також як для агоністичних антитіл, дуже важлива стійкість під час очищення і зберігання. Можуть бути деякі способи для створення таких антитіл, які фізично краще, в той же час зберігають антагоністичну активність. Лікарські засоби, що пропонувалися в продажу до цього часу у вигляді антитіл, відносяться головним чином до підкласу lgG1, і немає повідомлень про проблеми при їх включенні в фармацевтичні препаративні форми. На основі цих фактів, з точки зору фізичних властивостей може мати перевагу отримання константної області антитіл з lgG1. Однак у випадку анти-CD40 антитіл, бажано, щоб їх активності ADCC і CDC були нижче. Як наслідок, можуть бути бажані антитіла, що мають константну область типу lgG1, модифіковану якою-небудь точковою мутацією. Описані вище мутації можна використати для створення таких антитіл. Константна область типу lgG1 може стати такою, що має більш низькі активності ADCC і CDC при включенні в неї точкової мутації P331G. Спостерігається також, що включення точкової мутації L235E в IgG4 усуває незначну агоністичну активність in vivo для того, щоб зробити його більш фармацевтично активним, але це робить його фізично менш стійким 31 при низькому рН. Таким чином, заміщення L235 амінокислотою, відмінною від Е, може зробити її фізично більш функціональною. Що стосується антитіла 4D11, то воно дуже схоже на антитіло 2В11 відносно структури його варіабельної області. Антитіло 2В11 має більш низьку антагоністичну активність, але має більш високу стійкість при низькому рН, в порівнянні з антитілом 4D11. Якщо деякі амінокислоти, отримані з константної області 2В11 включити в антитіло 4D11 на основі вказаних вище властивостей, то 4D11 може стати більш стійким. Зокрема, точкова мутація L38V, P58R, G62W, І79М, K81Y, K87Y, S98A, K109R, V120M або Е124А у важкому ланцюгу або N75S в легкому ланцюгу або їх комбінація можуть бути ефективні для цієї мети. Зокрема, мутант, створений заміщенням L в положенні 38 у варіабельній області важкого ланцюга антитіла 4D11 на V (скорочено позначений як L38V; далі будуть використовуватися аналогічні позначення), мутант P58R, мутант G62W, мутант І79М. мутант K81Y, мутант H87Y, мутант S98A, мутант K109R, мутант V120M млм мутант Т124А або мутант N75S в легкому ланцюгу або їх комбінація для цієї мети можуть бути надані. Антитіло відповідно до даного винаходу має, щонайменше, одну мутацію амінокислот для зниження активності ADCC і/або CDC, переважно, 1-15, 1-13, 1-12, 1-11, 1-10, 1-9, 1-8, 1-7, 1-6, 15, 1-4, 1-3 або 1 або 2 мутації. Даний винахід надає наступні мутанти антагоністичних анти-CD40 антитіл і інші: 53) Важкий ланцюг моноклонального антитіла, що має антагоністичну активність, здатного зв'язуватися з CD40. причому важкий ланцюг містить константну область, щонайменше, з однією амінокислотою, підданою делеції або заміщенню, або, щонайменше, однією амінокислотою, доданою до неї, причому вказана делеція, заміщення або додання здатні збільшити або зменшити ADCC і/або CDC. 54) Важкий ланцюг за п.53, де константна область отримана з людського IgG. 55) Важкий ланцюг за п.54, де людський IgG являє собою людський lgG1. 56) Важкий ланцюг за п.54, де людський IgG являє собою людський IgG2. 57) Важкий ланцюг за п.54, де людський IgG являє собою людський IgG3. 58) Важкий ланцюг за п.54, де людський IgG являє собою людський IgG4. 59) Важкий ланцюг за будь-яким з пп. 55, 57 або 58, де вказане заміщення амінокислот в константній області являє собою заміщення лейцину глутаміновою кислотою в положенні 235, яке позначене індексом EU, як у Kabat et al. 60) Важкий ланцюг за будь-яким з пп. 53-58, де важкий ланцюг містить константну область, щонайменше, з однією амінокислотою, підданою делеції або заміщенню, або, щонайменше, однією амінокислотою, доданою до неї, причому вказана делеція, заміщення або додання здатні сприяти утворенню зв'язку S-S між важкими ланцюгами. 93027 32 61) Важкий ланцюг антитіла за п.60. де вказане заміщення амінокислот в константній області являє собою заміщення серину проліном в положенні 228, яке позначене індексом EU, як у Kabat et al. 62) Моноклональне антитіло, що містить важкий ланцюг за будь-яким з пп.53-61. 63) Важкий ланцюг за будь-яким з пп.53-61, де важкий ланцюг містить варіабельну область з важкого ланцюга моноклонального антитіла, що продукується гібридомою 4D11 (№ доступу FERM ВР-7758). 64) Моноклональне антитіло, що містить важкий ланцюг за п.63 і легкий ланцюг, що містить варіабельну область з легкого ланцюга моноклонального антитіла, що продукується гібридомою 4D11 (№ доступу FERM ВР-7758). 65) Важкий ланцюг за будь-яким з пп.53-61, де важкий ланцюг містить варіабельну область поліпептиду, представленого SEQ ID NO: 46. 66) Моноклональне антитіло, що складається з важкого ланцюга за п.65 і легкого ланцюга моноклонального антитіла, де легкий ланцюг містить варіабельну область поліпептиду, представленого SEQ ID NO: 48. 67) Важкий ланцюг за п.53, причому важкий ланцюг складається з частини, що залишилася, отриманої видаленням сигнальної послідовності з поліпептиду, представленого SEQ ID NO: 140. 68) Моноклоиальне антитіло, що складається з важкого ланцюга за п.67 і легкого ланцюга моноклонального антитіла, де легкий ланцюг складається з частини, що залишилася, отриманої видаленням сигнальної послідовності з поліпептиду, представленого SEQ ID NO: 142. 69) Важкий ланцюг за и.53, де важкий ланцюг продукується хазяїном, що містить вектор експресії, який має полінуклеотид, представлений SEQ ID NO: 139. 70) Моноклональне антитіло за п.62, де моноклональне антитіло продукується хазяїном, що містить вектор експресії, що має полінуклеотид, представлений SEQ ID NO: 139, і полінуклеотид, представлений SEQ ID NO: 141. 71) Полінуклеотид, представлений SEQ ID NO: 139. 72) Полінуклеотид, представлений SEQ ID NO: 141. 73) Вектор експресії, що має полінуклеотид за п.71. 74) Вектор експресії, що має полінуклеотид за п.72. 75) Вектор експресії, що має полінуклеотиди за пп.71 і 72. 76) Хазяїн, що містить вектор експресії за п.73. 77) Хазяїн, що містить вектор експресії за н.74. 78) Хазяїн, що містить вектор експресії за п.75. 79) Спосіб отримання важкого ланцюга моноклонального антитіла, що передбачає стадії культивування хазяїна за п.76 в культуральному середовищі і отримання важкого ланцюга моноклонального антитіла з культури і/або хазяїна. 33 80) Спосіб отримання моноклонального антитіла, що передбачає стадії культивування хазяїна за п.78 в культуральному середовищі і отримання моноклонального антитіла з культури і/або хазяїна. 81) Фармацевтична композиція, що містить моноклональне антитіло за п.62, 64, 66, 68 або 70 як активний інгредієнт. 82) Фармацевтична композиція за п.81, що використовується для профілактики або лікування відторгнення трансплантату, аутоімунного захворювання, алергії або інгібування фактора VIII згортання крові. 83) Спосіб профілактики або лікування відторгнення трансплантату, аутоімунного захворювання, алергії або інгібування фактора VIII згортання крові, який передбачає введення ссавцеві фармацевтичної композиції за п.81. 84) Застосування моноклонального антитіла за пп.62, 64, 66, 68 або 70 для отримання фармацевтичної композиції, що використовується для профілактики або лікування відторгнення трансплантату, аутоімунного захворювання, алергії або інгібування фактора VIII згортання крові. 85) Спосіб отримання важкого ланцюга моноклонального антитіла, що має антагоністичну активність, здатного зв'язуватися з CD40, причому антагоністична активність знижена, що передбачає стадію отримання делеції або заміщення, щонайменше, однієї амінокислоти або додання, щонайменше, однієї амінокислоти в константній області важкого ланцюга людського антитіла. 86) Спосіб за п.85, де константна область отримана з людського IgG. 87) Спосіб за п.86, де людський IgG являє собою людський IgG4. 88) Спосіб за будь-яким з пп.85-87, де вказане заміщення амінокислот в константній області являє собою заміщення лейцину глутаміновою кислотою в положенні 235, яке позначене індексом EU, як у Kabat et al. 93) Полінуклеотид, отриманий видаленням частини, що кодує сигнальну послідовність з полінуклеотиду, представленого SEQ ID NO: 139. 94) Полінуклеотид, отриманий видаленням частини, що кодує сигнальну послідовність з полінуклеотиду, представленого SEQ ID NO: 141. Крім того, даний винахід надає представлені нижче матеріали. Мутант антагоністичного анти-CD40 антитіла, що містить, щонайменше, одне заміщення, вибране з групи, що складається із заміщення L на V в положенні 38, заміщення Ρ на R в положенні 58. заміщення G на W в положенні 62, заміщення І на Μ в положенні 79, заміщення K на Υ в положенні 81, заміщення Η на Υ в положенні 87, заміщення S на A в положенні 98, заміщення K на R в положенні 109, заміщення V на Μ в положенні 120 і заміщення Τ на А в положенні 124, причому всі заміщення здійснюються у варіабельній області важкого ланцюга моноклонального антитіла, що продукується гібридомою 4D11 (№ доступу FERM ВР-7758) і мутант антагоністичного анти-CD40 антитіла, що містить заміщення N на S в поло 93027 34 женні 75 у варіабельної області легкого ланцюга антитіла 4D11. Тут зниження активностей ADCC і CDC означає зниження цих активностей, в порівнянні з відповідними активностями анти-CD40 моноклонального антитіла, відмінного від описаних вище мутантів, наприклад, в порівнянні з відповідними активностями моноклонального антитіла, що продукується гібридомою 4D11 (№ доступу FERM ВР-7758). Активності ADCC і CDC можна аналізувати будь-яким відомим способом, наприклад, способом, описаним в розділі «Приклади» даного опису. Послідовності варіабельних областей у важкому і легкому ланцюгах моноклонального антитіла, яке продукується гібридомою 4D11 (№ доступу FERM ВР-7758), будуть представлені нижче. Нижче буде представлена ДНК, що кодує варіабельні області у важкому і легкому ланцюгах антитіла 4D11, і амінокислотні послідовності важкого і легкого ланцюгів. У нуклеотидній послідовності важкого ланцюга (SEQ ID NO: 45) антитіла 4D11 кордон між сигнальною послідовністю і варіабельною областю розташований між «цитозином» ([С]) в положенні 93 і цитозином (С) в положенні 94, а кордон між варіабельною областю і константною областю розташований між аденіном (А) в положенні 456 і гуаніном (G) в положенні 457 (використали програмне забезпечення генного прогнозування (Signal Ρ ver.2). В амінокислотній послідовності важкого ланцюга (SEQ ID NO: 46) антитіла 4D11 кордон між сигнальною послідовністю і варіабельною областю розташований між серином (S) в положенні 26 і глутаміном (Q) в положенні 27, а кордон між варіабельною областю і константною областю розташований між серином (S) в положенні 147 і аланіном (А) в положенні 148. Відповідно, варіабельна область у важкому ланцюгу антитіла 4D11 має нуклеотидну послідовність в діапазоні від цитозину (С) в положенні 94 до аденіну (А) в положенні 456, як видно в SEQ ID NO: 45. Крім того, варіабельна область у важкому ланцюгу антитіла 4D11 має амінокислотну послідовність в діапазоні від глутаміну (Q) в положенні 27 до серину (S) в положенні 147, як видно в SEQ ID NO: 46. У нуклеотидній послідовності легкого ланцюга (SEQ ID NO: 47) антитіла 4D11 кордон між сигнальною послідовністю і варіабельною областю розташований між «тиміном» ([Т]) в положенні 124 і гуаніном (G) в положенні 125, а кордон між варіабельною областю і константною областю розташований між аденіном (А) в положенні 442 і «цитозином» [(С)] в положенні 443 (використали програмне забезпечення генного прогнозування (Signal Ρ ver.2). В амінокислотній послідовності легкого ланцюга (SEQ ID NO: 48) антитіла 4D11 кордон між сигнальною послідовністю і варіабельною областю розташований між цитозином (С) в положенні 22 і аланіном (А) в положенні 23, а кордон між варіабельною областю і константною областю 35 93027 36 розташований між лізином (К) в положенні 128 і «аргініном [(R)] в положенні 129. Відповідно, варіабельна область в легкому ланцюгу антитіла 4D11 має нуклеотидну послідовність в діапазоні від гуаніну (G) в положенні 125 до аденіну (А) в положенні 442, як видно в SEQ ID NO: 47. Крім того, варіабельна область в легкому ланцюгу антитіла 4D11 має амінокислотну послідовність в діапазоні від аланіну (А) в положенні 23 до лізину (К) в положенні 128, як видно в SEQ ID NO: 48. У нуклеотидній послідовності важкого ланцюга (SEQ ID NO: 139) антитіла 4D11 G4PE кордон між сигнальною послідовністю і варіабельною областю розташований між «цитозином» ([С]) в положенні 78 і цитозином (С) в положенні 79, а кордон між варіабельною областю і константною областю розташований між аденіном (А) в положенні 441 і гуаніном (G) в положенні 442 (використали програмне забезпечення генного прогнозування (Signal Ρ ver.2). У амінокислотній послідовності важкого ланцюга (SEQ ID NO: 140) антитіла 4D11 кордон між сигнальною послідовністю і варіабельною областю розташований між серином (S) в положенні 26 і глутаміном (Q) в положенні 27. а кордон між варіабельною областю і константною областю розташований між серином (S) в положенні 147 і аланіном (А) в положенні 148. Відповідно, варіабельна область у важкому ланцюгу антитіла 4D11 має нуклеотидну послідовність в діапазоні від цитозину (С) в положенні 79 до аденіну (А) в положенні 441, як видно в SEQ ID NO: 139. Крім того, варіабельна область у важкому ланцюгу антитіла 4D11 має амінокислотну послідовність в діапазоні від глутаміну (Q) в положенні 27 до серину (S) в положенні 147, як видно в SEQ ID NO: 140. 37 У нуклеотидній послідовності легкого ланцюга (SEQ ID NO: 141) 4D11G4PE кордон між сигнальною послідовністю і варіабельною областю розташований між «тиміном» ([Т]) в положенні 66 і гуаніном (G) в положенні 67, а кордон між варіабельною областю і константною областю розташований між аденіном (А) в положенні 384 і «цитозином» ([С]) в положенні 385 (використали програмне забезпечення генного прогнозування (Signal Ρ ver.2). В амінокислотній послідовності легкого ланцюга (SEQ ID NO: 142) 4D11G4PE кордон між сигнальною послідовністю і варіабельною областю розташований між цитозином (С) в положенні 93027 38 22 і аланіном (А) в положенні 23, а кордон між варіабельною областю і константною областю розташований між лізином (К) в положенні 128 і «аргініном» ([R]) в положенні 129. Відповідно, варіабельна область в легкому ланцюгу 4D11G4PE має нуклеотидну послідовність в діапазоні від гуаніну (G) в положенні 67 до аденіну (А) в положенні 384, як видно в SEQ ID NO: 141. Крім того, варіабельна область в легкому ланцюгу антитіла 4D11 має амінокислотну послідовність в діапазоні від аланіну (А) в положенні 23 до лізину (К) в положенні 128, як видно в SEQ ID NO: 142. 39 3. Визначення Терміни, що використовуються тут, будуть визначені нижче. "CD40", описаний в даному винаході, відноситься до поліпептиду, що має амінокислотну послідовність, описану Е. A. Clark et al., Proc. Natl. Acad. Sci. USA 83: 4494, 1986, або I. Stamenkovic et al., EMBO J. 8: 1403, 1989, і, зокрема, до антигенного поліпептиду, що експресується на поверхні В клітин, DC, макрофагів, ендотеліальних клітин, епітеліальних клітин або пухлинних клітин, що походять з них. «Анти-CD40 антитіло» відноситься до будьякого моноклонального антитіла до експресованого клітинами CD40, CD40 повної довжини або CD40 неповної довжини. Крім того, «антитіло» винаходу походить з генів (які колективно називаються генами антитіла), що кодують варіабельну область важкого ланцюга і константну область важкого ланцюга, а також варіабельну область легкого ланцюга і константну область легкого ланцюга, які разом складають імуноглобулін. Людські імуноглобуліни поділяється на 5 різних класів, що складаються з IgG, IgA, IgM, IgD i IgE. Крім того, IgG складається з 4 різних підкласів, lgG1, IgG2, IgG3 і IgG4, тоді як IgA складається з 2 різних підкласів, IgA1 і IgA2, lgG1, IgG2, IgG3 i IgG4 розташовані в 14q32, 33 людських хромосом. Основна структура імуноглобуліну складена з двох гомологічних L ланцюгів (легких ланцюгів) і гомологічних Η ланцюгів (важких ланцюгів). Клас і підклас імуноглобуліну визначається його Η ланцюгами. Антитіло відповідно до даного ι винаходу може включати будьякий клас, будь-який підклас або будь-який ізотип імуноглобуліну. «Функціональний фрагмент» ан 93027 40 титіла за винаходом відноситься до частини (частковому фрагменту) визначеного вище антитіла, який активний одиночно або множинно на антигені до антитіла, включаючи, наприклад, F(ab')2, і Fab', Fab, Fv, стабілізований дисульфідом FV, одноланцюжковий FV (scFV) і його мультимер (D. J. King, Applications and Engineering of Monoclonal Antibodies, 1998, T. J. International Ltd.). До цього часу було відомо, що lgG1 включає J00228, Z17370 and Y14737, IgG2 включає J00230, AJ250170, AF449616, AF449617, AF449618, Z49802 і Z49801, IgG3 включає М12958, K01313, Х16110, Х99549, AJ390236. AJ390237, AJ390238, AJ390241, AJ390242, AJ390246, AJ390247, AJ390252, AJ390244, AJ390254, AJ390260, AJ390262, AJ390272, AJ390276 і AJ390279, і IgG4 включає K01316, AJ001563 і AJ001564 (перераховані вище позначення вказують номер доступу генів). У даному винаході кожний з CH1, шарніру, СН2 і CH3 означає частину константної області важкого ланцюга будь-якого антитіла і оснований на показнику EU по Kabat et al. (Kabat et al., Sequences of proteins of immunological interest, 1991 Fifth edition). По визначенню, CH1 знаходиться в діапазоні від 118 до 215 по показнику EU, шарнір знаходиться в діапазоні від 216 до 230 по показнику EU, СH2 знаходиться в діапазоні від 231 до 340 по показнику EU, і CH3 знаходиться в діапазоні від 341 до 446 по показнику EU. «Людське антитіло» згідно з даним винаходом означає антитіло, яке являє собою продукт експресії гена, отриманого у людини. Термін «агоністичний» відноситься до дії посилення зв'язування ліганду з CD40, що експре 41 сусться на поверхні таких клітин як В клітини, пухлинні клітини або дендритні клітини, або дії падання клітин, що експресуються CD40, щонайменше, з одним ефектом, який ліганд CD40 надає на клітини, експресуючі CD40. «Агоністичнe антитіло» відноситься до антитіла, що надає таку агоністичну дію. Прикладом ефектів, що забезпечуються для клітин, які експресують CD40, є сприяння експресії CD95. Термін «антагоністичний» відноситься до дії інгібування зв'язування ліганду з CD40, що експресусться на поверхні таких клітин як В клітини, пухлинні клітини або дендритні клітини, або дії, нейтралізуючій, щонайменше, один ефект, який ліганд CD40 надає на клітини, які експресують CD40. «Антагоністичне антитіло» відноситься до антитіла, що надає таку антагоністичну дію. Прикладом ефектів, що забезпечуються для клітин, які експресують CD40, є придушення проліферації В клітин або продукції антитіл. Дана заявка ясно представляє антитіла, або їх варіабельні області важкого ланцюга або легкого ланцюга за допомогою амінокислотних послідовностей. Даний винахід також охоплює амінокислотні послідовності, щонайменше, з однією амінокислотою, підданою делеції або заміщенню, або доданою до неї, переважно, з 1-10, 1-9, 1-8, 1-7, 1-6, 1-5, 1-4, 1-3 або 1 або 2 амінокислотами. Дана заявка ясно представляє гени, які кодують антитіла або їх варіабельні області важкого ланцюга або легкого ланцюга нуклеотидними послідовностями. Даний винахід також охоплює нуклеотидні послідовності, щонайменше, з одним нуклеотидом, підданим делеції або заміщенню, або доданим до неї, переважно, з 1-10, 1-9, 1-8, 1-7, 1-6, 1-5, 1-4, 1-3 або 1 або 2 нуклеотидами. Анти-CD40 антитіло відповідно до даного винаходу може бути надано включенням гена антитіла у вектор експресії, трансфекцією вектора у відповідну клітину-хазяїна, збором антитіла з клітин, що культивуються, або надосадової рідини, і очищенням його. Вектор може являти собою фаг або плазміду, яка може самостійно реплікуватися в клітиніхазяїні або може бути інтегрована в хромосому клітини-хазяїна. ДНК плазмі ди може бути отримана з Escherichia colі, Bacillus subtilis або дріжджів, тоді як ДНК фага може бути з фага. Клітина-хазяїн для трансформації конкретно не обмежується, якщо вона може експресувати ген-мішень. Приклади клітин-хазяїв можуть включати бактерії (Escherichia coli, Bacillus subtilis), дріжджі, клітини тварин (клітини COS, клітини СНО і т.д.) і клітини комах. Відомі способи перенесення гена в клітинихазяєва, включаючи будь-який спосіб, такий як опосередкований іонами кальцію, електропорація, злиття зі сферопластом, опосередкований ацетатом літію, трансфекцію фосфатом кальцію або ліпофекцію. Для перенесення гена в тварину, як описано нижче, способи передбачають мікроінєкцію, електропорацію або ліпофекцію для клітин ES і ядерну трансплантацію. У даному винаході «культура» відноситься до (а) надосадової рідини культури, (b) клітин, що 93027 42 культивуються, біомаси, що культивується, або її зруйнованої речовини або (с) секреції трансформанту. Для культивування трансформанту використовується середовище, відповідне для хазяїна, і можна використати статичну культуру, культуру у посудині, що обертається, або якунебудь іншу. Після культивування, за необхідності, білок антитіла продукується всередині біомаси або клітин, антитіло збирають руйнуванням біомаси або клітин. Якщо необхідне антитіло продукується з біомаси або клітин, то культуральний розчин використовується як він є або після його відділення від біомаси або клітин центрифугуванням або іншими способами. Потім біохімічний процес з використанням будь-якої хроматографії, яка підходить для відділення/очищення білків використовується окремо або, необов'язково, в комбінації з іншим способом для відділення/виділення необхідного антитіла з культури. Крім того, можна використати технологію створення трансгенної тварини для отримання трансгенної тварини, яке являє собою тваринухазяїна, що має ген, інтегрований в ендогенний ген, такої як трансгенна корова, трансгенна коза, трансгенна вівця або трансгенна свиня (Wright, G., et al., (1991) Bio/Technology 9, 830-834), і велику кількість моноклонального антитіла, отриманого з гена антитіла, можна отримати з молока, що виділяється трансгенною твариною. Культуру гібридоми in vitro можна отримати використанням відомого поживного середовища або будь-якого поживного середовища, отриманого дериватизацією з відомих основних середовищ, що використовуються для вирощування, підтримки і зберігання гібридоми і для продукції моноклонального антитіла в надосадовій рідині, в залежності від властивостей культивованої гібридоми, що є метою дослідження і способу культивування. 4. Властивості антитіла (1) Агоністичні антитіла Мутант агоністичного антитіла відповідно до даного винаходу може активувати імунну систему, не ушкоджуючи імунокомпетентні клітини, оскільки воно має активність ADCC і/або CDC, рівну або нижчу, ніж вихідне антитіло, в той же самий час, зберігаючи агоністичну активність. Таким чином, очікується, що мутант виявляє імуноактивуючу дію, яка дорівнює або вище, ніж у виіхдного антитіла, і цитотоксичність відносно клітин, які експресують CD40, яка дорівнює або нижче, ніж у вихідного антитіла. (2) Антагоністичні антитіла Мутант антагоністичного анти-CD40 антитіла відповідно до даного винаходу має знижену активність ADCC і/або CDC, в порівнянні з немодифікованим антитілом, в той же самий час зберігаючи переважну активність проти імуноактивуючих сигналів, індукованих CD40L. Очікується також, що він знижує активність індукції сигналів in vivo, яка, як вважають, відбувається через Fc рецептори. 5. Фармацевтичні композиції 43 Фармацевтична композиція, що містить препаративну форму очищеного антитіла відповідно до даного винаходу, також входить в об'єм даного винаходу. Фармацевтична композиція може переважно містити фізіологічно прийнятний розріджувач або носій, в доповнення до антитіла, і може являти собою його суміш з іншим антитілом або іншим препаратом, таким як антибіотичний засіб. Відповідний носій може включати, але не обмежується, фізіологічний розчин, фізіологічний сольовий розчин, забуферений фосфатом, фізіологічний сольовий розчин з глюкозою, забуферений фосфатом, і забуферений фізіологічний сольовий розчин. Альтернативно, антитіло може бути ліофілізованe для зберігання і при використанні, розчинятися у водному буфері, як описано вище. Фармацевтичну композицію можна вводити оральним шляхом або парентеральним шляхом, таким як внутрішньовенна, внутрішньом'язова, підшкірна або внутрішньочеревинна ін'єкція або введення. Однократна ефективна доза, яка являє собою комбінацію антитіла згідно з даним винаходом з відповідним розріджувачем і фізіологічно прийнятним носієм, складає від 0,0001 мг до 100 мг на 1 кг масу тіла, і її можна приймати через інтервал часу від 2 днів до 8 тижнів. Коли фармацевтична композиція згідно з даним винаходом являє собою агоністичне антитіло, вона використовується як імуностимулятор (антивірусний або протиінфекційний засіб) у відношенні патогенів, що включають, наприклад, вірус гепатиту А, В, С, D, і Е, ВІЛ, вірус грипу, вірус простого герпесу, цитомегаловірус, вірус Епштейна-Бара, вірус папіломи, хламідій, мікоплазми, токсоплазми, малярійний плазмодій, трипаносому і туберкульозну бацилу; протипухлинний засіб відносно злоякісних пухлин, що мають ракові клітини з експресованим CD40, включаючи, наприклад, рак підшлункової залози, рак сечового міхура, лімфому (наприклад, ходжкінську лімфому), лейкоз, злоякісну меланому, рак легенів, рак яєчників, рак молочної залози, рак товстої кишки, рак передміхурової залози, і рак голови і шиї; і терапевтичний засіб відносно аутоімунних захворювань, таких як ревматизм. Фармацевтичну композицію можна застосовувати відносно комбінації вказаних вище захворювань. її можна також застосовувати в комбінації з ад'ювантом відносно специфічного для раку пептиду. З іншого боку, коли фармацевтична композиція являє собою антагоністичне антитіло, її можна використати як: імуносупресанту при трансплантації органів (профілактичного або терапевтичного засобу відносно відторгнення при трансплантації острівців підшлункової залози, нирок або інших органів і тканин, або хронічного відторгнення трансплантату (хвороби «трансплантат проти хазяїна»), терапевтичного засобу відносно аутоімунних захворювань (наприклад, ревматизму, псоріазу, хронічного виразкового коліту, хвороби Крона, системного червоного вовчака, розсіяного склерозу, міастенії, склеродермії, синдрому антифосфоліпідних антитіл, аутоімунного гепатиту, ідіопатичної тромбоцитопенічної пурпури, синд 93027 44 рому Бехчета, артеріосклерозу, нефриту і респіраторного дистрес-синдрому), терапевтичного засобу відносно алергії (наприклад, астма), і терапевтичного засобу для інгібування фактора VIII згортання крові. Фармацевтичну композицію можна застосовувати для комбінації вказаних вище захворювань. 6. Енітопи Зв'язування епітопів CD40 визначали відповідно для антитіл КМ341-1-19 і 2105, що мають перевершуючу агоністичну активність, і для антитіла 4D11, що має перевершуючу антагоністичну активність (приклад 2). Даний винахід надає антитіла, що мають агоністичну або антагоністичну активність, які мають послідовність варіабельної області, відмінну від послідовностей варіабельної області вказаних вище антитіл, але розпізнають той же епітоп, що і одне з вказаних вище антитіл. Ці антитіла можна отримати в такій процедурі, як описано нижче. Коли мається намір отримати анти-CD40 антитіло, що розпізнає той же епітоп, що, наприклад, і антитіло КМ341-1-19, мишей або подібних тварин імунізують CD40 для вироблення моноклональних антитіл, з яких скринінг деяких моноклональних антитіл, конкуруючих з антитілом КМ341-1-І9 за зв'язування з CD40, проводять згідно зі стандартною процедурою. З підданих скринінгу антитіл, згідно зі способом, описаним в прикладі 2, відбирають антитіло, що має той же тип зв'язування з пептидом, що і антитіло КМ3411-19. Даний винахід буде більш детально описаний нижче з посиланням на приклади. Однак даний винахід не обмежується варіантами здійснення, описаними в прикладах. Приклад 1: Експресія і очищення білків антитіла і антигена. Плазміду вектора, що містить варіабельну область антитіла, трансфікують в клітини СНО (АТСС), і клітини, що експресують антитіло, відбирають з використанням G418, для отримання лінії клітин з стійкою експресією. Мутантний антиген експресувався за допомогою випадкового внесення вектора в клітини HEK (АТСС). Анти-CD40 антитіло очищали з вказаної вище надосадової рідини культури наступним способом. Культуральну надосадову рідину, що містить анти-CD40 антитіло, піддавали афінному очищенню в колонці Hyper D Protein А (що виготовляється, NGK Insulatord, Ltd.) або у разі очищення мишачого lgG1, колонці Protein G (Amersham Pharmacia Biotech), відповідно до прикладеної інструкції, використовуючи PBS(-) (забуферений фосфатом сольовий розчин) як адсорбційний буфер і 0,1 Μ буфер цитрату натрію (рН 3) як буфер елюювання. рН елюйованої фракції доводили приблизно до рН 7,2 доданням 1 Μ Tris-HCl (pH 8,0) або розчину Na2HPO4. Отриманий розчин антитіла заміняли PBS(-), використовуючи діалізну мембрану (10000 каналів, що виготовляється Spectrum Laboratories, Inc.) або колонку SP (Amersham Pharmacia Biotech) і фільтрували і стерилізували, використовуючи 45 мембранний фільтр MILLEX-GV з діаметром пор 0,22 мкм (виготовлений Millipore Corp.). Концентрацію очищеного антитіла розраховували вимірюванням спектральної поглинальної здатності при 280 нм, приймаючи 1 мг/мл за 1,450 D. Приклад 2: Визначення епітопів 13-мірний пептид, що охоплює амінокислоту 175 (SEQ ID NO: 1) у позаклітинній області CD40 зміщали двома амінокислотами кожну для синтезу всього 82 пептидів (SEQ ID NOS: від 49 до 130) у вигляді плям від С-кінця на целюлозній мембрані і ацетилування його N-кінця (Jerinin AG, Germany). Потім реакцію проводили на основі звичайного вестерн аналізу (див., наприклад Reineke. U. et al. (2001), "Epitope mapping with synthetic peptides prepared by SPOT synthesis." Antibody Engineering (Springer Lab Manual) Eds.: Kontermann/Dubel, 433-459). При аналізі інтенсивність фарбування кожної плями якісно визначали, використовуючи LumilmagerTM (BoehringerMannheim Corp.) (Фіг. 1Α-1, А-2, В-1 і В-2). Результати підтвердили, що антитіло 4D11 активно розпізнає пептиди з 20-го по 24-й і 41-й, антитіло 2105 активно розпізнає пептиди з 12-го по 23-й і 64-й, антитіло КМ341-1-19 активно розпізнає 41-й і 42-й пептиди, КМ643-4-11 активно розпізнає 43-й пептид, F72 активно розпізнає 75й пептид, 110 активно розпізнає 64-й пептид, F4465 активно розпізнає 34-й, 35-й, 54-й, 55-й, 65-й, 66-й і 75 й пептиди, КМ281-1-10 активно розпізнає 21-й, 24-й, 64-й і 75-й пептиди, 2В11 (нове антитіло) активно розпізнає 21-й, 24-й і 64-й пептиди і F76 (нове антитіло) активно розпізнає 21-й, 35-й, 51-й і 52-й пептиди. Для підтвердження сайта зв'язування антиCD40 антитіла отримували гібридний білок CD40FC, що має внесену в нього мутацію, і здатність зв'язування з ним досліджували ELISA (імуноферментним аналізом). Оскільки анти-CD40 антитіло перехресно не взаємодіє з мишачими В клітинами, то 5 гібридних білків CD40Fc отримували частковим перетворенням амінокислотної послідовності в мишачу амінокислотну послідовність CD40. Досліджували зв'язування антитіла з антигенами. Спосіб отримання мутантних гібридних білків CD40-FC показаний нижче. Сайт мутації отримували внесенням послідовності мишачого CD40 в частину пептидної послідовності, з якою міцно зв'язується антитіло. CD40mut1 перетворює EFTE в сайті, відповідному 15-му пептиду, в ALEK, CD40mut2 перетворює LDT в сайті, відповідному 21-му пептиду, в SAQ, CD40mut3 перетворює ТР в сайті, відповідному 24-му пептиду, в IR, CD40mut4 перетворює EEGW в сайті, відповідному 42-му пептиду, в KEGQ, і CD40mut5 перетворює VSSA в сайті, відповідному 64-му пептиду, в QSSL. Мутанти отримували відповідно до методики генної інженерії (Фіг. 2А, В і С). Результати аналізу підтвердили, що антитіло 2105 має надто знижену здатність зв'язування з CD40mut1. Результати також підтвердили, що антитіло 4D11 2В11 мають надто знижену здатність зв'язування з CD40mut2. Приклад 3: Активність зв'язування анти-CD40 агоністичного антитіла з клітинами Ramos 93027 46 Лінію клітин Ramos суспендували в забарвлюючому буфері (SB) PBS, що містить 0,1% NaN3 і 2% FCS в концентрації 2 106/мл. Клітинну суспензію (100 мкл/ямка) вміщували в 96-ямкову планшету з круглим дном (що виготовляється Becton, Dickinson and Company). Додавали надосадову рідину кожної культури гібридоми (50 мкл) і інкубували при температурі льоду протягом 30 хв. Людське lgG1 антитіло до людського сироваткового альбуміну як негативний контроль доводили до концентрації 2 мкг/мл в культуральному середовищі для гібридоми, додавали в кількості 50 мкл і потім інкубували при температурі льоду протягом 15 хв. Після промивання планшети SB додавали 50 мкл розбавленого в 250 разів флюоресцентно міченого антилюдського антитіла RPE (виготовленого Southern Biotechnology Associates, Inc.), і інкубували при температурі льоду протягом 15 хв. Після двократного промивання планшети SB, антитіло суспендували в 300-500 мкл буферу FACS, і інтенсивність флюоресценції кожної клітини вимірювали, використовуючи FACS (FACSort, FACScan, виготовлений Becton, Dickinson and Company). Приклад 4: Оцінка агоністичної активності анти-CD40 агоністичного антитіла відносно клітин Ramos 5,0 105 суспензії клітин Ramos висівали на 96-ямкову планшету при 100 мкл/ямка. Надосадову рідину культури гібридоми або очищеного антитіла розбавляли до 20 мкг/мл в середовищі, і розведений склад додавали в 96-ямкову планшету в концентрації 100 мкл/ямка. Після культивування протягом ночі, клітини збирали, і R-PEмічеие анти-CD95 антитіло (Pharmigen NJ) використовували для клітин. Аналіз проводили, використовуючи FACScan або FACsort (Becton, Dickinson and Company). Приклад 5: Інгібування експресії CD95 антиCD40 антагоністичним антитілом в клітинах Ramos 1,0 106 клітин/мл суспензії клітин Ramos висівали на 96-ямкову планшету в концентрації 50 мкл/ямка. Надосадову рідину культури гібридоми або очищеного антитіла доводили до 2 мкг/мл в середовищі, і середовище додавали в 96-ямкову планшету в концентрації 100 мкл/ямка. 4 мкг/мл розчинного ліганду CD40 (Alexis Corporation) і 4 мкг/мл анти-FLAG антитіла (М2, Sigma) додавали до середовища, і середовище додавали у в 96ямкову планшету в концентрації 50 мкл/ямка. Після культивування протягом ночі, клітини збирали, і для клітин використали мічене R-РЕ антиCD95 антитіло (Pharmingen NJ). Аналіз проводили, використовуючи FACS. Приклад 6: Вимірювання активності CDC у анти-CD40 антитіла При аналізі CDC клітини-мішені, мічені 2000 51 Cr , і комплемент, отриманий з людської сироватки (виготовлений Sigma Co) або комплемент, отриманий з кролячої сироватки (Cedarlane Laboratories Limited, Ontario, Canada) в кінцевій концентрації 5% культивували в 96-ямковій планшеті з круглим дном в загальному об'ємі 200 47 мкл разом з антитілом в різних концентраціях при 37°С в присутності 5% СО2 протягом 2 год. Після культивування планшету центрифуїували для того, щоб викликати осадження клітин, і потім 50 мкл иадосадової рідини переносили в 96-ямкову планшету, що включає порошковий сцинтилятор (Lumaplate -96: виготовлений Packard Instruments Co., Inc.) і сушили при 55°С протягом 1,5 год. Після підтвердження того, що планшета була висушена, її покривали спеціальною кришкою (TopSeal -A: 96-ямкові мікропланшети: виготовлені Packard Instruments Co., Inc.), і дозу -променів вимірювали сцинтиляційним лічильником (TopCount: виготовленим Packard Instruments Co., Inc.). Приклад 7: Вимірювання активності ADCC анти-CD40 антитіла Вимірювали опосередковану антитілом цитотоксичність, цитотоксичність відносно клітинмішеней в присутності клітин, що мають кілерну активність, таких як клітини NK або нейтрофіли, і антитіла (антитіло-залежна клітинна цитотоксичність, далі ADCC) і цитотоксичність відносно клітин-мішеней в присутності комплементу і антитіла (комплемент-залежна цитотоксичність, далі CDC). hlgG використовували як контроль. Спосіб вимірювання просто описаний таким чином. Радіоактивний хром (Cr51) включали в цитоплазму клітин-мішеней, і кількість Cr51, що вивільняється в розчин культури внаслідок загибелі клітин, вимірювали у вигляді дози променів. Зокрема, 105 клітин-мішеней клітинної лінії Rajі (АТСС CCL-86) лімфоми Буркітта суспендували в 15 мкл фетальної телячої сироватки (FCS). 50 мкл (37 MBq/мл) міченого Cr51 хромату натрію (виготовленого PerkinElmer, Inc.: що далі іменується Cr51) додавали до суспензії, і клітини культивували при 37°С протягом 1 год. Потім додавали 10 мл середовища, і середовище видаляли центрифугуванням. Цю операцію повторювали 3 рази для видалення Cr51, не включеного в клітини. В аналізі ADCC 2000 мічених Cr51 клітинмішеней і 200000 мононуклеарних лейкоцитів периферичної крові здорових людей, отриманих способом, описаним в прикладі 6, культивували в 96-ямковій планшеті з круглим дном (виготовленій Falcon) в загальному об'ємі 200 мкл разом з антитілом в різних концентраціях при 37°С в присутності 5% СО2 протягом 4 год. Після культивування планшету центрифугували для того, щоб викликати осадження клітин, і потім 50 мкл надосадової рідини переносили в 96-ямкову планшету, що містить порошковий сцинтилятор (Lumaplate -96: виготовлений Packard Instruments Co., Inc.) і сушили при 55°С протягом 1,5 год. Після підтвердження того, що планшета була висушена, її покривали спеціальною кришкою (TopSeal -A: 96-ямкові мікропланшети: виготовлені Packard Instruments Co., Inc.), і дозу -променів вимірювали сцинтиляційним лічильником (TopCount: виготовленим Packard Instruments Co., Inc.). 93027 48 Приклад 8: Отримання і оцінка активності мутанта P331S анти-CD40 агоністичного антитіла Генне клонування анти-CD40 агоністичних антитіл КМ341 1-19 і 2105 описане в WO 02/099186. Повідомляється, що активність CDC знижується перетворенням Pro в положенні 331 в константній області IgG2 в Ser. Для зниження активності CDC антитіла КМ341 1-19 і антитіла 2105, мутацію P331S вводили в константну область їх IgG2. Константну область людського lgG1, що експресує антитіло вектора N5KG1-Val Lark (IDEC Pharmaceuticals: далі скорочено N5KG1) заміняли людським IgG2 для отримання N5KG2, і Pro в положенні 331 IgG2 був перетворений в Ser для отримання мутації. Клонування цДНК константної області IgG2 проводили збором гібридоми КМ341-1-19 центрифугуванням, доданням TRIZOL (Gibco BRL) і екстрагуванням всієї ОHК відповідно до інструкції. Варіабельну область цДНК антитіла клонували, використовуючи набір ампліфікації цДНК SMART RACE Clontech Laboratories, Inc., відповідно до прикладеної інструкції. 1-о ниткову цинк отримували, використовуючи 5 мкг всієї РНК у вигляді матриці. PCR (полімеразну ланцюгову реакцію) проводили tnlg3Nhe: atatGCTAGCACCAAGGGCCCATCGGTCTTCCCC CTGGC (SEQ ID NO: 2) G і tnIgG2Bam: atatggatccTCATTTACCCGGAGACAGGGAGAGGC TC (SEQ ID: 3) як послідовність затравки, використовуючи набір ZtaqPCR (Takara) кожний по 30 циклів, що складаються з реакції при 98°С протягом 1 сек., при 55°С протягом 30 сек. і при 72°С протягом 1 хв. для ампліфікації гена. Після реакції ампліфікований продукт очищали набором очищення QIAGEN PCR, переварювали Nhel і ВатНІ і включали в N5KG1 для підтвердження послідовності. Цей вектор був визначений як N5KG2. N5KG2Ser (з Pro в положенні 331, перетвореним в Ser) отримували таким чином. Реакцію при 98°С протягом 1 сек., при 60°С протягом 30 сек. і при 72°С протягом 30 сек. проводили 15 разів, використовуючи N5KG2 як матрицю і затравку IgG3Nhe: atatGCTAGCACCAAGGGCCCATCGGTCTTCCCC CTGGCG (SEQ ID NO. 4) і G2Ser2: GTTTTCTCGATGGAGGCTGGGAGGCC (SEQ ID NO: 5). У той же самий час, реакцію при 98°С протягом 1 сек., при 60°С протягом 30 сек. і при 72°С протягом 30 сек. проводили 15 разів, використовуючи N5KG2 як матрицю і затравку IgG2Bam: atatggatccTCATTTACCCGGAGACAGGGAGAGGC TC (SEQ ID NO: 6) і G2Serl: GGCCTCCCAGCCTCCATCGAGAAAAC (SEQ ID NO: 7). Фрагменти ампліфікованої ДНК очищали, використовуючи набір очищення PCR, і змішували однакові кількості двох фрагментів ампліфікованої ДНК. Потім реакцію при 98°С протягом 1 сек., при 60°С протягом 30 сек. і при 72°С протягом 30 сек. проводили 5 разів. До суміші додавали затравка IgG3Nhe і IgG2Bam, і ту ж реакцію проводили 15 разів. Фрагмент ампліфікованої 49 ДНК розщеплювали Nhel і ВатНІ і заміняли константною областю lgG1 вектора N5KG1 (N5KG2Ser). Фрагмент, що містить послідовність варіабельної області антитіла, перевареної BgUI і Nhel, включали у вектор N5KG2Ser. Антитіло, експресоване і очищене вказаним вище способом, оцінювали з точки зору здатності зв'язування з клітинами Ramos (Фіг. 3А) і агоністичної активності (Фіг. 3В). Коливання активності внаслідок внесення варіації P331S не спостерігали. Приклад 9: Вимірювання активності CDC мутанта 331ser анти-CD40 агоністичного антитіла Активність CDC вимірювали вказаним вище способом. Використали комплемент, отриманий з кролячої сироватки, і як клітини-мішені використали клітини Ramos. Результати підтвердили, що при в антитілі КМ341-1-19 при концентрації антитіла 1 мкг/мл, IgG2ser виявляв активність CDC, значно знижену, в порівнянні з IgG2 (Фіг. 4А). З іншого боку, коли використали людський комплемент, змін не спостерігали (Фіг. 4В). Приклад 10: Отримання і вимірювання активності агоністичного анти-CD40 антитіла, що має перетворену константну область Серед анти-CD антитіл, описаних в WO 02/088186, 2 антитіла, що виявляють найбільш сильну агоністичну активність (антитіло КМ341-119 і антитіло 2105) відносяться до підкласу IgG2. Для дослідження того, важливий чи ні підклас IgG2 для активації CD40, отримували рекомбінантні білки, які мають константну область, перетворену відповідно в lgG1, IgG3 і IgG4 і вимірювали з точки зору здатності зв'язування з антигеном і посилюючої експресію CD95 активності в клітинах Ramos, відповідно до прикладів 4 і Клонування цДНК константної області IgG3 проводили згідно зі способом клонування lgG2, частково модифікованим з використанням специфічною для IgG3 затравки. IgG4 експресувався з використанням N5KG4PE (IDEC Pharmaceuticals). Білок антитіла експерсувався відповідно до прикладу 1. На здатність зв'язування з клітинами Ramos, що експресують людський CD40 антитіла КМ341-1-19 і антитіла 2105 не впливало перетворення IgG2 в lgG1, IgG3 або IgG4 (Фіг. 5А-1 і 5А2). Однак було виявлено, що ці антитіла мають активність, яка посилює експресію CD95 в клітинах Ramos, знижену на 10% або більше (за Фіг. 5В-1 і 5В-2). Цe показує, що не тільки структура варіабельної області, що визначає область зв'язування антитіла, але також структура константної області антитіла важливі для сильної агоністичної активності антитіла 2105 і антитіла КМ3411-19. Таким чином, для дослідження того, яка область в константній області IgG2 важлива для агоністичної активності, для вимірювання її активності отримували мутант обміну доменів, в якому структура IgG2 змішується зі структурою IgG4. Як описано нижче, мутант обміну доменів отримують заміщенням шарнірної області. У цьому випадку, «шарнірна область» включає верхній шарнір (з Kabat EU код 216), середній шарнір (з Kabat EU код 226) і нижнього шарніра (з Kabat EU код 231), як описано в публікації Оlе Η Brekke et 93027 50 al., Immunology Today 1995, 16, 85-90. 4 мутанта обміну доменів IgG2/4 (CH1 і шарнірна область: IgG2, інші області: IgG4), IgG4/2/4 (шарнірна область: IgG2, інші області: IgG4) IgG2/4/4 (CH1: IgG2, інші області: IgG4) і IgG4/2/2 (CH1: IgG4, інші області: IgG2) отримували відповідно для антитіла КМ341-1-19 і антитіла 2105. Вектор N5KG2/4 для експресії антитіла IgG2/4 отримували, використовуючи набір Ztaq PCR (Takara). Реакцію при 98°С протягом 1 сек., при 60°С протягом 30 сек. і при 72°С протягом 30 сек. проводили 15 разів, використовуючи N5KG2 як матрицю і затравку IgG3Bam: atatggatccTCATTTACCCGGAGACAGGGAGAGGC (SEQ ID NO: 8) і 24Сhi4: AGGGGTCCGGGAGATCATGAGAGTGTCCTT (SEQ ID NO: 9). У той же самий час, реакцію при 98°С протягом 1 сек., при 60°С протягом 30 сек. і при 72°С протягом 30 сек. проводили 15 разів, використовуючи N5KG4 (IDEC Pharmaceuticals) як матрицю і затравку 24Сhi3: AAGGACACTCTCATGATCTCCCGGACCCCT (SEQ ID NO: 10) і linkH2: tgatcatacgtagatatcacggc (SEQ ID NO: 11). Фрагменти ампліфікованої ДНК очищали, використовуючи набір очищення PCR, і змішували однакові кількості двох очищених фрагментів ДНК. Потім реакцію при 98°С протягом 1 сек., при 60°С протягом 30 сек. і при 72°С протягом 30 сек. проводили 5 разів. До суміші додавали затравку IgG3Nhe і linkH2: tgatcatacgtagatatcacggc (SEQ ID NO: 12), і ту ж реакцію проводили 15 разів. Фрагмент ампліфікованої ДНК розщеплювали Nhel і ВатНІ і заміняли константною областю lgG1 вектора N5KG1. Вектор N5KG4/2/4 для експресії IgG4/2/4 отримували таким чином. Реакцію при 98°С протягом 1 сек., при 60°С протягом 30 сек. і при 72°С протягом 30 сек. проводили 15 разів, використовуючи N5KG4 як матрицю і затравку linkH: gggtacgtcctcacattcagtgatcag (SEQ ID NO: 13), G2Hin3: TTTGCGCTCAACTGTCTTGTCCACCTTGGTGTTG CTGGG (SEQ ID NO: 14), linkH2: tgatcatacgtagatatcacggc (SEQ ID NO: 15) і G2Hin4: ACAGTTGAGCGCAAATGTTGTGTCGAGTGCCCA CCG (SEQ ID NO: 16). Фрагменти ампліфікованої ДНК очищали, використовуючи набір очищення PCR. і змішували однакові кількості двох фрагментів очищеної ДНК. Потім реакцію при 98°С протягом 1 сек., при 60°С протягом 30 сек. і при 72°С протягом 30 сек. проводили 5 разів, використовуючи суміш як матрицю. До суміші додавали затравку linkH і linkH2, і ту ж реакцію проводили 15 разів. Фрагмент ампліфікованої ДНК розщеплювали Nhel і ВатНІ і заміняли константною областю lgG1 вектора N5KG1. Вектор N5KG2/4/4 для експресії IgG2/4/4 отримували таким чином. Реакцію при 98°С протягом 1 сек., при 60°С протягом 30 сек. і при 72°С протягом 30 сек. проводили 15 разів, використовуючи N5KG2 як матрицю і затравку linkH: gggtacgtcctcacattcagtgatcag (SEQ ID NO: 17) і G4CH1-2: GGTGTTGCTGGGCTTGTGATCTACGTTGCAG (SEQ ID NO: 18). У той же самий час, реакцію при 51 98°С протягом 1 сек., при 60°С протягом 30 сек. і при 72°С протягом 30 сек. проводили 15 разів, використовуючи N5KG4 як матрицю і затравку G4CH1-1: CTGCAACGTAGATCACAAGCCCAGCAACACC (SEQ ID NO: 19) і linkH2: tgatcatacgtagatatcacggc (SEQ ID NO: 20). Фрагменти ампліфікованої ДНК очищали, використовуючи набір очищення PCR, і змішували однакові кількості двох очищених фрагментів ДНК. Потім реакцію при 98°С протягом 1 сек., при 60°С протягом 30 сек. і при 72°С протягом 30 сек. проводили 5 разів. До суміші додавали затравку linkH і linkH2, і ту ж реакцію проводили 15 разів. Фрагмент ампліфікованої ДНК розщеплювали Nhel і ВатНІ і заміняли константною областю lgG1 вектора N5KG1. Вектор N5KG4/2/2 для експресії IgG4/2/2 отримували таким чином. Реакцію при 98°С протягом 1 сек., при 60°С протягом 30 сек. і при 72°С протягом 30 сек. проводили 15 разів, використовуючи N5KG4 як матрицю і затравку linkH: gggtacgtcctcacattcagtgatcag (SEQ ID NO: 21) і G4CH1-2: GGTGTTGCTGGGCTTGTGATCTACGTTGCAG (SEQ ID NO: 22). У той же самий час, реакцію при 98°С протягом 1 сек., при 60°С протягом 30 сек. і при 72°С протягом 30 сек. проводили 15 разів, використовуючи N5KG2 як матрицю і затравку G4CH1-1: CTGCAACGTAGATCACAAGCCCAGCAACACC (SEQ ID NO: 23) і linkH2: tgatcatacgtagatatcacggc (SEQ ID NO: 24). Фрагменти ампліфікованої ДНК очищали, використовуючи набір очищення PCR, і змішували однакові кількості двох очищених фрагментів ДНК. Потім реакцію при 98°С протягом 1 сек., при 60°С протягом 30 сек. і при 72°С протягом 30 сек. проводили 5 разів. До суміші додавали затравку linkH і linkH2, і ту ж реакцію проводили 15 разів. Фрагмент ампліфікованої ДНК розщеплювали Nhel і ВатНІ і заміняли константною областю lgG1 вектора N5KG1. Досліджували активність зв'язування відповідних чотирьох мутантів обміну доменів антитіла КМ341-1-19 і антитіла 2105. У результаті, між ними і вихідним IgG2 не спостерігали відмінності з точки зору активності зв'язування (Фіг. 6А-1 і 6А2). Однак тільки IgG2/4/4 і антитіла КМ341-1-19, і антитіла 2105 виявляли значно знижену агоністичну активність (Фіг. 6В-1 і 6В-2). Результати підтвердили, що шарнірна область IgG2 важлива для агоністичної активності. Далі, досліджували, яка послідовність важлива в шарнірній області. Шарнірна область ділиться на 3 сайти, зокрема, верхній шарнір, середній шарнір і нижній шарнір (Оlе Η Brekke et al., Immunology Today 1995, 16, 85-90). IgG2специфічні послідовності в цих областях відповідно заміняли lgС4-специфічними послідовностями. Антитіла, отримані внесенням мутації у верхній шарнір (з Kabat EU код 216), середній шарнір (з Kabat EU код 226) і нижній шарнір (з Kabat EU код 231), відповідно позначали як IgG2UH4, IgG2MH4 і IgG2LH4. їхні відповідні вектори експресії позначали як N5KG2UH4, N5KG2MH4 і N5KG2LH4. «Шарнір» визначається як показники 93027 52 EU від 216 до 230 згідно з даними Kabat et al.Sequences of proteins of immunological interest, 1991 Fifth edition. N5KG2UH4 отримували таким чином. Реакцію при 98°С протягом 1 сек., при 60°С протягом 30 сек. і при 72°С протягом 30 сек. проводили 15 разів, використовуючи N5KG2 як матрицю і затравку linkH: gggtacgtcctcacattcagtgatcag (SEQ ID NO: 25) і UH4-2: CACAACATTTggaCTCAACTcTCTTGTCCACC (SEQ ID NO: 26). У той же самий час, реакцію при 98°С протягом 1 сек., при 60°С протягом 30 сек. і при 72°С протягом 30 сек. проводили 15 разів, використовуючи N5KG2 як матрицю і затравку UH4-1: GGTGGACAAGAgAGTTGAGtccAAATGTTGTG (SEQ ID NO: 27) і linkH2: tgatcatacgtagatatcacggc (SEQ ID NO: 28). Фрагменти ампліфікованої ДНК очищали, використовуючи набір очищення PCR, і змішували однакові кількості двох фрагментів очищеної ДНК. Потім реакцію при 98°С протягом 1 сек., при 60°С протягом 30 сек. і при 72°С протягом 30 сек. проводили 5 разів. До суміші додавали затравку linkH і linkH2, і ту ж реакцію проводили 15 разів. Фрагмент ампліфікованої ДНК розщеплювали Nhel і ВатНІ і заміняли константною областю lgG1 вектора N5KG1. N5KG2MH4 отримували таким чином. Реакцію при 98°С протягом 1 сек., при 60°С протягом 30 сек. і при 72°С протягом 30 сек. проводили 15 разів, використовуючи N5KG2 як матрицю і затравку linkH: gggtacgtcctcacattcagtgatcag (SEQ ID NO: 29) і UM4-2: GGCACGGTGGGCAtgggggaccataTTTGCGCTC (SEQ ID NO: 30). У той же самий час, реакцію при 98°С протягом 1 сек., при 60°С протягом 30 сек. і при 72°С протягом 30 сек. проводили 15 разів, використовуючи N5KG2 як матрицю і затравку UM4-1: GAGCGCAAAtatggtcccccaTGCCCACCGTGCC (SEQ ID NO: 31) і linkH2: tgatcatacgtagatatcacggc (SEQ ID NO: 32). Фрагменти ампліфікованої ДНК очищали, використовуючи набір очищення PCR, і змішували однакові кількості двох очищених фрагментів ДНК. Потім реакцію при 98°С протягом 1 сек., при 60°С протягом 30 сек. і при 72°С протягом 30 сек. проводили 5 разів. До суміші додавали затравка linkH і linkH2, і ту ж реакцію проводили 15 разів. Фрагмент ампліфікованої ДНК розщеплювали Nhel і ВатНІ і заміняли константною областю lgG1 вектора N5KG1. N5KG2LH4 отримували таким чином. Реакцію при 98°С протягом 4 сек., при 60°С протягом 30 сек. і при 72°С протягом 30 сек. проводили 15 разів, використовуючи N5KG2 як матрицю і затравку nkH: gggtacgtcctcacattcagtgatcag (SEQ ID NO: 33) і UL4-2: GAAGACTGACGGTCCccccaggaactcTGGTGCTGG GCA (SEQ ID NO: 34). У той же самий час, реакцію при 98°С протягом 1 сек., при 60°С протягом 30 сек. і при 72°С протягом 30 сек. проводили 15 разів, використовуючи N5KG2 як матрицю і затравку UL4-1: TGCCCAGCACCAgagttcctggggGGACCGTCAGTC TTC (SEQ ID NO: 35) і linkH2: 53 tgatcatacgtagatatcacggc (SEQ ID NO: 36). Фрагменти ампліфікованої ДНК очищали, використовуючи набір очищення PCR, і змішували однакові кількості двох очищених фрагментів ДНК. Потім реакцію при 98°С протягом 1 сек., при 60°С протягом 30 сек. і при 72°С протягом 30 сек. проводили 5 разів. До суміші додавали затравка linkH і linkH2, і ту ж реакцію проводили 15 разів. Фрагмент ампліфікованої ДНК розщеплювали Nhel і ВатНІ і заміняли константною областю lgG1 вектора N5KG 1. Досліджували ці 3 відповідних мутанти обміну доменів антитіла КМ341-1-19 і антитіла 2105, і вони мали однакову активність зв'язування з антигеном (Фіг. 6А-1 і 6А-2). Однак IgG2UH4 і IgG2MH4 виявили значно знижену агоністичну активність відносно клітин Ramos (Фіг. 6В-1 і 6В2). З представлених вище результатів було виявлено, що структури верхнього шарніра і середнього шарніра в шарнірній області важливі для залежної від підкласу IgG2 агоністичної активності анти CD40 антитіл КМ341-1-19 і 2105. Оскільки було виявлено, що підклас IgG2 важливий для агоністичної активності, то антитіла підкласу, відмінного від IgG2, перетворювали в антитіла підкласу IgG2 для дослідження того, чи посилюється агоністична активність чи ні. При дослідженні декількох клонів, агоністичну активність F76 можна було посилити перетворенням підкласу lgG1 в підклас IgG2 (Фіг. 7A і В). Приклад 11: Отримання мутантів анти-CD40 антагоністичного антитіла Фрагмент ДНК, що містить важкий ланцюг і легкий ланцюг гена антитіла 4D11, описаного в WO 02/088186, чий початковий підклас являє собою lgG1, переварювали Bg1II і Nhel і потім інтегрували у вектори N5KG4PE, N5KG4P і N5KG4 (IDEC Pharmaceuticals). N5KG4PE містить точкові мутації S228P і L235E в константній області IgG4, a N5KG4P містить точкову мутацію S228P в константній області IgG4. Білок антитіла експресували і очищали відповідно до описаного вище способу. Антитіло очищали відповідно до описаного вище способу, використовуючи як показник клітини Ramos. Зміна активності зв'язування lgG1, IgG4, IgG4P і IgG4PE з клітинами Ramos не спостерігалося (Фіг. 8А). Антагоністичну активність lgG1 порівнювали з агоністичною активністю різних мутантів IgG4, відповідно до описаного вище способу для виявлення того, що агоністична активність lgG1 не відрізняється від агоністичної активності мутантів IgG (Фіг. 8В). Приклад 12: Оцінка активності ADCC і активність CDC мутантів анти-Р40 антагоністичного антитіла Активність ADCC і активність CDC мутантів анти-D40 антитіл оцінювали відповідно до описаного вище способу. При використанні людських MNC як ефекторних клітин, і CD40-експресуючих клітин Daudi як клітин-мішeней, за спостереженнями, 2 мутанти, IgG4 і IgG4PE, мали значно знижену активність ADCC, в порівнянні з lgG1 як вихідного підкласу антитіла 4D11 (Фіг. 9). 93027 54 Активність CDC lgG1 порівнювали з активністю IgG4P, використовуючи клітини Daudi як клітини-мішені. Було виявлено, що активність CDC значно знижувалася, в порівнянні з lgG1 (Фіг. 10). Приклад 13: Вплив анти-Р40 антагоністичного антитіла на В клітини 100 мкг кожного з lgG1, IgG4P і IgG4PE антитіла 4D11 вводили в хвостову вену мишей, що мають генетичний фон, за допомогою чого вони являли собою гомозиготи для мишачого ендогенного розірваного CD40, і що дають притулок трансгену гена людського CD40 (Yasui et al., Int. Immunol. 2002 Vol. 14: 319). Через 24 год. після введення кров брали з венозного сплетення орбіти. Після гемолізу 0,16 моль/л хлориду амонію, до гемолізату додавали мічене FITC анти-В220 антитіло, і його аналізували, використовуючи FASC. Результати показані на Фіг. 11. На кресленні подовжня вісь вказує співвідношення В клітин в загальній кількості лімфоцитів. lgG1 більше усього знижував співвідношення В клітин, IgG4P знижував це співвідношення в меншій мірі, і IgG4PE знижував це співвідношення в набагато меншій мірі. Через 24 год. після введення, селезінку видаляли і роздавлювали покривним склом для отримання клітинної суспензії. Після гемолізу клітинної суспензії мічене РЕ анти-В220 антитіло і мічене FITC анти-CD23, CD86 або CD95 антитіло використали для гемолізату, і його аналізували, використовуючи FACS. Результати показані на Фіг. 12А, В і С. На кресленнях подовжня вісь показує співвідношення В клітин, що експресують кожний поверхневий маркер у всіх лімфоцитах. Було виявлено, що 4D11G1 досягає того ж рівня збільшення експресії кожного маркера, що і у мишачого антитіла, що є в продажу 5СЗ проти людського анти-CD40 агоністичного антитіла 5С3 (Pharmingen). IgG4PE досяг невеликого збільшення експресії кожного поверхневого маркера активації, в порівнянні з lgG1 і IgG4P. Приклад 14: Вплив інгібування продукції антиген-специфічного антитіла і зміна кількості В клітин, викликана анти-CD40 антагоністичним антитілом 100 мкг (на основі NP-CGG) комплексу кон'югатів 4-гідрокси-3-нітрофенілацетил-курячого глобуліну (NP-CGG: поширюваного професором Hitoshi KIKUTANI, Research Institute for Microbial Diseases, Osaka University) і квасців (гелю гідроокису алюмінію) внутрішньочеревинно вводили мишам, що мають генетичний фон, за допомогою чого вони являли собою гомозиготи для мишачого ендогенного розірваного CD40, і що дає притулок трансгену гену людського CD40 (Yasui et al., Int. Immunol. 2002 Vol. 14: 319), для сенсибілізації мишей. Безпосередньо перед сенсибілізацією антигеном, 50 або 100 мкг кожного антитіла вводили в хвостову вену. 100 мкг людського антитіла IgG4PE проти людського альбуміну вводили як негативний контроль. Через 7 і 14 днів після сенсибілізації, кров брали з венозного сплетення орбіти. Кількості NP-специфічних lgG1 і IgM антитіл в сироватці вимірювали способом ELISA. Спосіб ELISA проводили таким чином. 50 мкл/ямка пов'язаного з NP бичачого сироватково 55 го альбуміну (NP-BSA: 2,5 мкг/мл) додавали в кожну ямку 96-ямкової мікропланшети для ELISA (Mixisorp, виготовленої Nunc A/S) і інкубували при 4°С для того, щоб викликати NP-BSA для адсорбції на ній. Потім, надосадову рідину видаляли, і в кожну ямку додавали блокуючий реагент (SuperBlock, виготовлений Pierce Biotechnology, Inc.) і інкубували при кімнатній температурі для проведення блокування. Потім кожну ямку 3 рази промивали фосфатним буфером (PBS-T), що містить 0,1% Tween 20. Потім, кожну сироватку, розбавлену PBS-T, що містить 10% Block Асе (50 мкл/ямка), додавали в кожну ямку і інкубували і піддавали взаємодії при 37°С протягом 2 год. Мікропланшету промивали PBS-T 3 рази. Потім в кожну ямку додавали 1000-кратне розбавлення козячого антитіла проти мишачого lgG1, міченого лужною фосфатазою (Cosmo Bio, 1070-04 або 1020-04) PBS-T, що містить 10% Block Асе (50 мкг/ямка) і інкубували при 37°С протягом 2 год. Потім мікропланшету промивали PBS-T, і потім в кожну ямку додавали розчин фарбувального субстрату (50 мкл/ямка, Sigma 104, фосфатний субстрат). Спектральну поглинальну здатність при довжині хвиль 405 нм вимірювали, використовуючи зчитувальний пристрій мікропланшет. Результати показані на Фіг. 13А і В. На кресленнях подовжня вісь показує величини, отримані перетворенням 10000-кратного розведення (у випадку lgG1) або 100-кратного розведення (у випадку IgM антитіла) сироватки, взятої у мишей C57BL/6, яким двічі ін'єктували NP-CGG, і об'єднували в один блок. Антитіло 4D11 і антитіло IgG4P або IgG4PE з 281 однаково сильно інгібували продукцію NP-специфічних антитіл lgG1 і IgM. Зміна кількості В клітин в периферичній крові і селезінці у мишей, використаних для дослідження впливу інгібування продукції антитіла вимірювали відповідно до того ж способу, як і в прикладі 1. Результати показані на Фіг. 14А і В. Антитіло 4D11 іантитіло IgG4P 281 значно зменшувало співвідношення В клітин в периферичній крові, в порівнянні з антитілом IgG4PE. Введення 100 мкг антитіла IgG4PE не змінювало співвідношення В клітин в селезінці, видаленій через 14 днів після сенсибілізації антигеном. Однак введення IgG4P змінило або мало тенденції до зміни співвідношення. Приклад 15: Вплив анти-CD40антагоністичного антитіла на зелених мавп 30 мг/кг IgG4P або IgG4PE антитіла 4D11 вводили в поверхневу вену передпліччя зелених мавп, і кров брали з стегнової вени після певного періоду часу. При субпопуляційному аналізі лімфоцитів периферичної крові для кожної клітинної суспензії використали анти-CD3 антитіло, мічене FITC, анти-CD20 антитіло, мічене РЕ і анти-CD45 антитіло, мічене АРС, і співвідношення позитивних клітин вимірювали, використовуючи FACS, для розрахунку співвідношення С045-позитивних клітин. Результати показані на Фіг. 15. На кресленні подовжня вісь показує відношення CD20позитивних клітин в кожний час до CD20позитивних клітин перед введенням антитіла. Через 1-7 днів після введення антитіла в індиві 93027 56 дуумів, яким вводили антитіло IgG4P, кількість CD20-позитивних клітин знизилася приблизно на 40%. Однак через 4 дні після введення в індивідуумів, яким вводили антитіло lgG4PE, кількість CD20-позитивних клітин знизилася приблизно тільки на 20%. Концентрацію IL12 в сироватці вимірювали способом ELISA. Крові, взятій з стегнової вени, давали можливість стояти при кімнатній температурі протягом 20-60 хв., а потім після центрифугування при 3000 об./хв. стояти при кімнатній температурі протягом 15 хв. Концентрацію IL12 в отриманій сироватці вимірювали, використовуючи набір ELISA визначення IL12 мавп (BioSource International Inc.). Результати показані на Фіг. 16. Збільшення продукції IL12 антитілом IgG4PE не спостерігалося ні в одній точці взяття крові. Однак максимальна продукції IL12 антитілом IgG4P спостерігалася на 4-й день. Приклад 16: Вплив анти-CD40 антагоністичного антитіла на модель уповільненої гіперчутливості у зелених мавп 9 самців зелених мавп внутрішньошкірно і внутрішньом'язово сенсибілізували правцевим токсоїдом (ТТх) (10 Lf/мл; Denka Seiken Co., Ltd.) для індукції уповільненої гіперчутливості до ТТх. У той же самий час, за 10 хв. до початку сенсибілізації кожним трьом тваринам 3 рази (1 раз/тиждень) внутрішньовенно вводили 0,1 і 10 мг/кг антитіла 4D11G4PE для дослідження впливу 4D11G4PE на уповільнену гіперчутливість. Під місцевою анестезією внутрішньом'язовим введенням кетаміну сенсибілізацію проводили внутрішньошкірним введенням ТТх в спину (50 мкл/ділянка (12 ділянок) і внутрішньом'язовим введенням ТТх в стегно (0,6 мл/маса тіла), і провокаційну пробу проводили внутрішньошкірним введенням ТТх в ділянку грудної клітини (10 мкл/ділянка, від 0 до 10 Lf/мл для кожних трьох ділянок) через 21 день після сенсибілізації. Через 24 і 48 год. після провокації спостерігають шкірну реакцію в дільницях введення і оцінюють відповідно до бальної оцінки Draize подразнення шкіри. Результати визначення концентрації ТТх в кожних трьох ділянках були відповідно представлені у вигляді середньої величини. Результати показані на Фіг. 17. Введення антитіла 4D11G4PE очевидно інгібувало реакцію уповільненої гіперчутливості, що спостерігалася через 24 і 48 год. після введення. Досліджували вплив ТТх на титри ТТхспецифічних IgG і IgM антитіл. Крові, взятій з стегнової вени протягом часу, давали можливість постояти при кімнатній температурі протягом 2060 хв. і потім центрифугували при 3000 об./хв. при кімнатній температурі протягом 15 хв. Титр антитіл в отриманій сироватці вимірювали, використовуючи метод ELISA. Метод ELISA здійснювали таким чином. 100 мкл/ямка ТТх (0,5 Lf/мл) додавали в кожну ямку 96-ямкової мікропланшети для EL1SA (Махісогр, виготовленої Nunc A/S) і інкубували при 4°С для того, щоб викликати адсорбцію на неї ТТх. Потім надосадову рідину видаляли і в кожну ямку додавали блокуючий реагент (фосфатний буфер, що містить 0,5% BSA) і 57 інкубували при кімнатній температурі для здійснення блокування. Потім кожну ямку 3 рази промивали фосфатним буфером (PBS-T), що містить 0,05% Tween 20. Потім кожну сироватку, розбавлену PBS-T, що містить 0,5% BSA (розведення від 100 до 819200 разів, збільшення розведення: 2; 100 мкл/ямка), додавали в кожну ямку і інкубували і проводили реакцію при кімнатній температурі протягом 2 год. Мікропланшету промивали PBS-T 3 рази. Потім в кожну ямку додавали 3000кратне розведення козячого анти-мавп'ячого IgG антитіла або IgM антитіла, міченого пероксидазою (Nordic Immunology) з PBS-T, що містить 0,5% BSA (100 мкл/ямка) і інкубували при кімнатній температурі протягом 1 год. Потім мікропланшету промивали PBS-T, і потім в кожну ямку додавали розчин фарбувального субстрату (100 мкл/ямка. о-гідрохлорид фенілендіаміну + водний перекис водню). Спектральну поглинальну здатність при довжині хвиль 492 нм вимірювали, використовуючи пристрій, що зчитує мікропланшети. Титр анти-ТТх антитіла визначали як максимальне збільшення розведення для доведення спектральної поглинальної здатності до 0,1 і більше. Титр антитіла становив 0, коли спектральна поглинальна здатність не досягала 0,1 навіть при 100-кратному розведенні. Результати показані на Фіг. 18 і 19. Введення 1 мг/кг 4D11G4PE придушувало титри ТТх-специфічного IgG і IgM антитіла приблизно до 1/10. Коли вводили 10 мг/кг 4D11G4PE. титри антитіл були нижче за чутливість виявлення в будь-якій точці взяття крові. Приклад 17: Вплив анти-CD40 антагоністичного антитіла на утворення тромбоцитарного тромбу Кров, взяту у здорової людини, ділили на 4 аліквотних частини (кожна по 6 мл). Контрольне людське IgG4PE, контрольне мишаче IgG2a, людське IgG4PE проти людського CD40 (4D11) і мишаче IgG2a проти людського CD 154 (5С8) відповідно додавали до фракцій, так що кожна фракція мала концентрацію крові 100 мкг/мл. Плоску перфузійну камеру (GlycoTech Corp.) і покриту колагеном чашку Петрі збирали відповідно до прикладеної інструкції. Викликали потік крові, обробленої різними антитілами, в камеру з швидкістю, яка може створити напруження зсуву 1500/сeк. на кров протягом 7 хв. Потім викликали потік 4% параформальдегідфосфатного буфера в камеру з швидкістю, яка може створити напруження зсуву 1500/сек. на буфер протягом 10 хв. Агрегат тромбоцитів, що сформувався на чашці Пeтрі, фіксували, забарвлювали специфічним для тромбоцитів антитілом CD41a. міченим РЕ, і спостерігали флюоресцентним мікроскопом. Результати показані на Фіг. 20А і В. Кров, оброблена людським IgG4PE проти людського CD40 (4D11), формувала тромбоцитарний агрегат на покритій колагеном чашці Петрі, як і кров, оброблена контрольними антитілами. Однак кров, оброблена мишачим IgG2a проти людського CD 154 не утворювала тромбоцитарний агрегат. Приклад 18: Оцінка стійкості анти-CD40 антагоністичного антитіла 93027 58 Антитіла з модифікованою константною областю антитіла 4D11 порівнювали і досліджували з точки зору стійкості. При способі оцінки надосадові рідини культур, отримані відповідно скороминуще експресуючими G4P, G4PE, G2Ser і G4/2/4 в клітинах HEK293 завантажували в колонку білка A (Amersham Pharmacia Biotech), елюювали 0,1 Μ цитратним буфером (рН 2,7) і потім інкубували при 37°С протягом 1 хв. і 10 хв. Потім їх нейтралізували 50 нМ фосфатним буфером (рН 7,0). Вміст олігомеру в отриманих розчинах антитіла вимірювали, використовуючи гельфільтраційну колонку (Tosoh Corp.). У результаті, було виявлено, що вміст олігомера збільшується пропорційно часу інкубації, і легкість продукції олігомера розташовується в наступному порядку убування: G4/2/4, G4PE, G2Ser і G4P (Фіг. 21). Приклад 19: Ефект інгібування відторгнення шкірного трансплантату анти-CD40 антагоністичним антитілом Трансплантат, взятий з хвоста мишей DBA/2, трансплантували в задню бічну ділянку грудної клітини мишей C57BL/6 тіньового фенотипу, що мають генетичну середовище, за допомогою чого вони були гомозиготами для мишачого ендогенного розірваного CD40 і включали трансген гена людського CD40, і трансплантат фіксували пластиром на 7 днів. 100 мкг досліджуваної речовини 4D11G4PE або носій вводили в хвостову вену відповідно через 0, 2, 4, 7, 9, 11 і 14 днів після трансплантації шкіри. Для інгібування відторгання клітинами NK всім мишам за 3 дні до операції і через 1, 4 і 9 днів після операції внутрішньочеревинно вводили 100 мкг анти-асіало GML антитіло. Результати показані на Фіг. 22. У порівнянні з групою, що отримувала носій, в групі, якій вводили 4D11G4PE, спостерігалася значуща затримка відторгнення трансплантату. Приклад 20: Аналіз експресії CD40 в лініях клітин пухлин людини Експресію CD40 в лінії клітин Ramos лімфоми Буркітта, лінії клітин раку сечового міхура (АТСС, HТВ-4), лінії клітин раку підшлункової залози Hs 766T (АТСС, НТВ-134) і Capan-2 (АТСС, HТВ-80), підтверджували аналізом FASC, використовуючи 341G2Ser. Т24, Hs 766T і Capan-2 переварювали трипсином і збирали, a Ramos збирали без обробки. Лінії клітин промивали PBS і потім ресуспендували в забарвлюючому буфері, що містить 1 мкг/мл 341G2Ser. Забарвлюючий буфер отримували доданням 0,05 мМ EDTA, 0,05% азиду натрію і 5% імобілізованої бичачої сироватки до PBS. Після інкубації при 4°С протягом 15 хв., клітини двічі промивали забарвлюючим буфером і ресуспендували в розведенні 1:250 пов'язаного з РЕ козячого антилюдського IgG ( ) (Southern Biotechnology Associates, Inc.) із забарвлюючим буфером. Після інкубації при 4°С протягом 15 хв., клітини двічі промивали забарвлюючим буфером і аналізували FASCalibur (що виготовляється BD Biosciences). Таку ж кількість людського анти-2,4динітрофенольного (DNP) антитіла використали як негативний контроль. Аналіз проводили, використовуючи Cellquest (що виготовляється BD 59 Biosciences) як програмне забезпечення аналізу даних для розрахунку середньої інтенсивності флюоресценції. У результаті, Ramos, T24, Hs766T і Capan-2 мали середню інтенсивність флюоресценції, очевидно більш високу, ніж інтенсивність флюоресценції негативного контролю, при фарбуванні 341G2Ser, і, таким чином, була підтверджена експресія CD40. Приклад 21: Вплив анти-CD40 агоністичного антитіла на лінії клітин пухлин людини 2,5 103 клітин Ramos, 2,5 102 клітин Т24, 5 103 клітин Hs766T і 5 103 клітин Capan-2 відповідно суспендували в середовищі для отримання загального об'єму 100 мкл в плоскодонній 96ямковій планшеті (виготовленій Falcon). Ramos і Hs766T, Capan-2 і Т24 культивували відповідно протягом 66 год., 90 год. і 114 год. разом з 341G2Ser в концентрації від 1 нг/мл до 1000 нг/мл при 37°С в присутності 5% СO2. Додавали 10 мкл (3,7 MBq/мл) міченого 3Н тимідином (виготовленим Amersham Biosciences) і культивували при 37°С в присутності 5% СО2 протягом 6 год.. Клітини Ramos збирали на Printed Filtermat А (виготовлений PerkinElmer, Inc.), використовуючи 96ямковий мікроскладальник клітин (виготовлений Skatron Instruments, Inc.) і покривали мішком зразка (виготовленим PerkinElmer, Inc.). Додавали 12 мл Betaplate Scint (виготовленого PerkinElmer, Inc.), і дозу -променів вимірювали рідким сцинтилляційним лічильником (Pharmacia 1205 Betaplate: виготовленим Pharmacia Corp.)· Клітини Hs 766Т, клітини Т24 і клітини Сараn-2 збирали на фільтр Unifilter (виготовлений PerkinElmer, Inc.), використовуючи складальник клітин (виготовлений PerkinElmer, Inc.). Спеціальний ущільнювач був прикріплений до задньої частини кожного фільтра, і в нього додавали 20 мкл/ямка MicroScint20 (виготовленого PerkinElmer, Inc.). Дозу -променів вимірювали сцинтиляційним лічильником (TopCount: виготовлений Packard Instrument Co., Inc.). Дані виражали у вигляді частоти виживання клітин (%), середньої величини трикратних вимірювань, що отримується розподілом, отриманого в трьох незалежних тестах, на величину в контролі без обробки. У результаті, частоти виживання клітин знизилися у всіх лініях клітин, в залежності від концентрації 341G2Ser (табл. 1). При доданні 100 нг/мл 341G2Ser, частота виживання клітин Ramos становила 58%, частота виживання клітин Т24 становила 22%, частота виживання клітин Hs 766T становила 15%, і частота виживання клітин Capan-2 становила 77%. Було виявлено, що 341G2Ser володіє активністю інгібування зростання клітин Ramos, клітин Т24, клітин Hs 766T і клітин Capan-2. 93027 60 Таблиця 1 Частота виживання клітин Концентрація 341G2Ser (нг/мл) Лінія клітин 1 10 100 1000 Ramos 98,49% 81,68% 57,77% 55,26% Т24 97,94% 50,72% 21,97% 25,35% Hs 766T 34,67% 21,50% 14,67% 15,18% Capan-2 100,94% 85,34% 76,76% 72,89% Приклад 22: Вплив анти-CD40 агоністичного антитіла на модель мишей, уражених раком (1) Клітини Ramos 6-тижневих самиць «голих» мишей Balb/c (закуплених в CLEA Japan, Inc.) опромінювали радіацією в дозі 3 Gy, і 2 107 клітин/миша клітин Ramos підшкірно трансплантували в їх спину. Через 16 днів після трансплантації, вимірювали розмір пухлин, що зросли там. Маючих рак мишей з розміром пухлини від 50 до 170 мм3 ділили на групи, кожна з яких складалася з 5 мишей. На 16-ий день маючим рак мишам внутрішньовенно вводили 100 мкг/миша 341G2Ser (розчин в 200 мкл PBS, що містить 1% сироватку «голих» мишей), і розмір пухлини вимірювали до 47-го дня. Людське антитіло проти альбуміну людської сироватки (HAS) використали як негативний контроль. (2) Клітини Т24 Масу клітин Т24, яку піддали трикратному підшкірному пасажу на спину «голих» мишей, видаляли і підшкірно трансплантували в спину 6тижневих самиць «голих» мишей Balb/c (закуплених в CLEA Japan, Inc.). Маса пухлинних клітин, призначених для трансплантації, становила приблизно 3 мм . Через 10 днів після трансплантації вимірювали розмір прищеплених пухлин. Маючих рак мишей з розміром пухлини від 80 до 200 мм3 ділили на групи, кожна з яких складалася з 5 мишей. На 10-й день маючим рак мишам однократно внутрішньовенно вводили 100 мкг/миша 341G2Ser (розчин в 200 мкл PBS, що містить 1% сироватку «голих» мишей), і розмір пухлини вимірювали до 29-го дня. Таку ж кількість людського анти-DNP антитіла використали як негативний контроль. (3) Клітини Hs 766T 7 105 клітин Hs 766T /миша підкшкірно трансплантували в спину 8-тижневих самиць «голих» мишей Balb/c (закуплених в CLEA Japan, Inc.). Через 16 днів після трансплантації вимірювали розмір прищеплених пухлин. Маючих рак мишей з розміром пухлини від 50 до 140 мм3 ділили на групи, кожна з яких складалася з 5 мишей. На 16й день маючим рак мишам однократно внутрішньовенно вводили 100 мкг/миша 341G2Ser (розчин в 200 мкл PBS, що містить 1% сироватку «голих» мишей), і розмір пухлини вимірювали до 32го дня. Таку ж кількість людського анти-DNP антитіла використали як негативний контроль. (4) Клітини Capan-2
ДивитисяДодаткова інформація
Назва патенту англійськоюMutant antibody, which specifically binds to cd40
Автори англійськоюTakahasi Nobuaki, Miura Toru, Kitagava Yosinori, Hirano Aki
Назва патенту російськоюМутантное антитело, которое специфически связывается с cd40
Автори російськоюТакахаси Нобуаки, Миура Тору, Китагава Йосинори, Хирано Аки
МПК / Мітки
МПК: C07K 16/28, A61K 39/395, A61P 37/00, A61P 7/00, C12N 15/09, C12P 21/08
Мітки: специфічно, антитіло, яке, зв'язується, мутантне
Код посилання
<a href="https://ua.patents.su/144-93027-mutantne-antitilo-yake-specifichno-zvyazuehtsya-z-cd40.html" target="_blank" rel="follow" title="База патентів України">Мутантне антитіло, яке специфічно зв’язується з cd40</a>
Попередній патент: Водонепроникний паропроникний багатошаровий виріб, спосіб виготовлення такого виробу (варіанти)
Наступний патент: Система і спосіб, що використовують протокол розподіленого резервування при керуванні доступом до надширокосмугового середовища передавання даних
Випадковий патент: Тепломасообмінний апарат "газ-рідина"