Консорціум мікроорганізмів для біоремедіації, суміш для біоремедіації та їх застосування для видалення забруднюючих речовин з ґрунту
Номер патенту: 110449
Опубліковано: 25.12.2015
Автори: Коморовская Іга, Бощик-Малешак Ханка, Поповская Магдалена
Формула / Реферат
1. Консорціум мікроорганізмів для біоремедіації, який містить штам 2L Stenotrophomonas sp., штам 5L Stenotrophomonas sp., штам 6L Stenotrophomonas sp., штам 3N Stenotrophomonas sp., штам 4P Achromobacter sp., штам 1N Arthrobacter sp., штам 2N Brevundimonas sp., штам 5N Brevundimonas sp., штам 6N Brevundimonas sp., штам 3G Pseudomonas sp. та штам 4G Pseudomonas sp., депонований під номером KKP 2041p (Колекція промислових мікроорганізмів IAFB - Варшавський інститут сільськогосподарської та харчової біотехнології).
2. Консорціум мікроорганізмів за п. 1, який відрізняється тим, що щонайменше один штам із консорціуму мікроорганізмів, переважно всі штами, характеризуються стійкістю до щонайменше одного антибіотика з наступних груп: аміноглікозидів, фторхінолонів, глікопептидів, макролідів, пеніцилінів, сульфонамідів та тетрациклінів;
причому переважно щонайменше один штам із консорціуму мікроорганізмів, переважно всі штами, характеризуються стійкістю до щонайменше одного з ципрофлоксацину, еритроміцину, гентаміцину, пеніциліну, стрептоміцину, сульфаметоксазолу, тетрацикліну, ванкоміцину.
3. Консорціум мікроорганізмів за п. 1 або п. 2, який відрізняється тим, що щонайменше один штам із консорціуму мікроорганізмів, переважно всі штами, характеризуються стійкістю до важких металів, таких як As (III), Cu (II), Cr (VI), Zn (II) та Ni (II).
4. Суміш для біоремедіації, яка містить консорціум мікроорганізмів штамів за будь-яким із пп. 1-3.
5. Суміш для біоремедіації за п. 4, яка відрізняється тим, що, окрім консорціуму мікроорганізмів з 11 штамів, вона містить рідке або тверде мінеральне середовище, доповнене нітросполукою як єдиним джерелом вуглецю.
6. Суміш для біоремедіації за п. 4 або п. 5, яка відрізняється тим, що вона містить 105 бактеріальних клітин в 1 мл середовища.
7. Суміш для біоремедіації за п. 5 або п. 6, яка відрізняється тим, що нітросполука у середовищі вибрана з нітробензолу, п-нітроаніліну, 2-нітротолуолу, 4-нітротолуолу, динітротолуолів, тринітротолуолів, мононітрофенолів, полінітрофенолів.
8. Суміш для біоремедіації за п. 5 або п. 6, яка відрізняється тим, що джерело вуглецю у середовищі являє собою щонайменше одну з нітросполук за п. 7;
та причому нітросполука є доданою в кількості 50-200 мг/л культурального середовища, залежно від ступеня забруднення ґрунту.
9. Застосування суміші для біоремедіації за будь-яким із пп. 4-8 для видалення з ґрунту забруднюючих речовин у формі ароматичних нітросполук.
10. Спосіб обробки забрудненого ґрунту, який відрізняється тим, що спосіб включає наступні етапи:
внесення у ґрунт із забрудненням розмноженої культури консорціуму мікроорганізмів за будь-яким із пп. 1-3 або суміші за будь-яким із пп. 4-8,
збагачення киснем ґрунту із забрудненням механічним способом та підтримання його вологості на відповідному рівні,
видалення ароматичних нітросполук із забрудненого ґрунту за допомогою внесених мікроорганізмів.
11. Спосіб за п. 10, який відрізняється тим, що його здійснюють in situ або ex situ.
12. Спосіб за п. 10 або п. 11, який відрізняється тим, що культуру розмножують на рідкому або твердому мінеральному середовищі, доповненому нітросполукою як єдиним джерелом вуглецю,
та причому нітросполука у середовищі переважно включає нітробензол, п-нітроанілін, 2-нітротолуол, 4-нітротолуол, динітротолуоли, тринітротолуоли, мононітрофеноли, полінітрофеноли.
13. Спосіб за п. 12, який відрізняється тим, що джерело вуглецю у середовищі являє собою щонайменше одну з нітросполук за п. 12,
та причому нітросполуку додають у кількості 50-200 мг/л культурального середовища, залежно від ступеня забрудненості ґрунту.
14. Спосіб за будь-яким із пп. 10-13, який відрізняється тим, що культуру розмножують при значеннях температури 20-25 °C.
15. Спосіб за будь-яким із пп. 10-14, який відрізняється тим, що забруднений ґрунт обприскують суспензією бактеріальної культури при об'ємному співвідношенні суміші і ґрунту в діапазоні 1:10-3:10.
Текст
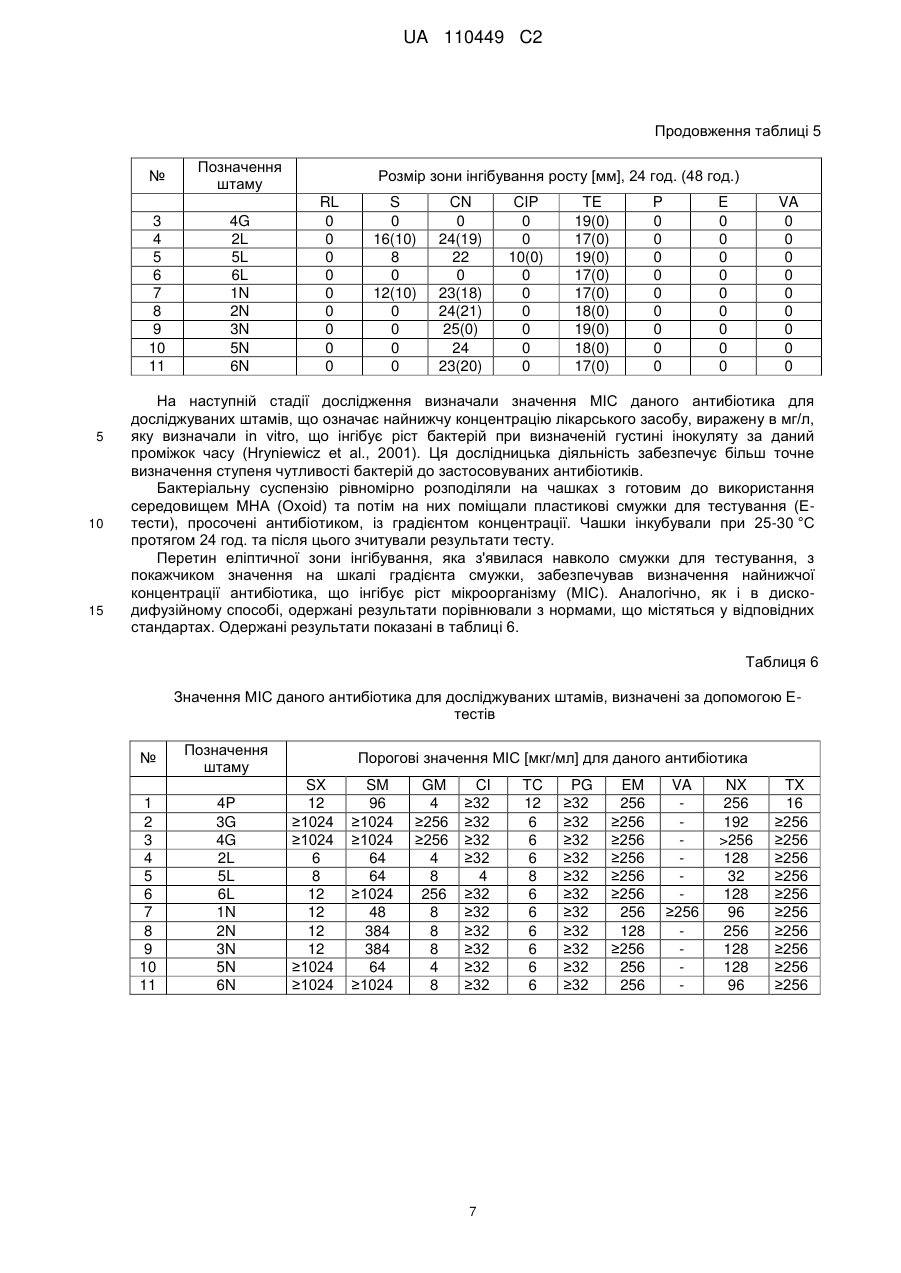
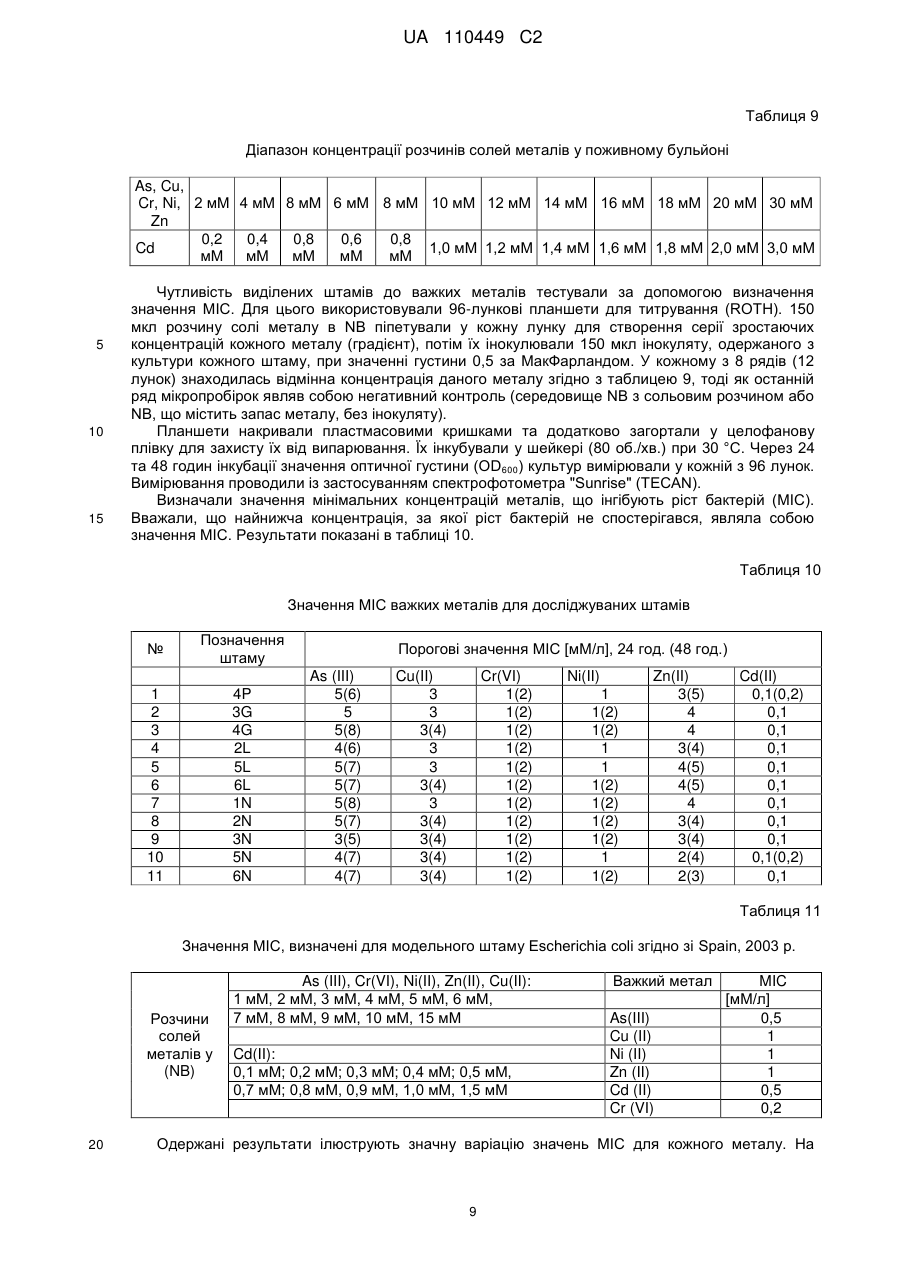
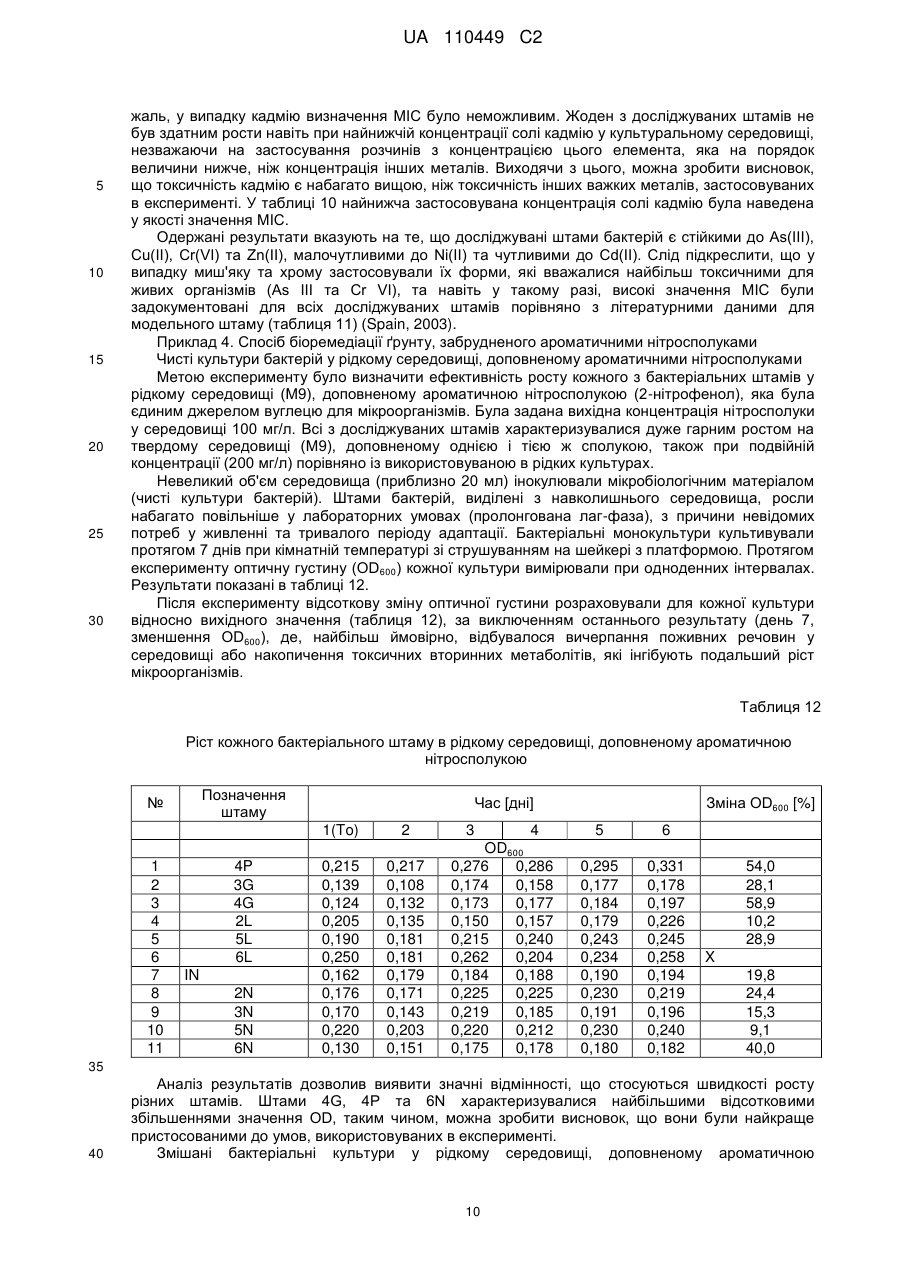
Реферат: Запропонований винахід описує консорціум мікроорганізмів для біоремедіації, який містить штам 2L Stenotrophomonas sp., штам 5L Stenotrophomonas sp., штам 6L Stenotrophomonas sp., UA 110449 C2 (12) UA 110449 C2 штам 3N Stenotrophomonas sp., штам 4Р Achromobacter sp., штам 1N Arthrobacter sp., штам 2N Brevundimonas sp., штам 5N Brevundimonas sp., штам 6N Brevundimonas sp., штам 3G Pseudomonas sp. та штам 4 Pseudomonas sp., депонований під номером ККР 2041р (Колекція промислових мікроорганізмів IAFB - Варшавський інститут сільськогосподарської та харчової біотехнології), суміш для біоремедіації, яка містить ці штами, застосування суміші для видалення забруднюючих речовин з ґрунту та спосіб обробки забрудненого ґрунту. UA 110449 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки Даний винахід відноситься до композиції, яка містить 11 штамів: штам 2L Stenotrophomonas sp., штам 5L Stenotrophomonas sp., штам 6L Stenotrophomonas sp., штам 3N Stenotrophomonas sp., штам 4P Achromobacter sp., штам 1N Arthrobacter sp., штам 2N Brevundimonas sp., штам 5N Brevundimonas sp., штам 6N Brevundimonas sp., штам 3G Pseudomonas sp. та штам 4G Pseudomonas sp., депонованої під номером KKP 2041p, вакцини для біоремедіації (суміші для біоремедіації), яка містить композицію цих бактеріальних штамів, їхнього застосування при видаленні забруднюючих речовин з ґрунту, а також способу обробки ґрунту. Рівень техніки Безперервний розвиток промисловості пов'язаний з появою у навколишньому середовищі хімічних сполук, які за нормальних умов там не зустрічаються. Нині нітросполуки відносяться до основних типів антропогенного засмічення, причому із них нітробензол, 2- та 4-нітротолуол, 3нітротолуол, 4-нітрофенол, 3-нітрофенол та п-нітроанілін заслуговують особливої уваги. Їх застосовують при виготовленні вибухових речовин, при одержанні пестицидів та гербіцидів, у якості субстратів при синтезі барвників, пластмас, фарб, а також у фармацевтичній 8 промисловості. Розраховано, що кожного року у світі одержують приблизно 10 тон органічних нітросполук та при цьому більше 8,5 тони тільки нітробензолу викидається в навколишнє середовище. Протягом майже 80 років масштабне використання цих сполук у багатьох галузях промисловості, а також виробництво великої кількості матеріалів військового призначення та боєприпасів у першій половині минулого століття у зв'язку з двома світовими війнами сприяло значному забрудненню навколишнього середовища нітросполуками. Вищезгадані типи сполук та їхні метаболіти є високотоксичними та небезпечними для людини. Деякі з них є сильнодіючими отрутами, часто з сильними мутагенними та канцерогенними властивостями. Більшість ароматичних нітросполук характеризуються їхньою стабільністю та здатністю зберігатися в біосистемах, а також значною стійкістю до розкладання (Kulkarni та Chaudhari, 2007). Ще одне питання пов'язане з тим фактом, що забруднення ґрунту нітросполуками також є безпосередньою загрозою для підземних вод, та, як наслідок, може привести в результаті до проникнення цих забруднювачів у проточну воду. Проблема забруднення ґрунту та підземних вод органічними сполуками із різних галузей промисловості турбує не тільки Польщу та інші країни Європейського Союзу, але практично всі промислово розвинені країни у світі. Як у Польщі, так і в усьому світі, проблема засмічення навколишнього середовища цими сполуками, головним чином, стосується ділянок, суміжних з хімічними заводами, де їх використовували у якості субстратів в органічному синтезі, а також ділянок військових баз, де їх тримали та зберігали. Існують декілька загальноприйнятих способів фізико-хімічної нейтралізації нітросполук, наприклад, окиснення та фотоокиснення, гідроліз, випарювання, спалювання, адсорбція і т.п. (Kanekar et al., 2003). Ці способи, однак, мають численні недоліки та обмеження. Спалювання не є ні економічно ефективним, ні безпечним для навколишнього середовища. Крім того, воно супроводжується викидом значних кількостей токсичних димових газів у навколишнє середовище. Під час таких процедур, як фільтрація, екстракція або адсорбція на смолі, небажані сполуки тільки відокремлюються та це не приводить до їхнього розпаду. У той же час способи окиснення приводять до утворення токсичних похідних та пов'язані з високою вартістю (Kulkarni та Chaudhari, 2007). Були розроблені декілька стратегій ремедіації земель, які засновані на фізичних, хімічних та біологічних способах. Однак, вважається, що технології біоремедіації є найбільш дешевими та найбільш ефективними, а також, таким чином, безпечними є технології, у яких використовується метаболічний потенціал мікроорганізмів. Біоремедіація являє собою спосіб регенерації, при якому мікроорганізми, наприклад, бактерії, дріжджі та нитчасті гриби застосовують для розщеплення шкідливих речовин до менш токсичних або нетоксичних сполук. Для цілей, пов'язаних зі способами біоремедіації, мікроорганізми виділяють з природної мікрофлори, присутньої у забрудненому навколишньому середовищі (реінокуляція), або одержують за допомогою способів генної інженерії. На практиці, у способі біологічного розкладання використовують спеціальні набори (консорції мікроорганізмів), які характеризуються особливими здатностями до розкладання певних груп вуглеводнів. Такі консорції, крім високої активності детоксикації, повинні швидко пристосовуватися до забрудненого навколишнього середовища, взаємодіяти з аборигенною мікрофлорою та не накопичувати токсичні проміжні продукти розщеплення. Можна розрізнити два типи мікробіологічних препаратів: препарати, які містять штами 1 UA 110449 C2 5 10 15 20 25 30 35 40 45 50 55 60 зовнішнього походження, та аутовакцини, які містять ефективні аборигенні штами, виділені з обробленого ґрунту із застосуванням різних способів. У патенті PL 180141 розкритий спосіб мікробіологічної ремедіації ґрунтів, забруднених нафтопродуктами, при якому використовують аборигенні мікроорганізми, виділені з ґрунту, що підлягає обробці. Виділені штами бактерій культивують за аеробних умов у рідкому мінеральному середовищі, доповненому нафтовими вуглеводнями, та після визначення відбирають бактерії з найвищою активністю при розкладанні цих забруднювачів. Відібрані 5-10 різних видів бактерій культивують при 26 °C протягом 48-72 годин. Розмножену культуру вносять у забруднений ґрунт шляхом його обприскування водною суспензією бактерій при 5 більше 10 клітин на 1 г сухого ґрунту. У патенті PL 189586 розкритий спосіб одержання аутовакцини, яка прискорює обробку ґрунту та стічної води, забруднених нафтопродуктами, що заснований на виділенні бактерій з ґрунту та стічних вод за допомогою розведення та селективного культивування у середовищах, збагачених стерильною сирою нафтою або нафталіном в якості єдиного джерела вуглецю. Тривала присутність ароматичних нітросполук, особливо нітроаніліну, нітробензолу та нітрофенолу, у ґрунті запускає процес природної адаптації та добору мікроорганізмів у забрудненій ділянці, що впливає на якість, а також композицію видів автохтонних (нативних для даної екосистеми) груп мікроорганізмів. Ефективна біоремедіація потребує, окрім точного знання мікроорганізмів, що забезпечують розкладання даних ароматичних нітросполук, розуміння шляхів розкладання цих сполук на фізіологічному, біохімічному та молекулярному рівнях, а також дослідження, спрямованого на оптимізацію умов, необхідних для безперешкодного здійснення способів біоремедіації. Така науково-дослідна робота була виконана авторами даного вирішення. Дуже часто повідомляється про високі концентрації не тільки ряду органічних ксенобіотиків, але також важких металів, наприклад, миш'яку, кадмію, хрому, міді, свинцю, ртуті, нікелю, цинку та інших у ґрунтах з військових об'єктів (серед іншого, полігонів для військової підготовки) та промислових ділянок (Bahig та Altalhi, 2009). Важкі метали розглядаються як сильні інгібітори процесів біологічного розкладання органічних ксенобіотиків (Silva et al., 2007). Вважається, що присутність важких металів у промислових стічних водах є одним з основних факторів, що обмежують застосування способів біологічної ремедіації (Kulkami та Chaudhari, 2007). Довгострокова присутність цих забруднювачів у навколишньому середовищі, однак, привела у результаті до розвитку у бактерій механізмів детоксикації цих сполук. Крім того, припускають, що витривалість мікроорганізмів до важких металів може впливати на збереження та передачу генів стійкості до антибіотиків між бактеріями шляхом підвищення селективного тиску навколишнього середовища (Spain, 2003). Також існують дані щодо зв'язку між стійкістю бактерій до багатьох клінічно важливих класів антибактеріальних лікарських засобів, важких металів та сполук четвертинного амонію, які застосовують у якості засобів для дезінфекції. У багатьох випадках це пов'язано з локалізацією генів, які визначають таку стійкість, у безпосередній близькості в одній і тій же бактеріальній плазміді, що дозволяє припустити можливість передачі цілих кластерів генів шляхом горизонтального переносу генів (Schluter et al., 2007). Існують численні дослідження щодо способу біоремедіації різних ксенобіотиків, що засмічують ґрунт, наприклад, сирої нафти та її похідних, але в існуючому рівні техніки відсутні дослідження щодо in situ біоремедіації ділянок, забруднених ароматичними нітросполуками. У спеціальній літературі, що стосується біологічного розкладання циклічних нітросполук, цю проблему розглядали та аналізували тільки у лабораторному масштабі. Застосування ефективного способу біологічного розкладання нітросполук, особливо нітроаніліну, очевидно, є оптимальним вирішенням з багатьох причин, головним чином, оскільки ці процеси відбуваються в природних умовах у навколишньому середовищі, а також, що дуже важливо, вони є дуже ефективними та пов'язані з меншими витратами, ніж традиційні способи, наприклад, фізикохімічні методики. У патенті Польщі PL 380007 розкритий спосіб біоремедіації ґрунту та запобігання поширенню забруднення органічними речовинами, що заснований на внесенні дріжджів виду Yarrowia lipolytica в іммобілізованій формі у ґрунт. Дріжджі вносять безпосередньо у забруднені ділянки або поблизу від них, із застосуванням in situ способу, в формі вакцини (біологічного препарату) на органічному середовищі, що являє собою альгінат натрію, агар, желатин, колаген або пташині пера. Вакцину, у рідкій або сухій формі, можна вносити у вигляді гранул, або біоплівки, або біогелю, та при цьому дріжджі складають 5-50 % вакцини (за масою), причому вакцина може складати від 10 до 100 % матеріалу, який вносять у ґрунт. Вакцину поміщають на глибину 0,1-2 м у ямки діаметром 0,1-1,0 м, при цьому їх розподіл може бути лінійним, або 2 UA 110449 C2 5 10 15 20 25 30 35 40 45 50 55 60 таким, що перекривається у поперечному напрямку, або концентричним, або таким, що охоплює дану ділянку, або розташовують у найнижчій точці відповідно до напрямку течії підземних вод, та у випадку захисту водойм, поблизу урізу води, там, куди не досягають хвилі. Цей винахід можна застосовувати, зокрема, щодо ділянок, забруднених сполуками, що відносяться до нафтопродуктів, відходами нафтової промисловості, рослинними оліями та мінеральними маслами. Розкриття винаходу Дане вирішення відноситься до природного способу видалення шкідливих забруднювачів із навколишнього середовища без внесення у нього будь-яких синтетичних продуктів. In situ біоремедіація заснована на природних процесах, які відбуваються у навколишньому середовищі, що пов'язано зі значно більш низькими витратами, ніж звичайні фізико-хімічні способи. Винайдена та депонована композиція штамів (вакцина) забезпечує швидке досягнення відповідної кількості складу та здійснення біоремедіації за короткий проміжок часу. Бактеріальні штами, які входять до складу композиції вакцини для біоремедіації, що є об'єктом даного винаходу, здатні розкладати/метаболізувати ароматичні нітросполуки та, як правило, ароматичні сполуки, наприклад, феноли, амінофеноли, нітрофеноли, а також поліциклічні ароматичні сполуки, які можуть використовуватися цими мікроорганізмами у якості єдиного джерела вуглецю та енергії. Крім того, ці штами здатні рости в присутності високих концентрацій важких металів (та причому важкі метали також присутні у випадку ґрунтів, забруднених органічними нітросполуками або нафтопродуктами). У той же час вони здатні рости у присутності високих концентрацій антибіотиків (це має високу значущість у випадках біоремедіації ділянок поблизу фармацевтичних підприємств або додатково забруднених антибіотиками або їхніми метаболітами); причому антибіотики належать до наступних груп: макролідів (еритроміцин), аміноглікозидів (стрептоміцин), фторхінолонів (ципрофлоксацин), тетрациклінів (тетрациклін), бета-лактамів (пеніцилін), глікопептидів (ванкоміцин). Метою даного винаходу є ефективний спосіб видалення токсичних ароматичних нітросполук із застосуванням мікробіологічної суміші для біоремедіації (вакцини) для біоремедіації ґрунту, забрудненого ароматичними нітросполуками. Об'єктом даного винаходу є композиція штамів, яка містить штам 2L Stenotrophomonas sp., штам 5L Stenotrophomonas sp., штам 6L Stenotrophomonas sp., штам 3N Stenotrophomonas sp., штам 4P Achromobacter sp., штам 1N Arthrobacter sp., штам 2N Brevundimonas sp., штам 5N Brevundimonas sp., штам 6N Brevundimonas sp., штам 3G Pseudomonas sp. та штам 4G Pseudomonas sp., депонована під номером KKP 2041p (Колекція промислових мікроорганізмів IAFB - Варшавський інститут сільськогосподарської та харчової біотехнології, Польща). Переважно щонайменше один штам із композиції, більш переважно всі штами характеризуються стійкістю до антибіотиків з наступних груп: аміноглікозидів, фторхінолонів, глікопептидів, макролідів, пеніцилінів, сульфонамідів, тетрациклінів. Переважно щонайменше один штам із композиції, більш переважно всі штами характеризуються стійкістю до ципрофлоксацину. Переважно щонайменше один штам із композиції, більш переважно всі штами характеризуються стійкістю до еритроміцину. Переважно щонайменше один штам із композиції, більш переважно всі штами характеризуються стійкістю до гентаміцину. Переважно щонайменше один штам із композиції, більш переважно всі штами характеризуються стійкістю до пеніциліну. Переважно щонайменше один штам із композиції, більш переважно всі штами характеризуються стійкістю до стрептоміцину. Переважно щонайменше один штам із композиції, більш переважно всі штами характеризуються стійкістю до сульфаметоксазолу. Переважно щонайменше один штам із композиції, більш переважно всі штами, характеризуються стійкістю до тетрацикліну. Переважно щонайменше один штам із композиції, більш переважно всі штами, характеризуються стійкістю до ванкоміцину. Переважно щонайменше один штам із композиції, більш переважно всі штами, характеризуються стійкістю до важких металів, таких як As (III), Cu (II), Cr (VI), Zn (II) та Ni (II). Іншим об'єктом даного винаходу є вакцина для біоремедіації (суміш для біоремедіації), яка містить композицію штамів, як описано вище. 5 Переважно вакцина містить 10 клітин бактерій у мл середовища. Переважно, окрім композиції з 11 штамів, вакцина містить рідке мінеральне середовище, доповнене нітросполукою у якості єдиного джерела вуглецю. 3 UA 110449 C2 5 10 15 20 25 30 35 40 45 Переважно, окрім композиції з 11 штамів, вакцина містить тверде мінеральне середовище, доповнене нітросполукою у якості єдиного джерела вуглецю. Переважно нітросполука у середовищі являє собою нітробензол, п-нітроанілін, 2нітротолуол, 4-нітротолуол, динітротолуоли, тринітротолуоли, мононітрофеноли або полінітрофеноли. Переважно джерелом вуглецю у середовищі є щонайменше одна з нітросполук, вказаних вище. Переважно до культурального середовища додають нітросполуку в кількості 50–200 мг/л, залежно від ступеня забруднення ґрунту. Іншим об'єктом даного винаходу є вакцина для біоремедіації для видалення з ґрунту забруднюючих речовин у формі ароматичних нітросполук. Іншим об'єктом даного винаходу є спосіб обробки забрудненого ґрунту за допомогою застосування вакцини, який заснований на виділенні ґрунтових мікроорганізмів із забрудненого ґрунту, їхньому культивуванні, відборі/визначенні мікроорганізмів та потім вирощуванні відібраних ґрунтових мікроорганізмів, після чого розмножену культуру вносять у забруднений ґрунт, який збагачують киснем механічним способом, та його вологість підтримують на відповідному рівні, причому характеризується тим фактом, що із забрудненого ґрунту видаляють ароматичні нітросполуки та ґрунтові мікроорганізми входять до складу композиції штамів, як описано вище. Переважно спосіб здійснюють in situ. Переважно спосіб здійснюють ex situ. Переважно культури розмножують на рідкому мінеральному середовищі, доповненому нітросполукою у якості єдиного джерела вуглецю. Переважно культури розмножують на твердому мінеральному середовищі, доповненому нітросполукою у якості єдиного джерела вуглецю. Переважно нітросполука у середовищі являє собою нітробензол, п-нітроанілін, 2нітротолуол, 4-нітротолуол, динітротолуоли, тринітротолуоли, мононітрофеноли або полінітрофеноли. Переважно джерелом вуглецю у середовищі є щонайменше одна з нітросполук, вказаних вище. Переважно до культурального середовища додають нітросполуку в кількості 50-200 мг/л, залежно від ступеня забруднення ґрунту. Переважно культуру розмножують при значеннях температури 20-25 °C. Переважно забруднений ґрунт обприскують суспензією бактерій (вакциною для біоремедіації) при об'ємному співвідношенні вакцини до ґрунту у діапазоні 1:10-3:10. Короткий опис графічних матеріалів На фігурі 1 представлений ріст змішаної культури бактерій (11 штамів) у рідкому середовищі (M9), доповненому ароматичною нітросполукою. Опис варіантів здійснення Застосування композиції, що являє собою об'єкт даного винаходу, є природним способом, при якому не вносять ніяких синтетичних продуктів у навколишнє середовище. Той факт, що об'єкт даного вирішення містить автохтонні організми, приводить до скорочення проміжку часу, необхідного для біологічного розкладання. Більше того, спосіб заснований на процесах, які в природі відбуваються у навколишньому середовищі, що є ефективними та більш ефективними, ніж, наприклад, фізико-хімічні способи. Мікроорганізми виділяли з ґрунту, забрудненого нітросполуками (колишня військова база у Померанії). Для цілей даного вирішення штами позначали наступним чином. Таблиця 1 Позначення штамів 2L 5L 6L 4P 3G 4G 1N Stenotrophomonas sp. Stenotrophomonas sp. Stenotrophomonas sp. Achromobacter sp. Pseudomonas sp. Pseudomonas sp. Arthrobacter sp. 50 4 UA 110449 C2 Продовження таблиці 1 Позначення штамів 2N 3N 5N 6N 5 10 15 20 25 Brevundimonas sp. Stenotrophomonas sp. Brevundimonas sp. Brevundimonas sp. Об'єкт даного винаходу був представлений у наступних необмежувальних варіантах здійснення. Приклади Приклад 1. Визначення взаємного антагоністичного ефекту штамів, що складають композицію Для визначення того, чи окремі штами не виявляють антагоністичний ефект один на одного (інгібування росту деяких штамів іншими в результаті секреції бактеріоцинів у навколишнє середовище), бактерії висівали за допомогою стерильної інокуляційної петлі на чашки Петрі з середовищем M9 (Na2HPO4 x H2O – 0,134 г; KH2PO4 – 0,03 г; NaCl – 0,5 г; MgSO4 x 7H2O – 2,47 г; CaCl2 – 111 мг, дистильована H2O до об'єму 1000 мл), доповненим 2-нітрофенолом при концентрації 200 мг/л (варіант I) або поживним агаром (варіант II). Визначені бактеріальні штами висівали на відстані приблизно 2 мм при фіксованому розміщенні. Створені конфігурації були призначені для підтвердження того, що кожний зі штамів здатний рости у безпосередній близькості від інших штамів. Результати зчитували після 24 годин інкубації при 30 °C. Кожний зі штамів, які тестували, був здатним рости у безпосередній близькості від іншого. Виходячи з цього, можна зробити висновок, що антагоністичні ефекти між мікроорганізмами, які тестували, відсутні, тобто жоден з досліджуваних штамів не змінює навколишнє середовище так, щоб інгібувати ріст будь-якого з інших, наприклад, за допомогою продукції бактеріоцинів. Однакові результати одержували в обох варіантах експерименту, що підтверджує те, що також і в присутності застосовуваного ксенобіотика, досліджувані штами не продукують біологічно активні речовини, які будуть приводити до бактеріостазу. Приклад 2. Визначення чутливості до антибіотиків у штамів, що складають композицію Диско-дифузійний спосіб здійснювали для визначення чутливості бактерій до вибраних антибіотиків. Використовували диски, просочені антибіотиком з точно визначеною концентрацією (BioMerioux) (таблиця 2) та проводили тест із визначенням мінімальної інгібувальної концентрації за допомогою E-тестів (Oxoid) (таблиця 3). Таблиця 2 Диски з антибіотиками, застосовувані в дослідженнях Антибіотик ципрофлоксацин (CIP) еритроміцин (E) гентаміцин (CN) пеніцилін G (P) стрептоміцин (S) сульфаметоксазол (RL) тетрациклін (TE) ванкоміцин (VA) Концентрація [мкг/мл] 5 15 30 10 25 25 30 30 30 Таблиця 3 E-тести, застосовувані в дослідженнях E-тест (антибіотик) ципрофлоксацин (CI) еритроміцин (EM) гентаміцин (GM) норфлоксацин (NX) Діапазон E-тесту [мкг/мл] 32 – 0,002 256 – 0,016 256 – 0,016 256 – 0,016 5 UA 110449 C2 Продовження таблиці 3 E-тест (антибіотик) пеніцилін G (PG) стрептоміцин (SM) сульфаметоксазол (SX) тетрациклін (TC) цефтриаксон (TX) ванкоміцин (VA) 5 10 15 Діапазон E-тесту [мкг/мл] 32 – 0,002 1024 – 0,064 1024 – 0,064 256 – 0,016 256 – 0,016 256 – 0,016 Метою проведеного дослідження було визначити, у якій мірі виділені бактеріальні штами є чутливими до вибраних антибіотиків. Антибіотики вибирали таким чином, що вони належали до різних груп, відповідно, аміноглікозидів (гентаміцин, стрептоміцин); фторхінолонів другого покоління (ципрофлоксацин); глікопептидів (ванкоміцин); макролідів (еритроміцин); пеніцилінів (пеніцилін); сульфонамідів (сульфаметоксазол); тетрациклінів (тетрациклін). Інокулят зі значенням 0,5 за МакФарландом одержували з культури кожного штаму за допомогою денситометра (EMO). Потім за допомогою стерильних ватних паличок суспензію бактеріальних клітин розподіляли на чашках з готовим до використання середовищем MHA (Oxoid) та через 15 хвилин на них поміщали диски, просочені антибіотиками при визначених концентраціях. Чашки інкубували при 25-30 °C та результати зчитували через 24 та 48 годин. Мірою чутливості штаму, який тестували, до даного антибіотика був розмір зони інгібування, яка утворилася навколо диска, просоченого антибіотиком. Зчитані результати (розміри зон, виміряні в мм) порівнювали з даними, що містяться в стандартах Європейського комітету з тестування чутливості до антимікробних препаратів (European Committee on Antimicrobial Susceptibility Testing) (EUCAST), 2010 р. (таблиця 4). Таблиця 4 Граничні значення зон інгібування росту згідно зі стандартами EUCAST, 2010 р. Повна назва антибіотика ципрофлоксацин еритроміцин гентаміцин пеніцилін стрептоміцин сульфаметоксазол тетрациклін ванкоміцин Скорочення Вміст антибіотика у диску[мкг] CIP E CN P S RL TE VA 5 15 30 10 25 25 30 30 Граничне значення зони інгібування росту (мм) S*>= R*256 128 32 128 96 256 128 128 96 TX 16 ≥256 ≥256 ≥256 ≥256 ≥256 ≥256 ≥256 ≥256 ≥256 ≥256 UA 110449 C2 Таблиця 7 Діапазони E-тесту та порогові значення MIC згідно зі стандартами EUCAST, 2010 р. Повна назва антибіотика ципрофлоксацин еритроміцин гентаміцин норфлоксацин пеніцилін G стрептоміцин сульфаметоксазол тетрациклін цефтриаксон ванкоміцин Скорочення Діапазон E-тесту [мкг/мл] 32 – 0,002 256 – 0,016 256 – 0,016 256 – 0,016 32 – 0,002 1024 – 0,064 1024 – 0,064 256 – 0,016 256 – 0,016 256 – 0,016 CI EM GM NX PG SM SX TC TX VA Порогове значення MIC [мкг/мл] S*>= R*< 0,5 1 1 2 2 4 0,5 1 8 4 4 2 4 1 2 1 2 2 2 * S - сприйнятливий; R - стійкий 5 10 15 Значення MIC, визначені у цьому дослідженні, узгоджуються з результатами, одержаними за допомогою диско-дифузійного способу. Штами, для яких зони інгібування росту навколо дисків, просочених визначеним антибіотиком, як було виявлено, були більшими у порівнянні з іншими штамами, характеризувалися більш низькими значеннями MIC, що означає більш низьку концентрацію антибіотика, що інгібує ріст мікроорганізму та, таким чином, більш високу чутливість штаму до цього лікарського засобу. Порівняння значень MIC з результатами, одержаними за допомогою диско-дифузійного способу, продемонструвало високий ступінь збіжності між ними. Що стосується штамів бактерій, для яких були продемонстровані високі значення MIC, зони інгібування росту навколо диска з антибіотиком, не спостерігалися або були дуже малими. Такий результат підтверджує, що досліджуваний штам є стійким до даного антибіотика. Одержані значення MIC порівнювали з пороговими значеннями MIC (таблиця 7), які містяться в інструкції EUCAST (2010). Виходячи з цього, можна стверджувати, що всі з 11 досліджуваних штамів є стійкими до антибіотиків, застосовуваних в дослідженні. Приклад 3. Визначення чутливості штамів, що складають композицію, до важких металів Таблиця 8 Солі важких металів, розчинні у воді Сіль металу Арсеніт натрію Хлорид нікелю Дихромат калію Сульфат цинку Сульфат кадмію Сульфат міді 20 25 Формула NaAsO2 NiCl2 × 6H2O Cr2K2O7 ZnSO4 × 7H2O CdSO4 × 8H2O CuSO4 Молярна маса [г/моль] 129,90 237,70 294,20 287,50 769,54 159,60 Для одержання вихідного розчину, що містить метал (концентрованого) (таблиця 8): • 100 мМ водного розчину солей As(III), Cd(II), Cr(VI), Ni(II), Zn(II), • 1 M водного розчину Cu(II) аліквоту солі металу розчиняли у дистильованій воді, потім фільтрували через шприцевий фільтр із розміром пор 0,22 мкм. Одержані розчини зберігали при 4 °C. У цих дослідженнях використовували концентрації важких металів у діапазоні 0,2-30 мМ. Для цього безпосередньо перед застосуванням рідке середовище (поживний бульйон) доповнювали відповідним об'ємом концентрованого вихідного розчину до кінцевої концентрації, вказаної у таблиці 9 для кожного металу. 8 UA 110449 C2 Таблиця 9 Діапазон концентрації розчинів солей металів у поживному бульйоні As, Cu, Cr, Ni, 2 мМ 4 мМ 8 мМ 6 мМ 8 мМ 10 мМ 12 мМ 14 мМ 16 мМ 18 мМ 20 мМ 30 мМ Zn 0,2 0,4 0,8 0,6 0,8 Cd 1,0 мМ 1,2 мМ 1,4 мМ 1,6 мМ 1,8 мМ 2,0 мМ 3,0 мМ мМ мМ мМ мМ мМ 5 10 15 Чутливість виділених штамів до важких металів тестували за допомогою визначення значення MIC. Для цього використовували 96-лункові планшети для титрування (ROTH). 150 мкл розчину солі металу в NB піпетували у кожну лунку для створення серії зростаючих концентрацій кожного металу (градієнт), потім їх інокулювали 150 мкл інокуляту, одержаного з культури кожного штаму, при значенні густини 0,5 за МакФарландом. У кожному з 8 рядів (12 лунок) знаходилась відмінна концентрація даного металу згідно з таблицею 9, тоді як останній ряд мікропробірок являв собою негативний контроль (середовище NB з сольовим розчином або NB, що містить запас металу, без інокуляту). Планшети накривали пластмасовими кришками та додатково загортали у целофанову плівку для захисту їх від випарювання. Їх інкубували у шейкері (80 об./хв.) при 30 °C. Через 24 та 48 годин інкубації значення оптичної густини (OD 600) культур вимірювали у кожній з 96 лунок. Вимірювання проводили із застосуванням спектрофотометра "Sunrise" (TECAN). Визначали значення мінімальних концентрацій металів, що інгібують ріст бактерій (MIC). Вважали, що найнижча концентрація, за якої ріст бактерій не спостерігався, являла собою значення MIC. Результати показані в таблиці 10. Таблиця 10 Значення MIC важких металів для досліджуваних штамів № Позначення штаму 1 2 3 4 5 6 7 8 9 10 11 4P 3G 4G 2L 5L 6L 1N 2N 3N 5N 6N Порогові значення MIC [мМ/л], 24 год. (48 год.) As (III) 5(6) 5 5(8) 4(6) 5(7) 5(7) 5(8) 5(7) 3(5) 4(7) 4(7) Cu(II) 3 3 3(4) 3 3 3(4) 3 3(4) 3(4) 3(4) 3(4) Cr(VI) 1(2) 1(2) 1(2) 1(2) 1(2) 1(2) 1(2) 1(2) 1(2) 1(2) 1(2) Ni(II) 1 1(2) 1(2) 1 1 1(2) 1(2) 1(2) 1(2) 1 1(2) Zn(II) 3(5) 4 4 3(4) 4(5) 4(5) 4 3(4) 3(4) 2(4) 2(3) Cd(II) 0,1(0,2) 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1(0,2) 0,1 Таблиця 11 Значення MIC, визначені для модельного штаму Escherichia coli згідно зі Spain, 2003 р. Розчини солей металів у (NB) 20 As (III), Cr(VI), Ni(II), Zn(II), Cu(II): 1 мМ, 2 мМ, 3 мМ, 4 мМ, 5 мМ, 6 мМ, 7 мМ, 8 мМ, 9 мМ, 10 мМ, 15 мМ Cd(II): 0,1 мМ; 0,2 мМ; 0,3 мМ; 0,4 мМ; 0,5 мМ, 0,7 мМ; 0,8 мМ, 0,9 мМ, 1,0 мМ, 1,5 мМ Важкий метал As(III) Cu (II) Ni (II) Zn (II) Cd (II) Cr (VI) MIC [мМ/л] 0,5 1 1 1 0,5 0,2 Одержані результати ілюструють значну варіацію значень MIC для кожного металу. На 9 UA 110449 C2 5 10 15 20 25 30 жаль, у випадку кадмію визначення MIC було неможливим. Жоден з досліджуваних штамів не був здатним рости навіть при найнижчій концентрації солі кадмію у культуральному середовищі, незважаючи на застосування розчинів з концентрацією цього елемента, яка на порядок величини нижче, ніж концентрація інших металів. Виходячи з цього, можна зробити висновок, що токсичність кадмію є набагато вищою, ніж токсичність інших важких металів, застосовуваних в експерименті. У таблиці 10 найнижча застосовувана концентрація солі кадмію була наведена у якості значення MIC. Одержані результати вказують на те, що досліджувані штами бактерій є стійкими до As(III), Cu(II), Cr(VI) та Zn(II), малочутливими до Ni(II) та чутливими до Cd(II). Слід підкреслити, що у випадку миш'яку та хрому застосовували їх форми, які вважалися найбільш токсичними для живих організмів (As III та Cr VI), та навіть у такому разі, високі значення MIC були задокументовані для всіх досліджуваних штамів порівняно з літературними даними для модельного штаму (таблиця 11) (Spain, 2003). Приклад 4. Спосіб біоремедіації ґрунту, забрудненого ароматичними нітросполуками Чисті культури бактерій у рідкому середовищі, доповненому ароматичними нітросполуками Метою експерименту було визначити ефективність росту кожного з бактеріальних штамів у рідкому середовищі (M9), доповненому ароматичною нітросполукою (2-нітрофенол), яка була єдиним джерелом вуглецю для мікроорганізмів. Була задана вихідна концентрація нітросполуки у середовищі 100 мг/л. Всі з досліджуваних штамів характеризувалися дуже гарним ростом на твердому середовищі (M9), доповненому однією і тією ж сполукою, також при подвійній концентрації (200 мг/л) порівняно із використовуваною в рідких культурах. Невеликий об'єм середовища (приблизно 20 мл) інокулювали мікробіологічним матеріалом (чисті культури бактерій). Штами бактерій, виділені з навколишнього середовища, росли набагато повільніше у лабораторних умовах (пролонгована лаг-фаза), з причини невідомих потреб у живленні та тривалого періоду адаптації. Бактеріальні монокультури культивували протягом 7 днів при кімнатній температурі зі струшуванням на шейкері з платформою. Протягом експерименту оптичну густину (OD600) кожної культури вимірювали при одноденних інтервалах. Результати показані в таблиці 12. Після експерименту відсоткову зміну оптичної густини розраховували для кожної культури відносно вихідного значення (таблиця 12), за виключенням останнього результату (день 7, зменшення OD600), де, найбільш ймовірно, відбувалося вичерпання поживних речовин у середовищі або накопичення токсичних вторинних метаболітів, які інгібують подальший ріст мікроорганізмів. Таблиця 12 Ріст кожного бактеріального штаму в рідкому середовищі, доповненому ароматичною нітросполукою Позначення штаму № Час [дні] 1(To) 1 2 3 4 5 6 7 8 9 10 11 4P 3G 4G 2L 5L 6L IN 2N 3N 5N 6N 2 0,215 0,139 0,124 0,205 0,190 0,250 0,162 0,176 0,170 0,220 0,130 0,217 0,108 0,132 0,135 0,181 0,181 0,179 0,171 0,143 0,203 0,151 3 4 OD600 0,276 0,286 0,174 0,158 0,173 0,177 0,150 0,157 0,215 0,240 0,262 0,204 0,184 0,188 0,225 0,225 0,219 0,185 0,220 0,212 0,175 0,178 Зміна OD600 [%] 5 6 0,295 0,177 0,184 0,179 0,243 0,234 0,190 0,230 0,191 0,230 0,180 0,331 0,178 0,197 0,226 0,245 0,258 0,194 0,219 0,196 0,240 0,182 54,0 28,1 58,9 10,2 28,9 X 19,8 24,4 15,3 9,1 40,0 35 40 Аналіз результатів дозволив виявити значні відмінності, що стосуються швидкості росту різних штамів. Штами 4G, 4P та 6N характеризувалися найбільшими відсотковими збільшеннями значення OD, таким чином, можна зробити висновок, що вони були найкраще пристосованими до умов, використовуваних в експерименті. Змішані бактеріальні культури у рідкому середовищі, доповненому ароматичною 10 UA 110449 C2 5 10 15 20 25 30 35 40 45 50 55 60 нітросполукою Численні літературні дані вказують на те, що для ефективного розкладання ароматичних нітросполук, у тому числі мононітрофенолів, необхідний синергічний ефект консорції бактерій (Nielsen et al., 2006). У зв'язку із зазначеним вище, вирішили, що слід одержати змішані культури, які містять виділені штами бактерій. Створювали змішані культури на основі цих штамів. Зразки інкубували протягом 2 тижнів. Аналогічно, як і в попередньому експерименті, оптичну густину (OD600) кожної культури вимірювали через 24 год. Одержані результати представлені на фігурі 1, на якій показаний ріст змішаної культури бактерій (11 штамів) у рідкому середовищі (M9), доповненому ароматичною нітросполукою. Визначення ефективності біоремедіації в мікрокосмах Одержання ґрунту Ґрунт, застосовуваний в дослідженні, відбирали з глибини приблизно 20 см з ділянки, не забрудненої ароматичними нітросполуками, розташованої на значній відстані від доріг та промислових підприємств (присадибна ділянка). Перед створенням мікрокосмів ґрунт тричі стерилізували в автоклаві (0,7 атм., 30 хв.) для зменшення кількості аборигенної мікрофлори, що перевіряли за допомогою висівання відповідних розведень ґрунтового екстракту до та після процесу стерилізації. Одержаний ґрунт забруднювали ароматичною нітросполукою, 2-нітрофенолом, при концентрації 200 мг/кг ґрунту. Аліквоти (0,5 кг) ґрунту поміщали в овальні пластмасові контейнери та накривали кришками з невеликими отворами (що забезпечувало умови з оптимальною кількістю кисню). Одержання інокуляту Бактеріальні інокуляти одержували виходячи зі штамів бактерій, які є об'єктом даного винаходу, виділених із середовищ, забруднених ароматичними нітросполуками. Біомасу клітин бактерій збирали з чашок Петрі після нанесення на їхню поверхню 2 мл сольового розчину та знімали бактеріальну плівку за допомогою шпателя. Суспензію клітин кількісно переносили у стерильну колбу. Вимірювали значення оптичної густини (OD 600) суспензій. Значення OD600 у кожному випадку доводили до подібного значення приблизно 0,6. Інокуляція ґрунту Ґрунт, забруднений нітросполукою (2-нітрофенол при концентрації 1500 мкг/л), інокулювали бактеріальним інокулятом. Об'ємне співвідношення інокуляту до середовища складало 1:10, що 8 відповідало 10 клітин на 1 г сухої маси ґрунту. Мікрокосми інкубували у затемненій кімнаті при зовнішній температурі приблизно 20 °C. Час від часу інокульований ґрунт перемішували для забезпечення умов з достатньою кількістю кисню. Протягом усієї 30-денної інкубації вміст вологи підтримували при приблизно 50 % вологоємності (WHC). Втрачену воду компенсували достатнім об'ємом стерильної дистильованої води. Визначення ефективності біоремедіації Ефективність способу біоремедіації ґрунту, забрудненого ароматичною нітросполукою (2нітрофенол) (оцінка зниження вмісту нітрофенолу в досліджуваному ґрунті) перевіряли шляхом здійснення вимірювань концентрації нітросполуки за допомогою газової хроматографії з полум'яно-іонізаційним детектором GC-FID. Визначення вмісту доручили лабораторії із захисту навколишнього середовища "WESSLING" (http://pl.wessling-group.com/pl/uslugi/), також як і визначення кількості бактерій. Спостерігали значне зменшення вмісту 2-нітрофенолу в ґрунті (в мікрокосмах) в результаті біологічного розкладання забруднювачів. Контрольний зразок (неінокульований ґрунт) містив 2-нітрофенол при концентрації 1500 мкг/л, та причому здійснення способів біологічного розкладання із застосуванням вакцини для біоремедіації приводило до зниження вмісту застосовуваного нітроарену приблизно у 3 рази. Більше того, у досліджуваній експериментальній конфігурації (окрім контрольної конфігурації) було задокументовано збільшення кількості бактерій від 105 клітин/мл (день 1) до приблизно 108 клітин/мл (день 30). Одержані результати вказують на високу ефективність способу, та причому результати біоремедіації у лабораторному масштабі виявились задовільними. Основною метою даного вирішення було розробити, виходячи з колекції одержаних штамів, мікробіологічну вакцину для застосування при біоремедіації ґрунту, забрудненого нітросполуками, а також оцінити ефективність способу біологічного розкладання в мікрокосмах. Виходячи з автохтонної мікрофлори ділянок, забруднених ароматичними нітросполуками, визначали композицію вакцини для біоремедіації, призначену для землі, забрудненої цими ксенобіотиками, та причому її ефективність підтверджували у мікрокосмах. Цій стадії передували дослідження, які привели до відбору найбільш ефективних монокультур та груп 11 UA 110449 C2 5 10 15 20 25 30 35 бактерій (що характеризувалися найкращим ростом на рідкому середовищі, доповненому ароматичною нітросполукою в якості єдиного джерела вуглецю). Перевірка способу біоремедіації ґрунту із забрудненням була заснована на фізико-хімічних та мікробіологічних аналізах. Ефекти біоремедіації в мікрокосмах були задовільними. Після застосування бактеріальних інокулятів (комплект з 11 штамів), після інкубаційного періоду 30 днів, досягали трикратного зниження забруднення у порівнянні з контрольним зразком (неінокульований ґрунт). Більше того, визначення кількості мікроорганізмів на початку здійснення способу біоремедіації та після його завершення продемонструвало, що застосовувані мікроорганізми характеризуються хорошою здатністю до проліферації навіть за несприятливих умов (присутність нітроарену в середовищі). Крім того, для 11 штамів бактерій, включених у вакцину для біоремедіації, була продемонстрована здатність рости в присутності високих концентрацій важких металів та антибіотиків, та причому, виходячи з існуючих стандартів, ці штами вважалися стійкими. Враховуючи той факт, що щодо ґрунтів із забрудненням часто повідомлялося про високі концентрації не тільки ряду органічних ксенобіотиків, але також важких металів (Bahig та Altalhi, 2009), які розглядалися як сильні інгібітори процесів біологічного розкладання органічних ксенобіотиків (Silva et al., 2007), а також антибіотиків або їхніх метаболітів, дане вирішення є дуже цінним та важливим для забезпечення ефективності способу біоремедіації ґрунту. Джерела інформації: 1. Bahig E.D., Altalhi A.D. 2009. Degradative plasmid and heavy metal resistance plasmid naturally coexist in phenol and cyanide assimilating bacteria. Am. J. Biochem. Biotech. 5(2): 84-93. 2. EUCAST. 2011. Clinical Breakpoint Table v. 1.3 2011-01-05. http://www.eucast.org/fileadmin/src/media/PDFs/EUCAST_files/Disk_test_documents/EUCAST_break points_v1.3_pdf.pdf. 3. Kanekar P., Doudpure P., Sarnaik S. 2003. Biodegradation of nitroexplosives. Indian J. Exper. Biol. 41: 991-1001. 4. Kulkarni M., Chaudhari A. 2007. Microbial remediation of nitro-aromatic compounds: An overview. J. Environ. Manag. 85: 496-512. 5. Nielsen D.R., McLellan P.J., Dauguls A.J. 2006. Direct estimation of the oxygen requirements of Achromobacter xyloxidans tor aerobic degradation of monoaromatic hydrocarbons (BTEX) in a bioscrubber. Biotechnol. Lett. 28: 1293-1298. 6. Schluter A., Szczepanowski R., Puhler A., Top E.M. 2007. Genomics of IncP-1antibiotic resistance plasmids isolated from wastewater treatment plants provides evidence for a widely accessible drug resistance gene pool. FEMS Microbiol. Rev. 31:449–477. 7. Silva A.D.A., Pereira P.M., Filho S.G., Hofer E. 2007. Utilization of phenol in the presence of heavy metals by metal-tolerant non-fermentative gram-negative bacteria isolated from wastewater. Microbiol. 49: 68-73. 8. Spain A. 2003. Implications of microbial heavy metal tolerance in the environment. Rev. Undergrad. Res. 2: 1-6. 40 ФОРМУЛА ВИНАХОДУ 45 50 55 60 1. Консорціум мікроорганізмів для біоремедіації, який містить штам 2L Stenotrophomonas sp., штам 5L Stenotrophomonas sp., штам 6L Stenotrophomonas sp., штам 3N Stenotrophomonas sp., штам 4P Achromobacter sp., штам 1N Arthrobacter sp., штам 2N Brevundimonas sp., штам 5N Brevundimonas sp., штам 6N Brevundimonas sp., штам 3G Pseudomonas sp. та штам 4G Pseudomonas sp., депонований під номером KKP 2041p (Колекція промислових мікроорганізмів IAFB - Варшавський інститут сільськогосподарської та харчової біотехнології). 2. Консорціум мікроорганізмів за п. 1, який відрізняється тим, що щонайменше один штам із консорціуму мікроорганізмів, переважно всі штами, характеризуються стійкістю до щонайменше одного антибіотика з наступних груп: аміноглікозидів, фторхінолонів, глікопептидів, макролідів, пеніцилінів, сульфонамідів та тетрациклінів; причому переважно щонайменше один штам із консорціуму мікроорганізмів, переважно всі штами, характеризуються стійкістю до щонайменше одного з ципрофлоксацину, еритроміцину, гентаміцину, пеніциліну, стрептоміцину, сульфаметоксазолу, тетрацикліну, ванкоміцину. 3. Консорціум мікроорганізмів за п. 1 або п. 2, який відрізняється тим, що щонайменше один штам із консорціуму мікроорганізмів, переважно всі штами, характеризуються стійкістю до важких металів, таких як As (III), Cu (II), Cr (VI), Zn (II) та Ni (II). 4. Суміш для біоремедіації, яка містить консорціум мікроорганізмів штамів за будь-яким із пп. 13. 12 UA 110449 C2 5 10 15 20 25 30 35 5. Суміш для біоремедіації за п. 4, яка відрізняється тим, що, окрім консорціуму мікроорганізмів з 11 штамів, вона містить рідке або тверде мінеральне середовище, доповнене нітросполукою як єдиним джерелом вуглецю. 5 6. Суміш для біоремедіації за п. 4 або п. 5, яка відрізняється тим, що вона містить 10 бактеріальних клітин в 1 мл середовища. 7. Суміш для біоремедіації за п. 5 або п. 6, яка відрізняється тим, що нітросполука у середовищі вибрана з нітробензолу, п-нітроаніліну, 2-нітротолуолу, 4-нітротолуолу, динітротолуолів, тринітротолуолів, мононітрофенолів, полінітрофенолів. 8. Суміш для біоремедіації за п. 5 або п. 6, яка відрізняється тим, що джерело вуглецю у середовищі являє собою щонайменше одну з нітросполук за п. 7; та причому нітросполука є доданою в кількості 50-200 мг/л культурального середовища, залежно від ступеня забруднення ґрунту. 9. Застосування суміші для біоремедіації за будь-яким із пп. 4-8 для видалення з ґрунту забруднюючих речовин у формі ароматичних нітросполук. 10. Спосіб обробки забрудненого ґрунту, який відрізняється тим, що спосіб включає наступні етапи: внесення у ґрунт із забрудненням розмноженої культури консорціуму мікроорганізмів за будьяким із пп. 1-3 або суміші за будь-яким із пп. 4-8, збагачення киснем ґрунту із забрудненням механічним способом та підтримання його вологості на відповідному рівні, видалення ароматичних нітросполук із забрудненого ґрунту за допомогою внесених мікроорганізмів. 11. Спосіб за п. 10, який відрізняється тим, що його здійснюють in situ або ex situ. 12. Спосіб за п. 10 або п. 11, який відрізняється тим, що культуру розмножують на рідкому або твердому мінеральному середовищі, доповненому нітросполукою як єдиним джерелом вуглецю, та причому нітросполука у середовищі переважно включає нітробензол, п-нітроанілін, 2нітротолуол, 4-нітротолуол, динітротолуоли, тринітротолуоли, мононітрофеноли, полінітрофеноли. 13. Спосіб за п. 12, який відрізняється тим, що джерело вуглецю у середовищі являє собою щонайменше одну з нітросполук за п. 12, та причому нітросполуку додають у кількості 50-200 мг/л культурального середовища, залежно від ступеня забрудненості ґрунту. 14. Спосіб за будь-яким із пп. 10-13, який відрізняється тим, що культуру розмножують при значеннях температури 20-25 °C. 15. Спосіб за будь-яким із пп. 10-14, який відрізняється тим, що забруднений ґрунт обприскують суспензією бактеріальної культури при об'ємному співвідношенні суміші і ґрунту в діапазоні 1:10-3:10. Комп’ютерна верстка А. Крижанівський Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 13
ДивитисяДодаткова інформація
Автори англійськоюPopowska, Magdalena, Boszczyk-Maleszak, Hanka, Komorowska, Iga
Автори російськоюПоповская Магдалена, Бощик-Малешак Ханка, Коморовская Ига
МПК / Мітки
МПК: C12R 1/38, C12R 1/01, B09C 1/10, C12R 1/06
Мітки: видалення, забруднюючих, консорціум, біоремедіації, застосування, мікроорганізмів, ґрунту, суміш, речовин
Код посилання
<a href="https://ua.patents.su/15-110449-konsorcium-mikroorganizmiv-dlya-bioremediaci-sumish-dlya-bioremediaci-ta-kh-zastosuvannya-dlya-vidalennya-zabrudnyuyuchikh-rechovin-z-runtu.html" target="_blank" rel="follow" title="База патентів України">Консорціум мікроорганізмів для біоремедіації, суміш для біоремедіації та їх застосування для видалення забруднюючих речовин з ґрунту</a>
Попередній патент: Спосіб диференційної діагностики тривожних, депресивних розладів та деперсоналізацій у пацієнтів з психічними захворюваннями за шевченко-бітенським к.в.
Наступний патент: Холоднотвердна суміш для виготовлення ливарних форм і стрижнів
Випадковий патент: Електромагнітно-акустичний перетворювач для контролю трубчатих неферомагнітних металовиробів з перетином у вигляді кола