Система доставки лікарських засобів
Формула / Реферат
1. Система доставки лікарських засобів для введення щонайменше одної фармацевтично активної речовини, що має розчинність per se у воді менш ніж приблизно 100 мкг/мл, причому зазначена речовина перебуває у формі часток з ефективним середнім розміром менш ніж приблизно 50 нм, яка характеризується тим, що
частки речовини є по суті аморфними;
частки речовини укладені в наночастки, утворені натрієвої сіллю метилового ефіру N-повністю-транс-ретиноїлцистеїнової кислоти, натрієвою сіллю метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти або їх комбінацією; і
відношення маси зазначеної натрієвої солі метилового ефіру N-повністю-транс-ретиноїлцистеїнової кислоти, натрієвої солі метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти або їх комбінації до маси зазначеної речовини перебуває в діапазоні від приблизно 1:1 до приблизно 4:1,
за умови, що зазначена щонайменше одна фармацевтично активна речовина не є паклітакселом або циклоспорином.
2. Система доставки лікарських засобів за п. 1, яка характеризується тим, що відношення маси зазначеної натрієвої солі метилового ефіру N-повністю-транс-ретиноїлцистеїнової кислоти, натрієвої солі метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти або їх комбінації до маси зазначеної речовини перебуває в діапазоні від приблизно 1:1 до приблизно 10:1.
3. Система доставки лікарських засобів за п. 1, яка характеризується тим, що зазначена щонайменше одна фармацевтично активна речовина вибрана з доцетакселу та його похідних.
4. Система доставки лікарських засобів за п. 1, яка характеризується тим, що зазначена щонайменше одна фармацевтично активна речовина вибрана із сиролімусу, такролімусу та їх похідних.
Текст
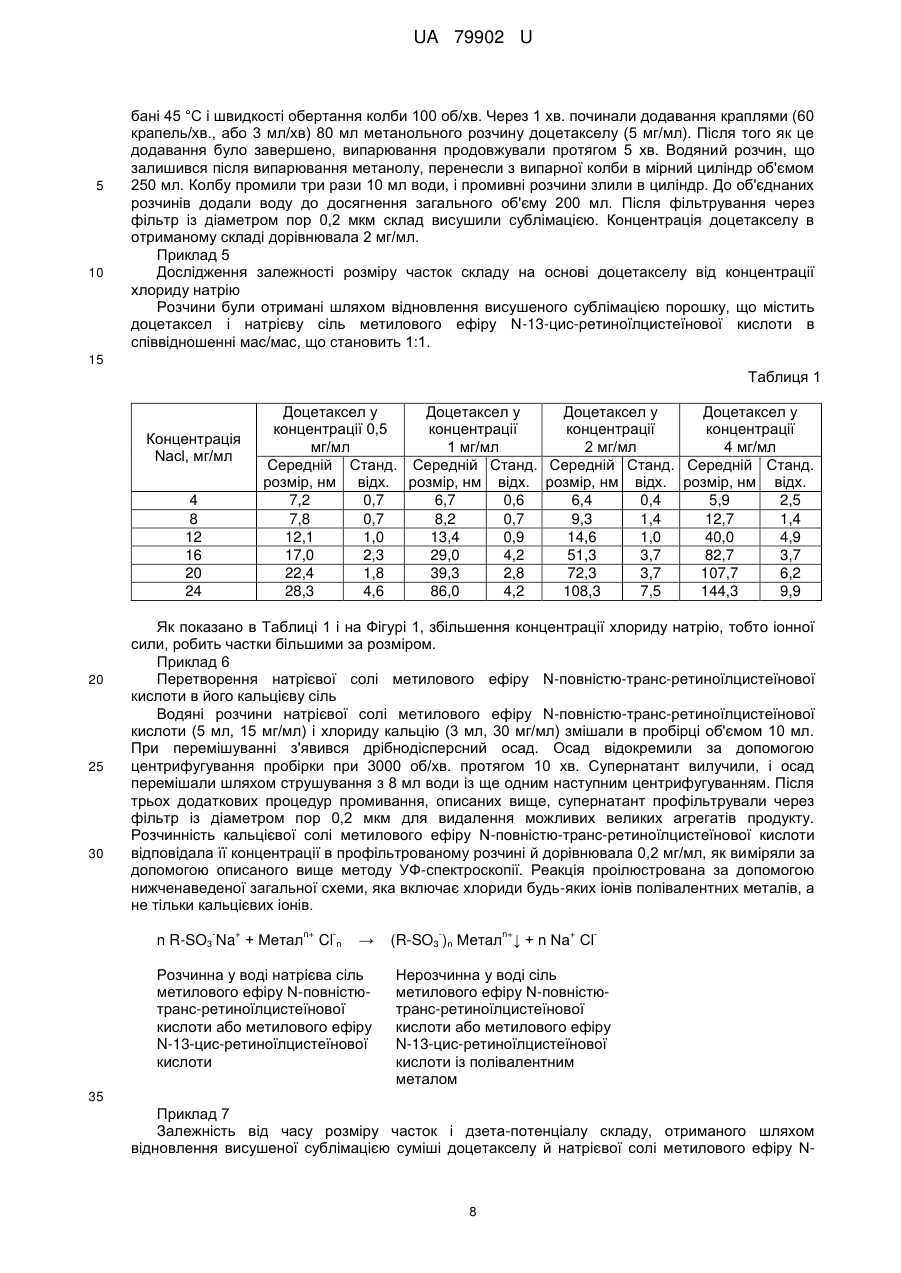
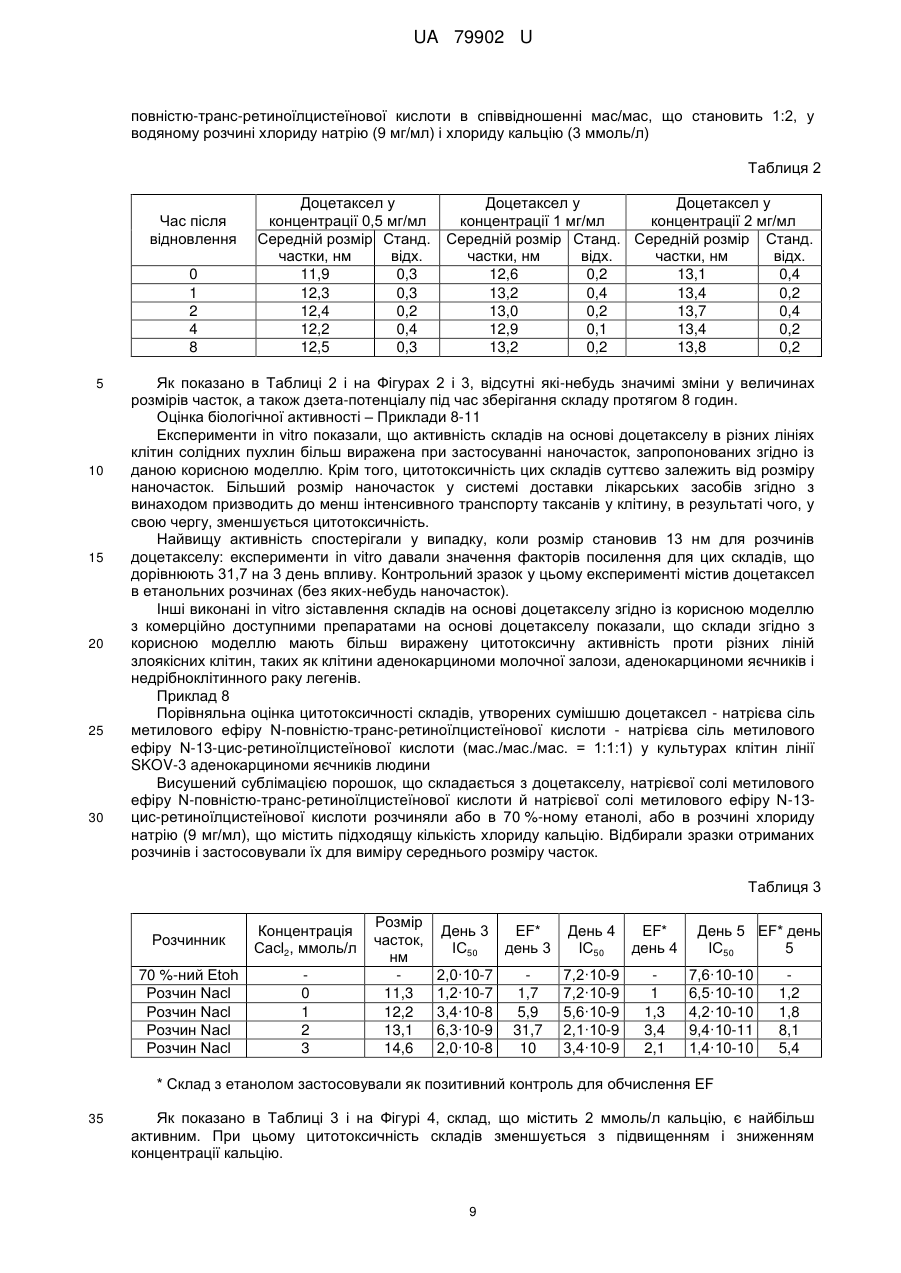
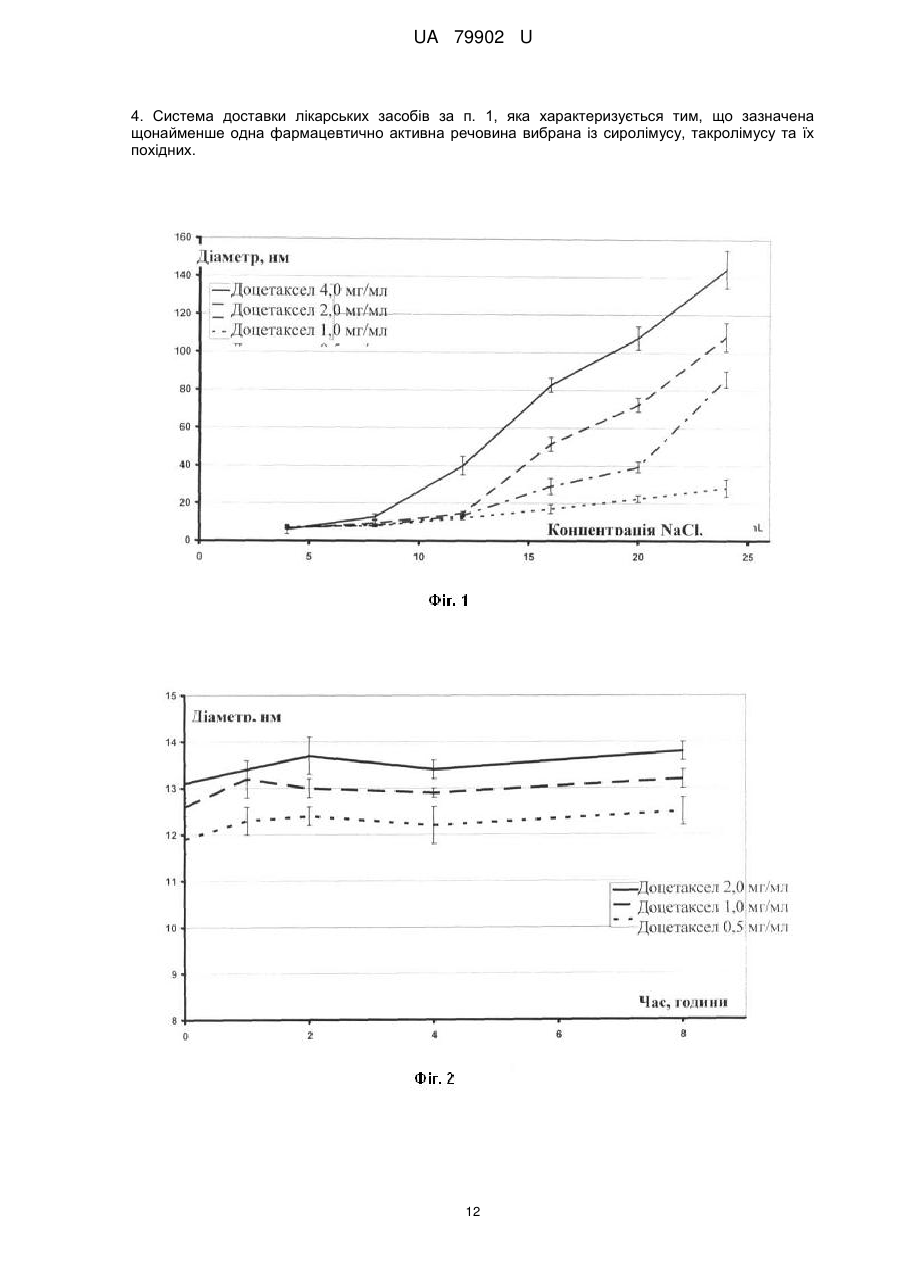
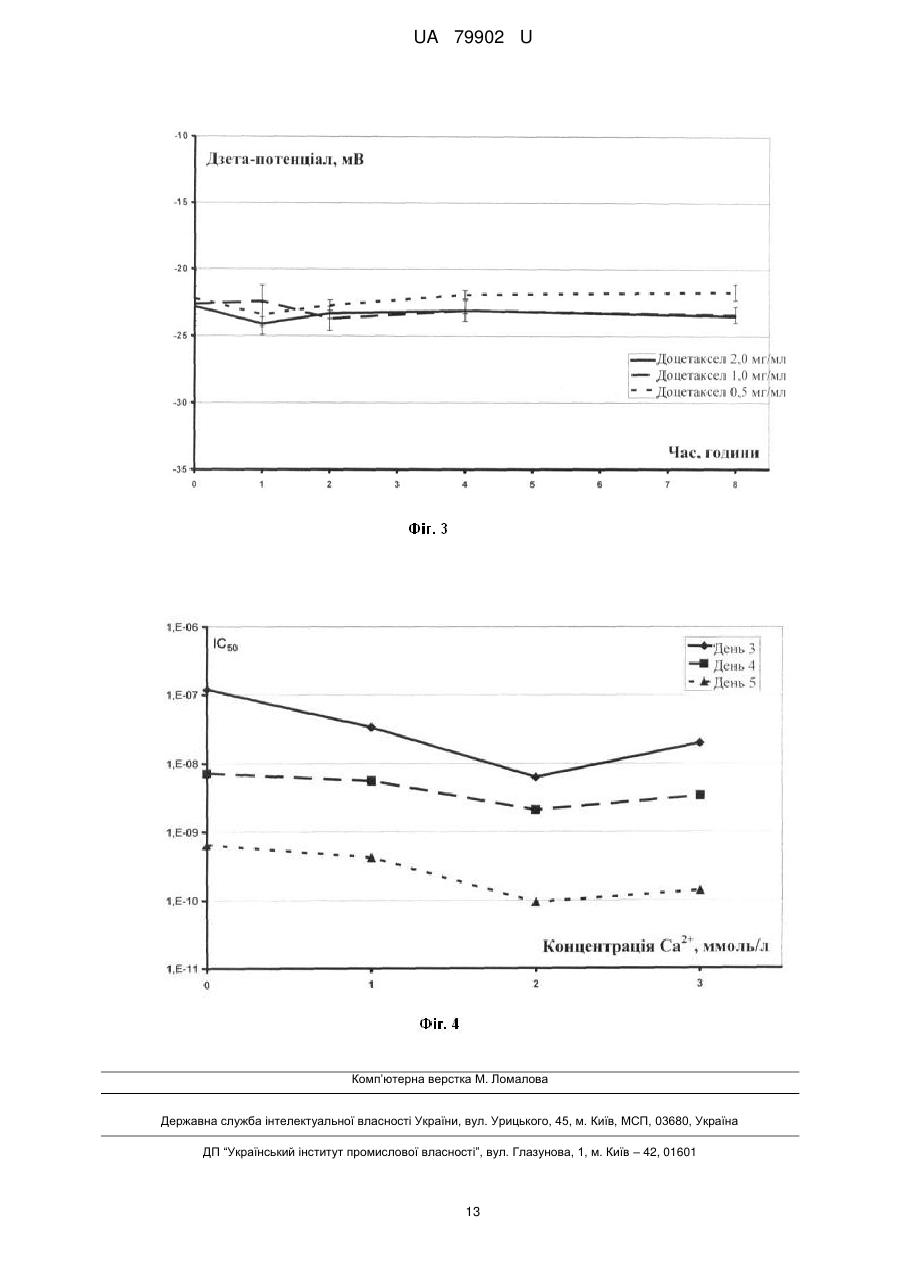
Реферат: Система доставки лікарських засобів для введення фармацевтично активної речовини, що має розчинність per se у воді менш ніж приблизно 100 мкг/мл. Зазначена речовина перебуває у формі часток з ефективним середнім розміром менш ніж приблизно 50 нм, яка характеризується тим, що частки речовини є по суті аморфними; частки речовини укладені в наночастки, утворені натрієвої сіллю метилового ефіру N-повністю-транс-ретиноїлцистеїнової кислоти, натрієвою сіллю метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти або їх комбінацією. Відношення маси зазначеної натрієвої солі метилового ефіру N-повністю-трансретиноїлцистеїнової кислоти, натрієвої солі метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти або їх комбінації до маси зазначеного речовини перебуває в діапазоні від приблизно 1:1 до приблизно 4:1, за умови, що зазначена щонайменше одна фармацевтично активна речовина не є паклітакселом або циклоспорином. UA 79902 U (54) СИСТЕМА ДОСТАВКИ ЛІКАРСЬКИХ ЗАСОБІВ UA 79902 U UA 79902 U 5 10 15 20 25 30 35 40 45 50 55 60 Дана корисна модель належить до системи доставки лікарських засобів для введення фармацевтично активних речовин, малорозчинних у воді. У фармацевтичній і інших родинних галузях промисловості існує гостра потреба в готуванні підходящих з погляду промислового виробництва нерозчинних у воді або малорозчинних у воді речовин у вигляді складів для перорального, ін'єкційного, інгаляційного, офтальмологічного й інших шляхів доставки. Підходящі з погляду промислового виробництва нерозчинні у воді або малорозчинні у воді речовини включають нерозчинні у воді або малорозчинні у воді біологічно цінні сполуки, радіофармацевтичні засоби, фармацевтично цінні сполуки й, зокрема, нерозчинні у воді й малорозчинні у воді лікарські засоби для застосування в медицині й ветеринарії. Приклади нерозчинних у воді або малорозчинних у воді речовин для застосування згідно із даною корисною моделлю включають жарознижуючі засоби, протизапальні засоби, болезаспокійливі засоби, анксіолітики, заспокійливі засоби, протипухлинні агенти, протимікробні агенти, антибіотики, антиліпемічні засоби, засоби проти кашлю/відхаркувальні засоби, міорелаксанти, протиепілептичні засоби, противиразкові засоби, антидепресанти, протиалергійні засоби, кардіотонічні засоби, антиаритмічні засоби, судинорозширювальні засоби, гіпотензивні засоби/сечогінні засоби, засоби для терапії діабету, туберкулостатичні засоби, протиревматичні засоби, стероїди, антагоністи наркотичних препаратів, гормони, жиророзчинні вітаміни, антикоагулянти, засоби для терапії ішемічної хвороби, засоби для терапії імунопатології, засоби для терапії хвороби Альцгеймера, засоби для терапії остеопорозу, засоби для терапії ангіопоезу, засоби для терапії ретиніту, засоби для терапії закупорки вени сітківки, засоби для терапії старечої дископодібної дегенерації жовтої плями, засоби для терапії спазму церебральних судин, засоби для терапії тромбозу церебральних судин, засоби для терапії ішемічного інсульту, засоби для терапії закупорки церебральних судин, засоби для терапії внутрішньомозкового крововиливу, засоби для терапії субарахноїдального крововиливу, засоби для терапії гіпертензивної енцефалопатії, засоби для терапії транзиторної ішемічної атаки, засоби для терапії мультиінфарктної деменції, засоби для терапії атеросклерозу судин, засоби для терапії хвороби Хантингтона, засоби для терапії ураження тканини головного мозку, засоби для терапії невропатії зорового нерва, засоби для терапії глаукоми, засоби для терапії внутрішньоочної гіпертензії, засоби для терапії відшарування сітківки, засоби для терапії артриту, антисептики, лікарські засоби проти септичного шоку, лікарські засоби проти астми, засоби для терапії прискореного сечовипускання/нетримання, засоби для терапії атопічного риніту, засоби для терапії алергійного риніту, косметичні композиції, композиції агрохімікатів, інсектициди, бактерициди, гербіциди, питні або харчові композиції й композиції ветеринарних лікарських препаратів. Той факт, що тільки розчинні у воді речовини можуть бути введені внутрішньовенно, значно обмежує вибір органічних молекул, що підходять для застосування як протипухлинні лікарські засоби, тому що багато, якщо не більшість із них є малорозчинними у воді. Уведення в такі речовини полярних функціональних груп не вирішує зазначену проблему, оскільки зміни структури призводять до втрати необхідних фармакологічних властивостей лікарських засобів. Розробка систем доставки лікарських засобів, здатних забезпечувати розчинення малорозчинних сполук у водяних розчинах, надзвичайно сприяла б реалізації протипухлинного потенціалу широкого кола речовин і забезпечила б створення нових поколінь лікарських засобів. Доцетаксел належить до протипухлинних лікарських засобів класу таксанів, тому що дана речовина або його попередники виробляються рослинами роду Taxus (тисові дерева). Доцетаксел синтезують із 10-деацетилбакатину. Механізм дії доцетакселу заснований на здатності останнього зв'язуватися з β-субодиницею тубуліну, що перешкоджає деполімеризації мікротрубочок, ушкоджуючи тим самим клітини, що діляться. Цю специфічність дії широко застосовують в онкології для лікування різних солідних пухлин, особливо раку яєчників, легенів, молочної залози, сечового міхура, голови й шиї. Доцетаксел має низьку пероральну біодоступність і, таким чином, внутрішньовенна (в/в) інфузія являє собою єдиний шлях уведення. Недостатня розчинність у воді також унеможливлює застосування водяних розчинів цього таксану. Для розв'язання даної проблеми застосовували декілька носіїв. У препараті Таксотер (TAXOTERE®) Полісорбат 80 (відомому під торговельною назвою Твін 80 (TWEEN®80)) похідне поліетоксильованого сорбіту й олеїнової кислоти виконує роль носія. Масове співвідношення (мас/мас.) між носієм і доцетакселом становить 24:1. Полісорбат 80 є неіонним детергентом, що складається з ноліетоксиланцюгів, і може також викликати реакції, обумовлені гіперчутливістю. 1 UA 79902 U 5 10 15 20 25 30 35 40 45 50 55 60 Як було виявлено, доцетаксел може бути розчинений у водяних розчинах розчинних у воді похідних ретинової кислоти, що діють як аніонні поверхнево-активні речовини. Унікальність структури цих похідних дозволяє їм розчиняти доцетаксел при несподівано низькому співвідношенні мас/мас, що становить 0,5:1. Іксабепилон (аналог епотилона В) дуже схожий на таксани відносно механізму дії й розчинності у водяних розчинах. Він показаний для лікування метастатичного або місцеворозповсюдженого раку молочної залози. Препарат іксабепилона для в/в уведення, Іксемпра (Ixempra®), розроблений компанією Bristol-Myers Squibb (BMS), заснований на Кремофорі EL, і у зв'язку із цим потрібні передомедикація й тривала інфузія для ослаблення реакцій, обумовлених гіперчутливістю. Етопозид, аналог токсину подофілотоксину, являє собою інгібітор топоізомерази II, і його застосовують для лікування саркоми Юінга, рака легенів, рака яєчка, лімфоми й нелимфоцитарної лейкемії. Препарати етопозиду для в/в уведення засновані на похідних поліетиленгліколю (ПЕГ), таких як Полісорбат 80 (Твін 80) або Макрогол 300, застосовуваних з метою солюбілізації недостатньо розчинного у воді активного фармацевтичного інгредієнта. Ретиноїди включають сімейство поліізопреноїдів, які включають вітамін А (ретинол) і його природні (ретинова кислота) і синтетичні аналоги (фенретинид, етретинат, тазаротен, бексаротен, адапален). Ці сполуки демонструють широкий спектр біологічної активності, включаючи участь у контролі клітинної проліферації, клітинної диференцировки й ембріонального розвитку, що дозволяє застосовувати ретиноїди як протипухлинні агенти для лікування різних типів раку, таких як лейкемія, лімфома, саркома Капоті, рак легенів і рак молочної залози. Ці сполуки також застосовують для лікування різних захворювань шкіри, таких як псоріаз, акне й сонячні опіки. Зазвичай ретиноїди є високоліпофільними сполуками, а їхнє застосування у формі водяного розчину потребує введення якої-небудь системи доставки. Однак дотепер не існує розроблених для комерційного виробництва розчинних у воді препаратів ретиноїдів, і останні доступні винятково для перорального введення. Сиролімус, такролімус і еверолімус являють собою імунодепресанти, які майже не розчинні у воді. Біодоступність цих лікарських засобів при пероральному уведенні становить лише приблизно 20 %. Комерційно доступні препарати цих імунодепресантів засновані винятково на застосуванні поліоксіетильованої касторової олії, яка викликає реакції, обумовлені гіперчутливістю, при внутрішньовенному уведенні. Пошук і розробка нових систем доставки лікарських засобів інтенсифікувалися з усвідомленням того факту, що лікарські засоби в занадто високих концентраціях є токсичними й - у найкращому разі - неактивними в занадто низьких концентраціях; однак, якщо піддавати клітини впливу занадто низьких концентрацій лікарських засобів, то часто активується механізми стійкості до лікарського засобу. Діапазон концентрацій, коли лікарський засіб викликає бажану відповідь із меншими побічними ефектами, відомий як "терапевтичне вікно". Тривалі інфузії, як було доведено, зменшують токсичність протипухлинних агентів, але цей шлях уведення значно більш складний із практичної точки зору. Як було виявлено, повільне вивільнення лікарського засобу може бути досягнуте шляхом застосування лікарських засобів, які зв'язані або інкапсульовані в наночастки різного виду. Ці частки можуть циркулювати в крові протягом декількох днів, виконуючи роль "депо". Вивільнення лікарського засобу відбувається за рахунок дифузії інкапсульованих лікарських засобів або руйнування й розкладання часток. Найбільш часто застосовувані типи наночасток у даній області досліджень являють собою міцели й ліпосоми, оскільки утворення таких наночасток є досить простим, що характеризуються ентропійним контролем процесом, тобто частки з'являються спонтанно, а їхні властивості запрограмовані умовами утворення. Розмір часток, застосовуваних у цих системах доставки, перебуває усередині діапазону, що становить від 8 до 200 нм і навіть більше. Однак зі збільшенням розміру частка стає "видимою" для ретикулоендотеліальної системи частини імунної системи, що складається з фагоцитів, які перебувають у ретикулярній сполучній тканині лімфатичних вузлів, печінки й селезінки. Рівень кліренсу, обумовленого активністю ретикулоендотеліальної системи, збільшується з розміром часток, значно зменшуючи загальну кількість лікарського засобу в кровотоці. Інше цікаве завдання в області техніки, пов'язаної з доставкою лікарських засобів, полягає в спрямованій доставці лікарських засобів в ефекторні камери, яке могло б збільшити терапевтичну ефективність аж до максимального рівня. Як було виявлено, наночастки дуже підходять у цьому відношенні. Солідні пухлини відрізняються патоанатомічно від здорових тканин екстенсивним ангіогенезом, а також гіперпроникною й недосконалою структурою судинної мережі. Інакше кажучи, розмір капілярів пухлини є більшим, що потенційно надає 2 UA 79902 U 5 10 15 20 25 30 35 40 45 50 55 60 можливість значно збільшити інтенсивність пасивного транспорту наночасток, навантажених цитотоксичним вмістом, у пухлину в порівнянні зі здоровим ендотелієм. У публікації US 2004048923 описана група ретиноїдів, що включає, серед множини інших, натрієву сіль метилового ефіру N-(повністю-транс-ретиноїл)-L-цистеїнової кислоти й натрієву сіль метилового ефіру N-(13-цис-ретиноїл)-L-цистеїнової кислоти. Стверджується, що зазначені речовини дозволяють одержати нові міцелярні склади малорозчинних фармацевтичних сполук, таких як доцетаксел. Незважаючи на те, що незначна розчинність фармацевтичних сполук дозволяє припустити, що вони перебувають у формі часток, у публікації US 2004048923 повністю відсутня яка-небудь інформація щодо розміру й морфології часток. Зокрема, немає вказівки або припущення, що сполуки повинні перебувати в аморфному стані, або навіть про те, що вони можуть існувати в такому стані. Ще менше повідомляється про який-небудь спосіб одержання часток у такому стані. Як добре відомо фахівцям у даній області техніки, поліморфізм, включаючи можливий аморфний стан, у принципі непередбачений для органічних речовин. Створення нової системи доставки лікарських засобів з контрольованим або заздалегідь заданим вивільненням лікарського засобу, що імітує тривалі введення, було б найвищою мірою бажаним. Однією задачею даної корисної моделі є забезпечення такої системи доставки лікарських засобів. Таким чином, один аспект корисної моделі належить до системи доставки лікарських засобів для введення щонайменше одної фармацевтично активної речовини, що має розчинність per se у воді, яка складає менш, ніж приблизно 100 мкг/мл, причому зазначена речовина перебуває у формі часток з ефективним середнім розміром частки менш ніж приблизно 50 нм, при цьому частки речовини є по суті аморфними; зазначені частки речовини укладені в наночастки, утворені натрієвої сіллю метилового ефіру N-повністю-транс-ретиноїлцистеїнової кислоти, натрієвою сіллю метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти або їхньою комбінацією; і відношення маси зазначеної натрієвої солі метилового ефіру N-повністю-трансретиноїлцистеїнової кислоти, натрієвої солі метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти або їх комбінації до маси зазначеної речовини перебуває в діапазоні від приблизно 1:1 до приблизно 4:1, за умови, що зазначена щонайменше одна фармацевтично активна речовина неє паклитакселом або циклоспорином. Дана корисна модель буде описана більш докладно в наступних описі, прикладах і на прикладених кресленнях, де Фіг. 1 ілюструє залежність розміру часток, утворених натрієвою сіллю метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти й доцетакселом (співвідношення мас/мас. = 1:1), від концентрації хлориду натрію у різних концентраціях доцетакселу. Фіг. 2 і 3 ілюструють залежність від часу розміру часток і дзета-потенціалу складу, отриманого шляхом відновлення висушеної сублімацією суміші доцетакселу й натрієвої солі метилового ефіру N-повністю-транс-ретиноїлцистеїнової кислоти в співвідношенні мас/мас, що становить 1:2, у водяному розчині хлориду натрію (9 мг/мл) і хлориду кальцію (3 ммоль/л). Фіг. 4 ілюструє порівняльну оцінку цитотоксичності складів, утворених сумішшю доцетаксел натрієва сіль метилового ефіру N-повністю-транс-ретиноїлцистеїнової кислоти натрієва сіль метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти (мас./мас./мас.=1:1:1), у культурах лінії клітин SKOV3 аденокарциноми яєчників людини. Перш ніж дана корисна модель буде розкрита і описана, слід розуміти, що дана корисна модель не обмежується конкретними формами, стадіями процесів і речовинами, запропонованими в даній заявці, тому що такі форми, стадії процесів і речовини можуть трохи мінятися. Також слід розуміти, що застосовувана в даній заявці термінологія використовується для цілей опису лише конкретних варіантів реалізації й не є обмежуючою, оскільки дана корисна модель обмежена винятково прикладеними пунктами формули корисної моделі та їхніми еквівалентами. Слід зазначити, що в даному описі й формулі корисної моделі невизначена й визначена форми однини включають обумовлені об'єкти в множині, якщо з контексту явно не випливає інше. У даному описі, якщо не зазначене інше, термін "приблизно", який змінює кількість інгредієнта в системах доставки лікарських засобів або композиціях згідно з корисною моделлю або застосовуваний у способах згідно з корисною моделлю, належить до варіювання чисельної величини, яке може зустрічатися, наприклад, при виконанні типових процедур виміру й обігу рідин, застосовуваних для одержання концентратів, або застосовуваних на практиці розчинів; внаслідок неминучої помилки в цих процедурах; внаслідок відмінностей в одержанні, джерелі або чистоті інгредієнтів, застосовуваних для одержання систем доставки лікарських засобів або 3 UA 79902 U 5 10 15 20 25 30 35 40 45 50 55 60 композицій, або виконанні способів; і т.п. Термін "приблизно" також охоплює кількості, що різняться через різні рівноважні стани для композиції, що утворюється в результаті з конкретної первісної суміші. Незалежно від того, чи модифікована формула корисної моделі терміном "приблизно", вона включає еквіваленти зазначеним кількостям. У даному описі, якщо не зазначене інше, термін "система доставки лікарських засобів" належить до складу або обладнання, яке доставляє терапевтичний агент(и) у бажану ділянку (ділянки) тіла й/або забезпечує своєчасне вивільнення терапевтичного агента (агентів). У даному описі, якщо не зазначене інше, термін "розмір частки" належить до Z-середнього діаметра, обмірюваного за допомогою динамічного розсіювання світла із застосуванням червоного лазера з довжиною хвилі 633 нм. Під вираженням "ефективний середній розмір частки менш ніж приблизно 100 нм" розуміють, що щонайменше 90 % часток мають розмір менш ніж приблизно 100 нм при вимірі за допомогою вищезгаданого способу. У даному описі, якщо не зазначене інше, термін "наночастка" належить до мікроскопічної частки, розмір якої вимірюється в нанометрах. Діаметр наночасток згідно з корисною моделлю перебуває, як правило, у діапазоні від приблизно 1 до приблизно 949 нм, і наночастки можуть містити включену, інкапсульовану або вкладену біологічно активну молекулу. У даному описі, якщо не зазначене інше, термін "розчинність" речовини належить до здатності цієї речовини бути розчиненою у зазначеному розчиннику при приблизно кімнатній температурі, під якою розуміють температуру від приблизно 15 °C до приблизно 38 °C. У даному описі, якщо не зазначене інше, термін "аморфний" указує на тверду структуру, яка або є некристалічною, або складається з дуже маленьких кристалів, що мають розмір часток приблизно 10 нм або менше. У даному описі, якщо не зазначене інше, термін "цитотоксична сполука" належить до сполуки, яка має здатність пригнічувати ріст клітин або вбивати клітини. У даному описі, якщо не зазначене інше, термін "цитостатична сполука" належить до сполуки, яка має здатність приводити клітини, хоча й необов'язково лизовані або вбиті, у перманентний непроліферативний стан. У даному описі, якщо не зазначене інше, термін "імунодепресант" належить до сполуки, яка має здатність інгібувати активність імунної системи, зокрема, для запобігання відторгненню трансплантованого органа й терапії розладів, коли імунна система організму атакує його власні тканини. У даному описі, якщо не зазначене інше, термін "похідне" належить до сполуки, утвореної з вихідної структури або прямо, якщо піддати вихідну структуру хімічній реакції, або шляхом "модифікації", яка являє собою часткове заміщення вихідної структури, або за допомогою дизайну й синтезу de novo. Похідні можуть бути синтетичними або можуть бути продуктами метаболізму клітини або ферментативної реакції in vitro. В одному варіанті реалізації частки речовини в системі доставки лікарських засобів згідно з корисною моделлю мають ефективний середній розмір частки, що перебуває в діапазоні приблизно 5-50 нм. В іншому варіанті реалізації частки речовини в системі доставки лікарських засобів згідно з корисною моделлю мають ефективний середній розмір частки, що перебуває в діапазоні приблизно 8-30 нм. В одному варіанті реалізації даної корисної моделі відношення маси натрієвої солі метилового ефіру N-повністю-транс-ретиноїлцистеїнової кислоти, натрієвої солі метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти або їх комбінації до маси фармацевтично активної речовини перебуває в діапазоні від приблизно 1:1 до приблизно 10:1. В одному варіанті реалізації даної корисної моделі фармацевтично активна речовина являє собою б/с-хлорнитрозомочевину (Кармустин); в іншому варіанті реалізації сполука являє собою етопозид; у ще одному варіанті реалізації сполука обрана з доцетакселу та його похідних. В одному варіанті реалізації даної корисної моделі фармацевтично активна речовина обрана із сиролімусу, такролімусу та їхніх похідних. Система доставки лікарських засобів згідно з корисною моделлю може бути отримана за допомогою способу, згідно з яким фармацевтично активну речовину одержують у формі практично аморфних часток з ефективним середнім розміром менш ніж приблизно 50 нм, за допомогою способу, що включає стадії: розчинення зазначеної речовини в підходящому органічному розчиннику з одержанням органічного розчину зазначеної речовини; додавання приблизно 0,01-3 молярних еквівалентів натрієвої солі метилового ефіру N-повністю-трансретиноїлцистеїнової кислоти, натрієвої солі метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти або їх комбінацій до зазначеного органічного розчину; і випарювання органічного розчинника із зазначеного органічного розчину з одержанням залишку, що містить 4 UA 79902 U 5 10 15 20 25 30 35 40 45 50 55 фармацевтично активну речовину у формі практично аморфних часток. В одному варіанті реалізації цього способу приблизно 0,1-1 молярних еквівалентів натрієвої солі метилового ефіру N-повністю-транс-ретиноїлцистеїнової кислоти, натрієвої солі метилового ефіру N-13-цисретиноїлцистеїнової кислоти або їх комбінації додають до органічного розчину. Запропонований спосіб заснований на здатності натрієвої солі метилового ефіру Nповністю-транс-ретиноїлцистеїнової кислоти, а також натрієвої солі метилового ефіру N-13-цисретиноїлцистеїнової кислоти запобігати кристалізації фармацевтично активних речовин. Під час випарювання органічного розчинника натрієва сіль метилового ефіру N-повністютранс-ретиноїлцистеїнової кислоти, натрієва сіль метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти або їх комбінація співкристалізується разом з фармацевтично активною речовиною, утворюючи плівку. Вода, додана до цієї плівки, розчиняє натрієву сіль метилового ефіру N-повністю-транс-ретиноїлцистеїнової кислоти, натрієву сіль метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти або їх комбінацію й забезпечує одержання фармацевтично активної речовини у високоаморфній формі зі значно збільшеною площею поверхні. Отриманий таким чином розчин по суті аморфних часток фармацевтично активної речовини може бути застосований прямо без виділення або очищення для інфузій або для одержання висушених сублімацією продуктів для наступних відновлень. Альтернативно, по суті аморфні частки фармацевтично активної речовини можуть бути отримані в сухій формі за допомогою, наприклад, випарювання, а потім пізніше бути розчинені у водяному розчині, що містить приблизно 0,01-50 молярних еквівалентів зазначеної натрієвої солі метилового ефіру N-повністю-транс-ретиноїлцистеїнової кислоти, натрієвої солі метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти або їх комбінації. В одному варіанті реалізації зазначені частки активної речовини можуть бути розчинені в такому розчині, що містить приблизно 0,1-5 молярних еквівалентів натрієвої солі метилового ефіру N-повністютранс–ретиноїлцистеїнової кислоти, натрієвої солі метилового ефіру N-13-цисретиноїлцистеїнової кислоти або їх комбінації. По суті аморфні частки здатні розчинитися в розчині натрієвої солі метилового ефіру N-повністю-транс-ретиноїлцистеїнової кислоти, натрієвої солі метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти або їх комбінації за пару хвилин. Відповідно до іншого альтернативного варіанта, розчин фармацевтично активної речовини в органічному розчиннику додають до водяного розчину натрієвої солі метилового ефіру Nповністю-транс-ретиноїлцистеїнової кислоти, натрієвої солі метилового ефіру N-13-цисретиноїлцистеїнової кислоти або їх комбінації, після чого органічний розчинник випаровують, залишаючи водяний розчин, що містить фармацевтично активну речовину в аморфній формі. Цей спосіб може бути оптимізований і спрощений шляхом установлення припливу органічного розчину фармацевтично активної речовини у випарну колбу, що містить водяний розчин натрієвої солі метилового ефіру N-повністю-транс-ретиноїлцистеїнової кислоти, натрієвої солі метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти або їх комбінації, одночасно з випарюванням. Швидкість потоку органічного розчину, внутрішній тиск у випарній системі, а також температура випарювання можуть бути обрані таким чином, щоб концентрація органічного розчину не перевищувала 15 %. Органічний розчинник, застосовуваний у процесі для одержання фармацевтично активної речовини у формі по суті аморфних часток, може являти собою спирт, такий як, наприклад, метанол або етанол. Застосування метанолу, що має більш низьку температуру кипіння, замість етанолу, спрощує випарювання водно-спиртових сумішей. Однак оскільки залишкові кількості органічного розчинника можуть бути менш підходящими для прямого застосування in vivo, органічні розчини по суті аморфних часток фармацевтично активної речовини можуть, наприклад, бути висушені сублімацією з видаленням органічного розчинника, у результаті чого по суті аморфні частки фармацевтично активної речовини залишаються в порошковій формі, зручній для зберігання й одержання нових складів. Розчинні у воді склади, отримані із застосуванням натрієвої солі метилового ефіру Nповністю-транс-ретиноїлцистеїнової кислоти, натрієвої солі метилового ефіру N-13-цисретиноїлцистеїнової кислоти або їх комбінації, стабільні протягом декількох годин у широкому інтервалі умов утворення цих складів. Таким чином, дана корисна модель дозволяє запропонувати водяні розчини для інфузії в інших випадках малорозчинного у воді доцетакселу без якого-небудь застосування неіонних поверхнево-активних речовин. Це значно послаблює реакцію гіперчутливості на розчини для 5 UA 79902 U 5 10 15 20 25 30 35 40 45 50 55 інфузії, скорочує час інфузії й усуває необхідність у передмедикації пацієнтів проти такої гіперчутливості. Винахід буде проілюстрований більш докладно в наступних необмежуючих прикладах. Приклади Матеріали й методи Склади з активних фармацевтичних інгредієнтів з натрієвою сіллю метилового ефіру Nповністю-транс-ретиноїлцистеїнової кислоти, натрієвою сіллю метилового ефіру N-13-цисретиноїлцистеїнової кислоти або їх комбінацією одержували шляхом відновлення або свіжевипарених, або висушених сублімацією залишків активного інгредієнта з похідними ретиноїлцистеїнової кислоти спеціалізованим розчином для відновлення. Повністю-транс-ретинова кислота була придбана в Sigma-Aldrich Sweden AB. Доцетаксел був придбаний в Scinopharm Taiwan, Ltd. Іксабепилон був придбаний в Chemtronica KB, Sweden. Фенретинид синтезували у відповідності зі стандартною методикою (Cancer Research, 39, 13391346, April 1979). Таксотер був придбаний в аптеці й відновлений відповідно до вказівок виробника щодо застосування препарату. Розмір часток складів вимірювали за допомогою методу динамічного розсіювання світла із застосуванням червоного лазера (633 нм). Дзета(Z)-потенціал вимірювали за допомогою методу електрофоретичного розсіювання світла. Аналізатор Nano-zs (Malvern Instruments Ltd.) застосовували для визначення та розміру часток, і дзета-потенціалу. Обчислювали середні значення із трьох незалежних вимірів для нанесення на графік, що відбиває характер зміни розміру часток і дзета-потенціалу. Планки погрішності на осі Υ отримані шляхом додавання й віднімання величини стандартного відхилення вимірів. Для оцінки цитотоксичності in vitro клітини різних ліній клітин пухлин людини були придбані в American Type Culture Collection (Rockville, Md., USA): лінія клітин MDA-MB-231 аденокарциноми молочної залози людини (АТСС-НТВ-26, Lot 3576799), лінія клітин SKOV-3 аденокарциноми яєчників людини (АТСС-НТВ-77, Lot 3038337) і лінія клітин А549 недрібноклітинного раку легенів людини (ATCC-CCL-185, Lot 3244171). Клітини MDA-MB-231 культивували в культуральному середовищі MEM (модифіковане середовище Ігла) з додаванням 2 мМ L-глутаміну, 10 % фетальної бичачої сироватки (FBS) і антибіотиків. Клітини SKOV-3 культивували в культуральному середовищі McCoy's 5А (середовище Маккоя 5А) з додаванням 1,5 мМ Lглутаміну, 10 % FBS і антибіотиків. Усі середовища й добавки були придбані в Sigma-Aldrich Co. (St. Louis, Mi., USA). Культивування клітин усіх ліній проводили в культуральних флаконах BD 2 Falcon™ площею 25 або 75 см (Becton Dickinson Labware). Клітини А549 культивували в культуральному середовищі Ham's F-12 (середовище Хема F-12) з додаванням 1 мМ Lглутаміну, 10 % FBS і антибіотиків. Культивування клітин усіх ліній проводили в культуральних 2 флаконах BD Falcon™ площею 25 або 75 см . Перевірку цитотоксичності лікарських препаратів виконували із застосуванням 96-ямкових культуральних планшетів BD Falcon™ для адгезивних клітин (Becton Dickinson Labware). У ці планшети висівали клітини в концентрації 8×103 клітин/лунка для клітин MDA-MB-231, 10×103 клітин/лунка для клітин SKOV-3 або 6×103 клітин/лунка для клітин А549 в об'ємі 200 мкл/лунка. І флакони, і культуральні планшети інкубували для росту клітин при 37 °C у зволоженій атмосфері, що складається на 95 % з повітря й на 5 % з СО2. Клітинні культури в культуральних планшетах залишали прикріплюватися до поверхні протягом 24-годинної інкубації. На 1 день після посіву клітин 4 мкл розчинів складів, що підлягають перевірці, з різними концентраціями в підходящих розчинниках додавали в лунки з культурами (експерименти по встановленню залежності між дозою й ефектом). У контрольні культури додавали 4 мкл розчинників як контролю ефекту розчинника. Клітини інкубували протягом 2-4 днів підряд. Наприкінці періоду інкубації адгезивні клітини відокремлювали від поверхні обробкою трипсином, і число життєздатних клітин підраховували із застосуванням тесту, заснованого на фарбуванні клітин барвником трипановим синім, і гемоцитометра. Усі експерименти проводили щонайменше три рази, і дані одержували із середнього значення із трьох визначень, кожне з яких виконували в чотири повторення. Результати виражали як середнє число клітин ± середньоквадратична помилка (SE), і відмінності між контрольними й дослідними серіями оцінювали за допомогою t-тесту Стьюдента. Цитотоксичність лікарських препаратів оцінювали на підставі ступеня інгібування росту клітин. Інгібування росту клітин дослідними лікарськими препаратами розраховували із застосуванням наступної формули: Контроль - Дослідна серія Ингібування росту клітин % 100 . Контроль У контрольних серіях 4 мкл різних розчинників, застосовуваних для перевірки лікарських препаратів, додавали до культур як негативні контролі розчинників. Відмінності між цими 6 UA 79902 U 5 10 контрольними серіями були незначущими; таким чином, середню величину негативних контролів застосовували для розрахунків. Розчини доцетакселу, а також його комерційні склади, застосовували як позитивні контролі. Відмінності в інгібуванні росту цим лікарським препаратом у різних розчинниках були незначущими; таким чином, середню величину інгібування позитивними контролями застосовували для розрахунків. Середні значення концентрацій препаратів, що викликають 50 %-е інгібування росту клітин, (IC50) ± SE обчислювали на підставі результатів щонайменше трьох незалежних експериментів. Фактори посилення (EF) розраховували шляхом ділення IC 50 контрольного лікарського порівняльного препарату на IC50 складу згідно корисній моделі. Іонна сила розчину являє собою функцію концентрації всіх іонів, що є присутніми у розчині: IC 15 20 25 30 35 40 45 50 55 1 n 2 c B zB , 2 B 1 де c B являє собою концентрацію іона B, zB являє собою зарядове число цього іона, і сума взята по всіх іонах, що є присутніми у розчині. Приклад 1 Одержання аморфного доцетакселу 27 мл стокового розчину доцетакселу в метанолі (с=0,5 мг/мл) і 1 мл водяного розчину натрієвої солі метилового ефіру N-повністю-транс-ретиноїлцистеїнової кислоти (с=15 мг/мл) об'єднали в кругло донній колбі об'ємом 100 мл. Отриманий розчин упарили під вакуумом насухо; залишок розчинили в 20 мл метанолу, після чого ще раз упарили метанол під вакуумом. Плівка, отримана після випарювання, складалася із суміші аморфного доцетакселу й натрієвої солі метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти. Приклад 2 Розчинення аморфного доцетакселу у водяному розчині натрієвої солі метилового ефіру Ν13-цис-ретиноїлцистеїнової кислоти 24,4 мл води додали до аморфного доцетакселу, отриманого згідно із Прикладом 1, і суміш перемішували за допомогою магнітної мішалки протягом 5 хвилин. Потім до суспензії додали 2,6 мл водяного розчину натрієвої солі метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти (с=15 мг/мл), і суміш перемішували протягом 15 хв. Отриманий розчин був чистим і прозорим. Він містив розчинений доцетаксел у концентрації 0,5 мг/мл. Фільтрування розчину через фільтр із діаметром пор 0,2 мкм не виявило якого-небудь зменшення концентрації доцетакселу. Приклад 3 Одержання водного складу на основі доцетакселу шляхом ступінчастого змішування водяного розчину натрієвої солі метилового ефіру N-повністю-транс-ретиноїлцистеїнової кислоти й етанольного розчину доцетакселу 6 мл розчину доцетакселу (5 мг/мл) в 95 %-ному етанолі додали краплями у круглодонну колбу об'ємом 500 мл, що містить 100 мл водяного розчину натрієвої солі метилового ефіру Nповністю-транс-ретиноїлцистеїнової кислоти (3 мг/мл) при перемішуванні за допомогою магнітної мішалки. Основну частину етанолу упарювали на роторному випарнику при швидкості обертання колби 90 об/хв. і температурі бані 55 °C доти, поки внутрішній тиск у закритій вакуумній системі, що складається з колби, випарника й вакуумного насоса, не впав до 60 мбар. Таке, описане вище, додавання етанольного розчину доцетакселу з наступним випарюванням повторили двічі. Загальний об'єм доданого етанольного розчину склав 30 мл. Водяний розчин, що залишився після випарювання етанолу, перенесли з колби в мірний циліндр об'ємом 250 мл. Колбу промили гри рази 5 мл води, і промивні розчини злили в циліндр. До об'єднаних розчинів додали воду до досягнення загального об'єму 150 мл. Після фільтрування через фільтр із діаметром пор 0,2 мкм склад висушили сублімацією. Концентрація доцетакселу в отриманому складі дорівнювала 1 мг/мл. Приклад 4 Одержання водного складу на основі доцетакселу шляхом змішування водяного розчину натрієвої солі метилового ефіру N-повністю-транс-ретиноїлцистеїнової кислоти й натрієвої солі метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти й етанольного розчину доцетакселу в процесі випарювання Круглодонну колбу об'ємом 1000 мл, що містить 150 мл водяного розчину натрієвої солі метилового ефіру N-повністю-транс-ретиноїлцистеїнової кислоти (3 мг/мл) і натрієвої солі метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти (3 мг/мл) приєднали до роторного випарника із впускним патрубком для подачі спиртових розчинів таксанів таким чином, що впускний патрубок не стикався з водяним розчином. Випарювання починали при температурі 7 UA 79902 U 5 10 бані 45 °C і швидкості обертання колби 100 об/хв. Через 1 хв. починали додавання краплями (60 крапель/хв., або 3 мл/хв) 80 мл метанольного розчину доцетакселу (5 мг/мл). Після того як це додавання було завершено, випарювання продовжували протягом 5 хв. Водяний розчин, що залишився після випарювання метанолу, перенесли з випарної колби в мірний циліндр об'ємом 250 мл. Колбу промили три рази 10 мл води, і промивні розчини злили в циліндр. До об'єднаних розчинів додали воду до досягнення загального об'єму 200 мл. Після фільтрування через фільтр із діаметром пор 0,2 мкм склад висушили сублімацією. Концентрація доцетакселу в отриманому складі дорівнювала 2 мг/мл. Приклад 5 Дослідження залежності розміру часток складу на основі доцетакселу від концентрації хлориду натрію Розчини були отримані шляхом відновлення висушеного сублімацією порошку, що містить доцетаксел і натрієву сіль метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти в співвідношенні мас/мас, що становить 1:1. 15 Таблиця 1 Концентрація Nacl, мг/мл 4 8 12 16 20 24 20 25 30 Доцетаксел у Доцетаксел у Доцетаксел у Доцетаксел у концентрації 0,5 концентрації концентрації концентрації мг/мл 1 мг/мл 2 мг/мл 4 мг/мл Середній Станд. Середній Станд. Середній Станд. Середній Станд. розмір, нм відх. розмір, нм відх. розмір, нм відх. розмір, нм відх. 7,2 0,7 6,7 0,6 6,4 0,4 5,9 2,5 7,8 0,7 8,2 0,7 9,3 1,4 12,7 1,4 12,1 1,0 13,4 0,9 14,6 1,0 40,0 4,9 17,0 2,3 29,0 4,2 51,3 3,7 82,7 3,7 22,4 1,8 39,3 2,8 72,3 3,7 107,7 6,2 28,3 4,6 86,0 4,2 108,3 7,5 144,3 9,9 Як показано в Таблиці 1 і на Фігурі 1, збільшення концентрації хлориду натрію, тобто іонної сили, робить частки більшими за розміром. Приклад 6 Перетворення натрієвої солі метилового ефіру N-повністю-транс-ретиноїлцистеїнової кислоти в його кальцієву сіль Водяні розчини натрієвої солі метилового ефіру N-повністю-транс-ретиноїлцистеїнової кислоти (5 мл, 15 мг/мл) і хлориду кальцію (3 мл, 30 мг/мл) змішали в пробірці об'ємом 10 мл. При перемішуванні з'явився дрібнодісперсний осад. Осад відокремили за допомогою центрифугування пробірки при 3000 об/хв. протягом 10 хв. Супернатант вилучили, і осад перемішали шляхом струшування з 8 мл води із ще одним наступним центрифугуванням. Після трьох додаткових процедур промивання, описаних вище, супернатант профільтрували через фільтр із діаметром пор 0,2 мкм для видалення можливих великих агрегатів продукту. Розчинність кальцієвої солі метилового ефіру N-повністю-транс-ретиноїлцистеїнової кислоти відповідала її концентрації в профільтрованому розчині й дорівнювала 0,2 мг/мл, як виміряли за допомогою описаного вище методу УФ-спектроскопії. Реакція проілюстрована за допомогою нижченаведеної загальної схеми, яка включає хлориди будь-яких іонів полівалентних металів, а не тільки кальцієвих іонів. + n R-SO3 Na + Метал n+ Cl n → Розчинна у воді натрієва сіль метилового ефіру N-повністютранс-ретиноїлцистеїнової кислоти або метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти n+ + (R-SO3 )n Метал ↓ + n Na Сl Нерозчинна у воді сіль метилового ефіру N-повністютранс-ретиноїлцистеїнової кислоти або метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти із полівалентним металом 35 Приклад 7 Залежність від часу розміру часток і дзета-потенціалу складу, отриманого шляхом відновлення висушеної сублімацією суміші доцетакселу й натрієвої солі метилового ефіру N 8 UA 79902 U повністю-транс-ретиноїлцистеїнової кислоти в співвідношенні мас/мас, що становить 1:2, у водяному розчині хлориду натрію (9 мг/мл) і хлориду кальцію (3 ммоль/л) Таблиця 2 Час після відновлення 0 1 2 4 8 5 10 15 20 25 30 Доцетаксел у концентрації 0,5 мг/мл Середній розмір Станд. частки, нм відх. 11,9 0,3 12,3 0,3 12,4 0,2 12,2 0,4 12,5 0,3 Доцетаксел у Доцетаксел у концентрації 1 мг/мл концентрації 2 мг/мл Середній розмір Станд. Середній розмір Станд. частки, нм відх. частки, нм відх. 12,6 0,2 13,1 0,4 13,2 0,4 13,4 0,2 13,0 0,2 13,7 0,4 12,9 0,1 13,4 0,2 13,2 0,2 13,8 0,2 Як показано в Таблиці 2 і на Фігурах 2 і 3, відсутні які-небудь значимі зміни у величинах розмірів часток, а також дзета-потенціалу під час зберігання складу протягом 8 годин. Оцінка біологічної активності – Приклади 8-11 Експерименти in vitro показали, що активність складів на основі доцетакселу в різних лініях клітин солідних пухлин більш виражена при застосуванні наночасток, запропонованих згідно із даною корисною моделлю. Крім того, цитотоксичність цих складів суттєво залежить від розміру наночасток. Більший розмір наночасток у системі доставки лікарських засобів згідно з винаходом призводить до менш інтенсивного транспорту таксанів у клітину, в результаті чого, у свою чергу, зменшується цитотоксичність. Найвищу активність спостерігали у випадку, коли розмір становив 13 нм для розчинів доцетакселу: експерименти in vitro давали значення факторів посилення для цих складів, що дорівнюють 31,7 на 3 день впливу. Контрольний зразок у цьому експерименті містив доцетаксел в етанольних розчинах (без яких-небудь наночасток). Інші виконані in vitro зіставлення складів на основі доцетакселу згідно із корисною моделлю з комерційно доступними препаратами на основі доцетакселу показали, що склади згідно з корисною моделлю мають більш виражену цитотоксичну активність проти різних ліній злоякісних клітин, таких як клітини аденокарциноми молочної залози, аденокарциноми яєчників і недрібноклітинного раку легенів. Приклад 8 Порівняльна оцінка цитотоксичності складів, утворених сумішшю доцетаксел - натрієва сіль метилового ефіру N-повністю-транс-ретиноїлцистеїнової кислоти - натрієва сіль метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти (мас./мас./мас. = 1:1:1) у культурах клітин лінії SKOV-3 аденокарциноми яєчників людини Висушений сублімацією порошок, що складається з доцетакселу, натрієвої солі метилового ефіру N-повністю-транс-ретиноїлцистеїнової кислоти й натрієвої солі метилового ефіру N-13цис-ретиноїлцистеїнової кислоти розчиняли або в 70 %-ному етанолі, або в розчині хлориду натрію (9 мг/мл), що містить підходящу кількість хлориду кальцію. Відбирали зразки отриманих розчинів і застосовували їх для виміру середнього розміру часток. Таблиця 3 Розчинник Концентрація Сасl2, ммоль/л 70 %-ний Etoh Розчин Nacl Розчин Nacl Розчин Nacl Розчин Nacl 0 1 2 3 Розмір часток, нм 11,3 12,2 13,1 14,6 День 3 ІС50 EF* день 3 День 4 ІС50 EF* день 4 2,0·10-7 1,2·10-7 3,4·10-8 6,3·10-9 2,0·10-8 1,7 5,9 31,7 10 7,2·10-9 7,2·10-9 5,6·10-9 2,1·10-9 3,4·10-9 1 1,3 3,4 2,1 День 5 EF* день ІС50 5 7,6·10-10 6,5·10-10 4,2·10-10 9,4·10-11 1,4·10-10 1,2 1,8 8,1 5,4 * Склад з етанолом застосовували як позитивний контроль для обчислення EF 35 Як показано в Таблиці 3 і на Фігурі 4, склад, що містить 2 ммоль/л кальцію, є найбільш активним. При цьому цитотоксичність складів зменшується з підвищенням і зниженням концентрації кальцію. 9 UA 79902 U 5 10 15 Приклад 9 Оцінка цитотоксичності складу "Доцетаксел - натрієва сіль метилового ефіру N-повністютранс-ретиноїлцистеїнової кислоти натрієва сіль метилового ефіру N-13-цисретиноїлцистеїнової кислоти (мас./мас./мас. = 1:0.5:0.5)" у порівнянні із препаратом Таксотер (TAXOTERE®) і доцетакселом окремо в культурах клітин лінії MDA-MB-231 аденокарциноми молочної залози людини Зазначений у заголовку склад одержували шляхом розчинення висушеною сублімацією порошку у водяному розчині, що містить хлорид натрію (6 мг/мл), хлорид калію (0,3 мг/мл), гексагідрат хлориду кальцію (0,4 мг/мл), лактат натрію (3,1 мг/мл). Доцетаксел застосовували в метанольному розчині. Зразок препарату Таксотер (TAXOTERE®) готували відповідно до інструкцій виробника шляхом розведення комерційно доступного концентрату (40 мг/мл) спочатку розчином етанолу до концентрації 10 мг/мл, за яким ішло подальше розведення в розчині хлориду натрію (9 мг/мл). Усі зразки застосовували протягом однієї години після одержання. Ефекти посилення обчислювали проти метанольного розчину доцетакселу. Результати представлено в Таблиці 4 нижче. Таблиця 4 Склад Доцетаксел Таксотер (TAXOTERE®) Доцетаксел - натрієва сіль метилового ефіру Nповністю-трансретиноїлцистеїнової кислоти - натрієва сіль метилового ефіру N-13-цисретиноїлцистеїнової кислоти 20 25 30 Розмір часток, нм ІС50 день 3 (1,25±0,11)·10-8 (1,08±0,09)·10-8 EF день 3 1,2 12 (3,1±0,1)10-9 4,0 ІС50 EF день 4 день 4 (1,0±0,1)·10-8 (9,60±0,18)·10-9 1,0 (1,2±0,1)10-9 8,3 Приклад 10 Оцінка цитотоксичною складу "Доцетаксел - натрієва сіль метилового ефіру N-повністютранс-ретиноїлцистеїнової кислоти - натрієва сіль метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти (мас./мас./мас. = 1:0,5:0,5)" ν порівнянні із препаратом Таксотер (TAXOTERE®) і доцетакселом окремо в культурах клітин лінії SKОV-3 аденокарциноми яєчників людини Зазначений у заголовку склад одержували шляхом розчинення висушеного сублімацією порошку у водяному розчині, що містить хлорид натрію (6 мг/мл), хлорид калію (0,3 мг/мл), гексагідрат хлориду кальцію (0,4 мг/мл), лактат натрію (3,1 мг/мл). Доцетаксел застосовували в метанольному розчині. Зразок препарату Таксотер (TAXOTERE®) готували відповідно до інструкцій виробника шляхом розведення комерційно доступного концентрату (40 мг/мл) спочатку розчином етанолу до концентрації 10 мг/мл, за яким ішло подальше розведення в розчині хлориду натрію (9 мг/мл). Усі зразки застосовували протягом однієї години після одержання. Ефекти посилення обчислювали проти метанольного розчину доцетакселу. Результати представлено в Таблиці 5 нижче. Таблиця 5 Склад Доцетаксел Таксотер (TAXOTERE®) Доцетаксел - натрієва сіль метилового ефіру N-повністютранс--ретиноїлцистеїнової кислоти - натрієва сіль метилового ефіру N-13-цисретиноїлцистеїнової кислоти Розмір часток, нм ІС50 день 3 (9,07±0,38)·10-8 (1,18±0,09)·10-7 EF день 3 0,8 ІС50 день 4 (2,85±0,26)·10-8 (2,03±0,15)·10-8 EF день 4 1,4 12 (3,24±0,18)·10-8 2,8 (2,86±0,13)·10-9 10,0 35 10 UA 79902 U 5 10 15 Приклад 11 Оцінка цитотоксичностб складу "Доцетаксел - натрієва сіль метилового ефіру N-повністютранс-ретиноїлцистеїнової кислоти натрієва сіль метилового ефіру N-13-цисретиноїлцистеїнової кислоти (мас./мас./мас. = 1:0,5:0,5)" у порівнянні із препаратом Таксотер (TAXOTERE®) і доцетакселом окремо в культурах клітин лінії А549 недрібноклітинного раку легенів людини Зазначений у заголовку склад одержували шляхом розчинення висушеного сублімацією порошку у водяному розчині, що містить хлорид натрію (6 мг/мл), хлорид калію (0,3 мг/мл), гексагідрат хлориду кальцію (0,4 мг/мл), лактат натрію (3,1 мг/мл). Доцетаксел застосовували в метанольному розчині. Зразок препарату Таксотер (TAXOTERE®) готували відповідно до інструкцій виробника шляхом розведення комерційно доступного концентрату (40 мг/мл) спочатку розчином етанолу до концентрації 10 мг/мл, за яким ішло подальше розведення в розчині хлориду натрію (9 мг/мл). Усі зразки застосовували протягом однієї години після одержання. Ефекти посилення обчислювали проти метанольного розчину доцетакселу. Результати представлено в Таблиці 6 нижче. Таблиця 6 Склад Доцетаксел Таксотер (TAXOTERE®) Доцетаксел - натрієва сіль метилового ефіру Nповністю-трансретиноїлцистеїнової кислоти - натрієва сіль метилового ефіру N-13-цисретиноїлцистеїнової кислоти 20 Розмір часток, нм ІС50 день 3 (5,76±0,26)·10-9 (4,81±0,34)·10-9 EF день 3 1,2 ІС50 день 4 (4,97±0,27)·10-9 (4,63±0,17)·10-9 EF день 4 1,1 12 (9,14±0,47)·10-10 6,3 (5,35±0,15)·10-10 7,9 Незважаючи на те, що корисна модель була описана у відношенні деяких варіантів реалізації, включаючи кращий варіант, відомий у цей час винахідникам, слід розуміти, що різні зміни й модифікації, як повинне бути очевидно для середнього фахівця в даній області техніки, можуть бути зроблені без виходу за рамки корисної моделі, обумовлені прикладеною до даного опису формулою корисної моделі. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 25 30 35 40 45 1. Система доставки лікарських засобів для введення щонайменше одної фармацевтично активної речовини, що має розчинність per se у воді менш ніж приблизно 100 мкг/мл, причому зазначена речовина перебуває у формі часток з ефективним середнім розміром менш ніж приблизно 50 нм, яка характеризується тим, що частки речовини є по суті аморфними; частки речовини укладені в наночастки, утворені натрієвою сіллю метилового ефіру N-повністютранс-ретиноїлцистеїнової кислоти, натрієвою сіллю метилового ефіру N-13-цисретиноїлцистеїнової кислоти або їх комбінацією; і відношення маси зазначеної натрієвої солі метилового ефіру N-повністю-трансретиноїлцистеїнової кислоти, натрієвої солі метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти або їх комбінації до маси зазначеної речовини перебуває в діапазоні від приблизно 1:1 до приблизно 4:1, за умови, що зазначена щонайменше одна фармацевтично активна речовина не є паклітакселом або циклоспорином. 2. Система доставки лікарських засобів за п. 1, яка характеризується тим, що відношення маси зазначеної натрієвої солі метилового ефіру N-повністю-транс-ретиноїлцистеїнової кислоти, натрієвої солі метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти або їх комбінації до маси зазначеної речовини перебуває в діапазоні від приблизно 1:1 до приблизно 10:1. 3. Система доставки лікарських засобів за п. 1, яка характеризується тим, що зазначена щонайменше одна фармацевтично активна речовина вибрана з доцетакселу та його похідних. 11 UA 79902 U 4. Система доставки лікарських засобів за п. 1, яка характеризується тим, що зазначена щонайменше одна фармацевтично активна речовина вибрана із сиролімусу, такролімусу та їх похідних. 12 UA 79902 U Комп’ютерна верстка М. Ломалова Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 13
ДивитисяДодаткова інформація
Назва патенту англійськоюDrug delivery system
Автори англійськоюAleksov Julian, Lokot Igor
Назва патенту російськоюСистема доставки лекарственных средств
Автори російськоюАлексов Джулиан, Локот Игорь
МПК / Мітки
МПК: C07C 39/23, A61K 31/185
Мітки: засобів, система, доставки, лікарських
Код посилання
<a href="https://ua.patents.su/15-79902-sistema-dostavki-likarskikh-zasobiv.html" target="_blank" rel="follow" title="База патентів України">Система доставки лікарських засобів</a>
Попередній патент: Спосіб моделювання фіброзу легень у щурів
Наступний патент: Фармацевтична композиція
Випадковий патент: Безконтактна синхронна машина суміщеного типу