Вакцинна композиція на основі стихолізину, інкапсульованого в ліпосоми
Номер патенту: 111944
Опубліковано: 11.07.2016
Автори: Лаборде Кінтана Раді Худіт, Пасос Сантос Ісабель Фабіола, Алонсо Біоска Марія Еухенія, Крус Леал Йоеліс, Меса Пардільо Сірсе, Валлє Гарай Айсель, Ланіо Руїс Марія Еліана, Альварес Валькарсель Карлос Мануель, Фернандес Моліна Луїс Енріке, Лусардо Лоренсо Марія дель Кармен, Техука Мартінес Майра, Канет Сантос Льєм
Формула / Реферат
1. Вакцинний носій для індукції клітинної імунної відповіді, який включає ліпідні везикули, що містять дипалмітоїлфосфатидилхолін і холестерин в еквімолярному співвідношенні, спільно інкапсульовані з білками, одержаними з анемона Stichodactyla helianthus, що вибрані з групи, яка включає стихолізин І (StI), стихолізин ІІ (StII), мутант стихолізину І W111С (StIW111C), необоротно інактивований димер StIW111Cirrev (StIW111Cirrev) або інактивований нагріванням StII, і антиген.
2. Вакцинний носій за п. 1, в якому антигеном є білок або поліпептид, який індукує специфічну цитотоксичну Т-лімфоцитарну імунну відповідь проти пухлин.
3. Вакцинна композиція, яка включає вакцинний носій за будь-яким з пп. 1-2, причому вказана композиція не містить інших імунологічних ад'ювантів.
4. Застосування вакцинного носія за будь-яким з пп. 1-2 для лікування пухлин.
Текст
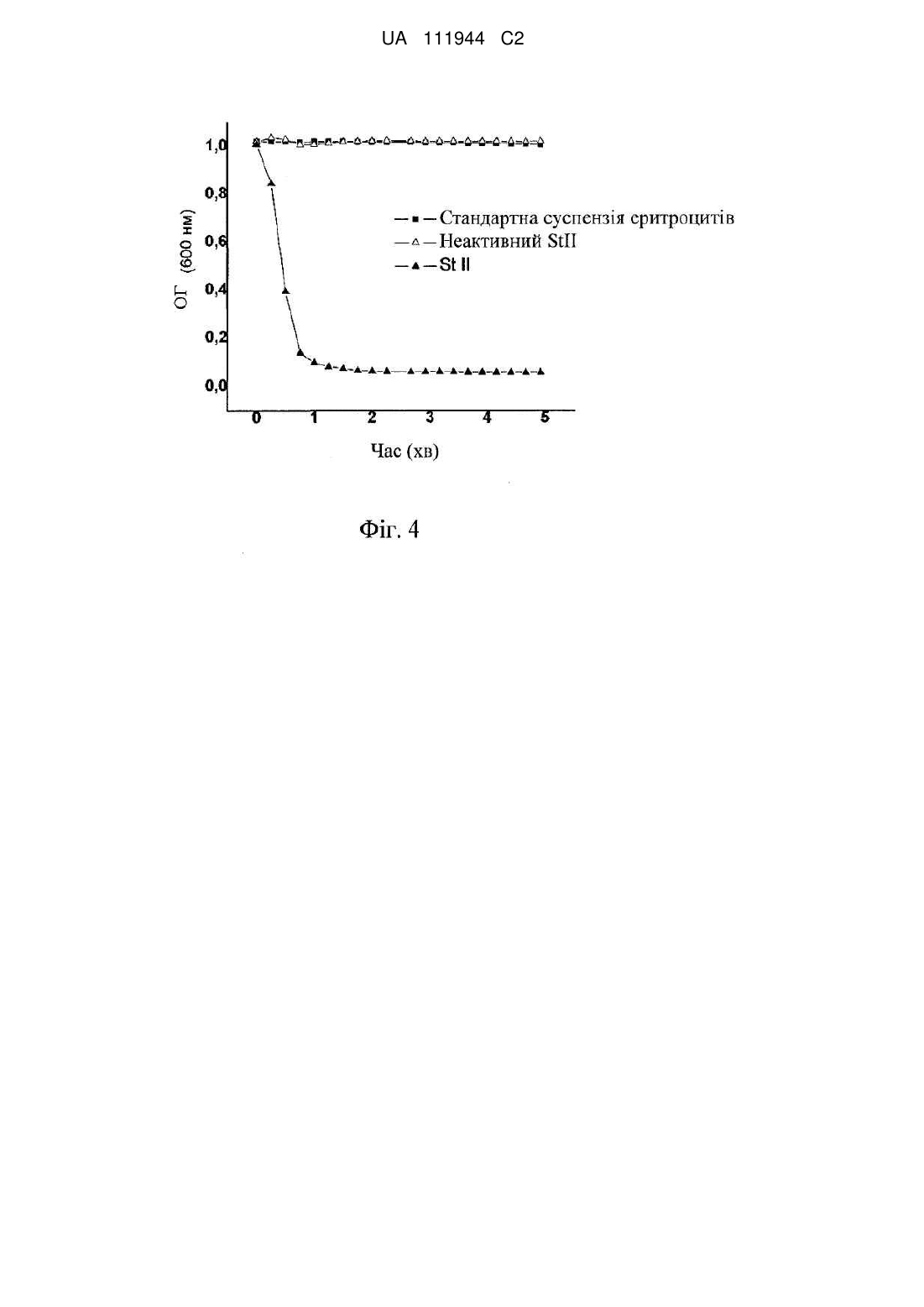
Реферат: Винахід стосується вакцинного носія для індукції клітинної імунної відповіді, який включає ліпідні везикули, що містять дипалмітоїлфосфатидилхолін: холестерин в молярному співвідношенні 1:1, спільно інкапсульовані з білками, одержаними з анемона Stichodactyla helianthus, і антиген; вакцинної композиції, яка включає вказаний вакцинний носій, та застосування вакцинного носія для лікування пухлин. UA 111944 C2 (12) UA 111944 C2 UA 111944 C2 5 10 15 20 25 30 35 40 45 50 55 60 ГАЛУЗЬ ТЕХНІКИ Даний винахід стосується галузі біотехнології, яка стосується здоров'я людини. Зокрема, даний винахід стосується вакцинного носія для застосування як підшкірно, так і внутрішньом'язово, основаного на ліпосомах, які містять стихолізин, і який посилює антигенспецифічні клітинні імунні відповіді, застосовного при імунотерапії раку і лікуванні захворювань, викликаних внутрішньоклітинними патогенами. ПЕРЕДУМОВИ СТВОРЕННЯ ВИНАХОДУ Про здатність ліпосомних везикул до імуноад'ювантної дії відомо довгий час. Існуючий раціоналізм використання ліпосом при імунізації і розробці вакцин основується на їх здатності до передачі антигенної молекули антигенпрезентуючим клітинам (АРС) і стимуляції імунної відповіді. Найважливіші переваги ліпосом як імуноад'ювантів зводяться до (i) здатності до відтворення патогенів, які несуть велику кількість антигену до АРС, (ii) можливості інкапсулювання антигенів разом з імуностимулючими молекулами, (iii) податливості до зміни фізико-хімічних властивостей з метою збільшення ефективності і (iv) того факту, що вони є біодеградованими і нетоксичними (Leserman in Journal of Liposome Research, 2004, 14 (3&4), 175-189). Проблемою в галузі вакцинології є посилення клітинної імунної відповіді, опосередкованої антигенспецифічними цитотоксичними Т-лімфоцитами CD8+ (CTL), який має вагомість для попередження і лікування захворювань, викликаних внутрішньоклітинними патогенами і пухлинними клітинами. Ліпосомні везикули можуть посилити опосередковану CTL відповідь, але не завжди ефективно. Різні стратегії на основі ліпосомних везикул були розроблені з метою приведення у відповідність цієї функції; прикладами є чутливі до рН в кислотному середовищі ліпосоми, катіонні ліпосоми, включення імуномодуляторів, таких як CpG і пороутворювальних токсинів з бактерій. Незважаючи на ряд публікацій, деякі з цих стратегій мали обмежений успіх в індукції ефективних клітинних імунних відповідей або знаходяться в невигідному положенні, і тому необхідна краща розробка до реалізації. Інтеграція білків вірусних оболонок в ліпосомну мембрану для прискорення злиття мембран в умовах рН в кислотному середовищі або протеолітичного процесування була іншим альтернативним рішенням для розробки вакцинних носіїв. Ці везикули, відомі як віросоми, не тільки використовувалися як вакцини проти батьківських вірусів, але також використовувалися як вектори для антигенів вакцини, пов'язаних з віросомою або інкапсульованих в неї (Zurbriggen en Vaccine, 2003 14; 21(9-10): 921-924). Частинки у вигляді віросом, відомі зі скороченням IRIV (підсилюючі імунну відповідь, реконструйовані віросоми грипу), які містять білки і ліпіди з оболонки вірусу грипу, є найкращим прикладом цієї стратегії і утворюють основу патенту, який стосується вакцини проти гепатиту А (патент США № 5565203). Однак цей вакцинний препарат був розроблений для посилення продукції нейтралізуючих антитіл проти гепатиту А. Зв'язування інактивованого вірусу гепатиту А, який має високий ступінь чистоти з віросомною мембраною сприяє процесуванню і презентації похідних пептидів за класичним шляхом MHCII, в результаті процесу злиття віросоми з ендосомними мембранами АРС (Gluck end Walti in Dev. Biol. (Basel), 2000, 103, 189-197). Описані факти кажуть про важливість фізичного зв'язку антигенів з віросомами в імуноад'юванті (Zurbriggen et al., Progr., in Lipid Res., 2000, 39(1), 3-18: Amacker et al., in Int. Immunol., 2005, 17(6), 695-704). Schumacher і інш. в Vaccine 22: 714-723, 2004 повідомляли, що IRIV здатні до посилення клітинноопосередкованої імунної відповіді. Зокрема, Schumacher і інш. продемонстрували їх ад'ювантну активність в індукції CTL in vitro. Ця здатність залежала в основному від стимуляції реактивності CD4+ Т-клітин, специфічних стосовно вірусних білків. Однак, незважаючи на те, що використання віросом як ад'ювантів має множину переваг, таких як низька токсичність і висока імуногенність, однією з проблем в сучасній віросомній технології є відсутність методів ефективного інкапсулювання розчинених речовин, таких як білки, необхідних для індукції опосередкованого CTL відповіді. Враховуючи концентрацію ліпіду, при якій продукують віросоми, (приблизно 1 мМ ліпіду) і їх діаметр (приблизно 200 нм), менше 1 % водної фази інкапсулюється у віросоми (Schoen et al., en J. Liposome Res., 3: 767-792, 1993). Ці особливості значно зменшують ефективність віросом в передачі антигенів або генів клітинам. Одна стратегія для подолання цього недоліку і отримання імуногенного препарату для CD8+ Т-клітин, нещодавно опублікована в заявці на патент США № 20100015214, основується на комбінації пустих віросом з векторами, переважно ліпосомами, в які інкапсулюються антигени. У заявці США № 20100015214 описується трансад'ювантний ефект віросом, хоча ці частинки і ліпосоми не демонструють яку-небудь фізичну взаємодію між собою. У статті Lanio і інш., опублікованій в J. Liposome Res., 2008, 18(1), 1-19, описана велика ефективність в інкапсуляції/утриманні rhEGF ліпосоми, отриманої методом дегідратаціїрегідратації (DRV) і яка складається з фосфатидилхоліну (РС) насиченого 1 UA 111944 C2 5 10 15 20 25 30 35 40 45 50 55 (дипалмітоїлфосфатидилхоліну, DPPC) і холестерину (Cho) в молярному співвідношенні 1:1, в порівнянні з ліпосомами, які містять ненасичений РС і Cho. Насправді, метод отримання DRV дає везикули з множиною бішарів, які мають високу ефективність інкапсуляції/утримання широкого ряду розчинених речовин. Lanio і інш. продемонстрували імуноад'ювантні властивості цих везикул для посилення продукції антитіл, кількісно і якісно кращої, проти rhEGF. У огляді, опублікованому Alvarez і інш. в Toxicon, 2009, 54(8); 1135-1147, підсумовані структурні і функціональні властивості двох білків, продукованих морським безхребетним тваринам, анемоною Карибського моря Stichodactyla helianthus, і названих авторами стихолізинами (St) I і II (StI/II). Ці білки є пороутворювальними токсинами (PFT), які належать до сімейства білків - актинопоринів, унікального класу PFT еукаріотичного походження, виявленого тільки у морських анемон. Подібно до інших членів цього сімейства, St є основними білками з високою ізоелектричною точкою (> 9,5), з молекулярною масою, яка складає приблизно 20 кДа, які не містять залишки цистеїну в своїх амінокислотних послідовностях, і демонструють перевагу мембранам, які містять сфінгомієлін (SM). St продукуються в розчинній формі, але можуть легко з'єднуватися з різними клітинними і модельними мембранними системами, утворюючи пори діаметром, який дорівнює 2 нм, ймовірно, в результаті взаємодії α-спіралей Nкінців з чотирьох мономерів. Обидві події, з'єднання і утворення пор, залежать від фізикохімічних властивостей мембран. У статті, опублікованій в Toxicon, 2007, 49: 68-81, Martinez і інш. повідомляють про важливість присутності SM і Cho для з'єднання і утворення пор в мембранах за допомогою StII. Фазовий стан мембрани впливає на з'єднання StII з цими структурами. Як повідомлялося Martinez і інш. в Journal Biology, 2002, 16, 2: 85-93, цей токсин оборотно зв'язується з мембранами з DPPC і SM, з дуже низькою здатністю до зміни проникності мембрани. Незважаючи на те, що в різних статтях повідомлялося про імуномодулюючі властивості пороутворювальних токсинів з бактерій для індукції антигенспецифічної, CTL-опосередкованої відповіді, використовуючи різні стратегії, які включають їх інкапсуляцію в ліпосоми, як підсумовано в оглядах Dietrich і інш., і Moron et al. в TRENDS in Microbiology, 2001, Vol. 9 No. 1, 23-28 і TRENDS in Immunology, 2004, Vol. 25 No. 2, 92-97, відповідно, немає згадки про функціонально гомологічні токсини з морських еукаріотичних організмів. У розрізі їх застосувань при імунотерапії пухлинних захворювань, бажано мати нові вакцинні препарати, які здатні до індукції специфічної клітинної імунної відповіді проти антигенів, і менш агресивні, ніж ті композиції, які містять бактеріальні токсини. КОРОТКИЙ ОПИС ВИНАХОДУ Несподівано автори даного винаходу виявили, що при підшкірному або внутрішньом'язовому введенні антигену, інкапсульованого у вакцинний склад ліпосома-St, який містить будь-який з описаних варіантів токсинів, які включають ті, які не виявляють пороутворювальну або літичну активність, індукуються набагато більші відсотки лізису клітинмішеней, ніж ті, які відмічалися в групі позитивного контролю, використовуючи поліінозиновуполіцитидилову кислоту (poly I:С, PIC), яка розглядається в рівні техніки як основний підсилювач CTL-опосередкованої відповіді, рівнів немодифікованих антитіл і змішаної Th1/Th2 відповіді, які індукуються ліпосомним антигеном. Це вказує на потенціал системи ліпосома-St для виклику і клітинної, і гуморальної відповіді проти білкового антигену, що важливо для застосування цього складу з метою вакцинації. Об'єктом цього винаходу є вакцинний носій на основі ліпосомних препаратів з DPPC і Cho, в які інкапсулюються токсини, відомі як St, разом з білковим антигеном. Об'єктом даного винаходу також є ліпосомні препарати з DPPC і Cho, в які інкапсулюються мутанти токсинів, відомих як St, (наприклад, StIW111C і StIW111Cirrev) разом з білковим антигеном. У іншому аспекті об'єктом даного винаходу також є вакцинні композиції на основі вакцинного носія, які мають токсини разом з антигеном, які вводяться підшкірно або внутрішньом'язово для індукції сильної антигенспецифічної CTL-опосередкованої відповіді. Іншим об'єктом цього винаходу є застосування описаних вакцинних композицій, основаних на вакцинному носії, які містять токсини разом з антигеном і які вводяться підшкірно або внутрішньом'язово, для посилення імунної відповіді у пацієнта, який страждає на захворювання, вибиране з групи, яка складається з раку і інфекційних захворювань, які викликаються внутрішньоклітинними патогенами. У іншому аспекті об'єктом даного винаходу також є спосіб лікування пацієнтів, у випадку яких потрібне посилення імунної відповіді у них, причому пацієнт страждає на захворювання, вибиране з групи, яка складається з раку і інфекційних захворювань, які викликаються внутрішньоклітинними патогенами, і, причому спосіб включає введення підшкірно або 2 UA 111944 C2 5 10 15 20 25 30 35 40 45 50 55 внутрішньом'язово вакцинних композицій на основі цього вакцинного носія, які містять токсини St або їх мутанти разом з релевантним для захворювання антигеном. Крім того, даний винахід також стосується захисту, який забезпечується такими вакцинними композиціями, проти тих, які вводяться для перевірки наявності імунітету пухлинних клітин, експресуючих антиген, зменшенню відсотка пухлин і збільшенню виживання суб'єктів з пухлинами. Отже, об'єктом цього винаходу також є спосіб профілактики виникнення захворювання, пов'язаного з антигеном. ДОКЛАДНИЙ ОПИС ДАНОГО ВИНАХОДУ Вакцинний носій згідно з даним винаходом оснований на дисперсіях у воді ліпосом DRV, які складаються з DPPC і Cho в молярному співвідношенні DPPC:Cho, який дорівнює 1:1, в які інкапсулюються St разом з антигеном, і які, зрештою, можуть містити інші співрозчинники, які змішуються з водою, не токсичні, які не спричиняють подразнення, і які не викликають дестабілізацію везикул, такі як ті, які звичайно використовуються в ін'єктованих фармацевтичних композиціях, наприклад, цукри, поліетиленгліколь і т. д. Ліпосомні препарати згідно з даним винаходом отримують методом дегідратації-регідратації, і в їх склад входять DPPC і Cho в молярному співвідношенні 1:1, і в них інкапсулюється антиген разом з деякими з варіантів St або їх оборотно неактивних мутантів, причому вказані вакцинні композиції здатні до активації антигенспецифічної CTL-опосередкованої імунної відповіді і є протективними проти тих, які вводяться для перевірки наявності імунітету пухлинних клітин. У одному варіанті здійснення даного винаходу вакцинна композиція містить як антиген білок OVA, але антигеном може бути будь-який білок або поліпептид, пов'язаний із захворюванням, в якому, з терапевтичної точки зору, важлива індукція специфічної CTL-опосередкованої імунної відповіді проти цього білкового антигену. Наприклад, антигеном може бути білок або поліпептид, пов'язаний з раком, білок або поліпептид, пов'язаний з СНІДом, або білок або поліпептид, пов'язаний з туберкульозом. Ліпосоми, які описуються тут отримують методом дегідратації-регідратації, описаним Kirby і Gregoriadis в Biotechnology, 1984, 2, 979-984; вони являють собою везикули з внутрішньою водною фазою, оточеною декількома ліпідними бішарами, які характеризуються високою ефективністю інкапсуляції і утримання рухливих молекул, таких як антиген і білкиімуномодулятори. Розчини в хлороформі DPPC і Cho в молярному співвідношенні, яке дорівнює 1:1, піддають випарюванню і тримають під вакуумом протягом 30 хвилин. Ліпіди гідратують за допомогою деіонізованої води при температурі, яка перевищує температуру фазового переходу (Тс) DPPC (Т>45 °C). Суспензію багатошарових везикул (MLV), яка отримується в результаті, перетворюють в SUV або LUV (невеликі одношарові везикули і великі одношарові везикули, відповідно) за допомогою циклів піддавання впливу ультразвуку і спокою або видавлювання через полікарбонатні мембрани з розміром пор, який становить 100 нм. Отримані везикули змішують з білковими розчинами, виходячи з відношення ліпід: білок - 16-64 мкмолів ліпідів: 1,87 нмолів антигену і 0,5-2 нмоля St, і піддають ліофілізації протягом 20-24 годин. Регідратацію здійснюють з використанням деіонізованої води і перемішування протягом 30 хвилин при температурі, меншій ніж 45 °C. Не інкапсульований в ліпосоми матеріал видаляють відмиванням забуференим фосфатом сольовим розчином (PBS) pH 7,4 (136 ммоль/л NaCl, 1,47 ммоль/л KH2PO4, 9,55 ммоль/л Na2HPO4, 2,68 ммоль/л KCl) з подальшим центрифугуванням при 10000×g протягом 15 хв. У таких препаратах досягається ефективність інкапсуляції різних варіантів St, яка становить приблизно 50 %, з утриманням, яке становить 70 % після зберігання протягом одного місяця при 4 °C з суспендуванням в PBS. Токсини StI і StII виділяють і піддають очищенню з морської анемони Stichodactyla helianthus, використовуючи метод, описаний Lanio і інш. в Toxicon 2001, 39, 187-194. Рекомбінантний стихолізин I (rStI) і мутант rStI, StIW111C, отриманий стосовно методів, описаних Pazos і інш. в Toxicon, 2006, 48, 1083-1094 і Penton і інш. в Protein Eng. Des. Sel. 2011, 24, 485-493, відповідно. У діапазоні від 0,25 до 1 мкМ знаходиться концентрація St, яка використовується у вакцинному носії даного винаходу, і які інкапсулюються разом з антигеном в діапазоні концентрації 1-3,5 мкМ в суспензію ліпосом з діапазоном загальної концентрації ліпіду від 16 до 64 мМ. Переважно вакцинний носій даного винаходу містить кількість St, яка складає 0,3-0,4 нмоля, і які інкапсульовані разом з 1-2 нмолі антигену в суспензію ліпосом з 20 мкмолями ліпідів загалом в об'ємі 200 мкл. Діапазон доз, які використовуються для вакцин, на який посилаються в даному винаході, використовуючи терміни "підшкірно" або "внутрішньом'язово", становить 1-2 нмолі (50-100 мг) антигену. 3 UA 111944 C2 5 10 15 20 25 30 35 40 45 50 55 60 Основною характерною ознакою вакцинних композицій даного винаходу є відсутність в них імунологічних ад'ювантів, відмінних від тих, які описані. Як вже розкрито вище, з рівня техніки відомо, що бактеріальні пороутворювальні токсини, інкапсульовані в ліпосомні везикули, здатні до посилення CTL-опосередкованої відповіді, але відомо, що вакцинні композиції на основі бактеріальних токсинів при їх застосуванні надають несприятливі ефекти на людину; однак автори даного винаходу несподівано виявили, що не бактеріальні токсини здатні надавати той же імуностимулючий ефект. Більше того, авторам даного винаходу вдалося відділити пороутворювальну активність токсинів від їх ефектів стимуляції CTL-опосередкованої відповіді, що дає величезні переваги цьому вакцинному носію у випадку клінічного застосування для людей. Результати, отримані з використанням вакцинного носія даного винаходу, молекулярних структур StIW111Cirrev або інактивованого нагріванням StII, які інкапсульовані разом з антигеном в ліпосоми, слугують доказом того, що між посиленням антигенспецифічної CTL-опосередкованої імунної відповіді за допомогою препаратів ліпосома-St і здатністю цих білків до утворення пор в мембранах немає повної залежності. Дослідження дозрівання дендритних клітин (DC), виділених з кісткового мозку мишей C57BL/6 і підданих впливу StII in vitro, демонструє здатність цього білка, не тільки у випадку його активного варіанту, але також у випадку інактивованого нагріванням варіанту, до індукції активації CD, подібно до того, що відмічалося при використанні LPS (позитивного контролю) в схожих умовах. Здатність St до утворення пор в мембранах оцінювали за допомогою дослідження гемолітичної активності і проникності LUV, навантажених карбоксифлуоресцеїном (CF), як описано Martinez і інш. в Toxicon, 2001, 39, 1547-1560. Було встановлено, що St не виявляють активності, яка стосується зміни проникності мембрани, при аналізі проникності ліпосомних везикул з DPPC:Cho (1:1), в які інкапсульований CF, в порівнянні з тим, що відмічалося у випадку везикул, які складаються з фосфатидилхоліну яєчного жовтка і SM (1:1) (позитивним контролем). Було підтверджено за допомогою дослідження гемолітичної активності і електрофорезу в SDS-PAGE в присутності 2-меркаптоетанолу (2-МЕ) як відновлювальний агент і за його відсутності, як описано Penton і інш. в Protein Eng Des Sel. 2011, 24, 485-493, що мутантний StIW111C утворює неактивний димер, який стабілізує дисульфідний зв'язок. Нездатність димерної структури до утворення пор в еритроцитах, як модельних клітин, була результатом його не з'єднання з мембраною. Був розроблений метод отримання необоротної димерної структури StIW111C (StIW111Cirrev) на основі відновлення StIW111C за допомогою інкубації з 2-МЕ (0,1 моль/л), видалення відновлювального агента за допомогою фільтрації на колонці PD-10 і негайної інкубації StIW111Cmonomer з гомобіфункціональним реагентом біс(малеімід)гексан (ВМН) в молярному співвідношенні StIW111Cmonomer:ВМН 1:1-2:1 протягом 2 годин при 4 °C. StIW111Cirrev піддавали очищенню за допомогою гель-фільтрації на колонці Superdex 75 HR 10/300 в присутності відновлювального агента. Отримання необоротного димера і ступінь його чистоти підтверджували задопомогою електрофорезу в SDS-PAGE в відновлювальних умовах. Необоротний димер був отриманий зі ступенем чистоти, який складає 94 % і ступенем забруднення, який складає лише 6 % необоротного димера. Відсутність функціональної активності підтверджували за допомогою дослідження гемолітичної активності. Необоротну інактивацію StII за допомогою термообробки виконували відповідно до методу, описаному Martinez і інш. в Toxicon, 2001, 39, 1547-1560, і загальне зменшення здатності до утворення пор в мембрані перевіряли за допомогою дослідження гемолітичної активності. Імуномодулючі властивості різних молекулярних структур St в системі ліпосома-St, пов'язані з їх здатністю до посилення антигенспецифічної цитотоксичної імунної відповіді in vivo і протипухлинного імунітету в превентивному випадку, можна визначити в експериментальній моделі на лінії мишей C57BL/6, використовуючи антиген OVA і лінію пухлинних клітин E.G7, субклон тимоми EL-4 миші (Kusmartsev end Gabrilovich, in J. Leukoc Biol., 2003, 74: 186-196), трансфіковану комплементарною ДНК OVA pAc-neo-OVA (Moore і інш., Cell, 1988, 54: 777-785) і отриману з Американської колекції типових культур (ATCC, VA). Автори даного винаходу також виявили, що щеплення з превентивною метою, використовуючи вакцинний носій ліпосома-St, який містить антиген, приводить до більшого протипухлинного захисту, ніж при використанні ліпосом, які не містять StII. Ці результати слугують доказом того, що система ліпосома-St ефективна в індукції протипухлинної відповіді, функціонально сильної і протективної, при використанні білкового антигену, без необхідності в інших ад'ювантах. У свою чергу, застосування цього препарату в комбінованих терапіях може привести до подальшого збільшення його протипухлинного ефекту. 4 UA 111944 C2 5 10 15 20 25 30 35 40 45 50 55 У наступні приклади включені деталі порівняльних експериментів, які дозволяють підтвердити імунологічну ефективність в індукції антигенспецифічної цитотоксичної імунної відповіді in vivo і протипухлинного імунітету у превентивному випадку вакцинних композицій об'єкта даного винаходу відносно інших складів, які не є ліпосомними і не містять St. ПРИКЛАДИ Приклад 1: Оцінка цитотоксичності і CTL-опосередкованої відповіді при використанні вакцинного носія, використовуючи природний StI або StII і OVA як білковий антиген. Вакцинний носій на основі ліпосом був приготований, як описано раніше. У везикули DRV, до складу яких входили DPPC і Cho (в молярному співвідношенні 1:1), в 10 мкмоль ліпідів загалом, були інкапсульовані разом OVA як модельний антиген і St (StI або StII) в молярному співвідношенні: 1,1 нмоль OVA і 0,3 нмоль St в забуференому фосфатом сольовому розчині (PBS) pH 7,4. Слідуючи цьому методу, були отримані дві вакцинні композиції. Вакцинна композиція А: ліпосоми DRV з DPPC і Cho (60 мкмоль ліпідів загалом), в які інкапсульовано 6,6 нмоль (50 мкг) OVA. Вакцинна композиція В: ліпосоми DRV з DPPC і Cho (60 мкмоль ліпідів загалом), в які інкапсульовано 6,6 нмоль (50 мкг) OVA і 1,88 нмоль StI або StII. П'ятнадцять самиць мишей C57BL/6 з вагою тіла в діапазоні 18-20 г були відібрані, і розділені на 5 експериментальних груп по три тварини в кожній. Групі 1 (негативному контролю) вводили підшкірно в дні 0, 12, 13 і 14 0,2 мл забуференого фосфатом сольового розчину (PBS). Групі 2 (позитивному контролю) вводили підшкірно на день 12 22,2 нмолів (1 мг) OVA, змішаного зі 100 мкг поліінозинової-поліцитидилової кислоти (PIC), синтетичного ліганду TLR3 і класичного індуктора CTL-опосередкованої відповіді (Hamilton-Williams і інш. In J. Immunol., 2005, 174: 1159-1163), в дні 13 і 14 тварини знов отримували 100 мкг PIC. Групі 3 вводили підшкірно в дні 0 і 12 0,2 мл вакцинної композиції А (що еквівалентно 1,1 нмолям або 50 мкг OVA). Групі 4 вводили підшкірно в дні 0 і 12 0,2 мл вакцинної композиції В (що еквівалентно 1,1 нмолям або 50 мкг OVA і 0,3 нмолям або 6,25 мкг StI). Групі 5 вводили підшкірно в дні 0 і 12 0,2 мл вакцинної композиції В (що еквівалентно 1,1 нмолям або 50 мкг OVA і 0,3 нмолям або 6,25 мкг StII). У день 20 експерименту клітини селезінки від не підданих імунізації мишей C57BL/6 інкубували з сукцинімідиловим ефіром діацетату карбоксифлуоресцеїну (CFSE) в двох концентраціях (0,33 і 5 мкмоль/л, відповідно); мічені клітини з найбільшою інтенсивністю флуоресценції також інкубували з 1 мкмоль/л імунодомінатного пептиду (257-SIINFEKL-264) OVA застосовно до гаплотипу MHC I у випадку лінії мишей C57BL/6. Згодом обидві популяції мічених клітин змішували в співвідношенні 1:1, і в хвостову вену мишей експериментальних груп 6 1-5 вводили 30×10 клітин суміші в загальному об'ємі, який дорівнював 0,2 мл. Мишей умертвляли через 16 годин, і за допомогою проточної цитометрії (FACS) визначали лізис (%) клітин-мішеней в паховому лімфатичному вузлі ближче до місця імунізації. На фіг. 1 демонструється цитотоксичність, породжена in vivo внаслідок імунізації мишей ліпосомами, в які інкапсульовані разом OVA і St. Тварини, піддані імунізації ліпосомами, в які інкапсульовані St (StI або StII), продемонстрували відповідь, опосередковану цитотоксичними Тлімфоцитами CD8+ (CTL), специфічну відносно OVA, який статистично перевищує такий в групі позитивного контролю. Крім того, ліпосоми, які містили тільки OVA, також індукували CTLопосередковану відповідь, статистично схожу з такою у випадку класичного позитивного контролю для цього дослідження (PIC). Приклад 2: Індукція протипухлинного захисту за допомогою вакцинного носія у випадку модельного білка OVA. Досліджували здатність вакцин на основі ліпосом до індукції протипухлинного захисту. З цією метою шістдесят самиць мишей C57BL/6 з вагою тіла в діапазоні 18-20 г були відібрані, і розділені на 3 досліджувані групи по 20 тваринах в кожній. Групі 1 (негативному контролю) вводили внутрішньом'язово в дні 0 і 12 0,2 мл забуференого фосфатом сольового розчину (PBS). Групі 2 вводили внутрішньом'язово в дні 0 і 12 0,2 мл вакцинної композиції А, описаної в прикладі 1, (що еквівалентно 1,1 нмолям або 50 мкг OVA). Групі 3 вводили внутрішньом'язово в дні 0 і 12 0,2 мл вакцинної композиції В, описаної в прикладі 1, (що еквівалентно 1,1 нмолям або 50 мкг OVA і 0,3 нмолям або 6,25 мкг StII). Всі групи 1-3 піддавали перевірці на наявність імунітету за допомогою підшкірного введення 5 в день 19 3×10 клітин лінії пухлинних клітин E.G7 (0,2 мл). 5 UA 111944 C2 5 10 15 20 25 30 35 40 45 50 55 60 Тварин індивідуалізували з дня 0, і тричі на тиждень визначали наступні параметри: об'єм пухлини, період часу до прогресування і виживання. Нижче описані отримані результати: Період часу до прогресування Період часу до прогресування є параметром, який характеризує час, який пройшов у випадку кожної тварини від моменту введення пухлинних клітин до виникнення пухлини. Що стосується мишей, у яких не було розвитку пухлини до кінця експерименту, вважали, що період часу до прогресування становить 60 днів. Ефект на подовження періоду часу до прогресування є у високому ступені бажаним параметром у випадку вакцини проти раку. Як можна бачити на фіг. 2А, тваринні групи 3, вакциновані з використанням вакцинної композиції В, описаної в прикладі 1 і яка є об'єктом даного винаходу, продемонстрували найбільш чудові результати Виживання За допомогою цього параметра оцінюється здатність вакцинації до збільшення періоду часу, протягом якого піддані імунізації тварини залишаються живими після введення для перевірки наявності імунітету експресуючих OVA пухлинних клітин (E.G7). Цей параметр вимірюють в днях, і він має відносний характер, оскільки його порівнюють з виживанням не підданих впливу тварин. З метою доказу статистичної значущості відмінностей, встановлених в результатах по виживанню серед груп, використовували логарифмічний ранговий критерій. Фіг. 2В ясно показує, що тваринні групи 3, вакциновані з використанням вакцинної композиції В, описаної в прикладі 1 і яка є об'єктом даного винаходу, є тваринами, які живуть довше після введення пухлинних клітин. Приклад 3: Гемолітична активність мутантів St Утворення пор в мембранах еритроцитів породжує колоїдно-осмотичний шок, який викликає лізис клітин. Про здатність до поротворення так званих поринів може свідчити їх гемолітична активність (НА), яку можна експериментально визначити за допомогою вимірювання зменшення уявної оптичної густини (λ = 600 нм) суспензії еритроцитів внаслідок лізису клітин. У цьому дослідженні НА необоротно неактивного димера StIW111C (StIW111Cirrev) порівнювали з НА оборотного димера StIW111C в відновлювальних (0,1 моль/л 2-МЕ) і невідновлювальних умовах при відносно високій концентрації білка в дослідженні (0,15 мкмоль/л), якщо порівнювати з аналізом НА StI/StII, описаним Alvarez і інш. в Toxicon, 2009, 54(8): 1135-1147. Залежності гемолізу від часу, подані на фіг. 3, свідчать про те, що StIW111Cirrev був неактивним в невідновлювальних умовах. У відновлювальних умовах StIW111Cirrev продемонстрував меншу активність, ніж StIW111C, або повністю відновлений, або не відновлений. Приклад 4: Оцінка здатності до поротворення інактивованого StII. Втрата здатності до утворення пор в мембранах за допомогою StII, необоротно інактивованого нагріванням при 80 °C протягом двох годин, була встановлена, використовуючи дослідження гемолітичної активності. Фіг. 4 показує відсутність гемолітичної активності у інактивованого за допомогою термообробки StII в порівнянні з активним білком. Приклад 5. Ефект вакцинного носія на дозрівання DC Дозрівання DC, яке індукується StII, оцінювали в клітинах, отриманих з кісткового мозку мишей C57BL/6, підданих впливу активного StII (0,1 нмоль або 2 мкг) або інактивованого за допомогою термообробки StII (4 мкг) в присутності 20 мкг поліміксину В (pmxB, агента, нейтралізуючого біологічну активність ендотоксинів в результаті зв'язування з А-фракцією ліпідів LPS) протягом 24 годин при 37 °C в термостаті з CO2. Як позитивний контроль використовували LPS (2 мкг), а негативним контролем було середовище RPMI плюс 30 pmxB. Клітини, витягнуті з кісткового мозку мишей, культивували в кількості, яка дорівнює 60000 попередників DC в RPMI в кожній ямці, використовуючи 6-ямкові планшети. Додавали телячу фетальну сироватку (BFS) до 10 %, 400 мкл GMCSF і RPMI до повного об'єму, який дорівнював 3 мл в кожній ямці. Фіг. 5 показує збільшення (%) молекулярних маркерів (CD80, CD86 і CD40), що свідчить про активацію DC в результаті піддавання цих клітин in vitro впливу і активного, і інактивованого нагріванням варіантів StII, результати, порівняні з тими, які були отримані з використанням позитивного контролю. Приклад 6: Оцінка цитотоксичності і CTL-опосередкованої відповіді при використанні вакцинного носія, використовуючи мутанти St і OVA як білковий антиген. У ліпосоми з DPPC і Cho (в молярному співвідношенні 1:1), в 10 мкмоль ліпідів загалом, були інкапсульовані димерні варіанти StI з оборотно (StIW111C) або необоротно (StIW111Cirrev) низькою пороутворювальною активністю і інактивований за допомогою термообробки варіант StII разом з OVA в молярному співвідношенні: 1,1 нмоль OVA: 0,3 нмоль StIW111C, 6 UA 111944 C2 5 10 15 20 25 30 35 40 45 50 55 60 StIW111Cirrev або інактивованого нагріванням StII, в PBS, pH 7,4, і була оцінена здатність цих вакцинних препаратів до індукції OVA-специфічної цитотоксичної активності in vivo. У цих дослідженнях використовувалися по суті ті ж вакцинні композиції, як і в прикладі 1, у випадку композиції В використовувалися різні варіанти St. Вакцинна композиція А: ліпосоми DRV з DPPC і Cho (60 мкмоль ліпідів загалом), в які інкапсульовано 6,6 нмоль OVA. Вакцинна композиція В: ліпосоми DRV з DPPC і Cho (60 мкмоль ліпідів загалом), в які інкапсульовано 6,6 нмоль OVA разом з 1,875 нмоль St (StIW111C, StIW111Cirrev, природного StII або інактивованого нагріванням StII). У першому дослідженні дванадцять самиць мишей C57BL/6 з вагою тіла в діапазоні 18-20 г були відібрані, і розділені на 4 експериментальні групи по три тварини в кожній. Групі 1 (негативному контролю) вводили підшкірно в дні 0 і 12 0,2 мл PBS. Групі 2 (позитивному контролю) вводили підшкірно в дні 0 і 12 0,2 мл вакцинної композиції В (що еквівалентно 1,1 нмолям або 50 мкг OVA і 0,3 нмолям або 6,25 мкг природного StII). Групі 3 вводили підшкірно в дні 0 і 12 0,2 мл вакцинної композиції В (що еквівалентно 1,1 нмолям або 50 мкг OVA і 0,3 нмолям або 6,25 мкг StIW111C). Групі 4 вводили підшкірно в дні 0 і 12 0,2 мл вакцинної композиції В (що еквівалентно 1,1 нмолям або 50 мкг OVA і 0,3 нмолям або 6,25 мкг StIW111Cirrev). Фіг. 6А показує, що тварини, піддані імунізації з використанням ліпосом, які містять варіанти St з низькою пороутворювальною активністю, (LP/OVA+StIW111С або LP/OVA+StIW111Cirrev) демонструють цитотоксичну реакцію, статистично схожу з такою, отриманою при використанні StII після інкапсуляції в ліпосоми разом з OVA (LP/OVA+StII). У іншому дослідженні дев'ять самиць мишей C57BL/6 з вагою тіла в діапазоні 18-20 г були відібрані, і розділені на 3 групи по 3 тварини в кожній. Групі 1 (негативному контролю) вводили підшкірно в дні 0 і 12 0,2 мл забуференого фосфатом сольового розчину (PBS). Групі 2 вводили підшкірно в дні 0 і 12 0,2 мл вакцинної композиції А (що еквівалентно 1,1 нмолям або 50 мкг OVA). Групі 3 вводили підшкірно в дні 0 і 12 0,2 мл вакцинної композиції В (що еквівалентно 1,1 нмолям або 50 мкг OVA і 0,3 нмолям або 6,25 мкг неактивного StII). Фіг. 6В свідчить про те, що імунізація з використанням ліпосом, в які інкапсульований OVA разом з повністю інактивованим нагріванням StII, індукує OVA-специфічну цитотоксичну активність, яка значно перевищує ту, яку індукують ліпосоми, які містять лише антиген, і схожу з тією, яка спостерігається при використанні ліпосомного препарату, який містить природний StI/StII. Експериментальні результати слугують доказом того, що вакцина, яка є об'єктом цього винаходу на основі ліпосом, в які інкапсульований антиген разом з будь-яким варіантом стихолізину, навіть з тими, які не виявляють пороутворювальну активність, індукувала ефективну, сильну і функціональну антигенспецифічну CTL-опосередковану відповідь, яка перевищує навіть ту, яка індукувала класичний позитивний контроль (PIC), який використовується в in vivo аналізі CTL. Препарат ліпосома-St в превентивному випадку значно збільшував період часу імплантації пухлинних клітин і значно збільшував виживання в групах, які оцінюються стосовно тих, які отримували тільки PBS. На закінчення, вакцинація з використанням ліпосом-St продемонструвала кращі результати, ніж ті, які відмічалися при використанні ліпосомних везикул, які містять тільки антиген. КОРОТКИЙ ОПИС КРЕСЛЕНЬ Фіг. 1 являє собою діаграми, на яких представлений відсоток лізису клітин-мішеней, навантажених імунодомінантним пептидом (SIINFEKL) OVA і мічених CFSE, у експериментальних тварин, підданих введенню різних вакцин, в in vivo дослідженні цитотоксичності. Кожна точка відповідає даним, отриманим від однієї тварини, а лінія середньому значенню, принаймні, двох незалежних експериментів. Різні букви означають статистично вагомі відмінності серед підданих імунізації груп стосовно критерію Т3 Даннета (р
ДивитисяДодаткова інформація
Назва патенту англійськоюVaccine compositions based on sticholysin encapsulated in liposomes
Автори англійськоюFernandez Molina, Luis Enrique, Lanio Ruiz, Maria Eliana, Laborde Quintana, Rady Judith, Cruz Leal, Yoelys, Luzardo Lorenzo, Maria del Carmen, Mesa Pardillo, Circe, Alvarez Valcarcel, Carlos Manuel, Pazos Santos, Isabel Fabiola, Tejuca Martinez, Mayra, Valle Garay, Aisel, Alonso Biosca, Maria Eugenia, Canet Santos, Liem
Автори російськоюФернандес Молина Луис Энрике, Ланио Руис Мария Элиана, Лаборде Кинтана Ради Худит, Крус Леал Йоелис, Лусардо Лоренсо Мария дэль Кармен, Меса Пардильо Сирсе, Альварес Валькарсель Карлос Мануель, Пасос Сантос Исабель Фабиола, Техука Мартинес Майра, Валле Гарай Айсель, Алонсо Биоска Мария Еухения, Канет Сантос Льем
МПК / Мітки
МПК: A61K 39/39, A61K 31/685, A61P 35/00, A61K 9/127
Мітки: вакцинна, ліпосоми, інкапсульованого, стихолізину, композиція, основі
Код посилання
<a href="https://ua.patents.su/16-111944-vakcinna-kompoziciya-na-osnovi-stikholizinu-inkapsulovanogo-v-liposomi.html" target="_blank" rel="follow" title="База патентів України">Вакцинна композиція на основі стихолізину, інкапсульованого в ліпосоми</a>
Попередній патент: Спосіб і реактор для селективного видалення продукту із газоподібної системи
Наступний патент: Пристрій для підрахунку голосів під час голосування в залах за степаном філіпчуком
Випадковий патент: Спосіб переведення та зберігання риби в стані штучного гіпобіозу і установка для його здійснення