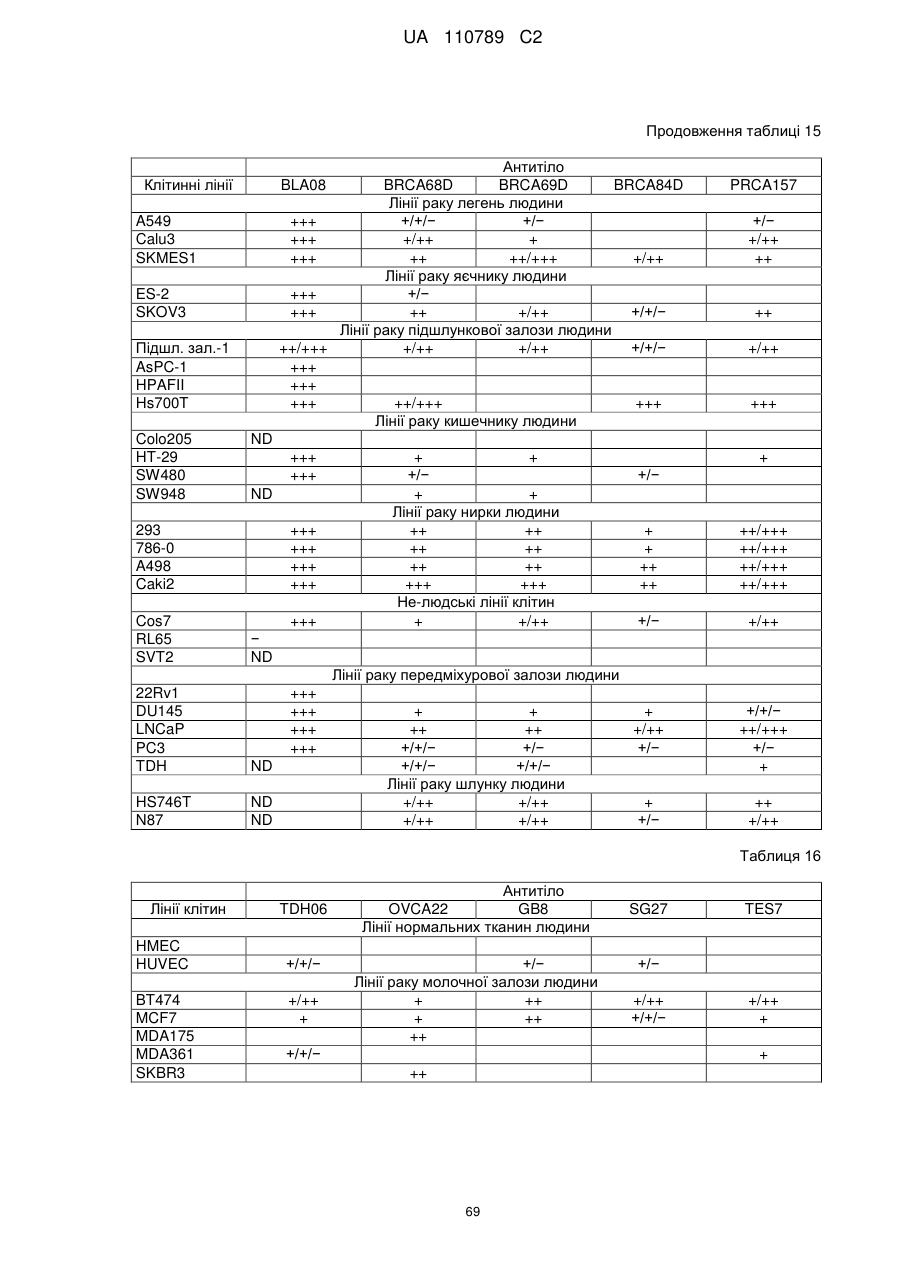
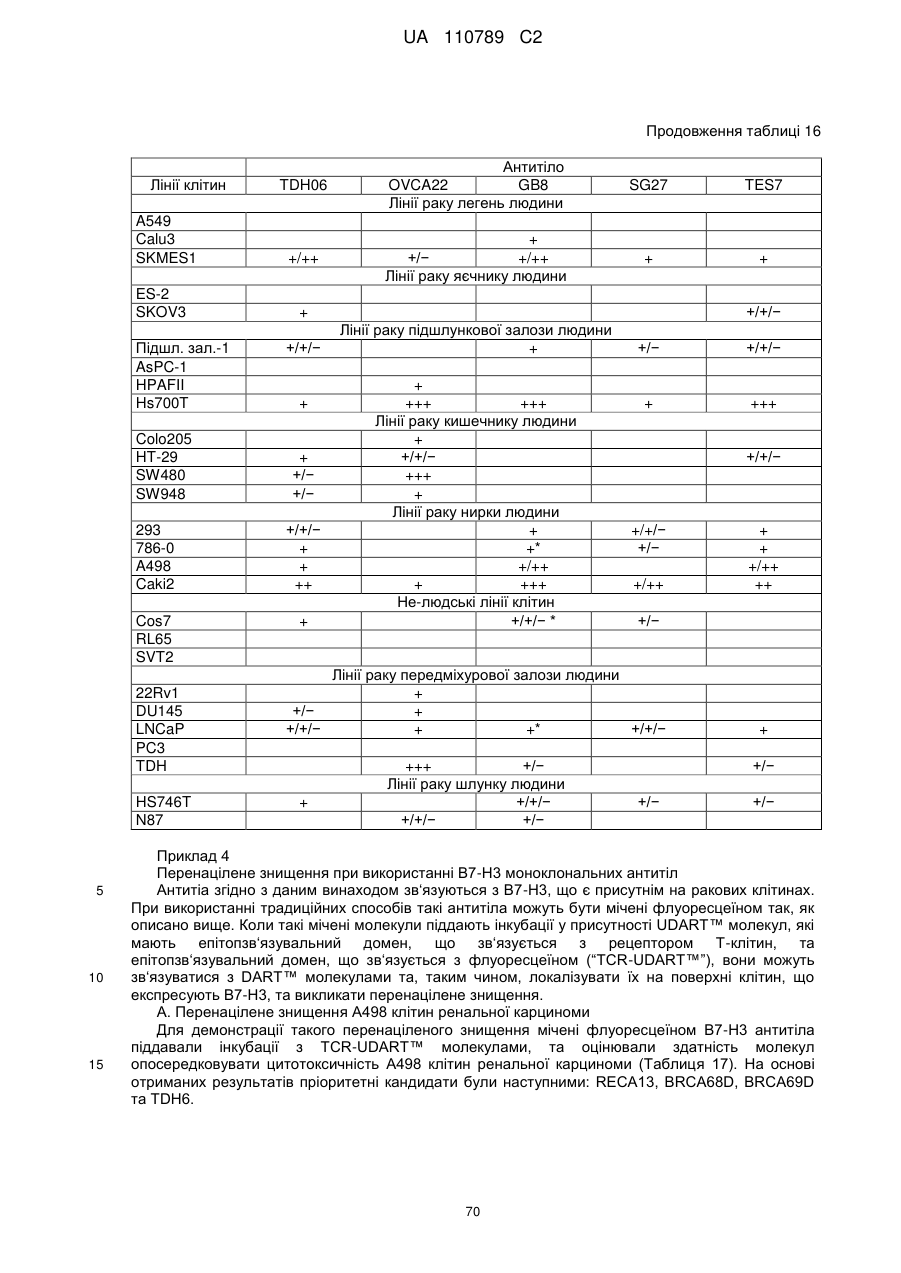
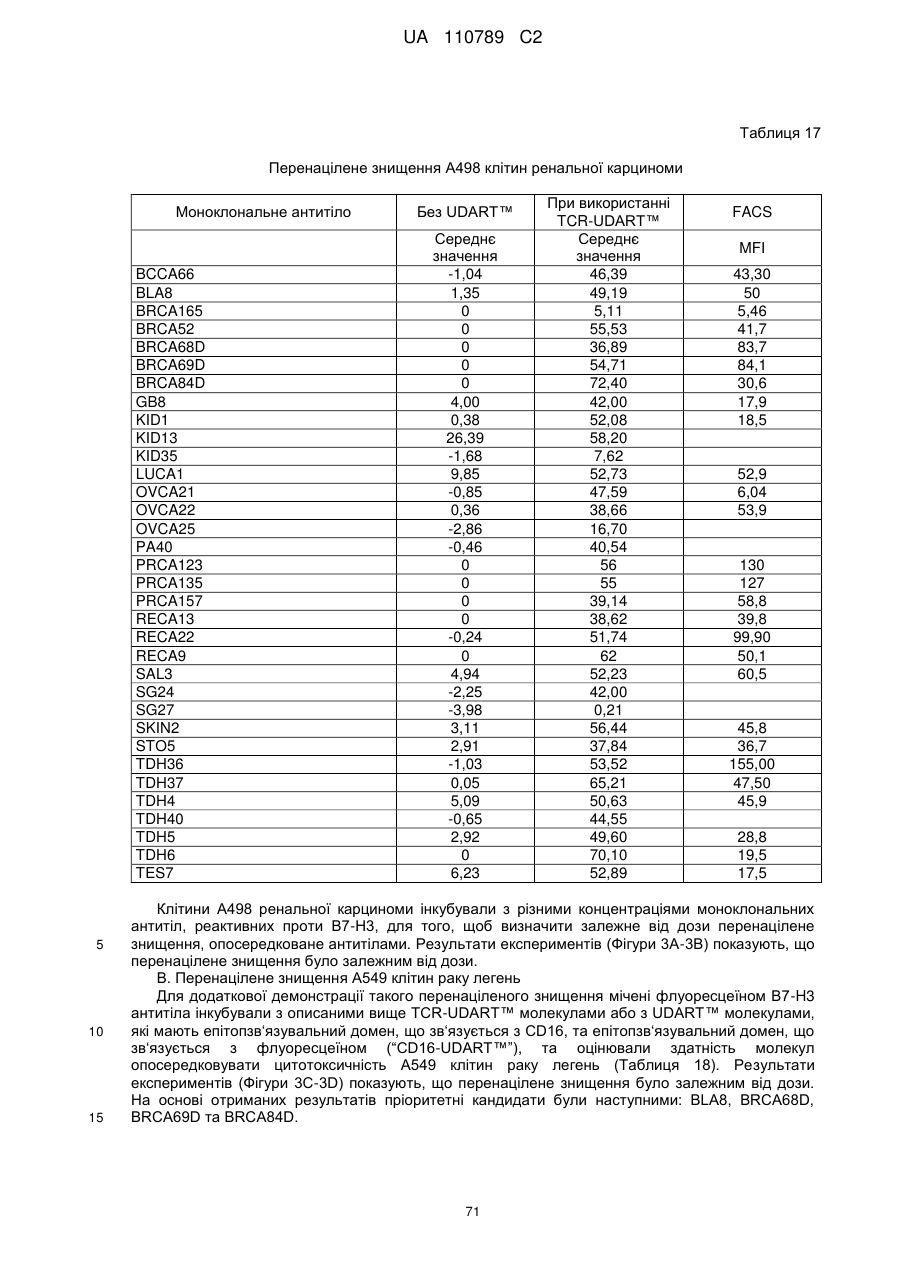
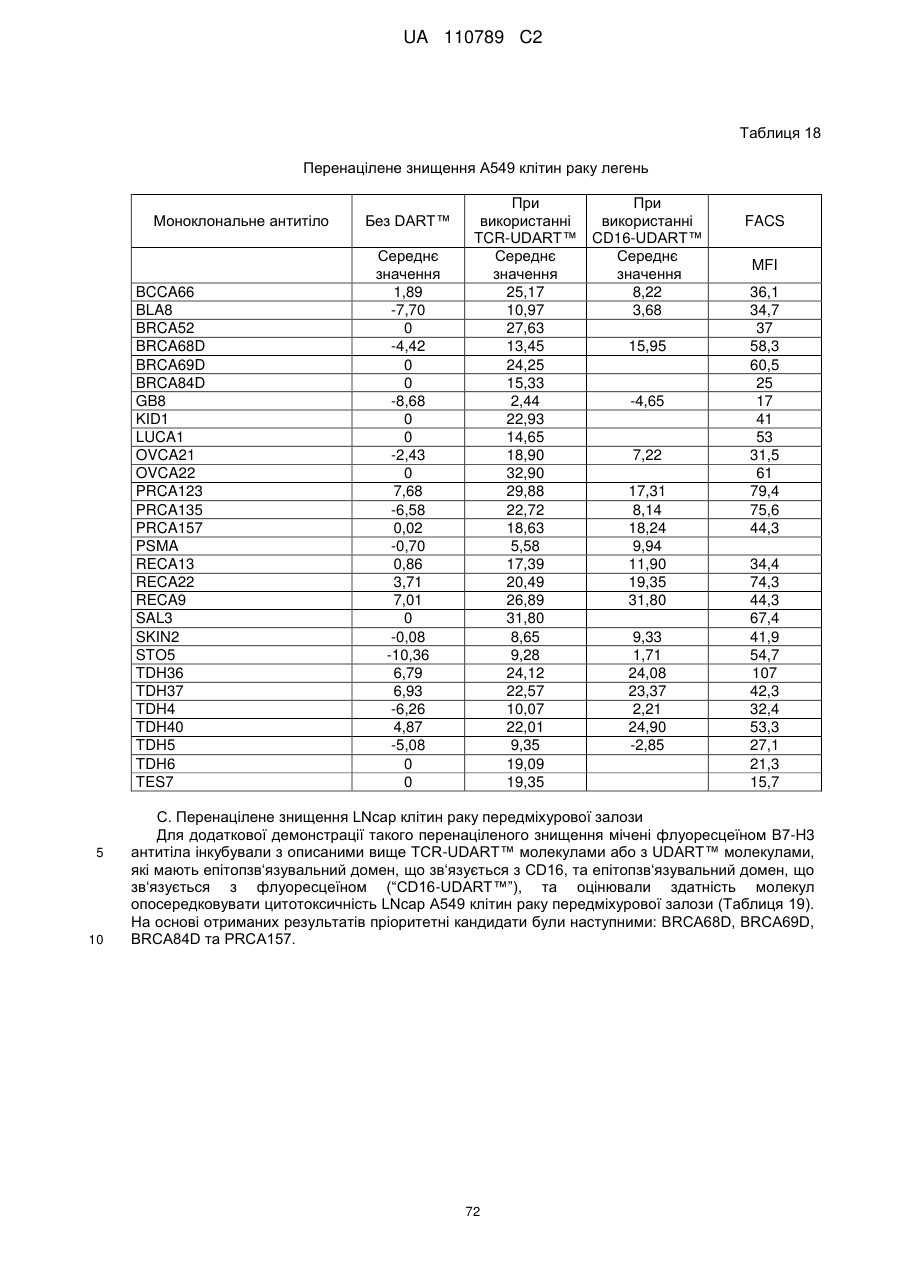
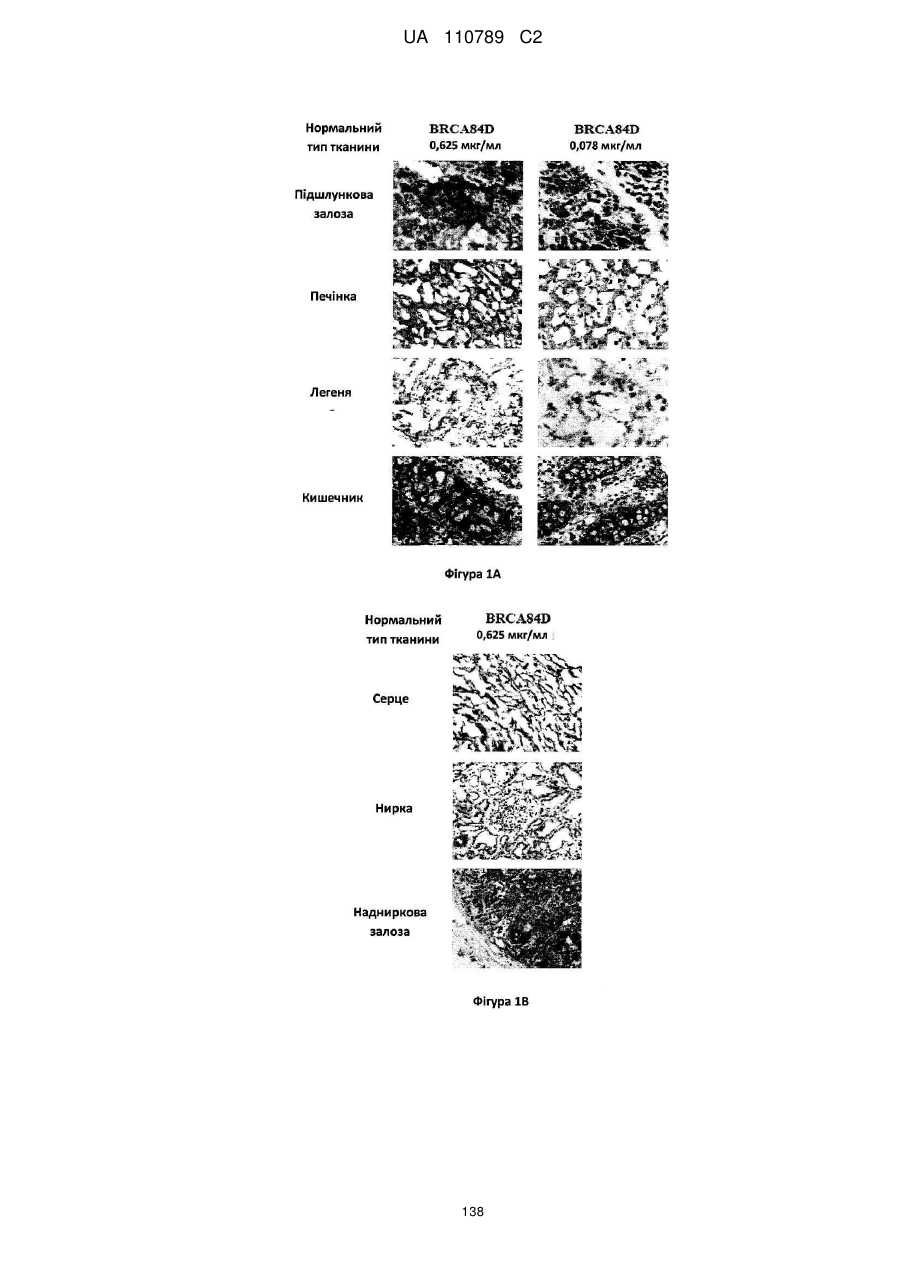
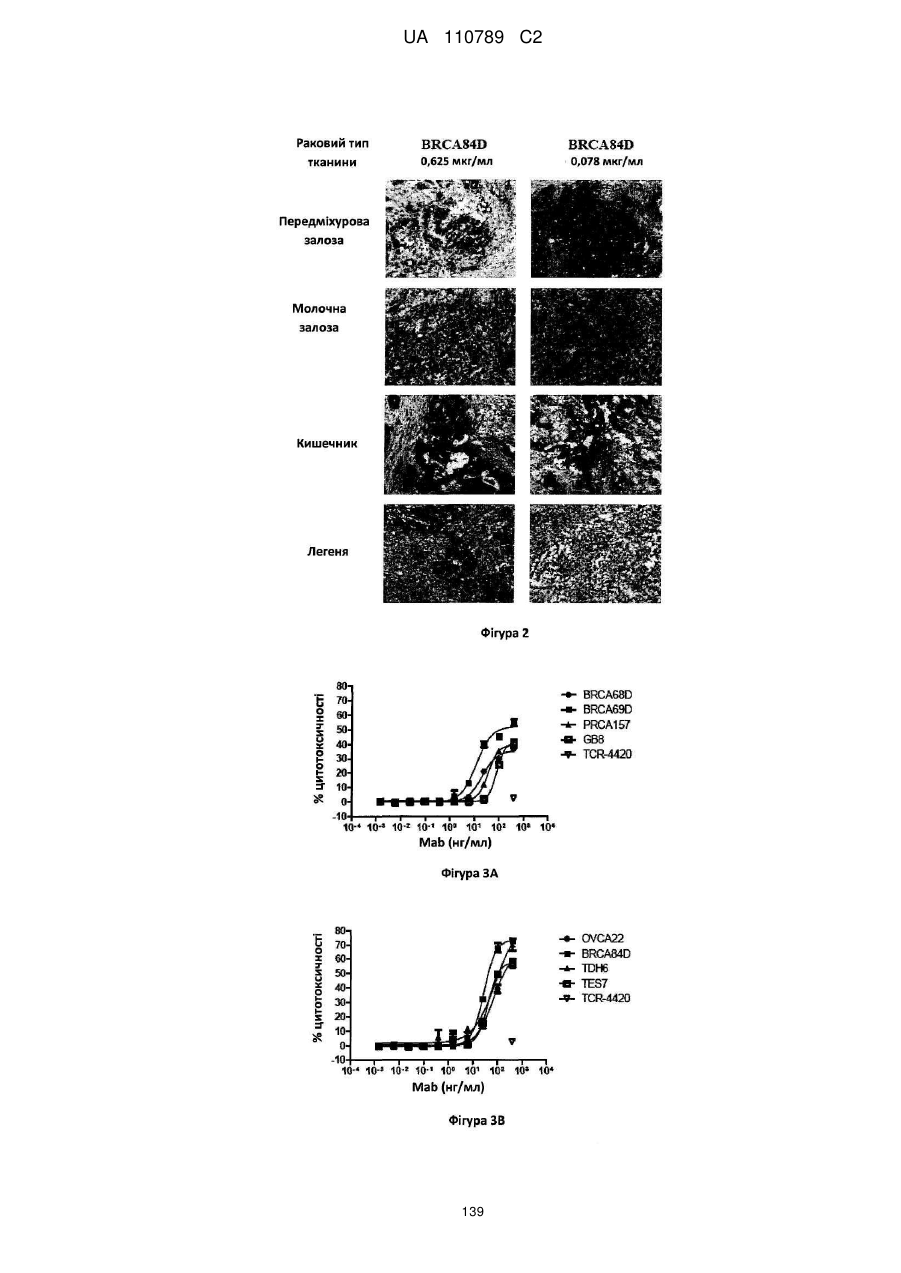
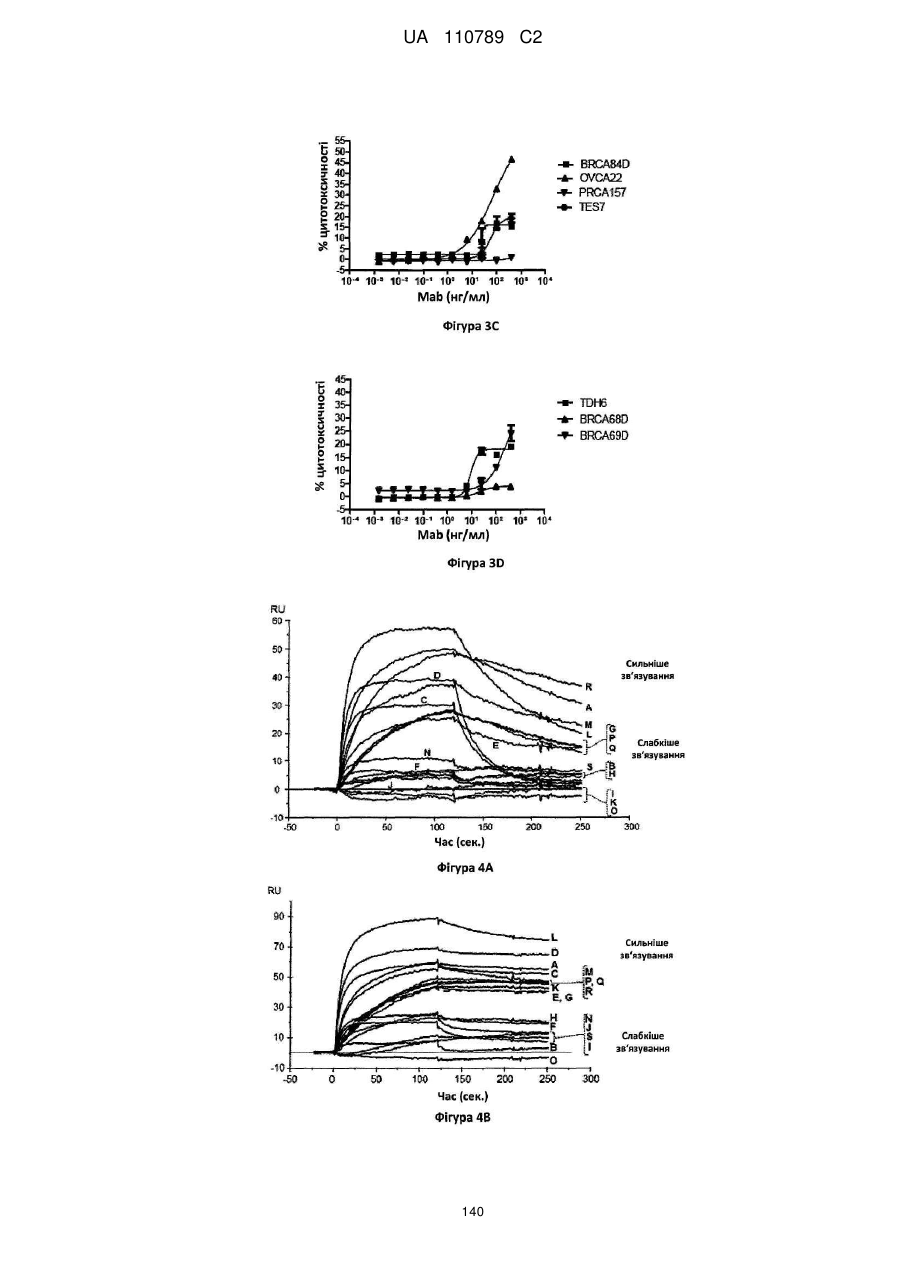
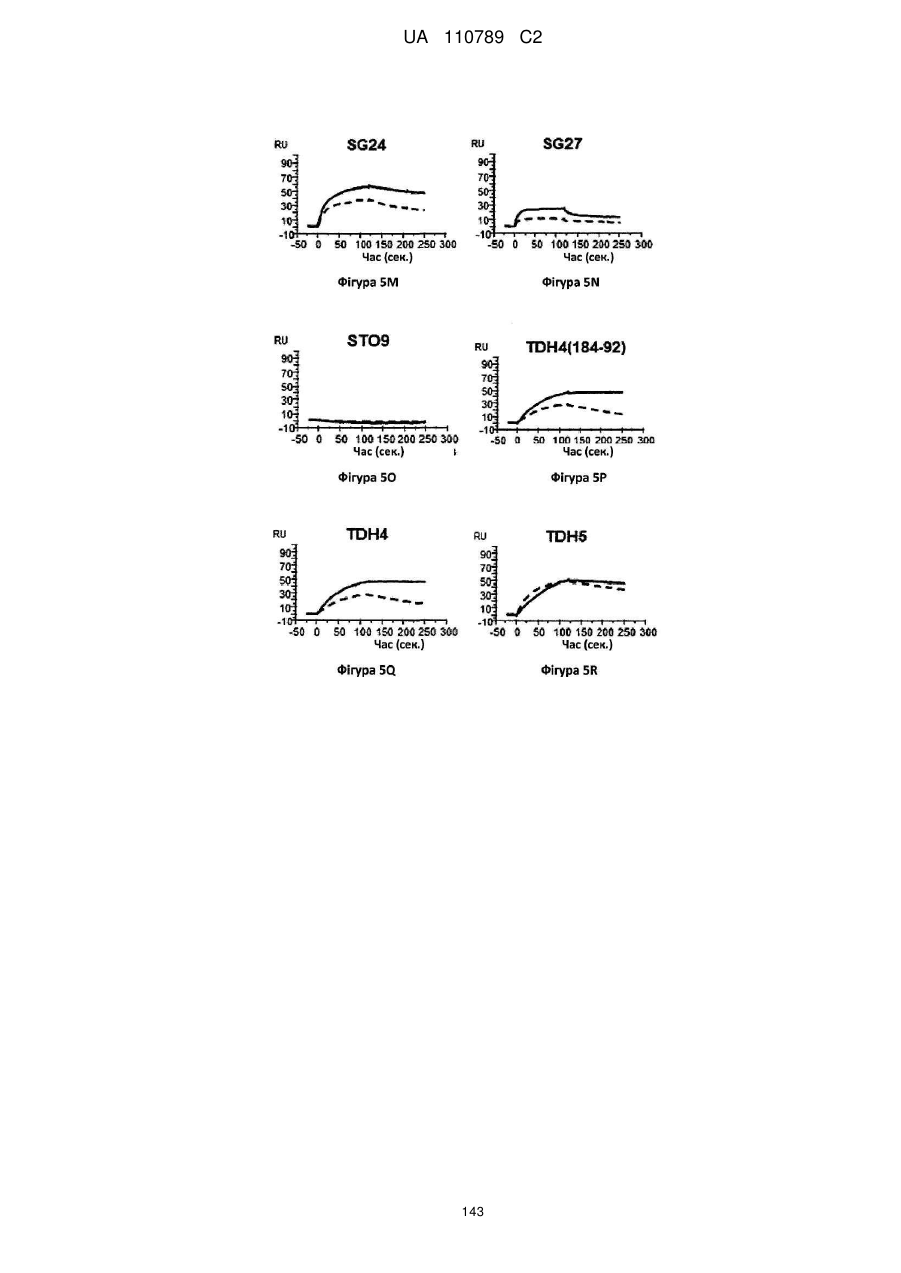
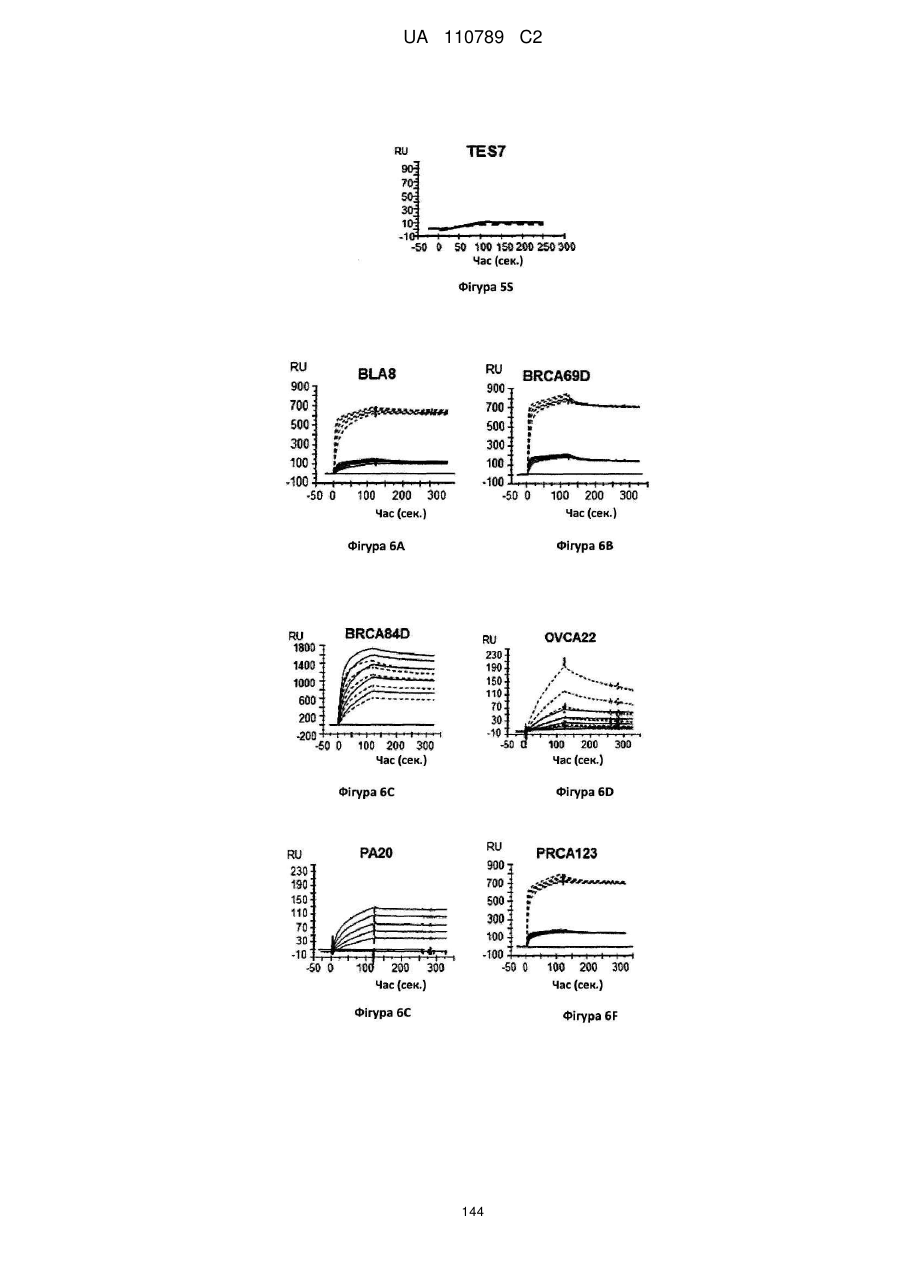
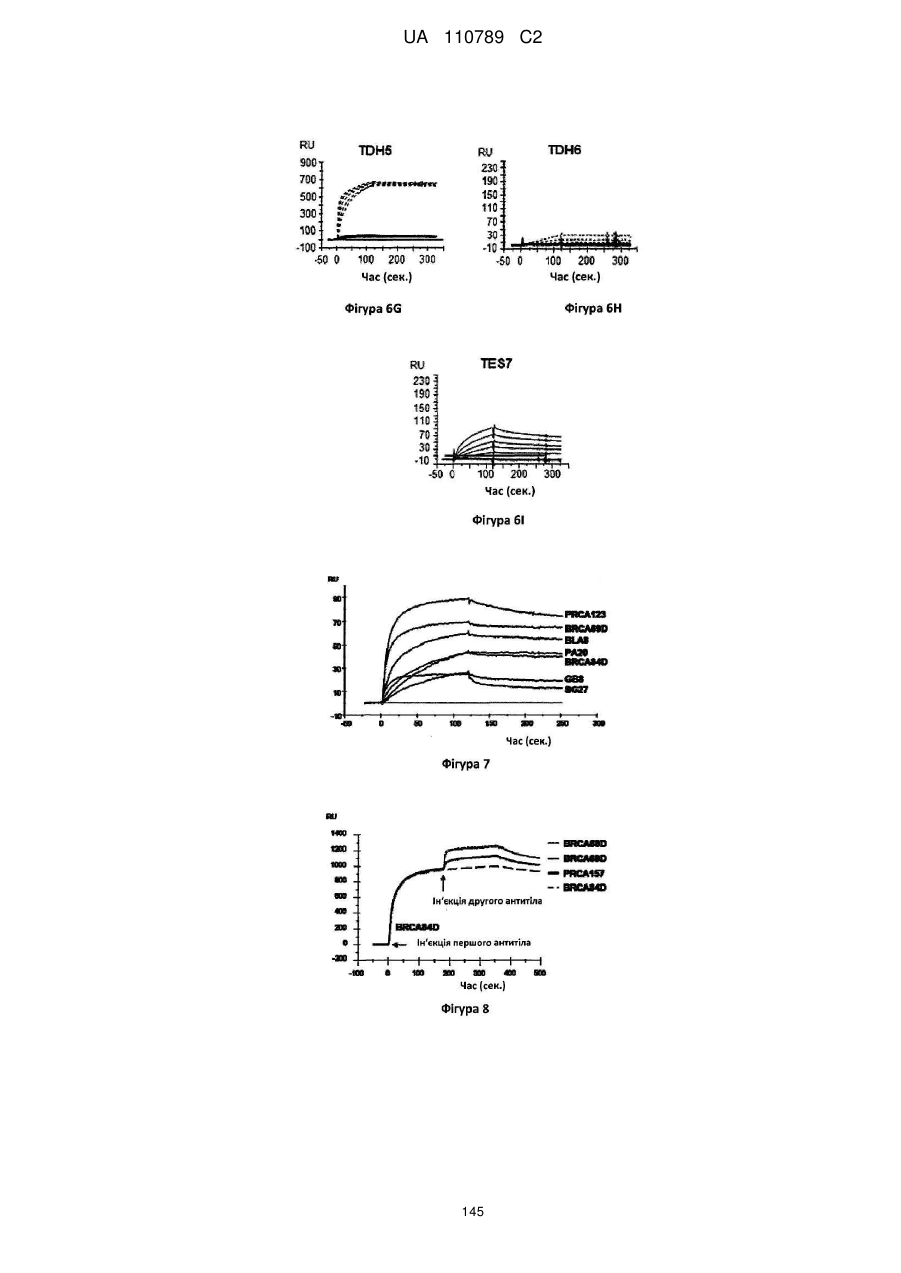
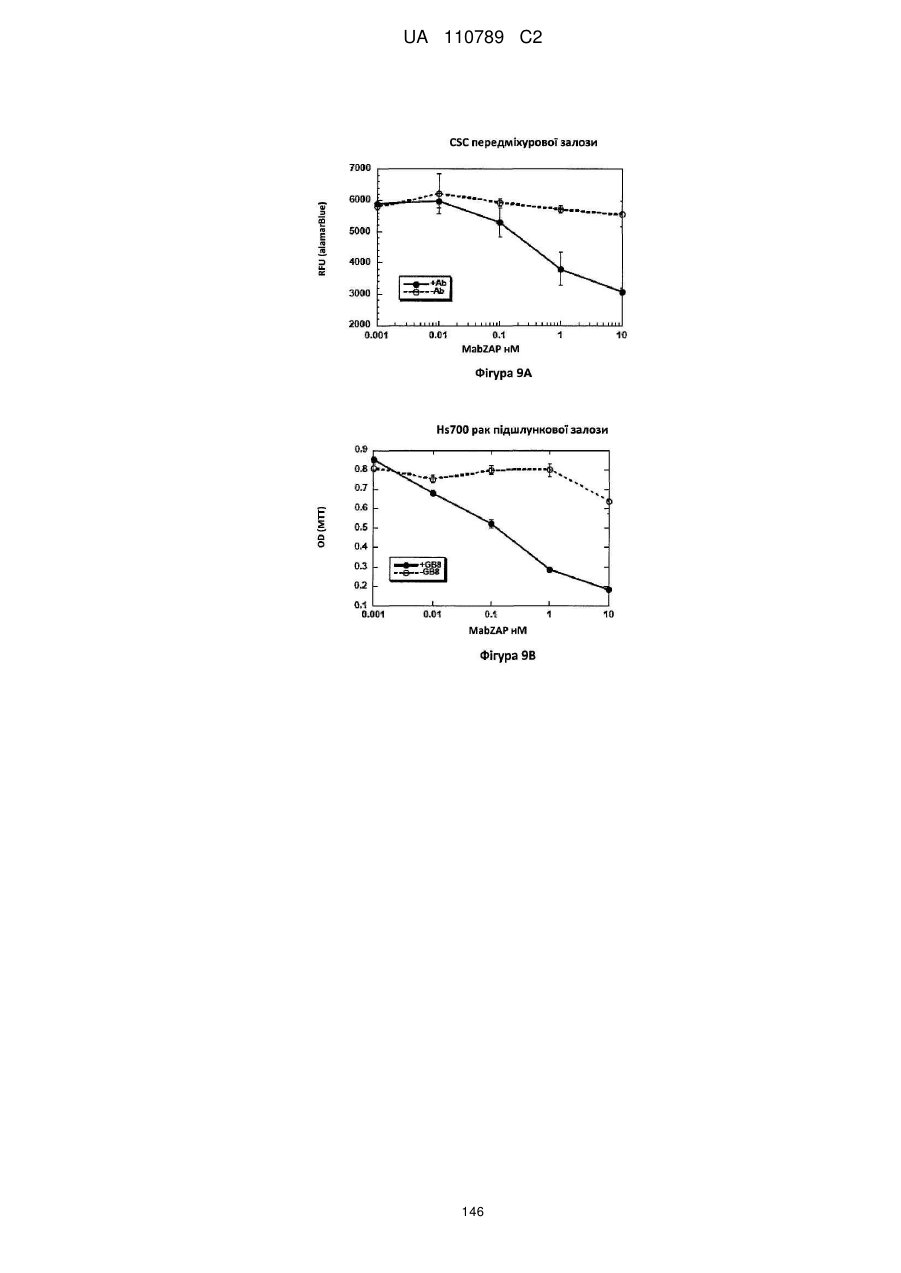
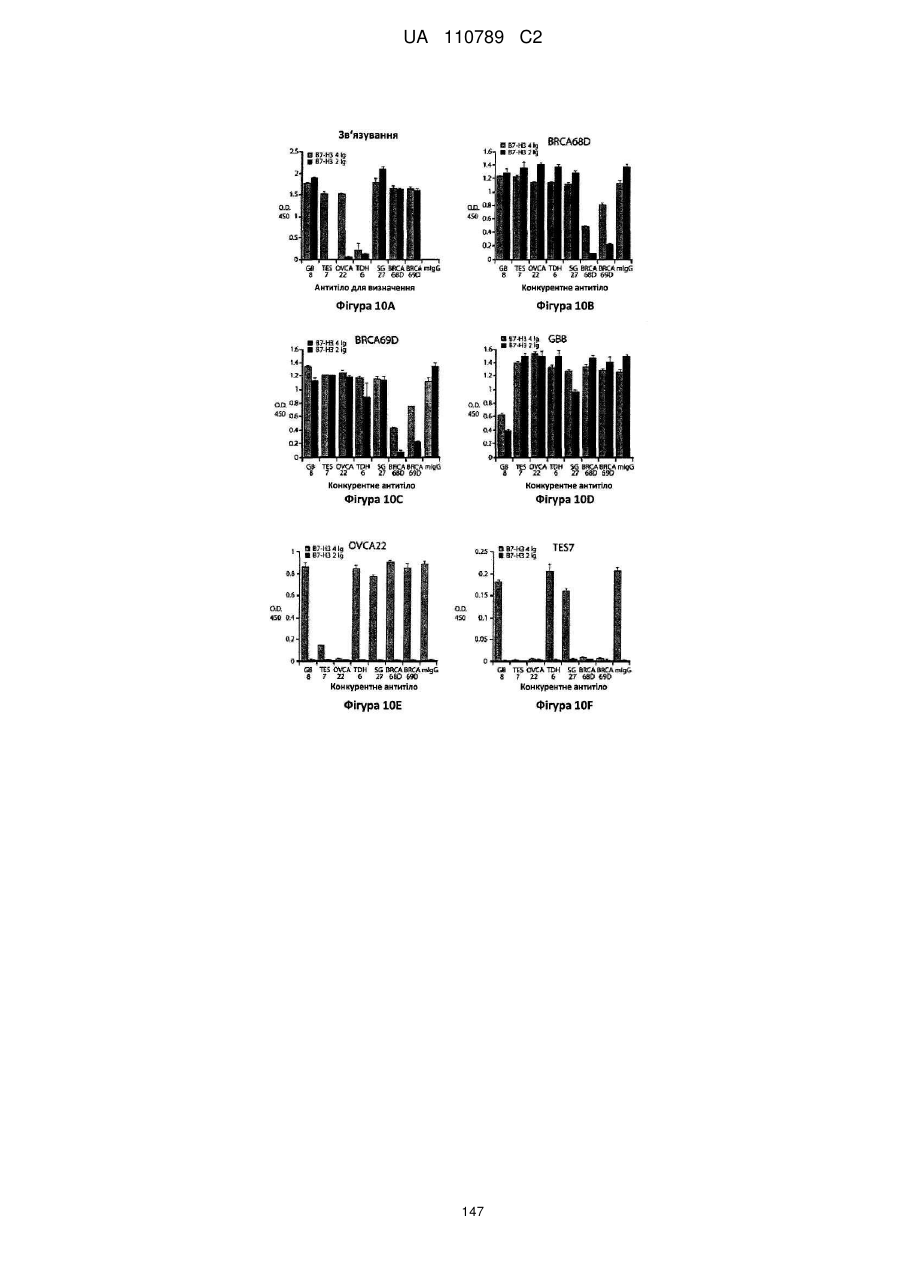
Антитіло, реактивне відносно b7-h3, його імунологічно активні фрагменти та їх застосування
Номер патенту: 110789
Опубліковано: 25.02.2016
Автори: Джонсон Леслі С., Лу Дерік Т., Хуан Лін, Мур Пол А., Чень Франсін Чжіфень
Формула / Реферат
1. B7-H3 зв'язувальна молекула, де вказана молекула являє собою антитіло, його імунореактивний фрагмент або діатіло, яка включає варіабельний домен, що специфічно зв'язується із позаклітинним доменом B7-H3, де вказана B7-H3 зв'язувальна молекула включає:
(1) варіабельний домен легкого ланцюга, що включає CDR1, що має амінокислотну послідовність SEQ ID NO: 21, CDR2, що має амінокислотну послідовність SEQ ID NO: 23 та CDR3, що має амінокислотну послідовність SEQ ID NO: 25, та варіабельний домен важкого ланцюга, що включає CDR1, що має амінокислотну послідовність SEQ ID NO: 29, CDR2, що має амінокислотну послідовність SEQ ID NO: 31, та CDR3, що має амінокислотну послідовність SEQ ID NO: 33;
(2) варіабельний домен легкого ланцюга, що включає CDR1, що має амінокислотну послідовність SEQ ID NO: 5, CDR2, що має амінокислотну послідовність SEQ ID NO: 7, та CDR3, що має амінокислотну послідовність SEQ ID NO: 9, та варіабельний домен важкого ланцюга, що включає CDR1, що має амінокислотну послідовність SEQ ID NO: 13, CDR2, що має амінокислотну послідовність SEQ ID NO: 15, та CDR3, що має амінокислотну послідовність SEQ ID NO: 17; або
(3) варіабельний домен легкого ланцюга, що включає CDR1, що має амінокислотну послідовність SEQ ID NO: 37, CDR2, що має амінокислотну послідовність SEQ ID NO: 39, та CDR3, що має амінокислотну послідовність SEQ ID NO: 41, та варіабельний домен важкого ланцюга, що включає CDR1, що має амінокислотну послідовність SEQ ID NO: 45, CDR2, що має амінокислотну послідовність SEQ ID NO: 47, та CDR3, що має амінокислотну послідовність SEQ ID NO: 49.
2. B7-H3 зв'язувальна молекула за пунктом 1, де вказана B7-H3 зв'язувальна молекула зв'язується з B7-H3, що ендогенно експресується на поверхні ракової клітини.
3. B7-H3 зв'язувальна молекула за пунктом 1 або пунктом 2, де вказана B7-H3 зв'язувальна молекула зв'язується з B7-H3, що інтерналізується при зв'язуванні з B7-H3, який експресується на поверхні ракової клітини.
4. B7-H3 зв'язувальна молекула за будь-яким з пунктів 1-3, яка являє собою гуманізоване моноклональне антитіло.
5. B7-H3 зв'язувальна молекула за будь-яким з пунктів 1-4, де вказана B7-H3 зв'язувальна молекула включає варіантну Fc ділянку людського IgG1, де вказана варіантна Fc ділянка людського IgG1 включає принаймні одну амінокислотну модифікацію відносно Fc ділянки дикого типу, при цьому вказана(і) амінокислотна(і) модифікація(ї) включає(ють) амінокислотну(і) модифікацію(ї), яка(і) змінює(ють) афінність або авідність вказаної варіантної Fc ділянки для зв'язування з FcγR, так, що вказана B7-H3 зв'язувальна молекула демонструє поліпшену ефекторну функцію у порівнянні із вказаною Fc ділянкою дикого типу.
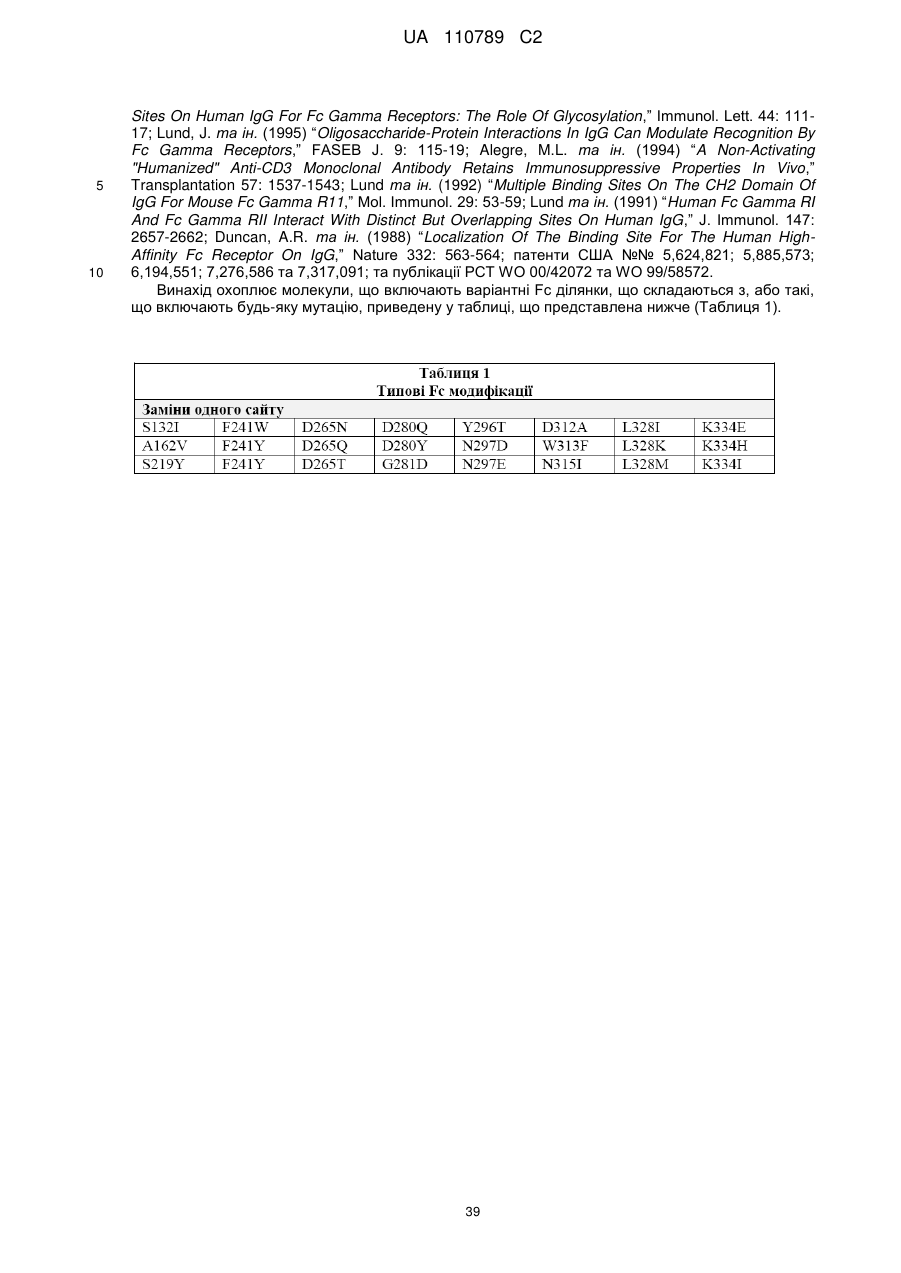
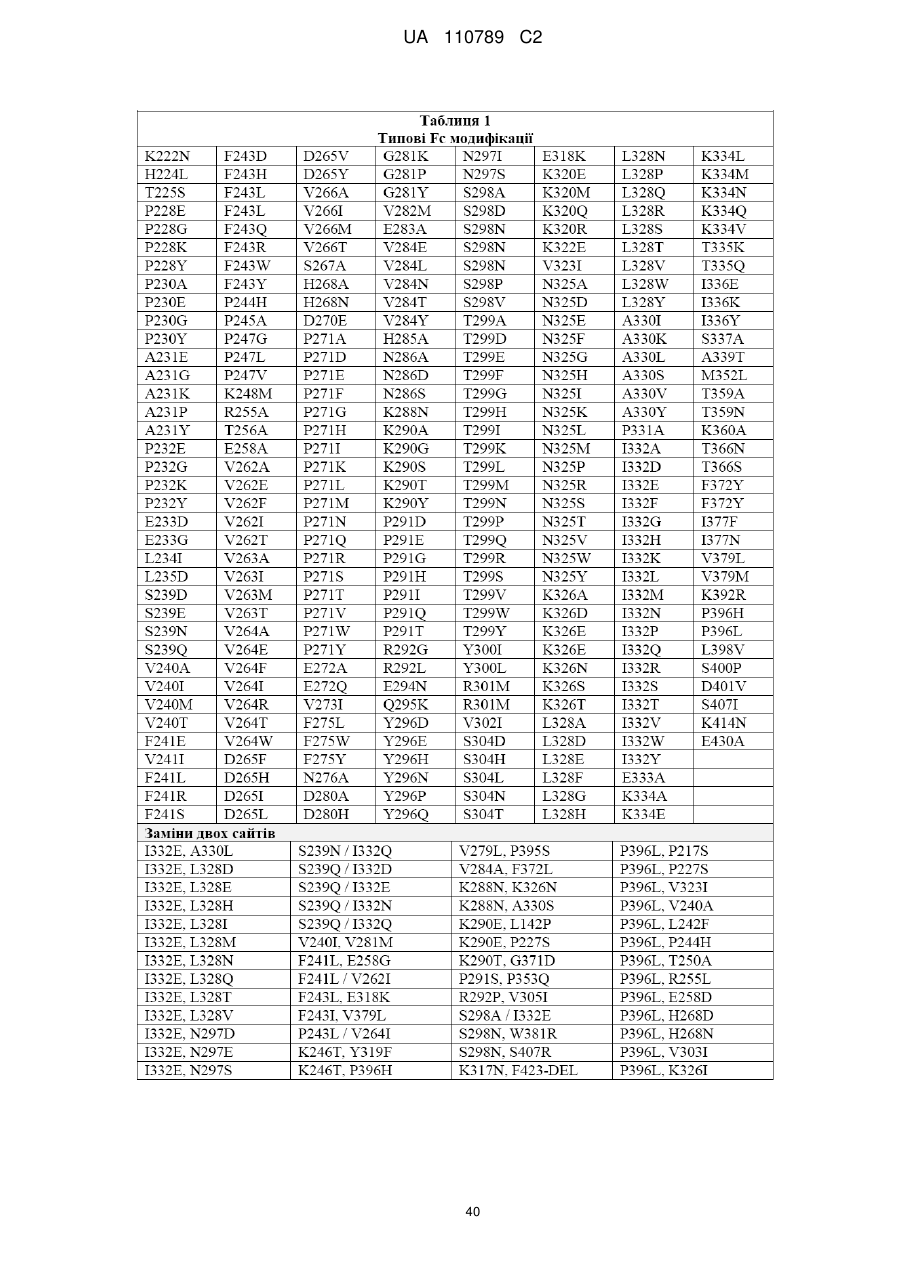
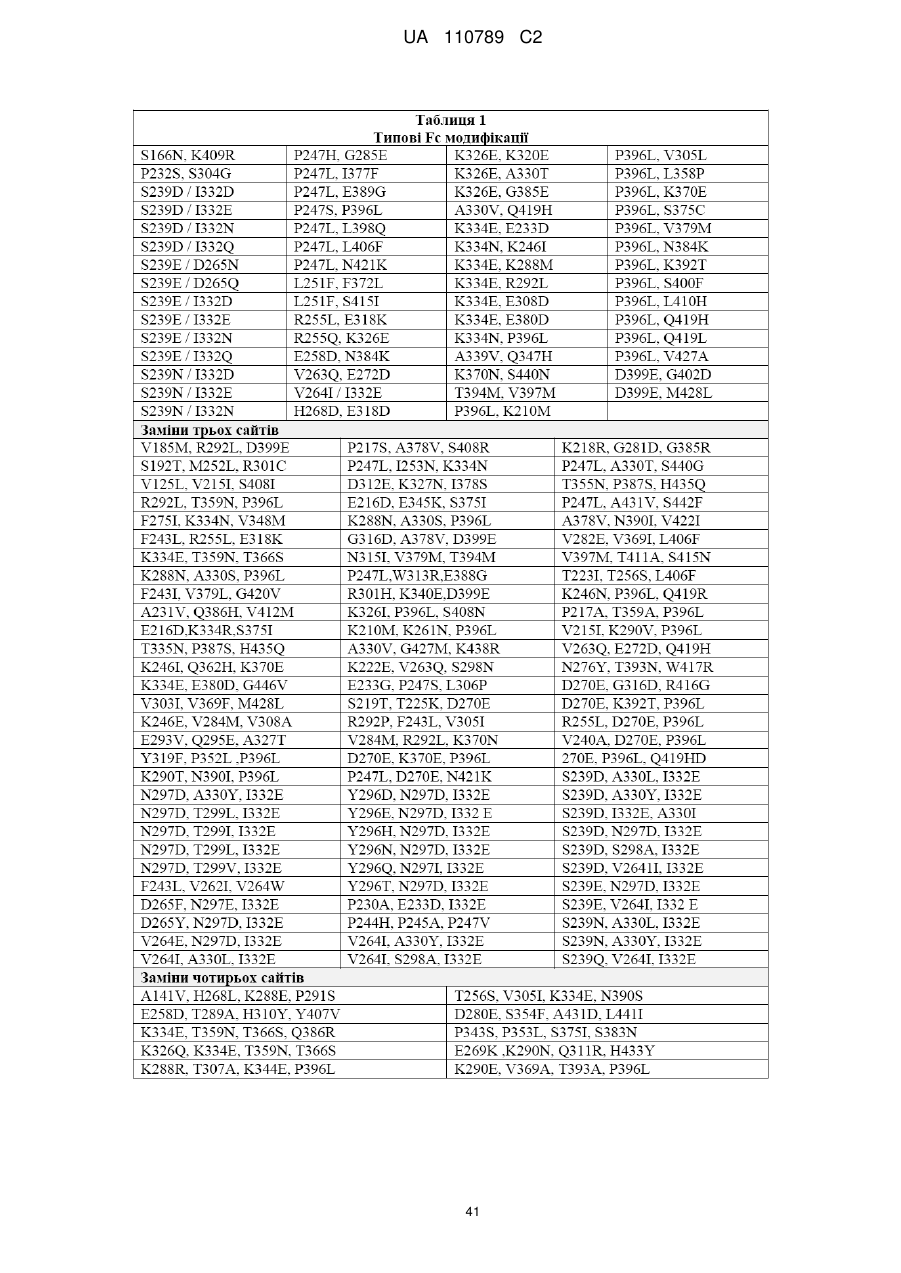
6. B7-H3 зв'язувальна молекула за пунктом 5, де вказана модифікація Fc ділянки включає:
(A) принаймні одну заміну, вибрану з групи, що складається з:
(1) F243L;
(2) D270E;
(3) R292P;
(4) S298N;
(5) Y300L;
(6) V305I;
(7) A330V; та
(8) P396L;
(B) принаймні одну заміну з двох амінокислотних залишків, при цьому вказані заміни є вибраними з групи, що складається з:
(1) F243L та P396L;
(2) F243L та R292P; та
(3) R292P та V305I;
(C) принаймні одну заміну з трьох амінокислотних залишків, при цьому вказані заміни є вибраними з групи, що складається з:
(1) F243L, R292P та Y300L;
(2) F243L, R292P та V305I;
(3) F243L, R292P та P396L; та
(4) R292P, V305I та P396L;
(D) принаймні одну заміну з чотирьох амінокислотних залишків, при цьому вказані заміни є вибраними з групи, що складається з:
(1) F243L, R292P, Y300L та P396L; та
(2) F243L, R292P, V305I та P396L;
або
(E) заміну принаймні п'яти амінокислотних залишків: F243L, R292P, Y300L, V305I та P396 L,
де вказана нумерація представлена відповідно до схеми нумерації Кабат.
7. B7-H3 зв'язувальна молекула за пунктом 5, де вказана модифікація Fc ділянки включає заміни:
(A) F243L, R292P та Y300L;
(B) L235V, F243L, R292P, Y300L та P396L; або
(C) F243L, R292P, Y300L, V305I та P396L,
де вказана нумерація представлена відповідно до схеми нумерації Кабат.
8. B7-H3 зв'язувальна молекула за пунктом 7, де вказана B7-H3 зв'язувальна молекула включає:
(А) варіабельний домен легкого ланцюга, що включає CDR1, що має амінокислотну послідовність SEQ ID NO: 5, CDR2, що має амінокислотну послідовність SEQ ID NO: 7, та CDR3, що має амінокислотну послідовність SEQ ID NO: 9, та варіабельний домен важкого ланцюга, що включає CDR1, що має амінокислотну послідовність SEQ ID NO: 13, CDR2, що має амінокислотну послідовність SEQ ID NO: 15, та CDR3, що має амінокислотну послідовність SEQ ID NO: 17; та
(B) модифікацію Fc ділянки, що включає заміни: L235V, F243L, R292P, Y300L та P396L,
де вказана нумерація представлена відповідно до схеми нумерації Кабат.
9. B7-H3 зв'язувальна молекула за пунктом 8, де вказана B7-H3 зв'язувальна молекула являє собою химерне антитіло.
10. B7-H3 зв'язувальна молекула за пунктом 8, де вказана B7-H3 зв'язувальна молекула являє собою гуманізоване антитіло.
11. B7-H3 зв'язувальна молекула за пунктом 1, де вказана молекула включає:
(A) варіабельний домен легкого ланцюга, що має амінокислотну послідовність SEQ ID NO: 89;
(B) варіабельний домен важкого ланцюга, що має амінокислотну послідовність SEQ ID NO: 99;
(C) Fc-ділянку, що має заміни: L235V, F243L, R292P, Y300L та P396L,
де вказана нумерація представлена відповідно до схеми нумерації Кабат.
12. Виділена молекула нуклеїнової кислоти, що кодує поліпетидний ланцюг B7-H3 зв'язувальної молекули за будь-яким з пунктів 1-10.
13. B7-H3 зв'язувальна молекула за пунктом 1, де вказана B7-H3 зв'язувальна молекула представляє собою діатіло, яке включає:
(A) поліпептидний ланцюг I, що включає імуноглобуліновий VL епітопзв'язувальний домен, специфічний для зв'язування B7-H3, та VH епітопзв'язувальний домен, специфічний для зв'язування молекули, відмінної від B7-H3; та
(B) поліпептидний ланцюг II, що включає імуноглобуліновий VH епітопзв'язувальний домен, специфічний для зв'язування B7-H3, та VL епітопзв'язувальний домен, специфічний для зв'язування вказаної молекули, відмінної від B7-H3;
де вказані поліпептидні ланцюги I та II є асоційованими разом так, що утворюють функціональні епітопзв'язувальні домени, здатні до зв'язування з B7-H3 та вказаною молекулою, відмінною від B7-H3.
14. B7-H3 зв'язувальна молекула за пунктом 13, де вказана молекула, відмінна від B7-H3, являє собою гаптен.
15. B7-H3 зв'язувальна молекула за пунктом 14, де вказаний гаптен являє собою флуоресцеїн ізотіоціанат.
16. B7-H3 зв'язувальна молекула за пунктом 13, де вказана молекула, відмінна від B7-H3, являє собою рецептор T-клітини або рецептор NKG2D.
17. B7-H3 зв'язувальна молекула за пунктом 13, де вказана молекула, відмінна від B7-H3, являє собою асоційований з пухлиною антиген.
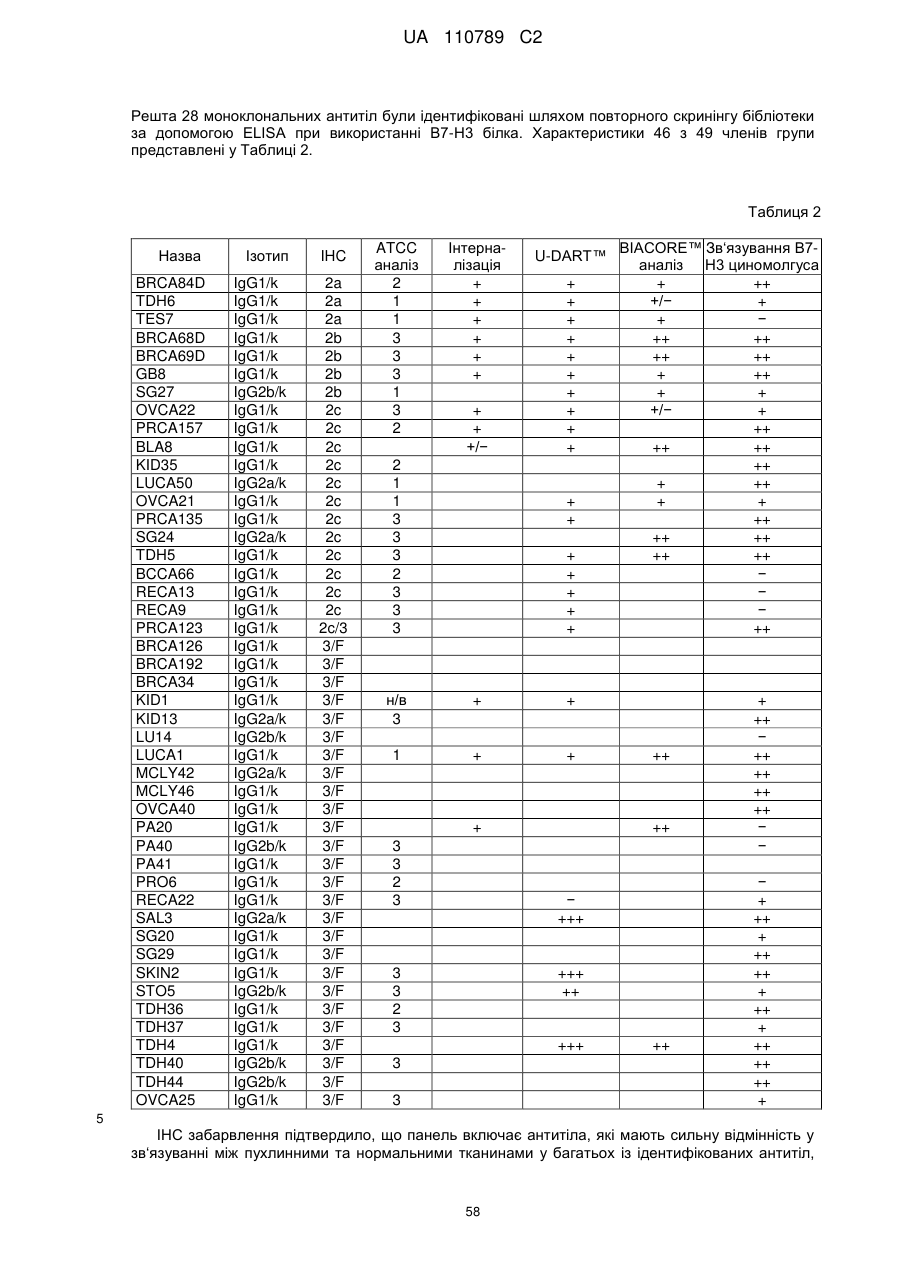
18. B7-H3 зв'язувальна молекула за пунктом 17, де вказаний асоційований з пухлиною антиген є вибраним з групи, що складається з A33; ADAM-9; ALCAM; BAGE; бета-катеніну; CA125; карбоксипептидази M; CD103; CD19; CD20; CD22; CD23; CD25; CD27; CD28; CD36; CD40/CD154; CD45; CD46; CD5; CD56; CD79a/CD79b; CDK4; CEA; CTLA4; цитокератину 8; EGF-R; EphA2; ErbB1; ErbB3; ErbB4; GAGE-1; GAGE-2; GD2/GD3/GM2; gp100; HER-2/neu; людського папіломавірусу-E6; людського папіломавірусу-E7; інтегрину-альфа-V-бета-6; JAM-3; KID3; KID31; KSA (17-1A); LUCA-2; MAGE-1; MAGE-3; MART; MUC-1; MUM-1; N-ацетилглюкозамінілтрансферази; онкостатину M; p15; PIPA; PSA; PSMA; ROR1; sTn; рецептора TNF-ß; рецептора TNF-α; TNF-γ рецептора; рецептора трансферину та VEGF рецептора.
19. Молекула нуклеїнової кислоти, що кодує поліпептидний ланцюг B7-H3 зв'язувальної молекули за будь-яким з пунктів 13-18.
20. Фармацевтична композиція, що включає (i) терапевтично ефективну кількість B7-H3 зв'язувальної молекули за будь-яким з пунктів 1-11 або 13-18 та (ii) фармацевтично прийнятний носій.
21. Фармацевтична композиція за пунктом 20, яка додатково включає один або більше додаткових протиракових агентів.
22. Фармацевтична композиція за пунктом 21, де вказаний додатковий протираковий агент являє собою хіміотерапевтичний агент, радіаційний терапевтичний агент, гормональний терапевтичний агент, токсин або імунотерапевтичний агент.
23. Фармацевтична композиція за пунктом 21, де вказаний додатковий протираковий агент являє собою токсин, вибраний з групи, що складається з: таксану, майтансоноїду, ауристатину, каліхеаміцину, антрацикліну, аналога CC-1065, доцетакселу, катепсину, рицину, гелоніну, eкзoтоксину Pseudomonas, дифтерійного токсину, РНКази та токсичного радіоізотопу.
24. Застосування B7-H3 зв'язувальної молекули за будь-яким з пунктів 1-11 або 13-18 для діагностики раку, де вказана B7-H3 зв'язувальна молекула є міченою за допомогою здатної до визначення мітки.
25. Застосування за пунктом 24, яке відрізняється тим, що вказаний рак характеризується присутністю ракової клітини, вибраної з групи, що складається з клітини пухлини надниркової залози, раку, асоційованого зі СНІДом, альвеолярної саркоми м'яких тканин, астроцитарної пухлини, раку жовчного міхура, раку кісток, раку головного та спинного мозку, метастатичного раку мозку, раку молочної залози, пухлин каротидного гломуса, раку шийки матки, хондросаркоми, хордоми, хромофобної карциноми ниркових клітин, гіпернефроїдної пухлини нирки, раку кишечника, колоректального раку, шкірної доброякісної фіброзної гістіоцитоми, десмопластичної дрібнокруглоклітинної пухлини, епіндимоми, саркоми Юїнга, позаскелетної міксоїдної хондросаркоми, фіброгенного недовершеного остоегенезу, фіброзної дисплазії кісток, раку жовчного міхура або жовчної вивідної протоки, раку шлунково-кишкового тракту, гестаційного трофобластного захворювання, пухлини зародкових клітин, раку голови та шиї, карциноми печінкових клітин, пухлини острівкових клітин, саркоми Капоші, раку нирки, лейкемії, ліпоми/доброякісної ліпоматозної пухлини, ліпосаркоми/злоякісної ліпоматозної пухлини, печінкового раку, лімфоми, раку легень, медулобластоми, меланоми, менінгіоми, множинної ендокринної неоплазії, множинної мієломи, мієлодиспластичного синдрому, нейробластоми, нейроендокринних пухлин, раку яєчника, раку підшлункової залози, папілярної карциноми щитовидної залози, пухлини паращитовидної залози, педіатричного раку, пухлини капсули периферичного нерву, феохромоцитоми, пухлини гіпофіза, раку передміхурової залози, задньої ювеальної меланоми, виключного гематологічного розладу, ниркового метастатичного раку, паличковидної пухлини, рабдоміосаркоми, саркоми, раку шкіри, саркоми м'яких тканин, раку лускатих клітин, раку шлунку, синовіальної саркоми, тестикулярної саркоми, тимусної карциноми, тимоми, метастатичного раку щитовидної залози та раку матки.
26. Застосування B7-H3 зв'язувальної молекули за будь-яким з пунктів 1-11 або 13-18 або фармацевтичної композиції за будь-яким з пунктів 20-23 для одержання лікарського засобу для лікування раку у пацієнта.
27. Застосування B7-H3 зв'язувальної молекули за пунктом 26, яке відрізняється тим, що вказаний рак характеризується присутністю ракової клітини, вибраної з групи, що складається з клітини пухлини надниркової залози, раку, асоційованого зі СНІДом, альвеолярної саркоми м'яких тканин, астроцитарної пухлини, раку жовчного міхура, раку кісток, раку головного та спинного мозку, метастатичного раку мозку, раку молочної залози, пухлин каротидного гломуса, раку шийки матки, хондросаркоми, хордоми, хромофобної карциноми ниркових клітин, гіпернефроїдної пухлини нирки, раку кишечника, колоректального раку, шкірної доброякісної фіброзної гістіоцитоми, десмопластичної дрібнокруглоклітинної пухлини, епіндимоми, саркоми Юїнга, позаскелетної міксоїдної хондросаркоми, фіброгенного недовершеного остоегенезу, фіброзної дисплазії кісток, раку жовчного міхура або жовчної вивідної протоки, раку шлунково-кишкового тракту, гестаційного трофобластного захворювання, пухлини зародкових клітин, раку голови та шиї, карциноми печінкових клітин, пухлини острівкових клітин, саркоми Капоші, раку нирки, лейкемії, ліпоми/доброякісної ліпоматозної пухлини, ліпосаркоми/злоякісної ліпоматозної пухлини, печінкового раку, лімфоми, раку легень, медулобластоми, меланоми, менінгіоми, множинної ендокринної неоплазії, множинної мієломи, мієлодиспластичного синдрому, нейробластоми, нейроендокринних пухлин, раку яєчника, раку підшлункової залози, папілярної карциноми щитовидної залози, пухлини паращитовидної залози, педіатричного раку, пухлини капсули периферичного нерву, феохромоцитоми, пухлини гіпофіза, раку передміхурової залози, задньої ювеальної меланоми, виключного гематологічного розладу, ниркового метастатичного раку, паличковидної пухлини, рабдоміосаркоми, саркоми, раку шкіри, саркоми м'яких тканин, раку лускатих клітин, раку шлунку, синовіальної саркоми, тестикулярної саркоми, тимусної карциноми, тимоми, метастатичного раку щитовидної залози та раку матки.
28. Застосування за пунктом 27, яке відрізняється тим, що застосування додатково включає введення однієї або більше додаткових протиракових терапій, вибраний з групи, що складається з хіміотерапії, імунотерапії, радіаційної терапії, гормональної терапії та хірургії.
Текст
Реферат: Винахід належить до В7-Н3 зв’язувальних антитіл та їх фрагментів або діатіл, застосування вказаних антитіл для діагностики раку, фармацевтичної композиції, що містить вказане антитіло та застосування антитіла або фармацевтичної композиції для одержання лікарського засобу для лікування раку. UA 110789 C2 (12) UA 110789 C2 UA 110789 C2 5 10 15 20 25 30 35 40 45 50 55 60 Перехресні посилання на споріднені заявки: Ця заявка заявляє пріоритет патентних заявок США із серійними номерами 61/310,692 (подана 4 березня 2010 року; знаходиться на стадії розгляду); 61/310,695 (подана 4 березня 2010 року; знаходиться на стадії розгляду), 61/311,057 (подана 5 березня 2010 року; знаходиться на стадії розгляду), кожна із цих заявок є введеною в дану заявку як посилання у своїй цілісності. Посилання на список послідовностей: Ця заявка включає один або більше списків послідовностей у відповідно з 37 C.F.R. 1.821 et seq., які є представленими як на паперовому носії, так і на носії для комп‘ютера, при цьому розкриття як паперового носія, так і носія для комп‘ютера є введеним у дану заявку як посилання у своїй цілісності. Передумови створення винаходу: Галузь, до якої відноситься винахід: Даний винахід відноситься до антитіл та їх фрагментів, які є імунореактивними стосовно рецептора B7-H3 ссавців та, зокрема, людини, та до його застосувань, зокрема у лікуванні раку та запалення. Таким чином, даний винахід, зокрема, відноситься до гуманізованих B7-H3реактивних антитіл та їх імунореактивних фрагментів, які є здатними опосередковувати, та більш бажано, поліпшувати активацію імунної системи проти ракових клітин, які є асоційованими з різноманітними видами раку людини. Опис рівня техніки: Ріст та метастази пухлин у значній мірі залежать від їх здатності уникати хазяйського імунологічного контролю та долати захист хазяїна. Більшість пухлин експресують антигени, які можуть впізнаватися у різній мірі імунною системою хазяїна, проте у багатьох випадках може виникати неадекватна імунна відповідь з причини неефективної активації ефекторних Т-клітин (Khawli, L.A. та ін. (2008) “Cytokine, Chemokine, and Co-Stimulatory Fusion Proteins for the Immunotherapy of Solid Tumors,” Exper. Pharmacol. 181: 291-328). CD4+ Т-лімфоцити представляють суттєвих організаторів більшості імунних та аутоімунних відповідей (Dong, C. та ін. (2003) “Immune Regulation by Novel Costimulatory Molecules,” Immunolog. Res. 28(1): 39-48). Активація CD4+ хелперних Т-клітин була виявлена як така, що опосередковується шляхом ко-стимуляторної взаємодії між антиген-презентуючими клітинами та нестимульованими CD4+ Т-лімфоцитами. Є необхідними дві взаємодії (Viglietta, V. та ін. (2007) “Modulating Co-Stimulation,” Neurotherapeutics 4: 666-675; Korman, A.J. та ін. (2007) “Checkpoint Blockade in Cancer Immunotherapy,” Adv. Immunol. 90: 297-339). У першій взаємодії антиген-презентуючі клітини повинен демонструвати цільовий антиген, релевантно зв‘язаний з основним комплексом клітинної гістосумісності так, що він може зв‘язуватися з Т-клітинним рецептором (“TCR”) нестимульованого CD4+ T-лімфоцита. У другій взаємодії ліганд антигенпрезентуючої клітини повинен зв‘язуватися з CD28 рецептором CD4+ T-лімфоцита (Dong, C. та ін. (2003) “Immune Regulation by Novel Costimulatory Molecules,” Immunolog. Res. 28(1): 39-48; Lindley, P.S. та ін. (2009) “The Clinical Utility Of Inhibiting CD28-Mediated Costimulation,” Immunol. Rev. 229: 307-321). CD4+ хелперні Т-клітини, що піддаються впливу обох стимуляторних сигналів, потім стають здатними відповідати на цитокіни (такі, як інтерлейкін-2 та інтерлейкін-12) для перетворення нав Th1 клітини. Такі клітини продукують інтерферон-гамма (IFN-γ) та фактор альфа некрозу пухлин (TNF-α), що опосередковують запальні відповіді на цільові клітини, які експресують цільовий антиген. Також відбувається активація та проліферація В-клітин, що приводить до утворення антитіл, специфічних для цільового антигену (Bernard, A. та ін. (2005) “T and B Cell Cooperation: A Dance of Life та Death,” Transplantation 79: S8-S11). За відсутності обох ко-стимуляторних сигналів під час включення TCR Т-клітини входять у стан функціональної нечутливості, що називається клональною толерантністю (Khawli, L.A. та ін. (2008) “Cytokine, Chemokine, and Co-Stimulatory Fusion Proteins for the Immunotherapy of Solid Tumors,” Exper. Pharmacol. 181: 291-328). При патологічних станах Th1 клітини є основними фігурами різноманітних органоспецифічних аутоімунних захворювань, таких, як діабет І типу, ревматоїдний артрит та розсіяний склероз (Dong, C. та ін. (2003) “Immune Regulation by Novel Costimulatory Molecules,” Immunolog. Res. 28(1): 39-48). I. B7 надродина та B7-H3 Дослідження стосовно лігандів CD28 рецептора привели до характеристики набору споріднених молекул, які є відомими як B7 надродина (Coyle, A.J. та ін. (2001) “The Expanding B7 Superfamily: Increasing Complexity In Costimulatory Signals Regulating T Cell Function,” Nature Immunol. 2(3): 203-209; Sharpe, A.H. та ін. (2002) “The B7-CD28 Superfamily,” Nature Rev. Immunol. 2: 116-126; Greenwald, R.J. та ін. (2005) “The B7 Family Revisited,” Ann. Rev. Immunol. 23: 515-548; Collins, M. та ін. (2005) “The B7 Family Of Immune-Regulatory Ligands,” Genome Biol. 1 UA 110789 C2 5 10 15 20 25 30 35 40 45 50 55 60 6: 223.1-223.7; Loke, P. та ін. (2004) “Emerging Mechanisms Of Immune Regulation: The Extended B7 Family and Regulatory T Cells.” Arthritis Res. Ther. 6: 208-214; Korman, A.J. та ін. (2007) “Checkpoint Blockade in Cancer Immunotherapy,” Adv. Immunol. 90: 297-339; Flies, D.B. та ін. (2007) “The New B7s: Playing a Pivotal Role in Tumor Immunity,” J. Immunother. 30(3): 251-260; Agarwal, A. та ін. (2008) “The Role Of Positive Costimulatory Molecules In Transplantation Аnd Tolerance,” Curr. Opin. Organ Transplant. 13: 366-372; Lenschow, D.J. та ін. (1996) “CD28/B7 System of T Cell Costimulation,” Ann. Rev. Immunol. 14: 233-258; Wang, S. та ін. (2004) “CoSignaling Molecules Of The B7-CD28 Family In Positive And Негативн. Regulation Of T Limphocyte Responses,” Microbes Infect. 6: 759-766). На сьогоднішній день існує сім відомих членів цієї родини: B7.1 (CD80), B7.2 (CD86), індуцибельний ко-стимуляторний ліганд (ICOS-L), ліганд запрограмованої смерті 1 (PD-L1), ліганд запрограмованої смерті 2 (PD-L2), B7-H3 та B7-H4 (Collins, M. та ін. (2005) “The B7 Family Of Immune-Regulatory Ligands,” Genome Biol. 6: 223.1223.7). Члени родини B7 являють собою членів надродини імуноглобулінів з імуноглобулін-Vподібним та імуноглобулін-C-подібним доменом (наприклад, IgV–IgC) (Sharpe, A.H. та ін. (2002) “The B7-CD28 Superfamily,” Nature Rev. Immunol. 2: 116-126). Кожний з IgV та IgC доменів членів B7-родини кодується одиничними екзонами, з додатковими екзонами, які кодують лідерні послідовності, трансмембранні та цитоплазматичні домени. Цитоплазматичні домени є короткими, коливаються за довжиною від 19 дo 62 амінокислотних залишків та можуть кодуватися множинними екзонами (Collins, M. та ін. (2005) “The B7 Family Of Immune-Regulatory Ligands,” Genome Biol. 6: 223.1-223.7). B7-H3 є унікальним в тому, що основна людська форма містить два позаклітинні тандемні IgV-IgC домени (тобто, IgV–IgC–IgV–IgC) (Collins, M. та ін. (2005) “The B7 Family Of Immune-Regulatory Ligands,” Genome Biol. 6: 223.1-223.7). Члени родини B7, як передбачається утворюють бек-ту-бек, нековалентні гомодимери на поверхні клітин, та такі димери були виявлені по відношенню до B7-1 (CD80) та B7-2 (CD86). B7-1 (CD80) та B7-2 (CD86) мають подвійну специфічність для стимуляторного CD28 рецептора та інгібіторного CTLA-4 (CD152) рецептора (Sharpe, A.H. та ін. (2002) “The B7-CD28 Superfamily,” Nature Rev. Immunol. 2: 116-126). Незважаючи на те, що спочатку передбачалося, що вони включають тільки 2 Ig домени (IgV–IgC) (Chapoval, A. та ін. (2001) “B7-H3: A Costimulatory Molecule For T Cell Activation and IFN-γ Production,” Nature Immunol. 2: 269–274; Sun, M. та ін. (2002) “Characterization of Mouse and Human B7-H3 Genes,” J. Immunol. 168: 62946297), було ідентифіковано варіант, що містить чотири імуноглобулінові позаклітинні домени (“4Ig-B7-H3”), та виявлено, що він являє собою більш загальну форму людського білка (Sharpe, A.H. та ін. (2002) “The B7-CD28 Superfamily,” Nature Rev. Immunol. 2: 116-126). Не спостерігали ніякої функціональної відмінності між цими двома формами, оскільки природна мишача форма (2Ig) та людська 4Ig форма демонструють подібні функції (Hofmeyer, K. та ін. (2008) “The Contrasting Role Of B7-H3,” Proc. Natl. Acad. Sci. (U.S.A.) 105(30): 10277-10278). Молекула 4IgB7-H3 інгібує обумовлений клітинами природних кілерів лізис ракових клітин (Castriconi, R. та ін. “Identification Of 4Ig-B7-H3 As A Neuroblastoma-Associated Molecule That Exerts A Protective Role From An NK Cell-Mediated Lysis,” Proc. Natl. Acad. Sci. (U.S.A.) 101(34): 12640-12645). Людський B7-H3 (2Ig форма) було виявлено як такий, що сприяє активації T-клітин та продукції IFN-γ шляхом зв‘язування путативного рецептора на активованих Т-клітинах (Chapoval, A. та ін. (2001) “B7-H3: A Costimulatory Molecule For T Cell Аctivation and IFN-γ Production,” Nature Immunol. 2: 269–274; Xu, H. та ін. (2009) “MicroRNA miR-29 Modulates Expression of Immunoinhibitory Molecule B7-H3: Potential Implications for Immune Based Therapy of Human Solid Tumors,” Cancer Res. 69(15): 5275-6281). Як B7-H4, так і B7-H1, є потужними інгібіторами імунної функції, коли експресуються на пухлинних клітинах (Flies, D.B. та ін. (2007) “The New B7s: Playing a Pivotal Role in Tumor Immunity,” J. Immunother. 30(3): 251-260). Спосіб дії B7-H3 є складним, оскільки білок опосередковує як ко-стимуляцію, так і коінгібування T-клітин (Hofmeyer, K. та ін. (2008) “The Contrasting Role Of B7-H3,” Proc. Natl. Acad. Sci. (U.S.A.) 105(30): 10277-10278; Martin-Orozco, N. та ін. (2007) “Inhibitory Costimulation And Anti-Tumor Immunity,” Semin. Cancer Biol. 17(4): 288-298; Subudhi, S.K. та ін. (2005) “The Balance Of Immune Responses: Costimulation Verse Coinhibition,” J. Mol. Med. 83: 193-202). B7-H3 зв‘язується з (TREM)-подібним транскриптом 2 (TLT-2) та ко-стимулює активацію T-клітин, а також зв‘язується з ще неідентифікованим(и) рецептором(ами) для того, щоб опосередковувати ко-інгібування T-клітин. Крім того, B7-H3 шляхом взаємодії з невідомим(и) рецептор(ами) являє собою інгібітор для клітин природних кілерів та клітин остеобластів (Hofmeyer, K. та ін. (2008) “The Contrasting Role Of B7-H3,” Proc. Natl. Acad. Sci. (U.S.A.) 105(30): 10277-10278). Інгібування може здійснюватися шляхом взаємодії з членами основних шляхів передачі сигналу, за допомогою яких рецептор T-клітин (TCR) регулює транскрипцію генів (наприклад, NFTA, NF-κB 2 UA 110789 C2 5 10 15 20 25 30 35 40 45 50 55 60 або AP-1 факторів). B7-H3 ко-стимулює проліферацію CD4+ та CD8+ T-клітин. B7-H3 також стимулює продукцію IFN-γ та CD8+ літичну активність (Chapoval, A. та ін. (2001) “B7-H3: A Costimulatory Molecule For T Cell Аctivation and IFN-γ Ptoduction,” Nature Immunol. 2: 269–274; Sharpe, A.H. та ін. (2002) “The B7-CD28 Superfamily,” Nature Rev. Immunol. 2: 116-126). Проте, можливо, білок також діє за допомогою NFAT (ядерний фактор для активованих T-клітин), NF-κB (ядерний фактор каппа B), та AP-1 (білок-1 активатора) фактори, що приводить до інгібуванням активації T-клітин (Yi. K.H. та ін. (2009) “Fine Tuning The Immune Response Through B7-H3 And B7-H4,” Immunol. Rev. 229: 145-151). B7-H3 також передбачається як такий, що інгібує Th1, Th2 або Th17 in vivo (Prasad, D.V. та ін. (2004) “Murine B7–H3 Is A Негативн. Regulator Of T Cells,” J. Immunol. 173: 25002506; Fukushima, A. та ін. (2007) “B7–H3 Regulates The Development Of Experimental Allergic Conjunctivitis In Mice,” Immunol. Lett. 113: 52-57; Yi. K.H. та ін. (2009) “Fine Tuning The Immune Response Through B7-H3 And B7-H4,” Immunol. Rev. 229: 145-151). Декілька незалежних досліджень показали, що клітини злоякісної пухлини людини демонструють значне підвищення експресії B7-H3 білка та що ця підвищена експресія була асоційована з підвищеною тяжкістю захворювання (Zang, X. та ін. (2007) “The B7 Family And Cancer Therapy: Costimulation And Coinhibition,” Clin. Cancer Res. 13: 5271-5279), це дає змогу передбачити, що B7-H3 використовується пухлинами як шлях уникнення імунітету (Hofmeyer, K. та ін. (2008) “The Contrasting Role Of B7-H3,” Proc. Natl. Acad. Sci. (U.S.A.) 105(30): 10277-10278). Молекули, що блокують здатність B7 молекули зв‘язуватися з рецептором Т-клітини (наприклад, CD28), інгібують імунну систему, та вони були запропоновані для лікування аутоімунного захворювання (Linsley, P.S. та ін. (2009) “The Clinical Utility Of Inhibiting CD28Mediated Co-Stimulation,” Immunolog. Rev. 229: 307-321). Клітини нейробластоми, що експресують 4Ig-B7-H3, оброблені при використанні aнти-4Ig-B7-H3 антитіл, були більш чутливими до NK клітин. Проте є неясним, чи може ця активність бути приписана тільки антитілам, направленим проти 4Ig-B7-H3 форми, оскільки усі описані антитіла, що виникали проти 4Ig-B7-H3, також зв‘язувалися з двома Ig-подібними формами B7H3 (Steinberger, P. та ін. (2004) “Molecular Characterization of Human 4Ig-B7-H3, a Member of the B7 Family with Four Ig-Like Domains,” J. Immunol. 172(4): 2352-2359 та Castriconi та ін. (2004) “Identification Of 4Ig-B7-H3 As A Neuroblastoma-Associated Molecule That Exerts A Protective Role From An NK Cell-Mediated Lysis,” Proc. Natl. Acad. Sci. (U.S.A.) 101(34): 12640-12645). B7-H3 не експресується на B або T клітинах, що знаходяться у стані спокою, моноцитах або дендритних клітинах, проте він індукується на дендритних клітинах за допомогою IFN-γ та на моноцитах за допомогою GM-CSF (Sharpe, A.H. та ін. (2002) “The B7-CD28 Superfamily,” Nature Rev. Immunol. 2: 116-126). Рецептор(и), що зв‘язує(ють) B7-H3 не були повністю охарактеризовані. Рання робота передбачає, що один такий рецептор буде необхідним для швидкої та транзієнтної підвищувальної регуляції на Т-клітинах після активації (Loke, P. та ін. (2004) “Emerging Mechanisms Of Immune Regulation: The Extended B7 Family And Regulatory T Cells.” Arthritis Res. Ther. 6: 208-214). Нещодавно рецептор (TREM)-подібного транскрипта 2 (TLT-2, або TREML2) (King, R.G. та ін. (2006) “Trem-Like Transcript 2 Is Expressed On Cells Of The Myeloid/Granuloid And B Lymphoid Lineage And Is Up-Regulated In Response To Imflamantation,” J. Immunol. 176: 6012-6021; Klesney-Tait, J. та ін. (2006) “The TREM Receptor Family And Signal Integration,” Nat. Immunol. 7: 1266–1273; Yi. K.H. та ін. (2009) “Fine Tuning The Immune Response Through B7-H3 And B7-H4,” Immunol. Rev. 229: 145-151), який експресується на мієлоїдних клітинах, був продемонстрований як такий, що є здатним до зв‘язування з B7-H3 та, таким чином, до ко-стимуляції активації CD8+ Т-клітин, зокрема (Zang, X. та ін. (2003) “B7x: A Widely Expressed B7 Family Member That Inhibits T Cell Аctivation,” Proc. Natl. Acad. Sci. (U.S.A.) 100:10388–10392; Hashiguchi, M. та ін. (2008) “Triggering Receptor Expressed On Myeloid CellLike Transcript 2 (TLT-2) Is A Counter-Receptor For B7–H3 And Enhances T Cell Responses,” Proc. Natl. Acad. Sci. (U.S.A.) 105(30): 10495-10500; Hofmeyer, K. та ін. (2008) “The Contrasting Role Of B7-H3,” Proc. Natl. Acad. Sci. (U.S.A.) 105(30): 10277-10278). Додатково до його експресії на клітинах нейробластоми, людський B7-H3 є також відомими як такий, що експресується на різноманітних ракових клітинах (наприклад, клітинах різних видів раку шлунку, яєчника та недрібноклітинного раку легень). Експресія B7-H3 білка була імуногістологічно визначена у лініях пухлинних клітин (Chapoval, A. та ін. (2001) “B7-H3: A Costimulatory Molecule For T Cell Аctivation And IFN-γ Production,” Nature Immunol. 2: 269–274; Saatian, B. та ін. (2004) “Еxpression Of Genes For B7-H3 And Other T Cell Ligands By Nasal Epithelial Cells During Differentiation And Аctivation,” Amer. J. Physiol. Lung Cell. Mol. Physiol. 287: L217–L225; Castriconi та ін. (2004) “Identification Of 4Ig-B7-H3 As A Neuroblastoma-Associated Molecule That Exerts A Protective Role From An NK Cell-Mediated Lysis,” Proc. Natl. Acad. Sci. 3 UA 110789 C2 5 10 15 20 25 30 35 40 45 50 55 60 (U.S.A.) 101(34):12640-12645); Sun, M. та ін. (2002) “Characterization of Mouse And Human B7-H3 Genes,” J. Immunol. 168: 6294-6297). Експресія мРНК була виявлена у серці, нирках, яєчках, легенях, підшлунковій залозі, передміхуровій залозі, кишечнику та у клітинах остеобластів (Collins, M. та ін. (2005) “The B7 Family Of Immune-Regulatory Ligands,” Genome Biol. 6: 223.1223.7). На білковому рівні B7-H3 був виявлений у печінці, легенях, жовчному міхурі, яєчках, передміхуровій залозі, молочних залозах, плаценті та лімфоїдних органах (Hofmeyer, K. та ін. (2008) “The Contrasting Role Of B7-H3,” Proc. Natl. Acad. Sci. (U.S.A.) 105(30): 10277-10278). II. Tерапевтичні антитіла На доповнення до їх відомого застосування у діагностиці, антитіла були продемонстровані як корисні як терапевтичні агенти. Наприклад, імунотерапія, або застосування антитіл для терапевтичних цілей, використовувалося останніми роками для лікування раку. Пасивна імунотерапія передбачає застосування моноклональних антитіл у лікуванні раку (див. наприклад, DeVita, Hellman, And Rosenberg's Cancer: Principles & Practice of Oncology, восьме видання (2008), DeVita, V. та ін. ред., Lippincott Williams & Wilkins, Philadelphia, PA, стор. 537547, 2979-2990). Ці антитіла можуть мати генетично детерміновану терапевтичну біологічну активність як для безпосереднього інгібування росту пухлинних клітин або їх виживання, так і стосовно їх здатності залучати активність клітин природних кілерів імунної системи організму Ці агенти, які можуть вводитися самостійно або у поєднанні з опроміненням або хіміотерапевтичними агентами ритуксимабом та трастузумабом, що є схваленими для лікування не-ходжкінської лімфоми та раку молочної залози, відповідно, являють собою приклади таких терапевтичних агентів. Альтернативно, антитіла можуть використовуватися для створення кон‘югатів антитіл, в яких антитіло є зв‘язаним з токсичним агентом та направляє цей агент до пухлини шляхом специфічного зв‘язування з пухлиною. Гемтузумаб озогаміцин являє собою приклад схваленого кон‘югату антитіла, що використовується для лікування лейкемії. Були розкриті моноклональні антитіла, що зв‘язуються з раковими клітинами та мають потенційне застосування для діагностики та терапії (див., наприклад, наступні патентні заявки які розкривають, зокрема, деякі молекулярні маси цільових білків: патент США № 6,054,561 (200 кДа c-erbB-2 (Her2), та інші невідомі антигени, що мають розмір 40-200 кДа) та патент США № 5,656,444 (онкофетальні білки 50 кДа та 55 кДа)). Приклади антитіл, які перебувають на стадії клінічних досліджень та/або є схваленими для лікування солідних пухлин, включають: трастузумаб (антиген: 180 кДа, HER2/neu), едреколомаб (антиген: 40-50 кДа, Ep-CAM), антилюдські глобули молочного жиру (HMFGl) (антиген >200 кДа, HMW муцин), цетуксимаб (антигени: 150 кДа та 170 кДа, EGF рецептор), алемтузумаб (антиген: 21-28 кДа, CD52) та ритуксимаб (антиген: 35 кДа, CD20). Антигенні мішені трастузумабу (Her-2 рецептор), який використовується для лікування раку молочної залози, та цетуксимабу (EGF рецептор), який перебуває на стадії клінічних досліджень та використовується для лікування деяких видів раку, є присутніми на деякому здатному до визначення рівні у великій кількості нормальних тканин людини, включаючи шкіру, кишечник, легені, яєчник, печінку та підшлункову залозу. Широта терапевтичного діапазону при застосуванні цих лікарських засобів, можливо, забезпечується відмінністю у рівнях експресії антигену або у доступі до цих сайтів, або активності антитіла у цих сайтах. Інший тип імунотерапії являє собою активну імунотерапію, або вакцинацію, при використанні антигену, присутнього на специфічній(их) раковій(их) пухлині(ах), або ДНК конструкціях, що направляють експресію антигену, який потім втягується в імунну відповідь індивідуума, тобто, для індукції індивідуума з метою активної продукції антитіл проти його власного виду раку. Активна імунізація не використовувалася так часто, як пасивна імунотерапія або імунотоксини. Були запропоновані деякі моделі розвитку захворювання (включаючи рак). Теорії коливаються від обумовленості захворювання однією інфективною/трансформуючою подією до еволюції у підвищеній мірі “подібного до захворювання” або “подібного до раку” типу тканини, що в результаті приводить до такого з повною патогенною або злоякісною здатністю. Деякі стверджують, що у випадку раку, наприклад, однієї мутаційної події є достатньо для того, що спричинити злоякісність, у той час, як інші доводять, що подальші зміни також є необхідними. Деякі дослідники також стверджують, що підвищене мутаційне навантаження та вид пухлини є необхідними як для ініціації, так і для розвитку неоплазії через ряд подій селекції мутацій на клітинному рівні. Деякі ракові мішені виявляються тільки у пухлинних тканинах, у той час як інші є присутніми у нормальних тканинах та піддаються підвищувальній регуляції та/або понадекспресуються у пухлинній тканині. У таких ситуаціях деякі дослідники передбачають, що понадекспресія є пов‘язаною з набуттям злоякісності, у той час як інші передбачають, що понадекспресія являє собою тільки маркер тенденції у проходженні довгого шляху стану посилення захворювання 4 UA 110789 C2 5 10 15 20 25 30 35 40 45 50 55 60 У деяких випадках ракові мішені, такі, як онкобілки, експресовані або понадекспресовані у пухлинах, були продемонстровані як такі, що є присутніми під час ембріонального та фетального розвитку та служать як регулятори росту та диференціації. Деякі дослідники виявили, що експресія цих онкобілків під час ембріонального та фетального розвитку, як виявилося, є обмеженою специфічними тканинами та також обмежується специфічними стадіями розвитку. На противагу до цього, експресія цих oнкобілків у дорослих була показана як така, що асоціюється з понадекспресією у пухлинному рості та/або порушенням функціонування пухлинних супресорних білків. Ідеальне діагностичне та/або терапевтичне антитіло буде специфічним для антигену, присутнього у великій кількості видів раку, проте такого, що відсутнім або присутнім на дуже низьких рівнях у будь-якій нормальній тканині. Відкриття, характеристика та ізоляція нового антитіла, здатного до зв‘язування з антигеном, що є специфічно асоційованим з раком, буде корисним у багатьох способах. По-перше, антитіло буде мати біологічну активність проти таких ракових клітин та буде здатним організувати відповідь імунної системи, забезпечуючи лікування захворювання. Антитіло може вводитися у формі єдиної терапії або у комбінації із сучасними способами лікування або використовуватися для одержання iмунокон‘югатів, зв‘язаних з токсичними агентами. Aнтитіло з такою ж специфічністю, проте з низькою біологічною активністю або без біологічної активності при введенні самостійно може також бути корисним у тому, що антитіло може використовуватися для одержання імунокон‘югату з радіоізотопом, токсином або хіміотерапевтичним агентом або ліпосомою, що містить хіміотерапевтичний агент, кон‘югованої форми, яка є біологічно активною за рахунок того, що антитіло направляє токсин до клітин, які містять антиген. Як обговорюється вище, антитіла та інші молекули, що специфічно зв‘язуються з B7-H3, були описані (див., патенти США № 7,527,969; 7,368,554; 7,358,354; та 7,279,567; публікації патентних заявок США № US 20090087416; US 20090022747; US 20090018315; US2008116219; US20080081346; US 20050202536; US20030103963; US20020168762; PCT публікації WO 2008/116219; WO 2006/016276; WO 2004/093894; WO 04/001381; WO 2002/32375; WO 2002/10187 та WO 2001/094413; EP 1292619B; Modak, S. та ін. (March 1999) “Disialoganglioside GD2 And Аntigene 8H9: Potential Targets For Аntibody-Based Іmmunotherapy Against Desmoplastic Small Round Cell Tumor (DSRCT) And Rhabdomyosarcoma (RMS),” Proceedings Of The American th Association For Cancer Research Annual Meeting, том 40:474 (90 Annual Meeting Of The American Association For Cancer Research; Philadelphia, Pennsylvania, US; April 10-14, 1999; Modak, S. та ін. (March 2000) “Radioimmunotargeting To Human Rhabdomyosarcoma Using Моnoclonal Аntibody 8H9,” Proc. Am. Assoc. Cancer Res.41 :724; Modak, S. та ін. (2001) “Моnoclonal Аntibody 8H9 Targets A Novel Cell Surface Аntigene Expressed By A Wide Spectrum Of Human Solid Tumors,” Cancer Res. 61(10): 4048-4054; Steinberger, P. та ін. (2004) “Molecular Characterization of Human 4Ig-B7-H3, a Member of the B7 Family with Four Ig-Like Domains,” J. Immunol. 172(4): 2352-2359; Xu, H. та ін. (2009) “MicroRNA miR-29 Modulates Еxpression of Immunoіnhibitor Molecule B7-H3: Potential Implications for Immune Based Therapy of Human Solid Tumors,” Cancer Res. 69(15): 5275-6281). Проте один аспект, бажаний для ідеального діагностичного та/або терапевтичного антитіла, буде являти собою відкриття та характеристику нових антитіл, здатних опосередковувати та, зокрема, поліпшувати активацію імунної системи проти ракових клітин (особливо ракових клітин людини), що є асоційованими з різними видами раку. Такі композиції будуть також корисними для відкриття лікарських засобів (наприклад, невеликих молекул) та для додаткової характеристики клітинної регуляції, росту та диференціації. Таким чином, незважаючи на усі попередні відкриття, все ще залишається необхідність у поліпшених композиціях, здатних до зв‘язування з раковими клітинами та до поліпшення або опосередковування імунної відповіді проти ракових клітин. Такі композиції можуть використовуватися для діагностики та лікування таких видів раку. Існує додаткова потреба, що базується на відкриттях, розкритих в даній заявці, у нових композиціях, що специфічно впізнають подвійні мішені на поверхні клітин, та які можуть, таким чином, модулювати або знижувати, або підвищувати здатність B7-H3 опосередковувати активацію T-клітин або шляхом впізнання, або шляхом знищення ракових клітин, що експресують B7-H3. Об‘єкт даного винаходу являє собою ідентифікацію таких композицій. Інший об‘єкт даного винаходу являє собою забезпечення нових сполук для застосування в аналізі експресії B7-H3. Як детально описується нижче, даний винахід відноситься до нових антитіл, включаючи, зокрема, перенацілювальні агенти з подвійною афінністю (“DART™s”), що включають модулятори активації B7-H3 T-клітин, які є здатними впливати на активацію T-клітин, а також нових антитіл, що зв‘язуються з B7-H3 рецепторами ракових клітин та сприяють або 5 UA 110789 C2 5 10 15 20 25 30 35 40 45 опосередковують загибель таких клітин. Даний винахід є направленим на такі композиції та на їх застосування у діагностиці та у лікуванні таких захворювань, як рак. Короткий виклад суті винаходу: Даний винахід відноситься до антитіл та їх фрагментів, що є імунореактивними стосовно ссавців, та особливо, людського B7-H3 рецептора, та до їх застосування, зокрема, у лікуванні раку та запалення. Винахід, таким чином, зокрема, стосується гуманізованих B7-H3-реактивних антитіл та їх імунореактивних фрагментів, які є здатними до опосередковування, та більш бажано, до підвищення активації імунної системи проти ракових клітин, що є асоційованими з різноманітними видами раку людини. Більш детально, даний винахід стосується ізольованого антитіла або його імунореактивного фрагменту, де ізольоване антитіло або його фрагмент включає варіабельний домен, який специфічно зв‘язується з позаклітинним доменом B7-H3, де антитіло конкурує за зв‘язування B7-H3 з будь-яким з антитіл: BRCA69D, BRCA84D або PRCA157. Винахід додатково відноситься до описаного вище ізольованого антитіла або його імунореактивного фрагменту, де антитіло або цей фрагмент включає варіабельний домен, що включає: Винахід додатково відноситься до будь-якого з описаних вище ізольованих антитіл або його імунореактивних фрагментів, де антитіло зв‘язується з B7-H3, що ендогенно експресується на поверхні ракової клітини. Винахід додатково відноситься до будь-якого з описаних вище ізольованих антитіл або його імунореактивних фрагментів, де антитіло зв‘язується з B7-H3, що інтерналізується при зв‘язуванні з B7-H, який експресується на поверхні ракової клітини. Винахід додатково відноситься до будь-якого з описаних вище ізольованих антитіл або його імунореактивних фрагментів, де антитіло являє собою гуманізоване моноклональне антитіло. Винахід додатково відноситься до будь-якого з описаних вище ізольованих антитіл або його імунореактивних фрагментів, де антитіло являє собою модифіковане антитіло, що включає варіант Fc ділянки людського IgG1, де варіант Fc ділянки людського IgG1 включає принаймні одну амінокислотну модифікацію стосовно Fc ділянки вихідного антитіла, при цьому амінокислотна(і) модифікація(ї) включає амінокислотну(і) модифікацію(ї), що змінює(ють) афінність або авідність варіантної Fc ділянки для зв‘язування з FcγR, так, що модифіковане антитіло демонструє поліпшену ефекторну функцію у порівнянні із вихідним антитілом. Винахід додатково відноситься до будь-якого з описаних вище ізольованих антитіл або його імунореактивних фрагментів, де модифікація Fc ділянки включає: (A) принаймні одну заміну, вибрану з групи, що складається з: (1) F243L; (5) Y300L; (2) D270E; (6) V305I; (3) R292P; (7) A330V; та (4) S298N; (8) P396L; (B) принаймні одну заміну з двох амінокислотних залишків, де заміна є вибраною з групи, що складається з: (1) F243L та P396L; (2) F243L та R292P; та (3) R292P та V305I; 6 UA 110789 C2 5 10 15 20 25 30 35 40 45 50 55 60 (C) принаймні одну заміну з трьох амінокислотних залишків, де заміна є вибраною з групи, що складається з: (1) F243L, R292P та Y300L; (2) F243L, R292P та V305I; (3) F243L, R292P та P396L; та (4) R292P, V305I та P396L; (D) принаймні одну заміну з чотирьох амінокислотних залишків, де заміна є вибраною з групи, що складається з: (1) F243L, R292P, Y300L та P396L; та (2) F243L, R292P, V305I та P396L; or (E) заміну принаймні п‘яти амінокислотних залишків: F243L, R292P, Y300L, V305I та P396. Винахід додатково відноситься до описаного вище антитіла, де антитіло включає заміни: (A) F243L, R292P та Y300L; (B) L235V, F243L, R292P, Y300L та P396L; або (C) F243L, R292P, Y300L, V305I та P396L. Винахід додатково відноситься до описаного вище антитіла, де антитіло включає: (A) варіабельний домен, що включає CDR1 (SEQ ID NO: 5), CDR2 (SEQ ID NO: 7) та CDR3 (SEQ ID NO: 9) легкого ланцюга BRCA84D, та CDR1 (SEQ ID NO: 13), CDR2 (SEQ ID NO: 15) та CDR3 (SEQ ID NO: 17) важкого ланцюга BRCA84D; та (B) модифікацію Fc ділянки, що включає заміни: L235V, F243L, R292P, Y300L та P396L. Винахід додатково відноситься до описаного вище антитіла, де антитіло являє собою химерне антитіло або гуманізоване антитіло. Винахід додатково відноситься до описаних вище ізольованих антитіл або їх імунореактивних фрагментів, де антитіло включає: (A) варіабельну ділянку легкого ланцюга, що має амінокислотну послідовність hBRCA84D-2 VL (SEQ ID NO: 89); (B) варіабельну ділянку важкого ланцюга, що має амінокислотну послідовність hBRCA84D-2 VH (SEQ ID NO: 99); та (C) Fc-ділянку, що має заміни: L235V, F243L, R292P, Y300L та P396L. Винахід додатково відноситься до гібридоми, що секретує моноклональне антитіло, яке специфічно зв‘язується з позаклітинним доменом B7-H3, де антитіло конкурує за зв‘язування B7-H3 з будь-яким із антитіл: BRCA69D, BRCA84D або PRCA157. Винахід додатково відноситься до молекули нуклеїнової кислоти, що кодує будь-яке з описаних вище ізольованих антитіл або імунореактивних фрагментів. Винахід додатково відноситься до перенацілювального реагенту з подвійною афінністю (DART™), де реагент включає: (A) поліпептидний ланцюг I, що включає епітопзв‘язувальний домен VL імуноглобуліну, специфічний для зв‘язування B7-H3, та епітопзв‘язувальний домен VH, специфічний для зв‘язування молекули, відмінної від B7-H3; та (B) поліпептидний ланцюг II, що включає епітопзв‘язувальний домен VH імуноглобуліну, специфічний для зв‘язування B7-H3, та епітопзв‘язувальний домен VL, специфічний для зв‘язування молекули, відмінної від B7-H3; де поліпептидні ланцюги I та II є асоційованими разом так, що утворюють функціональні епітопзв‘язувальні домени, здатні до зв‘язування B7-H3 та молекули, відмінної від B7-H3. Винахід додатково відноситься до описаного вище перенацілювального реагенту з подвійною афінністю (DART™), де молекула, відмінна від B7-H3, що може зв‘язуватися за допомогою DART™, являє собою гаптен, та зокрема, де гаптен являє собою флуоресцеїн ізотіоціанат. Винахід додатково відноситься до описаного вище перенацілювального реагенту з подвійною афінністю (DART™), де молекула, відмінна від B7-H3, що може зв‘язуватися за допомогою DART™, являє собою рецептор T-клітини або рецептор NKG2D. Винахід додатково відноситься до описаного вище перенацілювального реагенту з подвійною афінністю (DART™), де молекула, відмінна від B7-H3, що може зв‘язуватися за допомогою DART™, являє собою асоційований з пухлиною антиген, та зокрема, де асоційований з пухлиною антиген є вибраним із групи, що складається з A33; ADAM-9; ALCAM; BAGE; бета-катеніну; CA125; карбоксипептидази M; CD103; CD19; CD20; CD22; CD23; CD25; CD27; CD28; CD36; CD40/CD154; CD45; CD46; CD5; CD56; CD79a/CD79b; CDK4; CEA; CTLA4; цитокератину 8; EGF-R; EphA2; ErbB1; ErbB3; ErbB4; GAGE-1; GAGE-2; GD2/GD3/GM2; gp100; HER-2/neu; людського папіломавірусу-E6; людського папіломавірусу-E7; інтегрин-альфа-V-бета 7 UA 110789 C2 5 10 15 20 25 30 35 40 45 50 55 60 6; JAM-3; KID3; KID31; KSA (17-1A); LUCA-2; MAGE-1; MAGE-3; MART; MUC-1; MUM-1; Nацетилглюкозамінілтрансферази; онкостатину M; p15; PIPA; PSA; PSMA; ROR1; sTn; рецептора TNF-ß; рецептора TNF-α; рецептора TNF-γ; рецептора трансферину; та VEGF рецептора. Винахід додатково відноситься до молекули нуклеїнової кислоти, що кодує поліпептидний ланцюг будь-якого з описаних вище перенацілювальних реагентів з подвійною афінністю (DART™). Винахід додатково відноситься до фармацевтичної композиції, що включає (i) терапевтично ефективну кількість будь-якого з описаних вище ізольованих антитіл або імунореактивних фрагментів або перенацілювальних реагентів з подвійною афінністю (DART™) та (ii) фармацевтично прийнятний носій. Винахід додатково відноситься до описаної вище фармацевтична композиція, де антитіло являє собою гуманізоване антитіло, що включає: (A) варіабельний домен, що включає CDR1 (SEQ ID NO: 5), CDR2 (SEQ ID NO: 7) та CDR3 (SEQ ID NO: 9) легкого ланцюга BRCA84D, та CDR1 (SEQ ID NO: 13), CDR2 (SEQ ID NO: 15) та CDR3 (SEQ ID NO: 17) важкого ланцюга BRCA84D; та (B) модифікацію Fc ділянки, що включає заміни: L235V, F243L, R292P, Y300L та P396L. Винахід додатково відноситься до описаної вище фармацевтичної композиції, де антитіло являє собою гуманізоване антитіло, що включає: (A) варіабельну ділянку легкого ланцюга, що має амінокислотну послідовність hBRCA84D-2 VL (SEQ ID NO: 89); (B) варіабельну ділянку важкого ланцюга, що має амінокислотну послідовність hBRCA84D-2 VH (SEQ ID NO: 99); та (C) Fc-ділянку, що має заміни: L235V, F243L, R292P, Y300L та P396L. Винахід додатково відноситься до будь-якої з описаних вище фармацевтичних композицій, що додатково включає один або більше додаткових протиракових агентів, та зокрема, де додатковий протираковий агент являє собою хіміотерапевтичний агент, радіаційний терапевтичний агент, гормональний терапевтичний агент або імунотерапевтичний агент. Винахід додатково відноситься до застосування будь-якого з описаних вище антитіл або імунореактивних фрагментів або перенацілювальних агентів з подвійною афінністю (DART™) у діагностиці раку, де ізольоване антитіло, імунореактивний фрагмент або DART™ є міченим за допомогою здатної до визначення мітки. Винахід додатково відноситься до описаного вище застосування, що відрізняється тим, що рак характеризується присутністю ракової клітини, вибраної з групи, яка складається з клітини пухлини надниркової залози, раку, асоційованого зі СПІДом, альвеолярної саркоми м‘яких тканин, астроцитарної пухлини, раку жовчного міхура, раку кісток, раку головного та спинного мозку, метастатичного раку мозку, раку молочної залози, пухлин каротидного гломуса, раку шийки матки, хондросаркоми, хордоми, хромофобної карциноми ниркових клітин, гіпернефроїдної пухлини нирки, раку кишечника, колоректального раку, шкірної доброякісної фіброзної гістіоцитоми, десмопластичної дрібнокруглоклітинної пухлини, епіндимоми, саркоми Юїнга,позаскелетної міксоїдної хондросаркоми, фіброгенного недовершеного остоегенезу, фіброзної дисплазії кісток, раку жовчного міхура або жовчної вивідної протоки, раку шлунковокишкового тракту, гестаційного трофобластного захворювання, пухлини зародкової клітини, раку голови та шиї, карциноми печінкових клітин, пухлини острівкових клітин, саркоми Капоші, раку нирки, лейкемії, ліпоми/доброякісної ліпоматозної пухлини, ліпосаркоми/злоякісної ліпоматозної пухлини, печінкового раку, лімфоми, раку легень, медулобластоми, меланоми, менінгіоми, множинної ендокринної неоплазії, множинної мієломи, мієлодиспластичного синдрому, нейробластоми, нейроендокринних пухлин, раку яєчника, раку підшлункової залози, папілярної карциноми щитовидної залози, пухлини паращитовидної залози, педіатричного раку, пухлини капсули периферичного нерву, феохромоцитоми, пухлини гіпофізу, раку передміхурової залози, задньої ювеальної меланоми, виключного гематологічного розладу, ниркового метастатичного раку, паличковидної пухлини, рабдоміосаркоми, саркоми, раку шкіри, саркоми м‘яких тканин, раку лускатих клітин, раку шлунка, синовіальної саркоми, тестикулярної саркоми, тимусної карциноми, тимоми, метастатичного раку щитовидної залози та раку матки. Винахід додатково відноситься до застосування будь-якого з описаних вище антитіл або імунореактивних фрагментів або перенацілювальних реагентів з подвійною афінністю (DART™) в одержанні лікарського засобу для лікування або запобігання раку у пацієнта. Винахід додатково відноситься до таких застосувань, які відрізняються тим, що рак характеризується присутністю ракової клітини, вибраної з групи, яка складається з клітини пухлини надниркової залози, раку, асоційованого зі СПІДом, альвеолярної саркоми м‘яких тканин, астроцитарної пухлини, раку жовчного міхура, раку кісток, раку головного та спинного мозку, метастатичного 8 UA 110789 C2 5 10 15 20 25 30 35 40 45 50 55 60 раку мозку, раку молочної залози, пухлин каротидного гломуса, раку шийки матки, хондросаркоми, хордоми, хромофобної карциноми ниркових клітин, гіпернефроїдної пухлини нирки, раку кишечника, колоректального раку, шкірної доброякісної фіброзної гістіоцитоми, десмопластичної дрібнокруглоклітинної пухлини, епіндимоми, саркоми Юїнга, позаскелетної міксоїдної хондросаркоми, фіброгенного недовершеного остоегенезу, фіброзної дисплазії кісток, раку жовчного міхура або жовчної вивідної протоки, раку шлунково-кишкового тракту, гестаційного трофобластного захворювання, пухлини зародкової клітини, раку голови та шиї, карциноми печінкових клітин, пухлини острівкових клітин, саркоми Капоші, раку нирки, лейкемії, ліпоми/доброякісної ліпоматозної пухлини, ліпосаркоми/злоякісної ліпоматозної пухлини, печінкового раку, лімфоми, раку легень, медулобластоми, меланоми, менінгіоми, множинної ендокринної неоплазії, множинної мієломи, мієлодиспластичного синдрому, нейробластоми, нейроендокринних пухлин, раку яєчника, раку підшлункової залози, папілярної карциноми щитовидної залози, пухлини паращитовидної залози, педіатричного раку, пухлини капсули периферичного нерву, феохромоцитоми, пухлини гіпофізу, раку передміхурової залози, задньої ювеальної меланоми, виключного гематологічного розладу, ниркового метастатичного раку, паличковидної пухлини, рабдоміосаркоми, саркоми, раку шкіри, саркоми м‘яких тканин, раку лускатих клітин, раку шлунка, синовіальної саркоми, тестикулярної саркоми, тимусної карциноми, тимоми, метастатичного раку щитовидної залози та раку матки. Винахід додатково відноситься до описаних вище застосувань, які відрізняються тим, що застосування додатково включає введення однієї або більше додаткових протиракових терапій, вибраних з групи, що складається з хіміотерапії, імунотерапії, радіаційної терапії, гормональної терапії та хірургії. Короткий опис малюнків Фігури 1A-1B показують результати IHC досліджень, що проводилися при використанні зразків нормальних тканин підшлункової залози, печінки, легені та товстого кишечнику із застосуванням BRCA84D при дозі 0,625 мкг/мл та 0,078 мкг/мл (Фігура 1A) та нормальної тканини серця, нирки та надниркової залози при використанні BRCA84D при дозі 0,625 мкг/мл (Фігура 1B). Фігура 2 показує результати IHC досліджень, що проводилися при використанні зразків ракових тканин підшлункової залози, молочної залози, товстого кишечнику та легені із застосуванням BRCA84D при дозі 0,625 мкг/мл та 0,078 мкг/мл. Фігури 3A-3D показують залежне від дози перенацілене знищення, опосередковане антитілами згідно з даним винаходом. Фігури 3A-3B показують залежне від дози перенацілене знищення клітин A498 карциноми ниркових клітин (із нестимульованими PBMC через 18 годин (LDH)) моноклональними антитілами, реактивних стосовно B7-H3 (співвідношення ефектор : мішень 20:1) (Фігура 3A: BRCA68D, BRCA69D, PRCA157, GB8, TCR-4420; Фігура 3B: OVCA22, BRCA84D, TDH6, TES7, TCR-4420). Фігури 3C-3D показують залежне від дози перенацілене знищення клітин A549 раку легень (із нестимульованими PBMC через 18 годин (LDH)) моноклональними антитілами, реактивних стосовно B7-H3 (співвідношення ефектор : мішень 30:1) (Фігура 3C: BRCA84D, OVCA22, PRCA157, TES7; Фігура 3D: TDH6, BRCA68D, BRCA69D). Фігури 4A-4B показують здатність анти-B7-H3 антитіл до зв‘язування з розчинним B7H3-2Ig (Фігура 4A) та розчинним B7H3-4Ig B7-H3 (Фігура 4B) (концентрація антитіла складає 100 нM). Позначення: (A) BLA8; (B) BRCA165; (C) BRCA68D; (D) BRCA69D; (E) BRCA84D; (F) GB8; (G) LUCA1; (H) LUCA50; (I) OVCA21; (J) OVCA22; (K) PA20; (L) PRCA123; (M) SG24; (N) SG27; (O) STO9; (P) TDH4 (184-192); (Q) TDH4; (R) TDH5; (S) TES7. Вертикальне положення позначення корелює з положенням відповідної кривої. Фігури 5A-5S демонструють зв‘язувальну афінність між антигенами у розчині та такими, що є захопленими моноклональними антитілами (суцільні лінії; B7-H3(4Ig) 100 нМ; пунктирні лінії; B7H3, 100 нМ). Фігури 6A-6I показують результати BIACORE™ аналізів B7-H3 антитіл, імобілізованих на B7H3-2Ig (пунктирні сірі лінії) або B7-H3-4Ig (суцільні чорні лінії). Антитіла титрували від 0,063 мкМ дo 1 мкМ. Час позначений у секундах. Фігура 7 забезпечує порівняння BIACORE™ аналізу антитіл PRCA157, BRCA69D, BLA8, PA20, BRCA84D, GB8 та SG27. Фігура 8 забезпечує BIACORE™ аналіз, який демонструє, що антитіла BRCA68D, BRCA69D та PRCA157 не конкурують з BRCA84D за зв‘язування з людським B7-H3. Фігури 9A-9B показують результати досліджень здатності анти-B7-H3 антитіл даного винаходу ставати інтерналізованими при зв‘язуванні з раковими клітинами (Фігура 9A, CSC клітини передміхурової залози; Фігура 9B, Hs700t клітини підшлункової залози). Фігури 10A-10F показують здатність анти-B7-H3 антитіл згідно з даним винаходом 9 UA 110789 C2 5 10 15 20 25 30 35 40 45 50 55 60 перехресно блокувати одне одного, виявляючи, таким чином, перекривання відмінних епітопів. Використовували десятикратний надлишок конкурентного антитіла. Фігури 11A-11B показують вирівнювання амінокислотних залишків варіабельних легких ланцюгів (Фігура 11A) або варіабельних важких ланцюгів (Фігура 11B) BRCA84D та його гуманізованої похідної, hBRCA84D. Фігура 12 показує відносні зв‘язувальні афінності похідних легкого ланцюга hBRCA84D: BRCA84D-3VL, BRCA84D-4VL та BRCA84D-5VL для людського B7-H3. Фігура 13 показує відносні зв‘язувальні афінності hBRCA84D похідних важкого ланцюга hBRCA84D: BRCA84D-2VH, BRCA84D-3VH та BRCA84D-4VH для людського B7-H3. Фігура 14 показує відносні зв‘язувальні афінності (1) антитіл, що містять hBRCA84D-2VL та hBRCA84D-2VH (досліди 1 та 2), (2) химерного BRCA84D, (3) антитіла, що містить hBRCA84D5VL, та химерного BRCA84D-HC та (4) антитіла, що містить hBRCA84D-5VL та hBRCA84D-2VH. Фігура 15 показує здатність Fc-модифікованих гуманізованих анти-B7-H3 антитіл до інгібування пухлинного росту клітин HT-1197 карциноми сечового міхура in vivo у ксенотрансплантатній мишачій модельній системі. Fc-модифіковане hBRCA84D-2 антитіло (що включає Fc модифікації L235V, F243L, R292P, Y300L та P396L) вводили мишам (при дозі 1 мкг/кг, 10 мкг/кг або 20 мкг/кг) через 7 днів, 14 днів, 21 день та 28 днів після імплантації ракових клітин. Фігура 16 показує здатність Fc-модифікованих гуманізованих анти-B7-H3 антитіл до інгібування пухлинного росту клітин A498 ренальної карциноми клітин in vivo у ксенотрансплантатній мишачій модельній системі. Fc-модифіковане hBRCA84D-2 антитіло (що включає Fc модифікації L235V, F243L, R292P, Y300L та P396L) вводили мишам (при дозі 1 мкг/кг, 10 мкг/кг або 20 мкг/кг) через 7 днів, 14 днів, 21 день та 28 днів після імплантації ракових клітин. Фігури 17A-17D демонструють здатність hBRCA84D-2 / анти-TCR DART™ (“T-DART™”) опосередковувати перенацілене знищення SK-MES-1 клітин раку легень, A498 клітин ренальної карциноми, LNCaP клітин раку передміхурової залози та UACC-62 клітин меланоми. Фігури 18A-18C показують фармакокінетичне концентрації падіння анти-B7-H3 Mab1 у сироватці самців мишей mCD16-/-, hCD16A_FOXN1, що не мають пухлини (Фігури 18A-18B). Фігура 18C показує передбачені фармакокінетичні профілі, одержані при використанні двокомпартментної моделі з параметрами від дози 5 мг/кг при 0,1, 0,5, 1, 5 та 10 мг/кг. Фігура 19 показує відносну експресію HER2 та PRCA135 клітинною лінією HT-1197 раку сечового міхура. Фігура 20 показує зв‘язувальну афінність варіантів анти-B7-H3 антитіла hBRCA84D стосовно HT-1197 клітин. Фігури 21A-21C показують результати аналізу у мишачій ксенотрансплантатній моделі для HT-1197. Групи з 8 самок мишей одержували носій або 10 мг/кг IgG контролю, або цетуксимаб при дозі 1, 5, або 15 мг/кг або анти-B7-H3 антитіло Mab1 при дозі 0,1, 0,5, 1, 5 або 10 мг/кг (Q7D x 5). Вимірювання пухлин здійснювали кожні 3-4 дні. Фігура 21A показує здатність анти-B7-H3 антитіла Mab1 запобігати або інгібувати пухлинний розвиток у мишачій ксенотрансплантатній моделі. Порівняння проти IgG контролю: Mab1 (1 та 5 мг/кг) проти IgG контролю *** від дня 51; Mab1 (10 мг/кг) проти IgG контролю ** від дня 48. Фігура 21B показує здатність цетуксимабу запобігати або інгібувати пухлинний розвиток у мишачій ксенотрансплантатній моделі. Цетуксимаб (7 мг/кг) проти IgG контролю ** від дня 51; цетуксимаб (15 мг/кг) проти IgG контролю *** від дня 58. Фігура 21C порівнює результати, одержані при максимальних дозах, які піддавали аналізу. Фігури 22A-22B показують відносну експресію HER2 та PMSA клітинною лінією HT-1376 раку сечового міхура. Фігура 23 показує результати мишачого ксенотрансплантатного аналізу для HT-1376. Групи мишей одержували носій або 1,0 мг/кг анти-B7-H3 антитіла Mab1 (Q7D x 4). Фігура 24 показує результати мишачого ксенотрансплантатного аналізу для AGS. Групи мишей одержували носій або 10 мг/кг анти-B7-H3 антитіла Mab1 при дозі 0,5, 1, 5 або 10 мг/кг (Q7D x 5). Фігура 25 показує результати in vitro аналізу цитотоксичності A549 клітин раку легень при інкубації з hBRCA84D, chBRCA84D та hBRCA84 (Fc Var1) варіантом анти-B7-H3 антитіла (E:T співвідношення = 25:1; ефектор = людський PBMC; LDH зчитування результатів). Фігура 26 показує результати мишачого ксенотрансплантатного аналізу для A549. Групи мишей одержували носій або 1,0 мг/кг анти-B7-H3 антитіла Mab1 (Q7D x 4). Фігура 27 показує результати мишачого ксенотрансплантатного аналізу для CaLu3. Групи мишей одержували носій або 0,5, 1 або 5 мг/кг (Q7D x5) анти-B7-H3 антитіла Mab1 або IgG 10 UA 110789 C2 5 10 15 20 25 30 35 40 45 50 55 60 контролю (10 мг/мл). Фігури 28A-28C показують результати мишачого ксенотрансплантатного аналізу для LOXIMVI клітин меланомного раку. Групи з 8 самок мишей одержували носій або 5 мг/кг IgG контролю, або доцетаксел при дозі 5, 10 або 20 мг/кг, або анти-B7-H3 антитіло Mab1 при дозі 0,5, 1, 5 або 10 мг/кг. Фігура 28A показує здатність анти-B7-H3 антитіла Mab1 запобігати або інгібувати пухлинний розвиток у мишачій ксенотрансплантатній моделі. Фігура 28B показує здатність доцетакселу запобігати або інгібувати пухлинний розвиток у мишачій ксенотрансплантатній моделі. Фігура 28C порівнює результати, одержані при максимальних дозах, які піддавали аналізу. Фігура 29 показує показує результати мишачого ксенотрансплантатного аналізу для UACC62 клітин меланомного раку. Групи мишей одержували носій або 5 мг/кг IgG контролю, або антиB7-H3 антитіло Mab1 при дозі 0,5, 1, 5 або 10 мг/кг. Фігури 30A-30C показують результати мишачого ксенотрансплантатного аналізу для 2rv клітин раку передміхурової залози. Групи з 8 самок мишей одержували носій або 10 мг/кг IgG контролю, або трастузумаб при дозі 1, 7 або 15 мг/кг, або анти-B7-H3 антитіло Mab1 при дозі 0,5, 1, 5 або 10 мг/кг. Фігура 30A показує здатність анти-B7-H3 антитіла Mab1 запобігати або інгібувати пухлинний розвиток у мишачій ксенотрансплантатній моделі. Фігура 30B показує здатність трастузумабу запобігати або інгібувати розвиток пухлини у мишачій ксенотрансплантатній моделі. Фігура 30C порівнює результати, одержані при максимальних дозах, які піддавали аналізу. Фігура 31 показує результати in vitro аналізу цитотоксичності A498 клітин ниркового раку при інкубації з hBRCA84D, chBRCA84D та hBRCA84 (Fc Var1) варіантами анти-B7-H3 антитіла (E:T співвідношення = 25:1; ефектор = людські PBMC; LDH зчитування результатів). Фігура 32 показує результат мишачого ксенотрансплантатного аналізу для клітин A498 ренального раку. Групи мишей одержували носій або 10 мг/кг IgG контролю, або анти-B7-H3 антитіло Mab1 при дозі ,.1, 0.5, 1, 5 або 10 мг/кг. Цетуксимаб (анти-EGRF антитіло) вводили мишам контрольної групи при дозах 1, 7 або 15 мг/кг. Фігури 33A-33B результат мишачого ксенотрансплантатного аналізу для клітин 786-0 ренального раку у порівнянні із цетуксимабом. Групи мишей одержували носій або 10 мг/кг IgG контролю, або анти-B7-H3 антитіло Mab1 при дозі 0,1, 0,5, 1, 5 або 10 мг/кг. Цетуксимаб (антиEGRF антитіло) вводили мишам контрольної групи при дозах 1, 7 або 15 мг/кг. Фігура 34 показує результат мишачого ксенотрансплантатного аналізу для клітин 786-0 ренального раку у порівнянні із паклітакселом. Групи мишей одержували носій або 5 мг/кг IgG контролю, або анти-B7-H3 антитіло Mab1 при дозі 0,1, 0,5, 1, 5 або 10 мг/кг. Паклітаксел вводили мишам контрольної групи при дозі 2,5 мг/кг. Детальний опис винаходу: Даний винахід відноситься до антитіл та їх фрагментів, що є імунореактивними у ссавців, та більш конкретно, до людського B7-H3 рецептора та до їх застосування, зокрема, у лікуванні раку та запалення. Винахід, таким чином, зокрема, стосується гуманізованих B7-H3-реактивних антитіл та їх імунореактивних фрагментів, які є здатними до опосередковування та ,більш бажано, до поліпшення активації імунної системи проти ракових клітин, що є асоційованими з різноманітними видами раку людини. I. Загальні методики Практика даного винаходу буде використовувати, якщо не зазначене інше, традиційні методики молекулярної біології (включаючи рекомбінантні методики), мікробіології, клітинної біології, біохімії та імунології, які є звичайними для даної галузі техніки. Такі методики повністю пояснюються у літературі, такій, як, Molecular Cloning: A Laboratory Manual, третє видання (Sambrook та ін. Eds., 2001) Cold Spring Harbor Press, Cold Spring Harbor, NY; Oligonucleotide Synthesis: Methods And Applications (Methods in Molecular Biology), Herdewijn, P., вид., Humana Press, Totowa, NJ; Oligonucleotide Synthesis (Gait, M.J., вид., 1984); Methods in Molecular Biology, Humana Press, Totowa, NJ; Cell Biology: A Laboratory Notebook (Cellis, J.E., вид., 1998) Academic Press, New York, NY; Animal Cell Culture (Freshney, R.I., вид., 1987); Introduction to Cell And Tissue Culture (Mather, J.P. та Roberts, P.E., вид., 1998) Plenum Press, New York, NY; Cell And Tissue Culture: Laboratory Procedures (Doyle, A. та ін., ред., 1993-8) John Wiley and Sons, Hoboken, NJ; Methods in Enzymology (Academic Press, Inc.) New York, NY; Weir’s Handbook of Experimental Immunology (Herzenberg, L.A. та ін. ред. 1997) Wiley-Blackwell Publishers, New York, NY; Gene Transfer Vectors for Mammalian Cells (Miller, J.M. та ін. ред., 1987) Cold Spring Harbor Press, Cold Spring Harbor, NY; Current Protocols in Molecular Biology (Ausubel, F.M. та ін., ред., 1987) Greene Pub. Associates, New York, NY; PCR: The Polymerase Chain Reaction, (Mullis, K. та ін., ред., 1994) Birkhäuser, Boston MA; Current Protocols in Immunology (Coligan, J.E. та ін., ред., 1991) John 11 UA 110789 C2 5 10 15 20 25 30 35 40 45 50 55 60 Wiley та Sons, Hoboken, NJ; Short Protocols in Molecular Biology (John Wiley and Sons, 1999) Hoboken, NJ; Immunobiology 7 (Janeway, C.A. та ін., 2007) Garland Science, London, UK; Аntibody (P. Finch, 1997) Stride Publications, Devoran, UK; Аntibodies: A Practical Approach (D. Catty., ред., 1989) Oxford University Press, USA, New York NY); Monoclonal Antibodies: A Practical Approach (Shepherd, P. та ін., вид., 2000) Oxford University Press, USA, New York NY; Using Antibodies: A Laboratory Manual (Harlow, E. та ін., вид., 1998) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY; The Antibodies (Zanetti, M. та ін., вид. 1995) Harwood Academic Publishers, London, UK); та DeVita, Hellman, And Rosenberg's Cancer: Principles & Practice of Oncology, 8-е вид., DeVita, V. та ін., ред. 2008, Lippincott Williams & Wilkins, Philadelphia, PA. II. Визначення Як використовується в даній заявці, термін “B7-H3” відноситься до члена родини людських білків B7, мембранного білка типу I з Ig-подібними доменами, що також є відомим як CD276. Термін “2Ig-B7-H3” позначає B7-H3 форму, що включає тільки два Ig-подібні домени; термін “4Ig-B7-H3” позначає B7-H3 форму, що включає чотири Ig-подібні домени (див., Sun, M. та ін. (2002) “Characterization of Mouse and Human B7-H3 Genes,” J. Immunol. 168: 6294-6297; Steinberger та ін. (2004), “Molecular Characterization Of Human 4Ig-B7-H3, A Member Of The B7 Family With Four Ig-like Domains,” J. Immunol. 2004, 172(4): 2352-2359 та Castriconi та ін. (2004) “Identification Of 4Ig-B7-H3 As A Neuroblastoma-Associated Molecule That Exerts A Protective Role From An NK Cell-Mediated Lysis,” Proc. Natl. Acad. Sci. (U.S.A.) 101(34): 12640-12645). Антиген “TES7” (WO 2008/066691) являє собою антиген, що володіє характеристиками 4Ig-B7-H3. У відповідності із цим антитіла, що специфічно зв‘язуються з TES7, зв‘язуються з 4Ig-B7-H3. TES7 антиген може мати більше, ніж один, відмінний епітоп, та епітопи можуть бути нелінійними. Декілька анти-B7-H3 антитіл є відомими як такі, які зв‘язуються з нелінійними епітопами, включаючи деякі, які є присутніми тільки на ізоформі 4Ig-B7-H3. На сьогоднішній день передбачається, що TES7 може піддаватися понадекспресії у деяких ракових клітинах у порівнянні із аналогами у нормальній тканині. Агоністи, антагоністи та інші модулятори функції B7-H3 очевидним чином є включеними в об‘єм даного винаходу. Ці агоністи, антагоністи та модулятори являють собою поліпептиди, що включають один або більше сайтів антигенної детермінанти B7-H3, або включають один або більше фрагментів таких сайтів, варіантів таких сайтів, або пептидоміметиків таких сайтів. Ці агоністичні, антагоністичні та B7-H37 модуляторні сполуки забезпечуються в лінійній або циклічній формі, та необов‘язково включають принаймні один амінокислотний залишок, що звичайно виявляється у природі, або принаймні один амідний ізостер. Ці сполуки можуть бути глікозильованими. Зокрема, термін “B7-H3 модулятор”, як використовується в даній заявці, визначається як будь-яка сполука, яка (1) є здатною до руйнування або блокування взаємодії між людським B7H3 та його природними лігандами або анти-B7-H3 антитілом; (2) є здатною до зв‘язування з людським B7-H3 та його природними лігандами або анти-B7-H3 антитілом; (3) містить антигенний сайт, що може використовуватися для індукції антитіл, здатних до зв‘язування з людським B7-H3 та його природними лігандами або анти-B7-H3 антитілом; (4) містить антигенний сайт, що може використовуватися у скринінгу антитіл, здатних до зв‘язування з людським B7-H3 та його природними лігандами або анти-B7-H3 антитілом; (5) містить антигенний сайт, що може використовуватися для індукції антитіл, здатних до руйнування або блокування взаємодії між людським B7-H3 та його природними лігандами або анти-B7-H3 антитілом; (6) містить антигенний сайт, що може використовуватися у скринінгу антитіл, здатних до руйнування або блокування взаємодії між людським B7-H3 та його природними лігандами або анти-B7-H3 антитілом. B7-H3 модулятори можуть являти собою “B7-H3 агоністи” або “B7-H3 антагоністи” у залежності від того, чи поліпшує їх активність активацію T-клітин або інгібує активацію T-клітин, відповідно. B7-H3 агоністи, антагоністи та модулятори включають B7-H3 варіанти, B7-H3 пептидні антагоністи, пептидоміметики та малі молекули, анти-B7-H3 антитіла та імуноглобулінові варіанти, амінокислотні варіанти людського B7-H3, включаючи варіанти на основі амінокислотної заміни, делеції та вставки, або будь-якої їх комбінації та химерні імуноглобуліни. B7-H3 агоністи, антагоністи та модулятори згідно з даним винаходом базуються на ідентифікації B7-H3 доменів, втягнутих у зв‘язування людського B7-H3 з його нативними лігандами або антиB7-H3 антитілами. Таким чином, винахід забезпечує B7-H3 агоністи, антагоністи та модулятори з молекулярними структурами, які дублюють або імітують один або більше анти-B7-H3 зв‘язувальних доменів людського B7-H3. Як використовується в даній заявці, термін “B7-H3 варіант” означає будь-який амінокислотний варіант людського B7-H3, включаючи варіанти на основі амінокислотної заміни, 12 UA 110789 C2 5 10 15 20 25 30 35 40 45 50 55 60 делеції та вставки, або будь-якої їх комбінації. Визначення охоплює химерні молекули, такі, як химера людський B7-H3/ не-людський та інші гібридні молекули. Також у це визначення є включеним будь-який фрагмент варіантів B7-H3 молекули, що включає варіант або гібридну(і) ділянку(и) молекули. Як використовується в даній заявці, “антитіло” являє собою молекулу імуноглобуліну, здатну до специфічного зв‘язування з мішенню, такою, як вуглевод, полінуклеотид, ліпід, поліпептид, тощо, за допомогою принаймні одного антигенного сайту впізнання, розміщеного у варіабельній ділянці молекули імуноглобуліну. Як використовується в даній заявці, термін охоплює не тільки поліклональні або моноклональні антитіла, але також їх фрагменти (такі, як Fab, Fab', F(ab')2 Fv), одиничні ланцюги (ScFv), їх мутанти, існуючі в природі варіанти, злиті білки, що включають частину антитіла із сайтом впізнання антигену необхідної специфічності, гуманізовані антитіла, химерні антитіла, “BiTEs®,” “DART™” молекули та будь-які інші модифіковані конфігурації молекули імуноглобуліну, що включають сайт впізнання антигену необхідної специфічності. Термін “BiTE” (біспецифічні захоплюючі T-клітини) відноситься до одноланцюгових поліпептидних молекул, які мають два антигензв‘язувальні домени, один з яких зв‘язується з Tклітинним антигеном, а другий зв‘язується з антигеном, присутнім на поверхні мішені (WO 05/061547; Baeuerle, P та ін. (2008) “BiTE®: A New Class Of Antibody That Recruit T Cells,” Drugs of the Future 33: 137-147; Bargou, та ін. 2008) “Tumor Regression in Cancer Patients by Very Low Doses of a T Cell-Engaging Аntibody,” Science 321: 974-977). Термін “DART™” (перенацілювальний реагент з подвійною афінністю) відноситься до імуноглобулінової молекули, що включає принаймні два поліпептидні ланцюги, що об‘єднуються (зокрема, шляхом ковалентної взаємодії) з утворенням принаймні двох епітопзв‘язувальних сайтів, які можуть впізнавати ті самі або відмінні епітопи. Кожний з поліпептидних ланцюгів DART™ включає варіабельну ділянку легкого ланцюга імуноглобуліну та варіабельну ділянку важкого ланцюга імуноглобуліну, проте ці ділянки не взаємодіють з утворенням епітопзв‘язувального сайту. Переважніше варіабельна ділянка важкого ланцюга імуноглобуліну одного (наприклад, першого) DART™ поліпептидного ланцюга взаємодіє з варіабельною ділянкою легкого ланцюга імуноглобуліну відмінного поліпептидного ланцюга (наприклад, другого) DART™ з утворенням епітопзв‘язувального сайту. Подібно до цього, варіабельна ділянка легкого ланцюга імуноглобуліну одного поліпептидного ланцюга (наприклад, першого) DART™ взаємодіє з варіабельною ділянкою важкого ланцюга імуноглобуліну відмінного поліпептидного ланцюга (наприклад, другого) DART™ з утворенням епітопзв‘язувального сайту. DART™ можуть бути моноспецифічними, біспецифічними, триспецифічними, тощо, та, таким чином, є здатними до одночасного зв‘язування одного, двох, трьох або більше різних епітопів (які можуть являти собою однакові або різні антигени). DART™ можуть додатково бути моновалентними, бівалентними, тривалентними, тетравалентними, пентавалентними, гексавалентними, тощо, та, таким чином, є здатними до одночасного зв‘язування однієї, двох, трьох, чотирьох, п‘яти, шести або більше різних молекул. Ці дві властивості DART™ (тобто, ступінь специфічності та валентності можуть бути поєднані, наприклад, для одержання біспецифічних антитіл (тобто, здатних до зв‘язування двох епітопів) що є тетравалентними (тобто, є здатними до зв‘язування чотирьох наборів епітопів), тощо. DART™ молекули розкриваються у публікаціях РСТ WO 2006/113665, WO 2008/157379 та WO 2010/080538. Термін “моноклональне антитіло” відноситься до гомогенної популяції антитіла, в якій моноклональне антитіло включає амінокислоти (існуючі в природі та такі, що не існують в природі), що є втягненими у селективне зв‘язування антигену. Моноклональні антитіл є високо специфічними та направленими проти антигенного сайту. Термін “моноклональне антитіло” охоплює не тільки інтактні моноклональні антитіла та повнорозмірні моноклональні антитіл, а також їх фрагменти (такі, як Fab, Fab', F(ab')2 Fv), одиничні ланцюги (ScFv), їх мутанти, злиті білки, що включають частину антитіла, гуманізовані моноклональні антитіла, химерні моноклональні антитіла та будь-які інші модифіковані конфігурації імуноглобулінових молекул, що включають сайт впізнання антигену необхідної специфічності та мають здатність до зв‘язування антигену. Термін не є призначеним для обмеження джерелом одержання антитіла або способом, за допомогою якого його одержують (наприклад, при використанні гібридоми, фагової селекції, рекомбінантної експресії, трансгенних тварин, тощо). Термін включає цільні імуноглобуліни, а також їх фрагменти, тощо, описані вище, що підпадають під визначення “антитіло.” Термін “гуманізоване антитіло” відноситься до химерних молекул, які звичайно одержують при використанні рекомбінантних методик, що мають сайт зв‘язування антигену, який походить від імуноглобуліну з видів, відмінних від людини, та іншу структуру молекулу імуноглобуліну, що базується на структурі та /або послідовності людського імуноглобуліну. Антигензв‘язувальний 13 UA 110789 C2 5 10 15 20 25 30 35 40 45 50 55 60 сайт може включати або повні варіабельні домени, злиті на константних доменух, або тільки ділянки, що визначають комплементарність (CDR), прищеплені на прийнятні каркасні ділянки у варіабельних доменух. Антигензв‘язувальні сайти можуть бути дикого типу або модифіковані за допомогою однієї або більше амінокислотних замін. Це усуває константні ділянки як імуноген у людських індивідуумах, проте здатність до імунної відповіді на сторонні варіабельні ділянки залишається (LoBuglio, A.F. та ін. (1989) “Mouse/Human Chimeric Monoclonal Antibody In Man: Kinetics And Immune Response,” Proc. Natl. Acad. Sci. (U.S.A.) 86: 4220-4224). Інший підхід фокусується не тільки на забезпеченні константних ділянок, що походять від людини, але й на модифікації варіабельних ділянок, а також на переформуванні їх для того, щоб вони були більш близькими до людської форми. Є відомим, що варіабельні ділянки як важкого, так і легкого ланцюгів, містять три ділянки, що визначають комплементарність (CDR), які варіюють у відповідь на певний антиген та визначають здатність до зв‘язування, фланковані чотирма каркасними ділянками (FR), які є відносно консервативними у даних видів та які путативно забезпечують утворення CDR. Коли не-людські антитіла одержують стосовно певного антигену, варіабельні ділянки можуть бути "переформовані" або “гуманізовані” за допомогою прищеплення CDR, які походять від не-людського антитіла, FR, що є присутніми у людському антитілі, яке піддається модифікації. Застосування цього підходу до різноманітних антитіл було описане Sato, K. та ін. (1993) Cancer Res 53 :851-856. Riechmann, L. та ін. (1988) “Reshaping Human Antibodies for Therapy,” Nature 332: 323-327; Verhoeyen, M. та ін. (1988) “Reshaping Human Antibodies: Grafting An Antilysozyme Activity,” Science 239: 1534-1536; Kettleborough, C. A. та ін. (1991) “Humanization Of A Mouse Monoclonal Antibody By CDR-Grafting: The Importance Of Framework Residues On Loop Conformation,” Protein Engineering 4: 773-3783; Maeda, H. та ін. (1991) “Construction Of Reshaped Human Antibodies With HIV-Neutralizing Activity,” Human Antibodies Hybridoma 2: 124-134; Gorman, S. D. та ін. (1991) “Reshaping A Therapeutic CD4 Antibody,” Proc. Natl. Acad. Sci. (U.S.A.) 88: 4181-4185; Tempest, P.R. та ін. (1991) “Reshaping A Human Monoclonal Antibody To Inhibit Human Respiratory Syncytial Virus Infection in vivo,” Bio/Technology 9: 266-271; Co, M. S. та ін. (1991) “Humanized Antibodies For Antiviral Therapy,” Proc. Natl. Acad. Sci. (U.S.A.) 88: 2869-2873; Carter, P. та ін. (1992) “Humanization Of An Antip185her2 Antibody For Human Cancer Therapy,” Proc. Natl. Acad. Sci. (U.S.A.) 89: 4285-4289; and Co, M.S. та ін. (1992) “Chimeric And Humanized Antibodies With Specificity For The CD33 Antigen,” J. Immunol. 148: 1149-1154. В деяких втіленнях гуманізовані антитіла зберігають усі CDR послідовності (наприклад, гуманізоване мишаче антитіло, яке містить усі шість CDR з мишачого антитіла). В інших втіленнях гуманізовані антитіла мають один або більше CDR (один, два, три, чотири, п‘ять, шість), які є зміненими у порівнянні із вихідним антитілом, які також називаються одним або більше CDR, що “походять від” одного або більше CDR з вихідного антитіла. Як використовується в даній заявці, антитіло або поліпептид, як кажуть, “специфічно” зв‘язує ділянки іншої молекули (тобто, епітопу), якщо воно реагує або асоціюється частіше, швидше, з більшої тривалістю та/або з більшою афінністю з епітопом, спорідненим з альтернативним епітопом. Наприклад, антитіло, що специфічно зв‘язується з B7-H3 епітопом, являє собою антитіло, що зв‘язує цей B7-H3 епітоп з більшою афінністю, авідністю, зв‘язує більш легко, та/або з більшою тривалістю, ніж воно зв‘язується з B7-H3 eпітопами або не-B7-H3 eпітопами. Є також зрозумілим при читанні цього визначення, що, наприклад, антитіло (або залишок, або епітоп), який специфічно зв‘язується з першою мішенню може специфічно або переважно зв‘язуватися з другою мішенню або може не зв‘язуватися з нею. Як таке, “специфічне зв‘язування” з необхідністю не вимагає (незважаючи на те, що може включати) виключне зв‘язування. В загальному випадку, проте без необхідності, посилання на зв‘язування означає “специфічне” зв‘язування. Як використовується в даній заявці, термін “що є імунологічно активним” при посиланні на епітоп або “залишається імунологічно активним” відноситься до здатності антитіла (наприклад, анти-B7-H3 антитіла) зв‘язуватися з епітопом за різних умов, наприклад, після того, як епітоп піддавали дії відновних умов та умов денатурації. Різні біологічні функції асоціюються з анти-B7-H3 антитілами, включаючи, але не обмежуючись один або більше з: здатність до специфічного зв‘язування з B7-H3 (та, зокрема, з B7-H3 молекулами, що експресуються на поверхні ракових клітин, включаючи, але без обмеження, нирки, передміхурову залозу або легені, ракові клітини); здатність до конкурентного інгібування переважного зв‘язування відомого анти-B7-H3 антитіла з B7-H3, включаючи здатність до переважного зв‘язування з тим самим B7-H3 епітопом, з яким переважно зв‘язується вихідне антитіло; здатність зв‘язуватися з частиною B7-H3, що міститься на поверхні живої клітини in vitro або in vivo; здатність зв‘язуватися з частиною B7-H3, що міститься на поверхні живої ракової клітини, такої, як, але без обмеження, ракові клітини передміхурової 14 UA 110789 C2 5 10 15 20 25 30 35 40 45 50 55 60 залози, легенів або нирок, здатність до доставки хіміотерапевтичного агента до ракових клітин (до таких, як ракові клітини нирки, передміхурової залози або легень), що експресують B7-H3 на своїй поверхні; та/або здатність до доставки терапевтичного агента або здатного до визначення маркера у ракові клітини, що експресують B7-H3 на своїй поверхні. Як обговорюється в даній заявці, поліпептиди (включаючи антитіла) згідно з винаходом можуть мати будь-яку одну або більше таких характеристик. “Анти-B7-H3 eквівалентне антитіло” або “анти-B7-H3 еквівалентний поліпептид” відноситься до антитіла або поліпептиду, що має одну або більше біологічних функцій, які асоціюються з анти-B7-H3 антитілом, таку, як, наприклад, зв‘язувальна специфічність. Як використовується в даній заявці, термін “aгент” відноситься до біологічної, фармацевтичної або хімічної сполуки. Необмежувальні приклади включають прості та складні неорганічні та органічні молекули, пептид, білок, олігонуклеотид, антитіло, похідне антитіла, фрагмент антитіла, похідне вітаміну, вуглевод, токсин або хіміотерапевтичну сполуку. Можуть синтезуватися різноманітні сполуки, наприклад, малі молекули та олігомери (наприклад, олігопептиди та олігонуклеотиди) та синтетичні органічні сполуки, що базуються на різноманітних корових структурах. Крім того, різноманітні природні джерела можуть забезпечувати сполуки для скринінгу, такі, як рослинні або тваринні екстракти, та подібні до них. Агенти, що використовуються у способах згідно з даним винаходом, можуть піддавати грубому відбору, раціональному відбору або конструюватися. Як використовується в даній заявці, кажуть, що агент є грубо відібраний тоді, коли агент вибирають без попереднього розгляду або знань специфічних амінокислотних або інших хімічних залишків, які є втягненими в асоціацію молекули з її нативним(и) партнером(ами) зв‘язування або відомими антитілами. Приклад випадковим чином відібраного агента являє собою агент, який був ідентифікований при використанні та скринінгу хімічної бібліотеки або пептидної комбінаторної бібліотеки. Як використовується в даній заявці, коли кажуть, що агент є раціонально відібраним або сконструйованим, то у цьому випадку агент вибирають на невипадковій основі, що бере до уваги послідовність цільового сайта та/або його конформацію у зв‘язку з дією агента. У зв‘язку з анти-B7-H3 агентами зараз передбачається, що існує принаймні три епітопи на B7-H3, до яких утворюються антитіла, та, таким чином, принаймні три сайти дії для агентів, які блокують B7H3/анти-B7-H3 взаємодію. Даний винахід також охоплює агенти, що діють при сайтах взаємодії між B7-H3 та його нативним партнером зв‘язування, незважаючи на те, що інші ліганди та їх активні B7-H3-інтерактивні сайти, або такі, що є відомими на сьогоднішній день, або такі, що ідентифіковані пізніше, також охоплюються об‘ємом даного винаходу. Агенти можуть бути раціонально відібрані або раціонально сконструйовані при використанні пептидних послідовностей, які складають сайти контакту рецептор/ліганд та/або комплекс B7-H3/анти-B7H3 антитіло. Наприклад, раціонально відібраний пептидний агент може бути пептидом, амінокислотна послідовність якого є ідентичною з епітопом, який виявляється на B7-H3, оскільки він розміщується на поверхні живої клітини в її нативному оточенні. Такий агент буде знижувати або блокувати асоціацію анти-B7-H3 антитіла з B7-H3 або асоціацію B7-H3 з його нативним лігандом, як є бажаним, шляхом зв‘язування з анти-B7-H3 антитілом або його нативним лігандом. Як використовується в даній заявці, термін “мічений” стосовно антитіла є призначеним для охоплення безпосереднього мічення антитіла шляхом злиття (тобто, фізичного зв‘язування) з речовиною, здатною до визначення, такою, як радіоактивний агент або флуорофор (наприклад, фікоеритрин (PE) або флуоресцеїн ізотіоціанат (який також є відомим як фторізотіоціанат або FITC)) з антитілом, а також опосередкованого зв‘язування зонда або антитіла при використанні реактивності зі здатною до визначення речовиною. Як використовується в даній заявці, термін “асоціація” стосовно до антитіла, включає ковалентне та нековалентне приєднання або зв'язування агента (наприклад, хіміотерапевтичного агента) з антитілом. Антитіло може бути асоційованим з агентом (наприклад, хіміотерапевтичним агентом) шляхом безпосереднього зв‘язування або опосередкованого зв‘язування шляхом приєднання до загальної платформи, так, що антитіло направляє локалізацію агента до ракових клітин, з якими зв‘язується антитіло, та де антитіло та агент не піддаються суттєвій дисоціації при фізіологічних умовах, так, що агент не є націленим на ту саму ракову клітину, з якою зв‘язується антитіло, або так, що ефективність агента не знижується. Термін "біологічний зразок" включає в себе різні типи зразків, які отримані від індивідуума та які можуть використовуватися в діагностичних аналізах або при моніторингу. Визначення включає в себе слину, кров та інші зразки рідин біологічного походження, тверді зразки тканин, такі, як шматочки біопсії або культури тканин або клітин, що походять від них, та їх потомство, 15 UA 110789 C2 5 10 15 20 25 30 35 40 45 50 55 60 наприклад, клітини, що одержують із зразка тканини від особи, яка передбачається як така, що має рак, у переважному втіленні з яєчників, легенів, простати, підшлункової залози, товстої кишки та тканини молочної залози. Визначення також включає зразки, які піддавалися обробці будь-яким чином після їх одержання, такій, як обробка реагентом, солюбілізація або збагачення на деякі компоненти, такі, як білки або полінуклеотиди, або включення у напівтвердий або твердий матрикс для цілей одержання зрізів. Термін "біологічний зразок" включає в себе клінічні зразки, а також включає клітини у культурі, клітинні супернатанти, клітинні лізати, сироватку, плазму, біологічні рідини та зразки тканини. Термін "клітина-хазяїн" включає окремі клітини або культуру клітин, які можуть являти собою або являли собою рецепієнта для вектора(ів) для введення полінуклеотидної вставки. Хазяйські клітини включають потомство однієї клітини-хазяїна, при цьому потомство не обов'язково може бути повністю ідентичним (за морфологією або за комплементом геномної ДНК) з вихідною батьківською клітиною завдяки природним, випадковим або навмисних мутаціям. Хазяйські клітини включають клітини, трансфіковані in vivo за допомогою полінуклеотиду(ів) згідно з даним винаходом. Як використовується в даній заявці, термін "затримка розвитку метастазів" означає відстрочку, запобігання, уповільнення, гальмування, стабілізацію та/або віддалення розвитку метастазів. Ця затримка може складати різні проміжки часу, в залежності від історії раку та/або індивідуумів, яких піддають лікуванню. Як є очевидним для фахівця в даній галузі техніки, достатня або значна затримка може, по суті, охоплювати профілактику, в тому, що індивідуум не розвиває метастази. Як використовується в даній заявці, “ефективна кількість” фармацевтичної композиції в одному з втілень являє собою кількість, достатню для одержання корисних або бажаних результатів, включаючи, але без обмеження, клінічні результати, такі, як зменшення розмірів пухлини (в контексті раку, наприклад, раку молочної залози або раку передміхурової залози), уповільнення росту ракових клітин, відстрочення розвитку метастазів, зменшення симптомів в результаті захворювання, підвищення якості життя людей, які страждають від захворювання, зниження дози інших препаратів, необхідних для лікування захворювання, сприяння ефекту інших лікарських засобів, як, наприклад, за допомогою націлювання та/або інтерналізації, затримку розвитку захворювання, та/або подовження виживання людей. Ефективну кількість можна вводити за допомогою одного або більше введень. Для цілей цього винаходу ефективна кількість препарату, сполуки або фармацевтичної композиції являє собою кількість, достатню для зниження проліферації (або руйнування) ракових клітин та зменшення та/або затримку розвитку або росту метастазів ракових клітин, або безпосередньо або опосередковано. У деяких втіленнях ефективна кількість препарату, сполуки або фармацевтичної композиції може бути досягнута або не може бути досягнута у поєднанні з іншим лікарським засобом, сполукою або фармацевтичною композицією. Таким чином, "ефективна кількість" може бути розглянута в контексті введення одного або більше хіміотерапевтичних агентів, та одиничний агент може розглядатися як такий, що вводиться в ефективній кількості, якщо, в поєднанні з одним або більше іншими агентами, бажаний результат може бути досягнутий або досягається. Незважаючи на те, що індивідуальні потреби варіюють, визначення оптимальних інтервалів ефективних кількостей кожного компонента знаходиться у межах знань в даній області техніки. Звичайна доза включає від 0,1 до 100 мг/кг/маси тіла. Переважні дози включаються від 1 до 100 мг/кг/маси тіла. Найбільш бажані дози включаються від 10 до 100 мг/кг/маси тіла. Як використовується в даній заявці, кажуть, що молекула нуклеїнової кислоти або агент, антитіло, композиція або клітина, тощо, є “ізольованою” тоді, коли ця молекула нуклеїнової кислоти або агент, антитіло, композиція або клітина, тощо, є суттєво відокремленою від контамінантних молекул нуклеїнової кислоти, антитіл, агентів, композицій або клітин, тощо, що у природі є присутніми в їх природному джерелі. Термін “індивідуум” відноситься до хребетної тварини, переважно ссавців. Ссавці включають, але без обмеження, людей, сільськогосподарських тварини, спортивних тварини, домашніх тварин, приматів, мишей та щурів. У найбільш бажаному втіленні термін індивідуум означає людини. Терміни "поліпептид", "олігопептид", "пептид" та "білок" використовуються тут як взаємозамінні для позначення полімерів амінокислот будь-якої довжини. Полімер може бути лінійним або розгалуженим, він може включати модифіковані амінокислоти, та він може бути перерваний хімічними структурами, відмінними без амінокислот. Терміни також охоплюють амінокислотні полімери, які були змінені природно або шляхом втручання людини; наприклад, шляхом утворення дисульфідних зв'язків, глікозилювання, ліпідування, ацетилювання, фосфорилювання або будь-яких інших маніпуляцій або модифікацій, таких, як кон‘югація з 16 UA 110789 C2 5 10 15 20 25 30 35 40 45 50 55 60 компонентом для мічення. Також включеними у визначення є, наприклад, поліпептиди, що містять один або більше аналогів амінокислот (включаючи, наприклад, неприродні амінокислоти та інші), а також інші модифікації, що є відомими в даній галузі. Зрозуміло, що, оскільки поліпептиди згідно з даним винаходом базуються на антитілі, поліпептиди можуть утворюватися у вигляді одного ланцюга або як зв‘язані ланцюги. Також даним винаходом охоплюються пептидоміметики B7-H3 пептидних агоністів, антагоністів та модуляторів (включаючи анти-B7-H3 антитіла) описані в даній заявці. Такі пептидоміметики включають пептиди, в яких принаймні один амінокислотний залишок є заміщеним залишком амінокислоти, що не зустрічаються у природі, такими, як ізомер D амінокислот або N-алкіловані види амінокислот. В інших втіленнях пептидоміметики утворюються шляхом заміни принаймні одного амідного зв'язку (-C(=O)-NH-) в B7-H3 пептидному агоністі, антагоністі або модуляторах амідним ізостером. Прийнятні амідні ізостери включають –CH2−NH−, –CH2−S−, –CH2−S(O)−, –CH2−S(O)2−, –CH2−CH2−, –CH=CH− (E або Z форма), −C(=O)−CH2−, –CH(CN)−NH−, –C(OH)−CH2−та −O−C(=O)−NH−. Амідні зв‘язки в B7-H3 пептидному агоністі, антагоністі або модуляторі, що є прийнятними кандидатами для заміщення за допомогою амідних ізостерів, включають зв‘язки, що є здатними до гідролізу за допомогою ендогенних естераз або протеаз у суб‘єкта, призначеного для лікування при використанні B7-H3 пептидного агоніста, aнтагоніст або модулятора. Як використовується в даній заявці, термін "суттєво чистий" відноситься до матеріалу, який складає не менше 50% чистого (тобто вільного від забруднення), більш переважно принаймні на 90% є чистим, більш переважно принаймні на 95%, більш переважно принаймні на 98%, більш переважно, принаймні на 99% є чистим, та найбільш переважно більше ніж на 99% є чистим. Як використовується в даній заявці, термін “токсин” відноситься до будь-якої речовини, яка викликає шкідливий ефект у клітині. Наприклад, токсин, направлений на ракову клітину, буде мати шкідливий, іноді руйнівний ефект, на ракову клітину. Приклади токсинів включають, але без обмеження такими, таксан, майтансиноїд, аурістатин (наприклад, монометил ауристатин (MMAE), монометил ауристатин F (MMAF), ауристатин E (AE), тощо) (такі, як ті, що є розкритими у патентах США № 5,208,020; 5,416,064; 6,333,410; 6,340,701; 6,372,738; 6,436,931; 6,441,163; 6,596,757; 7,276,497; 7,585,857; або 7,851,432), каліхеаміцин, антрациклін (наприклад, доксорубіцин), CC-1065 аналог, доцетаксел, катепсин B або E; рицин, гелонін, eкзoтоксин Pseudomonas, дифтерійний токсин, та РНКазу; радіоактивно мічені антитіла (наприклад, 90 131 тіуксетан-кон‘юговані або мічені за допомогою токсичного радіоізотопу (наприклад, Y; I, 177 186 188 211 212 213 225 Lu, Re, Re, At, Bi, Bi, Ac, тощо). Як використовується в даній заявці, терміни "лікування" або "процес лікування" означають підхід для отримання корисного або бажаного результату, включаючи та переважно корисного або бажаного клінічного результату. Такі корисні або бажані клінічні результати включають, але без обмеження такими, один або більше з наступних: зниження проліферації (або знищення) ракових клітин або інших хворих клітин, зниження метастазів ракових клітин, що виявляються при ракових захворюваннях, зменшення розмірів пухлини, зменшення симптомів в результаті захворювання, підвищення якості життя людей, які страждають від захворювання, зниження дози інших препаратів, необхідних для лікування захворювання, затримку розвитку захворювання та/або подовження виживання індивідуумів. Як використовується в даній заявці, термін "рак" є призначеним для охоплення видів раку, які характеризуються наявністю ракової клітини, вибраної з групи, яка складається з клітини пухлини надниркової залози, раку, асоційованого зі СПІДом, альвеолярної саркоми м‘яких тканин, астроцитарної пухлини, раку жовчного міхура, раку кісток, раку головного та спинного мозку, метастатичного раку мозку, раку молочної залози, пухлин каротидного гломуса, раку шийки матки, хондросаркоми, хордоми, хромофобної карциноми ниркових клітин, гіпернефроїдної пухлини нирки, раку кишечника, колоректального раку, шкірної доброякісної фіброзної гістіоцитоми, десмопластичної дрібнокруглоклітинної пухлини, епіндимоми, саркоми Юїнга, позаскелетної міксоїдної хондросаркоми, фіброгенного недовершеного остоегенезу, фіброзної дисплазії кісток, раку жовчного міхура або жовчної вивідної протоки, раку шлунковокишкового тракту, гестаційного трофобластного захворювання, пухлини зародкової клітини, раку голови та шиї, карциноми печінкових клітин, пухлини острівкових клітин, саркоми Капоші, раку нирки, лейкемії, ліпоми/доброякісної ліпоматозної пухлини, ліпосаркоми/злоякісної ліпоматозної пухлини, печінкового раку, лімфоми, раку легень, медулобластоми, меланоми, менінгіоми, множинної ендокринної неоплазії, множинної мієломи, мієлодиспластичного синдрому, нейробластоми, нейроендокринних пухлин, раку яєчника, раку підшлункової залози, папілярної карциноми щитовидної залози, пухлини паращитовидної залози, педіатричного раку, пухлини 17 UA 110789 C2 5 10 15 20 25 30 35 40 45 50 55 60 капсули периферичного нерву, феохромоцитоми, пухлини гіпофізу, раку передміхурової залози, задньої ювеальної меланоми, виключного гематологічного розладу, ниркового метастатичного раку, паличковидної пухлини, рабдоміосаркоми, саркоми, раку шкіри, саркоми м‘яких тканин, раку лускатих клітин, раку шлунка, синовіальної саркоми, тестикулярної саркоми, тимусної карциноми, тимоми, метастатичного раку щитовидної залози та раку матки. III. Способи створення антитіл та поліпептидів Способи створення моноклональних антитіл є відомими у галузі техніки. Один спосіб, який може використовуватися, являє собою метод Kohler, G. та ін. (1975) “Continuous Cultures Of Fused Cells Secreting Аntibody о Of Predefined Specificity,” Nature 256: 495-497, або його модифікацію. Типово, моноклональні антитіла одержують у видів, відмінних від людини, таких, як миші. В загальному випадку, миші або пацюки використовуються для імунізації, але інші тварини також можуть використовуватися. Антитіла одержують шляхом імунізації мишей імуногенною кількістю клітин, клітинних екстрактів або препаратів білка, які містять людський B7-H3. Імуноген може являти собою, але не обмежуючись такими, первинні клітини, культури ліній клітин, ракові клітини, нуклеїнові кислоти або тканини. В одному втіленні використовуються клітини людської карциноми легенів. Клітини, які використовуються для імунізації, наприклад, такі чоловічої статевої залози або аденокарциноми підшлункової залози, або клітини шлунка, можуть культивуватися протягом певного періоду часу (наприклад, протягом принаймні 24 годин) до їх використання як імуногена. Клітини (наприклад, такі чоловічої статевої залози, шлунка або клітини аденокарциноми підшлункової залози) можуть використовуватися як імуногени самі по собі або у поєднанні з неденатуруючим ад'ювантом, таким, як Ribi. В загальному випадку, клітини повинні бути інтактними та переважно бути життєздатними при використанні як імуногенів. Інтактні Т-клітини можуть дозволити проводити краще визначення антигенів, ніж виявити пошкоджені клітини, отримані від імунізованої тварини. Використання денатуруючих або жорстких ад'ювантів, наприклад, ад'юванта Фрейнда, може призвести до розриву клітин, та тому їх використання не рекомендується. Імуноген може бути введений кілька разів через певні проміжки часу, наприклад, раз на два тижні, або на тиждень, або може бути введений таким чином, щоб підтримувати життєздатність тварини (наприклад, в рекомбінантній тканині). В одному втіленні моноклональні антитіл, що зв‘язуються з B7-H3, одержують при використанні хазяйських клітин, які понадекспресують B7-H3 як імуноген. Такі клітини включають, як приклад, але без обмеження такими, клітин легеневої карциноми людини та клітини раку товстого кишечнику людини. Для моніторингу антитілогенезу невеликий біологічний зразок (наприклад, кров) можуть одержувати від тварин та перевіряти на титр антитіла проти імуногена. Селезінка та/або декілька великих лімфатичних вузлів можуть бути видалені та дисоційовані на одиничні клітини. При бажанні клітини селезінки можуть піддаватися скринінгу (після видалення клітин, що приєдналися неспецифічно) шляхом перенесення клітинної суспензії на чашку або пластину, покриту антигеном. B-клітини, що експресують зв‘язаний з мембраною імуноглобулін, специфічний для антигену, будуть зв'язуватися з пластиною, та не змиваються з при використанні решти суспензії. В результаті цього B-клітини або всі дисоційовані клітини селезінки можуть бути злиті з мієломною клітиною (наприклад, X63-Ag8.653 та такими із SaIk Institute, Cell Distribution Center, San Diego, CA). Поліетиленгліколь (PEG) може використовуватися для злиття клітин селезінки або лімфоцитів з мієломними клітинами, щоб сформувати гібридоми. Гібридому потім культивують у селективному середовищі (наприклад, у середовищі на основі гіпоксантину, аміноптерину, тимідину, яке є відомим як "середовище НАТ"). Одержані гібридоми потім переносять шляхом обмежувального розведення та піддають аналізу на продукцію антитіл, які спеціфічно зв‘язуються з імуногеном, при використанні, наприклад, скринінгу на основі FACS (сортування флуоресцентно активованих клітин) або імуногістохімії (IHC). Відібрані гібридоми, що секретують моноклональне антитіло, потім культивують або in vitro (наприклад, у колбах для культури тканин або ферментерах із системою порожнистих волокон), або in vivo (наприклад, як асцити у мишей). Як ще одну альтернативу до методики злиття клітин для одержання моноклональних антитіл згідно з даним винаходом можуть використовуватися іморталізовані вірусом ЕпштейнаБарр (EBV) B клітини. Гібридоми розмножують та піддають субклонуванню, при бажанні, та супернатанти аналізують на анти-імуногенну активність звичайними методами аналізу (наприклад, FACS, IHC, радіоімуноаналіз, імуноферментний аналіз, флуоресцентний імуноаналіз і т.д.). Згідно з іншою альтернативою анти-B7-H3 моноклональне антитіло та будь-яке інше еквівалентне антитіло можуть бути секвеновані та одержані рекомбінантними способами, 18 UA 110789 C2 5 10 15 20 25 30 35 40 45 50 55 60 відомими в даній галузі (наприклад, гуманізація, використання трансгенних мишей для продукції повністю людських антитіл, технологія фагового дисплею і т.д. ). В одному втіленні анти-B7-H3 моноклональне антитіло піддають секвенуванню, та полінуклеотидну послідовність потім клонують у вектор для експресія або розмноження. Послідовність, що кодує антитіло, яке представляє інтерес, може підтримуватися у векторі в хазяйській клітині, та хазяйська клітина може потім піддаватися розмноженню та заморожуватися для подальшого використання. Полінуклеотидна послідовність анти-B7-H3 моноклонального антитіла та будь-яких інших еквівалентних антитіл може використовуватися для генетичних маніпуляцій для створення "гуманізованого" антитіла, для поліпшення афінності або інших характеристик антитіла. Загальний принцип гуманізації антитіла включає збереження основних послідовності антигензв'язувальної частини антитіла при заміні не-людської частини, що залишилася, на послідовності з людського антитіла. Існують чотири основні етапи гуманізації моноклонального антитіла. До них відносяться: (1) визначення нуклеотидної та передбаченої амінокислотної послідовності варіабельних доменів легкого та важкого ланцюгів вихідного антитіла (2) конструювання гуманізованого антитіла, тобто визначення, які каркасні ділянки антитіла використовувати для процесу гуманізації (3) методики/способи фактичної гуманізації та (4) трансфекція та експресія гуманізованого антитіла. Див., наприклад, патенти США №№ 4816567; 5807715; 5866692; та 6331415. Був описаний ряд молекул “гуманізованого” антитіла, що включають антигензв‘язувальний сайт, які походять від не-людського імуноглобуліну, включаючи химерні антитіла, що мають V ділянки пацюків або модифіковані V ділянки пацюків та асоційовані з ними ділянки, що визначають комплементарність (CDR), злиті з людськими константними доменами (див., наприклад, Winter та ін. (1991) “Man-made Anditbodies,” Nature 349: 293-299; Lobuglio та ін. (1989) “Mouse/Human Chimeric Monoclonal Antybody In Man: Kinetics And Immune Response,” Proc. Natl. Acad. Sci. (U.S.A.) 86: 4220-4224 (1989), Shaw та ін. (1987) “Characterization Of A Mouse/Human Chimeric Monoclonal Antybody (17-1A) To A Colon Cancer Tumor-Associated Аntigen,” J. Immunol. 138: 4534-4538, та Brown та ін. (1987) “Tumor-Specific Genetically Engineered Murine/ Human Chimeric Monoclonal Antybody,” Cancer Res. 47: 3577-3583). Інші посилання описують CDR пацюків, прищеплені на ділянки, що підтримують каркасну ділянку (FR) людини, перед злиттям з прийнятним константним доменом людського антитіла (див., наприклад, Riechmann, L. та ін. (1988) “Reshaping Human Antibodies for Therapy,” Nature 332: 323-327; Verhoeyen, M. та ін. (1988) “Reshaping Human Antibodies: Grafting An Antilysozyme Activity,” Science 239: 1534-1536; та Jones та ін. (1986) “Replacing The ComplementarityDetermining Regions In A Human Antibody With Those From A Mouse,” Nature 321: 522-525). Інше посилання описує CDR пацюків, що підтримуються рекомбінантно фланкованими каркасними ділянками пацюків. Див, наприклад, публікацію європейського патенту № 519,596. Такі “гуманізовані” молекули конструюють для мінімізації небажаної імунологічної відповіді на молекули анти-людського антитіла пацюків, що обмежує тривалість та ефективність терапевтичних застосувань цих залишків у людських реципієнтів. Інші способи гуманізації антитіл, що можуть використовуватися, є розкритими Daugherty та ін. (1991) “Polymerase Chain Reaction Facilitates The Cloning, CDR-Grafting, And Rapid Експресія Of A Murine Monoclonal Antibody Directed Against The CD18 Component Of Leukocyte Integrins,” Nucl. Acids Res. 19: 24712476 та патенти США №№ 6,180,377; 6,054,297; 5,997,867; та 5,866,692. Винахід також охоплює фрагменти варіабельних ділянок одиничних ланцюгів (“scFv”) антитіл згідно з даним винаходом, такі, як mu-анти-B7-H3. Фрагменти варіабельних ділянок одиничних ланцюгів одержують шляхом зв‘язування варіабельних ділянок легкого та/або важкого ланцюга при використанні коротких зв‘язувальних пептидів. Bird та ін. (1988) (“SingleChain Аntigen-Binding Proteins,” Science 242: 423-426) описує принцип зв‘язування пептидів, що мають місток розміром приблизно 3,5 нм між карбокситермінальним кінцем однієї варіабельної ділянки та амінотермінальним кінцем іншої варіабельної ділянки. Були сконструйовані та використовуються лінкери, що мають інші послідовності (Bird та ін. (1988) “Single-Chain АntigenBinding Proteins,” Science 242: 423-426). Лінкери, у свою чергу, можуть бути модифіковані для здійснення інших функцій, таких, як приєднання лікарських засобів або приєднання до твердих поверхонь. Одноланцюгові варіанти можуть бути одержані або рекомбінантно, або синтетичним шляхом. Для синтетичного одержання scFv може використовуватися автоматичний синтезатор. Для рекомбінантної продукції ScF прийнятна плазміда, що містить полінуклеотид, який кодує ScFv, може бути введена у прийнятну хазяйську клітину або еукаріот, таку, як клітини дріжджів, рослин, комах або ссавців, або прокаріот, таких, як E. coli. Полінуклеотиди, які кодують ScFv, що представляє інтерес, можуть бути одержані шляхом звичайних маніпуляцій, таких, як лігування полінуклеотидів. Отримані ScFv можуть бути ізольовані при використанні стандартних методів 19 UA 110789 C2 5 10 15 20 25 30 35 40 45 50 55 60 очищення білка, що є відомими в даній галузі. Винахід включає модифікації антитіл та поліпептидів, які зв'язуються з B7-H3, та його агоністи, антагоністи та модулятори, включаючи функціонально еквівалентні антитіла та поліпептиди, що істотно не впливають на їх властивості, та варіанти, яки підвищують або знижують активність. Модифікація поліпептидів є звичайною практикою у даній галузі та не повинна докладно описуватися в даному документі. Приклади зміни поліпептидів включають поліпептиди з консервативними замінами амінокислотних залишків, одне або більше видалення або вставку амінокислот, які не викликають істотної шкідливої зміни функціональної активності, або використання хімічних аналогів. Амінокислотні залишки, які можуть бути консервативно замінені один на інший, включають але без обмеження такими: гліцин/аланін, валін/ізолейцин/лейцин, аспарагін/глютамін; аспарагінова кислота глутамінова кислота, серин/треонін, лізин/аргінін та фенілаланін/триозин. Ці поліпептиди також включають глікозильовані та неглікозильовані поліпептиди, а також поліпептиди з іншими посттрансляційними модифікаціями, такими як, наприклад, глікозилювання з різними цукрами, ацетилювання та фосфорилювання. Переважно, амінокислотні заміни будуть консервативними, тобто заміщені амінокислоти будуть володіти подібними хімічними властивостями, що й оригінальні амінокислоти. Такі консервативні заміни є відомими у галузі техніки та їх приклади були надані вище. Амінокислотні модифікації можуть варіюватися від зміни або зміни однієї або більше амінокислот до повного переконструювання ділянки, такої, як варіабельна ділянка. Зміни в варіабельних ділянках можуть змінити зв'язувальну афінність та/або специфічність. Інші методи модифікації здійснюють при використанні методик злиття, відомих в даній галузі, включаючи, але не обмежуючись такими, як ферментативні засоби, окисне заміщення та хелатування. Модифікації можуть бути використані, наприклад, для приєднання міток для імуноаналізу, таких, як введення радіоактивних фрагментів для радіоімуноаналізу. Модифіковані поліпептиди одержують при використанні добре відомих процедур та піддають скринінгу при використанні стандартних аналізів, відомих в даній галузі. Винахід також охоплює злиті білки, що включають один або більше фрагментів або ділянок з поліпептидів та антитіл згідно з даним винаходом. В одному втіленні забезпечується злитий поліпептид, який включає принаймні 10 послідовних амінокислот варіабельної ділянки легкого ланцюга та принаймні 10 амінокислот варіабельної ділянки важкого ланцюга. В іншому втіленні злитий поліпептид містить гетерологічну константну ділянку імуноглобуліну. В іншому втіленні злитий поліпептид містить варіабельні ділянки легкого ланцюга та варіабельні ділянки важкого ланцюга антитіла, одержаного з доступної гібридоми. Для цілей даного винаходу злитий білок антитіла містить один або більше поліпептидних доменів, що специфічно зв‘язуються з B7-H3, та іншу амінокислотну послідовність, до якої він не приєднується у нативній молекулі, наприклад, гетерологічну послідовність або гомологічну послідовність з іншої ділянки. Aнти-B7-H3 поліпептиди та інші B7-H3 агоністи, антагоністи та модулятори можуть бути створені за допомогою способів, відомих у галузі техніки, наприклад, синтетично або рекомбінантно. Один спосіб одержання B7-H3 пептидних агоністів, антагоністів та модуляторів втягує хімічний синтез поліпептидів, після чого здійснюють обробку за умов окиснення, прийнятних для одержання нативної конформації, іншими словами, правильних дисульфідних зв‘язків. Цього можна досягти при використанні методик, добре відомих спеціалістам у даній галузі техніки (див., наприклад, Kelley, R. F. та ін. (1990) In: GENETIC ENGINEERING PRINCIPLES AND METHODS, Setlow, J.K. ред., Plenum Press, N.Y., том 12, стор. 1-19; Stewart, J.M та ін. (1984) SOLID PHASE PEPTIDE SYNTHESIS, Pierce Chemical Co., Rockford, IL; див. також патенти США №№ 4,105,603; 3,972,859; 3,842,067; та 3,862,925). Поліпептиди згідно з винаходом можуть бути традиційно одержані при використанні твердофазного синтезу пептидів (Merrifield, B. (1986) “Solid Phase Synthesis,” Science 232(4748): 341-347; Houghten, R.A. (1985) “General Method For The Rapid Solid-Phase Synthesis Of Large Numbers Of Peptides: Specificity Of Antigen-Antibody Interaction At The Level Of Individual Amino Acids,” Proc. Natl. Acad. Sci. (U.S.A.) 82(15): 5131-5135; Ganesan, A. (2006) “Solid-Phase Synthesis In The Twenty-First Century,” Mini Rev. Med. Chem. 6(1): 3-10). Ще в одному альтернативному втіленні повністю людське антитіло може бути одержане за допомогою застосування комерційно доступних мишей, які були виведені для експресії специфічних білків людського імуноглобуліну. Трансгенні тварини, що є виведеними для продукування більш бажаної (наприклад, повного людського антитіла) або більш сильної імунної відповіді, можуть також використовуватися для одержання гуманізованих або людських антитіл. Приклади такої методики являють собою XENOMOUSE™ (Abgenix, Inc., Fremont, CA), HUMAB-MOUSE® та TC MOUSE™ (обидва від Medarex, Inc., Princeton, NJ). В альтернативному втіленні антитіла можуть бути створені рекомбінантно та експресовані 20 UA 110789 C2 5 10 15 20 25 при використанні будь-якого способу, відомого у галузі техніки. Антитіла можуть бути створені рекомбінантно спочатку за допомогою ізоляції антитіл, одержаних із організму тварини хазяїна, одержання послідовності гена та при використанні цієї послідовності гена для рекомбінантної експресії антитіла у хазяйських клітинах (наприклад, CHO клітинах). Інший спосіб, що може використовуватися, являє собою експресію послідовності антитіла у рослинах (наприклад, тютюну) або трансгенному молоці. Прийнятні способи для рекомбінантної експресії антитіл у рослинах або молоці були розкриті (див., наприклад, Peeters та ін. (2001) “Production Of Antibodies And Antibody Fragments In Plants,” Vaccine 19: 2756; Lonberg, N. та ін. (1995) “Human Antibodies From Transgenic Mice,” Int. Rev. Immunol 13: 65-93; та Pollock та ін. (1999) “Transgenic Milk As A Method For The Production Of Recombinant Antibodies,” J. Immunol Methods 231: 147157). Прийнятні способи для одержання похідних антитіл, наприклад, гуманізованих, одноланцюгових, тощо, є відомими у галузі техніки. В іншій альтернативі антитіла можуть бути створені рекомбінантно при використанні технології фагового дисплея (див., наприклад, патенти США №№ 5,565,332; 5,580,717; 5,733,743; 6,265,150; та Winter, G. та ін. (1994) “Making Аntibodies By Phage Display Technology,” Annu. Rev. Immunol. 12. 433-455). Антитіла або білок, що представляють інтерес, можуть піддаватися секвенуванню за допомогою деградації Едмана, яка є добре відомою спеціалісту у даній галузі техніки. Інформація про пептиди, одержана за допомогою мас-спектрометрії або деградації Едмана, може використовуватися для конструювання зондів або праймерів, які використовуються для клонування білка, що представляє інтерес. Альтернативний спосіб клонування білка, що представляє інтерес, здійснюється шляхом “пенінгу” при використанні очищеного B7-H3 або його частин для клітин, що експресують антитіло або білок, який представляє інтерес. B7-H3 існує у вигляді “2Ig” форми та у вигляді “4Ig” форми. Амінокислотна послідовність “2Ig” форми людського B7-H3 являє собою (SEQ ID NO:1): Послідовність кДНК, що кодує “2Ig” форму людського B7-H3, являє собою (SEQ ID NO:2): 30 Амінокислотна послідовність “2Ig” форми людського B7-H3 (SEQ ID NO:1) (приведена нижче, 21 UA 110789 C2 виділена жирним шрифтом та підкреслена) повністю є включеною у “4Ig” форму людського B7H3(SEQ ID NO:76): 5 Послідовність кДНК, що кодує “4Ig” форму людського B7-H3, являє собою (SEQ ID NO:77); залишки, що кодують “2Ig” форму B7-H3, виділені жирним шрифтом та підкреслені: 10 15 Процедура “пенінга” може проводитися шляхом одержання бібліотеки кДНК з тканин або клітин, що експресують B7-H3, понадекспресії кДНК у клітинах іншого типу та скринінгу трансфікованих клітин іншого типу на специфічне зв‘язування з B7-H3. Детальні описи способів, що використовуються у клонуванні генів ссавців, які кодують білки поверхні клітин, шляхом “пенінгу”, можуть бути знайдені у даній галузі техніки (див., наприклад, Aruffo, A. та ін. (1987) 22 UA 110789 C2 5 10 15 20 25 30 35 40 45 50 55 60 “Molecular Cloning Of A CD28 cDNA By A High-Efficiency COS Cell Expression System,” Proc. Natl. Acad. Sci. (U.S.A.) 84: 8573-8577 та Stephan, J. та ін. (1999) “Selective Cloning Of Cell Surface Proteins Involved In Organ Development: Epithelial Glycoprotein Is Involved In Normal Epithelial Differentiation,” Endocrinol. 140: 5841-5854). кДНК, які кодують анти-B7-H3 антитіла та інші B7-H3 пептидні агоністи, антагоністи та модулятори, можуть бути отримані шляхом зворотної транскрипції мРНК з конкретного типу клітин у відповідності зі стандартними методами, що є відомими у даній області. Зокрема, мРНК може бути ізольована при використанні різних літичних ферментів або хімічних розчинів у відповідності з процедурами, викладеними у Sambrook та ін., що приведені вище, або може бути екстрагована за допомогою комерційно доступних смол, що зв‘язують нуклеїнові кислоти у відповідності із супроводжувальними інструкціями виробників (наприклад, Qiagen, Invitrogen, Promega). Синтезовані кДНК потім вводять в експресійний вектор для одержання антитіла або білка, що представляє інтерес, у клітини іншого типу. Мається на увазі, що експресійний вектор повинен бути здатним до реплікації у хазяйських клітинах або як епісома, або як невід'ємна частина хромосомної ДНК. Прийнятні експресійні вектори включають, але без обмеження такими, плазміди, вірусні вектори, включаючи аденовіруси, адено-асоційовані віруси, ретровіруси та косміди. Вектори, що містять полінуклеотиди, які представляють інтерес, можуть бути введені у хазяйську клітину за допомогою будь-якого з ряду прийнятних засобів, включаючи електропорацію, трансфекцію з використанням хлориду кальцію, хлориду рубідію, фосфату кальцію, DEAE-декстрану або інших речовин; шляхом бомбардування мікрочастинками; ліпофекції та інфекції (наприклад, де вектор являє собою інфекційний агент, такий, як вірус коров'ячої віспи). Вибір векторів або полінуклеотидів, що вводяться, часто залежить від особливостей хазяйської клітини. Будь-які хазяйські клітини, здатні до понадекспресії гетерологічних ДНК, можуть бути використані для виділення генів, що кодують антитіло, поліпептиди або білок, що представляють інтерес. Не обмежувальні приклади прийнятних хазяйських клітин ссавців включають, але без обмеження такими, клітини COS, HeLa та CHO. Є бажаним, коли, хазяйські клітини експресують кДНК на рівні близько у 5 разів вище, більш переважно у 10 разів вище, ще більш переважно у 20 разів вище, ніж такий для відповідного ендогенного антитіла або білка, що представляє інтерес, якщо вони є присутніми у хазяйських клітинах. Скринінг хазяйських клітин на специфічне зв'язування з B7-H3 здійснюють за допомогою імуноаналізу або FACS. Клітини, що понадекспресують антитіло або білок, що представляє інтерес, можуть бути ідентифіковані. Також є доступними різні способи, які зараз використовуються для продукції мутантних B7H3 пептидних агоністів, антагоністів та модуляторів, які передбачають вставки, делеції або зміни в амінокислотній послідовності одержаного білка у порівнянні із молекулою вихідного пептидного агоніста, антагоніста або модулятора B7-H3. Винахід включає поліпептиди, що включають амінокислотну послідовність з антитіл згідно з даним винаходом. Поліпептиди згідно з даним винаходом можуть бути одержані за допомогою процедур, відомих в даній галузі техніки. Поліпептиди можуть бути одержані за допомогою протеолітичних методів або інших способів деградація антитіл, рекомбінантними методами (наприклад, одиничний або злитий поліпептид), як описано вище, або шляхом хімічного синтезу. Поліпептиди з антитіл, особливо короткі поліпептиди, що містять до 50 амінокислот, традиційно одержують шляхом хімічного синтезу. Методи хімічного синтезу є відомими в даній галузі техніки та є комерційно доступними. Наприклад, анти-B7-H3 поліпептиди можуть бути одержані при використанні автоматизованого синтезатора поліпептидів за допомогою методу твердих фаз. IV. Способи скринінгу поліпептидів та моноклональних антитіл Деякі методи можуть бути використані для скринінгу поліпептидів та моноклональних антитіл, які зв'язуються з B7-H3. Є зрозумілим, що термін "зв‘язування" відноситься до біологічно або імунологічно релевантного специфічного зв'язування, та не відноситься до неспецифічного зв'язування, яке може виникати, наприклад, тоді, коли імуноглобулін використовується при дуже високій концентрації проти неспецифічної мішені. В одному втіленні моноклональні антитіла піддаються скринінгу на зв'язування з B7-H3 при використанні стандартних методів скринінгу. Таким чином було отримане анти-B7-H3 моноклональне антитіло. Бажаними гібридомами згідно з даним винаходом є такі, що продукують антитіла BRCA69D, BRCA84D або PRCA157. Можуть бути ідентифіковані додаткові моноклональні антитіла, які зв'язуються з B7-H3. З цією метою моноклональні антитіла піддаються скринінгу на їх диференціальну здатність 23 UA 110789 C2 5 10 15 20 25 30 35 40 45 50 55 60 зв'язуватися з раковою тканини, але не з нераковими клітинами. В одному втіленні відбирають моноклональні антитіла, які зв'язуються з B7-H3, та такі є перехресно реактивними в людських ракових клітинах або тканинах, але не в нормальних тканинах клітин або тканинах у такій самій мірі. Один з методів, які можуть можуть використовуватися для скринінгу, являє собою імуногістохімію (IHC). Стандартні імуногістохімічні методи є відомими середньому спеціалісту у даній галузі техніки. Див., наприклад, ANIMAL CELL CULTURE METHODS (J.P. Mather та D. Barnes, ред., Academic Press, NY, том 57, глави 18 та 19, стор. 314-350, 1998). Біологічні зразки (наприклад, тканини) можуть бути отримані з біопсії, аутопсії або з розтину. Щоб з'ясувати, чи є B7-H3 присутнім тільки на ракових клітинах, анти-B7-H3 антитіла можуть бути використані для виявлення присутності B7-H3 на тканинах індивідуумів з раком, у той час, як інші неракові тканини від індивідуум, які страждають на рак, або тканин від індивідуумів без раку, використовують як контроль. Тканина може поміщатися у тверду або напівтверду речовину, яка запобігає пошкодженню при заморожуванні (наприклад, агарозний гель або ОСТ), після чого готують зрізи для наступного забарвлювання. Зразки раку з різних органів та на різних стадіях раку можуть бути використані для скринінгу моноклональних антитіл. Приклади тканин, які можуть бути використані для цілей скринінгу, включають, але без обмеження такими, тканини яєчників, молочної залози, легенів, передміхурової залози, товстої кишки, нирки, шкіри, щитовидної залози, головного мозку, серця, печінки, шлунку, нервів, кровоносних судин, кісток, верхніх відділів травного тракту та підшлункової залози. Приклади різних типів раку, які можуть бути використані для цілей скринінгу, включають, але без обмеження такими, карциноми, аденокарциноми, саркоми, aденосаркоми, лімфоми та лейкемії. Ще в одному альтернативному втіленні лінії ракових клітин, такі, як HMEC (BioWhittaker CC2251), HUVEC (первинні ендотеліальні клітини), BT-474 (ATCC# HTB-20), MCF7 (ATCC# HTB22), MDA-MB-175-VII (ATCC# HB-25), MDA-MB-361 (ATCC# HB-27), SKBR3 (ATCC# HTB-30), A549 (ATCC# CCL- 185), Calu-3 (ATCC# HTB-55), SKMES-I (ATCC# HTB-58), ES-2 (ATCC# CRL-1978), SKOV3 (ATCC# HTB- 77), Panc-1 (ATCC# CRL-1469), AsPC-I (ATCC# CRL-1682), HPAF-II (ATCC# CRL-1997), Hs700T (ATCC# HTB-174), Colo205 (ATCC# CCL-222), HT-29 (ATCC# HTB-38), SW480 (ATCC# CCL-228), SW948 (ATCC# CCL- 237), 293 (ATCC # CRL-1573), 786-O (ATCC# CRL-1932), A498 (ATCC# HTB-44), Caki-2 (ATCC# HTB-47), COS-7 (ATCC# CRL-1651), RL-65 (ATCC # CRL-10345), SV-T2 (ATCC# CCL-163.1), 22RV1 (ATCC# CRL-2505), DU145 (ATCC# HTB81), LNCaP (ATCC# CRL-1740), PC-3 (ATCC# CRL-1435), HT29 (ATCC# HTB-38), Hs746T (ATCC# HTB-135), NCI-N87 (ATCC# CRL-5822) та нормальні клітини з відповідних тканин можуть використовуватися для скринінгу на моноклональні антитіл, які є специфічними для ракової тканини. Первинні клітинні культури або такі з невисокою кількістю пасажів, які походять від нормальних тканин з різних органів, включаючи, але без обмеження, культури клітин нирок, яєчників, молочної залози, легенів, передміхурової залози, товстої кишки, нирок, шкіри, щитовидної залози, гладких м'язів аорти, та ендотеліальних клітин, можна використовувати як негативні контролі. Ракові або неракові клітини можуть вирощуватися на предметних або покривних скельцях, або на пластикових поверхнях, або можуть одержані у пристрої CellArray ™, як описано у WO01/43869, та піддаватися скринінгу на зв'язування антитіла при використанні IHC, як описано вище для тканин. Альтернативно, клітини можуть бути видалені з поверхні росту при використанні непротеолітичних засобів, після чого їх піддають центрифугуванню з одержанням осаду, який потім поміщають у парафін та обробляють як тканини для IHC аналізу, як описано вище. Клітини можуть бути введені імунодефіцитним тваринам, при цьому пухлину залишають для росту, потім цю пухлину можуть вилучати, поміщати у парафін та використовувати як джерело тканини для IHC аналізу. В іншій альтернативі одиничні клітини можуть піддаватися скринінгу шляхом інкубації з первинним антитілом, вторинним "репортерним" антитілом, зв‘язаним з люмінесцентними молекулами та потім аналізуватися при використанні пристрою для здійснення сортування флуоресцентно активованих клітин (FACS). Будь-яка з декількох різних систем визначення може використовуватися для виявлення зв'язування антитіл на зрізах тканини. Як правило, імуногістохімія передбачає зв‘язування первинного антитіла з тканиною, а потім вторинне антитіло, реактивне стосовно видів, з яких одержують первинне антитіло, піддають кон‘югації зі здатним до визначення маркером (наприклад, пероксидазою хрону, HRP або діамінобензидином, DAB). Один з альтернативних методів, які можуть бути використані, являє собою поліклональні комплементарні антитіла дзеркального зображення або polyMICA™ (polyclonal Mirror Image Complementary Аntibodies; The Binding Site Limited, Birmingham, UK; Mangham, D.C. та ін. (1999) " A Novel Immunohistochemical Detection System Using Mirror Image Complementary Аntibodies (MICA),” Histopathology 35(2): 129-33). Техніка PolyMICA™ може використовуватися для аналізу зв‘язування первинних антитіл (наприклад, анти-B7-H3 антитіл) з нормальною та раковою 24 UA 110789 C2 5 10 15 20 25 30 35 40 45 50 55 60 тканиною. Кілька видів polyMICA™ комплектів для виявлення є комерційно доступними: продукт під номером HK004.D являє собою polyMICA ™ набір для визначення, що використовує DAB хромоген; продукт під номером HK004.A являє собою polyMICA™ набір для визначення, що використовує AEC хромоген. Альтернативно, первинне антитіло може піддаватися безпосередньому міченню за допомогою здатного до визначення маркера. Перший етап у скринінгу IHC для вибору прийнятного антитіла являє собою зв‘язування первинних антитіл, які утворилися у мишей (наприклад, анти-B7-H3 антитіл), з одним або більше імуногенами (наприклад, клітин або зразків тканини). В одному втіленні зразок тканини являє собою зрізи замороженої тканини з різних органів. Зразки клітин або тканини можуть бути як раковими, так і не раковими. Одержують заморожені тканини, готують зрізи, з або без фіксації, та здійснюють IHC за допомогою будь-якого зі способів, які є відомими спеціалісту у даній галузі техніки (див., наприклад, Stephan та ін. (1999) “Distribution And Function Of The Adhesion Molecule BEN During Rat Development,” Dev. Biol. 212: 264-277 та Stephan та ін. (1999) “Selective Cloning Of Cell Surface Proteins Involved In Organ Development: Epithelial Glycopritein Is Involved In Normal Epithelial Differentiation,” Endocrinology 140: 5841-5854). V. Способи характеристики анти-B7-H3 антитіл Будь-який з декількох методів може бути використаний для характеристики анти-B7-H3 антитіл. Один з методів полягає у визначенні епітопа, з яким воно зв'язується. Картування епітопів є комерційно доступним з різних джерел, Наприклад, Pepscan системи (Lelystad, Нідерланди). Картування епітопів може використовуватися для визначення послідовності, з якою зв‘язується анти-B7-H3 антитіло. Епітоп може бути лінійним епітопом, тобто міститися у стрічці амінокислот, або конформаційним епітопом, який утворюється за допомогою просторових взаємодій амінокислот, які не обов'язково можуть розміщуватися в одній стрічці. Пептиди різної довжини (наприклад, переважно такі, що мають довжину принаймні 4-6 амінокислот) можуть бути синтезовані або ізольовані (наприклад, рекомбінантно) та використовуються для зв'язування з анти-B7-H3 антитілом. Епітоп, з яким зв'язується анти-B7H3 антитіло, може бути визначений шляхом систематичного скринінгу при використанні пептидів, що перекриваються, отриманих з позаклітинної послідовності, та визначення його зв'язування анти-B7-H3 антитілом. Ще один спосіб, який може використовуватися для характеристики анти-B7-H3 антитіла, являє собою використання конкурентних аналізів з іншими відомими антитілами, які є відомими як такі, що зв'язуються з тим самим антигеном, тобто, B7-H3, для того, щоб визначити, чи зв'язується анти-B7-H3 антитіло з тим самим епітопом інших антитіл. Приклади комерційно доступних антитіл до B7-H3 може бути комерційно доступними та можуть бути ідентифікованіі при використанні аналізів зв'язування, як описується в даній заявці. Конкурентні аналізи є добре відомими спеціалістам у даній галузі, та такі процедури та ілюстративні дані докладно будуть описані далі у прикладах. Анти-B7-H3 антитіла можуть бути додатково охарактеризовані тканинами, типами раку або типами пухлини, з якими вони зв'язуються. Інший спосіб характеристики анти-B7-H3 антитіл являє собою антиген, з яким вони зв'язуються. Анти-B7-H3 антитіла використовувалися у Вестерн-блотах лізатів клітин, одержаних з різних видів раку людини. Як відомо спеціалістові у даній галузі, Вестерн-блоттінг може включати в себе пропускання клітинних лізатів та/або фракцій клітин через денатуруючий або неденатуруючий гель, перенос білків на нітроцелюлозний фільтр, а потім зондування блоту з антитілом (наприклад, анти-B7-H3 антитілом), щоб побачити, які білки зв‘язуються антитілом. B7-H3 асоціюється з різними видами раку людини з різних тканин, включаючи, але без обмеження, такими товстої кишки, молочної залози, яєчників, підшлункової залози та легенів. VI. Способи діагностики раку при використанні анти-B7-H3 антитіл та B7-H3 модуляторів Моноклональні антитіла до B7-H3, одержані за допомогою способів, описаних в даній заявці, можуть бути використані для визначення наявності або відсутності ракових клітин в різних тканинах, включаючи, але не обмежуючись, такі яєчників, молочної залози, легенів, передміхурової залози, товстої кишки, нирок, підшлункової залози, шкіри, щитовидної залози, головного мозку, серця, печінки, шлунка, нервів, кровоносних судин, кісток та верхніх відділів травного тракту, для цілей діагностики. Моноклональні антитіла до B7-H3, одержані за допомогою способів, описаних в даній заявці, можуть бути також використані для визначення наявності або відсутності ракових клітин або визначення їх рівня у циркулюючій крові після вивільнення із солідних пухлин. Такі циркулюючі антигени може являти собою інтактний B7-H3 антиген або фрагмент його, який зберігає здатність до виявлення у відповідності із методами, описаними в даній заявці. Таке визначення може бути здійснено шляхом FACS аналізу при використанні стандартних методів, які зазвичай використовуються в даній галузі техніки. 25 UA 110789 C2 5 10 15 20 25 30 35 40 45 50 55 60 Такі використання може втягувати утворення комплексу між B7-H3 таантитілом, яке специфічно зв‘язується з B7-H3. Приклади таких антитіл включаються, але без обмеження такими, анти-B7-H3 моноклональні антитіла, що продукуються гібридомами BRCA84D, BRCA69D та PRCA157. Формування такого комплексу може здійснюватися in vitro або in vivo. Не вдаючись у теорію, моноклональне антитіло анти-B7-H3 може зв'язуватися з B7-H3 за допомогою позаклітинного домену B7-H3 та потім може інтерналізуватися. У бажаному втіленні методів діагностики згідно з даним винаходом антитіло несе здатну до визначення мітку. Приклади мітки, що може використовуватися, включають радіоактивний агент або флуорофор, такий, як фікоеритрин або ізотіоціанат флуоресцеїну (також відомий як фторізотіоціанат або FITC). Як і для інших відомих антитіл, що використовуються в комерційних цілях для діагностики та з терапевтичною метою, цільовий антиген згідно з даним винаходом широко експресується в нормальних тканинах. Він також піддається підвищувальній регуляції в деяких пухлинах. Таким чином, конкретні дози та способи доставки антитіл згідно з даним винаходом, які використовуються як діагностичні або терапевтичні агенти, будуть визначатися з урахуванням конкретної пухлини або стану, а також від конкретних індивідуумів, яких піддають лікуванню. Один зі способів використання антитіл для діагностики являє собою одержання зображень in vivo, шляхом зв‘язування антитіла з радіоактивним або рентгеноконтрастним агентом, введення антитіла індивідууму та використання рентгенівських променів або інших пристроїв для одержання зображень для візуалізацію локалізації міченого антитіла на поверхні ракових клітин, які експресують антиген. Антитіло вводять в концентрації, яка сприяє зв‘язуванню при фізіологічних умовах. In vitro методики для визначення B7-H3 є звичайними у галузі техніки та включають твердофазні імуноферментні аналізи (ELISA), імунопреципітацію, імунофлуоресценцію, імуноферментний аналіз (EIA), радіоімуноаналіз (RIA) та Вестерн-блоттінг аналіз. В аспектах згідно з даним винаходом способи одержання радіозображення пухлин або новоутворень або вимірювання ефективності методу лікування при використанні міченого антитіла включають стадію введення міченого, специфічного для пухлини антитіла індивідууму у відповідності з практикою згідно з даним винаходом. Мічене антитіло може бути моноклональним або поліклональним антитілом, що включає радіоактивну мітку, бажано вибрану з групи, що складається з технецію-99m, індію-111, йоду-131, ренію-186, ренію-188, самарію-153, лютецію-177, міді-64, скандію-47, ітрію-90. Моноклональні антитіл, мічені при використанні терапевтичних радіонуклідів, таких, як йод-131, реній-188, гольмій-166, самарій153 та скандій-47, які не знижують імунореактивності антитіл та не руйнуються в in vivo, є особливо бажаними. Спеціалістові у даній галузі техніки є зрозумілим, що є відомими інші радіоактивні ізотопи, вони також можуть бути придатними для специфічних застосувань. Одержання радіозображення може бути проведене при використанні однофотонної емісійної комп'ютерної томографії (SPECT), позиційної емісійної томографії (РЕТ), комп'ютерної томографії (СТ) або магнітно-резонансної томографії (МРІ). Також передбачається одержання кореляційного зображення, що дозволяє одержати краще анатомічне визначення розташування метастазів при використанні радіоімунозображення. В інших методах ракові клітин видаляються, та тканину готують для імуногістохімічних методів, добре відомих в даній галузі (наприклад, шляхом поміщення у заморожені сполуки, заморожування та одержання зрізів, з фіксацією або без фіксації, фіксації та заключення у парафін при використанні різних способів виявлення антигену та контрастного забарвлювання, або без їх застосування). Моноклональні антитіла також можуть використовуватися для ідентифікації ракових клітин на різних стадіях розвитку. Антитіла також можуть використовуватися для визначення, які пухлини індивідуумів експресують антиген на своїй поверхні на заздалегідь визначеному рівні та, таким чином, є кандидатами на проведення імунотерапії при використанні антитіл, направлених проти вказаного антигену. Антитіла можуть впізнавати як первинний рак, так і метастазуючий рак, що експресує B7-H3. Як використовується в даній заявці, виявлення може включаюти якісне та/або кількісне визначення та може включати порівняння визначеного рівня з таким у нормальній клітині для визначення підвищеного рівня експресії B7-H3 у ракових клітинах. Винахід також забезпечує способи сприяння діагностиці раку, що характеризується раковими клітинами, які експресують B7-H3, у індивідуумів при використанні будь-якого антитіла, яке зв'язується з B7-H3, та будь-які інші способи, які можуть бути використані для визначення рівня експресії B7-H3. Як використовується в даній заявці, способи для "сприяння діагностиці" означають, що ці способи надають допомогу у проведенні клінічного визначення, що стосуються класифікації, або природи, раку, та можуть бути або можуть не бути 26 UA 110789 C2 5 10 15 20 25 30 35 40 45 50 55 60 переконливим щодо остаточного діагнозу. У відповідності із цим, спосіб сприяння діагностиці раку може включати етап визначення рівня B7-H3 в біологічному зразку, одержаному від індивідуума, та/або визначення рівня експресія B7-H3 у зразку. Антитіла, що впізнають антиген або його частину, також можуть використовуватися для створення діагностичних імуноаналізів для виявлення антигену, що вивільняється або секретується із живих або мертвих ракових клітин в рідинах організму, включаючи, але не обмежуючись такими, кров, слину, сечу, легеневу рідину або асцитну рідину. Не усі клітини у конкретній пухлині, що представляє інтерес, будуть експресувати B7-H3, ракові клітини в інших тканинах можуть експресувати B7-H3, таким чином, індивідууми повинні піддаватися скринінгу на наявність або відсутність B7-H3 на ракових клітинах для визначення корисності імунотерапії у індивідуумів. Анти-B7-H3 антитіла, одержані за допомогою способів, описаних у даній заявці, можуть бути використані для визначення, чи буде індивідуум, діагностований як такий, що має рак, вважатися кандидатом на проведення імунотерапії при використанні антитіл, спрямованих проти B7-H3. В одному втіленні ракова пухлина або зразки біопсії можуть бути перевірені на експресію В7-Н3 при використанні антитіл, спрямованих проти B7-H3. Індивідууми з раковими клітинами, що експресують B7-H3, є придатними кандидатами для імунотерапії при використанні антитіл, спрямованих проти B7-H3. Забарвлювання анти-B7H3 антитіла може також використовуватися для того, щоб відрізнити ракові тканини від нормальних тканин. Способи застосування анти-B7-H3 антитіл для діагностичних цілей можуть бути використані як до, так після здійснення будь-якої форми протиракового лікування, наприклад, хіміотерапії або променевої терапії, для визначення, які пухлини найбільш ймовірно є чутливими до даного лікування, прогнозу індивідуума, хворого на рак, підтипу пухлини або походження метастатичного захворювання та прогресування захворювання або відповіді на лікування. Композиції згідно з даним винаходом також є придатними для діагностики станів захворювання, відмінного від раку, при використанні способів, які в загальному вигляді є описаними вище у заявці, з іншими хворими (нераковими) клітинами. Стани захворювання, придатні для використання у способах згідно з даним винаходом, включають, але без обмеження такими, захворювання або розлади, пов'язані із запальними або аутоімунними реакціями у індивідуумів. Методи, описані вище, можуть використовуватися для модуляції запальних або аутоімунних реакцій у індивідуумів. Захворювання та стани, причиною яких є запальні та аутоімунні захворювання, що можуть піддаватися діагностиці та/або лікуванню при використанні композицій та способів згідно з винаходом, включають, як приклад та без обмеження такими, розсіяний склероз, менінгіт, енцефаліт, інсульт, інші церебральні травми, запальні захворювання кишечнику, включаючи виразковий коліт та хворобу Крона, міастенію, вовчак, ревматоїдний артрит, бронхіальну астму, гострий ювенільний діабет, СНІД-деменцію, атеросклероз, нефрит, ретиніт, атопічний дерматит, псоріаз, ішемію міокарда та гостре пошкодження легенів, опосередковане лейкоцитами. Інші показання для діагностичного та/або терапевтичного використання антитіл та інших терапевтичних агентів згідно з винаходом включають введення їх індивідуумам, які мають ризик відторгнення органа або трансплантата. За останні роки відбулося значне покращення ефективності хірургічних методів пересадки тканин та органів, таких, як шкіра, нирки, печінка, серце, легені, підшлункова залоза та кістковий мозок. Можливо, основною невирішеною проблемою при цьому є відсутність задовільних агентів для стимулювання імунологічної толерантності у реципієнта пересаджуваного алотрансплантату або органу .Коли алогенні клітини або органи пересаджують у хазяйський організм (тобто донорів та реципієнт є різними індивідуумами того самого виду), імунна система хазяїна, ймовірно, буде розвивати імунну відповідь на чужорідні антигени у трансплантаті (захворювання хазяїн-проти-трансплантата), що приводить до руйнування пересадженої тканини. Застосування анти-B7-H3 антитіл, описаних будь-де у даній заявці, також охоплює застосування інших B7-H3 агоністів, антагоністів та модуляторів, як описано в даній заявці. У таких втіленнях B7-H3 агоніст, aнтагоніст або інший модулятор, відмінний від антитіла, замінюється на B7-H3 антитіло на описаних етапах, та такі зміни у межах компетенції кваліфікованого спеціаліста звичайно здійснюють для адаптації способу до заміни композиції модулятора B7-H3. Моноклональні антитіл до B7-H3, одержані за допомогою способів, описаних у даній заявці, можуть бути використані для визначення наявності або відсутності ракових стовбурових клітин людини в різних тканинах. Ракові стовбурові клітини (CSC), як було передбачено, грають певну роль у рості пухлини та метастазах (Ghotra, V.P. та ін. (2009) “The Cancer Stem Cell Microenvironment And Anti-Cancer Therapy,” Int. J. Radiat. Biol. 85(11): 955-962; Gupta, P.B. та ін. 27 UA 110789 C2 5 10 15 20 25 30 35 40 45 50 55 60 (2009) “Cancer Stem Cells: Mirage Or Reality?” Nat. Med. 15(9): 1010-1012; Lawson, J.C. та ін. (2009) “Cancer Stem Cells In Breast Cancer And Metastasis,” Breast Cancer Res. Treat. 118(2): 241254; Hermann, P.C. та ін. (2009) “Pancreatic Cancer Stem Cells--Insights And Perspectives,” Expert Opin. Biol. Ther. 9(10): 1271-1278; Schatton, T. та ін. (2009) “Identification And Targeting Of Cancer Stem Cells,” Bioessays 31(10): 1038-1049; Mittal, S. та ін. (2009) “Cancer Stem Cells: The Other Face Of Janus,” Amer. J. Med. Sci. 338(2): 107-112; Alison, M.R. та ін. (2009) “Stem Cells And Lung Cancer: Future Therapeutic Targets?” Expert Opin. Biol. Ther. 9(9): 1127-1141; Charafe-Jauffret, E. та ін. (2009) “Breast Cancer Stem Cells: Tools And Models To Rely On,” BMC Cancer 9: 202; Scopelliti, A. та ін. (2009) “Therapeutic Implications Of Cancer Initiating Cells,” Expert Opin. Biol. Ther. 9(8): 1005-1016; публікація РСТ WO 2008/091908). Відповідно до цієї гіпотези CSC забезпечують невелику, відмінну підмножину клітин в кожній пухлині, які є здатними до необмеженого самовідтворення та розвиваються в більш дорослу(і) пухлинну(і) клітину(и), що є відносно обмеженими у своїй здатності до реплікації. Була висловлена гіпотеза, що ці ракові стовбурові клітини можуть бути більш стійкими до хіміотерапевтичних агентів, радіаційних або інших токсичних умов, та, таким чином, є стійкими після клінічної терапії та пізніше перетворюються у вторинні пухлини, метастази або несуть відповідальність за рецидиви. Було висловлено припущення, що CSC можуть виникати або від "нормальних" стовбурових клітин тканини, або від більш диференційованих тканинних клітин попередників. Людські ракові стовбурові клітини мають кілька визначальних характеристик. Такі характеристики описані в публікації РСТ WO 2008/091908 та включені сюди як посилання. Моноклональні антитіла до мішеней на клітинній поверхні ракових стовбурових клітин можуть використовуватися для визначення наявності або відсутності раку стовбурових клітин в різних тканинах. Моноклональні антитіла до B7-H3, одержані за допомогою способів, описаних в даній заявці, можуть також бути використані для визначення наявності або відсутності раку стовбурових клітин або рівня раку стовбурових клітин у зразку або тканині або у руслі крові після їх звільнення із солідних пухлин. Такий циркулюючий антиген може бути інтактним B7-H3 антигеном або його фрагментом, який зберігає здатність бути виявлений у відповідності із способами, розкритими у даній заявці. Таке визначення може бути проведене за допомогою FACS аналізу при використанні стандартних методів, які зазвичай використовуються в даній області. В іншому втіленні таке визначення може бути проведене за допомогою імуногістохімічного аналізу зразків тканин при використанні стандартних методик, які зазвичай використовуються в даній галузі техніки. Такі застосування передбачають утворення комплексу між B7-H3 та антитілом, яке спеціфічно зв‘язується з B7-H3 на ракових стовбурових клітинах. Приклади таких антитіл включають, але без обмеження, анти-B7-H3 моноклональні антитіла, що продукуються гібридомами BRCA84D, BRCA69D та PRCA157. Формування такого комплексу може здійснюватися in vitro або in vivo. Застосування, описані у даній заявці, що поширюються на застосування анти-B7-H3 антитіл, також охоплюють застосування інших B7-H3 агоністів, антагоністів та модуляторів, як описано в даній заявці, для застосування при ідентифікації та лікування раку стовбурових клітин. У таких варіантах анти-B7-H3 антитіла та інші B7-H3 агоністи, антагоністи та модулятори використовуються для ідентифікації, діагностики або терапевтичного лікування раку стовбурових клітин при використанні способів, подібних до описаних у даній заявці, та змін у рамках компетенції звичайного кваліфікованого практикуючого спеціаліста, які зроблені для того, щоб адаптувати спосіб до ідентифікації / діагностики або лікування раку стовбурових клітин. VII. Бажані композиції згідно з даним винаходом Даний винахід охоплює композиції, включаючи фармацевтичні композиції, які містять антиB7-H3 антитіла, поліпептиди, що походять від анти-B7-H3 антитіл, полінуклеотиди, що включають послідовність, яка кодує анти-B7-H3 антитіла, та інші агенти, як описується в даній заявці. Як використовується в даній заявці, композиції додатково включають одне або більше антитіл, поліпептидів та/або білків, що зв‘язуються з B7-H3, B7-H3 агоністи, антагоністи, модулятори та/або один або більше полінуклеотидів, що включають послідовності, які кодують одне або більше антитіл, поліпептидів та білків, що зв‘язуються з B7-H3. Винахід додатково забезпечує кон‘югати будь-якого B7-H3 пептидного агоніста, aнтагоніста або модулятора та додаткові хімічні структури, які підтримують визначену функцію або функції, зокрема, B7-H3 пептидного агоніста, aнтагоніста або модулятора. Ці кон‘югати включають B7-H3 пептидний агоніст, антагоніст або модулятор, ковалентно зв‘язаний з макромолекулами такими, як будь-який нерозчинний, твердий матрикс основи, що використовуються у діагностичних процедурах, процедурах скринінгу або очистки, що 28
ДивитисяДодаткова інформація
Назва патенту англійськоюAntibodies reactive with b7-h3, immunologically active fragments thereof and uses thereof
Автори англійськоюLoo, Deryk, T., Huang, Ling, Moore, Paul, A., Chen, Francine, Zhifen, Johnson, Leslie, S.
Автори російськоюЛу Дерик Т., Хуан Лин, Мур Пол А., Чень Франсин Чжифень, Джонсон Лесли С.
МПК / Мітки
МПК: A61P 35/00, A61K 39/395, C07K 16/00
Мітки: відносної, застосування, реактивне, фрагменти, b7-h3, активні, імунологічно, антитіло
Код посилання
<a href="https://ua.patents.su/167-110789-antitilo-reaktivne-vidnosno-b7-h3-jjogo-imunologichno-aktivni-fragmenti-ta-kh-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Антитіло, реактивне відносно b7-h3, його імунологічно активні фрагменти та їх застосування</a>
Попередній патент: Газовий нагрівальний пристрій для болтів
Наступний патент: Спосіб передбачування рецидиву раку молочної залози при ендокринному лікуванні
Випадковий патент: Контактний тепло-масообмінний апарат