Спосіб передбачування рецидиву раку молочної залози при ендокринному лікуванні
Номер патенту: 110790
Опубліковано: 25.02.2016
Автори: Дартманн Марайке, Петри Крістоф, Германн Матіас, Кроненветт Ральф, Федер Інке Сабін, Вебер Карстен, фон Тьорн Крістіан, Хенніг Гідо
Формула / Реферат
1. Спосіб передбачування наслідків раку молочної залози в позитивній по рецептору естрогена і негативній по HER2 пухлини у пацієнта з раком молочної залози, причому вказаний спосіб включає:
(a) визначення в зразку пухлини від вказаного пацієнта рівнів експресії РНК наступних 8 генів: UBE2C, BIRC5, DHCR7, STC2, AZGP1, RBBP8, IL6ST і MGP;
(b) математичне комбінування величин рівня експресії для генів вказаного набору, причому ці величини визначають в зразку пухлини з отриманням комбінованого показника, де вказаний комбінований показник указує на прогноз у вказаного пацієнта.
2. Спосіб за п. 1, де вказаному пацієнту проведена ендокринна терапія або йому передбачають проводити ендокринну терапію.
3. Спосіб за п. 2, де вказана ендокринна терапія включає тамоксифен або інгібітор ароматази.
4. Спосіб за будь-яким з пп. 1-3, де передбачають ризик розвитку рецидиву раку молочної залози або пов'язаної з ризиком смерті.
5. Спосіб за будь-яким з пп. 1-4, де вказаний рівень експресії визначають як рівень експресії матричної РНК.
6. Спосіб за п. 5, де вказаний рівень експресії визначають за допомогою щонайменше одного зі способів: спосіб на основі ПЦР, спосіб на основі мікроматриці і спосіб на основі гібридизації.
7. Спосіб за будь-яким з попередніх пунктів, де вказане визначення рівнів експресії проводять у фіксованому у формаліні зануреному в парафін зразку пухлини або в свіжозамороженому зразку пухлини.
8. Спосіб за будь-яким з вказаних вище пунктів, де рівень експресії щонайменше одного маркерного гена визначають як профіль експресії відносно щонайменше одного еталонного гена або щодо обчисленої середньої величини експресії.
9. Спосіб за будь-яким з попередніх пунктів, де вказана стадія математичного комбінування включає стадію застосування алгоритму до величин, що характеризують рівні експресії даних генів, де вказаний алгоритм є лінійною комбінацією вказаних величин, характерних для рівнів експресії даних генів.
10. Спосіб за п. 9, де значення характерної величини рівня експресії даного гена множать на коефіцієнт.
11. Спосіб за будь-яким з попередніх пунктів, де один, два або більше порогових значень визначають для вказаного комбінованого показника, які відокремлюють в групи високого і низького ризику, високого, проміжного і низького ризику або на більшу кількість груп ризику шляхом застосування порогу до комбінованого показника, причому високий комбінований показник указує на користь цитотоксичної хіміотерапії.
12. Спосіб за будь-яким з попередніх пунктів, де інформація відносно статусу вузлів у пацієнта переробляється на стадії математичного комбінування величин рівня експресії для генів з одержанням комбінованого показника.
13. Спосіб за п. 11 або 12, де вказана інформація, що стосується статусу вузлів, є числовою величиною, якщо вказаний статус є негативним, і вказана інформація є відмінною числовою величиною, якщо вказаний статус вузлів є позитивним, і вказана інформація є відмінною або ідентичною числовою величиною, якщо вказаний статус вузлів є невідомим.
14. Застосування набору для виконання способу за будь-яким з пп. 1-13, причому вказаний набір містить набір олігонуклеотидів, здатних специфічно зв'язувати послідовності або зв'язуватися з послідовностями фрагментів генів в комбінації генів, де вказана комбінація містить 8 генів: UBE2C, BIRC5, DHCR7, STC2, AZGP1, RBBP8, IL6ST і MGP.
Текст
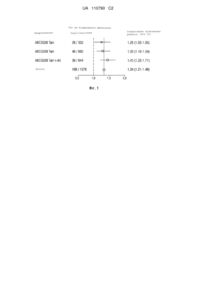
Реферат: Винахід належить до способу, набору для прогнозування наслідків захворювання при раку молочної залози, причому вказаний спосіб включає: (a) визначення в зразку пухлини від вказаного пацієнта рівнів експресії РНК наступних 8 генів: UBE2C, BIRC5, DHCR7, STC2, AZGP1, RBBP8, IL6ST і MGP; (b) математичне комбінування величин рівня експресії для генів вказаного набору, причому ці величини визначають в зразку пухлини з одержанням комбінованого показника, де вказаний комбінований показник указує на прогноз у вказаного пацієнта. UA 110790 C2 (12) UA 110790 C2 UA 110790 C2 5 10 15 20 25 30 35 40 45 50 55 60 Технічна галузь Даний винахід відноситься до способів, наборів і систем для прогнозування наслідків рака молочної залози. Конкретніше, даний винахід відноситься до прогнозування рака молочної залози на основі вимірювання рівнів експресії маркерних генів в зразках пухлини пацієнтів з раком молочної залози. Рівень техніки, до якого відноситься винахід Рак молочної залози є однією з основних причин смертності від раку у жінок в західних країнах. Конкретніше, тільки в США щорічно рак молочної залози забирає життя приблизно 40000 жінок, і його діагностують приблизно у 200000 жінок. Протягом останніх декількох десятиліть ад'ювантна системна терапія привела до значного збільшення виживаності при ранньому раку молочної залози. Цей клінічний досвід привів до узгоджених рекомендацій, що пропонують ад'ювантну системну терапію для переважної більшості пацієнтів з раком молочної залози (EBCAG). При раку молочної залози доступна безліч варіантів лікування, які можна застосовувати на додаток до хірургічного видалення пухлини, що зазвичай проводиться, і подальшого опромінювання ложа пухлини. Три основних і принципово різних стратегії є ендокринне лікування, хіміотерапія і лікування націленою терапією. Передумовою для лікування ендокринними засобами є експресія рецепторів гормонів в пухлинній тканині, тобто або рецептора естрогену, або рецептора прогестерону, або обох з них. Доступні декілька ендокринних засобів з різним способом дії і відмінностями в результаті захворювання при тестуванні у великих групах пацієнтів. Тамоксифен є основою ендокринного лікування впродовж останніх трьох десятиліть. Значні клінічні випробування продемонстрували, що тамоксифен значно знижує ризик рецидиву пухлини. Додатковий варіант лікування заснований на інгібіторах ароматази, які відносяться до нового класу ендокринних лікарських засобів. В протилежність тамоксифену, який є конкурентним інгібітором зв'язування естрогену, інгібітори ароматази блокують продукування самого естрогену, тим самим знижуючи стимул до зростання для позитивних по рецептору естрогену пухлинних кліток. Крім того, у деяких пацієнтів виникає рецидив, не зважаючи на ендокринне лікування, і конкретно для цих пацієнтів можуть бути корисні додаткові терапевтичні лікарські засоби. Було показано, що хіміотерапія антрациклинами, таксанами і іншими засобами є ефективною для придушення рецидиву захворювання як у позитивних по рецептору естрогену пацієнтів, так і у негативних по рецептору естрогену пацієнтів. У дослідженні NSABP-20 порівнювали тамоксифен окремо з тамоксифеном плюс хіміотерапія у негативних по вузлах позитивних по рецептору естрогену пацієнтів і показали, що комбіноване лікування було ефективнішим, ніж лікування тамоксифеном окремо. Проте дослідження IBCSG IX, в якому порівнювали тамоксифен окремо з тамоксифеном плюс хіміотерапія, не показало якої-небудь користі додавання цитотоксичних засобів. Недавно було показано, що введене системне антитіло, що направлене проти антигена HER2/neu на поверхні пухлинних клітин, знижує ризик рецидиву у декілька разів у пацієнтів зі зверхекспресуючими Her2neu пухлинами. Проте більшість, якщо не всі, з різних способів медикаментозного лікування мають численні побічні дії, які можуть значно погіршити якість життя пацієнтів (Shapiro and Recht, 2001; Ganz et al., 2002). Це робить обов'язковим вибір стратегії лікування на основі ретельної оцінки ризику у конкретного пацієнта, щоб уникнути надмірного, а також недостатнього лікування. Оскільки користь хіміотерапії є відносно великою у разі позитивних по HER2/neu пухлин і пухлин, що характеризуються відсутністю експресії HER2/neu і рецепторів естрогену (базальний тип), в порівнянні з негативними по HER2/neu і позитивних по рецепторах естрогену пухлинах (люминальний тип), найбільш важке прийняття рішення про лікування стосується люминальных пухлин, для яких класичні клінічні чинники, такі як ступінь, розмір пухлини або залучення лімфатичних вузлів, не забезпечують чіткої відповіді на питання про використання хіміотерапії. Для задоволення цієї медичної потреби були розроблені новіші молекулярні інструменти, такі як аналіз 21 гена, аналіз геномного показника ступеня і інші аналізи. Методичні рекомендації по лікуванню зазвичай розробляються відомими в даній області експертами. У Європі методичні рекомендації St Gallen 2009 року рекомендували хіміотерапію у пацієнтів з позитивним по HER2 раком молочної залози, а також у пацієнтів з негативним по HER2 і негативним по ER захворюванням. Неясність про користь хіміотерапії виникає у разі пацієнтів з негативним по HER2 і позитивним по ER захворюванням. Щоб прийняти збалансоване рішення для суб'єкта як найбільш корисний критерій використовують вірогідність рецидиву раку. Клінічні критерії, такі як стан лімфатичних вузлів, ступінь пухлини, розмір пухлини та інші, є корисними, оскільки вони забезпечують інформацію про ризик рецидиву. Пізніше було показано, що мультигенні аналізи забезпечують інформацію краще або додатково до стандартних клінічних чинників ризику. Є загальновизнаним, що маркери проліферації, 1 UA 110790 C2 5 10 15 20 25 30 35 40 45 50 55 60 очевидно, забезпечують основну прогностичну інформацію. Відомими прикладами цих прогностичних засобів є тест Mammaprint від Agendia, показник рецидиву від Veridex і геномний індекс ступеня, що розроблений в інституті Jules Bordet і ліцензований для Ipsogen. Всі з цих аналізів засновано на визначенні рівнів експресії щонайменше 70 генів і всі з них були розроблені для РНК, не деградованою значно фіксацією формаліном і зануренням в парафін, а виділеною із свіжої тканини (транспортованою в RNALaterTM). Іншим важливим мультигенним аналізом є тест показника рецидиву від Genomic Health Inc. Цей тест визначає рівень експресії 16 пов'язаних з раком генів і 5 еталонних генів після екстракції РНК з фіксованих у формаліні і занурених в парафін зразків тканини. Проте сучасні інструменти мають недолік відсутності клінічної надійності і застосовності в найбільш важливій клінічній групі ризику, тобто у тих пацієнтів з раком молочної залози, що мають проміжний ризик рецидиву на основі стандартного клінічного параметра. Таким чином, потрібні кращі інструменти для оптимізації прийняття рішення про лікування на основі прогнозу для пацієнта. Для клінічної користі, що полягає в уникненні хіміотерапії, потрібний тест з високою чутливістю і високою негативною прогностичною силою, щоб не піддати пацієнта недостатньому лікуванню, у якого зрештою розвинеться віддалений метастаз після хірургічної операції. Що стосується потреби, що залишається, в матеріалах і способах, придатних для прийняття клінічних рішень відносно ад'ювантної терапії, даний винахід задовольняє потреби в перспективних способах прогнозування раку молочної залози на основі добре доступних клінічних і експериментальних даних. Визначення Якщо не визначено інакше, технічні і наукові терміни, використовувані в цьому документі, мають таке ж значення, яке зазвичай має на увазі фахівець в області, до якої відноситься даний винахід. Термін "рак" не обмежується якою-небудь стадією, ступенем, гістохімічним ступенем, агресивністю або злоякісністю ураженої тканини або клітинного агрегату. Термін "передбачення наслідків" захворювання, як використовують в рамках винаходу, означає як передбачення наслідків у пацієнта, що піддається даній терапії, так і прогноз у пацієнта, якого не піддають лікуванню. Термін "передбачення наслідків", зокрема, може відноситися до ризику розвитку у пацієнта метастаза, локального рецидиву або загибелі. Термін "передбачення", як використовують в рамках винаходу, відноситься до індивідуальної оцінки раки або до очікуваної виживаності (OAS, загальна виживаність або DFS, виживання без захворювання) пацієнта, якщо пухлину лікують даною терапією. В протилежність цьому, термін "прогноз" відноситься до індивідуальної оцінки рака, або до очікуваної виживаності (OAS, загальна виживаність або DFS, виживання без захворювання) у пацієнта, якщо пухлина залишається без лікування. "Результат" в рамках даного винаходу є певним станом, що досягається в ході захворювання. Цей результат захворювання може бути, наприклад, клінічний стан, такий як "рецидив захворювання", "розвиток метастаза", "розвиток вузлового метастаза", "розвиток віддаленого метастаза", "виживання", "загибель", "показник ремісії пухлини", стадія або ступінь захворювання або схожі з ними. Під "ризиком" мають на увазі число, пов'язане з вірогідністю розвитку у суб'єкта або пацієнта або досягнення суб'єктом або пацієнтом певного результату захворювання. Термін "ризик" в контексті даного винаходу не має на увазі наявність якого-небудь позитивного або негативного значення, що мається на увазі, відносно благополуччя пацієнта, а відноситься тільки до можливості або вірогідності виникнення або розвитку даного стану. Термін "клінічні дані" відноситься до всіх доступних даних і інформації, що стосуються стану здоров'я пацієнта, включаючи, але не обмежуючись ними, вік, стать, масу тіла, менопаузальний/гормональний статус, етіопатологічні дані, дані анамнезу, дані, отримані за допомогою діагностичних способів in vitro, таких як гістопатологія, аналізи сечі або крові, дані, отримані способами візуалізації, такими як рентген, комп'ютерна томографія, MRI, PET, spect, ультразвукове дослідження, електрофізіологічні дані, генетичний аналіз, аналіз експресії генів, оцінка за допомогою біопсії, внутрішньоопераційні дані. Термін "позитивний по вузлах", "діагностований як позитивний по вузлах", "залучення вузлів" або "залучення лімфатичних вузлів" означає пацієнта, у якого раніше були діагностовані метастази в лімфатичних вузлах. Це охоплює метастаз як в дренуючий лімфатичний вузол, близькорозташований лімфатичний вузол, так і у віддалений лімфатичний вузол. Цей попередній діагноз не складає частина способу за винаходом. Замість цього, він є передумовою для вибору пацієнтів, зразки яких можна використовувати для одного з варіантів здійснення даного винаходу. Цей попередній діагноз може бути поставлений будь-яким придатним 2 UA 110790 C2 5 10 15 20 25 30 35 40 45 50 55 60 способом, відомим в даній області, включаючи, але не обмежуючись ними, видалення лімфатичних вузлів і патологічний аналіз, аналіз за допомогою біопсії, аналіз біомаркерів in vitro, вказуючих на метастаз, способи візуалізації (наприклад, комп'ютерна томографія, рентген, магнітно-резонансна томографія, ультразвукове дослідження) і внутрішньоопераційні дані. У контексті даного винаходу "біологічним зразком" є зразок, що отриманий з біологічного організму або знаходився у контакті з біологічним організмом. Прикладами біологічних зразків є: клітини, тканина, рідини організму, змивна рідина, мазання, біоптати, кров, сеча, слина, мокрота, плазма, сироватка, супернатант клітинної культури та інші. "Зразком пухлини" є біологічний зразок, що містить пухлинні клітини, або цілі, або зруйновані. Зразок може бути зразком будь-якої біологічної тканини або рідини. Такі зразки включають, але не обмежуються ними, мокроту, кров, сироватку, плазму, клітини крові (наприклад, лейкоцити), тканину, зразки центральної або тонкоігольної біопсії, що містять клітини рідини організму, сечу, рідину черевної порожнини і плевральну рідину, спинномозкову рідину, слізну рідину або клітини, виділені з них. Також вони можуть включати зрізи тканин, такі як заморожені або фіксовані зрізи, узяті для гістологічних цілей або піддані мікродисекції клітини або їх позаклітинні частини. Зразок пухлини, що підлягає аналізу, може бути тканинним матеріалом з неопластичного осередку пошкодження, узятого аспіруванням або пункцією, вирізуванням або будь-яким іншим хірургічним способом, що забезпечує отриманий біопсією або резекцією клітинний матеріал. Такий зразок містить пухлинні клітини або фрагменти пухлинних клітин, отримані від пацієнта. Клітини можуть бути знайдені в клітинному "мазку", узятому, наприклад, шляхом аспірування через соски, лаважа проток, тонкоігольної біопсії або шляхом стимульованого або самовільного виділення з сосків. У іншому варіанті здійснення зразком є рідина організму. Такі рідини включають, наприклад, рідини крові, сироватку, плазму, лімфу, асцитичні рідини, гінекологічні рідини або сечу, але не обмежуючись цими рідинами. "Ген" є набір сегментів нуклеїнової кислоти, який містить інформацію, необхідну для отримання функціонального РНК-продукту. "Продукт гена" є біологічною молекулою, що продукується шляхом транскрипції або експресії гена, наприклад мРНК, кДНК або трансльованого білка. "мРНК" є транскрибованим продуктом гена і цей термін має звичайне значення, що використовується фахівцем в даній області. "Молекула, що походить з мРНК" є молекулою, яка хімічно або ферментативний отримана з мРНК-матриці, такої як кДНК. Термін "рівень експресії" відноситься до певного рівня експресії гена. Це може бути певний рівень експресії гена як абсолютна величина або в порівнянні з еталонним геном (наприклад, геном домашнього господарства), з середнім значенням для двох або більш еталонних генів, або з вирахуваною середньою величиною експресії (наприклад, в аналізі з ДНК-чіпом) або з іншим інформативним геном без застосування еталонного зразка. Рівень експресії гена можна вимірювати прямо, наприклад, шляхом отримання сигналу, де сила сигналу корелює з кількістю мРНК-транскриптів цього гена, або він може бути отриманий непрямо на білковому рівні, наприклад, за допомогою способів імуногістохімії, CISH, ELISA або RIA. Рівень експресії також можна отримувати за допомогою конкурентної реакції з еталонним зразком. Величині експресії, яку визначають шляхом вимірювання деякого фізичного параметра в аналізі, наприклад, випускання флуоресценції, можна привласнювати числове значення, яке можна використовувати для подальшої обробки інформації. "Еталонний профіль рівнів експресії" в рамках винаходу означає будь-який профіль рівнів експресії, який можна використовувати для порівняння з іншим профілем рівнів експресії. У переважному варіанті здійснення винаходу еталонний профіль рівнів експресії є, наприклад, середнім профілем рівнів експресії, що спостерігається в групі здорових суб'єктів, суб'єктів із захворюванням або суб'єктів із захворюванням, яким проводили конкретний тип терапії, службовців як еталонна група, або суб'єкти з хорошим або поганим результатом. Термін "математичне комбінування рівнів експресії" в рамках даного винаходу означає отримання числової величини з певного рівня експресії гена і застосування алгоритму до однієї або декількох таких числових величин для отримання комбінованої величини або комбінованого показника. "Алгоритм" є процес, який здійснює деяку послідовність дій для вироблення інформації. "Показник" є числовою величиною, яка отримана математичним комбінуванням рівнів експресії з використанням алгоритму. Також вона може бути отримана з рівнів експресії і іншої інформації, наприклад, клінічних даних. Показник може бути пов'язаний з результатом захворювання пацієнта. "Дискримінантна Функція" є функцією набору перемінних, використовуваних для класифікації об'єкту або події. Таким чином, дискримінантна функція дозволяє класифікацію 3 UA 110790 C2 5 10 15 20 25 30 35 40 45 50 55 60 пацієнта, зразка або події в категорію або безліч категорій згідно з доступними даними або параметрами від вказаного пацієнта, зразка або події. Така класифікація є стандартним інструментом статистичного аналізу, добре відомим кваліфікованому спеціалісту. Наприклад, пацієнта можна класифікувати як такого, що "має високий ризик" або що "має низький ризик", "має високу вірогідність метастаза" або що "має низьку вірогідність метастаза", що "потребує лікування" або "не потребує лікування" згідно даним, отриманим від вказаного пацієнта, зразка або події. Класифікація не обмежується "високим проти низького", а може здійснюватися на безліч категорій, ступенів або подібних з ними. Класифікацію також слід розуміти в ширшому сенсі як відрізняючий показник, де, наприклад, вищий показник відповідає вищій вірогідності віддаленого метастаза, наприклад, (загальний) ризик віддаленого метастаза. Приклади функцій дискримінантів, які дозволяють класифікацію, включають, але не обмежуються ними, функції, що визначаються методом опорних векторів (SVM), методом к-найближчих сусідів (kNN), (наївні) байесовскі моделі, моделі лінійної регресії або фрагментарно визначені функції, наприклад, такі як при виявленні підгруп, в деревовидній схемі рішень, в логічному аналізі даних (LAD) і тому подібне. У ширшому значенні, прикладами для цілей ілюстрації є величини безперервних показників математичних методів або алгоритмів, таких як коефіцієнти кореляції, проекції, показники методу опорних векторів, інші способи на основі схожості, їх комбінації і тому подібне. Термін "методика лікування", "порядок лікування", "режим", а також "режим лікування" відноситься до послідовного або одночасного за часом проведення введення протипухлинних, і/або антиваскулярних, і/або стимулюючих імунну систему засобів, і/або засобів, що забезпечують проліферацію клітин крові, і/або променевої терапії, і/або гіпертермії, і/або гіпертермії для лікування раку. Їх введення можна проводити в ад'ювантному і/або неоад'ювантному порядку. Склад такого "протоколу" може варіювати з погляду дози одного засобу, тимчасових рамок застосування і частоти введення в межах певного терапевтичного діапазону. В даний час проводяться дослідження різних комбінацій різних лікарських засобів і/або фізичних способів, і різних схем. Термін "цитотоксична хіміотерапія" відноситься до різних методик лікування, що впливають на проліферацію і/або виживання клітин. Лікування може включати введення алкілуючих засобів, антиметаболітів, антрациклінів, алкалоїдів рослин, інгібіторів топоізомерази і інших протипухлинних засобів, включаючи моноклональні антитіла і інгібітори кінази. Зокрема, цитотоксичне лікування може відноситися до лікування таксанами. Таксани є алкалоїдами рослин, які блокують ділення клітин шляхом перешкоди функціонуванню мікротрубочок. Прототипним таксаном є природний продукт паклитаксел, початково відомий як таксол і вперше отриманий з кори тиса тихого. Доцетаксел є напівсинтетичним аналогом паклитаксела. Таксани підвищують стабільність мікротрубочок, перешкоджаючи розбіжності хромосом в ході анафази. Термін "ендокринне лікування" або "гормональне лікування" (також іноді зване "антигормональним лікуванням") означає лікування, яке націлене на передачу сигналу гормонами, наприклад, інгібування гормонів, інгібування рецепторів гормонів, використання агоністів або антагоністів рецепторів гормонів, використання рецепторів-сміттярів або сирітських рецепторів, використання похідних гормонів і перешкода продукуванню гормонів. Конкретним прикладом є терапія тамоксифеном, яка модулює передачу сигналу рецептором естрогену, або ароматазне лікування, яке перешкоджає продукуванню стероїдних гормонів. Тамоксифеном є перорально активний селективний модулятор рецепторів естрогену (SERM), який застосовують для лікування рака молочної залози, і в даний час він є лікарським засобом, що найбільш продається в світі, для цієї мети. Тамоксифен продається під торговими назвами Nolvadex, Istubal і Valodex. Проте цей лікарський засіб, навіть до закінчення дії патенту на нього, був і залишається широко згадуваним за його непатентованим найменуванням "тамоксифен". Тамоксифен і похідні тамоксифену конкурентно зв'язуються з рецепторами естрогену на пухлинах і інших тканинних мішенях, утворюючи ядерний комплекс, який знижує синтез РНК і інгібує ефекти естрогену. Рецепторами стероїдів є внутріклітинні рецептори (як правило, цитоплазма), які здійснюють передачу сигналу стероїдних гормонів. Їх приклади включають рецептори типу I, зокрема, рецептори статевих гормонів, наприклад, рецептор андрогенів, рецептор естрогену, рецептор прогестерону; рецептор глюкокортикоїдів, рецептор мінералокортикоїдів; і рецептори типу II, наприклад, рецептор вітаміну A, рецептор вітаміну D, рецептор ретиноїдів, рецептор гормону щитовидної залози. Термін "спосіб на основі гібридизації", як використовують в рамках винаходу, відноситься до способів, що залучають процес об'єднання комплементарних одноланцюжкових нуклеїнових 4 UA 110790 C2 5 10 15 20 25 30 35 40 45 50 55 60 кислот або нуклеотидних аналогів в одну дволанцюжкову молекулу. Нуклеотиди або нуклеотидні аналоги зв'язуються з комплементарними ним молекулами в нормальних умовах, так що дві абсолютно комплементарних нитки легко зв'язуються одна з одною. У біоаналізах дуже часто використовують мічені одноланцюжкові зонди для пошуку комплементарних послідовностей-мішеней. Якщо такі послідовності існують в зразку, зонди гібридизуються з вказаними послідовностями, які потім можна виявляти завдяки мітці. Інші способи на основі гібридизації включають способи на мікроматрицях і/або біочіпах. У цих способах зонди імобилизують на твердій фазі, яку потім контактують із зразком. Якщо в зразку існують комплементарні нуклеїнові кислоти, вони гібридизуються із зондами, і, таким чином, їх можна виявити. Ці підходи також відомі як "способи на основі чіпів". Іншим способом на основі гібридизації є ПЦР, яка описана нижче. Коли потрібне визначення рівнів експресії, способи на основі гібридизації, наприклад, можна використовувати для визначення кількості мРНК даного гена. Олігонуклеотид, здатний специфічно зв'язуватися з послідовностями гена або їх фрагментами, відноситься до олігонуклеотида, який специфічно гібридизується з геном або продуктом гена, таким як мРНК або кДНК гена, або з його фрагментом. Для специфічної детекції гена або продукту гена необов'язково виявляти всю послідовність гена. Фрагмент розміром приблизно 20-150 основ містить достатню специфічну інформацію про послідовність для забезпечення специфічної гібридизації. Термін "спосіб на основі ПЦР", як використовують в рамках винаходу, відноситься до способів, що включають полімеразну ланцюгову реакцію (ПЦР). Вона є способом експоненціальної ампліфікації нуклеїнових кислот,наприклад ДНК, шляхом ферментативної реплікації in vitro. Оскільки ПЦР є технологією in vitro, її можна проводити без обмежень форми ДНК, і її можна широко модифікувати для проведення широкого набору генетичних маніпуляцій. Коли потрібно визначити рівні експресії, спосіб на основі ПЦР можна використовувати, наприклад, для детекції присутності даної мРНК шляхом (1) зворотної транскрипції повного набору мРНК (так званого транскриптома) в кДНК за допомогою ферменту зворотної транскриптази, і (2) детекції присутності даної кДНК за допомогою відповідних праймерів. Цей підхід широко відомий як ПЦР із зворотною транскриптазою (ОТ-ПЦР). Більш того, способи на основі ПЦР включають, наприклад, ПЦР в реальному часі, і, зокрема, придатні для аналізу рівнів експресії, кінетичної або кількісною ПЦР (q-ПЦР). Термін "кількісна ПЦР" (q-ПЦР)" відноситься до будь-якого типу способу ПЦР, який дозволяє кількісне визначення матриці в зразку. Кількісна ПЦР в реальному часі включає різні способи виконання або детекції продуктів, як наприклад, спосіб TaqMan або спосіб LightCycler. Наприклад, в способі TaqMan використовується флуорогенний зонд з подвійним міченням. У ПЦР в реальному часі TaqMan вимірюється накопичення продукту через флуорофор на експоненціальних стадіях ПЦР, а не на кінцевій стадії, як в загальноприйнятій ПЦР. Експоненціальне збільшення продукту використовують для визначення порогового циклу, CT, тобто кількості циклів ПЦР, при якому виявляється значне експоненціальне збільшення флуоресценції, і яке прямо корелює з кількістю копій ДНК-матриці, присутніх в реакції. Умови реакції у високому ступені схожі із загальноприйнятою ПЦР, проте її проводять в термоблоці для аналізу в реальному часі, який дозволяє вимірювання флуоресцентних молекул в пробірках для ПЦР. На відміну від звичайної ПЦР, в ПЦР в реальному часі TaqMan в реакційну суміш додають зонд, тобто одноланцюжковий олігонуклеотид, комплементарний сегменту із 20-60 нуклеотидів в ДНК-матриці і розташований між двома праймерами. З 5'- і 3'-кінцями зонду пов'язані флуоресцентний репортер або флуорофор (наприклад, 6-карбоксифлуоресцеїн, скорочена назва: FAM, або тетрахлорфлуоресцеїн, скорочена назва: TET) і гасильник (наприклад, тетраметилродамин, скорочена назва: TAMRA, або дигідроциклопірролоіндолтрипептидний "гасильник black hole" скорочена назва: BHQ), відповідно [2]. Близьке розташування флуорофору і гасильника, пов'язаних із зондом, інгібує флуоресценцію флуорофору. В процесі ПЦР, з початком синтезу ДНК, 5'-3' екзонуклеазна активність Taq-полімерази порушує це співвідношення в зонді, який піддався відпалу з матрицею. Деградація зонда вивільняє флуорофор з нього і порушує близьке розтатування до гасильника, таким чином, усуваючи ефект гасіння і забезпечуючи флуоресценцію флуорофору. Таким чином, флуоресценція, що виявляється в термоблоці ПЦР в реальному часі, прямо пропорційна вивільненому флуорофору і кількості ДНК-матриці, присутньої в ПЦР. Під "матрицею" або "впорядкованою системою" мають на увазі розташування областей, що адресуються, або "адресу" на пристрої. Положення можуть бути організовані у вигляді двомірних матриць, тривимірних матриць або інших форматів впорядкованих систем. Кількість положень може знаходитися в діапазоні від декількох до щонайменше сотень тисяч. Найбільш 5 UA 110790 C2 5 10 15 20 25 30 35 40 45 50 55 60 важливо, кожнм розташуванням є повністю незалежна реакційна ділянка. Матриці включають, але не обмежуються ними, матриці нуклеїнових кислот, матриці білків і матриці антитіл. "Матриця нуклеїнових кислот" відноситься до матриці, що містить зонди нуклеїнових кислот, такі як олігонуклеотиди, нуклеотидні аналоги, полінуклеотиди, полімери нуклеотидних аналогів, morpholinos або крупніші частини генів. Нуклеїнова кислота і/або аналог на матриці переважно є одноланцюжковими. Матриці, де зонди є олігонуклеотиди, називають "олігонуклеотидними матрицями" або "олігонуклеотидними чіпами". "Мікроматриця" в справжньому описі також відноситься до "біочіпа" або "біологічного чіпа", матриці з ділянок, що має щільність окремих ділянок щонайменше приблизно 100/см2, і переважно щонайменше приблизно 1000/см2. "Пари праймерів" і "зонди" в рамках винаходу мають звичайне значення цього терміну, яке добре відоме фахівцеві в області молекулярної біології. У переважному варіанті здійснення винаходу "пари праймерів" і "зонди" означають полінуклеотидні молекули, що мають послідовність, ідентичну, комплементарну, гомологічну областям полінуклеотиду-мішені, або гомологічну комплементарній послідовності областей полінуклеотиду-мішені, який підлягає детекції або кількісному визначенню. Інший варіант здійснення також включає нуклеотидні аналоги для застосування як праймери і/або зонди. Технології зондів, використовуваних для застосування в кінетичній ПЦР або ПЦР в реальному часі, можуть бути, наприклад, системи TaqMan®, що отримуються від Applied Biosystems, зонди для подовження, такі як Scorpion® Primers, подвійні гібридизаційні зонди Amplifluor®, що отримуються від Chemicon International, Inc, або малоборознисті ліганди. "Індивідуально мічені зонди" в рамках винаходу означають молекулярні зонди, що містять полінуклеотид, олігонуклеотид або нуклеотидний аналог і мітку, яка сприяє детекції або кількісному визначенню зонда. Переважними мітками є флуоресцентні молекули, люмінесцентні молекули, радіоактивні молекули, ферментні молекули і/або молекули гасників. "Розміщені зонди" в рамках винаходу означає набір имобілізованих зондів, переважно у впорядкованому розташуванні. У переважному варіанті здійснення винаходу окремі "розміщені зонди" можуть бути ідентифіковані по їх відповідному положенню на твердій підкладці, наприклад, на "чіпі". При використанні відносно послідовності одноланцюжкової нуклеїнової кислоти, термін "по суті гомологічний" відноситься до будь-якого зонду, який може гібризуватися (тобто він є комплементарною послідовністю для) з послідовністю одноланцюжкової нуклеїнової кислоти в умовах низької жорсткості, як описано вище. Суть винаходу У загальних рисах, даний винахід відноситься до способу оцінки ризика рецидиву у пацієнта з негативним або позитивним по вузлах, позитивних по рецептору естрогену і негативних по HER2/NEU раком молочної залози, зокрема, у пацієнтів, яким проводять ендокринну терапію, наприклад, при лікуванні тамоксифеном. Статус рецепторів естрогену, як правило, визначають з використанням імуногістохімії, статус HER2/NEU (ERBB2), як правило, визначають з використанням імуногістохімії і флуоресцентної гібридизації in situ. Проте для цілей винаходу статус рецепторів естрогену і статус HER2/NEU (ERBB2) можна визначати за допомогою будь-якого придатного способу, наприклад, імуногістохімії, флуоресцентній гібридизації in situ (FISH) або аналіза експресії РНК. Даний винахід відноситься до способу передбачення результату рака молочної залози у пацієнта з раком молочної залози, що має позитивну по рецептору естрогену і негативну по HER2 пухлину, причому вказаний спосіб включає: (a) визначення в зразку пухлини від вказаного пацієнта рівнів експресії РНК щонайменше 2 з наступних 9 генів: UBE2C, BIRC5, RACGAP1, DHCR7, STC2, AZGP1, RBBP8, IL6ST і MGP; (b) математичне комбінування величин рівня експресії для генів вказаного набору, причому ці величини визначають в зразку пухлини з отриманням комбінованого показника, де вказаний комбінований показник указує на прогноз у вказаного пацієнта. У одному варіанті здійснення вибирають щонайменше 3, 4, 5 або 6 генів. У наступному варіанті здійснення винаходу спосіб включає: (a) визначення в зразку пухлини від вказаного пацієнта рівнів експресії РНК наступних 8 генів: UBE2C, RACGAP1, DHCR7, STC2, AZGP1, RBBP8, IL6ST і MGP; (b) математичне комбінування величин рівня експресії для генів вказаного набору, причому ці величини визначають в зразку пухлини з отриманням комбінованого показника, де вказаний комбінований показник указує на прогноз у вказаного пацієнта. У наступному варіанті здійснення спосіб за винаходом включає: (a) визначення в зразку пухлини від вказаного пацієнта рівнів експресії РНК наступних 8 генів: UBE2C, BIRC5, DHCR7, STC2, AZGP1, RBBP8, IL6ST і MGP; 6 UA 110790 C2 5 10 15 20 25 30 35 40 45 50 55 (b) математичне комбінування величин рівня експресії для генів вказаного набору, причому ці величини визначають в зразку пухлини з отриманням комбінованого показника, де вказаний комбінований показник указує на прогноз у вказаного пацієнта. У іншому варіанті здійснення винаходу BIRC5 може бути замінений UBE2C, або TOP2A, або RACGAP1, або AURKA, або NEK2, або E2F8, або PCNA, або CYBRD1, або DCN, або ADRA2A, або SQLE, або CXCL12, або EPHX2, або ASPH, або PRSS16, або EGFR, або CCND1, або TRIM29, або DHCR7, або PIP, або TFAP2B, або WNT5A, або APOD, або PTPRT, за умови, що після заміни вибирають 8 різних генів; і UBE2C може бути замінений BIRC5, або RACGAP1, або TOP2A, або AURKA, або NEK2, або E2F8, або PCNA, або CYBRD1, або ADRA2A, або DCN, або SQLE, або CCND1, або ASPH, або CXCL12, або PIP, або PRSS16, або EGFR, або DHCR7, або EPHX2, або TRIM29 за умови, що після заміни вибирають 8 різних генів; і DHCR7 може бути замінений AURKA, BIRC5, UBE2C або будь-яким іншим геном, який може замінювати BIRC5 або UBE2C, за умови, що після заміни вибирають 8 різних генів; і STC2 може бути замінений INPP4B, або IL6ST, або SEC14L2, або MAPT, або CHPT1, або ABAT, або SCUBE2, або ESR1, або RBBP8, або PGR, або PTPRT, або HSPA2, або PTGER3, за умови, що після заміни вибирають 8 різних генів; і AZGP1 може бути замінений PIP, або EPHX2, або PLAT, або SEC14L2, або SCUBE2, або PGR за умови, що після заміни вибирають 8 різних генів; і RBBP8 може бути замінений CELSR2, або PGR, або STC2, або ABAT, або IL6ST за умови, що після заміни вибирають 8 різних генів; і IL6ST може бути замінений INPP4B, або STC2, або MAPT, або SCUBE2, або ABAT, або PGR, або SEC14L2, або ESR1, або GJA1, або MGP, або EPHX2, або RBBP8, або PTPRT, або PLAT за умови, що після заміни вибирають 8 різних генів; і MGP може бути замінений APOD, або IL6ST, або EGFR за умови, що після заміни вибирають 8 різних генів. Згідно одному аспекту винаходу передбачений спосіб, як описано вище, де вказаний комбінований показник указує на користь цитотоксичної хіміотерапії. Використання способу за винаходом до проведення у пацієнта ендокринної терапії дозволяє передбачення ефективності ендокринної терапії. У таблиці 2 нижче показано, чи указує надекспресія кожного з представлених вище маркерних генів на хороший результат або на поганий результат у пацієнта, якому проводять ендокринну терапію. Таким чином, кваліфікований фахівець може сконструювати математичну комбінацію, тобто алгоритм, враховуючи ефект даних генів. Наприклад, підсумовування або зважене підсумовування генів, надекспресія яких указує на хороший результат, забезпечує алгоритм, де високий показник ризику указує на хороший результат. Надійність алгоритму можна досліджувати шляхом аналізу зразків пухлин пацієнтів з історією хвороби, де, наприклад, показник для пацієнтів з хорошим результатом і для пацієнтів з поганим результатом можна визначати окремо і порівнювати. Кваліфікованому фахівцеві, біостатистикові, відоме застосування інших математичних методів, таких як дискримінантні функції, для отримання оптимізованих алгоритмів. Алгоритми можна оптимізувати, наприклад, для чутливості або специфічності. Алгоритми можна адаптувати для конкретної аналітичної платформи, використовуваної для вимірювання експресії маркерних генів, такий як кількісна ПЦР. Згідно одному аспекту винаходу передбачений спосіб, як описано вище, де вказана ендокринна терапія включає тамоксифен або інгібітор ароматази. Згідно одному аспекту винаходу передбачений спосіб, як описано вище, де передбачають ризик розвитку рецидиву. Згідно одному аспекту винаходу передбачений спосіб, як описано вище, де вказаний рівень експресії визначають як рівень небілкової експресії. Згідно одному аспекту винаходу передбачений спосіб, як описано вище, де вказаний рівень експресії визначають як рівень експресії РНК. Згідно одному аспекту винаходу передбачений спосіб, як описано вище, де вказаний рівень експресії визначають з допомогою щонайменше одного з: спосіб на основі ПЦР спосіб на основі мікроматриці, і спосіб на основі гібридизації. Згідно одному аспекту винаходу передбачений спосіб, як описано вищим, де вказане визначення рівнів експресії проводять у фіксованому у формаліні зануреному в парафін зразку пухлини або в свіжозамороженому зразку пухлини. 7 UA 110790 C2 5 10 15 20 25 30 35 40 45 50 55 Згідно одному аспекту винаходу передбачений спосіб, як описано вище, де рівень експресії вказаного щонайменше одного маркерного гена визначають як патерн експресії відносно щонайменше одного еталонного гена, або щодо обчисленої середньої величини експресії. Згідно одному аспекту винаходу передбачений спосіб, як описано вище, де вказана стадія математичного комбінування включає стадію застосування алгоритму до величин, характерних для рівня експресії даного гена. Згідно одному аспекту винаходу передбачений спосіб, як описано вище, де вказаним алгоритмом є лінійне комбінування вказаних величин, характерних для рівня експресії даного гена. Згідно одному аспекту винаходу передбачений спосіб, як описано вище, де величину, характерну для рівня експресії даного гена, множать на коефіцієнт. Згідно одному аспекту винаходу передбачений спосіб, як описано вище, де для вказаного комбінованого показника визначають одне, два або більш порогових значень і його виділяють в групи високого і низького ризику, високого, проміжного і низького ризику, або більшу кількість груп ризику шляхом застосування порогового значення до комбінованого показника. Згідно одному аспекту винаходу передбачений спосіб, як описано вище, де високий комбінований показник указує на користь агресивнішої терапії, наприклад, цитотоксичної хіміотерапії. Кваліфікованому фахівцеві зрозуміло, що "високий показник" в цьому відношенні відноситься до еталонної величини або порогової величини. Крім того, кваліфікованому фахівцеві зрозуміло, що, залежно від конкретного алгоритму, використовуваного для отримання комбінованого показника, також "низький" показник нижче за межу або еталонну величину може указувати на користь агресивнішої терапії, наприклад, цитотоксичної хіміотерапії. Це відбувається у тому випадку, коли гени, що мають позитивну кореляцію з високим ризиком метастазів, враховуються в алгоритмі з позитивним коефіцієнтом, так що загальний високий показник указує на високу експресію генів, що мають позитивну кореляцію з високим ризиком. Згідно одному аспекту винаходу передбачений спосіб, як описано вище, де інформація, що стосується статусу вузлів у пацієнта, обробляється на стадії математичного комбінування величин рівня експресії генів з отриманням комбінованого показника. Згідно одному аспекту винаходу передбачений спосіб, як описано вище, де вказана інформація, що стосується статусу вузлів, є числовою величиною >0, якщо вказаний статус вузлів є негативним, і вказана інформація є числовою величиною >0, якщо статус вузлів є позитивним або невідомим. У ілюстративних варіантах здійснення винаходу негативному статусу вузлів привласнюють величину 0, невідомому статусу вузлів привласнюють величину 0,5 і позитивному статусу вузлів привласнюють величину 1. Можна вибирати інші величини, так щоб вони відображали різну вагу статусу вузлів в алгоритмі. Крім того, винахід відноситься до набору для виконання способу, як описано вище, причому вказаний набір містить набір олігонуклеотидів, здатних специфічно зв'язувати послідовності, або зв'язуватися з послідовностями, фрагментів генів в комбінації генів, де (i) вказана комбінація містить щонайменше 8 генів: UBE2C, BIRC5, DHCR7, STC2, AZGP1, RBBP8, IL6ST і MGP; або (ii) вказана комбінація містить щонайменше 10 генів: BIRC5, AURKA, PVALB, NMU, STC2, RBBP8, PTGER3, CXCL12, CDH1 і PIP; або (iii) вказана комбінація містить щонайменше 9 генів BIRC5, DHCR7, RACGAP1, PVALB, STC2, IL6ST, PTGER3, CXCL12 і ABAT; або (iv) вказана комбінація містить щонайменше 9 генів: DHCR7, RACGAP1, NMU, AZGP1, RBBP8, IL6ST і MGP; Крім того, винахід відноситься до застосування набору для здійснення способу за будь-яким з пп.1-17 формули винаходу, причому вказаний набір містить набір олігонуклеотидів, здатних специфічно зв'язувати послідовності, або зв'язуватися з послідовностями, фрагментів генів в комбінації генів, де (i) вказана комбінація містить щонайменше 8 генів: UBE2C, BIRC5, DHCR7, STC2, AZGP1, RBBP8, IL6ST і MGP; або (ii) вказана комбінація містить щонайменше 10 генів BIRC5, AURKA, PVALB, NMU, STC2, RBBP8, PTGER3, CXCL12, CDH1 і PIP; або (iii) вказана комбінація містить щонайменше 9 генів: BIRC5, DHCR7, RACGAP1, PVALB, STC2, IL6ST, PTGER3, CXCL12 і ABAT; або (iv) вказана комбінація містить щонайменше 9 генів: DHCR7, RACGAP1, NMU, AZGP1, RBBP8, IL6ST і MGP; 19. Комп'ютерний програмний продукт, здатний обробляти величини, характерні для рівня експресії генів AKR1C3, MAP4 і SPP1, шляхом математичного 8 UA 110790 C2 5 10 15 20 25 30 35 40 45 50 55 60 комбінування вказаних величин з отриманням комбінованого показника, де вказаний комбінований показник указує на користь цитотоксичної хіміотерапії у вказаного пацієнта. Крім того, винахід відноситься до комп'ютерного програмного продукту, здатного обробляти величини, характерні для рівнів експресії комбінації генів, шляхом математичного комбінування вказаних величин з отриманням комбінованого показника, де вказаний комбінований показник указує на ефективність або користь ендокринної терапії вказаного пацієнта, згідно з описаними вище способами. Вказаний комп'ютерний програмний продукт може зберігатися на носієві даних або він може бути реалізований в діагностичній системі, здатній видавати величини, характерні для рівня експресії даного гена, такий як система ПЦР в реальному часі. Якщо комп'ютерний програмний продукт зберігається на носієві даних або виконується на комп'ютері, працівник, що управляє, може вводити величини експресії, отримані для рівня експресії відповідних генів. Потім комп'ютерний програмний продукт може застосовувати алгоритм для отримання комбінованого показника, вказуючого на користь цитотоксичної хіміотерапії для даного пацієнта. Способи за даним винаходом мають перевагу забезпечення надійного передбачення результату захворювання на основі використання тільки невеликої кількості генів. Було виявлено, що способи за даним винаходом особливо придатні для аналізу відповіді на ендокринне лікування, наприклад, тамоксифеном, у пацієнтів з пухлинами, класифікованими як позитивні по ESR1 і негативні по ERBB2. Докладний опис винаходу Винахід пояснено за допомогою ілюстративних варіантів здійснення і фігур, що додаються: На фиг.1 представлений графік типу "форрест-плот" для скоректованого відношення ризиків з 95 % довірчим інтервалом для показника T5 в комбінованій групі, а також в окремих ланках лікування досліджень ABCSG06 і 08, з використанням віддаленого метастаза як результат. На фиг.2 представлений аналіз Каплана-Мейера пацієнтів ER+, HER-, N0-3 з комбінованих груп ABCSG06 і 08, стратифікованих як високий або низький ризик згідно величині показника T5. У даному описі описані унікальні комбінації маркерних генів, які можна комбінувати в алгоритм для представленого в даному описі нового передбачуваного тесту. Технічно, спосіб за винаходом можна застосовувати на практиці з використанням двох технологій: 1.) Виділення загальної РНК зі свіжої або фіксованої пухлинної тканини і 2.) Кінетична ОТ-ПЦР виділених нуклеїнових кислот. Альтернативно передбачається вимірювання рівнів експресії з використанням альтернативних технологій, наприклад, за допомогою мікроматриці, або шляхом вимірювання на білковому рівні. Способи за винаходом засновані на кількісному визначенні молекул РНК, виділених з пухлини, для отримання величин експресії і подальшого біоинформативного аналізу вказаних певних величин експресії. Молекули РНК можна виділяти з будь-якого типу зразка пухлини, наприклад, біоптатів, мазків, підданого резекції матеріалу пухлини, свіжозамороженій тканині пухлини або із зануреної в парафін і фіксованої у формаліні пухлинної тканини. По-перше, визначають рівні РНК генів, що кодують конкретні комбінації генів UBE2C, BIRC5, DHCR7, RACGAP1, AURKA, PVALB, NMU, STC2, AZGP1, RBBP8, IL6ST, MGP, PTGER3, CXCL12, ABAT, CDH1 і PIP, або їх конкретні комбінації, як вказано. Виходячи з цих величин експресії, обчислюють прогностичний показник шляхом математичного комбінування, наприклад, згідно формулам T5, T1, T4 або T5b (див. нижче). Висока величина показника указує на високий ризик розвитку віддаленого метастаза, низька величина показника указує на низький ризик віддаленого метастаза. Отже, високий показник також указує на те, що пацієнт є пацієнтом з високим ризиком, для якого буде корисна агресивніша терапія, наприклад, цитотоксична хіміотерапія. Представлені приклади засновані на ідентифікації прогностичних генів з використанням пухлин пацієнтів з гомогенним лікуванням в ад'ювантному режимі тамоксифеном. Більш того, ідентифікація відповідних генів була обмежена пухлинами, класифікованими як позитивні по ESR1 і негативні по ERBB2, виходячи з рівнів експресії РНК. Крім того, для розробки алгоритму розглядали гени, що дозволяють виділяти пухлини проміжного ризику, ступені 2. Нарешті, проводили перенесення платформи з матриць Affymetrix HG U133a на кількісну ПЦР в реальному часі, а також перемикання типу зразка зі свіжозамороженої тканини на тканину FFPE для забезпечення надійного виконання алгоритму, незалежно від платформи і типу тканини. В результаті визначення рівня експресії молекули РНК з первинної пухлини і подальший комплексний і багатофакторний аналіз, як описано вище, забезпечують кращий спосіб передбачення вірогідності рецидиву захворювання у пацієнтів, у яких діагностований негативний або позитивний по лімфатичних вузлах ранній рак молочної залози, при лікуванні 9 UA 110790 C2 5 10 15 20 25 30 35 40 45 50 55 60 тільки тамоксифеном в ад'ювантному режимі. Таким чином, тест заснований на меншій кількості генів, ніж конкуруючі тести, але забезпечує кращу інформацію з погляду високої чутливості і негативної передбачуваної величини, зокрема, для пухлин, що вважаються такими, які проявляють проміжний ризик рецидиву, виходячи із стандартних клінічних чинників. Тотальну РНК екстрагували способом Siemens, заснованим на гранулах з кремнезема і який є повністю автоматизованим способом виділення РНК, з одного цілісного 10-мкм зрізу тканини FFPE на роботові для роботи з рідинами Hamilton MICROLAB STARlet (17). Робот, буфери і хімічні реагенти були частиною системи Siemens VERSANT® kPCR Molecular System (Siemens Healthcare Diagnostics, Tarrytown, NY; не є комерційно доступною в США). У короткому викладі, 150 мкл буфера FFPE (буфер FFPE, реагент для дослідження, Siemens Healthcare Diagnostics) додавали до кожного зрізу і інкубували протягом 30 хвилин при 80 °C при струшуванні для плавлення парафіну. Після охолоджування додавали протеазу K і інкубували протягом 30 хвилин при 65 °C. Після лізису залишковий дебрис тканині видаляли з рідини для лізису за допомогою стадії інкубації протягом 15 хвилин при 65 °C з 40 мкл покритих кремнеземом гранул оксиду заліза. Гранули зі зв'язаним з поверхнею дебрисом відокремлювали за допомогою магніта і лізати переносили в стандартний 2-мл планшет з глибокими лунками (96 лунок). У них тотальну РНК і ДНК пов'язувала з 40 мкл невикористаних гранул і інкубувала при кімнатній температурі. Хаотропні умови отримували шляхом додавання 600 мкл буфера для лізису. Потім, гранули піддавали магнітному розділенню і супернатанти видаляли. Після цього зв'язані з поверхнею нуклеїнові кислоти промивали три рази з подальшим застосуванням намагнічення, аспірування і видалення супернатантів. Після цього нуклеїнові кислоти елюювали шляхом інкубації гранул з 100 мкл буфера для елюювання протягом 10 хвилин при 70 °C при струшуванні. Нарешті, гранули відокремлювали і супернатант інкубували з 12 мкл суміші ДНКази I (2 мкл ДНКази I (без РНКази); 10 мкл 10x буфера ДНКази I; Ambion/Applied Biosystems, Darmstadt, Німеччина) для видалення контамінучої ДНК. Після інкубації протягом 30 хвилин при 37 °C, розчин, що не містить ДНК, тотальною РНК розділяли на аліквоти і зберігали при-80 °C, або безпосередньо використовували для аналізу експресії мРНК за допомогою кінетичної ПЦР із зворотною транскрипцією (RTkPCR). Всі зразки аналізували за допомогою одностадійної Отk-ПЦР відносно експресії аж до трьох еталонних генів (RPL37A, CALM2, OAZ1) і аж до 16 генівмішеней в ABI PRISM® 7900HT (Applied Biosystems, Darmstadt, Німеччина). Систему для одностадійної кількісної ОТ-ПЦР Superscript® III Platinum® з ROX (6-карбокси-X-родамін) (Invitrogen, Karlsruhe, Німеччина) використовували згідно інструкціям виготівника. Відповідні зонди і праймери представлені в таблиці 1. Умови ПЦР були наступними: 30 хвилин при 50 °C, 2 хвилини при 95 °C, а потім 40 циклів по 15 секунд при 95 °C і 30 секундах при 60 °C. Всі аналізи ПЦР проводили у трьох екземплярах. Як замісний маркер для виходу РНК використовували порогову (Ct) величину циклів для гена домашнього господарства RPL37A, як описано в літературі (17). Відповідні рівні експресії генів-мішеней обчислювали способом дельта-Ct з використанням формули: 20-(Ct(мішень) -середнє значення (Ct (еталонні гени))). Перенесення платформи з матриць Affymetrix HG U133a (свіжозаморожена тканина) на кількісну ПЦР в реальному часі обчислювали таким чином. Проводили вимірювання для матеріалу від 158 пацієнтів з використанням обох платформ з отриманням парних вибірок. З даних ПЦР обчислювали величини дельта-Ct. З даних Affymetrix обчислювали Log2-вираження шляхом застосування нижньої межі (що встановлює всі величини нижче за нижню межу як нижню межу), а потім обчислюючи логарифм з основою 2. Застосування нижньої межі знижує ефект збільшеного відносного шумового сигналу при вимірюванні для генів/зразків з низькою експресією; використовували нижню межу 20, також придатна нижня межа від 0,1 до 200. Для кожного заміряного способом ПЦР гена був вибраний набір зондів HG-U133a шляхом максимізації коефіцієнта кореляції Пірсона між величиною дельта-Ct (від ПЦР) і log2вираженням (від Affymetrix). Також придатні інші заходи кореляції, наприклад, коефіцієнт кореляції Спірмана. В більшості випадків найкращий корелюючий набір зондів належав передбачуваному гену, для решти випадків ПЦР-ген видаляли для подальшої обробки. Гени, що демонструють погану кореляцію між платформами, також видаляли, де використовували поріг коефіцієнта кореляції Пірсону, рівний 0,7 (також придатні величини від 0,5 до 0,8). Перенесення платформи завершували обчисленням тих, що не піддавалися контролю zпереходів для обох платформ і комбінуванням їх; потім єдину величину Пцр-дельта-ct трансформували в шкалу Affymetrix за допомогою наступних стадій: (i) застосувати афінну лінійну трансформацію, де коефіцієнти визначають за допомогою z-трансформації даних ПЦР, (ii) застосувати зворотну афінну лінійну трансформацію, де коефіцієнти визначали за допомогою z-трансфорів даних Affymetrix, (iii) інвертувати log2, тобто обчислити експоненціал 10 UA 110790 C2 по відношенню до основи 2. Альтернативами двократним z-трансформаціям є лінійна регресія або регресія вищого порядку, стійка регресія, або основні компонентні способи, які також є придатними. Послідовності праймерів і зондів були наступними: 5 10 У таблиці 2 нижче представлені гени, використані в способах за винаходом і в конкретних варіантах здійснення T5, T1, T4 і T5b. Також в таблиці 2 показано, чи указує надекспресія даного гена на хороший або поганий результат при терапії тамоксифеном. У таблиці 2 приведена функція гена, компартментна локалізація в клітині і клітинні процеси, в які він залучений. 11 UA 110790 C2 Таблиця 2 Перелік генів для алгоритмів T5, T1, T4 і T5b Ген UBE2C BIRC5 Назва убіквітинкон'югуючий фермент E2C бакуловірусний IAPповтор, що містить, 5 Висока експресія Функція Компонент Поганий результат зв'язування ATP цитозоль Поганий результат зв'язування GTP-ази Ran цитозоль клітинний цикл мембрана ендоплазматичної мережі регуляція проліферації кліток цитоплазма клітинний цикл центросома мітотичний клітинний цикл Поганий результат Поганий результат Поганий результат активність 7дегідрохолестеринредуктази активність активатора GTP-ази зв'язування ATP зв'язування іонів кальцію зв'язування рецепторів Хороший результат активність гормону позаклітинна область AZGP1 альфа-2глікопротеїн 1 Хороший результат активність трансмембранного переносника білків позаклітинна область RBBP8 ретинобластомний зв'язуючий білок 8 Хороший результат зв'язування білків ядро IL6ST передавач сигналу інтерлейкину 6 Хороший результат MGP матриксний білок Gla Хороший результат PTGER3 рецептор 3 простагландину E Хороший результат CXCL12 ліганд 12 хемокіна (мотив C-XC) Хороший результат рецепторна активність структурний компонент позаклітинного матриксу активність лігандзалежного рецептора активність хемокіна Хороший результат активність трансферази Хороший результат зв'язування молекул плазматична клітинної адгезії мембрана DHCR7 7-дегідрохолестеринредуктаза RACGAP1 Активуючий GTP-азу Поганий Rac білок 1 результат AURKA кіназа aurora A PVALB парвальбумін NMU нейромедин U STC2 станніокальцин 2 ABAT CDH1 4-амінобутиратамінотрансфераза кадгерин 1 Процес Поганий результат 12 позаклітинна область ділення клітин передача сигналу пов'язана з рецептором клітинної поверхні передача сигналу негативна регуляція проліферації клітин позаклітинна область контрольна точка клітинного циклу передача сигналу позаклітинна область дифференцірування клітин плазматична мембрана передача сигналу позаклітинна область передача сигналу катаболічний процес гаммааміно-масляної кислоти мітохондрії гомофільная адгезія кліток UA 110790 C2 Таблиця 2 Перелік генів для алгоритмів T5, T1, T4 і T5b Ген PIP Назва пролактиніндукуючий білок Висока експресія Хороший результат Функція Компонент зв'язування актину Процес позаклітинна область Еталонний ген Еталонний ген Еталонний ген CALM2 OAZ1 RPL37A У таблиці 3 нижче представлені комбінації генів, використані для кожного алгоритму. 5 У таблиці 4 нижче представлений ID набору зондів Affy і картування ID моделі TaqMan для маркерних генів за даним винаходом. 13 UA 110790 C2 У таблиці 5 нижче представлені повні назви, ID гена Entrez, номер доступу в gene bank і хромосомна область маркерних генів за даним винаходом. Таблиця 5 Офіційне Офіційна повна назва ID гена Entrez Номер доступу Розташування позначення UBE2C убіквитин-кон'югуючий фермент E2C 11065 U73379 20q13.12 бакуловірусний IAP-повтор, що BIRC5 332 U75285 17q25 містить, 5 DHCR7 7-дегідро-холестерин-редуктаза 1717 AF034544 11q13.4 STC2 станніокальцин 2 8614 AB012664 5q35.2 RBBP8 ретинобластомний зв'язуючий білок 8 5932 AF043431 18q11.2 IL6ST передавач сигналу інтерлейкину 6 3572 M57230 5q11 MGP матриксний білок Gla 4256 M58549 12p12.3 альфа-2-глікопротеїн 1, цинкAZGP1 563 BC005306 11q22.1 зв'язаний RACGAP1 активуючий GTP-азу Rac білок 1 29127 NM_013277 12q13 AURKA кіназа aurora A 6790 BC001280 20q13 PVALB парвальбумін 5816 NM_002854 22q13.1 NMU нейромедин U 10874 X76029 4q12 рецептор 3 простагландину E (підтип PTGER3 5733 X83863 1p31.2 Ер3) ліганд 12 хемокіна (мотив C-XC) CXCL12 6387 L36033 10q11.1 (стромальний клітинний чинник 1) ABAT 4-амінобутират-амінотрансфераза 18 L32961 16p13.2 кадгерин 1, тип 1, Е-кадгерин CDH1 999 L08599 16q22.1 (епітеліальний) PIP пролактин-индукуючий білок 5304 NMM_002652 7q32-qter 14 UA 110790 C2 5 10 15 20 25 30 35 40 Приклад алгоритму T5: Алгоритм T5 є групою з чотирьох членів, де кожен член є лінійною комбінацією з двох генів. Математичні формули для T5 представлені нижче; позначення є такими ж, як і для T1. T5 можна обчислювати тільки з даних про експресію генів. член 1 ризику=0,434039 [0,301…0,567]*(0,939*BIRC5-3,831) -0,491845 [-0,714…-0,270]*(0,707*RBBP8-0,934) член 2 ризику=0,488785 [0,302…0,675]*(0,794*UBE2C-1,416) -0,374702 [-0,570…-0,179]*(0,814*IL6ST-5,034) член 3 ризику=-0,39169 [-0,541…-0,242]*(0,674*AZGP1-0,777) + 0,44229 [0,256…0,628]*(0,891*DHCR7-4,378) член 4 ризику=-0,377752 [-0,543…-0,212]*(0,485*MGP+4,330) -0,177669 [-0,267…-0,088]*(0,826*STC2-3,630) ризик=член 1 ризику+член 2 ризику+член 3 ризику+член 4 ризику Коефіцієнти зліва на кожному рядку обчислювали як коефіцієнти регресії пропорційних ризиків COX, числа в квадратних дужках визначають 95 % довірчих інтервалів для цих коефіцієнтів. Іншими словами, замість множення значення виразу (0,939*BIRC5-3,831) на 0,434039, воно може бути помножене на будь-який коефіцієнт між 0,301 і 0,567 і, проте, даватиме передбачуваний результат з 95 % довірчим інтервалом. Значення виразів в круглих дужках справа в кожному рядку позначають перенесення платформи з ПЦР на Affymetrix: змінні PVALB, CDH1 … означають засновану на ПЦР експресію, нормалізовану до еталонних генів (величини дельта-Ct), повне значення виразу в круглих дужках відповідає логарифму (основа 2) величин експресії на мікроматриці Affymetrix для відповідних наборів зондів. Ефективність алгоритму T5 тестували у пацієнтів, яких лікували тамоксифеном або анастрозолом з не більше ніж 3 позитивними лімфатичними вузлами і ER+, HER2-пухлинами, які брали участь в рандомізованих клінічних випробуваннях ABCSG06 (n=332) або ABCSG08 (n=1244). Як представлено на фіг.1, регресійний аналіз Cox показує, що показник T5 має значущу асоціацію з розвитком віддаленого метастаза у всіх протестованих групах. Аналіз Каплана-Мейера проводили після класифікації пацієнтів об'єднаних груп ABCSG з використанням заданої межі для показника T5. Пацієнти з низьким ризиком розвитку віддаленого метастаза мали показник T5?-9,3, тоді як пацієнти з високим ризиком розвитку віддаленого метастаза мали показник T5 вище-9,3. Як представлено на фіг.2, спостерігають високо значуще розділення для обох груп ризику. Важливо, що показник T5 оцінювали і порівнювали проти "Adjuvant! Online", інтерактивного інструменту, що допомагає вибрати терапію на основі введених клінічних параметрів, таких як розмір пухлини, ступінь пухлини і статус вузлів. Коли показник T5 тестували за допомогою регресії Cox з двома змінними проти показника ризику рецидива в Adjuvant! Online, обидва показники зберігали значущу асоціацію з розвитком віддалених метастазів. Регресія Cox з двома змінними з використанням дихотомизованих даних, які стратифікували згідно T5 (межа9,3), відповідно, відносно Adjuvant! Online (межа 8), знов давала високо значущі і незалежні асоціації з часом до метастаза як клінічний результат. Таблиця 6 Регресія Cox з двома змінними для T5 і Adjuvant! Online Змінна Adjuvant! Online Сигнатура експресії генів (група ризику) Adjuvant! Online (показник) Сигнатура експресії генів (група ризику) Відношення ризиків 2,36 2,62 1,04 1,35 95 % CI* 1,58-3,54 1,71-4,01 1,02-1,06 1,21-1,49 Р
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for breast cancer recurrence prediction under endocrine treatment
Автори англійськоюDartmann, Mareike, Feder, Inke Sabine, Gehrmann, Mathias, Hennig, Guido, Weber, Carsten, von Torne, Christian, Kronenwett, Ralf, Petry, Christoph
Автори російськоюДартманн Марайке, Федер Инке Сабин, Германн Матиас, Хэнниг Гидо, Вебер Карстен, фон Тёрн Кристиан, Кроненветт Ральф, Петри Кристоф
МПК / Мітки
МПК: C12Q 1/68
Мітки: молочної, залози, лікуванні, спосіб, раку, ендокринному, рецидиву, передбачування
Код посилання
<a href="https://ua.patents.su/48-110790-sposib-peredbachuvannya-recidivu-raku-molochno-zalozi-pri-endokrinnomu-likuvanni.html" target="_blank" rel="follow" title="База патентів України">Спосіб передбачування рецидиву раку молочної залози при ендокринному лікуванні</a>
Попередній патент: Антитіло, реактивне відносно b7-h3, його імунологічно активні фрагменти та їх застосування
Наступний патент: Спосіб проведення контролю якості для визначення аномалій в роботі мікрофлюїдної системи
Випадковий патент: Виконавчий орган гірничого комбайна