Криптоблокуючі антитіла та їх застосування
Номер патенту: 85163
Опубліковано: 12.01.2009
Автори: Шиффєр Сузан, Рейхорн Пол, Уілльямс Кевін, Санікола-Надел Мікелє
Формула / Реферат
1. Антитіло, яке специфічно зв'язується з епітопом Cripto, що знаходиться в домені, який включає амінокислотні залишки від амінокислоти 46 до амінокислоти 62 SEQ ID NO:1 або SEQ ID NO:2.
2. Антитіло за п. 1, де антитіло зв'язує епітоп, вибраний з групи епітопів, з якими зв'язуються антитіла, які продукуються гібридомами, вибраними з групи, яка включає А10B2.18 та В3F6.17.
3. Антитіло за п. 1 або п. 2, де антитіло здатне інтерналізувати Cripto.
4. Антитіло за будь-яким з пп. 1-3, яке являє собою фрагмент антитіла, вибраний з групи, яка включає фрагмент Fab, Fab' та F(ab)2.
5. Антитіло за будь-яким з пп. 1-3, яке являє собою антитіло повної довжини.
6. Антитіло за будь-яким з пп. 1-3, яке являє собою одноланцюгове антитіло.
7. Антитіло за будь-яким з пп. 1-6, яке кон'юговане з хіміотерапевтичним агентом.
8. Антитіло за будь-яким з пп. 1-6, для застосування у терапії в комбінації з некон'югованим хіміотерапевтичним агентом.
9. Антитіло за п. 7, де хіміотерапевтичний агент вибраний з групи, яка включає проліки, які активуються пухлиною, радіонуклід та токсин, вибраний з групи, яка складається з рицину, дифтеротоксину та екзотоксину Pseudomonas.
10. Антитіло за п. 7 або 9, де хіміотерапевтичний агент являє собою мейтанзиноїд.
11. Антитіло за будь-яким з пп. 1-10, яке являє собою людське антитіло.
12. Антитіло за будь-яким з пп. 1-10, яке являє собою моноклональне антитіло.
13. Антитіло за будь-яким з пп. 1-10, яке являє собою олюднене антитіло.
14. Фармацевтична композиція, що містить принаймні одне з антитіл за будь-яким з пп. 1-7 та 9-13 та необов'язково носій.
15. Фармацевтична композиція за п. 14, яка додатково містить некон'югований хіміотерапевтичний агент.
16. Фармацевтична композиція за п. 14 або 15, де антитіло являє собою олюднене B3F6.17.
17. Застосування антитіла за будь-яким з пп. 1-13 або композиції за будь-яким з пп. 14-16 для зменшення росту пухлини in vitro.
18. Застосування антитіла за будь-яким з пп. 1-13 або композиції за будь-яким з пп. 14-16 для приготування фармацевтичної композиції для зменшення росту пухлини in vivo.
19. Застосування за п. 17 або 18, у якому клітина пухлини вибрана з групи, що включає клітини пухлин молочної залози, сім'яників, товстої кишки, легень, яєчника, сечового міхура, матки, шийки матки, підшлункової залози та шлунка.
20. Застосування антитіла за будь-яким з пп. 1-13 або композиції за будь-яким з пп. 14-16 для приготування фармацевтичної композиції для лікування небажаної проліферації клітин.
21. Спосіб модулювання росту клітин пухлин in vitro в зразку, що включає стадії додавання до зразка антитіла за будь-яким з пп. 1-13 або композиції за будь-яким з пп. 14-16.
Текст
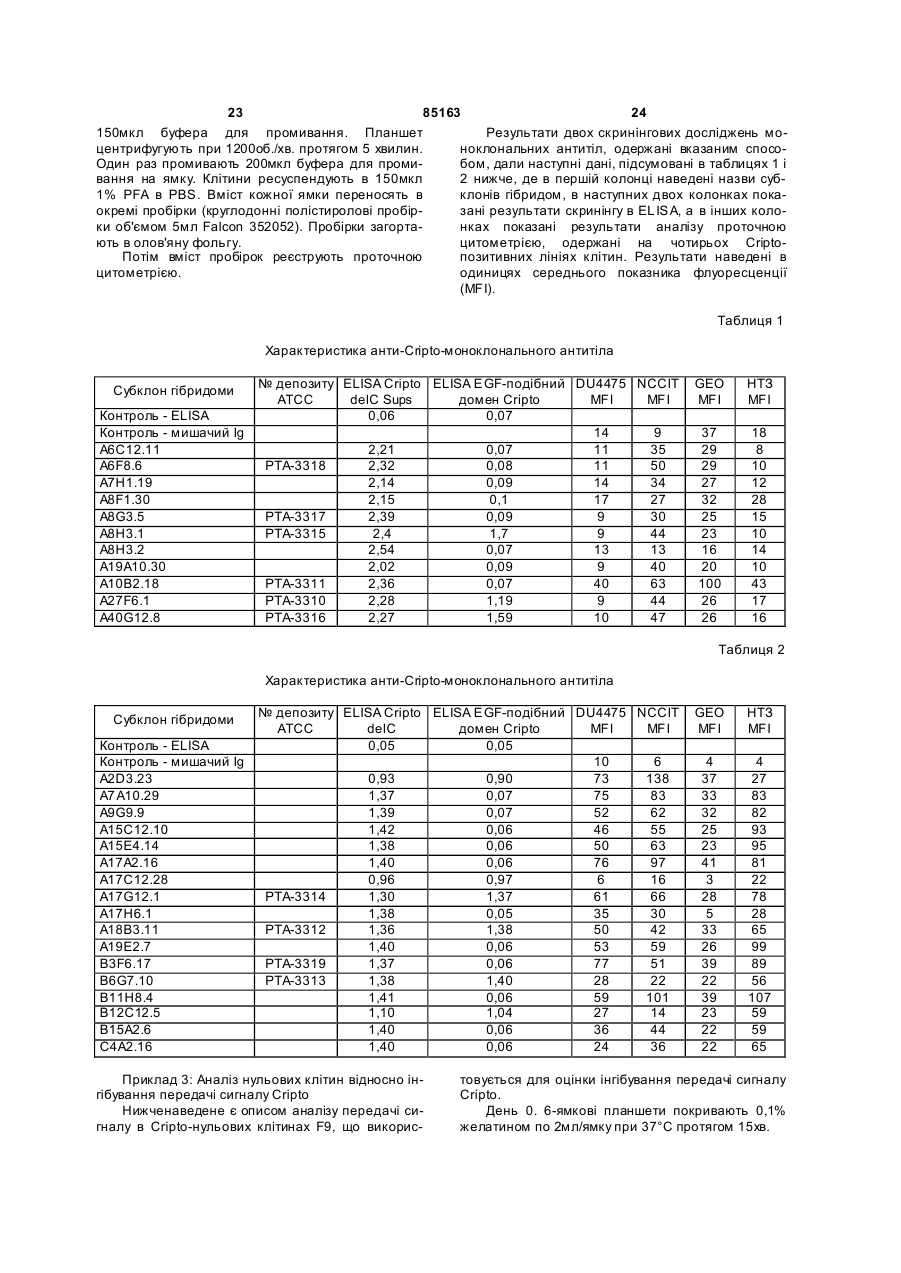
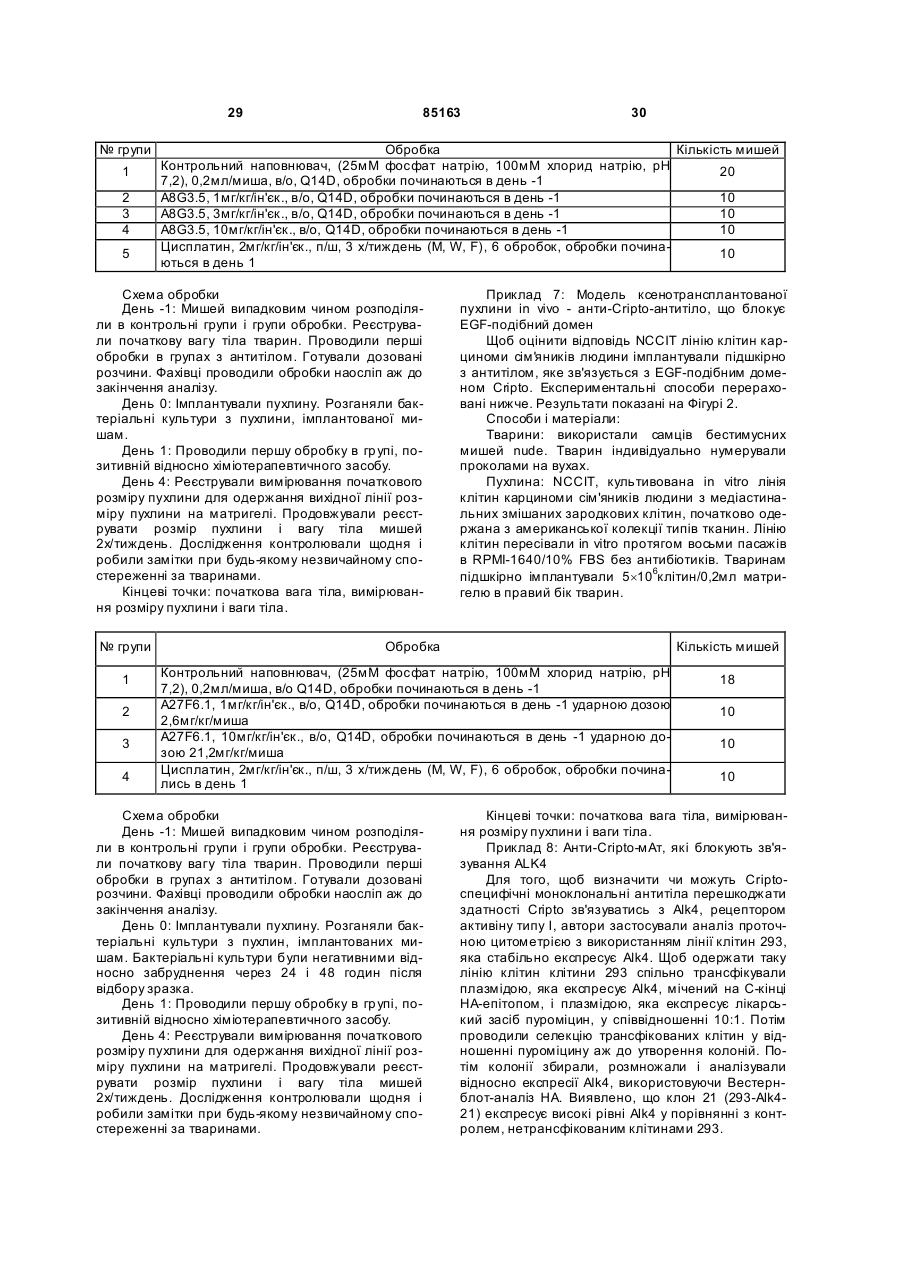
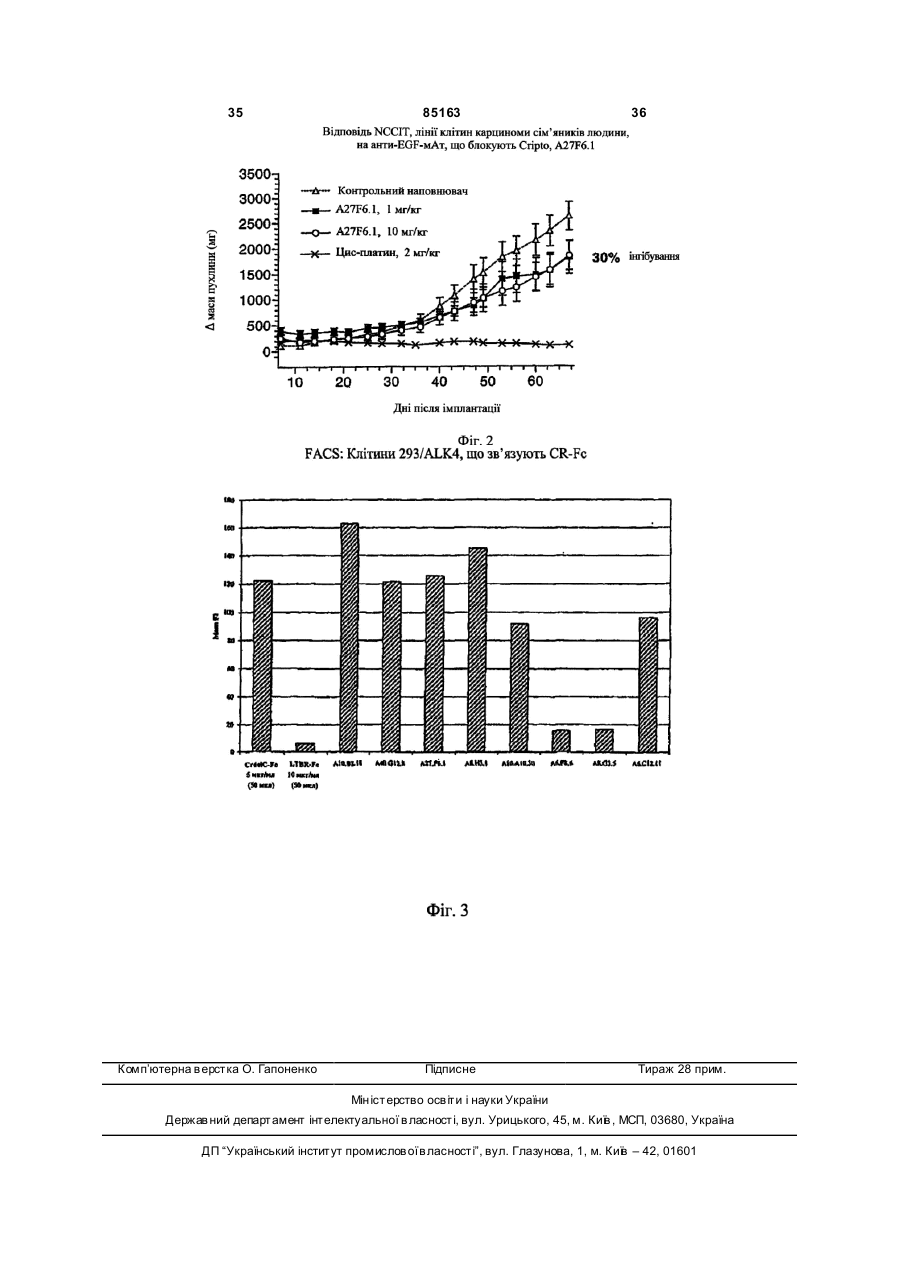
1. Антитіло, яке специфічно зв'язується з епітопом Cripto, що знаходиться в домені, який включає амінокислотні залишки від амінокислоти 46 до амінокислоти 62 SEQ ID NO:1 або SEQ ID NO:2. 2. Антитіло за п. 1, де антитіло зв'язує епітоп, вибраний з групи епітопів, з якими зв'язуються антитіла, які продукуються гібридомами, вибраними з групи, яка включає А10B2.18 та В3F6.17. 3. Анти тіло за п. 1 або п. 2, де антитіло здатне інтерналізувати Cripto. 4. Ан титіло за будь-яким з пп. 1-3, яке являє собою фрагмент антитіла, вибраний з групи, яка включає фрагмент Fab, Fab' та F(ab)2. 5. Ан титіло за будь-яким з пп. 1-3, яке являє собою антитіло повної довжини. UA (21) 20031110670 (22) 17.04.2002 (24) 12.01.2009 (86) PCT/US02/11950, 17.04.2002 (31) 60/286,782 (32) 26.04.2001 (33) US (31) 60/293,020 (32) 17.05.2001 (33) US (31) 60/301,091 (32) 26.06.2001 (33) US (31) 60/367,002 (32) 22.03.2002 (33) US (46) 12.01.2009, Бюл.№ 1, 2009 р. (72) САНІКОЛА-Н АДЕЛ МІКЕЛЄ, УІЛЛЬЯМС КЕВІН, ШИФФЄР СУЗАН, РЕЙ ХОРН ПОЛ (73) БАЙОДЖІН АЙДЕК МА ІНК. (56) BRANDT ET AL.: 'Identification and biological characterization of an epidermal growth factor-related protein:Cripto-1' THE JOURNAL OF BIOLOGIC AL CHEMISTR Y vol. 269, 24 June 1994, pages 17320 17328. CICCODICOLA ET AL.: 'Molecular characterization of a gene of the 'EGF family' expressed in undifferentiated human NTERA2 teratocarcinoma cells' THE EMBO JOURNAL vol. 8, 1989, pages 1987 - 1991. EBERT ET AL.: 'Cripto-1 induces phosphatidylinositol 3'-kinase-dependent phosphorylation of AKT and glycogen synthase kinase 3beta in human cervical carcinoma cells' CANCER RESEARCH vol. 59, 15 September 1999, pages 4502 - 4505. KANNAN ET AL.: 'Cripto enhances the tyrosin phosphorylation of she and activates mitogenactivated protein kinase (MAPK) in mammary epithelial cells' THE JOURNAL OF BIOLOGIC AL CHEMISTR Y vol. 272, 07 February 1997, pages 3330 - 3335. BIANCO ET AL.: 'Cripto-1 indirectly stimulates the tyrosine phosphorylation of erb B-4 through a novel 2 (19) 1 3 85163 4 6. Ан титіло за будь-яким з пп. 1-3, яке являє собою 15. Фармацевтична композиція за п. 14, яка додатодноланцюгове антитіло. ково містить некон'югований хіміотерапевтичний 7. Антитіло за будь-яким з пп. 1-6, яке кон'юговане агент. з хіміотерапевтичним агентом. 16. Фармацевтична композиція за п. 14 або 15, де 8. Антитіло за будь-яким з пп. 1-6, для застосуванантитіло являє собою олюднене B3F6.17. ня у терапії в комбінації з некон'югованим хіміоте17. Застосування антитіла за будь-яким з пп. 1-13 рапевтичним агентом. або композиції за будь-яким з пп. 14-16 для змен9. Анти тіло за п. 7, де хіміотерапевтичний агент шення росту пухлини in vitro. вибраний з групи, яка включає проліки, які активу18. Застосування антитіла за будь-яким з пп. 1-13 ються пухлиною, радіонуклід та токсин, вибраний з або композиції за будь-яким з пп. 14-16 для пригогрупи, яка складається з рицину, дифтеротоксину тування фармацевтичної композиції для зменшента екзотоксину Pseudomonas. ня росту пухлини in vi vo. 10. Антитіло за п. 7 або 9, де хіміотерапевтичний 19. Застосування за п. 17 або 18, у якому клітина агент являє собою мейтанзиноїд. пухлини вибрана з групи, що включає клітини пух11. Антитіло за будь-яким з пп. 1-10, яке являє лин молочної залози, сім'яників, товстої кишки, собою людське антитіло. легень, яєчника, сечового міхура, матки, шийки 12. Антитіло за будь-яким з пп. 1-10, яке являє матки, підшлункової залози та шлунка. собою моноклональне антитіло. 20. Застосування антитіла за будь-яким з пп. 1-13 13. Антитіло за будь-яким з пп. 1-10, яке являє або композиції за будь-яким з пп. 14-16 для пригособою олюднене антитіло. тування фармацевтичної композиції для лікування 14. Фармацевтична композиція, що містить принебажаної проліферації клітин. наймні одне з антитіл за будь-яким з пп. 1-7 та 921. Спосіб модулювання росту клітин пухлин in 13 та необов'язково носій. vitro в зразку, що включає стадії додавання до зразка антитіла за будь-яким з пп. 1-13 або композиції за будь-яким з пп. 14-16. Дана заявка є продовженням заявки на видачу [патенту U.S.S.N. 60/367002, поданої 22 березня 2002, яка є частковим продовженням заявки U.S.S.N. 60/301091, поданої 26 червня 2001, яка є частковим продовженням заявки U.S.S.N. 60/293020, поданої 17 травня 2001, яка є частковим продовженням заявки U.S.S.N. 60/286782, поданої 26 квітня 2001]. Повний опис кожної з вищезгаданих заявок на видачу патентів включений в даний опис у вигляді посилання. Даний винахід, загалом, відноситься до області генетики і клітинної і молекулярної біології. Більш конкретно винахід відноситься до антитіл, які зв'язуються і модулюють передачу сигналу Cripto, до наборів, які містять такі антитіла, і способів, в яких антитіла використовуються. Cripto є білком клітинної поверхні, що складається з 188 амінокислотних залишків, випадково виділених при скринінгу кДНК бібліотеки ембріональної карциноми людини [Ciccodicola et al., 1989, EMBO J., vol. 8, No. 7, pp. 1987-1991]. Білок Cripto має, щонайменше, два помітних домени: багатий цистеїном домен і домен, спочатку охарактеризований як домен, схожий з доменом, виявленим в сімействі епідермального фактора росту (EGF). Cripto спочатку класифікували як представника сімейства EGF [Ciccodicola et al., вище]; однак подальший аналіз показав, що Cripto не зв'язує жоден з відомих рецепторів EGF, і його EGFподібний домен насправді відрізняється від сімейства EGF [Bianco et al., 1999, J. Biol. Chem., 274:8624-8629]. Сигнальний шлях Cripto залишається неясним, незважаючи на дослідження, що продовжується, при наявності відомостей в літературі, підтвер джуючих активацію декількох різних шля хів, включаючи МАР-кіназний шлях [DeSantis et al., 1997, Cell Growth Differ., 8:1257-1266; Kannan et al., 1997, J. Biol. Chem., 272:3330-3335], шлях TGF-b [Gritsman et al., 1999, Development, 127:921-932; Schier et al., 2000, Nature, 403:385-389], можливі взаємодії з шляхом Wnt [Salomon et al., Endocr. Relat. Cancer. 2000 Dec;7(4): 199-226] і взаємний вплив у випадку шляху EGF [Bianco et al., 1999, J. Biol. Chem., 274:8624-8629]. У [патенті США 5256643] і двох споріднених йому виділених заявках [патенти США 5654140 і 5792616] описаний ген Cripto людини, білок Cripto і антитіла до Cripto. У [патенті США 5264557] і трьох споріднених йому виділених заявках [патенти США 5620866, 5650285 і 5854399] описаний споріднений Cripto ген і білок людини. Також заявлені антитіла, які зв'язуються з білком, спорідненим Cripto, але перехресно не реагують за допомогою зв'язування з самим білком Cripto. Понадекспресія білка Cripto пов'язана з багатьма типами пухлин (включаючи, але не обмежуючись вказаним, пухлини молочної залози, сім'яників, товстої кишки, легені, яєчника, сечового міхура, матки, шийки матки, підшлункової залози і шлунка), як показано за допомогою імунофарбування тканини людини поліклональними антитілами кролика, одержаними проти невеликих пептидів cripto [Panico et al., 1996, Int. J. Cancer, 65:51-56; Byrne et al., 1998, J. Pathology, 185:108-111; De Angelis et al., 1999, Int. J. Oncology, 14:437-440]. Таким чином, в даній області існує необхідність в засобах контролю, обмеження і/або запобігання такій понадекспресії, модулюванню передачі сиг 5 85163 6 налу Cripto і модулюванню наслідків експресії Cys-багатому домені. Антитіла, які специфічно Cripto (тобто, стимулювання і/або підтримки клізв'язуються з епітопом в Cys-багатому домені, тинної трансформації). включають, але не обмежені вказаним, А19А10.30, Даний винахід відноситься до нових антитіл, A8G3.5 (ATCC інвентарний №. РТА-3317), A6F8.6 які специфічно зв'язуються з Cripto, і способів оде(ATCC інвентарний №. РТА-3318) і A6C12.11. ржання і застосування таких антитіл. Винахід таВ іншому варіанті епітоп, з яким зв'язуються кож відноситься до антитіл, які зв'язуються з Cripto антитіла згідно з даним винаходом, знаходиться в і модулюють передачу сигналу Cripto або взаємодомені, що охоплює амінокислотні залишки 46-62 дію білків, наприклад, до антитіла, яке зв'язується Cripto. Антитіла, які специфічно зв'язуються з епіз Cripto так, що сигнал, виникаючий внаслідок взатопом в домені, що охоплює амінокислотні залишємодії білків з Cripto, придушується. Винахід також ки 46-62 Cripto, включають, але не обмежені вкавідноситься до антитіл, які зв'язуються з Cripto і заним, А10В2.18 (ATCC інвентарний №. РТАблокують взаємодію між Cripto і ALK4. Винахід 3311), B3F6.17 (ATCC інвентарний №. РТА-3319) і також відноситься до антитіл, які зв'язуються з А17А2.16. Cripto і модулюють зростання пухлини. Винахід Даний винахід також відноситься до антитіл, також відноситься до антитіл, які зв'язуються з які специфічно зв'язуються з Cripto і здатні модуCripto, модулюють передачу сигналу Cripto і модулювати передачу сигналу Cripto. Анти тіла, які спелюють зростання пухлини. Винахід також відноцифічно зв'язуються з Cripto і здатні модулювати ситься до антитіл, які зв'язуються з Cripto, блокупередачу сигналу Cripto, включають, але не обмеють взаємодію між Cripto і ALK4 і модулюють жені вказаним, A40G12.8 (ATCC інвентарний №. зростання пухлини. РТА-3316), А8Н3.1 (ATCC інвентарний №. РТАВ одному аспекті винаходу антитіло згідно з 3315), A27F6.1 (ATCC інвентарний №. РТА-3310) і даним винаходом специфічно зв'язується з епітоA6C12.11. В одному варіанті антитіла згідно з дапом, вибраним з групи епітопів, з якими зв'язуютьним винаходом, які специфічно зв'язуються з ся антитіла A6C12.11, A6F8.6 (ATCC Інвентарний Cripto і здатні модулювати передачу сигналу №. РТА-3318), А7Н1.19, A8F1.30, A8G3.5 (ATCC Cripto, зв'язуються з епітопом в EGF-подібному інвентарний №. РТА-3317), А8Н3.1 (ATCC інвентадомені або Cys-багатому домені Cripto. рний №. РТА-3315), А8Н3.2, А19А10.30, А10В2.18 Даний винахід також відноситься до антитіл, (ATCC інвентарний №. РТА-3311), A27F6.1 (ATCC які специфічно зв'язуються з Cripto і блокують взаінвентарний №. РТА-3310), A40G12.8 (ATCC інвеємодію між Cripto і ALK4. Ан титіла, які специфічно нтарний №. РТА3316), A2D3.23, А7А10.29, A9G9.9, зв'язуються з Cripto і здатні блокувати взаємодію А15С12.10, А15Е4.14, А17А2.16, А17С12.28, між Cripto і ALK4, включають, але не обмежені A17G12.1 (ATCC інвентарний №. РТА-3314), вказаним, A8G3.5 (ATCC інвентарний №. РТАА17Н6.1, A18B3.11 (ATCC інвентарний №. РТА3317), A6F8.6 (ATCC інвентарний №. РТА-3318) і 3312), А19Е2.7, B3F6.17 (ATCC інвентарний №. А6С12.11. В одному варіанті антитіла згідно з даРТА-3319), B6G7.10 (ATCC інвентарний №. РТАним винаходом, які специфічно зв'язуються з 3313), В11Н8.4. Cripto і здатні блокувати взаємодію між Cripto і В іншому аспекті винаходу антитіло згідно з ALK4, зв'язуються з епітопом в EGF-подібному даним винаходом специфічно зв'язується з епітодомені або Cys-багатому домені Cripto. пом в ліганд/рецепторзв'язувальному домені В іншому аспекті даний винахід відноситься до Cripto. Cripto може бути вибраний з CR-1 (SEQ ID антитіл, які специфічно зв'язуються з Cripto і здатні №: 1) або CR-3 (SEQ ID №: 2). У більш конкретномодулювати зростання пухлини. Антитіла, які спему варіанті антитіла, які специфічно зв'язуються з цифічно зв'язуються з Cripto і здатні модулювати епітопом в ліганд/рецепторзв'язувальному домені, зростання пухлини, включають, але не обмежені включають, наприклад, A6C12.11, A6F8.6 (ATCC вказаним, A27F6.1 (ATCC інвентарний №. РТАінвентарний №. РТА-3318), A8G3.5 (ATCC інвен3310), B6G7.10 (ATCC інвентарний №.РТА-3313) і тарний №. РТА-3317), А19 А10.30, А8Н3.1 (ATCC A8G3.5 (ATCC інвентарний №. РТА-3317). інвентарний №. РТА-3315), A27F6.1 (ATCC інвенВ одному варіанті антитіла згідно з даним витарний №. РТА-3310), A40G12.8 (ATCC інвентарнаходом, які специфічно зв'язуються з Cripto і зданий №. РТА-3316), A17G12.1 (ATCC інвентарний тні модулювати зростання пухлини, зв'язуються з №. РТА-3314), A18B3.11 (ATCC інвентарний №. епітопом в EGF-подібному домені або CysРТА-3312) і B6G7.10 (ATCC інвентарний №. РТАбагатому домені Cripto. 3313). У ще одному аспекті даний винахід відноситьВ одному варіанті епітоп, з яким зв'язуються ся до антитіл, які специфічно зв'язуються з Cripto, антитіла згідно з даним винаходом, знаходиться в які здатні модулювати передачу сигналу Cripto і які EGF-подібному домені. Антитіла, які специфічно здатні модулювати зростання пухлини. Анти тіла, зв'язуються з епітопом в EGF-подібному домені, які специфічно зв'язуються з Cripto, які здатні мовключають, але не обмежені вказаним, A40G12.8 дулюва ти передачу сигналу Cripto і які здатні мо(ATCC інвентарний №. РТА-3316), А8Н3.1 (ATCC дулюва ти зростання пухлини, включають, але не інвентарний №. РТА-3315), A27F6.1 (ATCC інвенобмежені вказаним, A27F6.1 (ATCC інвентарний тарний №. РТА-3310), B6G7.10 (ATCC інвентарний №. РТА-3310). №. РТА-3313), A17G12.1 (ATCC інвентарний №. В одному варіанті антитіла згідно з даним виРТА-3314) і A18B3.11 (ATCC інвентарний №. РТАнаходом, які специфічно зв'язуються з Cripto, які 3312). здатні модулювати передачу сигналу Cripto і які В іншому варіанті епітоп, з яким зв'язуються здатні модулювати зростання пухлини, зв'язуютьантитіла згідно з даним винаходом, знаходиться в 7 85163 8 ся з епітопом в EGF-подібному домені або Cysсуб'єкта в імуноаналізі з використанням будь-якого багатому домені Cripto. з описаних вище антитіл. Також розглядаються У ще одному аспекті даний винахід відноситьспособи визначення того, чи понадекспресує лінія ся до антитіл, які специфічно зв'язуються з Cripto, клітин Cripto, що включають стадію аналізу лінії які здатні блокувати взаємодію між Cripto і ALK4 і клітин в імуноаналізі з використанням будь-якого з які здатні модулювати зростання пухлини. Анти тіописаних вище антитіл. ла, які специфічно зв'язуються з Cripto, які здатні Вказані та інші аспекти винаходу більш детаблокувати взаємодію між Cripto і ALK4 і які здатні льно представлені нижче в докладному описі вимодулювати зростання пухлини, включають, але находу. не обмежені вказаним, A8G3.5 (ATCC інвентарний Виявлені антитіла, які специфічно зв'язуються №. PTA-3317). з Cripto, і їх застосування для модулювання переВ іншому варіанті даний винахід відноситься дачі сигналу Cripto або взаємодії білків і/або для до антитіла, продукованого гібридомою, вибраного блокування взаємодії між Cripto і ALK4, і/або моз групи, що складається з A6F8.6 (ATCC інвентардулювання зростання пухлинних клітин. Виявлені ний №. РТА-3318), A8G3.5 (ATCC інвентарний №. різні класи антитіл, які специфічно зв'язуються з РТА-3317), А8Н3.1 (ATCC інвентарний №. РТАCripto, включаючи, наприклад, антитіла, які спе3315), А10В2.18 (ATCC інвентарний №. РТА-3311), цифічно зв'язуються з епітопом в ліA27F6.1 (ATCC інвентарний №. РТА-3310), ганд/рецепторзв'язувальному домені або нативноA40G12.8 (ATCC інвентарний №. РТА-3316), го білка Cripto, або денатурованої форми Cripto; A17G12.1 (ATCC інвентарний №. РТА-3314), антитіла, які зв'язують EGF-подібний домен, CysA18B3.11 (ATCC інвентарний №. РТА-3312), багатий домен або пептид (наприклад, приблизно B3F6.17 (ATCC інвентарний №. РТА-3319) і з 3-20 амінокислот) з ділянки, що містить амінокиB6G7.10 (ATCC інвентарний №. PTA-3313). слотні залишки 46-150; антитіла, які зв'язують Антитіла згідно з даним винаходом включаCripto і модулюють передачу сигналу Cripto; антиють, але не обмежені вказаним, моноклональні, тіла, які зв'язують Cripto і модулюють зростання поліклональні, гуманізовані, химерні і людські анпухлинних клітин; і антитіла, які зв'язують Cripto, титіла. модулюють передачу сигналу Cripto і модулюють Даний винахід також відноситься до композиції зростання пухлинних клітин. Вказані антитіла вибдля введення суб'єкту, що має пухлину, яка ексрані з використанням звичайних аналізів in vitro пресує Cripto, що містить, щонайменше, одне з для відбору антитіл, які зв'язують ліантитіл, описаних вище. У більш конкретному ваганд/рецепторзв'язувальний домен, модулюють ріанті суб'єктом є людина. Композиція може містипередачу сигналу Cripto або модулюють зростання ти фармацевтично прийнятний наповнювач. Опипухлинних клітин. сані вище антитіла можна кон'югувати з Способи згідно з даним винаходом застосовні хіміотерапевтичним засобом або вводити в комбів терапії злоякісних або доброякісних пухлин ссанації з некон'югованим хіміотерапевтичним засовців в тому випадку, коли швидкість зростання бом. пухлини (яка є аномальною швидкістю для нормаВ іншому аспекті винаходу розглядаються льної тканини), щонайменше, частково залежить способи модулювання зростання пухлинних клітин від Cripto. Аномальною швидкістю зростання є у зразку in vitro, що включають стадію додавання швидкість зростання, яка перевищує швидкість, до зразка описаних вище композицій. необхідну для нормального гомеостазу, і перевиТакож розглядаються способи модулювання щує швидкість для нормальних тканин того ж позростання пухлинних клітин у суб'єктів in vi vo, що ходження. включають стадію введення суб'єкту ефективної Визначення кількості описаних вище композицій. У конкретноВ документі наведені різні визначення. Більму варіанті суб'єктом є людина. шість слів мають значення, яке може приписуваІншим аспектом даного винаходу є способи літись таким словам фахівцем в даній області. Слокування суб'єктів, що мають пухлину, яка понадеква, конкретне визначення яких наведене або спресує Cripto, що включають введення суб'єкту нижче, або в іншому місці даного документа, маописаних вище композицій в ефективній кількості. ють значення, наведене в контексті даного винаКомпозиції для введення можуть включати фарходу загалом, і яке звичайно розуміється фахівцямацевтично прийнятні наповнювачі, антитіла, ми в даній області. кон'юговані з хіміотерапевтичними засобами, і анУ значенні, що використовується в даному титіла, що вводяться в комбінації з некон'юговаописі, термін «ділянка» означає фізично безпереними хіміотерапевтичними засобами. рвну частин у первинної структури біомолекули. У Способи згідно з даним винаходом особливо випадку білків ділянку визначають як безперервну корисні для модулювання зростання пухлинних частину амінокислотної послідовності даного білклітин і/або лікування суб'єкта (тобто людини), що ка. має пухлину, в тому випадку, коли пухлинна клітиУ значенні, що використовується в даному на вибрана з пухлинних клітин молочної залози, описі, термін «домен» відноситься до структурної сім'яників, товстої кишки, легені, яєчника, сечового частини біомолекули, яка вносить внесок у відому міхура, матки, шийки матки, підшлункової залози і або очікувану функцію біомолекули. Домени мошлунка. жуть мати рівну протяжність з ділянками або їх У ще одному варіанті даний винахід відночастинами; домени також можуть включати частиситься до способів визначення того, чи експресує ну біомолекули, яка відрізняється від конкретної тканина Cripto, що включає стадію аналізу тканини ділянки, нарівні з повною вказаною областю або її 9 85163 10 частиною. Приклади білкових доменів включають, для зв'язування антигену, амінокислотами з відпоале не обмежені вказаним, позаклітинний домен відних ділянок легкого або важкого ланцюга імуно(тягнеться приблизно від залишку 31 до залишку глобуліну людини. Тобто, вони є химерами, що 188 Cripto, включаючи Cripto, CR-1 (SEQ ID NO: 1) головним чином містять послідовності імуноглобуі CR-3 (SEQ ID NO: 2)) і трансмембранний домен ліну людини, в які були вбудовані ділянки, відпові(тягнеться приблизно від залишку 169 до залишку дальні за специфічне зв'язування антигену [ди188 Cripto, включаючи Cripto, CR-1 (SEQ ID NO: 1) вись, наприклад, заявку на видачу патенту PCT і CR-3 (SEQ ID NO: 2)). ЛіWO 94/04679]. Тварин імунізують необхідним антиганд/рецепторзв'язувальний домен білка Cripto геном, виділяють відповідні антитіла і видаляють тягнеться приблизно від залишку 75 до залишку частину послідовностей варіабельних ділянок, 150 Cripto, включаючи Cripto, CR-1 (SEQ ID NO: 1) відповідальних за специфічне зв'язування антигеі CR-3 (SEQ ID NO: 2) і містить EGF-подібний дону. Одержані від тварини антигензв'язувальні дімен Cripto, який тягнеться, наприклад, приблизно лянки потім клонують у відповідному положенні від залишку 75 до залишку 112 Cripto, включаючи генів антитіла людини, в яких були делеговані анCripto, CR-1 (SEQ ID NO: 1) і CR-3 (SEQ ID NO: 2), і тигензв'язувальні ділянки. Гуманізовані антитіла багатий цистеїном домен Cripto, який тягнеться, мінімізують використання гетерологічних (міжвинаприклад, приблизно від залишку 114 до залишку дових) послідовностей в антитілах для застосу150 Cripto, включаючи Cripto, CR-1 (SEQ ID NO: 1) вання в терапії людини, і менше імовірність того, і CR-3 (SEQ ID NO: 2). Наприклад, багато які монощо вони викличуть небажані імунні відповіді. Подіклональні антитіла згідно з даним винаходом були бним чином можна одержати приматизовані антиідентифіковані як антитіла, що зв'язуються з EGFтіла. подібним або Cys-багатим доменами. Крім того, Інший варіант винаходу включає застосування моноклональні антитіла А10В2.18 (ATCC інвенталюдських антитіл, які можна продукувати у тварирний №. РТА-3311), B3F6.17 (ATCC інвентарний нах, які відрізняються від людини, таких як транс№. РТА-3319) і А17А2.16 були ідентифіковані як генні тварини, які несуть один або декілька трансантитіла, що зв'язуються з епітопом, утвореним в генів імуноглобуліну людини. Таких тварин можна домені в ділянці, що охоплює амінокислотні заливикористати як джерело спленоцитів для одершки 46-62, «лівіше» EGF-подібного домена. Дижання гібридом, як описано в [патенті США вись приклад 3 нижче. Епітоп в лі5569825]. ганд/рецепторзв'язувальному домені є епітопом, Фрагменти антитіл і моновалентні антитіла тащо утворюється або в конформаційно нативному кож можна використати у способах і композиціях білку, або в денатурованому білку Cripto, з яким згідно з даним винаходом. Моновалентні антитіла можуть зв'язуватись антитіла. містять димер важкий ланцюг/легкий ланцюг, поУ значенні, що використовується в даному в'язаний з областю Fc (або стволовою областю) описі, мається на увазі, що термін «антитіло» віддругого важкого ланцюга. «Fab-область» відноноситься до повних інтактних антитіл і Fab, Fab', ситься до тих частин ланцюгів, які приблизно еквіF(ab)2 та інших їх фрагментів. Повні інтактні антивалентні або аналогічні послідовностям, які містіла включають, але не обмежені вказаним, монотять Y-розгалужені частини важкого ланцюга, і клональні антитіла, такі як мишачі моноклональні повністю до легкого ланцюга, і які, як було показаантитіла, поліклональні антитіла, химерні антитіла, но, спільно (в агрегатах) виявляють активність людські антитіла і гуманізовані антитіла. Різні фоантитіла. Білок Fab включає агрегати одного важрми антитіл можна одержати з використанням кого і одного легкого ланцюга (звичайно відомі як стандартних способів на основі рекомбінантної Fab'), а також тетрамери, які відповідають двом ДНК [Winter and Milstein, Nature 349: 293-99, 1991]. розгалуженим ділянкам антитіла Y (звичайно віНаприклад, можна сконструювати «химерні» антидомі як F(ab)2), при ковалентній або нековалентній тіла, в яких антиген-зв'язувальний домен з антитіагрегації будь-яких вказаних ви ще компонентів, за ла тварини пов'язаний з константним доменом умови, що агрегат здатний специфічно реагувати з людини (антитіло, початково одержане від ссавця, конкретним антигеном або сімейством антигенів. який відрізняється від людини, для якої викорисБудь-яке з антитіл згідно з винаходом необотали технологію рекомбінантної ДНК, щоб замінив'язково може бути кон'юговане з хіміотерапевтичти всі або частину ділянок шарнірної і константної ним засобом, визначення якого наведене нижче. ділянок важкого ланцюга і/або константної ділянки У значенні, що використовується в даному легкого ланцюга відповідними ділянками з легкого описі, термін «зв'язування» означає фізичну або ланцюга або важкого ланцюга імуноглобуліну люхімічну взаємодію між двома білками або сполукадини) [дивись, наприклад, Cabilly et al., патент ми або асоційованими білками або сполуками або США 4816567; Morrison et al., Proc. Natl. Acad. Sci. їх комбінаціями, включаючи взаємодію між антиті81: 6851-55, 1984]. Химерні антитіла зменшують лом і білком. Зв'язування включає іонні, неіонні, імуногенні відповіді, що викликаються антитілами водневі зв'язки, Ван-дер-Ваальсові і гідрофобні тварин у випадку використання при клінічному взаємодії і т.д. При фізичній взаємодії зв'язування лікуванні людей. може бути або прямим, або посереднім, при цьому Крім того, можна синтезувати рекомбінантні посереднє здійснюється за допомогою або завдя«гуманізовані» антитіла. Гуманізовані антитіла є ки впливу іншого білка або сполуки. Пряме зв'язуантитілами, початково одержаними від ссавця, вання відноситься до взаємодій, які не відбуваякий відрізняється відлюдини, для яких викорисються за допомогою або за рахунок впливу іншого тали технологію рекомбінантної ДНК, щоб замінибілка або сполуки, а навпаки відбувається без інти деякі або всі амінокислоти, що не вимагаються ших реальних хімічних проміжних сполук. Зв'язу 11 85163 12 вання можна реєструвати багатьма різними спона 60%, більш переважно на 70%, більш переважсобами. Способи реєстрації зв'язування добре но на 80%, більш переважно на 90% і найбільш відомі фахівцям в даній області. переважно на 100%. Модулювання зростання пухУ значенні, що використовується в даному линних клітин in vitro можна виміряти за допомоописі, «антитіло, здатне інтерналізувати Cripto» гою аналізів, відомих в даній області, таких як означає антитіло, яке проникає в клітину, видаляаналіз в м'я кому агарі клітин GEO, показаний в ючи Cripto з клітинної поверхні. Можна провести прикладі 4. скринінг відносно антитіл до Cripto, які здатні інУ значенні, що використовується в даному терналізувати Cripto, з використанням флуоресцеописі, «модулювання зростання пухлинних клітин нтних мічених моноклональних антитіл до Cripto. in vivo» означає збільшення або зменшення кільДля того щоб визначити, які антитіла інтерналізукості пухлинних клітин in vi vo приблизно на 5%, ютсья в Cripto-позитивні клітини, можна провести переважно на 10%, більш переважно на 20%, аналіз відносно поглинання флуоресцентного сигбільш переважно на 30%, більш переважно на налу антитіл в клітини, спостерігаючи клітини у 40%, більш переважно на 50%, більш переважно флуоресцентному і/або конфокальному мікроскопі. на 60%, більш переважно на 70%, більш переважВказані антитіла, які інтерналізувались, будуть но на 80%, більш переважно на 90% і найбільш видні як флуоресцентні сигнали в цитоплазматичпереважно на 100%. Модулювання зростання пухних і/або клітинних везикулах. Необмежувальні линних клітин in vivo можна виміряти за допомогою приклади антитіл до Cripto, здатних інтерналізувааналізів, відомих в даній області, таких як аналіз, ти Cripto, включають A27F6.1 і B3F6.17. показаний у прикладі 5. У значенні, що використовується в даному Термін «профілактика» відноситься до зменописі, термін «сполука» означає будь-який хімічшення імовірності того, що організм буде заражений агент, що ідентифікується, або молекулу, ний або буде розвиватись аномальний стан. включаючи, але не обмежуючись вказаним, іон, Термін «лікування» відноситься до одержання атом, невелику молекулу, пептид, білок, цукор, терапевтичного ефекту і, щонайменше, часткового нуклеотид або нуклеїнову кислоту, і така сполука ослаблення або скасування аномального стану може бути природною або синтетичною. організму. Лікування включає підтримку зростання У значенні, що використовується в даному пухлини в пригніченому стані та індукцію ремісії. описі, терміни «модулює» або «модифікує» ознаТермін «терапевтичний ефект» відноситься до чають збільшення або зменшення кількості, якості придушення аномального стану. Терапевтичний або впливу конкретної активності або білка. ефект в деякій мірі зменшує один або декілька У значенні, що використовується в даному симптомів аномального стану. По відношенню до описі, термін «модулює передачу сигналу Cripto» лікування аномальних станів терапевтичний ефект означає збільшення або зменшення кількості, якоможе відноситись до одного або декількох з настусті або впливу активності Cripto, приблизно на 5%, пних показників: (а) збільшення або зменшення переважно на 10%, більш переважно на 20%, проліферації, зростання і/або диференціювання більш переважно на 30%, більш переважно на клітин; (b) інгібування (тобто уповільнення або 40%, більш переважно на 50%, більш переважно зупинка) або стимуляція загибелі клітин; (с) інгібуна 60%, більш переважно на 70%, більш переважвання дегенерації; (d) зменшення в деякій мірі одно на 80%, більш переважно на 90% і найбільш ного або декількох симптомів, пов'язаних з аномапереважно на 100%. Активність можна виміряти за льним станом; і (e) посилення функціонування допомогою аналізів, відомих в даній області, таких популяції клітин. Сполуки, що виявляють ефективяк аналіз нульових клітин, показаний в прикладі 3. ність, направлену проти аномальних станів, можна В іншому варіанті білкова взаємодія між Cripto та ідентифікувати, як вказано в даному описі. іншим білком схожим чином придушують за допоТермін «введення» відноситься до способу могою зв'язування антитіл згідно з винаходом. включення сполуки в клітини або тканини організУ значенні, що використовується в даному му. Можна проводити профілактику або лікування описі, термін «блокування взаємодії між Cripto і аномального стану в тому випадку, коли клітини ALK 4» означає збільшення або зменшення взаєабо тканини організму існують в організмі або поза модії, тобто зв'язування між Cripto і ALK4 приблизорганізмом. Клітини, існуючі поза організмом, моно на 5%, переважно на 10%, більш переважно на жна підтримувати або вирощува ти на чашках для 20%, більш переважно на 30%, більш переважно культури тканини або в іншому організмі. Для кліна 40%, більш переважно на 50%, більш переважтин, які містяться в організмі, в даній області існує но на 60%, більш переважно на 70%, більш перебагато способів, щоб ввести сполуки, включаючи важно на 80%, більш переважно на 90% і най(без обмеження) пероральне, парентеральне, дебільш переважно на 100%. Активність можна рмальне, ін'єкційне і аерозольне застосування. виміряти за допомогою аналізів, відомих в даній Для клітин поза організмом в даній області існує області, таких як аналіз зв'язування, показаний в множина способів, щоб ввести сполуки, включаюприкладі 8. чи (без обмеження) способи мікроін'єкції в клітини, У значенні, що використовується в даному способи трансформації і способи на основі носіїв. описі, термін «модулювання зростання пухлинних Введення можна здійснити множиною способів, клітин in vitro» означає збільшення або зменшення відомих в даній області, наприклад, перорально, кількості пухлинних клітин in vitro приблизно на внутрішньовенно, внутрішньоочеревинно, внутрі5%, переважно на 10%, більш переважно на 20%, шньом'язово і т.д. У випадку використання для більш переважно на 30%, більш переважно на терапії in vivo антитіла згідно з даним винаходом 40%, більш переважно на 50%, більш переважно вводять пацієнту в е фективних кількостях. У зна 13 85163 14 ченні, що використовується в даному описі, «еферицин, дифтерійний токсин, екзотоксин ктивною кількістю» є кількість, достатня для того, Pseudomonas. щоб одержати позитивні або необхідні клінічні реХіміотерапевтичні засоби, які можна викорисзультати (тобто кількості, які видаляють або зметати в комбінації з антитілами згідно з винаходом, ншують пухлинне навантаження пацієнта). Ефека не кон'югувати з ними (тобто некон'юговані хіміотивну кількість можна ввести в одне або декілька терапевтичні засоби), включають, але не обмежені введень. З метою даного винаходу ефективна ківказаним, наступні засоби: платину (тобто, цисплькість антитіл згідно з даним винаходом являє латин), антрацикліни, аналоги нуклеозидів (пурину собою кількість антитіл, яка є достатньою для поі піримідину), таксани, камптотецини, епіподофілоліпшення, стабілізації або уповільнення розвитку токсини, ДНК-алкілуючі агенти, антагоністи фолапов'язаного з Cripto патологічного стану, зокрема тів, алкалоїди вінка, інгібітори рибонуклеотидредупов'язаних з Cripto пухлин. Детенція і вимірювання ктази, інгібітори естрогену, інгібітори прогестерону, вказаних індикаторів ефективності обговорюється інгібітори андрогену, інгібітори ароматази, інтернижче. Приклад звичайного режиму лікування ферони, інтерлейкіни, моноклональні антитіла, включає введення суб'єкту за допомогою внутріштаксол, камптосар, адріаміцин (dox), 5-FU і гемциньовенної інфузії антитіл згідно з винаходом за табін. Такі хіміотерапевтичні засоби можна викосхемою один раз на тиждень в дозі приблизно 2ристати в практиці винаходу в комбінації з антиті5мг/кг. Антитіла вводять амбулаторно у відділенні лами згідно з винаходом шляхом спільного хемоінфузії, якщо немає необхідності в госпіталівведення антитіла і некон'югованого хіміотерапевзації пацієнта. Інші схеми введення відомі в даній тичного засобу. області і також передбачаються у винаході. «Фармацевтично прийнятний носій або наповПрофілактику і лікування аномального стану нювач» відноситься до біологічно інертних сполук, також можна проводити за допомогою введення відомих в даній області і які використовуються у антитіла згідно з винаходом в групу клітин, що мавипадку введення антитіл згідно з винаходом. ють відхилення в шляху сигнальної трансдукції в Прийнятні носії добре відомі в даній області і опиорганізмі. Потім можна здійснювати моніторинг сані, наприклад, у [Remington's Pharmaceutical впливу введення сполуки на функцію організму. Sciences, Gennaro, ed., Mack Publishing Co., 1990]. Організм переважно є організмом людини. Прийнятні носії можуть включати біосумісні, інертМається на увазі, що «понадекспресія Cripto» ні або біологічно всмоктувані солі, забуферювальозначає експресію Cripto тканиною, експресія в ні агенти оліго- або полісахариди, полімери, в'язякій вище, ніж експресія Cripto в сусідній нормалькопружну сполуку, таку як гіалуронова кислота, ній тканині, в статистично значущій кількості. агенти, що підвищують в'язкість, консерванти і Термін «хіміотерапевтичний засіб» відноситьтому подібне. ся до будь-яких засобів, ідентифікованих в даній «Суб'єкт» відноситься до хребетних, зокрема області як засоби, що надають терапевтичний до представників видів ссавців, і включає, але не вплив на інгібування зростання пухлини, підтриобмежений вказаним, домашніх тварин, спортивмання зростання пухлини в пригніченому стані них тварин і приматів, включаючи людей. і/або індукцію ремісії, таких як природні сполуки, Антитіла згідно з винаходом синтетичні сполуки, білки, модифіковані білки і Антитіла згідно з винаходом специфічно зв'ярадіоактивні сполуки. Хіміотерапевтичні засоби, зуються з Cripto. У значенні, що використовується що розглядаються в даному описі, включають зав даному описі, Cripto включає білок Cripto CR-1, соби, які можна кон'югувати з антитілами згідно з білок Cripto CR-3 і їх фрагменти. Такі фрагменти даним винаходом, або альтернативно засоби, які можуть являти собою повні домени, такі як позаможна використати в комбінації з антитілами згідклітинний або внутрішньоклітинний домени, EGFно з даним винаходом, некон'югуючи їх з антитіподібний домен, Cys-багатий домен, домен, зв'ялом. Приклади хіміотерапевтичних засобів, які зувальний рецептор і тому подібне. Такі фрагменможна кон'югувати з антитілами згідно з даним ти також можуть включати в себе безперервні і винаходом, включають, але не обмежені вказаним, переривчасті епітопи в будь-якому домені білка радіоактивні кон'югати (90Y, 1311, 99mTc, 111In, Cripto. 186Rh, та інш.), що активуються в пухлини проліків Послідовність CR-1 довжиною 188 амінокислот (мейтанзиноїди, аналоги CC-1065, похідні кліхеаявляє собою наступну послідовність [SEQ ID NO: міцину, антрацикліни, алкалоїди вінка та інш.), 1]: Послідовність CR-3 довжиною 188 амінокислот являє собою наступну послідовність [SEQ ID NO: 2]: 15 85163 В одному варіанті антитіла згідно з винаходом зв'язуються з епітопом в EGF-подібному домені Cripto. EGF-подібний домен тягнеться приблизно від амінокислотного залишку 75 до амінокислотного залишку 112 зрілого білка Cripto. Епітопи в EGFподібному домені можуть містити лінійні або нелінійні ділянки амінокислотних залишків. Приклад лінійних епітопів, що розглядаються, включає, але не обмежений вказаним, приблизно залишки 7585, 80-90, 85-95, 90-100, 95-105, 100-110 або 105112. В одному варіанті епітоп в EGF-домені є епітопом, що утворюється в конформаційно нативному білку Cripto на відміну від денатурованого білка Cripto. В іншому варіанті антитіла згідно з винаходом зв'язуються з епітопом в Cys-багатому домені Cripto. Cys-багатий домен тягнеться приблизно від амінокислотного залишку 114 до амінокислотного залишку 150 зрілого білка Cripto. Епітопи в Cysбагатому домені можуть містити лінійні або нелінійні ділянки амінокислотних залишків. Приклад лінійних епітопів, що розглядаються, включає, але не обмежений вказаним, приблизно залишки 114125, 120-130, 125-135, 130-140, 135-145 або 140150. В одному варіанті епітоп в Cys-багатому домені є епітопом, що утворюється в конформаційно нативному білку Cripto на відміну від денатурованого білка Cripto. Після створення антитіл зв'язування антитіл з Cripto можна аналізувати з використанням стандартних способів, відомих в даній області, таких як ELISA, тоді як присутність Cripto на клітинній поверхні можна аналізувати з використанням проточної цитометрії (FACS), як показано в прикладі 2. Альтернативно можна використати будь-який інший спосіб вимірювання такого зв'язування. Даний винахід відноситься до антитіл (наприклад, моноклональних і поліклональних антитіл, одноланцюгових антитіл, химерних антитіл, біфункціональних/біспецифічних антитіл, гуманізованих антитіл, людських антитіл і антитіл з прищепленими районами, що визначають комплементарність (CDR), включаючи сполуки, які містять послідовності CDR, які специфічно впізнають поліпептид згідно з винаходом), специфічних по відношенню до Cripto або його фрагментів. Винахід також відноситься до фрагментів антитіл, включаючи Fab, Fab', F(ab')2 і Fg. Терміни «специфічне» і «вибіркове» у випадку використання для опису зв'язування антитіл згідно з винаходом вказують, що варіабельні ділянки антитіл згідно з винаходом впізнають і зв'язують поліпептиди Cripto. Буде зрозуміло, що специфічні антитіла згідно з винаходом також можуть взаємодіяти з іншими білками (наприклад, білком A S. aureus або іншими антитілами в способах ELISA) за допомогою взаємодій з послідовностями поза варіабельними ділянками антитіл і, зокрема, в константній ділянці молекули. Скринінгові аналізи для визначення специфічності зв'язування антитіла згідно з винаходом (тобто антитіл, які специфічно зв'язуються з епітопом в ліганд/рецепторзв'язувальному домені і домені, що охоплює залишки амінокислот 46-62) добре відомі і постійно використовуються на практиці в даній області. З метою повного обговорення таких ана 16 лізів, дивись [Harlow et al. (Eds.), Antibodies A Laboratory Manual; Cold Spring Harbor Laboratory; Cold Spring Harbor, NY (1988), Chapter 6]. Також представлені антитіла, які впізнають і зв'язують фрагменти білка Cripto, за умови, що антитіла є специфічними по відношенню до поліпептидів Cripto. Антитіла згідно з винаходом можна одержати з використанням будь-якого способу, добре відомого і постійно використовуваного на практиці в даній області. В одному варіанті винахід відноситься до антитіла, яке специфічно зв'язується з епітопом в ліганд/рецепторзв'язувальному домені Cripto. Специфічність антитіла більш детально описана нижче. Однак потрібно підкреслити, що антитіла, які можна створити на основі інших поліпептидів, які були раніше описані в літературі і які здатні випадково перехресно реагувати з Cripto (наприклад, внаслідок випадкового існування схожого епітопу в обох поліпептидах), вважаються «перехресно реагуючими» антитілами. Такі перехресно реагуючі антитіла не є антитілами, «специфічними» по відношенню до Cripto. Визначення того, чи зв'язується антитіло специфічно з епітопом Cripto, здійснюють з використанням будь-якого з декількох аналізів, таких як Вестерн-блот-аналіз, які добре відомі в даній області. Антитіла, які специфічно зв'язуються з позаклітинним епітопом білка Cripto (тобто з частинами білка Cripto, що виявляються ззовні клітини), особливо корисні для ідентифікації клітин, які експресують Cripto, а також для модулювання ліганд/рецепторзв'язувальної активності Cripto. В одному варіанті винахід відноситься до безклітинної композиції, що містить поліклональні антитіла, де, щонайменше, одне з антитіл є антитілом згідно з винаходом, специфічним у відношенні Cripto. Прикладом композиції є антисироватка, виділена з тварини, яка являє собою композицію, що містить фракцію антитіл антисироватки, яка була ресуспендована у воді або в іншому розріджувачі, наповнювачі або носії. В іншому варіанті винахід відноситься до моноклональних антитіл. Моноклональні антитіла є високо специфічними, оскільки направлені проти одного антигенного сайту. Крім того, на відміну від поліклональних препаратів, які звичайно містять різні антитіла, направлені проти різних епітопів, кожне моноклональне антитіло направлене проти єдиної детермінанти на антигені. Моноклональні антитіла придатні для підвищення вибірковості і специфічності способів діагностичного і аналітичного дослідження з використанням зв'язування антиген-антитіло. Інша перевага моноклональних антитіл полягає в тому, що вони синтезуються культурою гібридоми, що не містить домішок інших імуноглобулінів. Гібридоми, які продукують такі антитіла, також вважаються аспектами винаходу. У ще одному спорідненому варіанті винахід відноситься до антиідіотипічного антитіла, специфічного відносно антитіла, яке специфічне для Cripto. З метою більш докладного обговорення антиідіотипічних антитіл дивись, наприклад, [патенти США 6063379 і 5780029]. 17 85163 18 Добре відомо, що антитіла містять відносно ференціювання, що сприяє вияву характеристик невеликі антигензв'язувальні домени, які можна мезенхімальних клітин, підвищеної проліферації і виділити хімічним способом або одержати рекомміграції клітин [Salomon et al., BioEssays 21: 61бінантними способами. Такі домени як такі є при70,1999; Ciardiello et al., Oncogene 9: 291-298, датними як молекули, які зв'язують Cripto, a також 1994; і Baldassarre et al., Int. J. Cancer 66: 538-543, їх можна повторно ввести в людські антитіла або 1996], вияву фенотипів, пов'язаних з трансформазлити з хіміотерапевтичним засобом або поліпепцією клітин, що спостерігається при неоплазії. тидом. Таким чином, в ще одному варіанті винахід Одними зі способів тестування активності анвідноситься до поліпептиду, що містить фрагмент ти-Cripto-антитіл і їх здатності модулювати переCripto-специфічного антитіла, де фрагмент і асоцідачу сигналу є спосіб з використанням лінії клітин йована молекула, якщо вона існує, зв'язуються з F9, «нокаутованих» (КO) за Cripto [Minchiotti at al., Cripto. Як необмежувальний приклад винахід відMech. Dev. 90: 133-142, 2000]. Cripto стимулює носиться до поліпептидів, які є одноланцюговими фосфорилювання smad2 і фактор транскрипції антитілами і CDR-прищепленими антитілами. Для FAST в ембріонах Xenopus, і активність фактора більш докладного обговорення CDR-прищеплених транскрипції FAST можна контролювати, вимірююантитіл дивись, наприклад, [патент США 5859205]. чи активність люциферази репортерного гена реВ іншому варіанті надлюдські антитіла можна гуляторний елемент FAST-люцифераза [Saijoh et гуманізувати будь-яким способом, відомим в даній al., Mol. Cell 5:35-47, 2000]. У клітинах F9-Cripto-KO області. Гуманізовані антитіла придатні для тераделетований ген Cripto, і таким чином вони є нупевтичних застосувань in vivo. Крім того, можна льовими клітинами у відношенні Cripto і залежної синтезувати рекомбінантні «гуманізовані» антитівід Cripto передачі сигналу [Minchiotti at al., Mech. ла. Гуманізовані антитіла являють собою антитіла, Dev. 90: 133-142, 2000]. Передачу сигналу Cripto початково одержані з ссавця, який відрізняється можна оцінити в клітинах F9-Cripto-KO шляхом від людини, для яких використали технологію ретрансфекції генної конструкції Cripto, FAST і регукомбінантної ДНК, щоб замінити деякі або всі аміляторний елемент FAST-люцифераза. У вказаних нокислоти, не необхідні для зв'язування антигену, лініях клітин залежної від Cripto FASTамінокислотами з відповідних ділянок легкого або люциферазної активності не спостерігається, поки важкого ланцюга імуноглобуліну людини. Тобто, в них не трансфікують кДНК Cripto і кДНК FAST. вони є химерами, що головним чином містять поАнтитіла, здатні блокувати Cripto-залежну передаслідовності імуноглобуліну людини, в які були вбучу сигналу Nodal, є антитілами, які блокують функдовані ділянки, відповідальні за специфічне зв'яцію передачі сигналу Cripto. зування антигену [дивись, наприклад, заявку на Фахівці в даній області можуть використати видачу патенту PCT WO 94/04679]. Тварин імуніінші аналізи, що дозволяють вимірювати активзують необхідним антигеном, виділяють відповідні ність Cripto, такі як аналіз зростання в м'якому агаантитіла і видаляють частину послідовностей варі (дивись приклад 4 нижче). Здатність клітин росріабельних ділянок, відповідальних за специфічне ти в м'якому агарі пов'язана з трансформацією зв'язування антигену. Одержані від тварини антиклітин, і аналіз є класичним аналізом in vitro для гензв'язувальні ділянки потім клонують у відповідвимірювання інгібування зростання пухлинних кліному положенні генів антитіла людини, в яких були тин. Інші аналізи, застосовні для визначення інгіделетовані антигензв'язувальні ділянки. Гуманізобування активності, включають аналізи in vitro на вані антитіла мінімізують використання гетерологіпластику і тому подібні. чних (міжвидових) послідовностей в антитілах для Терапевтичні застосування застосування в терапії людини, і менш ймовірно, Антитіла згідно з винаходом також застосовні що вони викличуть небажані імунні відповіді. Подідля терапевтичних цілей, таких як модулювання бним чином можна одержати приматизовані антизростання пухлинних клітин, діагностичних цілей тіла, використовуючи гени антитіл примату (напридля виявлення або кількісного вимірювання Cripto і клад, резусу, бабуїна і шимпанзе). Потім можна для очищення Cripto. ввести інші зміни в каркас антитіла, щоб модулюВ одному варіанті винаходу представлені анвати афінність або імуногенність. [Дивись, напрититіла, які здатні специфічно зв'язуватись з Cripto і клад патенти США №. 5585089, 5693761, 5693762 і які модулюють зростання пухлинних клітин у паці6180370]. єнта. В одному варіанті пухлинними клітинами є Інший варіант винаходу включає застосування клітини пухлини сім'яників, молочної залози, товслюдських антитіл, які можна продукувати в тваритої кишки, легені, яєчника, сечового міхура, матки, нах, які відрізняються від людини, таких як трансшийки матки, підшлункової залози і шлунка. генні тварини, що несуть один або декілька трансВ іншому варіанті представлені антитіла, які генів імуноглобуліну людини. Таких тварин можна здатні специфічно зв'язуватись з Cripto і які модувикористати як джерело спленоцитів для одерлюють зростання пухлинних клітин, які понадекспжання гібридом, як описано в [патенті США ресують Cripto. B одному варіанті пухлинними клі5569825, заявках на видачу патенту WO 00076310, тинами є лінії клітин, які понадекспресують Cripto, WO 00058499 і WO 00037504, включеному в даний такі як лінії клітин, одержані зі злоякісної пухлини опис у вигляді посилань]. молочної залози, сім'яників, товстої кишки, легені, Модулювання сигналу яєчника, сечового міхура, матки, шийки матки, В іншому варіанті антитіла згідно з винаходом підшлункової залози і шлунка. зв'язуються з Cripto і модулюють передачу сигналу Можна проводити скринінг анти-Cripto-антитіл Cripto або взаємодії Cripto-білків. Понадекспресія відносно активності in vivo як потенційні протираактивності Cripto може приводити до стану дедикові засоби, слідуючи стандартним протоколам, 19 85163 20 що використовуються фахівцями в даній області, людини [амінокислоти 1-169 SEQ ID NO: 1], злиті з як показано у прикладі 4 нижче. Приклади таких Fc-доменом IgG1 людини (тобто, «CR(del C)-Fc»), у протоколів загалом описані National Cancer векторі pEAG1100. Для знайомства з більш доклаInstitute (NCI) в їх протоколах «скринінгу моделей дним описом вказаного вектора, дивись заявку, що злоякісних пухлин in vivo», номер публікації NIH знаходиться на спільному розгляді на видачу [па84-2635 (лютий 1984). тенту США з реєстраційним №. 60/233148, подану В іншому варіанті винаходу антитіла згідно з 18 вересня 2000]. Вектор pEAG1100 є похідним винаходом використовують для лікування пацієнплазміди pCMV-Sport-betagal GIBCO-BRL Life та, що має злоякісну пухлин у. Technologies, застосування якого для тимчасових Антитіла згідно з даним винаходом можна трансфекцій CHO описане [Schifferli et al., 1999, комбінувати з фармацевтично прийнятним наповFocus 21: 16]. Він був одержаний видаленням Notlнювачем і вводити пацієнту в терапевтично ефекфрагмента репортерного гена бета-галактозидази тивній дозі. Для обговорення способів інгібування з плазміди pCMV-Sport-Betagal (номер в каталозі зростання пухлин дивись, наприклад, [патент США 10586-014) таким чином: плазміду розщеплювали 6165464]. Notl і EcoRV, Notl-фрагмент кістяка вектора розміТакож передбачені способи лікування суб'єкта, ром 4,38т.п.н. піддавали очищенню в гелі і лігувастраждаючого порушенням, пов'язаним з аномали. Ліговану ДНК трансформували в компетентні льними рівнями (тобто підвищеними або знижениклітини E. соlі DHS-альфа. pEAG1100 виділяли у ми) Cripto, при цьому спосіб включає в себе ввевигляді плазміди, що містить необхідний рекомбідення суб'єкту е фективної кількості антитіла, яке нант, з окремої ізольованої колонії. Підтверджуваспецифічно зв'язується з епітопом в ліли послідовність pEAG1100, що о хоплює промоганд/рецепторзв'язувальному домені Cripto, вклютор, полілінкер і сигнал термінації транскрипції. чаючи, але не обмежуючись вказаним, випадки, Плазміду pSGS480 тимчасово трансфікували коли епітоп знаходиться в EGF-подібному домені в клітини CHO, і клітини вирощували при 28°C або Cys-багатому домені Cripto. протягом 7 днів. Наявність білка CR(del C)-Fc у Також передбачені способи лікування суб'єкта, вказаних клітинах і кондиціонованих середовищах страждаючого порушенням, пов'язаним з аномаоцінювали за допомогою Вестерн-блот-аналізу. льними рівнями (тобто підвищеними або знижениДля Вестерн-блот-аналізу кондиціоновані середоми) Cripto, при цьому спосіб включає введення вища і клітини з Cripto-трансфікованих культур суб'єкту е фективної кількості антитіла, яке специклітин піддавали SDS-ΠΑΑΓ в 4-20%-градієнтних фічно утворює комплекс з Cripto і направлене до гелях у відновлювальних умовах, за допомогою епітопу, до якого направлене антитіло, вибране з електрофорезу переносили на нітроцелюлозу, і групи, що складається з А6С12.11, A6F8.6 (ATCC злитий білок Cripto виявляли за допомогою поліінвентарний №. PTA-3318), A7H1.19, A8F1.30, клональної кролячої антисироватки, одержаної A8G3.5 (ATCC інвентарний №. PTA-3317), A8H3.1 проти кон'югату 17-мірного пептиду Cripto (що міс(ATCC інвентарний №. PTA-3315), A8H3.2, тить залишки 97-113 SEQ ID NO: 1) з гемоціаніном A19A10.30, A10B2.18 (ATCC інвентарний №. PTAморського блюдця «замкова щілина». Після 3311), A27F6.1 (ATCC інвентарний №. PTA-3310), центрифугування для видалення клітин проведеA40G12.8 (ATCC інвентарний №. PTA-3316), ний Вестерн-блот-аналіз показав, що білок CR(del A2D3.23, A7 A10.29, A9G9.9, A15C12.10, A15E4.14, C)-Fc ефективно секретується в кондиціоновані A17A2.16, A17C12.28, A17G12.1 (ATCC інвентарсередовища (надосад). Надосад наносили на біний №.PTA-3314), A17H6.1, A18B3.11 (ATCC інвелок А-сефарозу (Pharmacia), і пов'язаний білок нтарний №. PTA-3312), A19E2.7, B3F6.17 (ATCC елюювали 25мМ фосфа том натрію, рН 2,8, 100мМ інвентарний №. PTA-3319) і B6G7.10 (ATCC інвенNaCl. Елюйований білок нейтралізували 0,5M фотарний №. РТА-3313). сфатом натрію при рН 8,6 і аналізували відносно Діагностику за допомогою детекції Cripto легко вмісту загального білка на основі вимірювань поздійснити за допомогою стандартних аналізів зв'яглинання при 240-340нм і відносно чистоти за дозування з використанням нових антитіл згідно з помогою SDS-ΠΑΑΓ. Елюйований білок фільтрувинаходом, що дозволяють фахівцям специфічно вали через фільтр з діаметром пор 0,2 мікрона і виявляти наявність Cripto в широкому колі зразків, зберігали при -70°C. культур і т.д. Приклад 2: Створення і скринінг антитіл Також передбачені набори, що містять антитіЕлюйований білок CR(del C)-Fc ін'єктували ло згідно з винаходом, для будь-яких наведених в мишам і використали стандартні способи гібридом, даному описі цілей. Як правило, набір згідно з вивідомі фахівцям в даній області,щоб створити находом також містить контрольний антиген, по моноклональні антитіла. відношенню до якого антитіло є імуноспецифічА.С творення антитіл ним. Варіанти включають набори, що містять всі Зокрема, самиць мишей Robertsonian (Jackson реагенти та інструкції з їх застосування. Labs) внутрішньоочеревинно імунізували 25мкг Додаткові характерні особливості винаходу очищеного CR(del C)-Fc, емульгованого з повним будуть зрозумілі на основі наступних ілюстративад'ювантом Фрейнда (GibcoBRL №15721-012). них прикладів. Мишей два рази піддавали бустер-імунізації внутПриклади рішньоочеревинно 25мкг CR(del C)-Fc, емульговаПриклад 1: Експресія і очищення Cripto ного з неповним ад'ювантом Фрейнда (GibcoBRL Експресуючу плазміду, названу pSGS480, №15720-014), і один раз на кульках з білком А. конструювали за допомогою субклонування до Проводили скринінг сироваток і через 3 тижні після ДНК, що кодує амінокислотні залишки 1-169 Cripto останньої бустер-імунізації миша з найвищим тит 21 85163 22 ром бустер-імунізували внутрішньоочеревинно, кали досуха. Надосади розводили 1:50 в буфері використовуючи 50мкг розчинного CR(del C)-Fc, за для промивання і вміщували в планшети по три дні до злиття. Мишу бустер-імунізували внут50мкл/ямку з подальшою інкубацією протягом 1 рішньовенно, використовуючи 50мкг CR(del C)-Fc години при кімнатній температурі. Планшети 3 за день до злиття. Клітини селезінки миші зливали рази енергійно промивали 250мкл/ямку буфера з клітинами мієломи FL653 у співвідношенні 1 клідля промивання. Потім додавали 100мкл/ямку 2тина селезінки: 6 клітин мієломи і висівали при ого антитіла, розведеного в буфері для промиванщільності 100000, 33000 і 11000 клітин на ямку в ня у співвідношенні 1:10000, з подальшою інкуба96-ямковий планшет для культури тканини в селецією протягом 30хв. при кімнатній температурі. ктивні середовища. Через тиждень проводили Потім планшети 3 рази енергійно промивали скринінг ямок, позитивних відносно зростання, за 250мкл/ямку буфера для промивання, потім додадопомогою FACS і ELISA. Проводили два злиття. вали субстрат по 100мкл/ямку. Давали можливість B. Скринінг антитіл забарвленню розвинутись до достатньої інтенсивПроводили скринінг надосадів, одержаних ності, потім додавали 100мкл/ямку розчину для внаслідок першого або другого злиття, спочатку на зупинки і проводили реєстрацію планшетів відноспланшетах для ELISA для пізнавання білків Cripto но поглинання при 450нм. del C і/або EGF-подібного домену Cripto. ПланшеD. Проточна цитометрія ти ELISA покривали контрольним злитим білком Cripto-позитивні лінії клітин можна використати (LT-бета-рецептор-Fc), щоб позбутись моноклонадля аналізу моноклональних антитіл відносно зв'яльних антитіл, які впізнавали епітоп Fc людини. зування з Cripto, використовуючи фарбування кліELISA виконували як описано нижче в розділі C. У тинної поверхні і проточну цитометрію таким чивипадку першого злиття також проводили скринінг ном: первинних надосадів відносно їх здатності впізнаКлітини вивільняють з флаконів Т162, викоривали білок Cripto на клітинній поверхні лінії клітин стовуючи 2мл PBS з 5мМ EDTA протягом 10хв. пухлини сім'яників NCCIT за допомогою FACS. У при 37°С. Доводять до 20мл середовищем з сировипадку другого злиття аналізували здатність наваткою, декілька разів піпетують вгор у і вниз, щоб досадів впізнавали Cripto на двох лініях пухлинних роз'єднати клітини. Центрифугують при клітин, NCCIT і лінії клітин раку молочної залози 1200об./хв. протягом 5 хвилин. Клітини промиваDU4475, за допомогою FACS. Вторинні скринінги ють 5-10мл PBS з температурою 4°C з 0,1% БСА включали тестування здатності надосадів монок(буфер для промивання). Центрифугують при лональних антитіл впізнавали Cripto клітинної по1200об./хв. протягом 5 хвилин. Ресуспендують при верхні на панелі ліній пухлинних клітин (дивись концентрації 4´106-107/мл в буфері для промиванрезультати в таблицях 1 і 2), здібності моноклонаня. Зберігають на льоду. льних антитіл впізнавали Cripto людини імуногісГотують антитіла для фарбування. Очищені тохімічно на зрізах тканини пухлини молочної заантитіла розводять до 1-10мкг/мл в буфері для лози і товстої кишки людини, здібності промивання. Додають по 50мкл клітин в 96-ямкові моноклональних антитіл блокувати при аналізі планшети Linbro з V-подібним дном (ICN 7632105). передачі сигналу Cripto-Nodal, здібності блокувати По одній ямці засівають клітинами для кожного з зростання ліній пухлинних клітин при аналізах на контролів кожної лінії клітин, яку необхідно аналіпластику або в м'якому агарі і здібності інтерналізувати, включаючи клітини без антитіла, тільки з 2зувати Cripto клітинної поверхні. м антитілом, з середовищем для гібридом, з надоC. ELISA садом антитіл позитивного контролю, якщо такий є Аналізи ELISA виконували таким чином: або очищений, і контролем підкласу IgG (у випадМатеріали: ку, використання очищених антитіл). Планшети: 96-ямкові з високою здібністю до Засівають по одній ямці для кожного експеризв'язування і планшети, що легко промиваються, ментального зразка для кожної лінії клітин, що Costar (07-200-642) аналізується. Планшет центрифугують при 2-е антитіло: антитіло кози проти мишачого 1200об./хв. протягом 5 хвилин, використовуючи IgG (H+L)-HRP (P131430) настільну центрифугу, при 4°C. Швидко видаляють Субстрат: субстратний набір TMB Pierce буфер, перевертаючи планшет і струшуючи доти, (34021) поки рідина в основному не стече. Додають в ямки Розчин для зупинки: 1N H 2SO4 по 40-50мкл антитіл (або буфера для промивання Буфери: у випадку ямок без антитіла або контрольних ямок Буфер для зв'язування: 0,1M NaHPO4, рН 9,0 тільки з 2-им антитілом). Інкубують, щонайменше, Блокуючий буфер: PBS+10% донорська сиро30 хв. - 1 годину при 4°С. Планшет центрифугують ватка теляти при 1200об./хв. протягом 5 хвилин. Швидко видаБуфер для промивання: PBS+0,1% Твін-20 ляють розчини антитіл. Ямки двічі промивають Антигени CR(del C)-Fc і CR EGF-Fc, контроль200мкл буфера для промивання на ямку, центриний злитий білок IgGl людини розбавляли в буфері фугуючи після кожного промивання. Буфер швиддля зв'язування до 500нг/мл. Додавали по 100мкл ко видаляють. на ямку та інкубували протягом 1год. при 37°С або Клітини в кожній ямці ресуспендують в 50мкл протягом ночі при 4°С. Рідину декантували, і міченого R-PE антитіла кози проти мишачого IgG, планшет перевертали і промокали досуха. Потім Fc-специфічного (Jackson Immunoresearch додавали 250мкл/ямку блокуючого буфера, після Laboratories катал. № 115-116-071), в розведенні чого інкубували протягом 30хв. при 37°C. Рідину 1:200 (в буфері для промивання). Інкубують 20хв. знов декантували, і планшет перевертали і промопри 4°C в темряві. До клітин в кожній ямці додають 23 85163 24 150мкл буфера для промивання. Планшет Результати двох скринінгових досліджень моцентрифугують при 1200об./хв. протягом 5 хвилин. ноклональних антитіл, одержані вказаним спосоОдин раз промивають 200мкл буфера для промибом, дали наступні дані, підсумовані в таблицях 1 і вання на ямку. Клітини ресуспендують в 150мкл 2 нижче, де в першій колонці наведені назви суб1% PFA в PBS. Вміст кожної ямки переносять в клонів гібридом, в наступних двох колонках покаокремі пробірки (круглодонні полістиролові пробірзані результати скринінгу в EL ISA, а в інших колоки об'ємом 5мл Falcon 352052). Пробірки загортанках показані результати аналізу проточною ють в олов'яну фольгу. цитометрією, одержані на чотирьох CriptoПотім вміст пробірок реєструють проточною позитивних лініях клітин. Результати наведені в цитометрією. одиницях середнього показника флуоресценції (MFI). Таблиця 1 Характеристика анти-Cripto-моноклонального антитіла Субклон гібридоми Контроль - ELISA Контроль - мишачий Ig A6C12.11 A6F8.6 А7Н1.19 A8F1.30 A8G3.5 А8Н3.1 А8Н3.2 А19А10.30 А10В2.18 A27F6.1 A40G12.8 № депозиту ELISA Cripto ELISA EGF-подібний DU4475 NCCIT ATCC delC Sups домен Cripto MFI MFI 0,06 0,07 14 9 2,21 0,07 11 35 РТА-3318 2,32 0,08 11 50 2,14 0,09 14 34 2,15 0,1 17 27 РТА-3317 2,39 0,09 9 30 РТА-3315 2,4 1,7 9 44 2,54 0,07 13 13 2,02 0,09 9 40 РТА-3311 2,36 0,07 40 63 РТА-3310 2,28 1,19 9 44 РТА-3316 2,27 1,59 10 47 GEO MFI НТЗ MFI 37 29 29 27 32 25 23 16 20 100 26 26 18 8 10 12 28 15 10 14 10 43 17 16 Таблиця 2 Характеристика анти-Cripto-моноклонального антитіла Субклон гібридоми Контроль - ELISA Контроль - мишачий Ig A2D3.23 А7 А10.29 A9G9.9 А15С12.10 А15Е4.14 А17А2.16 А17С12.28 A17G12.1 А17Н6.1 A18B3.11 А19Е2.7 B3F6.17 B6G7.10 В11Н8.4 В12С12.5 B15A2.6 C4A2.16 № депозиту ELISA Cripto ELISA EGF-подібний DU4475 NCCIT ATCC delC домен Cripto MFI MFI 0,05 0,05 10 6 0,93 0,90 73 138 1,37 0,07 75 83 1,39 0,07 52 62 1,42 0,06 46 55 1,38 0,06 50 63 1,40 0,06 76 97 0,96 0,97 6 16 РТА-3314 1,30 1,37 61 66 1,38 0,05 35 30 РТА-3312 1,36 1,38 50 42 1,40 0,06 53 59 РТА-3319 1,37 0,06 77 51 РТА-3313 1,38 1,40 28 22 1,41 0,06 59 101 1,10 1,04 27 14 1,40 0,06 36 44 1,40 0,06 24 36 Приклад 3: Аналіз нульових клітин відносно інгібування передачі сигналу Cripto Нижченаведене є описом аналізу передачі сигналу в Cripto-нульових клітинах F9, що викорис GEO MFI НТЗ MFI 4 37 33 32 25 23 41 3 28 5 33 26 39 22 39 23 22 22 4 27 83 82 93 95 81 22 78 28 65 99 89 56 107 59 59 65 товується для оцінки інгібування передачі сигналу Cripto. День 0. 6-ямкові планшети покривають 0,1% желатином по 2мл/ямку при 37°С протягом 15хв. 25 85163 26 Для кожного зразка змішують разом розчин А і Клітини висівають при щільності 6´105 Criptoрозчин В. Інкубують 45 хвилин при кімнатній темнульових клітин F9 на ямку. День 1. Трансфекція: пературі. Ямки промивають 2мл/ямку Opti Mem1. Рідину видаляють безпосередньо перед наступКожний з наступних зразків додають до ною стадією. 300мкл OptiMem1, щоб одержати розчин А для До кожної суміші розчинів А+В додають 2,4мл кожного зразка: OptiMem1, перемішують, додають в ямки по Зразок 1: 0,5мкг репортерної кДНК (N2)7люциферази-FAST плюс 1,5мкг кДНК пустого век1,5мл/ямку в повторах. Інкубують 5 годин при 37°С. Додають 1,5мл/ямку DMEM+20% FCS, 2мМ тора. Gin, P/S в ямки, в які вносили зразки 1-3. АнтиЗразок 2: 0,5мкг кДНК (N2)7-люциферази, Cripto-антитіла додають таким чином: ямки зі зраз0,5мкг кДНК FAST і 1мкг кДНК пустого вектора. ком 4: A27F6.1, 10мкг/мл; ямки зі зразком 5: Зразок 3: 0,5мкг кДНК (N2)7-люциферази, 0,5мкг кДНК Cripto, 0,5мкг кДНК FAST і +0,5мкг A27F6.1, 2мкг/мл; ямки зі зразком 6: A40G12.8; 10мкг/мл, ямки зі зразком 7: A40G12.8, 2мкг/мл; кДНК пустого вектора. ямки зі зразком 8: А10В2.18, 10мкг/мл; ямки зі зраЗразок 4: 0,5мкг кДНК (N2)7-люциферази, зком 9: А10В2.18,2мкг/мл. 0,5мкг кДНК Cripto, 0,5мкг кДНК FAST і 0,5мг кДНК День 2. Видаляють середовища, клітини пропустого вектора. Зразок 5: 0,5мкг кДНК (N2)7-люциферази, мивають PBS, 2мл/ямку. Додають DMEM+0,5% FCS, 2мМ Gin, P/S з такими ж кількостями Cripto0,5мкг кДНК Cripto, 0,5мкг кДНК FAST і 0,5мг кДНК антитіл, як в попередній день в ті ж самі ямки. пустого вектора. День 3. Виявляють сигнал люциферази. Ямки Зразок 6: 0,5мкг кДНК (N2)7-люциферази, промивають PBS+Ca2+ і Mg2+, 2мл/ямку. Викорис0,5мкг кДНК Cripto, 0,5мкг кДНК FAST і 0,5мг кДНК пустого вектора. товують набір LucLite, Packard катал. № 6016911. Буфер і субстрат доводять до кімнатної темпераЗразок 7: 0,5мкг кДНК (N2)7-люциферази, тури. Кімнату затемняють. Субстрат перерозчиня0,5мкг кДНК Cripto, 0,5мкг кДНК FAST і 0,5мг кДНК ють з використанням 10мл буфера. Розбавляють пустого вектора. 1:1 PBS+Ca2+ і Mg2+. Рідину з ямок видаляють. Зразок 8: 0,5мкг кДНК (N2)7-люциферази, 0,5мкг кДНК Cripto, 0,5мкг кДНК FAST і 0,5мг кДНК Швидко додають 250мкл розбавленого субстрату в ямку, використовуючи пристрій для піпетування пустого вектора. декількох зразків. Розчин перемішують і переноЗразок 9: 0,5мкг кДНК (N2)7-люциферази, сять по 200мкл в ямки 96-ямкового планшета з 0,5мкг кДНК Cripto, 0,5мкг кДНК FAST і 0,5мг кДНК білим непрозорим дном Falcon 35-3296. Прочитупустого вектора. Розчин В містить 30мкл ліпофектаміну плюс ють планшет в люмінометрі, використовуючи Winglow, видаючи дані в Excel. 270мкл OptiMem1. Результати аналізу підсумовані нижче в таблиці 3. Таблиця 3 Аналіз передачі сигналу Cripto: Інгібування анти-Cripto-моноклональними антитілами Трансфікована кДНК (N2)7luc (N2)7luc, FAST (N2)7luc, FAST, Cripto (N2O7Iuc, FAST, Cripto (N2)7luc, FAST, Cripto (N2)7luc, FAST, Cripto (N2)7luc, FAST, Cripto (N2)7luc, FAST, Cripto JN2)7luc, FAST, Cripto Анти-Cripto-антитіло Відсутній Відсутній Відсутній A27F6.1 10мкг/мл A27F6.1 2мкг/мл A40G12.8 10мкг/мл A40G12.8 2мкг/мл A10B2.18 10мкг/мл А10В2.18 2мкг/мл Приклад 4: Аналіз інгібування зростання пухлинних клітин in vitro Інгібування передачі сигналу Cripto також можна аналізувати за допомогою вимірювання зростання клітин GEO в м'якому агарі. Дивись, наприклад, [Ciardiello et al, Oncogene. 1994 Jan; 9 (1): 291-8; Ciardiello et al., Cancer Res. 1991 Feb 1; 51 (3): 1051-4]. Спочатку розплавляють 3% бактоагар. Зберігають при 42°С на водяній бані. Потім змішують 3% розчин бактоагару із заздалегідь нагрітим повним середовищем, щоб одержати розчин 0,6% бактоагару, який утримують при 42°С. Вміщують Відносні одиниці люмінесценції 123 259 3091 1507 2297 1213 2626 3466 3103 4мл розчину в 6-см чашки і дають можливість вихолонути , щонайменше, протягом 30 хвилин з утворенням нижнього шару агару. Трипсинізують клітини GEO і ресуспендують до 105клітин/мл в повному середовищі. До суспензій клітин додають антитіла, що аналізуються, або контролі, титруючи антитіла від 20мкг до 1мкг. Змішують рівні об'єми суспензій клітин GEO і 0,6% бактоагару і нашаровують по 2мл зверху на нижній шар агару. Дають можливість вихолонути, щонайменше, протягом 1 години. Інкубують протягом 14 днів при 37°С в СО2-інкубаторі. Підраховують колонії, видимі без застосування мікроскопа. Відсутність колоній в 27 85163 28 порівнянні з негативними контролями свідчить про Вказаний аналіз використали для одержання те, що антитіла, які тестуються, інгібують зростанрезультатів, показаних в таблиці 4, для антитіл ня пухлинних клітин in vitro. A27F6.1 і B6G7.10, які обидва виявляють здатність зменшувати зростання колоній клітин Geo. Таблиця 4 або без додаткових хіміотерапевтичних обробок, які можуть надавати синергетичну або адитивну Результати аналізу зростання в м'якому агарі дію на інгібування пухлини. Аналіз можна проводити альтернативно з використанням різних ліній пухлинних клітин, наприАнтитіло Середня кількість колоній клад, таких як GEO (добре диференційована лінія Відсутній 109,0 клітин раку товстої кишки людини, що культивуВідсутній 104,3 ється in vitro, одержана з американської колекції A27F6 20мкг/мл 82,0 типів тканин (ATCC)), DU-4475 (лінія клітин раку A27F6.1 10мкг/мл 78,3 молочної залози in vitro, одержана з ATCC), NCCIT A27F6.1 5мкг/мл 79,0 (лінія клітин пухлини сім'яника, одержана з ATCC) A27F6.1 1мкг/мл 108,7 або інших ліній, відомих в даній області. Одним з В6О7.10 20мкг/мл 102,3 прикладів таких аналізів є наступний аналіз: B6G7.10 10мкг/мл 71,7 Тварин індивідуально маркують проколюванПриклад 5: Аналіз інгібування зростання пухлинних клітин in vivo Щоб оцінити інгібування зростання пухлинних клітин лінію пухлинних клітин людини імплантують підшкірно бестимусним мишам nude і досліджують вплив антитіл згідно з винаходом з використанням № групи 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 ням вух. Лінію клітин GEO пересівають in vitro або in vivo протягом 1-4 пасажів. Тваринам імплантують клітини GEO підшкірно в область правого боку. Можна використати наступні групи тварин: Обробка Контрольний фізіологічний розчин, 0,2 мл/миша, в/о три рази на тиждень (M, W, F) мАт, низька доза, в/о мАт, середня доза, в/о мАт, висока доза, в/6 5- FU, 30мг/кг/ін'єкц., в/о, 3 прийоми/тиждень (M, W, F) Цисплатин, 2мг/кг/ін'єкц., п/ш, 3 прийоми/тиждень (M, W, F) Адріаміцин, 1,6мг/кг/ін'єкц., в/о, 3 прийоми/тиждень (M, W, F) Іринотекан, 10мг/кг/ін'єкц., в/о, 5 прийомів/тиждень (M-F) мАт, низька доза, в/о + 5-FU (проміжна доза) мАт, середня доза, в/о + 5-FU (проміжна доза) мАт, висока доза, в/о + 5-FU (проміжна доза) мАт, низька доза, в/о + цисплатин (проміжна доза) мАт, середня доза, в/о + цисплатин (проміжна доза) мАт, висока доза, в/о + цисплатин (проміжна доза) мАт, низька доза, в/о + адріаміцин (проміжна доза) мАт, середня доза, в/о + адріаміцин (проміжна доза) мАт, висока доза, в/о + адріаміцин (проміжна доза) мАт, низька доза, в/о + іринотекан (проміжна доза) мАт, середня доза, в/о + іринотекан (проміжна доза) мАт, висока доза, в/о + іринотекан (проміжна доза) День 0: Імплантують пухлину, реєструють початкову ва гу тіла тварин. День 1: Починають обробку, як вказано вище. День 5: Починають вимірювання розміру пухлини і ваги тіла і продовжують вимірювання два рази на тиждень аж до закінчення експерименту. Оцінюють вимірювання початкової ваги тіла, розміру пухлини, гістологію при умертвленні та імуногістохімічний аналіз пухлин, аналізуючи експресію Cripto, зростання пухлини та їх інгібування. Приклад 6: Модель ксенотрансплантованої пухлини in vivo - анти-Cripto-антитіло, що блокує Cys-багатий домен Щоб оцінити відповідь NCCIT лінію клітин карциноми сім'я ників людини імплантували підшкірно з антитілом, яке зв'язується з Cys-багатим доме Кількість мишей 20 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 ном Cripto. Експериментальні способи перераховані нижче. Результати показані на Фігурі 1. Способи і матеріали Тварини: використали самців бестимусних мишей nude. Тварин індивідуально нумерували проколами на вухах. Пухлина: NCCIT, культивована in vitro лінія клітин карциноми сім'яників людини з медіастинальних змішаних зародкових клітин, початково одержана з американської колекції типів тканин. Лінію клітин пересівали in vitro протягом шести пасажів в RPMI-1640/10% FBS без антибіотиків. Тваринам підшкірно імплантували 5´106клітин/0,2мл матригелю в правий бік тварин. 29 № групи 1 2 3 4 5 85163 30 Обробка Кількість мишей Контрольний наповнювач, (25мМ фосфат натрію, 100мМ хлорид натрію, рН 20 7,2), 0,2мл/миша, в/о, Q14D, обробки починаються в день -1 A8G3.5, 1мг/кг/ін'єк., в/о, Q14D, обробки починаються в день -1 10 A8G3.5, 3мг/кг/ін'єк., в/о, Q14D, обробки починаються в день -1 10 A8G3.5, 10мг/кг/ін'єк., в/о, Q14D, обробки починаються в день -1 10 Цисплатин, 2мг/кг/ін'єк., п/ш, 3 х/тиждень (M, W, F), 6 обробок, обробки почина10 ються в день 1 Схема обробки День -1: Мишей випадковим чином розподіляли в контрольні групи і групи обробки. Реєстрували початкову вагу тіла тварин. Проводили перші обробки в групах з антитілом. Готували дозовані розчини. Фахівці проводили обробки наосліп аж до закінчення аналізу. День 0: Імплантували пухлину. Розганяли бактеріальні культури з пухлини, імплантованої мишам. День 1: Проводили першу обробку в гр упі, позитивній відносно хіміотерапевтичного засобу. День 4: Реєстрували вимірювання початкового розміру пухлини для одержання вихідної лінії розміру пухлини на матригелі. Продовжували реєструвати розмір пухлини і вагу тіла мишей 2х/тиждень. Дослідження контролювали щодня і робили замітки при будь-якому незвичайному спостереженні за тваринами. Кінцеві точки: початкова вага тіла, вимірювання розміру пухлини і ваги тіла. Приклад 7: Модель ксенотрансплантованої пухлини in vivo - анти-Cripto-антитіло, що блокує EGF-подібний домен Щоб оцінити відповідь NCCIT лінію клітин карциноми сім'я ників людини імплантували підшкірно з антитілом, яке зв'язується з EGF-подібним доменом Cripto. Експериментальні способи перераховані нижче. Результати показані на Фігурі 2. Способи і матеріали: Тварини: використали самців бестимусних мишей nude. Тварин індивідуально нумерували проколами на вухах. Пухлина: NCCIT, культивована in vitro лінія клітин карциноми сім'яників людини з медіастинальних змішаних зародкових клітин, початково одержана з американської колекції типів тканин. Лінію клітин пересівали in vitro протягом восьми пасажів в RPMI-1640/10% FBS без антибіотиків. Тваринам підшкірно імплантували 5´106клітин/0,2мл матригелю в правий бік тварин. № групи Обробка Кількість мишей 1 Контрольний наповнювач, (25мМ фосфат натрію, 100мМ хлорид натрію, рН 7,2), 0,2мл/миша, в/о Q14D, обробки починаються в день -1 A27F6.1, 1мг/кг/ін'єк., в/о, Q14D, обробки починаються в день -1 ударною дозою 2,6мг/кг/миша A27F6.1, 10мг/кг/ін'єк., в/о, Q14D, обробки починаються в день -1 ударною дозою 21,2мг/кг/миша Цисплатин, 2мг/кг/ін'єк., п/ш, 3 х/тиждень (M, W, F), 6 обробок, обробки починались в день 1 18 2 3 4 Схема обробки День -1: Мишей випадковим чином розподіляли в контрольні групи і групи обробки. Реєстрували початкову вагу тіла тварин. Проводили перші обробки в групах з антитілом. Готували дозовані розчини. Фахівці проводили обробки наосліп аж до закінчення аналізу. День 0: Імплантували пухлину. Розганяли бактеріальні культури з пухлин, імплантованих мишам. Бактеріальні культури були негативними відносно забруднення через 24 і 48 годин після відбору зразка. День 1: Проводили першу обробку в гр упі, позитивній відносно хіміотерапевтичного засобу. День 4: Реєстрували вимірювання початкового розміру пухлини для одержання вихідної лінії розміру пухлини на матригелі. Продовжували реєструвати розмір пухлини і вагу тіла мишей 2х/тиждень. Дослідження контролювали щодня і робили замітки при будь-якому незвичайному спостереженні за тваринами. 10 10 10 Кінцеві точки: початкова вага тіла, вимірювання розміру пухлини і ваги тіла. Приклад 8: Анти-Cripto-мАт, які блокують зв'язування ALK4 Для того, щоб визначити чи можуть Criptoспецифічні моноклональні антитіла перешкоджати здатності Cripto зв'язуватись з Alk4, рецептором активіну типу І, автори застосували аналіз проточною цитометрією з використанням лінії клітин 293, яка стабільно експресує Alk4. Щоб одержати таку лінію клітин клітини 293 спільно трансфікували плазмідою, яка експресує Alk4, мічений на С-кінці НА-епітопом, і плазмідою, яка експресує лікарський засіб пуроміцин, у співвідношенні 10:1. Потім проводили селекцію трансфікованих клітин у відношенні пуроміцину аж до утворення колоній. Потім колонії збирали, розмножали і аналізували відносно експресії Аlk4, використовуючи Вестернблот-аналіз НА. Виявлено, що клон 21 (293-Alk421) експресує високі рівні Alk4 у порівнянні з контролем, нетрансфікованим клітинами 293. 31 85163 32 Щоб проаналізувати зв'язування Cripto-Alk4 за (специфічним по відношенню до Fc-фрагмента) з допомогою проточної цитометрії, використали Jackson Immunologies. Потім зразки знов промиваочищену розчинну форму Cripto людини (а/к 1ли, фіксували в 1% параформальдегіді в PBS і 169), злиту з Fc-частиною IgG людини Cr(delC)-Fc. аналізували, використовуючи стандартні способи Приблизно 5мкг/мл Cr(delC)-Fc або контрольного проточної цитометрії. Результати FACS-аналізу показані на Фігурі 3. білка Fc інкубували з 3´105 клітин 293-Аlk4-21 на Деякі з варіантів описаного вище винаходу в льоду протягом 30 хвилин в загальному об'ємі 50мкл буфера для FAGS (PBS з 0,1% БСА). У визагальних рисах вказані нижче і включають наступні варіанти, але не обмежені ними. Як буде зропадку зразків, що містять анти-Cripto-антитіла, зуміло фахівцям в даній області можна здійснити 5мкг/мл Cr(delC)-Fc заздалегідь інкубували з численні зміни і модифікації різних варіантів вина50мкг/мл кожного анти-Cripto-антитіла (А10.В2.18, ходу, не відходячи від суті винаходу. Мається на A40.G12.8, A27.F6.1, А8.Н3.1, А19.А10.30, A6.F8.6, A8.G3.5, A6.C12.11) на льоду перед додаванням увазі, що всі такі зміни входять в об'єм винаходу. Повний опис кожної публікації, цитованої в даклітин. Потім клітини промивали буфером для ній заявці, включений в даний опис у вигляді посиFACS, і пов'язаний білок Fc визначали за допомолання. гою інкубування клітин з кон'югованим з Rфікоеритрином антитілом кози проти IgG людини 33 85163 34 35 Комп’ютерна в ерстка О. Гапоненко 85163 Підписне 36 Тираж 28 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюCriptoblocking antibodies and use thereof
Автори англійськоюSanicola-Nadel Michele, Williams Kevin, Shiffer Susan, Reichorn Paul
Назва патенту російськоюКриптоблокирующие антитела и их применение
Автори російськоюСаникола-Надел Микели, Уильямс Кевин, Шиффир Сюзан, Рейхорн Пол
МПК / Мітки
МПК: A61P 35/00, C07K 16/46, G01N 33/53, C07K 16/28, A61K 39/395
Мітки: антитіла, криптоблокуючі, застосування
Код посилання
<a href="https://ua.patents.su/18-85163-kriptoblokuyuchi-antitila-ta-kh-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Криптоблокуючі антитіла та їх застосування</a>
Попередній патент: Спосіб виготовлення біосорбенту для очищення водних середовищ від радіонуклідів та важких металів
Наступний патент: Спосіб поліпшення здатності утримання лопатки з кріпленням типу асиметричного молотка
Випадковий патент: Спосіб цифрового комплексного радіопеленгування