Штам бактеріофага та його застосування
Номер патенту: 112551
Опубліковано: 26.09.2016
Автори: Румійовская-Галевіч Анна, Гурецкая Ельжбета, Дзядек Ярослав, Дастих Ярослав, Войтасік Аркадіуш, Вуйцік Евеліна
Формула / Реферат
1. Застосування бактеріофагу, вибраного з групи, що складається з PCM F/00069, PCM F/00070 та PCM F/00071, у попередженні або боротьбі з інфекціями домашнього птаха, спричинюваними патогенними штамами Salmonella sp., чутливих до цих фагів, при цьому вказані бактеріофаги вводять з їжею або водою уразливим тваринам з інтервалами від одного до семи днів.
2. Штам бактеріофага, придатний для попередження або ліквідації інфекції, спричинюваної патогенними штамами Salmonella sp, вибраний із групи, що складається з PCM F/00069, PCM F/00070 та PCM F/00071, при цьому вказаний штам бактеріофага зберігає свій титр у порядку величин протягом трьох місяців зберігання при температурі -20 С або 4 °С.
Текст
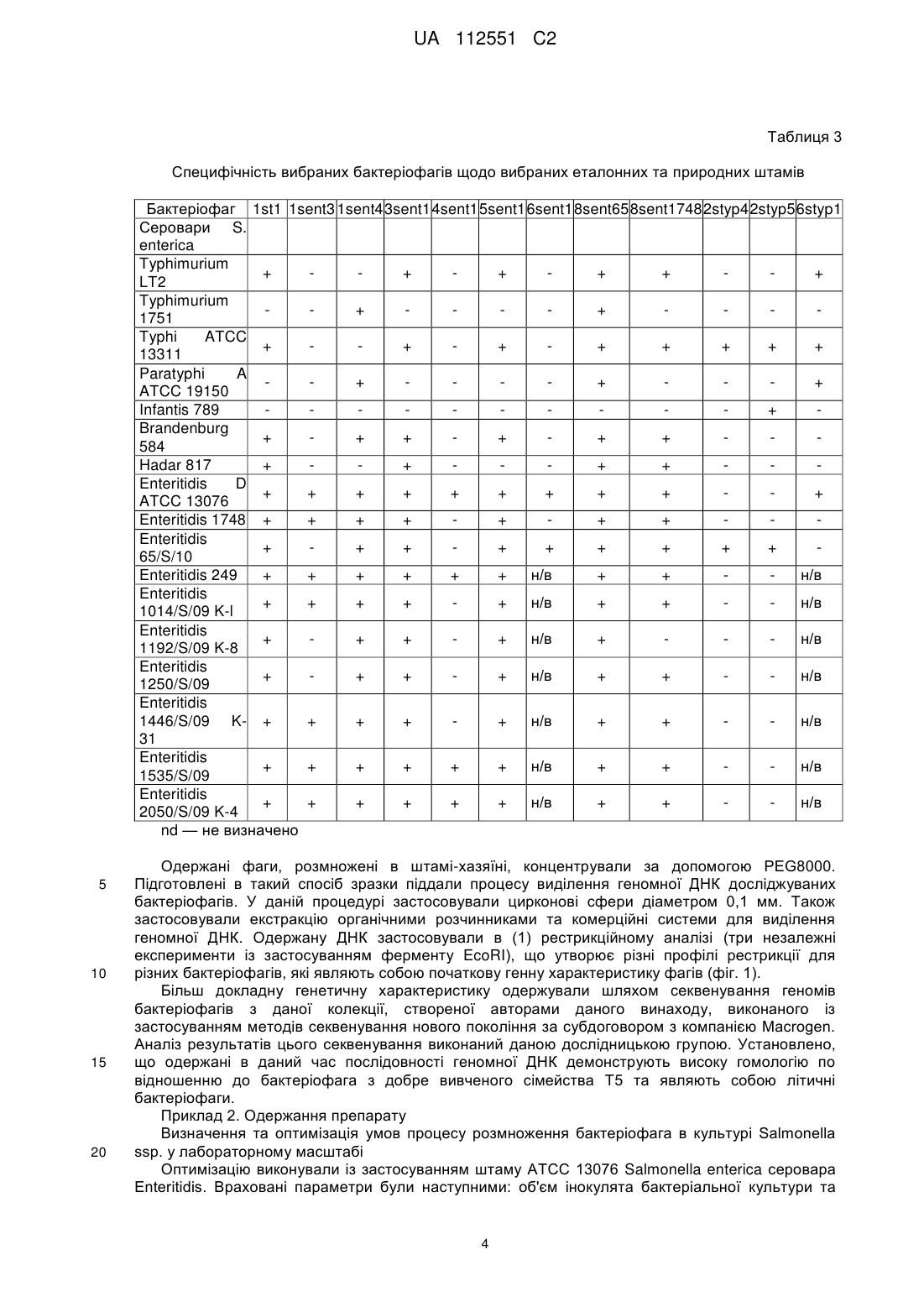
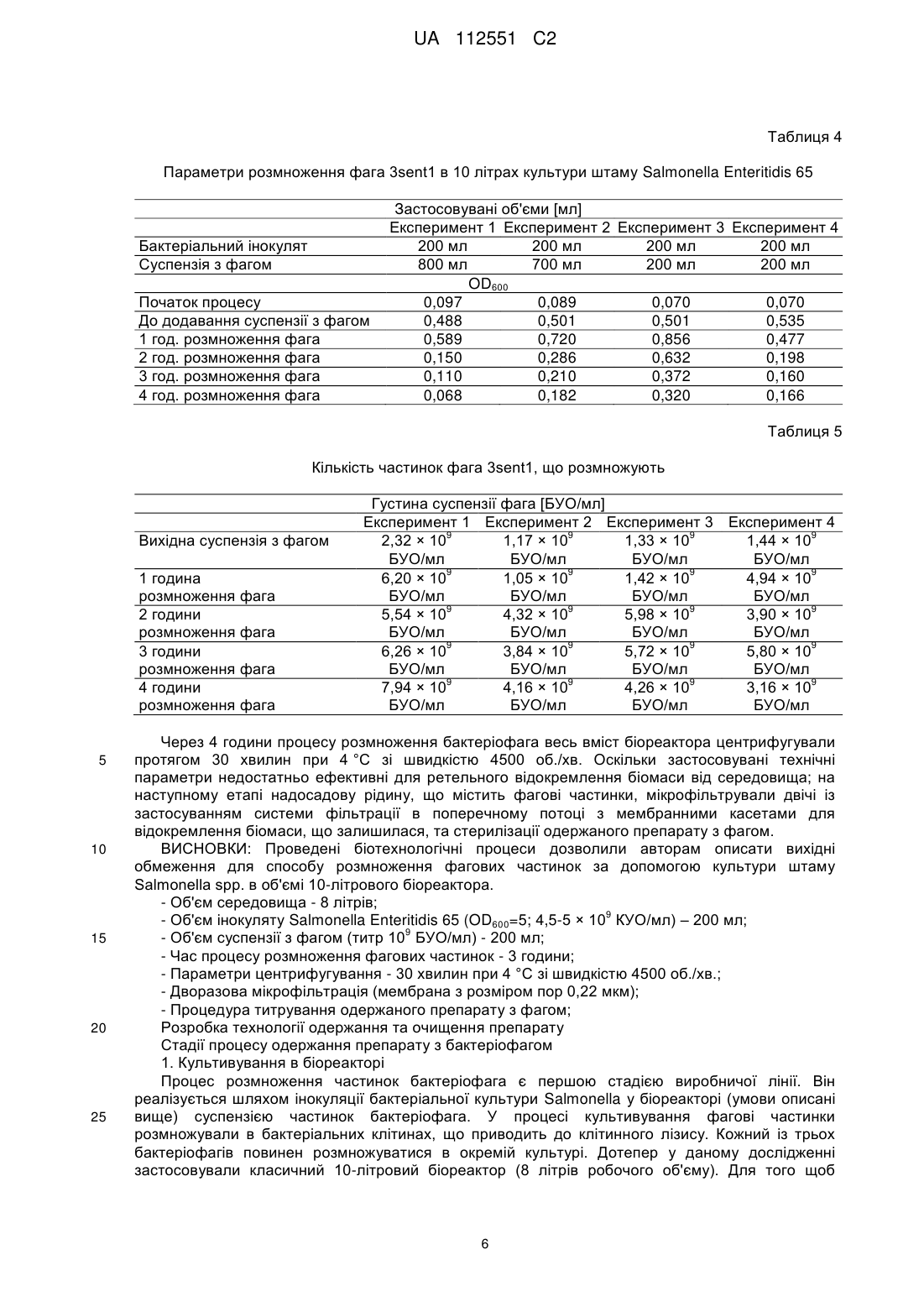
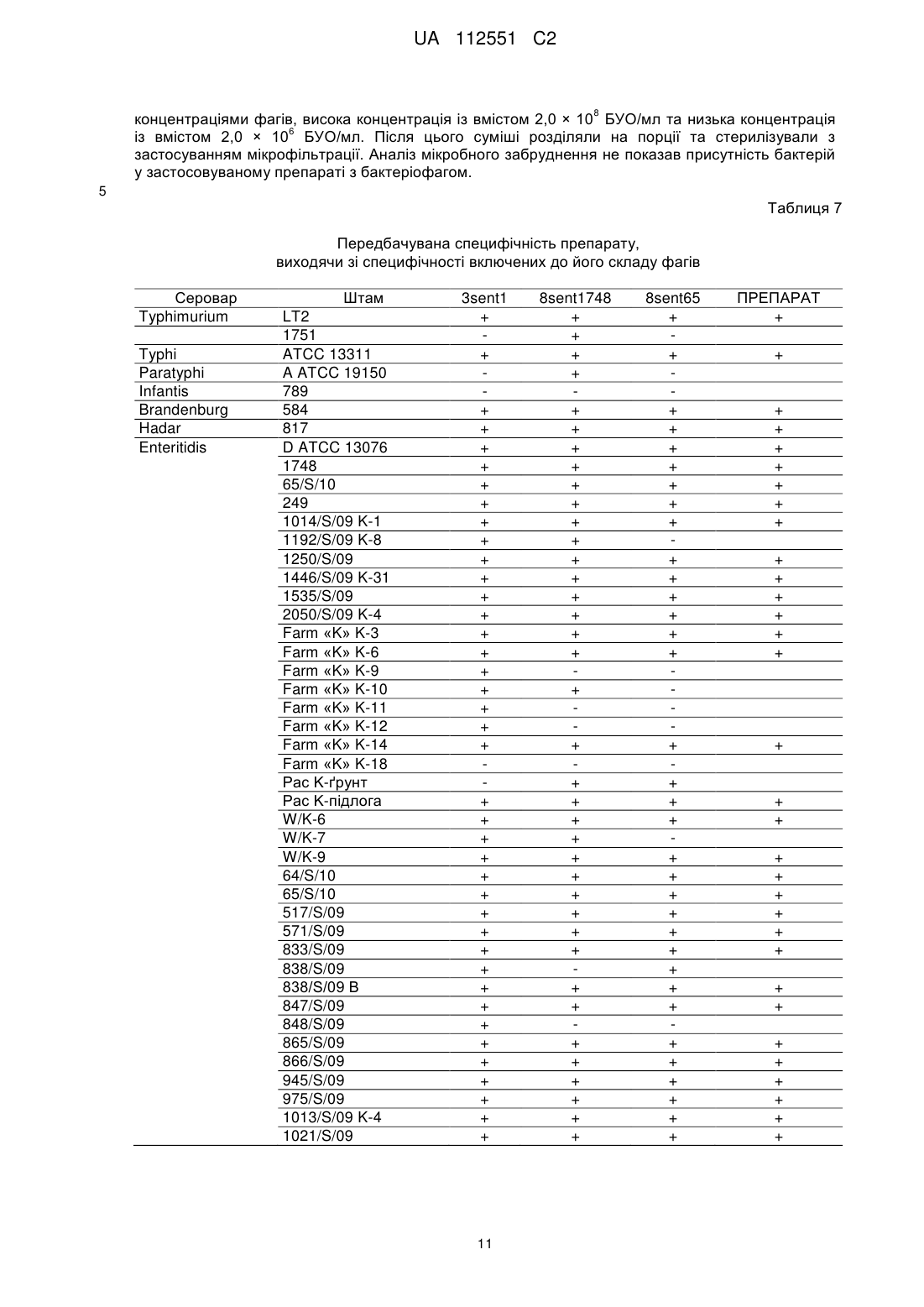
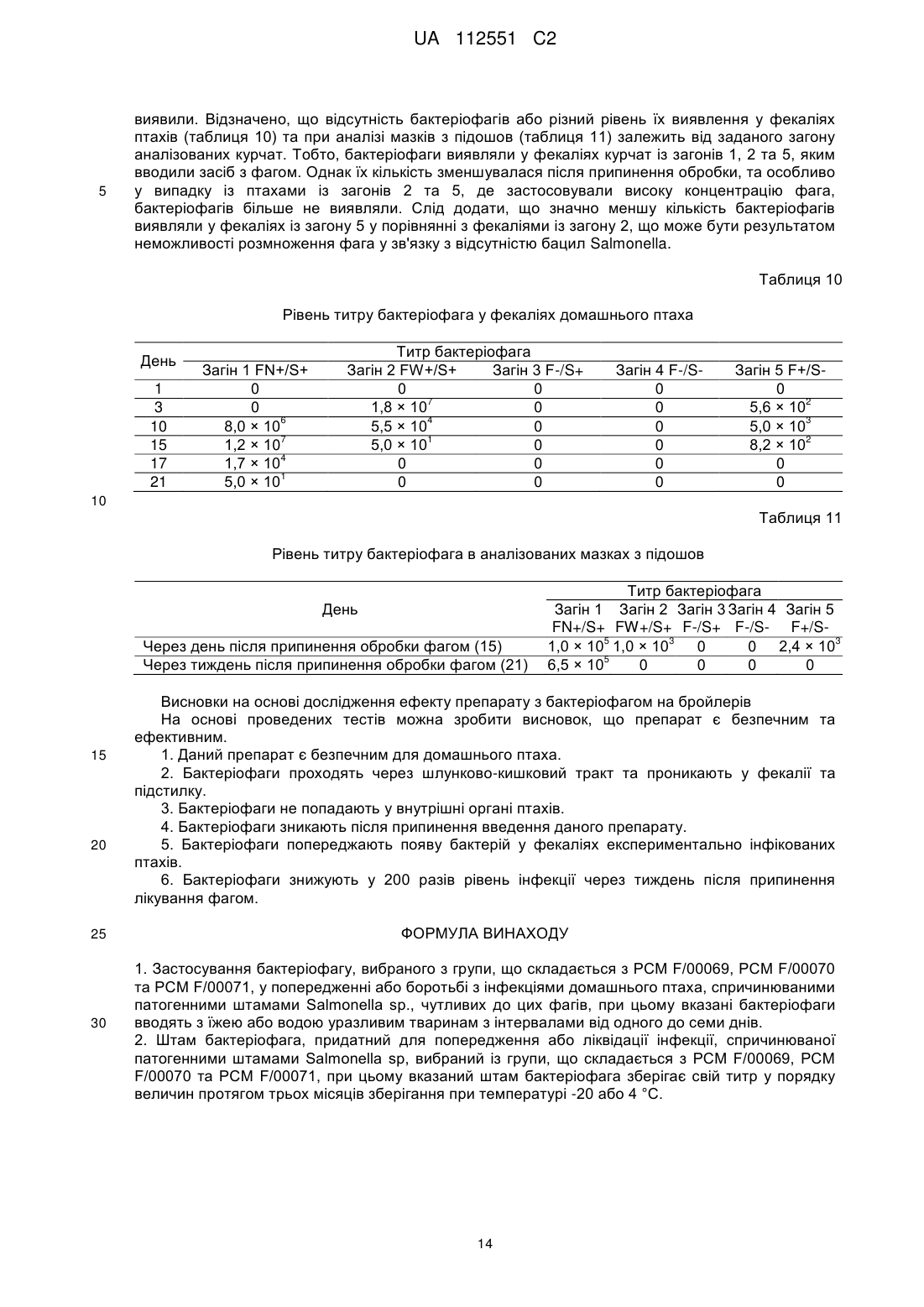
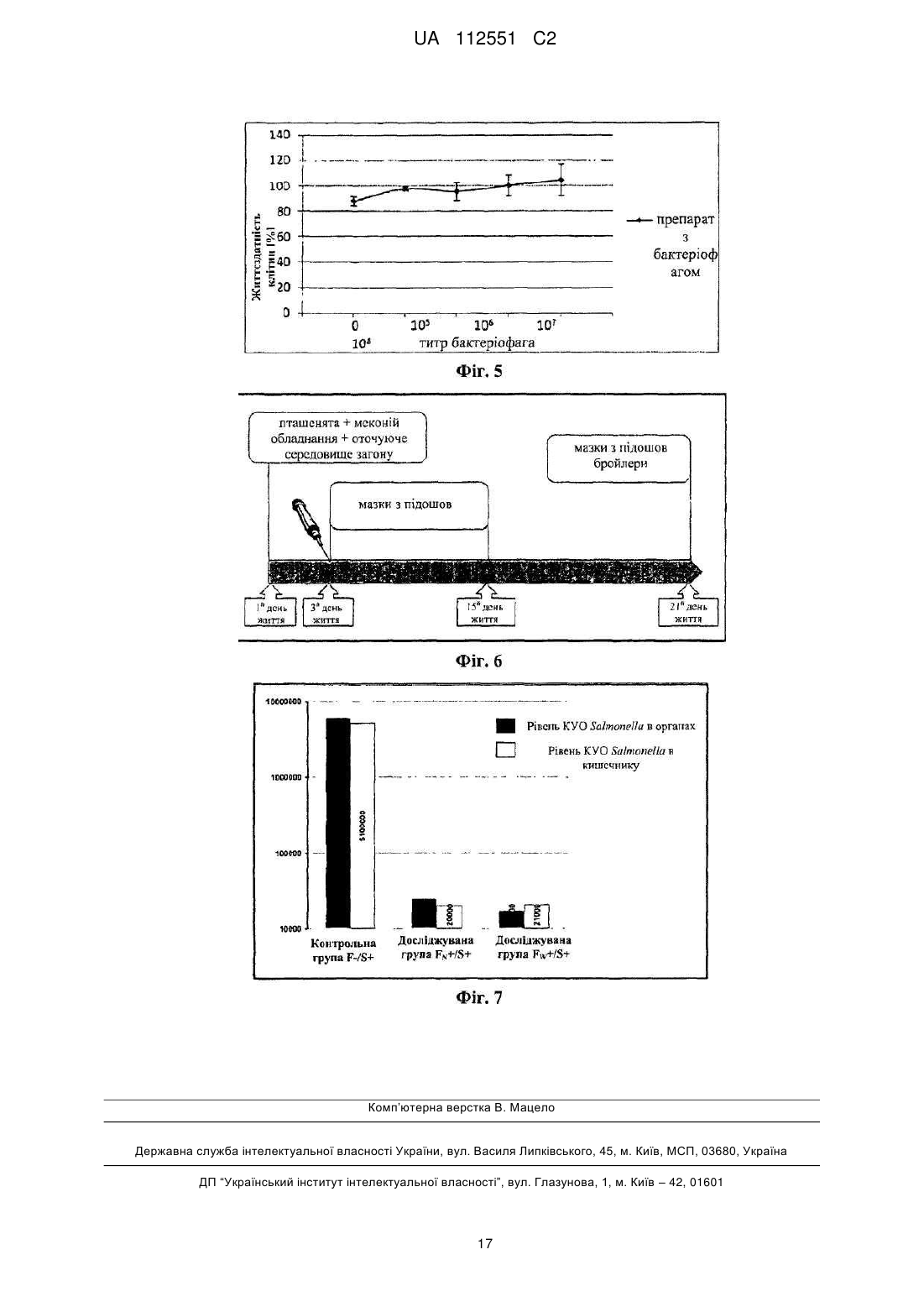
Реферат: Винахід стосується застосування бактеріофага, вибраного з групи, що складається з PCM F/00069, PCM F/00070 та PCM F/00071, у попередженні або боротьбі з інфекціями домашнього птаха, спричинюваними патогенними штамами Salmonella sp., чутливих до цих фагів, при цьому вказані бактеріофаги вводять з їжею або водою уразливим тваринам з інтервалами від одного до семи днів. Також винахід належить до зазначених вище штамів бактеріофага і які здатні зберігати свій титр у порядку величин протягом трьох місяців зберігання при температурі -20 або 4 °С. UA 112551 C2 (12) UA 112551 C2 UA 112551 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід відноситься до способу одержання штаму бактеріофага, специфічного до обраного штаму бактерій, штамів бактеріофагів, одержаних таким чином, та застосування бактеріофагів в одержанні препарату для попередження та боротьби з інфекціями сільськогосподарських тварин, зокрема, домашнього птаха, спричинюваними патогенними штамами бактерій, чутливих до цих бактеріофагів. Метою даного винаходу є забезпечення технології виробництва протимікробного препарату, придатного для застосування в якості кормової добавки для домашнього птаха та свиней, який у той самий час був би специфічним до патогенних штамів Salmonella spp., які є причиною виникнення сальмонельозу, зокрема, у людей. Даний препарат повинен відповідати строгим вимогам безпеки для кормових добавок. Заборона на застосування антибіотиків у кормі для тварин, що діє в країнах Європейського Союзу з 1 січня 2006 року, створила величезний попит на кормові добавки, що не містять антибіотики, але мають протимікробний ефект. Метою даного винаходу є забезпечення препарату, який зміг би замінити застосовувані на даний час антибіотики. Несподівано такий препарат був успішно одержаний у даному винаході. Даний винахід відноситься до способу одержання штаму бактеріофага, специфічного до обраного штаму бактерій, який відрізняється тим, що a) одержують колекцію штамів бактеріофагів, що містить штам бактеріофага, специфічний до обраного штаму бактерій, b) здійснюють культивування обраного штаму бактерій на стерильному культуральному середовищі, с) зразки культури наносять на спеціальний багатолунковий вимірювальний планшет, потім суспензію тестованого штаму бактеріофага додають у різних концентраціях та інкубують при 37 °C протягом щонайменше 4 годин, d) до культури додають резазурин та продовжують інкубацію в темряві при 37 °C протягом щонайменше 3 годин, e) контролюють колір або флуоресценцію культури, а також штам бактеріофага, що знаходиться в культурі, яка зберігає синій колір або не демонструє суттєвого збільшення флуоресценції в порівнянні з контрольним зразком, ідентифікують як штам бактеріофага, специфічний до обраного штаму бактерій; при цьому стерильний зразок, який піддали такій самій інкубації, застосовують у якості контрольного зразка, f) розмножують ідентифікований штам бактеріофага, специфічний до вибраного штаму бактерій. Переважно, щоб вибраний бактеріальний штам являв собою штам S. enterica серовара Enteritidis. Розкритий спосіб підходить для легкого та швидкого скринінгу великих колекцій бактеріофагів та дозволяє легко визначити титр (літичну концентрацію) тестованих фагів, що обов'язково при промислових застосуваннях. Іншою метою даного винаходу є застосування бактеріофагів у виробництві препарату для попередження та боротьби з інфекціями сільськогосподарських тварин, зокрема, домашнього птаха, спричинюваними патогенними штамами бактерій, чутливих до цих бактеріофагів. Одержаний препарат призначений для введення, тваринам, які перебувають у небезпеці, з їжею або водою з інтервалами від одного до семи днів. Переважно, щоб одержаний препарат забезпечував щонайменше 200-кратне зниження рівня інфекції через тиждень після припинення застосування. Переважно, щоб інфекція, з якою потрібно боротися, являла собою інфекцію домашнього птаха, спричинювану патогенними штамами Salmonella sp., тоді як для того, щоб одержати препарат, застосовують штам бактеріофага, вибраний із групи, що включає ті штами, які розкриті в даній заявці, депоновані 7 червня 2011 року в Польській Колекції Мікроорганізмів (Polish Collection of Microorganisms) під наступними депозитними номерами: PCM F/00069 (штам 8 sent 1748), PCM F/00070 (штам 8 sent 65) та PCM F/00071 (штам 3 sent 1). Іншою метою даного винаходу є штам бактеріофага, придатний для попередження або боротьби з інфекціями, спричинюваними патогенними штамами Salmonella sp., вибраний із групи, що включає PCM F/00069 (штам 8 sent 1748), PCM F/00070 (штам 8 sent 65) та PCM F/00071 (штам 3 sent 1). Препарат згідно з даним винаходом базується на природних компонентах екосистеми та не має несприятливого впливу на організми крім конкретних патогенних бактерій. У той час як комерційно доступні замінники антибіотиків мають в основі речовини, які, як, наприклад, органічні кислоти, неспецифічно модулюють бактеріальну флору, попереджаючи певною мірою ріст небажаних мікроорганізмів, препарат згідно з даним винаходом гарантує, що вибірково 1 UA 112551 C2 5 10 15 20 25 30 35 пригнічуються тільки патогенні штами Salmonella spp. Несподівано також виявилося, що препарат згідно з даним винаходом не затримується в організмі людини або тварини, якщо не є присутнім Salmonella spp. У конкретній реалізації препарат підходить для застосування у тваринництві, зокрема, для боротьби з інфекцією Salmonella у домашнього птаха. Штами бактеріофага, розкриті в даній заявці, ідентифікували способом згідно з даним винаходом. Несподівано вони демонструють широку специфічність за участю лізису щонайменше чотирьох конкретних серотипів Salmonella та зберігають стабільність в умовах зберігання в охолодженому стані протягом щонайменше 3 місяців. Крім того, вони можуть бути успішно розмножені в промисловому масштабі без втрати активності та вони не є специфічними до пробіотичних бактерій Lactobacillus. Для того щоб пояснити даний винахід, його проілюстрували прикладеними фігурами, які представляють фігуру 1: профілі рестрикції для вибраних бактеріофагів; фігуру 2: графіки контрольованих параметрів проведених експериментів; фігуру 3: зразок зображення планшетів ELISA безпосередньо після додавання реакційної суміші та через три години інкубації; при цьому оптична густина OD600 застосовуваної суспензії штаму АТСС 13076 S. enterica серовара Enteritidis у кількості 0,05; 0,1; 0,25; 0,5; 1,0 і 2,0; 5 6 6 7 8 8 відповідно, відповідає густині клітин - 8 × 10 , 1,05 × 10 , 7,0 × 10 , 3,5 × 10 , 1,4 × 10 і 3,8 × 10 ; фігуру 4: результати термостабільності вибраних бактеріофагів, виконані протягом трьох місяців у трьох різних температурних умовах; фігуру 5: результати випробування препарату з бактеріофагом на цитотоксичність способом з нейтральним червоним; при цьому препарат, що містить стерильну суміш бактеріофагів, додавали протягом 24 годин до культури фібробластів 3T3 мишей та оцінювали життєздатність клітин із застосуванням тесту поглинання нейтрального червоного; фігуру 6: виявлення бацил Salmonella у проведеному експерименті; фігуру 7: рівень КУО Salmonella у внутрішніх органах та кишечнику 21-денних курчат. Наведений у даному документі опис доповнений наступними прикладами, які служать для кращої ілюстрації сутності даного винаходу. Однак ці приклади не слід ототожнювати з повним обсягом даного винаходу. Приклад 1. Виділення та опис бактеріофагів Створення банку штамів (сероварів) Salmonella, що найбільш часто виділяють у людей та сільськогосподарських тварин Набір зі 108 штамів Salmonella ssp., який включає серовари, що найбільш часто виділяють, зібрали для потреб проекту (таблиця 1). Ці штами застосовували для визначення специфічності очищених бактеріофагів. Колекція включає як еталонні штами, доступні в загальнодоступних сховищах, так і ізоляти, одержані завдяки співробітництву з компанією VETLAB (Брудзев, Польща) та Державною санітарною інспекцією. Таблиця 1 Перелік сероварів Salmonella enterica та їх походження № 1 2 3 4 5 6 Серовар Berta Brandenburg Coeln Colindale Derby Enteritidis 7 Gallimarum Pullorum 8 Hadar 9 Heidelberg Кількість штамів Джерело 1 1 1 1 1 1 1 58 1 VetLab Державна санітарна інспекція VetLab VetLab VetLab ATCC Державна санітарна інспекція VetLab VetLab 2 1 1 VetLab Державна санітарна інспекція VetLab 40 2 UA 112551 C2 Продовження таблиці 1 10 Infantis 11 Mbandaka 12 Moscow 13 Newport 14 Paratyphi 15 Senfenberg 16 Typhi 17 Typhimurium 18 Virchow 5 10 6 1 1 1 5 1 1 1 1 1 10 9 VetLab Державна санітарна інспекція VetLab VetLab VetLab ATCC VetLab ATCC ATCC Державна санітарна інспекція VetLab Vetlab Виділення бактеріофагів зі зразків навколишнього середовища, що демонструють активність щодо вибраних сероварів еталонних штамів Salmonella ssp Бактеріофаги виділяли зі зразків, наданих станціями водоочищення з Лодзі, Польща, та Тушина, Польща. Дослідження підтвердили, що зразки, зібрані на стадії відокремлення пісків (піщана камера), яка являє собою один зі способів очищення стічних вод, є найбагатшим джерелом вірусів. Крім того, бактеріофаги також одержали з курячих фекалій, наданих приватним фермером та компанією VETLAB, що спеціалізується на аналізі бактеріального забруднення ферм. Виділення фагів виконували із застосуванням еталонних штамів Salmonella enterica, включаючи серовари Typhimurium, Enteritidis та Typhi, а також декількох природних штамів. На даний час докладно описані декілька вибраних фагів (таблиця 2). Таблиця 2 Перелік одержаних бактеріофагів та їх штамів-хазяїв № 1 2 3 4 5 6 7 8 9 10 11 12 15 20 Бактеріофаг lstl 1sent3 1sent4 3sentl 4sentl 6sentl 5sent1 8sent65 8sentl748 2styp4 2styp5 6styp 1 Джерело Станція з очищення стічних вод Станція з очищення стічних вод Станція з очищення стічних вод Станція з очищення стічних вод Фермерське господарство Фермерське господарство VetLab VetLab VetLab VetLab VetLab Фермерське господарство Штам-хазяїн S. enterica сер. Typhimurium LT2 S enterica сер. Enteritidis ATCC 13076 S enterica сер. Enteritidis 65/S/10 S. enterica сер. Enteritidis 1748 S. enterica сер. Typhi ATCC 13311 Усі фаги, призначені для подальших досліджень, очищали із застосуванням способу відбору для того, щоб одержати одиночні плями на чашках LB (Луріа-Бертані). Ця процедура вимагає щонайменше п'ятикратного застосування процесу скринінгу. Спочатку специфічність вірусів, виділених із застосуванням чашкового способу, встановили шляхом визначення літичної здатності виділених бактеріофагів по відношенню до 17 вибраних штамів S. enterica, включаючи 7 різних вибраних сероварів, 9 штамів сероварів Enteritidis, виділених з людини та сільськогосподарських тварин, а також штами-хазяїни аналізованих бактеріофагів (таблиця 3). Для того щоб підтвердити результати, визначення специфічності виділених бактеріофагів повторювали три рази. 3 UA 112551 C2 Таблиця 3 Специфічність вибраних бактеріофагів щодо вибраних еталонних та природних штамів Бактеріофаг 1st1 1sent3 1sent4 3sent1 4sent1 5sent1 6sent1 8sent65 8sent1748 2styp4 2styp5 6styp1 Серовари S. enterica Typhimurium + + + + + + LT2 Typhimurium + + 1751 Typhi ATCC + + + + + + + + 13311 Paratyphi A + + + ATCC 19150 Infantis 789 + Brandenburg + + + + + + 584 Hadar 817 + + + + Enteritidis D + + + + + + + + + + ATCC 13076 Enteritidis 1748 + + + + + + + Enteritidis + + + + + + + + + 65/S/10 Enteritidis 249 + + + + + + н/в + + н/в Enteritidis + + + + + н/в + + н/в 1014/S/09 K-l Enteritidis + + + + н/в + н/в 1192/S/09 K-8 Enteritidis + + + + н/в + + н/в 1250/S/09 Enteritidis 1446/S/09 K- + + + + + н/в + + н/в 31 Enteritidis + + + + + + н/в + + н/в 1535/S/09 Enteritidis + + + + + + н/в + + н/в 2050/S/09 K-4 nd — не визначено 5 10 15 20 Одержані фаги, розмножені в штамі-хазяїні, концентрували за допомогою PEG8000. Підготовлені в такий спосіб зразки піддали процесу виділення геномної ДНК досліджуваних бактеріофагів. У даній процедурі застосовували цирконові сфери діаметром 0,1 мм. Також застосовували екстракцію органічними розчинниками та комерційні системи для виділення геномної ДНК. Одержану ДНК застосовували в (1) рестрикційному аналізі (три незалежні експерименти із застосуванням ферменту EcoRI), що утворює різні профілі рестрикції для різних бактеріофагів, які являють собою початкову генну характеристику фагів (фіг. 1). Більш докладну генетичну характеристику одержували шляхом секвенування геномів бактеріофагів з даної колекції, створеної авторами даного винаходу, виконаного із застосуванням методів секвенування нового покоління за субдоговором з компанією Macrogen. Аналіз результатів цього секвенування виконаний даною дослідницькою групою. Установлено, що одержані в даний час послідовності геномної ДНК демонструють високу гомологію по відношенню до бактеріофага з добре вивченого сімейства Т5 та являють собою літичні бактеріофаги. Приклад 2. Одержання препарату Визначення та оптимізація умов процесу розмноження бактеріофага в культурі Salmonella ssp. у лабораторному масштабі Оптимізацію виконували із застосуванням штаму ATCC 13076 Salmonella enterica серовара Enteritidis. Враховані параметри були наступними: об'єм інокулята бактеріальної культури та 4 UA 112551 C2 5 10 15 20 25 30 35 40 45 50 бактеріофагів, час процесу чистого культивування та інкубації інфікованої культури, температура культури, рівень аерації, рH середовища та умови, необхідні для індукції літичного циклу. Оптимальний об'єм інокулята бактеріальної культури визначали як такий, що складає 2 × 9 10 КУО на 0,5 л культурального середовища. Оптимізований процес культивування виконували до досягнення рівня оптичної густини OD600=0,5, який досягли через 3 години інкубації. Температура 37 °C виявилася оптимальною для бактеріального росту. Оптимального рівня аерації досягли шляхом струшування при 220 об./хв. у шейкері New Brunswick. Оптимальний ріст культури спостерігали на середовищі LB при pH=7,0. Процес оптимізації показав, що 9 додавання 10 % суспензії з бактеріофагом, що демонструє титр 10 (50 мл на 500 мл культури), є найбільш вигідною кількістю інокулята. Також аналіз показав, що оптимальна вихідна пропорція частинок бактеріофага та бактеріальних клітин становить 25:1. Крім того, дослідження оптимізації виявили, що виділені бактеріофаги виявляють літичну природу та, отже, індукція літичного циклу не потрібна. Процес витягання бактеріофага з культури здійснювали ультрацентрифугуванням в ультрацентрифузі типу Beckman L-80. Бактеріальні культури, інфіковані бактеріофагами після належного процесу інкубації (див. вище), спочатку центрифугували протягом 30 хв. (3700 g). Після цього надосадову рідину переносили в пробірки для ультрацентрифугування типу Beckman та ультрацентрифугували протягом 2 годин (200000 g). Ця процедура дозволила провести одночасне очищення та концентрування препарату з фагом. Оптимізація культивування еталонного штаму Salmonella spp в 10-літровому об'ємі На наступному етапі оптимізації розробили спосіб розмноження бактеріофага в 10літровому біореакторі (8-літрів робочого об'єму). З цією метою 8 літрів середовища LB підготували та автоклавували (протягом 20 хв. при 120 °C) у біореакторі. Перед інокуляцією 200 мл штаму Salmonella Enteritidis 65 середовище аерували до 90 % - 100 % та нагрівали до 37 °C. Інокулят являв собою 16-годинну бактеріальну культуру, що демонструє оптичну густина 9 приблизно OD600=5,0 (4,5-5*10 КУО/мл). Після інокуляції середовища брали зразок для того, щоб виміряти оптичну густина (OD600) вихідної культури Salmonella Enteritidis 65. Контролювали ключові параметри культивування та кінцевий титр бактеріофагів, що розмножуються (таблиця 4 та 5). Культивування здійснювали в біореакторі з постійною аерацією 1,3 л/хв. (об'єм повітря, що доставляють у середовище протягом 1 хвилини) та перемішуванням при 50 об./хв. Через 40 хвилин процесу інтенсивність перемішування збільшували з 50 до 100 об./хв. У процесі культивування брали зразки кожні 30 хвилин для визначення оптичної густини культури (OD 600). Коли досягли значення оптичної густини бактеріальної культури (OD600) 0,48-0,55, суспензію з бактеріофагом 3sent1 підходящого титру додавали в культуру в наступних об'ємах: - 800 мл у випадку експерименту 1, - 700 мл у випадку експерименту 2, а також - 200 мл у випадку експерименту 3 та 4. З цього моменту часу культивування здійснювали протягом 4 годин при постійній аерації та перемішуванні (див. вище). Зміни оптичної густини та кінетики розмноження фага контролювали шляхом відбору зразків щогодини. Під час процесу контролювали параметри культивування, включаючи рH, рО2 (рівень аерації, зазначений у %), температуру середовища та відповідний рівень перемішування. Кожний контрольований параметр записували із застосуванням програмного забезпечення, призначеного для документування ходу процесу культивування (фігура 2), за винятком експерименту 1 через технічні проблеми, зазнаних при ініціалізації програмного забезпечення. У ході проведених експериментів було відзначено прогресуюче зменшення рівня розчиненого кисню в середовищі (збільшення споживання кисню бактеріальними клітинами через їхній ріст у культурі), а також невеликі коливання рH у діапазоні 7,2-6,7. Незалежно від застосовуваного об'єму суспензії з фагом (від 200 до 800 мл з титром 1,3-2,3 9 9 × 10 БУО/мл) досягали високого титру бактеріофага, що розмножується, приблизно 10 БУО/мл. 5 UA 112551 C2 Таблиця 4 Параметри розмноження фага 3sent1 в 10 літрах культури штаму Salmonella Enteritidis 65 Бактеріальний інокулят Суспензія з фагом Початок процесу До додавання суспензії з фагом 1 год. розмноження фага 2 год. розмноження фага 3 год. розмноження фага 4 год. розмноження фага Застосовувані об'єми [мл] Експеримент 1 Експеримент 2 Експеримент 3 Експеримент 4 200 мл 200 мл 200 мл 200 мл 800 мл 700 мл 200 мл 200 мл OD600 0,097 0,089 0,070 0,070 0,488 0,501 0,501 0,535 0,589 0,720 0,856 0,477 0,150 0,286 0,632 0,198 0,110 0,210 0,372 0,160 0,068 0,182 0,320 0,166 Таблиця 5 Кількість частинок фага 3sent1, що розмножують Вихідна суспензія з фагом 1 година розмноження фага 2 години розмноження фага 3 години розмноження фага 4 години розмноження фага 5 10 15 20 25 Густина суспензії фага [БУО/мл] Експеримент 1 Експеримент 2 Експеримент 3 Експеримент 4 9 9 9 9 2,32 × 10 1,17 × 10 1,33 × 10 1,44 × 10 БУО/мл БУО/мл БУО/мл БУО/мл 9 9 9 9 6,20 × 10 1,05 × 10 1,42 × 10 4,94 × 10 БУО/мл БУО/мл БУО/мл БУО/мл 9 9 9 9 5,54 × 10 4,32 × 10 5,98 × 10 3,90 × 10 БУО/мл БУО/мл БУО/мл БУО/мл 9 9 9 9 6,26 × 10 3,84 × 10 5,72 × 10 5,80 × 10 БУО/мл БУО/мл БУО/мл БУО/мл 9 9 9 9 7,94 × 10 4,16 × 10 4,26 × 10 3,16 × 10 БУО/мл БУО/мл БУО/мл БУО/мл Через 4 години процесу розмноження бактеріофага весь вміст біореактора центрифугували протягом 30 хвилин при 4 °C зі швидкістю 4500 об./хв. Оскільки застосовувані технічні параметри недостатньо ефективні для ретельного відокремлення біомаси від середовища; на наступному етапі надосадову рідину, що містить фагові частинки, мікрофільтрували двічі із застосуванням системи фільтрації в поперечному потоці з мембранними касетами для відокремлення біомаси, що залишилася, та стерилізації одержаного препарату з фагом. ВИСНОВКИ: Проведені біотехнологічні процеси дозволили авторам описати вихідні обмеження для способу розмноження фагових частинок за допомогою культури штаму Salmonella spp. в об'ємі 10-літрового біореактора. - Об'єм середовища - 8 літрів; 9 - Об'єм інокуляту Salmonella Enteritidis 65 (OD600=5; 4,5-5 × 10 КУО/мл) – 200 мл; 9 - Об'єм суспензії з фагом (титр 10 БУО/мл) - 200 мл; - Час процесу розмноження фагових частинок - 3 години; - Параметри центрифугування - 30 хвилин при 4 °C зі швидкістю 4500 об./хв.; - Дворазова мікрофільтрація (мембрана з розміром пор 0,22 мкм); - Процедура титрування одержаного препарату з фагом; Розробка технології одержання та очищення препарату Стадії процесу одержання препарату з бактеріофагом 1. Культивування в біореакторі Процес розмноження частинок бактеріофага є першою стадією виробничої лінії. Він реалізується шляхом інокуляції бактеріальної культури Salmonella у біореакторі (умови описані вище) суспензією частинок бактеріофага. У процесі культивування фагові частинки розмножували в бактеріальних клітинах, що приводить до клітинного лізису. Кожний із трьох бактеріофагів повинен розмножуватися в окремій культурі. Дотепер у даному дослідженні застосовували класичний 10-літровий біореактор (8 літрів робочого об'єму). Для того щоб 6 UA 112551 C2 5 10 15 20 25 30 35 40 45 50 55 60 здійснити цей тип культивування, застосовували раніше підготовлені компоненти, включаючи (1) бактеріальний інокулят та (2) суспензію з бактеріофагом, яку додавали після досягнення підходящої оптичної густини (OD600) бактеріальної культури. Після додавання суспензії з фагом здійснювали культивування від 3 до 4 годин, та процес дає можливість одержувати високий 9 титр бактеріофага, що розмножується, на рівні приблизно 10 БУО/мл. Після того, як процедура розмноження закінчена, культуру переносять у стерильних умовах на наступну стадію виробничого процесу за допомогою перистальтичного насоса. У майбутньому планується застосовувати на виробничій лінії 100-літрові біореактори або одноразові вдосконалені біореактори-мішки (до 15 літрів), які останнім часом успішно заміняють класичні біореактори. 2. Видалення біомаси Оскільки повний лізис бактеріальної культури під час інкубаційного процесу в біореакторі неможливий, потрібна наступна стадія відокремлення біомаси від культуральної рідини, що містить фаг. Таким чином, на першій стадії культуру переносять у центрифугу, та потім двічі виконують процес мікрофільтрації із застосуванням системи фільтрації в поперечному потоці, що містить мембрану з розміром пор 0,22 мкм. Ця процедура дозволяє одержувати стерильну суспензію з бактеріофагом з дуже невеликим зниженням титру фагових частинок. Після того, як процес фільтрації закінчений, суспензію переносять у стерильних умовах на наступну стадію виробничого процесу за допомогою перистальтичного насоса. У майбутньому планується розширення цієї стадії виробничої лінії за рахунок придбання додаткових систем фільтрації. Це дозволить обробити біологічний матеріал, одержаний з культури окремого біореактора, без необхідності очищення та стерилізації фільтраційного обладнання, застосовуваного на даній стадії. 3. Концентрування продукту (необов'язково) Залежно від попиту на продукт суспензія з бактеріофагом може бути концентрована в 10 раз, що дозволяє збільшити кількість фагових частинок у заданому об'єму. Таким чином, застосовували систему фільтрації в поперечному потоці з мембраною ультрафільтрації з відсіканням на 30 або 50 кДа (залежно від фага). Цей процес дозволяє 7,5-кратне концентрування частинок бактеріофага. 4. Видалення потенційного забруднення ендотоксином Для того щоб усунути ендотоксин, що залишився після лізису бактеріальних клітин, спричинюваного бактеріофагами під час біотехнологічного процесу, планують застосування спеціальних адсорбційних колонок. Ці колонки будуть містити смолу, що підходить для видалення ендотоксину, з розміром та ємністю залежно від об'єму препарату, що містить фаг. 5. Одержання продукту в рідкій фазі На цій стадії одержували суміш різних суспензій з бактеріофагом, одержаних у процедурах, описаних вище. Суміш повинна містити всі бактеріофаги з дуже подібним значенням титру. Бактеріофаги, вибрані для препарату, демонструють здатність до лізису широкого спектра бактеріальних штамів Salmonella spp. з наявної колекції. Потім препарат розділяли на порції в строго стерильних умовах. Крім того, під час цього процесу кінцеву суспензію знову піддавали стерилізації за допомогою одноразових мікрофільтрів (0,22 мкм). 6. Мікрокапсулювання (необов'язково) Залежно від того, чи потрібен продукт у рідкій або твердій формі, планують здійснення технології мікрокапсулювання для того, щоб помістити частинки бактеріофага в альгінатні капсули. Мета цієї стадії полягає в створенні капсул, що легко розсмоктуються, які безпечно проходять через травну систему та поступово вивільняють розміщені частинки бактеріофага в цільовому місці без подразнення всього організму. Приклад 3. Дослідження ефективності та безпеки препарату Дослідження in vitro Розробка та оптимізація високоефективного та автоматизованого колориметричного способу вимірювання активності препарату з бактеріофагом Наявний у продажі реагент аlamarBlue® застосовували для розробки аналізу, придатного для вимірювання літичної активності бактеріофага. Alamarblue® являє собою індикаторний барвник, який дозволяє швидку та точну кількісну оцінку проліферації та цитотоксичності на основі кольорової реакції. Зручний у роботі реагент вигідно застосовує феномен реакції окиснення-відновлення (REDOX), та під час даного процесу резазурин змінює свій колір із синього (нефлуоресцентного) на червоний (флуоресцентний) у результаті окиснення, яке є наслідком клітинної метаболічної активності. Зміна кольору видна неозброєним оком. Вона також може бути виміряна спектрофотометрично або флуорометрично. Через відсутність у нього клітинної токсичності, аlamarBlue® особливо цінний при спостереженні диференціювання бактеріальних клітин у мікробних культурах. Цей тест скорегували для застосування на 96 7 UA 112551 C2 5 10 15 20 25 30 35 40 45 50 55 60 лунковому планшеті для ELISA та розробили дві методики вимірювання. Перша з них призначена для оцінки літичної активності бактеріофагів. Під час тесту застосовували так звану свіжу робочу суміш (одержану безпосередньо перед нанесенням на планшет для ELISA), яка включала alamarBlue® та 20 % стерильний розчин Tween™80 (3 частини аlamarBlue® та 1 частина 20 % стерильного розчину Tween™80), та додавали в лунки, що містять суспензію з досліджуваним штамом Salmonella відповідної густини, а також у лунки, заповнені одночасно клітинною суспензією Salmonella відповідної густини та суспензією досліджуваного бактеріофага необхідного титру. Процедура дає можливість візуального визначення літичної активності фагових частинок щодо досліджуваних штамів Salmonella. Синій колір реакційної суміші аlamarBlue® + 20 % стерильний розчин Tween™80 (3 частини аlamarBlue® та 1 частина 20 % стерильного розчину Tween™80) вказує на відсутність росту досліджуваного штаму Salmonella та високий літичний ефект відповідної концентрації бактеріофага. Зміна кольору реакційної суміші аlamarBlue® + 20 % стерильний розчин Tween™80 (3 частини аlamarBlue® та 1 частина 20 % стерильного розчину Tween™80) із синього на червоний, викликана окисненням, пов'язаним з метаболічною активністю, вказує на ріст клітин Salmonella та відсутність або низький літичний ефект відповідної концентрації бактеріофага щодо досліджуваного штаму Salmonella. Докладний експериментальний протокол, що дає можливість кількісної оцінки літичної активності бактеріофагів, а також графічний матеріал, що представляє результати вибраного експерименту, проведеного для бактеріофага 3sent1 відносно штаму АТСС 13076 Salmonella enterica серовара Enteritidis (фігура 3), представлені нижче. 1. Додавали 100 мкл суспензії культури Salmonella spp. відповідної оптичної густини (OD600), 1 пов'язаної з відповідною кількістю колонієутворювальних одиниць (КУО/1 мл) , у кожну лунку першого ряду в колонки з 1 по 12. Більш докладно, суспензія оптичної густини 0,05; 0,1; 0,25; 0,5; 1,0 та 2,0 у лунки 1 та 7, 2 та 8, 3 та 9, 4 та 10, 5 та 11, а також 6 та 12 планшета, відповідно. 9 2. Додавали 100 мкл суспензії з фагом у концентрації 6,5 × 10 БУО (бляшкоутворювальних одиниць) у кожну лунку першого ряду в колонки з 1 по 6. Об'ємне співвідношення бактеріальної суспензії до суспензії з фагом складає 1:1. 3. Аналогічним чином додавали 75 мкл суспензії культури Salmonella spp. відповідної оптичної густини та 125 мкл суспензії з фагом у лунки другого ряду. Об'ємне співвідношення бактеріальної суспензії до суспензії з фагом складає 1:1,5. 4. Аналогічним чином додавали 50 мкл суспензії культури Salmonella spp. відповідної оптичної густини та 150 мкл суспензії з фагом у лунки третього ряду. Об'ємне співвідношення бактеріальної суспензії до суспензії з фагом складає 1:3. 5. Готували контролі; додавали стерильне середовище LB замість суспензії з фагом у кожну лунку першого, другого та третього рядів у колонки з 7 по 12 (контроль росту штаму Salmonella заданої густини). Крім того, додавали суспензію з фагом у кожну лунку 6-го, 7-го та 8-го рядів у колонку 3 (контроль забруднення суспензії з фагом) та додавали середовище LB у кожну лунку 7-го та 8-го рядів у колонку 7 (контроль забруднення середовища, застосовуваної для розведення культури в досліджуваному та контрольному наборах). 6. Накривали планшет для ELISA стерильними кришками та інкубували протягом 4 годин 2 при 37 °C. Після стадії інкубації додавали 50 мкл реакційної суміші аlamarBlue® + 20 % стерильний Tween™80 у кожну лунку планшета. У зв'язку із чутливістю реакційної суміші до світла, захищали планшет алюмінієвою фольгою. Продовжували інкубацію протягом наступних 3 годин при 37 °C. Виконували візуальне спостереження кожні 30 хвилин. 1 Співвідношення між оптичною густиною OD600 та значенням КУО повинні бути визначені експериментально в декількох незалежних підходах. 2 Суміш повинна бути одержана безпосередньо перед внесенням у лунки на планшеті для ELISA (3 частини аlamarBlue® та 1 частина 20 % стерильного розчину Tween™80). Модифікований протокол можна застосувати в якості корисного інструмента для оцінки захисного ефекту бактеріофагів проти росту Salmonella Enteritidis. Зміна кольору реакційної суміші аlamarBlue® із синього на червоний, яка викликана окисненням, пов'язаним з метаболічною активністю, вказує на ріст клітин Salmonella. Синій колір реакційної суміші аlamarBlue® + 20 % стерильний розчин Tween 80 вказує на захисний ефект суспензії з фагом, що попереджує ріст клітин Salmonella. Докладний протокол: 1. Додавали 20 мл середовища LB у конічну плоскодонну колбу Ерленмейера на 100 мл та автоклавували. 2. Інокулювали 20 мл стерильного рідкого середовища LB зі штамом S. Enteritidis та інкубували культуру протягом ночі при 37 °C зі струшуванням (об./хв. = 150). Суспензія повинна зберігатися в холодильнику при 4 °C не довше 1 тижня та розглядатися в якості інокуляту для 8 UA 112551 C2 5 10 15 20 25 30 35 40 поточних культур. 3. Інокулювали 20 мл стерильного рідкого середовища LB (у колби Ерленмейера на 100 мл) з 20 мкл штаму S. Enteritidis та інкубувати культуру протягом 1 години при 37 °C зі струшуванням (об./хв. = 150). 4. Робили відповідні розведення суспензії в LB. Розведення повинні містити 2000, 200 та 20 бактеріальних клітин в 1 мл. Застосовували для експериментів із суспензією, що демонструє захисний ефект. 5. Змішували 100 мкл відповідного розведення бактеріальних клітин S. Enteritidis зі 100 мкл суспензії бактеріофага та додавали суміші в послідовні лунки 96-лункового титрувального планшета. 6. Готували контролі; відповідні розведення суспензії з S. Enteritidis, які будуть слугувати в якості контролю бактеріального росту, а також суспензію з бактеріофагом та чисте середовище LB у якості контролів мікробного забруднення. 7. Накривали титрувальний планшет кришкою та інкубували протягом 4 годин при 37 °C. 8. Накривали титрувальний планшет кришкою та захищали алюмінієвою фольгою від доступу світла, потім продовжували інкубацію протягом наступних 4 годин при 37 °C. Виконували зчитування через 4 години інкубаційного процесу. Дослідження термостабільності бактеріофагів Аналіз термостабільності зберігання бактеріофагів виконували протягом 3 місяців при трьох різних температурах -20 °C, +4 °C та при кімнатній температурі. Стабільність вимірювали шляхом визначення титру фага за допомогою чашкового підрахунку на початку експерименту, через місяць та через три місяці зберігання при зазначених вище температурах. Бактеріофаги суспендували в середовищі LB після розмноження та очищення від бактеріальних клітин. Результати показували, що деякі з бактеріофагів існуючої колекції, а саме, 3sent1, 8sent65 та 8sent1748 (фіг. 4), зберігають свій титр у порядку величин протягом трьох місяців зберігання при температурі -20 °C або 4 °C, на відміну від інших фагів, наприклад, lst1 або 2styp5 (фіг. 4), що є важливим з точки зору стійкості. Дослідження безпеки препарату з бактеріофагом Визначення рівня ендотоксину Визначення концентрації ендотоксину (LPS), основного компонента клітинної стінки грамнегативних бактерій, виконували із застосуванням LAL-тесту (лізат амебоцитів Limulus). LAL-тести доступні у вигляді готових до застосування наборів для колориметричного вимірювання рівня та активності LPS: 1. Набір виробництва Genscript (Toxinsensor LAL Endotoxin Assay Kit). 2. Набір виробництва LONZA (QCL-1000 Endpoint chromogenic LAL Assay). У цих тестах LAL-реагент взаємодіє з ендотоксином в аналізованих зразках, приводячи до одержання продукту реакції, який здатний реагувати із хромогенним субстратом, у такий спосіб можливе спектрофотометричне вимірювання. Інтенсивність фарбування прямо пропорційна концентрації ендотоксину. Зразки, що містили фаг, брали на різних стадіях технологічного процесу (оцінка ефективності ультрацентрифугування - зразки А1-А2, та концентрації фагових частинок із застосуванням мембран з різним розміром пор 100 кДа - зразки B1-B5 та 50 кДа - зразки C1-C7) та аналізували щодо рівня ендотоксину. Одержані результати вказують на присутність великої кількості LPS у зразках, узятих після стадії концентрування фагових частинок (таблиця 6). 45 Таблиця 6 Результати концентрації LPS в аналізованих зразках Зразок Концентрація Опис № LPS ОЕ/мл 6 A1 Зразок, що містить осад у пробірці (фаги) після ультрацентрифугування, >10 суспендований у буфері SM A2 Зразок, що містить надосадову рідину після ультрацентрифугування 106345 6 B1 Вихідний зразок - середовище, що містить фаги після відокремлення >10 бактеріальних клітин та стерилізації B2 10-кратно концентрований препарат (ретентат) 156389 B3 Пермеат – рідина, профільтрована через концентраційну мембрану 4888 В4 Сольовий розчин, застосований для промивання мембрани після закінчення 55 процесу фільтрації, зібраний у вигляді пермеату 9 UA 112551 C2 Продовження таблиці 6 В5 Сольовий розчин, застосований для промивання мембрани після закінчення процесу фільтрації, зібраний у вигляді ретентату C1 Вихідний зразок — середовище, що містить фаги після відокремлення бактеріальних клітин та стерилізації C2 Пермеат — рідина, профільтрована через концентраційну мембрану C3 10-кратне концентрований препарат (ретентат) C4 Сольовий розчин, застосований для промивання мембрани після закінчення процесу фільтрації, зібраний у вигляді ретентату (перший зразок 100 мл) C5 Сольовий розчин, застосований для промивання мембрани після закінчення процесу фільтрації, зібраний у вигляді ретентату (другий зразок 200 мл) C6 Сольовий розчин, застосований для промивання мембрани після закінчення процесу фільтрації, зібраний у вигляді ретентату (третій зразок 200 мл) C7 Сольовий розчин, застосований для промивання мембрани після закінчення процесу фільтрації, зібраний у вигляді ретентату (четвертий зразок 500 мл) 5 10 15 20 25 30 35 40 0,5 211327 25 1,36 × 1010 1,69 × 109 1,32 × 109 1,05 × 108 1549 Аналіз цитотоксичності Дослідження виконували за допомогою аналізу поглинання нейтрального червоного. Тест проводили в 96-лункових планшетах із застосуванням клітинної лінії 3Т3. Клітини 3T3 являють собою одержані від миші нетрансформовані фібробласти, зазвичай застосовувані для аналізу токсичності in vitro. Аналіз виконували на препараті, що містить суміш трьох різних фагів у 4 серійних розведеннях. Вимірювання проводили у двох екземплярах та в 5 незалежних повторах. Одержані значення оптичної густини застосовували для розрахунків % життєздатності клітин шляхом порівняння оптичної густини аналізованого зразка з оптичною густиною контрольного зразка (тобто клітин, що інкубують у культуральному середовищі) (фігура 5). Тест цитотоксичності із застосуванням клітинної лінії 3T3: 1. Поміщали 10000 фібробластів 3T3, які суспендували в стандартному культуральному середовищі, у кожну лунку 96-лункового планшета та інкубували протягом 24 годин в інкубаторі (37 °C, 5 % CО2). 2. Видаляли культуральне середовище та додавали препарат з бактеріофагом, розведений у культуральному середовищі. Продовжували інкубацію протягом наступних 24 годин (37 °C; 5 % CО2). 3. Після інкубації видаляли середовище, що містить препарат з фагом, промивали моношар фібробластів в PBS та інкубували з розчином нейтрального червоного в PBS протягом 3 годин (37 °C, 5 % CО2). 4. Видаляли розчин нейтрального червоного, промивали PBS та індукували лізис клітин. Вимірювали кількість поглиненого барвника колориметричним способом. Одержані результати вказують на відсутність цитотоксичної активності препарату з бактеріофагом навіть у високих концентраціях. Отже, не очікується поява гострої цитотоксичності після застосування даного препарату in vivo у концентрації фага щонайменше 8 до 10 частинок. Дослідження іn vivo Визначення ефективності та безпеки препарату з бактеріофагом за прототипом, застосованого проти сальмонельозу в курячих бройлерів. Дослідження виконували в співробітництві з Вармінсько-Мазурським університетом, а також VETLAB. Мета: оцінити можливість застосування бактеріофагів у захисті проти сальмонельозних інфекцій у курчат-бройлерів. Штам 65/S/10 Salmonella enterica серовара Enteritidis, наданий VETLAB, застосовували для інфікування бройлерів, тоді як для підготовки засобу з бактеріофагом застосовували три бактеріофаги: 3sent1, 8sent65 та 8sent1748, виділені із двох штамів Salmonella enterica (таблиця 3) та що демонструють широкий спектр специфічності проти різних сероварів Salmonella, а також проти досліджуваних штамів Enteritidis. Виходячи зі специфічності застосованих бактеріофагів можна припустити специфічність повного препарату (таблиця 7). Препарат з бактеріофагом одержували наступним чином, кожний із трьох бактеріофагів піддавали оптимізованій процедурі розмноження, а потім одержані суспензії з фагом змішували таким чином, що значення їх титрів у кінцевому продукті були подібними. Готували дві суміші з різними 10 UA 112551 C2 8 концентраціями фагів, висока концентрація із вмістом 2,0 × 10 БУО/мл та низька концентрація 6 із вмістом 2,0 × 10 БУО/мл. Після цього суміші розділяли на порції та стерилізували з застосуванням мікрофільтрації. Аналіз мікробного забруднення не показав присутність бактерій у застосовуваному препараті з бактеріофагом. 5 Таблиця 7 Передбачувана специфічність препарату, виходячи зі специфічності включених до його складу фагів Серовар Typhimurium Typhi Paratyphi Infantis Brandenburg Hadar Enteritidis Штам LT2 1751 ATCC 13311 A ATCC 19150 789 584 817 D ATCC 13076 1748 65/S/10 249 1014/S/09 K-1 1192/S/09 K-8 1250/S/09 1446/S/09 K-31 1535/S/09 2050/S/09 K-4 Farm «K» K-3 Farm «K» K-6 Farm «K» K-9 Farm «K» K-10 Farm «K» K-11 Farm «K» K-12 Farm «K» K-14 Farm «K» K-18 Рас K-ґрунт Рас K-підлога W/K-6 W/K-7 W/K-9 64/S/10 65/S/10 517/S/09 571/S/09 833/S/09 838/S/09 838/S/09 В 847/S/09 848/S/09 865/S/09 866/S/09 945/S/09 975/S/09 1013/S/09 K-4 1021/S/09 3sent1 + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + 11 8sent1748 + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + 8sent65 + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + ПРЕПАРАТ + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + UA 112551 C2 Продовження таблиці 7 Серовар 5 10 15 Штам 1044/S/09 K-2 1047/S/09 K-1 1048/S/09 K-8 1061/S/09 K-5 1067/S/09 K-2 1067/S/09 K-3 1085/S/09 МЕК 1106/S/09 K-1 1143/S/09 1171/S/09 1206/S/09 МЕК 1231/S/09 1250/S/09 1257/S/09 K-7 1422/S/09 МЕК 1445/S/09 K-46 1465/S/09 МЕК 1535/S/09 1542/S/09 NWJ 1545/S/09 МЕК 1572/S/09 NWJ 1573/S/09 NWJ 1714/09 1748 2149/09 2619/S/10 3sent1 + + + + + + + + + + + + + + + + + + + + + + + + + 8sent1748 + + + + + + + + + + + + + + + + + + + + + 8sent65 + + + + + + + + + + + + + + + + + + + + + + + + ПРЕПАРАТ + + + + + + + + + + + + + + + + + + + + + Процедура експерименту Сто п'ятдесят півнів Ross 308, випадковим чином розділених на 5 рівних ізольованих груп (окремі кімнати - загони), застосовували для дослідження. Курчат годували стандартним збалансованим комбікормом виготовленим Agrocentrum Кольно, Польща, та утриманим в умовах, які відповідають рекомендації виробника біологічного матеріалу. Чотириденних курчат 5 із загонів 1, 2 та 3 інфікували бацилами Salmonella Enteritidis у дозі 1 × 10 КУО на тварину (таблиця 8). Курчат із загонів 4 та 5 не інфікували бацилами Salmonella. Препарат з 6 бактеріофагом вводили курчатам, поміщеним у загони 1 (низька концентрація 2,0 × 10 БУО/мл, 8 відзначений як FN), 2 та 5 (висока концентрація 2,0 × 10 БУО/мл, відзначений як FW). Препарат вводили півням раз на день протягом перших 14 днів їх життя. Засіб з бактеріофагом не вводили курчатам із загонів 4 та 5. Час вирощування складав 21 день, та протягом цього періоду померли тільки п'ять птахів із різних загонів (таблиця 8). Оскільки виявлена смертність була мінімальною та не залежала від заданої групи курчат, то смертність не могла бути результатом уведення препарату з фагом. Таблиця 8 Схема введення бактерій та бактеріофагів, а також життєздатність птахів Загін 1 2 3 4 5 20 Інфекція Salmonella 5 1 × 10 КУО/птаха 5 1 × 10 КУО/птаха 5 1 × 10 КУО/птаха Введення бактеріофага 6 2,0 × 10 БУО/мл 8 2,0 × 10 БУО/мл 8 2,0 × 10 БУО/мл Життєздатність курчат 30/30 29/30 28/30 30/30 28/30 Виявлення бацил Salmonella Зразки для виявлення бацил Salmonella збирали згідно зі схемою, описаною нижче (фігура 12 UA 112551 C2 6): 5 10 15 20 25 - дослідження фекалій протягом 21 дня експерименту, й й й - дослідження підстилки - збирали мазки з підошов на 3 , 15 та 21 день життя птахів, - дослідження печінки, селезінки та кишечнику 21-денних бройлерів, - дослідження порожніх загонів до розміщення пташенят - мазки збирали зі стін, годівниць, поїлок та підлоги (контроль), - дослідження одноденних пташенят - внутрішніх органів, кишечнику та меконію (контроль). Виявлення присутності бацил Salmonella в аналізованих зразках виконували в акредитованій лабораторії - VETLAB (Брудзев, Польща). В 2008 році ця лабораторія одержала дозвіл керівника Ветеринарної служби (№ Giwhig-5120-23/08) на проведення виявлення бацил Salmonella за допомогою бактеріологічного якісного способу. Бацили Salmonella не виявили в аналізованих зразках внутрішніх органів та кишечнику одноденних пташенят, меконію, а також мазків із загонів до розміщення пташенят. Відсутність бацил Salmonella або різний рівень їх виявлення у випадку аналізу фекалій за 21 день й й й експерименту, а також аналізу мазків з підошов на 3 , 15 та 21 день життя (таблиця 9) та аналізу внутрішніх органів 21-денних бройлерів (фігура 7) залежав від досліджуваного загону. Таким чином, як і очікувалося, бацили Salmonella не виявили в курчат із загонів 4 та 5. У випадку птахів із загону 3, яких інфікували бацилами Salmonella та не обробляли препаратом з бактеріофагом, бацили виявляли починаючи із шостого дня життя. У той самий час у випадку курчат із загонів 1 та 2, яких інфікували бацилами Salmonella та лікували засобом з фагом, інгібування розмноження бактерій було чітко видно доти, поки введення препарату з фагом не було припинено. Що важливо, кількість бацил, виявлених у внутрішніх органах та кишечнику 21денних птахів, було дуже низьким щодо курчат, яких не лікували препаратом з фагом. Таким чином, бактеріофаги запобігають розмноженню бактерій та, отже, появі бактерій у фекаліях птахів, інфікованих у ході експерименту. Відповідно, можна відзначити, що бактеріофаги зменшили у 200 раз рівень інфекції навіть через тиждень після припинення обробки фагом. Таблиця 9 Рівень наявності бацил Salmonella у фекаліях під час експерименту Наявність бацил Salmonella Додавання фага Загін 1 Загін 2 Загін 3 Загін 4 Загін 5 FN+/S+ Fw+/S+ F-/S+ F-/SFw+/S1 Так 2 Так 3 3 2,5 × 10 Так 4 Так 5 Так 1 6 1,0 × 10 Так 7 + Так 3 8 5,3 × 10 Так 9 + Так 4 10 1,0 × 10 Так 11 + Так 1 4 12 3,0 × 10 3,5 × 1 0 Так 13 + Так 3 3 14 2,0 × 10 5,5 × 10 Так 3 2 3 15 4,1 × 10 1,0 × 10 1,5 × 10 Нема 16 + + + Нема 2 4 17 2,1 × 10 + 3,0 × 10 Нема 4 21 5,0 × 102 2,2 × 103 4,3 × 10 Нема "-" означає, що бацили Salmonella не виявлені "+" означає, що бацили Salmonella виявлені, але було важко визначити їхній титр День Інфекція 30 Виявлення наявності бактеріофагів. Зразки, аналізовані на присутність бактеріофага, збирали з фекалій протягом 21 дня експерименту та з мазків з усіх загонів до розміщення пташенят, до інфікування, а також через день та через тиждень після припинення обробки фагом. Бактеріофаги у внутрішніх органах не 13 UA 112551 C2 5 виявили. Відзначено, що відсутність бактеріофагів або різний рівень їх виявлення у фекаліях птахів (таблиця 10) та при аналізі мазків з підошов (таблиця 11) залежить від заданого загону аналізованих курчат. Тобто, бактеріофаги виявляли у фекаліях курчат із загонів 1, 2 та 5, яким вводили засіб з фагом. Однак їх кількість зменшувалася після припинення обробки, та особливо у випадку із птахами із загонів 2 та 5, де застосовували високу концентрацію фага, бактеріофагів більше не виявляли. Слід додати, що значно меншу кількість бактеріофагів виявляли у фекаліях із загону 5 у порівнянні з фекаліями із загону 2, що може бути результатом неможливості розмноження фага у зв'язку з відсутністю бацил Salmonella. Таблиця 10 Рівень титру бактеріофага у фекаліях домашнього птаха День 1 3 10 15 17 21 Загін 1 FN+/S+ 0 0 6 8,0 × 10 7 1,2 × 10 4 1,7 × 10 1 5,0 × 10 Титр бактеріофага Загін 2 FW+/S+ Загін 3 F-/S+ 0 0 7 1,8 × 10 0 4 5,5 × 10 0 1 5,0 × 10 0 0 0 0 0 Загін 4 F-/S0 0 0 0 0 0 Загін 5 F+/S0 2 5,6 × 10 3 5,0 × 10 2 8,2 × 10 0 0 10 Таблиця 11 Рівень титру бактеріофага в аналізованих мазках з підошов День Через день після припинення обробки фагом (15) Через тиждень після припинення обробки фагом (21) 15 20 25 30 Титр бактеріофага Загін 1 Загін 2 Загін 3 Загін 4 Загін 5 FN+/S+ FW+/S+ F-/S+ F-/S- F+/S5 3 3 1,0 × 10 1,0 × 10 0 0 2,4 × 10 5 6,5 × 10 0 0 0 0 Висновки на основі дослідження ефекту препарату з бактеріофагом на бройлерів На основі проведених тестів можна зробити висновок, що препарат є безпечним та ефективним. 1. Даний препарат є безпечним для домашнього птаха. 2. Бактеріофаги проходять через шлунково-кишковий тракт та проникають у фекалії та підстилку. 3. Бактеріофаги не попадають у внутрішні органі птахів. 4. Бактеріофаги зникають після припинення введення даного препарату. 5. Бактеріофаги попереджають появу бактерій у фекаліях експериментально інфікованих птахів. 6. Бактеріофаги знижують у 200 разів рівень інфекції через тиждень після припинення лікування фагом. ФОРМУЛА ВИНАХОДУ 1. Застосування бактеріофагу, вибраного з групи, що складається з PCM F/00069, PCM F/00070 та PCM F/00071, у попередженні або боротьбі з інфекціями домашнього птаха, спричинюваними патогенними штамами Salmonella sp., чутливих до цих фагів, при цьому вказані бактеріофаги вводять з їжею або водою уразливим тваринам з інтервалами від одного до семи днів. 2. Штам бактеріофага, придатний для попередження або ліквідації інфекції, спричинюваної патогенними штамами Salmonella sp, вибраний із групи, що складається з PCM F/00069, PCM F/00070 та PCM F/00071, при цьому вказаний штам бактеріофага зберігає свій титр у порядку величин протягом трьох місяців зберігання при температурі -20 або 4 °С. 14 UA 112551 C2 15 UA 112551 C2 16 UA 112551 C2 Комп’ютерна верстка В. Мацело Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 17
ДивитисяДодаткова інформація
Назва патенту англійськоюThe method of obtaining a strain of bacteriofage, specific strains of bacteriophage and use thereof
Автори англійськоюDastych, Jaroslaw, Dziadek, Jaroslaw, Gorecka, Elzbieta, Rumijowska-Galewicz, Anna, Wojtasik, Arkadiusz, Wojcik, Ewelina
Автори російськоюДастих Ярослав, Дзядек Ярослав, Гурецкая Эльжбэта, Румийовская-Галевич Анна, Войтасик Аркадиуш, Вуйцик Эвелина
МПК / Мітки
МПК: A61K 35/66, C12R 1/42, A23K 50/75, A61K 39/112, A23K 10/16, A61K 35/76, C12N 7/00
Мітки: застосування, бактеріофага, штам
Код посилання
<a href="https://ua.patents.su/19-112551-shtam-bakteriofaga-ta-jjogo-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Штам бактеріофага та його застосування</a>
Попередній патент: Пристрій керування для ударного механізму та спосіб керування ударним механізмом
Наступний патент: Гетероцикліламіни як інгібітори pi3k
Випадковий патент: Пристрій для виготовлення стандартизованих за товщиною пластинчастих епоксидних шліфів