Композиція для перорального введення птахам та тваринам для лікування або зниження ризику інфекції травного тракту (варіанти), її застосування (варіанти) та спосіб лікування або зниження ризику інфекцій травног
Номер патенту: 78486
Опубліковано: 10.04.2007
Автори: Фодж Дуглас В., Андерсон Давид М., Хсіао Хумг-Ю, Ліу Лін
Формула / Реферат
1. Композиція для перорального введення птахам та тваринам для лікування або зниження ризику інфекції травного тракту, яка відрізняється тим, що вона включає (і) фермент, який являє собою естеразу, що розщеплює зв’язок, що складається з фосфатидилінозитолу, причому зазначене розщеплення приводить до вивільнення клітинного поверхневого білка або вуглеводу, та (іі) фізіологічно прийнятний носій для зазначеного ферменту.
2. Композиція за п. 1, яка відрізняється тим, що композиція є кормом.
3. Композиція за пп. 1 або 2, яка відрізняється тим, що композиція не містить іншого протиінфекційного агента, окрім зазначеного ферменту.
4. Композиція за будь-яким з пп. 1-3, яка відрізняється тим, що фермент розщеплює зв’язок, що приводить до вивільнення клітинного поверхневого білка.
5. Композиція за п. 1, яка відрізняється тим, що вказана естераза вибрана з групи, яка включає сфінгомієлінази та фосфоліпази.
6. Композиція за п.5, яка відрізняється тим, що фосфоліпаза являє собою фосфоліпазу типу C або типу D.
7. Композиція за п. 5, яка відрізняється тим, що фосфоліпаза являє собою специфічну до фосфатидилінозитолу фосфоліпазу C.
8. Композиція за будь-яким з пп. 1-7, яка відрізняється тим, що додатково включає стабілізатор, вуглеводний носій або консервант.
9. Композиція за п. 8, яка відрізняється тим, що стабілізатор являє собою буфер, вуглевод або гліколь.
10. Композиція за п. 8, яка відрізняється тим, що вуглеводний носій вибраний із групи, яка включає ксилозу, фруктозу, глюкозу, сорбіт та мальтотріозу.
11. Композиція за п. 8, яка відрізняється тим, що консервант вибраний з групи, яка включає пропілпарабен, сорбат натрію, сорбат калію та аскорбілпальмітат.
12. Композиція за будь-яким з пп. 1-11, яка відрізняється тим, що носій являє собою кормовий продукт, у який включено фермент.
13. Композиція за п. 12, яка відрізняється тим, що кормовий продукт являє собою корм для тварин, який включає зерновий матеріал, джерело білка, вітаміни, амінокислоти та мінерали.
14. Композиція за п. 13, яка відрізняється тим, що зерновий матеріал являє собою кукурудзу, сорго, пшеницю, ячмінь або овес.
15. Композиція за п. 13, яка відрізняється тим, що джерело білка являє собою боби або горох.
16. Композиція за будь-яким з пп. 1-11, яка відрізняється тим, що являє собою тверду або рідку композицію.
17. Композиція за будь-яким з пп. 1-11, яка відрізняється тим, що фермент знаходиться у таблетці або в капсулі з желатиновою оболонкою.
18. Композиція за п. 1, яка відрізняється тим, що фермент одержаний зі штаму Bacillus cereus.
19. Композиція за п. 18, яка відрізняється тим, що штам Bacillus cereus являє собою ATCC 7004 або ATCC 6464.
20. Композиція за п. 1, яка відрізняється тим, що фермент одержаний шляхом експресії рекомбінантної ДНК в організмі-хазяїні.
21. Композиція за п. 20, яка відрізняється тим, що організм-хазяїн походить зі штаму Bacillus megaterium.
22. Композиція за п. 1, яка відрізняється тим, що фермент присутній у кількості 200 МО/кг - 4000 МО/кг корму.
23. Композиція за п. 2, яка відрізняється тим, що фермент присутній у кількості 3-90 од/фунт корму (6,61 – 198,45 од./кг).
24. Композиція за п. 23, яка відрізняється тим, що фермент присутній у кількості 3 од/фунт корму (6,61 од./кг).
25. Композиція за п. 23, яка відрізняється тим, що фермент присутній у кількості 10 од/фунт корму (22,05 од./кг).
26. Композиція за п. 23, яка відрізняється тим, що фермент присутній у кількості 30 од/фунт корму(66,15 од./кг).
27. Композиція за п. 23, яка відрізняється тим, що фермент присутній у кількості 90 од/фунт корму (198,45 од./кг).
28. Спосіб лікування або зниження ризику інфекцій травного тракту, який включає пероральне введення суб’єкту, який страждає від інфекції або перебуває під ризиком інфікування, ефективної кількості ферменту, що являє собою фосфоліпазу, яка розщеплює зв’язок, що складається з фосфатидилінозитолу, причому зазначене розщеплення приводить до вивільнення клітинного поверхневого білка або вуглеводу.
29. Спосіб за п. 28, який відрізняється тим, що фермент розщеплює зв’язок, що приводить до вивільнення клітинного поверхневого білка.
30. Спосіб за п. 28, який відрізняється тим, що спосіб не включає введення іншого протиінфекційного агента, окрім зазначеного ферменту.
31. Спосіб за п. 28, який відрізняється тим, що інфекція викликана вірусним патогеном з найпростіших, бактерій, дріжджів або грибків.
32. Спосіб за п. 31, який відрізняється тим, що інфекція викликана патогеном із найпростіших роду Eimeria.
33. Спосіб за п. 31, який відрізняється тим, що інфекція викликана патогеном із найпростіших роду Cryptosporidium.
34. Спосіб за п. 31, який відрізняється тим, що інфекція викликана патогеном із бактерій роду Clostridium.
35. Спосіб за п. 28, який відрізняється тим, що фермент одержаний зі штаму Bacillus cereus.
36. Спосіб за п. 35, який відрізняється тим, що штам Bacillus cereus являє собою ATCC 7004 або ATCC 6464.
37. Спосіб за п. 28, який відрізняється тим, що фермент одержаний шляхом експресії рекомбінантної ДНК в організмі-хазяїні.
38. Спосіб за п. 37, який відрізняється тим, що організмом-хазяїном є штама Bacillus megaterium.
39. Спосіб за п. 28, який відрізняється тим, що фосфоліпаза являє собою фосфоліпазу типу C або типу D.
40. Спосіб за п. 39, який відрізняється тим, що фосфоліпаза являє собою специфічну до фосфатидилінозитолу фосфоліпазу C.
41. Композиція для перорального введення, яка відрізняється тим, що вона включає (і) фермент, який являє собою геміцелюлазу та (іі) фізіологічно прийнятний носій для зазначеного ферменту та не містить іншого протиінфекційного агента, окрім зазначеного ферменту.
42. Композиція за п. 41, яка відрізняється тим, що як вказаний носій вона містить кормовий продукт з введеним в нього вказаним ферментом.
43. Композиція за будь-яким з п. 42, яка відрізняється тим, що кормовий продукт являє собою корм для тварин, який включає зерновий матеріал, джерело білка, вітаміни, амінокислоти та мінерали.
44. Композиція за п. 43, яка відрізняється тим, що зерновий матеріал являє собою кукурудзу, сорго, пшеницю, ячмінь або овес.
45. Композиція за п. 43, яка відрізняється тим, що джерело білка являє собою боби або горох.
46. Композиція за п. 41, яка відрізняється тим, що являє собою тверду або рідку композицію.
47. Композиція за п. 41, яка відрізняється тим, що фермент знаходиться у пігулці або в капсулі з желатиновою оболонкою.
48. Композиція за п. 41, яка відрізняється тим, що геміцелюлаза являє собою мананазу.
49. Композиція за п. 48, яка відрізняється тим, що мананаза являє собою ендо-1,4-b-D-мананазу, що продукована штамом Bacillus lentus, позначеним як ATCC 55045.
50. Композиція за п. 41, яка відрізняється тим, що додатково включає стабілізатор, вуглеводний носій або консервант.
51. Композиція за п. 50, яка відрізняється тим, що стабілізатор являє собою буфер, вуглевод або гліколь.
52. Композиція за п. 50, яка відрізняється тим, що вуглеводний носій вибраний із групи, яка включає ксилозу, фруктозу, глюкозу, сорбіт та мальтотріозу.
53. Композиція за п. 50, яка відрізняється тим, що консервант вибраний з групи, яка включає пропілпарабен, сорбат натрію, сорбат калію та аскорбілпальмітат.
54. Композиція за п. 42, яка відрізняється тим, що фермент присутній у кількості 3-90 од./фунт корму (6,61 – 198,45 од./кг).
55. Композиція за п. 54, яка відрізняється тим, що фермент присутній у кількості 3 од./фунт корму (6,61 од./кг).
56. Композиція за п. 54, яка відрізняється тим, що фермент присутній у кількості 10 од./фунт корму (22,05 од./кг).
57. Композиція за п. 54, яка відрізняється тим, що фермент присутній у кількості 30 од./фунт корму (66,15 од./кг).
58. Композиція за п. 54, яка відрізняється тим, що фермент присутній у кількості 90 од./фунт корму (198,45 од./кг).
59. Спосіб лікування або зниження ризику інфекцій травного тракту, який включає пероральне введення суб’єкту, який страждає від інфекції або перебуває під ризиком інфікування, ефективної кількості ферменту, що являє собою геміцелюлазу без введення разом з указаним ферментом ефективної кількості іншого протиінфекційного агента.
60. Спосіб за п. 59, який відрізняється тим, що інфекція викликана вірусним патогеном з найпростіших, бактерій, дріжджів або грибків.
61. Спосіб за п. 60, який відрізняється тим, що інфекція викликана патогеном із найпростіших роду Eimeria.
62. Спосіб за п. 60, який відрізняється тим, що інфекція викликана патогеном із найпростіших роду Cryptosporidium.
63. Спосіб за п. 60, який відрізняється тим, що інфекція викликана патогеном із бактерій роду Clostridium.
64. Спосіб за п. 60, який відрізняється тим, що фермент одержаний зі штаму Bacillus lentus.
65. Спосіб за п. 59, який відрізняється тим, що фермент одержаний шляхом експресії рекомбінантної ДНК в організмі-хазяїні.
66. Спосіб за п. 65, який відрізняється тим, що організм-хазяїн походить зі штаму Bacillus megaterium.
67. Спосіб за п. 59, який відрізняється тим, що геміцелюлаза являє собою мананазу.
68. Спосіб за п. 67, який відрізняється тим, що мананаза являє собою ендо-1,4-b-D-мананазу, що продукована штамом Bacillus lentus, позначеним як ATCC 55045.
69. Застосування пероральної лікарської форми ферменту, який являє собою естеразу, яка розщеплює зв’язок, що складається з фосфатидилінозитолу, де зазначене розщеплення приводить до вивільнення клітинного поверхневого білка або вуглеводу, як засобу для лікування або зниження ризику інфекцій травного тракту.
70. Застосування ферменту, який являє собою фосфоліпазу, що розщеплює зв’язок, що складається з фосфатидилінозитолу, де зазначене розщеплення приводить до вивільнення клітинного поверхневого білка або вуглеводу, для виготовлення пероральної лікарської форми лікарського препарату для лікування або зниження ризику інфекцій травного тракту.
71. Застосування пероральної лікарської форми ферменту, який являє собою геміцелюлазу без ефективної кількості у відношенні до мікробів іншого протиінфекційного агента як засобу для лікування або зниження ризику інфекцій травного тракту.
72. Застосування ферменту, який являє собою геміцелюлазу без ефективної кількості у відношенні до мікробів іншого протиінфекційного агента для виготовлення пероральної лікарської форми лікарського препарату для лікування або зниження ризику інфекцій травного тракту.
Текст
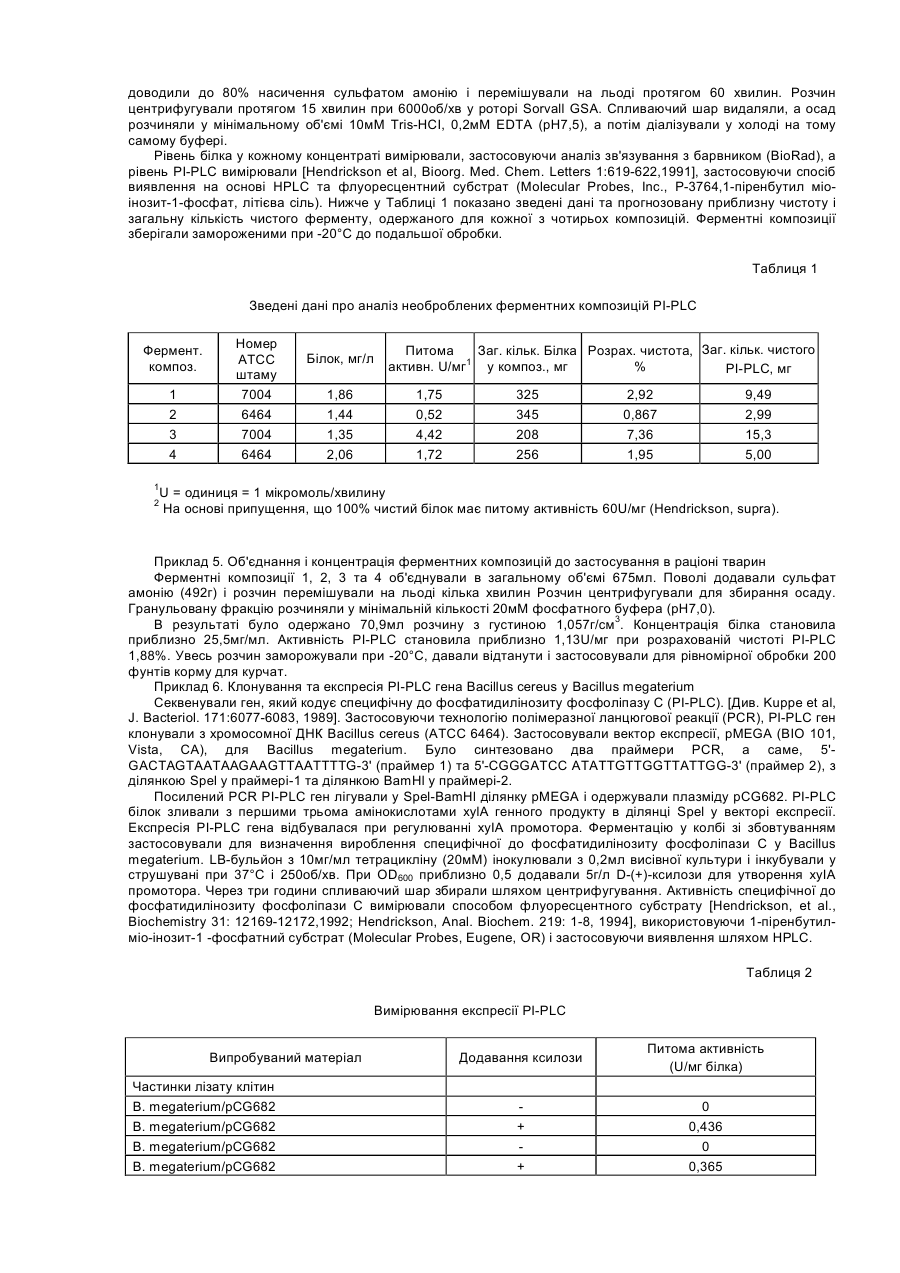
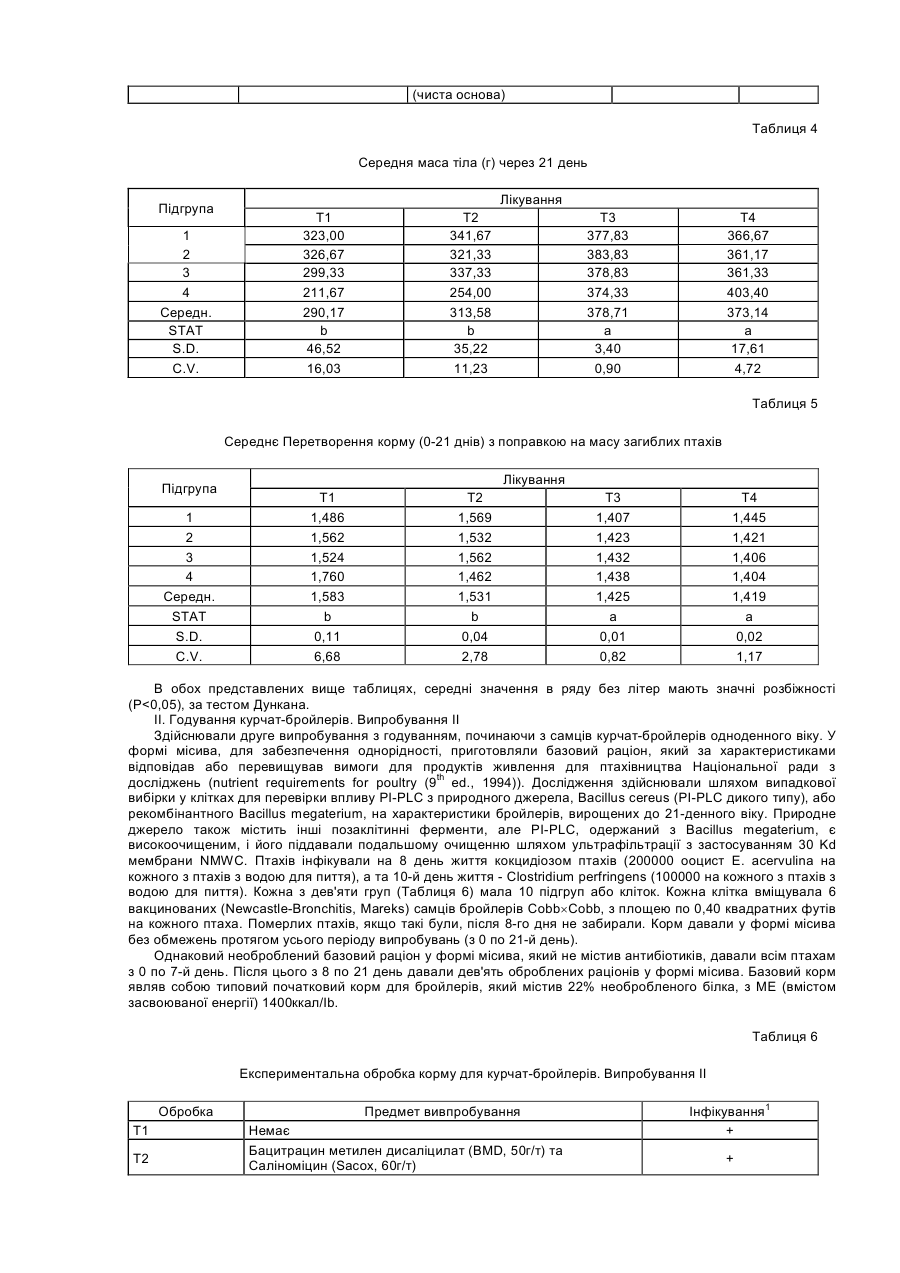
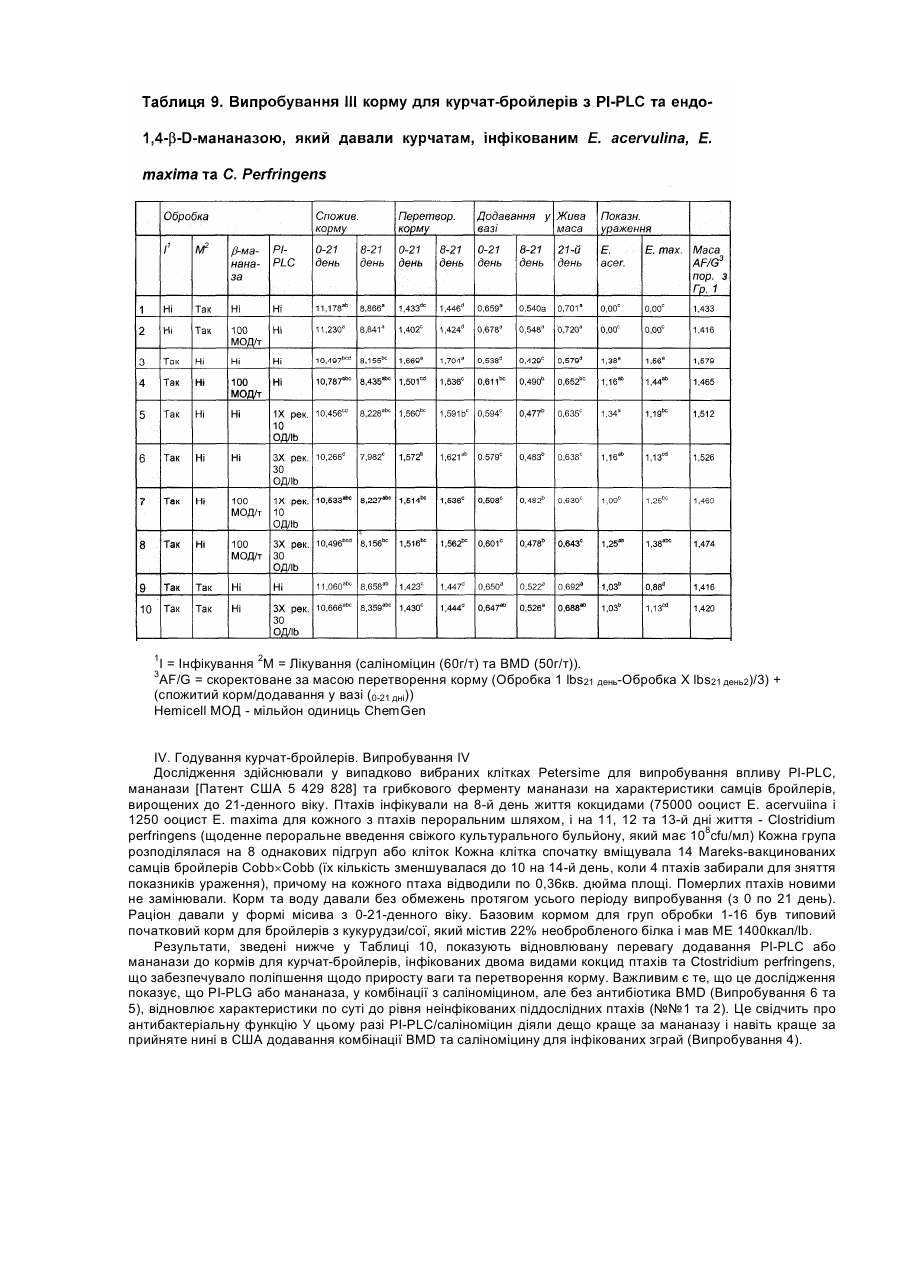
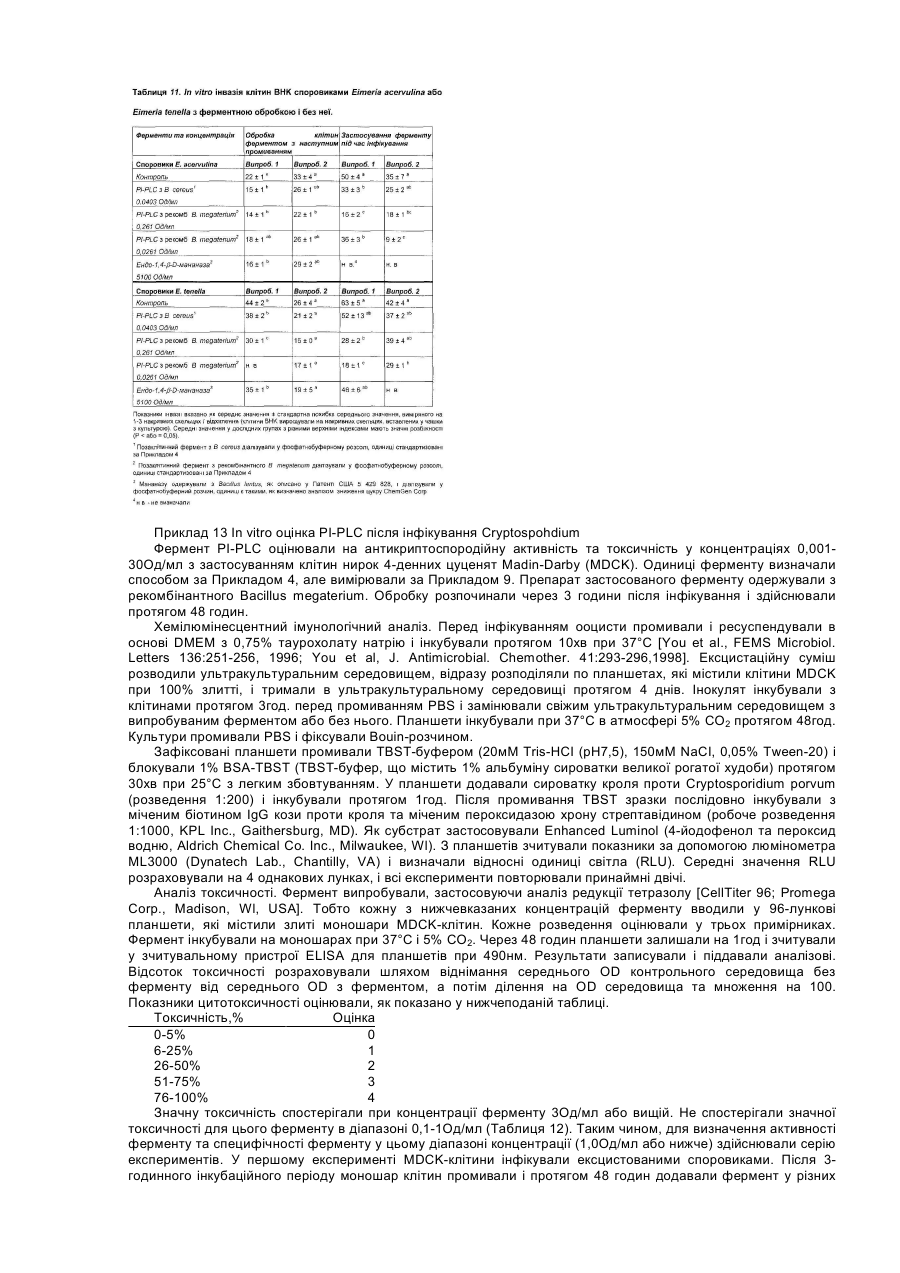
Даний винахід стосується композиції, яка включає ферменти, та способів використання ферментів як протиінфекційних агентів у контексті лікування або зниження ризику інфекцій травного тракту. У своєму звіті [World Population Estimates and Projections "Оцінки та прогнози щодо населення світу" за 1998 рік] Відділ народонаселення Департаменту ООН з економічних та соціальних справ прогнозував, що населення світу досягне 6 мільярдів у 1999 році. У звіті також зазначалося, що для збільшення населення з 5 до 6 мільярдів знадобилося лише 12 років, порівняно з 123 роками для збільшення з одного до двох мільярдів. До середини XXI століття населення за прогнозами становитиме від 7,3 до 10,7 мільярдів. Помітне збільшення населення в останнє десятиріччя частково зумовлюється суттєвими досягненнями у виробництві продовольства в результаті застосування технологій та практики інтенсивного виробництва продовольства. Для подальшого росту необхідно буде дотримуватися темпів збільшення ефективності у виробництві продовольства. Один з підходів, який дозволяє підвищити ефективність виробництва м'яса тварин, включає широке застосування антимікробних хімічних продуктів та антибіотиків у раціоні тварин. На великих фермах, в умовах переповнених приміщень, поширення інфекції є дуже швидким. Таким чином, поширення хвороби контролюють шляхом профілактичного та терапевтичного застосування цих речовин. Наприклад, для контролю над кокцидіозними інфекціями загальною практикою є включення до раціону тварин хімічних продуктів (наприклад, саліноміцину, монензину, роксарзону (3-нітро), галхінолу, карбадоксу та олахіндоксу), а також антимікробних антибіотиків (наприклад, бацитрацину, віргінаміцину, тилозину, тетрацикліну, хлортетрацикліну, пеніциліну, олеандоміцину, новобіоцину, лінкоміцину, бамберміцинів, апраміцину, спіраміцину, еритроміцину, неоміцину та інших). Така практика широко застосовується завдяки тому, що вона сприяє ростові і поліпшує перетравлювання корму. Вироблення комплексної резистентності до антибіотиків серед патогенів людини, таких як Staphylococcus aureus, Streptococcus pneumoniae, Haemophilus influenza, Neisseria gonorrhoeae та Mycobacterium tuberculosis, дало підстави для побоювань, що ця резистентність до антибіотиків, яка виробилася у мікробах, пов'язаних зі свійськими тваринами, може мігрувати до патогенів людини через перехідні фактори резистентності до ліків. Існує свідчення того, що тварини, яким вводили антибіотики, є джерелом бактерій з перехідними факторами резистентності [Див. Hooge, Feedstuffs 71(20):59,1999]. Хоча антибіотики, які застосовують для тварин і для людей, як правило, є різними, між ними існують спільні особливості у механізмах, які можуть призводити до перехресної резистентності. В одному випадку прийнятним для боротьби з інфекціями Е. соlі (колібацильозом) у деяких тварин вважають застосування фторхінолонів, а також застосовують їх для лікування людей. Див. Hooge, supra. Нещодавно FDA/CVM запропонувало скасувати ухвалення щодо застосування фторхінолоненрофлоксацину для птиці через вироблення резистентної до фторхінолону кампілобацили та перенесення її на людину. [Див. Murhead, S. Feedstuffs 72(45): 1-4,2000]. Стурбованість серед виробників м'яса також викликає можливість зниження продуктивності та відновлення хвороб рослин у разі заборони застосування антибіотиків та антимікробних засобів у кормах. У 1986 році, наприклад, Швеція заборонила застосування кормових антибіотиків, і захворюваність тварин зросла. Це супроводжувалося збільшенням застосування терапевтичних антибіотиків, що призвело до загального збільшення застосування антибіотиків, а також підвищення вартості виробництва. [Див. Smith, Feedstuf's 71 (13); 1, 1999]. У грудні 1998 року Рада міністрів ЄС вирішила призупинити застосування шести антимікробних засобів, які формально були ухвалені для відпускання без рецепта як активатори росту для введення з кормом [Official Journal of the European Communities 29.12.98, Постанова Ради №2821/98 стосовно Директиви 70/524]. Два додатки на основі хіноксаліну також були заборонені у серпні 1999 через стурбованість утворенням залишків у м'ясі. Результатом цих дій стала активізація поширення хвороб, які формально вважалися подоланими, серед яких: некротичний ентерит у бройлерів; ентерит, спричинений Clostridium perfringens у молочних поросят; дизентерія та спірохетозна діарея свиней; спричинена Е.соlі діарея. [Див. Miller, United States Animal Health Association, 1999 Proceedings "Antibiotic Usages in Food Animal Production and Resistance-European Perspective"]. Щороку вмирає 30000 людей через внутрішньолікарняне зараження резистентними патогенами, але значно менше смертей викликають харчові патогени. У жодному випадку смерть від харчових патогенів не була пов'язана з резистентністю до антибіотиків (див. Smith, supra). Таким чином, залишається нез'ясованим, чи загострює застосування антибіотиків у м'ясній промисловості проблему резистентних до ліків патогенів при внутрішньолікарняних зараженнях людей. Стурбованість також викликає брак нових антибіотиків для лікування заражень резистентними патогенами. [Див. Henry, C.M., Chemical and Engineering News, March 6, 2000, cтoр.41-58]. Це може означати, що при виробленні значної резистентності патогенів до антибіотиків не завжди є нові антибіотики для лікування від інфекцій. Очевидно, труднощі, пов'язані з розробкою антибіотиків, розмір ринку та регулятивні проблеми спричинили ситуацію, коли більшість фармацевтичних компаній перестають зосереджувати наукові дослідження на розробці антибіотиків, особливо для застосування на тваринах. Запропоновані нові правила щодо реєстрації ліків для застосування на тваринах є настільки складними, що розробки поступово припиняються. Див. Smith, supra. Щоправда, існують дрібні компанії, які займаються розробкою нових антибіотиків (Henry, supra). У деяких тваринних популяціях інфекція вже є пандемічною. Наприклад, кокцидіоз у птахів є хворобою, з якою можна боротися, але неможливо реально тримати під контролем. Інфікуються фактично всі зграї, і антикокцидіозні хімікати, як правило, додають до раціону для стримування шкоди та обмеження розвитку резистентних штамів. Кокцидіоз забирає у птахівників $350 мільйонів щорічно за рахунок збитків та витрат на медикаментозне лікування антибіотиками, такими як саліноміцин. [Див. Suszkiw, USDA Agricultural Research Service News, October 28, 1997]. Згідно з оцінками, у Сполучених Штатах до 1999 року має витрачатися близько $114 мільйонів щорічно на зниження захворюваності на кокцидіоз. [Див. Frost & Sullivan, U.S. Pharmaceutical Products for Food Animals, Report 5245-54,1995]. Очевидно, що існує потреба в нових і більш ефективних способах контролю над інфекціями у травному тракті тварин, які вирощуються інтенсивними методами. В основі цієї потреби лежить вимога досягнення більшої ефективності виробництва, яке має встигати за швидким ростом населення світу. Поліпшення контролю над кишковими інфекціями гарантує прискорення росту та збільшення ефективності годування. Існує також потреба в альтернативі застосування антибіотиків у тваринництві для розв'язання проблеми можливої резистентності до антибіотиків, яка виробляється у патогенів людини. Немає ніякого ризику сприяння розвиткові резистентних патогенних мікроорганізмів, які являють проблему для здоров'я людини при застосуванні в лікуванні на основі ферментів, які діють не так, як усі антибіотики. Оскільки ферменти є білками, то не існує ризику вмісту небезпечного хімічного залишку у м'ясних продуктах, як це трапляється у разі деяких антибіотиків та антикокцидіозних хімічних продуктів. [Див. American Feed Control Officials Inc., Official Publication, 1999, "Drugs and Feed Additives, Section 30.0 Enyzmes," стор. 206-217, ISBN 1-878341-10-3]. Таким чином, мета даного винаходу полягає у забезпеченні ферментного лікування для зменшення впливу інфекцій травного тракту. Ще однією метою даного винаходу є забезпечення механізму зменшення впливу інфекцій травного тракту шляхом втручання у зв'язування патогенів з клітинами травного тракту. Ще однією метою даного винаходу є забезпечення способу збільшення вагових показників та перетворення корму для тварин, заражених патогенами, які викликають інфекції або некротичний ентерит. Ще однією метою даного винаходу є забезпечення придатної для перорального введення дозованої форми, ефективної для поліпшення стану об'єкта, який є зараженим або якому загрожує зараження мікробним патогеном. Для досягнення цих та інших цілей згідно з одним аспектом даного винаходу також було передбачено композицію, яка включає (і) фермент, який розщеплює зв'язок, що веде до вивільнення білка або вуглеводу клітинної поверхні, причому фермент не є ендо-1,4-b-D-мананазою, та (іі) фізіологічно прийнятний носій для ферменту, причому композиція передбачається у формі, придатній для перорального введення, і не містить іншого протиінфекційного агента, крім ферменту. В одному варіанті втілення даний фермент розщеплює зв'язок, що веде до вивільнення білка клітинної поверхні. В оптимальному варіанті втілення фермент, включений до композиції, є сфінгомієліназою або фосфоліпазою, особливо, фосфоліпазою типу С або типу D. В іншому оптимальному варіанті втілення фермент вибирають із групи, яка складається з естераз, цереброзидаз та карбогідраз, які розщеплюють зв'язок, що веде до вивільнення білка або вуглеводу клітинної поверхні. В іншому варіанті втілення фермент одержують із штаму Bacillus cereus, в оптимальному варіанті - АТСС 7004 або АТСС 6464. В альтернативному варіанті фермент одержують шляхом експресії рекомбінантної ДНК, яка кодує фермент у Bacillus megaterium. В іншому варіанті втілення фермент міститься в оболонці желатинової капсули і є присутнім у композиції в кількості 200МО/кг-4000МО/кг корму. Згідно з іншим аспектом даного винаходу, пропонується композиція, яка має вищезгадані компоненти (і) та (іі), у якій фізіологічно прийнятним носієм є кормовий продукт, до якого включено фермент. Таким чином, композиція може бути кормом для тварин, що не містить іншого протиінфекційного агента, крім ферменту. Композиція корму для тварин згідно з даним винаходом також включає зерновий матеріал, такий як кукурудза, сорго, пшениця, ячмінь або овес, джерело білка, таке як боби або горох, і вітаміни, амінокислоти та мінерали. Згідно з іще одним з аспектів, даний винахід забезпечує композицію, як було описано вище, у твердій або рідкій дозованій формі. Крім того, забезпечується спосіб лікування або зниження ризику інфекцій травного тракту, який включає пероральне введення суб'єктові, який є зараженим або перебуває під ризиком зараження, ефективної кількості ферменту, який розщеплює зв'язок, що веде до вивільнення білка або вуглеводу клітинної поверхні, причому фермент не є ендо-1,4-b-D-мананазою. Крім того, спосіб не включає введення іншого протиінфекційного агента, крім самого ферменту. Інфекція може бути викликана найпростішими, такими, як Еіmеrіа та Cryptosporidium, бактеріальними, такими як Clostridium, грибковими або дріжджовим патогеном. Пропонується також композиція, яка включає (і) фермент, який розщеплює зв'язок, що веде до вивільнення білка або вуглеводу клітинної поверхні, і (іі) фізіологічно прийнятний носій для ферменту, причому композиція передбачається у формі, придатній для перорального введення і не містить іншого протиінфекційного агента, крім ферменту. Забезпечується також спосіб лікування або зниження ризику інфекцій травного тракту, який включає пероральне введення суб'єктові, який є зараженим або перебуває під ризиком зараження, ефективної кількості ферменту, який розщеплює зв'язок, що веде до вивільнення білка або вуглеводу клітинної поверхні, причому цей спосіб не включає введення з ферментом ефективної проти мікробів кількості іншого протиінфекційного агента. Інші цілі, особливості та переваги даного винаходу стануть зрозумілими з нижчеподаного детального опису. Детальний опис та наукові приклади, хоча вони і вказують на оптимальні варіанти втілення, лише ілюструють винахід, оскільки різні зміни та модифікації, які відповідають сутності та обсягові винаходу, стануть зрозумілими спеціалістові з цього детального опису. Крім того, на прикладах показано лише принцип винаходу, і вони не можуть пояснити застосування цього винаходу для всіх конкретних інфекцій, при яких він може бути корисним на думку спеціаліста. На Фігурі 1 показано антикриптоспородійну активність рекомбінантного ферменту PI-PLC, який виробляється штамом Bacillus megaterium. Було виявлено, що ферменти певного класу, який характеризується здатністю до розщеплення зв'язку, що веде до вивільнення білка або вуглеводу клітинної поверхні, виявляють після перорального введення значну антибіотичну активність, яка є ефективною, наприклад, при лікуванні інфекцій травного тракту. До ферментів такого класу належать, крім інших, сфінгомієлінази та фосфоліпази типів С та D, а також ферменти з подібною специфічністю розщеплення. Таким чином, прикладами цього класу є ферменти, які розщеплюють і вивільнюють глікопротеїни або вуглеводи, які зчеплюються з мембраною через зв'язок із фосфатидилінозитом. Отже, фермент фосфатидилінозит, специфічний до фосфоліпази С (Е.С. 3.1.4.10), відомий також під скороченою назвою PI-PLC або як 1-фосфатидилінозит-фосфодіестераза, належить до цього класу. Ще одним прикладом є глікозилфосфатидилінозит-специфічна фосфоліпаза D або GPI-PLD. [Low and Prasad, Proc. Natl. Acad. Sci. 85: 980-984,1988]. Було описано ферменти GPI-PLD та PI-PLC з еукаріотних джерел. [Див. Low, "Degradation of glicosylphosphatidylinositol anchors by specific phospholapases", Chapter 2, стор.35-63, Molecular and Cell Biology of Membrane Proteines: Glycolipide Anchors of Cell-surface Proteins, A.J. Turner (ed.), Ellis Horwood, New York, 1990; Low and Prasad, Proc. Natl. Acad. Sci. 85:980-984, 1988; Essen et at., Nature 380:595-602, 1996; та Essen et al., Biochemistry 36:2753-2762, 1997]. Було описано PI-PLC з прокаріотних джерел, включаючи позаклітинне вироблення бактеріями. Серед відомих бактеріальних джерел PI-PLC - Bacillus cereus [Stein and Logan, J. Bacteriol. 85:369-381, 1963; Stein and Logan, J. Bacteriol.90: 69-81, 1965; Ikezawa et at., Biochimica et Biophysica Acta 450:154-164, 1976; Griffith et ai, Methods in Enzymology 197:493-502, 1991; Volwerk et at., J. Cell. Biochem. 39:315-325, 1989; та Kuppe et al., J. Bacteriol. 171:6077-6083, 1989], Bacillus thuringiensis [Ikezawa and Taguchi, Methods in Enzymology 71:731-741, 1981; японський патентний документ JP 55034039], Staphylococcus aureus [Low and Finean, Biochem. J. 162:235-240, 1977] та Clostridium novyi [Taguchi and Ikezawa, Arch. Biochem. Biophys. 186:196-201, 1978]. Удосконалені способи аналізу для ферменту PI-PLC було розроблено на основі флуоресцентного субстрату. [Див. Hendrickson et at., Biochemistry 31:12169-12172, 1992; Hendrickson, Anal. Biochem. 219:1-8, 1994; Hendrickson et at., Bioorg. Med. Chem. Letters. 1:619-622, 1991]. He посилаючись конкретно на жодну теорію, автори даного винаходу наголошують на тому, що фермент PI-PLC має здатність до розщеплення фосфатидилінозитгліколіпідного зчеплення білків клітинної поверхні та інших глікозилфосфатидилінозитів. [Див. Low, supra; Low and Saltiel, Science 239: 268-275, 1988]. Наприклад, різновиди поверхневих глікопротеїнів та інші поверхневі білки та вуглеводи кількох найпростіших паразитів зчеплюються глікозилфосфатидилінозитними ліпідами (GPI зчепленнями) і є чутливими до гідролізу та вивільнення PI-PLC. Види, які можуть служити прикладами, належать до родів Schistosoma, Toxoplasma, Plasmodium, Trypanosoma та Leishmania (Low, supra), а також Eimeria, Babesia, Theileria, Giardia, Leptomonas та Entamoeba. [Див. McConville and Ferguson, Biochemical J. 294: 305-324, 1993; Pearce and Sher, J. Immunol. 142:979-984, 1989; Sauma et al, Mol. Med. Biochem. Parasitol. 46:73-80, 1991; Hawn and Strand, Mol. Med. Biochem. Parasitol. 59:73-82, 1993]. Цей механізм зчеплення з компонентами поверхні клітин є універсальним для еукаріотних клітин, від дріжджів то клітин ссавців. Присутність GPI зчеплень у Giardia lamblia, який вважають дуже примітивним еукаріотом, вказує на те, що цей тип зчеплення розвивається в еукаріотах на ранній стадії. Підтверджує цю думку виявлення в архебактерії нового фосфогліцероліпіду GlcNal-6-міо-інозит-Р-діалкілгліцерину [Nishihara et al., J. Biol. Chem. 267:12432-12435, 1992], який є основою для розвитку більш складних еукаріотних структур GPI зчеплення. У найпростіших, система GPI зчеплення використовується більшою мірою, ніж у вищих еукаріотів, і є підстави вважати, що зчеплені GPI структури є важливими для життєздатності паразитів у хазяїв - комахах та ссавцях (McConville and Ferguson, supra). Наприклад, часте скидання різних поверхневих глікопротеїнів може служити механізмом уникнення впливу імунної системи. Найпростіше Eimeria tenella містить зчеплені фосфатидилінозитом структури, подібні до глікопротеїну/гліколіпіду Trypanosoma brucei. Їх вважають важливими для мембранного приєднання та наступного інфікування [Див. Gurnett et al., Моl. Med. Biochem. Parasitol. 41:177-186, 1990]. Структури Eimeria розщеплюються трипаносомною ліпазою та PI-PLC Bacillus thuringiensis (Gurnett, supra). Обробка паразитів PlPLC in vivo, якщо її можливо здійснити, очевидно, може допомогти імунній системі хазяїна і завадити приєднанню та інфікуванню патогенами, які проникають у травний тракт. Види Еіmеrіа є поширеною проблемою для птахівництва, яка вимагає великих витрат. Поширеним найпростішим паразитом є Cryptosporidium parvum, який викликає гостру діарею у людей та багатьох тварин. Передбачається, що білок споровиків, GP15/45/60, є зв'язаним GPI білком на основі послідовності ДНК, і моноклональні антитіла, які реагують із цим білком споровиків, інгібують інфекцію [Strong, W.B., et al., Infection and Immunity 68: 4117-4134, 2000; Cevallos, A.M., et al., infection and Immunity 68: 4108-4116, 2000]. Таким чином, С parvum є ще одним патогеном, на який може діяти PI-PLC. Прокаріотні бактерії не містять поверхневих глікопротеїнів та вуглеводів, зчеплених фосфатидилінозитом (McConville and Ferguson, supra), але PI-PLC все ж може зменшувати бактеріальні інфекції, заважаючи процесові приєднання. Патогенна Е. соlі та багато інших добре відомих патогенних бактерій Enterobacteriaceae експресують бактеріальний адгезин FimH, 29 kD манозозв'язувальний лектин, присутній на віддаленому кінці бахроми. [Abraham et al., Nature 336: 682-684, 1988]. Було виявлено, що цей адгезин зв'язується з CD48 мастоцитів, GPI-зчепленою молекулою. [Див. Malaviya et al., Proc. Nail. Acad, Sci. USA 96:8110-8115, 1999]. In vitro гідроліз за допомогою PI-PLC зменшував зв'язування мутантного GPl-зчепленого дифтеротоксинового (з Corynebacterium diphtheria) рецептора з NІНЗТЗ-клітинами мишей та щурів. [Див. Lanzrein et al, EMBO J. 15:725-734, 1996]. Крім того, альфа-токсин Clostridium septicum та аеролізин Aeromonas hydrophila обидва приєднуються до поверхні клітин за допомогою С-кінцевого GPI-зчеплення і можуть бути видалені з поверхні клітин під дією PI-PLC. [Див. Gordon et al., J. Biol Chem. 274:27274-27280,1999]. Механізм PI-PLC для зменшення впливу бактеріальної інфекції пов'язаний з відокремленням місця зв'язування CD48 від мастоцитів хазяїв. Зв'язування FimH з мастоцитами також започатковує запальну реакцію. Таким чином, згідно з даним винаходом, усунення місця зв'язування також має усувати запалення, яке може стати надмірним і шкідливим для самого стану кишечника, оскільки запальнареакція викликає вивільнення фактора некрозу пухлин a (Malaviya, supra). Отже, через цей механізм зменшення запалення та секреції фактора некрозу пухлин, яка лежить у його основі, фосфоліпазне лікування, згідно з даним винаходом, має послаблювати симптоми, які характеризують такі стани, як синдром подразненого кишечнику, коліт та хвороба Крона. [Див. van Deventer. S.J., Ann. Rheum. Dis. 58(1):I114-1120 (November 1999)]. Даний винахід також може бути ефективним проти вірусних інфекцій завдяки розриванню зв'язків між вірусними частинками та клітинами, які вірус може інфікувати in vivo. З огляду на виявлення авторами даного винаходу ефективності описаного перорального введення, цікавим є те, що попередня обробка вірусу грипу фосфоліпазою С, яка викликає вивільнення приблизно 50% фосфоліпіду вірусу, в результаті забезпечує значне зниження інфективності ембріонів курчат. [Див. Mizutani et al., Nature 204:781-782, 1964]. I навпаки, попередня обробка культивованих фібробластів ембріонів курчат фосфоліпазою С, виділених із Clostridium perfringens, помітно інгібує наступне інфікування клітин вірусом Semliki Forest. [Див. Friedman and Fasten, Proc. Natl. Acad. Sci. USA 59:1371-1378, 1968]. Хоча спеціалісти не вбачають у цих явищах ніякого терапевтичного значення, якщо поглянути в минуле, то можна побачити, що вони відповідають одному механізмові, який лежить в основі даного винаходу, а саме - розщепленню поверхневого ліганду патогену та/або спорідненого з ним рецептора клітинної мембрани, перешкоджаючи взаємодії, необхідній для інфекції. Ще одним шляхом ефективного застосування даного винаходу для запобігання вірусній інфекції є руйнування зв'язування вірусного GPI-зчеплених білків зі сприйнятливими клітинами. Прикладом вірусного GPI-зчепленого білка, який є чутливим до PI-PLC гідролізу, є вірус денге NS1 (неструктурний білок 1). [Див. Jacobs et al., FASEB J.14:1603-1610, 2000]. Існує кілька прикладів GPI-зчеплених білків клітин-хазяїв, які є місцями зв'язування для вірусів. До цих прикладів належать еховірус людини 6, 7, 12 та 21 і ентеровірус 70, які зв'язуються з GPI-зчепленим CD55 (фактор розпаду, DAF). [Див. Clarkson et al., J. Virology 69: 5497-5501,1995; Bergelson, et at., Proc. Natl Acad. ScL USA 91: 6245-6248, 1994; та Karnauchow, et al., J. Virology 70: 5143-5152, 1996]. Інфікування парвовірусом собачих (CPV) може бути блоковане in vitro шляхом попередньої обробки клітин котячих PI-PLC. [Див. Barbis and Parrish, Brazilian J. Med. Biol. Res. 27: 401-407, 1994]. Деякі рецептори клітинної поверхні, які нібито відіграють важливу роль у викликанні інфекцій, приєднують до мембран із застосуванням механізмів, відмінних від GPI-зчеплення. До них належать такі структури, як естери холестерину [Rostand and Esko, J. Biol. Chem. 268:24053-24059, 1993], нефосфорильовані глікосфінголіпіди [Karlsson, Ann Rev, Biochem 58: 309-350, 1989] та інші фосфоліпіди, такі як фосфатидилетаноламін та фосфатидилсерин. [Див. Sylvester, Infect. Immun. 64:4060-4066, 1996]. Отже, з вищевказаних причин обробка таких структур відповідними естеразами, цереброзидазами, карбогідразами та фосфоліпазами, які діють для відчеплення цих структур від поверхонь клітин, після перорального введення згідно з даним винаходом має сприятливий вплив на лікування від інфекцій травного тракту. Завдяки універсальному характерові фосфатидилінозит-зв'язаних поверхневих білків та вуглеводів в еукаріотах, терапевтична методологія даного винаходу, пов'язана з введенням ферменту, при гострих захворюваннях або профілактично, для розщеплення зчеплювального зв'язку для таких білків та/або вуглеводів клітинної поверхні, знаходить широке застосування у подоланні викликаних найпростішими, бактеріями, грибками та вірусами інфекцій травного тракту. З цієї точки зору головним аспектом даного винаходу є демонстрація того, що фермент, який не лише є активним у розщеплювальних компонентах поверхні клітин, може вводитись перорально як протиінфекційний агент і бути ефективним in vivo. Слід зважити, що хоча типовий придатний фермент, PI-PLC, є доступним з 1960-х років, цей підхід раніше ще не пропонувався. Ще одним аспектом даного винаходу є використання ферменту, як було описано вище, як ефективного протиінфекційного агента у кормі для тварин з метою лікування або зниження ризику інфекцій травного тракту у тварин, які вживають корм. Відомими є корми, які містять ендо-1,4-b-D-мананазу, і в деяких повідомленнях припускалася протигрибкова активність мананази. [Див. WO 00/21381 (РСТ/ЕР99/07835) та Kudo et al., Experentia 48:227-281, 1992]. У цих випадках мананазу комбінували з визнаним антибіотиком, хоча в цілому обговорювалася перспектива використання ферменту в кормах, які не містять антибіотиків. [Adams, Feed Mix (Special 2000), стор.16-18]. Таким чином, в одному з аспектів даний винахід стосується композицій, включаючи кормові композиції,які містять фермент, що характеризується вищезгаданою розщеплювальною активністю і не є мананазою або, точніше, ендо-1,4-b-D-мананазою, і відрізняється, наприклад, від мананоспрямованого ферменту іншою специфічністю розщеплення, як описано в [Enzyme nomenclature 1992 (Academic Press) (див. статті 3.2.1.77, 3.2.1.78, 3.2.1.101, 3.2.1.106, 3.2.1.130 та 3.2.1.137]. Крім того, даний винахід розглядає композицію, яка містить такий фермент, включаючи мананазу, але не містить ніяких інших протиінфекційних агентів. Таким чином, згідно з даним винаходом, позаклітинна ферментна композиція, одержана з Bacillus cereus і стандартизована щодо вмісту PI-PLC, може бути використана для досягнення дуже значного приросту ваги та перетворення корму у присутності інфекції. Цей результат є несподіваним, оскільки B. cereus є умовним патогеном, який зазвичай викликає гастроентерит, який переноситься з кормом, та ендофтальміт В. cereus. Раніше проведені дослідження показали, що зроблена кролям ін'єкція позаклітинного ферменту В. anthracis або В. cereus викликає фосфасемію і навіть смерть. Наприклад, [див. Stein and Logan, J. Bacteriol, 85:369-381, 1963]. Отже, несподіваним є те, що позаклітинний фермент із патогена, який викликає гастроентерит, згідно з даним винаходом має цілющий вплив по відношенню до хвороби, викликаної бактеріальною інфекцією. Bacillus cereus перетворює різноманітні діючі у позаклітинній мембрані ферменти та цитолітичні токсини, включаючи PI-PLC та Cereolysin AB, які складаються з фосфоліпази С та сфінгомієлінази. [Див. Gilmore, J. Bacteriol. 171:744-753, 1989]. У вищезгаданій ферментній композиції позаклітинну специфічну до фосфатидилінозиту фосфоліпазу С [Е.С. 3.1.4.10], вироблену В. cereus, вважають активним інгредієнтом. Ферментне лікування згідно з даним винаходом є ефективним протикокцидіозним і антибіотичним засобом. Отже, воно являє собою ефективний і реально здійсненний з комерційної точки зору підхід до лікування інфекцій травного тракту, особливо за умов заборони нині застосовуваних речовин. Якщо вони не є вкритими, ферменти здатні на необоротну інактивацію шлунковими рідинами. У [патенті США №4079125] описано поліпшені композиції кишкової дії, які містять вкритий фермент, для приймання ссавцями з дефіцитом ферментів. Несподівано було виявлено, що додавання PI-PLC до раціону тварин без покриття в результаті забезпечує ефективне лікування патогенних інфекцій. Ферментні композиції згідно з винаходом в оптимальному варіанті створюють як висушені, тверді або рідкі композиції для перорального введення. Такі композиції, як правило, включають стабілізатори, такі як буфер, вуглевод та/або гліколь. Висушені, стійкі при зберіганні композиції ферментів, згідно з даним винаходом придатні для включення до таблеток або капсул, одержують, наприклад, шляхом ліофілізації, розпилювального сушіння в сушарці з псевдозрідженим шаром з інертним або вуглеводним носієм, або шляхом застосування технологій випарювання у поєднанні зі склотвірними стабілізаторами. [Див. Franks et аl, Biopharm. 4:38-55,1 991]. Інший підхід пов'язаний з осадженням солей, наприклад, сульфату амонію або розчинника, так як за допомогою ацетону для утворення порошку, з наступним висушуванням та змішуванням з носієм. Деякі вуглеводи, зокрема, моносахариди, дисахариди та нижчі олігосахариди, є важливими склотвірними вуглеводами. Прикладами вуглеводів для застосування як носіїв є, крім інших, ксилоза, фруктоза, глюкоза, сорбіт та мальтотріоза, як описано Франксом (Franks, supra). В основі вибору вуглеводного носія лежить сумісність із ферментом, схильність до слабкого поглинання вологи та сприятлива крива склування. Стабілізатор грегалоза є особливо придатним для створення стійкого до температури біологічного середовища. [Див. патент США №4 891 319; Roser, Biopharm. 4 (8):47-53,1991; Colaco et al., Bio/Technology 10:1007-1011, 1992; Aldridge, Genetic Engineering News, March 15, 1995, стор.10-11]. Ферменти для даного винаходу приготовляють у рідкій формі, наприклад, як сиропи з сорбітом або гліцерином для зниження активності води та стабілізації білка. Такі розчини перед фармацевтичним застосуванням, як правило, стерилізують фільтруванням. Як зазначалося раніше, даний винахід в одному з аспектів стосується забезпечення ферменту як компонента корму або кормового продукту. Корми складаються, головним чином, із зернового матеріалу, джерела білка, вітамінів, амінокислот та мінералів. Зерновий матеріал зазвичай включає кукурудзу, сорго, пшеницю, ячмінь або овес. Джерелом білків можуть бути, наприклад, боби або горох. Прикладами мінералів, амінокислот та вітамінів є В12, вітамін А, пантотенова кислота, ніацин, рибофлавін, K, DL-метіонін, L-лізин, холінхлорид, фолієва кислота, дикальційфосфат, сульфонат магнію, сульфат калію, карбонат кальцію, хлорид натрію, селеніт натрію, оксид марганцю, йодат кальцію, оксид міді, оксид цинку та D-активований тваринний стерин. Для застосування в кормах рідку ферментну композицію приготовляють із сольовим розчином (наприклад, NaCI, 15-18% (маса/маса)) або сиропом для зниження активності води та запобігання розвиткові мікробів у концентрованому продукті. Прикладами інших випробуваних хімічних консервантів для кормів є бензоат натрію, пропілпарабен, сорбат натрію або калію та аскорбілпальмітат, які також застосовують для запобігання можливому псуванню через розвиток мікробів у продукті. [Див. Association of American Feed Control Officials, Inc., Official Publication 2000, Частина 18, "Chemical Preservatives", стор.215-217, ISBN 1-878341-11-1]. Ці консерванти можуть бути застосовані в кормах шляхом гранулювання з розведенням у великій кількості з застосуванням технології автоматичного розпилення. [Див. Fodge et al, Feedstuff's, September 29,1997]. Такі рідкі композиції можуть містити стабілізуючі вуглеводи, такі як сорбіт або гліцерин, якщо вони є сумісними. Для підвищення ефективності можуть бути включені матеріали, які є необхідними компонентами кормів, такі як інші ферменти або вітаміни, нестійкі при нагріванні. У випадках, коли корм застосовують у формі негранульованого місива (тобто без термообробки), ферменти для даного винаходу пропонуються у вигляді сухого концентрату для додавання у змішувач кормової суміші. Такі сухі ферментні концентрати одержують, спочатку концентруючи рідку ферментну композицію з використанням а 10 Kd NMWC або іншого підходящого ультрафільтра для досягнення високого відсоткового вмісту ферменту, а потім змішуючи з дуже сухим носієм, таким як кукурудзяна крупа, соєва крупа, або навіть з інертним матеріалом чи нерозчинною сіллю, прийнятною для використання в кормах. [Див. Official Publication, American Feed Control Officials, supra, Part 582, "Substances generally regarded as safe in animal feeds". Існує багато способів утворення ферментів для функціонування у травному тракті, достатньо стійких при низьких температурах, щоб витримувати процес гранулювання у кормодробарках, зберігаючи достатню активність. Загальновідомо, що модифікація структури білка, насамперед, через зміну кодуючої послідовності ДНК або, у другу чергу, через хімічну модифікацію, може надавати ферментам більшої стійкості проти інактивації. Ілюстрацією цього є застосування хімічного зшивання кристалів ферменту. [Див. Collins et al, Organic Process Research and Development 2(6):400-406, 1998]. Інший спосіб підвищення стійкості ферменту для даного винаходу пов'язаний зі зміною амінокислот шляхом мутагенез гена, який кодує потрібний фермент, або одержання генів чи частин генів для перестановок. [Див. Crameri et al., Nature 391:288-291, 1998; Arnold, Nature Biotechnol. 16:617-618, (1998); Zhao et al., Nature Biotechnol. 16:258-235, 1998; Zhao and Arnold, Protein Eng. 12:47-53, 1999]. Можливо також здійснити мутацію та відбір на "спрямовану еволюцію" ферментів з потрібними властивостями. Наприклад, [див. Giver et al., Proc. Natl Acad. Sci. USA 95:12809-12813,1998; Liao et al., Proc. Nat'I Acad. Sci. USA 83:576-580, 1986; Cherry et al., Nature Biotechnol. 17:379-384,1999]. Деякі модифікації білків, включаючи глікозилування, PEG-ілування та сукцинілування, також можуть підвищувати стійкість і змінювати оптимальні показники рН - характеристики, які можуть бути оптимізовані для ферменту, який має використовуватися згідно з даним винаходом. Таким чином, можуть бути застосовані відомі протоколи для одержання модифікованого ферменту для випробування згідно з прикладами, з метою перевірки придатності для способів згідно з винаходом. Ефективний спосіб вироблення PI-PLC було виявлено при клонуванні гена В. cereus у В. megaterium. Експресійна система [Rygus and Hillen, Appl. Microbiol. Bacteriol. 35:594-599,1991] використовує елементи з регулону ксилози Bacillus megaterium [Rygus et al., Arch. Microbiol. 155:535-542,1991] і постачалася на ринок від ВІОІОІ Corp. (Vista, California). Створювалося злиття між лідерною кодуючою послідовністю PI-PLC гена та першими трьома амінокислотами гена В. megaterium xylA у плазміді, стабілізованій резистентністю до тетрацикліну і регульованій чутливим до ксилози репресором. Штами цього типу з посиленою експресією забезпечують реальний засіб виробництва PI-PLC у промислових кількостях для включення до раціону тварин згідно з даним винаходом. Деякі ізоляти Bacillus cereus виробляють антибіотики, такі як тунікаміцин. [Див. Kamogashira et al., Agric. Biol, Chem. 52:859-861, 1988]. Ще один ізолят Bacillus cereus (ATCC 53522) описано у [патентах США №№4 877 738 та 5 049 379] як агент біоконтролю для запобігання загибелі рослин від мільдью та гнилі коренів рослин. Вважають, що цей вплив є результатом дії двох антибіотиків, які отримали назви "цвітерміцин," лінійний амінополіол, 396 Дальтон, та "антибіотик В", аміноглікозид. У прикладах, детально описаних нижче, можливість залучення цих двох антибіотиків усувалася через виключення можливих антибіотиків з низькою молекулярною масою з ферментної композиції. Зокрема, за допомогою мембрани з виключенням молекулярної маси 10 Kd концентрували безклітинний ферментативний бульйон. Для подальшої обробки використовували концентрат, який містить білок, більший за 10 Kd. Антибіотики малої молекулярної маси, такі як описані Гандельсманом (Handelsman, supra), проходять крізь цей фільтр. Крім того, застосовували осадження сульфату амонію, щоб осадити білки великої молекулярної маси, залишивши матеріали низької молекулярної маси у розчині. Після повторного розчинення осаду сульфату амонію одержаний в результаті ферментний розчин діалізували на буфері, піддаючи додатковій обробці з видаленням антибіотиків з низькою молекулярною масою. І нарешті, білок осаджували вдруге, знову з сульфатом амонію, для перенесення будь-якої решти сполук з низькою молекулярною масою до розчину. Комбіноване застосування цих чотирьох видів обробки майже виключає можливість зумовлення антибіотичного впливу, який спостерігають, антибіотиком з низькою молекулярною масою, який виробляється АТСС 6464 або АТСС 7004. Ферментативний бульйон також піддавали випробуванню випробувальним штамом Е. соlі на присутність антибіотика, але ніякої антибіотичної активності не було виявлено. Даний винахід далі описується з посиланням на нижчеподані пояснювальні приклади. Приклад 1. Одержання заморожених вихідних культур Bacillus cereus АТСС 6464 та АТСС 7004 Склянки з ліофілізованими клітинами з АТСС відкривали й інокулювали у висівне середовище, яке складалося з Amberferm 4015 (Red Star), 10г/л, Amberex 695 (Red Star), 5г/л, та хлориду натрію, 5г/л, рН7,0, і вирощували при 30°С. Первісну культуру наносили штрихуванням на агарові планшети з LB-бульйоном, отриману в результаті єдину колонію знову інокулювали у 20мл висівного середовища у 250мл колбі з перегородкою (ВеІІсо) і вирощували зі збовтуванням при 30°С. Коли густина культури досягала OD600 з показником 1,5, додавали стерильний гліцерин до приблизно 10% (об'єм/об'єм), і склянки, які містили 1,8мл культури, заморожували при -80°С. Приклад 2. Вирощування ізолятів АТСС 6464 та АТСС 7004 Bacillus cereus для одержання специфічної до фосфатидилінозиту фосфоліпази С У два ферментатори Biostat C, по 30 літрів кожен, подавали середовище такого складу у водопровідній воді: живильний бульйон №2 (Oxoid), 25г/л, триптон (Difco), 10г/л, екстракт дріжджів (Difco), 10г/л, та протиспінювач Mazu DPIOP Modi 1 (BASF), 0,1мл на літр. Первісний об'єм порції становив 9,5л, і бульйон стерилізували при 121°С протягом 40 хвилин. Первісний рівень рН доводили до 7,0 газоподібним аміаком після стерилізації. Висівні культури приготовляли у 500мл такого самого середовища у 4-літрових колбах для збовтування з перегородками з приєднаним через силіконову трубку аспіратором (ВеІІсо) зі з'єднувачем для інокуляції. Колби стерилізували в автоклаві при 121°С протягом 50 хвилин до інокуляції 1,8мл замороженої вихідної культури, одержаної з партії АТТС (Приклад 1). Культури з колби для висівання вирощували при 30°С протягом 5,5 години зі збовтуванням при 200об/хв в інкубаторі з регульованим середовищем (NBS модель G25). Перед інокуляцією культура АТСС 7004 мала показник OD600 1,53 і рН6,58. Культура АТСС 6464 мала OD600 1,28 і рН6,79. 500мл висівних культур інокулювали у the 30-літрові ферментатори і обробляли за таких умов: температура 30°С, змішування 600об/хв, повітряний потік 10 літрів на хвилину, і тиск 0,5бар. OD600 первісної культури становив 0,81. Через шість годин ферментацію припиняли з кінцевим показником OD600 22,1 (АТСС 7004) і 24,2 (АТСС 6464). Ферментація проходила без регулювання рН, і кінцевий показник рН становив 8,17 (АТСС 7004) і 8,13 (АТСС 6464). Бульйон забирали з ферментатора і охолоджували до 8°С перед подальшою обробкою. Ферментатори запускали вдруге, застосовуючи фактично ту ж саму процедуру з обома ізолятами АТСС Bacillus cereus. У цьому разі висівні культури використовували шість годин при OD600 2,86 (АТСС 7004) і 1,98 (АТСС 6464), та рН6,69 (АТСС 7004) і 6,65 (АТСС 6464). Основна ферментація тривала протягом 6,5 годин з кінцевим OD600 35,9 (АТСС 7004) і 33,6 (АТСС 6464). Кінцевий рівень рН становив 8,38 (АТСС 7004) і 8,47 (АТСС 6464) на час охолодження. Приклад 3. Видалення клітин шляхом фільтрації та концентрація ферменту PI-PLC Видаляли і промивали клітини з кожного з чотирьох ферментаторів, описаних у Прикладі 2, застосовуючи два послідовно з'єднані 3мм фільтри A/G Technology (UFP-500-K-6A) з порожніх волокон 500000 з виключенням молекулярної маси (500 Kd NMWC). Охолоджений бульйон перекачували крізь фільтри перистальтичним насосом при швидкості 2 літри на хвилину з рециркуляцією знову до резервуара для утримування. Розчинену речовину, яка містила фермент, збирали до резервуара, охолодженого на льоді. Первісний об'єм бульйону, що містив клітини, приблизно 9 літрів, концентрували до приблизно 2 літрів, і в цей момент розпочинали розчинення в 10мМ Tris-HCI, pH8,5. Після того, як було зібрано приблизно 14 літрів розчиненої речовини, промивання клітин припиняли. 500 Kd розчиненої речовини (приблизно 14 літрів з кожного ферментатора) концентрували, застосовуючи два послідовно з'єднані 0,5мм фільтри A/G Technology (UFP-10-C-4XTCA) з порожніх волокон 10000 з виключенням молекулярної маси (10 Kd). Застосовували такий самий спосіб перекачування з рециркуляцією концентрату, за винятком того, що розчинену речовину зливали. Кінцевий концентрат в об'ємі приблизно 500мл з кожного ферментатора зберігали для наступного етапу обробки. Приклад 4. Подальше очищення та концентрація ферменту PI-PLC 10 Kd ультрафільтрований концентрат (Приклад 3), одержаний після кожної ферментації Bacillus cereus, доводили до 80% насичення сульфатом амонію і перемішували на льоді протягом 60 хвилин. Розчин центрифугували протягом 15 хвилин при 6000об/хв у роторі Sorvall GSA. Спливаючий шар видаляли, а осад розчиняли у мінімальному об'ємі 10мМ Tris-HCI, 0,2мМ EDTA (рН7,5), а потім діалізували у холоді на тому самому буфері. Рівень білка у кожному концентраті вимірювали, застосовуючи аналіз зв'язування з барвником (BioRad), а рівень PI-PLC вимірювали [Hendrickson et al, Bioorg. Med. Chem. Letters 1:619-622,1991], застосовуючи спосіб виявлення на основі HPLC та флуоресцентний субстрат (Molecular Probes, Inc., Р-3764,1-піренбутил міоінозит-1-фосфат, літієва сіль). Нижче у Таблиці 1 показано зведені дані та прогнозовану приблизну чистоту і загальну кількість чистого ферменту, одержаного для кожної з чотирьох композицій. Ферментні композиції зберігали замороженими при -20°С до подальшої обробки. Таблиця 1 Зведені дані про аналіз необроблених ферментних композицій PI-PLC Фермент. композ. 1 2 3 4 1 2 Номер АТСС штаму 7004 6464 7004 6464 Білок, мг/л 1,86 1,44 1,35 2,06 Питома Заг. кільк. Білка Розрах. чистота, Заг. кільк. чистого активн. U/мг1 у композ., мг % PI-PLC, мг 1,75 0,52 4,42 1,72 325 345 208 256 2,92 0,867 7,36 1,95 9,49 2,99 15,3 5,00 U = одиниця = 1 мікромоль/хвилину На основі припущення, що 100% чистий білок має питому активність 60U/мг (Hendrickson, supra). Приклад 5. Об'єднання і концентрація ферментних композицій до застосування в раціоні тварин Ферментні композиції 1, 2, 3 та 4 об'єднували в загальному об'ємі 675мл. Поволі додавали сульфат амонію (492г) і розчин перемішували на льоді кілька хвилин Розчин центрифугували для збирання осаду. Гранульовану фракцію розчиняли у мінімальній кількості 20мМ фосфатного буфера (рН7,0). В результаті було одержано 70,9мл розчину з густиною 1,057г/см3. Концентрація білка становила приблизно 25,5мг/мл. Активність PI-PLC становила приблизно 1,13U/мг при розрахованій чистоті PI-PLC 1,88%. Увесь розчин заморожували при -20°С, давали відтанути і застосовували для рівномірної обробки 200 фунтів корму для курчат. Приклад 6. Клонування та експресія PI-PLC гена Bacillus cereus у Bacillus megaterium Секвенували ген, який кодує специфічну до фосфатидилінозиту фосфоліпазу С (PI-PLC). [Див. Kuppe et al, J. Bacteriol. 171:6077-6083, 1989]. Застосовуючи технологію полімеразної ланцюгової реакції (PCR), PI-PLC ген клонували з хромосомної ДНК Bacillus cereus (ATCC 6464). Застосовували вектор експресії, pMEGA (BIO 101, Vista, CA), для Bacillus megaterium. Було синтезовано два праймери PCR, а саме, 5'GACTAGTAATAAGAAGTTAATTTTG-3' (праймер 1) та 5'-CGGGATCC ATATTGTTGGTTATTGG-3' (праймер 2), з ділянкою Spel у праймері-1 та ділянкою ВаmHl у праймері-2. Посилений PCR PI-PLC ген лігували у Spel-BamHl ділянку pMEGA і одержували плазміду pCG682. PI-PLC білок зливали з першими трьома амінокислотами хуlА генного продукту в ділянці Spel у векторі експресії. Експресія PI-PLC гена відбувалася при регулюванні хуІА промотора. Ферментацію у колбі зі збовтуванням застосовували для визначення вироблення специфічної до фосфатидилінозиту фосфоліпази С у Bacillus megaterium. LB-бульйон з 10мг/мл тетрацикліну (20мМ) інокулювали з 0,2мл висівної культури і інкубували у струшувані при 37°С і 250об/хв. При OD600 приблизно 0,5 додавали 5г/л D-(+)-ксилози для утворення хуІА промотора. Через три години спливаючий шар збирали шляхом центрифугування. Активність специфічної до фосфатидилінозиту фосфоліпази С вимірювали способом флуоресцентного субстрату [Hendrickson, et al., Biochemistry 31: 12169-12172,1992; Hendrickson, Anal. Biochem. 219: 1-8, 1994], використовуючи 1-піренбутилміо-інозит-1 -фосфатний субстрат (Molecular Probes, Eugene, OR) і застосовуючи виявлення шляхом HPLC. Таблиця 2 Вимірювання експресії PI-PLC Випробуваний матеріал Частинки лізату клітин В. megaterium/pCG682 В. megaterium/pCG682 В. megaterium/pCG682 В. megaterium/pCG682 Додавання ксилози Питома активність (U/мг білка) + + 0 0,436 0 0,365 Частинки ферментативного бульйону 6. megaterium/pCG682 В. megaterium/pCG682 В. megatehum/pCG682 В. megaterium/pCG682 + + 0 4,087 0 4,56 Ці дані показують, що більша частина PI-PLC є позаклітинною, і що експресія відбувається лише після додавання D (+) ксилози (Таблиця 2). За розрахунками, цей рекомбінантний штам має щонайменше у 15 разів вищу продуктивність (мг/л/OD), ніж середній штам дикого типу, який вирощували у Прикладі 2. Приклад 7. Ферментація В. megaterium для вироблення PI-PLC В. megaterium/pCG682 описаний у Прикладі 6, використовували для вироблення PI-PLC шляхом ферментації. Середовище (РМ) для етапів висівання та ферментації містило 20г/л Amberferm 4015 (Universal Flavors Bionutrients, Indianapolis, IN), 10г/л екстракту дріжджів Amberex 695 (Universal Flavors Bionutrients, Indianapolis, IN), 10г/л NZ Case Plus (Quest International, Hoffman Estates, IL), 2,0г/л K2HPO4, 0,1г/л MgSO4×7H2O і спочатку 2,0г/л глюкози та 12,5мг/л тетрацикліну. Рівень рН доводили до 7,5. Етап висівання (500мл у 2,8-літровій колбі з перегородкою) започатковували шляхом інокуляції з замороженої висівної склянки і збовтування при 250об/хв і 30°С. Висівні склянки підготовляли шляхом додавання окремої колонії, яку вирощували на планшеті з LB-агаром, до 20мл РМ у 250мл колбі для збовтування. Після вирощування до приблизно 1,0 OD600 при 30°С додавали 5мл 50% стерильного гліцерину, змішували і розчин розподіляли по 2мл пластмасових стерильних склянках і заморожували при -60°С. 500мл висівні колби використовували після вирощування до приблизно 1,2-1,8 OD600 нм після 9 годин збовтування. Дві колби використовували для висівання у 60-літровий ферментатор, заповнений 50л того ж самого стерилізованого парою середовища. Тетрациклін стерилізували фільтруванням (0,2-мікронний фільтр) як 1% розчин у 40% етанолі і додавали після стерилізації та охолодження до 30°С. У ферментатори також додавали 0,1мл/л протиспінювача Mazu DF10PMOD11 (BASF, Gurnee, IL) у первісному об'ємі, який додавали у разі потреби для стримування піни під час ферментації. Робочі умови для етапу висівання у першому ферментаторі були такими: тиск від 0,5 до 2,5psig; температура 30°С±0,5°С; струшування при 200-450об/хв; барботування повітрям 25-50 SLPM; розчинений кисень >25%. Показник рН контролювали на рівні від 6,9 до 8,1, застосовуючи 21,25% Н3РО4 або 5N NaOH. Коли показник OD600 досягав 8-10, вміст використовували для висівання у 600-літровий ферментатор, що містив 425л такого самого середовища. Робочі умови 600-літрового ферментатора для продукування були такими: тиск від 0,5 до 2,5 psig; температура 30°С±0,5°С; струшування при 100-300об/хв; барботування повітрям 250-500 SLPM; розчинений кисень >25%. Показник рН контролювали на рівні від 6,9 до 8,1, використовуючи 21,25% Н3РО4 або 5N NaOH. Коли через 5 годин при OD600 приблизно 17 вичерпувалася початкова глюкоза, розпочинали подачу ксилози (яку було попередньо стерилізовано автоклавуванням при 121°С протягом 20 хвилин і яка складалася з 10кг D-(+)-ксилози та 10 літрів води). D-ксилозу отримували від Varsal Instruments, New Jersey. Подачу розпочинали при 25мл/хв і здійснювали на цій швидкості 1,5 години, а потім посилювали до 43мл/хв. Другу швидкість підтримували доти, доки не витрачалися всі 22,5 літра ксилози. Рівень розчиненого кисню підтримували, ступінчасто посилюючи барботування повітрям на 50 SLPM до 500 SLPM. По досягненні повітряного потоку 500 SLPM збільшували кількість обертів на хвилину. Ферментацію припиняли через 20 годин. За 17 годин накопичувалося 7440U/л (одиниці визначено у Прикладі 4). Ферментативний бульйон збирали, застосовуючи Pall Filtron CIO Skid та чотири модулі CellFlo Microgon (мембранні пори 0,2мкм, волокна діаметром 1мм, 3,3м2). Розчинену речовину, пропущену крізь 0,2мкм мембрану, концентрували, застосовуючи LT100 Pall Filtron Skid з ультрафільтраційною мембраною від AG/Technologies, розмір 85 10К. Об'єм кінцевого концентрату становив 10 літрів, і його заморожували при 20°С. Приклад 8. Ферментативний бульйон Bacillus cereus не мав антибіотичної активності Ферментацію з Bacillus cereus (ATCC 7004) здійснювали згідно зі способом, описаним у Прикладі 2, за винятком того, що первісний об'єм збільшували до 20 літрів. Випробування на присутність антибіотика здійснювали з В. coli MGI 655 як тестовим штамом з кінцевим ферментативним бульйоном або частково очищеним PI-PLC, приготовленим згідно зі способом, описаним у Прикладах 3-5. Випробування здійснювали шляхом аналізу на циліндрах. [Див. Brantner, Pharmazie 52 (1):34-40, 1997]. Чистої зони, яка свідчила б про антибіотичну активність, навколо циліндрів, що містили зразки ферменту, не спостерігали. Приклад 9 Випробування PI-PLC шляхом флуоресцентного аналізу мікротитрувальних планшетів Було розроблено удосконалене біохімічне випробування для PI-PLC способом Хендриксона (Hendrickson et al. (supra)), застосованим у Прикладі 4. Субстрат 4-метилумбелліферил-міо-інозит-1-фосфату, N-метилморфолінову сіль отримували від Biosynth (Naperville, Illinois). Реакції спостерігали у зчитувальному пристрої для флуоресцентного аналізу мікротитрувальних планшетів Flouroscan II від МТХ Lab Systems (Vienna, Virginia). Для аналізу ферментативного бульйону або ферментних концентратів у чорних пластмасових мікротитрувальних планшетах приготовляли 200мкл реакційної суміші, яка складалася з 10мМ Tris-CI, 0,16% деоксихолату, 0,8мМ 4-метилумбелліферил-міо-інозит-1-фосфату, N-метил-морфолінової солі та розведеного ферменту, рН8,0. Розведення ферменту в разі потреби здійснювали у 0,1% розчину BSA у воді. Реакцію проводили при 37°С протягом 30 хвилин зі зчитуванням з 2-хвилинними інтервалами для спостереження вивільнення метилумбелліферону з субстрату зі збудженням при 350нм та емісією при 450нм. Для розрахунку одиниць (мікромолів на хвилину), утворених на кількість доданого ферментного розчину, застосовували кореляцію одиниць флуоресценції з мікромолями метилумбелліферону. Реакція при рН8,0 являє собою компроміс між рівнем рН, оптимальним для ферменту, та рівнем рН для максимальної флуоресценції метилумбелліферону (рН10). Крім того, при рН9,0 і вище швидкість неферментного вивільнення метилумбелліферону стає значною. За цих умов аналізу питома активність (ОД/мг) є приблизно у 39,3 рази вищою, ніж при застосуванні способу Hendrickson et al, (supra). Для ефективності випробувань в експериментах з раціоном тварин одиниці, виміряні з застосуванням цього аналізу, перетворювали на еквівалентні одиниці Хендриксона для можливості порівняння з першими випробуваннями до застосування цього аналізу. Приклад 10. Аналіз PI-PLC, який додавали в ефективних дозах до раціону тварин Для вимірювання ферменту після додавання до раціону тварин було розроблено аналіз PI-PLC на основі більш чутливого варіанта 4-метилумбелліферил міо-інозит-1-фосфату, N-метил-морфолінової солі (Приклад 9), який передбачає один рівень рН для аналізу та інший рівень рН для вимірювання флуоресценції. Фермент видобували з кормового матеріалу для випробувань шляхом зважування 4г корму та додавання його до 20мл 10мМ Tris-CI (рН7,5) з 0,1% деоксихолату для одержання 20г/л. Цю суспензію струшували у струшувачі NBS G-25 (New Brunswick Scientific) протягом 1 години при кімнатній температурі і 250об/хв. Суспензію центрифугували при 13000об/хв у мікроцентрифузі ІЕС Micromax з 1,5мл пробірками для мікроцентрифугування. Відповідне розведення екстрактів здійснювали у 0,1% BSA (альбумін сироватки великої рогатої худоби). Зразки, видобуті з корму при 10ОД/lb, не розводили. Перший етап реакції. Пробірки готували таким чином. Включали пробірки зі стандартним 1:100 або 1:200 розведенням 0,12Од/мл PI-PLC (одиницю визначено як у Прикладі 4) та чисті пробірки. Зразки реакційної суміші мали бути накриті плівкою для захисту субстрату від світла. 20мкл Tris-Hcl, 0,10 М, рН6,0 40мкл деоксихолату (0,8%) 40мкл PI-PLC-субстрату (4мМ) 100мкл ферменту 200мкл/пробірку Total React при 25°С У два моменти часу (30хв та 60хв) забирали 0,10мл кожної реакційної суміші. Аліквоти нагрівали при 65°С протягом 15 хвилин для зупинення ферментної реакції і охолоджували на льоді. І нарешті, зразки центрифугували при 12000об/хв у мікроцентрифузі протягом 5 хвилин. Флуорометричні показники. 120мА 0,10М Tris-буфера (рН8,0). Tris-буфер додавали у мікротитрувальну лунку в чорному пластмасовому планшеті, після чого перед зчитуванням, описаним у Прикладі 7, додавали 80мкл реакційної суміші. Віднімали фоновий контрольний рівень. Розраховували швидкість вироблення одиниць флуоресценції за хвилину. Одиниці флуоресценції перетворювали на мікромолі продукту реакції і розраховували кількість одиниць ферменту, видобутого на первісний фунт корму. Приклад 11. Випробування корму для курчат шляхом піддання дії патогену І. Годування курчат-бройлерів. Випробування І Здійснювали перше випробування з годуванням, починаючи з самців курчат-бройлерів одноденного віку. У формі місива приготовляли типовий однорідний раціон "початкового корму" для курчат, який за характеристиками відповідав або перевищував вимоги для продуктів живлення для птахівництва Національної ради з досліджень (nutrient requirements for poultry (9thed., 1994)). Курчат розсаджували у клітки (площею 12´24 дюйми) по чотирьох дослідних групах, причому кожна група розподілялася на чотири однакові підгрупи, які складалися з шести птахів на одну клітку (Таблиця 3). Воду та корм давали без обмежень протягом усього 21денного періоду випробування. Курчат по клітках і клітки по групах розподіляли шляхом рандомізації по групах. Усі клітки, годівниці та напувалки перед початком випробування піддавали дезінфекції. Освітлення лампами розжарювання було безперервним (24 години на добу). Масу тіла визначали на перший та 21-й день. Споживання їжі вимірювали на 21-день. На 5-й день кожного з курчат пероральним шляхом інфікували 200000 ооцист Eimeria acervulina. На 7-й день усіх птахів додатково інфікували 500000 Clostridium perfringens через споживання ними води. Негативні контрольні групи (Т1) лікуванню від інфекції не піддавали. Позитивним контрольним групам (Т2) з кормом давали антикокцидіозні та антибіотичні засоби. Це були засіб антикокцидіозного лікування Sacox (60г/тонну саліноміцину) та антибіотик BMD-50 (50г/тонну). Для підданих лікуванню груп, Т3 та Т4, застосовували оброблений ферментом PI-PLC дикого типу корм (приблизно 0,34г PI-PLC на чистій основі), починаючи з п'ятого дня під час перорального введення Eimeria acervulina. Увесь корм приготовляли однією однорідою партією, а потім розділяли для додавання антибіотика (Дослідна група Т2) та ферменту (Дослідні групи Т3 та Т4). Результати аналізу маси птахів представлено в Таблиці 4, а розрахунки годування/додавання у вазі представлено в Таблиці 5. Таблиця 3 Експериментальна обробка корму для курчат-бройлерів. Випробування 1 Дослідна група № Назва випробування Т1 Негативний контроль Т2 Позитивний контроль Т3 PI-PLC дикого типу Т4 PI-PLC дикого типу Випробуваний матеріал Немає Антикокцидіозне та саліноміцинове лікування 0,34г ферменту на тонну (чиста основа) 0,34г ферменту на тонну Підгрупи Курчат на підгрупу 4 6 4 6 4 6 4 6 (чиста основа) Таблиця 4 Середня маса тіла (г) через 21 день Підгрупа 1 2 3 4 Середн. STAT S.D. C.V. Лікування Т1 323,00 326,67 299,33 211,67 290,17 b 46,52 16,03 Т2 341,67 321,33 337,33 254,00 313,58 b 35,22 11,23 Т3 377,83 383,83 378,83 374,33 378,71 а 3,40 0,90 Т4 366,67 361,17 361,33 403,40 373,14 а 17,61 4,72 Таблиця 5 Середнє Перетворення корму (0-21 днів) з поправкою на масу загиблих птахів Підгрупа 1 2 3 4 Середн. STAT S.D. C.V. Лікування Т1 1,486 1,562 1,524 1,760 1,583 b 0,11 6,68 Т2 1,569 1,532 1,562 1,462 1,531 b 0,04 2,78 Т3 1,407 1,423 1,432 1,438 1,425 a 0,01 0,82 Т4 1,445 1,421 1,406 1,404 1,419 a 0,02 1,17 В обох представлених вище таблицях, середні значення в ряду без літер мають значні розбіжності (Р
ДивитисяДодаткова інформація
Назва патенту англійськоюFormulation for oral use in fowls and animals for treating or decreasing risk of infections of digestive tract (variants), use of composition (variants), method for treating or decreasing risk of infections of digestive tract (variants)
Автори англійськоюLiu Lin, Hsiao Humg-Yu
Назва патенту російськоюКомпозиция для перорального введения птицам и животным для лечения или снижения риска инфекции пищеварительного тракта (варианты), ее применение (варианты) и способ лечения или снижения риска инфекции пищеварительного тракта (варианты)
Автори російськоюЛиу Лин, Хсиао Хумг-Ю
МПК / Мітки
МПК: A23K 1/165, A61K 38/43, A61K 38/48
Мітки: інфекції, спосіб, травного, введення, птахам, зниження, інфекцій, ризику, перорального, травног, тракту, тваринам, застосування, лікування, композиція, варіанти
Код посилання
<a href="https://ua.patents.su/19-78486-kompoziciya-dlya-peroralnogo-vvedennya-ptakham-ta-tvarinam-dlya-likuvannya-abo-znizhennya-riziku-infekci-travnogo-traktu-varianti-zastosuvannya-varianti-ta-sposib-likuvannya-abo-zn.html" target="_blank" rel="follow" title="База патентів України">Композиція для перорального введення птахам та тваринам для лікування або зниження ризику інфекції травного тракту (варіанти), її застосування (варіанти) та спосіб лікування або зниження ризику інфекцій травног</a>
Попередній патент: Спосіб визначення товщини окремих шарів багатошарової полімерної плівки
Наступний патент: Спосіб вилучення германію з надсмольної води коксохімічного виробництва
Випадковий патент: Спосіб лікування дітей, хворих на атопічний дерматит