Фенілпіперазини
Номер патенту: 74426
Опубліковано: 15.12.2005
Автори: Ронкен Ерік, Крузе Корнеліс Г., Фенстра Рулоф В., Маккрірі Ендрю, ван Шарренбург Густаф Й.М.
Формула / Реферат
1. Похідні фенілпіперазину формули (1)
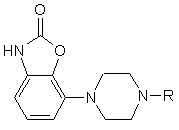 , (1)
, (1)
де R - група формули (а) або (b),
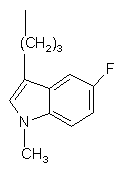 , (a)
, (a)
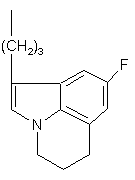 , (b)
, (b)
та їхні солі.
2. Спосіб одержання сполуки за п. 1, який відрізняється тим, що сполуку формули (2)
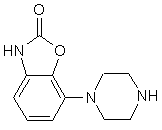 (2)
(2)
піддають реакції в основних умовах зі сполукою формули L-(a) або L-(b),
де L - відщеплювана група, а (а) та (b) мають значення, вказані в п. 1.
3. Фармацевтична композиція, що містить як діючу речовину принаймні одну сполуку за п. 1.
4. Спосіб лікування хвороби Паркінсона, який відрізняється тим, що використовують сполуку за п. 1.
5. Спосіб лікування розладів ЦНС, наприклад шизофренії, неспокою та депресії, який відрізняється тим, що використовують сполуку за п. 1.
Текст
Винахід стосується нових похідних фенілпіперазину формули (1): (1) де R - група формули (а) або (b) та їх солей. Встановлено, що сполуки згідно з винаходом виявляють високу спорідненість як до рецептора допаміну D2, так і до сайту повторного засвоєння серотоніну. Така комбінація придатна для лікування психічних розладів типу шизофренії (лікує як позитивні, так і негативні симптоми) та інших психічних захворювань. Ці сполуки виявляють активність як (часткові) агоністи, що робить їх також придатними для лікування хвороби Паркінсона. Зазначені сполуки виявляють антагоністичну активність щодо рецепторів допаміну D 2, антагонізуючи викликану апоморфіном лазальну поведінку в мишей. Вони також діють як інгібітори повторного засвоєння серотоніну, потенціюючи викликану 5-НТР поведінку в мишей. Ці сполуки виявляють активність у терапевтичних моделях, чутливих до клінічно дійових антипсихотиків [наприклад, реакція зумовленого уникання; Van der Heyden & Bradford, Behav.Brain Res., 1988, 31: 61-67] та антидепресантів і анксіолітиків [наприклад, придушення спричиненої стресом вокалізаціях; van der Poel et al., Psychopharmacology. 1989, 97: 147-148]. Вони активні у клінічно дійових моделях для хвороби Паркінсона [наприклад, обертальна поведінка у щурів; U.Ungerstedt, Acta Ph ysiol. Seand., 1971, 82 (suppl.367): 69-93]. У протилежність клінічно дійовим антагоністам рецептора D 2, зазначені сполуки не схильні викликати каталепсію в гризунів і як такі, скоріш за все, спричинюють менше екстрапірамідальних бічних явищ, ніж відомі антипсихотичні ліки. Здатність інгібувати повторне засвоєння серотоніну, притаманна цим сполукам. може пояснювати лікувальну дію, що має місце у моделях поведінки, чутливи х як до антидепресантів, так і до анксіолітиків. Ці сполуки можна застосовувати для лікування порушень або хвороб центральної нервової системи, спричинених збуреннями допамінергічної або серотонергічної системи, наприклад, агресивності, непокоїв, аутизму, запаморочення, депресії, розладів судження або пам’яті, хвороби Паркінсона, а також шизофренії та інших психічних розладів. Фармаційно прийнятними кислотами, з якими сполуки за винаходом можуть утворювати придатні кислі адуктні солі, є, наприклад, соляна кислота, сірчана кислота, фосфорна кислота, азотна кислота, а також органічні кислоти, як от лимонна, фумарова, малеїнова, винна, оцтова, бензойна, р-толуолсульфонова, метансульфонова та нафталінсульфонова кислоти. Сполукам та їхнім адуктним солям можна надавати форми, зручної для введення, за допомогою відомих способів з застосуванням допоміжних речовин, наприклад, рідких та твердих носіїв. Сполуки формули (1) можна приготувати реакцією сполуки формули (2) за основних умов зі сполукою формули L-(a) чи L-(b) де значення формул (а) та (b) наведені вище, a L - так звана відщеплювана група, наприклад, атом водню або мезилатна група. Піперазин формули (2) можна одержати, як описано [у заявці ЕР 0189612]. Вихідні матеріали формули L(a) можна одержати за схемою: Сполуку 1р2 можна одержати з 1р1 таким само чином, як сполуку 2р4, тобто сполуку L-(b), де L мезилатиа група, зі сполуки 2рЗ (див. нижче схему В). Винахід пояснюється наступними прикладами. Приклад 1 18,1г (0,1моля) 2р1 розчиняють у 250мл СH2Сl2 та охолоджують до 0°С. До розчину СH2Сl2 додають розчин, одержаний виливанням 50мл концентрованої сірчаної кислоти на 200г криги. Одержану суміш витримують при 0°С на крижано-ацетоновій бані. До зазначеного розчину додають по краплинах 8,3г (0,12моля) NaNO2, розчиненого у 50мл води, утримуючи температуру нижче 2°С. Перемішують протягом 1 години. Після того відокремлюють органічну фазу, водну фаз у екстрагують один раз (СH2Сl2), з’єднані органічні фази сушать над MgSО 4. С ушильний агент відфільтровують, фільтрат концентрують у вакуумі та одержують 17,8г (вихід 99%) сирих темно-жовтих кристалів 2р2. В атмосфері азоту розчин 17,8г (0,099моля) 2р2 у 100мл сухого те трагідрофурану (ТГФ) додають дуже обережно по краплинах до суспензії LіA1H4 (9,75г, 244ммоля) у зрошувальному сухому ТГФ. По закінченні цього додання одержаній суміші дають реагувати ще протягом 40 хвилин. Реакційну суміш доводять до кімнатної температури й охолоджують далі на крижано-етаноловій бані. Після того додають: 9,75мл суміші 1:1 вода-ТГФ, 18,5мл водного розчину 2N NaOH та 18,5мл води. Одержану суміш зрошують 20 хвилин. Після охолодження реакційну суміш фільтрують на фільтрі Гайфло. фільтрат концентрують у вакуумі й одержують 15,9г осаду. Останній розчинюють у 98мл 1N НСІ у ЕtOАс, осад відфільтровують і одержують 17,5г (вихід 87%) 2р3.НСl. 17,5г (86ммолів) 2р3.НСІ розчинюють у суміші 190мл етиленгліколю та 90мл води, одержаний розчин нагрівають до 95°С. Після того додають по краплинах 7,96г (94,6ммолів) (3,4)-дігідро-2Н-пірану. По закінченні додання перемішують ще 3 години при 95°С. Коли реакційна суміш досягає кімнатної температури, додають воду та тро хи розсолу і провадять екстракцію 3 обсягами EtOAc. Органічні фази зливають, промивають водою, водним розчином NaHSО3, водою, водним розчином NaHCО3, водним розчином NaCl відповідно, після чого сушать органічну фазу над Na2SO4 . Після видалення сушильного агента та розчинника осад очищують колонковою хроматографією (SiО2, елюент 3 МеОН:97 СH2Сl2), одержуючи 12г (вихід 63%) темно-червоної олії з вмістом відповідного спирту, з якої на повітрі твердне 2р4. Після того спирт перетворюють на його мезилат відомими способами (MsCl, діізопропилетиламін у СH2Сl2, 0°С), одержуючи 2р4 (вихід 98%). Фенілпіперазин формули (2) реагує з 2р4, як описано [у заявці ЕР 0900792], даючи сполуку (1). де R група формули (b) (точка топлення 182-185°С). Приклад 2 1p1 перетворюють на 1р2 аналогічно приготуванню 2р4 у прикладі 1. 1р2 перетворюють на 1р3 за методикою, описаною [в Rajan Babu et al., J.Org.Chem., 51 (1986), 1704]. В атмосфері азоту 31,9г (103ммоля) 1р3 розчинюють у 49мл діметилформаміду (ДМФ). Одержаний розчин потроху додають до розчину, який містить 5,88г (134ммоля) оліїстої суспензії з вмістом 55% NaH у 148мл ДМФ, та перемішують ще годину при кімнатній температурі, далі охолоджують реакційну суміш на кризі з водою. До одержаного розчину додають по краплинах 8,34мл (19,02г, 134ммоля, 1,3 г-екв) МеІ, розчиненого у 49мл ДМФ. Реакційну суміш перемішують 16 годин при кімнатній температурі. До неї додають воду та провадять екстракцію 2 обсягами Et2O, органічну фазу промивають двічі водою та один раз розсолом, а за бажанням сушать над MgSO4. Після видалення сушильного агента та розчинника у вакуумі осад піддають колонковій хроматографії (SiO2, елюент 3 СH2Сl2:1 гексан), одержуючи 26,2г (вихід 79%) 1р4 у вигляді жовтавої олії. В атмосфері азоту 25,03г (78ммолів) 1р4 розчинюють у 110мл ТГФ, після чого додають 93мл (0,93ммоля, 1,2 г-екв) 1N (nBut)4N+F- у ТГФ. Після годинного перемішування додають Et2O, одержану суміш тричі промивають водою і один раз розсолом. Органічну фазу сушать над Na2SO4. Після видалення сушильного агента та розчинника осад зсипають до толуолу, а потім концентрують у вакуумі для видалення слідів (трет)бутилтриметилсілилфториду. Осад піддають випарювальній хроматографії (SiO2, елюент Et2О), одержуючи 14,8г (ви хід 92%) 1р5. 1,69г (6,45ммоля) РРh3 та 0,44г (6,44ммоля) імідазолу розчинюють у 20мл СH2Сl2, після чого потроху додають 1,64г (6,45ммоля) йоду. Реакційну суміш перемішують 30 хвилин при кімнатній температурі. До неї повільно додають 1,07г (5,16ммоля) 1р5, розчиненого у 10мл СH2Сl2. За 30 хвилин реакційну суміш промивають водним розчином NaHSO3 та розсолом, а органічну фазу, що лишилася, сушать над. Після видалення сушильного агента та розчинника у вакуумі осад розчинюють у Na2SO4 Еt 2О та відфільтровують одержаний осад Рh3РО. Фільтрат концентрують у вакуумі, осад очищують випарювальною хроматографією (SiO2, елюент 1 СH2Сl2:1 гексан) і одержують 1,45г (вихід 88%) цільового йодиду 1р6. Фенілпіперазин формули (2) реагує з 1р6, як описано [у заявці ЕР 0900792], даючи сполуку (1), де R група (а) (точка топлення 202-204°С).
ДивитисяДодаткова інформація
Назва патенту англійськоюPhenylpiperazines
Автори англійськоюVeenstra Roelof W., Kruse Cornelis G., Kruse, Cornelis G., van Scharrenburg Gustaaf J.M.
Назва патенту російськоюФенилпиперазины
Автори російськоюФенстра Рулоф В., Крузе Корнелис Г., ван Шарренбург Густаф Й.М.
МПК / Мітки
МПК: C07D 471/06, C07D 413/12, A61P 25/00, A61P 25/22, A61K 31/496, A61P 25/24, A61P 25/16, A61P 43/00
Мітки: фенілпіперазини
Код посилання
<a href="https://ua.patents.su/2-74426-fenilpiperazini.html" target="_blank" rel="follow" title="База патентів України">Фенілпіперазини</a>
Попередній патент: Модульний хопер-вагон
Наступний патент: Лікарський препарат протидіабетичної дії на основі гліклазиду
Випадковий патент: Вітросилова установка






