Спосіб одержання гібридного насіння, використовуючи умовну жіночу стерильність, експресійна касета, промотор, активний переважно в жіночих репродуктивних органах (варіанти), рослина та її насіння (варіанти)
Номер патенту: 73070
Опубліковано: 15.06.2005
Автори: Кроссленд Лайл Дін, Харпер Стейсі Мерайя, Паскаль Еріка
Формула / Реферат
1. Спосіб одержання гібридного насіння, який включає:
(а) одержання рослини з умовною жіночою стерильністю, яка містить промотор, активний переважно в жіночих репродуктивних органах, вибраний із групи, яка включає промотор, виділений із геномного клону кукурудзи, що має реєстраційний номер NRRL В-21920; промотор, виділений із геномного клону пшениці, що має реєстраційний номер NRRL B-21655; і промотор, виділений із геномного клону пшениці, що має реєстраційний номер NRRL B-21919; функціонально з'єднаний з кодуючою послідовністю, яка кодує фермент, який каталізує перетворення прототоксину на токсин,
(б) висаджування рослини з умовною жіночою стерильністю з чоловічою стерильною рослиною,
(в) індукування жіночої стерильності застосуванням прототоксину до рослини з умовною жіночою стерильністю, і
(г) одержання гібридного насіння.
2. Спосіб за п. 1, який відрізняється тим, що вищезгадана рослина є рослиною, якій за нормальних умов властиве самозапилення.
3. Спосіб за п. 1, який відрізняється тим, що вищезгадана рослина є рослиною, якій за нормальних умов властиве перехресне запилення.
4. Спосіб за п. 2, який відрізняється тим, що вищезгаданою рослиною, якій за нормальних умов властиве самозапилення, є пшениця.
5. Спосіб за п. 2, який відрізняється тим, що вищезгаданою рослиною, якій за нормальних умов властиве самозапилення, є ячмінь.
6. Спосіб за п. З, який відрізняється тим, що вищезгаданою рослиною, якій за нормальних умов властиве перехресне запилення, є кукурудза.
7. Спосіб за п. 1, який відрізняється тим, що вищезгаданим промотором, активним переважно в жіночих репродуктивних органах, є промотор, виділений із геномного клону кукурудзи, що має реєстраційний номер NRRL В-21920.
8. Спосіб за п. 1, який відрізняється тим, що вищезгаданим промотором, активним переважно в жіночих репродуктивних органах, є промотор, виділений із геномного клону пшениці, що має реєстраційний номер NRRL B-21655.
9. Спосіб за п. 1, який відрізняється тим, що вищезгаданим промотором, активним переважно в жіночих репродуктивних органах, є промотор, виділений із геномного клону пшениці, що має реєстраційний номер NRRL B-21919.
10. Спосіб за п. 1, який відрізняється тим, що вищезгадану кодуючу послідовність, яка кодує фермент, який каталізує перетворення прототоксину на токсин, одержують з гена, вибраного з групи, яка складається з гена argЕ, гена Р450sul-монооксигенази і гена pehA.
11. Спосіб за п. 10, який відрізняється тим, що вищезгадану кодуючу послідовність одержують з гена argЕ.
12. Спосіб за п. 1, який відрізняється тим, що вищезгаданим прототоксином є ацетил-фосфінотрицин.
13. Експресійна касета, яка містить промотор, активний переважно в жіночих репродуктивних органах, вибраний із групи, яка включає промотор, виділений із геномного клону кукурудзи, що має реєстраційний номер NRRL B-21920; промотор, виділений із геномного клону пшениці, що має реєстраційний номер NRRL В-21655; і промотор, виділений із геномного клону пшениці, що має реєстраційний номер NRRL B-21919; функціонально з'єднаний з кодуючою послідовністю, яка представляє інтерес, яка кодує фермент, який каталізує перетворення прототоксину на токсин.
14. Експресійна касета за п. 13, яка відрізняється тим, що вищевказану кодуючу послідовність одержують з гена, вибраного з групи, яка складається з гена argЕ, гена Р450sul-монооксигенази і гена реhА.
15. Експресійна касета за п. 14, яка відрізняється тим, що кодуючу послідовність одержують з гена argЕ.
16. Експресійна касета за п. 14, яка відрізняється тим, що кодуючу послідовність одержують з гена Р450sul-монооксигенази.
17. Експресійна касета за п. 14, яка відрізняється тим, що кодуючу послідовність одержують з гена pehA.
18. Експресійна касета за п. 13, яка відрізняється тим, що вищезгаданий промотор, активний переважно в жіночих репродуктивних органах, виділяють із геномного клону кукурудзи, що має реєстраційний номер NRRL B-21920; і кодуючу послідовність, яка представляє інтерес, одержують з гена argЕ.
19. Експресійна касета за п. 13, яка відрізняється тим, що вищезгаданий промотор, активний переважно в жіночих репродуктивних органах, виділяють із геномного клону пшениці, що має реєстраційний номер NRRL В-21655; і кодуючу послідовність, яка представляє інтерес, одержують з гена argЕ.
20. Експресійна касета за п. 13, яка відрізняється тим, що вищезгаданий промотор, активний переважно в жіночих репродуктивних органах, виділяють із геномного клону пшениці, що має реєстраційний номер NRRL В-21919; і кодуючу послідовність, яка представляє інтерес, одержують з гена argЕ.
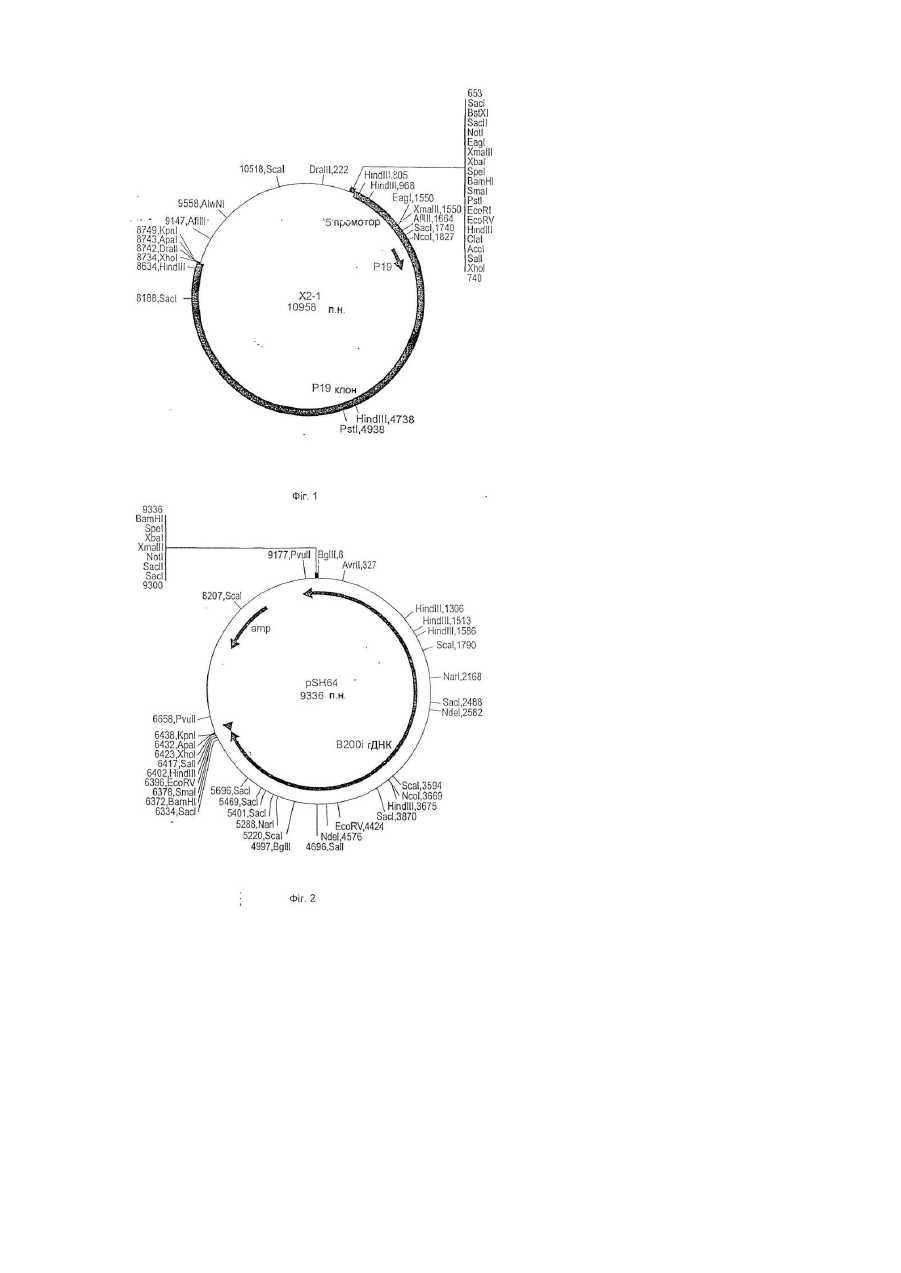
21. Промотор, активний переважно в жіночих репродуктивних органах, який можна виділити з геномного клону В200i4-2, що має реєстраційний номер NRRL B-21920.
22. Промотор, активний переважно в жіночих репродуктивних органах за п. 21, який відрізняється тим, що вищезгаданий промотор містить нуклеотиди 1 – 1390 SEQ ID NO:11.
23. Промотор, активний переважно в жіночих репродуктивних органах, який можна виділити з геномного клону Р26, що має реєстраційний номер NRRL В-21655.
24. Промотор, активний переважно в жіночих репродуктивних органах за п. 23, який відрізняється тим, що вищезгаданий промотор має послідовність, наведену в SEQ ID NO:2.
25. Промотор, активний переважно в жіночих репродуктивних органах, який можна виділити з геномного клону Р19, що має реєстраційний номер NRRL В-21919.
26. Промотор, активний переважно в жіночих репродуктивних органах за п. 25, який відрізняється тим, що вищезгаданий промотор містить нуклеотиди 1 – 1093 SEQ ID NO:14.
27. Рослина, яка містить експресійну касету за п. 13.
28. Рослина, яка містить експресійну касету за п. 15.
29. Рослина, яка містить експресійну касету за п. 18.
30. Рослина, яка містить експресійну касету за п. 19.
31. Рослина, яка містить експресійну касету за п. 20.
32. Насіння рослини за п. 27, яке містить експресійну касету за п. 13.
33. Насіння рослини за п. 28, яке містить експресійну касету за п. 15.
34. Насіння рослини за п. 29, яке містить експресійну касету за п. 18.
35. Насіння рослини за п. 30, яке містить експресійну касету за п. 19.
36. Насіння рослини за п. 31, яке містить експресійну касету за п. 20.
Текст
Ця заявка затверджує права попередньої заявки США №60/039527, зареєстрованої 3 березня 1997 року. Галузь винаходу Цей винахід стосується одержання гібридного насіння рослин. Зокрема, винахід стосується способу одержання гібридного насіння, використовуючи як одну батьківську рослину гібриду рослину, трансформовану рекомбінантним геном, який, якщо експресується в жіночих репродуктивних структурах, дає протеїн, що каталізує перетворення застосовуваного екзогенно прототоксину на токсин, таким чином роблячи запліднення неефективним. Винахід також стосується використання умовно-стерильних жіночих рослин разом з умовностерильними чоловічими рослинами для більш продуктивного одержання гібридного насіння; рекомбінантних геномів, корисних для винаходу; трансгенних рослин, що містять рекомбінантні геноми; та нових промоторів, корисних для експресії в жіночих репродуктивних стр уктурах рослини. Рівень техніки Значну увагу привертає гетерозис в сільськогосподарських культурах завдяки його помітному впливу на збільшення врожаю. Підвищена продуктивність при схрещуванні різних сортів кукурудзи була вперше виявлена наприкінці 19 сторіччя і відтоді розвивалася згідно з методичними генетичними процедурами. Звичайним способом для підвищення врожаю гібридної кукурудзи є створення багатьох інбредних ліній, одержання інтеркросів і визначення, які гібриди є більш продуктивними в певній місцевості. Успіх гібридної кукурудзи став причиною для селекціонерів рослин для вивчення існування та важливості гібридної сили в багатьох інших видах, які є економічно важливими. Загалом, гібриди виявляють підвищений вихід врожаю в порівнянні з негібридними сортами. Гібриди зазвичай більш придатні для використання факторів росту і дають більший ефект на одиницю факторів росту, таких як вода та добриво. В стресових умовах гібриди загалом мають перевагу над батьківськими сортами за рахунок більш стабільної продуктивності в широкому діапазоні умов навколишнього середовища. Гібридам властива одноманітність насіння або плодів та термінів достигання, що часто полегшує збирання врожаю та підвищує цінність продукції на ринку. Гібрид може також поєднувати риси, які важко або неможливо поєднати іншим способом. Це особливо стосується багатьох міжвидових та міжродових гібридів. Загальним висновком з дослідження є те, що гібридна сила, звичайний феномен рослин, має достатню значимість для виправдання комерційного використання за умови винайдення відповідних способів. Протягом багатьох років гібридну силу визначали як широкорозповсюджений феномен рослин і тварин. Комерційні гібриди багатьох сільськогосподарських культур широко використовуються. До них належать кукурудза, сорго, цукровий буряк та соняшник. Інші широко використовувані сільськогосподарські культури, такі як пшениця, овес та рис, й досі вирощуються головним чином як інбредні сорти. Дослідження проводяться на цих й інших сільськогосподарських культурах, що може дозволити широке використання комерційних гібридів у майбутньому, але головним обмежуючим фактором в розвитку нової гібридної сільськогосподарської культури є брак способів економічного одержання гібридного насіння для цих сільськогосподарських культур. Традиційне масове одержання гібридного насіння здійснюється висадженням окремих рядків або блоків жіночих батьківських ліній і чоловічих батьківських ліній для їх запилення. Збирають лише насіння з жіночих батьківських рядків. Для того, щоб переконатися, що це насіння є гібридним насінням без домішок власного насіння, повинні застосовуватися способи контролю за запиленням жіночих батьківських рослин для того, щоб переконатися, що насіння, яке утворилося на них, є результатом перехресного запилення, а не самозапилення. До відомих способів контролю за запиленням належать механічні, хімічні або генетичні. Видалення здатного до запилення пилку з жіночих батьківських рослин може бути досягнуто р учним каструванням у деяких однодомних видів, таких як кукурудза. Таке видалення здатного до запилення пилку досягається за допомогою висмикування або відрізання чоловічих суцві ть (волоті) у рослин з жіночої батьківської популяції. Ця проста процедура запобігає самозаплідненню механічною обробкою жіночих рослин перед тим, як пилок почне розповсюджуватись. Проте, більша частина корисних сільськогосподарських рослин мають функціональні чоловічі та жіночі органи в одній квітці, що робить кастрацію нездійсненною. Навіть, де це й можливо, ця форма одержання гібридного насіння потребує важких людських зусиль і, таким чином, є дорогою. Для того, щоб уникнути використання людської праці, необхідної для запобігання самозапліднення у гібридних ліній, у деяких видів були використані генетичні фактори, які обумовлюють чоловічу стерильність. Чоловічу стерильність у жіночих батьківських рослин можна контролювати генами ядра або цитоплазматично-генетичною системою. Генетична чоловіча стерильність контролюється генами ядра, в яких алелі стерильності, як правило, є рецесивними стосовно алелей родючості. Генетична чоловіча стерильність зустрічається у багатьох видів. Звичайно, вона контролюється одним рецесивним геном, що повинен бути гомозиготним для того, щоб викликати чоловічу стерильність. Селекціонери, які використовують генетичну чоловічу стерильність для одержання гібридного насіння, звичайно одержують фенотипічно однорідну жіночі лінію, що дає 50% чоловічих стерильних і 50% здатних до запилення чоловічих рослин. Вихід насіння для цих ліній підвищують відокремленням, збираючи насіння з рослин, гомозиготних на ген чоловічої стерильності, що запилюються рослинами, гетерозиготними на ген чоловічої стерильності, і, отже, здатними до запилення. Для одержання комерційного гібридного насіння з генетичною чоловічою стерильністю 50% жіночих рослин із здатними до запилення чоловічими органами потрібно видалити з поля як тільки їх фертильність можна буде визначити. Потреба у застосуванні людської сили для відокремлення фертильних рослин від жіночих рослин значно обмежує використання генетичної чоловічої стерильності при одержанні гібридного насіння. Існує кілька проблем, пов'язаних з цією системою одержання комерційного гібридного насіння. По-перше, не можна відокремити фертильні рослин від бажаних стерильних чоловічих рослин серед жіночої популяції. Генетичні стерильні чоловічі рослини потрібно зберігати, схре щуючи їх з фертильними чоловічими рослинами. Половина F1 рослин від такого схрещування була б стерильною, але решта рослин була б фертильною. Таким чином, небажані фертильні чоловічі рослини серед популяції жіночих рослин можуть розповсюджувати пилок і зменшува ти ви хід бажаних чоловічих батьківських рослин. Успішне використання цитоплазматичної чоловічої стерильності для комерційного одержання гібридного насіння потребує стабільної стерильної чоловічої цитоплазми, відповідного джерела пилку і ефективної системи перенесення пилку з чоловічих ба тьківських рослин на стерильні чоловічі жіночі рослини. До того ж, цитоплазматично-генетична система чоловічої стерильності потребує трьох ліній для одержання одного схрещуваного гібриду; А лінії (стерильна чоловіча), В лінії (фертильна чоловіча підтримуюча) і R лінії (фертильна чоловіча з відтворюючими генами). Одержані трьома шляхами чоловічі стерильні цитоплазматично-генетичні продукти схре щування включали підтримання і одержання чотирьох ліній, А і В лінії з однієї інбредної й фертильні чоловічі інбредні з інших дво х. Крім того, гниль кукурудзи, викликана Helminthosporium maydis, Race Т., яка сильна пошкоджує гібриди кукурудзи з цитоплазматичною стерильною чоловічою Т-цитоплазмою, виявляли чутливість до одержання гібридного насіння промисловим чином, основаним на одному джерелі стерильної чоловічої цитоплазми. Для гібридної кукурудзи більша частина виробників насіння повернулась до ручної або механічної кастрації і запилення вітром. Гібридне насіння можна також одержати, використовуючи хімікати, що блокують або вбивають утворення життєздатного пилку. Ці хімікати, що мають назву гаметоциди, використовуються для створення короткочасної чоловічої стерильності. Проте, вартість, придатність хімікатів і надійність застосування обмежують одержання гібридного насіння через використання гаметоцидів. Були також описані молекулярні способи одержання гібридного насіння. Такі способи трансформують рослини конструктами, що містять антисмислову ДНК й інші гени, які здатні контролювати утворення здатного до запилення пилку в рослинах. Такі регенеровані рослини є функціонально стерильними чоловічими рослинами і використовуються для одержання гібридного насіння схрещуванням з пилком фертильних чоловічих рослин. Головними недоліками цих підходів є те, що вставлений за допомогою генетичної інженерії ген чоловічої стерильності, що є антисмисловою послідовністю або РНКазою, може зберігатися лише в гетерозиготному стані. Вони є фундаментально такими ж, що і природні генетичні чоловічі стерильні рослини в тому, що їх треба підтримувати схрещуванням з ізогенними чоловічими фертильними лініями. Це є найбільшою проблемою на полі для схрещування гібридів, де площа велика і вихід обмежений. Гетерозиготні жіночі батьківські рослини, з яких лише 50% будуть чоловічими стерильними рослинами, потрібно висаджувати в рядки поруч з чоловічими батьківськими рослинами, які є донорами пилку, і 50% фертильних жіночих батьківських рослин потрібно видалити Це легше здійснити на створених за допомогою генної інженерії чоловічих стерильних рослинах, тому що ген резистентності до гербіциду може бути з'єднаний з геном чоловічої стерильності, і розбризкування гербіциду може бути використане для видалення фертильних рослин, але все ж таки це значить, що жіночі батьківські рядки потрібно висаджувати в подвійній кількості для того, щоб одержати такий самий вихід на акр нашої системи. Це викликатиме деяке зменшення виходу внаслідок конкуренції. Розбризкування гербіциду також обумовлює зменшення виходу, тому що резистентні рослини ніколи не матимуть 100% захисту від гербіциду, і витрати на розбризкування гербіциду будуть відчутними. Недоліком цих традиційних систем одержання гібридного насіння є потреба у висаджуванні окремих рядків або блоків чоловічих і жіночих батьківських ліній. Фізична відстань між донорами чоловічого пилку і жіночими рослинами - реципієнтами пилку приводить до зменшення ефективності перенесення пилку, поганого утворення насіння на жіночих батьківських рослинах, потреби у застосуванні більших площ для одержання рослин-донорів пилку та зменшення виходу гібридного насіння на одиницю площі. Цей недолік є особливо гострим при вирощуванні сільськогосподарських видів, таких як пшениця, що вивільнює малу кількість пилку, і пилок не ефективно переноситься вітром. Традиційні способи одержання гібридного насіння при застосуванні до пшениці потребували від однієї третьої до двох треті х поля для одержання чоловічих рослин-донорів пилку (Johnson і Schmidt, Adv. Agronomy 20:199-233 (1968); Wilson, Plant Breeding Reviews 303309 (1989)). Результатом є занадто висока вартість одержання насіння гібридної пшениці, що робить таке одержання неможливим, незважаючи на наявність способів одержання гібридного насіння та доведений гетерозис. Щоб досягти більш економічного одержання гібридного насіння для пшениці й інших сільськогосподарських культур, необхідно звести чоловічі і жіночі батьківські рослини ближче одну до одної, щоб зробити перенесення пилку більш ефективним. Чоловічі і жіночі батьківські рослини потрібно пересаджувати в ти х самих рядках на відстань, що складає сантиметри, ніж висаджувати в окремі блоки рядків так, щоб насіння можна було збирати лише з жіночих батьківських рослин. Оскільки не можливо здійснити збирання насіння лише з жіночих батьківських рослин, коли вони так щільно розташовані, необхідно запобігти утворенню життєздатного насіння на чоловічих батьківських рослинах та запобігти утворенню життєздатного пилку на жіночих батьківських рослинах. Одним способом запобігання утворенню життєздатного насіння є використання жіночих стерильних рослин. Жіноча стерильність, що зустрічається в природі, була виявлена у кількох сільськогосподарських культур (Honma and Phatak, Journal of Heredity 55:143-145 (1964); Sniezdo and Winiarczyk, Protoplasma 187:3138 (1995); Justus and Meyer, Journal of Heredity 54:167-168 (1963); Hanna and Powell, Journal of Heredity 65:247249 (1974); Brown and Bingham, Crop Science 24:1207-1208 (1984)), але існують проблеми в підтриманні цих ліній, і вони комерційно не використовуються. Спосіб побудови домінантного гена жіночої стерильності був описаний (ЕР 412006 А1 (1990); Goldman et al., EMBO Journal 13.2976-2984 (1994)), але знову підтримання стерильної жіночої лінії, що містить цей ген, є проблематичним завдяки неспроможності створити лінію, гомозиготну по гену жіночої стерильності. Був описаний спосіб підтримання і використання цього гена жіночої стерильності при одержанні гібридного насіння (ЕР 402270 (1990)). Проте, цей спосіб потребує введення гена жіночої стерильності, гена-відтворювача першого гена чоловічої стерильності, другого гена чоловічої стерильності і двох генів резистентності до гербіцидів з комплексі серій послідовних трансформацій для створення жіночо-стерильної чоловічої батьківської лінії, і він потребує введення першого гена чоловічої стерильності, гена-відтворювача гена жіночої стерильності і гена резистентності до гербіциду в комплексі серій послідовних трансформацій для створення чоловічо-стерильної жіночої батьківської лінії. Обробка гербіцидом потрібна для відбору вірних генотипів в кожному циклі збільшення ліній, і для одержання гібридного насіння поле для одержання потребує обробки одним з гербіцидів для видалення небажаних генотипів, які утворюються внаслідок процесу. Хоча вищезгадана система могла б мати економічну перевагу завдяки пересаджуванням чоловічих і жіночі ліній, вона все ж є занадто складною для комерційного використання. Таким чином, існує потреба у простому, економічному способі для одержання гібридного насіння. Короткий опис винаходу Цей винахід пропонує спосіб одержання гібридного насіння, що складається з одержання умовних жіночих стерильних рослин, які містять промотор, активний переважно в жіночих репродуктивних органах, функціонально з'єднаний з кодуючою послідовністю, яка кодує фермент, що каталізує перетворення прототоксину на токсин; висадження умовної жіночої стерильної рослини з чоловічою стерильною рослиною; індукції жіночої стерильності застосуванням прототоксину на умовну жіночу стерильну рослину; і одержання гібридного насіння. У одному кращому втіленні винаходу рослину або піддають звичайному самозапиленню або звичайному перехресному запиленню. В особливо кращих втіленнях рослину вибирають з групи, що складається з кукурудзи, пшениці і ячменю. Винахід також пропонує гібридне насіння, одержане способом винаходу. Винахід також пропонує експресійну касету, що складається з промотору, активного переважно в жіночих репродуктивних органах, функціонально з'єднаного з кодуючою послідовністю, яка кодує фермент, що каталізує перетворення прототоксину на токсин. У кращому втіленні промотор, активний переважно в жіночих репродуктивних органах, функціонально з'єднаний з кодуючою послідовністю гена argЕ. У кращих втіленнях до промоторів, активних переважно в жіночих репродуктивних органах, належить промотор з В200і4-2 клону, Р26 клону або Р19 клону. У особливо кращому втіленні промотор, активний переважно в жіночих репродуктивних органах, є промотором з В200і4-2 клону або Р19 клону, функціонально з'єднаний з кодуючою послідовністю argЕ. До додаткових втілень кодуючих послідовностей, корисних у винаході, належать ті, що одержані з гена P450sul-монооксигенази і гена pehA. Винахід також пропонує рослини, що містять експресійну касету, яка складається з промотору, активного переважно в жіночих репродуктивних органах, функціонально з'єднаного з кодуючою послідовністю, яка кодує фермент, що каталізує перетворення прототоксину на токсин, і насіння таких рослин. Ще одним об'єктом винаходу є використання прототоксину у способі індукції жіночої фертильності в рослині, яка містить промотор, активний переважно в жіночих репродуктивних органах, функціонально з'єднаний з кодуючою послідовністю, яка кодує фермент, що каталізує перетворення прототоксину на токсин, і індукції жіночої стерильності застосуванням прототоксину до рослини. Іншим об'єктом винаходу є використання кодуючої послідовності гена argЕ у способі одержання гібридного насіння, де кодуюча послідовність argЕ функціонально з'єднана з промотором, активним переважно в жіночих репродуктивних органах, який при експресії каталізує перетворення прототоксину на токсин, таким чином індукуючи жіночу стерильність. Опис винаходу Визначення та термінологія Термін "жіноча репродуктивна структура", який використовується в цьому винаході, визначає ті частини рослини, які містять плодолистик або гінецей (давнім усталеним терміном, використовуваним стосовно гінецею, був "маточка"). Плодолистик квітки рослини включає, крім іншого, приймочку, стовпчик, зав'язь і клітини або тканини, які містять приймочку, стовпчик і зав'язь Як використовується в цьому винаході, "промотор, активний переважно в жіночих репродуктивних органах" - це промотор, що має транскрипційну активність лише або головним чином в одній або кількох клітинах або тканинах жіночої репродуктивної структури рослини. "Експресійна касета", як використовується в цьому винаході, - це послідовність ДНК, здатна спрямовувати експресію гена в клітинах рослин, що містять промотор, функціонально з'єднаний з ділянкою, що кодує послідовність амінокислот, яка функціонально з'єднана з ділянкою термінації. Ген може бути рекомбінантним, це означає, що принаймні один компонент гена є гетерологічним стосовно принаймні одного іншого компонента гена. Ген може також зустрічатися в природі, але той, що був одержаний в рекомбінантній формі, корисній для генетичної трансформації рослини. "Прототоксин", як використовується в цьому винаході, -це хімічна речовина з мінімальною фітотоксичністю, що може бути активована дією ферменту з утворенням продукту реакції, що є токсичним для клітин рослини або порушує функції клітин рослини способом, достатнім для затримання, пригнічення або запобігання нормальному росту, розвитку або метаболічній активності. Токсичний продукт реакції в цьому винаході має назву "токсин." У винаході прототоксин застосовують екзогенно до рослини, що може бути здійснено будь-якими засобами, які сприяють поглинанню листям і коренем, прямому контакту з потрібними частинами рослини або переміщенню з однієї частини рослини до іншої. "Жіноча фертильність", як використовується в цьому винаході, означає, що жіночі репродуктивні структури рослини здатні підтримувати утворення життєздатного насіння при запиленні функціональним або життєздатним пилком. "Жіноча стерильність", як використовується в цьому винаході, означає, що жіночі репродуктивні структури рослини не здатні підтримувати утворення життєздатного насіння при запиленні функціональним або життєздатним пилком. "Умовна жіноча стерильність", як використовується в цьому винаході, означає, що жіноча стерильність проявляється при екзогенному застосуванні прототоксину, який після цього активується ферментом з утворенням токсичного продукту реакції. "Чоловіча стерильність", як використовується в цьому винаході, означає, що чоловічі репродуктивні структури рослини нездатні утворювати життєздатний або функціональний пилок. Регулювання жіночої фертильності рослин Одним з корисних аспектів цього винаходу є використання його для регулювання утворення життєздатного насіння рослин в польових умовах шляхом контролю жіночої фертильності. Фертильність жіночих структур можна регулювати одержанням трансгенної рослини, що містить складену або рекомбінантну нуклеотидну послідовність, яка кодує фермент, що каталізує перетворення прототоксину на токсин, який, якщо експресується під контролем промотору, активного переважно в жіночих репродуктивних органах, робить жіночі репродуктивні структури нездатними до утворення життєздатного насіння при екзогенному застосуванні прототоксину. Як було згадано вище, трансгенним рослинам властива умовна жіноча стерильність, оскільки жіноча стерильність регулюється присутністю прототоксину. Перетворення прототоксину на токсин в репродуктивних структурах жіночої рослини змогло б запобігти утворенню життєздатного насіння за допомогою кількох механізмів залежно від того, коли, і в яких клітинах або тканинах промотор, активний переважно в жіночих репродуктивних органах, знаходиться в активованому стані. Запобігання утворенню життєздатного насіння можна досягти, крім іншого: 1) порушенням нормального розвитку маточки так, що маточка більше не буде спроможною до запліднення, 2) інгібуванням проростання пилку в маточку утвореним токсином, 3) порушенням розвитку життєздатних гамет і 4) порушенням розвитку насіння після запліднення. В одному втіленні цього винаходу прототоксин застосовують екзогенно на трансгенні рослини в польових умовах, і перетворення прототоксину на токсин відбувається в жіночій репродуктивній структурі. Утворенню життєздатного насіння запобігає дія токсину в жіночій репродуктивній структурі. Кодуючі послідовності та прототоксини, корисні в цьому винаході До корисних кодуючих послідовностей винаходу належить, крім іншого, будь-яка послідовність, яка кодує протеїн, здатний перетворювати прототоксин на токсин. Ці кодуючі послідовності можуть бути гомологічного або гетерологічного походження. В одному кращому втіленні кодуюча послідовність гена argЕ функціонально з'єднана з промотором, активним переважно в жіночих репродуктивних органах. Експресія цього рекомбінантного гена в трансгенній рослині приводить до виникнення умовної жіночої стерильності в присутності прототоксину Nацетилфосфінотрицину (N-ацетил РРТ). Продуктом гена argЕ є N-ацетил-L-орнітин-деацетилаза Е. соlі, яка має широку специфічність до гідролізу субстратів типу R1CO-NH-CH((CH2)-R2)-COOH. Внаслідок цієї активності продукт гена argЕ каталізує перетворення прототоксину ацетил-фосфінотрицину на токсин фосфінотрицин (РРТ) (Kiete et al., The Plant Journal 9:809-818 (1996)). В іншому кращому втіленні кодуюча послідовність гена P450sul-монооксигенази, CPY105A1, функціонально з'єднана з промотором, активним переважно в жіночих репродуктивних органах. Ця експресія приводить до виникнення умовної жіночої стерильності в присутності суль фонаміду прототоксину. Спрямування Р450sulмонооксигенази Streptomyces griseolus в хлоропласт приводить до N-деалкілування сполуки сульфонілсечовини R7402 (2-метилетил-2,2-дигідро-N-[(4,6-диметоксипіримідин-2-іл)амінокарбоніл]-1,2бензотіазол-7-сульфонамід-1,1-діоксид і перетворює його на токсин (O'Keefe et al. Plant Physiology 105:473-482 (1994)). У ще одному кращому втіленні кодуючу послідовність гена pehA функціонально з'єднують з промотором, активним переважно в жіночих репродуктивних органах, і ця експресія приводить до проявлення умовної жіночої стерильності в присутності прототоксину гліцерилгліфосату. Продукт гена pehA Burkholderia catyophili штаму PG2982 є гідролазою фосфонатного моноетеру, яка каталізує перетворення прототоксину гліцерилгліфосату на токсин гліфосат (Dotson et al., Plant Journal 10:383-392 (1996)). Вищезгадані приклади наведені з метою ілюстрації, а не обмеження. Будь-яка кодуюча послідовність, яка кодує фермент, що каталізує перетворення прототоксину на токсин, може бути використана у винаході за умови, що вона функціонально з'єднана з промотором, активним переважно в жіночих репродуктивних органах. Промотори, корисні у цьому винаході Для того, щоб здійснити винахід, бажано, щоб вищезгадані нуклеотидні послідовності, що кодують фермент, який каталізує перетворення прототоксину на токсин, були функціонально з'єднаними з 5' регуляторною послідовністю, яка спрямовує експресію таким чином, що експресія відбувається переважно в жіночих репродуктивних структурах рослини Ця особливість експресії гарантує, що вплив експресованого ферменту буде здійснюватися лише в тих тканинах або клітинах, які необхідні для утворення життєздатного насіння, і не буде завдавати шкоди рослині окрім впливу на фертильність. До промоторів, активних переважно в жіночих репродуктивних стр уктурах рослини, корисних в цьому винаході, належать, крім іншого: промотори дводольних, такі як модифікований S13 промотор (Dzelkains et al.. Plant Cell 5:855 (1993)), промотор тютюну Stigi (Goldman et al., EMBO J. 13:2976-2984 (1994)), промотор AGL5 (Savidge et al.. Plant Cell 7:721-733 (1995)) і промотор тютюну TTS1 (Cheung et al.. Cell 82:383-393 (1995)). Всі вищезгадані промотори були перевірені і виявились функціональними в трансгенних рослинах. До промоторів однодольних належить промотор плодолистик-специфічного гена ZAG2 кукур удзи (Thiessen e: al., Gene 156:155-166 (1995)). Крім того, послідовності промоторів в геномній ДНК, що експресуються переважно в жіночих репродуктивних стр уктурах, можна виділити за допомогою кДНК, відомої в галузі. До таких промоторів належать, крім іншого, промотори генів Fbp7 і Fbp11 Arabidopsis (Angenent et al.. Plant Cell 7:1569-1582 (1995)) і жіноче-специфічні кДНК орхідеї О40, O108, O39, O126 і O141 (Nadeau et al., Plant Cell 8:213-239 (1996)). Гени, які експресуються переважно в жіночих репродуктивних органах, корисні для певних видів рослин, можуть бути клонованими за допомогою виділення нових транскриптів, що експресуються в жіночих тканинах, використовуючи способи, відомі фахівцям у галузі. Ці способи включають виділення РНК з жіночих тканин, таких як волоть кукурудзи або маточки пшениці і диференційний скринінг способами, такими як диференційне проявлення, вибране за допомогою PCR вирахування кДНК і субтрактивне створення бібліотеки кДНК для виділення клонів кДНК, що експресуються переважно в жіночих тканинах, а не в інших частинах рослини, таких як листок, корінь або китиця. Тканинна специфічність цієї клонованої кДНК може бути підтверджена Нозерн-блотингом. Послідовності промоторів клонів, що екс пресуються переважно в жіночих репродуктивних структурах, можуть бути одержані, використовуючи виділені нові кДНК як зонди для скринінгу бібліотеки геному. Можуть бути виділені геномні клони, які містять 5' і 3' регуляторні послідовності, необхідні для експресії в жіночій тканині. Ці послідовності можуть бути використані для створення експресійних касет для експресії рекомбінантних генів переважно в жіночих тканинах. Інші регуляторні елементи, корисні у винаході 5' регуляторна ділянка експресійної касети може також містити інші енхансерні послідовності. Було виявлено, що багато послідовностей підсилюють експресію генів в трансгенних рослинах. Наприклад, відомі кілька лідерних послідовностей вірусів, що не підлягають трансляції, які підсилюють експресію. Зокрема виявилось, що лідерні послідовності вірусу мозаїки тютюну (TMV, "W-послідовність"), вірусу зеленої мозаїки кукурудзи (MC MV) і вірусу мозаїки люцерни (AMV) є е фективним для підсилення експресії (наприклад, Gallic et al. Nucl. Acids Res. 15:8693-8711 (1987); Skuzeski et al. Plant Molec. Biol. 15:65-79(1990)). До інших лідерних послідовностей, відомих у галузі, належать, крім іншого: Лідерні послідовності пікорнавірусу, наприклад, лідерна послідовність EMCV (енцефаломіокардитна 5'некодуюча ділянка) (Elroy-Stein, О., Fuerst, T.R., and Moss, В. PNAS USA 86:6126-6130 (1989)); Лідерні послідовності потівірусу, наприклад, лідерна послідовність TEV (вірус гравіювання тютюну) (Allison et al., (1986); лідерна послідовність MDMV (вір ус карликовості та мозаїчності кукурудзи); Virology, 154:9-20); Лідерна послідовність протеїну, що зв'язується з важкими ланцюгами імуноглобуліну людини (ВіР), (Macejak, D. G., and Sarnow, P., Nature, 353: 90-94 (1991); Лідерна послідовність, що не підлягає трансляції, з протеїну оболонки мРНК вірусу мозаїки люцерни (AMV РНК 4), (Jobling, S.A., and Gehrke, L, Nature, 325:622-625 (1987); Лідерна послідовність вірусу мозаїки тютюну (TMV), (Gallic, D.R. et al., Molecular Biology of RNA, стор.237256 (1989); і лідерна послідовність MCMV (Lommel, S.A. ei al., Virology, 81:382-385 (1991). Див. також, DellaCioppa et al. Plant Physiology, 84:965-968 (1987). Було виявлено, що різні інтронні послідовності підсилюють експресію при з'єднанні з 5'-регуляторною ділянкою, зокрема в клітинах однодольних. Наприклад, було виявлено, що інтрони гена Adhl кукурудзи значно підсилюють експресію гена дикого типу під його рідним промотором при введенні в клітини кукурудзи (Callis et al.. Genes Develop. 1:1183-1200(1987)). Крім промоторів, різні 3'-термінатори транскрипції також можна використовувати в цьому винаході. Термінатори транскрипції відповідають за термінацію транскрипції і вірне поліаденілювання мРНК. До придатних термінаторів транскрипції і тих, які відомі як такі, що функціонують в рослинах, належать: термінатор CaMV 35S, термінатор tml, термінатор нопалінсинтетаза, термінатор rbcS E9 гороху та інші, відомі в галузі. Ці термінатори можуть бути використані як в однодольних, так і в дводольних рослинах. Трансформація рослин Експресійні касети цього винаходу можуть бути введені в клітину рослини кількома визнаними в галузі шляхами. Фахівці в галузі розумітимуть, що вибір способу залежатиме від типу рослини, тобто однодольної або дводольної, вибраної для трансформації. До придатних способів трансформації клітин рослин належать, крім іншого, мікроін'єкція (Crossway et al, BioTcchniques 4320-334 (1986)), електропорація (Riggs et al., Proc. Natl. Acad. Sci. USA 83.5602-5606 (1986), опосередкована Agrobacterium трансформація (Hinchee et al., Biotechnology 6:915-921 (1988)), пряме перенесення генів (Paszkowski et al., EMBO J. 3 :2717-2722 (1984)) та балістичне прискорення часток, використовуючи пристрої, які можна придбати в Agracetus, Inc.; Мадисон, штат Вісконсін і BioRad, Геркулес, штат Каліфорнія (див. наприклад; Sanford et al., патент США №4945050; і McCabe el al., Biotechnology 6:923926 (1988)). Також. див., Weissinger et- al., Annual Rev. Genet. 22:421-477 (1988); Sanford et al., Particulate Science and Technology 5:27-37 (1987)(цибуля); Christou et al., Plant Physiol. 87:671-674 (1988)(соя); McCabe et al., Biotechnology 6:923-926 (1988)(соя); Datta et al.. Biotechnology 8:736-740 (1990)(рис); Klein et al., Proc. Natl. Acad. Sci. USA, 85:4305-4309 (1988)(кукурудза); Klein etai., Bio/Technology 6:559-563 (1988)(кукурудза); Klein et al., Plant Physiol. 91:440-444 (1988)(кукурудза); Fromm et al., Bio/Technology 8:833-839 (1990)(кукурудза); і Gordon-Kamm et al., Plant Cell 2:603-618 (1990)(кукурудза); Svab et al., Proc. Natl. Acad. Sci. USA 87: 8526-8530 (1990)(хлоропласт тютюн у); Ko ziel et al., Biotechnology 11: 194-200 (1993)(кукурудза); Shimamoto et al., Nature 338: 274-277 (1989)(рис); Christou et al.. Biotechnology 9: 957-962 (1991)(рис); Європейська патентна заявка ЕР 0 332 581, Horn et al. (orchrdgrass та інші Pooideae); Vasil et al., Biotechnology 11: 1553-1558 (1993)(пшениця); Weeks et al., Plant Physiol. 102: 1077-1084 (1993)(пшениця); Wan and Lemaux, Plant Physiol. 104, 37-48 (1994)(ячмінь). Одна найкраща серія втілень для введення експресійних касет цього винаходу в кукур удзу бомбардуванням мікрочастками описана Патенті США, реєстраційний номер 08/008374, включеному сюди цілком шляхом посилання Ще одним кращим втіленням є спосіб трансформації протопласту кукурудзи, як описано в Європейський патентній заявці ЕР 0292435 та в патенті США №5350689, включених сюди цілком шляхом посилання. Одна найкраща серія втілень для введення експресійних касет цього винаходу в пшеницю бомбардуванням мікрочастками описана в патенті США №5610042, включеному сюди цілком шляхом посилання. Трансформація рослин може бути здійснена однією молекулою ДНК або багатьма молекулами ДНК (тобто, котрансформацією), і обидва ці способи придатні для використання з експресійними касетами цього винаходу. Існує бага то векторів для трансформації рослин і експресійні касети цього винаходу можуть бути використані разом з будь-яким з таких векторів Вибір вектора залежатиме від вибраного способу трансформації і вибраних видів для трансформації. Існує багато векторів для трансформації, що використовують Agrobacterium tumefaciens. Ці вектори типово містять принаймні одну Т-ДНК граничну послідовність, а також вектори, такі як pBIN19 (Bevan, Nucl Acids Res. (1984)). В одному кращому втіленні експресійні касети цього винаходу можуть бути вставлені в обидва з бінарних векторів рСІВ200 і рСІВ2001 для використання з Agrobacterium. Ці векторні касети для Agrobactehumопосередкованої трансформації створювали наступним чином pTJS75kan створювали розщепленням Narl pTJS75 (Schmidhauser & Helinski, J Bacteriol. 164: 446-455 (1985)), дозволяючи вирізання гена резистентності до тетрацикліну, після чого проводили вставлення фрагмента АссІ з pUC4K, що несе NPTII (Messing & Vierra, Gene 19: 259-268 (1982), Bevan et al., Nature 304-184-187 (1983); McBride et al., Plant Molecular Biology 14: 266276 (1990)) Xhol лінкери приєднували до фрагмента EcoRV рСІВ7, який містить лівий і правий кінець Т-ДНК, рослино-селективний рекомбінантний ген nos/nptll і полілінкер pUC (Rothstein et al., Gene 53: 153-161 (1987)) та Хhol-розщеплений фрагмент клонували в Sail-розщеплений pTJS75kan для створення рСІВ200 [див. також Європейський патент (ЕР) №0332104, приклад 19]. рСІВ200 містить наступні унікальні полілінкерні сайти рестрикції: EcoRI, Sstl, Kpnl, Bglll, Xbul і Sail. Плазміда рСІВ2001 є похідною рСІВ200, яку створювали вставленням в "полілінкер додаткових сайтів рестрикції. Унікальними сайтами рестрикції в полілінкері рСlВ2001 є EcoRI, Sstl, Kpnl, Bglll, Xbal, Sall, Mlul, Bell, Avrll, Apal, Hpal і Stul. pCIB2001, крім того, що містить ці унікальні сайти рестрикції, також має рослинну й бактеріальну селекцію канаміцином, ліві та праві кінці Т-ДНК для Agrobacterium-опосередкованої трансформації, функціональну складову trfA, похідну RK2, для мобілізації між Е. соlі та іншими хазяїнами й функціональні складові ОrіТ та OriV також з RK2. Полілінкер рСІВ2001 придатний для клонування рослинних експресійних касет, що містять свої власні регуляторні сигнали. Ще одним вектором, корисним для Agrobacterium-опосередкованої трансформації, є бінарний вектор рСІВІО, який містить ген, що кодує резистентність до канаміцину для селекції рослин, праві та ліві граничні послідовності Т-ДНК і містить послідовності з плазміди pRK252, придатної для використання в багатьох хазяях, дозволяючи їй реплікуватися в Е соlі і Agrobacterium. Його будова описана Rothstein et al., Gene 53: 153-161 (1987). Були створені різні похідні рСІВ10, які містять ген гігроміцин В-фосфотрансферази, описані Gritz et al., Gene 25: 179-188 (1983). Ці похідні дозволяють проводити селекцію трансгенних клітин рослини лише на гігромщині (рСІВ743) або гігроміцині та канаміцині (рСІВ715, рСІВ717). Способи, в яких використовуються або форма прямого перенесення генів, або Agrobacteriumопосередковане перенесення, зазвичай, але не обов'язково, втілюють з селективним маркером, який може надавати резистентності до антибіотику (наприклад, канаміцину, гігроміцину або метотрексату) або гербіциду (наприклад, фосфінотрицину). Вибір селективного маркера для трансформації рослини не є, однак, обмежуючим для винаходу, . якщо тільки експресія цієї резистентності та її біохімічна активність не впливає на вибір перетворення прототоксину на токсин, вибраний для використання при створенні умовної фертильності. Для певних видів рослин можна використовувати різні селекційні маркери на антибіотик або гербіцид. До селекційних маркерів, що зазвичай використовуються при трансформації, належать: ген nptll, який надає резистентності до канаміцину й споріднених антибіотиків (Messing & Vierra, Gene 19: 259-268 (1982); Bevan et al., Nature 304:184-187 (1983)), ген bar, який надає резистентності до гербіциду фосфінотрицину (White et al., Nucl Acids Res 18:1062 (1990), Spencer et al., Theor Appl Genet 79:625-631(1990)), ген hph, який надає резистентності до антибіотику гігроміцину (Blochinger & Diggelmann, МоІ Cell Biol 4: 2929-2931), ген dhfr, який надає резистентності до метотрексату (Bourouis et al., EMBOJ. 2:1099-1104 (1983)), ген манозофосфатізомерази, який дозволяє проводити селекцію на манозі, як джерелі вуглецю (ЕР 530129, WO 94/20627). Одним таким вектором, корисним для способу прямого перенесення генів разом з селекцією гербіцидом Basta (або фосфінотрицином), є рСІВ3064. Цей вектор оснований на плазміді рСІВ246, яка містить промотор CaMV 35S у функціональному з'єднані з геном GUS Е. соlі і термінатором транскрипції CaMV 35S, та описаний у РСТ опублікованій заявці WO 93/07278, включеній сюди шляхом посилання. Одним геном, корисним для надання резистентності до фосфінотрицину, є ген bar із Streptomyces hygroscopicus (Thompson etal., EMBO J 6: 2519-2523 (1987)). Цей вектор придатний для клонування експресійних касет для рослин, що містять свої власні регуляторні сигнали. Варто відмітити, однак, що використання гена bar як селективного маркера може заважати втіленню цього винаходу, якщо він також здатний експресуватися в жіночих репродуктивних структурах рослини. Ця проблема може бути вирішена використанням промоторів, які регулюють, експресію в клітині або культурах тканин, використаних для трансформації, але не приводять до експресії гена bar в жіночих репродуктивних структурах. Іншим трансформаційним вектор є вектор pGL2 (Shimamoto et al. Nature 338, 274-276 (1989), який містить ген гігроміцинфосфотрансферази Streptomyces (hpt), функціонально з'єднаний з послідовностямипромотору 35S і термінатору 35S. Ще одним вектором для трансформації є pSOG35, який використовує ген дигідрофолатредуктази Е. соlі (DHFR) як селективний маркер, що надає резистентності до метотрексату. Використовували PCR для ампліфікації промотору 35S (-800п.н.), інтрону 6 з гена Adhl кукурудзи (-550п.н.) і лідерної послідовності, що не підлягає трансляції, GUS (18п.н.) з pSOGIO. 250п.н фрагмент, що кодує ген дигідрофолатредуктази типу II Е. Сolі, також ампліфікували PCR і ці два PCR-фрагменти з'єднували з фрагментом Sacl-Pstl з рВІ221 (Clonetech), який містив основу вектора pUC19 і термінатор нопалінсинтази. Складання цих фрагментів привело до утворення pSOG19, яка містить промотор 35S, з'єднаний з послідовністю інтрону 6, лідерну послідовність GUS, ген DHFR і термінатор нопалінсинтази. Заміна лідерної послідовності GUS в pSOG19 на лідерну послідовність MCMV привела до утворення вектора pSOG35 pSOG19 і pSOG35 несуть ген резистентності до ампіциліну, похідний від pUC, і мають Hindlll, Sphl, Pstl і EcoRJ сайти, придатні для клонування чужорідних послідовностей. Одержання гібридного насіння, використовуючи умовну жіночу стерильність Для того, щоб одержати гібридне насіння без домішок насіння, створеного за допомогою самозапилення, повинні застосовуватись способи для запобігання самозапиленню жіночих батьківських рослин і перехресному запиленню чоловічими батьківськими рослинами. Це звичайно досягається механічними способами, генетичною чоловічою стерильністю або хімічними гібридизуючими агентами (СНА). Наприклад, для кукурудзи сучасним процесом є механічна обробка жіночої (або тієї, де утворюється насіння) батьківської рослини, і цей процес потребує багато часу і людських зусиль. У разі пшениці регулювання фертильності механічними засобами є нездійсненним з точки зору одержання насіння, а генетичні джерела чоловічої стерильності не створені комерційно. Способи одержання гібридного насіння, основані лише на регулюванні запилення, потребують, щоб блоки чоловічих батьківських рослин були фізично відокремленими від блоків жіночих батьківських рослин, оскільки чоловічі батьківські рослини утворюватимуть насіння самозапиленням. Використання цього винаходу з метою одержання гібридного насіння пропонує переваги надійності, легкості використання і, що найбільш важливо, дозволятиме висаджування чоловічих і жіночих батьківських рослин разом, що приведе до більш ефективного перенесення пилку, потреби в меншій кількості чоловічих батьківських рослин і більш економічного одержання гібридного насіння. Для того, щоб одержати гібридне насіння, використовуючи винахід, потрібна трансгенна батьківська рослина, яка експресує фермент, який каталізує перетворення прототоксину на токсин переважно в жіночих репродуктивних стр уктурах. Одержання трансгенних рослин, що мають цей генотип, описане вище. Трансгенні рослини, що містять складені або рекомбінантні гени цього винаходу, можуть бути створені гомозиготними й підтримуватися необмежено довго, використовуючи загальноприйняті способи селекції рослин. Також необхідною для одержання гібридного насіння згідно з винаходом є батьківська рослина, яка має чоловічу стерильність. Чоловіча стерильність - це недолік або нездатність утворювати життєздатний або функціональний пилок. Чоловіча стерильність може виникати від пошкоджень, що приводять до неутворення пилку або браку функціональної здатності пилку при його формуванні. Таким чином, або пилок не утворюється, або, якщо й утворюється, то він або нежиттєздатний, або нездатний до ефективного запліднення за нормальних умов. Відомо багато джерел чоловічої стерильності для використання в одержанні гібридного насіння (Kaul, Male Sterility in Higher Plants, Springer-Verlag (1988)). Гени цитоплазматичної чоловічої стерильності, що зустрічаються в природі, і їх використання були описані для кукурудзи (Levings, Science 250942-947 (1990), пшениці (Toriyama et al., Jpn J Breed. 3:517-524 (1993)), тютюн у (Gerstel et al., Genetics 89:157-169 (1978)), жита (Steinbom et al., Theor Appl. Genet. 85:822-824 (1993)), соняшника (Crouzillat et al., Plant Моl. Biol. 16:415-426 (1991)), col (Davis, патент США №4763441 (1988)), Brassica (Grelon et al., Моl Gen. Genet 243:540-547 (1994)), моркви (Kitagawa et al, Sex Plant Reprod 7:41-50 (1994)), сорго (Chen et al., Plant Моl Biol 28:799-809 (1995)), рису (Kadowaki et al., Моl. Gen Genet 224 10-16 (1990)) і ячменю (Kaul і Singh, Cytobios 66 71-85 (1991)). Також відоме створення складеного або рекомбінантного генів чоловічої стерильності. Було виявлено, що ген, який кодує b-1,3-глюканазу, якщо експресується з промотору, активного лише в клітинах тапетуму пиляка, викликає чоловічу стерильність в трансгенних рослинах (Worrall et al., Plant Cell 4:759-771 (1992)). Було показано, що ген, який кодує незмінений мітохондріальний генatp9 пшениці, викликає чоловічу стерильність, якщо експресується з конститутивним промотором CaMV- 35S в трансгенних рослинах (Hemould et al , Proc. Natl. Acad. Sci USA 902370-2374 (1993)). Було показано, що ген, який кодує фермент РНКазу, викликає чоловічу стерильність, якщо експресується з промотором, активним лише в клітинах тапетуму пиляка в трансгенних рослинах (DeBlock et al, Plant 189:218-225 (1993); ЕР №344029; Mariani et al, Nature 347:737-741 (1990)). Було показано, що експресія антизмістовної РНК, комплементарної до гена, є критичною для утворення пилку й викликає чоловічу стерильність в трансгенних рослинах (ЕР №513884). Крім того, існує багато інших промоторів, активних у чоловічих репродуктивних органах, що є добре відомими у галузі і можуть бути використані при створенні складених генів чоловічої стерильності. До цих промоторів належать промоторні послідовності для експресії в пилку, тапетумі або інших стр уктурах пиляка. До прикладів промоторів, активних у чоловічи х репродуктивних органах, належать, крім іншого, промотор LAT52 (Twell et al., Dev. 109 705-13 (1989)), промотор А127 томатів (Dotson et al.Plant J.10, 383-392. (1996)), промотор Zmg кукурудзи (Hamilton et al. Sex.Plant Reprod. 2:08-212 (1989)), промотор CDPK кукурудзи (Guerro et al., Моl. Gen Genet. 224:161-168 (1990)), промотори ant32 і ant43D, активні у пиляках, описані в патенті США №5477002, включений сюди цілком шляхом посилання. Крім того, послідовності промоторів кДНК, специфічних до пиляків, можуть бути клоновані за допомогою виділення відповідних геномних послідовностей ДНК і визначення промоторних регуляторних ділянок, наприклад, виділенням послідовностей промоторів для гена Р450, специфічного до стовпчика пиляка орхідеї (Nadeau et al., Plant Cell 8:213-239 (1996)) і Вср1 Arabidopsis (Xu et al. Proc. Natl Acad. Sci. 92:2106-2110 (1995)). Таким же, чином, нові гени, активні у чоловічих репродуктивних органах, можуть бути виділеними різними способами, такими як диференційне виявлення, кДНК. виявлення PCR селекцією і диференційний скринінг бібліотеки кДНК. Як тільки ці послідовності будуть ідентифіковані, відповідні геномні послідовності можуть бути виділені, промоторні ділянки характеризовані й ці послідовності потім використані як промоторні ділянки для створення експресійних касет, що експресуватимуться в чоловічих репродуктивних органах. Вищезгадані штучні гени чоловічої стерильності мають недоліком те, що їх дія є конститутивною й домінантною. Як тільки трансгенна рослина створена, вона назавжди стає стерильною по чоловічих репродуктивних органах, що робить підтримання рослинних ліній важким і неможливим для створення гомозиготної, справжньої рослинної лінії, що піддається селекції. Були описані інші категорії генів чоловічої стерильності, в яких чоловічий стерильний фенотип є умовним. У цій категорії, чоловіча фертильність порушується лише після застосування хімічного прототоксину. В одному прикладі умовної чоловічої стерильності був описаний ген, що кодує N-ацетил-L-орнітин-деацетилазу, яка каталізує перетворення прототоксину N-ацетил-L-фосфінотрицину на гербіцидний токсин L-фосфінотрицин (Kriete et al, Plant Journal 9:809-818 (1996); ЕР №531716 А2 (1992)). Трансгенні рослини, що експресували цей ген в клітинах тапетуму пиляка, набували чоловічої стерильності лише після обробки прототоксином - Nацетил-L-фосфінотрицином. В іншому прикладі умовної чоловічої стерильності був описаний ген, що кодує бактеріальний цитохром Р450, який каталізує перетворення сульфонілсечовини прототоксину R7402 на гербіцидний токсин (WO 91/03561; O'Keefe et al., Plant Physiology 105:473-482 (1994)). Трансгенні рослини, що експресували цей ген в клітинах тапетуму пиляка, набували чоловічої стерильності лише після обробки прототоксином R7402. В іншому прикладі умовної чоловічої стерильності був описаний ген, що кодує гідролазу фосфонатного- моноетеру, яка каталізує перетворення прототоксину гліцерилгліфосату на гербіцидний токсин гліфосат (Dotson, et al., Plant J. 10: 383-392(96)). Трансгенні рослини, що експресували цей ген в клітинах тапетуму пиляка, набували чоловічої стерильності лише після обробки прототоксином гліцерилгліфосату. Будь-які з джерел чоловічої стерильності, описані вище або відомі в галузі, можуть бути застосованими в цьому винаході. До цих джерел належить будь-яка чоловіча стерильна генетична система, що зустрічається в природі, або трансформований в певні жіночі батьківські лінії складений або рекомбінантний ген. Згідно з винаходом утворення життєздатного насіння запобігається в рослині з умовною жіночою стерильністю (чоловіча батьківська рослина) внаслідок перетворення прототоксину на токсин у репродуктивних стр уктура х жіночої рослини, і утворення пилку запобігається на рослинах з чоловічою стерильністю (жіноча батьківська рослина). Для одержання гібридного насіння гомозиготне насіння чоловічих батьківських рослин і жіночих батьківських рослин висаджують в полі, таким чином дозволяючи ефективне перенесення пилку. В одному прикладі використання цього винаходу для одержання гібридного насіння, жіноча батьківська рослина є чоловіча стерильною внаслідок будь-яких засобів і чоловічу батьківську рослину піддають генній інженерії для утворення жіночої стерильності в присутності належно застосовуваного екзогенно прототоксину. Після застосування прототоксину в певний час протягом розвитку рослину лише утворення життєздатного насіння буде результатом чоловічого батьківського (жіночою стерильного) пилку, запилюючого жіночі батьківські (чоловічі стерильні) насінні зачатки. У кращому способі-використання цього винаходу жіночу батьківську .рослину піддають генній інженерії для виникнення чоловічої стерильності при застосуванні прототоксину, тоді як чоловічу батьківську рослину піддають генній інженерії для виникнення жіночої стерильності в присутності того ж прототоксину. Для одержання гібридного насіння дві батьківські лінії висаджують разом і після застосування прототоксину в певний час протягом розвитку рослини одержують лише гібридне насіння. За допомогою цих засобів може бути одержане будь-яке бажане гібридне насіння. Для одержання гібридного насіння пшениці чоловічу батьківську рослину піддають генній інженерії для виникнення жіночої стерильності в присутності належно застосовуваного екзогенно прототоксину і жіночу батьківську рослину піддають генній інженерії для виникнення чоловічої стерильності в присутності того ж прототоксину. Обидві трансгенні батьківські лінії роблять гомозиготними і кількість насіння збільшують стандартними методами в цій галузі. Для одержання гібридного насіння гомозиготне насіння підданих генній інженерії чоловічих і жіночих батьківських ліній висаджують разом у співвідношенні чоловічих до жіночих рослин, визначеному для забезпечення ефективного запилення. В належний час протягом розвитку рослини прототоксин застосовують на полі для одержання насіння. Після дозрівання насіння збирають врожай на цілому полі, враховуючи ли ше гібридне насіння. Приклади Наступні приклади описують матеріали й способи, використані в здійсненні винаходу, і наступні результати. Вони запропоновані шляхом ілюстрацій, і їх перерахування не повинно вважатися обмеженням винаходу. Приклад 1: Рослини тютюну, які є умовними по жіночій стерильності Створювали плазміду pSH58, що містила DS13 промотор (від -339 до -79 промотору SLG13, з'єднували з від -46 до +8 промотору CaMV 35S, Dzelkalns et al, Plant cell 5: 855-863 (1993)) і з'єднували з геном argE (ПОСЛІДОВНІСТЬ №3) у вірній трансляційній рамці зчитування DS13 промотор - це промотор, активний переважно в жіночих репродуктивних органах. Ген argE одержували з геномної ДНК E.coli за допомогою PCR реакцій з праймером 5'TATCTAGACCAGAGGTGTGTC AACAAATGAA-3' (послідовність №5) і праймером 5'CGTCTAGATTGCGGC ACTGGAGTTTC-3 (послідовність №6). Створений фрагмент клонували в pGEM-TA (Strategene) і підтверджували вірність послідовності. Використовуючи цикли PCR і етапи субклонування, розміщували рослинну трансляційну консенсусну послідовність і сайт BamHI вище сайту початку трансляції argE, використовуючи PCR праймери, 5'CGCGGATCCTAAACAATGAAAAAC AAATTACCGCC-3' (послідовність №7) і GCGCCTAGGCGCTTAATGCC AGC AAAAATCC-3' (послідовність №8) Цей продукт потім приєднували нижче промотору DS13 в плазміді pSH15 (промотор DS13 в blucscnpt sk) і термінатор транскрипції nos додавали до 3' кінця гена b-глюкуронідази (GUS). Цю DS13-argE-nos касету потім приєднували як фрагмент EcoR1 в рСІВ200, що містить кінці Т-ДНК і функціональний в рослинах селективний маркер, такий як резистентність до канаміцину. Ця плазміда мала назву pSH58. Плазміду pFA100 створювали таким же чином, що й pSH58, описану вище, за винятком того, що ген argE (послідовність №3) замінює ген GUS в Stig1-GUS (Goldman et al., EMBO J. 13:2976-2984 (1994)) у вірній трансляційній рамці зчитування, використовуючи належні ферменти рестрикції. STIG1-argE потім приєднують у вектор, такий як рСІ3200, що містить кінці Т-ДНК, 3' послідовності термінації й функціональний в рослинах селективний маркер, такий як резистентність до канаміцину. Промотор Stig1 - це промотор, активний переважно в жіночих репродуктивних органах. Листкові диски тютюну трансформували, як описано в Horsch el al, Science 227:1229-1231 (1985), плазмідою pSH58. Присутність вставлених трансгенів підтверджували PCR. Нозерн-блотинг РНК, одержаної з жіночої тканини, використовували для підтвердження тканино-специфічної експресії гена argE в трансгенних рослинах. Ці рослини були самофертильними і мали фенотип умовної жіночої стерильності. Т1 насіння збирали після самозапилення. Трансген жіночої умовної стерильності pFA100 також вводили в тютюн, використовуючи такі самі процедури. Приклад 2: Рослини тютюну, які є умовними по чоловічій стерильності Створювали плазміду pSH60 з промотором ТА29 (Kriete et al., Plant J 9:809-818 (1996)) з'єднану з геном argE. Промотор ТА29 тютюну клонували за допомогою PCR, використовуючи праймери 5'-AACTGCAGCTTTTTGGTTAGCGAATGC-3' (послідовність №9) і 5¢-CAGACTAGTTTTAGCTAATTTCTTTAAGTAAAAAC-3' (послідовність №10). Серіями етапів субклонування фрагмент ТА29 з'єднували з вищого боку argE, що містить рослинну консенсусну трансляційну послідовність, як описано в Прикладі 1, і термінатор транскрипції nos додавали до 3' гена argE. ТА29-argE-nos касету клонували між кінцями Т-ДНК в плазміді pSGCGF1, яка також містить рослинний селективний маркер - гігроміцин. Створена плазміда мала назву pSH60. Листові диски тютюну трансформували, як описано в Horsch et al., Science 227:1229-1231 (1985), плазмідою pSH60. Присутність вставлених трансгенів підтверджували за допомогою PCR. Нозерн-блотинг РНК, одержаної з жіночої тканини використовували для підтвердження тканино-специфічної експресії гена argE в трансгенних рослинах. Ці рослини були самофертильними і мали фенотип умовної чоловічої стерильності. Т1 насіння збирали після самозапилення. Листкові диски тютюну також трансформували pGK73, що містить експресійну касету гена argE під контролем промотору ТА29 (Kriete et al., Plant J. 9:809-818 (1996)), як описано в Horsch et al., Science 227:12291231 (1985). Присутність вставлених трансгенів підтверджували за допомогою PCR. Нозерн-блотинг РНК, одержаної з пиляків, використовували для підтвердження тканино-специфічної експресії гена argE в трансгенних рослинах. Ці рослини були самофертильними і мали фенотип умовної чоловічої стерильності. Насіння покоління Т1 збирали після самозапилення. Приклад 3: Хімічна обробка трансформованих рослин тютюну надає тканино-специфічної стерильності Насіння покоління Т1 як з умовно жіночо-стерильними рослинами (трансформованими pFA100), так і з умовно чоловічо-стерильними рослинами (трансформованими pGK73) висаджували в ґрунт. Як тільки кільчики досягали достатнього розміру, листкову тканину перевіряли за допомогою PCR на присутність трансгена argE. PCR-позитивні рослини переносили до теплиці. Ці рослини були повністю фертильними при відсутності застосовуваного екзогенно прототоксину. Підгрупу умовно жіночо-стерильних рослин і підгрупу умовно чоловічо- стерильних рослин обообляли прототоксином ацетил-РРТ протягом стадій зростання. Внаслідок переважного перетворення прототоксину на токсин, оброблені умовно чоловічо-стерильні рослини ставали чоловічо-стерильними і умовно жіночо-стерильні рослини ставали жіночо-стерильними. Рослини, що не підлягали обробці, залишалися повністю фертильними. Пилок з оброблених жіночих стерильних рослин збирали і використовували для запилення маточок оброблених чоловічих стерильних рослин, які були жіночими батьківськими рослинами. Запліднення відбулось і гібридне насіння одержували з чоловічих стерильних рослин. Приклад 4: Одержання клонів ДНК нових генів, що переважно експресуються в жіночих репродуктивних структурах кукур удзи Спочатку ідентифікували волоть-специфічний кДНК-фрагмент, використовуючи набір для виявлення кДНК PCR-селекцією Clontech (Каталог Clontech № К1 804-1). Виділяли поліА мРНК з волоті кукурудзи, що розвивається, цілої китиці, листка і кореня тканин кукурудзи інбредної лінії CG00526 після процедур, визначених в наборі для швидкого виділення поліА мРНК (Каталог Stratagene №200348). кДНК синтезували з поліА мРНК кожної тканини і розподіляли на "тестерну кДНК", у цьому випадку представлену кДНК волоті, і "драйверну кДНК", що складалася з еквівалентної кількості кДНК китиці, листка і кореня. Виявлення кДНК і ампліфікацію PCR виконували, як описано в інструкції користувача. Продукти PCR субклонували в ТАклонуючий вектор, pCRII (Каталог In vitrogen № К2000-01). Кожний субклон піддавали скринінгу на тканинну специфічність в Нозерн-блотах з 5мкг загальної мРНК тканин волоті, китиці, листка і кореню кукурудзи. Клон В200i, у 145п.н., виявив волоть-специфічну експресію. В200і волоть-специфічний фрагмент кДНК використовували для скринінгу бібліотеки кДНК волоті, що розвивається. Створювали бібліотеку кДНК волоті, використовуючи поліА мРНК, виділену з волоті, взятої від початків 18см довжиною, згідно з процедурами, описаними детально в наборі для клонування кДНК Stratagene Zap Gigapack II Gold Cloning kit (Каталог Stratagene №200402). Клони, що гібридизувались до зонду В200і, відбирали на аналіз послідовності. Один клон, розміром 772п.н., містив послідовність зонду В200і. Цей клон, В20014-2, використовували як зонд в Нозерн-блотах, що містили 1мкг поліА мРНК з тканин волоті, китиці, листка й кореня кукурудзи. Експресію спостерігали лише у волоті. Послідовність кДНК клону В200і4-2 наведена в послідовності №1. Для того, щоб виділити відповідну геномну ділянку, використовували кДНК В200і4-2 як зонд для скринінгу геномної бібліотеки кукурудзи Мо17 (Stratagene). Виділяли l-клони, які гібридизувалися лише з зондом В200і42. Саузерн-блотинг і рестрикційне картування використовували для ідентифікації геномних фрагментів, що містять відповідну послідовність кДНК з 5' і 3¢-ділянками. Фрагмент ВаmНІ ~6,5 т.п.н. виділяли одним з позитивних l-клонів і субклонували в Bluescript SK+ (Stratagene) і називали pSH64. Геномний клон В200i4-2, pSH64, що містить 5¢ і 3'-регуляторні ділянки аналізували секвенуванням. Також використовували комп'ютеризоване сканування для ідентифікації передбачуваних промоторних елементів. Послідовність 5' і 3'-регуляторної ділянки гена, що експресується переважно в жіночих репродуктивних структурах, що міститься в геномному клоні pSH64 наведена в послідовності №11. Клон pSH64 віддавали на зберігання на умовах Будапештського договору, укладеного 27 лютого, 1998, до Відомства сільськогосподарських досліджень, колекції патентних культур (NRRL), Північного регіонального дослідницького центру, 1,815,Worth University Street, Пеорія,-штат Іллінойс 61604, США, і отримували реєстраційний номер NRRL В-21920. Рекомбінантний геном, який експресується переважно в репродуктивних структурах жіночої рослини, створювали наступним чином. 5'-регуляторну ділянку в 431 п.н. В200i ампліфікували pSH64 за допомогою PCR, використовуючи праймери: 5'-AAAACTGC AGGAATTC ACTGCTGAGGGAGCGA-3' (послідовність №12) і 5'GCGGGATCCTTCTTGCTGTAGTCCTCGACCACG-3' (послідовність №13) і клонували як фрагмент Pstl-BamHI в pSOG10, який містить GUS, з'єднаний з послідовністю термінації nos. Касету B200i-GUS-nos потім субклонували як фрагмент EcoRI в pSH64, розщеплену EcoRI, ефективно розміщуючи GUS-nos нижче від регуляторної ділянки В2001 (нуклеотиди 1-3790 послідовності №11). Ця плазміда мала назву pSH70. Регуляторну ділянку В200i з pSH70, як описано вище, клонували як Bglll-ВаmНІ фрагмент в BS-KS (Stratagene) і 3'-регуляторну ділянку В200i з pSH64 додавали нижче як фрагмент EcoRV (нуклеотид 4427-6397 послідовності №11). Ця плазміда мала назву pSH73. Плазміду pSH74 створювали частковим розщепленням BamHI pSH73 і вставленням фрагмента ДНК, що містить argЕ (з прикладу 1) в місці сайту BamHI, ефективно розміщуючи argЕ між 5' і 3'-регуляторними ділянками В200і. Приклад 5: Одержання клонів кДНК нових генів, що експресуються переважно в жіночих репродуктивних структурах пшениці Специфічний щодо маточки фрагмент кДНК виділяли з UC703 пшениці, використовуючи метод диференційного виявлення мРНК (Каталог Genhunter №М502), як описано в інструкції для набору. Праймерами, що використовували для ідентифікації специфічного щодо маточки фрагмента кДНК, були АР-18 і Т12 СА. Фрагмент субклонували в pGEM-TA клонуючий вектор (Каталог Promega №А362А) і називали Р26. Клон Р26 використовували як зонд для Нозерн-блотингу, що містить 5мкг загальної мРНК тканин маточки, пиляка, листка і кореня пшениці, і перевіряли на тканинну специфічність. Створювали бібліотеку кДНК маточки пшениці, використовуючи маточки, виділені з пшениці UC703, згідно з процедурами, визначеними в наборі для клонування кДНК Stratagene Zap GigaPack II Gold (Каталог Stratagene №200402). Клони, що гібридизувалися з зондом Р26, відбирали для аналізу послідовності. Один клон, Р26-А4, був 881п.н. довжиною і містив 203п.н послідовність Р26. Нозерн-блоти, що містили 5мкг загальної мРНК з чотирьох стадій розвитку маточок, А) початкова, Б) поява, В) зріла і Г) фертильна, а також пилку, листка й кореню, гібридизували з 881п.н. зонду Р26-А4. Експресію, що відбувалася переважно в маточці, спостерігали в маточках з дуже малою експресією в корені. Другий специфічний щодо маточки фрагмент кДНК також виділяли з UC703 пшениці, використовуючи такі самі процедури, що й вищезгадані. Цей фрагмент субклонували в pGEM-TA клонуючий вектор (Каталог Promega №A362A) і називали Р19. Клон Р19 використовували як зонд в Нозерн-блотах, що містив 5мкг загальної мРНК з тканин маточки, пиляка, листка і кореня пшениці, і перевіряли на тканинну специфічність. Створювали бібліотеку кДНК маточки пшениці, як описано вище. Клони, що гібридизувалися з зондом Р19, відбирали для аналізу послідовності. Один клон, P19-QA, був 649п.н. довжиною і містив послідовність Р19. Нозерн-блоти, що містили 5мкг загальної мРНК з чотирьох стадій розвитку маточок, А) початкова, Б) появлення, В) зріла і Г) фертильна, а також пилку, листка й кореню, гібридизували з зондом 649 P19-QA. Експресія переважно відбувалася в маточці. Приклад 6: Одержання геномних клонів нових генів, що експресуються переважно в репродуктивних структурах жіночої рослини пшениці, і ідентифікація промоторної ділянки Для того, щоб виділити відповідну геномну ділянку, кДНК Р26-А4 використовували як зонд для скринінгу звичайної геномної бібліотеки пшениці UC703, одержаної з двохтижневих кільчиків. Бібліотеку створювали частковим розщепленням Mbol загальної геномної ДНК з наступним приєднанням 8-22т.п.н. фракції з ВаmНІрозщепленої l-EMBL3 ДНК (Каталог Clontech № CS 1013j). Виділяли l-клони, які гібридизувалися лише з зондом Р26-А4. Саузерн-блотинг і рестрикційне картування використовували для ідентифікації геномних фрагментів, що містили відповідні послідовності кДНК з 5і і 3'-ділянок. 5.5т.п.н. фрагмент Xbal виділяли з одного з позитивних l-клонів і субклонували в Bluescript SK+ (Stratagene). Ця плазміда мала назву рСlВ10302. Клон Р26-А4 віддавали на зберігання на умовах Будапештського договору, укладеного 27 лютого, 1998, до Відомства сільськогосподарських досліджень, колекції патентних культур (NRRL), Північного регіонального дослідницького центру, 1815 North University Street, Пеорія, штат Іллінойс 61604, США, і отримували реєстраційний номер NRRL В-21655. Геномний клон Р26-А4, рСІВ 10302, що містить 5'-регуляторні ділянки, аналізували секвенуванням. Також використовували комп'ютерне сканування для ідентифікації передбачуваних промоторних елементів. Далі 5'ділянки піддавали картуванню ендонуклеазами рестрикції й визначали початковий сайт транскрипції за допомогою способів RACE PCR і захистом РНКазою. Послідовність 5'-регуляторної ділянки гена, що експресується переважно в жіночих репродуктивних органах і міститься в геномному клоні Р26-А4, наведена в послідовності №2. Для, того, щоб виділити відповідну геномну ділянку кДНК Р19 використовували як зонд для скринінгу звичайної геномної бібліотеки пшениці UC703, одержаної з двотижневих кільчиків, як описано в прикладі 6. Виділяли l-клони, які гібридизувалися лише з зондом Р19. Саузерн-блотинг і рестрикційне картування використовували для ідентифікації геномних фрагментів, що містили відповідні послідовності кДНК з 5' і 3'ділянок. Фрагмент Xhol ~8т.п.н. виділяли з одного з позитивних l-клонів і субклонували в Bluescript SK+ (Stratagene), що одержала назву Х2-1. Геномний клон Р19, що містив 5' і 3'-регуляторні ділянки аналізували секвенуванням послідовності. Також використовували комп'ютерне сканування для ідентифікації передбачуваних промоторних елементів. Далі, 5і і 3'-ділянки піддавали картуванню ендонуклеазами рестрикції. Послідовність 5'-регуляторної ділянки гена, що експресується переважно в жіночих репродуктивних структурах, що містилась в геномному клоні Х2-1, наведена в послідовності №14. Клон Х2-1 віддавали на зберігання на умовах Будапештського договору, укладеного 27 лютого, 1998, до Відомства сільськогосподарських досліджень, колекції патентних культур (NRRL), Північного регіонального дослідницького центру, 1815 North University Street, Пеорія, штат Іллінойс 61604, США, і о тримували реєстраційний номер NRRL В-21919. Приклад 7: Створення складених генів, які експресуються переважно в репродуктивних структура х жіночої рослини Створювали плазміду pFA200 за допомогою функціонального з'єднання, - .використовуючи стандартні способи, відомі у галузі, наступних компонентів: 1) регуляторних ділянок Р26, як описано вище (nts 1-3987), 2) фрагмента ДНК, що містить ген argE, підданий генній інженерії зі створенням сайтів рестрикції дляприєднання ATG відкритої рамки зчитування argE в рамку з сайтом початку трансляції (ATG у nt 3987) фрагмента Р26, таким чином, приєднуючи вище регуляторну ділянку Р26 з argE і 3) вектор, що містить 3'послідовності термінації, які є функціональними в рослинах Експресія argE під контролем промотору Р26 приведе до утворення продукту гена argE переважно в жіночій репродуктивній структурі рослини. 5'-регуляторні ділянки Р19 (нуклеотиди 1-1093 послідовності №14), розрізані Pst І, сайт фермента рестрикції, знайдений вище від послідовностей Р19 в плазміді Х2-1, і Ncol (нуклеотид 1088 послідовності №14) в місці ATG P19, приєднували до pSOG15, розрізану Pstl і Ncol (pSOG15 містить ген GUS і термінатор nos з сайтом Pstl, що знаходиться з 5' кінця до гена GUS і Nco І у місці ATG гена GUS). Ця плазміда мала назву рХВІ. Плазміду p19arg створювали, використовуючи стандартні способи, відомі у галузі, функціональним з'єднанням наступних компонентів: 1) регуляторні ділянки Р19, як описано вище, 2) фрагмент ДНК, що містить ген argE підданий генній інженерії зі створенням сайтів рестрикції для приєднання ATG відкритої рамки зчитування argЕ в рамку з сайтом початку трансляції (ATG у положенні 1090 послідовності №14) фрагмента Р19, таким чином приєднуючи вище регуляторну ділянку Р19 з argЕ і 3) вектор, що містить 3'-послідовності термінації, які є функціональними в рослинах. Експресія argЕ під контролем промотору Р26 приведе до утворення продукту гена argЕ переважно в жіночій репродуктивній структурі рослини. Короткочасну експресію генів у репродуктивних структурах жіночої рослини визначали передачею інтактним тканинам. Квіткову тканину пшениці (маточки й пиляки) висаджували на середовище Мурашиге (Murashige) і Скуга (Skoog), що містить 15% мальтозу. ДНК р ХВІ або pSH70 осаджували на мікрометрові золоті частки, використовуючи стандартні процедури. Дві пластинки-мішені з 20 маточками і пиляками на мішень обстрілювали 2 або 3 рази з гелієвим пристроєм DuPont Biolistics®, використовуючи розривний тиск 7,58МПа. Пластинки обстрілювали з використанням 80 - коміркового фільтру між платформою каретки й мішенню. Мішені розміщували в темряві при 26°С протягом 16 годин після бомбардування перед тим, як тканини переносили до середовища для розвитку GUS (100мг Х-глюк. в 200мл 0.05М фосфату натрію рН 7) протягом від 2 до 24 годин при 37°С. Гени GUS в рХВІ і pSH70 проявляли активність GUS в маточках. Контрольні аналізи трансформації pSH70 у тканинах волоті кукурудзи виявили експресію GUS в жіночих тканинах. Приклад 8: Трансформація пшениці рекомбінантним геном, який кодує протеїн, що каталізує перетворення прототоксину на токсин переважно в жіночих репродуктивних стр уктура х Незрілі ембріони (0,75-1,0мм довжиною) генотипу UC703 висаджували на середовище Мурашиге і Скуга, що містить 3мг/л 2,4-D і 3% цукрози. Після приблизно 4 годин ембріони висаджували віссю ембріонів до низу на планшети, що містили середовище Мурашиге та Скуга з 15% мальтозою, 3% цукрозою і 3мг/л 2,4-D, вкриті фільтрувальним папером, що підтримував блок агарози, який містив ті самі компоненти. Ембріони піддавали плазмолізу протягом 2-3 годин перед бомбардуванням. ДНК pFA200 і pS0G35 осаджували на мікрометрові золоті часточки, використовуючи стандартні процедури. Чотири пластинки-мішені з 20 ембріонами на мішень бомбардували двічі гелієвим пристроєм DuPont Biolistics®, використовуючи розривний тиск 7,58МПа. Пластинки обстрілювали з використанням 80коміркового фільтру між платформою каретки й мішенню. Мішені розміщували в темряві при 26°С протягом 24 годин після бомбардування перед тим, як блоки з ембріонами викладали на планшети, що містили середовище Мурашиге та Скуга з 3мг/л 2,4-D і 3% цукрозою. Окремі ембріони видаляли з блоків і розміщували прямо на свіже середовище того ж складу після ще 48 годин. Приблизно через 6 тижнів після перенесення гена відповідну тканину розміщували на середовище Мурашиге та Скуга з 3мг/л 2,4-D і 3% цукрози з 0,2мг/л метотрексату протягом 3 тижнів. Потім тканину переносили на регенераційне середовище, що складалося з середовища Мурашиге та Скуга з 1мг/л zeatin riboside і 1мг/л метотрексату. Після 2 тижнів, регенеровані кільчики переносили до стерильних контейнерів, що мали назву "GA7s" з половинною іонного силою солей середовища Мурашиге та Скуга, 2% цукрози, 1мг/л NAA і або 4, або 8мг/л метотрексату. В іншому прикладі незрілі ембріони (0,75-1,0мм довжиною) генотипу UC703 обробляли, як описано вище, за винятком того, що використовували середовище Мурашиге та Скуга, що містило 2мг/л 2,4-D. Після приблизно 4 годин ембріони висаджували віссю ембріону до низу на планшети, що містили середовище Мурашиге та Скуга з 15% мальтозою, 3% цукрозою і 2мг/л 2,4-D, вкриті фільтрувальним папером, що підтримував блок агарози, який містив ті самі компоненти. Ембріони піддавали плазмолізу протягом 2-3 годин перед бомбардуванням. ДНК pFA200, pSH74 або p19arg, разом з pUbi-Hyg, що містили промотор убіквітину кукурудзи, функціонально з'єднаний з геном гігроміцинфосфотрансферази, осаджували на мікрометрові золоті часточки, використовуючи стандартні процедури. Чотири пластинки-мішені з 20 ембріонами на мішень бомбардували двічі гелієвим пристроєм DuPont - Biolistics®, використовуючи розривний тиск 7,58МПа Пластинки обстрілювали з використанням 80-коміркового фільтру між платформою каретки й мішенню. Мішені розміщували в темряві при 26°С протягом 24 годин після бомбардування перед тим, як блоки з ембріонами викладали на планшети, що містили середовище Мурашиге та Скуга з 3мг/л 2,4-D і 3% цукрозою. Приблизно за 3 тижні після перенесення гена, відповідну тканину розміщували на середовище Мурашиге та Скуга з 3мг/л 2,4-D і 3% цукрози. Потім тканину переносили на регенераційне середовище, що складалося з середовища Мурашиге та Скуга з 3% цукрози, 5мг/л GA3, 1мг/л N AA і 20 мг/л гігроміцину. За 2 тижні тканину, що регенерується, переносять на середовище Мурашиге та Скуга з 3% цукрозою і 20мг/л гігроміцином. За 2 тижні, що регенерується, переносять до стерильних контейнерів, що мали назву "GA7s" з половинною іонною силою солей середовища Мурашиге та Скуга, 2% цукрози, 1мг/л NAA та 20мг/л гігроміцину. ДНК екстрагували з тканини листків рослин, що були піддані трансформації, і проводили PCR на присутність генів dhfr або hyg селективних маркерів і гена argЕ. PCR-позитивні рослини переносили до теплиці для розмноження. Протягам етапів цвітіння збирали маточки з кожної трансгенної рослини і РНК, одержаної з цієї тканини. Експресію argЕ підтверджували Нозерн-блотингом. Рослин піддавали самозапиленню і збирали насіння. Приклад 9: Одержання складених генів, які експресуються переважно в чоловічих репродуктивних структурах Плазміду pGK73 використовують як початковий матеріал. Видаляли послідовності термінації TA29-argE-3' як касету з вектора Agrobacterium-опосередкованої трансформації і вставляли в pBluescript KS+, використовуючи належні ферменти рестрикції. Створена плазміда мала назву рМА200. Пиляк-специфічний промотор В6 створювали з плазміди pSGBNEI, яка містила 3т.п.н. геномний клон, субклонований як фрагмент EcoRI-Nhel з pSGB6gl (див. патент США №5470359). Кінці фрагменту 1558п.н. Apal I/Xbal робили "тупими", клонували в Bluescript (KS) у Sma І сайт. Трансляційний конструкт гена агдЕ створювали, як було попередньо описано в Прикладі 2. Створена плазміда мала назву pSH68. Пилок-специфічний промотор Zmg 1т.п.н. фрагмент Hindlll-PpuMI Zmg13 (Hamilton et al. Sexual Plant Reproduction 2, 208-212 (1989)) клонували з рСІВ391 в bluescript, як фрагмент Hindlll-Smal. Додавали ділянку термінації транскрипції nos як фрагмент BamHI-Xbal. Потім приєднували кодуючу послідовність для argЕ як BamHI фрагмент (з Прикладу 1) у сайт BamHI, ефективно розміщуючи argЕ між промотором Zmg і послідовністю термінації nos. Ця плазміда мала назву Zmgarg. Приклад 10: Трансформація пшениці рекомбінантним геном, який експресується переважно в чоловічих репродуктивних органах Плазміди pUbi-Hyg, що містили промотор убіквітину кукурудзи, функціонально з'єднували з геном гігроміцинфосфотраисферази, і рМА200, pSH68 або pZmgarg використовували як рекомбінантні послідовності для трансформації незріліх ембріонів пшениці, як описано в Прикладі 8. Рослини регенерували і PCR використовували для підтвердження присутності трансгена argЕ. Трансгенні рослини переносили до теплиці. Пиляки і РНК, одержану з цієї тканини, збирали протягом етапів цвітіння і експресію argЕ підтверджували Нозерн-блотингом. Рослини піддавали самозапиленню і збирали насіння. Приклад 11: Трансформація кукурудзи рекомбінантним геном, який кодує протеїн, що каталізує перетворення прототоксину на токсин переважно в жіночих репродуктивних стр уктура х Одержували калус типу І з незрілих зиготичних ембріонів генотипу CG00526, використовуючи стандартні способи культивування. Для перенесення гена приблизно 300мг калусу тип у І готували нарізанням лезом скальпелю, промиваючи 3 рази стандартним культуральним середовищем, що містило 18% цукрози, і відразу переносили на напівтверде культуральне середовище, що містило 18% цукрози. За приблизно 4 години тканину бомбардували, використовуючи пристрій PDS-1000/He від BioRad. Одну з наступних плазмід. pFA200, pSH74 або p19arg, разом з pSOG35, осаджували на мікрометрові золоті частки, використовуючи стандартний протокол від BioRad. Приблизно за 16 годин після перенесення гена калус переносили на стандартне культуральне середовище, що містило 2% цукрозу і 2мг/л метотрексату. Калус субкультивували на селекційне середовище протягом 8 тижнів, після чого калус, що вижив ріс переносили до стандартного середовища для регенерації для одержання рослин. Одержують рослини і дають їм номери. Рослини перевіряли за допомогою PCR на присутність гена argЕ і PCR-позитивні рослини переносили до теплиці. Під час цвітіння збираликолоски, одержували РНК з цих тканин і експресію argЕ підтверджували Нозерн-блотингом. Як альтернатива, рослини трансгенної кукурудзи одержують бомбардуванням мікрочастками незрілих ембріонів. Колоски генотипу CG00526 піддають самозапиленню і незрілі зиготичні ембріони одержують приблизно за 10 днів. Приблизно 840 незрілих зиготичних ембріонів розподіляли серед 14 різних пластинокмішеней, що містили середовище, здатне індукувати і підтримувати утворення ембріогенного калусу. Незрілі зиготичні ембріони переносили відразу на те ж середовище, але яке містило 12% цукрози. За 5 годин незрілі зиготичні ембріони бомбардували з pFA200 або pSH74 або p19arg, разом з pSOG35, використовуючи пристрій PDS-1000/He від BioRad. Плазміни осаджували на мікрометрові золоті частинки згідно з опублікованою процедурою від BioRad, як описано вище. Частинки прискорювали, використовуючи розривний тиск гелію 10,68МПа. Кожну пластинку-мішень обстрілювали двічі препаратом плазміди і золотих часток. Селекційний агент метотрексат застосовують у дозі 2мг/л в день перенесення гена і підвищували дозу після приблизно одного місяця. Таким чином одержаний ембріогенний калус регенерували в присутності селекційного агента метотрексату. Одержують рослини і дають їм номери. Рослини перевіряли за допомогою PCR на присутність гена argЕ і PCR-позитивні рослини переносили до теплиці. Під час цвітіння збирали колоски, одержували РНК з цих тканин і експресію argЕ підтверджували Нозерн-блотингом. Приклад 12: Трансформація кукурудзи складеним геном, який кодує протеїн, що каталізує перетворення прототоксину на токсин переважно в чоловічих репродуктивних стр уктура х Плазміди рМА200, pSH68 або pZmgarg і pSOG35 використовують як рекомбінантні послідовності для трансформації незрілих ембріонів кукурудзи, як описано в Прикладі 11. Рослини регенерують і PCR використовують для підтвердження присутності трансгена argЕ. Трансгенні рослини переносили до теплиці. Під час цвітіння збирали качани, одержували РНК з цих тканин і експресію argЕ підтверджували Нозернблотингом. Рослини піддавали самозапиленню і збирали насіння. Приклад 13: Трансформація ячменю, який кодує протеїн, що каталізує перетворення прототоксину на токсин переважно в жіночих репродуктивних структурах Збирали колоски ячменю (сорту Golden Promise) з незрілими ембріонами приблизно від 1,5 до 2,5мм у розмірі, поверхню стерилізували 15% (г/г) знебарвлювачем (5,25% гіпохлорит натрію) протягом 10 хвилин і промивали п'ять разів стерильною водою. Незрілі ембріони вирізалися з молодих зернівок і розрізались вздовж. їх висаджували на середовище, що індукувало калус (Wan і Lcmaux, Plant Physiology 104.37-48 (1994)), що містило основні солі Мурашига та Скуга з 30г/л мальтози, 1мг/л тіамін-НСІ, 0,25г/л міо-інозитолу, 1г/л гідролізату казеїну, 0,69г/л проліну, 2,5мг/л дикамба і піддавали загущенню 3,5г/л Ph ytagel®(Sigma). Для бомбардування ембріонів ембріони інкубували щи тком до верху в темряві при 24-28°С протягом 1-3 днів. В день трансформації ембріони розміщували в центрі ча шки Петрі (100х15мм) з утворенням кільця ДНК з плазмід pFA200 або pSH74, або p19arg, разом з pUbi-hyg осаджували на 0,6 або 1,0мкм золотих частках (BioRad) згідно з інструкцією DuPont Biolistic Particle Delivery Systems. Кожну чашку з ембріонами бомбардували раз гелієвим пристроєм DuPont PDS-1000, використовуючи розривний тиск 7,58МПа. Після бомбардування ембріони переносили до свіжого середовища для індукції калусу щитком до низу. За 3-7 днів після бомбардування ембріони переносили до селекційного середовища (середовище для індукції калусу 10мг/л гігроміцину) протягом приблизно 14 днів. Калус, що утворився, подрібнюють на маленькі шматки і зберігають окремо. У наступних культивуваннях калус переносять на свіже селекційне середовище з 20мг/л гігроміцину приблизно кожні 21-28 дні. Після 2-3 культивувань калус, що вижив, переносили до FHG середовища (Hunter, Ph.D. thesis. Wye College, University of London, Ashford, Kent, 1988) з 1-3мг/л 6-бензил-амінопурину і 10-20мг/л гігроміцину для регенерації рослин. Рослини регенерували при 23-25°С під флуоресцентним світлом. Зелені кільчики, що утворилися, або паростки, переносили до основного середовища Мурашиге та Скуга, що не містило гормонів, у 25х100мм чашку Петрі. Рослини переносили до контейнера Magenta GA7 для подальшого розвитку, коли вони досягли 2-3см у розмірі. Для бомбардування калусу ембріони інкубували щитком до низу в темряві при 24-28°С протягом принаймні 10 днів. У день трансформації ембріогенний калус з культивованих ембріонів подрібнювали на маленькі шматки і розміщували в центрі чашки Петрі. Перенесення ДНК і наступні етапи регенерації рослин такі самі, як і ті, що описані в способі бомбардування ембріонів. Рослини перевіряли за допомогою PCR на присутність трансгена і ті, що виявились позитивними, переносили до теплиці. Під час цвітіння збирали колоски і одержували РНК з цих тканин. Експресію argE підтверджували Нозерн-блотингом. Рослин піддавали самозапиленню і збирали насіння. Приклад14: Трансформація ячменю складеним геном, який кодує протеїн, що каталізує, перетворення прототоксину на токсин переважно в чоловічих репродуктивних стр уктура х Використовували плазміди рМА200 або pSH68, або pZmgarg і pUbi-Hyg як рекомбінантні послідовності для трансформації незрілих ембріонів ячменю і калусу, як описано в Прикладі 13. Рослини регенерували і PCR використовували для підтвердження присутності трансгена argE. Трансгенні рослини переносили до теплиці. Під час цвітіння збирали качани, одержували РНК з цих тканин і експресію argE підтверджували Нозернблотингом. Рослини піддавали самозапиленню і збирали насіння. Приклад 15: Хімічна обробка трансформованих рослин надає умовної стерильності Насіння з покоління Т1 рослин, трансформованих pFA200 або pSH74, або p19arg (що надає умовної жіночої стерильності) і рослин, трансформованих рМА200 або pSH68, або pZmgarg (що надає умовної чоловічої стерильності) висаджували в гр унт. Як тільки кільчики виростали до достатніх розмірів, тканину листка перевіряли за допомогою PCR на присутність трансгена argE. PCR-позитивні рослини переносили до теплиці. Ці рослини були повністю фертильними. Підгрупу рослин, що містили pFA200 або pSH74, або p19arg, і підгрупу, що містила рМА200 або pSH68, або pZmarg, обробляли прототоксином ацетил-РРТ протягом зростання. Рослини, трансформовані рМА200 або pSH68, або pZmgarg (гомозиготи, потрібні для конструкту промотору Zmgarg пилку), були чоловічо-стерильними внаслідок перетворення ацетил-РРТ на РРТ в чоловічих репродуктивних стр уктура х. Рослини, трансформовані pFA200 або pSH74, або p19arg, були жіночо-стерильними внаслідок перетворення ацетил-РРТ на РРТ в репродуктивних структурах жіночої рослини. Необроблемі рослини, трансформовані pFA200, або pSH74, , або p19arg і рМА200, або pSH68, або pZmgarg були повністю фертильними. Приклад 16: Одержання гібридного насіння пшениці, використовуючи трансгенні рослини, які перетворюють прототоксин на токсин в репродуктивних структурах жіночої рослини Трансгенні рослини пшениці з Прикладів 8 і 10, які були трансформовані pFA200 або pSH74, або р19arg (що надає умовної жіночої стерильності) і рМА200 або pSH68, або pZmgarg (що надає умовної чоловічої стерильності), піддають селекції як рослинні лінії, гомозиготні по кожному трансгенові, і насіння розмножують стандартними способами. Гомозиготне насіння з рослин, що містило pFA200 або pSH74, або p19arg, і рослин, що містили рМА200 або pSH68, або pZmgarg висаджували в співвідношенні чоловічих до жіночих батьківських, достатнім для забезпечення ефективного перенесення пилку У певний час протягом розвитку рослини прототоксин ацетил-РРТ застосовують в польових умовах. Після дозрівання насіння збирають врожай з цілого поля, вибираючи лише гібридне насіння. Усі публікації та патентні заявки, згадані в цьому описі, розраховані на рівень фахівців у галузі, яких цей винахід стосується. Усі публікації та патентні заявки включені сюди шляхом посилання так само, як і кожна окрема публікація або патентна заявка була особливо й окремо вказана як така, що включена шляхом посилання. Хоча ви щезгаданий винахід був описаний в деяких місцях шля хом ілюстрації і прикладу з метою чіткості пояснення, буде очевидно, що певні зміни й модифікації можуть бути зроблені, не виходячи з об'єму доданої формули винаходу. СПИСОК ПОСЛІДОВНОСТЕЙ (1) ЗАГ АЛЬНІ ДАНІ: (і) ЗАЯВНИК Кроссланд, Лілі Д Харпер, Стасі М (іі) НАЗВА ВИНАХОДУ СПОСІБ ОДЕРЖАННЯ ГІБРИДНОГО НАСІННЯ З ВИКОРИСТАННЯМ УМОВНОЇ ЖІНОЧОЇ СТЕРИЛЬНОСТІ (ііі) КІЛЬКІСТЬ ПОСЛІДОВНОСТЕЙ 14 (iv) АДРЕС А ДЛЯ ЛИСТУВАННЯ (A) АДРЕСАТ: No vartis Corporation- Patent & Trademark Dept. (Б) ВУЛИЦЯ: Р О. Bo x 12257 (Б) МІСТО: Research Triangle Park (Г) ШТАТ: NCNY (Д) КРАЇНА: USA (Е) ІНДЕКС: 22057 (v) ЕЛЕКТРОННИЙ ВАРІАНТ: (А) ТИП НОСІЯ: Гнучкий диск (Б) КОМП'ЮТЕР- ІВМ-сумісний (Б) ОПЕРАЦІЙН А СИСТЕМА PC-DOS/MS-DOS (Д) ПРОГРАМНЕ ЗАБЕЗПЕЧЕННЯ Patentin Release ft 1.0, Version #1.30 (vi) ДАНІ ЩОДО ЦІЄЇ ЗАЯВКИ: (А) НОМЕР ЗАЯВКИ: US TBA (Б) ДАТА РЕЄСТРАЦІЇ: 27 02 1998 (Б) КЛАСИФІКАЦІЯ: (vii) ДАНІ ЩОДО ПОПЕРЕДНЬОЇ ЗАЯВКИ: (А) НОМЕР ЗАЯВКИ: US (prov) (vііi) ДАНІ ЩОДО АДВОКАТА/АГЕНТА (А) ІМ'Я Пейс, Гарі М (Б) РЕЄСТРАЦІЙНИЙ НОМЕР 40403 (Б) НОМЕР СПРАВИ/НОМЕР РЕЄСТРА: CGC 1915/Reg (іх) ТЕЛЕКОМУНІКАЦІЙНІ ДАНІ: (А) ТЕЛЕФОН: 919-541-8582 (Б) ТЕЛЕФАКС: 919-541-8689 (2) ДАНІ ЩОДО ПОСЛІДОВНОСТІ №1: (і) ХАРАКТЕРИСТИКИ ПОСЛІДОВНОСТІ: (А) ДОВЖИНА: 772 base pairs (Б) ТИП: нуклеїнова кислота (Б) ЛАНЦЮГОВІСТЬ: одинична (Г) ТОПОЛОГІЯ: лінійна (іі) ТИП МОЛЕКУЛИ: інша нуклеїнова кислота (А) ОПИС: /опис = "послідовність кДНК для транскрипту, що транскрибується переважно в жіночих репродуктивних органах, має назву В200і4-2" (ііі) ГІПОТЕТИЧНІСТЬ: немає (хі) ОПИС ПОСЛІДОВНОСТІ: послідовність №1: (2) ДАНІ ЩОДО ПОСЛІДОВНОСТІ №2: (і) ХАРАКТЕРИСТИКИ ПОСЛІДОВНОСТІ: (А) ДОВЖИНА 4126п.н. (Б) ТИП: нуклеїнова кислота (Б) ЛАНЦЮГОВІСТЬ: одинична (Г) ТОПОЛОГІЯ: лінійна (іі) ТИП МОЛЕКУЛИ: ДНК (геномна) (ііі) ГІПОТЕТИЧНІСТЬ: не має (іх) ВЛАСТИВІСТЬ: (А) ІМ'Я/КЛЮЧ: ТАТА_сигнал (Б) РОЗТАШУВАННЯ: 3864 (іх) ВЛАСТИВІСТЬ: (А) ІМ'Я/КЛЮЧ: misc_властивість (Б) РОЗТАШУВАННЯ: 3912 (Г) ІНША ІНФОРМАЦІЯ: /функція="сайт початку транскрипції" (іх) ВЛАСТИВІСТЬ: (А) ІМ'Я/КЛЮЧ: misc_властивість (Б) РОЗТАШУВАННЯ: 3983 (Г) ІНША ІНФОРМАЦІЯ: /функція = "сайт ATG, використаний для трансляційних з'єднань" (хі) ОПИС ПОСЛІДОВНОСТІ: послідовність №2: (2) ДАНІ ЩОДО ПОСЛІДОВНОСТІ №3: (і) ХАРАКТЕРИСТИКИ ПОСЛІДОВНОСТІ: (А) ДОВЖИНА: 2070 пар основ (Б) ТИП: нуклеїнова кислота (Б) ЛАНЦЮГОВІСТЬ: одинична (Г) ТОПОЛОГІЯ: лінійна (ii) ТИП МОЛЕКУЛИ: ДНК (геномна) (iii) ГІПОТЕТИЧНІСТЬ: немає (іх) ВЛАСТИВІСТЬ: (А) ІМ'Я/КЛЮЧ: CDS (Б) РОЗТАШУВАННЯ: 211..1362 (Г) ІНША ІНФОРМАЦІЯ: /продукт= "N-ацетилорнітинза" (хі) ОПИС ПОСЛІДОВНОСТІ : послідовність №3: (2) ДАНІ ЩОДО ПОСЛІДОВНОСТІ №4: (і) ХАРАКТЕРИСТИКИ ПОСЛІДОВНОСТІ: (А) ДОВЖИНА- 384 амінокислоти (Б) ТИП: амінокислота (Г) ТОПОЛОГІЯ: лінійна (іі) ТИП МОЛЕКУЛИ: протеїн (хі) ОПИС ПОСЛІДОВНОСТІ: послідовність №4: (2) ДАНІ ЩОДО ПОСЛІДОВНОСТІ №5: (і) ХАРАКТЕРИСТИКИ ПОСЛІДОВНОСТІ: (А) ДОВЖИНА: 31п.н. (Б) ТИП: нуклеїнова кислота (Б) ЛАНЦЮГОВІСТЬ: одинична (Г) ТОПОЛОГІЯ: лінійна (іі) ТИП МОЛЕКУЛИ' інша нуклеїнова кислота (А) ОПИС: /опис = "праймер для argE" (ііі) ГІПОТЕТИЧНІСТЬ: немає (хі) ОПИС ПОСЛІДОВНОСТІ: послідовність №5: (2) ДАНІ ЩОДО ПОСЛІДОВНОСТІ №6: (і) ХАРАКТЕРИСТИКИ ПОСЛІДОВНОСТІ: (A) ДОВЖИНА: 26п.н. (Б) ТИП: нуклеїнова кислота (B) ЛАНЦЮГОВІСТЬ: одинична (Г) ТОПОЛОГІЯ: лінійна (іі) ТИП МОЛЕКУЛИ: інша нуклеїнова кислота (А) ОПИС: /опис = "праймер для argE" (ііі) ГІПОТЕТИЧНІСТЬ: немає (хі) ОПИС ПОСЛІДОВНОСТІ: послідовність №6: (2) ДАНІ ЩОДО ПОСЛІДОВНОСТІ №7: (і) ХАРАКТЕРИСТИКИ ПОСЛІДОВНОСТІ: (A) ДОВЖИНА: 35п.н. (Б) ТИП: нуклеїнова кислота (B) ЛАНЦЮГОВІСТЬ: одинична (Г) ТОПОЛОГІЯ: лінійна (іі) ТИП МОЛЕКУЛИ: інша нуклеїнова кислота (А) ОПИС: /опис = "праймер для argE" (ііі) ГІПОТЕТИЧНІСТЬ: немає (хі) ОПИС ПОСЛІДОВНОСТІ: послідовності №7: (2) ДАНІ ЩОДО ПОСЛІДОВНОСТІ №8: (і) ХАРАКТЕРИСТИКИ ПОСЛІДОВНОСТІ: (A) ДОВЖИНА: 31п.н. (Б) ТИП: нуклеїнова кислота (B) ЛАНЦЮГОВІСТЬ: одинична (Г) ТОПОЛОГІЯ: лінійна (іі) ТИП МОЛЕКУЛИ: інша нуклеїнова кислота (А) ОПИС: /опис =- "праймер для argЕ" (ііі) ГІПОТЕТИЧНІСТЬ: немає (хі) ОПИС ПОСЛІДОВНОСТІ: послідовність №8: (2) ДАНІ ЩОДО ПОСЛІДОВНОСТІ №9: (і) ХАРАКТЕРИСТИКИ ПОСЛІДОВНОСТІ: (A) ДОВЖИНА: 27п.н. (Б) ТИП: нуклеїнова кислота (B) ЛАНЦЮГОВІСТЬ: одинична (Г) ТОПОЛОГІЯ лінійна (іі) ТИП МОЛЕКУЛИ: інша нуклеїнова кислота (А) ОПИС: /опис = "праймер для ТА29" (ііі) ГІПОТЕТИЧНІСТЬ: немає (хі) ОПИС ПОСЛІДОВНОСТІ: послідовність №9: (2) ДАНІ ЩОДО ПОСЛІДОВНОСТІ №10: (і) ХАРАКТЕРИСТИКИ ПОСЛІДОВНОСТІ: (A) ДОВЖИНА: 35 п.н. (Б) ТИП: нуклеїнова кислота (B) ЛАНЦЮГОВІСТЬ: одинична (Г) ТОПОЛОГІЯ: лінійна (іі) ТИП МОЛЕКУЛИ: інша нуклеїнова кислота (А) ОПИС: /опис = "праймер для ТА29" (ііі) ГІПОТЕТИЧНІСТЬ: немає (хі) ОПИС ПОСЛІДОВНОСТІ: послідовність №10: (2) ДАНІ ЩОДО ПОСЛІДОВНОСТІ №11: (і) ХАРАКТЕРИСТИКИ ПОСЛІДОВНОСТІ: (A) ДОВЖИНА. 6596п.н (Б) ТИП: нуклеїнова кислота (B) ЛАНЦЮГОВІСТЬ: одинична (Г) ТОПОЛОГІЯ: лінійна (іі) ТИП МОЛЕКУЛИ: ДНК (геномна) (iiі) ГІПОТЕТИЧНІСТЬ: немає (іх) ВЛАСТИВІСТЬ: (A) ІМ'Я/КЛЮЧ: промотор (Б) РОЗТАШУВАННЯ: 1..3790 (B) СПОСІБ ІДЕНТИФІКАЦІЇ: експериментальний (Г) ІНША ІНФОРМАЦІЯ- /функція = "5'-регуляторна ділянка В200i4-2" /доказ = експериментально (іх) ВЛАСТИВІСТЬ: (A) ІМ'Я/КЛЮЧ: misc_сигнал (Б) РОЗТАШУВАННЯ: 4427..6397 (B) СПОСІБ ІДЕНТИФІКАЦІЇ: експериментальний (Г) ІНША ІНФОРМАЦІЯ: /функція= "3'-регуляторна ділянка В200i4-2" /доказ = експериментально (іх) ВЛАСТИВІСТЬ: (А) ІМ'Я/КЛЮЧ: misc_властивість (Б) РОЗТАШУВАННЯ: 3789..3791 (О ІНША ІНФОРМАЦІЯ: /function= "ATG translation start" (іх) ВЛАСТИВІСТЬ: (А) ІМ'Я/КЛЮЧ: misc_властивість (Б) РОЗТАШУВАННЯ: 4402..4404 (Г) ІНША ІНФОРМАЦІЯ: /функція="термінація трансляції" (хі) ОПИС ПОСЛІДОВНОСТІ: послідовність №11: (2) ДАНІ ЩОДО ПОСЛІДОВНОСТІ ID №12 (і) ХАРАКТЕРИСТИКИ ПОСЛІДОВНОСТІ: (A) ДОВЖИНА: 32п.н. (Б) ТИП: нуклеїнова кислота (B) ЛАНЦЮГОВІСТЬ: одинична (Г) ТОПОЛОГІЯ: лінійна (іі) ТИП МОЛЕКУЛИ: інша нуклеїнова кислота (А) ОПИС: /опис =- "праймер для В200i" (iii) ГІПОТЕТИЧНІСТЬ: немає (хі) ОПИС ПОСЛІДОВНОСТІ: послідовність №12: (2) ДАНІ ЩОДО ПОСЛІДОВНОСТІ №13: (і) ХАРАКТЕРИСТИКИ ПОСЛІДОВНОСТІ: (A) ДОВЖИНА: 33п.н. (Б) ТИП: нуклеїнова кислота (B) ЛАНЦЮГОВІСТЬ: одинична (Г) ТОПОЛОГІЯ: лінійна (іі) ТИП МОЛЕКУЛИ: інша нуклеїнова кислота (А) ОПИС: /опис = "праймер для В200i" (ііі) ГІПОТЕТИЧНІСТЬ: немає (хі) ОПИС ПОСЛІДОВНОСТІ: послідовності №13: (2) ДАНІ ЩОДО ПОСЛІДОВНОСТІ №14: (і) ХАРАКТЕРИСТИКИ ПОСЛІДОВНОСТІ: (A) ДОВЖИНА: 1093п.н. (Б) ТИП: нуклеїнова кислота (B) ЛАНЦЮГОВІСТЬ: одинична (Г) ТОПОЛОГІЯ: лінійна (іі) ТИП МОЛЕКУЛИ: ДНК (геномна) (ііі) ГІПОТЕТИЧНІСТЬ: немає (іх) ВЛАСТИВІСТЬ: (A) ІМ'Я/КЛЮЧ: misc_властивість (Б) РОЗТАШУВАННЯ: 1090..1092 (B) СПОСІБ ІДЕНТИФІКАЦІЇ: експериментальний (Г) ІНША ІНФОРМАЦІЯ: /функція = "ініціація трансляції ATG" /доказ = експериментально (їх) ВЛАСТИВІСТЬ: (A) ІМ'Я/КЛЮЧ промотор (Б) РОЗТАШУВАННЯ: 1..1093 (B) СПОСІБ ІДЕНТИФІКАЦІЇ: експериментальний (Г) ІНША ІНФОРМАЦІЯ: /функція = "5'-регуляторна ділянка Р19" /доказ = експериментально (хі) ОПИС ПОСЛІДОВНОСТІ: послідовність №14:
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for hybrid seed production with use of conditional female sterility
Назва патенту російськоюСпособ получения гибридных семян с использованием условной женской стерильности
МПК / Мітки
МПК: C12N 15/09, C12N 15/29, C12N 15/82, C07K 14/415, C12N 5/10, A01H 5/00
Мітки: умовну, насіння, використовуючи, спосіб, репродуктивних, касета, переважно, органах, активний, одержання, жіночих, стерильність, варіанти, промотор, гібридного, жіночу, експресійна, рослина
Код посилання
<a href="https://ua.patents.su/25-73070-sposib-oderzhannya-gibridnogo-nasinnya-vikoristovuyuchi-umovnu-zhinochu-sterilnist-ekspresijjna-kaseta-promotor-aktivnijj-perevazhno-v-zhinochikh-reproduktivnikh-organakh-varianti.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання гібридного насіння, використовуючи умовну жіночу стерильність, експресійна касета, промотор, активний переважно в жіночих репродуктивних органах (варіанти), рослина та її насіння (варіанти)</a>
Попередній патент: Блок покриття “ши бо”
Наступний патент: Спосіб ліофілізації водного розчину активованого білка с, ліофілізована фармацевтична композиція, яка містить активований білок с, одержаний вказаним способом
Випадковий патент: Спосіб визначення теплової провідності контакту з`єднань з натягом