Спосіб визначення зиготності події у рослини сої, що включає aad-12-подію pdab4468-0416 у сої
Номер патенту: 109644
Опубліковано: 25.09.2015
Автори: Цуй Юнсінь Корі, Грін Томас, Новак Стефен, Чжоу Нін
Формула / Реферат
1. Спосіб визначення зиготності події у рослини сої, що включає AAD-12-подію pDAB4468-0416 у сої, яка включає SEQ ID NO: 1, де вказана подія містить трансгенну конструкцію, що включає ген AAD-12, і вказана трансгенна конструкція фланкована 5'-фланкуючою геномною ДНК сої і 3'-фланкуючою геномною ДНК сої, де вказана 5'-фланкуюча ДНК включає залишки 1-2730 SEQ ID NO: 1, вказана 3'-фланкуюча ДНК включає залишки 9122-10212 SEQ ID NO: 1, і вказана трансгенна конструкція складається із залишків 2731-9121 SEQ ID NO: 1, де вказаний спосіб включає:
отримання ДНК-зразка геномної ДНК із вказаної рослини сої;
продукування зразка для контактування шляхом контактування вказаного зразка ДНК з
а) праймером першої події і праймером другої події, де вказаний праймер першої події специфічно зв'язується із вказаною трансгенною конструкцією, і вказаний праймер другої події специфічно зв'язується із вказаною 5'-фланкуючою геномною ДНК сої або із вказаною 3'-фланкуючою геномною ДНК сої, і де вказаний праймер першої події і вказаний праймер другої події продукують амплікон події у випадку, коли піддаються умовам проведення TAQMAN-ПЛР,
b) референсним прямим праймером і референсним зворотним праймером, які продукують референсний амплікон з ендогенного референсного гена сої у випадку, коли піддаються умовам проведення TAQMAN-ПЛР,
с) флуоресцентним зондом події, який гібридизується із вказаним ампліконом події,
d) флуоресцентним референсним зондом, який гібридизується із вказаним референсним ампліконом;
контактування вказаного зразка в умовах для проведення TAQMAN-ПЛР основаної на флуоресценції кінцевої точки;
проведення кількісного аналізу вказаного флуоресцентного зонда події, який гібридизується із вказаним ампліконом події;
проведення кількісного аналізу вказаного флуоресцентного референсного зонда, який гібридизується із вказаним референсним ампліконом;
порівняння кількостей флуоресцентного зонда події, який прогібридизувався, і флуоресцентного референсного зонда, який прогібридизувався; і
визначення зиготності pDAB4468-0416 шляхом порівняння співвідношення флуоресценції флуоресцентного зонда події, який прогібридизувався, і флуоресцентного референсного зонда, який прогібридизувався.
2. Спосіб за п. 1, де вказані амплікони складаються із 50-150 залишків.
3. Спосіб за п. 1, де вказаний референсний ген є ендогенним геном лектину сої.
4. Спосіб за п. 1, де вказаний праймер другої події зв'язується із залишками 2530-2730 SEQ ID NO: 1 або з комплементарною послідовністю.
5. Спосіб за п. 1, де вказаний праймер другої події зв'язується із залишками 9122-9322 SEQ ID NO: 1.
6. Спосіб за п. 1, де вказані амплікони складаються з 100-200 пар основ.
7. Спосіб за п. 1, де вказаний референсний ген включає або гібридизується з послідовністю, вибраною з групи, що складається з SEQ ID NO: 5, SEQ ID NO: 6 і SEQ ID NO: 7.
8. Спосіб за п. 1, де вказані референсні праймери містять SEQ ID NO: 5 і SEQ ID NO: 6 і вказаний референсний зонд містить SEQ ID NO: 7.
9. Спосіб за п. 1, де вказані зонди марковані флуоресцентним барвником і гасником.
10. Спосіб за п. 9, де вказаний зонд події містить FAM як вказаний флуоресцентний барвник на 5'-кінці вказаного зонда події і MGB-гасник на 3'-кінці вказаного зонда події.
11. Спосіб за п. 9, де вказаний референсний зонд маркований HEX на 5'-кінці вказаного референсного зонда і Black Hole Quencher 1 (BHQ1) на 3'-кінці вказаного референсного зонда.
12. Спосіб за п. 1, де вказаний зонд події містить SEQ ID NO: 4.
13. Спосіб за п. 1, де вказані праймери події вибрані з групи, що складається з SEQ ID NO: 2 і SEQ ID NO: 3.
14. Спосіб за п. 1, де результати вказаного способу зчитуються безпосередньо в планшет-рідері.
15. Комплект для виконання способу за п. 1, де вказаний комплект включає вказані праймери події, які складаються з SEQ ID NO: 2 і SEQ ID NO: 3, вказані референсні праймери, які складаються з SEQ ID NO: 5 і SEQ ID NO: 6, вказаний зонд події, який складається з SEQ ID NO: 4, і вказаний референсний зонд, який складається з SEQ ID NO: 7.
Текст
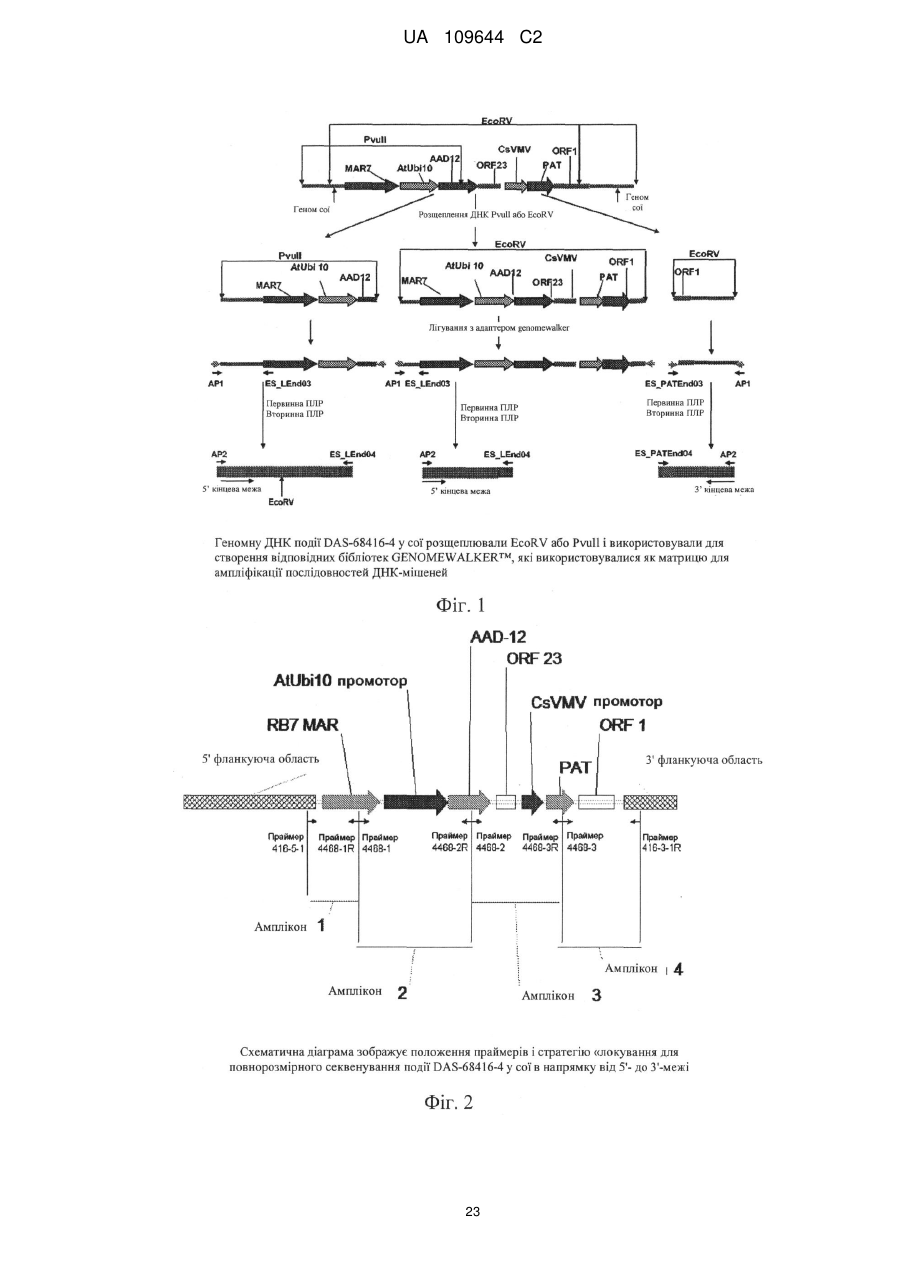
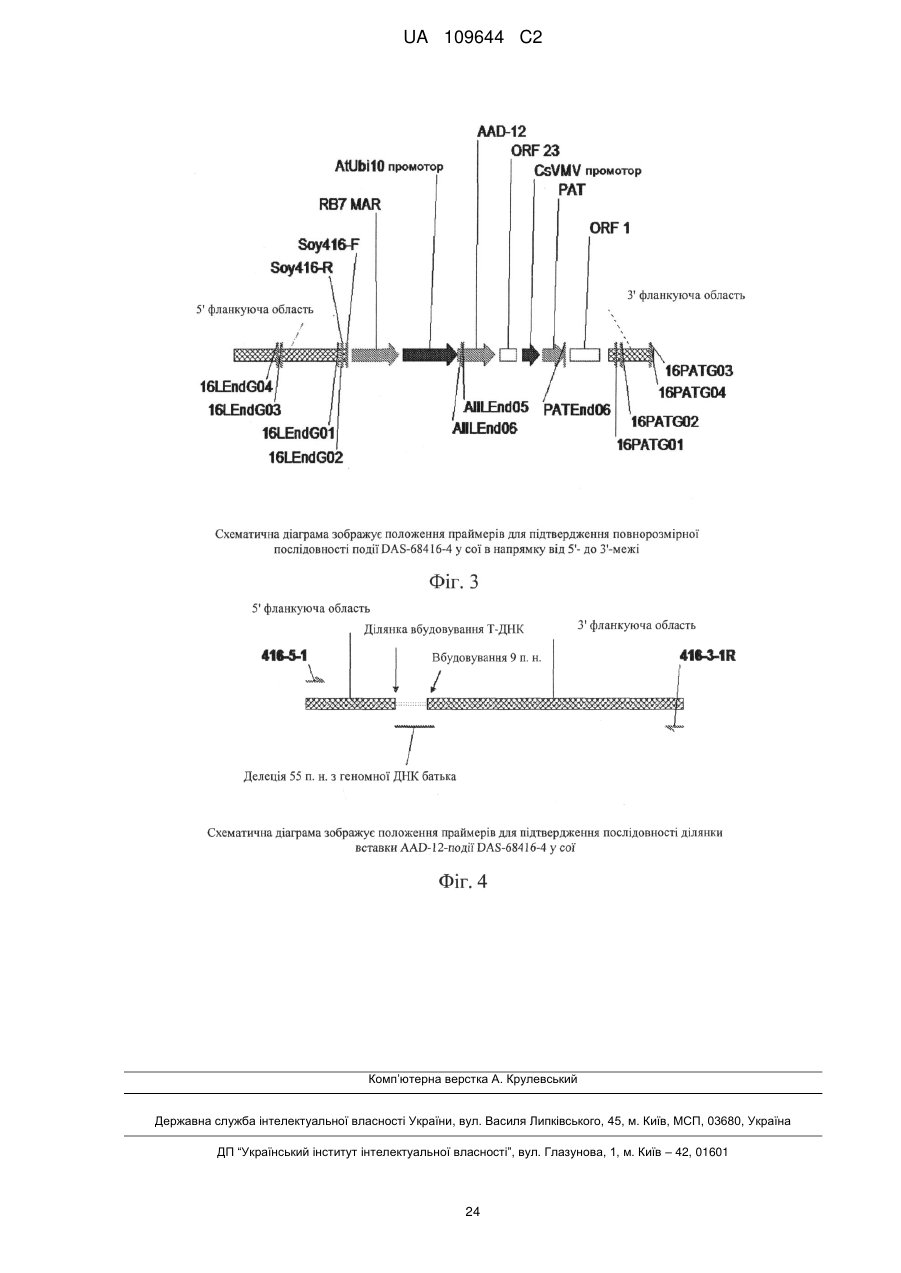
Реферат: Винахід стосується способів детектування події AAD-12 у сої, і описує TaqMan ПЛР-тест по кінцевій точці для події AAD-12 у сої. Запропоновано переважний референсний ген для використання при визначенні зиготності. Зокрема, винахід стосується способу визначення зиготності події у рослини сої, що включає AAD-12-подію pDAB4468-0416 у сої, де вказана подія містить трансгенну конструкцію, що включає ген AAD-12, і вказана трансгенна конструкція фланкована 5'-фланкуючою геномною ДНК сої і 3'-фланкуючою геномною ДНК сої. UA 109644 C2 (12) UA 109644 C2 UA 109644 C2 5 10 15 20 25 30 35 40 45 50 55 60 ПЕРЕДУМОВИ ВИНАХОДУ Ген aad-12 (спочатку з Delftia acidovorans) кодує білок арилоксіалканоатдіоксигеназу (AAD12). Ця ознака надає стійкості до 2,4-дихлорфеноксиоцтової кислоти, наприклад, і до піридилоксіацетатних гербіцидів. Сам по собі ген гербіцидної стійкості у рослин aad-12 був уперше розкритий в WO 2007/053482. Експресія гетерологічних або чужорідних генів в рослинах залежить від того, де гетерологічний ген вбудований в хромосому. Це може бути пов'язано зі структурою хроматину (наприклад, гетерохроматину) або близькістю елементів регуляції транскрипції (наприклад, енхансери) поруч з ділянкою інтеграції (Weising et al., Ann. Rev. Genet 22:421-477, 1988), наприклад. Один і той же ген в одному і тому ж типі трансгенної рослини (або іншого організму) може демонструвати велику відмінність в рівні експресії серед різних трансгенних подій. У просторовій або часовій структурі експресії також можуть бути відмінності. Наприклад, відмінності у відносній експресії трансгена в різних тканинах рослини можуть не відповідати профілям, очікуваним від елементів регуляції транскрипції, присутніх в конструкції введеного гена. Таким чином, велике число подій часто створюється і піддається скринінгу для того, щоб ідентифікувати подію, при якій введений ген, який представляє інтерес, експресується на рівні, задовільному для поставленої задачі. Для комерційних цілей, загальним є продукування від сотень до тисяч різних подій і скринінг цих подій заради єдиної події, яка має потрібні рівні і профілі експресії трансгена. Подія, яка має потрібні рівні і/або профілі трансгенної експресії, корисна для інтрогресії трансгена в інші генетичні оточення за допомогою статевого ауткросингу, використовуючи традиційні способи розмноження. Потомство таких схрещувань підтримує характеристики експресії трансгена вихідного трансформанта. Ця стратегія використовується для забезпечення надійної експресії генів в ряді сортів, які добре адаптовані до місцевих умов вирощування. Для детектування наявності події в зразку рослинної тканини можна використовувати різні прототипні способи. Одним з прикладів є методика піросеквенування, як описано в Winge (Innov. Pharma. Tech. 00: 18-24, 2000). У цьому способі створюється олігонуклеотид, який перекриває ділянку з'єднання прилеглої геномної ДНК і ДНК вставки. Олігонуклеотид гібридизують з одноланцюжковим ПЛР-продуктом з району, який представляє інтерес (один праймер у вбудовуваній послідовності і один у фланкуючій геномній послідовності), і інкубують в присутності ДНК-полімерази, АТФ, сульфурилази, люциферази, апірази, аденозин-5'фосфосульфату і люциферину. ДНТФ додають індивідуально, і включення приводить до світлового сигналу, який можна виміряти. Світловий сигнал вказує на наявність трансгенної вставки/фланкуючої послідовності в результаті успішної ампліфікації, гібридизації і подовження на одну або декілька основ. (Ця методика звичайно використовується для початкового секвенування, а не для детектування специфічного гена у випадку, коли він відомий.) Флуоресцентна поляризація являє собою ще один спосіб, який може бути використаний для детектування ампліконів. Відповідно до цього способу, створюється олігонуклеотид для перекривання ділянки з'єднання геномної фланкуючої ДНК і ДНК вставки. Олігонуклеотид гібридизують з одноланцюжковим ПЛР-продуктом з району, який представляє інтерес (один праймер у вбудовуваній ДНК і один у фланкуючій геномній послідовності ДНК), і інкубують в присутності ДНК-полімерази і флуоресцентно-мічених ддНТФ. Подовження на одну основу приводить до включення ддНТФ. Включення можна визначити за допомогою флуорометра як зміну в поляризації. Зміна в поляризації показує наявність трансгенної вставки/фланкуючої послідовності в результаті успішної ампліфікації, гібридизації і подовження на одну основу. Були описані молекулярні маяки для використання при детектування послідовностей. Коротко, створюють олігонуклеотидний зонд FRET, який накладається на ділянку з'єднання фланкуючої геномної ДНК і ДНК вставки. Унікальна структура зонда FRET приводить в результаті до наявності вторинної структури, яка підтримує флуоресцентну і гасильну частини в безпосередній близькості. Зонд FRET і ПЛР-праймери (один праймер в послідовності ДНК вставки і один у фланкуючій геномній послідовності) циркулюють в присутності термостабільної полімерази і дНТФ. Після успішної ПЛР-ампліфікації гібридизація зонда FRET з послідовністюмішенню приводить до усунення вторинної структури зонда і просторового розділення флуоресцентної і гасильних частин. Флуоресцентний сигнал вказує на наявність фланкуючої геномної/трансгенної вбудованої послідовності в результаті успішних ампліфікації і гібридизації. Аналіз з використанням гідролізу зонда, відомий також як TAQMAN (Life Technologies, Фостер-Ситі, Каліфорнія), являє собою спосіб детектування і кількісного визначення присутності послідовності ДНК. Коротко, олігонуклеотидний зонд FRET створюють з одним оліго в трансгенній і одним у фланкуючій геномній послідовності для події-специфічного детектування. 1 UA 109644 C2 5 10 15 20 25 30 35 40 45 50 55 60 Зонд FRET і ПЛР-праймери (один праймер в послідовності ДНК вставки і один у фланкуючій геномній послідовності) циркулюють в присутності термостабільної полімерази і дНТФ. Гібридизація зонда FRET приводить до відщеплення і звільнення флуоресцентної частини від гасильної частини зонда FRET. Флуоресцентний сигнал вказує на наявність фланкуючої/трансгенної вбудованої послідовності в результаті успішних ампліфікації і гібридизації. Ще однією проблемою, серед багатьох, є пошук відповідного контрольного гена для даного тесту. Наприклад, як указано в резюме Czechowski et al., «Виключно великий набір даних від досліджень Affymetrix ATH1 whole-genome GeneChip послужив засобом для ідентифікації нового покоління референсних генів з дуже стабільними рівнями експресії у видах модельної рослини Arabidopsis (Arabidopsis thaliana). Були знайдені сотні генів Arabidopsis, які перевершують традиційні референсні гени в плані стабільності експресії протягом розвитку і при широкому діапазоні умов навколишнього середовища» (Czechowski et al. (2005) Genome - wide identification and testing of superior reference genes for transcript normalization in Arabidopsis. Plant Physiol. 139, 5-17.). Робота Brodmann et al. (2002 р.) стосується кількісної ПЛР в реальному часі для детектування вмісту генетично модифікованої кукурудзи в харчових продуктах для чотирьох різних сортів кукурудзи, схвалених в Європейському Союзі. Brodmann, P.D., P.D., Ilg E.C., Berthoud Н., and Herrmann, A. Real-Time Quantitative Polymerase Chain Reaction Methods for Four Genetically Modified Maize Varieties and Maize DNA Content in Food. J. of AO AC international 2002 85 (3). Робота Hernandez et al. (2004) приводить чотири можливих гени для використання для ПЛР в реальному часі. Hernandez, M., Duplan, M.-N., Berthier, G., Vaitilingom, M., Hauser, W., Freyer, R., Pla, M., and Bertheau, Y. Development and comparison of four real-time polymerase chain reaction systems for specific detection and quantification of Zea mays L. J. Agric. Food Chem. 2004, 52, 4632-4637. У роботі Costa et al. (2007) розглянули ці чотири гени (також в контексті ПЛР в реальному часі) і прийшли до висновку, що гени алкогольдегідрогенази і зеїну являли собою кращі референсні гени для визначення зразкової «події» (ген лектину) для випускань трансгенних кормових сумішей. Costa, L. D., and Martinelli L. Development of а Real-Time PCR Method Based on Duplo Target Plasmids for Determining an Unexpected Genetically Modified Soybean Intermix with Feed Components. J. Agric. Food Chem. 2007, 55, 1264-1273. У роботі Huang et al. (2004) використовували плазміду pMulM2 як референсні молекули для детектування трансгенів MON810 і NK603 в кукурудзі. Huang and Pan, «Detection of Genetically Modified Maize MON810 and NK603 by Multiplex and Real-Time Polymerase Chain Reaction Methods», J. Agric. Food Chem., 2004, 52 (11), pp 3264-3268. Робота Gasparic et al. (2008) пропонує LNA-технологію, з порівняння з технологією циклування зондів, TaqMan, і різних хімій ПЛР в реальному часі, для кількісного аналізу подій у кукурудзи (таких, як MON810). Gasparic, Cankar, Zel, and Gruden, «Comparison of different realtime PCR chemistries and their suitability for detection and quantification of genetically modified organisms», BMC Biotechnol. 2008; 8: 26. US 20070148646 стосується способу подовження праймера для кількісного аналізу, який вимагає контрольованого розподілу окремих нуклеотидів, які можуть бути виявлені, і кількісно визначені по кількості включених нуклеотидів. Це відрізняється від способу TaqMan ПЛР, що використовує внутрішній референсний ген. Щоб розрізнити гомозиготний і гемізиготний генотипи ТС1507, для цієї події був успішно застосований аналіз Invader. Gupta, M., Nirunsuksiri, W., Schulenberg, G., Hartl, Т., Novak, S., Bryan, J., Vanopdorp, N., Bing, J. and Thompson, S. A non-PCR-based Invader Assay Quantitatively Detects Single-Copy Genes in Complex Plant Genomes. Mol. Breeding 2008, 21, 173-181. Робота Huabang (2009) стосується основаного на ПЛР тестування зиготності трансгенної кукурудзи. Однак, ніякого референсного гена, мабуть, не використовувалося. Huabang, «An Accurate and Rapid PCR-Based Zygosity Testing Method for Genetically Modified Maize», Molecular Plant Breeding, 2009, Vol.7, No.3, 619-623. КОРОТКИЙ ОПИС ВИНАХОДУ Даний винахід стосується, зокрема, способів детектування події AAD-12 у сої (Glycine max), позначеної DAS-68416-4, з насінням, депонованим в Американській колекції типових культур (ATCC) з номером доступу No РТА-10442. Конкретніше, даний винахід стосується, зокрема, кінцевої точки TaqMan ПЛР-аналізу на подію AAD-12 у сої. Деякі варіанти здійснення спрямовані на тести, які придатні для високопродуктивного аналізу на зиготність. Винахід, що розглядається, також стосується, 2 UA 109644 C2 5 10 15 20 25 30 35 40 45 50 55 зокрема, відкриття переважного референсного гена лектину для використання при визначенні зиготності. Ці і інші пов'язані з ними процедури можна застосовувати для однозначної ідентифікації ліній сої, що містять подію за винаходом, що розглядається. Цей винахід також стосується частково селекції рослин із застосуванням будь-якого зі способів, що розглядаються. У деяких варіантах здійснення вказана подія/полінуклеотидна послідовність може «комплектуватися» з іншими ознаками, включаючи, наприклад, інші ген(и) стійкості до гербіцидів і/або білки, що пригнічують комах. Проте, винахід, що розглядається, включає рослини, які мають одну подію, як описано в цьому документі. Крім того, винахід, що розглядається, надає тести для детектування наявності події, що розглядається, в зразку (сої, наприклад). Також надаються комплекти і умови, придатні при проведенні тестів. КОРОТКИЙ ОПИС ФІГУР Фіг. 1. Геномну ДНК події сої DAS-68416-4 обробляли EcoRV або по PvuII і використовували TM для створення відповідних бібліотек GENOMEWALKER , які були використані як матриці для ампліфікації послідовностей ДНК-мішеней. Фіг. 2. Схематична діаграма зображує положення праймерів і стратегію клонування для повнорозмірного секвенування події DAS-68416-4 у сої в напрямку від 5'- до 3'-кінця. Фіг. 3. Схематична діаграма зображує положення праймерів для підтвердження повнорозмірної послідовності події DAS-68416-4 у сої в напрямку від 5'- до 3'-кінця. Фіг. 4. Схематична діаграма зображує положення праймерів для підтвердження послідовності ділянки вставки AAD-12-події DAS-68416-4 у сої. КОРОТКИЙ ОПИС ПОСЛІДОВНОСТЕЙ SEQ ID NO: 1 представляє послідовність 5' і 3'-геномних фланкуючих послідовностей по обидві сторони від вставки AAD-12, включаючи вставку. Фланкуючі послідовності підкреслені. SEQ ID NO:2-7 представляють послідовності для праймерів і зондів для використання відповідно до винаходу, що розглядається. ДОКЛАДНИЙ ОПИС ВИНАХОДУ Трансгенну подію AAD-12 (що забезпечує стійкість до гербіциду) у сої pDAB4468-416 генерували шляхом трансформації Agrobacterium. Були клоновані як 5'-, так і 3'-кінцеві фланкуючі послідовності цієї трансгенної вставки AAD-12, секвеновані і охарактеризовані, як детально викладено в USSN 61/263950 (подано 24 листопада 2009 р.). У деяких конкретних варіантах здійснення, AAD-12 присутній в соєвих бобах як подія, позначена DAS-68416-4, з насінням, депонованим в Американській колекції типових культур (ATCC) з номером доступу No. PTA-10442, і потомстві, отриманому від цього. 2500 насінин було депоновано відповідно до Будапештського договору 22 жовтня 2009 року. Депозит був перевірений 2 листопада 2009 р., і на цю дату насіння було життєздатне. Були створені специфічні TAQMAN-праймери і зонди, як детально викладено в цьому документі, зокрема, відповідно до послідовностей ДНК, що знаходяться в області з'єднання між трансгенною ДНК і геномною ДНК хазяїна. Специфічність праймерів і зондів до події була успішно тестована в форматі дуплекса з лектином сої як референсного ген в ПЛР в реальному часі відносно різних AAD-12-подій у сої і нетрансгенного сорту сої Maverick. Процедури TAQMAN-тестів, специфічних для кінцевих подій, для визначення AAD-12-події у сої були отримані, як детально описано в цьому документі. Послідовність, що охоплює область інтеграційного з'єднання ДНК рослини-хазяїна і конструкції інтегрованого гена в цій AAD-12-події у сої, являє собою унікальну послідовність. Вона була використана для розробки подія-специфічного аналізу (звичайної ПЛР і ПЛР в реальному часі), щоб виявити присутність AAD-12-подій у сої pDAB4468-416 для ГМОтестування і визначити стан зиготності рослин у виведених популяціях. Подія-специфічний TAQMAN-тест, описаний в цьому документі, можна використовувати для обох додатків. Винахід, що розглядається, надає тести для детектування присутності трансгенної події у сої DAS-68416-4 в зразку. Аспекти винаходу, що розглядається, включають способи отримання і/або продукування будь-яких діагностичних молекул нуклеїнових кислот, що приводиться як приклади або що пропонується в цьому документі. Лінії рослин, що включають цю подію, можна детектувати за допомогою послідовностей, розкритих і запропонованих в цьому документі. Таким чином, в деяких варіантах здійснення, цей винахід стосується ідентифікації ліній сої, стійких до гербіцидів. Винахід, що розглядається, стосується, зокрема, детектування присутності події, що розглядається, для того, щоб визначити, чи містить потомство від статевого схрещування подію, яка представляє інтерес. Крім того, спосіб детектування події включений і є придатним, наприклад, для дотримання нормативів, що вимагають попереднього 3 UA 109644 C2 5 10 15 20 25 30 35 40 45 50 55 60 торгового затвердження і маркування харчових продуктів, отриманого, наприклад, з рекомбінантних сільськогосподарських рослин. Конкретніше, подія являє собою подію AAD-12, що також називається pDAB4468-0416. Цей винахід можна використовувати для його селекції і характеристики на стабільність, і експресію на рівні рослини загалом і на молекулярному рівні від покоління до покоління. Синтетичний ген (aad-12), що розглядається, використовуваний відповідно до винаходу, що розглядається, був отриманий з Delftia acidovorans, і кодує фермент, здатний дезактивувати деякі гербіциди з арилоксіалканоатною частиною, включаючи феноксіауксин (наприклад, 2,4-D, MCPA), а також піридилоксіауксини (наприклад, фтороксипір, трихлопір). Ген aad12, що контролюється промотором atUbi10, був введений в лінію сої Maverick за допомогою методології Agrobacterium tumefaciens. Винахід, що розглядається, стосується, зокрема, основаного на флуоресценції кінцевої точки TaqMan-ПЛР тесту, що використовує ендогенний ген як референсний (кількість копій) контроль при високопродуктивному аналізі зиготності події AAD-12 у сої. Винахід, що розглядається, також стосується, зокрема, відкриття переважного референсного гена, інвертази. Декілька референсних генів були визначені як можливі варіанти. Винахід, що розглядається, також стосується, зокрема, розробки біплексного кінцевої точки TaqMan-ПЛР-аналізу на зиготність, специфічного для подій AAD-12 у сої. Далі, винахід, що розглядається, стосується, зокрема, розробки тест-комплекту для селекції AAD-12. Тести кінцевої точки TaqMan основані на стратегії плюс/мінус, по якій «плюс» означає, що зразок є позитивним по аналізованому гену, а «мінус» означає, що зразок є негативним по аналізованому гену. Ці тести, як правило, використовують два комплекти олігонуклеотидів для визначення трансгенної послідовності AAD-12 і послідовності генів дикого типу, відповідно, а також зонди з подвійною міткою для визначення вмісту трансгенної послідовності і послідовності дикого типу. Незважаючи на те, що аналіз Invader являє собою могутній спосіб для характеристики подій, він є дуже чутливим до якості ДНК. Крім того, аналіз вимагає великої кількості ДНК. Invader також вимагає додаткової стадії денатурації, яка у випадку, якщо не проводиться належно, може привести до відсутності успіху при проведенні аналізу Invader. Крім того, більш тривалий час тестування при аналізі Invader обмежує гнучкість його застосування для того, щоб ефективно обробляти велику кількість зразків AAD-12-подій 416 для аналізу в комерційних задачах. Однією з головних переваг винаходу, що розглядається, є економія часу і ліквідація стадії денатурації. TaqMan-аналіз, що розглядається, в кінцевій точці для детектування подій AAD-12 416 пропонує дивні переваги над Invader, зокрема, при аналізі великого числа зразків. Визначення і приклади приведені в даному документі для допомоги в описі даного винаходу і інструктування фахівців в галузі, що розглядається, в практиці винаходу. Якщо не вказано інше, терміни потрібно розуміти відповідно до загальноприйнятого використання тими, хто спеціалізується в близьких галузях. Для основ ДНК використовується номенклатура, як указано в Зведенні федеральних правил 37 CFR з 1.822. Як використовується в цьому документі, термін «потомство» означає нащадка будь-якого покоління батьківського плану, який містить AAD-12-подію DAS-68416-4 у сої. Трансгенна «подія» утворюється шляхом трансформації рослинних клітин гетерологічної ДНК, тобто, конструкцією нуклеїнових кислот, яка включає представляючий інтерес трансген, відновлення популяції рослин, утворених в результаті вбудовування трансгена в геном рослин, і відбирання конкретної рослини, що характеризується вбудовуванням в певне положення генома. Термін «подія» стосується вихідного трансформанта і потомства трансформанта, яке включає гетерологічну ДНК. Термін «подія» стосується також потомства, зробленого шляхом статевого ауткроса між трансформантом і іншим сортом, що включає геномну/трансгенну ДНК. Навіть після повторного оборотного схрещування з рекурентним батьком, вбудована трансгенна ДНК і фланкуюча геномна ДНК (геномна/трансгенна ДНК) з трансформованого батька присутні в потомстві від схрещування в тому ж хромосомному положенні. Термін «подія» також стосується ДНК вихідного трансформанта і потомства цього, що містить вбудовану ДНК і фланкуючу геномну послідовність, що безпосередньо прилягає до вбудованої ДНК, яка, як очікується, передається потомству, яке отримує вбудовану ДНК, в тому числі транс ген, який представляє інтерес, як результат статевого схрещування однієї батьківської лінії, яка включає вбудовану ДНК (наприклад, вихідний трансформант і потомство, отримане в результаті самозапліднення) і батьківської лінії, яка не містить вбудованої ДНК. «Послідовність ділянки з'єднання» охоплює точку, в якій ДНК, вбудована в геном, з’єднана з ДНК нативного генома, фланкуючою точку вставки, ідентифікація і детектування тих або інших 4 UA 109644 C2 5 10 15 послідовностей ділянок з'єднання генетичного матеріалу рослини достатня для того, щоб діагностувати подію. Включаються послідовності ДНК, які охоплюють вставки описаних в цьому документі подій у сої і аналогічні довжини фланкуючої ДНК. Конкретні приклади таких діагностичних послідовностей представлені в цьому документі, однак, інші послідовності, які перекривають точки з'єднання вставок, або точки з'єднання вставок і геномної послідовності, також є діагностичними, і можуть використовуватися відповідно до винаходу, що розглядається. Винахід, що розглядається, стосується ідентифікації таких фланкуючих послідовностей, послідовностей ділянок з'єднання і вбудованих послідовностей. Пов'язані ПЛР-праймери і амплікони включені у винахід. Відповідно до винаходу, що розглядається, способи ПЛР-аналізу з використанням ампліконів, що розповсюджуються через вбудовану ДНК і її межі, можуть бути використані для детектування або ідентифікації продукованих серійно трансгенних сортів сої або ліній, отриманих від запатентованих трансгенних ліній сої, що розглядаються. Повні послідовності кожної з цих вставок, разом з частинами відповідних фланкуючих послідовностей, представлені в цьому документі, як SEQ ID NO:1. Координати вставки і фланкуючих послідовностей для цієї події відносно SEQ ID NO: 1 (всього 10212 пар основ) вказані нижче. Номери залишків (SEQ: 1) Довжина (пар нуклеотидів): 20 25 30 35 40 45 50 55 5' фланкуючий Вставка 3' фланкуючий 1-2730 3731-9121 9122-10212 2730 пар нуклеотидів 6391 пар нуклеотидів 1091 пар нуклеотидів Компоненти вставки і фланкуючих послідовностей також проілюстровані на Фігурах з 1 по 4. Способи детектування за даним винаходом особливо корисні в поєднанні з селекцією рослин, для визначення того, які рослини-нащадки включають певну подію, після схрещування батьківської рослини, що містить подію, яка представляє інтерес, з іншою рослинною лінією в спробі передати одну або декілька додаткових ознак, які представляють інтерес, потомству. Ці способи аналізу приносять користь програмам селекції сої, а також контролю якості, особливо для комерціалізованих трансгенного насіння соєвих бобів. Комплекти для детектування цих трансгенних ліній сої також тепер можна створювати, і використовувати. Також можна мати користь при реєстрації продукту і контролі якості продукції. Це можна використовувати для стратегій прискореної селекції і встановити дані по зчепленню. Послідовності, представлені в цьому документі, можна використовувати для дослідження і характеристики процесів інтеграції трансгенів, характеристики сайтів геномної інтеграції, сортування подій, стабільності трансгенів і їх фланкуючих послідовностей, і експресії генів (особливо пов'язаних з сайленсингом генів, профілями трансгенного метилування, ефектами положення і потенційними пов'язаними з експресією елементами, такими як МАRS [області прикріплення матриць], і т. д.). Далі, винахід, що розглядається, включає селекцію рослин-нащадків, переважно гербіцидстійкої рослини сої, де вказана рослина має геном, що включає детектовану вставку ДНК, як описано в цьому документі. Як використовується в цьому документі, термін «соя» означає Glycine max, і включає всі різновиди цього, які можна вивести з рослиною соя. Цей винахід також включає процеси отримання схрещувань, використовуючи рослину за винаходом, що розглядається як, принаймні, один з батьків. Цей винахід включає спосіб продукування насіння гібридів F1 шляхом схрещування типової рослини з іншою рослиною (наприклад, інбредним батьком) і збирання гібридного насіння. Характеристики отриманих в результаті рослин (або жіночих особин) можуть бути поліпшені шляхом ретельного розгляду батьківських рослин. Стійку до гербіцидів рослину сої можна вивести шляхом першого статевого схрещування першої батьківської рослини сої, що складається з рослини сої, вирощеної з насіння будь-якої з ліній, згаданих в цьому документі, і другої батьківської рослини сої, проводячи, таким чином, множину рослин першого покоління; і потім селекції рослини першого покоління, стійкої до гербіциду (або що має, принаймні, одну з подій за винаходом, що розглядається); і самозапилення рослини першого покоління, проводячи, таким чином, множину рослин другого покоління, а потім, селекції з рослин другого покоління рослини, стійкого до гербіциду (або що має, принаймні, одну з подій за винаходом, що розглядається). Ці стадії можуть також включати зворотне схрещування рослини першого покоління або рослини другого покоління з другою батьківською рослиною сої або третьою батьківською рослиною сої. Потім може бути посаджена соєва культура, що містить насіння сої за винаходом, що розглядається, або потомство цього. Потрібно також розуміти, що можна також схрещувати дві різні трансгенні рослини, щоб породжувати потомство, яке містить два незалежно сегрегуючих доданих, екзогенних гена. 5 UA 109644 C2 5 10 15 20 25 30 35 40 45 50 55 60 Самозапилення відповідного потомства може виробляти рослини, гомозиготні по обох доданих, екзогенних генах. Поворотне схрещування з батьківською рослиною і ауткросинг з нетрансгенним рослиною також передбачається, оскільки є вегетативним розмноженням. У галузі, що розглядається, відомі інші способи розмноження, що звичайно використовуються для різних ознак і культур. Розмноження шляхом поворотного схрещування було використане для передачі генів для простих спадкових, високо успадкованих ознак у бажаного гомозиготного сорту або інбредної лінії, що є рекурентним батьком. Джерело ознаки для передачі називається батьком-донором. У результаті рослина, як очікується, має атрибути рекурентного батька (наприклад, сорту) і бажаної ознаки, переданої від батька-донора. Після первинного схрещування особини, що мають фенотип батька-донора, відбирають, і повторно схрещують (поворотне схрещування) з рекурентним батьком. Отриманий в результаті батько, як очікується, повинен мати атрибути рекурентного батька (наприклад, сорту) і бажану ознаку, передану від батька-донора. Даний винахід може бути використаний з молекулярними маркерами в способі маркерапомічника селекції (MAB). Молекули ДНК за даним винаходом можна використовувати з іншими способами (наприклад, AFLP-маркери, RFLP-маркери, RAPD-маркери, SNP і SSR), які ідентифікують генетично пов'язані агрономічно корисні ознаки, як відомо, в галузі, що розглядається. Ознаки стійкості до гербіцидів можуть бути відслідковані в потомстві від схрещування з рослиною сої за винаходом, що розглядається (або в потомстві цього, і будьякого іншого культивара або сорту сої), використовуючи МАВ-способи. Молекули ДНК є маркерами для цієї ознаки, і МАВ-способи, які відомі в галузі, що розглядається, можна використовувати для відстеження ознаки(ознак) стійкості до гербіцидів у рослин сої, де, принаймні, одна лінія сої за винаходом, що розглядається, або потомство цього, являла собою батька або предка. Способи за даним винаходом можна використовувати для ідентифікації будь-якого сорту сої, що має подію, яка розглядається. Способи за винаходом, що розглядається, включають спосіб продукування стійкої до гербіцидів рослини сої, де вказаний спосіб включає розмноження рослини за винаходом, що розглядається. Конкретніше, вказані способи можуть включати схрещування двох рослин за винаходом, що розглядається, або однієї рослини за винаходом, що розглядається, і будь-якої іншої рослини. Переважні способи також включають селектування потомства вказаного схрещування шляхом аналізу вказаного потомства на подію, що детектується відповідно до винаходу, що розглядається. Наприклад, винахід, що розглядається, можна використовувати для відстеження події, що розглядається, протягом циклів селекції з рослинами, що мають інші бажані ознаки, такі як агрономічні ознаки, такими, як ознаки, перевірені в цьому документі в різних Прикладах. Рослини, що містять подію, яка розглядається, і бажану ознаку, можуть бути виявлені, ідентифіковані, відібрані і швидко використовуватися в подальших раундах розмноження, наприклад. Подію/ознаку, що розглядається, також можна комбінувати шляхом селекції, і відстежувати відповідно до винаходу, що розглядається, з ознакою(ами) стійкості до комах і/або з додатковими ознаками стійкості до гербіцидів. Одним переважним варіантом здійснення останнього є рослина, що містить подію, яка розглядається, в поєднанні з геномом, що кодує стійкість до гербіциду дикамба. Подію, що розглядається, можна комбінувати, наприклад, з ознаками, що кодують стійкість до гліфосату (наприклад, що визначають стійкість EPSPS, GOX, GAT рослин або бактерій), стійкість до глуфосинату (наприклад, Pat, bar), ацетолактатсинтазу(ALS)-інгібуючу гербіцидну стійкість (наприклад, імідазолінони [такі, як імазетапір], сульфонілсечовини, триазолопіримідин сульфонанілід, солі пірмідинілтіобензойної кислоти і інші хімічні склади [Csr1, SurA, et al.]), стійкість до бромоксинілу (наприклад, Bxn), стійкість до інгібіторів ферменту HPPD (4гідроксилфенілпіруватдіоксигенази), стійкість до інгібіторів фітоенедесатурази (PDS), стійкість до гербіцидів, які інгібують фотосистему II (наприклад, psbA), стійкість до гербіцидів, які інгібують фотосистему I, стійкість до гербіцидів, які інгібують протопорфіриногеноксидазу IX(PPO) (наприклад, PPO-1), стійкість до фенілсечовинних гербіцидів (наприклад, CYP76B1), ферменти, що розкладають дикамбу (дивись, наприклад, US 20030135879), і інші, можуть бути скомплектовані окремо або в різних комбінаціях, щоб забезпечити можливість ефективного контролю або запобігання росту бур'янів і/або стійкості до будь-якого гербіциду вищезазначених класів. Відносно додаткових гербіцидів, деякі додаткові переважні ALS-інгібітори (також відомі як AHAS-інгібітори) включають триазолопіримідин сульфонаніліди (такі, як хлорансулам-метил, дихлосулам, флорасулам, флуметсулам, метосулам і пеноксулам), солі піримідилтіобензойної кислоти (такі, як біспірибак і піритіобак) і флукарбазон. Деякі переважні HPPD-інгібітори включають мезотрион, ізоксафлутол і сулкотрион. Деякі переважні РРО-інгібітори включають 6 UA 109644 C2 5 10 15 20 25 30 35 40 45 50 55 60 флюміклорак, флуміоксазин, флюфенпір, пірафлуфен, флутіацет, бутафенацил, карфентразон, сульфентразон і дифенілефіри (такі, як ацифлюорфен, фомезафен, лактофен і оксифлюорфен). Крім того, AAD-12 сам по собі або в поєднанні з однією або декількома додатковими НТСознаками можна комбінувати з однією або декількома додатковим «вхідними» (наприклад, стійкість до комах, стійкість до грибків або стрес-стійкість, et al.) або ознаками, що характеризують вихід (наприклад, підвищена врожайність, поліпшений профіль маслянистості, покращена якість волокна, et al.). Таким чином, винахід, що розглядається, можна використовувати для забезпечення повного агрономічного пакету підвищення якості урожаю з можливістю гнучкого і економічно ефективного контролю будь-якого числа сільськогосподарських шкідників. Фермент, що розглядається, AAD-12 забезпечує можливість трансгенної експресії, що приводить до стійкості до комбінації гербіцидів, що дозволило б контролювати майже всі широколисті бур'яни і бур'яни-трави. AAD-12 може служити прекрасною ознакою стійкості культури до гербіциду (HTC) в поєднанні з іншими НТС-ознаками (наприклад, стійкість до гліфосату, стійкість до глуфосинату, стійкість до імідазолінону, стійкість до бромоксинілу, et al) і ознаками стійкості до комах (Cry IF, CrylAb, Cry 34/45, et al.), наприклад. Крім того, AAD-12 може служити як селективний маркер для допомоги при відбиранні первинних трансформантів рослин, модифікованих за допомогою способів генетичної інженерії другим геном або групою генів. НТС-ознаки за винаходом, що розглядається, можна використовувати в нових комбінаціях з іншими НТС-ознаками (включаючи, як необмежувальний приклад, стійкість до гліфосату). Ці поєднання ознак приводять до нових способів контролювання видів бур'янів (і подібних), завдяки щойно набутій стійкості або природженій стійкості до гербіцидів (наприклад, гліфосату). Таким чином, в доповнення до НТС-ознак, нові способи для контролю бур'янів за допомогою гербіцидів, для яких стійкість до гербіцидів була створена за допомогою вказаного ферменту в трансгенних культурах, знаходяться в рамках винаходу. Крім того, переважаючими є стійкі до гліфосату культури, що вирощуються по всьому світу. При багаторазовому чергуванні з іншими стійкими до гліфосату культурами контроль гліфосатстійких рослин-самосівів для культур, що чергуються, може бути утруднений. Таким чином, використання трансгенних ознак, що розглядаються, комбінованих або трансформованих індивідуально в сільськогосподарські культури, надає інструмент контролювання рослинсамосівів інших НТС-культур. Якщо не вказано інше, посилання на фланкуючі послідовності стосується тих послідовностей, які виявлені відносно SEQ ID NO:1 (дивись таблицю вище). Знову ж, SEQ ID NO:1 містить гетерологічну ДНК, вбудовану у вихідний трансформант, і ілюстративні фланкуючі геномні послідовності, що безпосередньо прилягають до вбудованої ДНК. Всі або частина цих фланкуючих послідовностей може, як очікується, передаватися потомству, яке отримує вбудовану ДНК в результаті статевого схрещування батьківської лінії, яка містить подію. Як використовується в цьому документі, «лінія» являє собою групу рослин, які виявляють трохи або відсутність генетичних відмінностей між особинами, принаймні, по одній ознаці. Такі лінії можна створити шляхом декількох поколінь самозапилення і селекції, або вегетативного розмноження з одного батька за допомогою технологій тканинних або клітинних культур. Як використовується в цьому документі, терміни «культивар» і «сорт» є синонімами, і стосуються лінії, яка використовується для комерційного виробництва. «Стабільність» або «стабільний» означає, що відносно даного компонента, компонент підтримується з покоління в покоління і, бажано, принаймні, три покоління, в основному, на тому ж рівні, наприклад, переважно ±15%, більш переважно ±10%, найбільш переважно ±5%. Стійкість може бути під впливом температури, місцеположення, стресу і часу саджання. При порівнянні подальших поколінь в польових умовах компоненти повинні продукуватися аналогічно. «Комерційна вигідність» визначається як отримання хорошої потужності рослини і високої фертильності, такої, що урожай може бути вироблений фермерами за допомогою звичайної сільськогосподарської техніки, і олії з описаними компонентами можна екстрагувати з насіння з використанням звичайного обладнання для дроблення і екстракції. Щоб бути комерційно вигідним, урожай, що визначається по насіннєвій масі, вмісту олії і загальній кількості масла, виробленого з акру, знаходиться в межах 15% від середнього виходу у іншого порівнянного комерційного сорту сої без ознак збільшеного виходу, вирощених в цьому ж регіоні. «Агрономічно елітний» означає, що лінія має бажані агрономічні характеристики, такі як врожайність, зрілість, стійкість до хвороб і т. д., в доповнення до стійкості до комах, внаслідок 7 UA 109644 C2 5 10 15 20 25 30 35 40 45 50 55 60 події(й), що розглядається. Агротехнічні ознаки, взяті окремо або в будь-якій комбінації, як указано в Прикладах, приведених нижче, у рослини, що містить подію за винаходом, що розглядається, знаходяться в межах винаходу, що розглядається. Будь-які і всі з цих агрономічних характеристик і експериментальних значень можуть бути використані для детектування таких рослин, або в точці, або на будь-якій межі або обох межах діапазону характеристик, що використовується для визначення таких рослин. Як встановить будь-який фахівець в галузі, що розглядається, в світлі даного розкриття, переважний варіант здійснення комплектів для детектування, наприклад, може включати в себе зонди і/або праймери, в тому числі полінуклеотидні зонди і/або амплікони. Праймер(и), «що приплавлюються» до фланкуючої послідовності, як правило, не призначені для гібридизації поза приблизно 200 парами або поза ділянкою з'єднання. Таким чином, типовий фланкуючий праймер потрібно проектувати так, щоб включити щонайменше 15 залишків будь-якого ланцюга всередині 200 пар у фланкуючій послідовності від початку вставки. Тобто, праймери, що включають послідовність відповідного розміру (або що гібридизується з) в діапазоні залишків ~2530-2730 і/або ~9122-9322 з SEQ ID NO: 1, знаходяться в рамках винаходу, що розглядається. Праймери вставки також можуть бути отримані де-небудь на вставці, але залишки ~2731-2931 і ~8921-9121 можуть бути використані, наприклад, не виключно для такого дизайну праймерів. Будь-який фахівець в галузі, що розглядається, також визнає, що праймери і зонди можуть бути отримані для гібридизації, в діапазоні стандартних умов гібридизації і/або ПЛР, з сегментом SEQ ID NO:1 (або комплементарним) і комплементарним цьому, де праймер або зонд не є повністю комплементарним представленій послідовності. Тобто, може бути допустима деяка міра невідповідності. Для праймера приблизно в 20 нуклеотидів, наприклад, як правило, один або два або декілька нуклеотидів не треба зв'язуватися з протилежним ланцюгом, якщо неспарена основа є внутрішньою або знаходиться на кінці праймера, який є протилежним у амплікона. Різні відповідні умови гібридизаціїприводяться нижче. Синтетичні нуклеотидні аналоги, такі як інозин, також можуть використовуватися в зондах. Можуть бути використані пептид-нуклеїновокислотні (PNA) зонди, а також ДНК- і РНК-зонди. Важливо, що такі зонди і праймери є діагностичними (здатними однозначно ідентифікувати і відрізнити) на наявність події за винаходом, що розглядається. Компоненти «вставки» проілюстровані на Фігурах. Полінуклеотидні послідовності ДНК цих компонентів або фрагменти цього, можна використовувати як ДНК-праймери і зонди в способах за даним винаходом. У деяких варіантах здійснення винаходу надані композиції і способи детектування присутності області трансгенної/геномної вставки, в рослинах і насіння і т. п., в рослинах сої. Надані послідовності ДНК, а також їх сегменти, і комплементарні типовим послідовностям і будь-яким їх сегментам. Ці і інші пов'язані з ними процедури можна використовувати для однозначної ідентифікації цих ліній сої. У деяких варіантах здійснення послідовності ДНК, які містять фрагмент, який прилягає до району нової трансгенної/геномної вставки, є аспектом цього винаходу. Включеними є послідовності ДНК, які містять достатньої довжини полінуклеотиди послідовності трансгенної вставки і полінуклеотиди достатньої довжини геномної послідовності сої з однієї або більше з трьох вищезазначених рослин сої і/або послідовності, які придатні як послідовності праймерів для виробництва продукту амплікону, діагностичного для однієї або декількох з цих рослин сої. Пов'язані варіанти здійснення стосуються послідовностей ДНК, які включають, принаймні, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 або більше суміжних нуклеотидів трансгенної частини послідовності ДНК, ідентифікованої в даному документі (таких як SEQ ID NO:1 і їх сегменти), або комплементарної їм, і схожої довжини фланкуюча послідовність ДНК сої з цих послідовностей, або комплементарні їм. Такі послідовності корисні як ДНК-праймери в способах ДНК-ампліфікації. Амплікони, які виробляються з використанням цих праймерів, є діагностичними для будь-якої з подій у сої, згаданої в цьому документі. Таким чином, винахід також включає амплікони, вироблені такими ДНК-праймерами і гомологічними праймерами. Цей винахід також включає способи детектування присутності ДНК в зразку, який відповідає події у сої, згаданій в цьому документі. Такі способи можуть включати: (a) контактування зразка, що містить ДНК, з набором праймерів, який, при використанні в реакції ампліфікації нуклеїнових кислот з ДНК з, принаймні, однією з цих подій у сої, проводить амплікон, який є діагностичним для вказаної події(й); (b) проведення реакції ампліфікації нуклеїнових кислот, тим самим продукуючи амплікон; і (с) детектування амплікону. 8 UA 109644 C2 5 10 15 20 25 30 35 40 45 50 55 60 Крім того, способи детектування за винаходом, що розглядається, включають спосіб детектування наявності ДНК в зразку, що відповідає, принаймні, одній зі вказаних подій, де вказаний спосіб включає: (a) контактування зразка, що містить ДНК, із зондом, яким гібридизується при жорстких умовах гібридизації з ДНК, принаймні, однією зі вказаних подій у сої, і який не гібридизується при жорстких умовах гібридизації з контрольною рослиною сої (ДНК без того, що представляє інтересів події); b) піддавання зразка і зонда жорстким умовам гібридизації; і (с) детектування гібридизації зонда з ДНК. У ще одному варіанті здійснення, винахід, що розглядається, включає способи отримання рослини сої, що містить подію aad-12 за винаходом, що розглядається, де вказаний спосіб включає стадії: а) статевого схрещування першої батьківської лінії сої (що включає експресійну касету за даним винаходом, яка надає вказану ознаку стійкості до гербіциду рослинам вказаної лінії) і другої батьківської лінії сої (у якої відсутня ця ознака стійкості до гербіциду), проводячи, таким чином, множину рослин-нащадків; і (b) селектування рослини-нащадка за допомогою винаходу, що розглядається. Такі способи можуть необов'язково включати додаткову стадію поворотного схрещування рослини-нащадка з другою батьківською лінією сої для отримання рослини сої чистої лінії, що містить вказану ознаку стійкості до гербіциду. Відповідно до деяких варіантів здійснення винаходу, що розглядається, надані способи визначення зиготності потомства схрещування. Вказані способи можуть включати контактування зразка, що містить ДНК сої, з набором праймерів за винаходом, що розглядається. Вказані праймери, при використанні в реакції ампліфікації нуклеїнових кислот з геномної ДНК з, принаймні, однієї зі вказаної події у сої, продукують перший амплікон, який є діагностичним для, принаймні, однієї зі вказаних подій у сої. Такі способи додатково включають проведення реакції ампліфікації нуклеїнових кислот, продукуючи, таким чином, перший амплікон; детектування першого амплікону; і контактування зразка, що містить ДНК сої, зі вказаним набором праймерів, при використанні в реакції ампліфікації нуклеїнової кислоти з геномною ДНК з рослин сої, продукування другого амплікону, що містить нативну геномну ДНК сої, гомологічну геномній області сої; і проведення реакції ампліфікації нуклеїнових кислот, продукуючи, таким чином, другий амплікон. Способи додатково включають детектування другого амплікону і порівняння першого і другого амплікону в зразку, де присутність обох ампліконів вказує на те, що зразок є гетерозиготним по трансгенній вставці. Комплекти для детектування ДНК за допомогою композицій, розкритих в цьому документі, і способи добре відомі в галузі детектування ДНК. Комплекти є корисними для ідентифікації події ДНК сої, що розглядається, в зразку, і можуть застосовуватися до способів розмноження рослин сої, що містять цю ДНК. Комплекти містять послідовності ДНК, гомологічні або комплементарні ампліконам, наприклад, розкритим в цьому документі, або послідовностям ДНК, гомологічним або комплементарним ДНК, що містяться в трансгенних генетичних елементах подій, що розглядаються. Ці послідовності ДНК можна використовувати в реакціях ампліфікації ДНК або як зонди в способах ДНК-гібридизації. Комплекти також можуть містити реагенти і матеріали, необхідні для виконання способу детектування. «Зонд» являє собою ізольовану молекулу нуклеїнової кислоти, яка приєднується до звичайної детектованої маркерної або репортерної молекули (наприклад, радіоактивний ізотоп, ліганд, хемілюмінесцентний агент або фермент). Такий зонд є комплементарним ланцюгу нуклеїнової кислоти-мішені, у випадку даного винаходу, до ланцюга геномної ДНК з однієї зі вказаних подій у сої, будь то ДНК з рослини сої або із зразка, який містить ДНК з події. Зонди відповідно до даного винаходу включають не тільки дезоксирибонуклеїнові і рибонуклеїнові кислоти, але також і поліаміди і інші матеріали зондів, які зв'язуються специфічно з послідовністю ДНК-мішені, і можуть бути використані для детектування наявності цієї послідовності ДНК-мішені. «Праймери» являють собою ізольовані/синтезуючі нуклеїнові кислоти, які випалюються з комплементарним ланцюгом ДНК-мішені шляхом гібридизації нуклеїнових кислот у вигляді гібрида між праймером і ланцюгом ДНК-мішені, а потім подовжуються по ланцюгу ДНК-мішені за допомогою полімерази, наприклад, ДНК-полімерази. Пара праймерів за даним винаходом стосується її використання для ампліфікації послідовності нуклеїнової кислоти-мішені, наприклад, шляхом полімеразної ланцюгової реакції (ПЛР) або інших звичайних способів ампліфікації нуклеїнових кислот. Зонди і праймери, як правило, становлять 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 9 UA 109644 C2 5 10 15 20 25 30 35 40 45 50 55 60 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 259, 260, 261, 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274, 275, 276, 277, 278, 279, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289, 290, 291, 292, 293, 294, 295, 296, 297, 298, 299, 300, 301, 302, 303, 304, 305, 306, 307, 308, 309, 310, 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 321, 322, 323, 324, 325, 326, 327, 328, 329, 330, 331, 332, 333, 334, 335, 336, 337, 338, 339, 340, 341, 342, 343, 344, 345, 346, 347, 348, 349, 350, 351, 352, 353, 354, 355, 356, 357, 358, 359, 360, 361, 362, 363, 364, 365, 366, 367, 368, 369, 370, 371, 372, 373, 374, 375, 376, 377, 378, 379, 380, 381, 382, 383, 384, 385, 386, 387, 388, 389, 390, 391, 392, 393, 394, 395, 396, 397, 398, 399, 400, 401, 402, 403, 404, 405, 406, 407, 408, 409, 410, 411, 412, 413, 414, 415, 416, 417, 418, 419, 420, 421, 422, 423, 424, 425, 426, 427, 428, 429, 430, 431, 432, 433, 434, 435, 436, 437, 438, 439, 440, 441, 442, 443, 444, 445, 446, 447, 448, 449, 450, 451, 452, 453, 454, 455, 456, 457, 458, 459, 460, 461, 462, 463, 464, 465, 466, 467, 468, 469, 470, 471, 472, 473, 474, 475, 476, 477, 478, 479, 480, 481, 482, 483, 484, 485, 486, 487, 488, 489, 490, 491, 492, 493, 494, 495, 496, 497, 498, 499 або 500 і більше полінуклеотидів в довжину. Такі зонди і праймери гібридизуються специфічно з послідовністю мішені при умовах гібридизації високої жорсткості. Переважно, зонди і праймери відповідно до даного винаходу мають повну схожість послідовності з послідовністю мішені, хоча зонди, відмінні від послідовності мішені, які зберігають можливість гібридизуватися з послідовністю мішені, можна спроектувати за допомогою традиційних способів. Способи підготовки і використання зондів і праймерів, описані, наприклад, в Molecular Cloning: А Laboratory Manual, 2nd ed., vol. 1-3, ed. Sambrook et al., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1989. Пари ПЛР-праймерів можна отримати з відомої послідовності, наприклад, за допомогою комп'ютерних програм, призначених для цієї мети. Праймери і зонди на основі фланкуючих ДНК і вбудованих послідовностей, розкриті в цьому документі, можуть бути використані для підтвердження (і, при необхідності, для виправлення) розкритих послідовностей, за допомогою традиційних способів, наприклад, шляхом переклонування і секренування таких послідовностей. Нуклеїнові кислоти зондів і праймерів за даним винаходом гібридизуються при жорстких умовах з послідовністю ДНК-мішені. Будь-який звичайний спосіб гібридизації нуклеїнових кислот або ампліфікації може бути використаний для ідентифікації присутності в зразку ДНК трансгенної події. Молекули нуклеїнових кислот або фрагменти цього здатні специфічно гібридизуватися з іншими молекулами нуклеїнових кислот при певних обставинах. Як використовується в цьому документі, дві молекули нуклеїнової кислоти вважаються здатними специфічно гібридизуватися одна з одною, якщо ці дві молекули здатні формувати антипаралельну, дволанцюжкову структуру нуклеїнової кислоти. Молекула нуклеїнової кислоти вважається «комплементарною» іншій молекулі нуклеїнової кислоти, якщо вони демонструють повну комплементарність. Як використовується в цьому документі, молекули вважаються виявляючими «повну комплементарність» у випадку, коли кожний нуклеотид однієї з молекул комплементарений нуклеотиду іншої. Дві молекули вважаються «мінімально комплементарними», якщо вони можуть гібридизуватися одна з одною з достатньою стійкістю, щоб дозволити їм залишатися випаленими одна з іншою при, принаймні, звичайних умовах «низької жорсткості». Аналогічним чином, молекули вважаються «комплементарними», якщо вони можуть гібридизуватися одна з одною з достатньою стійкістю, щоб дозволити їм залишатися випаленими одна з одною при звичайних умовах «високої жорсткості». Умови звичайної жорсткості описані в Sambrook et al., 1989. Відхилення від повної комплементарності, таким чином, допускаються при умові, що такі відхилення не повністю виключають здатність молекул утворювати дволанцюжкову структуру. Для того, щоб молекула нуклеїнової кислоти служила як праймер або зонд, необхідно, щоб вона була досить комплементарною по послідовності, щоб мати можливість утворювати стабільну дволанцюжкову структуру при використанні певних концентрацій розчинника і солі. Як використовується в цьому документі, істотно гомологічна послідовність являє собою послідовність нуклеїнових кислот, яка буде специфічно гібридизуватися з послідовністю, комплементарною послідовності нуклеїнових кислот, з якою відбувається порівняння при високих жорстких умовах. Термін «жорсткі умови» функціонально визначається з урахуванням гібридизації зонда нуклеїнових кислот з нуклеїновою кислотою-мішенню (тобто, з певною 10 UA 109644 C2 5 10 15 20 25 30 35 40 45 50 55 60 послідовністю нуклеїнових кислот, яка представляє інтерес) за допомогою певної методики гібридизації, викладеної в Sambrook et al., 1989 р., в 9.52-9.55. Див. також, Sambrook et al., 1989 року, в 9.47-9.52 і в 9.56-9.58. Відповідно, нуклеотидні послідовності за винаходом можна використовувати по їх здатності вибірково утворювати дуплексні молекули з комплементарними ділянками фрагментів ДНК. Залежно від передбаченого додатку, можна використовувати різні умови гібридизації, щоб досягти різного ступеня вибірковості зонда до послідовності-мішені. Для додатків, що вимагають високої вибірковості, як правило, застосовують досить жорсткі умови для утворення гібридів, наприклад, вибирають умови з відносно низьким вмістом солі і/або високою температурою, такі, які забезпечуються при концентрації від приблизно 0,02 М до приблизно 0,15 М NaCl і при температурі від приблизно 50°С до приблизно 70°С. Жорсткі умови, наприклад, можуть включати відмивання гібридизаційного фільтра, принаймні, два рази промивальним буфером з високим ступенем жорсткості (0,2 х SSC, 0,1% SDS, 65°С). Відповідні жорсткі умови, які сприяють ДНК-гібридизації, наприклад, 6,0 х хлорид натрію/цитрат натрію (SSC) при близько 45°С, за якими йде промивання 2,0 х SSC при 50°С, відомі фахівцям в галузі, що розглядається. Наприклад, концентрація солі на стадії промивання може бути вибрана від низької жорсткості з приблизно 2,0 х при 50°С до високої жорсткості приблизно 0,2 х SSC при 50°С. Крім того, температуру на стадії відмивання можна збільшити з кімнатної температури, приблизно 22°С при умовах низької жорсткості до приблизно 65°С при умовах високої жорсткості. Як температуру, так і сіль можна змінювати, або температура, або концентрація солі може бути постійною, а інша змінна змінюватися. Такі селективні умови допускають, якщо взагалі допускають, невелику невідповідність між зондом і матрицею або ланцюгом-мішенню. Детектування послідовностей ДНК за допомогою гібридизації добре відоме фахівцям в галузі, що розглядається, і рекомендації патентів США No. 4965188 і 5176995 є прикладами способів аналізів гібридизації. У особливо переважному варіанті здійснення, нуклеїнову кислоту за даним винаходом специфічно гібридизують з одним або більше з праймерів (або ампліконів або інших послідовностей), що представлені або пропонуються в цьому документі, включаючи комплементарні послідовності і фрагменти цього, в умовах високої жорсткості. У одному аспекті даного винаходу, маркерна молекула нуклеїнової кислоти за даним винаходом має послідовність нуклеїнових кислот, як указано в цьому документі в одній з представлених послідовностей, або комплементарних послідовностей і/або фрагментах цього. У іншому аспекті даного винаходу, маркерна молекула нуклеїнової кислоти за даним винаходом має від 80% до 100% або від 90% до 100% ідентичності послідовності з такими послідовностями нуклеїнових кислот. Ще в одному аспекті даного винаходу, маркерна молекула нуклеїнової кислоти за даним винаходом має від 95% до 100% ідентичності послідовності з такою послідовністю. Такі послідовності можуть бути використані як маркери в способах селекції рослин для ідентифікації потомства генетичних схрещувань. Гібридизацію зонда з молекулою ДНК-мішені можна виявити будь-яким числом способів, відомих фахівцям в галузі, що розглядається, вони можуть включати, як необмежувальні приклади, флуоресцентні мітки, радіоактивні мітки, мітки на основі антитіл і хемілюмінесцентні мітки. Відносно ампліфікації послідовності нуклеїнової кислоти-мішені (наприклад, за допомогою ПЛР) з використанням певної пари праймерів для ампліфікації, «жорсткі умови» являють собою умови, які дозволяють парі праймерів гібридизуватися тільки з послідовністю нуклеїнової кислоти-мішені, з якою праймер, що має відповідну послідовність дикого типу (або комплементарну їй), може зв'язатися і, бажано, продукувати унікальний продукт ампліфікації, амплікон. Термін «специфічний для (послідовності-мішені)» вказує, що зонд або праймер гібридизується при жорстких умовах гібридизації тільки з послідовністю-мішенню в зразку, що містить послідовність-мішень. Як використовується в цьому документі, «ампліфікована ДНК» або «амплікон» стосується продукту нуклеїновокислотної ампліфікації послідовності нуклеїнової кислоти-мішені, яка є частиною нуклеїновокислотної матриці. Наприклад, для визначення того, чи містить рослина сої, отримана в результаті статевого схрещування, геномну ДНК трансгенної події з рослини сої за даним винаходом, ДНК, екстраговані із зразка тканини рослини сої, можуть бути піддані способу ампліфікації нуклеїнових кислот з використанням пари праймерів, яка включає праймер, отриманий з фланкуючої послідовності в геномі рослини, прилеглої до ділянки вбудовування вбудованої гетерологічної ДНК, і другий праймер, отриманий із вбудованої гетерологічної ДНК, для продукування амплікону, який є діагностичним на наявність ДНК події. Амплікон має довжину і має послідовність, яка також є діагностичною для події. Амплікон може 11 UA 109644 C2 5 10 15 20 25 30 35 40 45 50 55 60 варіювати в довжину від загальної довжини пар праймерів плюс одна пара нуклеотидних основ, і/або загальна довжина пар праймерів плюс, приблизно 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 259, 260, 261, 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274, 275, 276, 277, 278, 279, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289, 290, 291, 292, 293, 294, 295, 296, 297, 298, 299, 300, 301, 302, 303, 304, 305, 306, 307, 308, 309, 310, 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 321, 322, 323, 324, 325, 326, 327, 328, 329, 330, 331, 332, 333, 334, 335, 336, 337, 338, 339, 340, 341, 342, 343, 344, 345, 346, 347, 348, 349, 350, 351, 352, 353, 354, 355, 356, 357, 358, 359, 360, 361, 362, 363, 364, 365, 366, 367, 368, 369, 370, 371, 372, 373, 374, 375, 376, 377, 378, 379, 380, 381, 382, 383, 384, 385, 386, 387, 388, 389, 390, 391, 392, 393, 394, 395, 396, 397, 398, 399, 400, 401, 402, 403, 404, 405, 406, 407, 408, 409, 410, 411, 412, 413, 414, 415, 416, 417, 418, 419, 420, 421, 422, 423, 424, 425, 426, 427, 428, 429, 430, 431, 432, 433, 434, 435, 436, 437, 438, 439, 440, 441, 442, 443, 444, 445, 446, 447, 448, 449, 450, 451, 452, 453, 454, 455, 456, 457, 458, 459, 460, 461, 462, 463, 464, 465, 466, 467, 468, 469, 470, 471, 472, 473, 474, 475, 476, 477, 478, 479, 480, 481, 482, 483, 484, 485, 486, 487, 488, 489, 490, 491, 492, 493, 494, 495, 496, 497, 498, 499, або 500, 750, 1000, 1250, 1500, 1750, 2000 або більше за пари нуклеотидних основ (плюс або мінус будь-які інкременти, перераховані вище). Альтернативно, пара праймерів може бути отримана з фланкуючої послідовності по обидві сторони від вбудованої ДНК, з тим, щоб продукувати амплікон, який включає всю вбудовану нуклеотидну послідовність. Член пари праймерів, отриманий з геномної послідовності рослини, може бути розташований на відстані від вбудованої послідовності ДНК. Ця відстань може складати від однієї пари нуклеотидних основ до, приблизно, двадцять тисяч пар нуклеотидних основ. Використання терміну «амплікон» специфічно виключає димери праймерів, які можуть утворюватися при термічній реакції ампліфікації ДНК. Нуклеїновокислотну ампліфікацію можна досягнути будь-яким з різних способів нуклеїновокислотної ампліфікації, відомих в галузі, що розглядається, в тому числі полімеразною ланцюговою реакцією (ПЛР). Різні способи ампліфікації відомі в галузі, що розглядається, і описані, зокрема, в патенті США No. 4683195 і патенті США No. 4683202. Способи ампліфікації були розроблені для ампліфікації до 22 т. п. н. геномної ДНК. Ці способи, а також інші способи, відомі в галузі ампліфікації ДНК, можуть бути використані в практиці за даним винаходом. Послідовність вбудованої гетерологічної трансгенної ДНК або фланкуючу геномну послідовність з події, що розглядається, у сої можна перевірити (і при необхідності скоректувати) шляхом ампліфікації таких послідовностей з події з використанням праймерів, отриманих з послідовностей, представлених в цьому документі, з подальшим стандартним секвенуванням ДНК ПЛР-ампліконів або клонованої ДНК. Амплікон, що виробляється цими способами, можна детектувати за допомогою різних способів. Електрофорез в агарозному гелі і фарбування бромистим етидієм є загальним добре відомим способом детектування ДНК-ампліконів. Іншим таким способом є генетичний біт-аналіз, при якому проектують ДНК-олігонуклеотид, який перекриває як прилеглу фланкуючу геномну послідовність ДНК, так і вбудовану послідовність ДНК. Олігонуклеотид іммобілізують в ямку мікроямкового планшета. Після ПЛР району, який представляє інтерес (з використанням одного праймера у вбудованій послідовності і одного в прилеглій фланкуючій геномній послідовності), одноланцюжковий ПЛР-продукт може гібридизуватися з іммобілізованим олігонуклеотидом і служити як матриця для реакції подовження на одну основу за допомогою ДНК-полімерази і мічених ддНТФ, специфічних для очікуваної наступної основи. Зчитування може бути флуоресцентним або на основі ELISA. Сигнал вказує на наявність вставки/фланкуючої послідовності, внаслідок успішної ампліфікації, гібридизації і подовження на одну основу. Всі патенти, заявки на патенти, попередні заявки і публікації, згадані або цитовані в цьому документі, включені за допомогою посилання в повному об'ємі в тій мірі, в якій вони не суперечать чіткій ідеї даної специфікації. 12 UA 109644 C2 5 10 15 20 25 30 35 40 45 50 55 Наступні приклади включені для ілюстрації процедур для тих, хто практикують винахід, і для демонстрації деяких переважних варіантів здійснення винаходу. Ці приклади не треба тлумачити як обмежуючі. Фахівцям в галузі, що розглядається, потрібно брати до уваги, що способи, розкриті в наступних прикладах, являють собою конкретні підходи, які використовуються для ілюстрації переважних режимів їх застосування. Проте, фахівці в галузі, що розглядається, повинні брати до уваги, в світлі даного розкриття, що багато змін можуть бути внесені в ці конкретні варіанти здійснення, по мірі отримання знову ж подібних або аналогічних результатів, без відступу від суті і меж винаходу. Якщо не вказано інше, всі проценти являють собою проценти по масі, і всі пропорції в сумішах сольвентів представлені по об'єму, якщо не вказано інше. Використовуються наступні скорочення, якщо не вказано інше. AAD-12 - арилоксіалканоатдіоксигеназа-1 п. о. - пара основ °С - градуси Цельсія ДНК - дезоксирибонуклеїнова кислота DIG - дигоксигенін ЕДТА - Етилендіамінтетраоцтова кислота т. п. о. - тисяча пар основ мкг - мікрограм мкл - мікролітр мл - мілілітр M - молярна маса OLP - перекриваючий зонд ПЛР - полімеразна ланцюгова реакція PTU - транскрипційна одиниця рослини SDS - додецилсульфат натрію SOP - Стандартна операційна процедура SSC - буферний розчин, що містить суміш хлориду натрію і цитрату натрію, рН 7,0 TBE - буферний розчин, що містить суміш Тріс-основи, борної кислоти і ЕДТА, рН 8,3 V - Вольти ПРИКЛАДИ Приклад 1. Подія-специфічний Taqman-аналіз Подія-специфічний TAQMAN-АНАЛІЗ® був розроблений для детектування присутності події DAS-68416-4 у сої і визначення стану зиготності рослин у виведених популяціях. Для розробки подія-специфічного тесту, специфічні Taqman-праймери і зонди були отримані відповідно до послідовностей ДНК, розташованих в 5'-ділянці з'єднання ДНК вставки-рослини. Для специфічного детектування події DAS-68416-4 у сої фрагмент ДНК в 128 п. о., який охоплює цю 5'-інтеграційну ділянку з'єднання, був ампліфікований з використанням двох специфічних праймерів. Ампліфікація цього ПЛР-продукту була визначена шляхом мішень-специфічного MGB-зонда, синтезованого Applied Biosystems, що містить FAM-репортер на його 5'-кінці. Специфічність цього способу Taqman-детектування для події DAS-68416-4 у сої була перевірена відносно 15 різних подій aad-12 у сої і нетрансгенного сорту сої (Maverick) в форматі дуплекса з певним ендогенним референсним геном сої - лектином. Приклад 1.1. Виділення геномної ДНК У цьому дослідженні були протестовані зразки геномної ДНК 15 різних подій AAD-12 у сої і нетрансгенні сорти сої. Геномна ДНК була отримана за допомогою Qiagen DNeasy 96 Plant Kit. Диски свіжих листів сої, вісім на зразок, були використані для екстрагування геномної ДНК з використанням модифікованого протоколу Qiagen DNeasy 96 Plant Kit. Геномну ДНК кількісно визначали способом з піко зеленим відповідно до інструкції постачальника (Molecular Probes, Eugene, OR). Зразки розбавляли водою, що не містить ДНКаз, в результаті чого для цілей даного дослідження концентрація становила 10 нг/мкл. Приклад 1.2. Taqman-аналіз і результати Специфічні Taqman-праймери і зонди були отримані для специфічного Taqman-аналізу події DAS-68416-4 у сої. Ці реагенти можна використовувати при умовах, перерахованих нижче, для детектування aad-12 в події DAS-68416-4 у сої. У таблиці 1 перераховані послідовності праймерів і зондів, які були отримані конкретно для детектування події DAS-68416-4. 13 UA 109644 C2 Таблиця 1 ПЛР-праймери і зонди Назва Soy416-F Soy416-R Soy416-зонд Назва ZN_007 ZN_008 ZN_LT_002 5 10 15 Реакція для події-мішені Опис Послідовність в напрямку 5' до 3' Прямий праймер SEQ ID NO:2 GGGCCTAACTTTTGGTGTGATG Зворотний праймер SEQ ID NO:3 TACTTGCTCTTGTCGTAAGTCAATAAATT Зонд SEQ ID NO:4 FAM-TTCAAGCACCAGTCAGCAT-MGB Реакція в референтній системі з лектином Опис Послідовність в напрямку 5' до 3' Прямий праймер SEQ ID NO:5 TCCCGAGTGGGTGAGGATAG Зворотний праймер SEQ ID:6 TCATGCGATTCCCCAGGTAT SEQ ID NO:7 HEX-TTCTCTGCTGCCAACGGGACTCGAЗонд BHQ1 Мультиплексні ПЛР-умови для ампліфікації є наступними: 1X ПЛР-буфер, 0,5-2,5 мМ MgCl2, 0,2 мМ дНТФ, 0,2 мкМ праймера Soy416-F, 0,2 мкМ праймера Soy416-R, 0,2 мкМ праймера ZN 007, 0,2 мкМ праймера ZN 008, 0,08 мкМ Soy416-Зонд, 0,08 мкм ZN LT 002, 40 од/мл HotStart Taq, 30 нг геномної ДНК в загальному реакційному об'ємі 25 мкл. Суміш ампліфікували з використанням наступних умов: i) 95°С протягом 15 хв., ii) 95°С протягом 20 сек, iii) 60°С протягом 60 сек, iv) повторення стадії ii-iii протягом 35 циклів, v) підтримування при 4°С. ПЛР в реальному часі проводили на термоциклерах BIO-RAD ICYCLERTM і ABI Gene Amp PCR System 9700. Аналіз даних був оснований на визначенні порогу циклу (СТ), який являє собою число циклів ПЛР, коли визначення флуоресценції досягає заданого значення. СТ-значення розраховували автоматично за допомогою програмного забезпечення iCycler. Спосіб Taqman-детектування для події DAS-68416-4 у сої був застосований відносно 16 різних aad-12 подій у сої і нетрансгенних сортів сої в форматі дуплекса зі специфічним ендогенним лектином сої як референсний ген. Цей тест специфічно детектував подію DAS68416-4 у сої і не продукував або ампліфікував які-небудь помилково-позитивні результати з контролів (тобто 15 різних aad-12 подій у сої і нетрансгенних сортів сої). Праймери і зонди, специфічні для події, можуть бути використані для детектування події DAS-68416-4 у сої, і ці умови і реагенти застосовні для тестів на зиготність. 20 14 UA 109644 C2 15 UA 109644 C2 16 UA 109644 C2 17 UA 109644 C2 18 UA 109644 C2 19 UA 109644 C2 20 UA 109644 C2 ФОРМУЛА ВИНАХОДУ 5 1. Спосіб визначення зиготності події у рослини сої, що включає AAD-12-подію pDAB4468-0416 у сої, яка включає SEQ ID NO: 1, де вказана подія містить трансгенну конструкцію, що включає ген AAD-12, і вказана трансгенна конструкція фланкована 5'-фланкуючою геномною ДНК сої і 3'-фланкуючою геномною ДНК сої, де вказана 5'-фланкуюча ДНК включає залишки 1-2730 SEQ ID NO: 1, вказана 3'-фланкуюча ДНК включає залишки 9122-10212 SEQ ID NO: 1, і вказана 21 UA 109644 C2 5 10 15 20 25 30 35 40 45 50 трансгенна конструкція складається із залишків 2731-9121 SEQ ID NO: 1, де вказаний спосіб включає: отримання ДНК-зразка геномної ДНК із вказаної рослини сої; продукування зразка для контактування шляхом контактування вказаного зразка ДНК з а) праймером першої події і праймером другої події, де вказаний праймер першої події специфічно зв'язується із вказаною трансгенною конструкцією, і вказаний праймер другої події специфічно зв'язується із вказаною 5'-фланкуючою геномною ДНК сої або із вказаною 3'фланкуючою геномною ДНК сої, і де вказаний праймер першої події і вказаний праймер другої події продукують амплікон події у випадку, коли піддаються умовам проведення TAQMAN-ПЛР, b) референсним прямим праймером і референсним зворотним праймером, які продукують референсний амплікон з ендогенного референсного гена сої у випадку, коли піддаються умовам проведення TAQMAN-ПЛР, с) флуоресцентним зондом події, який гібридизується із вказаним ампліконом події, d) флуоресцентним референсним зондом, який гібридизується із вказаним референсним ампліконом; контактування вказаного зразка в умовах для проведення TAQMAN-ПЛР основаної на флуоресценції кінцевої точки; проведення кількісного аналізу вказаного флуоресцентного зонда події, який гібридизується із вказаним ампліконом події; проведення кількісного аналізу вказаного флуоресцентного референсного зонда, який гібридизується із вказаним референсним ампліконом; порівняння кількостей флуоресцентного зонда події, який прогібридизувався, і флуоресцентного референсного зонда, який прогібридизувався; і визначення зиготності pDAB4468-0416 шляхом порівняння співвідношення флуоресценції флуоресцентного зонда події, який прогібридизувався, і флуоресцентного референсного зонда, який прогібридизувався. 2. Спосіб за п. 1, де вказані амплікони складаються із 50-150 залишків. 3. Спосіб за п. 1, де вказаний референсний ген є ендогенним геном лектину сої. 4. Спосіб за п. 1, де вказаний праймер другої події зв'язується із залишками 2530-2730 SEQ ID NO: 1 або з комплементарною послідовністю. 5. Спосіб за п. 1, де вказаний праймер другої події зв'язується із залишками 9122-9322 SEQ ID NO: 1. 6. Спосіб за п. 1, де вказані амплікони складаються з 100-200 пар основ. 7. Спосіб за п. 1, де вказаний референсний ген включає або гібридизується з послідовністю, вибраною з групи, що складається з SEQ ID NO: 5, SEQ ID NO: 6 і SEQ ID NO: 7. 8. Спосіб за п. 1, де вказані референсні праймери містять SEQ ID NO: 5 і SEQ ID NO: 6 і вказаний референсний зонд містить SEQ ID NO: 7. 9. Спосіб за п. 1, де вказані зонди марковані флуоресцентним барвником і гасником. 10. Спосіб за п. 9, де вказаний зонд події містить FAM як вказаний флуоресцентний барвник на 5'-кінці вказаного зонда події і MGB-гасник на 3'-кінці вказаного зонда події. 11. Спосіб за п. 9, де вказаний референсний зонд маркований HEX на 5'-кінці вказаного референсного зонда і Black Hole Quencher 1 (BHQ1) на 3'-кінці вказаного референсного зонда. 12. Спосіб за п. 1, де вказаний зонд події містить SEQ ID NO: 4. 13. Спосіб за п. 1, де вказані праймери події вибрані з групи, що складається з SEQ ID NO: 2 і SEQ ID NO: 3. 14. Спосіб за п. 1, де результати вказаного способу зчитуються безпосередньо в планшетрідері. 15. Комплект для виконання способу за п. 1, де вказаний комплект включає вказані праймери події, які складаються з SEQ ID NO: 2 і SEQ ID NO: 3, вказані референсні праймери, які складаються з SEQ ID NO: 5 і SEQ ID NO: 6, вказаний зонд події, який складається з SEQ ID NO: 4, і вказаний референсний зонд, який складається з SEQ ID NO: 7. 22 UA 109644 C2 23 UA 109644 C2 Комп’ютерна верстка А. Крулевський Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 24
ДивитисяДодаткова інформація
Назва патенту англійськоюDetection of aad-12 soybean event 416
Автори англійськоюNovak, Stephen, Cui, Yunxing Cory, Greene, Thomas, Zhou, Ning
Автори російськоюНовак Стефен, Цуй Юнсинь Кори, Грин Томас, Чжоу Нин
МПК / Мітки
МПК: C12P 19/34, C12N 15/82, A01H 1/04, C07H 21/04, C12Q 1/68
Мітки: включає, визначення, зиготності, спосіб, pdab4468-0416, сої, рослини, події, aad-12-подію
Код посилання
<a href="https://ua.patents.su/26-109644-sposib-viznachennya-zigotnosti-podi-u-roslini-so-shho-vklyuchaeh-aad-12-podiyu-pdab4468-0416-u-so.html" target="_blank" rel="follow" title="База патентів України">Спосіб визначення зиготності події у рослини сої, що включає aad-12-подію pdab4468-0416 у сої</a>
Попередній патент: Арил- і гетероарилкарбонільні похідні гексагідроінденопіридину та октагідробензохіноліну
Наступний патент: Інсектицидні сполуки на основі похідних ізоксазоліну
Випадковий патент: Спосіб одержання вакцини на основі живого атенуйов