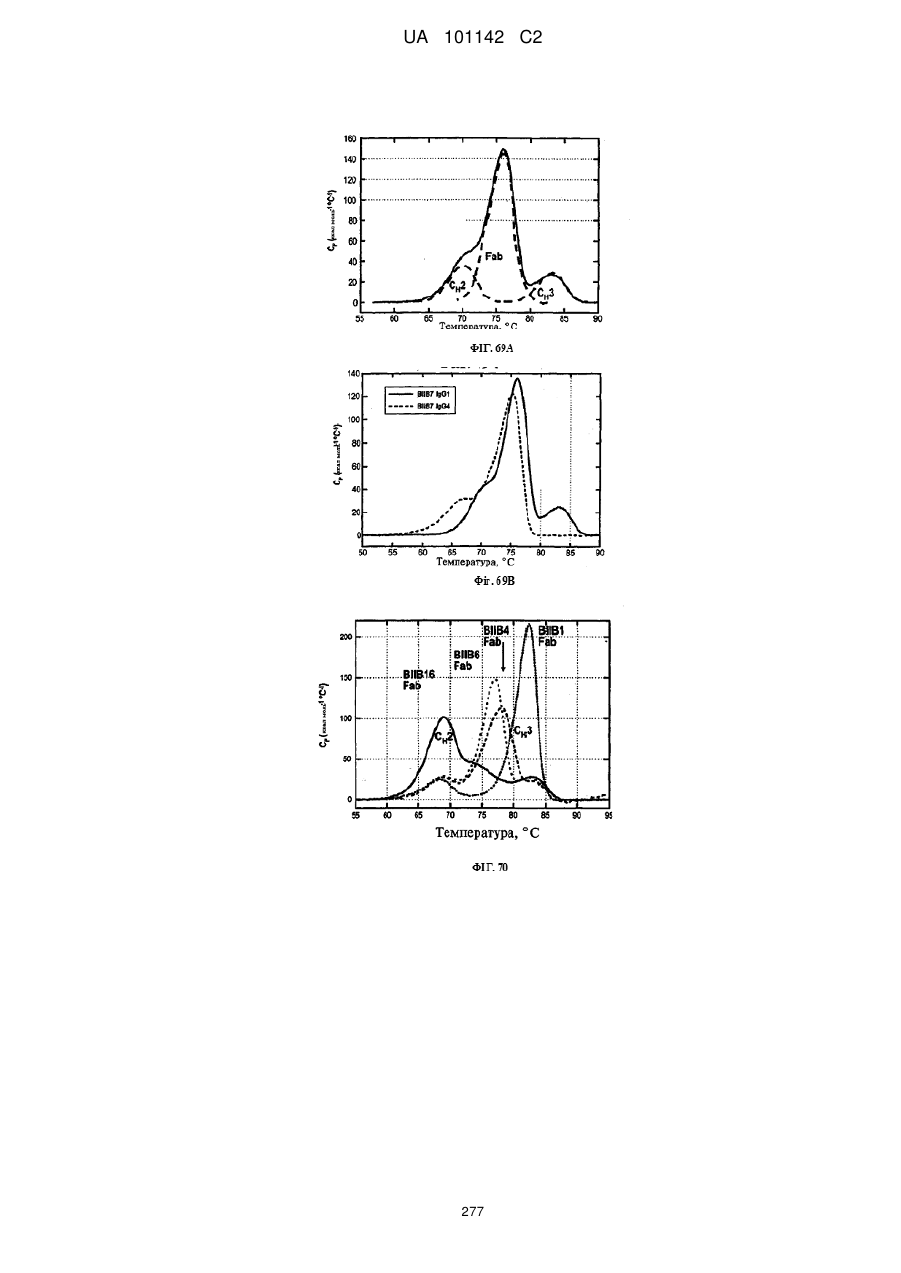
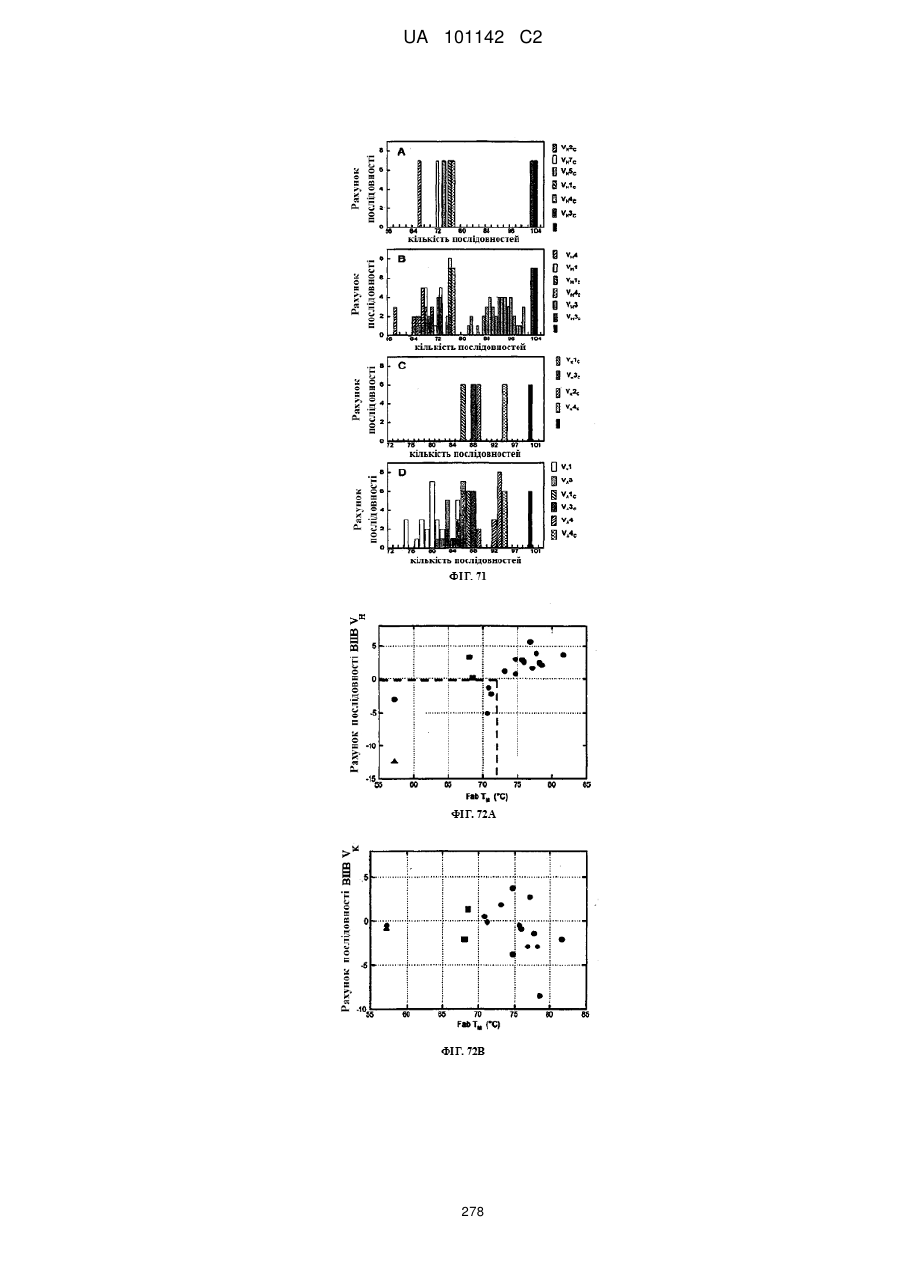
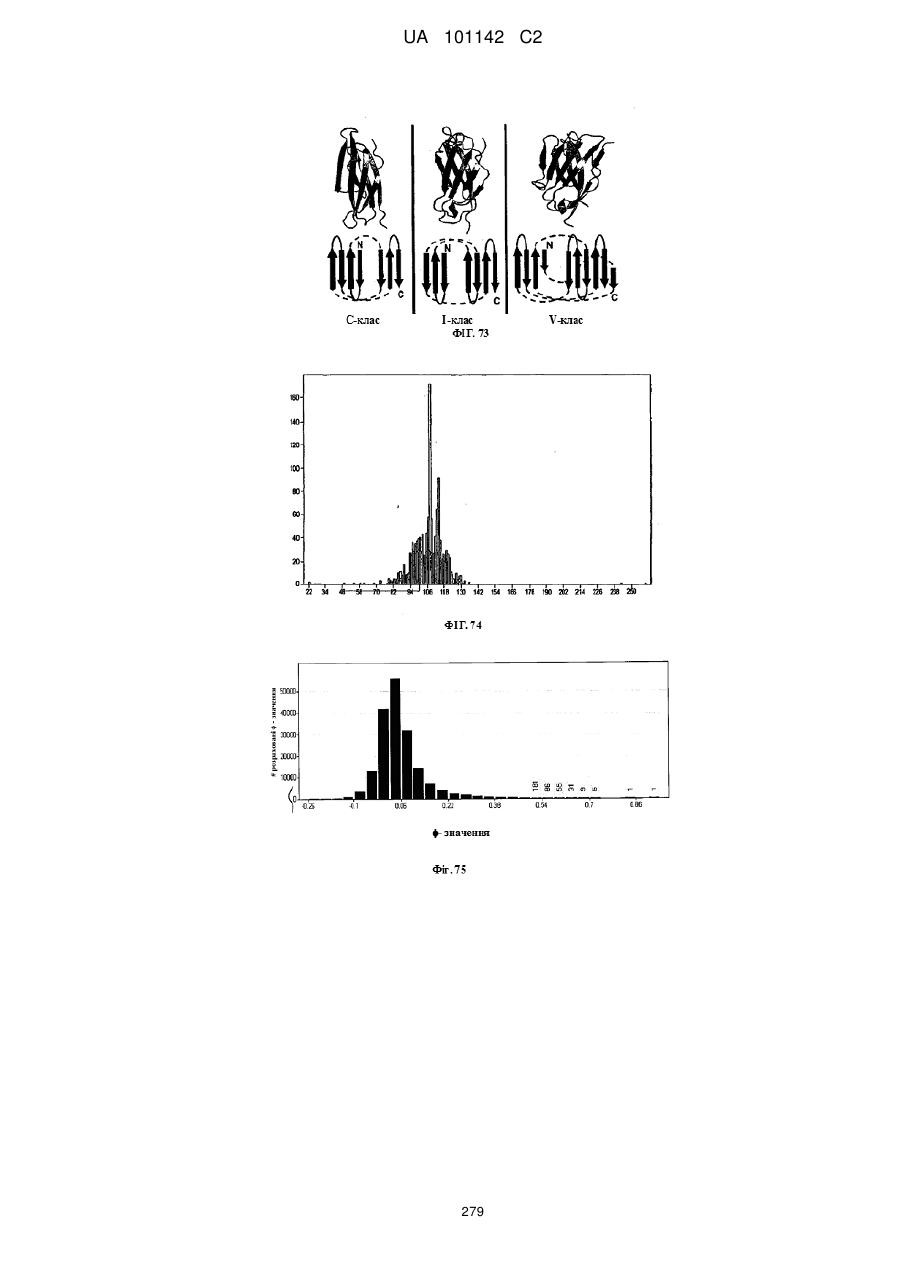
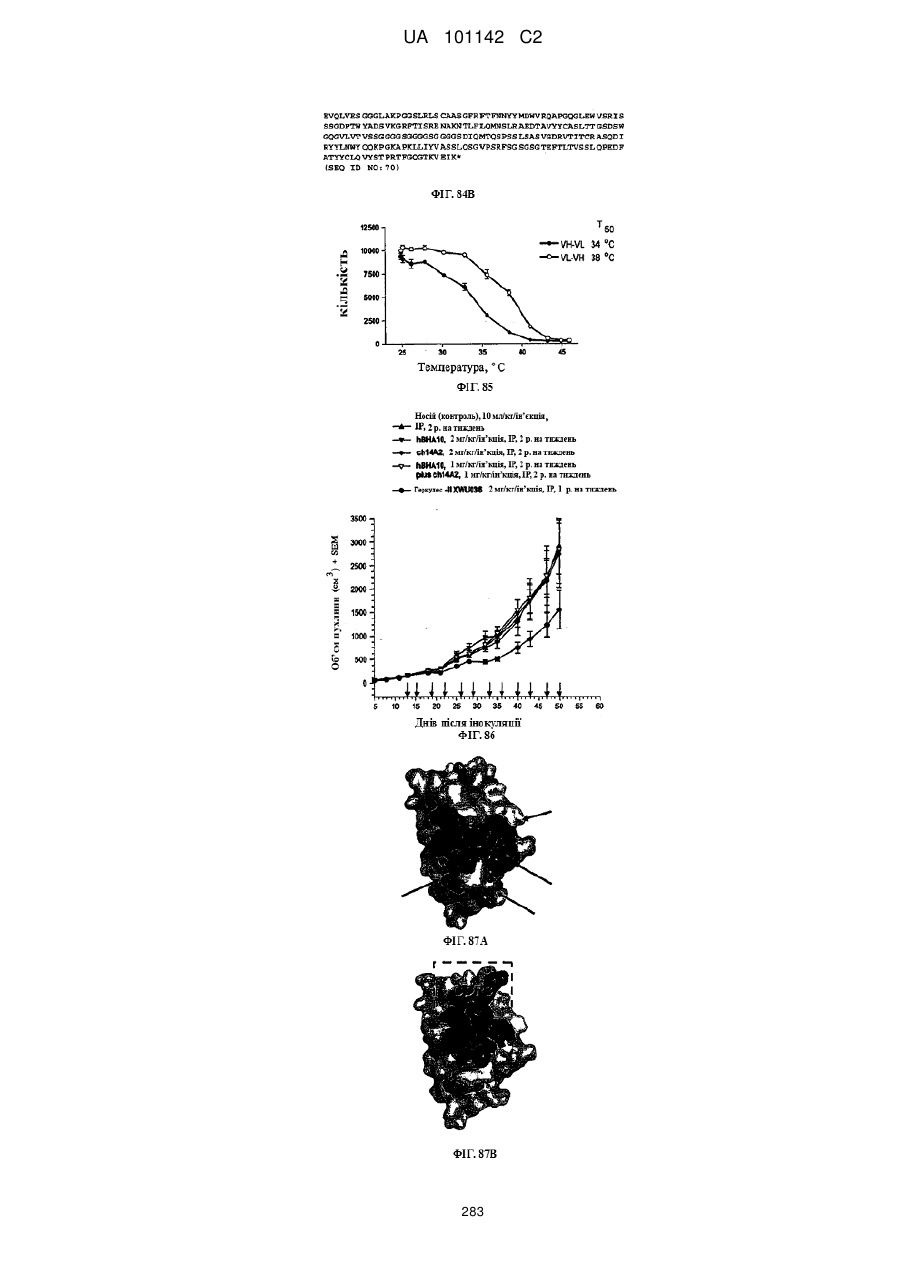
Спосіб розробки антитіла
Номер патенту: 101142
Опубліковано: 11.03.2013
Автори: Кроне Лайза Дж., Міллер Брайан Роберт, Ву Ксіуфенг, Снайдер Уільям Б., Дімарест Стівен, Глейзер Скотт, Луговской Алєксєй Алєксандровіч, Ванг Норман
Формула / Реферат
1. Спосіб розробки антитіла або його антиген-зв'язуючого фрагмента, у якому:
(a) забезпечують виправлений набір порівняння амінокислотних послідовностей, який містить послідовність, що відповідає імуноглобуліновому типу укладки ("Ig укладка") білка, який належить до білків надсімейства імуноглобулінів;
(b) вирівнюють амінокислотні послідовності набору порівняння з одержанням вирівняного набору;
(c) визначають коваріації між двома чи більше положеннями залишків у вирівняному наборі з одержанням коваріаційного набору даних;
(d) ідентифікують нековаріюючі амінокислоти у вказаному антитілі-кандидаті або його антиген-зв'язуючому фрагменті, де відповідні амінокислоти у послідовностях набору порівняння являють собою коваріюючі амінокислоти; та
(e) замінюють нековаріюючі амінокислоти послідовності кандидата на відповідні коваріюючі амінокислоти у наборі порівняння, таким чином покращуючи біофізіологічну властивість послідовності кандидата.
2. Спосіб за п. 1, де вказану біофізіологічну властивість вибирають з групи, що складається з термічної стабільності, профілю розгортання рН, стабільного видалення глікозилування, розчинності, біохімічної функції та їх комбінацій.
3. Спосіб за п. 1, де вказане антитіло чи його антиген-зв'язуючий фрагмент вибирають з групи, що складається з доменного антитіла, гуманізованого антитіла, людського антитіла, нелюдського моноклонального антитіла, химерного антитіла, біспецифічного антитіла, молекули scFv, scFv-вмісного антитіла, антитіла, що не містить домен, та комбінації будь-яких фрагментів вказаних антитіл.
4. Спосіб за п. 1, де коваріаційні амінокислоти є частиною структурної ознаки, вибраної з групи, що складається з дисульфідного зв'язку, сольового містка, частини ліганд-зв'язуючої кишені чи поверхні, мережі Ван-дер-Ваальса, водневого зв'язку і/або заряд-зарядної взаємодії, та комбінації двох чи більше зі вказаних структурних властивостей.
5. Спосіб за п. 1, де амінокислотна послідовність у наборі порівняння стадії (а) має менш ніж 95 % ідентичність з кожною з інших послідовностей у вказаному наборі порівняння.
6. Спосіб за п. 1, у якому:
(a) збирають набір структур Ig-укладки, де вказані структури містять Ig укладку з класу Ig укладки, що складається з групи, яка включає укладку V-класу, укладку I-класу, укладку C1-класу, укладку C2-класу та комбінації вказаних класів Ig укладок;
(b) фільтрують набір структур Ig-укладки шляхом видалення структур Ig-укладки, що містять послідовності з розривами, послідовності зі 100 % ідентичністю до інших послідовностей в межах набору, послідовності з аберантною довжиною або структури, що проявляють топології неправильного згортання;
(c) конструюють структурні вирівнювання, де відфільтровані набори структур Ig-укладки накладені один на інший;
(d) одержують вирівнювання послідовностей зі структурних вирівнювань, де амінокислоти з послідовності однієї структури відповідають амінокислотам з послідовності другої структури, виходячи з найкоротшої відстані між α-вуглецями поліпептидних каркасів;
(e) конструюють Приховані Моделі Маркова (ПMM) для класу Ig-укладки, виходячи з вирівнювань;
(f) виконують пошук у базі даних білкових послідовностей з використанням ПMM, отримуючи послідовності у базі даних білкових послідовностей, що відповідають ПMM; та,
(g) здійснюють валідацію призначення класів Ig-укладки білкових послідовностей, отриманих у (f), причому отриману послідовність залишають у наборі порівняння тільки, якщо її призначення до класу Ig-укладки є статистично значущим.
7. Спосіб за п. 1, де вказане вирівнювання додатково включає:
(aa) видалення надлишкових чи дуже подібних амінокислотних послідовностей з вирівнювання; та
(bb) видалення стовпчиків у вирівнюванні, які не відповідають станам у профілі ПMM.
8. Спосіб за п. 1, де розрахунок коваріації стадії (c) включає (i) ідентифікацію гепів як окремих типів залишків, (ii) застосування функції оцінки різноманіття, (iii) застосування функції фільтрування для коваріантних пар, (iv) застосування відсікання подій, де про коваріантні пари не повідомляють, якщо їх не спостерігають мінімальну кількість разів, де вказане відсікання подій становить приблизно 2 чи більше подій, та (v) комбінацію двох чи більше вказаних властивостей.
9. Спосіб за п. 1, де розрахунок коваріації стадії (c) включає розрахунок статистичної значущості коваріації за допомогою аналізу χ2.
10. Спосіб за п. 9, де значення χ2 розраховують за допомогою формули підрахунку подій.
11. Спосіб за п. 10, де вказана формула підрахунку подій є наступною:
,
у якій
p(i) та p(j) являють собою частоту повторення залишків будь-яких двох типів залишків, які розглядають, у положеннях i та j, відповідно, у вирівняному наборі послідовностей;
c(i, j) являє собою кількість спостерігань p(i) та p(j) в тій самій послідовності; та,
c(t) являє собою загальну кількість послідовностей у вирівнюванні,
де частоту повторення залишків визначають як кількість спостерігань типу залишку у конкретному положенні у вирівнюванні, розділену на загальну кількість послідовностей у вирівнюванні.
12. Спосіб за п. 1, де розрахунок коваріації стадії (c) включає розрахунок коефіцієнта кореляції (φ) за формулою:
у якій
aibj являє собою кількість виявлень амінокислот типу a чи b у тій самій послідовності у положеннях i та j, відповідно;
являє собою кількість разів, коли обидва типи амінокислот відсутні у тій самій послідовності;
являє собою кількість разів, коли амінокислота a наявна, тоді як амінокислота b відсутня; та,
являє собою кількість разів, коли амінокислота a відсутня, тоді як амінокислота b наявна,
та де коефіцієнт кореляції (φ) є мірою статистичної сили коваріації.
13. Спосіб за п. 1, де розрахунок коваріації стадії (c) включає одержання балів коваріації тільки для коваріацій, що задовольняють пороговому рівню статистичної значущості.
14. Спосіб за п. 13, де коваріаційні бали одержують лише для коваріацій, що є вищими або нижчими за порогові значення χ2 або значення φ.
15. Спосіб за п. 14, де амінокислоти у послідовності кандидата отримують позитивні специфічні коваріаційні бали у випадку позитивних коваріацій, що мають коефіцієнт кореляції φ більший за приблизно +0,2.
16. Спосіб за п. 14, де амінокислоти у послідовності кандидата отримують негативні специфічні коваріаційні бали у випадку негативних коваріацій, що мають коефіцієнт кореляції φ менший за приблизно –0,2.
17. Спосіб за п. 1, у якому додатково:
(aa) забезпечують структурні моделі матричного антитіла або антиген-зв'язуючого фрагмента та антитіла-кандидата або антиген-зв'язуючого фрагмента;
(bb) ідентифікують інтерфейсні залишки у матричному антитілі або антиген-зв'язуючому фрагменті, які є важливими для стабільності;
(cc) ідентифікують каркасні залишки, що коваріюють з інтерфейсними залишками зі стадії (bb);
(dd) замінюють один або більше інтерфейсних залишків або каркасних залишків у антитілі-кандидаті або антиген-зв'язуючому фрагменті на відповідні інтерфейсні залишки або каркасні залишки, визначені на стадіях (bb) та (cc).
18. Спосіб за п. 17, де інтерфейсні залишки розташовані на границі контакту VH або VL.
19. Спосіб за п. 1, у якому додатково:
(1) розраховують консенсусні бали для одного чи більше положень амінокислот у послідовності антитіла-кандидата або антиген-зв'язуючого фрагмента;
(2) вибирають амінокислотні заміни, у послідовності антитіла-кандидата, засновані на поєднанні комбінації консенсусних балів та коваріаційних даних.
20. Спосіб за п. 19, де при розрахунку консенсусних балів:
(i) забезпечують виправлений набір порівняння поліпептидних послідовностей, що належать до імуноглобулінового надсімейства;
(ii) вирівнюють послідовності набору порівняння з одержанням вирівняного набору; та,
(iii) розраховують частоту виявлення амінокислоти для амінокислоти у кожному положенні послідовності кандидата, де вказану частоту розраховують шляхом підсумовування кількості випадків, коли амінокислота присутня у відповідному положенні у вирівняному наборі, та розділення сумарного значення на загальну кількість послідовностей у вирівняному наборі.
21. Спосіб за п. 20, у якому додатково:
(a) визначають консенсусну послідовність, де амінокислота у кожному положенні у межах консенсусної послідовності відповідає амінокислоті, що найбільш часто зустрічається у вказаному положенні у вирівняному наборі;
(b) розраховують частоту виявлення амінокислоти для амінокислоти у кожному положенні консенсусної послідовності, де вказану частоту розраховують шляхом підсумовування кількості випадків, коли амінокислота присутня у відповідному положенні у вирівняному наборі, та розділення сумарного значення на загальну кількість послідовностей у вирівняному наборі; та
(c) розділяють частоту виявлення амінокислоти, визначену на стадії (ііі) п. 20, на частоту виявлення амінокислоти, визначену у (b) з одержанням консенсусного балу для кожного положення амінокислоти.
Текст
Реферат: Винахід належить до способу розробки антитіла або його антиген-зв'язуючого фрагмента шляхом забезпечення виправленого набору порівняння амінокислотних послідовностей, який UA 101142 C2 (12) UA 101142 C2 містить послідовність, що відповідає імуноглобуліновому типу укладки білка, вирівнювання амінокислотних послідовностей набору порівняння з одержанням вирівняного набору, визначення коваріацій між двома чи більше положеннями залишків у вирівняному наборі з одержанням коваріаційного набору даних, ідентифікації нековаріюючих амінокислот у вказаному антитілі-кандидаті, де відповідні амінокислоти у послідовностях набору порівняння являють собою коваріюючі амінокислоти та заміни нековаріюючих амінокислот послідовності кандидата на відповідні коваріюючі амінокислоти у наборі порівняння, покращуючи біофізіологічну властивість послідовності кандидата. UA 101142 C2 5 10 15 20 25 30 35 40 45 50 55 60 Споріднені заявки Дана заявка заявляє пріоритет наступних попередніх патентних заявок США, кожна з яких включена сюди шляхом посилання у всій своїй повноті для всіх цілей: 1) попередня патентна заявка номер 60/783,622, подана 17 березня 2006, під назвою "СТАБІЛІЗОВАНІ ПОЛІПЕПТИДИ Й СПОСОБИ ОЦІНКИ І ПІДВИЩЕННЯ ЇХ СТАБІЛЬНОСТІ"; 2) попередня патентна заявка номер 60/812,688, подана 9 червня 2006, під назвою "СТАБІЛІЗОВАНІ ПОЛІПЕПТИДИ Й СПОСОБИ ОЦІНКИ І ПІДВИЩЕННЯ ЇХ СТАБІЛЬНОСТІ"; 3) попередня патентна заявка номер 60/873,502, подана 8 грудня 2006, під назвою "СПОСОБИ ОЦІНКИ Й ПОСИЛЕННЯ БІОФІЗИЧНИХ ВЛАСТИВОСТЕЙ ПОЛІПЕПТИДІВ"; а також 4) попередня патентна заявка номер 60/873,996, подана 8 грудня, 2006, під назвою "СТАБІЛІЗОВАНІ ПОЛІПЕПТИДНІ КОМПОЗИЦІЇ". Зміст всіх патентів, патентних заявок і посилань, що процитовані у даній специфікації, включені сюди шляхом посилання у всій своїй повноті. Передумови створення винаходу У цей час визнано, що стабільність білків є центральною проблемою при розробці і масштабуванні білків, наприклад, молекул антитіл. Важкі й легкі ланцюги варіабельних послідовностей доменів антитіл перебувають під селективним тиском, і їх послідовність може сильно варіюватися від одного антитіла до іншого (Wu і Kabat, 1970). У геном людини входить безліч функціональних варіабельних важких (~40; Tomlinson et al., 1992; Tomlinson et al., 1994; Matsuda and Honjo, 1996), варіабельних капа (~40; Meindl et al., 1989; Cox et al., 1994; Barbie and Lefranc, 1998) і варіабельних лямбда (~30; Williams et al., 1996; Kawasaki, et al., 1997) генів зародкової лінії. Здатність імунної системи створювати велику кількість комбінацій важких і легких варіабельних ланцюгів є одним з механізмів створення різноманіття антитіл (Edelman, 1959; Franek, 1961). Розмаїтість досягається також включенням варіабельного з'єднуючого пептидного регіону, J-з'єднуючого пептиду (плюс D-з'єднуючого пептиду для важких доменів) між варіабельним і постійним доменами (Leder, 1982). Після вибору зародкового антитіла проти конкретного антигену В-клітини, що експресують антитіла з відібраними зародковими лініями варіабельного домену і (D-)J-з'єднуючі пептиди, піддаються процесу гіперсоматичної мутації у варіабельних доменах важких і легких ланцюгів з метою підвищення спорідненості антитіла стосовно антигену (Leder, 1982; Tomlinson et al., 1996). Крім того, звичайно, спостерігаються гіперсоматичні включення або делеції у варіабельних доменах, хоча й значно рідше гіперсоматичних мутацій (de Wildt et al., 1999). Таким чином, антитіло, що дозріло, проти конкретного антигену характеризуються унікальними послідовностями варіабельних доменів, не обов'язково оптимізованих стосовно стабільності. Погана стабільність може вплинути на здатність антитіла або домену антитіл правильно згортатися при експресії в різних клітинних системах, наприклад, у системах експресії бактерій або ссавців. Неправильне згортання або низька стабільність також можуть привести до появи популяцій нефункціонального матеріалу (Martsev et al., 1998) і/або антитіл з тенденцією до утворення великих розчинних агрегатів, потенційно небезпечних або імуногенних при терапевтичному застосуванні. Інші зв'язані зі стабільністю проблеми включають рефолдинг, деградацію, порушення авідності, агрегацію або втрату активності при зберіганні. Проблеми стабільності не обмежуються природними антитілами, вони можуть мати місце й у сконструйованих антиген-єднальних молекулах, таких як бібліотеки рекомбінантних антитіл (Hoogenboom, 2005), фрагменти антитіл (Holt et al., 2003; Todorovska et al., 2001; Worn і Pluckthun, 2001; Reiter і Pastan, 1996), а також сконструйовані або гуманізовані терапевтичні антитіла для виробничих і клінічних цілей (Ewert et al., 2004; Carter and Merchant, 1997). Проблеми стабільності можуть виникати також і в мультивалентних формах антитіл, таких як біспецифічні молекули. Хоча через терапевтичне застосування в людей біспецифічні антитіла небажані, їх утворення непередбачене. Наприклад, біспецифічні антитіла можуть приводити до істотного зниження термічної стабільності, виходу продукту або утворенню агрегатів низької молекулярної ваги. Неприродні зміни доменів VH і VL можуть виникати також при гуманізації антитіл гризунів. Звичайно, гуманізацію проводять, прищеплюючи регіони (complementarity determining regions (CDR)) гризунів, що визначають компліментарність, на найбільш схожі людські зародкові домени варіабельних ланцюгів (Hurle і Gross, 1994). Обрані для гуманізації зародкові лінії можуть використовуватися імунною системою не занадто часто, і для досягнення адекватного зв'язування антигену часто буває необхідно провести зміни в базовій структурі. Нестабільність білків приводить до безлічі проблем, включаючи одну або більше наступних: непридатність для масштабного виробництва в біореакторах (наприклад, через низький вихід, значної кількості небажаних супутніх продуктів, таких як незібраний продукт і/або агрегований 1 UA 101142 C2 5 10 15 20 25 30 35 40 45 50 55 60 матеріал), труднощі очищення, а також непридатність для фармацевтичного готування і використання (наприклад, через велику кількість продуктів розпаду, низької якості продуктів і/або несприятливих фармакокінетичних властивостей). Нестабільність варіабельних доменів антитіл, Fabs, Fvs або Fvs з одного ланцюга (single-chain Fvs, scFvs) може приводити до безлічі таких проблем. Конструкти scFv, особливо, демонструють проблеми стабільності, розчинності, експресії, агрегації, утворення продуктів розпаду, а також загальної здатності бути виробленими в системах експресії бактерій і ссавців (див. Worn і Pluckthun, 2001). Крім того, включення молекул scFv у раніше стабільні рекомбінантні антитіла часто приводить до появи цих небажаних характеристик у нових продуктів. Таким чином, у цей час спостерігається необхідність розробки нових удосконалених способів пророкування стабільності білків, таких як антитіла, а також поліпшених, стабільних антиген-єднальних молекул, придатних для масштабного виробництва. Є також потреба розробки вдосконалених способів масштабованого виробництва популяції стабільних антигенєднальних молекул, придатних для застосування у фармацевтиці. Короткий опис сутності винаходу Винахід заснований, принаймні, частково, на розробці поліпшених поліпептидних композицій, наприклад, молекул з поліпшеним зв'язуванням, що включає або складається з молекул scFv з поліпшеною стабільністю й способам їх готування. Відповідно до одного свого аспекту, винахід відноситься до популяції стабілізованих молекул scFv, де стабілізовані молекули scFv містять: i) лінкер scFv, розташований між доменами V H і VL, де домени VH and VL зв'язані дисульфідним містком між амінокислотою VH домену й амінокислотою VL домену, і де домени VH і VL молекул scFv характеризуються Tm більше 55ºC; або ii) лінкер scFv, розташований між доменами VH і VL, де домени VH і VL зв'язані дисульфідним містком між амінокислотою VH домену й амінокислотою VL домену, і де молекули scFv характеризуються Tm більше 49ºC. Відповідно до іншого свого аспекту, винахід відноситься до стабілізованої молекули scFv, де стабілізована молекула scFv включає i) лінкер scFv з амінокислотною послідовністю (Gly4 Ser)n, розташований між доменами VH і VL, де домени VH and VL зв'язані дисульфідним містком між амінокислотою VH домену 44 і амінокислотою VL домену 100; ii) домени VH and VL, де молекула включає щонайменше одну заміну, обрану з наступної групи: a) заміну амінокислотного залишку в положенні Кебата 13 домену VH; b) заміну амінокислотного залишку в положенні Кебата 16 домену VH; c) заміну амінокислотного залишку в положенні Кебата 46 домену VL; d) заміну амінокислотного залишку в положенні Кебата 49 домену VL; e) заміну амінокислотного залишку в положенні Кебата 50 домену VL; f) заміну амінокислотних залишків у положеннях Кебата 49 і 50 домену VL; g) заміну амінокислотного залишку в положенні Кебата 101 домену VH; h) заміну амінокислотного залишку в положенні Кебата 20 домену VH; i) заміну амінокислотного залишку в положенні Кебата 48 домену VH; j) заміну амінокислотного залишку в положенні Кебата 3 домену VL; k) заміну амінокислотного залишку в положенні Кебата 55 домену VH; l) заміну амінокислотного залишку в положенні Кебата 67 домену VH; m) заміну амінокислотного залишку в положенні Кебата 6 домену VH; n) заміну амінокислотного залишку в положенні Кебата 32 домену VH; o) заміну амінокислотного залишку в положенні Кебата 49 домену VH; p) заміну амінокислотного залишку в положенні Кебата 43 домену VH; q) заміну амінокислотного залишку в положенні Кебата 72 домену VH; r) заміну амінокислотного залишку в положенні Кебата 79 домену VH; s) заміну амінокислотного залишку в положенні Кебата 50 домену VL; t) заміну амінокислотного залишку в положенні Кебата 75 домену VL; u) заміну амінокислотного залишку в положенні Кебата 80 домену VH; v) заміну амінокислотного залишку в положенні Кебата 83 домену VH; або iii) VH домен і VL домен зі стабілізованим інтерфейсом між VH і VL молекули scFv, де отримана молекула включає, щонайменше, одну заміну в амінокислотній послідовності безпосередньо в інтерфейсі і/або амінокислотної послідовності, що забезпечує взаємодію між VH і VL, де, щонайменше, одне положення амінокислотного залишку обрано із групи, що складається з: 47H, 37H, 45H, 46H, 51H, 59H, 109H, 14H, 26H, 27H, 40H, 69H, 103H, 29H, 38H, 2 UA 101142 C2 5 10 15 20 25 30 35 40 45 50 55 60 44H, 49H, 55H, 63H, 54H, 68H, 72H, 74H, 79H, 82bH, 8H, 32H, 39H, 41H, 62H, 85H, 91H, 24H, 60H, 37L, 36L, 44L, 59L, 57L, 64L, 46L, 48L, 63L, 67L, 68L, 39L, 45L, 47L, 54L, 56L, 79L, 85L, 98L, 58L, 74L, 77L, 83L, 89L і 104L, відповідно до нумерації Кебата, і де T50 стабілізованої молекули scFv більше, ніж у молекули scFv без такої заміни. Відповідно до іншого аспекту, винахід відноситься до стабілізованої молекули scFv, що включає лінкер (Gly4 Ser)4 scFv між VH доменом і VL доменом, де домени VH і VL зв'язані дисульфідним містком між амінокислотним залишком домену VH і амінокислотним залишком домену VL. Відповідно до іншого аспекту, винахід відноситься до стабілізованої молекули scFv, що включає домени VH і VL, де молекула включає, щонайменше, одну заміну, обрану з наступної групи: а) заміну амінокислотного залишку в положенні Кебата 16 домену VH, наприклад, наприклад, на глутамат або глютамін, і заміну амінокислотного залишку в положенні Кебата 46 домену V L, наприклад, на лізин; b) заміну амінокислотного залишку в положенні Кебата 16 домену VH, наприклад, на глутамат або глютамін, заміну амінокислотного залишку в положенні Кебата 46 домену V L, наприклад, на лізин, і заміну амінокислотного залишку в положенні Кебата 55 домену V H, наприклад, на гліцин; а також с) заміну амінокислотного залишку в положенні Кебата 16 домену V H, наприклад, на глутамат або глютамін, заміну амінокислотного залишку в положенні Кебата 46 домену V L, наприклад, на лізин, заміну амінокислотного залишку в положенні Кебата 55 домену V H, наприклад, на гліцин, і заміну амінокислотного залишку в Положенні Кебата 101 домену V H, наприклад, на аспарагінову кислоту. Відповідно до іншого аспекту, стабілізована молекула scFv характеризується еквівалентом стабільності, що відповідає звичайному фрагменту Fab, в умовах термічного стрибка. Відповідно до одного аспекту, стабільність визначають, вимірюючи здатність зв'язуватися з молекулою-мішенню. Відповідно до одного аспекту, молекула scFv включає амінокислотну послідовність, закодовану нуклеотидною послідовністю, обраною із групи, що складається з SEQ ID NOs:9, 14, 16 і 18. Відповідно до одного аспекту, молекула scFv включає амінокислотну послідовність, обрану із групи, що складається з SEQ ID NOs:10, 15, 17 і 19. Відповідно до іншого аспекту, винахід відноситься до химерного білка, що включає стабілізовану молекулу scFv. Відповідно до одного аспекту, химерний білок включає, щонайменше, два сайти зв'язування антигену. Відповідно до іншого аспекту, винахід відноситься до популяції стабілізованих багатовалентних антиген-єднальних молекул, де стабілізовані єднальні молекули містять, щонайменше, одну стабілізовану молекулу scFv, що включає scFv-лінкер, розташований між доменами VH і VL, де домени VH і VL зв'язані дисульфідним містком між амінокислотою в домені VH і амінокислотою в домені VL, і де популяція стабілізованих єднальних молекул включає мономерні, розчинні білки, у яких в агрегованій формі присутнє не більше 10 %. Відповідно до одного аспекту, стабілізовані багатовалентні антиген-єднальні молекули експресуються в клітинах CHO або NS0. Відповідно до іншого аспекту, винахід відноситься до популяції стабілізованих багатовалентних антиген-єднальних молекул, де кожна багатовалентна антиген-єднальна молекула включає i) щонайменше, одну молекулу scFv, що включає лінкер scFv між доменами VH і VL, де домени VH і VL зв'язані дисульфідним містком між амінокислотою в домені V H і амінокислотою в домені VL, і де Tm доменів VH і VL, щонайменше, однієї молекули scFv перевищує 55ºC; або ii) щонайменше, одну молекулу scFv, що включає лінкер scFv між доменами VH і VL, де домени VH і VL зв'язані дисульфідним містком між амінокислотою в домені V H і амінокислотою в домені VL, і Tm, щонайменше, однієї молекули scFv багатовалентної антиген-єднальної молекули перевищує 49ºC. Відповідно до іншого аспекту, винахід відноситься до стабілізованої багатовалентної антиген-єднальній молекули, що включає: i) щонайменше, одну стабілізовану молекулу scFv, де стабілізована молекула scFv включає лінкер (Gly4 Ser)n scFv, розташований між доменами VH і VL, і де домени VH і VL зв'язані дисульфідним містком; ii) щонайменше, одну стабілізовану молекулу scFv, що включає лінкер scFv, у якого між 3 UA 101142 C2 5 10 15 20 25 30 35 40 45 50 55 60 доменами VH і VL розташована амінокислотна послідовність (Gly4 Ser)n, де домени VH і VL зв'язані дисульфідним містком між амінокислотним залишком 44 домену VH і амінокислотним залишком 100 домену VL; iii) щонайменше, одну стабілізовану молекулу scFv, де стабілізована молекула scFv включає, щонайменше, одну заміну, обрану з наступної групи: a) заміну амінокислотного залишку в положенні Кебата 13 домену VH; b) заміну амінокислотного залишку в положенні Кебата 16 домену VH; c) заміну амінокислотного залишку в положенні Кебата 46 домену VL; d) заміну амінокислотного залишку в положенні Кебата 49 домену VL; e) заміну амінокислотного залишку в положенні Кебата 50 домену VL; f) заміну амінокислотних залишків у положеннях Кебата 49 і 50 домену VL; g) заміну амінокислотного залишку в положенні Кебата 101 домену VH; h) заміну амінокислотного залишку в положенні Кебата 20 домену VH; i) заміну амінокислотного залишку в положенні Кебата 48 домену VH; j) заміну амінокислотного залишку в положенні Кебата 3 домену VL; k) заміну амінокислотного залишку в положенні Кебата 55 домену VH; l) заміну амінокислотного залишку в положенні Кебата 67 домену VH; m) заміну амінокислотного залишку в положенні Кебата 6 домену VH; n) заміну амінокислотного залишку в положенні Кебата 32 домену VH; o) заміну амінокислотного залишку в положенні Кебата 49 домену VH; p) заміну амінокислотного залишку в положенні Кебата 43 домену VH; q) заміну амінокислотного залишку в положенні Кебата 72 домену VH; r) заміну амінокислотного залишку в положенні Кебата 79 домену VH; s) заміну амінокислотного залишку в положенні Кебата 50 домену VL; t) заміну амінокислотного залишку в положенні Кебата 75 домену VL; u) заміну амінокислотного залишку в положенні Кебата 80 домену VH; v) заміну амінокислотного залишку в положенні Кебата 83 домену VH, а також iv) VH домен і VL домен зі стабілізованим інтерфейсом між VH і VL молекули scFv, де отримана молекула включає, щонайменше, одну заміну в амінокислотній послідовності безпосередньо в інтерфейсі і/або амінокислотної послідовності, що забезпечує взаємодію між VH і VL, де, щонайменше, одне положення амінокислотного залишку обрано із групи, що складається з: 47H, 37H, 45H, 46H, 51H, 59H, 109H, 14H, 26H, 27H, 40H, 69H, 103H, 29H, 38H, 44H, 49H, 55H, 63H, 54H, 68H, 72H, 74H, 79H, 82bH, 8H, 32H, 39H, 41H, 62H, 85H, 91H, 24H, 60H, 37L, 36L, 44L, 59L, 57L, 64L, 46L, 48L, 63L, 67L, 68L, 39L, 45L, 47L, 54L, 56L, 79L, 85L, 98L, 58L, 74L, 77L, 83L, 89L і 104L, відповідно до нумерації Кебата. Відповідно до іншого аспекту, винахід відноситься до стабілізованої багатовалентної антиген-єднальної молекули, що включає, щонайменше, одну стабілізовану молекулу scFv, що включає лінкер (Gly4 Ser)4 scFv між VH доменом і VL доменом, де домени VH і VL зв'язані дисульфідним містком між амінокислотним залишком домену VH і амінокислотним залишком домену VL. ii) Щонайменше, одну стабілізовану молекулу scFv, що включає лінкер scFv з амінокислотною послідовністю (Gly4 Ser)n, розташованою між VH доменом і VL доменом, де домени VH і VL зв'язані дисульфідним містком між амінокислотним залишком 44 домену V H і амінокислотним залишком 100 домену VL; а також iii) Щонайменше, одну стабілізовану молекулу scFv, де стабілізована молекула scFv включає, щонайменше, одну серію замін, обрану з наступної групи: а) заміну амінокислотного залишку (наприклад, глутаміну) у положенні Кебата 3 домену V L, наприклад, на аланін, серин, валін, аспарагінову кислоту або гліцин; b) заміну амінокислотного залишку (наприклад, серину) у положенні Кебата 46 домену V L, наприклад, на лейцин; с) заміну амінокислотного залишку (наприклад, серину) у положенні Кебата 49 домену V L, наприклад, на тирозин або серин; d) заміну амінокислотного залишку (наприклад, серину або валіну) у положенні Кебата 50 домену VL, наприклад, на серин, треонін, аргінін, аспарагінову кислоту, гліцин або лізин; е) заміну амінокислотного залишку (наприклад, серину) у положенні Кебата 49 і (наприклад, серину) у положенні Кебата 50 домену VL, відповідно, на тирозин і серин; на тирозин і треонін; на тирозин і аргінін; тирозин і гліцин; серин і аргінін; або серин і лізин; f) заміну амінокислотного залишку (наприклад, валіну) у положенні Кебата 75 домену VL, наприклад, на ізолейцин; g) заміну амінокислотного залишку (наприклад, проліну) у положенні Кебата 80 домену V L, 4 UA 101142 C2 5 10 15 20 25 30 35 40 45 50 55 60 наприклад, на серин або гліцин; h) заміну амінокислотного залишку (наприклад, фенілаланіну) у положенні Кебата 83 домену VL, наприклад, на серин, аланін, гліцин або треонін; i) заміну амінокислотного залишку (наприклад, глутамінової кислоти) у положенні Кебата 6 домену VH, наприклад, на глутамін; k) заміну амінокислотного залишку (наприклад, лізину) у положенні Кебата 13 домену VH, наприклад, на глутамат; l) заміну амінокислотного залишку (наприклад, серину) у положенні Кебата 16 домену V H, наприклад, на глутамат або глутамін; m) заміну амінокислотного залишку (наприклад, валіну) у положенні Кебата 20 домену V H, наприклад, на ізолейцин; n) заміну амінокислотного залишку (наприклад, аспарагіну) у положенні Кебата 32 домену VH, наприклад, на серин; o) заміну амінокислотного залишку (наприклад, глутаміну) у положенні Кебата 43 домену V H, наприклад, на лізин або аргінін; p) заміну амінокислотного залишку (наприклад, метіоніну) у положенні Кебата 48 домену V H, наприклад, на ізолейцин або гліцин; q) заміну амінокислотного залишку (наприклад, серину) у положенні Кебата 49 домену V H, наприклад, на гліцин або аланін; r) заміну амінокислотного залишку (наприклад, валіну) у положенні Кебата 55 домену V H, наприклад, на гліцин; s) заміну амінокислотного залишку (наприклад, валіну) у положенні Кебата 67 домену V H, наприклад, на ізолейцин або лейцин; t) заміну амінокислотного залишку (наприклад, глутамінової кислоти) у положенні Кебата 72 домену VH, наприклад, на аспартат або аспарагін; u) заміну амінокислотного залишку (наприклад, фенілаланіну) у положенні Кебата 79 домену VH, наприклад, на серин, валін або тирозин; а також v) заміну амінокислотного залишку (наприклад, проліну) у положенні Кебата 101 домену V H, наприклад, на аспарагінову кислоту Відповідно до іншого аспекту, винахід відноситься до багатовалентної антиген-єднальної молекули, що включає, щонайменше, одну стабілізовану молекулу scFv, де стабілізована молекула scFv включає, щонайменше, одну серію замін, обрану з наступної групи: а) заміну амінокислотного залишку в положенні Кебата 16 домену V H, наприклад, на глутамат або глутамін, і заміну амінокислотного залишку в положенні Кебата 46 домену VL, наприклад, на лізин; b) заміну амінокислотного залишку в положенні Кебата 16 домену V H, наприклад, на глутамат або глутамін, заміну амінокислотного залишку в положенні Кебата 46 домену V L, наприклад, на лізин; і заміну амінокислотного залишку в положенні Кебата 55 домену VH, наприклад, на гліцин; а також с) заміну амінокислотного залишку в положенні Кебата 16 домену V H, наприклад, на глутамат або глутамін, заміну амінокислотного залишку в положенні Кебата 46 домену V L, наприклад, на лізин; заміну амінокислотного залишку в положенні Кебата 55 домену VH, наприклад, на гліцин, і заміну амінокислотного залишку в положенні Кебата 101 домену V H, наприклад, на аспарагінову кислоту. Відповідно до одного аспекту, щонайменше, одна стабілізована молекула scFv генетично гібридизована з антитілом. Відповідно до іншого аспекту, дві стабілізовані молекули scFv генетично гібридизовані з антитілом. Відповідно до одного аспекту, щонайменше, одна стабілізована молекула scFv генетично гібридизована з карбокси-кінцем легкого або важкого ланцюга антитіла. Відповідно до одного аспекту, щонайменше, одна стабілізована молекула scFv генетично гібридизована з N-кінцем легкого або важкого ланцюга антитіла. Відповідно до одного аспекту, єднальна молекула винаходу включає, щонайменше, один сайт зв'язування, що зв'язується з молекулою, що краще експресується у ракових клітинах. Відповідно до одного аспекту, домен VH молекули scFv винаходу одержують із антитіла BHA10. Відповідно до одного аспекту, домен VL молекули scFv винаходу одержують із антитіла BHA10. Відповідно до одного аспекту, єднальна молекула винаходу включає, щонайменше, один сайт зв'язування, специфічний для молекули, обраної із групи HER1, HER3, CD80, CD86, PD-1, CTLA4, B7-H4, RON, CD200, CD4, BAF R, EGFR, IGFR, VEGFR, членів сімейства рецепторів 5 UA 101142 C2 5 10 15 20 25 30 35 40 45 50 55 60 TNF, рецептора Tie, MET, IGF1, IGF2, TNF, ліганда TNF, IL-6, TWEAK, Fn14, CD20, CD23, CRIPTO, HGF, альфа4бета1 інтегрину, альфа5бета1 інтегрину, альфа6бета4 інтегрину й альфа5бета6 інтегрину. Відповідно до одного аспекту, єднальна молекула винаходу включає, щонайменше, один сайт зв'язування, що зв'язується з молекулою, що приймає участь у модулюванні імунних відповідей. Відповідно до одного аспекту, молекула являє собою рецептор Fc. Відповідно до одного аспекту, єднальна молекула винаходу включає, щонайменше, один сайт зв'язування, що зв'язується з молекулою, що приймає участь у модулюванні ангіогенезу. Відповідно до одного аспекту, єднальна молекула винаходу зв'язується з VEGF або ангіопоетином. Відповідно до одного аспекту, єднальна молекула винаходу включає, щонайменше, один сайт зв'язування, що зв'язується з мішенню з області неврології. Відповідно до одного аспекту, єднальна молекула винаходу мультиспецифічна. Відповідно до одного аспекту, єднальна молекула винаходу біспецифічна. Відповідно до іншого аспекту, єднальна молекула винаходу зв'язується із двома членами сімейства рецепторів TNF. Відповідно до одного аспекту, єднальна молекула винаходу зв'язується з LTβR і Trail R2. Відповідно до одного аспекту, єднальна молекула винаходу включає молекулу BHA10 scFv, генетично гібридизовану з антитілом 14A2. Відповідно до одного аспекту, єднальна молекула винаходу включає важкий ланцюг, послідовність якого обрана із групи SEQ ID NO:33, SEQ ID NO:35, SEQ ID NO:37, SEQ ID NO:47, SEQ ID NO:49, SEQ ID NO:51, SEQ ID NO:53 і SEQ ID NO:55. Відповідно до одного аспекту, єднальна молекула винаходу включає нуклеотидну послідовність, що кодує поліпептид молекули по кожному з пунктів формули винаходу 4-8, 11, 12 і 18-22. Відповідно до одного аспекту, винахід відноситься до молекули нуклеїнової кислоти, що включає нуклеотидну послідовність, що кодує стабілізовану молекулу scFv, або до єднальної молекули, що включає стабілізовану молекулу scFv винаходу. Відповідно до одного аспекту, молекула нуклеїнової кислоти являє собою вектор. Відповідно до іншого аспекту, винахід відноситься до клітини-хазяїна, що включає такий вектор. Відповідно до одного аспекту, клітина-хазяїн являє собою клітину ссавця, наприклад, клітину CHO або NS0. Відповідно до одного аспекту, винахід відноситься до популяції єднальних молекул, що включають молекули scFv, причому ця популяція включає, щонайменше, на 10 % менше агрегатів, у порівнянні із клітинами-хазяївами, що експресують популяцію єднальних молекул, які містять звичайні молекули scFv. Відповідно до одного аспекту, винахід відноситься до способу одержання стабілізованої єднальної молекули, що включає вирощування клітини-хазяїна в таких умовах, щоб вона виробляла єднальні молекули. Відповідно до одного аспекту, щонайменше, 10 мг стабілізованої єднальної молекули виробляється на кожний літр культурального середовища, що включає клітини-хазяїни, і при цьому в такому середовищі не більше 10 % єднальних молекул присутні в агрегованій формі. Відповідно до одного аспекту, винахід відноситься до способу лікування суб'єкта, якому може принести користь лікування єднальною молекулою винаходу, що включає введення єднальної молекули суб'єктові, так що лікування може здійснитися. Відповідно до одного аспекту, суб'єкт страждає від захворювання або розладу, обраного із групи, що складається з раку, аутоімунного захворювання або розладу і неврологічного захворювання або розладу. Відповідно до одного аспекту, винахід відноситься до способу стабілізації молекули scFv, що включає генетичну гібридизацію VH домену й VL домену з використанням лінкера (Gly4 Ser)n scFv і конструювання домену VH так, щоб він містив цистеїн у положенні 44 амінокислотної послідовності, а також конструювання домену VL так, щоб він містив цистеїн у положенні 100 амінокислотної послідовності з одержанням стабілізованої молекули scFv. Відповідно до одного аспекту, винахід відноситься до способу виготовлення стабілізованого багатовалентного антитіла, що включає стабілізовану молекулу scFv, причому спосіб включає генетичну гібридизацію стабілізованої молекули scFv з N-кінцем або С-кінцем легкого або важкого ланцюга молекули антитіла. Відповідно до одного аспекту, винахід відноситься до способу виготовлення стабілізованої молекули scFv, що включає заміщення, щонайменше, одного амінокислотного залишку інтерфейсу VH/VL молекули scFv і/або, щонайменше, одного амінокислотного залишку каркаса VH/VL молекули scFv, що поліпшує термічну стабільність доменів V H і VL молекули scFv, у 6 UA 101142 C2 5 10 15 20 25 30 35 40 45 50 55 60 порівнянні зі звичайною молекулою scFv. Відповідно до ще одного аспекту, винахід відноситься до способу виготовлення стабілізованої молекули scFv, що включає заміщення, щонайменше, одного амінокислотного залишку VH домену або VL домену, що коваріюється із двома або більше амінокислотними залишками інтерфейсу між доменами VH і VL. Відповідно до ще одного аспекту, винахід відноситься до способу виготовлення стабілізованого химерного білка, що включає молекулу scFv; цей спосіб включає заміщення, щонайменше, одного амінокислотного залишку інтерфейсу VH/VL молекули scFv і/або, щонайменше, одного амінокислотного залишку каркаса VH/VL молекули scFv, а також генетичну гібридизацію молекули scFv з поліпептидом з одержанням стабілізованого химерного білка. Відповідно до ще одного аспекту, винахід відноситься до способу підвищення стабільності багатовалентної молекули, що включає, щонайменше, одну молекулу scFv, причому спосіб включає введення, щонайменше, однієї стабілізуючої мутації, щонайменше, в одну молекулу scFv, що й приводить до підвищення стабільності багатовалентної молекули. Відповідно до ще одного аспекту, винахід відноситься до способу підвищення стабільності молекули scFv, що включає введення, щонайменше, однієї стабілізуючої мутації в молекулу scFv, що й приводить до підвищення стабільності молекули scFv. Відповідно до ще одного аспекту, винахід відноситься до способу великомасштабного виготовлення стабілізованих химерних білків, що включає: (а) проведення тесту термічної стабільності молекули scFv з метою визначити її термічну стабільність; (b) порівняння термічної стабільності передбачуваної молекули scFv з підходящим контролем з метою ідентифікувати стабілізовану молекулу scFv, термічна стабільність якої підвищена, у порівнянні з контролем; (с) відбір стабілізованих молекул scFv, знайдених на етапі (b); (d) генетичну гібридизацію, щонайменше, однієї стабілізованої молекули scFv з білком з одержанням стабілізованого химерного білка; (е) трансфіціювання клітини-хазяїна зі ссавця молекулою нуклеїнової кислоти, що кодує стабілізований химерний білок; (g) культурування хазяйської клітини, отриманої на етапі (f), в умовах, за яких експресується стабілізований химерний білок, де стабілізований химерний білок експресується з не більш ніж 10 % агрегацією при вирощуванні в 10 л або більше культурального середовища. Відповідно до ще одного аспекту, винахід відноситься до способу визначення термічної стабільності укладання (фолдинг, fold) білка з поліпептидного надсімейства імуноглобулінів (Ig), що включає кандидатури амінокислотних послідовностей, цей спосіб включає наступні етапи: (а) вирівнювання відповідного референсного набору послідовностей, що відповідають укладанню Ig поліпептиду; (b) розрахунок коваріації між амінокислотними залишками послідовностей вирівнювання з даними коваріації; (с) визначення рахунку коваріації, специфічного для положення в послідовності-кандидаті, на підставі даних коваріації; а також (d) збереження або висновок специфічного для положення амінокислоти рахунку коваріації послідовності як міри стабільності поліпептиду. Відповідно до одного аспекту, спосіб включає повтори, щонайменше, етапів c) і d) для безлічі поліпептидів надсімейства імуноглобулінів (Ig). Відповідно до ще одного аспекту, спосіб додатково включає етап вибору з безлічі представників поліпептидів надсімейства імуноглобулінів (Ig) поліпептиду для виготовлення, на підставі специфічного для положення в послідовності рахунку коваріації послідовності-кандидата. Відповідно до іншого аспекту, спосіб також включає етап одержання відібраного поліпептиду надсімейства Ig і його готування для терапевтичного використання. Відповідно до іншого аспекту, поліпептид надсімейства Ig одержують із білка, обраного із групи, що включає імуноглобулін або його антиген-єднальний фрагмент, рецептор імуноглобуліну, білок клітинної адгезії, інтегрин, алерген, рецептор Т-клітин, а також головний комплекс гістосумісності (major hist compatibility complex (MHC)). Відповідно до одного аспекту, поліпептид надсімейства Ig обраний із групи, що складається з варіабельного регіону важкого ланцюга (VH), варіабельного регіону легкого ланцюга (VL), а також одноланцюгового антитіла (scFv). Відповідно до іншого аспекту, укладання Ig обране із групи, що складається з укладання Vкласу, укладання I-класу, укладання С1-класу та укладання С2-класу. 7 UA 101142 C2 5 10 15 20 25 30 35 40 45 50 55 60 Відповідно до одного аспекту, розмаїтість досліджуваного набору порівняння або вирівнювання не менше 50 %. Відповідно до одного аспекту, кожна послідовність у вирівнюванні характеризується менше, ніж 90 % ідентичністю з кожною іншою послідовністю у вирівнюванні. Відповідно до іншого аспекту, щонайменше, одна послідовність береться зі ссавців і, щонайменше, одна послідовність береться не зі ссавців. Відповідно до одного аспекту, залишкам у послідовності-кандидаті призначається позитивний специфічний для послідовності рахунок коваріації для задоволення позитивним коваріаціям, що включається у відповідних положеннях у вирівнюванні. Відповідно до одного аспекту, залишкам у послідовності-кандидаті призначається негативний специфічний для послідовності рахунок коваріації для задоволення негативним коваріаціям, що включаються у відповідних положеннях у вирівнюванні. Відповідно до одного аспекту, позитивна коваріація характеризується коефіцієнтом асоціації фі (Ф), приблизно, від +0,25 до +1,0. Відповідно до одного аспекту, негативна коваріація характеризується коефіцієнтом асоціації фі (Ф), приблизно, від -0,25 до -1,0. Відповідно до одного аспекту, вирівнювання обране із групи, що складається із заснованого на структурі вирівнювання послідовності, заснованого на послідовності вирівнювання послідовності, а також заснованого на структурі структурного вирівнювання. Відповідно до одного аспекту, специфічний для положення рахунок коваріації визначають для всіх можливих пар залишків для кожного положення залишку у вирівнюванні. Відповідно до одного аспекту, вирівнювання одержують шляхом (i) генерації моделі Hidden Markov Model (HMM) з початкового вирівнювання; (ii) запиту додаткових послідовностей з HMM; і (iii) вирівнювання додаткових послідовностей з початковим вирівнюванням. Відповідно до одного аспекту, винахід відноситься до комп'ютерної програми або комп'ютерного програмнгої продукту, а також до призначеного для читання на комп'ютері носія, що включає набір інструкцій, які виконуються процесором, слідуючи яким комп'ютер і здійснює спосіб винаходу. Відповідно до ще одного аспекту, винахід відноситься до комп'ютерної програми або комп'ютерному програмному продукту, а також до призначеного для читання на комп'ютері носія, що підходить для використання в електронних пристроях, що включає дані, необхідні для вирівнювання за способом винаходу. Відповідно до ще одного аспекту, винахід відноситься до комп'ютерної програми або комп'ютерному програмному продукту, а також до призначеного для читання на комп'ютері носія, що підходить для використання в електронних пристроях, що включають дані коваріації, способу винаходу. Відповідно до одного аспекту, винахід відноситься до пристрою, призначеного для виконання способу винаходу. Відповідно до одного аспекту, винахід відноситься до системи в комп'ютерному пристрої, що включає: (i) початковий процес збору послідовності; (ii) місце зберігання, здатне зберігати інформацію про послідовності з вирівнювання, відповідно до кожного з пунктів 58-74; (iii) засоби аналізу, які програмно аналізують коваріацію між парами залишків у вирівнюванні з метою одержання даних коваріації; (iv) пристрій виводу, пов'язаний із зазначеним електронним пристроєм, на який будуть виводитися зазначені дані коваріації. Відповідно до одного аспекту, винахід відноситься до носія в комп'ютерному пристрої, що включає інструкції, які виконуються, необхідні для виконання будь-якого етапу способу винаходу. Відповідно до ще одного аспекту, дані по частоті використання залишків становлять матрицю, що включає (i) безперервні фрагменти з амінокислотних залишків, що відповідають поліпептидній послідовності; і (ii) частоти використання залишків для залишків кожного типу й кожного їх положення. Відповідно до ще одного аспекту, частоту використання залишків відображають символічно. Відповідно до одного аспекту, представлені всі 20 амінокислот, пробіли й неясні залишки. Відповідно до одного аспекту, частота використання залишків корелює з розміром символу. Відповідно до одного аспекту, частота використання залишків позитивно корелює з розміром символу. Відповідно до одного аспекту, (i) положення залишків відображаються в стовпцях; і (ii) 8 UA 101142 C2 5 10 15 20 25 30 35 40 45 50 55 60 частоти використання залишків розташовуються в рядках. Відповідно до іншого аспекту, коваріацію між коваріантними залишками відображають у вигляді мережі накладень. Відповідно до одного аспекту, винахід відноситься до графічного користувальницького інтерфейсу, за допомогою якого графічно відображається: (i) графічна сітка, що включає сукупність даних про частоту використання залишків для набору послідовностей поліпептидів порівняння; і (ii) накладення коваріації. Відповідно до одного аспекту, інтерфейс також включає: (iii) відображення послідовності, що цікавить. Відповідно до одного аспекту, винахід відноситься до способу виготовлення поліпептиду надсімейства імуноглобулінів (Ig) з поліпшеною біофізичною властивістю, причому цей спосіб включає етапи: (а) створення вирівнювання набору послідовностей порівняння, що відповідають Igукладанню поліпептиду; (b) розрахунок коваріації між залишками послідовностей вирівнювання з метою ідентифікуватизалишки, що коваріюються; (с) заміщення залишків поліпептиду, які не задовольняють коваріації залишком, що коваріюється, з відповідного положення вирівнювання. Відповідно до іншого аспекту, біофізична властивість обрана із групи, що складається з термічної стабільності, профілю розгортання під дією рН, стабільному усуненню глікозилювання, розчинності, біохімічної функції і їх комбінаціям. Відповідно до одного аспекту, біохімічна функція обрана із групи, що складається з розпізнавання білкової мішені або хімічного об'єкту, причому хімічний об'єкт обраний із групи, що складається з фосфату, метилу, ацетилу, ліпіду, детергенту, іону металу, галогену, РНК, ДНК, олігонуклеотиду й олігонуклеозиду. Відповідно до одного аспекту, поліпептид надсімейства Ig одержують із білка, обраного із групи, що складається з антитіла або його антиген-єднального фрагмента, імуноглобулінового рецептора, білка клітинної адгезії, інтегрину, алергену, рецептора Т-клітин і молекули великого комплексу гістосумісності (MHC). Відповідно до одного аспекту, поліпептид надсімейства Ig вибирають із групи, що складається з варіабельного регіону важкого ланцюга (VH), варіабельного регіону легкого ланцюга (VL), а також одноланцюгового антитіла (scFv). Відповідно до одного аспекту, укладання Ig обране із групи, що складається з укладання Vкласу, укладання I-класу, укладання С1-класу й укладання С2-класу. Відповідно до іншого аспекту, поліпептид надсімейства Ig являє собою модифіковане антитіло, обране із групи, що складається з антитіла домену, гуманізованого антитіла, людського антитіла, не-людського моноклонального антитіла, химерного антитіла, біспецифічного антитіла, scFv-включаючого антитіла і антитіла з вилученим доменом. Відповідно до одного аспекту, коваріюючі залишки входять до складу структурного елемента, обраного із групи, що складається з дисульфідного містка, сольового містка, фрагмента ліганд-єднальної кишені або поверхні, а також мережі Ван-Дер-Ваальса, водневого містка і/або взаємодій заряд-заряд. Відповідно до іншого аспекту, винахід відноситься до способу одержання антитіла або модифікованого антитіла з поліпшеною стабільністю, причому зазначений спосіб включає наступні етапи: (а) створення структурної моделі шаблона антитіла високої роздільної здатності, стабільність якої підтверджується експериментально; (b) використання структурної моделі для ідентифікації інтерфейсу VH/VL і/або каркасних залишків інтерфейсу в шаблоні антитіла; (с) використання гомологічної моделі для ідентифікації відповідних залишків інтерфейсу VH/VL антитіла або модифікованого антитіла, які важливі для стабілізації інтерфейсу; а також (d) заміщення відповідних залишків інтерфейсу VH/VL антитіла або модифікованого антитіла на залишки інтерфейсу білка шаблона. Відповідно до одного аспекту, залишок інтерфейсу білка шаблона становить, щонайменше, 2 10 Å площі поверхні інтерфейсу. Відповідно до одного аспекту, модифіковане антитіло обране із групи, що складається з домену антитіла, гуманізованого антитіла, людського антитіла, не-людського моноклонального антитіла, химерного антитіла, біспецифічного антитіла, scFv-включаючого антитіла, химерного антитіла, а також антитіла з вилученим доменом. 9 UA 101142 C2 5 10 15 20 25 30 35 40 45 50 55 60 Відповідно до іншого аспекту, винахід відноситься до поліпептидів, отриманих способом винаходу. Відповідно до одного аспекту, поліпептид демонструє поліпшення біофізичної властивості, обраної із групи, що складається з термічної стабільності, профілю розгортання під дією рН, стабільному усуненню глікозилювання, розчинності, біохімічній функції і їх комбінаціям. Відповідно до одного аспекту, біохімічна функція являє собою спорідненість до ліганду або специфічність. Відповідно до іншого аспекту, винахід відноситься до способу створення бібліотеки, що включає стабілізовану молекулу scFv, причому такий спосіб включає: (а) створення набору послідовностей порівняння, що відповідають послідовності варіабельного домену молекули scFv; (b) ідентифікація амінокислоти усередині варіабельного домену, що зустрічається там з низькою частотою або відсутньої в наборі порівняння; а також (с) комбінування цієї інформації з даними коваріації, припускаючи, що модифікація амінокислоти, ідентифікованої в наборі порівняння з малою частотою, може задовольнити існуючим обмеженням коваріації усередині варіабельного домену; а також (d) заміщення амінокислоти етапу (b) стабілізованою амінокислотою-кандидатом з метою створення бібліотеки, що включаєстабілізовану молекулу scFvs. Відповідно до одного аспекту, амінокислота етапу (b) характеризується консенсусним рахунком менше 0,5. Відповідно до іншого аспекту, амінокислота етапу (b) присутня у менш ніж 10 % послідовностей набору порівняння. Відповідно до іншого аспекту, амінокислота етапу (b) являє собою неконсенсусний залишок. Відповідно до одного аспекту, стабілізована амінокислота-кандидат перебуває у відповідному положенні в наборі порівняння. Відповідно до ще одного аспекту, стабілізована амінокислота-кандидат являє собою консенсусну амінокислоту. Відповідно до одного аспекту, стабілізовану амінокислоту-кандидата можна знайти шляхом аналізу 3-D структури варіабельного регіону послідовності. Відповідно до іншого аспекту, стабілізовану амінокислоту-кандидата ідентифікують розрахунком упаковки бічних ланцюгів. Відповідно до ще одного аспекту, винахід відноситься до способу виготовлення стабілізованої молекули scFv, що включає в себе: (а) створення бібліотеки scFv, спроектованої у відповідності зі способом за пунктом 56 формули винаходу; (b) скринінг бібліотеки scFv способом термічного стрибка з метою ідентифікувати молекуликандидати scFv, (с) порівняння термічної стабільності молекул-кандидатів scFv з бібліотеки scFv з підходящим контролем, у якому підвищення термічної стабільності молекули-кандидата scFv щодо контролю ідентифікує молекулу-кандидата scFv як стабілізовану молекулу scFv. Відповідно до іншого аспекту, винахід відноситься до стабілізованої молекули scFv, ідентифікованої за допомогою способу винаходу, або до химерного білка, що включає стабілізовану молекулу scFv винаходу. Відповідно до іншого аспекту, винахід відноситься до способу пророкування стабільності білка-кандидата, що включає амінокислотну послідовність, до складу якої входять послідовності доменів-кандидатів, причому спосіб включає: (а) створення набору порівняння амінокислотних послідовностей, що відповідають послідовності домену-кандидату білку-кандидату; (b) визначення частот залишків в індивідуальних положеннях амінокислот тестової послідовності домену з метою одержання консенсусного рахунку; а також (с) використання консенсусного рахунку для пророкування стабільності білка-кандидата, де консенсусний рахунок корелює зі стабільністю білка-кандидата. Відповідно до іншого аспекту, винахід відноситься до способу пророкування стабільності білка-кандидата, причому спосіб містить у собі: (а) створення набору послідовностей порівняння, що відповідають тестової послідовності домену білка-кандидата; (b) визначення частот залишків в індивідуальних положеннях амінокислот у тестовій послідовності домену з одержанням консенсусного рахунку; а також (с) використання консенсусного рахунку для пророкування стабільності білка-кандидата. де консенсусний рахунок корелює зі стабільністю білка-кандидата. Відповідно до іншого аспекту, винахід відноситься до способу пророкування стабільності 10 UA 101142 C2 5 10 15 20 25 30 35 40 45 50 55 білка-кандидата, причому спосіб містить у собі: (а) створення набору послідовностей порівняння, що відповідають тестової послідовності домену білка-кандидата; (b) визначення частот залишків у положеннях амінокислот у тестовій послідовності домену з одержанням консенсусного рахунку; (с) визначення частот залишків у відповідних положеннях амінокислот у послідовності набору порівняння з одержанням середнього консенсусного рахунку; (d) порівняння консенсусного рахунку із середнім консенсусним рахунком з одержанням рахунку послідовності; а також (е) використання консенсусного рахунку для пророкування стабільності білка-кандидата, де консенсусний рахунок безпосередньо корелює зі стабільністю білка-кандидата. Відповідно до ще одного аспекту, винахід відноситься до способу пророкування стабільності антитіла-кандидата або модифікованого антитіла-кандидата, причому спосіб містить у собі: (а) створення набору порівняння послідовностей VH домену, що відповідають тестової послідовності VH домену антитіла-кандидата або модифікованого антитіла; (b) визначення частот амінокислотних залишків у положеннях тестової послідовності VH домену з одержанням консенсусного рахунку; (с) визначення частот залишків у відповідних положеннях амінокислот у послідовності набору порівняння з одержанням середнього консенсусного рахунку; (d) порівняння консенсусного рахунку із середнім консенсусним рахунком з одержанням рахунку послідовності; а також (е) використання консенсусного рахунку для пророкування стабільності антитіла-кандидата або модифікованого антитіла, де консенсусний рахунок безпосередньо корелює зі стабільністю антитіла-кандидата або модифікованого антитіла. Відповідно до одного аспекту, набір порівняння включає послідовності білків з таким же типом укладання, що й у білка-кандидата. Відповідно до іншого аспекту, набір порівняння включає ортологічні послідовності. Відповідно до одного аспекту, набір порівняння включає людські послідовності, наприклад, послідовність VH людини, наприклад, того ж класу Кебата. Відповідно до одного аспекту, набір порівняння включає людські зародкові послідовності V H. Відповідно до одного аспекту, тестова послідовність домену являє собою фрагмент послідовності домену білка-кандидата. Відповідно до одного аспекту, консенсусний рахунок визначають для кожного положення в тестовій послідовності і на підставі цих даних одержують загальний консенсусний рахунок, причому загальний консенсусний рахунок корелює зі стабільністю білка. Відповідно до іншого аспекту, загальний консенсусний рахунок розраховують за наступною формулою: h (r ) score i i c i (r ) де: score - рахунок ci(r) відповідає консенсусній частоті амінокислотних залишків у положенні консенсусної послідовності; hi(r) рівняється частоті тестових амінокислотних залишків у положенні тестової послідовності; і i відповідає кількості амінокислотних положень у тестовій послідовності. Відповідно до одного аспекту, стабільність білка визначають, порівнюючи консенсусний рахунок білка-кандидата з консенсусним рахунком підходящого контролю. Відповідно до іншого аспекту, стабільність білка визначають, порівнюючи консенсусний рахунок білка-кандидата з ідеальним консенсусним рахунком білка-кандидата. Відповідно до ще одного аспекту, стабільність білка визначають, порівнюючи консенсусний рахунок білка-кандидата з підходящим контролем. Відповідно до ще одного аспекту, стабільність білка визначають, порівнюючи рахунок послідовності антитіла-кандидата або модифікованого антитіла з підходящим контролем. Відповідно до одного аспекту, білок являє собою мультидоменний білок, причому послідовність домену-мішені одержують із найменш стабільного домену мультидоменного білка. Відповідно до іншого аспекту, білок являє собою модифіковане антитіло, обране із групи, що складається з антитіла верблюда, гуманізованого антитіла, людського антитіла, не-людського моноклонального антитіла, химерного антитіла, біспецифічного антитіла, scFv-включаючого 11 UA 101142 C2 5 10 15 20 25 30 35 40 45 50 55 60 антитіла і антитіла без домену. Відповідно до іншого аспекту, винахід відноситься до способу відбору білків-кандидатів для експресії, що включає визначення стабільності білка-кандитата способом винаходу, де білоккандитат відбирається для експресії, якщо його консенсусний рахунок або рахунок послідовності пророкує високу стабільність. Відповідно до іншого аспекту, винахід відноситься до способу відбору білків-кандидатів для експресії, що включає визначення стабільності білка-кандитата способом винаходу, де білоккандитат відбирається для експресії, якщо його специфічний для положення в послідовності рахунок коваріації пророкує високу стабільність. Відповідно до іншого аспекту, винахід відноситься до способу відбору тестової послідовності варіабельного регіону акцепторного імуноглобуліну для використання при гуманізації антитіла донора, причому цей спосіб включає визначення стабільності послідовності-кандидата способом винаходу, де послідовність-кандидата відбирають, якщо його рахунок послідовності пророкує високу стабільність. Відповідно до ще одного аспекту, винахід відноситься до способу відбору тестової послідовності варіабельного регіону акцепторного імуноглобуліну для використання при гуманізації антитіла донора, причому цей спосіб включає визначення стабільності послідовності-кандидата способом винаходу, де послідовність-кандидата відбирають, якщо його специфічний для положення в послідовності рахунок коваріації пророкує високу стабільність. Відповідно до іншого аспекту, тестова послідовність являє собою людську зародкову послідовність. Короткий опис графічних матеріалів На Фігурі 1А показана послідовність ДНК (SEQ ID NO:3), що кодує звичайний конструкт BHA10 scFv, що включає лінкер (Gly4Ser) 3 (виділений напівжирним шрифтом). На фігурі 1В показана послідовність (SEQ ID NO:4), що кодує звичайний конструкт BHA10 scFv. На Фігурі 2 відбиті результати виміру способом диференціальної скануючої калориметрії (ДСК) очищених звичайних фрагментів Fab або scFv послідовності BHA10. На Фігурі 2А показані результати ДСК-аналізу, у якому порівнювали розгортання звичайних фрагментів Fab або scFv послідовності BHA10. На фігурі 2В показані результати ДСК-аналізу очищеного BHA10 scFv при швидкості сканування 1˚C/хв і 2˚C/хв. На Фігурі 3А показана послідовність ДНК (SEQ ID NO:9), що кодує стабілізований дисульфідом між VH44/VL100 BHA10 scFv конструкт, що включає лінкер (Gly4Ser) 3 (показаний напівжирним шрифтом). На фігурі 3В показана амінокислотна послідовність (SEQ ID NO:10) стабілізованого дисульфідом між VH44/VL100 BHA10 scFv конструкта. Цистеїнові залишки, що формують VH44/VL100 дисульфідний місток виділені напівжирним шрифтом і курсивом. На Фігурі 4А показана послідовність ДНК (SEQ ID NO:14), що кодує стабілізований BHA10 scFv конструкт, що включає лінкер (Gly4Ser)4 (показаний напівжирним шрифтом). На фігурі 4В показана амінокислотна послідовність (SEQ ID NO:15) (Gly4Ser)4 BHA10 scFv конструкти. Пояснення таке ж, як і для Фігури 4А. На Фігурі 5А показана послідовність ДНК (SEQ ID NO:16), що кодує BHA10 scFv конструкт, що включає лінкер (Gly4Ser)5 (показаний напівжирним шрифтом). На фігурі 5В показана амінокислотна послідовність (SEQ ID NO:17) (Gly4Ser)5 BHA10 scFv конструкти. Анотація така ж, що й для Фігури 5А. На Фігурі 6 відбиті результати аналізу ВестерН Блот (Western Blot), у якому порівнювались рівні експресії звичайного BHA10 scFv (смуга 1) і стабілізованої BHA10 молекули scFvs винаходу (смуги 2-4). Кожний зразок піддавався електрофорезу як у відновлюючих (ліва панель), так і в не- відновлюючих (права панель) умовах. На Фігурі 7А показана послідовність ДНК (SEQ ID NO:18), що кодує стабілізований дисульфідом між VH44/VL100 BHA10 scFv конструкт, що включає лінкер (Gly4Ser)4 (показаний напівжирним шрифтом). На фігурі 7В показана амінокислотна послідовність (SEQ ID NO:19) стабілізованого дисульфідом між VH44/VL100 і (Gly4Ser)4 BHA10 scFv конструкта. Цистеїнові залишки, що формують VH44/VL100 дисульфідний місток виділені напівжирним шрифтом і курсивом. Пояснення таке ж, як і для Фігури 7А. На Фігурі 8 відбиті результати аналізу температурного стрибка (термічного аналізу), у ході якого термічну стабільність стабілізованої BHA10 молекули scFvs винаходу порівняли із традиційною BHA10 молекулою scFv. У підписах до малюнка зазначена температура, при якій 50 % молекул scFv зберігають свою єднальну активність (T50). На Фігурі 9 відбиті результати аналізу способом диференціальної скануючої калориметрії (ДСК), виконаного зі звичайними BHA10 scFv і BHA10 VH44:VL100/(Gly4Ser)4 scFv. На Фігурі 10 показані результати зв'язування гідрофобного флуоресцентного барвника 1 12 UA 101142 C2 5 10 15 20 25 30 35 40 45 50 55 60 аніліно-8-нафталін сульфонату (1-anilino-8-naphthaline sulfonate (ANS)) зі звичайним BHA10 scFv, BHA10 (Gly4Ser)4 scFv і BHA10 VH44:VL100/(Gly4Ser)4 scFv. На Фігурі 11 відбиті результати аналізу частоти залишків доменів BHA10 VH і VL. На Фігурі 11А перераховані положення BHA10 VH з бібліотеки для скринінгу на підставі аналізу частоти залишків послідовностей варіабельного домену IgG. На Фігурі 11В перераховані положення BHA10 VL з бібліотеки для скринінгу на підставі аналізу частоти залишків послідовностей варіабельного домену IgG. На Фігурі 12 відбиті результати аналізу температурного стрибка (термічного аналізу), у ході досліджували вплив стабілізуючих мутацій BHA10 scFv на термічну стабільність і адитивність стабілізуючих мутацій (GS3 означає (G4S)3 і GS4 означає (G4S)4; SS означає сульфідний зв'язок). На Фігурі 13 показаний приклад стабілізованого LTβR/TRAIL-R2 біспецифічного антитіла (антитіла "Геркулес") винаходу. Антитіла Геркулес утворюють гібридизацією стабілізованої молекули BHA10 scFv винаходу з антитілом 14A2 IgG. Молекулу scFv можна гібридизувати із Сабо N-кінцем важкого ланцюга (С-Геркулес або NH-Геркулес) або з N-кінцем легкого ланцюга (NL-Геркулес). На Фігурі 14 схематично відображені послідовні ПЦР-реакції, що використовуються для гібридизації звичайних і сконструйованих BHA10 scFv з аміно-кінцем (Фігура 14А) або карбоксикінцем (Фігура 14В) важкого ланцюга 14A2. На Фігурі 15А показана послідовність ДНК (SEQ ID NO:28) химерного легкого ланцюга 14A2, що включає сигнальний пептид (підкреслене). На Фігурі 15А показана амінокислотна послідовність (SEQ ID NO:29) химерного легкого ланцюга 14A2. На Фігурі 16 показана послідовність ДНК (SEQ ID NO:30) важкого ланцюга звичайного BHA10 scFv NH-Геркулес. На Фігурі 17 показана амінокислотна послідовність (SEQ ID NO:31) важкого ланцюга звичайного BHA10 scFv NH-Геркулес. На Фігурі 18 показана послідовність ДНК (SEQ ID NO:32) важкого ланцюга BHA10 scFv (Gly4Ser)4 NH-Геркулес. На Фігурі 19 показана амінокислотна послідовність (SEQ ID NO:33) важкого ланцюга BHA10 scFv (Gly4Ser)4 NH-Геркулес. На Фігурі 20 показана послідовність ДНК (SEQ ID NO:34) важкого ланцюга BHA10 scFv VH44:VL100 N-Геркулес. На Фігурі 21 показана амінокислотна послідовність (SEQ ID NO:35) важкого ланцюга BHA10 scFv VH44:VL100 NH-Геркулес. На Фігурі 22 показана послідовність ДНК (SEQ ID NO:36) важкого ланцюга BHA10 scFv VH44:VL100/(Gly4Ser)4 NH-Геркулес. На Фігурі 23 показана амінокислотна послідовність (SEQ ID NO:37) важкого ланцюга BHA10 scFv VH44:VL100/(Gly4Ser)4 NH-Геркулес. На Фігурі 24 показана послідовність ДНК (SEQ ID NO:44) важкого ланцюга звичайної BHA10 scFv C-Геркулес. На Фігурі 25 показана амінокислотна послідовність (SEQ ID NO:45) важкого ланцюга звичайної BHA10 scFv C-Геркулес. На Фігурі 26 показана послідовність ДНК (SEQ ID NO:46) важкого ланцюга BHA10 scFv (Gly4Ser)4 C- Геркулес. На Фігурі 27 показана амінокислотна послідовність (SEQ ID NO:47) важкого ланцюга BHA10 scFv (Gly4Ser)4 C-Геркулес. На Фігурі 28 показана послідовність ДНК (SEQ ID NO:48) важкого ланцюга BHA10 scFv VH44:VL100 C-Геркулес. На Фігурі 29 показана амінокислотна послідовність (SEQ ID NO:49) важкого ланцюга BHA10 scFv VH44:VL100 C-Геркулес. На Фігурі 30 показана послідовність ДНК (SEQ ID NO:50) важкого ланцюга BHA10 scFv VH44:VL100/(Gly4Ser)4 C-Геркулес. На Фігурі 31 показана амінокислотна послідовність (SEQ ID NO:51) важкого ланцюга BHA10 scFv VH44:VL100/(Gly4Ser)4 C-Геркулес. На Фігурі 32 показані результати аналізу Вестерн Блот С- і NH- Геркулес біспецифічних антитіл, що короткочасно експресуються, у клітинах CHO. Ліва панель проаналізувала в невідновлювальних умовах, а права - у відновлювальних умовах. На Фігурі 33 показані результати аналізу ELISA, що оцінює активність зв'язування стабілізованих антитіл Геркулес даного винаходу з рецепторами TRAIL R2. На Фігурі 33А відбиті результати зі стабілізованими антитілами C-Геркулес. На Фігурі 33В показані результати зі 13 UA 101142 C2 5 10 15 20 25 30 35 40 45 50 55 60 стабілізованими антитілами N-Геркулес. Скорочення "wt" означає звичайне антитіло N H Геркулес. "GS4" означає стабілізоване антитіло NH Геркулес, що включає стабілізовану (Gly4Ser)4 scFv. "ds" відповідає стабілізованому антитілу N H Геркулес, що включає стабілізовану scFv з VH44/VL100 дисульфідним лінкером. На Фігурі 34 показані результати аналізу ELISA, що оцінює активність зв'язування стабілізованих антитіл Геркулес даного винаходу з рецепторами LTβR. На Фігурі 34А відбиті результати зі стабілізованими антитілами C-Геркулес. На Фігурі 34В показані результати зі стабілізованими антитілами NH-Геркулес. Скорочення "wt" означає звичайне антитіло NH Геркулес. "GS4" означає стабілізоване антитіло NH Геркулес, що включає стабілізовану (Gly4Ser)4 scFv. "ds" відповідає стабілізованому антитілу N H Геркулес, що включає стабілізовану scFv з VH44/VL100 дисульфідним лінкером. На Фігурі 35 показані результати SEC аналізу стабілізованих біспецифічних антитіл CГеркулес після хроматографії Білка А. На Фігурі 36 показані результати SDS-PAGE аналізу очищених стабілізованих біспецифічних антитіл Геркулес. На Фігурі 36А відображені результати для біспецифічних антитіл NHГеркулес. На Фігурі 36В відображені результати для біспецифічних антитіл C-Геркулес. У кожну смугу завантажували по 5 мкг зразка. На Фігурі 37 показані результати аналітичного SEC аналізу очищених стабілізованих біспецифічних антитіл N-Геркулес. Панель А відображає профіль N-Геркулес із VH44:VL100 BHA10 scFv після хроматографії Білка А, а панель В – після препаративного SEC. Панель С відображає профіль N-Геркулес із VH44:VL100/(G4S)4 BHA10 scFv після хроматографії Білка А, а панель D – після препаративного SEC. На Фігурі 38 показані результати аналітичного SEC аналізу очищених стабілізованих біспецифічних антитіл С-Геркулес. Панель А відображає профіль С-Геркулес із VH44:VL100 BHA10 scFv після хроматографії Білка А, а панель В – після препаративного SEC. Панель С відображає профіль С-Геркулес із VH44:VL100/(G4S)4 BHA10 scFv після хроматографії Білка А, а панель D – після препаративного SEC. На Фігурі 39 показані результати аналізу способом диференціальної скануючої калориметрії (ДСК), виконаного для C-Геркулес із VH44:VL100/(G4S)4 BHA10 scFv і C-Геркулес звичайним BHA10 scFv. На Фігурі 40 показані результати аналізу ELISA, що оцінює активність біспецифічного зв'язування стабілізованих антитіл Геркулес даного винаходу з рецепторами TRAIL-R2 і LTβR Ig. "N-"Геркулес" Cys і C-"Геркулес'Cys являють собою антитіла Геркулес, що включають N Hабо C-кінцеві scFv з дисульфідним зв'язком VH44/VL100. "N-"Геркулес'Cys і N-"Геркулес" DM" являють собою антитіла Геркулес, що включають NH- або C-кінцеві scFv з дисульфідним зв'язком VH44/VL100 і лінкером (Gly4Ser)4. Пентамер CBE11 являє собою контрольне антитіло з неспецифічною LTβR-єднальною активністю. На Фігурі 41 відображені ефекти стабілізованих N- і C-Геркулес біспецифічних антитіл на ріст клітин пухлин. На Фігурах 41A-41D показані ефекти на ріст пухлинних клітин WiDr, пухлинних клітин Me180, MDA231 і HUVEC, відповідно. Фігура 42 являє собою схематичну діаграму стабілізованих двохланцюжкових димерних мінітіл, що включають стабілізовані scFv. Приклад мінітіла включає перший ланцюжковий фрагмент, що включає стабілізований scFv зі специфічністю зв'язування до антигену TRAIL R2 і другий ланцюжковий фрагмент, що включає стабілізований scFv зі специфічністю зв'язування до антигену LTβR. Орієнтація доменів VH і VL в scFv може змінюватися, і відповідної специфічності зв'язування також можуть бути змінені. Фігура 43 являє собою схематичну діаграму стабілізованого біспецифічного двохланцюжкового димерного тетравалентного мінітіла (стабілізованого біспецифічного N-scFv тетравалентного мінітіла), що включає стабілізовані фрагменти scFv винаходу, з'єднані з амінокінцем. Приклад стабілізованого димерного тетравалентного мінітіла включає перший ланцюжковий фрагмент, що включає два стабілізованих scFvs зі специфічністю зв'язування до антигену TRAIL R2 і другий ланцюжковий фрагмент, що включає два стабілізованих scFvs зі специфічністю зв'язування до антигену LTβR. Можливі також і інші конфігурації, наприклад, можна так сконструювати біспецифічне тетравалентне мінітіло, що кожний такий фрагмент буде містити два стабілізованих фрагменти scFv з різними специфічностями. Відповідно до іншого аспекту, орієнтація доменів VH і VL в scFv можна змінити. Відповідно до іншого аспекту, стабілізовано менше всіх scFv. Фігура 44 являє собою схематичну діаграму прикладу стабілізованого біспецифічного двохланцюжкового димерного тетравалентного мінітіла (стабілізованого біспецифічного С-scFv тетравалентного мінітіла), що включає стабілізовані фрагменти scFv винаходу, з'єднані з обома 14 UA 101142 C2 5 10 15 20 25 30 35 40 45 50 55 60 карбоксильними кінцями бівалентного мінітіла. Приклад стабілізованого димерного тетравалентного мінітіла включає перший ланцюжковий фрагмент, що включає два стабілізованих scFvs зі специфічністю зв'язування до антигену TRAIL R2 і другий ланцюжковий фрагмент, що включає два стабілізованих scFvs зі специфічністю зв'язування до антигену LTβR. Можливі також і інші конфігурації, наприклад, можна так сконструювати біспецифічне двуланцюжкове димерне тетравалентне мінітіло, що кожний такий ланцюг буде містити два стабілізованих фрагменти scFv з різними специфічностями. Відповідно до іншого аспекту, орієнтацію доменів VH і VL в scFv можна змінити. Відповідно до іншого аспекту, scFv стабілізовано менше всіх. Фігура 45 являє собою схематичну діаграму стабілізованого біспецифічного чотирьохланцюжкового димерного диатіла, що включає стабілізовані scFv винаходу. Можливі також і інші конфігурації, наприклад, можна так сконструювати стабілізоване біспецифічне двуланцюжкове димерне тетравалентне мінітіло, що кожне таке плече буде містити стабілізовані фрагменти scFv з різними специфічностями. Орієнтацію доменів V H і VL можна змінити. Відповідно до іншого аспекту, стабілізовано менше всіх scFv. Фігура 46 являє собою схематичну діаграму стабілізованого біспецифічного чотирьохланцюжкового димерного тетравалентного scFv антитіла (стабілізованого C-scFv тетравалентного антитіла), що включає стабілізовані scFv, з'єднані з карбоксильним кінцем CH3 і пептидом, приєднаним до шарніру. Орієнтацію доменів VH і VL у стабілізованому scFv можна змінити. Альтернативно, стабілізовані scFv фрагменти можна приєднувати до аміно-кінця або важкого, або легкого ланцюга з утворенням NH-scFv тетравалентних антитіл або NL-scFv тетравалентних антитіл, відповідно. Фігура 47 являє собою схематичну діаграму стабілізованого чотирьохланцюжкового тетравалентного біспецифічного антитіла scFv без домену CH2 (стабілізованого C-scFv тетравалентного біспецифічного антитіла без домену CH2), що включає стабілізоване антитіло scFv, приєднане до карбоксильнго кінця CH3 і пептидом, приєднаним до шарніру. Кожна ділянка важкого ланцюжка біспецифічного антитіла включає регіон Fv зі специфічністю зв'язування до антигену TRAIL R2 і стабілізований регіон scFv зі специфічністю зв'язування до антигену LTβR. Орієнтацію VH і VL доменів у стабілізованому scFv можна змінювати й міняти відповідні антигенєднальної специфічності. Відповідно до іншого аспекту, стабілізовано менше всіх scFv. Фігура 48 являє собою схематичну діаграму стабілізованого чотирьохланцюжкового тетравалентного біспецифічного антитіла scFv без домену CH2 (стабілізованого N H-scFv тетравалентного біспецифічного антитіла без домену CH2), що включає стабілізоване антитіло scFv, яке включає пептид і приєднане до аміно кінця V H, приєднаний до шарніру. Кожна ділянка важкого ланцюга біспецифічного антитіла включає регіон Fv зі специфічністю зв'язування до антигену TRAIL R2 і стабілізований регіон scFv зі специфічністю зв'язування до антигену LTβR. Орієнтацію VH і VL доменів у стабілізованому scFv можна змінювати й міняти відповідні антигенєднальні специфічності. Відповідно до іншого аспекту, стабілізовано менше всіх scFv. Фігура 49 являє собою схематичну діаграму стабілізованого чотирьохланцюжкового тетравалентного біспецифічного антитіла scFv без домену CH2 (стабілізованого NL-scFv тетравалентного біспецифічного антитіла без домену CH2), що включає стабілізоване антитіло scFv, яке включає пептид і приєднане до аміно кінця VL, приєднаний до шарніру. Кожна ділянка важкого ланцюжка біспецифічного антитіла включає регіон Fv зі специфічністю зв'язування до антигену TRAIL R2 і стабілізований регіон scFv зі специфічністю зв'язування до антигену LTβR. Орієнтацію VH і VL доменів у стабілізованому scFv можна змінювати й міняти відповідні антигенєднальні специфічності. Відповідно до іншого аспекту, стабілізовано менше всіх scFv. На Фігурі 50 зображені криві T50 BHA10 scFv дикого типу (зафарбовані кружки) у порівнянні зі стабілізуючими мутаціями BHA10 scFV, що включають VL_S46L (Фігура 15А, порожні кружки), VH_V55G (Фігура 15В, порожні кружки) і VH P101D (Фігура 15С, порожні кружки). На Фігурі 51 зображені криві ДСК VH-(GS)4-VL-6His BHA10 scFv дикого типу (сіра лінія) у порівнянні з BH10 scFv, що включають стабілізуючі мутації VL S46L (чорна лінія) (Фігура 51A) і VH V55G (чорна лінія) (Фігура 51B). На Фігурі 52 зображені криві ДСК VH-(GS)4-VL-6His BHA10 scFv дикого типу (сіра лінія) у порівнянні з BH10 scFv, що включають стабілізуючу мутацію VH_P101D (чорна лінія). На Фігурі 53 зображений аналіз SDS-PAGE scFv дикого типу ("WT (G4S)X3") і стабілізованого мутантного scFv. Всі мутантні scFv містять з'єднуючий пептид типу Gly-Ser і формули (Gly4 Ser)4 між N-кінцем VH і C-кінцем VL ("(G4S)X4"). Показано ідентичність scFv у кожній смузі. Смуги 12-14 містять BHA10 scFv з дисульфідним містком між VH44 і VL110. (G4S)X4/дисульфід стабілізуючі scFv позначені як 'DM', що означає 'double mutant' (подвійний мутант). Дві останні смуги включають задані мутації, які також є стабілізуючими для зв'язаних 15 UA 101142 C2 5 10 15 20 25 30 35 40 45 50 55 60 через дисульфіди scFv. На Фігурі 54А зображені криві ДСК BHA10 scFv дикого типу scFv ("VH-(GS)4-VL-6His") (пунктирна лінія), VH S16E мутантне scFv (тонка сіра лінія), VL S46L мутантне scFv (тонка чорна лінія), VH V55G мутантне scFv (товста сіра лінія), а також VH P101D мутантне scFv (товста чорна лінія). На Фігурі 54В показана залежна від температури флуоресценція 10 mM ANS в PBS (порожні кружки) або в присутності BHA10 scFv дикого типу ("VH-(GS)4-VL-6His") (зафарбовані сірі кружки), VH S16E мутантних scFv (ромбики), VL S46L мутантних scFv (квадратики), VH V55G мутантних scFv (зворотні трикутники), а також VH P101D мутантних scFv (трикутники). Проведені через криві лінії побудовані на підставі моделі розгортання із двома станами. На Фігурі 55 показана флуоресценція ANS при 15 ºC у присутності scFvs дикого типу й мутантних. Індукована кожним scFv флуоресценція ANS нанесена на графік проти TM домену VH того ж scFv, як визначено способом ДСК (Фігура 55А) і температуро-залежним збільшенням флуоресценції ANS, викликаним розгортанням кожної scFv (Фігура 55В). На Фігурі 56 представлені дані гель-хроматографії (size-exclusion chromatography (SEC)) високих концентрацій стабілізованого N-Геркулес (XWU028; BHA10 scFv VH44:VL100/(Gly4Ser)4 N-Геркулес; Фігура 56A), стабілізованого C-Геркулес (XWU036; (BHA10 scFv VH44:VL100/(Gly4Ser)4 C-Геркулес; Фігура 56B), а також антитіл BHA10 дикого типу (Фігура 56С) у шести тимчасових крапках (T=0, T=1 тиждень, T=2 тижня, T=1 місяць, T=2 місяці й T=3 місяці) і низьких температурах (2-8 °C). По осі Х відкладений час (хвилини), по осі y-mAU (одиниці поглинання) при 280 нм. За час експерименту значних змін у профілі елюювання відзначено не було. На Фігурі 57 представлені дані аналізу SDS-PAGE для XWU028 і XWU036 до зберігання і через 3 місяці після їх передачі на зберігання при 2-8 ºC. Панель А. Раніше відновлені зразки минулого окиснені до первісного стану (позначені як "NR"). Передбачувана молекулярна маса, MW, ~200 кДа, спостерігалася для біспецифічних зразків. BHA10 показав свою очікувану MW ~150 кДа. Смуги 1-4 відповідають зразкам XWU028. Смуги 5-8 відповідають зразкам XWU036. Смуги 9-10 відповідають зразкам BHA10 IgG. Панель В. Зразки відновили DTT (позначені як "Red", відновлені). Передбачувана молекулярна маса для важкого ланцюга становить ~75 кДа, а для легкого ланцюга ~25 кДа, вони спостерігалися для біспецифічних зразків у відновлювальних умовах. Важкі й легкі ланцюги BHA10 показали свої очікувані MW 50 кДа й 25 кДа, відповідно, у відновлювальних умовах. Панелі 1, 2, 6 і 7 відповідають зразкам XWU028. Панелі 3, 4, 8 і 9 відповідають зразкам XWU036. Панелі 5 і 10 відповідають зразкам BHA10 IgG. На Фігурі 58 показані дані інтактного мас-аналізу для XWU028 (Панель А) і XWU036 (Панель В) при Т=0, Т=1 місяць і Т=3 місяці. Для кожного білка спостерігалося кілька піків через високий рівень сиаліювання N-зв'язаних вуглеводів в CH2. Розподіл вуглеводів біспецифічних антитіл типово для стандартних білків IgG1. На Фігурі 59 відображені результати сендвіч-аналізу ELISA, у якому вимірялося біспецифічне зв'язування зразків сироватки, що включає N- термінальний Геркулес (XWU028; Фігура 56A) або C- термінальний Геркулес (XWU036; Фігура 56B), з рецепторами TRAIL-R2 і LTβR. Фігура 60 відбиває результати експерименту по оцінці відносної активності in vivo стабілізованих біспецифічних антитіл (XWU028 (ромбики) і XWU036 (порожні квадратики)), нестабілізованих біспецифічних антитіл (hCBE11 (зафарбовані трикутники)) і моноспецифічних антитіл, що вводилися окремо (hBHA10 (звернені трикутники) і ch14A2 (ромбики)) і спільно (порожні трикутники) проти мишачої моделі ксенотрансплантанту. Введення почалися на день 13. hCBE11 v. VC: P
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for antibody designing
Автори англійськоюDimarest Steven, Glaizer Scott, Miller Brian Robert, Wu Ksiufeng, Snider William B., Wang Norman, Krone Liza J., Lugovskoi Alieksiei Alieksandrovich
Назва патенту російськоюСпособ разработки антитела
Автори російськоюДимарест Стивен, Глейзер Скотт, Миллер Брайан Роберт, Ву Ксиуфенг, Снайдер Уильям Б., Ванг Норман, Кроне Лайза Дж., Луговской Алексей Александрович
МПК / Мітки
МПК: C12N 15/13
Мітки: розробки, спосіб, антитіла
Код посилання
<a href="https://ua.patents.su/289-101142-sposib-rozrobki-antitila.html" target="_blank" rel="follow" title="База патентів України">Спосіб розробки антитіла</a>
Попередній патент: Спосіб покращення фармакокінетики інгібіторів інтегрази віл
Наступний патент: Пристрій (варіанти) та спосіб (варіанти) обробки даних
Випадковий патент: Вільнопоршневий двигун внутрішнього згоряння