Склад, що має протипухлинну активність
Номер патенту: 3779
Опубліковано: 27.12.1994
Автори: Гирін Віталій Миколайович, Бударін Лев Іванович, Майданевич Надія Миколаївна, Шалімов Сергій Олександрович, Кейсевич Людвіг Владіславович, Трохименко Олена Петрівна, Самодумова Іннеса Михайлівна, Волченскова Іліма Іліодорівна
Формула / Реферат
Состав, обладающий противоопухолевой активностью, включающий цис-дихлородиамин-платину, хлорид натрия и добавку, отличающийся тем, что в качестве добавки содержит полиметилсилоксан при следующем соотношении компонентов, мас. %:
цис-дихлородиамин-платина
1,80-4,40
хлорид натрия
8,10-20,00
полиметилсилоксан
остальное
Текст
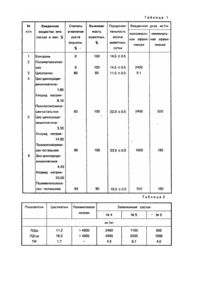
Изобретение относится к составам химических веществ, обладающи х биологической активностью, в частности, противоопухолевой, и может быть использовано для разработки лекарственного препарата для химиотерапии злокачественных опухолей. Известен целый ряд противоопухолевых составов, содержащих платину, представляющих собой химические соединения, а именно, синтетические низкомолекулярные аналоги цис-дихлородиаминплатины [1], которые обладают противоопухолевым действием. Однако они обладают недостаточным уровнем противоопухолевой активности и проявляют выраженную гематотоксичность. Известно применяемое в клинике для лечения онкологических больных вещество, представляющее собой лекарственный препарат цисплатин [2], который содержит в качестве активного неорганического ингредиента синтетическое низкомолекулярное комплексное соединение платины - цис-дихлородиаминплатину, в качестве стабилизатора - хлорид натрия и соляную кислоту, в качестве добавки - маннит и воду. Состав известного противоопухолевого ве щества цисплатина следующий, мас. %: цис-дихлородиамин платина 0,01-0,10 хлорид натрия 0,18-2,00 соляная кислота до рН 2,0-3,0 маннит 0,20-15,00 вода для инъекций остальное Цисплатин проявляет широкий спектр противоопухолевого действия и характеризуется высоким уровнем противоопухолевой активности. Недостатком цисплатина является его высокая токсичность, в частности, почечная, ограничивающая терапевтическую дозу препарата. Кроме того, недостатком цисплатина является его выраженный иммунодепрессивный эффект. По уровню противоопухолевого действиям по составу цисплатин является наиболее близким к заявляемому. Задачей данного изобретения является разработка состава с противоопухолевой активностью, который, за счет введения новых компонентов, обладает повышенной противоопухолевой активностью, низкой токсичностью, а также устраняет иммунодепрессивный эффект. Поставленная задача решается тем, что в известном составе на основе цис-дихлоро-диаминплатины. хлорида натрия и добавок, согласно изобретению, в качестве добавки используют полиметилсилоксан при следующем соотношении компонентов, мас. %: цис-дихлородиамин 1,80-4,40 платина хлорид натрия 8,10-20,00 полиметилсоликсан остальное Предпочтительным составом является состав, мас. %: цис-дихлородиамин платина 3,30 хлорид натрия 14,80 полиметилсоликсан остальное Состав готовили следующим образом; в воде растворяли хлорид натрия, добавляли цис-дихлородиамин платину, смешивали полученный раствор с гидрогелем полиметилсилоксана; смесь сушили в токе воздуха до получения сыпучего порошкообразного вещества. Заявляемый состав представляет собой мелкодисперсное аморфное вещество белого цвета с желтоватым оттенком. Исследования состава на электронном микроскопе показали, что его частицы имеют форму глобул с диаметром 4-7 нм. Изучение состава методом ртутной порометрии показало, что удельная поверхность глобул составляет 80-200 м 2/г. Противоопухолевая активность состава была изучена в экспериментах на животных по отношению к перевивному штампу эритромиелоза Швеца в сравнении с контролем, полиметилсилоксаном и цисплатином. Опыты проводили на белых беспородных крысах весом 150-200 г (в каждой группе по 10 животных), которым под кожу бедра инокули-ровали 2.108 клеток опухоли. На четвертые сутки после инокуляции опухолевы х клеток, т.е. в период логарифмической фазы роста опухоли, животным однократно внутрибрюшинно вводили исследуемые вещества в дозах, указанных в табл.1. Для заявляемого состава установлены максимальные и минимальные эффективные дозы. Перед введением животных наркотизировали путем подкожных инъекций 40-60 мг/кг гексенала. Через 30-60 мин после введения наркотизирующего вещества животных фиксировали, вскрывали брюшную полость, вносили туда предварительно простерилизованные автоклавированием порошки, по возможности распределяя их равномерно, затем рану зашиваликисетным швом. После прекращения действия наркоза животные пробуждались. Цисплатин вводили в виде инъекций. Контрольным животным внутрибрюшинно инъецировали физиологический раствор или наносили соответствующую травму. Противоопухолевую активность заявляемого состава оценивали по трем биологическим показателям: степени угнетения роста опухоли, выживаемости животных на 10-е сутки после перевивки опухоли, по продолжительности жизни животных. Конкретно приготовленные составы и результаты исследования их противоопухолевой активности представлены в табл.1. Свободный полиметилсилоксан не обладает противоопухолевой активностью. Он не угнетает рост опухоли, хотя и не влияет на продолжительность жизни животных, их выживаемость. Цисплатин проявляет высокую противоопухолевую активность. Он угнетает рост опухоли на 80 %. Однако цисплатин снижает процент выживаемости животных и продолжительность их жизни по сравнению с контролем. Заявляемый состав для подавления роста опухолей (пп. №№ 4-6) по уровню Противоопухолевой активности не только не уступает цисплатину, но и превосходит его. Он тормозит рост опухоли на 84-95 %, обеспечивает выживаемость 90-100 % животных и продолжительность их жизни в течение 18-23 суток. Особенно выделяется состав, приведенный в табл. 1 под № 5, который по сравнению с цисплатином на 15% более эффективно угнетает рост опухоли, на 20 % увеличивает выживаемость животных и на 12 суток (то есть вдвое) увеличивает продолжительность их жизни. Была изучена токсичность заявляемого состава в сравнении с токсичностью свободного полиметилсилоксана и цисплатина. Опыты проводили на белых беспородных крысах весом 150-200 г и белых нелинейных мышах весом 30±3 г. В каждой опытной группе было по 10 животных. Испытываемые вещества вводили внутрибрюшинно однократно. Цисплатин инъецировали в дозах 8,0, 14,0, 16,0 и 18 мг/кг в расчете на цис-дихлородиаминплатину. Полиметилсилоксан и заявляемый состав вводили в виде стерильных порошков в дозах; полиметилсилоксан и состав № 4 - 400, 800, 1600, 2400, 3200 и 4000 мг/кг, состав № 5 - 200, 400, 800, 1200, 1600, 2000 и 2400 мг/кг, состав № 6 –130, 260, 530, 800, 1060, 1300 мг/кг. Порошки вносили во вскрытую брюшную полость животных, под наркозом гексенала в дозах 40-60 мг/кг для крыс и 20-30 мг/кг - для мышей. После введения препаратов брюшную полость зашивали кисетным швом. Учет гибели животных проводили через 24 и 48 ч после введения веществ. Токсичность их выражали в виде доз, вызывающих гибель 50 % (ЛД50) и 100 % (ЛД100) животных. Испытания острой токсичности на мышах и крысах дали одинаковые результаты, которые приведены в табл. 2 и подтверждены актом испытаний. Из соотношения между минимальной эффективной дозой (ЕД) и токсической дозой был определен терапевтический индекс (ТИ) заявляемого состава под №№ 4-6; ТИ =ЛД50/ЕД. Результаты приведены в табл. 2. Из табл. 2 видно, что не обладающий терапевтической активностью прлиметилсилоксан неоказывает токсического действия даже в дозе, максимально возможной для введения, превышающей 4800 мг/кг. Заявляемый состав менее, токсичен и более эффективен, чем цисплатин. Наименее токсичным является состав № 4, Однако самый высокий терапевтический индекс имеет состав № 5. Следовательно, по терапевтическому действию заявляемый состав № 5 является самым эффективным. Действительно, он характеризуется наиболее высоким уровнем противоопухолевой активности и терапевтической эффективности. Изучали иммунологическую активность заявляемого оптимального состава (состава № 5), которую характеризовали по показателям гуморального иммунитета: количеству антителообразующих клеток в селезенке и количеству антител в сыворотке крови, образующи хся в ответ на иммунизацию эритроцитами барана интактных животных и животных опухоленосителей. Использовали крыс линии Вистар весом 150-200 г. Под опытным животным под кожу бедра инокулировали 2.10 клеток перевиваемого штамма эритромиелоза Швеца. На четвертые сутки после перевивки опухолевы х клеток животным вводили заявляемый состав. Для сравнения другим гр уппам животных вводили полиметилсилоксан и цисплатин. Препараты вводили однократно внутрибрюшинно в дозах, составляющи х половину от токсической (ЛД50/2) по той же методике, которая применялась при испытаниях противоопухолевой активности, токсичности и описана выше. На восьмые сутки после перевивки опухоли проводили иммунизацию животных, вводя им внутривенно эритроциты барана в дозе 1.106 клеток. Через четверо суток после иммунизации животных декапутировали на фоне эфирного наркоза и определяли содержание антителообразующи х клеток в селезенке по методу Ерне, а также титры агглютининов и гемолизинов в периферической крови по известным методам. Содержание антителообразующи х клеток определяли в расчете на 106 спленоцитов и на всю массу селезенки. Результаты опытов приведены в табл. 3 и подтверждены актом испытаний. Как видно из табл. 3, по сравнению с интактными животными у нелеченных животных-опухоленосителей все показатели гуморального иммунитета имеют более низкие значения. Содержание антителообразующих клеток в расчете на 106 спленоцитов понижается почти в 10 раз, титры агглютининов и гемолизинов уменьшаются примерно в 2 раза. Это свидетельствует о том, что рост опухоли сопровождается угнетением гуморального иммунитета организма. Введение опухоленосителям цисплатина еще в большей степени подавляет его гуморальный иммунитет, о чем говорит еще большее снижение соответствующих показателей. Так содержание антителообразующих клеток в расчете на 10 спленоцитов уменьшается примерно в 10 раз по сравнению с опухоленосителями без лечения и примерно в 100 раз по сравнению синтактными животными. Падают титры агглютининов и гемолизинов, характеризующие содержание антител в крови. Полиметилсилоксан и заявляемый состав практически не влияют на гуморальный иммунитет опухоленосителей. В отличие от цисплатина они не снижают количество антителообразующи х клеток в селезенке и почти не влияют на содержание антител в сыворотке крови, сохраняя показатели гуморального иммунитета на уровне, характерном для нелеченных опухоленосителей. Следовательно, у заявляемого состава устранен иммунодепрессивный эффект, который имеется у известных платиносодержащих противоопухолевых составов. Таким образом, предложенный состав для подавления роста опухолей, включающий цисдихлородиаминплатину, хлорид натрия и полиметилсилоксан в указанных соотношениях, обеспечивает достижение положительного эффекта, выражающегося в повышении противоопухолевой активности, снижении токсичности и устранении иммунодепрессивного действия, и тем самым превосходит известные составы противоопухолевого действия. Выявленный комплекс свойств делает заявляемый состав перспективным в качестве препарата для химиотерапии опухолей и позволит повысить эффективность лечения злокачественных новообразований.
ДивитисяДодаткова інформація
Назва патенту англійськоюComposition, having antitumor activity
Автори англійськоюVolchenkova Ilima Iliodorivna, Volchenskova Ilima Iliodorivna, Maidanevych Nadiia Mykolaivna, Budarin Lev Ivanovych, Samodumova Innesa Mykhailivna, Hyrin Vitalii Mykolaiovych, Shalimov Serhii Oleksandrovych, Trokhymenko Olena Petrivna, Keisevych Ludwig Vladyslavovych
Назва патенту російськоюСостав, обладающий противоопухолевой активностью
Автори російськоюВолченскова Илима Илиодоровна, Майданевич Надежда Николаевна, Бударин Лев Иванович, Самодумова Иннеса Михайловна, Гирин Виталий Николаевич, Шалимов Сергей Александрович, Трохименко Елена Петровна, Кейсевич Людвиг Владиславович
МПК / Мітки
МПК: A61K 33/24, A61K 31/282
Мітки: протипухлинну, має, склад, активність
Код посилання
<a href="https://ua.patents.su/4-3779-sklad-shho-maeh-protipukhlinnu-aktivnist.html" target="_blank" rel="follow" title="База патентів України">Склад, що має протипухлинну активність</a>
Попередній патент: Жароміцний сплав на основі нікелю
Наступний патент: Пристрій для електролітичного отримання та обробки тонкої фольги
Випадковий патент: Склад водовугільної суспензії на основі високосірчистого кам'яного вугілля