Спосіб індукції утворення мембранних везикул
Формула / Реферат
1. Спосіб індукції утворення мембранних везикул евкаріотичних клітин, який включає вирощування евкаріотичних клітин, який відрізняється тим, що клітини обробляють агентом, що інгібує АТФ-чутливі калієві канали ендоплазматичного ретикулуму, наприклад глібенкламідом.
2. Спосіб за п. 1, який відрізняється тим, що клітини додатково опромінюють електромагнітним чи іонізуючим випромінюванням, наприклад ультрафіолетовим випромінюванням типу В.
Текст
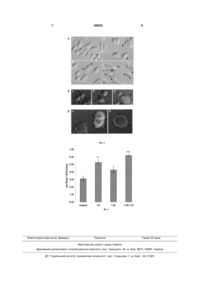
1. Спосіб індукції утворення мембранних везикул евкаріотичних клітин, який включає вирощу 3 процесах. Одним з керованих способів індукції утворення мембранних везикул є індукція апоптозу, яка супроводжується фрагментацією клітини на апоптичні тільця та конденсацією «тіла» клітини. Однак, при апоптозі відбувається екстерналізції фосфатидилсерину із внутрішньої на зовнішню поверхню плазматичної мембрани клітини, таким чином мембрані везикули експонують на своїй поверхні фосфатидилсерин. Показано, що молекули фосфатидилсерину володіють протизапальним впливом на імунну систему [Weiss, Frey, R6del, Herrmann, Schlücker, Voll, Fietkau and Gaipl, Ex vivo- and in vivo-induced dead tumor cells as modulators of antitumor responses. Annals of the New York Academy of Sciences, 2010. 1209.109117, Voll, Herrmann, Roth, Stach, Kalden and Girkontaite, Immunosuppressive effects of apoptotic cells. Nature, 1997. 390.350-1], і тому використання мембранних везикул, що експонують на поверхні фосфатидилсерин, як імуногенних агентів є неможливим. Одним із способів пригнічення імуногенних властивостей мембранних везикул є іх маскування за допомогою білків чи пептидів, які зв'язують фосфатидилсерин і маскують його (наприклад, анексину V) [Патент США US2005059587 від 17.05.2005, МПК А61К 38/17, Use of a protein for the production of a medicament for stimulating the innate non-specific immune system]. Недоліком даного підходу є потенційна можливість виникнення імунної реакції на маскуючі білки/пептиди, та висока вартість даних білків. Слід зазначити, що рівень блеббінгу за нормальних умов життєдіяльності клітини, також при її апоптичній загибелі часто є недостатнім для отримання достатньої кількості мембранних везикул, тому виникає потреба в ефектному способі індукції утворення мембранних везикул, які на сьогодні для евкаріотичних клітин не відомі. В основу корисної моделі поставлено завдання розробити спосіб індукції утворення мембранних везикул. Поставлене завдання вирішується так, що у способі індукції утворення мембранних везикул евкаріотичних клітин, який включає вирощування клітин, згідно з корисною моделлю, клітини обробляють агентом, що зв'язується з АТФ-чутливими калієвими рецепторами ендоплазматичного ретикулуму, наприклад глібенкламідом, після чого клітини опромінюють електромагнітним чи іонізуючим випромінюванням, наприклад ультрафіолетовим випромінюванням типу В, через 2-4 години утворені мембранні везикули відділяються від фракції клітин шляхом центрифугування (а за потреби додатково реєструються за допомогою фазовоконтрастного чи DIC-мікроскопу). Глібенкламід (5-хлоро-N-(4-[N(циклогексилкарбамот)сульфамот]фенетил)-2метоксибензамід; 5-chloro-N-(4-[N(cyclohexylcarbamoyl)sulfamoyl]phenethyl)-2methoxy-benzamide, CAS number 10238-21-8, PubChem CID 3488) - це похідне сульфонілсечовини, широковживаний і доступний фармацевтичний препарат, що використовується при лікуванні цукрового діабету типу II [Патент України 81615 від 25.01.2008, бюл. № 2/2008, МПК А61К 9/20, А61К 60626 4 31/64, Фармацевтична композиція, що містить метформін та глібенкламід, для лікування діабету типу II]. Глібенкламід зв'язується з, та інгібує АТФчутливі калієві канали ендоплазматичного ретикулуму (переважно накопичуючись у бета клітинах підшлункової залози) [Serrano-Martin, Payares and Mendoza-Leon, Glibenclamide, a blocker of K+(ATP) channels, shows antileishmanial activity in experimental murine cutaneous leishmaniasis. Antimicrob Agents Chemother, 2006. 50.4214-6]. Спосіб індукції утворення міхурців плазматичної мембрани полягає в наступному. Авторами вперше для індукції утворення міхурців плазматичної мембрани запропоновано використовувати глібенкламід та поєднання глібенкламіду та УФ-Б, що забезпечує утворення мембранних везикул вже через 2-4 години інкубації в кількостях більших, ніж окремо дія глібенкламіду чи УФ-Б. Також дія глібенкламіду чи поєднання дії глібенкламіду та УФ-Б призводить до утворення мембранних везикул із низьким вмістом екстерналізованого фосфатидилсерину. Клітини, у яких необхідно індукувати утворення міхурців плазматичної мембрани попередньо вирощують на покривних скельцях (для проведення наступної мікроскопії) чи в іншому пластиковому культуральному посуді (для отримання фракції міхурців плазматичної мембрани). Клітини промиваються забуференим фізіологічним розчином (ЗФР, фізіологічний розчин, який містить 0,8 % NaCl, 0,25 % КСl, 0,144 % Na2HPO4 та 0,024 % КН2РО4, рН 7,4) та поміщаються у розчин Хенкса (1 л якого містить NaCl 80,0 г, КСl 4,0 г, MgSO4*7H2O 1,0г, МgСl-6Н2O 1,0 г, Na2HPO4 0,6 г, КН2РO4 0,6 г, Глюкоза 10,0 г, СаСl2 1,4 г, феноловий червоний 0,2 г) або Рінгера (100 мл розчину містить 0,9 г натрію хлориду, 0,02 г калію хлориду, 0,02 г кальцію хлориду, 0,02 г натрію гідрокарбонату), до клітин додаються глібенкламід (розчин в диметилсульфоксиді) в кінцевій концентрації 5-10 мкг/мл середовища (в залежностівід типу клітин), клітини в культуральному посуді опромінюють уль2 трафіолетом-В, 180 мДж/см , поміщаючи культуральний посуд безпосередньо перед ультрафіолетовою лампою лабораторного трансілюмінатора. Звичайний лабораторний пластиковий посуд пропускає УФ-Б. Клітини інкубують 1-4 год. (в залежності від конкретного типу клітин) при 37°С після чого спостерігають утворення міхурців плазматичної мембрани за допомогою фазово-контрастного чи DIC-мікроскопу, або виділяють фракцію міхурців плазматичної мембрани шляхом центрифугування клітинної суспензії (у випадку суспензійних клітин) чи супернатанту (надосадової рідини, у випадку субстрат-залежних клітин) при 400д упродовж 5хв. Мембранні везикули залишаються в суспензії, в той час як клітини осідають. За потреби мембранні везикули осаджують центрифугуванням при 12500g упродовж 60 хв. Запропонований метод відрізняється від раніше описаних тим, що: - утворення мембранних везикул індукують в евкаріотичних клітин. 5 - утворення мембранних везикул індукують за допомогою глібенкламіду чи глібенкламіду та ультрафіолету-Б. - утворені мембранні везикули відрізняються низьким вмістом фосфатидилсерину. - для індукції мембранних везикул потрібно 1-4 години. На Фіг. 1 зображено: А - утворення мембранних везикул в культурі клітин раку шийки матки людини лінії HeLa в інтактних клітин (а), під впливом ультрафіолету (б), глібенкламіду (в), глібенкламіду та ультрафіолету (г). Б - експонування фосфатидилсерину на поверхні клітини та мембранних везикул, утворених дією глібенкламіду та УФ-Б (а, б) чи дією УФ-Б (в), - позитивний контроль фарбування на виявлення фосфатидилсерину, DIC мікроскопія та флуоресцентна мікроскопія, фарбування анексином V - Texas red. В експонування N-гліканів плазматичної мембрани, притаманних апоптичним клітинам, фарбування лектином WGA - Texas red, утворених дією глібенкламіду та УФ-Б (а, б), DIC мікроскопія та флуоресцентна мікроскопія. На Фіг. 2 зображено: Кількість мембранних везикул, утворених в культурі клітин раку шийки матки людини лінії HeLa інтактними клітинами (а), під впливом ультрафіолету (б), глібенкламіду (в), глібенкламіду та ультрафіолету (г). Утворення мембранних везикул оцінювали за вмістом білка (визначення білка по Петерсону), мкг/млн клітин. Можливість реалізації способу показано на наступних прикладах. Приклад 1. Мікроскопічні дослідження утворених мембранних везикул. Клітини лінії HeLa раку шийку матки людини висівали на культуральний посуд в середовищі RPMI-1640, що містило 10 % ембріональної телячої сироватки, 5 мМ глутаміну, та культивували при 37°С та 5 % СО2 упродовж 24-48 годин, доки клітини не займали принаймні 50 % площі культурального посуду. За потреби до клітин додавали глібенкламід, в кінцевій концентрації 5 мкг/мл, за потреби, через 10 хв. після додавання глібенкламіду культуральну чашку з клітинами опромінювали ультрафіолетовою лампою трасілюмінатора, з 2 розрахунку 180 мДж УФ-Б/см . Через 2-4 години проводили мікроскопічні дослідження клітин. Для виявлення мембранних везикул використовували диференціальний інтерференційно-контрастний (DIC) флуоресцентний мікроскоп Carl Zeiss Axiolmager A1. Як видно з Фіг. 1 А, сумісна дія УФ-Б та глібенкламіду призводить до значного утворення мембранних везикул на поверхні клітин. Оцінку розміру мембранних везикул здійснювали за допомогою програмного забезпечення AxioVision 4.6. Середній розмір досліджуваних клітин HeLa становив (тут і далі представлено середнє значення мінімум 50 вимірів ± стандартна похибка) 37±9 × 20±4 мкм, при утворенні мембранних везикул клітини округлювались (середній діаметр клітини 19,7±3,2 мкм) і утворювали мембранні везикули з 60626 6 середнім розміром 2,01±0,45 мкм, при цьому середній розмір мембранних везикул, утворених лише за дії ультрафіолетового випромінювання становив понад 5 мкм (5÷24 мкм). Для виявлення екстерналізації фосфатидилсерину клітини поміщали в розчин Рінгера (100 мл розчину містить 0,9 г натрію хлориду, 0,02 г калію хлориду, 0,02 г кальцію хлориду, 0,02 г натрію гідрокарбонату), що містив кон'югат анексин Vтехаський червоний, в кінцевій концентрації 1 мкг/мл, та спостерігали червону флуоресценцію при збудженні 550 нм та емісії 580-630 нм, флуоресценцію фіксували за допомогою камери Carl Zeiss AxioCam MRm. Для виявлення гліканів поверхні плазматичної мембрани клітини поміщали в розчин Рінгера, що містив кон'югат лектину зародків пшениці (WGА)-техаський червоний, в кінцевій концентрації 5 мкг/мл, та спостерігали червону флуоресценцію при збудженні 550 нм та емісії 580-630 нм. Мембранні везикули, утворені за дії УФ-Б та глібенкламіду характеризувались низьким вмістом екстерналізованого фасфатидилсерину (Фіг. 1Б, а,б), на відміну від везикул, утворених лише за дії УФ-Б (Фіг. 1Б, в). Мембранні везикули, утворені за дії УФ-Б та глібенкламіду також характеризувались низьким вмістом поверхневих гліканів, притаманних апоптичним клітинам [Bilyy and Stoika, Lectinocytochemical detection of apoptotic murine leukemia L1210 cells. Cytometry A, 2003. 56.89-95], що виявлялись за фарбуванням лектином WGA (Рис. 1В). Приклад 2. Виділення, очистка та кількісна оцінка утворених мембранних везикул. Клітини лінії HeLa раку шийки матки людини висівали на культуральний посуд в середовищі RPMI-1640, що містило 10 % ембріональної телячої сироватки, 5 мМ глутаміну, та культивували при 37°С та 5 % СО2 упродовж 24-48 годин, доки клітини не займали 100 % площі культурального посуду (повний конфлуент). Клітини тричі промивали розчином Рінгера. За потреби до клітин додавали глібенкламід, в кінцевій концентрації 10 мкг/мл, за потреби, через 10 хв. після додавання глібенкламіду, культура льну чашку з клітинами опромінювали ультрафіолетовою лампою з розра2 хунку 180 мДж УФ-Б/см , Через 4 години культуральну рідину збирали та переносили в нові пробірки. Центрифугували при 150g, 3 хв., для осадження клітин (якщо такі присутні), супернатант переносили у нові пробірки. Ці пробірки центрифугували при 12500g, 60 хв. для осадження мембранних везикул. Супернатант відбирали, отриманий осад містив мембранні везикули. Вміст білка у везикулах визначали за методом Петерсона, як описано [Peterson, A simplification of the protein assay method of Lowry et al. which is more generally applicable. Anal Biochem, 1977. 83.346-56]. Сумісна дія УФ-Б та глібенкламіду спричиняє достовірне зростання вмісту білка мембранних везикул в очищених препаратах везикул. 7 Комп’ютерна верстка Д. Шеверун 60626 8 Підписне Тираж 23 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for tinduction of membrane vesicle formation
Автори англійськоюBilyi Rostyslav Oleksandrovych
Назва патенту російськоюСпособ индукции образования мембранных везикул
Автори російськоюБилый Ростислав Александрович
МПК / Мітки
МПК: A61K 39/00
Мітки: індукції, мембранних, утворення, везикул, спосіб
Код посилання
<a href="https://ua.patents.su/4-60626-sposib-indukci-utvorennya-membrannikh-vezikul.html" target="_blank" rel="follow" title="База патентів України">Спосіб індукції утворення мембранних везикул</a>
Попередній патент: Спосіб поляризаційно-кореляційної діагностики і прогнозування перебігу хронічного некалькульозного холециститу на тлі цукрового діабету 2 типу
Наступний патент: Спосіб фрактальної діагностики і прогнозування перебігу хронічного некалькульозного холециститу на тлі цукрового діабету 2 типу
Випадковий патент: Засіб для лікування запальних та дистрофічних уражень слизових оболонок і шкіри