Антитіло, яке зв’язує tgf-альфа та епірегулін
Номер патенту: 110051
Опубліковано: 10.11.2015
Автори: Бейдлер Кетрін Бротігем, Хойєр Йозеф Георг, Петрован Рамона Джудіта
Формула / Реферат
1. Антитіло, яке зв'язує TGF-альфа і епірегулін, яке містить легкий ланцюг і важкий ланцюг, де вказаний легкий ланцюг містить варіабельну ділянку легкого ланцюга (LCVR), а вказаний важкий ланцюг містить варіабельну ділянку важкого ланцюга (HCVR), де LCVR включає в себе амінокислотні послідовності LCDR1, LCDR2 і LCDR3, a HCVR включає в себе амінокислотні послідовності HCDR1, HCDR2 і HCDR3, причому LCDR1 являє собою послідовність SEQ ID NO: 4, LCDR2 являє собою послідовність SEQ ID NO: 5, LCDR3 являє собою послідовність SEQ ID NO: 6, HCDR1 являє собою послідовність SEQ ID NO: 1, HCDR2 являє собою послідовність SEQ ID NO: 2 і HCDR3 являє собою послідовність SEQ ID NO: 3.
2. Антитіло за п. 1, де амінокислотна послідовність LCVR являє собою послідовність SEQ ID NO: 9 або послідовність SEQ ID NO: 10.
3. Антитіло за п. 1 або п. 2, де амінокислотна послідовність HCVR являє собою послідовність SEQ ID NO: 7.
4. Антитіло за будь-яким з пп. 1-3, де амінокислотна послідовність LCVR являє собою послідовність SEQ ID NO: 9, а амінокислотна послідовність HCVR являє собою послідовність SEQ ID NO: 7.
5. Антитіло за будь-яким з пп. 1-4, де амінокислотна послідовність легкого ланцюга являє собою послідовність SEQ ID NO: 13 або послідовність SEQ ID NO: 14.
6. Антитіло за будь-яким з пп. 1-5, де амінокислотна послідовність важкого ланцюга являє собою послідовність SEQ ID NO: 12.
7. Антитіло за будь-яким з пп. 1-6, що містить два легкі ланцюги, де амінокислотна послідовність кожного легкого ланцюга являє собою послідовність SEQ ID NO: 13, і два важкі ланцюги, де амінокислотна послідовність кожного важкого ланцюга являє собою послідовність SEQ ID NO: 12.
8. Антитіло за будь-яким з пп. 1-3 або 5-6, що містить два легкі ланцюги, де амінокислотна послідовність кожного легкого ланцюга являє собою послідовність SEQ ID NO: 14, і два важкі ланцюги, де амінокислотна послідовність кожного важкого ланцюга являє собою послідовність SEQ ID NO: 12.
9. Фармацевтична композиція, яка містить антитіло за будь-яким з пп. 1-8 і щонайменше один(-ну) фармацевтично прийнятний(-у) носій, розріджувач або допоміжну речовину.
10. Спосіб лікування діабетичної нефропатії у пацієнта, який включає введення вказаному пацієнту антитіла за будь-яким з пп. 1-8.
11. Антитіло за будь-яким з пп. 1-8 для застосування в терапії.
12. Антитіло за будь-яким з пп. 1-8 для застосування в лікуванні діабетичної нефропатії.
13. Антигензв'язувальний фрагмент за будь-яким з пп. 1-8.
14. Фармацевтична композиція, яка містить антигензв'язувальний фрагмент за п. 13 і щонайменше один(-ну) фармацевтично прийнятний(-у) носій, розріджувач або допоміжну речовину.
15. Спосіб лікування діабетичної нефропатії у пацієнта, який включає введення вказаному пацієнту антигензв'язувального фрагменту за п. 13.
16. Антигензв'язувальний фрагмент за п. 13 для застосування в терапії.
17. Антигензв'язувальний фрагмент за п. 13 для застосування в лікуванні діабетичної нефропатії.
Текст
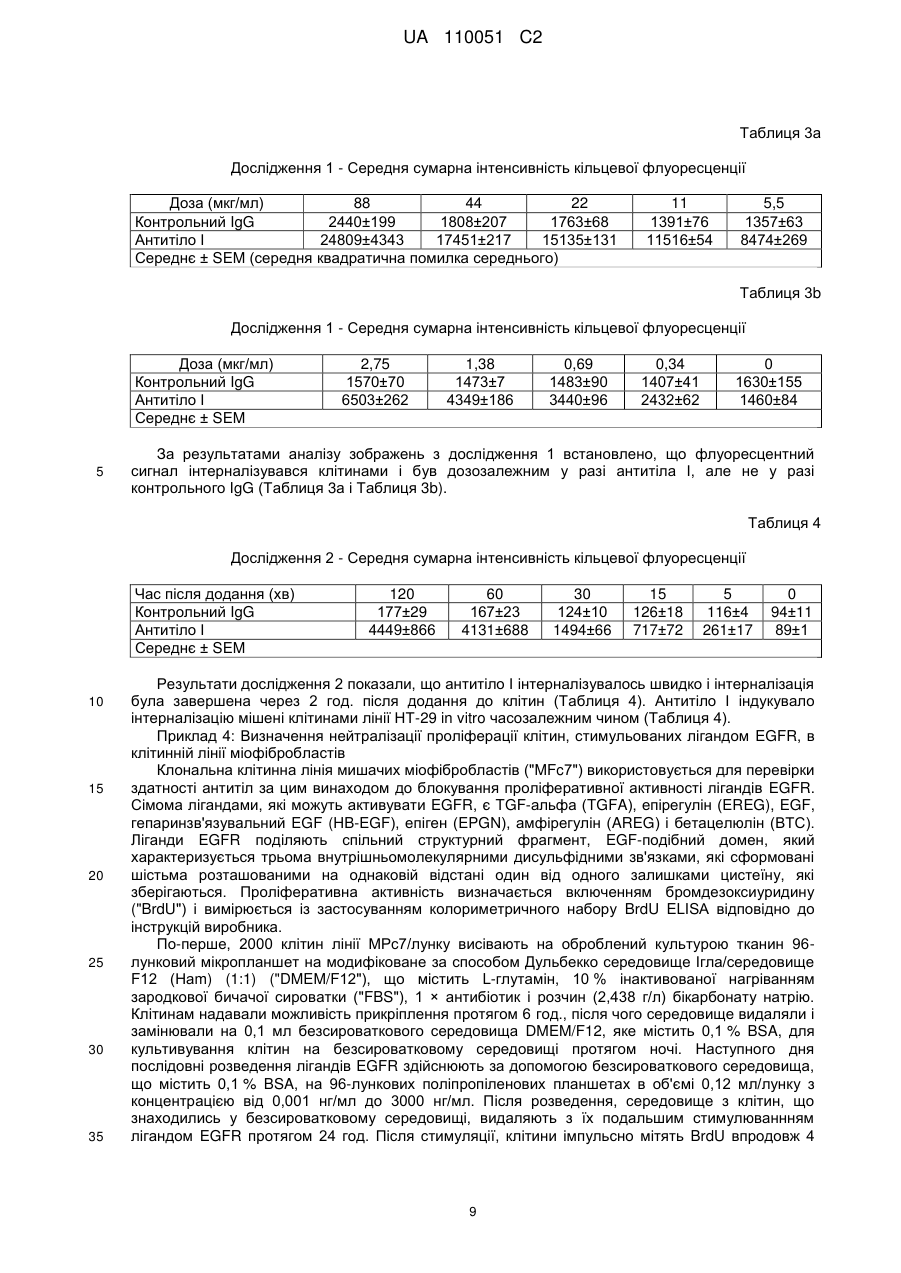
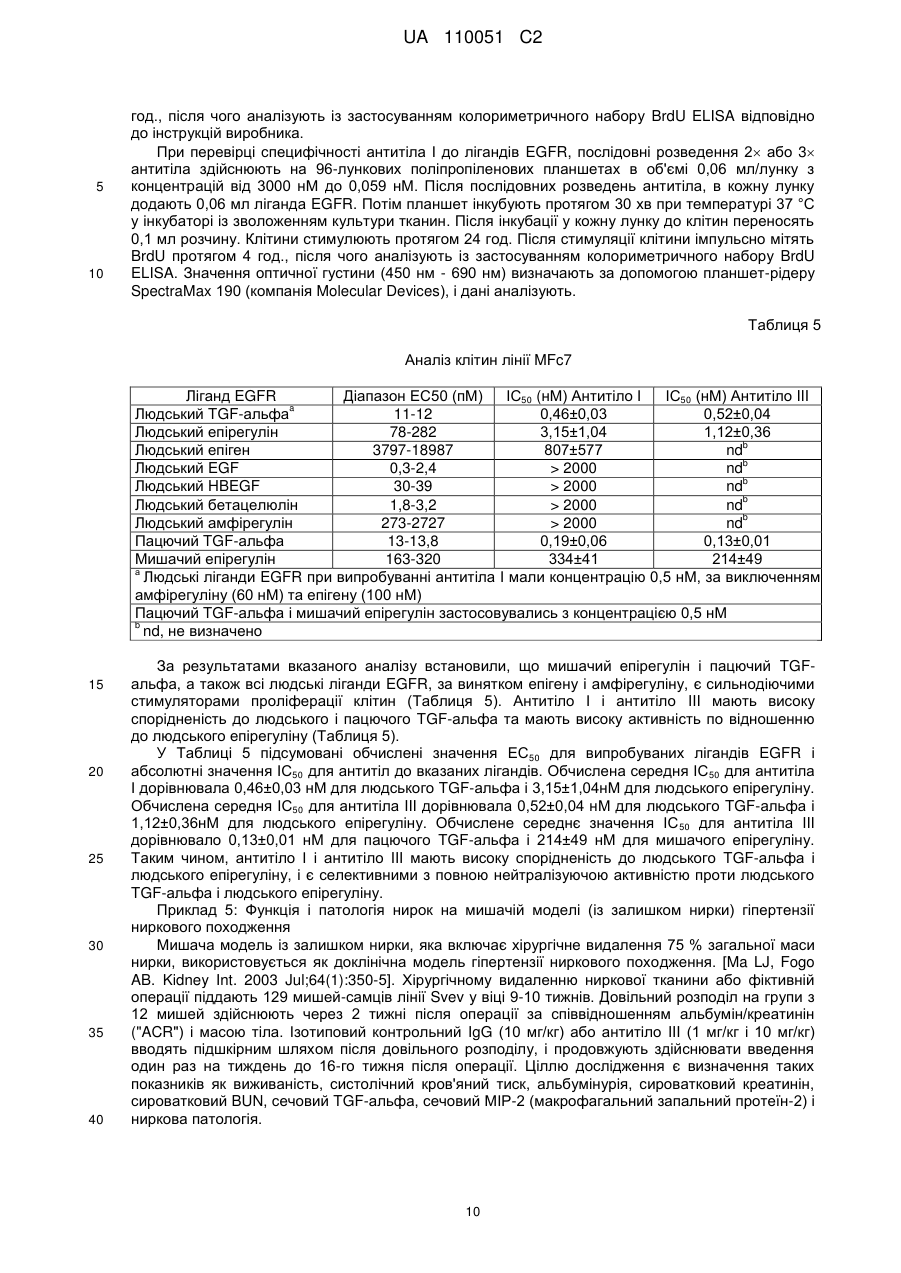
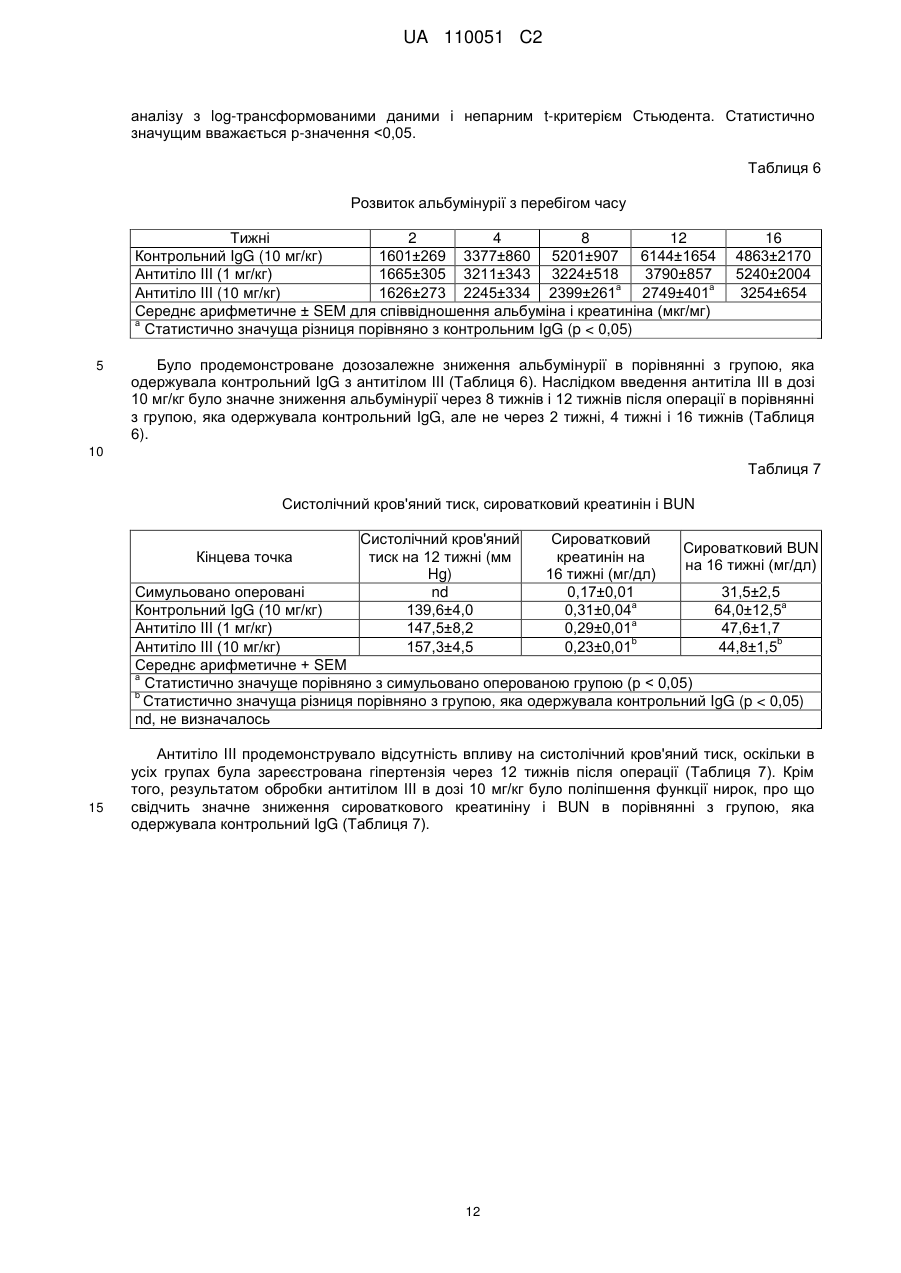
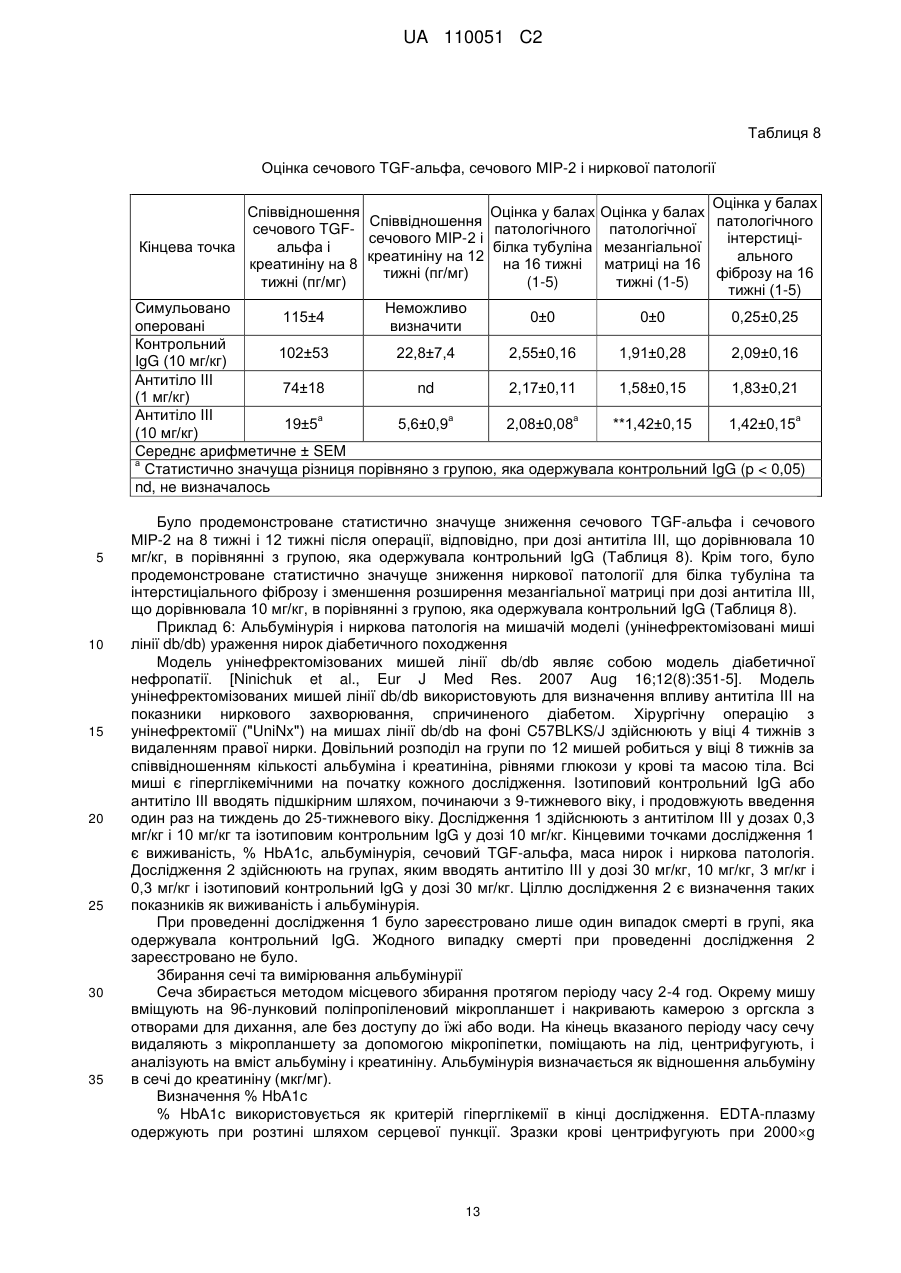
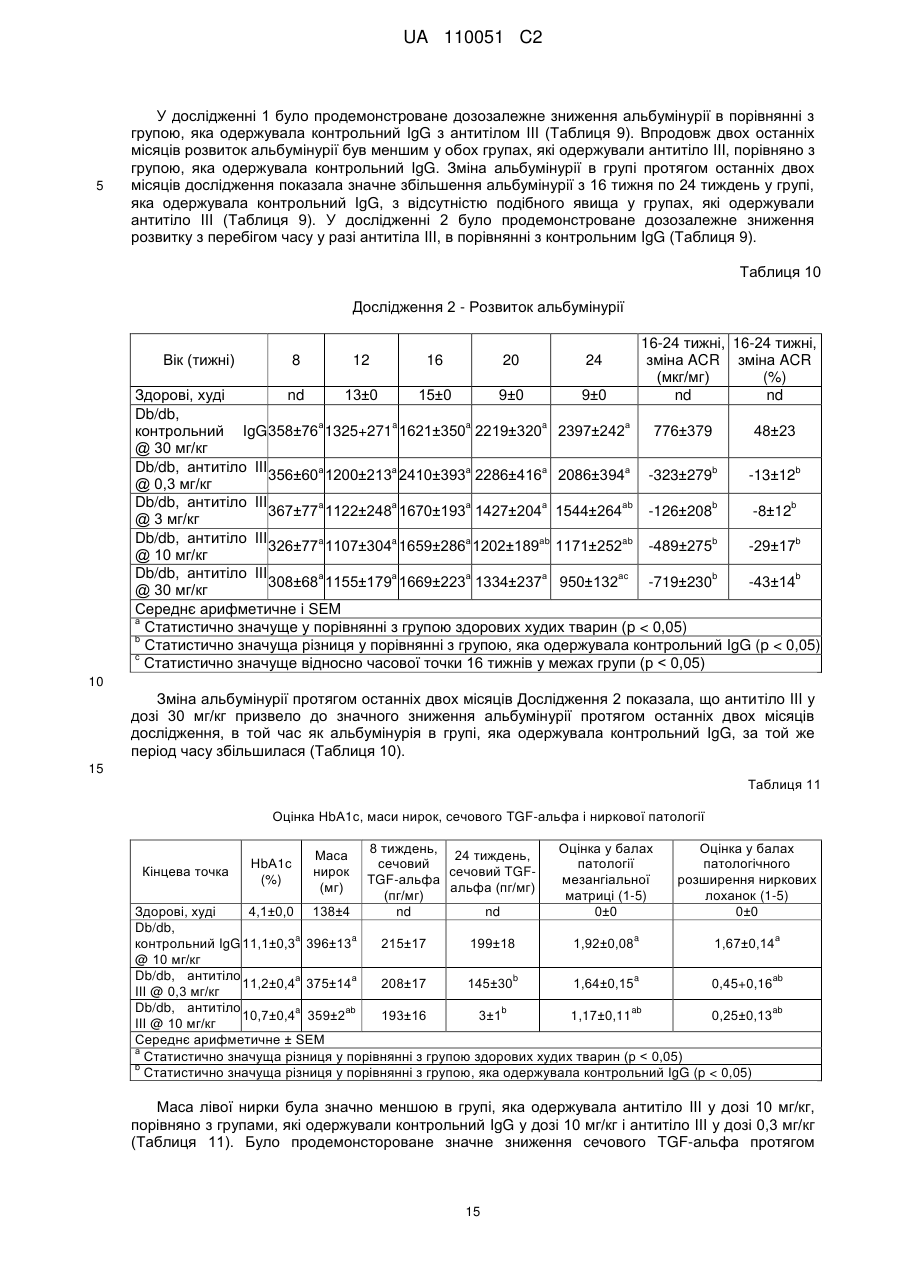
Реферат: Винахід належить до антитіла, яке зв'язує людський TGF-альфа та людський епірегулін і є придатними для лікування діабетичної нефропатії. UA 110051 C2 (12) UA 110051 C2 UA 110051 C2 5 10 15 20 25 30 35 40 45 50 55 60 Цей винахід стосується антитіл, які зв'язують людський TGF-альфа (трансформуючий альфа-фактор росту) та епірегулін, і варіантів їх застосування. TGF-альфа і епірегулін є двома з семи лігандів рецептору епідермального фактора росту ("EGFR"), які зазвичай функціонують в процесі загоєння ран після травми. Діабетична нефропатія ("DN") є одним з основних діабетичних ускладнень і провідною причиною термінальної стадії ниркової недостатності ("ESRD"). Протеїнурія є клінічним маркером хронічного захворювання нирок, що супроводжує діабетичну нефропатію і пов'язується з прогресуванням захворювання та підвищенням серцево-судинних ризиків, таких як серцева недостатність, судинні захворювання, аритмія. Стандарт ведення хворих у разі діабетичної нефропатії включає інгібітори АСЕ (ангіотензинконвертувальний фермент) і блокатори рецепторів ангіотензину ("ARB"), що лише уповільнює розвиток хвороби і залишає значний залишковий ризик. Блокування EGFR послаблює не тільки протеїнурію, але й патологію нирок на передклінічних тваринних моделях захворювання нирок. Проте інгібітори EGFR, такі як ERBITUX, разом з тим, що є схваленими для застосування при лікуванні раку, є пов'язаними з побічними ефектами, такими як сильний висип на обличчі і плечах, що пов'язується з цільовою інгібуючою терапією шкіри. Таким чином, все ще існує потреба в альтернативних лікарських засобах для терапії діабетичної нефропатії. Крім того, існує необхідність у більш ефективній терапії діабетичної нефропатії. Були описані антитіла, які зв'язують TGF-альфа (дивись, наприклад, US 5,190,858). Крім того, були описані антитіла, які зв'язують епірегулін (дивись, наприклад, US 2009/0324491). Даним винаходом запропоновані антитіла проти TGF-альфа і епірегуліну для лікування діабетичної нефропатії. Крім того, цим винаходом запропоновані антитіла проти TGF-альфа і епірегуліну, які взаємодіють з мішенню in vivo і згодом призводять до зниження протеїнурії із супутнім зниженням прогресування захворювання і ризику виникнення серцево-судинних захворювань. Цим винаходом запропоновані терапевтично корисні антитіла, які зв'язують як TGF-альфа, так і епірегулін, і які мають ряд бажаних властивостей. Антитіла за цим винаходом мають високу спорідненість і є селективними з повною нейтралізуючою активністю проти людського TGFальфа і людського епірегуліну. При введенні антитіла за цим винаходом спричинюють зниження альбумінурії і ниркової патології для білка тубуліна, інтерстиціального фіброзу, збільшення об'єму мезангіальної матриці і розширення ниркових лоханок in vivo. Крім того, антитіла за цим винаходом, яким віддають перевагу, не спричинюють пов'язаної з повним пригніченням EGFR токсичності для шкіри. Цим винаходом запропоноване антитіло, яке зв'язує TGF-альфа і епірегулін, яке містить легкий ланцюг і важкий ланцюг, де вказаний легкий ланцюг містить варіабельну ділянку легкого ланцюга (LCVR), а вказаний важкий ланцюг містить варіабельну ділянку важкого ланцюга (HCVR), де LCVR включає в себе амінокислотні послідовності LCDR1, LCDR2 і LCDR3, a HCVR включає в себе амінокислотні послідовності HCDR1, HCDR2 і HCDR3, причому LCDR1 являє собою послідовність SEQ ID NO: 4, LCDR2 являє собою послідовність SEQ ID NO: 5, LCDR3 являє собою послідовність SEQ ID NO: 6, HCDR1 являє собою послідовність SEQ ID NO: 1, HCDR2 являє собою послідовність SEQ ID NO: 2 і HCDR3 являє собою послідовність SEQ ID NO: 3. Цим винаходом запропонована також фармацевтична композиція, яка містить антитіло за цим винаходом, яке розкрите у цьому описі, і щонайменше один(-ну) фармацевтично прийнятний(-у) носій, розріджувач або допоміжну речовину. Цим винаходом для застосування в лікуванні діабетичної нефропатії запропоноване антитіло за цим винаходом, яке розкрите у цьому описі. У всьому описі, антитіло за цим винаходом, яке розкрите у цьому описі, зв'язує TGF-альфа і епірегулін, і містить легкий ланцюг і важкий ланцюг, де легкий ланцюг містить варіабельну ділянку легкого ланцюга (LCVR), а важкий ланцюг містить варіабельну ділянку важкого ланцюга (HCVR), де LCVR включає в себе амінокислотні послідовності LCDR1, LCDR2 і LCDR3, a HCVR включає в себе амінокислотні послідовності HCDR1, HCDR2 і HCDR3, причому LCDR1 являє собою послідовність SEQ ID NO: 4, LCDR2 являє собою послідовність SEQ ID NO: 5, LCDR3 являє собою послідовність SEQ ID NO: 6, HCDR1 являє собою послідовність SEQ ID NO: 1, HCDR2 являє собою послідовність SEQ ID NO: 2 і HCDR3 являє собою послідовність SEQ ID NO:3. Цим винаходом запропоноване антитіло, яке розкрите у цьому описі, де вказане антитіло є селективним до людського TGF-альфа і людського епірегуліну. Крім того, цим винаходом 1 UA 110051 C2 5 10 15 20 25 30 35 40 45 50 55 60 запропоноване антитіло, яке розкрите у цьому описі, причому вказане антитіло має повну нейтралізуючу активність проти людського TGF-альфа і людського епірегуліну. Крім того, за варіантом, якому віддають перевагу, цим винаходом запропоноване антитіло, яке розкрите у цьому описі, причому вказане антитіло є селективним до людського TGF-альфа і людського епірегуліну і має повну нейтралізуючу активність проти людського TGF-альфа і людського епірегуліну. Цим винаходом запропоноване антитіло, яке розкрите у цьому описі, причому вказане -9 -9 антитіло має константу дисоціації у стані рівноваги, Kd, у межах від 0,01 × 10 Μ до 1,0 × 10 М для людського TGF-альфа (послідовність SEQ ID NO: 18). Крім того, за варіантом, якому віддають перевагу, антитіло за цим винаходом, яке розкрите у цьому описі, має константу -9 -9 дисоціації у стані рівноваги, Kd, у межах від 0,05 × 10 Μ до 0,8 × 10 Μ для людського TGFальфа. Значення Kd встановлені за зв'язуванням у стані рівноваги при температурі 25 °C, як описано в Прикладі 2. За цим винаходом також запропоноване антитіло, яке розкрите у цьому описі, причому -9 -9 вказане антитіло має константу дисоціації у стані рівноваги, Kd, від 0,1 × 10 М до 30 × 10 Μ для людського мет-епірегуліну (послідовність SEQ ID NO:22). Крім того, за варіантом, якому віддають перевагу, антитіло за цим винаходом, яке розкрите у цьому описі, має константу -9 -9 дисоціації у стані рівноваги, Kd, у межах від 0,5 × 10 Μ до 10 × 10 Μ для людського епірегуліну. Значення Kd встановлені за зв'язуванням у стані рівноваги при температурі 25 °C, як описано в Прикладі 2. Цим винаходом також запропоноване антитіло, яке розкрите у цьому описі, причому вказане -9 -9 антитіло має константу дисоціації у стані рівноваги, Kd, у межах від 0,01 × 10 М до 1,0 × 10 М -9 для людського TGF-альфа (послідовність SEQ ID NO: 18) і Kd у межах від 0,1 × 10 М до 30 × -9 10 Μ для людського мет-епірегуліну (послідовність SEQ ID NO: 22). Крім того, за варіантом, якому віддають перевагу, антитіло за цим винаходом, яке розкрите у цьому описі, має константу -9 -9 дисоціації у стані рівноваги, Kd, у межах від 0,05 × 10 М до 0,8 × 10 М для людського TGF-9 -9 альфа і Kd у межах від 0,5 × 10 М до 10 × 10 Μ для людського епірегуліну. Значення Kd встановлені за зв'язуванням у стані рівноваги при температурі 25 °C, як описано в Прикладі 2. Цим винаходом запропоновані антитіла, які зв'язують людський TGF-альфа та епірегулін і спричинюють дозозалежне зниження альбумінурії, зниження сироваткового креатиніну і азоту сечовини крові ("BUN") in vivo на мишачій моделі із залишком нирки та на моделі унінефректомізованих мишей лінії db/db, як описано в Прикладі 5 і в Прикладі 6, відповідно. Цим винаходом запропоновані антитіла, які зв'язують людський TGF-альфа та епірегулін і спричинюють зниження ниркової патології для білка тубуліну та інтерстиціального фіброзу, і зменшення у разі збільшення об'єму мезангіальної матриці і розширення ниркових лоханок in vivo на мишачій моделі із залишком нирки та на моделі унінефректомізованих мишей лінії db/db, як описано в Прикладі 5 і в Прикладі 6, відповідно. Цим винаходом запропоновані антитіла, які зв'язують людський TGF-альфа та епірегулін і, як вважають, викликають зниження протеїнурії із супутнім зниженням прогресування захворювання і ризику виникнення серцево-судинних захворювань у людей. Крім того, цим винаходом запропоновані антитіла, які зв'язують людський TGF-альфа та епірегулін і, як вважають, є ефективними в лікуванні діабетичної нефропатії у людини. Цим винаходом запропоновані антитіла, які зв'язують людський TGF-альфа та епірегулін і не спричинюють токсичності для шкіри при дослідженні токсичності на макаках-крабоїдах, як описано в Прикладі 7. Цим винаходом запропоноване антитіло, яке зв'язує TGF-альфа та епірегулін, що містить легкий ланцюг і важкий ланцюг, де легкий ланцюг містить варіабельну ділянку легкого ланцюга (LCVR), а важкий ланцюг містить варіабельну ділянку важкого ланцюга (HCVR), де LCVR включає в себе амінокислотні послідовності LCDR1, LCDR2 і LCDR3, а HCVR включає в себе амінокислотні послідовності HCDR1, HCDR2 і HCDR3, причому LCDR1 являє собою послідовність SEQ ID NO: 4, LCDR2 являє собою послідовність SEQ ID NO: 5, LCDR3 являє собою послідовність SEQ ID NO: 6, HCDR1 являє собою послідовність SEQ ID NO: 1, HCDR2 являє собою послідовність SEQ ID NO: 2 і HCDR3 являє собою послідовність SEQ ID NO: 3. Крім того, цим винаходом запропоноване антитіло, яке зв'язує TGF-альфа та епірегулін, яке містить легкий ланцюг і важкий ланцюг, де легкий ланцюг містить варіабельну ділянку легкого ланцюга (LCVR), а важкий ланцюг містить варіабельну ділянку важкого ланцюга (HCVR), причому амінокислотна послідовність LCVR являє собою послідовність SEQ ID NO: 9 або послідовність SEQ ID NO: 10. Цим винаходом також запропоноване антитіло, яке зв'язує TGF-альфа та епірегулін, яке містить легкий ланцюг і важкий ланцюг, де легкий ланцюг містить варіабельну ділянку легкого 2 UA 110051 C2 5 10 15 20 25 30 35 40 45 50 55 60 ланцюга (LCVR), а важкий ланцюг містить варіабельну ділянку важкого ланцюга (HCVR), причому амінокислотна послідовність HCVR являє собою послідовність SEQ ID NO: 7. Цим винаходом також запропоноване антитіло, яке зв'язує TGF-альфа і епірегулін, яке містить легкий ланцюг і важкий ланцюг, де легкий ланцюг містить варіабельну ділянку легкого ланцюга (LCVR), а важкий ланцюг містить варіабельну ділянку важкого ланцюга (HCVR), де амінокислотну послідовність LCVR і амінокислотну послідовність HCVR вибирають з групи, яку складають: (і) LCVR, яка являє собою послідовність SEQ ID NO: 9, і HCVR, яка являє собою послідовність SEQ ID NO: 7; та (іі) LCVR, яка являє собою послідовність SEQ ID NO: 10, і HCVR, яка являє собою послідовність SEQ ID NO: 7. Цим винаходом запропоноване антитіло, яке зв'язує TGF-альфа та епірегулін, яке містить легкий ланцюг і важкий ланцюг, де легкий ланцюг містить варіабельну ділянку легкого ланцюга (LCVR), а важкий ланцюг містить варіабельну ділянку важкого ланцюга (HCVR), причому амінокислотна послідовність LCVR являє собою послідовність SEQ ID NO: 9, а амінокислотна послідовність HCVR являє собою послідовність SEQ ID NO: 7. Цим винаходом запропоноване антитіло, яке зв'язує TGF-альфа та епірегулін, яке містить легкий ланцюг і важкий ланцюг, де легкий ланцюг містить варіабельну ділянку легкого ланцюга (LCVR), а важкий ланцюг містить варіабельну ділянку важкого ланцюга (HCVR), причому амінокислотна послідовність LCVR являє собою послідовність SEQ ID NO: 10, а амінокислотна послідовність HCVR являє собою послідовність SEQ ID NO: 7. Крім того, цим винаходом запропоноване антитіло, яке зв'язує TGF-альфа та епірегулін, яке містить легкий ланцюг і важкий ланцюг, причому амінокислотна послідовність легкого ланцюга являє собою послідовність SEQ ID NO: 13 або послідовність SEQ ID NO: 14. Цим винаходом також запропоноване антитіло, яке зв'язує TGF-альфа та епірегулін, яке містить легкий ланцюг і важкий ланцюг, причому амінокислотна послідовність важкого ланцюга являє собою послідовність SEQ ID NO: 12. Крім того, цим винаходом запропоноване антитіло, яке зв'язує TGF-альфа і епірегулін, яке містить легкий ланцюг і важкий ланцюг, причому амінокислотну послідовність важкого ланцюга і амінокислотну послідовності легкого ланцюга вибирають з групи, яку складають: (і) важкий ланцюг, який являє собою послідовність SEQ ID NO: 12, і легкий ланцюг, який являє собою послідовність SEQ ID NO: 13, та (іі) важкий ланцюг, який являє собою послідовність SEQ ID NO: 12, і легкий ланцюг, який являє собою послідовність SEQ ID NO: 14. Цим винаходом запропоноване антитіло, яке зв'язує TGF-альфа та епірегулін, який містить два легкі ланцюги, причому амінокислотною послідовністю кожного легкого ланцюга є послідовність SEQ ID NO: 13, і два важкі ланцюги, причому амінокислотною послідовністю кожного важкого ланцюга є послідовність SEQ ID NO: 12. Цим винаходом запропоноване антитіло, яке зв'язує TGF-альфа та епірегулін, яке містить два легкі ланцюги, причому амінокислотною послідовністю кожного легкого ланцюга є послідовність SEQ ID NO: 14, і два важкі ланцюги, причому амінокислотною послідовністю кожного важкого ланцюга є послідовність SEQ ID NO: 12. Крім того, цим винаходом запропонований антигензв'язувальний фрагмент антитіла, яке розкрите у цьому описі. Цим винаходом також запропонована фармацевтична композиція, яка містить антитіло за цим винаходом, яке розкрите у цьому описі, і щонайменше один(-ну) фармацевтично прийнятний(-у) носій, розріджувач або допоміжну речовину. Крім того, цим винаходом запропонована фармацевтична композиція, яка містить антитіло за цим винаходом, яке розкрите у цьому описі, разом із щонайменше одним(-ією) фармацевтично прийнятним носієм, розріджувачем або допоміжною речовиною і, факультативно, іншими терапевтичними інгредієнтами. Цим винаходом також запропонований спосіб лікування діабетичної нефропатії у пацієнта, який включає введення пацієнту антитіла за цим винаходом, яке розкрите у цьому описі. Крім того, цей винахід пропонує антитіло за цим винаходом, яке розкрите у цьому описі, для застосування в терапії. За варіантом, якому віддають перевагу, цей винахід пропонує антитіло за цим винаходом, яке розкрите у цьому описі, для застосування в лікуванні діабетичної нефропатії. Крім того, цим винаходом запропоноване застосування антитіла за цим винаходом, яке розкрите у цьому описі, для виготовлення лікарського засобу для лікування діабетичної нефропатії. 3 UA 110051 C2 5 10 15 20 25 30 35 40 45 50 55 Цим винаходом також запропонований спосіб лікування діабетичної нефропатії у пацієнта, який включає введення пацієнту антитіла за цим винаходом, яке розкрите у цьому описі, в одночасній або послідовній комбінації зі стандартним веденням хворого. Крім того, цим винаходом запропоноване антитіло за цим винаходом, яке розкрите у цьому описі, для застосування в терапії, де вказане антитіло має бути введеним в одночасній або послідовній комбінації зі стандартним веденням хворого. За варіантом, якому віддають перевагу, цим винаходом запропоноване антитіло за цим винаходом, яке розкрите у цьому описі, для застосування в лікуванні діабетичної нефропатії, де вказане антитіло має бути введеним в одночасній або послідовній комбінації зі стандартним веденням хворого. Крім того, цим винаходом запропоноване застосування антитіла за цим винаходом, яке розкрите у цьому описі, для виготовлення лікарського засобу для лікування діабетичної нефропатії, де вказане антитіло має бути введеним в одночасній або послідовній комбінації зі стандартним веденням хворого. Цим винаходом також запропонована фармацевтична композиція, яка містить антигензв'язувальний фрагмент антитіла за цим винаходом, яке розкрите у цьому описі, і щонайменше один(-ну) фармацевтично прийнятний(-у) носій, розріджувач або допоміжну речовину. Крім того, цим винаходом запропонована фармацевтична композиція, яка містить антигензв'язувальний фрагмент антитіла за цим винаходом, яке розкрите у цьому описі, разом із щонайменше одним(-ією) фармацевтично прийнятним(-ою) носієм, розріджувачем або допоміжною речовиною і, за факультативним варіантом, іншими терапевтичними інгредієнтами. Цим винаходом також запропонований спосіб лікування діабетичної нефропатії у пацієнта, який включає введення пацієнту антигензв'язувального фрагменту антитіла за цим винаходом, яке розкрите у цьому описі. Крім того, цим винаходом запропонований антигензв'язувальний фрагмент антитіла за цим винаходом, яке розкрите у цьому описі, для застосування в терапії. За варіантом, якому віддають перевагу, цим винаходом запропонований антигензв'язувальний фрагмент антитіла за цим винаходом, яке розкрите у цьому описі, для застосування в лікуванні діабетичної нефропатії. Крім того, цим винаходом запропоноване застосування антигензв'язувального фрагмента антитіла за цим винаходом, яке розкрите у цьому описі, для виготовлення лікарського засобу для лікування діабетичної нефропатії. Цим винаходом також запропонований спосіб лікування діабетичної нефропатії у пацієнта, який включає введення пацієнту антигензв'язувального фрагмента антитіла за цим винаходом, яке розкрите у цьому описі, в одночасній або послідовній комбінації зі стандартним веденням хворого. Крім того, цим винаходом запропонований антигензв'язувальний фрагмент антитіла за цим винаходом, яке розкрите у цьому описі, для застосування в терапії, де вказаний антигензв'язувальний фрагмент має бути введеним в одночасній або послідовній комбінації зі стандартним веденням хворого. За варіантом, якому віддають перевагу, цим винаходом запропонований антигензв'язувальний фрагмент антитіла за цим винаходом, яке розкрите у цьому описі, для застосування в лікуванні діабетичної нефропатії, де вказаний антигензв'язувальний фрагмент має бути введеним в одночасній або послідовній комбінації зі стандартним веденням хворого. Крім того, цим винаходом запропоноване застосування антигензв'язувального фрагмента антитіла за цим винаходом, яке розкрите у цьому описі, для виготовлення лікарського засобу для лікування діабетичної нефропатії, де вказаний антигензв'язувальний фрагмент має бути введеним в одночасній або послідовній комбінації зі стандартним веденням хворого. Вказане стандартне ведення хворого для діабетичної нефропатії охоплює, але ними не обмежується, інгібітори АСЕ і блокатори рецепторів ангіотензину (ARBs). Загальна структура "антитіла" є дуже добре відомою в даній галузі. Для антитіла типу IgG, існує чотири амінокислотних ланцюги (два "важкі" ланцюги і два "легкі" ланцюги), які є перехресно зв'язаними за допомогою внутрішніх та міжланцюгових дисульфідних зв'язків. Антитіла, що мають немодифіковані людські послідовності Fc, коли вони експресовані у певних біологічних системах, глікозилуються на ділянці Fc. Антитіла можуть також бути глікозильованими у інших положеннях. Субодиничні структури і тривимірні конфігурації антитіл добре відомі в даній галузі. Кожний важкий ланцюг складається з N-кінцевої варіабельної ділянки важкого ланцюга ("HCVR") і константної ділянки важкого ланцюга ("HCCR"). Константна ділянка важкого ланцюга складається з трьох доменів (СН1, СН2 і СН3) у разі IgG, IgD та IgA, і 4 4 UA 110051 C2 5 10 15 20 25 30 35 40 45 50 55 доменів (СН1, СН2, СН3 і СН4) у разі IgM та IgE. Кожен легкий ланцюг складається з варіабельної ділянки легкого ланцюга ("LCVR") і константної ділянки легкого ланцюга ("LCCR"). Варіабельні ділянки кожної пари легкий/важкий ланцюг утворюють антигензв'язувальний центр антитіла. Вказані ділянки HCVR і LCVR можуть також підрозділятись на гіперваріабельні ділянки, які називають ділянками, що обумовлюють комплементарність ("CDR"), які перемежовуються більш консервативними ділянками, які називають каркасними ділянками ("FR"). Кожна з HCVR і LCVR складається з трьох CDR і чотирьох FR, розташованих від амінокінця до карбоксильного кінця в такому порядку: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. У цьому описі три CDRs важкого ланцюга позначають як "CDRH1, CDRH2 і CDRH3" і три CDR легкого ланцюга позначають як "CDRL1, CDRL2 і CDRL3". Вказані CDR містять більшість залишків, які утворюють специфічні взаємодії з антигеном. Розподіл амінокислот до кожного домену відповідає добре відомим номенклатурам [наприклад, Kabat, "Sequences of Proteins of Immunological Interest, " National Institutes of Health, Bethesda, Md. (1991)]. Антитіло за цим винаходом може мати константну ділянку важкого ланцюга, вибрану з будьякого класу імуноглобулінів (IgA, IgD, IgG, IgM та IgE). Крім того, антитіло за цим винаходом містить Fc-ділянку, що походить з Fc-ділянки людського IgG4 через його знижену здатність до зв'язування факторів комплементу в порівнянні з іншими підтипами IgG. Антитіло може бути одержаним з однієї копії або клону, у тому числі, наприклад, будь-якого еукаріотного, прокаріотного або фагового клону. За варіантом, якому віддають перевагу, антитіло за цим винаходом існує у однорідній або по суті однорідній популяції молекул антитіла. Непроцесоване антитіло містить повномірні або по суті повномірні константні ділянки, у тому числі Fc-ділянку. "Антигензв'язувальним фрагментом" такого антитіла є будь-яка скорочена форма антитіла, що містить антигензв'язувальну частину та зберігає антигензв'язувальну здатність. Такі скорочені форми включають, наприклад, Fab-фрагмент, Fab'-фрагмент або F(аb')2-фрагмент, що містить CDR або варіабельні ділянки розкритих антитіл. Окрім того, такі скорочені форми антитіла можуть бути одноланцюговим Fv-фрагментом, який можна одержати шляхом сполучення ДНК, що кодує LCVR та HCVR, з лінкерною послідовністю. (Дивись, Pluckthun, The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp 269-315, 1994). Термін "антитіло" не охоплює такі фрагменти, якщо не вказується інше. Антитіло за цим винаходом можна одержати із застосуванням методів, добре відомих у цій галузі, наприклад, технології рекомбінантних ДНК, методу фагового дисплею, методів синтезу або комбінацій таких методів чи інших методів, широко відомих у цій галузі. Антитіло за цим винаходом являє собою сконструйоване антитіло, яке було розроблено таким чином, щоб мати каркасні ділянки, шарнірні ділянки і константні ділянки людського походження, які є ідентичними або по суті ідентичними (практично людськими) каркасним ділянкам та константним ділянкам, одержаним з людських геномних послідовностей. Повністю людськими каркасними ділянками, шарнірними ділянками і константними ділянками є ділянки людських послідовностей зародкової лінії, а також послідовностей з природними соматичними мутаціями і ділянки із сконструйованими мутаціями. Антитіло за цим винаходом може містити каркасні, шарнірні або константні ділянки, одержані з повністю людської каркасної, шарнірної або константної ділянки, яка містить одну або декілька амінокислотних замін, делецій або додань. Крім того, антитіло за цим винаходом є практично неімуногенним в організмі людини. Різні людські каркасні послідовності можуть бути використані окремо або в комбінації як основа для антитіла за цим винаходом. За варіантом, якому віддають перевагу, каркасні ділянки антитіла за цим винаходом мають людське або по суті людське походження (щонайменше 95 %, 97 % або 99 % людське походження). Послідовності каркасних ділянок людського походження можна одержати з The Immunoglobulin Factsbook, by Marie-Paule Lafranc, Gerard Lefranc, Academic Press 2001, ISBN 012441351. Каркасна послідовність для антитіла за цим винаходом відіграє роль "донорної" варіабельної каркасної ділянки і може бути використана для створення додаткових антитіл з такими ж самими CDR, визначеними у цьому описі, з використанням методики, відомої у цій галузі. Крім того, каркасна послідовність для антитіла за цим винаходом може бути зіставлена з іншими відомими людськими каркасними послідовностями для одержання додаткових антитіл. Таким чином, ця інформація може бути використана для "зворотного мутування" іншої вибраної гомологічної людської каркасної ділянки до донорного амінокислотного залишку у цих положеннях. Крім того, будь-які "рідкісні" амінокислоти можуть бути виявлені у додаткових людських каркасних ділянках, завдяки чому у відповідному положенні може бути використаним консенсусний або донорний амінокислотний залишок. 5 UA 110051 C2 5 10 15 20 25 30 35 Терміни "TGF-альфа" або "людський TGF-альфа" означають людський білок TGF-альфа (послідовність SEQ ID NO: 18). Терміни "епірегулін" або "людський епірегулін" означають людський білок епірегуліна (послідовність SEQ ID NO: 33). Людський мет-епірегулін (послідовність SEQ ID NO: 22) використовується в цьому документі в in vitro експериментах. Посилання на здатність антитіл за цим винаходом, яке розкрите у цьому описі, до зв'язування або нейтралізування людського епірегуліну відноситься також до їх здатності зв'язувати і нейтралізувати людський метепірегулін в in vitro експериментах. Термін "пацієнт" означає ссавця, за варіантом, якому віддають перевагу, людину. Термін "лікування" (або "лікувати") означає уповільнення, зупинення, зменшення або звертання розвитку або тяжкості симптомів, розладу, стану або захворювання. Термін "терапевтично ефективна кількість" означає кількість або дозу антитіла за цим винаходом, які, при введенні пацієнтові однією або декількома дозами, забезпечують необхідне лікування. Наведені далі приклади можуть бути виконані по суті так, як описано нижче. ПРИКЛАДИ Приклад 1: Виготовлення антитіл Антитіло І і Антитіло II можна одержати і очистити так, як наведено нижче. Відповідну лінію клітини-хазяїна, наприклад, НЕK 293 або СНО, тимчасово або стабільно трансфекують експресійною системою для секретування антитіл із застосуванням оптимального попередньо визначеного співвідношення векторів HC:LC або одновекторною системою, яка кодує як НС, такі як послідовність SEQ ID NO: 15, так і LC, такі як послідовність SEQ ID NO: 16 або послідовність SEQ ID NO: 17. Просвітлене середовище, до якого було секретовано антитіло, очищають із застосуванням будь-якого з численних традиційних методів. Наприклад, середовище можна зручно завантажити у колонку Protein А або G, врівноважену сумісним буфером, таким як забуферений фосфатом фізіологічний розчин (рН7,4). Вказану колонку промивають для видалення компонентів неспецифічного зв'язування. Зв'язане антитіло елююють, наприклад, градієнтом рН (наприклад, від 0,1 Μ натрійфосфатного буферу (рН6,8) до 0,1 Μ натрійцитратного буферу (рН2,5)). Фракції антитіла виявляють, наприклад, із застосуванням SDS-PAGE (електрофорез у поліакриламідному гелі у присутності додецилсульфату натрію), після чого змішують. Подальше очищення є факультативним, у залежності від передбачуваного застосування. Антитіло може бути сконцентроване та/або відфільтроване за стерильних умов із застосуванням традиційних методів. Розчинні агрегати і мультимери можуть бути ефективно видалені із застосуванням традиційних методів, у тому числі шляхом гель-хроматографування за розміром молекул, гідрофобного хроматографування, іонообмінного хроматографування або хроматографування на гідроксиапатитній адсорбційній колонці. Ступінь чистоти антитіла після згаданих етапів хроматографування перевищує 99 %. Вказаний продукт може бути негайно замороженим при температурі -70 °C або може бути підданий ліофілізації. Нижче наведені амінокислотні послідовності цих антитіл. 40 Послідовності (SEQ ID Nos) антитіл Антитіло I II III Антитіло І II III 45 50 Важкий ланцюг 12 12 31 HCDR1 1 1 1 HCDR2 2 2 2 Легкий ланцюг 13 14 32 HCDR3 3 3 3 LCDR1 4 4 4 HCVR 7 7 8 LCDR2 5 5 5 LCVR 9 10 11 LCDR3 6 6 6 Приклад 2: Визначення зв'язувальної спорідненості антитіла І поверхневим плазмонним резонансом (ВІАсоrе) Дослідження методом поверхневого плазмонного резонансу здійснюють із застосуванням установки Віасоге Т2000 (ВІАcore® АВ, Upsala, Sweden), реактивів та програми Віасоrе Т2000 Evaluation Software Ver 4.1. Чіп СМ5 готують за розробленим виробником методом сполучення аміногруп із застосуванням активації за допомогою EDC/NHS. Поверхню всіх чотирьох протокових кювет активують шляхом введення суміші (1:1) EDC/NHS протягом 7хв зі швидкістю 10 мкл/хв. Козяче антилюдське Fc специфічне антитіло розводять до 50 мкг/мл в 10 мМ 6 UA 110051 C2 5 10 15 20 25 30 35 розчині ацетатного буферу (рН 4,0), та іммобілізують з розрахунку приблизно 10000 RU (реакційних одиниць) на всіх чотирьох протокових кюветах шляхом введення протягом 7 хв зі швидкістю потоку 10 мкл/хв. Сайти, що не прореагували, блокують шляхом введення етаноламіну протягом 7 хв зі швидкістю потоку 10 мкл/хв. Введення гліцину (3 × 20 с, рН 1,5, швидкість потоку 30мкл/хв) застосовують для видалення нековалентно сполученого білку. Протоковим буфером є розчин HBS-EP [10 мМ розчин HEPES, 150 мМ розчин хлориду натрію, 3 мМ розчин EDTA, 0,005 % розчин полісорбату 20]. При проведенні дослідження 1, антитіло І розбавляють до 50 мкг/мл у протоковому буфері і приблизно 400-600 RU іммобілізують в протоковій кюветі 2. Людський TGF-альфа (послідовність SEQ ID NO: 18), пацючий TGF-альфа (послідовність SEQ ID NO: 20), людський мет-епірегулін (послідовність SEQ ID NO: 22) та епірегулін макак-крабоїдів (послідовність SEQ ID NO:24) розбавляють від 100 мкг/мл до 200 нМ у протоковому буфері, після чого піддають двократному послідовному розведенню в протоковому буфері до 6,25 нМ. Мишачий епірегулін (послідовність SEQ ID NO: 23) розбавляють від 100 мкг/мл до 4мкМ в протоковому буфері, після чого піддають двократному послідовному розведенню в протоковому буфері до 125 нМ. Протягом 300 с при швидкості потоку 30 мкл/хв здійснюють введення ліганду у кожній концентрації з повторенням, з подальшою фазою дисоціації. Тривалість фази дисоціації становить 1800 с для людського і пацючого TGF-альфа, 1200 с для людського епірегуліну і епірегуліну макак-крабоїдів, і 120 с для мишачого епірегуліну. Регенерацію здійснюють шляхом введення 10 мМ розчину гліцину (рН 1,5, 3 × 20 с при швидкості потоку 30 мкл/хв) до всіх протокових кювет. При проведенні дослідження 2, антитіло III розбавляють до 100 мкг/мл в протоковому буфері і приблизно 400-600 RU іммобілізують в протоковій кюветі 2. Мишачий TGF-альфа (послідовність SEQ ID NO:19) розбавляють від 100 мкг/мл до 200 нМ у протоковому буфері, після чого піддають двократному послідовному розведенню в протоковому буфері до 6,25 нМ. Мишачий епірегулін (послідовність SEQ ID NO: 23) розбавляють від 100 мкг/мл до 4 мкМ в протоковому буфері, після чого піддають двократному послідовному розведенню в протоковому буфері до 125 нМ. Протягом 300 с при швидкості потоку 30 мкл/хв здійснюють введення ліганду у кожній концентрації з повторенням, з подальшою фазою дисоціації. Тривалість фази дисоціації становить 1800 с для мишачого TGF-альфа і 120 с для мишачого епірегуліну. Регенерацію здійснюють шляхом введення 10 мМ розчину гліцину (рН 1,5, 3 × 20 с при швидкості потоку 30 мкл/хв) до всіх протокових кювет. Дані (мінус еталонні значення) збирають як Fc2-Fc1. Результати вимірювань визначають при температурі 25 °C. Швидкість асоціації (kon) і швидкість дисоціації (ko) для кожного ліганда оцінюють із застосуванням моделі "1:1 (ленгмюрівського (Langmuir)) зв'язування". Спорідненістю (KD) обчислюють, виходячи з кінетики зв'язування відповідно до співвідношення: KD = ko/kоn. Таблиця 1 Параметри зв'язування для антитіла І Ліганд Вид Людський Пацючий Епірегулін Людський Макак-крабоїдів Мишачий Обчислено як KD= ko/kon TGF-альфа Швидкість асоціації -1 -1 (ko (M c ) (± SD (середнє квадратичне відхилення)) 5 4,18±0,28 × 10 5 3,78±0,39 × 10 5 4,91±0,42 × 10 5 6,73±0,71 × 10 4 4,10±1,15 × 10 7 Швидкість дисоціації -1 (ko) (с ) (±SD) -5 4,09±0,96 × 10 -5 2,66±0,74 × 10 -4 6,31±0,55 × 10 -4 7,05±0,23 × 10 -2 1,33±0,16 × 10 Спорідненість (KD) (±SD) 97,6±20,6 пМ 70,5±19,4 пМ 1,29±0,03 нМ 1,05±0,09 нМ 342±136 нМ UA 110051 C2 Таблиця 2 Параметри зв'язування для антитіла III Ліганд Мишачий TGF-альфа Мишачий епірегулін Обчислено як KD = ko/kon 5 10 15 20 25 30 35 40 45 Швидкість асоціації -1 -1 (kon) (M c ) (±SD) 5 5,41±0,50 × 10 4 6,55±0,38 × 10 Швидкість дисоціації (ko) -1 (с ) (±SD) -5 2,02±0,54 × 10 -2 1,41±0,09 × 10 Спорідненість (KD) (±SD) 38,0±13,6 пМ 215±15 нМ Антитіло І зв'язується з людським TGF-альфа і людським епірегуліном зі спорідненістю близько 98 пМ і 1,3 нМ, відповідно. Антитіло І також зв'язується з пацючим TGF-альфа і мишачим епірегуліном зі спорідненістю від приблизно 70 пМ до 340 нМ, відповідно. Крім того, антитіло І зв'язується з епірегуліном макак-крабоїдів зі спорідненістю приблизно 1 нМ. Антитіло III зв'язується з мишачим TGF-альфа і мишачим епірегуліном зі спорідненістю приблизно 38 пМ і 220 нМ, відповідно. Таким чином, антитіло І і антитіло III за цим винаходом мають високу спорідненість до людського TGF-альфа і людського епірегуліну. Приклад 3: Інтерналізації EGF-цільових лігандів в клітинній лінії НТ-29 карциноми товстої кишки людини Кон'югування Alexa Fluor® 488 з антитілами Alexa Fluor® 488 кон'югують з антитілом І і контрольним IgG відповідно до методики виробника. Білки розбавляють до 2 мг/мл у PBS. До 0,5 мл цього розчину, з концентрацією білка 2 мг/мл, додають 50 мкл 1 Μ розчину бікарбонату натрію (рН 9). Після цього розчин білку переносять у флакон з барвником, і перемішують при кімнатній температурі протягом 1 год. Мічений білок очищають за допомогою смоли Bio-Rad BioGel Р-30, яка входить до складу маркувального набору. In vitro аналіз інтерналізації При проведенні дослідження 1, 10000 клітин лінії НТ-29 (лінія клітин аденокарциноми ободової кишки, що експресує TGF-альфа і епірегулін) висівають в кожну лунку 96-лункового планшету і інкубують протягом ночі в живильному середовищі повного складу [модифіковане за способом Дульбекко середовище Ігла/середовище F12 (Наm) (1:1) ("DMEM/F12"), що містить Lглутамін, 10 % інактивованої нагріванням зародкової бичачої сироватки ("FBS"), 1 × антибіотик і розчин (2,438 г/л) бікарбонату натрію]. Наступного дня клітини промивають PBS (забуферений фосфатом фізіологічний розчин), який містить 0,1 % BSA (бичачий сироватковий альбумін), після чого інкубують з Alexa Fluor® 488-кон'югованим антитілом І або контрольним IgG в PBS з 0,1 % BSA при концентраціях від 0 мкг/мл до 88 мкг/мл протягом 2 год. при температурі 37 °C в інкубаторі для культур тканин. Після періоду інкубації клітини декілька разів промивають у PBS з 0,1 % BSA, після чого фіксують в 4 % розчині формальдегіду для аналізів. Кількісне визначення інтерналізації робиться таким чином: 500 клітин/лунку збирають за допомогою Cellomics ArrayScan VTI (компанія Thermo Scientific). Аналіз зображень здійснюють за допомогою програми "Compartment a1 analysis", призначеної для біологічного використання системи. Ядра клітин ідентифікують за допомогою барвника Hoechst (синій). Дві ділянки інтересу (ROI) встановлюють для збирання флуоресцентних сигналів з внутрішньоклітинних плям (червоні) і загальної зеленої флуоресценції (червоної і синьої), одержаних із замаскованого зображення. Обчислюють кількість, площу та інтенсивність флуоресценції від кожної плями і клітини. Для визначення інтерналізації, індукованої антитілом І, вибирають середню сумарну інтенсивність флуоресценції внутрішньоклітинних плям (червоних). При проведенні дослідження 2, 10000 клітин лінії НТ-29 одержують, як описано вище, і до клітин, з розрахунку 40 мкг/мл, додають Alexa Fluor® 488-кон'юговане антитіло І або контрольний IgG в PBS, що містить 0,1 % BSA. Клітини інкубують при температурі 37 °C в інкубаторі для культури тканин протягом різних періодів часу від 0 хв до 120 хв, після чого декілька разів промивають у PBS, що містить 0,1 % BSA, і фіксують в 4 % розчині формальдегіду для аналізів. Кількісне визначення сигналу здійснюють по суті так, як описано вище. 8 UA 110051 C2 Таблиця 3а Дослідження 1 - Середня сумарна інтенсивність кільцевої флуоресценції Доза (мкг/мл) 88 44 22 Контрольний IgG 2440±199 1808±207 1763±68 Антитіло І 24809±4343 17451±217 15135±131 Середнє ± SEM (середня квадратична помилка середнього) 11 1391±76 11516±54 5,5 1357±63 8474±269 Таблиця 3b Дослідження 1 - Середня сумарна інтенсивність кільцевої флуоресценції Доза (мкг/мл) Контрольний IgG Антитіло І Середнє ± SEM 5 2,75 1570±70 6503±262 1,38 1473±7 4349±186 0,69 1483±90 3440±96 0,34 1407±41 2432±62 0 1630±155 1460±84 За результатами аналізу зображень з дослідження 1 встановлено, що флуоресцентний сигнал інтерналізувався клітинами і був дозозалежним у разі антитіла І, але не у разі контрольного IgG (Таблиця 3а і Таблиця 3b). Таблиця 4 Дослідження 2 - Середня сумарна інтенсивність кільцевої флуоресценції Час після додання (хв) Контрольний IgG Антитіло І Середнє ± SEM 10 15 20 25 30 35 120 177±29 4449±866 60 167±23 4131±688 30 124±10 1494±66 15 126±18 717±72 5 116±4 261±17 0 94±11 89±1 Результати дослідження 2 показали, що антитіло І інтерналізувалось швидко і інтерналізація була завершена через 2 год. після додання до клітин (Таблиця 4). Антитіло І індукувало інтерналізацію мішені клітинами лінії НТ-29 in vitro часозалежним чином (Таблиця 4). Приклад 4: Визначення нейтралізації проліферації клітин, стимульованих лігандом EGFR, в клітинній лінії міофібробластів Клональна клітинна лінія мишачих міофібробластів ("MFc7") використовується для перевірки здатності антитіл за цим винаходом до блокування проліферативної активності лігандів EGFR. Сімома лігандами, які можуть активувати EGFR, є TGF-альфа (TGFA), епірегулін (EREG), EGF, гепаринзв'язувальний EGF (HB-EGF), епіген (EPGN), амфірегулін (AREG) і бетацелюлін (ВТС). Ліганди EGFR поділяють спільний структурний фрагмент, EGF-подібний домен, який характеризується трьома внутрішньомолекулярними дисульфідними зв'язками, які сформовані шістьма розташованими на однаковій відстані один від одного залишками цистеїну, які зберігаються. Проліферативна активність визначається включенням бромдезоксиуридину ("BrdU") і вимірюється із застосуванням колориметричного набору BrdU ELISА відповідно до інструкцій виробника. По-перше, 2000 клітин лінії МРс7/лунку висівають на оброблений культурою тканин 96лунковий мікропланшет на модифіковане за способом Дульбекко середовище Ігла/середовище F12 (Наm) (1:1) ("DMEM/F12"), що містить L-глутамін, 10 % інактивованої нагріванням зародкової бичачої сироватки ("FBS"), 1 × антибіотик і розчин (2,438 г/л) бікарбонату натрію. Клітинам надавали можливість прикріплення протягом 6 год., після чого середовище видаляли і замінювали на 0,1 мл безсироваткового середовища DMEM/F12, яке містить 0,1 % BSA, для культивування клітин на безсироватковому середовищі протягом ночі. Наступного дня послідовні розведення лігандів EGFR здійснюють за допомогою безсироваткового середовища, що містить 0,1 % BSA, на 96-лункових поліпропіленових планшетах в об'ємі 0,12 мл/лунку з концентрацією від 0,001 нг/мл до 3000 нг/мл. Після розведення, середовище з клітин, що знаходились у безсироватковому середовищі, видаляють з їх подальшим стимулюваннням лігандом EGFR протягом 24 год. Після стимуляції, клітини імпульсно мітять BrdU впродовж 4 9 UA 110051 C2 5 10 год., після чого аналізують із застосуванням колориметричного набору BrdU ELISA відповідно до інструкцій виробника. При перевірці специфічності антитіла І до лігандів EGFR, послідовні розведення 2 або 3 антитіла здійснюють на 96-лункових поліпропіленових планшетах в об'ємі 0,06 мл/лунку з концентрацій від 3000 нМ до 0,059 нМ. Після послідовних розведень антитіла, в кожну лунку додають 0,06 мл ліганда EGFR. Потім планшет інкубують протягом 30 хв при температурі 37 °C у інкубаторі із зволоженням культури тканин. Після інкубації у кожну лунку до клітин переносять 0,1 мл розчину. Клітини стимулюють протягом 24 год. Після стимуляції клітини імпульсно мітять BrdU протягом 4 год., після чого аналізують із застосуванням колориметричного набору BrdU ELISA. Значення оптичної густини (450 нм - 690 нм) визначають за допомогою планшет-рідеру SpectraMax 190 (компанія Molecular Devices), і дані аналізують. Таблиця 5 Аналіз клітин лінії MFc7 Ліганд EGFR Діапазон ЕС50 (пМ) ІС50 (нМ) Антитіло І ІС50 (нМ) Антитіло III a Людський TGF-альфа 11-12 0,46±0,03 0,52±0,04 Людський епірегулін 78-282 3,15±1,04 1,12±0,36 b Людський епіген 3797-18987 807±577 nd b Людський EGF 0,3-2,4 > 2000 nd b Людський HBEGF 30-39 > 2000 nd b Людський бетацелюлін 1,8-3,2 > 2000 nd b Людський амфірегулін 273-2727 > 2000 nd Пацючий TGF-альфа 13-13,8 0,19±0,06 0,13±0,01 Мишачий епірегулін 163-320 334±41 214±49 а Людські ліганди EGFR при випробуванні антитіла І мали концентрацію 0,5 нМ, за виключенням амфірегуліну (60 нМ) та епігену (100 нМ) Пацючий TGF-альфа і мишачий епірегулін застосовувались з концентрацією 0,5 нМ b nd, не визначено 15 20 25 30 35 40 За результатами вказаного аналізу встановили, що мишачий епірегулін і пацючий TGFальфа, а також всі людські ліганди EGFR, за винятком епігену і амфірегуліну, є сильнодіючими стимуляторами проліферації клітин (Таблиця 5). Антитіло І і антитіло III мають високу спорідненість до людського і пацючого TGF-альфа та мають високу активність по відношенню до людського епірегуліну (Таблиця 5). У Таблиці 5 підсумовані обчислені значення ЕС50 для випробуваних лігандів EGFR і абсолютні значення ІС50 для антитіл до вказаних лігандів. Обчислена середня ІС 50 для антитіла І дорівнювала 0,46±0,03 нМ для людського TGF-альфа і 3,15±1,04нМ для людського епірегуліну. Обчислена середня ІС50 для антитіла III дорівнювала 0,52±0,04 нМ для людського TGF-альфа і 1,12±0,36нМ для людського епірегуліну. Обчислене середнє значення ІС 50 для антитіла III дорівнювало 0,13±0,01 нМ для пацючого TGF-альфа і 214±49 нМ для мишачого епірегуліну. Таким чином, антитіло І і антитіло III мають високу спорідненість до людського TGF-альфа і людського епірегуліну, і є селективними з повною нейтралізуючою активністю проти людського TGF-альфа і людського епірегуліну. Приклад 5: Функція і патологія нирок на мишачій моделі (із залишком нирки) гіпертензії ниркового походження Мишача модель із залишком нирки, яка включає хірургічне видалення 75 % загальної маси нирки, використовується як доклінічна модель гіпертензії ниркового походження. [Ma LJ, Fogo AB. Kidney Int. 2003 Jul;64(1):350-5]. Хірургічному видаленню ниркової тканини або фіктивній операції піддають 129 мишей-самців лінії Svev у віці 9-10 тижнів. Довільний розподіл на групи з 12 мишей здійснюють через 2 тижні після операції за співвідношенням альбумін/креатинін ("ACR") і масою тіла. Ізотиповий контрольний IgG (10 мг/кг) або антитіло III (1 мг/кг і 10 мг/кг) вводять підшкірним шляхом після довільного розподілу, і продовжують здійснювати введення один раз на тиждень до 16-го тижня після операції. Ціллю дослідження є визначення таких показників як виживаність, систолічний кров'яний тиск, альбумінурія, сироватковий креатинін, сироватковий BUN, сечовий TGF-альфа, сечовий МІР-2 (макрофагальний запальний протеїн-2) і ниркова патологія. 10 UA 110051 C2 5 10 15 20 25 30 35 40 45 50 55 На прикінці цього дослідження було зареєстровано 3 смерті в групі, яка одержувала контрольний IgG (25 % смертність), та не було смертельних випадків в групах, які одержували антитіло III. Визначення систолічного кров'яного тиску Кров'яний тиск вимірюють через 12 тижнів після операції методом хвостової манжети. Відібраних мишей з кожної групи (N=3-4 на групу) призвичаюють до обмеження рухів шляхом розміщення їх в утримувачі мишей з хвостовою манжетою, яка прикріплюється до хвоста на 5 хв кожного дня, за 3-5 днів до фактичного вимірювання тиску. Температура кімнати з обладнанням підвищується до 24 °C для забезпечення додаткового тепла в процесі збирання даних з кров'яного тиску. Мишей вміщують у пристрій для фіксування, і встановлюють на верхній частині пристрою для підігрівання подушечок лапок (температура 31-33°С), щоб забезпечити розширення судинної мережі хвоста. Хвіст пропускають через хвостову манжету, і кожну мишу знерухомлюють впродовж приблизно 30 хв, але не більше 45 хв. Цей період часу включає в себе початкове нагрівання і вимірювання тиску з подальшим негайним поверненням до місця спільного знаходження тварин. Анестезія не використовується. Хвостова манжета надувається, щільно стискаючи хвіст достатньою мірою для миттєвого переривання артеріального кровотоку, з подальшим поступовим випусканням повітря з манжети і спостереженням за відновленням повернення артеріального пульсу. При відновленні артеріального пульсу, манжету повністю спускають. Вимірювання альбумінурії Сечу збирають кожні 4 тижні в камері для дослідження метаболізму (компанія Nalgene) протягом 24 год. Кожна миша (окремо розміщена) отримує корм і воду протягом 24 год. процесу збирання сечі. Наприкінці 24-годинного періоду зібрану сечу поміщають на лід, центрифугують і піддають аналізу на альбумін і креатинін. Альбумінурія визначається як відношення кількості альбуміну в сечі до кількості креатиніну в сечі (мкг/мг). Сироватковий креатинін і BUN (азот сечовини крові) На кінець дослідження сироватку, яка була одержана шляхом пункції серця, аналізують на BUN і креатинін. TGF-альфа і МІР-2 ELISA Сечу, яка була одержана впродовж 24 год. збирання, концентрують (5) шляхом центрифугування з використанням мембрани з 3К смугою пропускання при 14000g протягом 30 хв. Проводять сендвіч-ELISA (твердофазний імуноферментний аналіз) на мишачий TGF-альфа. Пацючий TGF-альфа використовують як стандарт. 96-лункові полістиролові планшети сенсибілізують 3 мкг/мл антитіла III протягом ночі при температурі 4 °C. Планшети промивають, блокують блокувальним буфером, знову промивають, після чого додають концентровані зразки сечі. Через 2 год. при кімнатній температурі планшети промивають, після чого додають "друге" біотиніловане поліклональне анти-hTGF-альфа антитіло. Через 2 год. при кімнатній температурі планшети промивають, і інкубують зі стрептавідином-HRP (пероксидаза хрону) протягом 30 хв. Сигнал генерують за допомогою ТМВ-субстрату, і зупиняють реакцію доданням 2н розчину H2SO4. Наявний у продажу набір Quantikine® sandwich-ELISA для мишачого макрофагального запального протеїну-2 (МІР-2, еквівалент людського IL-8) застосовують для виявлення сечового МІР-2 відповідно до інструкцій виробника. Дані оптичної густини для обох твердофазних імуноферментних аналізів одержують за допомогою планшет-рідеру SpectraMax 190 (компанія Molecular Devices), і вказані дані аналізують. Патологія нирок Залишки нирок після закінчення дослідження видаляють, фіксують у формаліні і обробляють парафіном для секціонування у відповідності зі стандартною методикою. Зрізи нирок оцінюються на ураження патологоанатомом. Рівень білка тубуліна, збільшення об'єму мезангіальної матриці та ступінь інтерстиціального фіброзу піддають напівкількісній оцінці за наведеною нижче шкалою: немає (0), мінімальний(-е) (1), невеликий(-е) (2), помірний(-е) (3), явно виражений(-е) (4) і тяжкий(-е) (5). Збільшення об'єму гломерулярних мезангіальних клітин і потовщення базальної мембрани оцінюють на зрізах, забарвлених гематоксиліном та еозином ("Н&Е"), і періодичною обробкою кислотою і шифовою основою ("PAS"). Зрізи нирок, забарвлені трихромом за методом Массона, оцінюють для визначення ступеню фіброзу (інтерстиціального і гломерулярного). Статистичні методи Всі дані аналізують із застосуванням програмного забезпечення JMP ν.8.0 (компанія SAS Institute). Оцінку патологічних змін у балах піддають статистичній обробці шляхом аналізу спряженості ознак і точного критерію Фішера. Усі інші дані оцінюються шляхом дисперсійного 11 UA 110051 C2 аналізу з log-трансформованими даними і непарним t-критерієм Стьюдента. Статистично значущим вважається р-значення
ДивитисяДодаткова інформація
Назва патенту англійськоюNormal;heading 1;heading 2;heading 3;antibody that binds tgf-alpha and epiregulin
Автори англійськоюBeidler, Catherine, Brautigam, Heuer, Josef Georg, Petrovan, Ramona Judita
Назва патенту російськоюАнтитело, связывающее tgf-альфа и эпирегулин
Автори російськоюБэйдлэр Кэтрин Бротигем, Хойер Йозеф Георг, Петрован Рамона Джудита
МПК / Мітки
МПК: C07K 16/22, A61P 7/12
Мітки: антитіло, епірегулін, зв'язує, tgf-альфа, яке
Код посилання
<a href="https://ua.patents.su/49-110051-antitilo-yake-zvyazueh-tgf-alfa-ta-epiregulin.html" target="_blank" rel="follow" title="База патентів України">Антитіло, яке зв’язує tgf-альфа та епірегулін</a>