Спосіб вітрифікації ембріонів в’юна
Номер патенту: 93023
Опубліковано: 27.12.2010
Автори: Міксон Костянтин Борисович, Копєйка Євгеній Федорович, Грищенко Валентин Іванович
Формула / Реферат
Спосіб вітрифікації ембріонів в'юна, який включає інкубацію ембріонів в кріозахисному середовищі, що містить кріопротектор 1,2-пропандіол, і накапування ембріонів з кріозахисним середовищем на заздалегідь охолоджену мідну пластину, який відрізняється тим, що 1,2-пропандіол беруть в концентрації 20 %, в кріозахисне середовище додатково вводять 30 % сахарози, 10 % етиленгліколю і 3 % поліетиленоксиду-1500, інкубацію проводять протягом 30 хв., а мідну пластину заздалегідь охолоджують до -110 ¸ -176 °С.
Текст
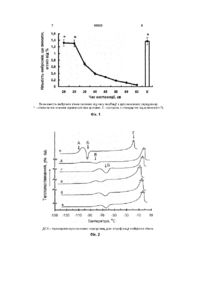
Спосіб вітрифікації ембріонів в'юна, який включає інкубацію ембріонів в кріозахисному середовищі, що містить кріопротектор 1,2пропандіол, і накапування ембріонів з кріозахисним середовищем на заздалегідь охолоджену мідну пластину, який відрізняється тим, що 1,2пропандіол беруть в концентрації 20 %, в кріозахисне середовище додатково вводять 30 % сахарози, 10 % етиленгліколю і 3 % поліетиленоксиду1500, інкубацію проводять протягом 30 хв., а мідну пластину заздалегідь охолоджують до -110 176°С. Винахід належить до галузі кріобіології і може бути використаний в промисловому рибництві для різних видів риб. Вітрифікація є єдиним способом, що дозволяє зберігати ембріони риб. На сьогоднішній день нам не відомі способи вітрифікації ембріонів в'юна. Існує спосіб вітрифікації ембріонів даніо pepio (Brachidanio rerio) [1]. Ембріони даніо реріо на стадії розвитку, відповідної утворенню 6 сомітов, інкубують в розчині метанолу (Мет) з концентрацією 12% протягом 40 хв, потім поміщають на золоту решітку і занурюють в рідкий азот (-196°С). Недоліком цього способу є те, що вітрифікуєтся 80% ембріонів, а після відігрівання ембріони зберігають морфологічну інтактність менше 20 хв. Існує спосіб вітрифікації ембріонів ліня (Tinea tinea) [2]. Ембріони ліня на стадії розвитку 29 годин, відповідної початку биття серця, інкубують протягом 40-60 хв у кріозахисному середовищі, що складається з 20% 1,2-пропандіола (ПД) і 20% Мет. Потім поміщають в пластикові трубочки об'ємом 0,5 мл і занурюють в рідкий азот. Недоліком цього способу є те, що кількість вітрифікованих ембріонів менше 40%, а при відігріванні всі ембріони гинуть. Найбільш близьким до заявленого є спосіб вітрифікації ембріонів морського карася (Pagrus major) [3]. Згідно з цим способом ембріони на стадії розвитку, відповідної початку биття серця, інкубують протягом 10,5 хв у кріозахисному середовищі, що складається з 20,5% диметилсульфоксиду (ДМСО), 15,5% ацетаміду (АА), 10% 1,2-ПД і 6% поліетіленгліколю (ПЕГ). Після цього ембріони в кількості 1-3 шт. разом з кріозахисним середовищем набирають мікропіпеткою (об'єм 0,005-0,01 см3) і накапують на мідну пластину, охолоджену до -196°С. Недоліком цього способу є те, що вітрифікуєтся до 77,8% ембріонів, а після відігрівання ембріони гинуть протягом 60 хв. Загибель пов'язана з недостатнім насиченням ембріонів кріопротекторами і подальшою кристалізацією при заморожуванні. (19) UA (11) 93023 (13) C2 (21) a201005048 (22) 26.04.2010 (24) 27.12.2010 (46) 27.12.2010, Бюл.№ 24, 2010 р. (72) МІКСОН КОСТЯНТИН БОРИСОВИЧ, КОПЄЙКА ЄВГЕНІЙ ФЕДОРОВИЧ, ГРИЩЕНКО ВАЛЕНТИН ІВАНОВИЧ (73) ІНСТИТУТ ПРОБЛЕМ КРІОБІОЛОГІЇ І КРІОМЕДИЦИНИ НАЦІОНАЛЬНОЇ АКАДЕМІЇ НАУК УКРАЇНИ (56) Liu X.H., Zhang Т., Rawson D.M. Feasibility of vitrification of zebrafish (Danio rerio) embryos using methanol // Cryo-Letters.- 1998.- № 19.-P. 309-318. El-Battawy K.A., Linhart 0. Preleminary studies on cryopreservation of common tench (Tinea tinea) embryos (Work in progress) // Journal of Fisheries Intemational.-2008.-Vol. 3, № 1. -P. 12-18. Ding F.H., Xiao Z.Z. Li J. Preliminary studies on the vitrification of red sea bream (Pagrus major) embryos // Theriogenology,- 2007.- Vol. 68, № 5.-P. 702-708. RU 2317703, A01K61/00, A01N1/02, 27.02.2008 3 В основу винаходу поставлено задачу створення такого способу вітрифікації ембріонів в'юна, в якому б, шляхом зміни умов інкубації ембріонів з кріозахисним середовищем і заморожування, забезпечувалася можливість підвищення кількості вітрифікованих ембріонів і їх переживаності після відігрівання. Ця задача вирішується тим, що в способі вітрифікації, який включає інкубацію ембріонів у кріозахисному середовищу, що містить кріопротектор 1,2-ПД, і накапування ембріонів з кріозахисним середовищем на заздалегідь охолоджену мідну пластину, згідно з винаходом, 1,2-ПД беруть в концентрації 20%, у кріозахисне середовище додатково вводять 30% сахарози, 10% етилгліколю (ЕГ) і 3% поліетиленоксиду-1500 (ПЕО-1500), інкубацію проводять протягом 30 хв, а мідну пластину заздалегідь охолоджують в парах рідкого азоту до110 -176°С. Збільшення концентрації 1,2-ПД дозволяє скоротити час інкубації і тим самим знизити токсичну дію інших кріопротекторів. Зміна складу кріозахисного середовища і часу інкубації в ній ембріонів дозволяють створити умови, при яких кріопротектори ЕГ, ПЕО-1500 і сахароза не ушкоджують ембріони. Кріопротектори ЕГ і 1,2-ПД є токсичними для ембріонів риб при інкубації більше 10 хв. Сахароза в концентрації 30% знижує токсичність ЕГ і 1,2-ПД, узятих в концентраціях 10 і 20%, відповідно, що дозволяє інкубувати ембріони до 30 хв, не знижуючи рівня їх виживаності. Різнорідність ембріональних структур не дозволяє досить повно і швидко наситити ембріони кріопротекторами. Кріопротектору ПЕО-1500, узятому в концентрації 3%, досить для розпушування мембранних комплексів і повнішого насичення ембріонів кріопротекторами і їх обезводнення. Заздалегідь охолоджена до -110 -176°С мідна пластина дозволяє збільшити швидкість охолоджування краплі кріозахисного середовища з ембріоном і цим запобігти процесу кристалізації. Таким чином, заявлені умови інкубації і заморожування дають можливість підвищити кількість вітрифікованих ембріонів до 100% і збільшити час переживаності після відігрівання до 6-14 годин. Спосіб здійснюють таким чином. Ембріони в'юна на стадії розвитку, відповідної биттю серця, поміщають на 30 хв у кріозахисне середовище, що складається з 30% сахарози, 10% ЕГ, 3% ПЕО-1500 і 20% 1,2-ПД, і інкубують протягом 30 хв. Після інкубації ембріони з кріозахисним середовищем за допомогою мікропіпетки (об'єм 10-20 мкл) накапують на мідну пластину, заздалегідь охолоджену до -110 -176°С, і після вітрифікації поміщають в рідкий азот, де зберігають при 196°С. Вітрифіковані ембріони визначають візуально. Ембріони білого кольору - що закристалізовувалися, вітрифіковані - прозорі [4]. Приклад 1. У лабораторних умовах зрілі яйця в'юна отримували введенням самкам хімічно чистого препарату хоріонічного гонадотропного гормону «Прегніл» (виробництво "Н.В. Органон", Нідерланди) [5]. Залежно від розміру самки його вводили внутрішньом'язово від 100 до 250 ME. При температурі 21°С овуляція наставала через 93023 4 24 години, і самка ставала текучою. У нормі самців не ін'єктували. Текучу сперму отримували при необхідності, ін'єктуючи самців описаним вище способом дозою гормону 100 150 ME. Для здобуття ембріонів до статевих продуктів самок і самців підливали трохи води і приводили ікру і сперму в контакт. Потім запліднену ікру переносили порціями по 300 ікринок в чашки Петрі і поміщали в термостат для інкубації при 21°С, рН 7,2, dGH 6,7 міліграм екв/л. Воду міняли 3-4 рази на добу. Незапліднені бліді ікринки і ембріони, що зупинилися в розвитку, видаляли із загальної групи. Стадії розвитку ембріонів визначали під мікроскопом МБС-9 відповідно до карт ембріонального розвитку в'юна [6]. Корекцію стадій розвитку здійснювали по стандартній методиці [7]. Ембріони на стадії розвитку, відповідної биттю серця, поміщали в кріозахисне середовище, що складається з 30% сахарози, 10% ЕГ, 3% ПЕО1500 і 20% 1,2-ПД, і інкубували протягом 30 хв. Потім ембріони набирали мікропіпеткою об'ємом 10-20 мкл поштучно для запобігання механічним пошкодженням і накапували на мідну пластину, охолоджену в парах рідкого азоту до температури -110 -176°С. Контроль температури пластини здійснювали за допомогою термоперетворювача опори, градуювання М-100 (100 Ом). Після вітрифікування ембріони поміщали в рідкий азот. Відігрів ембріонів проводили в чашках Петрі з водою об'ємом 20 мл при температурі 22°С. Кількість вітрифікованих ембріонів при цьому складала 100%, а переживаність після відігрівання 6-14 годин. Приклад 2. Проводили дослідження впливу часу інкубації на виживаність ембріонів в'юна. Для цього спосіб здійснювали аналогічно Прикладу 1, за винятком того, що змінювали час інкубації ембріонів в кріозахисному середовищі. Ембріони в'юна інкубували протягом 30 хв з кріозахисним середовищем, до складу якого входили 30% сахарози, 10% ЕГ, 3% ПЕО-1500 і 20% 1,2-ПД. Фіксований час між інтервалами для порівняння з контролем складав 5 хв. Контрольну групу інкубували за оптимальних умов. На Фіг. 1 показано, що при інкубації ембріонів з кріозахисним середовищем менше 30 хв показник рівня виживаності не має статистично значимих відмінностей з контролем. Проте цього часу не вистачає для насичення ембріонів кріопротекторами. В результаті не удається вітрифікувати ембріони при заморожуванні. При інкубації ембріонів з кріозахисним середовищем більше 30 хв рівень виживаності знижується і при інкубації 35 хв стає статистично значимим. Таким чином, оптимальний час інкубації складає 30 хв. Приклад 3. Для вибору кращого вітрифікуючого середовища за допомогою методу диференційної скануючої калоріметрії (ДСК) досліджували кріозахисні середовища, до складу яких входили: а) 30% сахарози, 10% Мет; б) 30% сахарози, 10% Мет, 2% ПЕО-3000; в) 21% сахарози, 3% ПЕО1500, 20% 1,2-ПД; г) 30% сахарози, 3% ПЕО-1500, 10% ЕГ; д) 8% сахарози, 2% ПЕО-1500, 10% ЕГ; е) 30% сахарози, 3% ПЕО-1500, 10% ЕГ, 20% 1,2-ПД. 5 Краплі кріозахисних середовищ наносили на заздалегідь охолоджену в парах рідкого азоту мідну пластину. Вітрифіковані зразки охолоджували до -196°С поза калориметричним блоком шляхом занурення в рідкий азот. Потім зразки (50 шт.) масою 1 г поміщали в заздалегідь охолоджений калориметричний блок і нагрівали з швидкістю 8,3x10-3°С/с. При нагріві розчину від -150°С на термограмах реєстрували стрибок (Фіг. 2, А), відповідний переходу речовини з твердого аморфного в переохолоджений рідкий стан. Висота стрибка вказувала на кількість склоподібної фази в системі після охолоджування нижче температури склування [8]. При подальшому підвищенні температури спостерігався процес кристалізації з переохолодженого рідкого стану - екзотермічний пік (Фіг. 2, Б). На термограмі розчину "д" після розсклування реєстрували розмитий екзотермічний пік (Фіг. 2, В), відповідний процесу завершення кристалізації, що протікала при охолоджуванні. При температурі, характерній для кожної системи, починалося її плавлення, при якому реєстрували пік теплопоглинання, характерний для всіх середовищ (Фіг. 2, Г). Відомо, що чим вище склоутворююча здатність розчину, тим сильніше виявляється його кріозахисна дія [9]. Таким чином, на підставі таких параметрів, як висота перегину (Фіг. 2, А) і екзотермічного піку (Фіг. 2, Б), з ряду кріозазисних середовищ було вибрано середовище для кріоконсервування ембріонів в'юна, що містить 30% сахарози, 3% ПЕО1500, 10% ЕГ і 20% 1,2-ПД. Далі досліджували вплив складу цих кріозахисних середовищ на процеси кристалізації усередині ембріонів. Для цього ембріони в'юна, вітрифіковані згідно з Прикладом 1, в контейнерах по 50 шт. поміщали в заздалегідь охолоджений калориметричний блок і нагрівали із швидкістю 8,3x103 °С/с. Маса досліджуваних зразків була 1 г. Методом ДСК встановлено, що найбільша кількість вітрифікованих ембріонів міститься в середовищі, що складається з 30% сахарози, 3% ПЕО-1500, 10% ЕГ і 20% 1,2-ПД (Фіг. 4, Е). Приклад 4. Проводили дослідження впливу температури охолоджування на кількість вітрифікованих ембріонів. Для цього спосіб здійснювали аналогічно Прикладу 1, за винятком того, що змінювали температуру охолодженої мідної пластини. Діапазон досліджуваних температур складав 50 -196°С. Ембріони в'юна у краплях кріозахисно 93023 6 го середовища накапували мікропіпеткою на мідну пластину, розміщену в парах рідкого азоту. На Фіг. 3 показано, що при температурі мідної пластини вище -110°С існує вірогідність кристалізації, а при температурі вище -82°С ембріони не вітрифікуються. При температурі мідної пластини нижче 176°С не удається візуально зафіксувати склування. Таким чином, оптимальний діапазон температури мідної пластини для вітрифікування ембріонів в'юна -110 -176°С. Джерела інформації 1. Liu X.H., Zhang Т., Rawson DM. Feasibility of vitrification of zebrafish (Danio rerio) embryos using methanol // Cryo-Letters. - 1998. - № 19. - P. 309318. 2. El-Battawy K.A., Linhart O. Preleminary studies on cryopreservation of common tench (Tinea tinea) embryos (Work in progress) // Journal of Fisheries International. - 2008. - Vol. 3, № 1. - P. 12-18. 3. Ding F.H., Xiao Z.Z. Li J. Preliminary studies on the vitrification of red sea bream (Pagrus major) embryos // Theriogenology. - 2007. - Vol. 68, № 5. - P. 702708. 4. Massip Α., Van Der Zwalmen P., Scheffen В., Ectors F. Pregnancies following transfer of cattle embryos preserved by vitrification // Cryo-Letters. 1986. - Vol. 7. - P. 270-273. 5. Нейфах А.А. Использование метода радиоактивной инактивации ядер для исследования их функций в раннем развитии рыб // Журн. Общ. Биол. 1959. - №20. - С. 202-213. 6. Костомарова А.А. Вьюн Misgurnus fossilis L. // Объекты биологии развития / Под ред.: Б.Л. Астауров и др. - М.: Наука, 1975. - С. 308-323. 7. Игнатьева Г.М., Костомарова А.А. Продолжительность митотического цикла в период синхронных делений дробления ( 0) и ее зависимость от температуры у зародышей вьюна // Докл. АН СССР. - М.: Изд-во АН СССР, 1966. - Т. 168. - С. 1221-1224. 8. Зинченко А.В. Исследование фазовых переходов и физических состояний водных растворов многоатомных спиртов в диапазоне температур 150°С - 0°С // автореф. дис. канд. физ.-мат. наук.Харьков, 1983. - 23 с. 9. Мревлишвили Г.М. Низкотемпературная калориметрия биологических макромолекул // Успехи физических наук. - 1979. - Т. 128, вып. 2. - С. 273312. 7 93023 8 9 Комп’ютерна верстка О. Гапоненко 93023 Підписне 10 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for vitrification of loach embryos
Автори англійськоюMikson Kostiantyn Borysovych, Kopeika Yevhenii Fedorovych, Hryschenko Valentyn Ivanovych
Назва патенту російськоюСпособ витрификации эмбрионов вьюна
Автори російськоюМиксон Константин Борисович, Копейка Евгений Федорович, Грищенко Валентин Иванович
МПК / Мітки
МПК: A01K 61/00
Мітки: в'юна, спосіб, вітрифікації, ембріонів
Код посилання
<a href="https://ua.patents.su/5-93023-sposib-vitrifikaci-embrioniv-vyuna.html" target="_blank" rel="follow" title="База патентів України">Спосіб вітрифікації ембріонів в’юна</a>
Попередній патент: Спосіб компарування штрих-кодових рейок
Наступний патент: Пристрій для керування індуктивним навантаженням
Випадковий патент: Спосіб підвищення продуктивності льону олійного