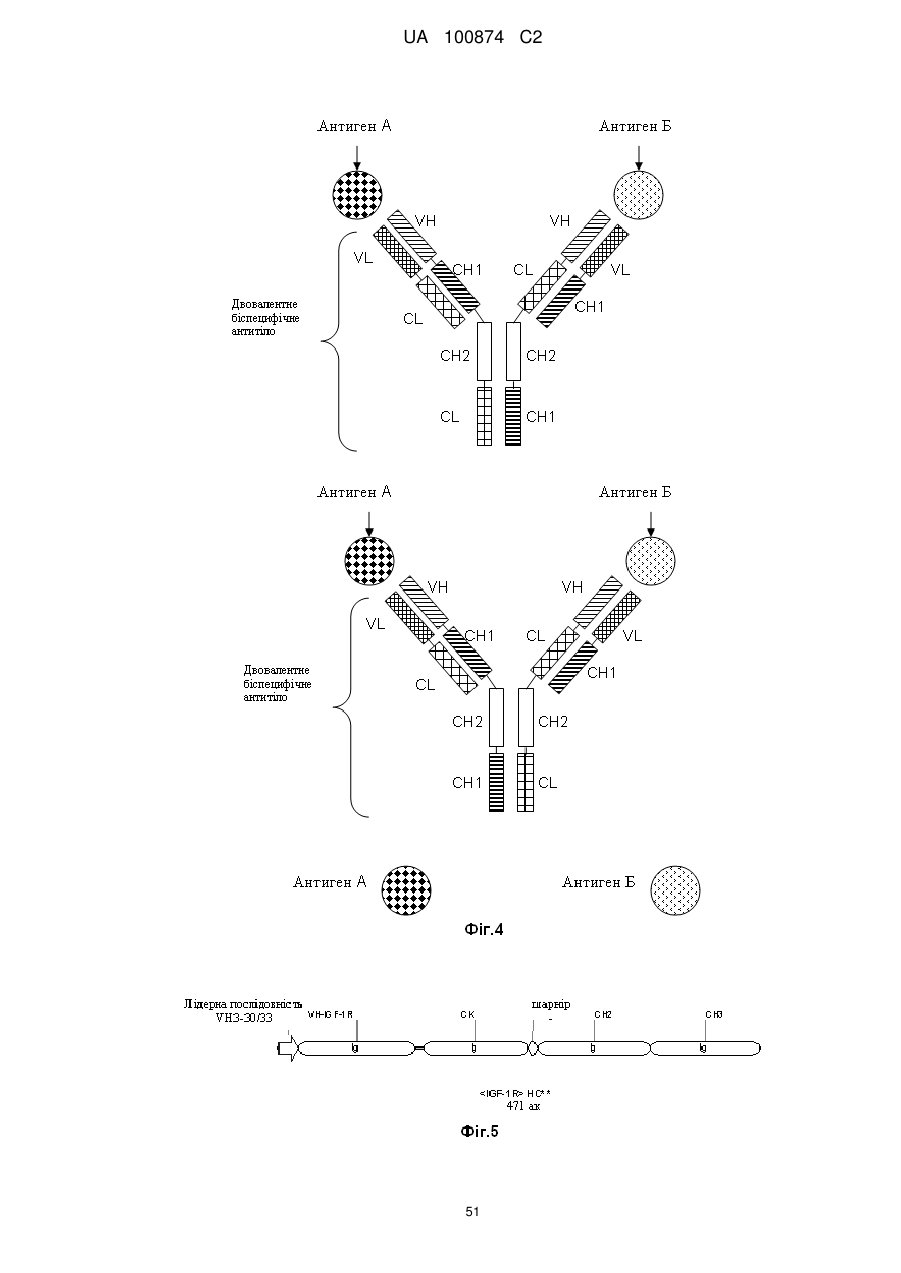
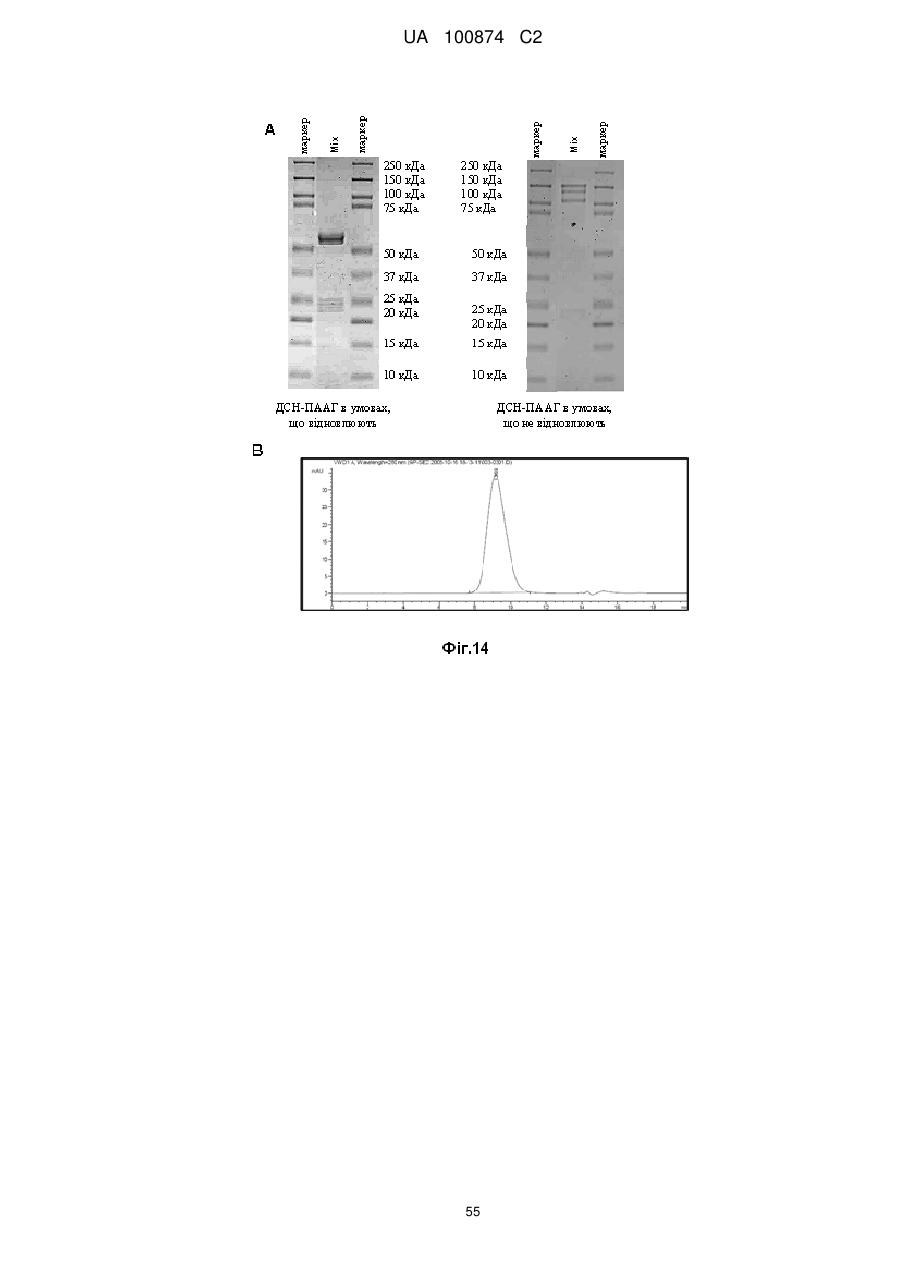
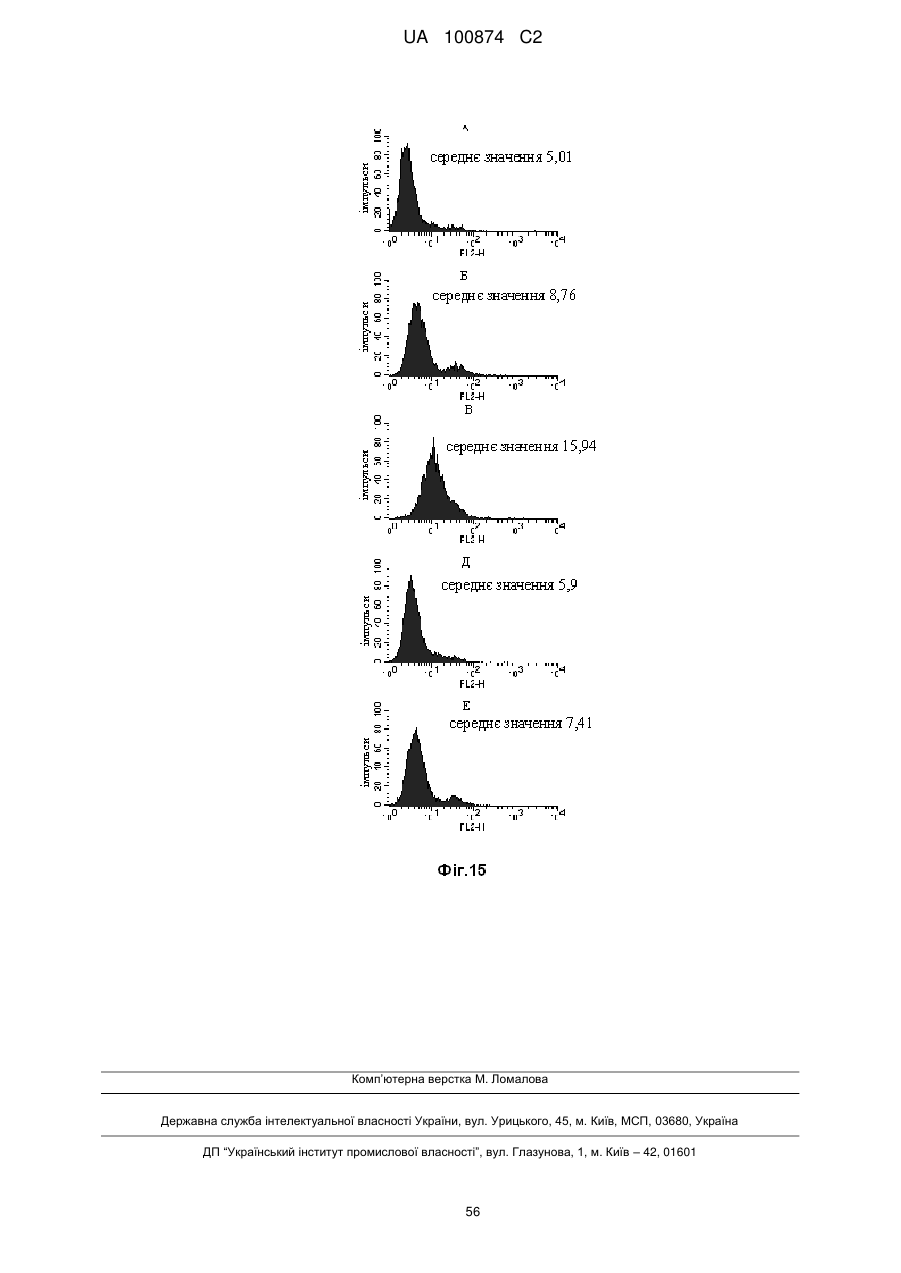
Двовалентні біспецифічні антитіла
Формула / Реферат
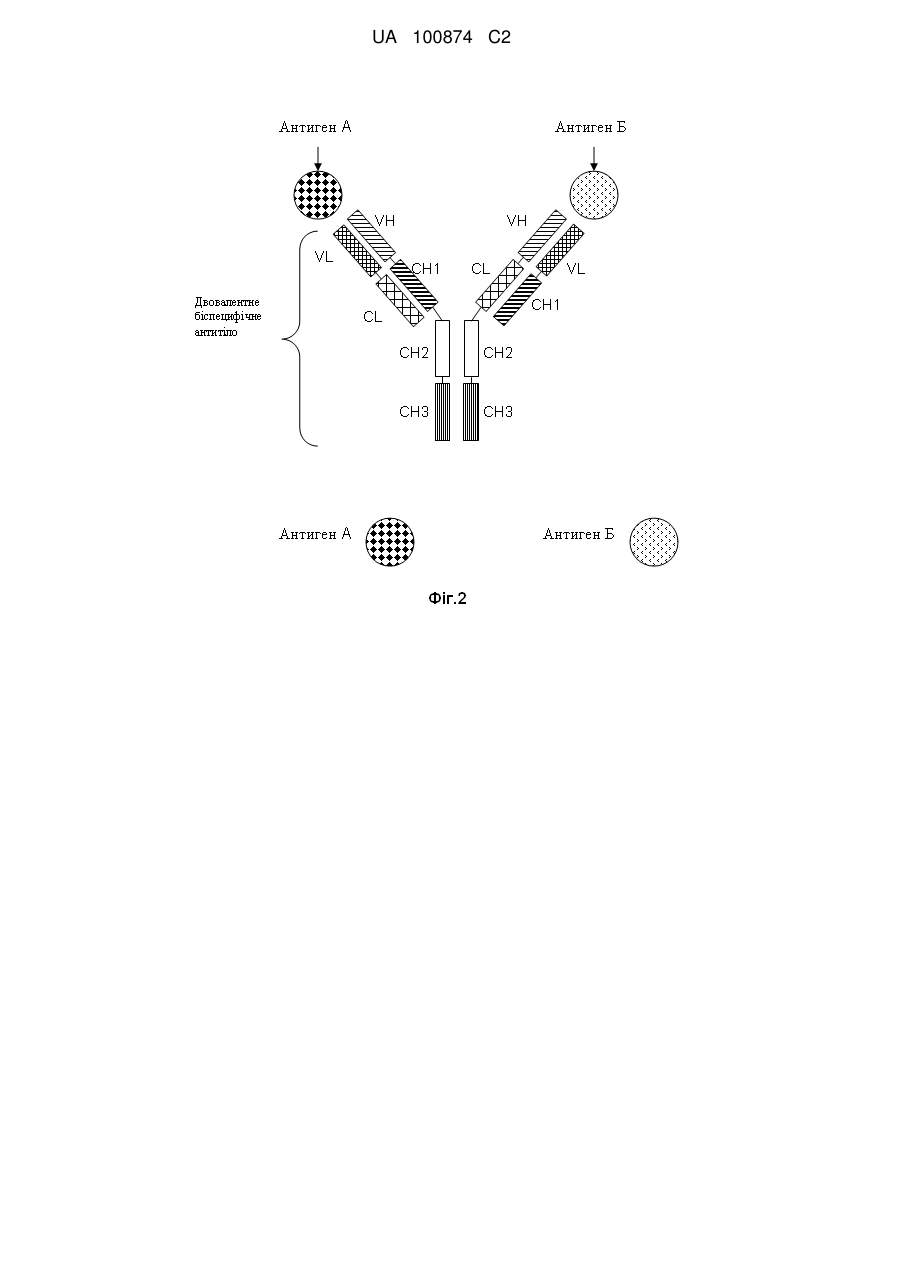
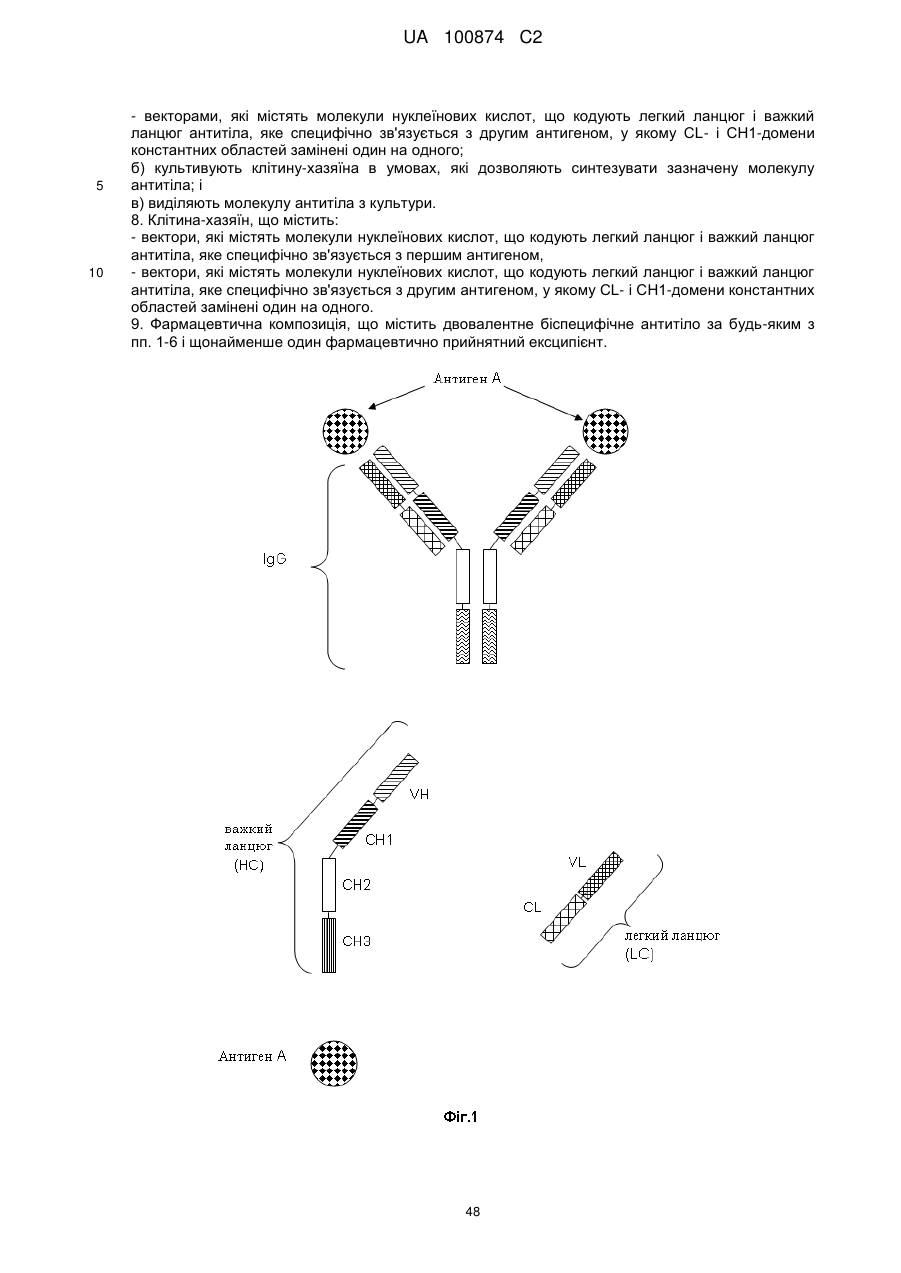
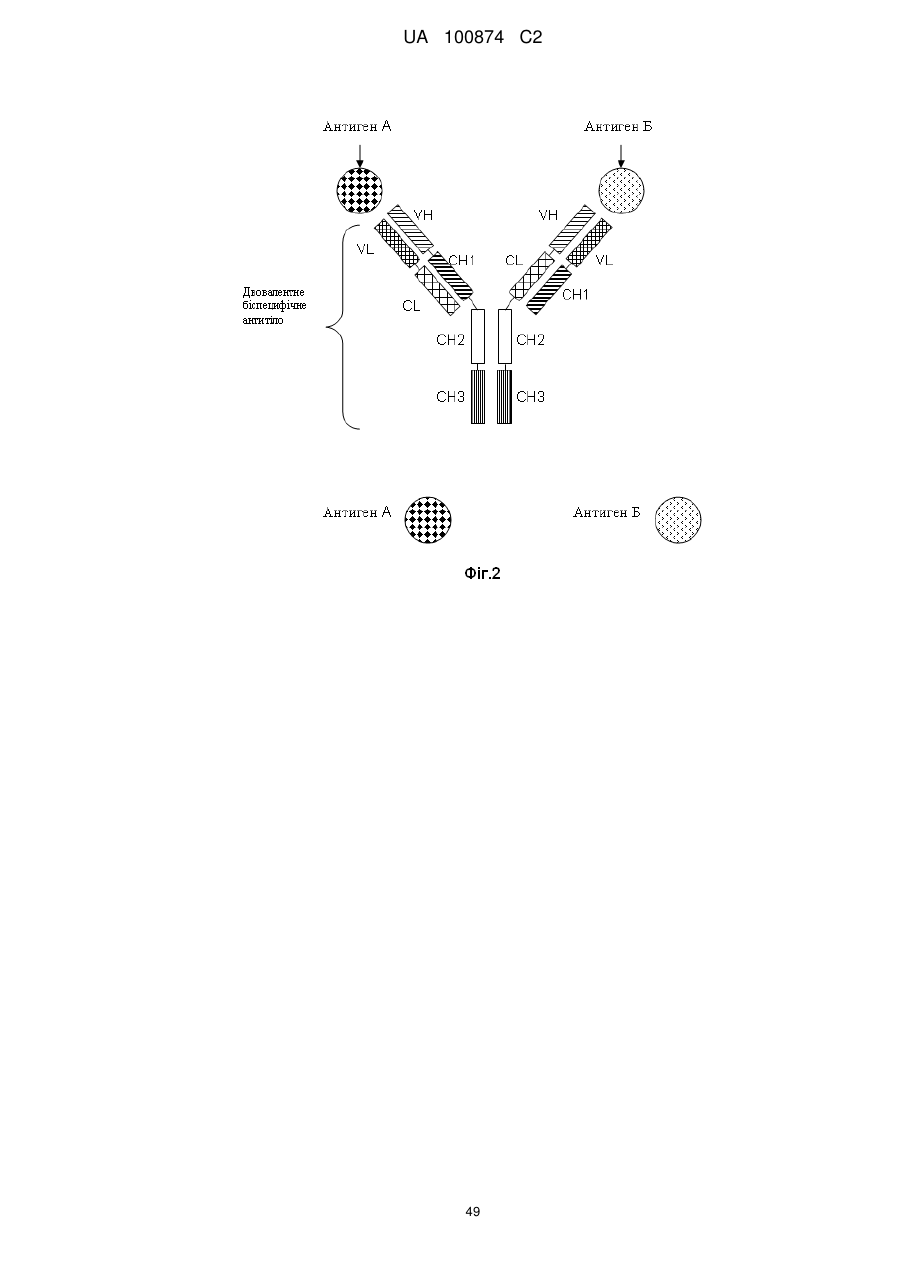
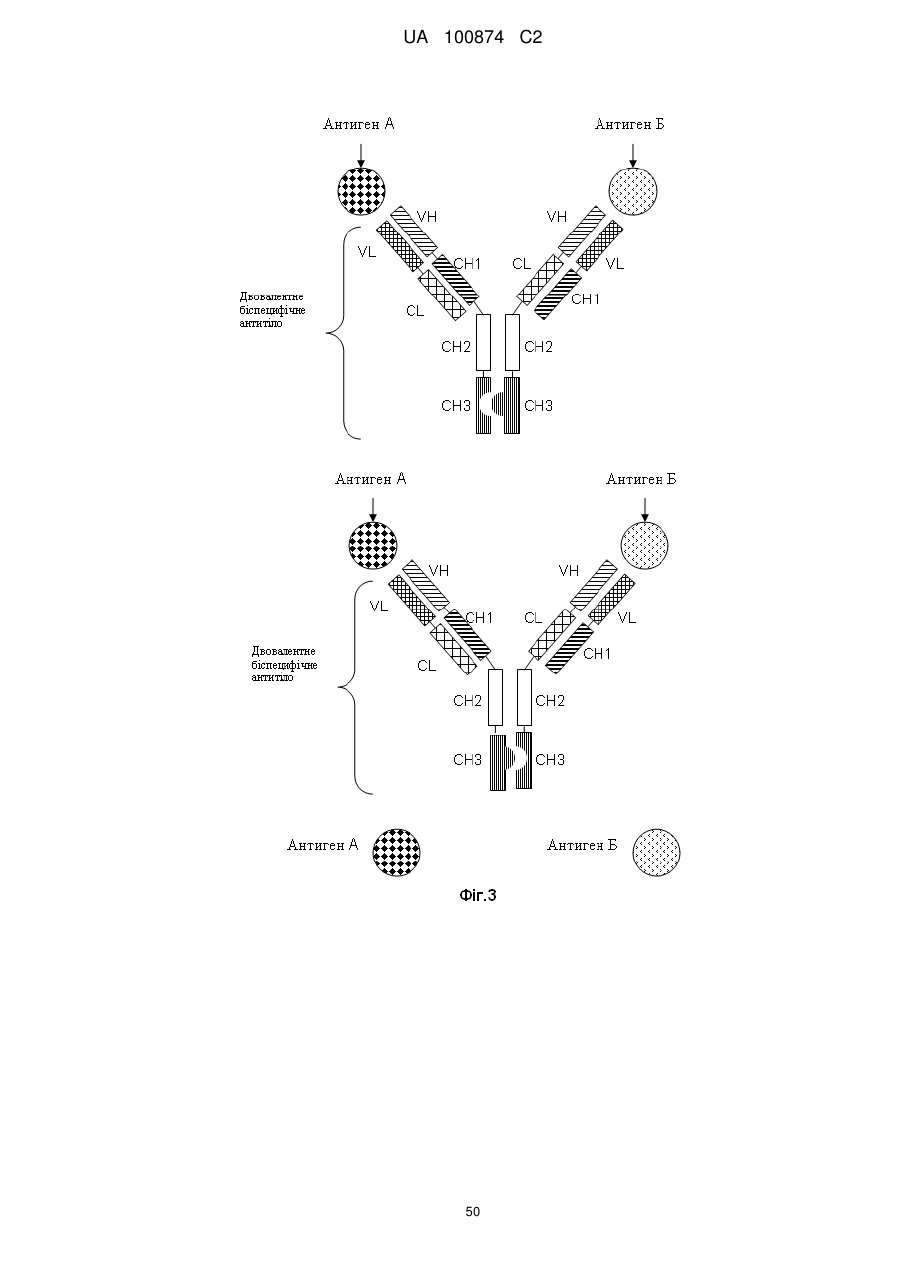
1. Двовалентне біспецифічне антитіло, що містить:
а) легкий ланцюг і важкий ланцюг антитіла, яке специфічно зв'язується з першим антигеном; і
б) легкий ланцюг і важкий ланцюг антитіла, яке специфічно зв'язується з другим антигеном, у якому CL- і СН1-домени константних областей замінені один на одного.
2. Антитіло за п. 1, яке відрізняється тим, що
СН3-домен одного важкого ланцюга й СН3-домен іншого важкого ланцюга кожний стикається один з одним на поверхні розділу, що являє собою вихідну поверхню розділу між СН3-доменами антитіла;
при цьому поверхня розділу змінена для активації формування двовалентного біспецифічного антитіла, де зміна відрізняється тим, що:
а) змінений СН3-домен одного важкого ланцюга
так, що на вихідній поверхні розділу СН3-домена одного важкого ланцюга, що стикається з вихідною поверхнею розділу СН3-домена другого важкого ланцюга у двовалентному біспецифічному антитілі, амінокислотний залишок замінений на амінокислотний залишок, який має більший за обсягом бічний ланцюг, що приводить до створення опуклості на поверхні розділу СН3-домена одного важкого ланцюга, яка може поміститися у порожнину на поверхні розділу СН3-домена іншого важкого ланцюга,
і
б) змінений СН3-домен іншого важкого ланцюга
так, що на вихідній поверхні розділу другого СН3-домена, що стикається з вихідною поверхнею розділу першого СН3-домена у двовалентному біспецифічному антитілі, амінокислотний залишок замінений на амінокислотний залишок, який має менший за обсягом бічний ланцюг, що приводить до створення порожнини на поверхні розділу другого СН3-домена, в яку може поміститися опуклість на поверхні розділу першого СН3-домена.
3. Антитіло за п. 2, яке відрізняється тим, що
зазначений амінокислотний залишок, що має більший за обсягом бічний ланцюг, вибраний з групи, що включає аргінін (R), фенілаланін (F), тирозин (Y), триптофан (W).
4. Антитіло за п. 2 або п. 3, яке відрізняється тим, що
зазначений амінокислотний залишок, що має менший за обсягом бічний ланцюг, вибраний з групи, що включає аланін (А), серин (S), треонін (Т), валін (V).
5. Антитіло за одним із пп. 2-4, яке відрізняється тим, що
обидва СН3-домени додатково змінені шляхом інтродукції цистеїну (С) як амінокислота у відповідні положення кожного СН3-домена.
6. Антитіло за п. 1, яке відрізняється тим, що
один з СН3-доменів константної області важкого ланцюга обох важких ланцюгів замінений на СН1-домен константної області важкого ланцюга; а інший СН3-домен константної області важкого ланцюга замінений на CL-домен константної області легкого ланцюга.
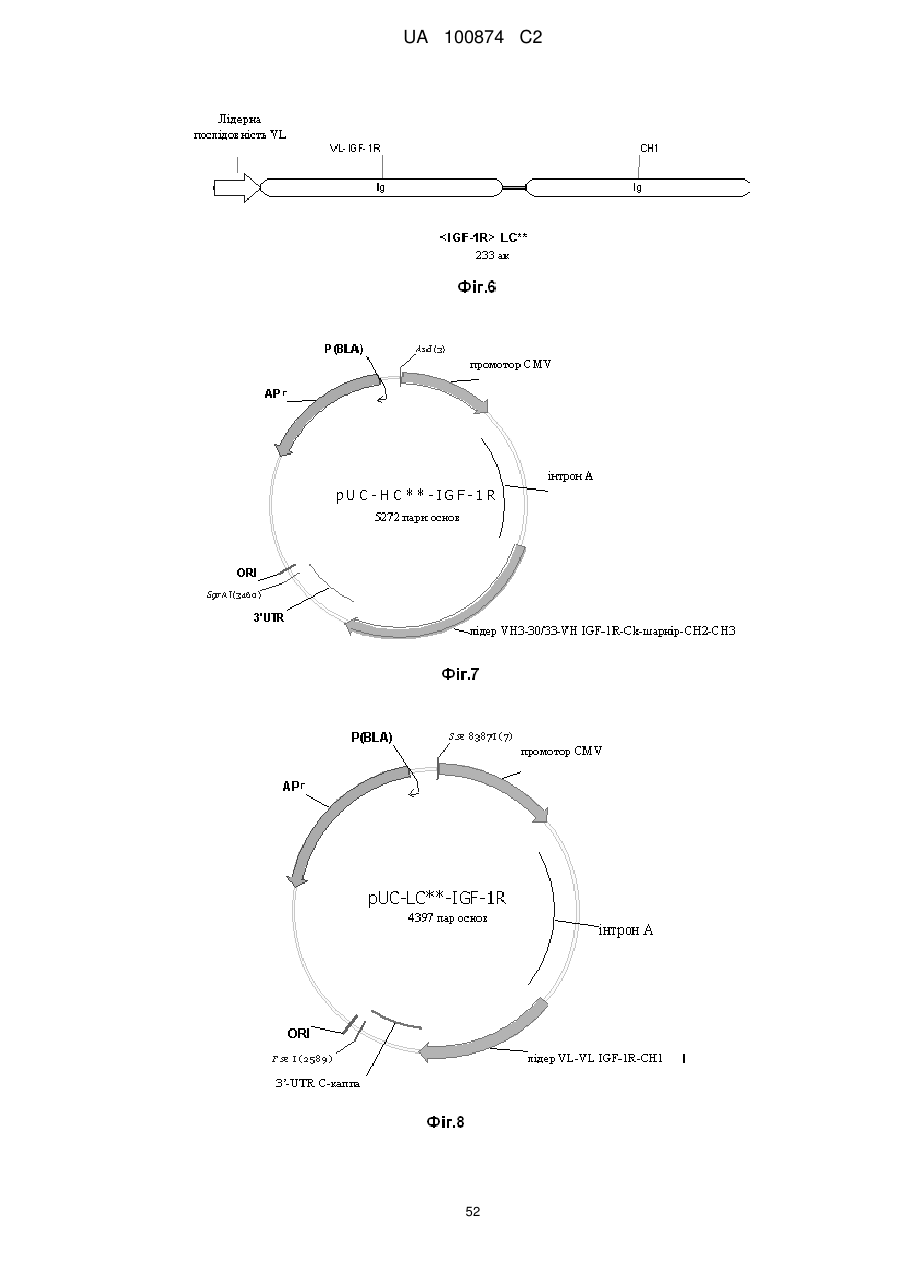
7. Спосіб одержання двовалентного біспецифічного антитіла за п. 1, який полягає у тому, що
а) трансформують клітину-хазяїна
- векторами, які містять молекули нуклеїнових кислот, що кодують легкий ланцюг і важкий ланцюг антитіла, яке специфічно зв'язується з першим антигеном,
- векторами, які містять молекули нуклеїнових кислот, що кодують легкий ланцюг і важкий ланцюг антитіла, яке специфічно зв'язується з другим антигеном, у якому CL- і СН1-домени константних областей замінені один на одного;
б) культивують клітину-хазяїна в умовах, які дозволяють синтезувати зазначену молекулу антитіла; і
в) виділяють молекулу антитіла з культури.
8. Клітина-хазяїн, що містить:
- вектори, які містять молекули нуклеїнових кислот, що кодують легкий ланцюг і важкий ланцюг антитіла, яке специфічно зв'язується з першим антигеном,
- вектори, які містять молекули нуклеїнових кислот, що кодують легкий ланцюг і важкий ланцюг антитіла, яке специфічно зв'язується з другим антигеном, у якому CL- і СН1-домени константних областей замінені один на одного.
9. Фармацевтична композиція, що містить двовалентне біспецифічне антитіло за будь-яким з пп. 1-6 і щонайменше один фармацевтично прийнятний ексципієнт.
Текст
Реферат: Винахід стосується двовалентного біспецифічного антитіла, що містить легкий ланцюг і важкий ланцюг антитіла, яке специфічно зв'язується з першим антигеном; і легкий ланцюг і важкий ланцюг антитіла, яке специфічно зв'язується з другим антигеном, у якому CL- і СН1-домени константних областей замінені один на одного. UA 100874 C2 (12) UA 100874 C2 UA 100874 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід належить до нових двовалентних біспецифічних антитіл, їх одержанню й застосуванню. Передумови створення винаходу У даній області відомі сконструйовані білки, такі як бі- і мультиспецифічні антитіла, які можуть зв'язуватися з двома або більшою кількістю антигенів. Зазначені мультиспецифічні єднальні білки можна створювати на основі методів клітинного злиття, хімічної кон'югації або рекомбінантної ДНК. В останні роки створена широка розмаїтість форматів рекомбінантних біспецифічних антитіл, наприклад, чотиривалентні біспецифічні антитіла, отримані шляхом злиття, наприклад, антитіла IgG-формату й одноланцюгових доменів (див., наприклад, Coloma M.J. і ін., Nature Biotech 15, 1997, сс. 159-163; WO 2001/077342 і Morrison S.L. , Nature Biotech 25, 2007, сс. 12331234). Розроблено також декілька інших нових форматів, у яких уже не зберігалася основна структура антитіла (IgA, IgD, IgE, IgG або IgM), таких як діа-, триа- або тетратіла, мінітіла, декілька одноланцюгових форматів (scFv, біс-scFv), які можуть зв'язувати два або більшу кількість антигенів (Holliger P. і ін., Nature Biotech 23, 2005, сс. 1126 - 1136; Fischer N., Leger O., Pathobiology 74, 2007, сс. 3-14; Shen J і ін., Journal of Immunological Methods 318, 2007, сс. 65-74; Wu C. і ін., Nature Biotech 25, 2007, сс. 1290-1297) У всіх зазначених форматах використовують лінкери або для злиття основної структури антитіла (IgA, IgD, IgE, IgG або IgM) з додатковим єднальним білком (наприклад, scFv), або для злиття, наприклад, двох Fab-фрагментів або scFv (Fischer N., Leger O., Pathobiology 74, 2007, сс. 3-14). Хоча очевидно, що лінкери мають перевагу при створенні біспецифічних антитіл, з ними можуть бути зв'язані також проблеми терапевтичного плану. Фактично ці чужорідні пептиди можуть викликати імунну відповідь проти самого лінкера або області стику між білком і лінкером. Крім того, гнучка природа цих пептидів робить їх більше чутливими до протеолітичного розщеплення, що може привести до поганої стабільності, агрегації й підвищення імуногенності антитіла. Крім того, може існувати необхідність у підтримці ефекторних функцій, таких як комплементзалежна цитотоксичність (CDC) або антитілообумовлена клітиннозалежна цитотоксичність (ADCC), які опосередковуються зв'язуванням з Fc-рецептором, шляхом збереження високого ступеня подібності з антитілами, що зустрічаються у природних умовах. Таким чином, в ідеальному варіанті необхідно створювати біспецифічні антитіла, які мають дуже подібну загальну структуру з антитілами, що зустрічаються у природних умовах (типу IgA, IgD, IgE, IgG або IgM), з мінімальним відхиленням від людських послідовностей. Відповідно до одного з підходів біспецифічні антитіла з високим ступенем подібності з антитілами, що зустрічаються у природних умовах, створювали за допомогою технології квадром (квадрогібридом) (див. Milstein C. і A.C. Cuello, Nature, 305, 1983, сс. 537-540) на основі соматичного злиття двох різних клітинних ліній гібридом, що експресують мишачі моноклональні антитіла з необхідними специфічностями біспецифічного антитіла. У результаті випадкового спарювання важких і легких ланцюгів двох різних антитіл у лінії клітин гібрида гібридоми (або квадроми), що утвориться, одержують аж до 10 різних видів антитіл, з яких тільки одне являє собою необхідне функціональне біспецифічне антитіло. Через присутність побічних продуктів, що мають помилкове спарювання, і у значній мірі зниженого виходу продукту, потрібні більше складні процедури очищення (див., наприклад, Morrison S.L., Nature Biotech 25, 2007, сс. 12331234). У цілому, ця ж проблема, пов'язана з побічними продуктами, що мають помилкові спарювання, зберігається при застосуванні методів рекомбінантної експресії. Підхід, за допомогою якого можна обійти проблему, пов'язану з побічними продуктами, що мають помилкові спарювання, відомий за назвою «knobs-into-holes» (взаємодія по типу «виступзападина»), спрямований на посилення спарювання двох різних важких ланцюгів антитіла шляхом інтродукції мутацій у CH3-домени для модифікації поверхні розділу в області контакту. На одному ланцюзі амінокислоти, що мають більші розміри, заміняли на амінокислоти з короткими бічними ланцюгами для створення «западини». І, навпаки, амінокислоти з більшими бічними ланцюгами інтродукували в інший CH3-домен, створюючи «виступ». Шляхом спільної експресіїцих двох важких ланцюгів (і двох ідентичних легких ланцюгів, які повинні відповідати обом важким ланцюгам), одержували високий вихід гетеродимерної формації («виступзападина») відносно гомодимерної формації («западина-западина» або «виступ-виступ») (Ridgway J. B., Presta L.G., Carter P. і WO 1996/027011). Процентний вміст гетеродимера можна додатково підвищувати шляхом ремоделювання поверхонь розділу двох CH3-доменів за допомогою технології фагового дисплея й інтродукції дисульфідного містка для стабілізації гетеродимерів (Merchant A.M, і ін., Nature Biotech 16, 1998, сс. 677-681; Atwell S., Ridgway J.B., 1 UA 100874 C2 5 10 15 20 25 30 35 40 45 50 55 60 Wells J.A., Carter P., J Mol Biol 270, 1997, сс.26–35). Нові підходи до технології «knobs-into-holes» описані, наприклад, в EP 1870459A1. Хоча зазначений формат, імовірно, є дуже привабливим, у цей час відсутні дані про його розвиток у напрямку клінічного застосування. Одним з важливих обмежень цієї стратегії є те, що легкі ланцюги двох батьківських антитіл повинні бути ідентичними для попередження помилкових спарювань і формування неактивних молекул. Таким чином, ця технологія не придатна для більше легкого створення рекомбінантних двовалентних біспецифічних антитіл до двох антигенів з використанням в якості вихідних двох антитіл до першого й другого антигену, оскільки повинні бути оптимізовані або важкі ланцюги цих антитіл, і/або ідентичні легкі ланцюги. У Simon T. і ін., EMBO Journal, 9, 1990, сс. 1051 -1056 описані мутанти доменів моноспецифічних антитіл. Короткий виклад сутності винаходу Даний винахід відноситься до двовалентного біспецифічного антитіла, що містить: a) легкий ланцюг і важкий ланцюг антитіла, яке специфічно зв'язується з першим антигеном; і б) легкий ланцюг і важкий ланцюг антитіла, яке специфічно зв'язується з другим антигеном, у якому СL- і СH1-домени константних областей (константні СL- і СH1-домени) замінені один на одного. Наступним варіантом здійснення винаходу є спосіб одержання двовалентного біспецифічного антитіла, запропонованого у винаході, який полягає у тому, що a) трансформують клітину-хазяїна - векторами, які містять молекули нуклеїнових кислот, що кодують легкий ланцюг і важкий ланцюг антитіла, яке специфічно зв'язується з першим антигеном, - векторами, які містять молекули нуклеїнових кислот, що кодують легкий ланцюг і важкий ланцюг антитіла, яке специфічно зв'язується з другим антигеном, у якому СL- і СH1-домени константних областей замінені один на одного; б) культивують клітину-хазяїна в умовах, які дозволяють синтезувати зазначену молекулу антитіла; і в) виділяють молекулу антитіла з культури. Наступним варіантом здійснення винаходу є клітина-хазяїн, що містить - вектори, які містять молекули нуклеїнових кислот, що кодують легкий ланцюг і важкий ланцюг антитіла, яке специфічно зв'язується з першим антигеном, - вектори, які містять молекули нуклеїнових кислот, що кодують легкий ланцюг і важкий ланцюг антитіла, яке специфічно зв'язується з другим антигеном, у якому СL- і СH1-домени константних областей замінені один на одного. Наступним варіантом здійснення винаходу є композиція, переважно фармацевтична або діагностична композиція антитіла, запропонованого у винаході. Наступним варіантом здійснення винаходу є фармацевтична композиція, що містить антитіло, запропоноване у винаході, і щонайменше один фармацевтично прийнятний ексципієнт. Наступним варіантом здійснення винаходу є спосіб лікування пацієнта, що має потребу у терапії, який відрізняється тим, що вводять пацієнтові у терапевтично ефективній кількості антитіло, запропоноване у винаході. Докладний опис винаходу Винахід відноситься до двовалентного біспецифічного антитіла, що містить: a) легкий ланцюг і важкий ланцюг антитіла, яке специфічно зв'язується з першим антигеном; і б) легкий ланцюг і важкий ланцюг антитіла, яке специфічно зв'язується з другим антигеном, у якому СL- і СH1-домени константних областей замінені один на одного. Таким чином, двовалентне біспецифічне антитіло містить: a) перший легкий ланцюг і перший важкий ланцюг антитіла, яке специфічно зв'язується з першим антигеном; і б) другий легкий ланцюг і другий важкий ланцюг антитіла, яке специфічно зв'язується з другим антигеном, у якому СL- і СH1-домени константних областей другого легкого ланцюга й другого важкого ланцюга замінені один на одного. Таким чином, для створення антитіла, яке специфічно зв'язується з другим антигеном, застосовують наступні процеси: у легкому ланцюзі СL-домен константної області легкого ланцюга заміняють на СН1-домен константної області важкого ланцюга зазначеного антитіла; 2 UA 100874 C2 5 10 15 20 25 30 35 40 45 50 55 і у важкому ланцюзі СН1-домен константної області важкого ланцюга заміняють на СL-домен константної області легкого ланцюга зазначеного антитіла. Поняття «антитіло» у контексті даного опису відноситься до повних моноклональних антитіл. Такі повні антитіла складаються з двох пар, кожна з яких включає «легкий ланцюг» (LC) і «важкий ланцюг» (HC) (зазначені пари легкий ланцюг (LC)/важкий ланцюг (HC) скорочено позначають у контексті даного опису як LC/HC). Легкі ланцюги й важкі ланцюги зазначених антитіл являють собою поліпептиди, що складаються з декількох доменів (областей). У повному антитілі кожний важкий ланцюг містить варіабельну область важкого ланцюга (скорочено позначена у контексті даного опису як HCVR або VH) і константну область важкого ланцюга. Константна область важкого ланцюга містить константні CH1-, CH2- і CH3-домени важкого ланцюга (в антитілі, що відноситься до класів IgA, IgD і IgG) і необов'язково константний CH4домен важкого ланцюга (в антитілі, що відноситься до класів IgE і IgM). Кожний легкий ланцюг містить варіабельний домен легкого ланцюга VL і константний домен легкого ланцюга CL. Структура одного з класів антитіл, що зустрічаються у природних умовах, а саме антитіла класу IgG, показана, наприклад, на фіг. 1. Варіабельні домени VH і VL можна додатково підрозділяти на області гіперваріабельності, позначені як гіперваріабельні ділянки (CDR), що перемежовуються більше консервативними областями, які називають каркасними ділянками (FR). Кожна VH- і VL-область складається з трьох CDR і чотирьох FR, які розташовані у напрямку від амінокінця до карбоксикінця у наступному порядку: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4 ((Janeway C.A., Jr. і ін., Immunobiology., 5-е вид., вид-в Garland Publishing, 2001; і Woof J., Burton D., Nat Rev Immunol 4, 2004, сс. 89-99). Дві пари, кожна з яких включає важкий ланцюг і легкий ланцюг (HC/LC), мають здатність специфічно зв'язуватися з тим самим антигеном. Таким чином, повне антитіло являє собою двовалентне моноспецифічне антитіло. Зазначені «антитіла» являють собою, наприклад, мишачі антитіла, людські антитіла, химерні антитіла, гуманізовані антитіла й створені за допомогою генної інженерії антитіла (варіанти антитіл або мутантні антитіла), якщо вони зберігають свої характерні властивості. Найбільше кращими є людські або гуманізовані антитіла, насамперед у вигляді рекомбінантних людських або гуманізованих антитіл. Відомо п'ять типів важких ланцюгів антитіл ссавців, які позначають грецькими буквами: α, δ, ε, γ і μ (Janeway C.A., Jr. і ін., Immunobiology., 5-е вид., вид-в Garland Publishing, 2001). Присутній тип важкого ланцюга визначає клас антитіла; зазначені ланцюги виявлені в антитілах типу IgA, IgD, IgE, IgG і IgM відповідно (Rhoades R.A., Pflanzer R.G., Human Physiology, 4-е вид., вид-в Thomson Learning, 2002). Різні важкі ланцюги відрізняються за розміром й складом; α і γ містять приблизно 450 амінокислот, а μ і ε складаються приблизно з 550 амінокислот. Кожний важкий ланцюг містить дві області, тобто константну область і варіабельну область. Константна область є ідентичною у всіх антитілах того самого ізотипу, але відрізняється в антитілах різного ізотипу. Важкі ланцюги γ, α і δ містять константну область, що складається з трьох константних доменів CH1, CH2 і CH3 (вибудувані в ряд) і шарнірної області, що надає гнучкість (Woof J., Burton D., Nat Rev Immunol 4, 2004, сс. 89-99); важкі ланцюги μ і ε містять константну область, що складається з чотирьох константних доменів CH1, CH2, CH3 і CH4 (Janeway C.A., Jr. і ін., Immunobiology., 5-е вид., вид-в Garland Publishing, 2001). Варіабельна область важкого ланцюга відрізняється в антитіл, які продукуються різними В-клітинами, але є однаковою у всіх антитіл, які продукуються індивідуальною B-клітиною або B-клітинним клоном. Варіабельна область кожного важкого ланцюга антитіла містить приблизно 110 амінокислот і складається з одного домена. У ссавців відомо тільки два типи легких ланцюгів, які позначають як лямбда (λ) і каппа (κ). Легкий ланцюг складається з двох послідовно розташованих доменів: один константний домен CL і один варіабельний домен VL. Приблизна довжина легкого ланцюга становить 211-217 амінокислот. Переважно легкий ланцюг являє собою легкий каппа (κ)-ланцюг, а константний домен CL переважно являє собою C-каппа (κ). Поняття «моноклональне антитіло» або «композиція моноклонального антитіла» у контексті даного опису відноситься до препарату молекул антитіл однакового амінокислотного складу. «Антитіла» відповідно до винаходу можуть являти собою антитіла будь-якого класу (наприклад, IgA, IgD, IgE, IgG і IgM, переважно IgG або IgE) або підкласу (наприклад, IgG1, IgG2, IgG3, IgG4, IgA1 і IgA2, переважно IgG1), при цьому обидва антитіла, з яких виводять двовалентне біспецифічне антитіло, запропоноване у винаході, мають Fc-область одного й того самого підкласу (наприклад, IgG1, IgG4 тощо, переважно IgG1), переважно того самого алотипу (наприклад, кавказького). 60 3 UA 100874 C2 5 10 15 20 25 30 35 40 45 50 55 60 Поняття «Fc-область (фрагмент) антитіла» добре відомо фахівцям у даній області й її визначають на основі розщеплення антитіл папаїном. Антитіла, запропоновані у винаході, містять в якості Fc-області переважно Fc-область, отриману з людського антитіла, і переважно всі інші частини людських константних областей. Fc-область антитіла безпосередньо бере участь в активації комплементу, C1q-зв'язуванні, C3-активації й зв'язуванні Fc-рецептора. У той час як вплив антитіла на систему комплементу залежить від певних умов, зв'язування з C1q обумовлено певними сайтами зв'язування в Fc-області. Зазначені сайти зв'язування відомі у даній області й описані, наприклад, у Lukas T.J. і ін., J. Immunol. 127, 1981, сс. 2555-2560; Brunhouse R. і Cebra J.J., Mol. Immunol. 16, 1979, сс. 907-917; Burton D.R. і ін., Nature 288, 1980, сс. 338-344; Thommesen J.E. і ін., Mol. Immunol. 37, 2000, сс. 995-1004; Idusogie E.E. і ін., J. Immunol. 164, 2000, сс. 4178-4184; Hezareh M. і ін., J. Virol. 75, 2001, сс. 12161-12168; Morgan A. і ін., Immunology 86, 1995, сс. 319-324; і EP 0307434. Зазначені сайти зв'язування являють собою, наприклад, L234, L235, D270, N297, E318, K320, K322, P331 і P329 (нумерація дана відповідно до нумерації EU Кебота, див. нижче). Антитіла підкласів IgG1, IgG2 і IgG3, як правило, характеризуються здатністю до активації комплементу, C1q-зв'язуванню й C3-активації, у той час як IgG4 не активують систему комплементу, не зв'язуються з C1q і не активують C3. Переважно Fc-область являє собою людську Fc-область. Поняття «химерне антитіло» відноситься до антитіла, що містить варіабельну область, тобто єднальну область, отриману з одного джерела або з тих самих видів, і щонайменше частину константної області, отриману з іншого джерела або інших видів, і його, як правило, одержують з використанням методів рекомбінантої ДНК. Кращими є химерні антитіла, які містять мишачу варіабельну область і людську константну область. Іншими кращими формами «химерних антитіл», що підпадають під обсяг даного винаходу, є антитіла, константна область яких модифікована або змінена у порівнянні з вихідним антитілом з метою одержання властивостей, запропонованих у винаході, насамперед відносно зв'язування C1q і/або зв'язування Fc-рецептора (FcR). Такі химерні антитіла позначають також як «антитіла переключеного класу». Химерні антитіла є продуктом експресії генів імуноглобулінів, що містять сегменти ДНК, які кодують варіабельні області імуноглобулінів, і сегменти ДНК, які кодують константні області імуноглобулінів. Методи одержання химерних антитіл включають звичайні методи рекомбінантної ДНК і генної трансфекції, які добре відомі у даній області (див., наприклад, Morrison S.L. і ін., Proc. Natl. Acad. Sci. USA 81,1984, сс. 6851-6855; US 5202238 і US 5204244). Поняття «гуманізоване антитіло» відноситься до антитіл, у яких каркасні або «гіперваріабельні ділянки» (CDR) модифіковані так, що вони містять CDR імуноглобуліну іншої специфічності у порівнянні зі специфічністю батьківського імуноглобуліну. У кращому варіанті здійснення винаходу для одержання «гуманізованого антитіла» мишачий CDR трансплантують у каркасну ділянку людського антитіла (див., наприклад, Riechmann L. і ін., Nature 332, 1988, сс. 323-327; і Neuberger M.S. і ін., Nature 314, 1985, сс. 268-270). Особливо кращі CDR відповідають CDR, які являють собою послідовності, що розпізнають антигени, зазначені вище для химерних антитіл. Іншими формами «гуманізованих антитіл», що підпадають під обсяг даного винаходу, є антитіла, константна область яких додатково модифікована або змінена у порівнянні з вихідним антитілом з метою одержання властивостей, запропонованих у винаході, насамперед відносно зв'язування C1q і/або зв'язування Fc-рецептора (FcR). Поняття «людське антитіло» у контексті даного опису відноситься до антитіл, варіабельні й константні області яких виведені з послідовностей імуноглобуліну людських зародків лінії. Людські антитіла добре відомі у даній області (van Dijk M.A. і van de Winkel J.G., Curr. Opin. Chem. Biol. 5, 2001, сс. 368-374). Людські антитіла можна одержувати також у трансгенних тварин (наприклад, мишах), які у результаті імунізації можуть продукувати повний спектр або певну частину людських антитіл при відсутності виробництва ендогенного імуноглобуліну. Перенос набору генів імуноглобулінів людської зародкової лінії у таку мутантну зародкову лінію мишей повинен приводити до виробництва людських антитіл після антигенної стимуляції (див., наприклад, Jakobovits A., і ін., Proc. Natl. Acad. Sci. USA 90, 1993, сс. 2551-2555; Jakobovits A. і ін., Nature 362, 1993, сс. 255-258; Bruggemann M. і ін., Year Immunol. 7, 1993, сс. 33-40). Людські антитіла можна одержувати також за допомогою фагових дисплейних бібліотек (Hoogenboom H.R. і Winter, G., J. Mol. Biol. 227, 1992, сс. 381-388; Marks J.D. і ін., J. Mol. Biol. 222, 1991, сс. 581-597). Для одержання людських моноклональних антитіл можна використовувати також методи Cole зі співавторами й Boerner зі співавторами (Cole і ін., Monoclonal Antibodies and Cancer Therapy, під ред. Alan R. Liss, 1985, с. 77; і Boerner P., і ін., J. Immunol. 147, 1991, сс. 8695). Як уже було відзначено для химерних і гуманізованих антитіл, запропонованих у винаході, поняття «людське антитіло» включає також такі антитіла, константна область яких 4 UA 100874 C2 5 10 15 20 25 30 35 40 45 50 55 60 модифікована з метою одержання властивостей, запропонованих у винаході, насамперед відносно зв'язування C1q і/або зв'язування FcR, наприклад, шляхом «перемикання класу», тобто заміни або мутації Fc-областей (наприклад, IgG1 на IgG4 і/або IgG1/IgG4-мутація). Поняття «рекомбінантне людське антитіло» у контексті даного опису відноситься до всіх людських антитіл, які одержують, експресують, створюють або виділяють за допомогою методів рекомбінації, наприклад, до антитіл, виділених із клітини-хазяїна, такій як NS0- або CHOклітина, або із тварини (наприклад, миші), що є трансгенною через присутність людських генів імуноглобулінів або антитіл, що експресуються з використанням рекомбінантного експресійного вектора, яким трансфектована клітина-хазяїн. Такі рекомбінантні людські антитіла мають варіабельну й константну області, які перебувають у перетвореній формі. Рекомбінантні людські антитіла, запропоновані у винаході, піддають соматичній гіпермутації in vivo. Таким чином, амінокислотні послідовності VH- і VL-областей рекомбінантних антитіл являють собою послідовності, які, хоча й виведені з послідовностей VH і VL людської зародкової лінії й родинних їм ліній, можуть не існувати у природних умовах у спектрі зародкової лінії людських антитіл in vivo. Поняття «варіабельна область (домен)» (варіабельний домен легкого ланцюга (VL), варіабельна область важкого ланцюга (VH)) у контексті даного опису відноситься до областей кожної з пари легких і важких ланцюгів, які беруть участь безпосередньо у зв'язуванні антитіла з антигеном. Домени варіабельних людських легких і важких ланцюгів мають однакову загальну структуру, і кожний домен містить чотири каркасних ділянки (FR), послідовності яких є досить консервативними, зв'язаних трьома «гіперваріабельними ділянками» (або визначальними комплементарність ділянками, CDR). Каркасні ділянки адоптовані до -складчастої конформації, а CDR можуть утворювати петлі, що з'єднують -складчасту структуру. CDR у кожному ланцюзі зберігають їхню тривимірну структуру за допомогою каркасних ділянок і утворюють разом з CDR з інших ланцюгів антигензв’язуючий центр. CDR3-ділянки важкого й легкого ланцюгів антитіла грають особливо важливу роль у специфічності зв'язування/афінності антитіл, запропонованих у винаході, і тому є додатковим об'єктом винаходу. Поняття «гіперваріабельна ділянка» або «антигензв’язуючий центр антитіла» у контексті даного опису відносяться до амінокислотних залишків антитіла, які відповідальні за зв'язування антигену. Гіперваріабельна ділянка містить амінокислотні залишки з «визначальних комплементарність ділянок» або «CDR». «Каркасні» або «FR»-ділянки являють собою ділянки варіабельної області, відмінні від зазначених у даному описі залишків гіперваріабельної ділянки. Таким чином, легкі й важкі ланцюги антитіла містять у напрямку від N- до C-кінця ділянки FR1, CDR1, FR2, CDR2, FR3, CDR3 і FR4. CDR кожного ланцюга розділені амінокислотами зазначеної каркасної ділянки. Зокрема, CDR3 важкого ланцюга являють собою ділянку, що вносить найбільший вклад у зв'язування з антигеном. CDR- і FR-ділянки визначають за допомогою стандартної номенклатури Кебота (Kabat і ін., Sequences of Proteins of Immunological Interest, 5-вид., вид-в Public Health Service, National Institutes of Health, Bethesda, MD (1991). «Константні області (домени)» важкого ланцюга й легкого ланцюга не приймають особистої участі у зв'язуванні антитіла з антигеном, але мають різні ефекторні функції. Залежно від амінокислотної послідовності константної області їхніх важких ланцюгів антитіла або імуноглобуліни підрозділяють на зазначені вище класи. Поняття «двовалентне біспецифічне антитіло» у контексті даного опису відноситься до антитіла, як воно описано вище, у якому кожна з двох пар, що включає важкий ланцюг і легкий ланцюг (HC/LC), специфічно зв'язується з різним антигеном, тобто перший важкий і перший легкий ланцюг (отримані з антитіла до першого антигену) специфічно зв'язуються обидва з першим антигеном, а другий важкий і другий легкий ланцюг (отримані з антитіла до другого антигену) специфічно зв'язуються обидва з другим антигеном (як показано на фіг. 2); зазначені двовалентні біспецифічні антитіла мають здатність специфічно зв'язуватися одночасно з двома різними антигенами й не більше, ніж із двома антигенами, у відмінність, по-перше, від моноспецифічного антитіла, що має здатність зв'язуватися тільки з одним антигеном, і, подруге, від чотиривалентного тетраспецифічного антитіла, що має здатність зв'язуватися одночасно з чотирома молекулами антигенів. Відповідно до винаходу співвідношення між необхідним двовалентним біспецифічним антитілом і небажаними побічними продуктами можна поліпшувати шляхом заміни деяких доменів тільки в одній парі, що включає важкий ланцюг і легкий ланцюг (HC/LC). Хоча перша з двох HC/LC-пара, отримана з антитіла, яке специфічно зв'язується з першим антигеном, залишається практично не зміненою, другу з двох HC/LC-пар, отриману з антитіла, яке специфічно зв'язується з другим антигеном, змінюють за допомогою наступної заміни: 5 UA 100874 C2 5 10 15 20 25 30 35 40 45 50 55 60 легкий ланцюг: заміна СL-домена константної області легкого ланцюга на СН1-домен константної області важкого ланцюга зазначеного антитіла, яке специфічно зв'язується з другим антигеном, і важкий ланцюг: заміна СН1-домена константної області важкого ланцюга на СL-домен константної області легкого ланцюга антитіла, яке специфічно зв'язується з другим антигеном. Таким чином, двовалентні біспецифічні антитіла, що утворилися, являють собою штучні антитіла, які містять a) легкий ланцюг і важкий ланцюг антитіла, яке специфічно зв'язується з першим антигеном; і б) легкий ланцюг і важкий ланцюг антитіла, яке специфічно зв'язується з другим антигеном, де зазначений легкий ланцюг (антитіла, яке специфічно зв'язується з другим антигеном) містить константний домен СH1 замість СL, і де зазначений важкий ланцюг (антитіла, яке специфічно зв'язується з другим антигеном) містить константний домен СL замість СH1. Згідно ще одному об'єкту винаходу зазначене поліпшене співвідношення між необхідним двовалентним біспецифічним антитілом і небажаними побічними продуктами можна додатково поліпшувати за допомогою одного із зазначених нижче двох альтернативних підходів: A) Перший альтернативний підхід (див. фіг. 3): CH3-домени зазначеного двовалентного біспецифічного антитіла, запропонованого у винаході, можна змінювати за допомогою технології «knob-into-holes», що описана докладно на декількох прикладах, наприклад, у WO 96/027011, Ridgway J.B. і ін., Protein Eng 9, 1996, сс. 617621; і у Merchant A.M. і ін., Nat Biotechnol 16, 1998, сс. 677-681. При використанні цього методу взаємодіючі поверхні двох CH3-доменів змінюють з метою підвищення гетеродимеризації обох важких ланцюгів, що містять ці два CH3-домена. Кожний з двох CH3-доменів (двох важких ланцюгів) може являти собою «виступ», а інший являти собою «западину». Введення дисульфідного містка стабілізує гетеродимери (Merchant A.M, і ін., Nature Biotech 16, 1998, сс. 677-681; Atwell S., Ridgway J.B., Wells J.A, Carter P., J Mol Biol 270, 1997, сс. 26-35) і підвищує вихід продукту. Таким чином, відповідно до кращого варіанта здійснення винаходу CH3-домени двовалентного біспецифічного антитіла, у якому перший CH3-домен і другий CH3-домен кожний стикається один з одним на поверхні розділу, що являє собою вихідну поверхню розділу між CH3-доменами антитіла, змінюють за допомогою технології «knob-into-holes», включаючи додаткову стабілізацію шляхом інтродукції дисульфідного містка у CH3-домени (як описано у WO 96/027011, Ridgway J.B. і ін., Protein Eng 9, 1996, сс. 617-621; Merchant A.M і ін., Nature Biotech 16, 1998, сс. 677-681; і Atwell S, Ridgway J.B., Wells J.A., Carter P., J Mol Biol 270, 1997, сс. 26-35) для активації формування двовалентного біспецифічного антитіла. Таким чином, відповідно до одного з об'єктів винаходу двовалентне біспецифічне антитіло відрізняється тим, що CH3-домен одного важкого ланцюга й CH3-домен іншого важкого ланцюга кожний стикається один з одним на поверхні розділу, що являє собою вихідну поверхню розділу між CH3-доменами антитіла; при цьому поверхню розділу змінюють для активації формування двовалентного біспецифічного антитіла, де зміна відрізняється тим, що: a) змінюють CH3-домен одного важкого ланцюга так, що на вихідній поверхні розділу CH3-домена одного важкого ланцюга, що стикається з вихідною поверхнею розділу CH3-домена другого важкого ланцюга у двовалентному біспецифічному антитілі, амінокислотний залишок заміняють на амінокислотний залишок, що має більший за обсягом бічний ланцюг, створюючи тим самим опуклість на поверхні розділу CH3-домена одного важкого ланцюга, що може поміститися у порожнину на поверхнірозділу CH3-домена іншого важкого ланцюга, і б) змінюють CH3-домен іншого важкого ланцюга так, що на вихідній поверхні розділу другого CH3-домена, що стикається з вихідною поверхнею розділу першого CH3-домена у двовалентному біспецифічному антитілі, амінокислотний залишок заміняють на амінокислотний залишок, що має менший за обсягом бічний ланцюг, створюючи тим самим порожнину на поверхні розділу другого CH3-домена, в яку може поміститися опуклість на поверхні розділу першого CH3-домена. Переважно зазначений амінокислотний залишок, що має більший за обсягом бічний ланцюг, вибирають з групи, що включає аргінін (R), фенілаланін (F), тирозин (Y), триптофан (W). Переважно зазначений амінокислотний залишок, що має менший за обсягом бічний ланцюг, 6 UA 100874 C2 5 10 15 20 25 30 35 40 45 50 55 60 вибирають з групи, що включає аланін (A), серин (S), треонін (T), валін (V). Відповідно до одного з об'єктів винаходу обидва CH3-домена додатково змінюють шляхом інтродукції цистеїну (C) як амінокислота у відповідних положеннях кожного CH3-домена так, щоб міг утворитися дисульфідний місток між обома CH3-доменами. В іншому кращому варіанті здійснення винаходу обидва CH3-домена змінюють, використовуючи залишки R409D; K370E (K409D) в якості утворюючих «виступ» залишків і D399K; E357K в якості утворюючих «западину» залишків, як описано, наприклад, в EP 1870459A1. Або Б) Другий альтернативний підхід (див. фіг. 4): Цей підхід передбачає заміну CH3-домена константної області одного важкого ланцюга на CH1-домен константної області важкого ланцюга; і заміну CH3-домена константної області іншого важкого ланцюга на CL-домен константної області легкого ланцюга. CH1-домен константної області важкого ланцюга, на який заміняють CH3-домен важкого ланцюга, може являти собою домен будь-якого Ig-класу (наприклад, IgA, IgD, IgE, IgG і IgM) або підкласу (наприклад, IgG1, IgG2, IgG3, IgG4, IgA1 і IgA2). CL-домен константної області легкого ланцюга, на який заміняють CH3-домен важкого ланцюга, може бути лямбда-() або каппа-() типу, переважно каппа-() типу. Таким чином, одним із кращих варіантів здійснення винаходу є двовалентне біспецифічне антитіло, що містить: а) легкий ланцюг і важкий ланцюг антитіла, яке специфічно зв'язується з першим антигеном; і б) легкий ланцюг і важкий ланцюг антитіла, яке специфічно зв'язується з другим антигеном, у якому константні домени СL і СH1 замінені один на одного, і необов'язково в) CH3-домен одного важкого ланцюга й CH3-домен іншого важкого ланцюга, кожний з яких стикається один з одним на поверхні розділу, що являє собою вихідну поверхню розділу між CH3-доменами антитіла; при цьому поверхню розділу змінюють для активації формування двовалентного біспецифічного антитіла, де зміна відрізняється тим, що: вa) змінюють CH3-домен одного важкого ланцюга так, що на вихідній поверхні розділу CH3-домена одного важкого ланцюга, що стикається з вихідною поверхнею розділу CH3-домена другого важкого ланцюга у двовалентному біспецифічному антитілі, амінокислотний залишок заміняють на амінокислотний залишок, що має більший за обсягом бічний ланцюг, створюючи тим самим опуклість на поверхні розділу CH3-домена одного важкого ланцюга, що може поміститися у порожнину на поверхні розділу CH3-домена іншого важкого ланцюга, і вб) змінюють CH3-домен іншого важкого ланцюга так, що на вихідній поверхні розділу другого CH3-домена, що стикається з вихідною поверхнею розділу першого CH3-домена у двовалентному біспецифічному антитілі, амінокислотний залишок заміняють на амінокислотний залишок, що має менший за обсягом бічний ланцюг, створюючи тим самим порожнину на поверхні розділу другого CH3-домена, в яку може поміститися опуклість на поверхні розділу першого CH3-домена; або г) CH3-домен константної області одного важкого ланцюга заміняють на CH1-домен константної області важкого ланцюга; і CH3-домен константної області іншого важкого ланцюга заміняють на CL-домен константної області легкого ланцюга. Поняття «антиген» або «молекула антигену» у контексті даного опису застосовують взаємозамінно, і вони відносяться до всіх молекул, які можуть специфічно зв'язуватися антитілом. Двовалентне біспецифічне антитіло специфічно зв'язується з першим антигеном і другим відмінним від першого антигеном. Поняття «антигени» у контексті даного опису включають, наприклад, білки, різні епітопи білків (як різні антигени відповідно до винаходу) і полісахариди. Вони головним чином включають частини (покриття, капсули, клітинні оболонки, джгутики, фімбрії й токсини) бактерій, вірусів і інших мікроорганізмів. Ліпіди й нуклеїнові кислоти є антигенами тільки при їхньому об'єднанні з білками й полісахаридами. Не стосовні до мікробів екзогенні (чужорідні) антигени можуть включати пилок, білок яєць і білки із трансплантованих тканин або органів або антигени, що перебувають на поверхні трансфузуємих кров'яних клітин. Переважно антиген вибирають з групи, що включає цитокіни, білки клітинної поверхні, ферменти й рецептори цитокінів, білків клітинної поверхні, ферментів і інші рецептори. 7 UA 100874 C2 5 10 15 20 25 30 35 40 45 50 55 60 Пухлинні антигени являють собою антигени, які презентуються молекулами ГКГ I або ГКГ II на поверхні пухлинних клітин. Іноді ці антигени презентуються пухлинними клітинами й ніколи здоровими клітинами. У цьому випадку їх називають специфічними для пухлини антигенами (TSA), і вони, як правило, є результатом специфічної для пухлини мутації. Більше розповсюдженими є антигени, які презентуються пухлинними клітинами й здоровими клітинами, і їх називають асоційованими з пухлиною антигенами (TAA). Цитотоксичні T-лімфоцити, які розпізнають ці антигени, можуть мати здатність руйнувати пухлинні клітини до їхньої проліферації або метастазування. Пухлинні антигени можуть перебувати також на поверхні пухлини у формі, зміненого у результаті мутації рецептора, у цьому випадку вони повинні розпізнаватися В-клітинами. В одному з кращих варіантів здійснення винаходу щонайменше один із двох різних антигенів (перший і другий антиген), з яким двовалентне біспецифічне антитіло специфічно зв'язується, являє собою пухлинний антиген. В іншому кращому варіанті здійснення винаходу обидва різних антигени (перший і другий антиген), з якими двовалентне біспецифічне антитіло специфічно зв'язується, являють собою пухлинні антигени; у цьому випадку перший і другий антиген можуть являти собою також два різних епітопа одного й того самого специфічного для пухлини білка. В іншому кращому варіанті здійснення винаходу щонайменше один із двох різних антигенів (перший і другий антиген), з яким двовалентне біспецифічне антитіло специфічно зв'язується, являє собою пухлинний антиген, а інший являє собою антиген ефекторної клітини, такий, наприклад, як T-клітинний рецептор, CD3, CD16 тощо. В іншому кращому варіанті здійснення винаходу щонайменше один із двох різних антигенів (перший і другий антиген), з яким двовалентне біспецифічне антитіло специфічно зв'язується, являє собою пухлинний антиген, а інший являє собою протиракову субстанцію, таку як токсин або інгібітор кінази. У контексті даного опису поняття «специфічно зв'язується» або «зв'язується специфічно з» відноситься до антитіла, яке специфічно зв'язується з антигеном. Переважно афінність до зв'язування антитіла, яке специфічно зв'язується з зазначеним антигеном, характеризується -9 -10 значенням KD 10 молей/л або нижче (наприклад, 10 молей/л), переважно значенням KD 10 10 -12 молей/л або нижче (наприклад, 10 молей/л). Афінність до зв'язування визначають за допомогою стандартного аналізу зв'язування, такого як поверхневий плазмонний резонанс (Biacore®). Поняття «епітоп» включає будь-яку поліпептидну детермінанту, що має здатність специфічно зв'язуватися з антитілом. У деяких варіантах здійснення винаходу епітопна детермінанта включає хімічно активні поверхневі групи молекул, такі як амінокислоти, бічні ланцюги цукрів, фосфорил або сульфоніл, і у деяких варіантах здійснення винаходу можуть мати специфічні тривимірні структурні характеристики й/або специфічні характеристики заряду. Епітоп являє собою область антигену, що зв'язується антитілом. У деяких варіантах здійснення винаходу вважається, що антитіло специфічно зв'язується з антигеном, коли воно переважно розпізнає його антиген-мішень у складній суміші білків і/або макромолекул. Ще одним варіантом здійснення винаходу є спосіб одержання двовалентного біспецифічного антитіла, запропонованого у винаході, який полягає у тому, що а) трансформують клітину-хазяїна - векторами, які містять молекули нуклеїнових кислот, що кодують легкий ланцюг і важкий ланцюг антитіла, яке специфічно зв'язується з першим антигеном, - векторами, які містять молекули нуклеїнових кислот, що кодують легкий ланцюг і важкий ланцюг антитіла, яке специфічно зв'язується з другим антигеном, у якому СL- і СH1-домени константних областей замінені один на одного; б) культивують клітину-хазяїна в умовах, які дозволяють синтезувати зазначену молекулу антитіла; і в) виділяють молекулу антитіла з культури. У цілому, застосовують два вектори, що кодують легкий ланцюг і важкий ланцюг антитіла, яке специфічно зв'язується з першим антигеном, і ще два вектори, що кодують легкий ланцюг і важкий ланцюг антитіла, яке специфічно зв'язується з другим антигеном. Один із двох векторів кодує відповідний легкий ланцюг, а інший з двох векторів кодує відповідний важкий ланцюг. Однак в альтернативному варіанті способу одержання двовалентного біспецифічного антитіла, запропонованого у винаході, можна застосовувати для трансформації клітини-хазяїна тільки один перший вектор, що кодує легкий ланцюг і важкий ланцюг антитіла, яке специфічно зв'язується з першим антигеном, і тільки один другий вектор, що кодує легкий ланцюг і важкий 8 UA 100874 C2 5 10 15 20 25 30 35 40 45 50 55 60 ланцюг антитіла, яке специфічно зв'язується з другим антигеном. Винахід відноситься також до способу одержання антитіл, який полягає у тому, що культивують відповідні клітини-хазяїни в умовах, які дозволяють синтезувати молекули антитіл, і виділяють антитіла з культури, наприклад, що передбачає експресію - першої нуклеотидної послідовності, що кодує легкий ланцюг антитіла, яке специфічно зв'язується з першим антигеном, - другої нуклеотидної послідовності, що кодує важкий ланцюг антитіла, яке специфічно зв'язується з першим антигеном, - третьої нуклеотидної послідовності, що кодує легкий ланцюг антитіла, яке специфічно зв'язується з другим антигеном, у якому СL-домен константної області легкого ланцюга замінений на СН1-домен константної області важкого ланцюга, і - четвертої нуклеотидної послідовності, що кодує важкий ланцюг антитіла, яке специфічно зв'язується з другим антигеном, у якому СН1-домен константної області важкого ланцюга замінений на СL-домен константної області легкого ланцюга. Ще одним варіантом здійснення винаходу є клітина-хазяїн, що містить - вектори, які містять молекули нуклеїнових кислот, що кодують легкий ланцюг і важкий ланцюг антитіла, яке специфічно зв'язується з першим антигеном, - вектори, які містять молекули нуклеїнових кислот, що кодують легкий ланцюг і важкий ланцюг антитіла, яке специфічно зв'язується з другим антигеном, у якому СL- і СH1-домени константних областей замінені один на одного. Ще одним варіантом здійснення винаходу є клітина-хазяїн, що містить a) вектор, що містить молекулу нуклеїнової кислоти, що кодує легкий ланцюг, і вектор, що містить молекулу нуклеїнової кислоти, що кодує важкий ланцюг антитіла, яке специфічно зв'язується з першим антигеном, б) вектор, що містить молекулу нуклеїнової кислоти, що кодує легкий ланцюг, і вектор, що містить молекулу нуклеїнової кислоти, що кодує важкий ланцюг, антитіла, яке специфічно зв'язується з другим антигеном, у якому СL- і СH1-домени константних областей замінені один на одного. Ще одним варіантом здійснення винаходу є композиція, переважно фармацевтична або діагностична композиція двовалентного біспецифічного антитіла, запропонованого у винаході. Ще одним варіантом здійснення винаходу є фармацевтична композиція, що містить двовалентне біспецифічне антитіло, запропоноване у винаході, і щонайменше один фармацевтично прийнятний ексципієнт. Ще одним варіантом здійснення винаходу є спосіб лікування пацієнта, що має потребу у терапії, який відрізняється тим, що вводять пацієнтові у терапевтично ефективній кількості двовалентне біспецифічне антитіло, запропоноване у винаході. Поняття «нуклеїнова кислота або молекула нуклеїнової кислоти» у контексті даного опису відноситься до молекул ДНК і молекул РНК. Молекула нуклеїнової кислоти може бути одноланцюговою або дволанцюговою, але переважно являє собою дволанцюгову ДНК. У контексті даного опису поняття «клітина», «клітинна лінія» і «клітинна культура» використовуються взаємозамінно, і всі такі визначення включають потомство. Так, поняття «трансформанти» і «трансформовані клітини» відносяться до первинної розглянутої клітини й отриманим з неї культурам безвідносно до кількості переносів. Варто розуміти також, що все потомство може не бути повністю ідентичним за складом ДНК через навмисні або випадкові мутації. Під обсяг винаходу підпадає варіант потомства, що має таку ж функцію або біологічну активність, яка виявлена у вихідної трансформованої клітини. Якщо використовуються інші визначення, то це буде очевидно з контексту. Поняття «трансформація» у контексті даного опису відноситься до процесу переносу вектора/нуклеїнової кислоти у клітину-хазяїна. Якщо як клітини-хазяїни застосовують клітини без важкоподоланих бар'єрів клітинних оболонок, то трансфекцію здійснюють, наприклад, за допомогою методу осадження фосфатом кальцію, що описаний у Graham і Van der Eh, Virology 52, 1978, сс. 546 і далі. Однак можна застосовувати також інші методи інтродукції ДНК у клітини, такі як ін'єкція ядер або злиття протопластів. Якщо застосовують прокаріотичні клітини або клітини, які містять виражені конструкції клітинних оболонок, можна застосовувати, наприклад, метод трансфекції, заснованої на обробці кальцієм, з використанням хлориду кальцію, що описаний у Cohen F. N, і ін., PNAS. 69, 1972, сс. 7110 і далі. Рекомбінантне одержання антитіл за допомогою трансформації добре відомо у даній області й описано, наприклад, в оглядових статтях Makrides S.C., Protein Expr. Purif. 17, 1999, сс. 183-202; Geisse S. і ін., Protein Expr. Purif. 8, 1996, сс. 271-282; Kaufman R.J., Mol. Biotechnol. 16, 2000, сс. 151-161; Werner R.G. і ін., Arzneimittelforschung 48, 1998, сс. 870-880, а також в US 9 UA 100874 C2 5 10 15 20 25 30 35 40 45 50 55 60 6331415 і US 4816567. У контексті даного опису поняття «експресія» відноситься до процесу, при якому нуклеїнова кислота транскрибується у мРНК, і/або до процесу, при якому транскрибуєма мРНК (яку позначають також як транскрипт) потім може транслюватися у пептиди, поліпептиди або білки. І транскрипти, і кодуємі поліпептиди позначають у цілому як генний продукт. Якщо полінуклеотид виводять з геномної ДНК, то експресія в еукаріотичній клітині може включати сплайсинг мРНК. «Вектор» являє собою молекулу нуклеїнової кислоти, зокрема самореплікаційну, що переносить вбудовану молекулу нуклеїнової кислоти у клітини-хазяїни й/або між клітинамихазяїнами. Поняття включає вектори, функція яких складається, насамперед, у вбудовуванні ДНК або РНК у клітину (наприклад, хромосомна інтеграція), у реплікаційні вектори, функція яких насамперед складається у реплікації ДНК або РНК, і в експресійні вектори, функція яких насамперед складається у транскрипції й/або трансляції ДНК або РНК. Під поняття підпадають також вектори, які мають декілька зазначених функцій. «Експресійний вектор» являє собою полінуклеотид, що при інтродукції у відповідну клітинухазяїна може транскрибуватися й транслюватися у поліпептид. Поняття «експресійна система», як правило, відноситься до прийнятної клітини-хазяїна, що містить експресійний вектор, функцією якої може бути вихід необхідного продукту експресії. Двовалентні біспецифічні антитіла, запропоновані у винаході, переважно одержують методами рекомбінації. Зазначені методи добре відомі у даній області й передбачають експресію білка у прокаріотичних і еукаріотичних клітинах з наступним виділенням поліпептиду антитіла й, як правило, очищенням до фармацевтично прийнятної чистоти. Для експресії білка нуклеїнові кислоти, що кодують легкі й важкі ланцюги або їхні фрагменти, вбудовують в експресійні вектори за допомогою стандартних методів. Експресію здійснюють у прийнятних прокаріотичних або еукаріотичних клітинах-хазяїнах типу CHO-клітин, NS0-клітин, SP2/0-клітин, HEK293-клітин, COS-клітин, дріжджів або клітин E.coli, і антитіло виділяють з клітин (з супернатанта або клітин після лізису). Двовалентні біспецифічні антитіла можуть бути присутніми у цілих клітинах, у клітинному лізаті або у частково очищеній або практично очищеній формі. Очищення здійснюють для видалення інших клітинних компонентів або інших забруднювачів, наприклад, інших клітинних нуклеїнових кислот або білків, стандартними методами, які включають обробку лугом/ДСН, хроматографію на колонках і інші методи, добре відомі у даній області (див. у Current Protocols in Molecular Biology, під ред. Ausubel F., і ін., вид-в Greene Publishing and Wiley Interscience, New York, 1987). Експресія у NS0-клітинах описана, наприклад, у Barnes L.M. і ін., Cytotechnology 32, 2000, сс. 109-123; і Barnes L.M. і ін., Biotech. Bioeng. 73, 2001, сс. 261-270. Короткочасна експресія описана, наприклад, у Durocher Y. і ін., Nucl. Acids. Res. 30, 2002, с. E9. Клонування варіабельних областей описане в Orlandi R. і ін., Proc. Natl. Acad. Sci. USA 86, 1989, сс. 38333837; Carter P. і ін., Proc. Natl. Acad. Sci. USA 89, 1992, сс. 4285-4289; і Norderhaug L. і ін., J. Immunol. Methods 204, 1997, сс. 77-87. Краща система короткочасної експресії (HEK293) описана у Schlaeger E.-J. і Christensen K., у Cytotechnology 30, 1999, сс. 71-83 і у Schlaeger E.-J. в J. Immunol. Methods 194, 1996, сс. 191-199. Контролюючі послідовності, які можна застосовувати для прокаріот, являють собою, наприклад, промотор, необов'язково послідовність оператора й сайт зв'язування рибосом. Відомо, що еукаріотичні клітини можуть використовувати промотори, енхансери й сигнали поліаденілювання. Нуклеїнова кислота «функціонально зв'язана», коли вона поміщена під функціональний контроль іншої нуклеотидної послідовності. Наприклад, ДНК передпослідовності або лідера секреції функціонально пов'язана з ДНК, що кодує поліпептид, якщо вона експресується у вигляді передбілка, що бере участь у секреції поліпептиду; промотор або енхансер функціонально пов'язаний з послідовністю, що кодує, якщо він впливає на транскрипцію послідовності; або сайт зв'язування рибосом функціонально пов'язаний з послідовністю, що кодує, якщо він поміщений так, щоб він полегшував трансляцію. Як правило, «функціонально зв'язані» означає, що послідовності ДНК, будучи зв'язані, є суміжними, а у випадку лідера секреції, суміжними у рамці зчитування. Однак не потрібно, щоб енхансери були суміжними. Зв'язування здійснюють шляхом лігування у придатних сайтах рестрикції. Якщо такі сайти не існують, то відповідно до загальноприйнятої практики використовують синтетичні олігонуклеотидні адаптори або лінкери. Двовалентні біспецифічні антитіла можна відокремлювати від культурального середовища за допомогою загальноприйнятих методів очистки імуноглобулінів, таких, наприклад, як хроматографія на протеїн A-сефарозі, хроматографія на гідроксилапатиті, гель-електрофорез, діаліз або афінна хроматографія. ДНК або РНК, які кодують моноклональні антитіла, легко 10 UA 100874 C2 5 10 15 20 25 30 35 40 45 50 55 виділяти й секвенувати за допомогою загальноприйнятих методів. Джерелом таких ДНК і РНК можуть служити клітини гібридом. Після виділення ДНК можна вбудовувати в експресійні вектори, якими потім трансфектують клітини-хазяїни, такі як клітини HEK293, CHO-клітини або клітини мієломи, які інакше не можуть продукувати білок імуноглобуліну, для синтезу рекомбінантних моноклональних антитіл у клітинах-хазяїнах. Варіанти амінокислотної послідовності (або мутанти) двовалентного біспецифічного антитіла одержують шляхом інтродукції відповідних нуклеотидних замін у ДНК антитіла або шляхом синтезу нуклеотидів. Однак такі модифікації можна здійснювати тільки у дуже обмеженому діапазоні, наприклад, як описано вище. Наприклад, модифікації не повинні змінювати вищевказані характеристики антитіла, такі як ізотип IgG і зв'язування з антигеном, але можуть підвищувати вихід продукту рекомбінації, стабільність білка або полегшувати очищення. Наступні приклади, перелік послідовностей і креслення дані з метою кращого розуміння даного винаходу, повний обсяг якого представлений у наведеній нижче формулі винаходу. Очевидно, що можуть бути зроблені модифікації у викладених процедурах без відхилення від суті винаходу. Перелік послідовностей SEQ ID NO: 1 амінокислотна послідовність важкого ланцюга антитіла дикого типу. SEQ ID NO: 2 амінокислотна послідовність легкого ланцюга антитіла дикого типу. SEQ ID NO: 3 амінокислотна послідовність важкого ланцюга ** (HC**) антитіла , що несе заміну СL-СH1, в якому СН1-домен важкого ланцюга замінений на СL-домен легкого ланцюга. SEQ ID NO: 4 амінокислотна послідовність легкого ланцюга ** (LC**) антитіла , що несе заміну СL-СH1, в якому СL-домен легкого ланцюга замінений на СH1-домен важкого ланцюга. SEQ ID NO: 5 амінокислотна послідовність ектодомена (ECD) IGF-1R, що несе мітку, яка являє собою His-стрептавідин-єднальний пептид (ECD IGF-1R-His-SBP). SEQ ID NO: 6 амінокислотна послідовність важкого ланцюга антитіла до ANGPT2 (ангіопоетин-2) дикого типу. SEQ ID NO: 7 амінокислотна послідовність легкого ланцюга антитіла до ANGPT2 дикого типу. SEQ ID NO: 8 амінокислотна послідовність CH3-домена («виступи») із заміною T366W для застосування у технології «knobs-into-holes». SEQ ID NO: 9 амінокислотна послідовність CH3-домена («западина») із заміною T366S, L368A, Y407V для застосування у технології «knobs-into-holes». SEQ ID NO: 10 амінокислотна послідовність ектодомена IGF-1R, що несе мітку, яка являє собою His-стрептавідин-єднальний пептид (ECD IGF-1R-His-SBP). Опис креслень На кресленнях показано: на фіг. 1 - схематичне зображення повного антитіла, що зустрічається у природних умовах, типу IgG, специфічного у відношенні одного антигену, з двома парами важких і легких ланцюгів, кожна з яких містить розташовані у загальноприйнятому порядку варіабельні й константні домени; на фіг. 2 - схематичне зображення двовалентного біспецифічного антитіла, що містить: a) легкий ланцюг і важкий ланцюг антитіла, яке специфічно зв'язується з першим антигеном; і б) легкий ланцюг і важкий ланцюг антитіла, яке специфічно зв'язується з другим антигеном, у якому СL- і СH1-домени константних областей замінені один на одного; на фіг. 3 - схематичне зображення двовалентного біспецифічного антитіла, що містить: a) легкий ланцюг і важкий ланцюг антитіла, яке специфічно зв'язується з першим антигеном; і б) легкий ланцюг і важкий ланцюг антитіла, яке специфічно зв'язується з другим антигеном, у якому СL- і СH1-домени константних областей замінені один на одного й у якому CH3-домени обох важких ланцюгів змінені за допомогою технології «knobs-into-holes»; на фіг. 4 - схематичне зображення двовалентного біспецифічного антитіла, що містить: a) легкий ланцюг і важкий ланцюг антитіла, яке специфічно зв'язується з першим антигеном; і б) легкий ланцюг і важкий ланцюг антитіла, яке специфічно зв'язується з другим антигеном, у якому СL- і СH1-домени константних областей замінені один на одного й у якому один з CH3доменів константної області обох важких ланцюгів замінений на CH1-домен константної області важкого ланцюга; а інший CH3-домен константної області важкого ланцюга замінений на CLдомен константної області легкого ланцюга; 60 11 UA 100874 C2 5 10 15 20 25 30 35 40 45 50 55 60 на фіг. 5 - схематичне зображення білкової послідовності важкого ланцюга ** HC** антитіла , що несе заміну СL-СH1 (з CL-доменом константної області легкого каппаланцюга); на фіг. 6 - схематичне зображення білкової послідовності легкого ланцюга ** LC***антитіла , що несе заміну СL-СH1; на фіг. 7 - плазмідна карта експресійного вектора pUC-HC**-IGF-1R важкого ланцюга ** HC**; на фіг. 8 - плазмідна карта експресійного вектора pUC-LC**-IGF-1R легкого ланцюга ** LC**; на фіг. 9 - плазмідна карта експресійного вектора 4700-Hyg-OriP; на фіг. 10 - принцип здійснення клітинного FACS-аналізу, що дозволяє виявляти утворення мостикового зв'язку типу IGF-1R-ANGPT2 з використанням клітин лінії I24, що експресують IGF1R, з метою виявлення присутності функціонального біспецифічного антитіла , що несе заміну СL-СH1; на фіг. 11 - схематичне зображення принципу здійснення Biacore-аналізу з використанням ECD IGF-1R; на фіг. 12 - результати, отримані за допомогою ДСН-ПААГ і гель фільтрації, для очищеного моноспецифічного двовалентного антитіла , що несе заміну СL-СH1 (IgG1**), у якого HC** і LC** виділені з супернатантів клітинних культур після короткочасної трансфекції клітин лінії HEK293-F; на фіг. 13 - дані про зв'язування моноспецифічного антитіла , що несе заміну СLСH1, і антитіла дикого типу з ECD IGF-1R, отримані на основі оцінки зв'язування за допомогою ELISA; на фіг. 14 - результати, отримані за допомогою ДСН-ПААГ і гель-фільтрації, для суміші, що містить антитіло , що несе заміну СL-СH1, очищеної з супернатантів клітинних культур після короткочасної трансфекції клітин лінії HEK293-F; на фіг. 15 - результати, отримані для зразків А-Е, за допомогою FACS-аналізу, що дозволяє виявляти утворення мостикового зв'язку типу IGF-1R-ANGPT2 з використанням клітин лінії I24, що експресують IGF-1R, з метою виявлення присутності функціонального біспецифічного антитіла , що несе заміну СL-СH1, в очищеній суміші антитіл: очищені білки зразків А-Е: A = клітини лінії I24, неопрацьовані, Б = I24 + 2 мкг/мл hANGPT2 + ізотип hIgG, В = I24 + 2 мкг/мл hANGPT2 + суміш, отримана у результаті спільної експресії антитіла , що несе заміну СL-СH1, і антитіла дикого типу, що містить біспецифічне антитіло , що несе заміну СL-СH1, Г - відсутній, Д = I24 + 2 мкг/мл hANGPT2 + антитіло дикого типу, Е = I24 + 2 мкг/мл hANGPT2 + антитіло дикого типу. Приклади Матеріали й загальні методи Загальна інформація, що стосується нуклеотидних послідовностей легких і важких ланцюгів людського імуноглобуліну, представлена у: Kabat E.A. і ін., Sequences of Proteins of Immunological Interest, 5-е вид., вид-в Public Health Service, National Institutes of Health, Bethesda, MD, 1991. Амінокислоти ланцюгів антитіл пронумеровані відповідно до нумерації EU (Edelman G.M. і ін., Proc. Natl. Acad. Sci. USA 63, 1969, сс. 78-85; Kabat E.A. і ін., Sequences of Proteins of Immunological Interest, 5-е вид., вид-в Public Health Service, National Institutes of Health, Bethesda, MD, 1991). Методи рекомбінантної ДНК Для маніпуляцій з ДНК використовували стандартні методи, описані у Sambrook J. і ін., Molecular cloning: A laboratory manual; Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, 1989. Реагенти для молекулярної біології використовували відповідно до інструкцій виробників. Синтез генів Необхідні сегменти генів одержували з олігонуклеотидів, створених шляхом хімічного синтезу. Генні сегменти довжиною 600 - 1800 т.п.н., які фланковані унікальними сайтами рестрикції, збирали шляхом відпалу й лігування олігонуклеотидів, включаючи ПЛР-ампліфікацію й наступне клонування через зазначені сайти рестрикції, наприклад, KpnI/ SacI або AscI/PacI у клонуючому векторі pGA4, основою якого є плазміда pPCRScript (фірма Stratagene). Послідовності ДНК субклонованих генних фрагментів підтверджували шляхом секвенування 12 UA 100874 C2 5 10 15 20 25 30 35 40 45 50 55 60 ДНК. Синтез генних фрагментів здійснювали у порядку, представленому у специфікації фірми Geneart (Регенсбург, Німеччина). Визначення послідовностей ДНК Послідовності ДНК визначали шляхом секвенування двох ланцюгів на фірмі MediGenomix GmbH (Мартинсрид, Німеччина) або фірмі Sequiserve GmbH (Фатерштеттен, Німеччина). Аналіз послідовностей ДНК і білків і обробка даних про послідовності Застосовували пакет програм фірми GCG (Genetics Computer Group, Медісон, шт. Вісконсин), версія 10.2 і Infomax's Vector NT1 Advance suite, версія 8.0 для створення, картування, аналізу, анотування й ілюстрації послідовностей. Експресійні вектори Для експресії описаних антитіл застосовували варіанти експресійних плазмід, призначених для короткочасної експресії (наприклад, у клітинах HEK293 EBNA або HEK293-F), або на основі кДНК-конструкції з використанням промотору CMV-інтрона A, або на основі геномної конструкції з використанням промотору CMV. Крім касети експресії антитіла вектори містили: - сайт ініціації реплікації, що забезпечує реплікацію зазначеної плазміди в E. coli, і - ген -лактамази, що надає стійкість в E. coli до ампіциліну. Транскрипційна одиниця гена антитіла складалася з наступних елементів: - унікальний(і) сайт(и) рестрикції на 5'-кінці, - негайно-ранній енхансер і промотор з людського цитомегаловірусу, - розташована за ним послідовність інтрону A у випадку експресії на основі кДНК-конструкції, - 5'-нетрансльована область гена людського антитіла, - сигнальна послідовність важкого ланцюга імуноглобуліну, - ланцюг людського антитіла (дикого типу або із заміною доменів) або у вигляді кДНКконструкції, або у вигляді геномної конструкції з екзон-інтронною конструкцією імуноглобуліну, - 3'-нетрансльована область з сигнальною послідовністю поліаденілювання й - унікальний(і) сайт(и) рестрикції на 3'-кінці. Злиття генів, що містять описані ланцюги антитіла, як зазначено нижче, здійснювали за допомогою ПЛР і/або синтезу й складання генів з використанням відомих методів і процедур рекомбінації шляхом з'єднання відповідних сегментів нуклеїнових кислот, наприклад, з використанням унікальних сайтів рестрикції у відповідних векторах. Субклоновані нуклеотидні послідовності підтверджували секвенуванням ДНК. Для короткочасних трансфекцій створювали великі кількості плазмід за допомогою одержання плазмід із трансформованих культур E. coli (набір Nucleobond AX, фірма Macherey-Nagel). Методики культивування клітин Застосовували стандартні методики культивування клітин, описані у Current Protocols in Cell Biology, під ред. Bonifacino J.S., Dasso M., Harford J.B., Lippincott-Schwartz J. і Yamada K.M., видв John Wiley & Sons, Inc., 2000. Біспецифічні антитіла експресували шляхом короткочасної котрансфекції відповідними експресійними плазмідами вирощених у вигляді прикріплених культур клітин HEK293-EBNA або вирощених у вигляді суспензійних культур клітин HEK29-F, як буде описано нижче. Короткочасні трансфекції у системі HEK293-EBNA Біспецифічні антитіла експресували шляхом короткочасної котрансфекції відповідними експресійними плазмідами (наприклад, що кодують важкий ланцюг і модифікований важкий ланцюг, а також відповідний легкий ланцюг і модифікований легкий ланцюг) вирощених у вигляді прикріплених культур клітин HEK293-EBNA (лінія клітин нирки людського ембріона 293, що експресує ядерний антиген вірусу Епштейна-Барра; Американська колекція типових культур, депонована під номером ATCC № CRL-10852, партія 959 218), які культивували у середовищі DMEM (модифікована по методу Дульбекко середовище Голка, фірма Gibco), доповненої 10% FCS (фетальна теляча сироватка, фірма Gibco) з ультра низьким вмістом IgG (Ultra Low IgG FCS), 2мМ L-глутаміном (фірма Gibco) і 250 мкг/мл генетицину (фірма Gibco). Для трансфекції застосовували реагент для трансфекції типу FuGENE™ 6 (фірма Roche Molecular Biochemicals), використовуючи співвідношення реагенту FuGENE™ (мкл) і ДНК (мкг) 4:1 (діапазон від 3:1 до 6:1). Білки експресували, застосовуючи відповідні плазміди, з використанням молярного співвідношення плазмід, що кодують (модифікованого й дикого типу) легкий ланцюг і важкий ланцюг, 1:1 (еквімолярне співвідношення), у діапазоні від 1:2 до 2:1 відповідно. Клітини підживлювали у день 3 L-глутаміном до концентрації 4мМ, глюкозою (фірма Sigma) і NAA (амід нікотинової кислоти) (фірма Gibco). Збирали супернатанти клітинних культур, що містять біспецифічне антитіло, у дні з 5 по 11 після трансфекції шляхом центрифугування й зберігали при -20°C. Загальну інформацію, що стосується рекомбінантної експресії людських 13 UA 100874 C2 5 10 15 20 25 30 35 40 45 50 55 60 імуноглобулінів, наприклад, у HEK293-клітинах, див. у Meissner P. і ін., Biotechnol. Bioeng. 75, 2001, сс. 197-203. Короткочасні трансфекції у системі HEK293-F Біспецифічні антитіла одержували шляхом короткочасної трансфекції відповідними плазмідами (наприклад, що кодують важкий ланцюг і модифікований важкий ланцюг, а також відповідний легкий ланцюг і модифікований легкий ланцюг), використовуючи систему HEK293-F (фірма Invitrogen) відповідно до інструкції виробника. У цілому, метод полягав у наступному: HEK 293-F-клітини (фірма Invitrogen), вирощені у вигляді суспензійної культури або у колбі, що струшується, або у ферментері з мішалкою у безсироваточному середовищі для експресії типу FreeStyle 293 (фірма Invitrogen), трансфектували сумішшю чотирьох експресійних плазмід і 293фектином або фектином (фірма Invitrogen). У 2-літрову колбу (фірма Corning), що струшується, 6 висівали клітини HEK293-F з щільністю 1,0×10 клітин/мл у 600 мл і інкубували при 120 об/хв, 6 8% CO2. Через 1 день клітини трансфектували при щільності клітин приблизно 1,5×10 клітин/мл за допомогою приблизно 42 мл суміші A), що містить 20 мл Opti-MEM (фірма Invitrogen) з 600 мкг загальної плазмідної ДНК (1 мкг/мл), що кодує важкий ланцюг або модифікований важкий ланцюг відповідно й відповідний легкий ланцюг, в еквімолярному співвідношенні, і суміші Б), що містить 20 мл Opti-MEM + 1,2 мл 293-фектину або фектину (2 мкл/мл). Залежно від поглинання глюкози у процесі ферментації додавали розчин глюкози. Через 5-10 днів збирали супернатант, що містить секретоване антитіло, і або з супернатанта безпосередньо очищали антитіла, або супернатант заморожували й зберігали. Визначення білка Концентрацію білків очищених антитіл і їхніх похідних визначали на основі оптичної щільності (ОЩ) при 280 нм, використовуючи коефіцієнт молярної екстинкції, розрахований на основі амінокислотної послідовності відповідно до методу, що описаний у Pace і ін., Protein Science, 1995, 4, сс. 2411-1423. Визначення концентрації антитіл у супернатантах Концентрацію антитіл і їхніх похідних у супернатантах клітинних культур визначали шляхом імунопреципітації з білок А-агарозними гранулами (фірма Roche). 60 мкл білок А-агарозних гранул відмивали тричі у TBS-NP40 (50мМ Трис, pH 7,5, 150мМ NaCl, 1% Nonidet-P40). Потім 1 15 мл супернатанта клітинної культури наносили на білок А-агарозні гранули, попередньо врівноважені у TBS-NP40. Після інкубації протягом 1 год при кімнатній температурі гранули відмивали на фільтрувальній колонці типу Ultrafree-MC (фірма Amicon), використовуючи однократно 0,5 мл TBS-NP40, двічі 0,5 мл дворазового (2×) забуференного фосфатом фізіологічного розчину (2×ЗФР, фірма Roche) і швидко чотири рази 0,5 мл 100мМ Na-цитратним буфером, pH 5,0. Зв'язане антитіло елюювали, додаючи 35 мкл буфера для зразків NuPAGE® LDS (фірма Invitrogen). Половину зразка поєднували з відновлювачем для зразків NuPAGE® або залишали у невідновленій формі відповідно й витримували протягом 10 хв при 70°C. Потім по 5-30 мкл застосовували для здійснення ДСН-ПААГ з використанням 4-12% біс-Трис-гелів NuPAGE® (фірма Invitrogen) (застосовуючи буфер MOPS для здійсненні ДСН-ПААГ в умовах, що не відновлюють, і буфер MES у вигляді рухливого буфера з антиоксидантною добавкою NuPAGE® (фірма Invitrogen) для здійсненні ДСН-ПААГ в умовах, що відновлюють) і офарбовували кумасси брильянтовим блакитним. Концентрацію антитіл і їхніх похідних у супернатантах клітинних культур оцінювали кількісно за допомогою афінної ЖХВР-хроматографії. У цілому, метод полягав у наступному: супернатанти, що містять антитіла і їхні похідні, які зв'язувалися з білком А, вносили на колонку Applied Biosystems Poros A/20 в 200мМ KH2PO4, 100мМ натрій-цитратний буфер, pH 7,4 і елюювали з матриксу за допомогою 200мМ NaCl, 100мМ лимонної кислоти, pH 2,5 з використанням системи Agilent HPLC 1100. Елюйований білок оцінювали кількісно за допомогою УФ-абсорбції й інтегрування площ піків. Очищене стандартне антитіло у вигляді IgG1 служило як стандарт. В альтернативному варіанті концентрацію антитіл і їхніх похідних у супернатантах клітинних культур оцінювали за допомогою «сендвіч»-IgG-ELISA. У цілому, метод полягав у наступному: 96-ямкові титраційні мікропланшети, що мають високу здатність зв'язувати стрептавідин А (планшети типу StreptaWell High Bind Strepatavidin A (фірма Roche)), сенсибілізували з розрахунку 100 мкл/лунку біотинільованим антилюдським IgG F(ab’)2BI, застосовуваним як іммобілізована молекула (фірма Dianova), у концентрації 0,1 мкг/мл протягом 1 год при кімнатній температурі або в іншому варіанті протягом ночі при 4°C і потім відмивали тричі, використовуючи 200 мкл/лунку ЗФР, 0,05% Твін (ЗФР, фірма Sigma). Додавали у лунки по 100 мкл/лунку серійних розведень у ЗФР (фірма Sigma), що містять відповідне антитіло супернатантів клітинних культур, та інкубували протягом 1-2 год на шейкері для титраційних 14 UA 100874 C2 5 10 15 20 25 30 35 40 45 50 55 60 мікропланшетів при кімнатній температурі. Лунки відмивали тричі, використовуючи 200 мкл/лунку ЗФРТ, і зв'язане антитіло виявляли за допомогою 100 мкл F(ab')2POD (фірма Dianova) у концентрації 0,1 мкг/мл як ідентифікуюче антитіло протягом 1-2 год на шейкері для титраційних мікропланшетів при кімнатній температурі. Незв'язане ідентифікуюче антитіло відмивали тричі, використовуючи 200 мкл/лунку ЗФР, і зв'язане ідентифікуюче антитіло виявляли, додаючи 100 мкл ABTS/лунку. Визначення абсорбції здійснювали на спектрометрі типу Tecan Fluor при довжині хвилі 405 нм (довжина референс хвилі 492 нм). Очищення білків Білки очищали із профільтрованих супернатантів клітинних культур відповідно до стандартних протоколів. У цілому, метод полягав у наступному: білки наносили на колонку, заповнену білок А-сефарозою (фірма GE Нealthcare), і відмивали ЗФР. Елюцію антитіл здійснювали при pH 2,8 з наступною негайною нейтралізацією зразка. Агрегований білок відокремлювали від мономерних антитіл гель-фільтрацією (Superdex 200, фірма GE Healthcare) у ЗФР або у 20мМ гістидині, 150мМ NaCl, pH 6,0. Фракції мономерних антитіл поєднували, при необхідності концентрували, використовуючи, наприклад, центрифужний концентратор типу MILLIPORE Amicon Ultra (30 MWCO (молекулярновагова межа), заморожували й зберігали при 20°C або -80°C. Частину зразків залишали для наступного аналітичного вивчення білка і його аналітичної характеризації, наприклад, за допомогою ДСН-ПААГ, гель-фільтрації або масспектрометрії. ДСН-ПААГ Застосовували систему гелю NuPAGE® Pre-Cast (фірма Invitrogen) відповідно до інструкції виробника. Зокрема використовували 10% або 4-12% біс-Трис-гелі NuPAGE®, Novex® (pH 6,4) і рухливі буфери, такі як NuPAGE® MES (гелі, які застосовуються в умовах, що відновлюють, рухливий буфер з антиоксидантною добавкою NuPAGE®) або MOPS (гелі, які застосовуються в умовах, що не відновлюють). Аналітична гель-фільтрація Як гель-фільтрація, призначена для визначення агрегованого й олігомерного стану антитіл, застосовували ЖХВР-хроматографію. У цілому, метод полягав у наступному: очищені на білку А антитіла вносили у колонку типу Tosoh TSKgel G3000SW у 300мМ NaCl, 50мМ KH 2PO4/K2HPO4, pH 7,5 у системі Agilent HPLC 1100, або у колонку Superdex 200 (фірма GE Healthcare) у 2×ЗФР у ЖХВР-системі Dionex. Кількість елюйованого білка визначали на основі УФ-абсорбції й інтегрування площ піків. Як стандарт застосовували стандарт для гель-фільтрації фірми BioRad (Gel Filtration Standard 151-1901). Мас-спектрометрія Загальну деглікозиловану масу антитіл, отриманих у результаті кросинговеру, визначали й підтверджували за допомогою мас-спектрометрії з іонізацією електроспреєм (ESI-МС). У цілому, метод полягав у наступному: 100 мкг очищених антитіл деглікозилували за допомогою 50 мед. N-глікозидази F (PNGаза, фірма ProZyme) у 100мМ KH2PO4/K2HPO4, pH 7 при 37°C протягом 1224 год при концентрації білка аж до 2 мг/мл і потім знесолювали за допомогою ЖХВР на колонці Sephadex G25 (фірма GE Healthcare). Масу відповідних важких і легких ланцюгів визначали за допомогою ESI-МС після деглікозилування й відновлення. У цілому, метод полягав у наступному: 50 мкг антитіла у 115 мкл інкубували з 60 мкл 1M TCEP і 50 мкл 8M гідрохлориду гуанідиду після знесолення. Загальну масу й масу відновлених важких і легких ланцюгів визначали за допомогою ESI-МС з використанням Мс-системи Q-Star Elite, забезпеченої джерелом NanoMate. ELISA для оцінки зв'язування ECD IGF-1R Особливості зв'язування створених антитіл з позаклітинним доменом (ECD) IGF-1R аналізували за допомогою ELISA. Для цієї мети позаклітинний домен IGF-1R (залишки 1-462), що містить лідерну послідовність, яка зустрічається у природних умовах, і 12 богатих LIцистеїном доменів ектодомена альфа-ланцюга людського IGF-IR (згідно McKern і ін., 1997; Ward і ін., 2001), злитий з N-кінцевою міткою, що представляє собою His-стрептавідин-єднальний пептид (His-SBP), клонували у похідному вектора pcDNA3 і короткочасно експресували у HEK293F-клітинах. Білкова послідовність ECD IGF-1R-His-SBP представлена у SEQ ID NO: 10. 96-ямкові титраційні мікропланшети, що мають високу здатність зв'язувати стрептавідин А (планшети типу StreptaWell High Bind Strepatavidin A (фірма Roche)), сенсибілізували, використовуючи 100 мкл/лунку супернатанта клітинної культури, що містить розчинний злитий білок IGF-1R-ECD-SBP, протягом ночі при 4°C і відмивали тричі, використовуючи 200 мкл/лунку ЗФР, 0,05% Твін (ЗФР, фірма Sigma). Потім додавали у лунки з розрахунку 100 мкл/лунку серійні розведення відповідного антитіла й в якості референс-антитіла антитіло дикого типу у ЗФР (фірма Sigma), що включало 1% БСА (фракція V, фірма Roche), та інкубували протягом 1-2 15 UA 100874 C2 5 10 15 20 25 30 35 40 45 50 55 60 год на шейкері для титраційних мікропланшетів при кімнатній температурі. При здійсненні серійних розведень у лунки вносили однакову кількість очищеного антитіла. Лунки відмивали тричі, використовуючи 200 мкл/лунку ЗФР, і зв'язане антитіло виявляли, використовуючи 100 мкл/лунку F(ab')2POD (фірма Dianova) у концентрації 0,1 мкг/мл (1:8000) як ідентифікуюче антитіло, протягом 1-2 год на шейкері для титраційних мікропланшетів при кімнатній температурі. Незв'язане ідентифікуюче антитіло відмивали тричі, використовуючи 200 мкл/лунку ЗФР, і зв'язане ідентифікуюче антитіло виявляли, додаючи 100 мкл ABTS/лунку. Визначення абсорбції здійснювали на спектрометрі Tecan Fluor при довжині хвилі 405 нм (довжина референс хвилі 492 нм). Biacore-аналіз із використанням ECD IGF-1R (IGF-1R-ECD) Зв'язування створених антитіл з людським IGF-1R-ECD досліджували також за допомогою поверхневого плазмонного резонансу, використовуючи пристрій типу BIACORE T100 (фірма GE Healthcare Biosciences AB, Упсала, Швеція). У цілому, метод полягав у наступному: для оцінки афінності козячі антилюдські антитіла типу IgG JIR 109-005-098 іммобілізували на CM5-чипі за допомогою амінового сполучення для презентації антитіл до людського IGF-1R-ECD, що несуть Fc. Зв'язування оцінювали у HBS-буфері (HBS-P (10мМ HEPES, 150мМ NaCl, 0,005% Твін 20, рН 7,4) при 25°C. IGF-1R-ECD (фірма R&D Systems або отриманий при створенні винаходу) додавали у розчин у різних концентраціях. Асоціацію оцінювали шляхом ін'єкції IGF-1R-ECD протягом проміжку часу від 80 с до 3 хв; дисоціацію оцінювали шляхом відмивання поверхні чипа HBS-буфером протягом 3-10 хв і значення KD визначали, використовуючи модель зв'язування Ленгмюра при співвідношенні 1:1. Через низьку щільність завантаження й рівня захоплення антитіл одержували дані про зв'язування одновалентного IGF-1R-ECD. Дані, отримані для негативного контролю (наприклад, криві, отримані тільки для буфера) віднімали з кривих, отриманих для зразка, для корекції властивого системі зрушення основного рівня й для зниження шумових сигналів. Застосовували програму Biacore T100 Evaluation, версія 1.1.1 для аналізу сенсограмм і для розрахунку даних, що стосуються афінності. На фіг. 11 представлене схематичне зображення Biacore-аналізу. Приклади 1 Одержання, експресія, очищення й характеризація моноспецифічного двовалентного антитіла , в якому СL- і СH1-домени константних областей замінені один на одного (скорочено позначено у контексті даного опису як антитіло , що несе заміну СL-СH1) Приклад 1A Створення експресійних плазмід для моноспецифічного двовалентного антитіла , що несе заміну СL-СH1 Послідовності варіабельних доменів важкого й легкого ланцюга моноспецифічного двовалентного антитіла , що несе заміну СL-СH1, включаючи відповідні лідерні послідовності, описані у даному прикладі, виводили з важкого ланцюга людського антитіла (SEQ ID NO: 1, плазміда 4843-pUC-HC-IGF-1R) і його легкого ланцюга (SEQ ID NO: 2, плазміда 4842-pUC-LC-IGF-1R), які описані у WO 2005/005635, і константні домени важкого й легкого ланцюга виводили з людського антитіла (C-каппа й IgG1). Генні сегменти, що кодують лідерну послідовність, варіабельний домен важкого ланцюга (VН) і домен людського легкого каппа-ланцюга (CL) антитіла зчіплювали й зливали з 5'-кінцем Fc-доменів константних областей людського важкого 1-ланцюга (шарнір-CH2-CH3). ДНК, що кодує відповідний злитий білок, отриманий у результаті заміни СH1-домена на СLдомен (заміна СH1-СL), створювали шляхом синтезу гена й позначали далі як HC** (SEQ ID NO: 3). Генні сегменти, що кодують лідерну послідовність, варіабельний домен легкого ланцюга (VL) і константний домен (СН1) людського важкого 1-ланцюга антитіла зчіплювали у вигляді незалежного ланцюга. ДНК, що кодує відповідний злитий білок, отриманий у результаті заміни СL-домена на СН1-домен (заміна СL-СH1), створювали шляхом синтезу гена й позначали далі як LC** (SEQ ID NO: 4). На фіг. 5 і фіг. 6 представлене схематичне зображення білкової послідовності модифікованого важкого ланцюга HC** і модифікованого легкого ланцюга LC**. Нижче коротко описані відповідні експресійні вектори: Вектор pUC-HC**-IGF-1R Вектор pUC-HC**-IGF-1R являє собою експресійну плазміду, наприклад, призначеного для короткочасної експресії несучого заміну СL-СH1 важкого ланцюга HC** (касета експресії на основі кДНК-конструкції; з CMV-інтроном A), у клітинах лінії HEK293 (EBNA) або стабільної експресії у CHO-клітинах. 16 UA 100874 C2 5 10 15 20 25 30 35 40 45 50 55 Крім експресійної касети HC** цей вектор містив: - сайт ініціації реплікації з pUC18, що забезпечує реплікацію зазначеної плазміди в E. coli, і - ген -лактамази, що надає стійкість в E. coli до ампіциліну. Транскрипційна одиниця гена HC** містила наступні елементи: - сайт рестрикції AscI на 5'-кінці, - негайно-ранній енхансер і промотор з людського цитомегаловірусу, - розташовану за ним послідовність інтрона A, - 5'-нетрансльовану область гена людського антитіла, - сигнальну послідовність легкого ланцюга імуноглобуліну, - ген людського зрілого HC**-ланцюга , що кодує злиття варіабельного домена людського важкого ланцюга (VH) і константного домена людського легкого каппа-ланцюга (CL), злитий на 5'-кінці Fc-доменів константних доменів людського важкого 1-ланцюга (шарнір-CH2CH3), - 3'-нетрансльовану область з сигнальною послідовністю поліаденілювання й - сайт рестрикції SgrAI на 3'-кінці. Плазмідна карта експресійного вектора pUC-HC**-IGF-1R, призначеного для несучого заміну СL-СH1 важкого ланцюга ** HC**, представлена на фіг. 7. Амінокислотна послідовність HC** (включаючи сигнальну послідовність) представлена у SEQ ID NO: 3. Вектор pUC-LC**-IGF-1R Вектор pUC-LC**-IGF-1R являє собою експресійну плазміду, наприклад, призначеного для короткочасної експресії несучого заміну СL-СH1 легкого ланцюга LC** ((касета експресії на основі кДНК-конструкції; з CMV-інтроном A), у клітинах лінії HEK293 (EBNA) або стабільної експресії у CHO-клітинах. Крім експресійної касети LC** цей вектор містив: - сайт ініціації реплікації з pUC18, що забезпечує реплікацію зазначеної плазміди в E. coli, і - ген β-лактамази, що надає стійкість в E. coli до ампіциліну. Транскрипційна одиниця гена LC** містила наступні елементи: - сайт рестрикції Sse8387I на 5'-кінці, - негайно-ранній енхансер і промотор з людського цитомегаловірусу, - розташовану за ним послідовність інтрона A, - 5'-нетрансльовану область гена людського антитіла, - сигнальну послідовність важкого ланцюга імуноглобуліну, - ген людського зрілого LC**-ланцюга , що кодує злиття варіабельного домена людського легкого ланцюга (VL) і константних доменів людського важкого 1-ланцюга (CH1), - 3'-нетрансльовану область з сигнальною послідовністю поліаденілювання й - сайти рестрикції SalI і FseI на 3'-кінці. Плазмідна карта експресійного вектора pUC-LC**-IGF-1R, призначеного для несучого заміну СL-СH1 легкого ланцюга ** LC**, представлена на фіг. 8. Амінокислотна послідовність LC** (включаючи сигнальну послідовність) представлена у SEQ ID NO: 4. Плазміди pUC-HC**-IGF-1R і pUC-LC**-IGF-1R можна застосовувати для короткочасних або стабільних котрансфекцій, наприклад, клітин HEK293, HEK293 EBNA або CHO (2-векторна система). З метою порівняння здійснювали короткочасну експресію антитіла дикого типу з плазмід 4842-pUC-LC-IGF-1R (SEQ ID NO: 2) і 4843-pUC-HC-IGF-1R (SEQ ID NO: 1), аналогічно методу, описаному у цьому прикладі. Для досягнення більше високих рівнів експресії при короткочасних експресіях у клітинах HEK293 EBNA експресійну касету HC** можна субклонувати із використанням сайтів AscI, SgrAI, а експресійну касету LC** можна субклонувати із використанням сайтів Sse8387I і FseI в експресійному векторі 4700-pUC-Hyg_OriP, що містив - елемент OriP і - ген, що обумовлює стійкість до гігроміцину, в якості селектуємого маркера. Транскрипційні одиниці важкого й легкого ланцюга можна або субклонувати у двох незалежних векторах 4700-pUC-Hyg-OriP з метою котрансфекції (2-векторна система), або їх можна клонувати в одному загальному векторі 4700-pUC-Hyg-OriP (1-векторна система) для наступних короткочасних або стабільних трансфекцій з використанням векторів, що утворилися. На фіг. 9 показана плазмідна карта основного вектора 4700-pUC-OriP. Приклад 1Б Створення експресійних плазмід для моноспецифічного двовалентного антитіла , що несе заміну СL-СH1 60 17 UA 100874 C2 5 10 15 20 25 30 35 40 45 50 55 Злиті гени (злиті гени HC** і LC**), що містять змінені Fab-послідовності щодо антитіла дикого типу, збирали за допомогою відомих методів і процесів рекомбінації шляхом з'єднання відповідних сегментів нуклеїнових кислот. Кожну з нуклеотидних послідовностей, що кодують HC** і LC** IGF-1R, синтезували шляхом хімічного синтезу й потім клонували у клонуючому векторі pGA4, основою якого є плазміда pPCRScript (фірма Stratagene), на фірмі Geneart (Регенсбург, Німеччина). Касету експресії, що кодує IGF-1R HC**, вбудовували шляхом лігування у придатну для E. coli плазміду, використовуючи сайти рестрикції PvuII і BmgBI, з одержанням кінцевого вектора pUC-HC**-IGF1R; касету експресії, що кодує відповідну IGF-1R LC**, вбудовували шляхом лігування у придатну для E. coli плазміду, використовуючи сайти рестрикції PvuII і SalI, з одержанням кінцевого вектора pUC-LC**-IGF-1R. Субклоновані нуклеотидні послідовності підтверджували шляхом секвенування ДНК. Для короткочасних і стабільних трансфекцій використовували великі кількості плазмід, які одержували з трансформованих культур E. coli (набір Nucleobond AX, фірма Macherey-Nagel). Приклад 1В Короткочасна експресія моноспецифічного двовалентного антитіла , що несе заміну СL-СH1, його очищення й підтвердження ідентичності за допомогою мас-спектрометрії Рекомбінантне антитіло , що несе заміну СL-СH1, експресували шляхом короткочасної котрансфекції плазмідами pUC-HC**-IGF-1R і pUC-LC**-IGF-1R клітин, що перебувають у суспензії, лінії HEK293-F відповідно до описаного вище методу. Експресоване й секретоване моноспецифічне двовалентне антитіло , що несе заміну СL-СH1, очищали з профільтрованих супернатантів клітинної культури за допомогою афінної хроматографії на білку A відповідно до описаного вище методу. У цілому, метод полягав у наступному: утримуючі антитіло , несучі заміну СL-СH1, супернатанти клітинної культури після короткочасних трансфекцій прояснювали центрифугуванням і фільтрацією й вносили на колонку HiTrap MabSelect Xtra (фірма GE Healthcare), що містить білок А, врівноважену ЗФР-буфером (10мМ Na2HPO4, 1мМ KH2PO4, 137мМ NaCl і 2,7мМ KCl, pH 7,4). Незв'язані білки відмивали врівноважуючим ЗФР-буфером, а потім 0,1M натрій-цитратним буфером, pH 5,5 і відмивали ЗФР. Для елюції антитіла застосовували 100мМ натрій-цитратний буфер, pH 2,8, після чого зразки негайно нейтралізували, додаючи 300 мкл 2M Трис, pH 9,0 на 2-мілілітрову фракцію. Агрегований білок відокремлювали від мономерних антитіл за допомогою гель-фільтрації на колонку HiLoad 26/60 Superdex 200 prep grade (фірма GE Healthcare) у 20мМ гістидині, 150мМ NaCl, pH 6,0, а фракцію мономерних антитіл потім концентрували за допомогою центрифужного концентратора MILLIPORE Amicon Ultra-15. Антитіло , що несе заміну СL-СH1, заморожували й зберігали при -20°C або -80°C. Цілісність антитіла , що несе заміну СL-СH1, аналізували за допомогою ДСН-ПААГ у присутності відновлювача або без нього й потім офарбовували кумасси брильянтовим блакитним відповідно до описаного вище методу. Мономерний стан антитіла , що несе заміну СL-СH1, підтверджували аналітичною гель-фільтрацією (фіг. 12). Охарактеризовані зразки використовували для подальшого аналітичного дослідження білка й вивчення функціональних характеристик. За допомогою ESI-мас-спектрометрії підтверджували теоретичну молекулярну масу повністю дегліколізованого антитіла , що несе заміну СL-СH1. Приклад 1Г Аналіз здатності моноспецифічного двовалентного антитіла , що несе заміну СLСH1, зв'язувати IGF-1R за допомогою застосовуваного для оцінки зв'язування IGF-1R-ECD ELISA і Biacore-аналізу Єднальні здатності моноспецифічного двовалентного антитіла , що несе заміну СL-СH1, оцінювали за допомогою ELISA з використанням позаклітинного домена (ECD) IGF-1R відповідно до описаного вище методу. Для цієї мети позаклітинний домен IGF-1R (залишки 1462), що містить лідерну послідовність, яка зустрічається у природних умовах, і 12 богатих LIцистеїном доменів ектодомена альфа-ланцюга людського IGF-IR (згідно McKern і ін., 1997; Ward і ін., 2001), злитий з N-кінцевою міткою, що представляє собою His-стрептавідин-єднальний пептид (His-SBP), клонували у похідному вектора pcDNA3 і короткочасно експресували у HEK293F-клітинах. Білкова послідовність ECD IGF-1R-His-SBP представлена вище. З отриманої титраційної кривої видно, що антитіло , що несе заміну СL-СH1, мало функціональну активність і для нього виявлені характеристики зв'язування й кінетичні характеристики, порівнянні з характеристиками антитіла дикого типу у межах помилки методу, і тому воно є повністю функціональним (фіг. 13). 60 18 UA 100874 C2 5 10 15 20 25 30 35 40 45 50 55 Ці дані корелюють з результатами, отриманими за допомогою Biacore-аналізу, що продемонстрував, що афінність моноспецифічного двовалентного антитіла , що несе заміну CL-CH1, характеризується значенням KD, рівним 3,7 пМ, і таким чином, воно має порівнянні параметри афінності й кінетичні характеристики зв'язування з ECD IGF-1R з вихідним антитілом дикого типу, для якого значення KD становить 3,2 нМ. Приклад 1Д Аналіз здатності моноспецифічного двовалентного антитіла , що несе заміну СLСH1, зв'язувати IGF-1R за допомогою FACS з використанням надекспресуючих IGF-1R I24клітин Для підтвердження активності зв'язування антитіла , що несе заміну СL-СH1, з IGF-1R, надекспресуємим на поверхні I24-клітин (NIH3T3-клітини, що експресують рекомбінантний людський IGF-1R, фірма Roche), використовували FACS-аналіз. У цілому, 5 метод полягав у наступному: 5×10 I24-клітин на кожну трубку, призначену для здійснення FACS, інкубували з розведенням очищеного антитіла , що несе заміну СL-СH1, і антитіла дикого типу в якості референс-антитіла та інкубували на льоді протягом 1 год. Незв'язаний білок відмивали за допомогою 4 мл охолодженого на льоді ЗФР (фірма Gibco) + 2% FCS (фірма Gibco). Потім клітини центрифугували (5 хв при 400 g), а зв'язане антитіло виявляли за допомогою кон’югата F(ab')2 PE (фірма Dianova) на льоді протягом 1 год, захищаючи від дії світла. Виявлене незв'язане антитіло відмивали за допомогою 4 мл охолодженого на льоді ЗФР + 2% FCS. Потім клітини центрифугували (5 хв при 400 g), ресуспендували у 300-500 мкл ЗФР і виявлене зв'язане антитіло оцінювали кількісно за допомогою пристрою FACSCalibur або FACS Canto (фірма BD (FL 2-канал, 10000 клітин на процес). В експеримент включали як контролі антитіла відповідного ізотипу для виключення будь-яких неспецифічних випадків зв'язування. Зв'язування антитіла , що несе заміну СL-СH1, і антитіла дикого типу з IGF-1R на поверхні I24-клітин характеризувалося порівняним залежним від концентрації зрушенням середньої інтенсивності флуоресценції. Приклади 2 Опис моноспецифічного двовалентного антитіла дикого типу Приклад 2A Створення експресійних плазмід для моноспецифічного двовалентного антитіла дикого типу Послідовності варіабельних областей важкого й легкого ланцюга моноспецифічного двовалентного антитіла до ANGPT2 () дикого типу, включаючи відповідні лідерні послідовності, описані у даному прикладі, виводили з важкого ланцюга людського антитіла (SEQ ID NO: 6) і його легкого ланцюга (SEQ ID NO: 7), які описані у WO 2006/045049, а константні домени важкого й легкого ланцюга виводили з людського антитіла (C-каппа й IgG1). Антитіло дикого типу клонували у плазмідах SB04-pUC-HC-ANGPT2 (SEQ ID NO: 6) і SB06-pUC-LC-ANGPT2 (SEQ ID NO: 7), які є аналогами векторів, описаних вище у прикладі 1A. З метою порівняння й для здійснення експериментів за спільною експресією (див. приклад 3) антитіло дикого типу короткочасно (ко-)експресували з використанням плазмід SB04-pUC-HC-ANGPT2 і SB06-pUC-LC-ANGPT2. Приклад 2Б Створення експресійних плазмід для моноспецифічного двовалентного антитіла дикого типу Кожну з нуклеотидних послідовностей, що кодують HC і LC , синтезували за допомогою хімічного синтезу й потім клонували у клонуючому векторі pGA4, основою якого є плазміда pPCRScript (фірма Stratagene), на фірмі Geneart (Регенсбург, Німеччина). Експресійну касету, що кодує HC , клонували у придатній для E. coli плазміді, одержуючи кінцевий вектор SB04-pUC-HC-ANGPT2; експресійну плазміду, що кодує відповідну LC , клонували у придатній для E. coli плазміді, одержуючи кінцевий вектор SB06-pUCLC-ANGPT2. Субклоновані нуклеотидні послідовності підтверджували шляхом секвенування ДНК. Для короткочасних і стабільних трансфекцій використовували великі кількості плазмід, які одержували з трансформованих культур E. coli (набір Nucleobond AX, фірма Macherey-Nagel). Приклади 3 Експресія біспецифічного двовалентного антитіла , в якому важкий і легкий ланцюг специфічно зв'язується з IGF-1R, константні домени СL і СH1 замінені один на одного (скорочено позначено у контексті даного опису як антитіло , що несе заміну СL-СH1) 60 19 UA 100874 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклад 3A Короткочасна спільна експресія й очищення антитіла , що несе заміну СL-СH1, і антитіла дикого типу у клітинах лінії HEK293 EBNA з одержанням біспецифічного антитіла , що несе заміну СL-СH1 Для створення функціонального біспецифічного антитіла, що розпізнає IGF-1R, на основі Fab-фрагмента антитіла , що несе заміну СL-СH1, з одного боку, і що розпізнає ANGPT2 на основі Fab-фрагмента антитіла дикого типу, з іншого боку, дві експресійні плазміди, що кодують антитіло , що несе заміну СL-СH1 (приклад 1A), спільно експресували із двома експресійними плазмідами, що кодують антитіло дикого типу (приклад 2A). З урахуванням підтвердженою статистикою асоціації важких ланцюгів (HC) дикого типу й несучих заміну важких ланцюгів СL-СH1 HC** це приводило до одержання біспецифічного й двовалентного антитіла , що несе заміну СL-СH1. З огляду на, що обидва антитіла однаково добре експресувались і при цьому не утворювалися побічні продукти у кількості, що може вплинути на результат, варто очікувати, що цей процес повинен приводити до одержання нижче зазначених трьох основних продуктів у співвідношенні 1:2:1: A) антитіло , що несе заміну СL-СH1, Б) біспецифічне антитіло , що несе заміну СL-СH1, і В) антитіло дикого типу. Можна було очікувати присутності декількох побічних продуктів. Однак через заміну тільки СL-СH1-доменів частота зустрічальності побічних продуктів повинна бути знижена у порівнянні з Fab, отриманими у результаті повного кросинговеру. Слід зазначити, що для антитіла дикого типу був виявлений більше високий вихід продукту короткочасної експресії у порівнянні з антитілом дикого типу й антитілом , що несе заміну СL-СH1, співвідношення плазмід, що кодують антитіло дикого типу, і плазмід, що кодують антитіло , що несе заміну СL-СH1, зрушувалося вбік експресії антитіла дикого типу. Для створення суміші основних продуктів, таких як A) антитіло , що несе заміну СLСH1, Б) біспецифічне антитіло , що несе заміну СL-СH1, і В) антитіло дикого типу, чотирома плазмідами pUC-HC**-IGF-1R і pUC-LC**-IGF-1R і плазмідами SB04-pUC-HC-ANGPT2 і SB06-pUC-LC-ANGPT2 короткочасно котрансфектували HEK293Fклітини, що знаходяться у виді суспензійної культури, відповідно до описаного вище методу. Зібраний супернатант, що містить суміш основних продуктів: A) антитіло , що несе заміну СL-СH1, Б) біспецифічне антитіло , що несе заміну СL-СH1, і В) антитіло дикого типу, позначили як «суміш, що містить біспецифічне антитіло, що несе заміну СL-СH1». Супернатанти клітинної культури, які включали суміш, що містить біспецифічне антитіло, що несе заміну СL-СH1, збирали центрифугуванням і потім очищали відповідно до описаного вище методу (фіг. 14). Цілісність суміші антитіл аналізували за допомогою ДСН-ПААГ у присутності відновлювача або без нього й потім офарбовували кумасси брильянтовим блакитним. Отримані за допомогою ДСН-ПААГ результати свідчать про те, що, як і слід було сподіватися, у препараті були присутні 2 різні важкі й легкі ланцюги (гель у присутності відновлювача). Мономерний стан суміші антитіл підтверджували аналітичною гель-фільтрацією, і було встановлено, що очищені види антитіл перебували у мономерному стані. Охарактеризовані зразки використовували для подальшого аналітичного дослідження білка й вивчення функціональних характеристик. Приклад 3Б Виявлення функціонального біспецифічного антитіла , що несе заміну СLСH1, за допомогою клітинного FACS-аналізу, що дозволяє виявляти утворення мостикового зв'язку, з використанням експресуючих IGF-1R клітин лінії I24 Для підтвердження присутності функціонального біспецифічного антитіла , що несе заміну СL-СH1, в очищеній суміші, що містила біспецифічне антитіло, що несе заміну СL-СH1, що включає наступні основні продукти: A) антитіло , що несе заміну СL-СH1, Б) біспецифічне антитіло , що несе заміну СL-СH1, і В) антитіло дикого типу, отримане після короткочасної спільної експресії відповідно до методу, описаному у прикладі 3A, проводили клітинний FACS-аналіз, що дозволяє виявляти утворення мостикового зв'язку такого як IGF-1R-ANGPT2, з використанням клітин лінії I24 (NIH3T 3-клітини, що експресують рекомбінантний людський IGF-1R, фірма Roche). Принцип аналізу показаний на фіг. 10. Біспецифічне антитіло , що несе заміну СL-СH1, що було присутнє в очищеній суміші антитіл, мало здатність зв'язуватися з IGF-1R на поверхні I24-клітин і одночасно з ANGPT2; і у такий спосіб мало здатність з'єднувати мостиковим зв'язком два його антигени-мішені з двома протилежними Fab-фрагментами. 5 У цілому, метод полягав у наступному: 5×10 клітин лінії I24 на трубку, призначену для здійснення FACS, інкубували із загальною сумішшю очищених антитіл на льоді протягом 1 год 20 UA 100874 C2 5 10 15 20 25 30 35 40 45 50 55 60 (титрація 160 мкг/мл суміші). Відповідні очищені антитіла дикого типу і наносили на I24-клітини як контролі. Незв'язане антитіло відмивали 4 мл охолодженого на льоді ЗФР (фірма Gibco) + 2% FCS (фірма Gibco), клітини центрифугували (5 хв при 400 g) і зв'язане біспецифічне антитіло виявляли за допомогою 50 мкл (2 мкг/мл) людського ANGPT2 (фірма R&D Systems) протягом 1 год на льоді. Потім незв'язаний ANGPT2 відмивали один або два рази 4 мл охолодженого на льоді ЗФР (фірма Gibco) + 2% FCS (фірма Gibco), клітини центрифугували (5 хв при 400 g) і зв'язаний ANGPT2 виявляли за допомогою 50 мкл (5 мкг/мл) антитіла mIgG 1-біотин (BAM0981, фірма R&D Systems) протягом 45 хв на льоді; в альтернативному варіанті клітини інкубували з 50 мкл (5 мкг/мл) кон’югата mIgG 1-біотин як контроль ізотипу (фірма R&D Systems). Незв'язане ідентифікуюче антитіло відмивали 4 мл охолодженого на льоді ЗФР (фірма Gibco) + 2% FCS (фірма Gibco), клітини центрифугували (5 хв при 400 g) і зв'язане ідентифікуюче антитіло виявляли за допомогою 50 мкл кон’югата 1:400 стрептавідин-PE (SA-PE) (фірма Invitrogen/Zymed) протягом 45 хв на льоді, захищаючи від дії світла. Незв'язаний кон’югат стрептавідин-PE відмивали 4 мл охолодженого на льоді ЗФР + 2% FCS. Потім клітини центрифугували (5 хв при 400 g), ресуспендували у 300-500 мкл ЗФР і зв'язаний кон’югат стрептавідин-PE оцінювали кількісно за допомогою пристрою FACSCalibur (фірма BD (FL 2-канал, 10000 клітин на процес). В експеримент включали як контролі антитіла відповідного ізотипу для виключення будь-яких неспецифічних випадків зв'язування. Крім того, як контролі включали очищені моноспецифічні двовалентні антитіла типу IgG1, такі як і . Результати, представлені на фіг. 15, демонструють, що інкубація з сумішшю, що містила очищене виникле у результаті кросинговеру антитіло (, що несе заміну СLСH1), отримане після спільної експресії виниклого у результаті кросинговеру антитіла (, що несе заміну СL-СH1) з антитілом дикого типу (антитіло дикого типу), приводила до істотного зрушення флуоресценції, що свідчить про присутність функціонального біспецифічного антитіла , що несе заміну СL-СH1, що має здатність зв'язуватися одночасно з IGF-1R на поверхні I24-клітин і з ANGPT2; і у такий спосіб має здатність з'єднувати мостиковим зв'язком два його антигени-мішені з двома протилежними Fabфрагментами. На відміну від цього відповідні контрольні антитіла і не приводили до зрушення флуоресценції при здійсненні FACS-аналізу, що дозволяє виявляти утворення мостикового зв'язку. У сполученні ці дані свідчать про те, що шляхом спільної експресії відповідних плазмід дикого типу й отриманих у результаті кросинговеру плазмід можна створювати функціональні біспецифічні антитіла. Вихід правильного біспецифічного антитіла можна підвищувати, збільшуючи рівень правильної гетеродимеризації важких ланцюгів дикого типу й модифікованих отриманих у результаті кросинговеру важких ланцюгів, наприклад, використовуючи технологію «knobs-into-holes», а також стабілізацію за допомогою дисульфідного містка (див. приклад 4). Приклад 4 Експресія двовалентного біспецифічного антитіла , що несе заміну СLСH1, з модифікованими CH3-доменами (технологія «knobs-into-holes») Для додаткового підвищення виходу біспецифічного антитіла , що несе заміну СL-СH1, застосовували технологію «knobs-into-holes» для спільної експресії антитіла , що несе заміну СL-СH1, і антитіла дикого типу , з метою одержання препарату гомогенного й функціонального біспецифічного антитіла. Для цієї мети CH3-домен у важкому ланцюзі * HC* антитіла , що несе заміну СL-СH1, заміняли на CH3-домен («виступи»), що має послідовність SEQ ID NO: 8 з заміною T366W, а CH3-домен у важкому ланцюзі антитіла дикого типу заміняли на CH3-домен («западина»), що має послідовність SEQ ID NO: 9 з замінами T366S, L368A, Y407V, або навпаки. Крім того, можна інтродукувати дисульфідний місток для підвищення стабільності й виходу, а також як додаткові залишки, що формують іонні зв'язки й підвищують вихід продукту гетеродимеризації (EP 1870459A1). Короткочасну спільну експресію й очищення утворившогося двовалентного біспецифічного антитіла , що несе заміну СL-СH1, з модифікованими CH3-доменами (технологія «knobs-into-holes») здійснювали відповідно до методу, описаному у прикладі 3. Слід зазначити, що для оптимізації гетеродимеризації можна застосовувати, наприклад, різні технології «knobs-in-holes», такі як інтродукція додаткового дисульфідного містка у CH3домен, наприклад, Y349C у несучий «виступ» ланцюг» і D356C у несучий «западину» ланцюг, і/або їхнє об'єднання зі застосуванням залишків R409D; K370E (K409D) в якості утворюючих «виступи» залишків і D399K; E357K в якості утворюючих «западину» залишків, які описані в EP 1870459A1. 21 UA 100874 C2 5 10 Аналогічно методу, описаному у прикладі 4, можна одержувати інші двовалентні біспецифічні антитіла, що несуть заміну СL-СH1, з модифікованими CH3-доменами (технологія «knobs-into-holes»), мішенню яких є ANGPT2 і інший антиген-мішень (використовуючи описані вище важкий і легкий ланцюг антитіла до ANGPT2 і важкий і легкий ланцюг** НС** і LС** антитіла, що несе заміну СL-СH1, до зазначеної іншої мішені, за допомогою чого обидва важкі ланцюги модифікували за допомогою технології «knobs-into-holes», або мішенню яких є IGF-1R і інший антиген-мішень (використовуючи важкий і легкий ланцюг антитіла до зазначеної іншої мішені й описані вище важкий і легкий ланцюг** НС** і LС** антитіла до IGF-1R, що несе заміну СL-СH1, за допомогою чого обидва важкі ланцюги модифікували за допомогою технології «knobs-into-holes»). 22 UA 100874 C2 23 UA 100874 C2 24 UA 100874 C2 25 UA 100874 C2 26 UA 100874 C2 27 UA 100874 C2 28
ДивитисяДодаткова інформація
Назва патенту англійськоюBivalent bispecific antibodies
Автори англійськоюKlein, Christian, Schaefer, Wolfgang
Назва патенту російськоюДвухвалентные биспецифические антитела
Автори російськоюКлайн Кристиан, Шефер Вольфганг
МПК / Мітки
МПК: A61K 39/00, C07K 16/00, C12P 21/08
Мітки: біспецифічні, антитіла, двовалентні
Код посилання
<a href="https://ua.patents.su/58-100874-dvovalentni-bispecifichni-antitila.html" target="_blank" rel="follow" title="База патентів України">Двовалентні біспецифічні антитіла</a>
Наступний патент: Залізничне колесо
Випадковий патент: Спосіб транспортування і очистки коренебульбоплодів та пристрій для його здійснення