Спосіб одержання 3-гетерил-2н-хромен-2-імінів та їх 2-n-арилімінопохідних
Номер патенту: 55107
Опубліковано: 10.12.2010
Автори: Коваленко Сергій Миколайович, Шинкаренко Павло Євгенович, Власов Сергій Віталійович, Черних Валентин Петрович
Формула / Реферат
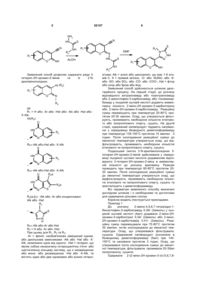
Спосіб одержання 3-гетерил-2Н-хромен-2-імінів та їх 2-N-арилімінопохідних шляхом взаємодії антраніламідів або тіоантраніламідів, або 2-амінотіофен-3-карбоксамідів, або тіосемікарбазидів з еквімолярною кількістю 2-іміно-2Н-хроменів у середовищі оцтової кислоти або диметилформаміду при нагріванні, який відрізняється тим, що реакції піддають 2-іміно-2Н-хромен-3-карбонітрили або 2-іміно-2Н-хромен-3-карботіоаміди протягом 20-30 хвилин при температурі 25-80 °С з утворенням осаду з наступним промиванням відфільтрованого осаду етиловим або ізопропіловим спиртом та сушінням, одержаний напівпродукт піддають нагріванню при температурі 135-150 °С у середовищі диметилформаміду протягом 15 хвилин-3 годин з утворенням осаду, який фільтрують, промивають етиловим або ізопропіловим спиртом та сушать, одержують відповідний 3-гетерил-2Н-хромен-2-імін, останній додають в еквімолярній кількості до розчину ариламіну, реакцію проводять у середовищі льодяної оцтової кислоти при температурі 60-80 °С протягом 20-30 хвилин з наступним охолодженням реакційної суміші до кімнатної температури, утворений осад відфільтровують, промивають етиловим або ізопропіловим спиртом, сушать та кристалізують з диметилформаміду, одержують відповідне 2-N-арилімінопохідне 3-гетерил-2Н-хромен-2-іміну.
Текст
Спосіб одержання 3-гетерил-2Н-хромен-2імінів та їх 2-N-арилімінопохідних шляхом взаємодії антраніламідів або тіоантраніламідів, або 2амінотіофен-3-карбоксамідів, або тіосемікарбазидів з еквімолярною кількістю 2-іміно-2Н-хроменів у середовищі оцтової кислоти або диметилформаміду при нагріванні, який відрізняється тим, що реакції піддають 2-іміно-2Н-хромен-3-карбонітрили або 2-іміно-2Н-хромен-3-карботіоаміди протягом 20-30 хвилин при температурі 25-80 °С з утворен U 2 (19) 1 3 55107 тіазину), двостадійність процесу синтезу з використанням безводних розчинників та низькі виходи цільових сполук, за рахунок гідролізу іміно групи (у випадку синтезу 3-(1,3-тіазол-2-іл)-2Н-хромен-2імінів). Відомий також спосіб одержання 3-гетерил2Н-хромен-2-онів, що є ізостерами 3-гетерил-2Нхромен-2-імінів. Спосіб базується на взаємодії 2іміно-2Н-хромен-3-карбоксамідів з динуклеофільними реагентами (антраніламідами, тіоантраніламідами, 2-амінотіофен-3-карбоксамідами, тіосемікарбазидами та інш.) у середовищі оцтової кислоти або диметилформаміду. Синтез кінцевих 3-гетерил-2Н-хромен-2-онів може бути проведений як в одну так і у дві стадії [4]. До недоліків даного способу можна віднести неможливість синтезу 3-гетерил-2Н-хромен-2імінів. Завданням корисної моделі є створення способу одержання різноманітних 3-гетерил-2Нхромен-2-імінів та їх 2-N-арилімінопохідних шляхом взаємодії 2-іміно-2Н-хромен-3-карбонітрилу або 2-іміно-2Н-хромен-3-карботіоаміду з динуклеофільними реагентами (антраніламідами або тіоантраніламідами або 2-амінотіофен-3карбоксамідами або тіосемікарбазидами). Спосіб дозволяє синтезувати широкий спектр 3-гетерил2Н-хромен-2-імінів з циклами хіназолін-4-ону або хіназолін-4-тіону або тієно[2,3-d]піримідин-4-ону або 2,4-дигідро-[1,2,4]триазол-3-тіону. Легкість та простота проведення синтезу, а також високі виходи кінцевих продуктів є основними перевагами даного способу. NH2 4 Поставлене завдання вирішується таким чином, що спосіб одержання 3-гетерил-2Н-хромен-2імінів та їх 2-N-арилімінопохідних шляхом взаємодії антраніламідів або тіоантраніламідів або 2амінотіофен-3-карбоксамідів або тіосемікарбазидів з еквімолярною кількістю 2-іміно-2Н-хроменів у середовищі оцтової кислоти або диметилформаміду при нагріванні, у відповідності з корисною моделлю передбачає, що реакції піддають 2-іміно2Н-хромен-3-карбонітрили або 2-іміно-2Н-хромен3-карботіоаміди протягом 20-30 хвилин при температурі 25-80°С з утворенням осаду з наступним промиванням відфільтрованого осаду етиловим або ізопропіловим спиртом та сушкою, одержаний напівпродукт піддають нагріванню при температурі 135-150°С у середовищі диметилформаміду протягом 15 хвилин - 3 годин з утворенням осаду, який фільтрують, промивають етиловим або ізопропіловим спиртом та сушать, одержують відповідний 3-гетерил-2Н-хромен-2-імін, останній додають в еквімолярній кількості до розчину ариламіну, реакцію проводять у середовищі льодяної оцтової кислоти при температурі 60-80°С протягом 20-30 хвилин з наступним охолодженням реакційної суміші до кімнатної температури, утворений осад відфільтровують, промивають етиловим або ізопропіловим спиртом, сушать та кристалізують з диметилформаміду, одержують відповідне 2-Nарилімінопохідне 3-гетерил-2Н-хромен-2-іміну. Реакцію одержання кінцевих продуктів з використанням антраніламідів, тіоантраніламідів, 2амінотіофен-3-карбоксамідів проводять за схемою. NH2 X EWG R1 EWG R1 O AcOH NH O N NH2 EWG=CN; CSNH2 X X=O,S DMF X X HN HN R3NH2 N R1 O AcOH N N R1 O NH R3 При цьому гетероциклічний замісник у 3положенні 2Н-хромен-2-імінів (R2) може варіюва тися наступним чином: O O N R2 = O S та інш. N S S S Відповідно реакцію з використанням тіосемікарбазидів здійснюють за схемою: 5 55107 6 NH2 HN N N S NH R1 R2 R1 O NH AcOH O DMF N O N R3 де R1 = Н або -Аr або -Het або -Аlк або -Hal або Х-Аlk; Ht(R2): O HN R2 N * R2=-Alk або-Hal або -Х-Аlk S HN R2 N * R2=-Alk або-Hal або -Х-Аlk R2a O HN R2b S N * R2(a,b)= -Alk або -Аr або конденсовані: Alk або -Het R2 N * N S N H R2=-Alk або-Аr або Het R3 = Н або -Аr або -Het. При цьому для R1, R2 та R3: -Аr = феніл, необов'язково заміщений одним, або декількома замісниками -Alk або -Hal або -XAlk, незалежно одне від одного; -Het = гетерил, що являє собою ненасичену гетероциклічну п'яти- або шестичленну кільцеву систему, що є незаміщеною або моно- або дизаміщеною -Hal або -X-Alk, та містить один або два однакових або різних гетеро N S N R1 R2 R1 S NH HN NH Заявлений спосіб дозволяє одержати ряди 3гетерил-2Н-хромен-2-імінів та їх 2-Nарилімінопохідних: Ht (R2) R2 O NH атоми; Alk = алкіл або циклоалкіл, що має 1-6 атомів С. X = прямий зв'язок, -О- або -N(Alk)- або -Sабо -SO- або SO2- або -CO- або -СОО-; Hal = фтор або хлор або бром або йод. Заявлений спосіб здійснюється шляхом двостадійного процесу. На першій стадії, до розчину відповідного антраніламіду або тіоантраніламіду або 2-амінотіофен-3-карбоксаміду або тіосемикарбазиду у льодяній оцтовій кислоті додають еквімолярну кількість 2-іміно-2Н-хромен-3-карбонітрилу або 2-іміно-2Н-хромен-3-карботіоаміду. Реакційну суміш перемішують при температурі 25-80°С протягом 20-30 хвилин. Осад, що утворюється фільтрують, промивають необхідною кількістю етилового або ізопропілового спирту, сушать. На другій стадії, одержаний напівпродукт піддають нагріванню у середовищі безводного диметилформаміду при температурі 135-150°С протягом 15 хвилин - 3 годин. Після охолодження реакційної суміші до кімнатної температури утворюється осад, що відфільтровують, промивають необхідною кількістю етилового чи ізопропілового спирту, сушать. Подальший синтез 2-N-арилімінопохідних 3гетерил-2Н-хромен-2-імінів здійснювали у середовищі льодяної оцтової кислоти додаванням відповідного 3-гетерил-2Н-хромен-2-іміну в еквімолярній кількості до розчину ариламіну. Реакцію проводять при температурі 60-80°С протягом 2030 хвилин. Після охолодження реакційної суміші до кімнатної температури утворюється осад, що відфільтровують, промивають необхідною кількістю етилового чи ізопропілового спирту, сушать та кристалізують з диметилформаміду. Всі параметри заявленого способу визначені дослідним шляхом і є необхідними та достатніми для одержання цільових сполук. Корисна модель ілюструється прикладами. Приклад 1 До розчину 2-аміно-4,5,6,7-тетрагідро-1бензотіофен-3-карбоксаміду 0,39г (2ммоль) у льодяній оцтовій кислоті (4мл) додавали 2-іміно-2Нхромен-3-карбонітрил 0,34г (2ммоль) або 2-іміно2Н-хромен-3-карботіоамід 0,41г (2ммоль). Реакційну суміш перемішували при 70-80°С протягом 30 хвилин, потім охолоджували до кімнатної температури. Осад, що утворювався фільтрували, сушили. Одержаний напівпродукт розчиняли в безводному диметилформаміді (5мл) при 140150°С та нагрівали протягом 3 годин. Осад, що утворювався після охолодження суміші до кімнатної температури, фільтрували, промивали 20-30мл ізопропанолу, сушили. Одержали 2-(2-іміно-2Н-хромен-3-іл)-5,6,7,8 7 55107 тетрагідро[1]бензотієно[2,3-d]піримідин-4-он структурної формули: O HN S N O NH Приклад 2 До розчину N-(4бромфеніл)гідразинкарботіоаміду 0,49г (2ммоль) у льодяній оцтовій кислоті (10мл) при 25°С додавали еквімолярну кількість 8-етоксі-2-іміно-2Нхромен-3-карбонітрилу 0,43г (2ммоль). Розчин, що утворювався перемішували протягом 30 хвилин при кімнатній температурі. Осад, що утворювався фільтрували, сушили. Одержаний напівпродукт розчиняли в безводному диметилформаміді (5мл) при 140-150°С та нагрівали протягом 15 хвилин. Осад, що утворювався відфільтровували, промивали ізопропанолом (15 мл), сушили. Одержали 4-(4-бромфеніл)-5-(8-етоксі-2-іміно2Н-хромен-3-іл)-2,4-дигідро-3Н-1,2,4-триазол-3тіон структурної формули: Br 8 Приклад 3 До розчину (3-фторфеніл)аміну 0,17г (1,5ммоль) в льодяній оцтовій кислоті (5мл) додавали 2-(2-іміно-2Н-хромен-3-іл)хіназолін-4-тіон 0,31г (1ммоль). Реакційну суміш перемішували при 70-80°С протягом 30 хвилин, потім охолоджували до кімнатної температури. Осад, що утворювався відфільтровували, промивали ізопропанолом (1520мл), сушили та перекристалізували з диметилформаміду. Одержали 2-[2-(4-фтор-феніліміно)-2Нхромен-3-іл]-хіназолін-4-тіон структурної формули: S HN N O N F Авторами було синтезовано у відповідності з заявленим способом ряд сполук, частину з яких наведено у таблиці 1. S N NH N O NH O CH3 Таблиця 1 Синтез 3-гетерил-2Н-хромен-2-імінів та їх 2-N-арилімінопохідних за заявленим способом Одержані сполуки Умови одержання Стадій: 2 O HN R2 N R1 O Замісники R1=H, R2=H 1: АсОН/6080°С/20-30хв. 2 R1=8-OMe, R2=H 3 R1=8-OEt, R2=H 4 R1=H, R2=H 1: АсОН/6080°С/20-30хв. 5 R1=8-OMe, R2=H 2: DMF/135150°С/15хв. 6 R1=8-OEt, R2=H NH 2-(2-іміно-2Н-хромен-3-іл)хіназолін4-они S HN R2 N R1 O Сполука № 1 2: DMF/135150°С/20хв. Стадій: 2 NH 2-(2-іміно-2Н-хромен-3-іл)хіназолін4-тіони 9 55107 10 Продовження таблиці 1 Одержані сполуки O Умови одержання Стадій: 3 O 7 R1=8-OEt, R2=H, R3=4-OEt-Ph 8 9 R1=8-OEt, R2=H, R3=4-Et-Ph R1=8-OEt, R2=H, R3=4-F-Ph 3: АсОН/6080°С/20-30хв. Стадій: 3 10 R1=8-OEt, R2=H, R3=3-OMe-Ph 1: АсОН/60-80°С /20-30хв. 11 R1=H, R2=H, R3=4-F-Ph 12 R1=H, R2=H, R3=4-Et-Ph 13 R1=8-OEt, R2=H, R3=3,5-diOMe-Ph R2 N R1 Замісники 1: АсОН/6080°С/20-30хв. HN Сполука № N R3 2: DMF/135150°С/20хв. 2-(2-(ариліміно)-2Н-хромен-3іл)хіназолін-4-они S HN R2 N R1 O N R3 2-(2-(ариліміно)-2Н-хромен-3іл)хіназолін-4-тіони 2: DMF/135150°С/15хв. 3: АсОН/6080°С/20-30хв. R2 O HN Стадій: 2 N S 17 R1 O NH 14 15 16 HN S N * 19 H 6-Cl HN 20 21 8-OEt O 18 1: АсОН/6080°С/20-30хв. R1 H 6-Cl 8-OMe O * 8-OMe S N 8-OEt O O 2-(2-іміно-2Н-хромен-3-іл)тієно[2,3d]піримідин-4-они 2:DMF/140150°C/3год. 23 24 25 H N * 26 N HN 22 S O O N HN * N S O H 6-Cl 8-OMe 8-OEt 11 55107 12 Продовження таблиці 1 Одержані сполуки O Умови одержання Стадій: 3 Сполука № Замісники R2 R1 R3 HN S N 1:АсОН/6080°С/20-30хв. R1 O 27 6-Сl N 3-OMePh R3 28 29 8-ОМе 8-OEt 3- АсОН/6080°С/20-30хв. 30 8-ОМе Стадій: 2 31 R1=8-OEt, R2=4-Br-Ph 1: АсОН/25-30°С /20-30хв. 2-(2-(ариліміно)-2Н-хромен-3іл)тієно[2,3-d]піримідин-4-они 2:DMF/140150°C/3год. 32 R1=8-OEt, R2=2-OMe-Ph 2: DMF/140150°С/15-20хв. 33 34 35 36 37 R1=H, R2=3,5-diOMe-Ph R1=H, R2=H R1=8-OEt, R2=2-Et-Ph R1=8-OEt, R2=3-OMe-Ph R1=8-OMe, R2=2-OMe-Ph S R2 N N N R1 O NH 5-(2-іміно-2Н-хромен-3-іл)-2,4дігідро-3Н-1,2,4-триазол-3-тіони Таким чином, заявлено новий спосіб одержання заміщених 3-гетерил-2Н-хромен-2-імінів. Даний спосіб відзначається рядом переваг: - можливість створення комбінаторних бібліотек хімічних сполук рядів заміщених 3-гетерил-2Нхромен-2-імінів; - низька собівартість та доступність вихідних реагентів; - проста технологія синтезу; Джерела інформації: 1. Hassan, Saber M.; Abdel Aal, Mahmoud M.; El-Maghraby, Ahmed A.; Bashandy, Mahmoud S.; Phosphorus, Sulfur and Silicon and the Related Комп’ютерна верстка А. Крулевський Elements; vol. 184; nb. 2; (2009); p. 427-452. 2. Belokon', Ya. V.; Kovalenko, S.N.; Silin, A.V.; Nikitchenko, V.M; Chemistry of Heterocyclic Compounds (New York, NY, United States); vol. 33; nb. 10; (1997); p. 1167-1176; Khimiya Geterotsiklicheskikh Soedinenii; nb. 10; (1997); p. 1345-1355. 3. El-Sayed, Ahmed M; Phosphorus, Sulfur and Silicon and the Related Elements; vol. 181; nb. 12; (2006); p. 2709-2723. 4. Kovalenko, S.M.; Bylov, I.E.; Sytnik, K.M.; et al. Molecules. 2000, Vol 5, pp. 1146-1165. Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of 3-heteryl-2h-chromen-2-imines and their 2-n-arylimino derivatives
Автори англійськоюChernykh Valentyn Petrovych, Kovalenko Serhii Mykolaiovych, Shynkarenko Pavlo Yevhenovych, Vlasov Serhii Vitaliiovych
Назва патенту російськоюСпособ получения 3-гетерил-2н-хромен-2-иминов и их 2-n-арилиминопроизводных
Автори російськоюЧерных Валентин Петрович, Коваленко Сергей Николаевич, Шинкаренко Павло Евгенович, Власов Сергей Витальевич
МПК / Мітки
МПК: C07D 311/26, C07D 311/04, C07D 311/06, A61K 31/37, C07D 311/08, C07D 311/00, C07D 311/12, C07D 311/42
Мітки: одержання, 2-n-арилімінопохідних, 3-гетерил-2н-хромен-2-імінів, спосіб
Код посилання
<a href="https://ua.patents.su/6-55107-sposib-oderzhannya-3-geteril-2n-khromen-2-iminiv-ta-kh-2-n-ariliminopokhidnikh.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 3-гетерил-2н-хромен-2-імінів та їх 2-n-арилімінопохідних</a>
Попередній патент: Біметалевий датчик температури
Наступний патент: Штанговий дизель-молот
Випадковий патент: Спосіб виготовлення сопілки