Амідометилзаміщені похідні 2-(4-сульфоніламіно)-3-гідрокси-3,4-дигідро-2н-хромен-6-ілу, спосіб і проміжні продукти для їх одержання й лікарські засоби, які містять ці сполуки
Номер патенту: 82907
Опубліковано: 26.05.2008
Автори: ЦІГЛЕР Дітер, Молоні Брайан, Веске Міхаель, Сайкс Девід, Млінарік Міхаель, Брюкнер Райнхард, Вітте Клаус, Бьокер Крістіане, Маррісон Лестер, Фішер Іван
Формула / Реферат
1. Сполуки загальної формули І
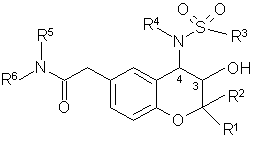 I,
I,
у якій
R1 означає С1-С4алкіл,
R2 означає С1-С4алкіл,
R3 означає феніл, необов'язково одно- або двозаміщений галогеном, С1-С4алкілом, С1-С4алкоксигрупою або трифторметилом, нафтил або біфеніл,
R4 означає водень, С1-С6алкіл або С3-С7циклоалкіл-С1-С4алкіл,
R5 означає водень й
R6 означає С1-С6алкіл, феніл-С1-С4алкіл, фенільна група якого необов'язково однозаміщена галогеном, фурил-С1-С4алкіл або тетрагідронафтил, або
R5 й R6 разом з азотом, з яким вони зв'язані, утворюють піперазинове кільце, необов'язково заміщене фенілом.
2. Сполуки за п. 1, у яких кожний з R1 й R2 означає метил.
3. Сполуки за п. 1, у яких R3 означає необов'язково однозаміщений феніл.
4. Сполуки за п. 1, у яких R4 означає водень, С1-С6алкіл або циклопропіл-С1-С4алкіл.
5. Сполуки за п. 1, у яких R6 означає феніл-С1-С4алкіл або тетрагідронафтил.
6. Сполуки за п. 1, у яких у пірановому кільці атом вуглецю (С-3), який несе гідроксизамісник, знаходиться в 5-конфігурації, а атом вуглецю (С-4), який несе азотвмісний замісник, знаходиться в R-конфігурації.
7. Сполуки формули І за будь-яким з попередніх пунктів, вибрані із групи, яка включає
2-(4-{[(4-етилфеніл)сульфоніл]аміно}-3-гідрокси-2,2-диметил-3,4-дигідро-2H-xpoмен-6-іл)-N-1,2,3,4-тетрагідронафтален-1-ілацетамід,
2-((3S,4R)-4-{[(4-етилфеніл)сульфоніл]аміно}-3-гідрокси-2,2-диметил-3,4-дигідро-2Н-хромен-6-іл)-N-[(1R)-1,2,3,4-тетрагідронафтален-1-іл]ацетамід,
N-бензил-2-{4-[[(4-етилфеніл)сульфоніл](неопентил)аміно]-3-гідрокси-2,2-диметил-3,4-дигідро-2Н-хромен-6-іл}ацетамід,
2-{4-[[(4-етилфеніл)сульфоніл](неопентил)аміно]-3-гідрокси-2,2-диметил-3,4-дигідро-2Н-хромен-6-іл}-N-(2-фенілетил)ацетамід й
2-(4-{[(4-метилфеніл)сульфоніл]аміно}-3-гідрокси-2,2-диметил-3,4-дигідро-2H-xpoмен-6-іл)-N-1,2,3,4-тетрагідронафтален-1-ілацетамід.
8. Лікарський засіб, який містить фармакологічно активну кількість сполуки формули І за п. 1 і звичайні фармацевтичні допоміжні речовини й/або носії.
9. Застосування сполук формули І за п. 1 для одержання лікарського засобу, призначеного для лікування серцево-судинних захворювань й/або для лікування проліферативних, хронічних запальних й аутоімунних захворювань.
10. Спосіб одержання сполук формули І
 І,
І,
у якій
R1 означає С1-С4алкіл,
R2 означає С1-С4алкіл,
R3 означає феніл, необов'язково одно- або двозаміщений галогеном, С1-С4алкілом, С1-С4алкоксигрупою або трифторметилом, нафтил або біфеніл,
R4 означає водень, С1-С6алкіл або С3-С7циклоалкіл-С1-С4алкіл,
R5 означає водень й
R6 означає С1-С6алкіл, феніл-С1-С4алкіл, фенільна група якого необов'язково однозаміщена галогеном, фурил-С1-С4алкіл або тетрагідронафтил, або
R5 й R6 разом з азотом, з яким вони зв'язані, утворюють піперазинове кільце, необов'язково заміщене фенілом,
який відрізняється тим, що сполуку загальної формули II
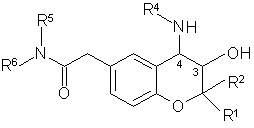 II,
II,
у якій R1, R2, R4, R5 й R6 мають вказані вище значення,
піддають взаємодії зі сполукою загальної формули III
X-SO2-R3 Ш,
у якій R3 має вказані вище значення, а X означає відщеплювану групу, яку вилучають.
11. Сполуки загальної формули II
 II,
II,
у якій
R1 означає С1-С4алкіл,
R2 означає С1-С4алкіл,
R4 означає водень, С1-С6алкіл або С3-С7циклоалкіл-С1-С4алкіл,
R5 означає водень й
R6 означає С1-С6алкіл, феніл-С1-С4алкіл, фенільна група якого необов'язково однозаміщена галогеном, фурил-С1-С4алкіл або тетрагідронафтил, або
R5 й R6 разом з азотом, з яким вони зв'язані, утворюють піперазинове кільце, необов'язково заміщене фенілом.
Текст
1. Сполуки загальної формули І C2 2 (19) 1 3 82907 9. Застосування сполук формули І за п. 1 для одержання лікарського засобу, призначеного для лікування серцево-судинних захворювань й/або для лікування проліферативних, хронічних запальних й аутоімунних захворювань. 10. Спосіб одержання сполук формули І R4 R5 R6 N O N 4 O O 4 R6 N O R3 OH R2 R1 І, у якій R1 означає С1-С4алкіл, R2 означає С1-С4алкіл, R3 означає феніл, необов'язково одно- або двозаміщений галогеном, С1-С4алкілом, С1С4алкоксигрупою або трифторметилом, нафтил або біфеніл, R4 означає водень, С1-С6алкіл або С3С7циклоалкіл-С1-С4алкіл, R5 означає водень й R6 означає С1-С6алкіл, феніл-С1-С4алкіл, фенільна група якого необов'язково однозаміщена галогеном, фурил-С1-С4алкіл або R5 й R6 разом з азотом, з яким вони зв'язані, тетрагідронафтил, або утворюють піперазинове кільце, необов'язково заміщене фенілом, який відрізняється тим, що сполуку загальної формули II Даний винахід стосується нових амідометилзаміщених похідних 2-(4сульфоніламіно)-3-гідрокси-3,4-дигідро-2Н-хромен6-ілу з блокуючою дією на калієві канали, насамперед з дією на серцево-судинну систему, а також лікарських засобів, які містять ці сполуки. Винахід стосується також способу одержання запропонованих у винаході нових сполук і проміжних продуктів, які одержують цим способом і використовують при його здійсненні. Із заявки WO 00/12077 A1 [відповідає патенту US 6150356] уже відомі індани, бензопірани й аналоги подібних сполук, які мають блокуючу дію на калієві канали, насамперед дію, яка позитивно впливає на серцево-судинну систему. У заявці WO 00/58300 A1 описуються похідні хроману, придатні для застосування як лікарські OH 3 O R2 R1 II, у якій R , R , R , R й R мають вказані вище значення, піддають взаємодії зі сполукою загальної формули III X-SO2-R3 Ш, у якій R3 має вказані вище значення, а X означає відщеплювану групу, яку вилучають. 11. Сполуки загальної формули II 1 3 NH 4 O S R4 R5 2 5 6 R4 R5 R6 4 N NH 4 O O OH 3 R2 R1 II, у якій R1 означає С1-С4алкіл, R2 означає С1-С4алкіл, R4 означає водень, С1-С6алкіл або С3С7циклоалкіл-С1-С4алкіл, R5 означає водень й R6 означає С1-С6алкіл, феніл-С1-С4алкіл, фенільна група якого необов'язково однозаміщена галогеном, фурил-С1-С4алкіл або R5 й R6 разом з азотом, з яким вони зв'язані, тетрагідронафтил, або утворюють піперазинове кільце, необов'язково заміщене фенілом. засоби, насамперед засоби, які мають противоаритмічну дію. В основу даного винаходу було покладена задача запропонувати нові діючі речовини для лікування захворювань серцево-судинної системи, переважно серцевої аритмії, які відрізнялися б високою ефективністю при хорошій фізіологічній сумісності, а при застосуванні як протиаритмічні засоби - також вираженою вибірною дією по відношенню до передсердя (атріоселективною дією). При створенні винаходу несподівано було встановлено, що запропонована в ньому група нових амідометилзаміщених похідних 2-(4сульфоніламіно)-3-гідрокси-3,4-дигідро-2Н-хромен6-ілу має властивості, які блокують калієві канали, і придатна для лікування захворювань серцевосудинної системи, переважно для лікування 5 серцевої аритмії. Запропоновані у винаході сполуки відрізняються високою ефективністю при хорошій фізіологічній сумісності, а у випадку застосування як протиаритмічні засоби - також вираженою атріоселективною дією. Крім цього запропоновані у винаході сполуки проявляють такі властивості, які ймовірно дозволять використовувати їх для надання додаткового позитивного впливу на імунну систему. Відповідно до вищевикладеного об'єктом даного винаходу є нові амідометилзаміщені похідні 2-(4-сульфоніламіно)-3-гідрокси-3,4дигідро-2Н-хромен-6-ілу загальної формули І у якій R1 означає С1-С4алкіл, R2 означає С1-С4алкіл, R3 означає феніл, необов'язково одно- або двозаміщений галогеном, C1-С4алкілом, С1С4алкоксигрупою або трифторметилом, нафтил або біфеніл, R4 означає водень, С1-С6алкіл або С3С7циклоалкіл-С1-С4алкіл, R5 означає водень й R6 означає С1-С6алкіл, феніл-С1-С4алкіл, фенільна група якого необов'язково однозаміщена галогеном, фурил-С1-С4алкіл або тетрагідронафтил або R5 й R6 разом з азотом, з яким вони зв'язані, утворюють піперазинове кільце, необов'язково заміщене фенілом. Об'єктом винаходу є також лікарські засоби, які містять сполуки формули І. Об'єктом винаходу є також спосіб одержання сполук формули І і проміжні продукти, які одержують цим способом і використовують при його здійсненні. У тих випадках, коли замісники в сполуках формули І або в інших представлених в даному описі й формулі винаходу сполуках являють собою або містять С1-С4алкіл або С1-С6алкіл, цей алкіл у кожному випадку може мати прямий або розгалужений ланцюг. Кожний з R1 й R2 переважно означає метил. R3 переважно означає феніл, необов'язково одно- або двозаміщений галогеном, С1-С4алкілом, С1-С4алкоксигрупою або трифторметилом. Насамперед R3 означає однозаміщений С1С4алкілом феніл. Якщо R3 означає феніл, заміщений галогеном, то як останній можуть розглядатися фтор, хлор, бром й йод. В одному з особливо переважних варіантів R3 являє собою 4етилфеніл. R4 переважно означає водень, С1-С6алкіл або циклопропіл-С1-С4алкіл, насамперед циклопропілметил. Якщо R4 означає С1-С6алкіл, то цей алкіл насамперед є розгалуженим і переважно являє собою неопентил, 2,2-диметилбутил, 2етилбутил, 3-метилбутил або 2-метилпропіл. R5 переважно означає водень. 82907 6 R6 переважно означає феніл-С1-С4алкіл, насамперед бензил або фенетил, або означає тетрагідронафтил, насамперед 1тетрагідронафтил. Переважним значенням є (R)-1тетрагідронафтил. Особливо переважні сполуки формули І вибрані із групи, яка включає 2-(4-{[(4етилфеніл)сульфоніл]аміно}-3-гідрокси-2,2диметил-3,4-дигідро-2Н-xpoмен-6-іл)-N-1,2,3,4тетрагідронафтален-1-ілацетамід, 2-((3S,4R)-4{[(4-етилфеніл)сульфоніл]аміно}-3-гідрокси-2,2диметил-3,4-дигідро-2Н-хромен-6-іл)-N-[(1R)1,2,3,4-тетрагідронафтален-1-іл]ацетамід, Nбензил-2-{4-[[(4етилфеніл)сульфоніл](неопентил)аміно]-3гідрокси-2,2-диметил-3,4-дигідро-2Н-хромен-6іл}ацетамід, 2-{4-[[(4етилфеніл)сульфоніл](неопентил)аміно]-3гідрокси-2,2-диметил-3,4-дигідро-2Н-хромен-6-іл}N-(2-фенілетил)ацетамід й 2-(4-{[(4метилфеніл)сульфоніл]аміно}-3-гідрокси-2,2диметил-3,4-дигідро-2Н-хромен-6-іл)-N-1,2,3,4тетрагідронафтален-1-ілацетамід. Відповідно до винаходу нові сполуки формули І одержують взаємодією сполуки загальної формули II у якій R1, R2, R4, R5 й R6 мають вказані вище значення, зі сполукою загальної формули III у якій R3 має вказані вище значення, a X означає відщеплювану групу, яку вилучають. Цю реакцію можна проводити відомим гідрохімічним шляхом в умовах з використанням інертного органічного розчинника, насамперед диполярного апротонного розчинника, такого як дихлорметан, або з використанням суміші подібних розчинників й у присутності відповідної основи. Як основи придатні ненуклеофільні органічні азотисті основи, такі як третинні (нижч.)алкіламіни, наприклад, триетиламін. Використовувані в надлишку рідкі органічні основи можуть служити також розчинниками. При необхідності реакцію можна каталізувати яким-небудь відомим допоміжним агентом, який сприяє сполученню, таким як 4N,Nдиметиламінопіридин (ДМАП). Реакцію переважно проводити при температурі в інтервалі від кімнатної до 80°C, наприклад, при 65°С. Реакцію можна проводити при тиску в діапазоні від нормального до порядку 200 бар, наприклад, при тиску 180 бар. При застосуванні сполуки формули III у рідкому вигляді може виявитися доцільним видаляти з реакційної суміші відомим шляхом, наприклад, при зниженому тиску, використовуваний розчинник після додавання сполуки формули III до розчиненої в розчиннику сполуки формули II. Якщо у вихідних сполуках формули II R4 являє собою водень, то сполуку 7 формули III доцільно застосовувати в еквімолярних кількостях. Як групу X, яку вилучають, у сполуках формули III звичайно використовують галоген, переважно хлор або бром. Взаємодію сполуки формули II зі сполукою формули III можна здійснювати також відомим способом на твердій фазі, насамперед на термопласті, такому як амінометилполіистирол (АМПС). Відповідно до цього варіанта реакцію переважно проводити для одержання невеликих кількостей продукту, наприклад, порядку 1-10 ммолів. При здійсненні синтезу на твердій фазі як основу переважно використовувати відомий іммобілізований на полімері (ІП-) метилпіперидин. При здійсненні синтезу на твердій фазі доцільно працювати при температурі в інтервалі від 10 до 40°С, переважно при кімнатній температурі. Сполуки формули І можна виділяти з реакційної суміші за відомою методикою й при необхідності очищати їх також відомим способом. Сполуки формули II можна одержувати здійснюваною за відомою методикою взаємодією епоксидної сполуки загальної формули IV у якій R1, R2, R5 й R6 мають вказані вище значення, з нуклеофільною органічною азотистою основою, переважно аміаком у водному розчині, у диполярному протонному розчиннику, такому як (нижч.)алкіловий спирт, переважно в етанолі. Реакцію можна проводити при температурах в інтервалі від кімнатної до 60°C. Якщо як цільовий продукт потрібно одержати сполуки формули II, де R4 являє собою С1-С6алкіл або С3-С7циклоалкілС1-С4алкіл, то отриману сполуку формули II, де R4 являє собою водень, можна потім відомим способом алкілувати. Алкілування можна здійснювати як аміноалкілування, піддаючи спочатку сполуку формули II, де R4 являє собою водень, взаємодії з альдегідом загальної формули V у якій R401 означає водень, С2-С5алкіл або С3С7циклоалкіл-С0-С3алкіл, і відновлюючи потім утворений проміжний іміновий продукт додаванням відповідного відновника до алкіламінової сполуки формули II. Як відновники можна використовувати комплексні борогідриди, такі як NaBH3CN або відомий іммобілізований на полімері борогідрид (ІП-ВH4). Відповідно до одного з варіантів реакцію можна проводити в умовах з використанням інертного полярного протонного органічного розчинника, насамперед метанолу, при цьому відновлення іміну in situ здійснюють без його виділення в тому ж самому розчиннику. Реакцію за цим варіантом можна проводити при температурах в інтервалі від кімнатної до 60°C, наприклад, при 50°C. Відповідно до іншого варіанта взаємодію сполуки формули II, де R4 являє собою водень, з альдегідом формули V з одержанням проміжного імінового продукту можна 82907 8 здійснювати в диполярному апротонном розчиннику, насамперед у тетрагідрофурані (ТГФ). При цьому для прискорення реакції доцільно додавати каталітичні кількості зневоднювального засобу, наприклад, ортоефіру, насамперед триметилортоформіату (ТМОФ). Потім проміжний іміновий продукт можна виділяти й розчиняти в вказаному вище для першого варіанта полярному протонному розчиннику з метою його відновлення в цьому розчиннику. Реакцію за другим варіантом переважно проводити при кімнатній температурі. За допомогою нуклеофільної реакції з розмиканням циклу епоксидів формули IV, здійснюваної за вищеописаними двома варіантами, як правило, одержують сполуки формули II, де віцинальні (сусідні) замісники в положенні 3 й у положенні 4 піранового кільця, а саме, гідроксигрупа й аміногрупа, знаходяться відповідно в транс-конфігурації один відносно одного. Сполуки формули II є новими й можуть успішно застосовуватися як проміжні продукти для одержання нових фармакологічно активних діючих речовин, наприклад, для одержання сполук формули І. Сполуки формули III, так само як і сполуки формули V у принципі відомі або ж їх можна одержувати за відомою методикою також з відомих сполук. Сполуки формули IV можна одержувати здійснюваною за відомою методикою взаємодією сполуки загальної формули VI у якій R1, R2, R5 й R6 мають вказані вище значення, зі здатною утворювати епоксид пероксидною сполукою, насамперед з .мхлорпербензойною кислотою (МХПБК), в умовах з використанням інертного органічного полярного протонного розчинника, переважно дихлорметану, і в присутності відповідної основи. Як така основа придатний насамперед водний розчин гідрокарбонату натрію. Реакцію переважно проводити при кімнатній температурі. Сполуки формули І мають принаймні у віцинальних атомах вуглецю в положенні 3 й у положенні 4 піранового кільця відповідно хіральний центр, і тому вони можуть бути представлені в декількох ізомерних формах. Об'єктом винаходу відповідно до цього є сполуки формули І як у вигляді чистих ізомерів, так й у вигляді сумішей даних ізомерів. Оптично активні сполуки формули І можуть бути отримані, наприклад, із сумішей ізомерів формули І або із сумішей ізомерів формули II за допомогою відомих методів, зокрема хроматографічним розділенням на використовувані в цих цілях хіральних матеріалах. Суміші ізомерів формули II можна одержувати також взаємодією з відповідними оптично активними кислотами, такими як камфорсульфонова кислота або D- або L-винна 9 кислота, і наступним розділенням на відповідні оптичні антиподи шляхом фракціонованої кристалізації отриманих солей. Оптично активні сполуки формули І можна одержувати також безпосередньо хіральним синтезом. Якщо передбачається одержання сполук формули І, де гідроксизамісник у положенні 3 піранового кільця й R4NSO2R3-замісник у положенні 4 піранового кільця знаходяться відповідно до стереохімії в траноконфігурації один відносно одного, то в цих випадках можна виходити з епоксидів формули IV із заздалегідь визначеною відповідною стереохімією. Епоксиди формули IV із заздалегідь визначеною відповідною стереохімією можна одержувати, наприклад, здійснюваним звичайним способом епоксидуванням алкенів формули VI з використанням хірального каталізатора за методом Якобсена (порівн., наприклад, EP 0521099 A1). Якщо, наприклад, передбачається одержання сполуки формули І, де хіральний центр у положенні З піранового кільця знаходиться в Sконфігурації, а хіральний центр у положенні 4 піранового кільця знаходиться в R-конфігурації, то проміжний продукт формули VI можна перетворювати в присутності хірального каталізатора, насамперед (S,S)-марганець(ІІІ)салену (сален являє собою 2-[2-[(2гідроксифеніл)метилиденаміно]етилімінометил] фенол), і в присутності донора кисню, насамперед гіпохлориту натрію, в умовах з використанням інертного органічного розчинника, насамперед дихлорметану. Реакцію доцільно проводити при значенні рН порядку 9,5-11,5. Для встановлення значення рН на необхідне до реакційної суміші переважно додавати буферний розчин, який складається з Na2HPО4 й N-оксиду піридину. Реакцію можна проводити при температурах в інтервалі від -10°C до кімнатної температури, переважно при 0°C. Якщо передбачається одержання сполуки формули І, де хіральний центр у положенні 3 піранового кільця знаходиться в Rконфігурації, а хіральний центр у положенні 4 піранового кільця знаходиться в S-конфігурації, то можна працювати аналогічно до описаного вище методу, але використовуючи замість (S,S)марганець(ІII)-салену (R,R)-марганець(III)-сален. за Сполуки формули VI можна одержувати відомою методикою аміноацилювання взаємодією сполуки загальної формули VII у якій R1 й R2 мають вказані вище значення, зі сполукою загальної формули VIII у якій R5 й R6 мають вказані вище значення. Як ацилювальні агенти можуть використовуватися карбонові кислоти формули VII або їх реакційноздатні похідні, такі як галогенангідриди, насамперед хлор- і бромангідриди цих кислот. При використанні як ацилювальних агентів кислот формули VII як таких їх взаємодію з аміновими сполуками формули VIII доцільно здійснювати 82907 10 також у присутності якого-небудь відомого агента сполучення, наприклад, 1,1-карбонілдіімідазолу, етилового ефіру хлормурашиної кислоти або алкілкарбодііміду, такого як N'-(3диметиламінопропіл)-N-етилкарбодіімід (ДЕК), або циклоалкілкарбодііміду, такого як дициклогексилкарбодіімід. Ацилювання можна здійснювати в умовах з використанням інертного органічного розчинника при температурі в інтервалі від -30 до +50°C, переважно при кімнатній температурі. Як розчинники для вказаних цілей прийнятні галогеновані вуглеводні, такі як дихлорметан, або прості циклічні ефіри, такі як тетрагідрофуран і діоксан, або ж суміші цих розчинників. Сполуки формули VII можна одержувати здійснюваним за відомою методикою омиленням складноефірної групи сполуки загальної формули IX у якій R1 й R2 мають вказані вище значення, a R7 означає С1-С4алкіл. Омилення можна проводити в полярному протонному розчиннику, такому як етиленгліколь, шляхом контактування з відповідною основою, наприклад, сильною основою, такою як розведений водний розчин їдкого натрію. Реакцію переважно проводити при температурі в інтервалі від кімнатної до температури кипіння розчинника або суміші розчинників. формули IX можна одержувати Сполуки здійснюваним за відомою методикою взаємодією сполуки загальної формули X у якій R7 має вказані вище значення, зі сполукою загальної формули XI у якій R1 й R2 мають вказані вище значення. Цю реакцію можна проводити в умовах з використанням інертного органічного розчинника, такого як толуол або ксилол, у присутності відповідної кислоти при відділенні води шляхом азеотропної дистиляції. Як кислоту в вказаних цілях можна використовувати, наприклад, оцтову кислоту або пропіонову кислоту. При проведенні реакції переважно працювати з додаванням каталізатора, такого як кислота Л'юіса, наприклад, фенілборонова кислота. Реакцію переважно проводити при температурі в інтервалі від до температури кипіння розчинника або суміші розчинників, наприклад, при температурі порядку 120°C. Сполуки формули X, так само як і сполуки формули XI у принципі відомі або ж їх можна 11 одержувати за відомою методикою також з відомих сполук. Наявність у сполук формули І як фармакологічно активних діючих речовин позитивних властивостей стає очевидним на фоні наступних пояснень. Відомо, що речовини, які блокують аутогенні кардіальні калієві канали, можуть застосовуватися як діючі речовини при серцево-судинних захворюваннях, насамперед при серцевій аритмії. Завдяки блокаді перетіканню іонів калію із клітин серця можна збільшити потенціал дії серця, що здійснює позитивний протиаритмічний ефект. Як приклади цього відомого використовуваного в терапії підходу можна назвати застосування протиаритмічних засобів класу III. Проблема, зв'язана із застосуванням таких неспецифічних блокаторів калієвих каналів, полягає в низькій вибірності їх дії на різні тканини серця. Так, уже тривалий час існує припущення, що насамперед протиаритмічні засобу класу III можуть приводити до небажаного збільшення тривалості інтервалу QT на електрокардіограмі (ЕКГ) і до поліморфної шлуночкової тахікардії (тріпотінню-мерехтінню шлуночків), що в остаточному підсумку може викликати небажані ускладнення, такі, наприклад, як фібриляція шлуночків. Тому здійснювалися й здійснюються спроби створення таких блокаторів калієвих каналів, які були б здатні селективно впливати на виявленіпотоки передсердя, а не Оскільки калієві в серці недавнокалієві шлуночка. канали Kv1.5 локалізовані винятково в передсерді, а не в шлуночку, відносно сполук, які блокують ці калієві канали K v1.5, можна припустити, що вони можуть застосовуватися як протиаритмічні засоби з атріоселективною дією. Однак калієві канали Kv1.5, так само як й інші калієві канали локалізовані не тільки в серці, але й, наприклад, у судинах інших частин тіла. Тому не можна повністю виключити можливість того, що сполуки, які блокують калієві канали K v1.5, внаслідок блокади калієвих каналів у судинах не приведуть до підвищення кров'яного тиску. Переважні тому такі сполуки, які блокують калієві канали Kv1.5, які не здатні викликати супутні ефекти, що проявляються в підвищенні кров'яного тиску. Із числа інших небажаних супутніх ефектів, які можуть мати місце при введенні в організм деяких сполук, які мають блокуючу дію на калієві канали Kv1.5, слід назвати також ефекти, що супроводжують застосування протиаритмічних засобів класу І, і негативні інотропні ефекти. Сполуки формули І відрізняються яскраво вираженою і вибірною кардіальною дією, яка блокує калієві канали K v1.5. Поряд з особливо високою ефективністю й вираженим атріоселективним протиаритмічним профілем дії сполуки формули І дозволяють при всіх умовах мінімізувати виникнення небажаних супутніх ефектів, таких як підвищення кров'яного тиску, ефектів, які супроводжують застосування протиаритмічних засобів класу І, а також негативних інотропних ефектів. Відповідно до цього сполуки формули І показані для лікування й/або профілактики серцево-судинних захворювань, насамперед мерехтіння передсердь, 82907 12 тріпотіння передсердь й інших серцевих аритмій, у великих ссавців і людини. Крім того, сполуки формули І проявляють виражену блокуючу дію на калієві канали K v1.3. Калієві канали Kv1.3 переважно локалізовані в клітинах імунної системи. Блокада калієвих каналів Kv1.3 розглядається, зокрема, у взаємозв'язку з антипроліферативною й/або імуносупресивною дією [див. C. Beeton й ін., The Journal of Immunology 166, 2001, cc.936-944]. Виходячи із цього, відносно сполук, здатних блокувати калієві канали KV1.3, у тому числі, наприклад, і відносно сполук формули І, можна припустити, що вони можуть застосовуватися також для лікування й/або профілактики проліферативних, хронічних запальних й аутоімунних в захворювань, таких як прикладів Вказані наступному описі номери розсіяний відповідають номерам описаних нижче прикладів склероз. одержання запропонованих у винаході сполук. 1. Дослідження блокуючої дії сполук на калієві канали K v1.5 в експериментах in vitro Наявність в запропонованих у винаході сполук блокуючої дії на калієві канали KV1.5 підтверджують дослідним шляхом проведенням дослідження на відомій як такій експериментальній моделі або її аналогу [див. W. Hu й ін., J. Pharmacol. Toxicol. Methods 34, 1995, сс.1-7]. При проведенні дослідження на цій експериментальній моделі використовують лінію клітин яєчника китайського хом'ячка (СНО-клітин від англ. "chinese hamster ovary"), отриманих від однієї єдиної клітини й стабільно експресуючих канал Kv1.5. Вказані CHO-клітини їх інкубацією протягом ночі в живильному середовингу, що містить RbCl, або в "буфері для навантаження" (склад (всі значення вказані в мМ): RbCl 5, NaCl 140, CaCl2 2, MgSO4 1, N-2-гідроксіетилпіперазин-N'-2етансульфонова кислота (HEPES) 10, глюкоза 5) "навантажують" катіонами Rb+ під дією АТФ-ази, яка переносить Na+/K+. Потім одну частину СНОклітин, яку використовують як порівняльний стандарт, інкубують за відсутності інгібітора, а іншу частину СНО-клітин інкубують у присутності відповідних тестованих сполук формули І, які мають інгібуючу дію. Після цього СНО-клітини шляхом підвищення позаклітинної концентрації іонів калію деполяризують, у результаті чого калієві канали K v1.5 СНО-клітин відкриваються. За інгібітора іони Rb+ перетікають через калієві канали Kv1.5 у рідину, яка їх оточує. У присутності ж тестованої сполуки формули І, яка має інгібуючу дію, іони Rb+ залишаються локалізованими всередині СНО-клітин. Як міру блокуючої дії тестованих сполук формули І на калієві канали Kv1.5 атомно-адсорбційною спектроскопією вимірюють концентрацію іонів Rb+ у рідині, яка їх оточує, в зіставленні з китайського хом'ячка (див. Клітини яєчника порівняльним стандартом. вище) культивували у відомому як такому, живильному середовищу, яке містить RbCl, для культивування СНО-клітин і потім переносили в лунки 96-лункового планшета. Для одержання моношару СНО-клітин їх залишали на ніч для розмноження. Після цього спочатку піпеткою видаляли живильне середовище й з кожну лунку тричі промивали буфером для попередньої 13 82907 інкубації з низькою концентрацією в ньому іонів калію (склад (всі значення вказані в мМ): KCl 5, NaCl 140, CaCl2 2, MgSO4 1, HEPES 10, глюкоза 5) порціями по 100мкл. Потім у кожну лунку додавали по 50мкл розчину відповідної тестованої сполуки (вихідний розчин у ДМСО, розведення буфером для попередньої інкубації, кінцева концентрація в дослідній суміші 10мкМ) або тільки розчинника (як негативний контроль) і інкубували в кожному випадку протягом 10хв при кімнатній температурі. Далі в кожну лунку додавали по 50мкл буфера для стимуляції з підвищеною концентрацією в ньому іонів калію (склад: KCl 145мМ, NaCl 0мМ, інші компоненти відповідають буферу для попередньої інкубації), після чого зразки інкубували ще протягом 10хв при кімнатній температурі. Потім по 80мкл рідини, яка оточує СНО-клітини, з кожної лунки окремо одна від одної переносили в лунки аналітичного планшета й атомно-адсорбційною спектроскопією визначали концентрацію іонів Rb+ у зразках рідини. З кожною з тестованих сполук проводили по два експерименти. На спектрограмі виділяли той фрагмент сигналу, який відповідав складовій перетікання катіонів Rb+ із клітин, що стосується каналу KV1.5, використовуючи як позитивний контроль відомий блокатор калієвих каналів 4-АР у високій концентрації (що в 100 разів перевищує значення ІС50 для каналу K v1.5). Таким шляхом вдалося визначити, яка частина перетікання катіонів Rb+ із клітин залежала від впливу блокатора A-AP і тому повинна була бути співвіднесена з каналом Kv1.5. Зі сполуками, які у використовуваній концентрації, що дорівнює 10мкМ, зменшували перетікання катіонів Rb+ із клітин принаймні на 50%, проводили додаткові досліди, у яких тестовувану сполуку використовували в менших концентраціях для можливості визначення її інгібуючої концентрації, яка дорівнює половині від максимально ефективної. Як відповідний показник у кожному випадку визначали ту концентрацію тестованої сполуки формули І, при якій ступінь інгібування дорівнює половині від максимальної (ІС50). У наведеній нижче таблиці 1 представлені тестовані сполуки формули І й отримані для них за результатами проведеного на цій експериментальній моделі дослідження значення IC50. Таблиця 1 Блокуюча дія тестованих сполук на калієві канали Kv1.5 в експериментах in vitro Приклад № 2 4 6 7 8 9 10 11 12 13 IC50 2,0 1,6 5,0 1,5 0,5 2,9 1,6 3,2 3,2 6,5 14 15 16 17 18 19 6 21 22 23 24 25 26 27 4,0 6,3 2,65 2,7 2,5 2,9 3,3 3,4 4,3 5 5,2 5,2 5,6 2. Дослідження блокуючої дії сполук на калієві канали K v1.3 в експериментах in vitro Наявність в запропонованих у винаході сполук блокуючої дії на калієві канали K v1.3 підтверджують дослідним шляхом проведенням дослідження на відомої як такої експериментальної моделі (наприклад, за методикою фірми Genion, Гамбург) або її аналогу [див.. J. Plasek й K. Sigler, J. Photochem. Photobiol. 33, 1996, cc.101-124]. При проведенні дослідження на цій експериментальній моделі використовують відомі клітини яєчника китайського хом'ячка (СНОклітини), стабільно трансфіковані калієвим каналом K v1.3. Блокада в трансфікованих клітинах властивої їм самим активності калієвих каналів Kv1.3 супроводжується зсувом мембранного потенціалу у бік позитивних значень із приблизно 40мВ до -30мВ, тоді як у СНО-клітинах дикого типу, які досліджувалися паралельно, не відбувається ніякого скільки-небудь істотного зсуву мембранного потенціалу. Зміна мембранного потенціалу безпосередньо зв'язана, таким чином, зі зниженням активності калієвих каналів Kv1.3. Блокада калієвих каналів K v1.3, наприклад, сполуками формули I, і зміна мембранного потенціалу, яка відбувається в результаті цього, приводять до нагромадження чутливого до мембранного потенціалу флуоресцентного барвника у внутрішньоклітинних компартментах СНО-клітин і в остаточному підсумку до збільшення інтенсивності флуоресценції. Зміну мембранного потенціалу СНО-клітин вимірюють, таким чином, непрямим шляхом за збільшенням інтенсивності флуоресценції трансфікували до K v1.3-плазмідою Клітини чутливого мембранного відомим методом з використанням наявного в потенціалу барвника. продажі реагенту для трансфекції (DMRIE-C фірми Gibco BRL, Німеччина). Результати трансфекції перевіряли за допомогою імунофлуоресценції, а також дослідженням струму іонів калію методом петч-клампа (фіксації потенціалу). Для вимірювання флуоресценції використовували флуориметр типу Tecan Safire фірми Тесаn, Німеччина. Як відповідний показник у кожному випадку визначали збільшення інтенсивності флуоресценції, зумовлене блокадою калієвих каналів K v1.3 в СНО-клітинах сполуками формули І у концентрації, що дорівнює 10мкМ. Таке збільшення інтенсивності флуоресценції в кожному випадку виражали у відсотковому 15 82907 відношенні (%) до збільшення інтенсивності флуоресценції, що викликається маргатоксином, який використовували як порівняльну сполуку. Маргатоксин відомий як селективний блокатор калієвих каналів K v1.3 [див., наприклад, M. GarciaCalvo й ін., J. Віоі. Chem. 268, 1993, сс.1886618874]. B наведеній нижче таблиці 2 представлені тестовані сполуки формули І й отримані для них за результатами проведеного на цій експериментальній моделі дослідження процентні значення. Таблиця 2 Блокуюча дія тестованих сполук на калієві канали Kv1.3 в експериментах in vitro Прикл ад № 2 6 5 9 10 11 12 13 17 18 19 21 22 23 Збільшення інтенсивності флуоресценції (в % по відношенню до збільшення інтенсивності флуоресценції, яке викликається маргатоксином) 72 97 82 107 82 99 111 53 72 141 171 86 71 41 3. Дослідження функціональної ефективності запропонованих у винаході сполук в експериментах in vitro на передсерді щура Наявність у запропонованих у винаході сполук функціональної протиаритмічної ефективності підтверджують дослідним шляхом проведенням дослідження на описаній нижче експериментальній моделі. При дослідженні на цій експериментальній моделі визначають ступінь, у якій сполуки формули І, які мають блокуючу дію на калієві канали Kv1.5, подовжують функціональний рефрактерний період у лівому передсерді щура. Рефрактерний період являє собою мінімально можливий інтервал часу, який проходить із моменту реакції на основне подразнення до моменту реакції на додатковий стимул і протягом якого можливо викликати повторне скорочення м'яза. Ступінь подовження функціонального рефрактерного періоду є мірою протиаритмічної ефективності запропонованих у винаході сполук. Для визначення функціонального рефрактерного періоду на препараті, який піддається електростимуляції, перевіряють, після закінчення якого проміжку часу з моменту попереднього скорочення можна викликати повторне скорочення в результаті додаткового подразнення імпульсом електричного струму. 16 В щурів (лінії Sprague-Dawley, фірма CharlesRiver, Німеччина) відразу ж після їх умертвіння витягали серце. Після цього виділяли ліві передсердя й закріплювали їх на датчиках сили в термостатованій (30°С), продутій газом певного складу (O2 95%, CO2 5%) ванночці для органів, заповненої модифікованим розчином Тироде (склад (всі значення вказані в мМ): NaCl 137, KCl 2,7, CaCl2 1,8, MgCl2 0,8, NaHCO3 11,9, Na2PO4 0,6, глюкоза 5). Регулярні скорочення викликали додаванням до препаратів стимулюючих імпульсів електричного струму (імпульси прямокутної форми, інтенсивністю, яка в 3,5-рази перевищує поріг подразнення, тривалістю 1,5мс і частотою повторення 1Гц). Спочатку визначали початкове значення функціонального рефрактерного періоду, для чого додатково до основного подразнення до препаратів прикладали додаткові імпульси електричного струму, поступово скорочуючи при цьому інтервал часу, який проходить із моменту попереднього основного подразнення до моменту подачі наступного додаткового імпульсу електричного струму, доти, поки у відповідь на подачу чергового додаткового імпульсу електричного струму не відбувалося додаткової скорочувальної реакції на нього препаратів. Після цього починали кумулятивне додавання сполук формули І у зростаючих концентраціях (від 0,1 до 10мкМ) з інтервалами в 20хв, повторно визначаючи при цьому рефрактерний період через 18хв після кожного додавання сполук формули І. Перед проведенням вимірювань готували вихідні розчини тестованих сполук (3,2 й 0,32мМ в 100% ДМСО). Для досягнення необхідної кінцевої концентрації тестованих сполук (0,1-10мкМ) у ванночці для органів (об'ємом 100мл) у неї потім додавали ці вихідні розчини у відповідних об'ємах. Як відповідний показник у кожному випадку визначали подовження в мілісекундах функціонального рефрактерного періоду (ФРП) у лівому передсерді щурів, що спостерігалося після додавання відповідної сполуки формули І у концентрації 10мкМ до препаратів передсердь. У наведеній нижче таблиці 3 представлені тестовані сполуки формули І й отримані для них за результатами проведеного на цій експериментальній моделі дослідження значення подовження рефрактерного періоду, при цьому більш високі значення відповідають більш високій протиаритмічній ефективності. Таблиця 3 Дія тестованих сполук, яка подовжує ФРП, (10мкМ) в експериментах in vitro на лівому передсерді щура Приклад № 1 2 4 7 8 9 Подовження ФРП [мс] 15 20 17 24 17 ЗО 17 10 11 12 13 14 15 16 82907 20 24 14 28 22 30 20 4. Дослідження функціональної ефективності запропонованих у винаході сполук в експериментах in vivo на серце морських свинок На прикладі описаної нижче експериментальної моделі продемонстровано, що запропоновані у винаході сполуки мають також незначну небажану проаритмічну дію на реполяризацію шлуночків серця. Із цією метою in vivo досліджують вплив сполук формули І на ефективний рефрактерний період (ЕРП) і на інші величини, які впливають на роботу серця морських свинок. У дослідженні на цій експериментальній моделі застосування неселективних блокаторів калієвих каналів, які не відповідають даному винаходу, що блокують також канали HERG й/або KvLQT1, приводить до небажаної зміни ЕРП, а також тривалості інтервалу QT на електрокардіограмі (ЕКГ). Тривалість інтервалу QT також є мірою реполяризації серця. Обумовлене застосуванням блокаторів калієвих каналів збільшення ЕРП і тривалості інтервалу QT у кожному їх двох випадків незалежно вказує на ризик виникнення небажаного тріпотіння-мерехтіння шлуночків ("Torsade-de-Pointes"). Крім цього за ЕКГ у кожному випадку визначали також тривалість QRS-комплексу як міру швидкості поширення шлуночкового збудження. Обумовлене застосуванням тестованої сполуки збільшення тривалості QRS-комплексу також зв'язують із підвищеним ризиком небажаних проаритмічних супутніх ефектів. Тому при дослідженні на цій експериментальній моделі відсутність збільшення ЕРП і тривалості інтервалу QT вказує на малий ризик, а поява значного збільшення ЕРП і тривалості інтервалу QT вказує на підвищений ризик небажаної проаритмічної дії. Крім цього відсутність обумовленого застосуванням досліджуваних сполук формули І збільшення тривалості QRS-комплексу означає малий ризик небажаних проаритмічних супутніх ефектів, оскільки відсутність збільшення тривалості QRSкомплексу вказує на непорушене поширення збудження в шлуночці серця. І навпаки, збільшення тривалості QRS-комплексу, яке звичайно викликається протиаритмічними засобами класу І, дослідження самців морських При проведенні свідчить про сповільнення швидкості проведення збудження й Charles River) свинок (лінії Dimkin-Hartley, фірма може сприяти виникненню наркотизували шлуночкової тахікардії аж до (кетаміном у дозі 50мг/кг, мерехтіння у дозі 10мг/кг) ксилазиномшлуночків серця. і в кожної тварини звільняли доступ до однієї з яремних вен для 18 введення через неї сполук формули І або тільки носія. Через іншу яремну вену морським свинкам у правий шлуночок серця вводили біполярний катетер для стимуляції (стимуляційна частота 5Гц). Артеріальний кров'яний тиск вимірювали за допомогою введеного в сонну артерію катетера, підключеного до датчика тиску Стетхема (Statham). ЕКГ знімали за допомогою голчастих електродів. Дані вимірювань оцифровували за допомогою аналого-цифрового перетворювача, обробляли на комп'ютері за допомогою відповідного програмного забезпечення (Ponemah Physiology Platform, фірма Gould, США) і паралельно роздруковували на багатоканальному самописі. Після закінчення 45-хвилинного періоду досягнення рівноважного стану морським свинкам з 12-хвилинними інтервалами внутрішньовенно вводили сполуки формули І або носій у зростаючому дозуванні. Перед першим введенням і через хвилину після кожного наступного введення сполук формули І у зростаючому дозуванні (від 0,1 до максимум 30мкмолів/кг) вимірювали ефективний рефрактерний період. Із цією метою після подачі кожних п'яти звичайних стимулюючих імпульсів електричного струму подавали додатковий імпульс, поступово збільшуючи при цьому інтервал часу, що проходить із моменту подачі попереднього імпульсу електричного струму до моменту подачі наступного додаткового імпульсу, доти, поки подача чергового додаткового імпульсу електричного струму не викликала серцеву діяльність. Зареєстрований інтервал часу відповідає ЕРП шлуночкового міокарда. Для виявлення можливого впливу, який здійснюється тестованими сполуками на кров'яний тиск, у цьому ж дослідженні після кожного введення тестованих сполук визначали систолічний й діастолічний кров'яний тиск і порівнювали виміряні значення з попереднім рівнем кров'яного тиску. Параметри кров'яного тиску реєстрували автоматично через 1 й 8хв після кожного введення тестованих сполук. У наведеній нижче таблиці 4 додатково представлені дані про зміну систолічного кров'яного тиску, викликану вказаними нижче сполуками формули І (за винятком обумовлених носієм ефектів). Жодна із вказаних сполук не приводила до істотного таблиці 4 представлені У наведеній нижче підвищення кров'яного тестовані сполуки формули І і виявлена ними в тиску. дослідженні на цій експериментальній моделі дія. У наведеній нижче таблиці представлені тільки статистично значимі результати, при цьому для статистичної перевірки використовували t-критерій при рівні значимості р
ДивитисяДодаткова інформація
Назва патенту англійськоюAmidomethyl-substituted 2-(4-sulfonilamino)-3-hidroxy-3,4-dihydro-2h-chromium-6-yl-derivatives, process and intermediates for the preparation thereof and drugs containing said compounds
Автори англійськоюSykes David, Moloney Brian, Cygler Diter, Bruckner Rainhard, Weske Michael, Fischer Yvan
Назва патенту російськоюАмидометилзамещенные производные 2-(4-сульфониламино)-3-гидрокси-3,4-дигидро-2н-хромен-6-ила, способ и промежуточные продукты для их получения и лекарственные средства, которые содержат эти соединения
Автори російськоюСайкс Девид, Молони Брайан, ЦИГЛЕР Дитер, БрюкнерРайнхард, Веске Михаэль, Фишер Иван
МПК / Мітки
МПК: A61P 9/06, C07D 311/68, C07D 407/12, A61K 31/353
Мітки: продукти, похідні, 2-(4-сульфоніламіно)-3-гідрокси-3,4-дигідро-2н-хромен-6-ілу, містять, лікарські, амідометилзаміщені, одержання, засоби, спосіб, проміжні, сполуки
Код посилання
<a href="https://ua.patents.su/18-82907-amidometilzamishheni-pokhidni-2-4-sulfonilamino-3-gidroksi-34-digidro-2n-khromen-6-ilu-sposib-i-promizhni-produkti-dlya-kh-oderzhannya-jj-likarski-zasobi-yaki-mistyat-ci-spoluki.html" target="_blank" rel="follow" title="База патентів України">Амідометилзаміщені похідні 2-(4-сульфоніламіно)-3-гідрокси-3,4-дигідро-2н-хромен-6-ілу, спосіб і проміжні продукти для їх одержання й лікарські засоби, які містять ці сполуки</a>
Попередній патент: Спосіб визначення властивостей гірських порід у процесі буріння свердловин і пристрій його реалізації
Наступний патент: Похідні 1н-імідазолу як модулятори рецепторів канабіноїдів
Випадковий патент: Пристрій для обчісування зернових на корені












