Спосіб отримання водної дисперсії холестерину
Формула / Реферат
1. Спосіб отримання водної дисперсії холестерину, що включає розчинення холестерину в етиловому спирті і додавання до суміші речовини-стабілізатора, перемішування суміші з подальшим упарюванням на роторному випарнику, який відрізняється тим, що як речовину-стабілізатор використовують наночастки ортованадатів рідкоземельних елементів nReVO4:Eu3+, де Re=Y, Gd, La розміром 1-5 нм при наступному співвідношенні компонентів, мас.%:
холестерин
0,1-8,0
наночастки ортованадатів
0,01-0,8
вода
решта.
2. Спосіб за п. 1, який відрізняється тим, що у водну дисперсію холестерину може бути додатково введений гідрофобний люмінесцентний барвник в концентрації 0,01-0,0001 мас. %.
3. Спосіб за п. 1, який відрізняється тим, що у водну дисперсію холестерину може бути додатково введена біологічно активна речовина, наприклад доксорубіцин в концентрації 0,01-0,0001 мас. %.
Текст
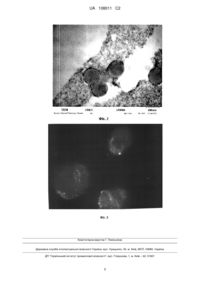
Реферат: Винахід стосується способу отримання водної дисперсії холестерину, що включає розчинення холестерину в етиловому спирті і додавання до суміші речовини-стабілізатора, перемішування суміші з подальшим упарюванням на роторному випарнику, у якому як речовину-стабілізатор 3+ використовують наночастки ортованадатів рідкоземельних елементів nReVO4:Eu , де Re=Y, Gd, La розміром 1-5 нм при наступному співвідношенні компонентів, мас. %: холестерин 0,1-8,0 наночастки ортованадатів 0,01-0,8 вода решта. UA 108011 C2 (12) UA 108011 C2 Також у водну дисперсію холестерину може бути додатково введений гідрофобний люмінесцентний барвник в концентрації 0,01-0,0001 мас. % та/або біологічно активна речовина, наприклад доксорубіцин в концентрації 0,01-0,0001 мас. %. UA 108011 C2 5 10 15 20 25 30 35 40 45 50 55 60 Винахід належить до області медицини, біотехнології та хіміко-фармацевтичної промисловості і може бути використано як речовина направленого транспорту холестерину та супутніх біологічно активних речовин в клітині та тканині організму при парентеральному введенні шляхом ін'єкцій. Відомо, що холестерин у складі клітинної плазматичної мембрани грає роль модифікатора бішару, додаючи йому певну жорсткість за рахунок збільшення щільності "упаковки" молекул фосфоліпідів. Холестерин бере участь в біосинтезі стероїдних статевих гормонів і кортикостероїдів, служить основою для утворення жовчних кислот і вітамінів групи D, бере участь в регулюванні проникності клітин і оберігає еритроцити крові від дії гемолітичної отрути (1). Ракові клітини будучи "пастками" холестерину - вибірково захоплюють холестерин з біологічного довкілля. Холестерин нерозчинний у воді і в чистому вигляді не може доставлятися до тканин організму за допомогою, заснованою на воді крові. Тому холестерин в крові знаходиться у вигляді ліпопротєїнів - добре розчинних комплексних сполук з білками-транспортерами (аполіпопротєїнами). Проте холестерин схильний до окислення при взаємодії з активними формами кисню, що знаходяться в організмі. Відомий спосіб отримання суспензії непористих мікросфер для парентерального введення [пат. RU № 2095055, А61К 9/52, 9/16, 9/10], що мають діаметр 5-300 мкм, які містять, щонайменше, одну фармацевтично активну речовину, поміщену в сферичну структуру, сформовану щонайменше одною речовиною-носієм Як носій, в числі інших речовин, використаний холестерин. Спосіб отримання твердих непористих мікросфер включає розплавлення фармацевтично неактивної речовини-носія, диспергування фармацевтично активної речовини в інертній атмосфері, розпилення отриманої дисперсії у вигляді туману в камері для заморожування під тиском, в інертній атмосфері, за температури від - 15 до – 50 С, і розділення отриманих мікросфер на фракції по розмірах. Як рідину для суспензії використовують водні розчини солей, наприклад фізіологічний розчин або масла. Вживання мікросфер дозволяє уповільнювати і пролонгувати ефект активних речовин, які дуже швидко розчиняються у фізіологічному середовищі (речовин, що діють на центральну або вегетативну нервову систему, таких як судинорозширювальні, противогістамінні засоби, гормони, контрацептиви). Відомий спосіб здобуття водної дисперсії фосфоліпідної форми холестерину [заявка РСТ № 90/03795, А61К 37/22], що включає розчинення речовин, здатних утворювати ліпідну оболонку ліпосом в органічному розчиннику, висушування отриманого розчину з утворенням плівки, ресуспензування ліпідної плівки в дисперсійному середовищі у присутності кріопротектору, диспергування ліпідів, що суспензують, в мікроемульсію, заморожування мікроемульсії при температурі -18 °C і ліофілізацію протягом 24 годин. Як речовина, здатна утворювати ліпідну оболонку, взятий дистеорилфосфатидилхоліл в мольному співвідношенні з холестерином 2:1. Як кріопротектор використовують суміш цукру з протеїном, пептидом і олігопептидом. При цьому цукор беруть у відношенні до фосфоліпідів, рівному 4:1, а протеїн, пептид або олігопептид у співвідношенні до фосфоліпідів 1:1. Відомий спосіб здобуття водної дисперсії фосфоліпідної форми холестерину [RU № 2144352, А61К9/19, 9/127], що включає розчинення речовин, здатних утворювати ліпідні везикули, в органічному розчиннику, висушування розчину із отриманням плівки, ресуспензування ліпідної плівки в дисперсійному середовищі у присутності кріопротектору, диспергування суспензії ліпідів в мікроемульсію, заморожування мікроемульсії і подальшу ліофілізацію. При цьому заморожування мікроемульсії проводять за температури -35…-45 °C, заморожену мікроемульсію перед ліофілізацією піддають гартуванню за температури -50…60 °C. Як речовини, що здатні утворювати везикули, використовують лецитин, холестерин, суміш кислих фосфоліпідів. Як дисперсійне середовище використовують водний розчин лікарських речовин. Як кріопротектори використовують сахарозу, взяту в масовому співвідношенні до речовин, здатних утворювати ліпідні везикули, рівному 4:1. Розмірним критерієм є дисперсія ліпосом з середнім розміром ліпосомних везикул не більш, ніж 0,4-1,0 мкм, інакше можливе пошкодження дрібних капілярних судин. Відомий спосіб здобуття водної дисперсії фосфоліпідної форми холестерину [пат. RU 2097038, А61К 31/575, 685], що включає розчинення фосфоліпіду і холестерину в органічному розчиннику, їх перемішування, упарювання, висушування за допомогою роторного випарника з подальшою гідратацією, гомогенізацію при високому тиску в безперервному процесі, центрифугування ліпосомальної суспензії і стерилізуючу фільтрацію. При цьому розчинені холестерин і фосфоліпіди в молярному співвідношенні від 1:1 до 2:1, фільтрують під тиском в атмосфері інертного газу і після випаровування і гідратації піддають циклічній гомогенізації в 1 UA 108011 C2 5 10 15 20 25 30 35 40 45 50 55 замкнутому контурі при тиску 10-120 МПа, температурі 15-45 °C, переважно біля температури фазового переходу відповідного фосфоліпіду, при цьому кількість циклів гомогенізації від 1 до 20,1 центрифугуванням протягом 40 хв. за 20 000 g і температури +5 °C. При цьому молярне співвідношення холестерин/фосфоліпід в ліпосомальній суспензії від 0,9-1,1 до 1,5-1,85, середній діаметр часток 40-200 нм, а стандартне відхилення розподілу часток 20-100 нм. Сумарна концентрація фосфоліпідів і холестерину в ліпосомальній суспензії рівна 1-10 мас. об. Відомий спосіб здобуття водної дисперсії фосфоліпідної форми холестерину [naT.RU № 2271801, А61К 9/127, А61Р 35/00], що включає розчинення холестерину в етиловому спирті і додавання 1 %-ного розчину лецитину. Суміш перемішують і упарюють на роторному випарнику у вакуумі при 30-37 °C до утворення ліпідної плівки. У колбу з ліпідною плівкою додають 0,1 %ный водний розчин "Фотосенса" (сульфований фталоцианін оксиалюмінію), що містить додатково 4 % сахарози, збовтують в ультразвуковій ванні до повного змивання плівки із стінок колби і утворення ліпосом. Отримані ліпосоми зменшують в розмірах методом екструзії на приладі Mini-extruder. Середній розмір ліпосом складає в середньому 200 нм. Суміш ліпідів включає лецитин і холестерин в молярному співвідношенні (1,8-2,2), а молярне співвідношення "загальний ліпід":фотосенсибілізатор складає (14-16): 1. Загальним недоліком приведених аналогів є той факт, що розміри дисперсних часток, отримуваних фосфоліпідних форм холестерину - 5-300 нм, що знаходиться за межами розмірного діапазону наночасток (до 100 нм), вони досить великі, що обмежує можливість їх вживання при парентеральному введенні (взаємодія з мембранними рецепторами і процеси ендоцитозу здійснюються переважно з частками менше 100 нм), а внесення до медичного препарату біологічно активних, але не надаючих лікувальної дії речовин (кріопротекторов), не завжди є виправданим. Крім того, відсутня можливість ідентифікації часток холестерину в клітинах і тканинах організму. Слід зазначити, що стабілізаторами дисперсних часток холестерину у всіх аналогах є фосфоліпіди, які, поряд з холестерином, піддаються швидкому окисленню при взаємодії з активними формами кисню, що знаходяться в організмі. У свою чергу, окислені форми холестерину і фосфоліпідів порушують) нативний метаболізм клітин і надають побічну негативну дію на фізіологічні процеси організму в цілому. В основу справжнього винаходу поставлено задачу розробки способу отримання стійкої відносно до активних форм кисню водної дисперсії холестерину, що забезпечує можливість контролю вступу холестерину в клітини і тканини організму і здобуття часток холестерину з максимальним розміром, що не перевищує 100 нм Як прототип нами вибраний останній з аналогів. Рішення задачі забезпечується тим, що в способі отримання водної дисперсії холестерину, що включає розчинення холестерину в етиловому спирті і додавання до суміші речовинистабілізатора, перемішування суміші з подальшим упарюванням на роторному випарнику, згідно з винаходом, як речовину-стабілізатор використовують наночастки ортованадатів 3+ рідкоземельних елементів nReVО4:Eu , де Re = Υ, Gd, La, розміром 1-5 нм при наступному співвідношенні компонентів, мас. %: холестерин 0,1-8,0 наночастки ортованадатів 0,01-0,8 вода решта. У водну дисперсію холестерину може бути додатково введений гідрофобний люмінесцентний фарбник в концентрації 0,01-0,0001 мас. % для реєстрації в умовах люмінесцентної мікроскопії. У водну дисперсію холестерину може бути додатково введене біологічно активна речовина, наприклад доксорубіцин в концентрації 0,01-0,0001 мас. %. У водному розчині вказані наночастки локалізуються на периферії часток холестерину за рахунок вандерваальсових і гідрофобних взаємодій і виконують роль стабілізатора за рахунок електростатичних взаємодій і, як показали дослідження, на відміну від аналогів, забезпечують отримання часток холестерину не більше 100 нм. Негативно заряджені наночастки ортованадатів перешкоджають злипанню і агрегації часток холестерину. З іншого боку, неорганічні наночастки ортованадатів рідкоземельних елементів проявляють антиоксидантні властивості і не піддаються окисленню, що сприяє збільшенню стійкості водної дисперсії холестерину відносно до активних форм кисню. Проведені нами дослідження показали [V. Klochkov, N. Kavok, G.Grygorova, Ο. Sedyh, Yu. Malyukin. Size and shape influence of luminescent orthovanadate nanoparticles on their accumulation in nuclear compartments of rat hepatocytes // Materials Science and Engineering C-2013.- V. 33.- P. 2 UA 108011 C2 3+ 5 10 15 20 25 30 35 40 45 50 55 60 2708-2712.], що наночастки nGdVO4:Eu мають люмінесцентні властивості і здатні проникати і накопичуватися усередині клітин. Тому у заявленому рішенні, ортованадатні наночастки одночасно є транспортуючим агентом холестерину, антиоксидантом і люмінесцентним мітчиком для ідентифікації локального накопичення холестерину методом люмінесцентної спектроскопії. Як показали дослідження, використання наночасток більше 5 нм знижує вірогідність їх локалізації на поверхні дисперсних часток холестерину і не забезпечують достатнього значення величини електрокінетичного потенціалу (заряду) на поверхні дисперсних часток холестерину для їх електростатичного відштовхування в розчині, а, отже, не сприяють їх агрегативній стабілізації в розчині Використання концентрації холестерину менше 0,1 мас. %. не має сенсу. При використанні концентрації холестерину більше 8,0 мас. % дисперсії агрегативно нестійкі. У дисперсній системі спостерігається розшарування води і холестерину. При використанні концентрації наночасток ортованадатів менше 0,01 мас. % дисперсії агрегативно нестійкі, оскільки стабілізуючих наночасток на периферії часток холестерину недостатньо для забезпечення стабілізуючого ефекту. При використанні концентрації наночасток ортованадатів більше 0,8 мас. % спостерігається агрегація наночасток між собою, що знижує ефект їх стабілізуючої дії і приводить до неконтрольованого укрупнення дисперсних часток холестерину. Додавання гідрофобних органічних біологічно активних сполук в холестерин може сприяти додатковому терапевтичному ефекту при направленій доставці препаратів (наприклад, доксорубіцину, що має протиракову активність). Вказані концентрації органічних біологічно активних сполук є достатніми для терапевтичного ефекту. Вихід за вказані граничні значення призводять або до відсутності помітного терапевтичного ефекту, або до зниження агрегативної стійкості дисперсій, оскільки великі концентрації біологічно активних з'єднань самі впливають на формування стійких дисперсій. Для реєстрації акумуляції дисперсій холестерину в клітинах і тканинах в умовах люмінесцентної мікроскопії, у водну дисперсію холестерину, що заявляється, може бути додатково введений гідрофобний люмінесцентний фарбник у вказаних концентраціях. Вихід за їх граничні значення приводить або до відсутності можливості інструментального виявлення люмінесценції фарбника, або до зниження агрегативної стійкості дисперсій, оскільки великі концентрації люмінесцентного фарбника впливають на формування стійких дисперсій. На фіг. 1 приведено схематичне зображення дисперсної частки холестерину, стабілізованої наночастками ортованадатів рідкоземельних елементів і що містить молекули гідрофобного барвника, на фіг.2 приведена просвічуюча електронна мікроскопія дисперсних часток холестерину 3+ розміром 80 нм, стабілізованих наночастками nGdVO4:Eu є, які висаджені з водного розчину на вуглецевій сіточці, на фіг. 3 приведено люмінесцентне зображення гепатоцитів щура, що акумулюють 3+ дисперсні частки холестерину, які стабілізовані наночастками nGdVO4:Eu і містять люмінесцентний барвник - 1,1’-діоктадецил 1-3,3,3',3'-тетраметиліндокарбоціанін перхлорат (помаранчева люмінесценція) на ділянках мембран гепатоцитів (автолюмінесценція клітин зелена). Заявлену водну дисперсію холестерину, отримують відомим способом змішування вихідних компонентів, наступним чином. Приклад 1. У хімічну склянку ємкістю 50 мл наливають \10 мл 0,1 Μ розчину холестерину в 96 % 3+ етанолі, додають 5 мл водного колоїдного розчину наночасток nGdVO4:Eu з розмірами часток 2 нм і концентрацією 0,2 г/л, перемішують на магнітній мішалці 10 хвилин. До отриманого розчину додають 15 мл дистильованої води і знов перемішують 5 хвилин. Потім отриманий розчин переливають в круглодонну колбу і упарюють на роторному випарнику до об'єму 5" мл 3+ Отримана водна дисперсія містить стабілізовані наночастками nGdVO4:Eu дисперсні частки холестерину, розміром менше 100 нм. Накопичення дисперсій холестерину в окремих тканинах і органах може бути підтверджене 3+ методом люмінесцентної спектроскопії при збудженні люмінесценції наночасток nGdVO4:Eu , що входять до складу дисперсій холестеринів. При цьому реєстрація присутності дисперсій в досліджуваному об'єкті здійснюється по виявленню характерних смуг люмінесценції європію в ортованадатній матриці. Аналогічно даному прикладу отримують водну дисперсію холестерину з частками, стабілізованими наночастками ортованадатів інших рідкоземельних елементів (Y, Gd, La) і з іншим, в межах тих, шо заявляються, розміром наночасток. Аналіз середнього 3 UA 108011 C2 5 10 15 20 розміру стабілізованих часток холестерину проводять з використанням методу просвічуючої електронної мікроскопії (фіг. 2). Приклад 2. Аналогічно прикладу 1, але перед упарюванням в розчин додають гідрофобний люмінесцентний фарбник, наприклад карбоціаніновий. При спостереженні в умовах люмінесцентної мікроскопії клітин, що інкубуються з буферним розчином, що містить 0,1-10 % дисперсій на основі холестерину, спостерігається акумуляція дисперсних часток в досліджуваному біологічному матеріалі. Накопичення дисперсій холестерину в окремих клітках може бути підтверджене візуально методом люмінесцентної мікроскопії. Для чого, отриманий розчин дисперсій холестерину за прикладом 2, вводять в буферний розчин, що містить досліджувані клітки і інкубують протягом 15-30 хвилин при температурі 37 °C. Потім, краплю досліджуваного зразка поміщають на предметне скло, накривають покривним склом і аналізують на люмінесцентному мікроскопі "Olympus IX 71" або аналогічному. Як приклад на фіг.3 приведено люмінесцентне зображення гепатоцитів, що акумулюють дисперсні частки холестерину, отримані за прикладом 2. Приклад 3. До складу дисперсних часток холестерину, отриманих в прикладах 1 і 2, додатково може бути введене біологічно активна сполука, що забезпечує додатковий терапевтичний ефект. Таким чином, пропонований спосіб забезпечує отримання стійкої відносно до активних форм кисню, водної дисперсії холестерину з максимальним розміром часток, що не перевищує 100 нм, а також можливість контролю вступу холестерину в клітини і тканини організму. ФОРМУЛА ВИНАХОДУ 25 30 1. Спосіб отримання водної дисперсії холестерину, що включає розчинення холестерину в етиловому спирті і додавання до суміші речовини-стабілізатора, перемішування суміші з подальшим упарюванням на роторному випарнику, який відрізняється тим, що як речовину3+ стабілізатор використовують наночастки ортованадатів рідкоземельних елементів nReVO4:Eu , де Re=Y, Gd, La розміром 1-5 нм при наступному співвідношенні компонентів, мас. %: холестерин 0,1-8,0 наночастки ортованадатів 0,01-0,8 вода решта. 2. Спосіб за п. 1, який відрізняється тим, що у водну дисперсію холестерину може бути додатково введений гідрофобний люмінесцентний барвник в концентрації 0,01-0,0001 мас. %. 3. Спосіб за п. 1, який відрізняється тим, що у водну дисперсію холестерину може бути додатково введена біологічно активна речовина, наприклад доксорубіцин в концентрації 0,010,0001 мас. %. 4 UA 108011 C2 Комп’ютерна верстка Г. Паяльніков Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 5
ДивитисяДодаткова інформація
Автори англійськоюKlochkov Volodymyr Kyrylovych
Автори російськоюКлочков Владимир Кириллович
МПК / Мітки
МПК: A61K 9/10, A61K 47/02, C07J 9/00
Мітки: водної, отримання, дисперсії, холестерину, спосіб
Код посилання
<a href="https://ua.patents.su/7-108011-sposib-otrimannya-vodno-dispersi-kholesterinu.html" target="_blank" rel="follow" title="База патентів України">Спосіб отримання водної дисперсії холестерину</a>
Попередній патент: Зубчаста муфта
Наступний патент: Спосіб оптимізації алопластики нижніх сечових шляхів в експерименті
Випадковий патент: Пристрій для фіксації ланцюга скребкового конвеєра