Заміщені 2-діалкіламіно-4-алкокситіазол-5-карбальдегіди і спосіб їх одержання
Номер патенту: 85160
Опубліковано: 25.12.2008
Автори: Черненко Віталій Миколайович, Афанасіаді Людмила Михайлівна, Десенко Сергій Михайлович
Формула / Реферат
1. Заміщені 2-діалкіламіно-4-алкокситіазол-5-карбальдегіди загальної формули І
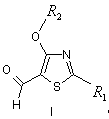
![]()
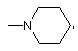
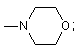
![]() .
.
2. Спосіб одержання заміщених 2-діалкіламіно-4-алкокситіазол-5-карбальдегідів загальної формули І

![]()


![]() ,
,
який відрізняється тим, що включає формілування гетероциклічної сполуки тіазолідин-2,4-діон, яку суспендують у хлороксиді фосфору, до одержаної суміші додають диметилформамід, причому хлороксид фосфору і диметилформамід беруть у співвідношенні 3,3:1,0 моль, послідовно витримують реакційну суміш 0,8-1 годину при температурі 20-25 °С, 0,8-1 годину при температурі 80-85 °С і 5-6 годин при температурі 110-115 °С, після чого продукт, що утворився внаслідок формілування, послідовно конденсують з R1-діалкіламіном у середовищі ацетонітрилу, а потім з первинним спиртом R2-OH у лужному середовищі до утворення цільового продукту.
Текст
1. Заміщені 2-діалкіламіно-4-алкокситіазол-5карбальдегіди загальної формули І 3 85160 засобів [S. Mallic et al., J. Med. Chem., 14, 528 (1971)]. Різноманітні галузі використання тіазолкарбальдегідів стимулюють підвищений інтерес до розробки нових сполук цієї структури і пошук у ефективних шляхів їх синтезу. Відомий структурний аналог сполук, що заявляються, - 2-феніл-оксазол-5-карбальдегід формули II і спосіб його одержання [Л.И.Беленький, M.А.Ческис. Химия гетероцикл. соедин., 1984, №7, с.881-884]. Сполука формули II добре розчиняється у хлороформі, спиртах, у полярних і неполярних розчинниках (диметилформамід, гексан, бензол), не розчиняється у воді. Одним із недоліків структури II є неможливість варіювання замісників у положенні 4 оксазольного циклу, що автори пояснюють природою самого циклу і його дезактивацією внаслідок протонування за атомом азоту в умовах електрофільного заміщення. Спосіб одержання сполуки формули II складається з 4 стадій і реалізується за схемою: На першій стадії одержують N(2оксіетил)бензамід кип'ятінням суміші етилбензоату і етаноламіну з одночасною відгонкою етанолу, що утворюється у результаті реакції. Температура кипіння одержаного продукту складає 218-220°C (8мм.рт.ст.), ви хід 77%. На другій стадії до п'ятикратного надлишку хлористого тіонілу при 0°C додають N(2оксіетил)бензамід, суміш видержують 1 годину при 0°C, після чого надлишок SOCl 2 відганяють у вакуумі. До твердого залишку, що утворився, додають розчин KOH у воді і кип'ятять суміш 8 годин. При охолодженні розчин екстрагують бензолом, бензол відганяють і вакуумною перегонкою виділяють 2-фенілоксазолін з температурою кипіння 122123°C (15мм.рт.ст.), ви хід 60%. На третій стадії одержують пероксид нікелю із сульфату нікелю і гіпохлориду натрію. Розчин 2фенілоксазоліну у бензолі кип'ятять із свіже приготовленим пероксидом нікелю при інтенсивному перемішуванні і постійній відгонці води за допомогою насадки Діна-Старка. Через 5 годин додають ще пероксид нікелю, цю операцію повторюють двічі. Розчин відфільтровують, відганяють бензол, одержують 2-фенілоксазол з температурою кипіння 98-100°C (10мм.рт.ст.), ви хід 56%. На четвертій стадії до розчину 2фенілоксазолу у диметилформаміді додають хлороксид фосфору і диметилформамід, перемішують 4 4 години при 90°C , нейтралізують NaOH (водний розчин) і охолоджують льодом. Суміш, що утворилася, кип'ятять 1 годину, екстрагують хлороформом. Залишок від відгонки екстрагують гарячим гексаном, одержують 2-феніл-оксазол-5карбальдегід. Температура кипіння 122-123°C (15мм.рт.ст.) після перекристалізації із гексану, вихід 58%. Загальний час синтезу сполуки II складає приблизно 40-45 годин. Вихід продукту з урахуванням всіх те хнологічних стадій складає приблизно 3035%. Відомий спосіб одержання сполуки II дає можливість одержати п'ятичленні гетероциклічні карбальдегіди, що вміщують ароматичний (феніл) замісник у 2-положенні гетероцикла. Вірогідність введення в це положення аліфатичного замісника авторами не обґрунтована. Введення діалкіламіногрупи в 2-положення повністю виключено, бо у цьому випадку при формілюванні (IV стадія) буде дезактивуватися не тільки атом азоту гетероцикла, але і азот діалкіламіногрупи внаслідок її протонування. До недоліків способу одержання сполуки II слід віднести багатостадійність синтезу з необхідністю виділення проміжних продуктів на кожній стадії. Сполука формули II, що утворюється у процесі реакції, брудна, потребує додаткового очищення шляхом перекристалізації, що приводить до використання додаткових кількостей органічних розчинників, матеріальних і енергетичних витрат. Виділення проміжних продуктів шляхом екстракцій легкозаймистими розчинниками (бензол, гексан) і відгонка надлишку цих розчинників збільшує не тільки тривалість реакції, але і вогненебезпечність способу одержання сполуки формули II. Кожна стадія одержання проміжних продуктів для синтезу сполуки формули II супроводжується вакуумною перегонкою при зниженому тиску. Хлорвмісний реагент SOCl2, що використовують у синтезі у значних кількостях (п'ятикратний надлишок), виявляє подразнювальну дію на слизову оболонку органів дихання і зору. Крім того, взаємодіючи з водою, SOCl2, виділяє велику кількість тепла, визиваючи опіки шкіри, має сльозоточивий і задушливий характер. До недоліків способу слід також віднести використання свіжоприготовленого пероксиду нікелю. Синтез цього реагенту подовжує час реакції, збільшує небезпечність її проведення, оскільки неорганічні пероксидні сполуки здатні викликати запалення органічних сполук (у даному разі в якості розчинника використовують легкозаймистий бензол). У зв'язку з викладеним технічне рішення має обмежене використання. Відомий структурний аналог сполук, що заявляється, - 2-метил-1,3-тіазол-4-карбальдегід формули III і спосіб його одержання [K.C.Nicolaou, S. Ninkovic et al., J. Amer. Chem. Soc, 119, №34, 7974 (1997)]. 5 85160 Сполука формули III добре розчиняється у полярних і неполярних розчинниках } спиртах, оцтовій кислоті, розчиняється у воді. Недоліком структури сполуки формули III є неможливість введення замісників у вільне 4положення гетероциклу, пов'язана з природою тіазольного кільця, що обмежує можливість реакцій електрофільного заміщення. Спосіб одержання сполуки формули III складається із трьох стадій і здійснюється за схемою: На першій стадії одержують етиловий ефір бромпіровиноградної кислоти, для чого газоподібний бромід водню повільно пропускають у реакційну суміш, що складається із етилового ефіру піровиноградної кислоти і N-бромсукциніміду (рівномолярні кількості) у сухому CCl4 упродовж 16 годин. Осад, що випадає, відфільтровують, фільтрат сушать над безводним Na2SO4, переганяють під вакуумом при 5мм.рт.ст. Вихід продукту 40%, температура плавлення 71-73°C. На другій стадії етиловий ефір бромпіровиноградної кислоти конденсують у спирті при кімнатній температурі з тіоацетамідом. Циклодегідратацією у спирті продукту, що утворюється у процесі реакції, одержують етил 2-метил-1,3-тіазол-4карбоксилат, який переганяють під вакуумом. Час реакції на другій стадії складає 5-6 годин. На третій стадії одержаний етил 2-метил-1,3тіазол-4-карбоксилат розчиняють у хлористому метилені, охолоджують суміш до -78°C. До розчину при цій температурі при інтенсивному перемішуванні додають 1M розчин діізобутилалюмінійгідриду (DIBAL) у CH2Cl2. Після повного додавання суміш перемішують 1 годину, слідкуючи за тим, щоб температура залишалася постійною -78°C. Потім додають метанол, етилацетат і насичений розчин NH4CI у воді. Температур у підвищують до кімнатної і перемішують реакційну масу ще 12 годин. Органічний шар відділяють, водний - екстрагують етилацетатом. Всі органічні витяжки об'єднують, сушать над безводним MgSO4, потім розчинник відганяють у вакуумі. Хроматографією на силікагелі (елюент - гексан) виділяють 2-метил-1,3-тіазол-4-карбальдегід. Після перекристалізації із хлороформу температура плавління альдегіду 56-57°C. Час реакції на цій стадії складає приблизно 35-36 годин. Сумарний вихід кінцевого продукту реакції автори не приводять, вказуючи лише вихід на кожній технологічній стадії (сумарний вихід продукту, який розрахований нами, складає приблизно 45-50%). Недоліком відомого способу є тривалість і трудомісткість процесу, пов'язана з виділенням 6 полупродуктів на кожній технологічній стадії і їх очищенням. Крім того, використання хладагента (78°C), газоподібного броміду водню, Nбромсукциніміду (які викликають подразнення шкіри і слизових оболонок дихальних шляхів і очей, опіки шкіри), вогненебезпечних розчинників (ефір, гексан), безводних солей для осушення реакційної суміші (Na2SO4 , MgSO4), тривалість самого процесу осушення, вакуумні перегонки, хроматографічне очищення кінцевого продукту - все це обмежує використання відомого способу у лабораторних і виробничих умовах. До недоліків способу слід також віднести використання діізобутилалюмінійгідриду, який самозаймається при контакті з повітрям, бурно реагує з водою, тому синтез треба проводити дуже обережно, у сухому посуді. Крім того, указаний реактив дорого коштує, вітчизняною промисловістю не випускається. Відомий структурний аналог сполук, що заявляється, - 2,4-диметоксипіримідин-5-карбальдегід формули IV і спосіб його одержання [W. Akitori, Ja. Junpei et al., J. Heterocycl. Chem. 27, №6, 1831 (1990)]. Недоліком структури сполуки формули IV являється дезактивація положення 6 молекули 2,4диметоксипіримідин-5-карбальдегіду для реакцій як електро-, так і нуклефільного заміщення. Сполука формули IV розчиняється у полярних (диметилформаміді, диметилсульфоксиді при кімнатній температурі) і неполярних розчинниках (гексан, бензол), добре розчиняється у спиртах, не розчиняється у воді. Спосіб одержання відомої сполуки формули IV складається із п'яти стадій і здійснюється за схемою: На першій стадії сплавленням еквімолярних кількостей акрилової кислоти і сечовини при 210220°C одержують гексагідропіримідин-2,4-діон. На другій стадії у присутності сильного окислювача гексаціаноферату калію K3Fe(CN6) у спирті при кипінні реакційної маси гексагідро-піримідин2,4-діон перетворюють у 2,4-дигідроксипіримідин, нестійкий, за твердженням авторів, у лужних розчинах. На третій стадії одержують 2,4дихлорпіримідин взаємодією 2,4дигідроксипіримідина з хлороксидом фосфору. На четвертій стадії 2,4-дихлорпіримідин розчиняють в абсолютному метанолі, додають розчин метоксиду натрію у абсолютному метанолі і суміш 7 85160 кип'ятять 15 хвилин. Одержують 2,4диметоксипіримідин з виходом 80%. На п'ятій стадії 2,4-диметоксипіримідин розчиняють у сухому діетиловому ефірі, додають суперосновний реагент - літій тетраметилпіперідиній. В якості інтермедіату утворюється літієва сполука 2,4-диметокси-5-піридиллітій, яка при додаванні диметилформаміду при 0°C електрофільно заміщується формільною групою з утворенням сполуки IV. Диметилформамід на цій стадії виконує подвійну роль - основного реагенту реакції, що прискорює електрофільне заміщення літію на формільну груп у, і частково - розчинника у реакції. До недоліків відомого способу одержання сполуки формули IV відносяться багатостадійність і тривалість процесу, що приводить до додаткового використання реактивів, робочого часу і енерговитрат. Застосування у процесі синтезу сухи х розчинників (ефір, абсолютний метанол) потребує проведення реакції в умовах повного зневоднення (сухий посуд, реактиви), щоб уникнути зіткнення з вологою повітря в апараті для проведення реакції використовуються трубки, наповнені Р2О5. Процеси абсолютування метанолу і осушення ефіру тривалі за часом, вибухо- і вогненебезпечні. Крім того, в залежності від кількості вологи, що присутня в указаних розчинниках, зменшується вихід кінцевого продукту реакції. При сплавленні реагентів при високих температурах (>200°С) можливе осмоління продуктів, що утворюються внаслідок реакції. Це потребує виділення їх із смоли шляхом декількох екстракцій розчинником (наприклад, спиртами) і додаткової очистки. При такій високій температурі велика вірогідність часткової полімерізації вихідної акрилової кислоти, що знижує ви хід кінцевого продукту. Крім того, у процесі синтезу сполуки формули IV використовують токсичні і легкозаймисті реагенти (метанол, акрилова кислота). Одним із недоліків способу одержання сполуки формули IV є також неможливість введення несиметричних замісників у 2- і 4-положення молекул піримідину. У якості прототипу як найбільш близький за технічною суттю вибрано перший із наведених аналогів. В основу винаходу поставлено задачу розробки заміщених тіазол-5-карбальдегідів з модифікованою структурою, що дозволяє варіювати замісники у положеннях 2 і 4 молекули тіазолу, а також розробки простого і доступного способу одержання таких сполук, що дає можливість зменшити тривалість процесу, підвищити ви хід і якість кінцевих продуктів. Рішення поставленої задачі забезпечується розробкою заміщених 2-діалкіламіно-4алкокситіазол-5-карбальдегідів формули І 8 Рішення поставленої задачі забезпечується також тим, що у способі одержання сполук загальної формули І що включає формілювання гетероциклічної сполуки формілюючою сумішшю, яка складається із хлороксиду фосфор у і диметилформаміду, згідно винаходу, в якості гетероциклічної сполуки використовують тіазол-ідин-2,4-діон, який суспендують у хлороксиді фосфору, до суміші, що одержано, додають диметилформамід, причому хлороксид фосфору і диметилформамід беруть у співвідношенні 3,3:1,0M, послідовно витримують реакційну суміш 0,8-1 годину при температурі 2025°C, 0,8-1 годину при температурі 80-85°C і 5-6 годин при температурі 110-115°C, після чого продукт, що утворився внаслідок формілювання, послідовно конденсують з R1-діалкіламіном у середовищі ацетонітрилу, а потім з первинним спиртом R2-OH у лужному середовищі до утворення цільового продукту. Структура сполук формули І, що заявляється, більш рухома і варіабільна порівняно із прототипом і забезпечує більш широкий асортимент 2,4заміщених тіазол-5-карбальдегідів несиметричної будови. Сполуки, що заявляються, не розчиняються у воді, розчиняються у полярних розчинниках і у спиртах. У неполярних розчинниках розчиняються вибірково: піперидил- і морфолінілзаміщені менше розчиняються у гептані і бензолі, ніж диметиламінозаміщені сполуки. Спосіб одержання сполук формули І, що пропонується, дозволяє одержувати несиметричнозаміщені сполуки з модифікованою структурою, варіювати замісники у вільних положеннях (2- і 4-) молекули тіазолу, значно розширюючи таким чином кількість нових заміщених гетероциклічних карбальдегідів. Склад формілюючої суміші експериментальним шляхом авторами було встановлено так (на 1M тіазолідин-2,4-діону беруть 3,3М хлороксиду фосфор у і 1,0M диметилформаміду), щоб реакція формілювання пройшла повністю з максимальним виходом без додаткових витрат ви хідних реагентів. При зміні співвідношення реагентів формілюючої суміші в кількості меншій, ніж заявляється, реакція формілювання проходить лише на 50-60%, у реакційній суміші виявляють вихідний тіазолідин2,4-діон, що не вступив до реакції. Використання реагентів формілюючої суміші у більшій кількості (хлороксид фосфору більше 3,ЗМ, диметилформамід більше 1,0M) приводить до утворення у реакційній масі смолистих продуктів, які важко не тільки виділити із суміші реагентів, але і їх ідентифікувати. Експериментальним шляхом було також визначено температурно-часовий режим реакції утворення 2,4-дихлортіазол-5-карбальдегіду. Так, під час досліджень було встановлено, що взаємо 9 85160 дія тіазолідин-2,4-діону з формілюючою сумішшю при кімнатній температурі упродовж 0,8-1 години сприяє повному формілюванню тіазолідин-2,4діону з утворенням тіазолідин-5-карбальдегід-2,4діону. При підвищенні температури реакції до 8085°C і видержуванні при цій температурі упродовж 0,8-1 години відбувається часткове заміщення одного атому кисню на атом хлору. На даній стадії реакції температура реакційної суміші не повинна бути нижче 80°C, інакше заміна не відбудеться. Оптимальним є і часовий режим реакції (0,8-1 годин) при формілю-ванні і заміні кисню на атом хлору. При зменшенні часу реакція проходить не повністю, в суміші можуть бути виявлені вихідні продукти, що не прореагували; розділити таку суміш на індивідуальні речовини і ідентифікувати їх не представляється можливим. Збільшення часу реакції (більш 1 години) не є доцільним, бо реакція проходить повністю вже за 1 годину, що підтверджено експериментальним шляхом і ідентифікацією утвореного продукту 2,4-дихлортіазол-5карбальдегіду елементним аналізом. Подальше підвищення температури до 110115°C і витримка при цій температурі впродовж 5-6 годин приводить до повного заміщення двох атомів кисню на хлор з утворенням 2,4-дихлортіазол5-карбальдегіду. Підвищення температури вище 115°C лімітоване температурою кипіння (108°C) хлороксиду фосфор у. Зменшення часу реакції (менш 5 годин) не приводить до повного виділення HCl і утворення 2,4-дихлор-тіазол-5-карбальдегіду. Збільшення часу реакції (більш 6 годин) не є доцільним, оскільки вже за 6 годин процес формілювання проходить повністю. Використання R1-діалкіламіну для конденсації з 2,4-дихлортіазол-5-карбальдегідом у середовищі інертного розчинника-ацетонітрилу дозволяє здійснити реакцію нуклеофільного заміщення одного із атомів хлору (у положенні 2 молекули тіазолу) діалкіламіногрупою у потрібному напрямі. Первинні спирти R2-OH при взаємодії з 2діалкіламіно-4-хлортіазол-5-карбальдегідом у присутності сильної основи NaOH використовують як реагенти, що дозволяють змінити другий атом хлору на алкоксигрупу. Крім того, первинний спирт виконує функцію розчинника для оптимального протікання реакції в бік утворення цільового продукту і сприяє виділенню чистих продуктів, що не потребують додаткової очистки, і з високими виходами. Спосіб здійснюють за наступною схемою: Синтез проходить у 3 стадії і заключається у формілюванні тіазол-ідин-2,4-діону хлороксидом фосфор у і диметилформамідом з утворенням 2,4дихлортіазол-5-карбальдегіду, потім у послідов 10 ному заміщенні атома хлору у 2-положенні тіазольного циклу діалкіламіном і другого атома хлору в 4-положенні первинним спиртом з утворенням несиметрично заміщених 2-діалкіламіно-4алкокситіазол-5-карбальдегідів. Вихідним продуктом у способі одержання заміщених 2-діалкіламіно-4-алкокситіазол-5карбальдегідів є тіазолідин-2,4-діон, який суспендують у хлороксиді фосфору (3,3M), додають краплями диметилформамід (1,0M), потім суміш послідовно видержують при кімнатній температурі 0,8-1 годину, при 80-85°C - 0,8-1 годину, при 110115°C - упродовж 5-6 годин до повного виділення HCl. 2,4-Дихлортіазол-5-карбальдегід, що утворився на першій стадії реакції, піддають взаємодії з діалкіламіном у співвідношенні 1:2 у середовищі ацетонітрилу при температурі реакційної маси, що не перевищує 30-35°C. Одержують 2-діалкіламіно4-хлортіазол-5-карбальдегід. Заміщення атома хлору у 4 положенні тіазольного цикла на алкоксигрупу здійснюють дією рівномолярної кількості NaOH у середовищі відповідного первинного спирта при кімнатній температурі. У цій реакції первинний спирт виконує роль розчинника і реагента у реакції заміщення. Структуру сполук формули І, що заявляється, підтверджено ЯМР спектрами. У таблиці 1 наведено порівняльні дані (постадійно) способу одержання сполук формули І, що заявляється, і способу-прототипу. У таблиці 2 дано характеристики сполук формули І і сполуки-прототипу, представлено спектральні дані, що підтверджують стр уктуру і чистоту сполук, що заявляються. Нижче приведено приклади конкретного виконання. Приклад 1. Одержання з 2-діетиламіно-4метокситіазол-5-карбальдегіду (див. таблицю 2, поз.1). 117г (1M) тіазолідин-2,4-діону розчиняють у 300мл (3,3M) РОСl3, додають краплями 78мл (IM) диметилформаміду з такою швидкістю, щоб температура реакційної суміші не перевищувала 30°C. Видержують 50 хвилин при 25°C, підвищують температуру маси до 80°C. Потім температуру підвищують до 115°C і кип'ятять суміш при цій температурі 6 годин до припинення виділення хлориду водню. Вміст колби повільно виливають на 5кг льоду, фільтрують, промивають водою і фільтрат переганяють з водяним паром. Одержують 2,4дихлортіазол-5-карбальдегід з температурою плавлення 49°C, вихід 108г (60%). 18,2г (0,1M) 2,4-дихлортіазол-5-карбальдегіду розчиняють в 100мл ацетонітрилу, до суміші додають краплями 0,2М діетиламіну з такою швидкістю, щоб температура реакційної маси не перевищувала 30°C. Суміш видержують при кімнатній температурі 0,5 години і виливають в 1л води. Осад, що випав, відфільтровують, промивають водою, сушать. Одержують 2-діетиламіно-4хлортіазол-5-карбальдегід з температурою плавління 35°C, вихід 20,7г (95%). Розчиняють 0,1M NaOH в 100мл метанолу і порціями (для запобігання бурхливого кипіння су 11 85160 міші) додають 20,7г (0,95M) 2-діетиламіно-4хлортіазол-5-карбальдегіду. Основну частину розчинника упарюють у роторному випарнику, залишок виливають у 0,5л води, осад фільтрують, промивають водою. Одержують 2-діетиламіно-4метокситіазол-5-карбаль-дегід (температура плавлення 60-63°C, вихід 18,2г (90%)), який достатньо чистий і не потребує додаткової перекристалізації. Структуру 2-діетиламіно-4-метокситіазол-5карбальдегіду підтверджено спектральними даними. Спектри ядерного магнитного резонансу (ЯМР H1) виміряно на спектрометрі VARIAN Mercury VX200 (200МГц) у розчинах дейтеродиметилсульфоксиду (ДМСО-d6), внутрішній стандарт - тетраметилсилан; δ (м.ч.): 1,16 (6Н, кв, (CH3CH2)N-), 3,50 (4Н, с, CH3CH2N), 3.98 (3Н, с, -OCH 3), 9.45 (1H, с, CHO). Приклад 2. Одержання 2-диметиламіно-4метокситіазол-5-карбальдегіду (див. таблицю 2, поз.3). 117г (1M) тіазолідин-2,4-діону розчиняють у 300мл (3,3M) POCl 3, додають краплями 78мл (1M) диметилформаміду з такою швидкістю, щоб температура реакційної суміші не перевищувала 30°C. Видержують 50 хвилин при 25°C, підвищують температуру маси до 80°C. Потім температуру підвищують до 115°C і кип’ятять суміш при цій температурі 6 годин до припинення виділення хлориду водню. Вміст колби повільно виливають на 5кг льоду, фільтрують, промивають водою і фільтрат переганяють з водяним паром. Одержують 2,4дихлортіазол-5-карбальдегід з температурою плавлення 49°C, вихід 108г (60%). У 50мл ацетонітрилу пропускають сухий диметиламін до тих пір, поки маса розчину не збільшиться на 6г. 18,2г (0,1M) 2,4-дихлортіазол-5карбальдегіду розчиняють у 50мл ацетонітрилу, краплями при перемішуванні додають розчин диметиламіну у ацетонітрилі з такою швидкістю, щоб 12 температура реакційної маси не перевищувала 30°C. Суміш видержують при кімнатній температурі 0,7 години і виливають в 1л води. Осад, що випав, відфільтровують, промивають водою, сушать. Одержують 2-диме-тиламіно-4-хлортіазол-5карбальдегід з т. пл. 108°C, вихід 18,4г (97%). Розчиняють 0,1M NaOH в 100мл метанолу і порціями (для запобігання бурхливого кипіння суміші) додають 18,4г (0,97M) 2-діметиламіно-4хлортіазол-5-карбальдегіду. Основну частину розчинника упарюють у роторному випарнику, залишок виливають у 0,5л води, осад фільтрують, промивають водою. Одержують 2-диметиламіно-4метокситіазол-5-карбальде-гід (температура плавлення 60-63°C, вихід 16,2г (90%)), який достатньо чистий і не потребує додаткової перекристалізації. Решту прикладів зведено у таблиці 2. Спосіб одержання сполук формули І дозволяє: - зменшити кількість технологічних стадій до 3 (у способі прототипі 4), див. таблицю 1; - зменшити тривалість процесу одержання до 14-15 годин (у способі-прототипі приблизно 40-45 годин); - підвищити вихід кінцевих продуктів до 5356%,(у способі-прототипі 30-35%; - одержувати чисті кінцеві продукти, що не потребують перекристалізації і додаткової очистки; - використовувати у синтезі доступні реактиви, що випускаються вітчизняною промисловістю; - здешевити вартість кінцевих продуктів. Таким чином, спосіб, що заявляється, дешевий, надійний, з використанням доступних реактивів, що вип ускаються вітчизняною промисловістю, і може бути рекомендований для проведення як у лабораторних, так і у промислових умовах. У зв’язку з указаними перевагами спосібодержання сполук формули І, що заявляється, значно розширює можливості застосування сполук формули І у препаративному органічному синтезі. Таблиця 1 Спосіб Стадії реакції Одержання 2,4-дихлортіазол-5-карбальдегіду Час реакції, год. 0,8-1,0 0,8-1,0 5-6 Спосіб, що заявляєть- Одержання 2-діетиламіно-4-хлортіазол-50,8-1,0 ся карбальдегіду Одержання 2-діетиламіно-4-метокситіазол-51,5-1,6 карбальдегіду Одержання N-(2-оксіетил)бензаміду Не вказано (приблизно 8 год) 1 Одержання 2-фенілоксазоліну Спосіб8 прототип* Одержання 2-фенілоксазолу 15 4 Одержання 2-фенілоксазол-5-карбальдегіду 1 *без урахування промивок, екстракцій, вакуумних перегонок, перекристалізацій Температура, °C 20-25 80-85 110-115 30-35 60-65 >100 0 90-95 80 90 90 13 85160 14 Таблиця 2 NN Сполуки І R1 R2 1 (CH3CH2)2N CH3 2 (CH3CH2)2N- CH3CH2 100-102 51 60-63 50 3 (CH3)2N CH3 115-117 54 4 (CH3)2N CH3CH2 77-80 52 CH3 182-185 55 6 O(CH2CH2)2N- CH3CH2- 148-150 52 7 (CH2)5N CH3 105-107 53 8 (CH2)5N CH3CH2 68-70 50 5 O(CH2CH2)2N ЯМР H1, δ (м.ч.) Т.пл, °С Вихід, % Комп’ютерна в ерстка Т. Чепелев а 1,16 (6H, кв., (CH 3CH2)N-), 3,50 (4Н, с, CH 3CH2N), 3,98 (3Н, с, -OCH 3), 9,45 (1H, с, CHO) 1,18 (6Н, тр., (CH3CH2)2N-), 1,31 (3Н, тр., CH3CH2O-), 3,50 (4Н, кв., (CH 3CH2)2N-), 4,41 (2Н, кв., CH3CH2N-), 9,47 (1H, с, -CHO) 3,11 (6Н, у. с, (CH3)2N-), 3,98 (3Н, с, -OCH3), 9,43 (1H, с, CHO) 1,30 (ЗН, тр., CH 3CH2O-), 3,12 (6Н, у. с, (CH 3) 2N-), 9,45 (1H, с, -CHO) 3,55 (4Н, м, O(CH 2CH2)2N-), 3,68 (4Η, м, O(CH2CH2)2Ν-) 3,98 (3Н, с, -OCH 3), 9,49 (1H, с, -CHO) 1,30 (ЗН, тр., CH3CH2O-), 3,54 (4Н, м., O(CH 2CH2)2N-), 3,67 (4Н, м., O(CH 2CH2)2N-), 4,41 (2Н,кв., CH3CH2O-), 9,49 (1H, с, -CHO) 1,59 (6Н, м., (CH 2)3(CH2)2N-), 3,54 (4Н, м., (CH 2)3(CH2)2N-), 3,57 (3Н, с, -OCH 3), 9,46 (1H, с, -CHO) 1,31 (ЗН, тр., CH3CH2O-), 1,60 (6Н, м., (СH2)3(СH2)2N-), 3,55 (4Н, м., (CH 2)3(CH2)2N-), 4,43 (2Н, кв., CH3CH2O-), 9,47 (1H, с, -CHO) Підписне Тираж 28 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted 2-dialkylamino-4-alkoxythiazole-5-carbaldehides and process for the preparation thereof
Автори англійськоюChernenko Vitalii Mykolaiovych, Desenko Serhii Mykhailovych, Afanasiadi Liudmyla Mykhailivna
Назва патенту російськоюЗамещенные 2-диалкиламино-4-алкокситиазол-5-карбальдегиды и способ их получения
Автори російськоюЧерненко Виталий Николаевич, Дэсэнко Сергей Михайлович, Афанасиади Людмила Михайловна
МПК / Мітки
МПК: C07D 227/00, C07C 47/28
Мітки: одержання, спосіб, 2-діалкіламіно-4-алкокситіазол-5-карбальдегіди, заміщені
Код посилання
<a href="https://ua.patents.su/7-85160-zamishheni-2-dialkilamino-4-alkoksitiazol-5-karbaldegidi-i-sposib-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Заміщені 2-діалкіламіно-4-алкокситіазол-5-карбальдегіди і спосіб їх одержання</a>
Попередній патент: Автоматизована система керування інформаційно-рекламними засобами, встановленими на контрольно-пропускних пристроях
Наступний патент: Розрядник для захисту від наднапруг та його активна частина
Випадковий патент: Складаний тент











