1-арил-4-хлоро-1н-імідазол-5-карбальдегіди та спосіб їх одержання
Номер патенту: 85029
Опубліковано: 10.12.2008
Автори: Чорноус Віталій Олександрович, Братенко Михайло Калінікович, Вовк Михайло Володимирович
Формула / Реферат
1. 1-Арил-4-хлоро-1Н-імідазол-5-карбальдегіди загальної формули І:
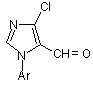 , І
, І
де Ar = Ph, 2-MeC6H4, 4-СlС6Н4, 4-ВrС6Н4, 4-МеС6Н4, 4-МеОС6Н4, 2,5-Ме2С6Н3, 1-нафтил.
2. Спосіб одержання сполук за п. 1, який відрізняється тим, що 2-(ариламіно)ацетаміди піддають взаємодії з сумішшю диметилформаміду і хлорокису фосфору у співвідношенні 1:2 при 85-95 °С з наступним виділенням цільових продуктів звичайними методами.
Текст
1. 1-Арил-4-хлоро-1Н-імідазол-5карбальдегіди загальної формули І: Cl N CH O N Ar ,І де Ar = Ph, 2-MeC 6H4, 4-СlС6Н4, 4-ВrС6Н4, 4МеС6Н4, 4-МеОС6Н 4, 2,5-Ме2С6Н3 , 1-нафтил. 2. Спосіб одержання сполук за п. 1, який відрізняється тим, що 2-(ариламіно)ацетаміди піддають взаємодії з сумішшю диметилформаміду і хлорокису фосфору у співвідношенні 1:2 при 85-95°С з наступним виділенням цільових продуктів звичайними методами. CH O H N CH O Ar де Ar=Ph, 2-MeC 6H4 , 4-СlС6Н4, 4-ВrС6Н4, 4МеС6Н4, 4-МеОС6Н 4, 2,5-Ме2С6Н3 , 1-нафтил та до способу їх одержання. Сполуки цього типу можуть знайти застосування як синтетичні блоки для отримання нових агрохімічних та фармацевтичних препаратів на основі раніше не описаних типів імідазольних систем. Названі сполуки, їх властивості і застосування в науковій літературі та патентних виданнях не описані. Найближчим структурним аналогом сполук, які заявляються, є 2-заміщені 4(5)-хлоро-1Н-імідазол5(4)-карбальдегіди: дe R=Et, н-Bu, CH 2Ph Показано, що сполуки даного типу, зокрема при R= н-Вu, використовуються як ключові синтезблоки для дизайну медичного препарату для лікування артеріальної гіпертонії - лазолтану [1-3] та його аналогів [4-9] - непептидних антагоністів рецептора ангіотензину II. Для їх отримання застосовують декілька підходів, які, як правило, характеризуються особливими технічними умовами, багатостадійністю, утворенням побічних продуктів і, як результат, пониженими виходами цільових продуктів. Зокрема, описаний метод синтезу 2-бутил-5-хлоро-3Німідазол-4-карбальдегіду окисненням оксидом марганцю (II) відповідного 5-хлоро-4-гідроксиметил3Н-імідазолу, який, в свою чергу, одержують конденсацією гідрохлориду етилпентанімідату з дигідроксиацетоном та аміаком при підвищеній температурі і тиску з подальшим хлоруванням 4-го положення імідазольного ядра N-хлорсукцинімідом 85029 N (11) R N UA Cl Cl N (19) Винахід відноситься до органічної хімії, а саме до нових похідних гетероциклічної системи імідазолу загальної формули : (13) C2 (21) a200804678 (22) 11.04.2008 (24) 10.12.2008 (46) 10.12.2008, Бюл.№ 23, 2008 р. (72) ВОВК МИХАЙЛО ВОЛОДИ МИРОВИЧ, U A, ЧОРНОУС ВІТАЛІЙ ОЛЕКСАНДРОВИЧ, U A, БРАТЕНКО МИХАЙЛО КАЛІНІКОВИЧ, U A (73) ІНСТИТУТ ОРГАНІЧНОЇ ХІМІЇ Н АН УКРАЇНИ, UA (56) RU 2103262 C1, 27.01.1998 SU 1814646 A3, 07.05.1993 Griffiths G. J., et al. Novel Syntheses of 2-Butyl-5chloro-3-H-imidazole-4-carbaldehyde: A Key Intermediate for the Synthesis of Angiotensin II Antagonist Lozartan // J. Org. Chem. - 1999. - Vol. 64, № 22. - P. 8084-8089 US 5696272 A, 09.12.1997 2 3 85029 [10]. Спосіб обмежений доступністю вихідного етилпентанімідату, неможливістю наробки більших кількостей продукту в автоклаві та перебігом побічних реакцій в процесі хлорування. Метод хлорформілювання 2-заміщених імідазолін-5-онів [3] реагентом Вільсмейєра-Хаака (суміш диметилформаміду та хлорокису фосфор у), хоч і відзначається препаративною простотою, але також вимагає застосування важкодоступних алкілімідатів для синтезу базових імідазолін-5-онів. Крім цього реакція супроводжується утворенням великої кількості побічних продуктів. Ще один спосіб синтезу 2бутил-5-хлоро-3Н-імідазол-4-карбальдегіду [11] також є недосконалим і передбачає використання 2-бутилімідазолу, із якого 5-стадійним перетворенням отримують цільовий продукт із виходом 24%. Варто також зазначити, що розглянуті ви ще методи не дають змоги отримувати незаміщені по положенню 2 циклу 4-хлоро-1Н-імідазол-5карбальдегіди. Задачею винаходу є пошук нових похідних імідазолу та спосіб їх одержання, що відкриває шлях до сполук, які, завдяки наявності двох високореакційноздатних функціональних груп, можуть знайти застосування як перспективні базові системи для 4 нових фармацевтичних та агрохімічних препаратів. Задача досягається 1-заміщеними 4-хлоро-1Німідазол-5-карбальдегідами загальної формули: Cl N N CH O Ar де Ar=Ph, 2-MeC 6H4 , 4-СlС6Н4, 4-ВrС6Н4, 4МеС6Н4, 4-МеОС6Н 4, 2,5-Ме2С6Н3 , 1-нафтил які легко отримуються при циклоконденсації з одночасним формілюванням доступних 2(ариламіно)ацетамідів [12, 13] під дією реагента Вільсмейєра-Хаака. Спосіб одержання сполук, які заявляються , полягає в тому, що 2-(ариламіно)ацетаміди піддають взаємодії з сумішшю диметилформаміду і хлорокису фосфору в мольному співвідношенні 1:2 при 85-95°С. Цільові продукти виділяють із реакційної суміші стандартними методами за допомогою операцій фільтрування та кристалізації. Виходи сягають 45-54%. Cl O NH2 ArNH Me 2NCHO/POCl3 O де Аr=Ph, 2-MeC 6H4 , 4-СlС6Н4, 4-ВrС6Н4, 4МеС6Н4, 4-МеОС6Н 4, 2,5-Ме2С6Н3 , 1-нафтил Отриманий результат є принципово новим і оригінальним, оскільки як в науковій, так і в патентній літературі відсутні дані, які б стосувались синтезу 1-заміщених 4-хлоро-1Н-імідазол-5карбальдегідів при реакції 2-N-заміщених ацетамідів з системою диметилформамід-хлорокис фосфору. З врахуванням закономірностей взаємодії 1,4-біфункціональних азотовмісних нуклеофілів з реагентом Вільсмейєра-Хаака [14], достовірно було допустити, що реакція перебігає через стадію проміжних 1-арил-5-(диметиламінометилен)імідазолін-4-онів, які в реакційних умовах зазнають подальшого хлорування та гідролізу до цільових сполук. Таке припущення знайшло підтвердження в результаті спеціально проведеного експерименту, який дозволив виділити із реакційної суміші 1-(4-толіл)-5(диметиламінометилен)імідазолін-4-он. Таким чином, розроблений спосіб добування 1-арил-4-хлоро-1Н-імідазол-5-карбальдегідів є втіленням ефективного синтетичного підходу, який базується на однореакторному варіанті формування на основі 2-(арил-аміно)ацетамідів імідазольного циклу з подальшою його функціоналізацією атомом хлору та альдегідною групою. Будова та склад отриманих 1-арил-4-хлоро1Н-імідазол-5-карбальдегідів доведені даними елементного аналізу, ІЧ-спектрів та ЯМР 1Н та 13С спектрів. N POCl3/H2O N Ar H NMe 2 N N CH O Ar Винахід ілюструється загальним способом одержання 1-арил-4-хлоро-1Н-імідазол-5карбальдегідів та фізико-хімічними характеристиками всіх синтезованих сполук. Загальний спосіб одержання 1-арил-4-хлоро1Н-імідазол-5-карбальдегідів. До суспензії 0.03моль 2-(ариламіно)ацетаміду в 6.75г (0.09моль) диметилформаміду при перемішуванні і охолодженні до 0-5°С додають 27,6г (0.18моль) хлорокису фосфору. Отриману суміш нагрівають на водяній бані до 90°С і перемішують при цій температурі 4год. Надлишок хлорокису фосфор у видаляють у вакуумі, до залишку додають 50мл води і нейтралізують кристалічним гідрокарбонатом натрію до рН 8. Осад, що утворився, відфільтровують, фільтрат екстрагують етилацетатом (3x20мл), екстракт випарюють, залишок об'єднують з осадом. Отриманий продукт розчиняють в суміші гексан-етилацетат, 3:1, повільно фільтрують крізь шар оксиду алюмінію, а потім перекристалізовують із 60%-ного водного етанолу. Приклад 1 1-Феніл-4-хлоро-1Н-імідазол-5-карбальдегід. Вихід 47%, т.топл.116-117°С. ІЧ спектр, см-1: 1675. Спектр ЯМР1Н, d, м.д.: 7.32м (2Наром.), 7.49м (3Наром.), 7.62с (1Н, Н2), 9.82с (1Н, СН=О). Спектр ЯМР 13С, d, м.д.: 125.21 (С5), 125.72, 129.43, 129.69, 135.12 (СAr), 140.87 (С2), 142.80 (С4), 177.27 (СН=О ). Знайдено, %: С 58.39; Н 3.47; N 13.75. C10H7ClN2O. Вирахувано, %: С 58.13; Н 3.41; N 13.56. 5 85029 Приклад 2 4-Хлоро-1-(4-хлорфеніл)-1Н-імідазол-5карбальдегід. Вихід 49%, т.топл. 159-160°С. ІЧ спектр, см -1: 1675. Спектр ЯМР1H d, м.д.: 7.27д (2Наром.), 7.45д (2Наром.), 7.61с (1Н, Н2), 9.82с (1H, СН=О). ). Спектр ЯМР 13С, d, м.д.: 125.12 (С5), 127.03, 129.58, 133.63, 135.69 (СAr), 140.90 (С2), 142.25 (С4), 177.21 (СН=O). Знайдено, %: С 50.04; Н 2.37; N 11.70. С10Н6Сl2H2О. Вирахувано, %: С 49.82; Н 2.51; N 11.62. Приклад 3 1-(4-Бромофеніл)-4-хлоро-1Н-імідазол-5карбальдегід. Вихід 54%, т.топл. 176-177°С. ІЧ спектр, см -1: 1670. Спектр ЯМР1Н, d, м.д.: 7.44д (2Наром.), 7.69д (2Наром.), 8.18с (1Н, Н2), 9.71с (1H, СН=О). Спектр ЯМР 13С, d, м.д.: 125.11 (С5), 123.78, 127.28, 132.62, 134.15 (САr), 143.38 (С2), 147.05 (С4), 177.26 (СН=О). Знайдено, %: С 42.31; Н 2.05; N 9.71. C10H6BrClN2O. Вирахувано, %: С 42.07; Н 2.12; N 9.81. Приклад 4 1-(2-Метилфеніл)-4-хлоро–1Н-імідазол-5карбальдегід. Вихід 45%, т.топл. 105-106°С. ІЧ спектр, см-1: 1670. Спектр ЯМР1Н, d, м.д.: 2.05с (3Н, СН3), 7.16-7.42м (4Наром.), 7.51с (1Н, Н2), 9.76с (1Н, СН=O). ). Спектр ЯМР 13С, d, м.д.: 17.25 (СН3), 125.88 (С5), 126.92, 130.16, 131.11, 134.64, 135.09, (САr), 140.87 (С2), 141.96 (С4), 177.22 (СН=O). Знайдено, %: С 60.07; Н 4.29; N 12.61. C11H9ClN2O. Вирахувано, %: С 59.88; Н 4.11; N 12.70. Приклад 5 1-(4-Метилфеніл) 4-хлоро-1H-імідазол-5карбальдегід. Вихід 49%, т.топл. 117-118°С. ІЧ спектр, см-1: 1665. Спектр ЯМР1Н, d, м.д.: 2.36с (3Н, СН3), 7.33дд (4Наром.), 8.11с (1Н, Н2), 9.67с (1Н, СН=O). Спектр ЯМР 13С, d, м.д.: 21.25 (СН3), 121.39 (С5), 125.30, 130.01, 132.60, 139.96 (САr), 140.85 (С2), 142.69 (С4), 177.35 (СН=О). Знайдено, %: С 59.59.; Н 4.33; N 12.53. C11H9ClN2O. Вирахувано, %: С 59.88; Н 4.11; N 12.70. Приклад 6 1-(4-Метоксифеніл)-4-хлоро-1Н-імідазол-5карбальдегід. Вихід 46%, т.топл. 102-103°С. ІЧ спектр, см-1: 1675. Спектр ЯМР1Н, d, м.д.: 3.85с (3Н, СН3), 6.96д (2Наром.), 7.23д (2Наром.), 7.58с (1Н, Н2), 9.80 с (1H, СН=O). Спектр ЯМР 13С, d, м.д.: 55.64 (СН3О), 125.38 (С5), 114.52, 126.99, 127.85 140.99 (СAr), 142.50 (С2), 160.38 (С4), 177.37 (СН=О ). Знайдено, %: С 55.59; Н 3.97; N 11.75. C11H9ClN2O2. Вирахувано, %: С 55.83; Н 3.83; N 11.84. Приклад 7 1-(2,5-Диметилфеніл)-4-хлоро-1Н-імідазол-5карбальдегід. Вихід 51%, т.топл. 110-111°С. ІЧ спектр, см-1: 1675. Спектр ЯМР1Н, d, м.д.: 1.98с (3Н, СН3), 2.34с (3Н, СН3), 7.12с (1Hаром.), 7.26с (2Наром.), 8.03с (1H, Н2), 9.64с (1Н, СН=О). Спектр ЯМР 13С, d, м.д.: 16.78 (СН3), 20.75 (СН3), 125.87 (С5), 127.39, 130.86, 131.79, 134.38, 136.90 (СAr), 140.83 (С2), 141.78 (С4), 177.22 (СН=O). Знайдено, %: С 61.19; Н 4.85; N 12.12. C12H11ClN2O. Вирахувано, %: С 61.41; H 4.72; N 11.94. 6 Приклад 8 1-(1-Нафтил)-4-хлоро-1Н-імідазол-5карбальдегід. Вихід 52%, т.топл. 140-141°С. ІЧ спектр, см -1: 1680. Спектр ЯМР1Н, d, м.д.: 7.28д (2Наром.), 7.53-7.65м (4Наром.), 8.06-8.14м (2Наром.), 8.23с (Н2), 9.64с (СН=О). Знайдено, %: С 65.28; Н 5.59; N 11.06. C14H9ClN2O. Вирахувано, %: С 65.51; Н 3.53; N 10.91. Приклад 9 5-(Диметиламінометилен)-1-(4толіл))імідазолін-4-он. Отримували аналогічно до 1-арил- 4-хлоро-1Н-імідазол-5-карбальдегідів з тією різницею, що використовували суміш диметилформаміду та хлорокису фосфору у мольному співвідношенні 1:1. Вихід 57%, т.топл. 156-157°С. ІЧ спектр, см -1: 1650, 1695. Спектр ЯМР1Н, d, м.д.: 2.34с (3Н, СН3), 3.25с (3Н,СН3), 3.51с (3Н,СН3), 7.19с (1Н, СН=), 7.22д (2Наром.), 7.46д (2Наром.), 7.73с (1Н,Н2). ). Знайдено, %: С 67.86; Н 6.42; N 18.57 C13H15N3O. Вирахувано, %: С 68.10; Н 6.59; N 18.32. Література: 1. Carini D.J., Duncia J.V., Aldrich P.E., Chiu A.T., Jonson A.L., Pierce M.E., Price W.A., Santella J.B., Wells G.J., Wexler R.R., Wong P.C., Yoo S., Timmermans P.B.M.W.M. Nonpeptide angiotensin II receptor antagonist: the discovery of a series of N(biphenylmethyl)imidazoles as potent, orally active antihypertensives // J. Med. Chem.- 1991.- Vol.34.P.2525-2547. 2. Duncia J.V., Carini D.J., Chiu A.T., Johnson A.L., Price W.A., Wong P.C., We xler R.R., Timmermans P.B.M.W.M. The discovery of Du753, a potent, orally active nonpeptide angiotensin II receptor antagonists // Med. Res. Rev.-1992.-Vol.12.№2.-P.149-191. 3. Griffiths G.J., Hauck M.B., Imwinkelried R., Kohr J., Roten C.A., Stucky G.C. No vel Syntheses of 2-Butyl-5-chloro-3-H-imidazole-4-carbaldehyde : A Key Intermediate for the Synthesis of Angiotensin II Antagonist Lozartan // J.Org.Chem.- 1999.- Vol.64, №22.- P.8084-8089. 4. Musicki В., Vevert J-P. Syntheses of Conformationally Restricted Analogues of Angiotensin II Receptor Antahonist. General Synthetic Approach to Functionalized Imidazol [1,5-a]pyridine Derivatives // Tetrahedron Lett.- 1994.-Vol.35, №50.-P.93919394. 5. Salimbeni A., Cavenotti R., Paleari F., Bonaccorsi F., Renzetti A.R., Belvisi L., Bravi G., Scolastico C. Nonpeptide Angiotensin II Receptor Antagonists. Synthesis, in Vitro Acti vity, and Molecular Modeling Studies of N-[(Heterobiaryl)methyl]imidazoles // J.Med.Chem.- 1994.- Vol.37, №23.-P.3928-3938. 6. Derdau V., Oekonomopulos R., Schubert G. 14 C-Labeled and Large-Scale Synthesis of the Angiotensin-(l-7) receptor Agonist AVE 0991 by Cross-Coupling Reactions // J.Org.Chem.- 2003.Vol.68, №13.- P.5168-5173. 7. Larsen R.D., King A.O., Chen C.Y., Corley E.G., Foster B.S., Roberts F.E., Yang C, Lieberman D.R., Reamer R.A., Tschaen D.M., Verhoeven T.R., Reider P.J. Efficient Synthesis of Losartan, A 7 85029 Nonpeptide Angiotensin II Receptor Antagonist // J. Org. Chem.- 1994. - Vol.59, №21.- P.6391-6394. 8. Kunan R.M., Weinstock J., Finkelstwin J.A., Franz R.G., Gaitanopulos D.E., Girard G.R., Hill D.T., Morgan T.M., Samanen J.M., Reishaft C.E., Tucker L.M., Augar N., Griffin E., Ohlstein E.N., Stack E.J., Weidley E.F., Edvards R.M. Potent Nonpeptide Angiotensin II Receptor Antagonists. 2. 1(Carboxybenyl)imidazole-5-Acrylic Acids // J.Med.Chem.- 1993.- Vol.36.-P.1880-1892. 9. Nouet S., Dodey P.R., Bondoux M.R., Pruneau D., Luccarini J-M., Groblewsky Т., Larguier R., Lombard C, Mare J., Renaut R.R., Leclerc G., Bonnafous J-C. Specific Nonpeptide Photoprobes as Tools for the Structural Study of the Angiotensin II AT 1 Receptor // J.Med. Chem.- 1999.- Vol.42.- P. 4572-4583. 10. Pat. Japan. 5798,270. 18 June 1982.- 1Benzyl-2-alkyl-4-chloroimidazole-5-acetic acids / Комп’ютерна в ерстка В. Клюкін 8 Takeda Chemical Industries Ltd. Chem. Abstr. 1983.- Vol.98.-4543a. 11. Watson S.P. A convenient synthesis of 2butyl-4(5)-chloro-1H-imidazole-5(4)-carboxaldehyde //Synthetic Commun.- 1992.- Vol.22, № 20.- P.29712977. 12. Гернштейн Р.А., Сытник З.П., Лифшиц Э.Б. Исследования в ряду мероцианинов, производных азолонов. XI. Диметилмероцианины, производные тиазолидинтион-2-она-5. - Журн. орган. Химии.1966.- Т.2, вып.2.-С. 543-551. 13. Lorizza A., Brancaccio G. Derivati dell'anilina ad azione farmacologica. -1959.- Vol.89.- №12.P.2402-2420. 14. Meth-Cohn O., Narine В., Tarnowski B. A versatile New Synthesis of Quinolines and Related Fused Pyrimidines. P.5. The synthesis of 2-Chloroquinoline-3-carbaldehides // J.Chem.Soc. Perkin Trans. 1.- 1981.-P. 1520-1530. Підписне Тираж 28 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською1-aryl-4-chloro-1h-imidazole-5-carbaldehydes and process for the preparation thereof
Автори англійськоюVovk Mykhailo Volodymyrovych, Chornous Vitalii Oleksandrovych, Bratenko Mykhailo Kalinikovych
Назва патенту російською1-арил-4-хлоро-1н-имидазол-5-карбальдегиды и способ их получения
Автори російськоюВовк Михаил Владимирович, Черноус Виталий Александрович, Братенко Михаил Калиникович
МПК / Мітки
МПК: C07D 233/68
Мітки: 1-арил-4-хлоро-1н-імідазол-5-карбальдегіди, одержання, спосіб
Код посилання
<a href="https://ua.patents.su/4-85029-1-aril-4-khloro-1n-imidazol-5-karbaldegidi-ta-sposib-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">1-арил-4-хлоро-1н-імідазол-5-карбальдегіди та спосіб їх одержання</a>
Попередній патент: Спосіб позапічної обробки рідкого чавуну
Наступний патент: Вино плодово-ягідне десертне “уманське калинове”
Випадковий патент: Комплекс технічних засобів автоматизації диспетчерського пункту шахти








