Спосіб моделювання експериментального гіпопітуїтаризму
Номер патенту: 99222
Опубліковано: 25.05.2015
Автори: Гєворкян Аіда Рубенівна, Губіна-Вакулик Галина Іванівна, Бондаренко Людмила Олександрівна
Формула / Реферат
Спосіб моделювання експериментального гіпопітуїтаризму шляхом інгібуючого впливу на продукцію тропних гормонів гіпофіза, який відрізняється тим, що молодих статевозрілих кролів піддають впливу цілодобового освітлення протягом 5 місяців в режимі - вдень природним світлом, а вночі електричною лампою, підтримуючи рівень освітлення 30-40 люкс.
Текст
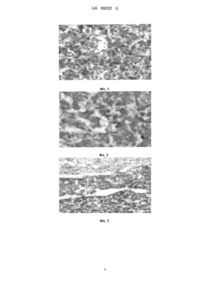
Реферат: Спосіб моделювання експериментального гіпопітуїтаризму шляхом інгібуючого впливу на продукцію тропних гормонів гіпофіза, причому молодих статевозрілих кролів піддають впливу цілодобового освітлення протягом 5 місяців в режимі - вдень природним світлом, а вночі електричною лампою, підтримуючи рівень освітлення 30-40 люкс. UA 99222 U (54) СПОСІБ МОДЕЛЮВАННЯ ЕКСПЕРИМЕНТАЛЬНОГО ГІПОПІТУЇТАРИЗМУ UA 99222 U UA 99222 U 5 10 15 20 25 30 35 40 45 50 55 60 Корисна модель належить до експериментальної медицини і може бути використана в галузі ендокринології для вивчення механізму дії різних засобів з метою попередження або лікування гіпопітуїтаризму. Гіпоталамо-гіпофізарна недостатність (гіпопітуїтаризм) являє собою клінічний синдром, обумовлений деструкцією аденогіпофіза з наступним стійким зниженням продукції тропних гормонів і порушенням діяльності периферичних ендокринних залоз. Гіпопітуїтаризм може бути частковим, при якому зберігається продукція одного або декількох гормонів, а також рівномірним і повним (пангіпопітуїтаризм), при якому до патологічного процесу залучено всі структури гіпофіза. При гіпопітуїтаризмі зона ураження аденогіпофіза складає, як правило, 6070 % його паренхіми. У деяких випадках до патологічного процесу окрім передньої та проміжної долі одночасно залучається також задня доля гіпофіза. В основі патогенеза гіпопітуїтаризму лежить дефіцит тропних гормонів гіпофіза, в результаті чого виникає вторинна гіпофункція щитовидної, надниркових та статевих залоз. У разі ураження задньої долі або ніжки гіпофіза можливе зниження рівня вазопресину з розвитком нецукрового діабету [1]. Для вивчення механізмів розвитку патологічного процесу та пошуку шляхів його корекції використовують наступні моделі гіпопітуїтаризму: - травматичний [2]; - нейрохірургічний [3]; - генетично детермінований [4]; - радіаційно індукований [5]; - аутоімунний [6]. Недоліком перелічених вище моделей слід вважати передусім той факт, що вони не є патогенетичними. Задача корисної моделі розробка патогенетичної моделі експериментального гіпопітуїтаризму. Поставлена задача вирішується тим, що статевозрілих кролів піддають впливу цілодобового освітлення протягом 5 місяців у режимі - вдень природним світлом, а вночі електричним, підтримуючи інтенсивність освітлення на рівні 30-40 люкс. Технічний результат - розширення арсеналу експериментальних моделей для дослідження порушень функції гіпофіза. Відомо, що зміна світлового режиму у вигляді постійного освітлення призводить до передчасного старіння епіфіза мозку та гальмування продукції мелатоніну, в основі якої і лежить порушення нейрогуморального механізму (зокрема, гіпофізарного) регуляції гормональної активності залоз внутрішньої секреції. При цьому порушується періодичність фізіологічних процесів, які спрямовані на підтримку адаптаційних можливостей організму до змін оточуючого середовища, що призводить до порушення цілісності організму. Спосіб апробовано на статевозрілих кролях, яких утримували в умовах цілодобового освітлення протягом 5 місяців. Контрольну групу складали кролі того ж віку і статі, яких утримували в умовах звичайної зміни дня і ночі. Гіпофіз кроля, як й інших ссавців, складається із передньої (аденогіпофіз), проміжної та задньої (нейрогіпофіз) долі. Гістологічне дослідження передньої долі гіпофіза у контрольних та піддослідних кролів показало наступне. У інтактних тварин, яких утримували в умовах природної зміни дня та ночі, аденотропоцити передньої долі гіпофіза виявляються як слабо диференційовані при фарбуванні мікропрепаратів гематоксиліном-еозином. Адренокортикотропоцити (АКТЦ), що локалізуються переважно в задньо-центральній частині аденогіпофіза [7], численні, розташовані компактно, тобто, переважно дуже щільно прилягають один до одного. Стромальні перегородки тонкі, з поодинокими фіброцитами в полі зору мікроскопа. Самі АКТЦ крупні внаслідок наявності в них об'ємної цитоплазми, котра при фарбуванні гематоксиліном-еозином має деякий відтінок базофілії, що характерно для АКТЦ. Ядра цих клітин округлі або овальні, невеликого розміру, досить темні, гомогенно гетерохромні. Кровоносні судини розширені та повнокровні. Просвіт капілярів та венул аденогіпофіза у ділянках локалізації при фарбуванні за Малорі АКТЦ має також жовте забарвлення, що вказує на присутність у ньому адренокортикотропного гормону АКТГ (фіг. 1). Такий морфофункціональний стан АКТЦ у кролів контрольної групи слід розглядати як досить низький, але з великими адаптаційними можливостями. У піддослідних тварин, підданих цілодобовому освітленню протягом 5 місяців, як в аденогіпофізі в цілому, так і в його адренокортикотропній зоні спостерігається виражене розрідження нейроендокринної паренхіми. У цих кролів АКТЦ, що залишились в структурі аденогіпофіза як функціонуючі, зберігають рівень підвищеної активності, розташовані 1 UA 99222 U 5 10 15 20 25 30 35 компактно. Вони добре диференційовані, мають великі ядра, чітко проглядаються ядерця, але часто зустрічаються апоптотичні клітини. Навколо капілярів АКТЦ формуються "розетки". Цитоплазма оранжпозитивна, проте малооб'ємна; цей факт вказує на те, що накопичення гормону не відбувається, він більшою мірою надходить у кровообіг (фіг. 2). Таким чином, внаслідок гальмування мелатонінутворюючої функції епіфіза світлом та по мірі поглиблення руйнівних процесів у пінеальній залозі в структурі гіпофіза паралельно відбувається також перебудова передньої долі, яка характеризується, передусім, "розрідженістю" задньо-центральної зони аденогіпофіза внаслідок значної, наростаючої у часі втрати функціонуючих АКТЦ шляхом апоптозу. Вивчення морфофункціонального стану проміжної долі гіпофіза також є принциповим в даному експерименті, оскільки меланостимулюючий гормон (МСГ), який синтезується в меланотропоцитах (МТЦ) цієї долі, як і АКТГ, утворюється із проопіомеланокортину - єдиного джерела для обох тропних гормонів гіпофіза. Залежно від ситуації, яка складається в організмі за тих, чи інших умов, метаболізм проопіомеланокортину може переключатись на продукцію або АКТГ, або МСГ. Більше того, при сильно- або тривалодіючому стресі за умов виснаження адренокортикотропної функції гіпофіза МСГ може брати на себе функцію кортикотропіну [8]. Відомо, що МСГ є антагоністом мелатоніну і стимулює перехід меланіну з меланоцитів в інші епідермоцити, що вважається захисною реакцією шкіри на дію світла (особливо в ультрафіолетовому діапазоні). У інтактних кролів, яких весь час утримували в умовах природної зміни дня і ночі, МТЦ щільно розташовані в трабекулах. Має місце пул запасних клітин з невеликим темним ядром та малооб'ємною цитоплазмою, які розташовані дрібними групами. Втім, є також МТЦ з великим, округлим, світлуватим ядром і дуже світлою цитоплазмою, тобто активно функціонуючі клітини (фіг. 3). На підставі даних гістологічного дослідження можна зробити висновок про те, що МТЦ, як і АКТЦ, у тварин контрольної групи мають значні адаптаційні резерви. У піддослідних кролів, підданих цілодобовій світловій експозиції, через 5 місяців після початку експерименту в проміжній долі гіпофіза виявляються окремі МТЦ, які містять в собі ядра переважно круглі, темні, невеликого розміру. Поряд з цим, зустрічаються також клітини з великими вакуолями, що створює вигляд порожнини; така картина розцінюється як ознака швидкого витрачання синтезованих гормонів (фіг. 4). Слід відзначити, що на мікропрепаратах, фарбованих за Ван-Гізон (фарбування для виявлення зрілого колагену сполучної тканини), привертає увагу наявність дрібних вогнищ інтерстиціального склерозу, причому як в аденогіпофізі, так і в проміжній долі гіпофіза. Дані каріометричного аналізу морфофункціонального стану АКТЦ і МТЦ контрольних та піддослідних кролів наведені в таблиці 1. Таблиця 1 Морфометричні показники ядер тропоцитів гіпофіза у статевозрілих кролів із гіпопінеалізмом, індукованим тривалим цілодобовим освітленням 2 Група Умова досліду I Інтактний контроль II Тривале цілодобове освітлення, 5 міс. Стат. показ n x Sx Площа ядер, мкм АКТЦ МТЦ 30 30 21,2±0,7 30 РI-II 16,6±0,5
ДивитисяДодаткова інформація
Автори англійськоюBondarenko Liudmyla Oleksandrivna, Hubina-Vakulyk Halyna Ivanivna, Hevorkian Aida Rubenivna
Автори російськоюБондаренко Людмила Александровна, Губина-Вакулик Галина Ивановна, Геворкян Аида Рубеновна
МПК / Мітки
МПК: G09B 23/28
Мітки: моделювання, експериментального, спосіб, гіпопітуїтаризму
Код посилання
<a href="https://ua.patents.su/7-99222-sposib-modelyuvannya-eksperimentalnogo-gipopitutarizmu.html" target="_blank" rel="follow" title="База патентів України">Спосіб моделювання експериментального гіпопітуїтаризму</a>
Попередній патент: Спосіб одержання силікатів титану на основі оксиду кремнію рисової лузги і сполук титану
Наступний патент: Стабілізатор постійної напруги
Випадковий патент: Спосіб промивки горна доменої печі