Прилад для аналізу біохімічних середовищ
Номер патенту: 110131
Опубліковано: 26.09.2016
Автори: Рачков Олександр Едуардович, Самойлов Антон Володимирович, Мацишин Микола Йосипович, Дорожинський Гліб Вячеславович, Ушенін Юрій Валентинович
Формула / Реферат
Прилад для аналізу біохімічних середовищ, що містить оптичний вузол, який складається з джерела р-поляризованого монохроматичного видимого світла, призми повного внутрішнього відбиття з нанесеним на її поверхню плівковим металевим робочим елементом і системи вимірювання інтенсивності світла, відбитого від робочого елемента, а також пристрій механічного повороту призми з кроковим двигуном і системою передачі обертального руху від крокового двигуна до призми, який відрізняється тим, що має проточну вимірювальну комірку, яка оснащена системою контролю, регулювання та стабілізації температури досліджуваного розчину в діапазоні від кімнатної температури до 70 °C з похибкою ±0,1 °C.
Текст
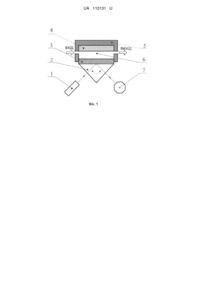
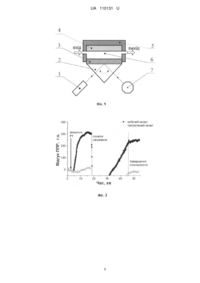
Реферат: Прилад для аналізу біохімічних середовищ містить оптичний вузол. Оптичний вузол складається з джерела р-поляризованого монохроматичного видимого світла, призми повного внутрішнього відбиття з нанесеним на її поверхню плівковим металевим робочим елементом і системи вимірювання інтенсивності світла, відбитого від робочого елемента. Також містить пристрій механічного повороту призми з кроковим двигуном і системою передачі обертального руху від крокового двигуна до призми. Має проточну вимірювальну комірку, яка оснащена системою контролю, регулювання та стабілізації температури досліджуваного розчину в діапазоні від кімнатної температури до 70 °C з похибкою ±0,1 °C. UA 110131 U (12) UA 110131 U UA 110131 U 5 10 15 20 25 30 35 40 45 50 55 60 Корисна модель належить до галузі оптоелектронних твердотільних сенсорних приладів на основі поверхневого плазмонного резонансу (ППР) для аналізу біомолекулярних реакцій, заснованого на реєстрації адсорбції або реакції взаємодії молекул у рідкому середовищі. Ці прилади дозволяють робити швидкий і економічний моніторинг навколишнього середовища, а також експресний аналіз рідин при медичних та клінічних дослідженнях, складу продуктів. Корисна модель може бути використана в харчовій, фармацевтичній промисловості, сільському господарстві, медицині та екології. Відомим аналогом є прилад на основі явища ППР [1], що містить оптичний вузол, який складається з призми повного внутрішнього відбиття з металевою плівкою, джерела рполяризованого монохроматичного випромінювання, що опромінює металеву плівку з боку призми, і систему вимірювання інтенсивності відбитого від металевої плівки світла. Принцип роботи приладу полягає у вимірюванні інтенсивності відбитого від металевої плівки монохроматичного світла при зміні кута падіння. Процес адсорбції біологічних молекул на сенсорній поверхні можна представити як формування шару молекул з певним коефіцієнтом заломлення та товщиною. В залежності від перебігу процесу адсорбції форма характеристики відбиття та положення її мінімуму змінюється. Таким чином, прилад дозволяє у реальному часі детектувати процеси адсорбції і взаємодії молекул, що відбуваються на сенсорній поверхні чутливого елемента приладу за рахунок визначення положення мінімуму характеристики відбиття з плином часу. Недоліком аналога є малий кут сканування (5 кут. град.), який дозволяє досліджувати шари з коефіцієнтом заломлення тільки в діапазоні 1,33-1,38, що суттєво обмежує перелік досліджуваних середовищ. Відомим аналогом є прилад для детектування і визначення концентрації біомолекул [2]. Прилад містить оптичний вузол, який складається з джерела р-поляризованого монохроматичного світла, призми повного внутрішнього відбиття з нанесеним на її поверхню плівковим металевим робочим елементом і системи вимірювання інтенсивності світла, відбитого від робочого елемента, а також пристрій механічного повороту призми з кроковим двигуном і системою передачі обертального руху від крокового двигуна до призми. Детектування і визначення концентрації біомолекул і молекулярних комплексів полягає в опроміненні металевої плівки з боку призми в широкому діапазоні кутів падіння, що досягається механічним поворотом призми, реєстрації інтенсивності відбитого світла (характеристики відбиття) для всього набору кутів падіння і математичній обробці даних вимірів по спеціально розробленому алгоритму. Аналізуючи форму характеристики відбиття та кутове положення її мінімуму, можна аналізувати характер біомолекулярних взаємодій для широкого кола речовин. Механічне сканування кута падіння випромінення в діапазоні 17 кутових градусів дозволяє працювати з середовищами з показниками заломлення 1,33-1,43, а також отримувати характеристику відбиття в діапазоні кутів від 53 до 70 градусів для подальшої математичної обробки на відміну від вищезгаданого приладу без механічної розгортки по куту. Недоліком аналога є невисока точність, пов'язана з відсутністю систем контролю та стабілізації температурних режимів вимірювання характеристики відбиття оптичною системою приладу. За відсутності термостабілізації виникає температурний дрейф кутового положення мінімуму характеристики відбиття під час його вимірювання, що негативно впливає на точність результату вимірювання. Крім цього, виміри, проведені при одному заданому значенні температури, дуже складно співставляти з вимірами, проведеними для однакових реагентів, але при інших значеннях температури, тому що їх показники заломлення залежать від температури, що негативно впливає на відтворюваність результату вимірювань. Найближчим аналогом до корисної моделі є прилад для аналізу біохімічних середовищ [3], який містить оптичний вузол, який складається з джерела р-поляризованого монохроматичного видимого світла, призми повного внутрішнього відбиття з нанесеним на її поверхню плівковим металевим робочим елементом і системи вимірювання інтенсивності світла, відбитого від робочого елемента, а також пристрій механічного повороту призми з кроковим двигуном і системою передачі обертального руху від крокового двигуна до призми, крім того прилад розміщується в термоізоляційному корпусі та має блок термостабілізації, який оснащений системою контролю та регулювання температури. Система термостабілізації, контролю та регулювання температури всього приладу, забезпечує підвищення точності вимірювань за рахунок того, що вимірювання проходить в наперед заданих температурних умовах. При цьому мінімум характеристики відбиття практично не змінює свого кутового положення при повторних вимірюваннях. Недоліком найближчого аналога є обмеження діапазону термостабілізації приладу та вимірювальної комірки з досліджуваним розчином максимально допустимою робочою 1 UA 110131 U 5 10 15 20 25 30 35 40 45 50 55 60 температурою джерела р-поляризованого монохроматичного світла, котра становить 35 °С. Цей недолік робить неможливим вимірювання біомолекулярних реакцій при температурах більших за 35 °C. Крім цього, робота приладу при температурах більших за 30 °C, зменшує його чутливість, надійність та тривалість безвідмовної роботи. В основу корисної моделі поставлена задача розширення діапазону термостабілізації, контролю та регулювання температури досліджуваного розчину для дослідження біомолекулярних реакцій при більш високих температурах у відносно широкому їх діапазоні. Поставлена задача вирішується тим, що прилад для аналізу біохімічних середовищ містить оптичний вузол, який складається з джерела р-поляризованого монохроматичного видимого світла, призми повного внутрішнього відбиття з нанесеним на її поверхню плівковим металевим робочим елементом і системи вимірювання інтенсивності світла, відбитого від робочого елемента, а також пристрій механічного повороту призми з кроковим двигуном і системою передачі обертального руху від крокового двигуна до призми, згідно з корисною моделлю, має проточну вимірювальну комірку, яка оснащена системою контролю, регулювання та стабілізації температури досліджуваного розчину в діапазоні від кімнатної температури до 70 °C з похибкою ±0,1 °C. Прилад, у якому реалізована система термостабілізації проточної вимірювальної комірки з досліджуваним розчином, забезпечує вимірювання високотемпературних біомолекулярних реакцій за рахунок того, що вимірювання проходить в наперед заданих температурних умовах в діапазоні температури від кімнатної до 70 °C. При температурах нижчих за кімнатну, термостабілізація може бути реалізована відповідно до прототипу. При температурах вищих за 70 °C зазнають суттєвих змін ціла низка явищ і процесів (виникнення механічних напружень між металевою плівкою та скляною поверхнею, послаблення зв'язку між іммобілізованими біомолекулами та металевою плівкою, посилене виділення газів, що були розчинені в досліджуваних рідинах при більш низькій температурі тощо), - все це негативно впливає на можливість адекватних досліджень. Температура джерела р-поляризованого монохроматичного світла та приладу в цілому підтримується в допустимих межах (приблизно 20-25 °C), що забезпечить як стабільність довжини хвилі випромінювання, так і надійність та тривалість безвідмовної роботи приладу в цілому. Це означає, що при наявності системи термостабілізації проточної вимірювальної комірки з досліджуваним розчином, при зміні зовнішніх температурних умов, характеристика відбиття та її мінімум будуть змінювати кутове положення лише внаслідок перебігу біомолекулярних реакцій в досліджуваному розчині (не будуть реагувати на зміни температури зовнішнього середовища). Похибка підтримання заданої температури ±0,1 °C забезпечує температурне розпізнавання біомолекулярних реакцій з достатньою точністю. Корисна модель пояснюється кресленнями. На фіг. 1 - приведена блок-схема приладу ППР, робота якого заснована на дослідженні кутової залежності інтенсивності світла, відбитого від робочого елемента сенсора, де 1 джерело р-поляризованого монохроматичного видимого світла,2 - призма повного внутрішнього відбиття, 3 - плівковий металевий робочий елемент (переважно Au, Ag), у якому відбувається збудження поверхневих плазмонів, 4 - система контролю, стабілізації та регулювання температури досліджуваного розчину, 5 - корпус теплоізоляційної проточної вимірювальної комірки, 6 - робочий об'єм проточної вимірювальна комірки для досліджуваного розчину, 7 - система вимірювання інтенсивності світла, відбитого від межі поділу призма/металева плівка. Корисна модель працює наступним чином. Призма (2) дискретно (під дією крокового двигуна) змінює своє положення в діапазоні кутів повного внутрішнього відбиття між межею поділу призма-метал та напрямком розповсюдження р-поляризованого монохроматичного видимого світла; під дією світла поверхневі плазмони збуджуються в металевій плівці (3), нанесеній на скляну призму повного внутрішнього відбиття; зовнішня сторона металевої плівки контактує з досліджуваним розчином у робочому об'ємі (6) проточної вимірювальної комірки, яка має патрубки для введення та виведення досліджуваного розчину. Система контролю та регулювання температури вимірювальної комірки (4) підтримує задану температуру досліджуваного розчину. При резонансі частот фотонів джерела рполяризованого видимого монохроматичного світла (1) і електронної плазми на зовнішній поверхні металу відбувається суттєве поглинання енергії фотонів. Проявом цього є зменшення інтенсивності відбитого світла при певному куті його падіння, яке фіксується системою вимірювання інтенсивності відбитого світла (7), що відповідає певним характеристикам досліджуваних розчинів або результату взаємодії їх компонентів. Форма кривої плазмонного резонансу і, зокрема, положення мінімуму, залежать від: оптичних параметрів і товщини шару біомакромолекул, що контактує з металевим робочим елементом при фіксованих значеннях 2 UA 110131 U 5 10 15 20 25 30 35 40 45 50 55 60 показника заломлення призми, оптичних констант і товщини металевої плівки, у якій збуджується поверхневий плазмонний резонанс. Фіксуючи зміну резонансних умов виникнення плазмонного ефекту, тобто, досліджуючи зміну у часі положення мінімуму характеристики відбиття за умов плазмонного резонансу, можна зробити висновки про динаміку процесів адсорбції та взаємодії молекул, що відбуваються на сенсорній поверхні чутливого елемента приладу та характеризувати їх кількісно. Аналіз кутового положення і форми резонансної кривої реєструється керуючою програмою, що дозволяє одержувати в реальному масштабі часу кінетичну криву (сенсограму), яка свідчить про процеси адсорбції та взаємодії біологічних молекул, присутніх у досліджуваному розчині. Результати вимірів математично обробляються по спеціально розробленому алгоритму. Для реалізації технічного рішення було зібрано прилад, згідно зі схемою, наведеною на фіг. 1. Як джерело р-поляризованого монохроматичного видимого світла було використано напівпровідниковий GaAs лазер з довжиною хвилі 650 нм; призма була виконана з оптичного силікатного скла Ф1 з показником заломлення 1,61; плівковий металевий робочий елемент представляв собою шар золота товщиною 50 нм; системою вимірювання інтенсивності відбитого від робочого елемента світла був фотоелектричний чутливий приймач (фотодіод), сигнал від якого підсилювали та виводили на систему реєстрації зображення (дисплей персонального комп'ютера), що давало змогу отримати графічне зображення залежності інтенсивності відбитого світла від кута опромінення. Зміну кутового положення призми задавали кроковим двигуном з кроком 10 кутових секунд. Система контролю та регулювання температури досліджуваного розчину була вмонтована в термоізоляційний корпус проточної вимірювальної комірки та представляла собою електричний резистивний нагрівач та резистивний термодатчик. Керування нагрівачем, вимірювання та обробка сигналу від резистивного термодатчика виконувалась системою контролю та регулювання температури вимірювальної комірки. Точність підтримання заданої температури в робочому об'ємі вимірювальної комірки ±0,1 °C. Приклад використання приладу для аналізу біомолекулярних реакцій із системою термостабілізації, контролю та регулювання температури. Даний приклад ілюструє нові, більш широкі можливості запропонованого приладу при дослідженні наприклад процесу гібридизації нуклеїнових кислот у порівнянні з зазначеними існуючими приладами: нижче наведений експеримент неможливо провести з використанням будь-якого з них, окрім запропонованого приладу для аналізу біомолекулярних реакцій із системою термостабілізації, контролю та регулювання температури. В цьому прикладі гібридизаційний ДНК-сенсор був створений за рахунок іммобілізації одноланцюгових олігонуклеотидів mod-Ph (SH-(CH2)6-GCT GAA GGG CTT TTG AAC TCT GCT) на сенсорній поверхні обох каналів вимірювальної комірки приладу для аналізу біомолекулярних реакцій із системою термостабілізації, контролю та регулювання температури. Відповідно до концепції способу, дискримінацію здійснюють в два етапи: спочатку досліджували процес гібридизації повністю комплементарних (до іммобілізованих олігонуклеотидів mod-Ph) олігонуклеотидів P1 (AGC AGA GTT CAA AAG ССС ТТС AGC), потім частково комплементарних (до іммобілізованих олігонуклеотидів mod-Ph) олігонуклеотидів Bcrex14 (CCA CTG GAT TTA AGC AGA GTT CAA). Кожен етап складається з трьох кроків. Спочатку в робочий канал вимірювальної комірки вводять 200 нМ розчин вибраних олігонуклеотидів (в контрольний канал продовжували вводити тільки робочий буферний розчин), проводять інкубацію протягом 10 хв. і промивання робочим буферним розчином по її завершенню, щоб отримати початковий відгук біосенсора на гібридизацію вибраних олігонуклеотидів з іммобілізованими олігонуклеотидами mod-Ph. Впродовж всього цього етапу дослідження підтримують початкову температуру Т 0. Потім за допомогою системи термостабілізації, контролю та регулювання температури забезпечують нагрівання робочого буферного розчину до вибраної температури і здійснюють промивання комірки цим розчином протягом 5 хв. При цьому дегібридизовані олігонуклеотиди видаляються з вимірювальної комірки. Після цього температуру в комірці знов знижували до Т 0. Третім кроком є визначення величини сенсорного відгуку після повернення температури до значення Т0. Порівнявши отриману величину з початковим сенсорним відгуком, можна визначити частку дволанцюгових комплексів, що залишились на сенсорній поверхні після нагрівання до вибраної температури і відмивання. DINAMelt веб сервер [4] дозволяє отримати термодинамічні параметри дволанцюгових комплексів (дуплексів) будь-якої визначеної нуклеотидної послідовності, що знаходиться у гомогенній системі (у розчині), в тому числі величини температури плавлення (Т m). За допомогою цього сервісу були розраховані величини Тm дуплексів mod-Ph/P1 (+64,0 °C) та дуплексів mod-Ph/Bcrex14 (+39,2 °C). Для досягнення термодискримінації (розрізнення за допомогою підвищення температури) досліджуваних 3 UA 110131 U 5 10 15 20 25 30 послідовностей нуклеїнових кислот була застосовано нагрівання до 40 °C, що є значно нижчою, ніж Тm дуплексів mod-Ph/P1, але дещо вище Тm дуплексів mod-Ph/Bcrex14, розрахованих для гомогенних умов. Як видно з фіг. 2, процедура підвищення температури до 40 °C та її повернення до Т0 практично не вплинула на рівень взаємодії mod-Ph і Р1: при охолодженні до початкової температури сенсорний відгук майже не відрізнявся від початкового. Коли ж замість повністю комплементарних олігонуклеотидів Р1 у вимірювальну комірку з іммобілізованими на сенсорній поверхні mod-Ph вводили частково комплементарні олігонуклеотиди Всгех14 (фіг. 3), то після процедури нагрівання до 40 °C і охолодження до початкової температури спостерігали практично повну відсутність сенсорного відгуку. Це свідчить про те, що практично всі дуплекси mod-Ph/Bcrex14 були дегібридизовані, а звільнені таким чином олігонуклеотиди Bcrex14 були видалені з вимірювальної комірки потоком робочого буферного розчину. Таким чином, за допомогою приладу для аналізу біомолекулярних реакцій із системою термостабілізації, контролю та регулювання температури при застосуванні нагрівання до 40 °C, що є значно нижчою, ніж Тm дуплексів mod-Ph/P1, але дещо вище Тm дуплексів для дуплексів mod-Ph/Bcrex14, розрахованих для гомогенних умов, вдалося показати не тільки різну стабільність двох зазначених видів дуплексів, але й досягти цілковитої температурної дискримінації вказаних послідовностей нуклеїнових кислот. Такий підхід може бути дуже ефективним при розробці методів діагностики різних інфекційних та генетичних захворювань. Джерело інформації: 1. United States Patent: 6,480,282, МПК G01N 021/05. Capillary surface plasmon resonance sensor and multisensors / Chinowsky T.M., Yee S.S.; November 12, 2002 2. Ширшов Ю.М., Венгер Є.Φ., Прохорович А.В., Ушенін Ю.В., Мацас Є.П., Чегель В.І., Самойлов А.В. Спосіб детектування та визначення концентрації біомолекул та молекулярних комплексів та пристрій для його здійснення, патент України на винахід № 46018, опубл. 15.05.2002; бюл. № 5 3. Дорожинський Г.В., Ушенін Ю.В., Самойлов А.В., Христосенко Р.В., Громовой Ю.С., Назаренко В.І., Маслов В.П. Прилад для аналізу біохімічних середовищ, патент України на корисну модель № 77042, опубл. 25.01.2013; бюл. №2. 4. The DINAMelt Web Server http://unafold.rna.albany.edu/?q=DINAMelt ФОРМУЛА КОРИСНОЇ МОДЕЛІ 35 40 Прилад для аналізу біохімічних середовищ, що містить оптичний вузол, який складається з джерела р-поляризованого монохроматичного видимого світла, призми повного внутрішнього відбиття з нанесеним на її поверхню плівковим металевим робочим елементом і системи вимірювання інтенсивності світла, відбитого від робочого елемента, а також пристрій механічного повороту призми з кроковим двигуном і системою передачі обертального руху від крокового двигуна до призми, який відрізняється тим, що має проточну вимірювальну комірку, яка оснащена системою контролю, регулювання та стабілізації температури досліджуваного розчину в діапазоні від кімнатної температури до 70 °C з похибкою ±0,1 °C. 4 UA 110131 U 5 UA 110131 U Комп’ютерна верстка А. Крулевський Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 6
ДивитисяДодаткова інформація
МПК / Мітки
МПК: G01N 21/55
Мітки: біохімічних, прилад, середовищ, аналізу
Код посилання
<a href="https://ua.patents.su/8-110131-prilad-dlya-analizu-biokhimichnikh-seredovishh.html" target="_blank" rel="follow" title="База патентів України">Прилад для аналізу біохімічних середовищ</a>
Попередній патент: Спосіб лікування хронічного тонзиліту
Наступний патент: Спосіб підвищення енергоефективності системи керування електромагнітними клапанами автомобільного газобалонного обладнання
Випадковий патент: Спосіб одержання самозатухаючого полістиролу, що спінюється