Аморфна металева композиція на основі fe і b для каталітичного виділення водню з лужних розчинів
Номер патенту: 89419
Опубліковано: 25.04.2014
Автори: Герцик Оксана Миронівна, Ковбуз Мирослава Олексіївна, Носенко Віктор Костянтинович, Бойчишин Лідія Михайлівна
Формула / Реферат
Аморфна металева композиція на основі Fe і B для каталітичного виділення водню з лужних розчинів, яка відрізняється тим, що додатково містить Nb і рідкісноземельний елемент Y або Gd, або Dy.
Текст
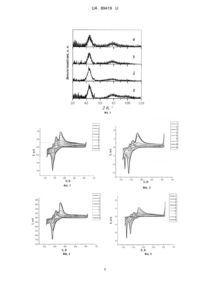
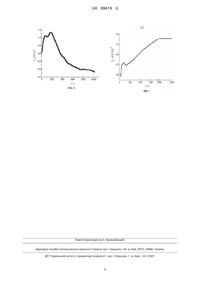
Реферат: Аморфна металева композиція на основі Fe і B для каталітичного виділення водню з лужних розчинів містить Nb і рідкісноземельний елемент Y або Gd, або Dy. UA 89419 U (12) UA 89419 U UA 89419 U 5 10 15 20 25 30 35 40 45 50 55 60 Корисна модель належить до хімічної галузі, зокрема електрохімії, і може бути використана у водневій енергетиці для здійснення електрокаталітичного виділення водню з лужних розчинів та його нагромадження. Відома аморфна і кристалічна композиція на основі Ni, легованого Со для електрокаталітичного виділення водню з лужних розчинів. Аморфні електроди тільки після хімічної обробки проявляють вищу каталітичну активність. У випадку кристалічних аналогів хімічна обробка електродів не приводить до підвищення їх електрокаталітичної активності [К. Lian, D.W. Kirk, S.J. Thorpe. Electrocatalytic behaviour of Ni-base amorphous alloys // Electrochimica Acta.-1991. -V. 36, Iss. 3-4. - P. 537-545]. Недоліком композиції є необхідність попередньої хімічної активації аморфного сплаву, що знижує відтворюваність результатів електрохімічної реакції за рахунок короткочасової зміни елементного складу поверхні. Відомий аморфний Ni-S-Co електрод для електрокаталітичного виділення водню з 30 % водного розчину КОН, на якому катодна реакція проходить з досить високою швидкістю при 297 2 2 К - 5,74 мА/см , при підвищенні температури до 333 К - 31,50 мА/см [Yuan Tie-chui, Li Rui-di, Zhou Ke-chao. Electrocatalytic properties of Ni-S-Co coating electrode for hydrogen evolution in alkaline medium // Trans. Nonferrous Met. Soc. China.-2007. - V. 17. - P. 762-765]. Недолік електроду полягає у складному процесі модифікації нікелевого катоду. Для отримання аморфного активного покриття катоду, що вимагає попереднього електролізу нікелевої пластинки протягом 60 хв при густині струму 30 мА/см, t=45 °C в середовищі водного розчину з рН = 4, що містив 120 г/л NiSO4·7H2O, 20 г/л CoSO4·7H2O, 50 г/л Н3ВО3, 30 г/л NaCl. Формування поверхневих шарів не завжди відтворюється і є достовірним. Відома металева композиція Ti2Ni/NiMo для одержання молекулярного водню з 30 % водного розчину КОН при 70 °C при низькому потенціалі катоду -80 мВ. Такий електрод може повторно використовуватись, не втрачаючи при цьому каталітичної активності [Weikang Hu, JaiYoung Lee. Electrocatalytic properties of Ti2Ni/Ni-Mo composite electrodes for hydrogen evolution reaction // International Journal of Hydrogen Energy.-1998. - V. 23, Iss. 4. - P. 253-257]. Недоліком цього електроду є висока температура проведення електрокаталізу у висококоцентрованому 30 % КОН - при 70 °C. Відомий кристалічний потрійний сплав Co-Ni-РЗМ для електрокаталітичного виділення водню з лужних розчинів. Сплави леговані до 8 % РЗМ = Y, Се, Рr, Еr. Чистота вихідного Co=99,98 %, Ni=99,9 %. Мікроструктура сплаву охарактеризована спектральними способами LOM, SEM. Виділення водню проводилось за триелектродною схемою (Pt, насичений каломельний електрод і робочий електрод з 1 М розчину NaOH при 298 К). Приріст катодної перенапруги для нелегованого і всіх легованих сплавів зумовлює ідентичне прискорення швидкості процесу, хоч густина струму дещо відрізняється. Максимальну електрокаталітичну 2 активність проявляє сплав Со57№з5Се8. При η = 20 мВ і = 12,2 мА/см [F. Rosalbino, S. Delsante, G. Borzone, E. Angelini. Electrocatalytic behaviour of Co-Ni-R (R=Rare earth metal) crystalline alloys as electrode materials for hydrogen evolution reaction in alkaline medium // International Journal of Hydrogen Energy.-2008. - V. 33, Iss. 22. - P. 6696-6703]. Недоліком композиції є висока ємність подвійного електричного шару, зокрема сплаву 5 2 легованого церієм - CdI=10 Ф/см , що легко піддається руйнуванню і електрод дезактивується. Відоме використання Ni-Mo-Cr та Bi-Sb електродів для виділення і накопичення водню. NiMo-Cr електрод працює до 3000 циклів, що є позитивною характеристикою активності електроду [Пат. № 2121728 СІ, RU МПК H01G 9/00, H01G 9/04. "Электрохимический накопитель энергии" Р.А. Мирзоев, М.И. Стыров, В.П. Кузнецов, Н.И. Степанова, А.И. Майоров, 10.11.1998]. Недоліком є відсутність уточнення складу робочого середовища і способу контролю активності електродів у ньому. Відомі сплави заліза з нікелем, кобальтом та ванадієм для генерування кисню і водню. Величина перенапруги виділення водню менша на сплаві Fe-Co на 150-200 мВ в порівнянні із сталлю і сплавом Fe-Ni. Сплави Fe-Ni, Fe-Co і Fe-Ni-(La, Ce) одержували електролізом із сульфаміновокислих електролітів, a Fe-V - отримували термічним сплавлянням 50 % Fe і 50 % V. Покриття наносили електролітичним способом на пластини 08КП-сталь і поляризували у 20 % розчині КОН при температурі 20-25 °C [Ю.И. Коваленко, Е.В. Воронина, Б.И. Байрачный. Электрокаталитические свойства сплавов железа // Вісник НТУ "ХПІ".-2012. - № 32. - С.170-174]. Недоліком сплаву є складна підготовка та отримання активних покриттів на сталевій підкладці. Найближчим за технічною суттю прототипом є аморфні електроди Fe 73C3Si7,3B8,5P5,7Mo2,5 і Fе59,5С3Si7,3B8,5Р5,7Мо2,5Со13,5 для виділення водню з 1 М водного розчину КОН [Shan Lin Wang, Dong-Hyun Kim, Seonghoon Yi. Electrocatalytic properties of Fe-based bulk metallic glasses for 1 UA 89419 U 5 10 15 20 25 30 35 40 45 50 55 hydrogen evolution reaction // Korean Journal of Chemical Engineering.-2011. - V. 28, Iss. 8. - P. 1672-1676]. В основу корисної моделі поставлена задача удосконалити аморфну металеву композицію на основі заліза з бором для каталітичного виділення водню з лужних розчинів шляхом додаткового введення Nb та рідкісноземельного елементу, що дасть змогу забезпечити поверхневі шари від корозійного руйнування і буде зберігати високу каталітичну активність в процесі виділення водню з водних лужних розчинів. Поставлена задача вирішується тим, що у аморфну металеву композицію на основі заліза і бора для каталітичного виділення водню з лужних розчинів додатково вводять ніобій і рідкісноземельний елемент Y або Gd, або Dy. Суттєвими відмінностями корисної моделі є: заміна у аморфному сплаві елементів Р, С і молібдену ніобієм; додаткове легування базового сплаву Y або Gd, або Dy; електрокаталітичне виділення водню проводилося з 0,5÷5,0 М розчинів КОН; електрокаталітична реакція проводилася у повітряній атмосфері; швидкість сканування потенціалу 20 мВ/с. Авторами запропоновано попереднє оцінювання антикорозійних властивостей сплавів, які подальше досліджуються як електроди з каталітичними властивостями. Аморфні і нанокристалічні матеріали мають високу корозійну стійкість. Механічна обробка сплавів на основі Fe приводить до поверхневої реструктуризації. Потенціал вільної корозії електрополірованих сплавів коливається біля -0,67±0,01 В і не залежить від концентрації аморфізаторів, наприклад, кремнію у сплаві. Порушення складу поверхневих меж зерен приводить до зміни електрохімічних параметрів аморфних сплавів. Межі зерен на поверхні нанорозмірні і знаходяться в шарах товщиною не більше 100 нм, але вплив їх на електрохімічні характеристики суттєвий. Їхня зміна може викликати зміну формального механізму як анодної, так і катодної реакції. Однак, основним фактором, що впливає на електрохімічну поведінку аморфних металевих сплавів (АМС) є не термообробка, що підвищує стійкість та розмір зерен, а те, що вона викликає зміну поверхневого співвідношення легуючих додатків на поверхні зерен. Не дивлячись на невелику глибину сегрегації домішок на поверхні (10-100 А) і невеликий сумарний вміст, їх вплив на електрохімічні параметри може бути найбільшим. Молекули розчинника (води) та наявні в розчині іони, особливо ОН , взаємодіючи з поверхнею електроду, утворюють хімічні зв'язки з поверхневими атомами металу електроду. Внаслідок хемосорбції іонів виникають поверхневі хімічні сполуки, тобто формуються поверхневі кластери. Прискорення анодного процесу в результаті руйнування поверхні щільних захисних шарів приводить реагуючу систему до енергетичного бар'єру, після досягнення якого спостерігається зниження окисно-відновної активності поверхні електроду. Для збереження електрокаталітчної здатності сплавів на базі заліза у процесі виділення водню з лужних розчинів необхідно збалансувати швидкість анодних і катодних процесів так, щоб електрокаталітична реакція превалювала над руйнуванням. Фіг. 1. Дифрактограми вихідних зразків АМС: 1-Fe82Nb2B14Y2, 2-Fe82Nb2B14Gd2, 3Fe82Nb2B14Dy2, 4-Fe84Nb2B14. Фіг. 2. Циклічні вольтамперограми аморфного сплаву Fe82Nb2B14Gd2 у 4 М КОН. Фіг. 3. Циклічні вольтамперограми аморфного сплаву Fe82Nb2B14Gd2 у 5 М КОН. Фіг. 4. Циклічні вольтамперограми аморфного сплаву Fe82Nb2B14Dy2 у 4 М КОН. Фіг. 5. Циклічні вольтамперограми аморфного сплаву Fe82Nb2B14Dy2 у 5 М КОН. Фіг. 6. Зміна ік виділення водню на АМС-електроді Fe84Nb2B14 при заданому потенціалі виділення водню -1,3 В у 5 М КОН. Фіг. 7. Зміна ік виділення водню на АМС-електроді Fe82Nb2B14Gd2 при заданому потенціалі виділення водню -1,3 В у 5 М КОН. Корисна модель ілюструється наступними прикладами: Приклад 1 Доказом високого ступеня аморфності сплавів Fe84Nb2B14, в яких 2 ат. % замінювались на РЗМ - Y або Gd, або Dy є форма дифрактограм (фіг. 1), знятих за допомогою дифрактометра X'Pert Philips Difractometer PV 3040/60 з СоКα випромінюванням. Наявність на дифрактограмах чітких гало в області 2θ 45° і розмитої низької інтенсивності при 2θ 80° підтверджує відсутність кристалічної фази у зразках АМС. 2 UA 89419 U 5 Приклад 2 Для тестування антикорозійної стійкості аморфних сплавів використано хронопотенціометричний спосіб дослідження, особливістю якого є відсутність зовнішнього потенціалу, АМС-електродів у водних розчинах КОН від 0,5 до 5 М. Реєстрація зміни вільного потенціалу від початкового (Е0) до кінцевого (Ек) проводилась за схемою: робочий електрод АМС, електрод порівняння -Ag/AgCl(KClHac). Таблиця 1 Хронопотенціометрична реєстрація зміни вільного потенціалу АМС-електродів у водних розчинах КОН АМС СКОН, М 0,5 1,0 2,0 3,0 4,0 5,0 Fe84Nb2B14 3 -Е0, В -Eс, В υ·10 , В/с 0,30 0,46 0,47 0,20 0,36 0,83 0,32 0,58 0,83 0,32 0,62 0,86 0,33 0,72 1,33 0,36 0,90 2,33 Fe82Nb2B14Y2 3 -Е0, В -Eс, В υ·10 , В/с 0,30 0,36 0,17 0,24 0,28 0,57 0,28 0,39 0,97 0,31 0,51 1,17 0,35 0,60 1,30 0,44 0,76 1,33 Fe82Nb2B14Gd2 3 -Е0, В -Eс, В υ·10 , В/с 0,22 0,21 0,67 0,17 0,24 0,83 0,19 0,38 0,77 0,29 0,39 0,83 0,33 0,45 0,67 0,36 0,64 1,33 Fe82Nb2B14Dy2 3 -Е0, В -Eс, В υ·10 , В/с 0,22 0,20 0,17 0,13 0,13 0,14 0,31 0,35 0,33 0,23 0,34 0,27 0,22 0,39 0,18 0,22 0,58 0,83 υ - початкова (60 с) швидкість катодного зсуву потенціалу 10 15 Наявність Nb в аморфних сплавах на основі Fe суттєво підвищує дисперсність первинних структурних угрупувань, що підвищує антикорозійні властивості сплавів, а легування РЗМ сприяє формуванню щільних недефектних поверхневих шарів, особливо у випадку Gd і Dy. Приклад 3 Антикорозійна стійкість досліджуваних АМС випробовувалась також в умовах циклічної розгортки потенціалу вольтамперометрично в умовах наближених до катодного виділення водню з лужних розчинів. Наведені в таблиці 2 результати (Екор, ікор) корозійних досліджень свідчать про високу антикорозійну стійкість зразків АМС. Величина Екор в результаті 9 циклів сканування потенціалу практично не змінюється. Таблиця 2 Вплив циклічної поляризації електродів і концентрації водних розчинів КОН на корозійні характеристики АМС-електродів 1МКОН 2МКОН 3МКОН 4МКОН 5МКОН 5 5 5 5 5 Цикл ік·10 , ік·10 , ік·10 , ік·10 , ік·10 , -Екор, В -Eкор, B -Екор, В Eкор, B -Екор, В 2 2 2 2 2 А/см А/см А/см А/см А/см Fe84Nb2B14 1 1,01 1,60 1,11 0,92 1,08 0,43 1,08 0,43 1,15 0,17 2 1,03 0,13 1,12 1,23 1,08 0,11 1,07 0,51 1,13 0,37 3 1,02 0,15 1,12 1,87 1,11 0,08 1,09 0,40 1,14 0,30 4 1,04 0,39 1,13 2,18 1,13 0,38 1,11 0,82 1,15 0,21 5 1,05 0,33 1,13 1,55 1,12 0,28 1,12 1,19 1,14 0,31 6 1,06 0,33 1,13 1,55 1,13 0,14 1,11 1,38 1,13 0,40 7 1,07 0,31 1,13 2,72 1,12 0,17 1,11 2,45 1,12 1,03 8 1,08 0,44 1,13 1,56 1,12 0,10 1,11 0,55 1,11 1,25 9 1,08 0,42 1,13 0,97 1,12 0,15 1,11 0,45 1,10 0,65 Fe82Nb2B14Y2 1 0,96 0,12 1,02 0,15 1,04 0,26 1,02 0,16 1,02 0,13 2 0,95 0,17 1,03 0,56 1,07 0,60 1,05 0,50 1,11 0,12 3 0,98 0,17 1,04 0,54 1,08 1,02 1,13 0,40 1,11 0,09 4 0,98 0,21 1,04 0,55 1,09 0,96 1,10 0,70 1,12 0,12 5 0,99 0,33 1,04 0,02 1,09 0,92 1,10 0,80 1,16 0,21 6 0,99 0,36 1,05 0,82 1,10 0,99 1,11 0,52 1,16 0,45 7 1,01 0,27 1,06 1,61 1,10 0,62 1,13 0,43 1,19 0,43 20 3 UA 89419 U Продовження таблиці 2 Цикл 8 9 1МКОН 5 ік·10 , -Екор, В 2 А/см 1,01 0,14 1,02 0,34 2МКОН 5 ік·10 , -Eкор, B 2 А/см 1,06 1,20 1,07 0,94 1 2 3 4 5 6 7 8 9 10 15 20 25 0,70 0,67 0,58 0,12 0,65 1,09 1,25 0,47 0,11 1,04 1,06 1,05 1,05 1,04 1,04 1,05 1,04 1,05 2,91 3,30 2,61 2,92 2,60 2,53 1,17 2,64 1,50 1 2 3 4 5 6 7 8 9 5 0,99 0,95 0,96 0,95 0,95 0,96 0,96 0,96 0,97 1,01 1,03 1,03 1,02 1,01 1,01 1,03 1,01 1,01 0,10 0,10 0,56 0,13 0,12 0,29 0,12 0,12 0,11 1,02 1,03 1,04 1,04 1,05 1,05 1,05 1,06 1,06 2,22 3,87 4,65 2,62 1,67 2,76 3,28 0,67 0,23 3МКОН 5 ік·10 , -Екор, В 2 А/см 1,11 0,58 1,11 0,48 Fe82Nb2B14Gd2 1,06 0,25 1,08 0,12 1,09 0,16 1,08 0,18 1,09 0,34 1,10 1,20 1,09 1,48 1,10 1,25 1,11 0,72 Fe82Nb2B14Dy2 1,03 0,23 1,06 0,12 1,10 0,19 1,07 0,22 1,08 0,78 1,08 0,84 1,09 1,15 1,09 0,71 1,09 0,43 4МКОН 5 ік·10 , Eкор, B 2 А/см 1,13 0,13 1,13 0,27 5МКОН 5 ік·10 , -Екор, В 2 А/см 1,19 0,37 1,19 0,34 1,07 1,08 1,11 1,12 1,12 1,13 1,13 1,13 1,13 0,44 0,72 0,65 0,83 0,78 0,86 0,70 0,30 0,72 1,08 1,10 1,11 1,12 1,13 1,15 1,14 1,14 1,15 0,23 0,84 1,15 2,62 1,40 1,11 0,90 0,77 0,54 1,06 1,09 1,10 1,10 1,10 1,00 1,00 1,11 1,12 0,20 0,55 0,64 0,49 0,58 0,71 0,67 0,76 0,51 1,08 1,12 1,14 1,17 1,18 1,17 1,25 1,20 1,20 0,25 0,75 0,65 0,84 0,87 0,83 0,21 0,19 0,14 Найстабільнішими у сильнолужних розчинах виявились сплави, леговані Gd або Dy. Приклад 4 На циклічних вольтамперограмах, знятих у межах -1,5 0,5 В АМС-електродів у 5 М КОН, ідентифіковані стадії поступового окиснення Fe (анодна вітка) та відновлення оксидів Fe і виділення Н2, ЕН2 -1,3 В (катодна гілка). Обидва аморфні сплави є активними каталізаторами електровиділення водню при 5 М концентрації КОН. При нижчих концентраціях (4М КОН) струм виділення водню зменшується на електродах, легованих Gd у 6 разів, a Dy - у 15 разів. Приклад 5 У потенціостатичному режимі при Е = -1,3 Ву5М водному розчині КОН визначено приріст струму виділення водню на нелегованому електроді Fe84Nb2B14 та на Fe82Nb2B14Gd2. Швидкий початковий приріст струму зумовлений адсорбцією гідроксид-іонів на електроді і подальшим їх відновленням до Н2. Суттєва різниця відновлення водню на легованому Gd електроді полягає в тому, що під час електролізу в потенціостатичному режимі при -1,3 В процес виділення водню активізується. Вищенаведені приклади доводять: 1) наявність Nb у сплавах Fe-Nb-B-РЗМ забезпечує високий ступінь аморфності і однорідності; 2) аморфні сплави на основі Fe84Nb2B14 внаслідок заміни 2 % Nb на РЗМ (Y або Gd, або Dy) мають підвищену антикорозійну стійкість у 0,55 М розчинах КОН; 3) електрод з аморфного сплаву Fe84Nb2B14, легованого Gd або Dy проявляють найвищу та довготривалу електрокаталітичну активність у реакції виділення Н2 з 5 М водного розчину КОН. Наведені результати тестування сплавів на корозійну стійкість та швидкість виділення водню підтверджують передбачуваний технічний результат. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 30 Аморфна металева композиція на основі Fe і B для каталітичного виділення водню з лужних розчинів, яка відрізняється тим, що додатково містить Nb і рідкісноземельний елемент Y або Gd, або Dy. 4 UA 89419 U 5 UA 89419 U Комп’ютерна верстка А. Крижанівський Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 6
ДивитисяДодаткова інформація
Автори англійськоюHertsyk Oksana Myronivna, Boitsyshyn Lidia Mykhailivna, Nosenko Viktor Kostiantynovych, Kovbuz Myroslava Oleksiivna
Автори російськоюГерцык Оксана Мироновна, Бойчишин Лидия Михайловна, Носенко Виктор Константинович, Ковбуз Мирослава Алексеевна
МПК / Мітки
МПК: C25B 11/06, C22C 38/32, C25B 11/04
Мітки: металева, композиція, водню, аморфна, лужних, виділення, каталітичного, основі, розчинів
Код посилання
<a href="https://ua.patents.su/8-89419-amorfna-metaleva-kompoziciya-na-osnovi-fe-i-b-dlya-katalitichnogo-vidilennya-vodnyu-z-luzhnikh-rozchiniv.html" target="_blank" rel="follow" title="База патентів України">Аморфна металева композиція на основі fe і b для каталітичного виділення водню з лужних розчинів</a>
Попередній патент: Газорозподільний механізм двигуна внутрішнього згоряння
Наступний патент: Магнітний, струмопровідний, композитний матеріал на основі поліаніліну
Випадковий патент: Апарат для проведення гарячого ступеня основної дефекації цукроутримуючих розчинів