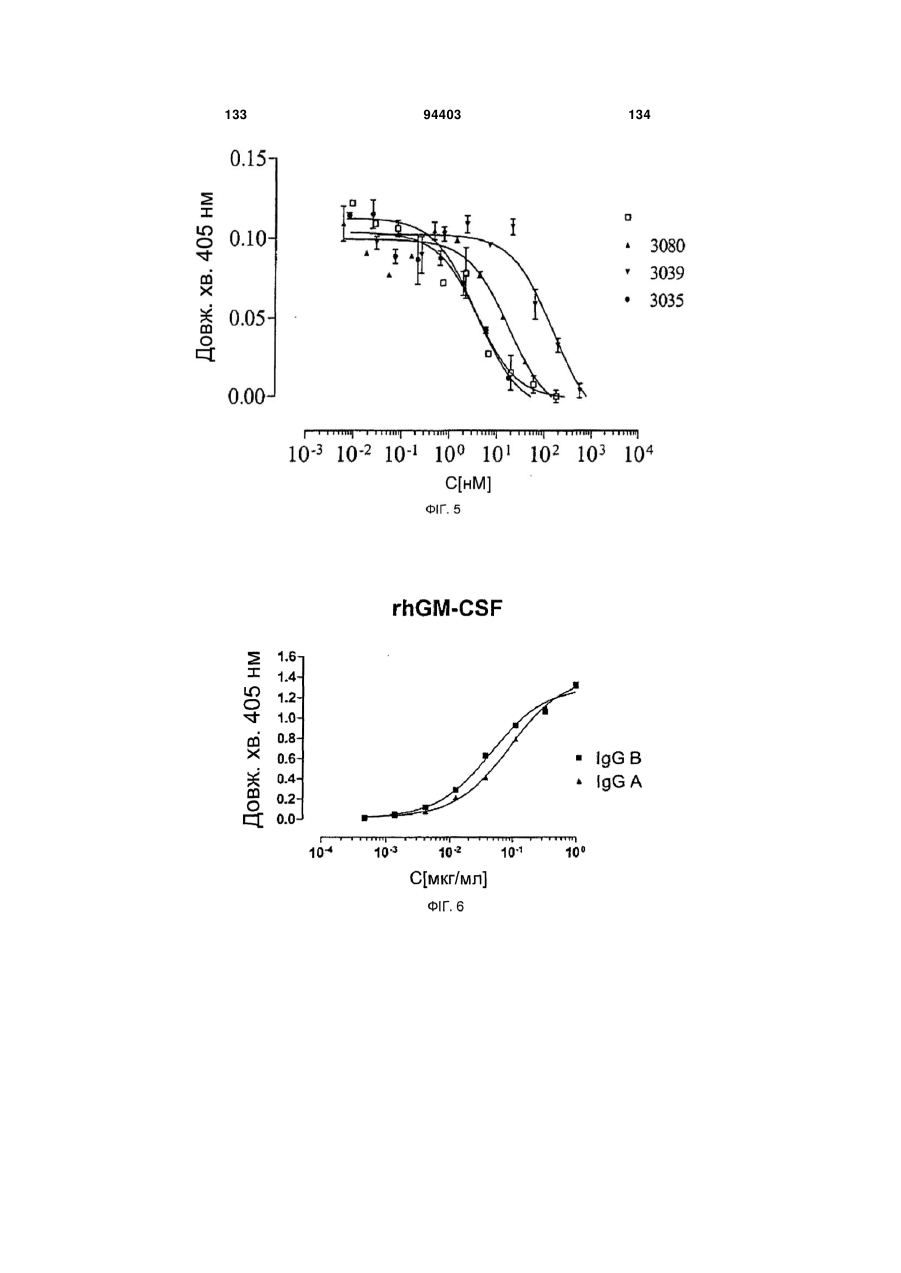
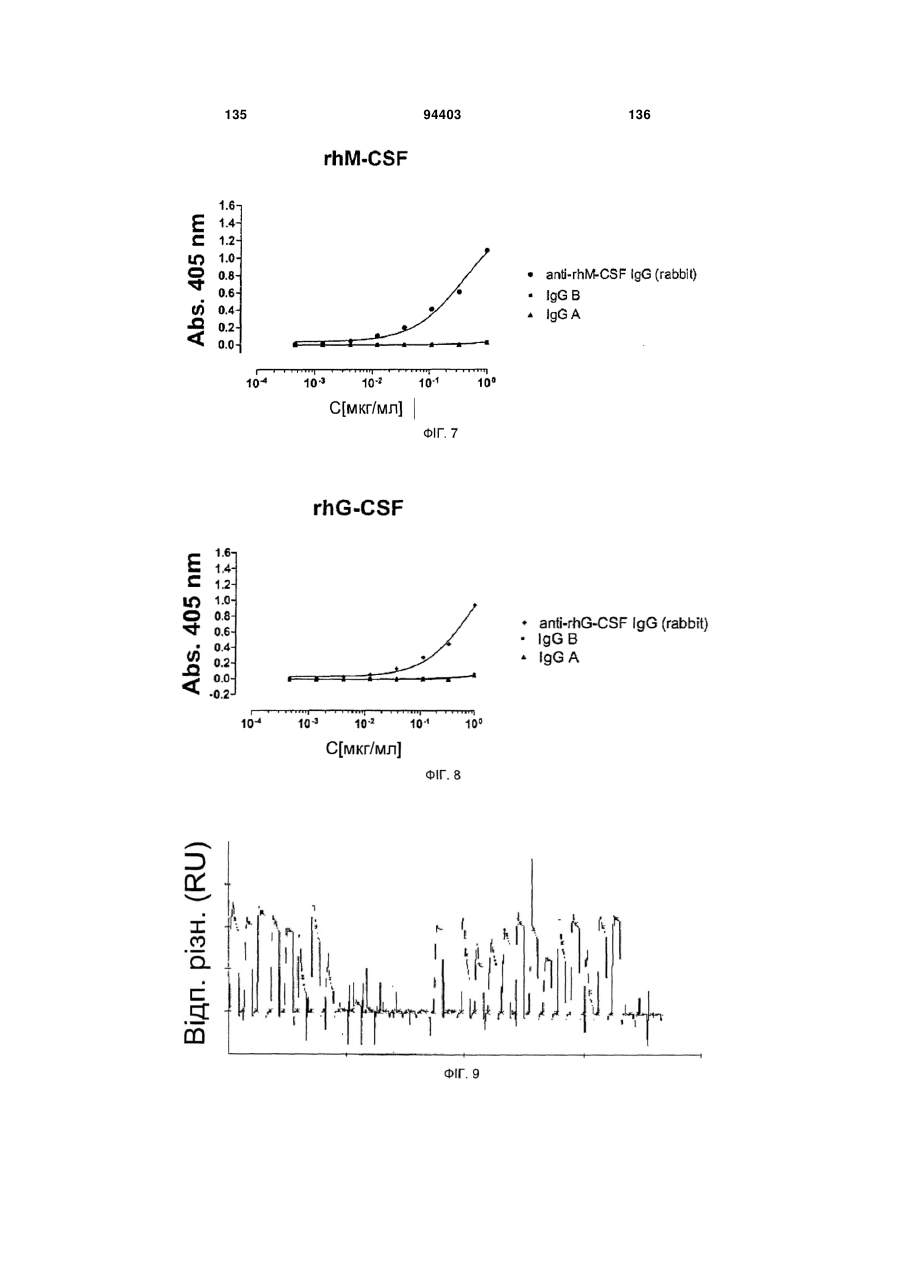
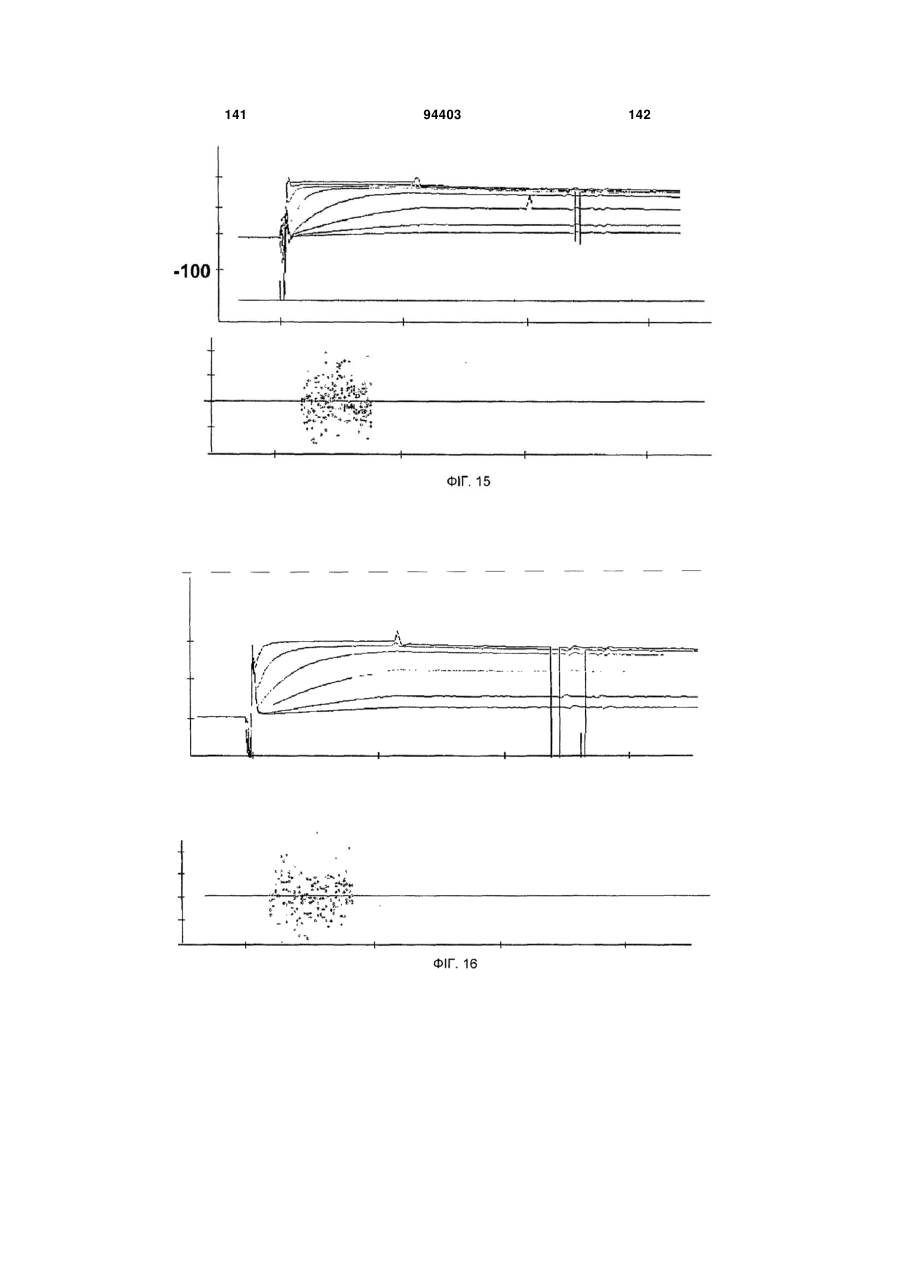
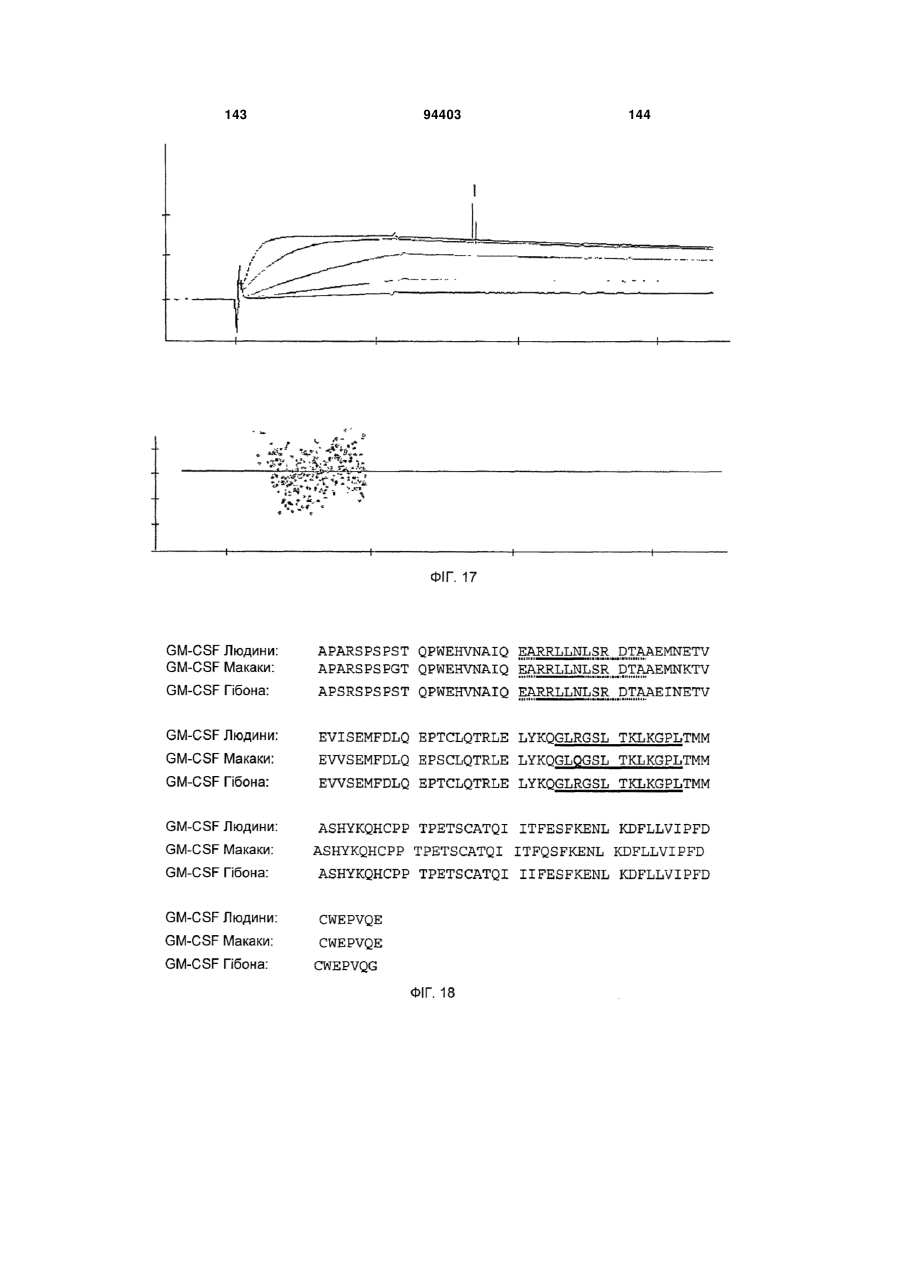
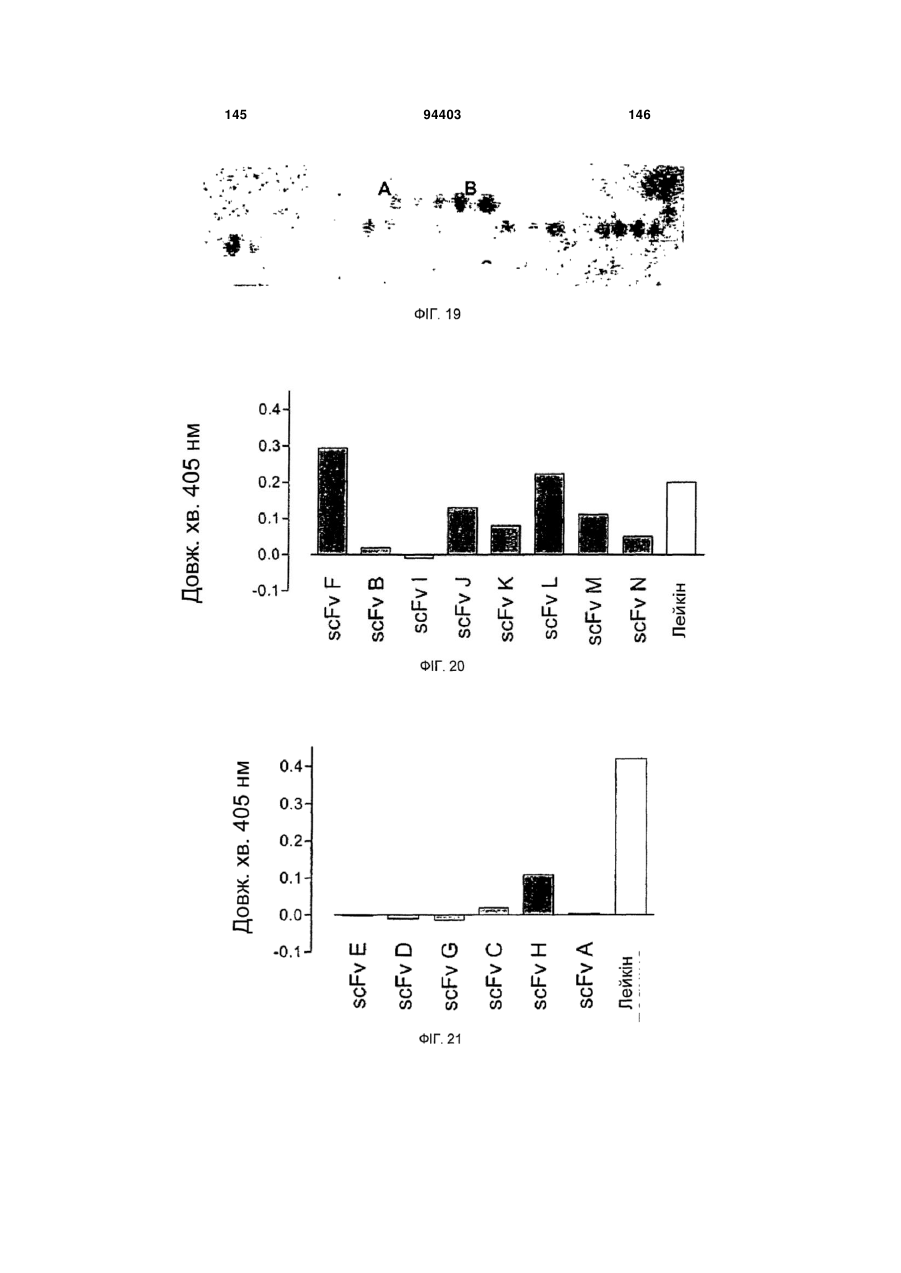
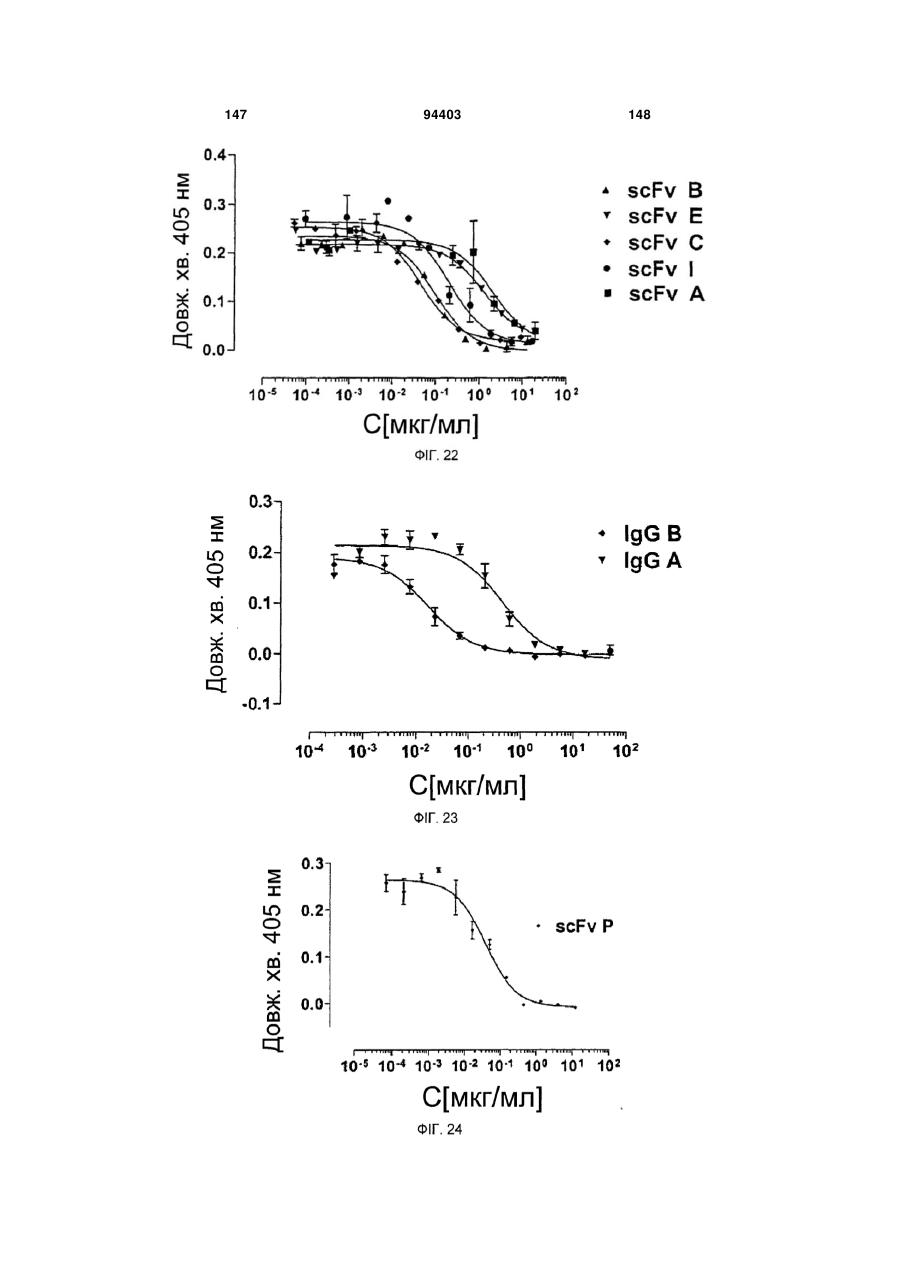
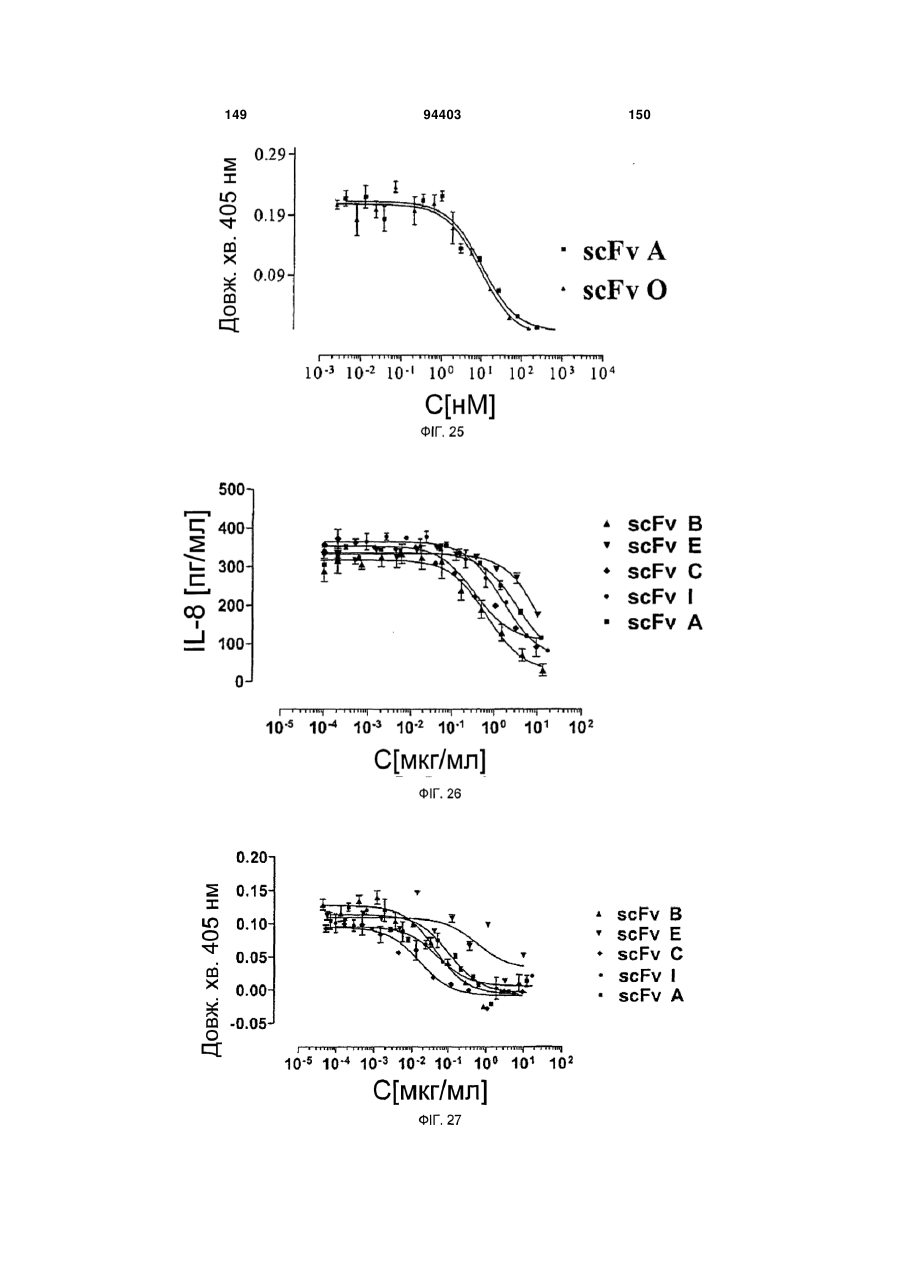
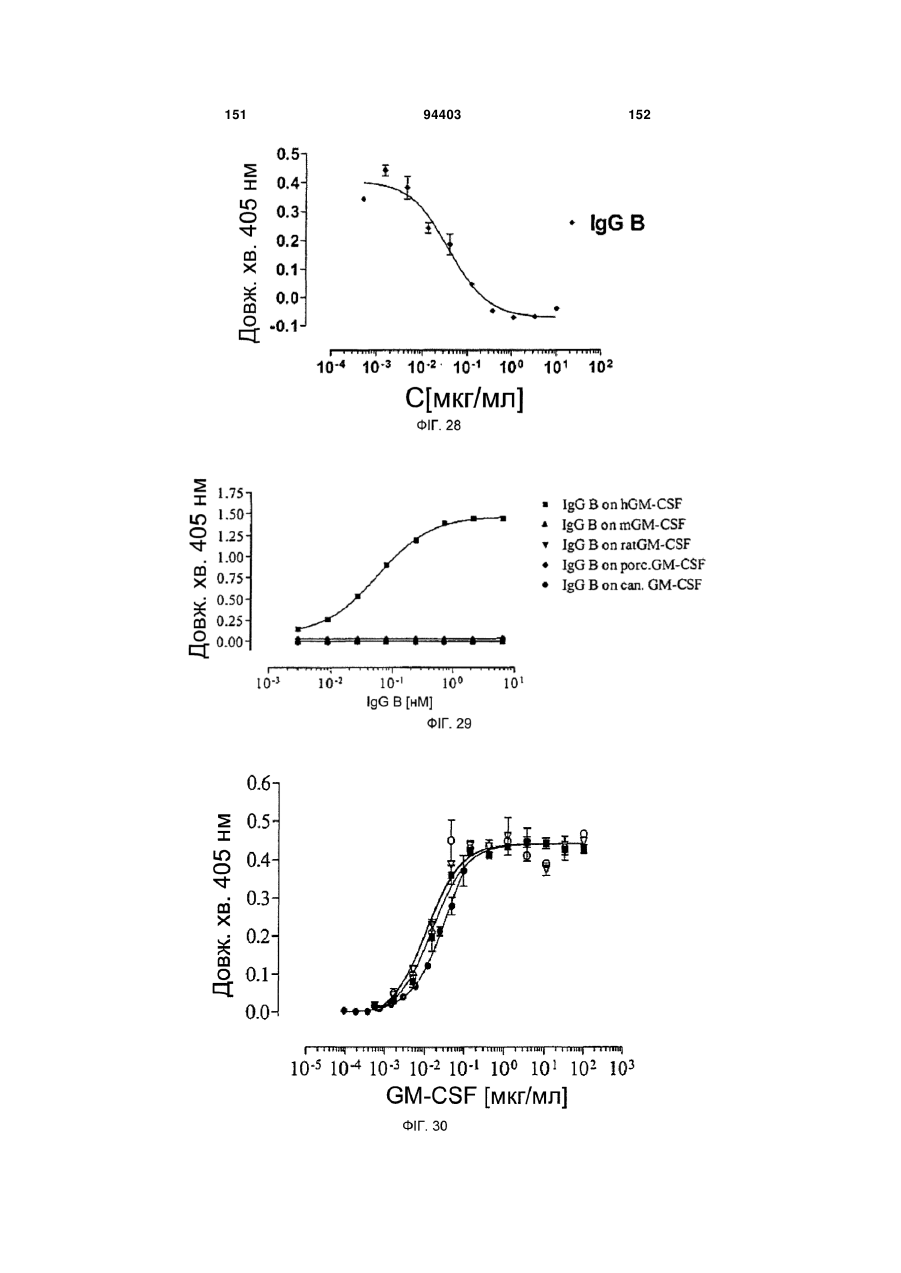
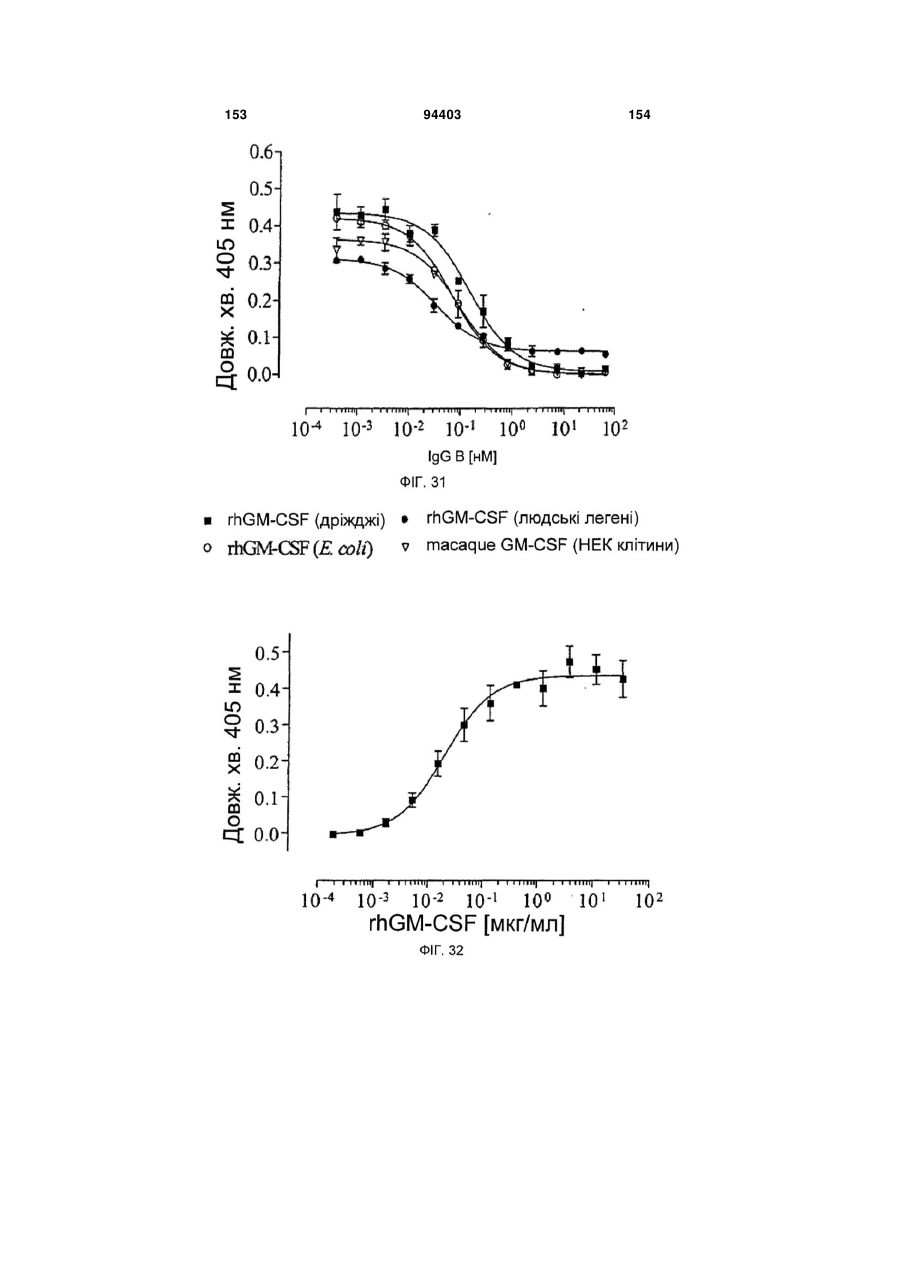
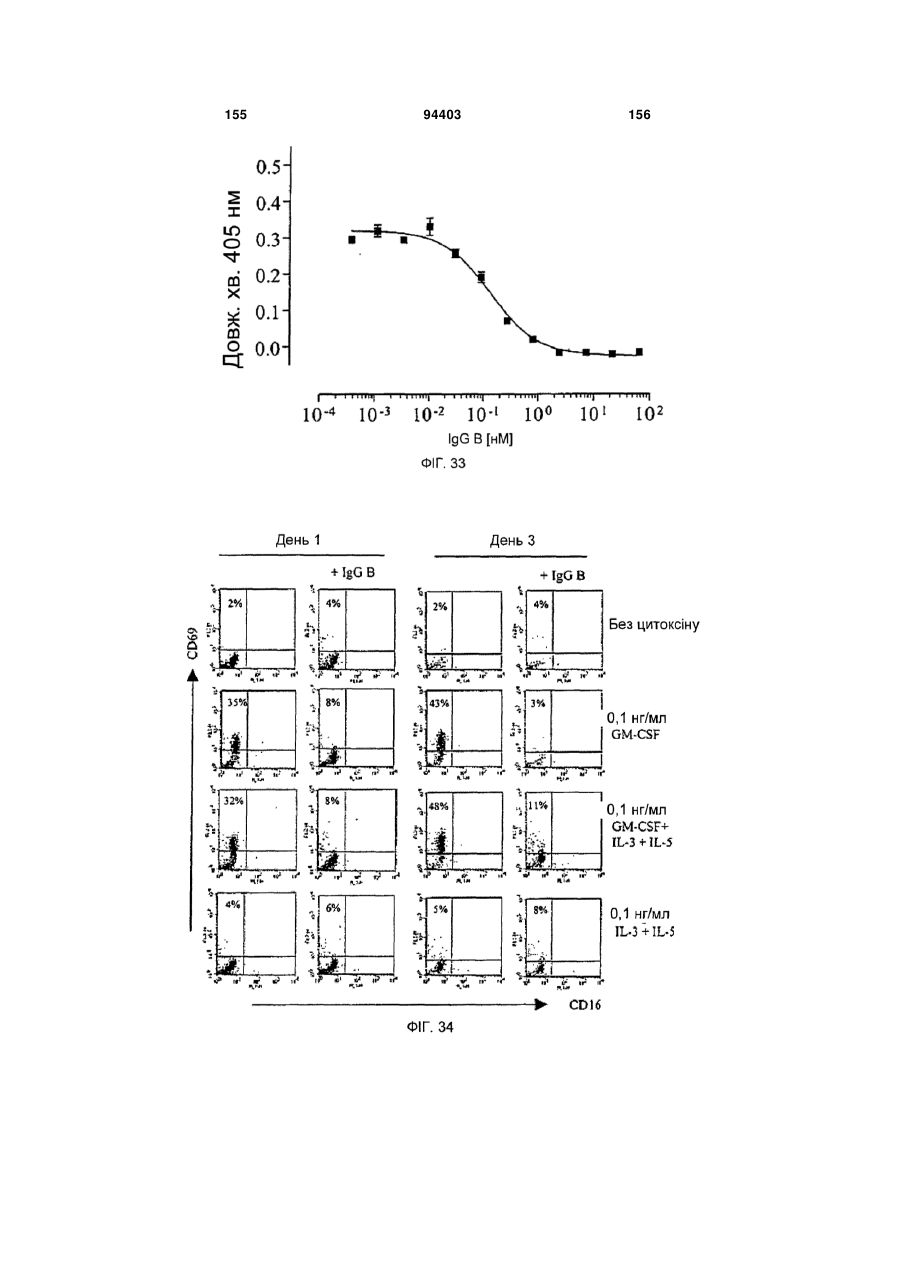
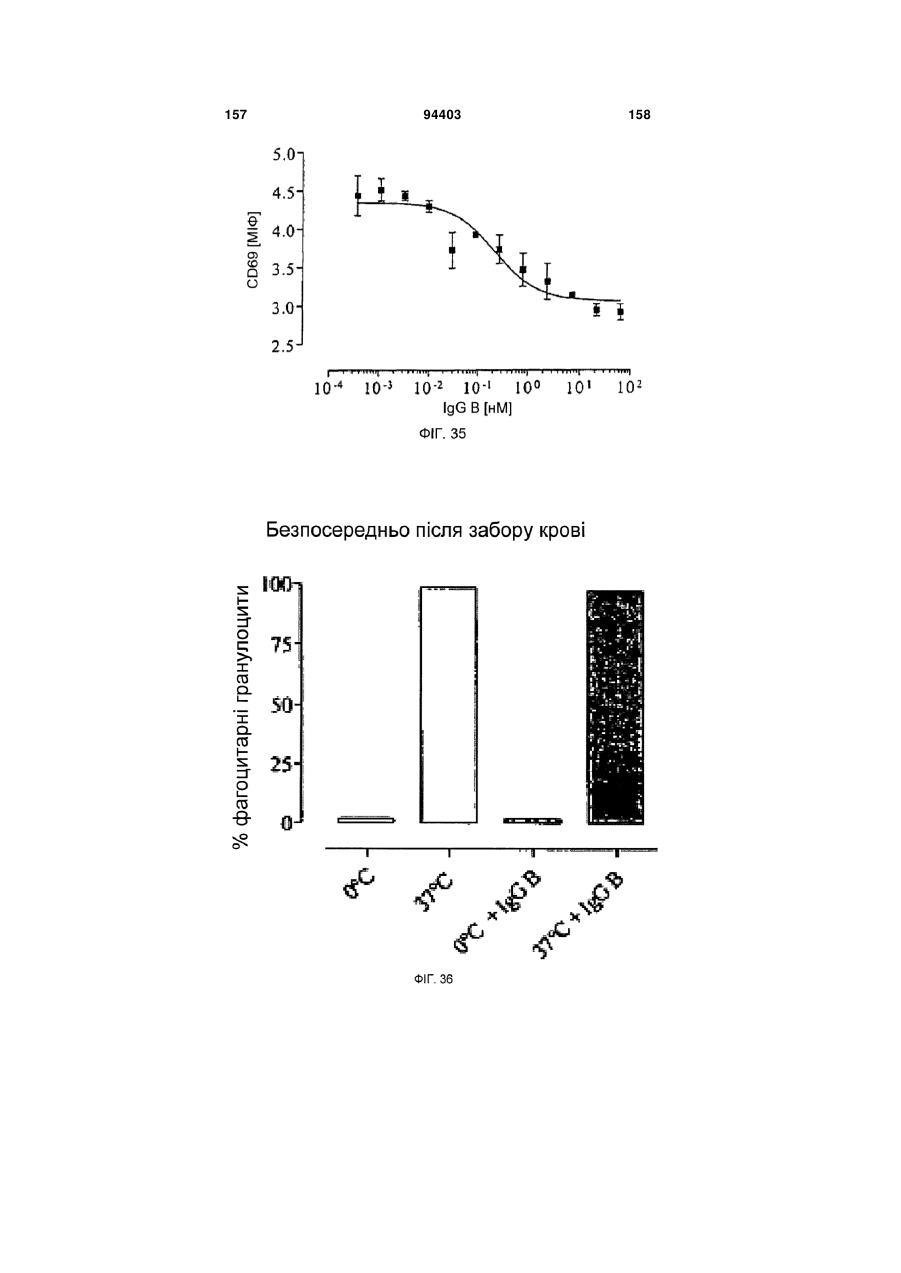
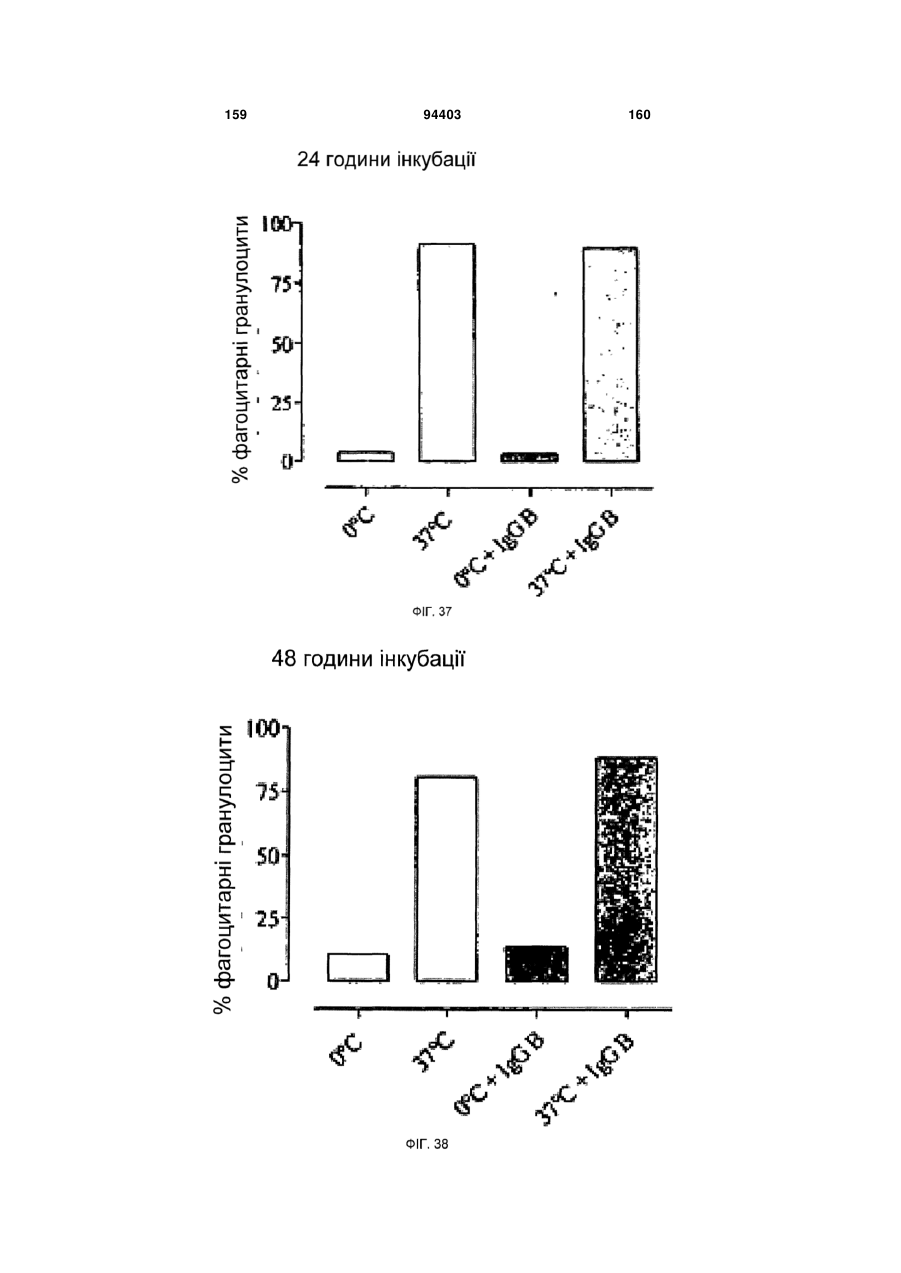
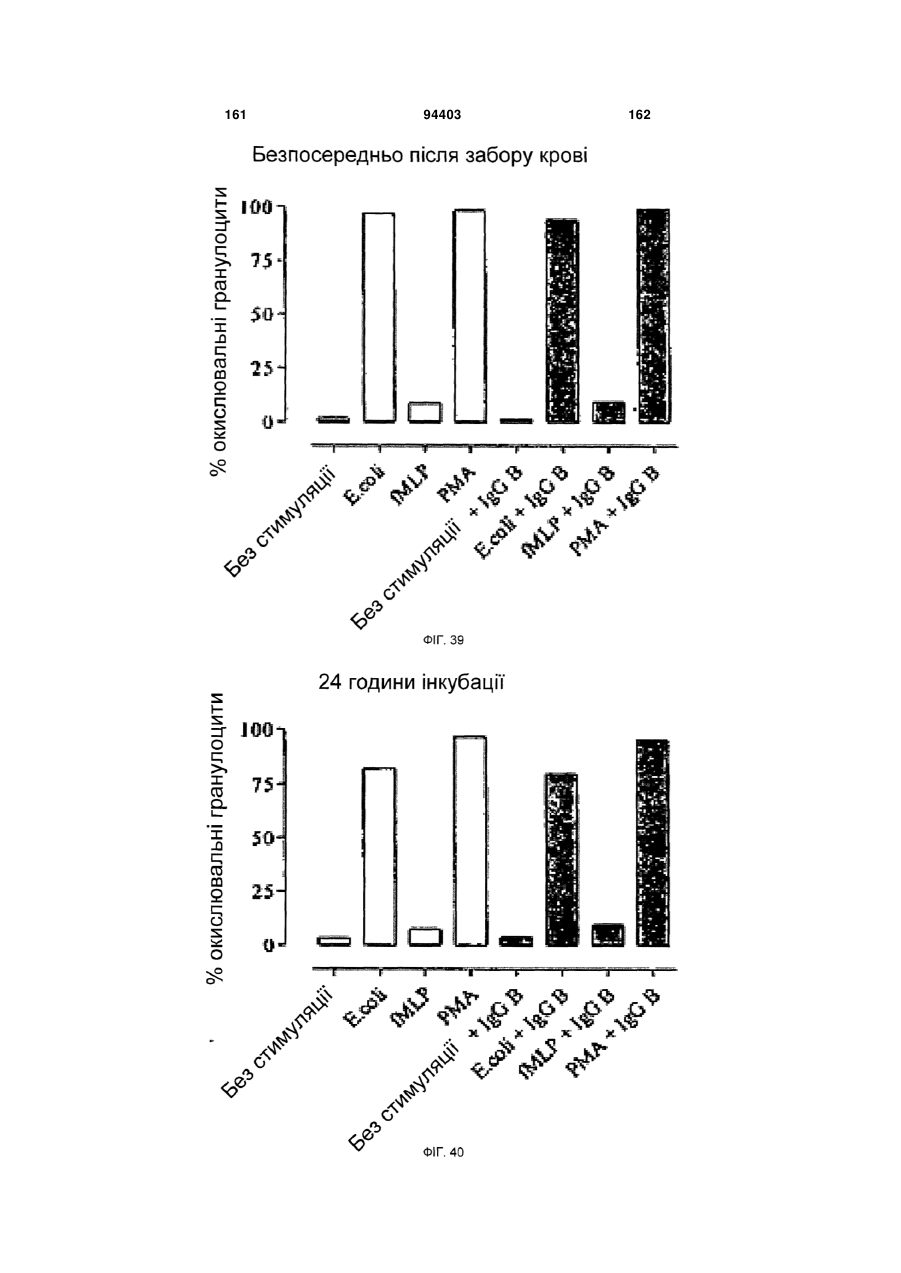
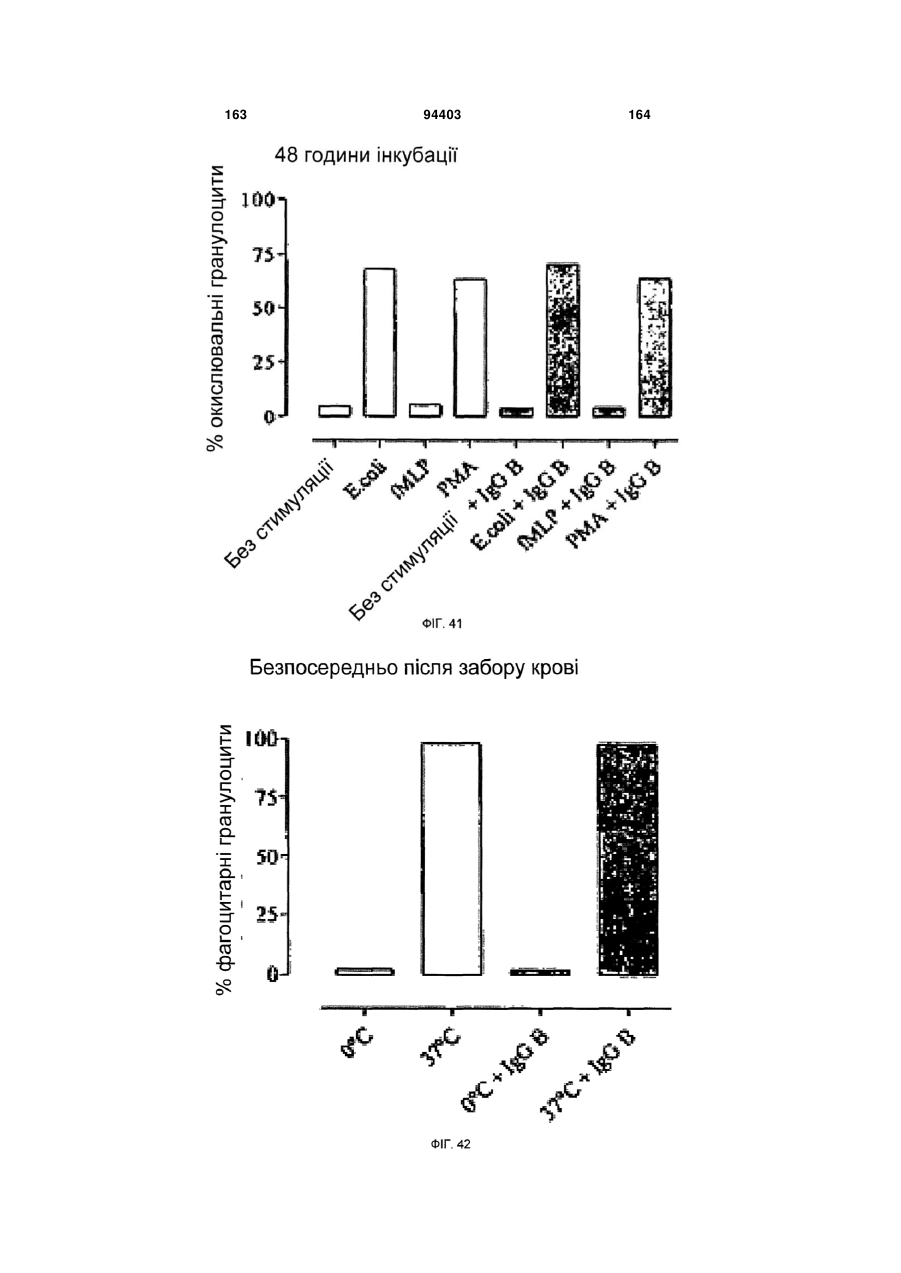
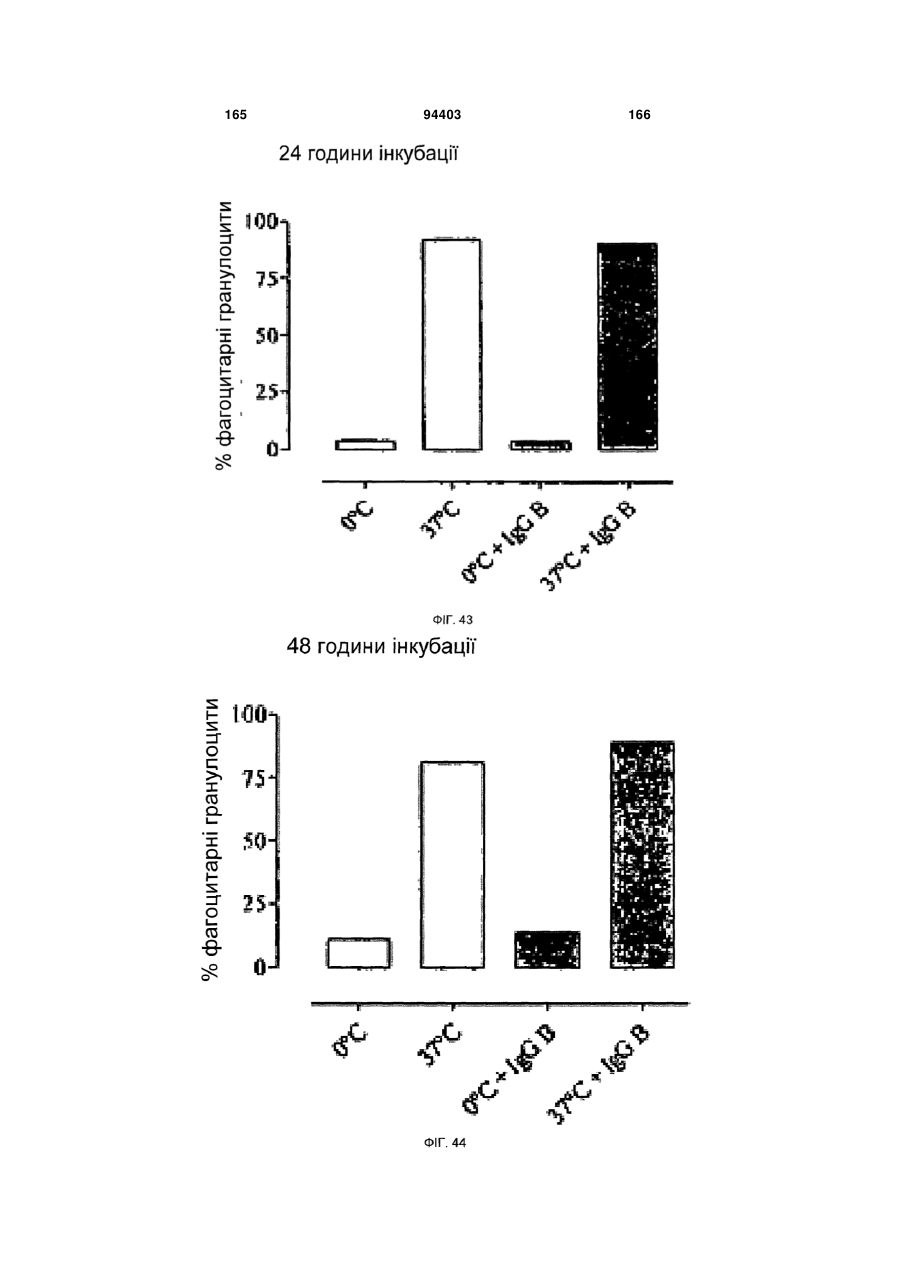
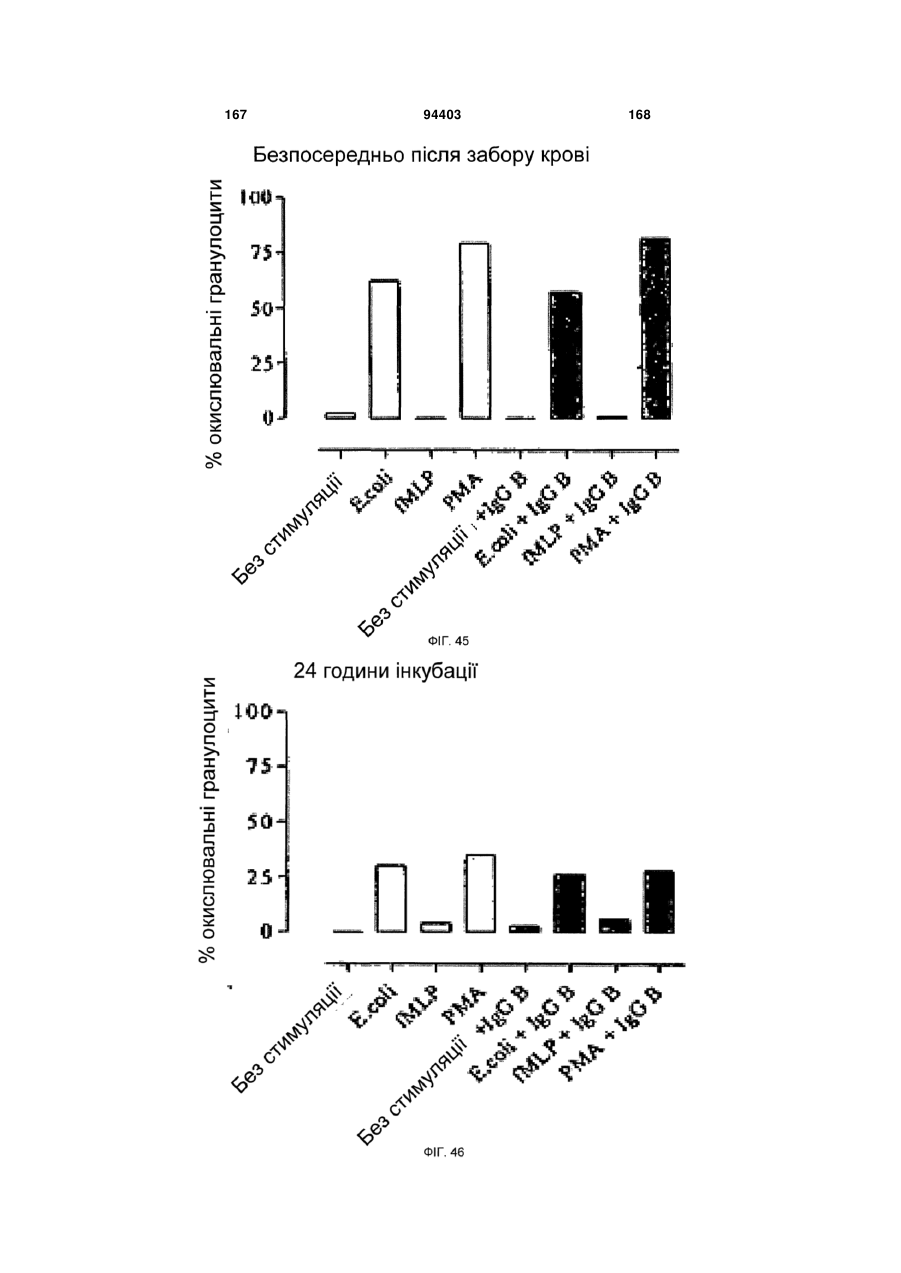
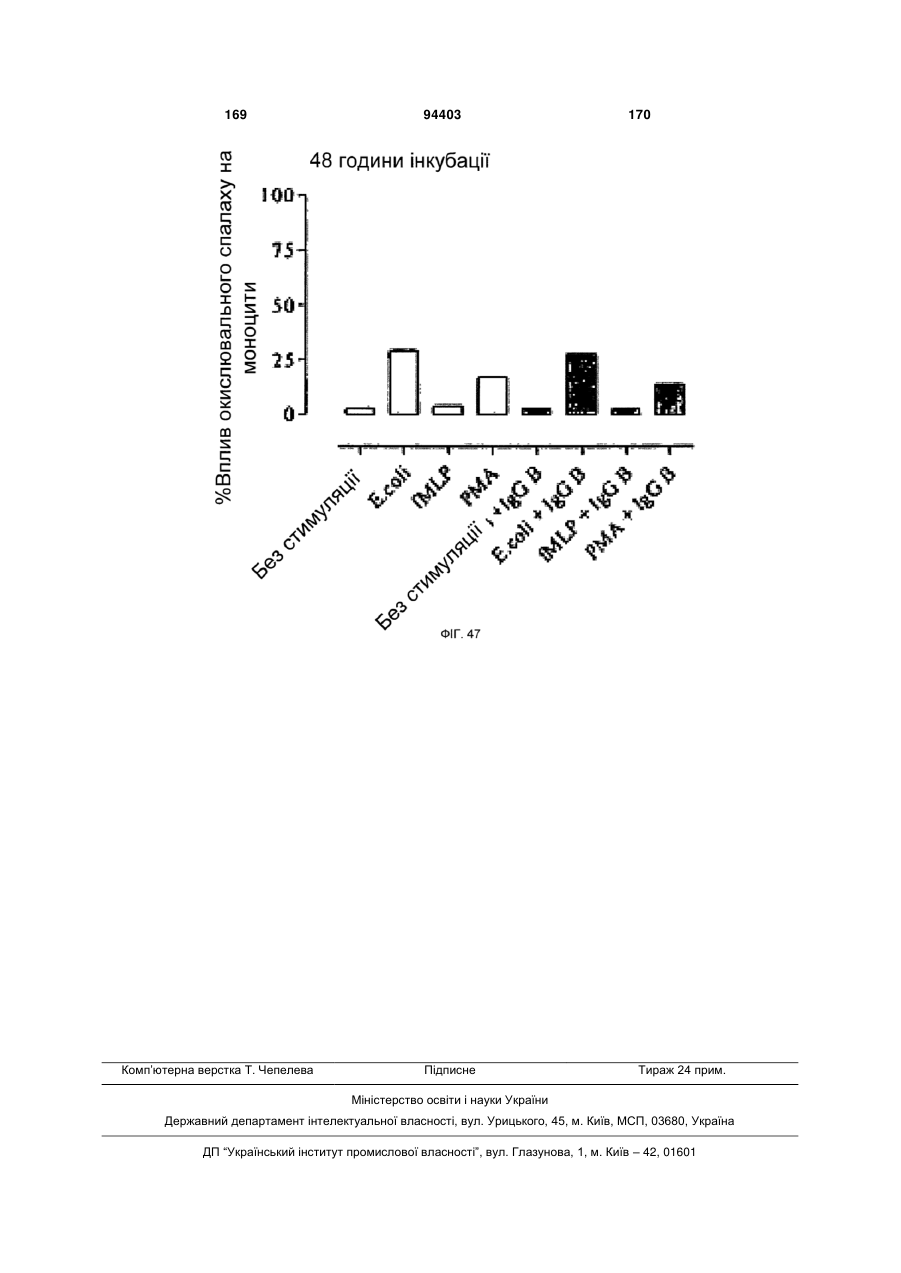
Людське моноклональне антитіло, яке нейтралізує gm-csf
Номер патенту: 94403
Опубліковано: 10.05.2011
Автори: Земан Стівен, Вольф Андреас, Петш (Нее Міттельстрасс) Сілке, Раум Тобіас, Хепп (Нее Хенкель) Юлія, Брукмайєр Сандра, Фісер Ева
Формула / Реферат
1. Людське моноклональне антитіло або його фрагмент, яке відрізняється тим, що специфічно зв’язується з епітопом, переважно переривчастим епітопом, та нейтралізує GM-CSF приматів, де епітоп включає амінокислоти 23-27 (RRLLN) та амінокислоти 65-77 (GLR/QGSLTKLKGPL).
2. Людське моноклональне антитіло або його фрагмент за п. 1, яке відрізняється тим, що вказаний примат є людиною або приматом, що не належить до людського роду.
3. Людське моноклональне антитіло або його фрагмент за п. 2, яке відрізняється тим, що вказаний примат, що не належить до людського роду, є яванською макакою, макакою-резус або гібоном.
4. Людське моноклональне антитіло за будь-яким з попередніх пунктів, яке відрізняється тим, що вказане антитіло являє собою IgG.
5. Людське моноклональне антитіло за п. 4, яке відрізняється тим, що вказаний IgG являє собою IgGl або IgG4.
6. Фрагмент людського моноклонального антитіла за будь-яким з пп. 1-3, який відрізняється тим, що вказаний фрагмент являє собою scFv, однодоменне антитіло, Fv, антитіло VHH, димерне антитіло, тандемне димерне антитіло, Fab, Fab’ або F(ab)2.
7. Людське моноклональне антитіло або його фрагмент за п. 6, яке відрізняється тим, що вказаний переривчастий епітоп додатково включає амінокислоти 28-31 (LSRD).
8. Людське моноклональне антитіло або його фрагмент за пп. 6 або 7, яке відрізняється тим, що вказаний переривчастий епітоп додатково включає амінокислоти 32-33 (ТА) та/або амінокислоти 21-22.
9. Людське моноклональне антитіло або його фрагмент за будь-яким з попередніх пунктів, яке відрізняється тим, що вказане людське моноклональне антитіло або його фрагмент містить у варіабельній ділянці важкого ланцюга CDR3, що містить амінокислотну послідовність, вибрану з групи, що складається з послідовностей, наведених в будь-якій з SEQ ID NO: 1-13 або 56.
10. Людське моноклональне антитіло або його фрагмент за п. 9, яке відрізняється тим, що будь-яка з вказаних послідовностей CDR3 варіабельної ділянки важкого ланцюга існує у варіабельній ділянці важкого ланцюга разом з послідовністю CDR1 варіабельної ділянки важкого ланцюга, наведеною в SEQ ID NO: 14, та послідовністю CDR2 варіабельної ділянки важкого ланцюга, наведеною в SEQ ID NO: 15.
11. Людське моноклональне антитіло або його фрагмент за п. 9 або 10, яке відрізняється тим, що вказане людське моноклональне антитіло або його фрагмент містить в у варіабельній ділянці легкого ланцюга CDR1, що містить амінокислотну послідовність, наведену SEQ ID NO: 16, CDR2, що містить амінокислотну послідовність, наведену в SEQ ID NO: 17, і CDR3, що містить амінокислотну послідовність, наведену в SEQ ID NO: 18.
12. Людське моноклональне антитіло або його фрагмент за п. 9 або 10, яке відрізняється тим, що вказане людське моноклональне антитіло або його фрагмент додатково містить у варіабельній ділянці легкого ланцюга амінокислотну послідовність, наведену в SEQ ID NO: 19, 54 або 55.
13. Людське моноклональне антитіло або його фрагмент за будь-яким з пп. 9-12, яке відрізняється тим, що вказане людське моноклональне антитіло або його фрагмент містить у варіабельній ділянці важкого ланцюга амінокислотну послідовність, наведену в будь-якій з SEQ ID NO: 20-33, 52 або 53.
14. Людське моноклональне антитіло або його фрагмент за будь-яким з попередніх пунктів, яке відрізняється тим, що містить у варіабельній ділянці легкого ланцюга CDR1, що містить амінокислотну послідовність, наведену в SEQ ID NO: 16, CDR2, що містить амінокислотну послідовність, наведену в SEQ ID NO: 17, і CDR3, що містить амінокислотну послідовність, наведену в SEQ ID NO: 18; та містить у варіабельній ділянці важкого ланцюга ділянку CDR1, що містить амінокислотну послідовність, наведену в SEQ ID NO: 14, ділянку CDR2, що містить амінокислотну послідовність, наведену в SEQ ID NO: 15, і CDR3, що містить амінокислотну послідовність, наведену в будь-якій з SEQ ID NO: 1-13 або 56.
15. Людське моноклональне антитіло за будь-яким з пунктів 9-14, яке відрізняється тим, що містить амінокислотну послідовність легкого ланцюга, наведену в SEQ ID NO: 34, та амінокислотну послідовність важкого ланцюга, наведену в будь-якій з SEQ ID NО: 35-48.
16. Людське моноклональне антитіло або його фрагмент за будь-яким з пунктів 9-15, яке відрізняється тим, що вказане людське моноклональне антитіло або його фрагмент містить амінокислотну послідовність, яка демонструє як мінімум 70 % гомологію з відповідною амінокислотною послідовністю, наведеною в будь-якій з SEQ ID NO: 1-48 та/або 52-56.
17. Молекула полінуклеотиду, що кодує будь-яке антитіло за пп. 1-16.
18. Фармацевтична композиція, яка включає людське моноклональне антитіло або його фрагмент за будь-яким з пп. 1-16 або молекулу полінуклеотиду за п. 17.
19. Застосування людського моноклонального антитіла або його фрагмента за будь-яким з пп. 1-16 або молекули полінуклеотиду за п. 17 у виробництві лікарського засобу для лікування запальних захворювань, що необов'язково містить один або більше додаткових протизапальних агентів.
20. Застосування за п. 19, яке відрізняється тим, що вказані запальні захворювання вибрані з групи, що складається з ревматоїдного артриту (РА) (зокрема РА, стійкого до лікування нейтралізаторами пухлинного некротичного фактору [ТМР]-альфа), астми, розсіяного склерозу (PC), хронічного обструктивного захворювання легень (ХОЗЛ), синдрому гострої дихальної недостатності (ARDS), хвороби Крона, ідіопатичного фіброзу легень (ІФЛ), запального захворювання кишечнику (ЗЗК), увеїту, дегенерації жовтої плями, коліту, псоріазу, дегенерації Валлеріана, антифосфоліпідного синдрому (АФС), гострого коронарного синдрому, рестенозу, атеросклерозу, рецидивуючого поліхондриту (РП), гострого або хронічного гепатиту, безуспішної імплантації ортопедичних імплантатів, гломерулонефриту, вовчаку або аутоімунних розладів.
21. Застосування людського моноклонального антитіла або його фрагмента за будь-яким з пп. 1-16 або молекули полінуклеотиду за п. 17 у виробництві лікарського засобу для лікування пухлинного захворювання або іншого стану, який характеризується затримкою апоптозу клітин, збільшеним виживанням або проліферацією клітин, що необов'язково містить один або більше додаткових протиракових засобів.
22. Застосування за п. 21, яке відрізняється тим, що вказане пухлинне захворювання являє собою рак.
23. Застосування за п. 22, яке відрізняється тим, що вказаний рак являє собою лейкемію, множинну мієлому, карциному шлунка або карциному шкіри.
Текст
1. Людське моноклональне антитіло або його фрагмент, яке відрізняється тим, що специфічно зв’язується з епітопом, переважно переривчастим епітопом, та нейтралізує GM-CSF приматів, де епітоп включає амінокислоти 23-27 (RRLLN) та амінокислоти 65-77 (GLR/QGSLTKLKGPL). 2. Людське моноклональне антитіло або його фрагмент за п. 1, яке відрізняється тим, що вказаний примат є людиною або приматом, що не належить до людського роду. 3. Людське моноклональне антитіло або його фрагмент за п. 2, яке відрізняється тим, що вказаний примат, що не належить до людського роду, є яванською макакою, макакою-резус або гібоном. 4. Людське моноклональне антитіло за будь-яким з попередніх пунктів, яке відрізняється тим, що вказане антитіло являє собою IgG. 5. Людське моноклональне антитіло за п. 4, яке відрізняється тим, що вказаний IgG являє собою IgGl або IgG4. 6. Фрагмент людського моноклонального антитіла за будь-яким з пп. 1-3, який відрізняється тим, що вказаний фрагмент являє собою scFv, однодоменне антитіло, Fv, антитіло VHH, димерне антитіло, тандемне димерне антитіло, Fab, Fab’ або F(ab)2. 7. Людське моноклональне антитіло або його фрагмент за п. 6, яке відрізняється тим, що вказаний переривчастий епітоп додатково включає амінокислоти 28-31 (LSRD). 8. Людське моноклональне антитіло або його фрагмент за пп. 6 або 7, яке відрізняється тим, що вказаний переривчастий епітоп додатково включає амінокислоти 32-33 (ТА) та/або амінокислоти 2122. UA (21) a200712125 (22) 18.04.2006 (24) 10.05.2011 (86) PCT/EP2006/003528, 18.04.2006 (31) 05008410.2 (32) 18.04.2005 (33) EP (46) 10.05.2011, Бюл.№ 9, 2011 р. (72) РАУМ ТОБІАС, DE, ХЕПП (НЕЕ ХЕНКЕЛЬ) ЮЛІЯ, DE/CH, ФІСЕР ЕВА, DE, ПЕТШ (НЕЕ МІТТЕЛЬСТРАСС) СІЛКЕ, DE, ЗЕМАН СТІВЕН, US/DE, ВОЛЬФ АНДРЕАС, DE, БРУКМАЙЄР САНДРА, DE (73) МІКРОМЕТ АГ, DE (56) WO A2 03068924, 21.08.2003. EP A1 0344957, 06.12.1989. EP A2 0265384, 27.04.1988. EP A2 0499161, 19.08.1992. EP A 1593690, 09.11.2005. KANAKURA Y ET AL: "Identification of functionally distinct domains of human granulocyte-macrophage colony-stimulating factor using monoclonal antibodies." BLOOD. 1 MAR 1991, vol. 77, no. 5, 1 March 1991 (1991-03-01), pages 1033-1043, XP002412135 ISSN: 0006-4971. BEIBOER S H W ET AL: "Guided selection of a pan carcinoma specific antibody reveals similar binding characteristics yet structural divergence between the original murine antibody and its human equivalent" JOURNAL OF MOLECULAR BIOLOGY, LONDON, GB, vol. 296, no. 3, 25 February 2000 (2000-02-25), pages 833-849, XP004461580 ISSN: 0022-2836. VAN DIJK MARC A ET AL: "Human antibodies as next generation therapeutics" CURRENT OPINION IN CHEMICAL BIOLOGY, vol. 5, no. 4, August 2001 (2001-08), pages 368-374, XP002412136 ISSN: 1367-5931. EBERHARDT, M.O. ET AL.: "Identification of two potential receptor-binding sites for hGM-CSF." BRAZ. J. CHEM. ENG., [Online] vol. 20, no. 1, 2003, pages 15-20, XP002412137 ISSN: 0104-6632 Retrieved from the Internet: URL:http://www.scielo.br/scielo.php?script=sci_arttext 2 (19) 1 3 94403 4 9. Людське моноклональне антитіло або його фрагмент за будь-яким з попередніх пунктів, яке відрізняється тим, що вказане людське моноклональне антитіло або його фрагмент містить у варіабельній ділянці важкого ланцюга CDR3, що містить амінокислотну послідовність, вибрану з групи, що складається з послідовностей, наведених в будь-якій з SEQ ID NO: 1-13 або 56. 10. Людське моноклональне антитіло або його фрагмент за п. 9, яке відрізняється тим, що будьяка з вказаних послідовностей CDR3 варіабельної ділянки важкого ланцюга існує у варіабельній ділянці важкого ланцюга разом з послідовністю CDR1 варіабельної ділянки важкого ланцюга, наведеною в SEQ ID NO: 14, та послідовністю CDR2 варіабельної ділянки важкого ланцюга, наведеною в SEQ ID NO: 15. 11. Людське моноклональне антитіло або його фрагмент за п. 9 або 10, яке відрізняється тим, що вказане людське моноклональне антитіло або його фрагмент містить в у варіабельній ділянці легкого ланцюга CDR1, що містить амінокислотну послідовність, наведену SEQ ID NO: 16, CDR2, що містить амінокислотну послідовність, наведену в SEQ ID NO: 17, і CDR3, що містить амінокислотну послідовність, наведену в SEQ ID NO: 18. 12. Людське моноклональне антитіло або його фрагмент за п. 9 або 10, яке відрізняється тим, що вказане людське моноклональне антитіло або його фрагмент додатково містить у варіабельній ділянці легкого ланцюга амінокислотну послідовність, наведену в SEQ ID NO: 19, 54 або 55. 13. Людське моноклональне антитіло або його фрагмент за будь-яким з пп. 9-12, яке відрізняється тим, що вказане людське моноклональне антитіло або його фрагмент містить у варіабельній ділянці важкого ланцюга амінокислотну послідовність, наведену в будь-якій з SEQ ID NO: 20-33, 52 або 53. 14. Людське моноклональне антитіло або його фрагмент за будь-яким з попередніх пунктів, яке відрізняється тим, що містить у варіабельній ділянці легкого ланцюга CDR1, що містить амінокислотну послідовність, наведену в SEQ ID NO: 16, CDR2, що містить амінокислотну послідовність, наведену в SEQ ID NO: 17, і CDR3, що містить амінокислотну послідовність, наведену в SEQ ID NO: 18; та містить у варіабельній ділянці важкого ланцюга ділянку CDR1, що містить амінокислотну послідовність, наведену в SEQ ID NO: 14, ділянку CDR2, що містить амінокислотну послідовність, наведену в SEQ ID NO: 15, і CDR3, що містить амінокислотну послідовність, наведену в будь-якій з SEQ ID NO: 1-13 або 56. 15. Людське моноклональне антитіло за будь-яким з пунктів 9-14, яке відрізняється тим, що містить амінокислотну послідовність легкого ланцюга, на ведену в SEQ ID NO: 34, та амінокислотну послідовність важкого ланцюга, наведену в будь-якій з SEQ ID NО: 35-48. 16. Людське моноклональне антитіло або його фрагмент за будь-яким з пунктів 9-15, яке відрізняється тим, що вказане людське моноклональне антитіло або його фрагмент містить амінокислотну послідовність, яка демонструє як мінімум 70 % гомологію з відповідною амінокислотною послідовністю, наведеною в будь-якій з SEQ ID NO: 1-48 та/або 52-56. 17. Молекула полінуклеотиду, що кодує будь-яке антитіло за пп. 1-16. 18. Фармацевтична композиція, яка включає людське моноклональне антитіло або його фрагмент за будь-яким з пп. 1-16 або молекулу полінуклеотиду за п. 17. 19. Застосування людського моноклонального антитіла або його фрагмента за будь-яким з пп. 1-16 або молекули полінуклеотиду за п. 17 у виробництві лікарського засобу для лікування запальних захворювань, що необов'язково містить один або більше додаткових протизапальних агентів. 20. Застосування за п. 19, яке відрізняється тим, що вказані запальні захворювання вибрані з групи, що складається з ревматоїдного артриту (РА) (зокрема РА, стійкого до лікування нейтралізаторами пухлинного некротичного фактору [ТМР]-альфа), астми, розсіяного склерозу (PC), хронічного обструктивного захворювання легень (ХОЗЛ), синдрому гострої дихальної недостатності (ARDS), хвороби Крона, ідіопатичного фіброзу легень (ІФЛ), запального захворювання кишечнику (ЗЗК), увеїту, дегенерації жовтої плями, коліту, псоріазу, дегенерації Валлеріана, антифосфоліпідного синдрому (АФС), гострого коронарного синдрому, рестенозу, атеросклерозу, рецидивуючого поліхондриту (РП), гострого або хронічного гепатиту, безуспішної імплантації ортопедичних імплантатів, гломерулонефриту, вовчаку або аутоімунних розладів. 21. Застосування людського моноклонального антитіла або його фрагмента за будь-яким з пп. 1-16 або молекули полінуклеотиду за п. 17 у виробництві лікарського засобу для лікування пухлинного захворювання або іншого стану, який характеризується затримкою апоптозу клітин, збільшеним виживанням або проліферацією клітин, що необов'язково містить один або більше додаткових протиракових засобів. 22. Застосування за п. 21, яке відрізняється тим, що вказане пухлинне захворювання являє собою рак. 23. Застосування за п. 22, яке відрізняється тим, що вказаний рак являє собою лейкемію, множинну мієлому, карциному шлунка або карциному шкіри. Даний винахід стосується антитіл та їх фрагментів, які нейтралізують активність людського гранулоцитарно-моноцитарного колонієстимулю вального фактора (GM-CSF). Винахід додатково стосується фармацевтичних композицій, що містять вказані антитіла та їх фрагменти, а також за 5 стосування вказаних антитіл та їх фрагментів для одержання лікарських засобів для лікування різних станів. Описаний насамперед як потужний стимул росту і диференціації клітин-прекурсорів гранулоцитів і макрофагів in vitro, колонієстимулювальний фактор (GM-CSF) гранулоцитів-макрофагів є глікопротеїном розміром приблизно 23 кДа з чотирма альфа спіральними пучковими структурами, які зв'язуються з гетеродимерним рецептором, що складається з субодиниць, які належать до сімейства рецепторів цитокіну типу 1. Він стимулює дозрівання, поміж іншого, макрофагів, нейтрофілів, гранулоцитів, еозинофілів та дендритних клітин, що представляють антиген, з метою збільшення їх функціональної ємності в боротьбі з інфекціями. Генетичні експерименти з видалення, тобто експерименти, що роблять "мовчазним" або "нокаутують" цільовий ген, - в даному випадку GM-CSF - у мишей, показали, що GM-CSF є суттєвим для збереження функціональної активності деяких популяцій макрофагів, наприклад, таких, що приймають участь в очищенні легеневого сурфактанта та реагуванні на деякі види інфекцій або імунних реакцій. Хоча GM-CSF in vitro демонструє високий рівень стимулюючої активності по відношенню до клітин-прекурсорів нейтрофілів, еозинофілів, макрофагів та, меншою мірою, по відношенню до еритроїдних та мегакаріоцитних клітин, одержані на мишах з "нокаутованим" геном результати in vivo свідчать про те, що основна фізіологічна роль GMCSF полягає в підтримці або стимуляції функціональної активності зрілих макрофагів і гранулоцитів та стимуляції представлення антигену імунній системі. Останню функцію він здійснює шляхом безпосередньої дії на дендритну клітину і продукування макрофагів, а також шляхом збільшення експресії основного комплексу гістосумісності класу II та рецепторів Fc на макрофагах і дендритних клітинах. GM-CSF стимулює функціональну активність нейтрофілів, еозинофілів та моноцитарних макрофагів. Це включає підвищення хемотаксичної активності, збільшення експресії молекул, що відповідають за адгезію до клітин, збільшення адгезії до поверхонь та підвищення фагоцитарної активності, а також інгібування і затримку апоптозу зазначених клітин. Нейтрофіли представляють першу лінію захисту проти агресії. Програмовану загибель нейтрофілів затримують прозапальні стимули, в тому числі GM-CSF, з метою вчасного забезпечення відповідного усунення запалення в належному місці. GM-CSF також стимулює ємність вказаних клітин з точки зору опосередкування антитіло-залежної цитотоксичності клітини і здатності спричиняти загибель внутрішньоклітинних мікроорганізмів та здійснює "праймувальний" вплив на ці клітини з метою підсилення їх реакції на подальшу стимуляцію для окиснювального спалаху (продукування супероксид-аніону), дегрануляції та вивільнення протимікробних агентів, а також хемотаксису. Крім того, GM-CSF стимулює вивільнення вторинних цитокінів і посередників з цих клітин, зокрема IL-1, G-CSF, M-CSF та лейкотрієнів з ней 94403 6 трофілів, а також IL-1, пухлинного некротичного фактора (TNF), IL-6, G-CSF, M-CSF і простагландинів з макрофагів. З наведених вище даних зрозуміло, що GMCSF виконує ключову роль в активації і збереженні популяцій клітини, необхідної для захисту від інфекції. Однак, в деяких випадках активація цих популяцій клітин може бути небажаною. Наприклад, активація згаданих вище ліній диференціювання клітини за відсутності патогена в багатьох випадках призводить до гострих та/або хронічних запальних станів, які, в екстремальних випадках, можуть загрожувати життю. Так само, надмірна експресія GM-CSF може призводити до надмірної активації імунної системи, що призводить до запалення. В таких випадках може бути бажаним нейтралізувати активність GM-CSF таким чином, щоб усунути або як мінімум зменшити симптоми цих запальних станів. Приклади такої нейтралізуючої активності існують в рівні техніки. Наприклад, виявлено, що нейтралізуюче анти-GM-CSF антитіло сприяє збільшенню швидкості апоптозу еозинофілів в зразках периферичної крові (Kankaanranta et al. (2000) Journal of Allergy and Clinical Immunology 106, 7783). Оскільки збільшення виживання еозинофіл корелює з астмою, можна очікувати, що збільшення апоптозу еозинофілів буде пом'якшувати симптоми астми. При хронічних запальних захворюваннях, таких як астма, ревматоїдний артрит і множинний склероз, місцеві, а в деяких випадках системні рівні GM-CSF є збільшеними і корелюють із запальним процесом при цих захворюваннях. Таким чином, метою даного винаходу є удосконалення способів нейтралізації збільшеної та/або небажаної активності GM-CSF, відомих з рівня техніки. Відповідним чином, один аспект винаходу стосується людського моноклонального антитіла або його фрагменту, яке специфічно зв'язується і нейтралізує GM-CSF приматів. Термін "специфічно зв'язується" та подібні вирази, такі як "специфічне зв'язування", "засіб, що специфічно зв'язується" і т. п. в даному описі означають здатність людського моноклонального антитіла або його фрагмента до розрізнення поміж GM-CSF приматів і будь-якою кількістю інших потенційних антигенів, які відрізняються від GM-CSF приматів, до такої міри, що, з пулу множини різних антигенів як потенційних партнерів по зв'язуванню, відбувається зв'язування або значною мірою зв'язування тільки з GM-CSF приматів. В межах значення у відповідності до винаходу, "значне" зв'язування з GM-CSF приматів, коли з пулу різноманітних рівною мірою доступних антигенів, що є потенційними партнерами по зв'язуванню, зв'язування з GM-CSF приматів відбувається частіше як мінімум в 10 разів, переважно в 50 разів, найбільш переважно в 100 разів або більше (з точки зору кінетичних параметрів), в порівнянні з будь-яким іншим антигеном, ніж GM-CSF приматів. Такі вимірювання кінетичних параметрів можуть бути здійснені на приладі Віасоrе. В даному описі терміни "нейтралізація," "нейтралізатор", "нейтралізувати" і граматично пов'язані 7 з ними варіанти означають часткове або повне послаблення біологічної дії GM-CSF. Таке часткове або повне послаблення біологічної дії GM-CSF є результатом модифікації, переривання та/або припинення GM-CSF-опосередкованого перетворення сигналу, як доведено, наприклад, для внутрішньоклітинного проведення сигналу, клітинної проліферації або вивільнення розчинних субстанцій, регулювання вгору або вниз активації внутрішньоклітинного гена, наприклад, такого, що веде до експресії поверхневих рецепторів для інших лігандів, окрім GM-CSF. Як буде зрозуміло фахівцю в даній галузі, існують численні способи визначення того, чи агент, наприклад, цільове антитіло або його фрагмент, може бути класифікований як нейтралізатор. Наприклад, це може бути здійснене за допомогою стандартного випробування in vitro, яке загалом здійснюють, як вказано нижче. В першому експерименті з дослідження проліферації лінію клітин, ступінь проліферації якої залежить від активності GM-CSF, інкубують в серіях зразків з різними концентраціями GM-CSF, і далі вимірюють ступінь проліферації лінії після інкубації. За результатами даного вимірювання визначають концентрацію GM-CSF, яка дозволяє проліферацію клітин на рівні половини максимуму. Далі здійснюють другий експеримент з дослідження проліферації, використовуючи в кожній із серій зразків таку ж кількість клітин, яку використовували в першому експерименті з дослідження проліферації, визначену вище концентрацію GM-CSF і, в той же час, різні концентрації антитіла або його фрагмента, для якого припускається здатність нейтралізувати GM-CSF. Проліферацію клітини вимірюють знову, щоб визначити концентрацію антитіла або його фрагмента, достатню для здійснення інгібування росту на рівні половини максимуму. Якщо одержаний графік інгібування росту проти концентрації антитіла (або його фрагмента) має сигмовидну форму, що демонструє зменшення проліферації клітини із збільшенням концентрації антитіла (або його фрагмента), то певною мірою здійснюється антитіло-залежне інгібування росту, тобто активність GM-CSF до певної міри є нейтралізованою. В такому випадку антитіло або його фрагмент може бути таким, що вважається "нейтралізатором" в значенні за даним винаходом. Одним з прикладів клітинної лінії, ступінь проліферації якої залежить від активності GM-CSF, є лінія клітин TF-1, як описано в Kitamura, Т. et al. (1989). J Cell Physiol 140, 323-34. Як буде зрозуміло середньому фахівцю в даній галузі, ступінь клітинної проліферації не є єдиним параметром, за яким може бути встановлено об'єм нейтралізації. Наприклад, вимірювання рівня сигнальних молекул (таких як цитокіни), рівень секреції яких залежить від GM-CSF, може бути застосоване для ідентифікації потенційного GMCSF нейтралізатора. Інші приклади клітинних ліній, які можуть бути використані для визначення того, чи володіє цільове антитіло або його фрагмент нейтралізуючою активності GM-CSF приматів, включають GML-193 (Lange, В. et al. (1987). Blood 70, 192-9); GF-D8 (Rambaldi, A. et al. (1993). Blood 81, 1376 94403 8 83); GM/SO (Oez, S. et al. (1990). Experimental Hematology 18, 1108-11); MO7E (Avanzi, G. С et al. (1990). Journal of Cellular Physiology 145, 458-64); TALL-103 (Valtieri, M. et al. (1987). Journal of Immunology 138, 4042-50); UT-7 (Komatsu, N. et al. (1991). Cancer Research 51, 341-8). Людське антитіло або його фрагмент у відповідності до винаходу є моноклональним. В даному описі термін "моноклональний" слід розуміти у значенні, яке звичайно надається в даній галузі, тобто антитіло (або його відповідний фрагмент), що є результатом єдиного клону антитілопродукуючої клітини, такої як В-клітина, і розпізнає єдиний епітоп на антигені, з яким воно зв'язується. Особливо важко одержати людські антитіла, які є моноклональними. На протилежність злиття мишачих В-клітин з безсмертними лініями клітин, злиття людських В-клітин з безсмертними лініями клітин дає нежиттєздатний результат. Таким чином, людське моноклональне антитіло за винаходом є результатом подолання значних технічних бар'єрів, що є загальновизнаними в галузі технології антитіл. Моноклональна природа антитіла робить його особливо придатним для застосування в ролі терапевтичного агента, оскільки таке антитіло буде існувати як єдині, гомогенні молекулярні види, які можуть бути добре описані і відтворюваним чином виготовлені та очищені. Зазначені фактори ведуть до одержання продукту, біологічна активність якого може бути передбачена з високим рівнем точності, що є дуже важливим, якщо передбачена реєстрація такої молекули для терапевтичного введення людині. Особливо важливим є те, що моноклональне антитіло (або відповідний фрагмент) у відповідності до винаходу є людським антитілом (або відповідним фрагментом). У визначенні меж цільового агента-антитіла, призначеного для терапевтичного введення людині, високою мірою переважним є те, що дане антитіло має людське походження. Після введення пацієнту-людині людське антитіло або його фрагмент з високою ймовірністю не будуть спричиняти вираженої імуногенної реакції з боку імунної системи пацієнта, тобто не буде розпізнане як "чужорідний" або негуманоїдний білок. Це означає, що хазяїн, тобто пацієнт, не буде утворювати антитіла проти терапевтичного антитіла, які в протилежному випадку блокували б активність терапевтичного антитіла та/або прискорювали виведення терапевтичного антитіла з організму пацієнта, таким чином перешкоджаючи його бажаній терапевтичній дії. Термін "людське" антитіло в даному описі слід розуміти в значенні того, що антитіло за винаходом або його фрагмент, містить (а) амінокислотну(ні) послідовність(ості), що міститься(яться) в репертуарі антитіл зародкової лінії людини. Для цілей визначення в даному описі антитіло або його фрагмент, таким чином, може бути таким, що вважається людським, якщо воно складається з такої (а) амінокислотної(их) послідовності(ей) зародкової лінії людини, тобто якщо амінокислотна(ні) послідовність(ості) цільового антитіла або його фрагмента є ідентичною(ими) експресованій(им) амінокислотній(им) послідовності(ям) зародкової 9 лінії людини. Антитіло або його фрагмент також може розглядатися як людське, якщо воно складається з (а) послідовності(ей), яка(і) відрізняється(ються) від найближчої людської послідовності(ей) зародкової лінії не більше ніж очікується як відбиток соматичної гіпермутації. Додатково, антитіла багатьох негуманоїдних ссавців, наприклад, гризунів, таких як миші і щури, містять амінокислотні послідовності VH CDR3, існування яких також можна очікувати в експресованому репертуарі людського антитіла. Будь-яка така послідовність(ості) людського або негуманоїдного походження, існування якої можна очікувати в експресованому людському репертуарі, також вважалася б "людською" в межах даного винаходу. У відповідності до одного варіанту винаходу, GM-CSF приматів є людським (Homo sapiens) GMCSF або GM-CSF негуманоїдного примата. Особливо переважні варіанти GM-CSF негуманоїдних приматів включають GM-CSF гібона (Nomascus concolor, також відомого як західний чорний увінчаний гібон) та GM-CSF мавп сімейства макак, наприклад, макаки-резус (Масаса mulatto) і яванської макаки (Масаса fascicularis). У відповідності до даного варіанту винаходу, людське моноклональне антитіло або його фрагмент демонструє перехресну реактивність поміж людиною та як мінімум одним з видів мавп, наведених вище. Це є особливо переважним у випадку молекули антитіла, яка призначається для терапевтичного введення суб'єкту-людині, оскільки для такого антитіла звичайно будуть проведені численні випробування перед реєстрацією, причому випробування на ранніх стадіях проводять на видах негуманоїдних тварин. Загалом, за здійснення таких випробувань, бажано застосовувати в ролі негуманоїдних видів ті, які мають високий ступінь генетичної подібності до людини, оскільки одержані таким чином результати загалом будуть давати високій ступінь передбачуваності відповідності результатам, яких можна очікувати при введенні такої ж молекули людині. Однак, така потужність передбачування на базі тваринних випробувань, залежить, як мінімум частково, від порівнянності молекули, і є дуже високою у випадках, коли за рахунок перехресної реактивності між видами, одна й та сама терапевтична молекула може бути введена людині і експериментальним тваринам. Як в даному варіанті винаходу, де молекула антитіла володіє перехресною реактивністю по відношенню до такого ж антигену у людини, як і в іншому високою мірою спорідненому виді, випробування може бути здійснене із застосуванням однієї і тієї ж молекули антитіла у людини та в даному високою мірою спорідненому виді, наприклад, в одному з наведених вище видів мавп. Це збільшує як безпосередню ефективність випробувань, так і потужність передбачування, яку забезпечують такі випробування, щодо поведінки зазначених антитіл в організмі людини, що є кінцевою метою з терапевтичної точки зору. У відповідності до іншого варіанту винаходу, людське моноклональне антитіло може бути IgG антитілом. Як добре відомо в даній галузі, IgG містить не тільки варіабельні ділянки антитіла, відпо 94403 10 відальні за високу ефективність розрізняльного розпізнавання антигену і зв'язування, але також постійні ділянки важких і легких поліпептидних ланцюгів антитіла, які в нормі присутні в ендогенних антитілах і, в деяких випадках, навіть містять в одному або більше сайтів вуглеводнів. Таке глікозилювання загалом являє собою відрізняльну ознаку формату IgG, і частини таких постійних ділянок складають так звану ділянку Fc повного антитіла, яка здійснює різноманітні ефекторні функції in vivo. Крім того, ділянка Fc опосередковує зв'язування IgG з рецептором Fc, таким чином, подовжуючи період напіввиведення in vivo, a також полегшуючи хомінг IgG до місць із збільшеною присутністю рецепторів Fc - наприклад, запаленої тканини. Переважно, антитіло IgG являє собою антитіло IgG1 або антитіло IgG4, тобто форматів, які є переважними, оскільки їх механізм дії in vivo особливо добре зрозумілий та описаний. Це є особливо справедливим у випадку антитіл IgG1. У відповідності до іншого варіанту винаходу фрагмент людського моноклонального антитіла може являти собою scFv, однодоменне антитіло, Fv, антитіло VHH, димерне антитіло, тандемне димерне антитіло, Fab, Fab' або F(ab)2. Ці формати загалом можна розділити на два підкласи, а саме такі, які складаються з одинарного поліпептидного ланцюга, і такі, що містять як мінімум два поліпептидні ланцюги. Члени першого підкласу включають scFv (містить одну ділянку VH і одну ділянку VL, з'єднані в єдиний поліпептидний ланцюг за допомогою поліпептидного лінкера); однодоменне антитіло (містить одну варіабельну ділянку антитіла), таке як антитіло VHH (містить одну ділянку VH). Члени останнього підкласу включають Fv (містить одну ділянку VH і одну ділянку VL як окремі поліпептидні ланцюги, що нековалентним чином зв'язані один з одним); димерне антитіло (містить два нековалентним чином зв'язані поліпептидні ланцюги, кожен з яких містить дві варіабельні ділянки антитіла - в нормі один VH і один VL на поліпептидний ланцюг - два поліпептидні ланцюги, розташовані у вигляді конформації "головадо-хвоста" таким чином, що утворюється двовалентна молекула антитіла); димерне тандемне антитіло (одноланцюгові антитіла Fv з подвійною специфічністю, що містять чотири ковалентно зв'язані варіабельні ділянки імуноглобуліну - VH і VL - ділянки двох різних специфічностей, що утворюють гомодимер, що є вдвічі більшим за описане вище димерне антитіло); Fab (містить в ролі одного поліпептидного ланцюга повний легкий ланцюг антитіла, що безпосередньо містить ділянку VL і повну постійну ділянку легкого ланцюга та, в ролі іншого поліпептидного ланцюга, частину важкого ланцюга антитіла, що містить повну ділянку VH і частину постійної ділянки важкого ланцюга, причому два вказаних поліпептидних ланцюги з'єднані між собою за допомогою міжмолекулярного дисульфідного зв'язку); Fab' (як Fab, вище, за винятком додаткового зменшення дисульфідних зв'язків, що містяться на важкому ланцюгу антитіла); і F(ab)2 (містить дві молекули Fab', причому кожна з молекул Fab' зв'язана з відповідною іншою молекулою Fab' за допомогою міжланцюгових дисульфідних 11 зв'язків). Загалом, фрагменти антитіла описаного вище типу дозволяють досягти значної гнучкості з точки зору пристосування, наприклад, щодо фармакокінетичних властивостей бажаного антитіла для терапевтичного введення за конкретними покзааннями. Наприклад, може бути бажаним зменшити розмір антитіла для введення з метою збільшення ступеню проникнення в тканини при лікуванні тканин із слабкою васкуляризацією (наприклад, суглобів). За деяких обставин також може бути бажаним збільшити швидкість, з якою терапевтичне антитіло виводиться з організму, причому вказана швидкість загалом може бути прискорена шляхом зменшення розміру антитіла, яке вводять. У відповідності до іншого варіанту винаходу вказане людське моноклональне антитіло або його фрагмент може існувати у формі одновалентного моноспецифічного; полівалентного моноспецифічного, зокрема двовалентного моноспецифічного; або полівалентного поліспецифічноого, зокрема двовалентного біспецифічного. Загалом, полівалентне моноспецифічне, зокрема, двовалентне моноспецифічне антитіло, таке як повний людський IgG, як описано вище, може забезпечити терапевтичну перевагу в тому, що нейтралізація, здійснювана таким антитілом, потенціюється ефектами авідності, тобто зв'язування одного й того ж антитіла з численними молекулами одного й того ж антигену, в даному випадку GM-CSF приматів. Вище описані декілька одновалентних моноспецифічних форм фрагментів антитіла за винаходом (наприклад, scFv, Fv, VHH або однодоменне антитіло). Полівалентні поліспецифічні, зокрема двовалентні біспецифічні форми людського моноклонального "анти-GM-CSF приматів" антитіла за винаходом, можуть включати повний IgG, в якому одне плече зв'язування зв'язується з GM-CSF приматів, тоді як інше плече зв'язування зв'язується з іншим антигеном, відмінним від GM-CSF приматів. Інша полівалентна поліспецифічна, зокрема, двовалентна біспецифічна форма переважно може являти собою людське одноланцюгове біспецифічне антитіло, тобто рекомбінантний конструкт людського антитіла, що містить два об'єкти scFv, як викладено вище, з'єднані в безперервний поліпептидний ланцюг за допомогою короткого проміжку поліпептидного спейсера, як загальновідомо в даній галузі (див., наприклад, WO 99/54440 щодо анти-CD19 × антиСD3 біспецифічного одноланцюгового антитіла). В такому випадку одна scFv частина одноланцюгового біспецифічного антитіла, що міститься в межах одноланцюгового біспецифічного антитіла, буде специфічно зв'язуватися з GM-CSF приматів, як вказано вище, тоді як відповідна інша частина scFv даного одноланцюгового біспецифічного антитіла буде зв'язуватися з іншим антигеном, визначеним як переважна терапевтична мішень. У відповідності до іншого варіанту людське моноклональне антитіло або його фрагмент може бути дериватизованим, наприклад, з використанням органічного полімеру, наприклад однієї або більше молекул поліетиленгліколю ("ПЕГ") та/або полівінілпіролідону ("ПВП"). Як відомо в даній га 94403 12 лузі, така дериватизація може бути переважною з точки зору модуляції фармакодинамічних властивостей антитіл або їх фрагментів. Особливо переважними є дериватизовані молекули ПЕГ, такі як ПЕГ-малеїнімід, які дозволяють кон'югацію з антитілом або його фрагментом в сайт-специфічній формі за допомогою сульфгідрильної групи амінокислоти цистеїну. З їх числа особливо переважним є ПЕГ-малеїнімід 20 кДа та/або 40 кДа, в розгалуженій або нерозгалуженій формі. Це може бути особливо переважним з точки зору збільшення ефективної молекулярної маси менших за розмірами фрагментів людського антитіла проти GMCSF приматів, таких як фрагменти scFv, шляхом сполучення останнього з однією або більше молекул ПЕГ, особливо ПЕГ-малеїнімідом. У відповідності до іншого варіанту винаходу, людське моноклональне антитіло або його фрагмент специфічно зв'язується з епітопом, зокрема, з переривчастим епітопом GM-CSF людини або негуманоїдного примату, що включає амінокислоти 23-27 (RRLLN) та/або амінокислоти 65-77 (GLR/QGSLTKLKGPL). Варіабельність в положенні 67 в амінокислотної послідовності 65-77, що зображена вище, відображає гетерогенність в даній частині GM-CSF приматів між, з одного боку, GM-CSF людини та гібону (де положенню 67 відповідає R), та, з іншого боку, GM-GSF мавп сімейства макак, наприклад, яванської макаки та макаки-резус (де положенню 67 відповідає Q). В даному описі нумерація GM-CSF людини та негуманоїдних приматів посилається на нумерацію зрілого GM-CSF, тобто GM-CSF без його сигнальної послідовності довжиною 17 амінокислот (повна довжина описаного вище зрілого GM-CSF як у людини, так і у гуманоїдних приматів становить 127 амінокислот). Послідовність GM-CSF людини та GM-CSF гібона є такою, як показано нижче: APARSPSPST QPWEHVNAIQ EARRLLNLSR DTAAEMNETV EVISEMFDLQ EPTCLQTRLE LYKQGLRGSL TKLKGPLTMM ASHYKQHCPP TPETSCATQI ITFESFKENL KDFLLVIPFD CWEPVQE Послідовність GM-CSF у деяких членів сімейства макак, наприклад, таких як макака-резус і яванська макака, є такою, як показано нижче: APARSPSPGT QPWEHVNAIQ EARRLLNLSR DTAAEMNKTV EVVSEMFDLQ EPSCLQTRLE LYKQGLQGSL TKLKGPLTMM ASHYKQHCPP TPETSCATQI ITFQSFKENL KDFLLVIPFD CWEPVQE Мінімальний епітоп, переважно переривчастий епітоп, з яким зв'язується людське моноклональне антитіло за винаходом (або його фрагмент), як викладено вище, показаний в наведеній вище послідовності GM-CSF напівжирним шрифтом. В даному описі термін "переривчастий епітоп" слід розуміти як мінімум дві не суміжні амінокислотні послідовності в межах даного поліпептидного ланцюга, в даному випадку зрілого GM-CSF людини і негуманоїдних приматів, з якими одночасно і специфічно (як визначено вище) зв'язується антитіло. У відповідності до даного визначення таке одночасне специфічне зв'язування може стосуватися GM 13 CSF поліпептиду в лінійній формі. В даному випадку можна уявити зрілий GM-CSF поліпептид, що утворює розширену петлю, в одній ділянці якої розташовані дві послідовності, показані напівжирним шрифтом вище, наприклад, більш-менш паралельно та поблизу одна одної. В такому стані вони специфічно і одночасно зв'язуються з фрагментом антитіла за винаходом. У відповідності до даного визначення, одночасне специфічне зв'язування двох ділянок послідовності зрілого GM-CSF, показаних вище, також може набувати форми зв'язування антитіла з конформаційним епітопом. В такому випадку зрілий GM-CSF вже утворив третинну конформацію, в якій він звичайно існує in vivo (Sun, Η. W., J. Bernhagen, et al. (1996). Proc Natl Acad Sci USA 93, 5191-6). В такій третинній конформації поліпептидний ланцюг зрілого GMCSF згорнутий таким чином, що показані вище дві ділянки послідовності знаходяться в просторовій близькості, наприклад, на зовнішній поверхні конкретної ділянки зрілого, згорнутого GM-CSF, де вони розпізнаються за їх тривимірною конформацією в контексті навколишніх поліпептидних послідовностей. В переважному варіанті вказаний вище (переривчастий) епітоп додатково містить амінокислоти 28-31 (LSRD), виділені курсивом в наведених вище послідовностях GM-CSF людини і негуманоїдних приматів. В особливо переважному варіанті будьякий з наведених вище (переривчастих) епітопів додатково містить амінокислоти 32-33 (ТА) та/або амінокислоти 21-22 (ЕА), причому кожен з цих фрагментів секвенування підкреслений в наведених вище послідовностях GM-CSF людини і негуманоїдних приматів. У відповідності до іншого варіанту винаходу людське моноклональне антитіло або його фрагмент містить у варіабельній ділянці важкого ланцюга CDR3, що містить амінокислотну послідовність, вибрану з групи, що складається з наведених в будь-якій з SEQ ID NO: 1-13 або 56. Переважним є людське моноклональне антитіло або його фрагмент, що містить послідовність варіабельної ділянки CDR1 важкого ланцюга, наведену в SEQ ID NO: 14; послідовність варіабельної ділянки CDR2 важкого ланцюга, наведену в SEQ ID NO: 15 і послідовність варіабельної ділянки CDR3 важкого ланцюга, наведену в SEQ ID NO: 1; або містить послідовність варіабельної ділянки CDR1 важкого ланцюга, наведену в SEQ ID NO: 14, послідовність варіабельної ділянки CDR2 важкого ланцюга, наведену в SEQ ID NO: 15, і послідовність варіабельної ділянки CDR3 важкого ланцюга, наведену в SEQ ID NO: 2; або містить послідовність варіабельної ділянки CDR1 важкого ланцюга, наведену в SEQ ID NO: 14, послідовність варіабельної ділянки CDR2 важкого ланцюга, наведену в SEQ ID NO: 15, і послідовність варіабельної ділянки CDR3 важкого ланцюга, наведену в SEQ ID NO: 3; або містить послідовність варіабельної ділянки CDR1 важкого ланцюга, наведену в SEQ ID NO: 14, послідовність варіабельної ділянки CDR2 важкого ланцюга, наведену в SEQ ID NO: 15, і послідовність варіабельної ділянки CDR3 важкого ланцюга, наведену в SEQ ID NO: 4; або 94403 14 містить послідовність варіабельної ділянки CDR1 важкого ланцюга, наведену в SEQ ID NO: 14, послідовність варіабельної ділянки CDR2 важкого ланцюга, наведену в SEQ ID NO: 15 і послідовність варіабельної ділянки CDR3 важкого ланцюга, наведену в SEQ ID NO: 5; або містить послідовність варіабельної ділянки CDR1 важкого ланцюга, наведену в SEQ ID NO: 14, послідовність варіабельної ділянки CDR2 важкого ланцюга, наведену в SEQ ID NO: 15, і послідовність варіабельної ділянки CDR3 важкого ланцюга, наведену в SEQ ID NO: 6; або містить послідовність варіабельної ділянки CDR1 важкого ланцюга, наведену в SEQ ID NO: 14, послідовність варіабельної ділянки CDR2 важкого ланцюга, наведену в SEQ ID NO: 15, і послідовність варіабельної ділянки CDR3 важкого ланцюга, наведену в SEQ ID NO: 7; або містить послідовність варіабельної ділянки CDR1 важкого ланцюга, наведену в SEQ ID NO: 14, послідовність варіабельної ділянки CDR2 важкого ланцюга, наведену в SEQ ID NO: 15, і послідовність варіабельної ділянки CDR3 важкого ланцюга, наведену в SEQ ID NO: 8; або містить послідовність варіабельної ділянки CDR1 важкого ланцюга, наведену в SEQ ID NO: 14, послідовність варіабельної ділянки CDR2 важкого ланцюга, наведену в SEQ ID NO: 15, і послідовність варіабельної ділянки CDR3 важкого ланцюга, наведену в SEQ ID NO: 9; або містить послідовність варіабельної ділянки CDR1 важкого ланцюга, наведену в SEQ ID NO: 14, послідовність варіабельної ділянки CDR2 важкого ланцюга, наведену в SEQ ID NO: 15, і послідовність варіабельної ділянки CDR3 важкого ланцюга, наведену в SEQ ID NO: 10; або містить послідовність варіабельної ділянки CDR1 важкого ланцюга, наведену в SEQ ID NO: 14, послідовність варіабельної ділянки CDR2 важкого ланцюга, наведену в SEQ ID NO: 15, і послідовність варіабельної ділянки CDR3 важкого ланцюга, наведену в SEQ ID NO: 11; або містить послідовність варіабельної ділянки CDR1 важкого ланцюга, наведену в SEQ ID NO: 14, послідовність варіабельної ділянки CDR2 важкого ланцюга, наведену в SEQ ID NO: 15, і послідовність варіабельної ділянки CDR3 важкого ланцюга, наведену в SEQ ID NO: 12; або містить послідовність варіабельної ділянки CDR1 важкого ланцюга, наведену в SEQ ID NO: 14, послідовність варіабельної ділянки CDR2 важкого ланцюга, наведену в SEQ ID NO: 15, і послідовність варіабельної ділянки CDR3 важкого ланцюга, наведену в SEQ ID NO: 13; або містить послідовність варіабельної ділянки CDR1 важкого ланцюга, наведену в SEQ ID NO: 14, послідовність варіабельної ділянки CDR2 важкого ланцюга, наведену в SEQ ID NO: 15, і послідовність варіабельної ділянки CDR3 важкого ланцюга, наведену в SEQ ID NO: 56. Ще більш переважно, будь-яка із наведених вище 14 комбінацій послідовностей CDR1, CDR2 і CDR3 існує в людському моноклональному антитілі або його фрагменті, що додатково містить у варіабельній ділянці легкого ланцюга CDR1, що містить амінокислотну послідовність, наведену в SEQ ID NO: 16, CDR2, що містить амінокислотну послідовність, наведену в SEQ ID NO: 17, і CDR3, що 15 містить амінокислотну послідовність, наведену в SEQIDNO: 18. У відповідності до іншого варіанту, людське моноклональне антитіло за винаходом або його фрагмент містить у варіабельній ділянці легкого ланцюга амінокислотну послідовність, наведену в SEQ ID NO. 19. Переважним є людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 19, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 20; або людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 19, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 21; або людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 19, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 22; або людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 19, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 23; або людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 19, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 24; або людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 19, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 25; або людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 19, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 26; або людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 19, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 27; або людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 19, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 28; або людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 19, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 29; або людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 19, і варіа 94403 16 бельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 30; або людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 19, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 31; або людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 19, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 32; або людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 19, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 33; або людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 19, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 52; або людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 19, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 53. У відповідності до іншого варіанту, людське моноклональне антитіло за винаходом або його фрагмент містить у варіабельній ділянці легкого ланцюга амінокислотну послідовність, наведену в SEQ ID NO. 54. Переважним є людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 54, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 20; або людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 54, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 21; або людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 54, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 22; або людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 54, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 23; або людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 54, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 24; або людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену 17 в SEQ ID NO. 54, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 25; або людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 54, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 26; або людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 54, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 27; або людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 54, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 28; або людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 54, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 29; або людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 54, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 30; або людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 54, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 31; або людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 54, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 32; або людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 54, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 33; або людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 54, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 52; або людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 54, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 53. У відповідності до іншого варіанту, людське моноклональне антитіло за винаходом або його фрагмент містить у варіабельній ділянці легкого ланцюга амінокислотну послідовність, наведену в SEQ ID NO. 55. Переважним є людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну 94403 18 послідовність, наведену в SEQ ID NO. 55, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 20; або людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 55, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 21; або людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 55, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 22; або людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 55, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 23; або людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 55, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 24; або людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 55, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 25; або людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 55, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 26; або людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 55, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 27; або людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 55, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 28; або людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 55, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 29; або людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 55, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 30; або людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 55, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 31; або людське моноклональне антитіло або його фрагмент, де варіабельна 19 ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 55, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 32; або людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 55, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 33; або людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 55, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 52; або людське моноклональне антитіло або його фрагмент, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO. 55, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO: 53. В переважному варіанті пропонується людське моноклональне антитіло або його фрагмент, що містить у варіабельній ділянці легкого ланцюга ділянку CDR1, що містить амінокислотну послідовність, наведену в SEQ ID NO. 16, ділянку CDR2, що містить амінокислотну послідовність, наведену в SEQ ID NO. 17 і ділянку CDR3, що містить амінокислотну послідовність, наведену в SEQ ID NO. 18, та містить у варіабельній ділянці важкого ланцюга ділянку CDR1, що містить амінокислотну послідовність, наведену в SEQ ID NO. 14, ділянку CDR2, що містить амінокислотну послідовність, наведену в SEQ ID NO. 15 та ділянку CDR3, що містить амінокислотну послідовність, наведену в будь-якій з SEQ ID NO. 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11,12, 13 або 56. В іншому переважному варіанті людське моноклональне антитіло містить в легкому ланцюгу амінокислотну послідовність, наведену в SEQ ID NO: 34, та містить у важкому ланцюгу амінокислотну послідовність, наведену в SEQ ID NO: 35; або містить в легкому ланцюгу амінокислотну послідовність, наведену в SEQ ID NO: 34, та містить у важкому ланцюгу амінокислотну послідовність, наведену в SEQ ID NO: 36; або містить в легкому ланцюгу амінокислотну послідовність, наведену в SEQ ID NO: 34, та містить у важкому ланцюгу амінокислотну послідовність, наведену в SEQ ID NO: 37; або містить в легкому ланцюгу амінокислотну послідовність, наведену в SEQ ID NO: 34, та містить у важкому ланцюгу амінокислотну послідовність, наведену в SEQ ID NO: 38; або містить в легкому ланцюгу амінокислотну послідовність, наведену в SEQ ID NO: 34, та містить у важкому ланцюгу амінокислотну послідовність, наведену в SEQ ID NO: 39; або містить в легкому ланцюгу амінокислотну послідовність, наведену в SEQ ID NO: 34, та містить у важкому ланцюгу амінокислотну послідовність, наведену в SEQ ID NO: 40; або містить в легкому ланцюгу амінокислотну послідовність, наведену в SEQ ID NO: 34, та містить у важкому ланцюгу амінокислотну послідовність, наведену в SEQ ID NO: 41; або містить в легкому ланцюгу амінокислотну послідовність, наведену в 94403 20 SEQ ID NO: 34, та містить у важкому ланцюгу амінокислотну послідовність, наведену в SEQ ID NO: 42; або містить в легкому ланцюгу амінокислотну послідовність, наведену в SEQ ID NO: 34, та містить у важкому ланцюгу амінокислотну послідовність, наведену в SEQ ID NO: 43; або містить в легкому ланцюгу амінокислотну послідовність, наведену в SEQ ID NO: 34, та містить у важкому ланцюгу амінокислотну послідовність, наведену в SEQ ID NO: 44; або містить в легкому ланцюгу амінокислотну послідовність, наведену в SEQ ID NO: 34, та містить у важкому ланцюгу амінокислотну послідовність, наведену в SEQ ID NO: 45; або містить в легкому ланцюгу амінокислотну послідовність, наведену в SEQ ID NO: 34, та містить у важкому ланцюгу амінокислотну послідовність, наведену в SEQ ID NO: 46; або містить в легкому ланцюгу амінокислотну послідовність, наведену в SEQ ID NO: 34, та містить у важкому ланцюгу амінокислотну послідовність, наведену в SEQ ID NO: 47; або містить в легкому ланцюгу амінокислотну послідовність, наведену в SEQ ID NO: 34, та містить у важкому ланцюгу амінокислотну послідовність, наведену в SEQ ID NO: 48. В наведених вище переважних варіантах пропонуються молекули людських моноклональних антитіл та/або їх фрагментів, що є особливо переважними як нейтралізатори активності GM-CSF приматів, особливо людини. Людські моноклональні антитіла або їх фрагменти у відповідності до вказаних особливо переважним варіантів є у високій мірі переважними з декількох причин. По-перше, вони розпізнають GM-CSF приматів високо специфічним чином, тобто, можна сказати, що з суміші GM-CSF приматів з іншими колонієстимулювальними факторами приматів (наприклад G-CSF і M-CSF приматів), молекули для зв'язування у відповідності до даних особливо переважних варіантів високою мірою розрізняють GM-CSF приматів, тоді як інші колонієстимулювальні фактори в тому ж навколишньому середовищі, не розпізнаються. Це означає, що можна очікувати, що людське моноклональне антитіло або його фрагмент у відповідності до цих варіантів при введенні людині буде специфічно зв'язуватися і нейтралізувати тільки цільову мішень, тоді як по відношенню до інших небажаних мішеней не буде відбуватися ні зв'язування, ані нейтралізації. Кінець кінцем, це приводить до вищого ступеня передбачуваності з точки зору терапевтичного способу дії in vivo. По-друге, засоби для зв'язування у відповідності до зазначених особливо переважних варіантів зв'язуються з GM-CSF приматів з надзвичайно високою спорідненістю. Для молекул даного класу спостерігаються значення KD від приблизно -9 -9 4×10 М і нижче, приблизно до 0,04×10 М, причому останнє відповідає приблизно 40 пМ. Оскільки кінетична швидкість асоціації таких молекул у водних середовищах в значній мірі контролюється дифузією, і, таким чином, не може бути покращена поза межами, які дозволяють місцеві умови дифузії за фізіологічних умов, низькі значення KD виникають, перш за все, в результаті кінетичної швидкості дисоціації, koff, яка для найвищої спорідненості антитіла для зв'язування становить 21 -5 -1 приблизно 10 с . Це означає, що, як тільки утворюється комплекс між людським моноклональним антитілом або його фрагментом у відповідності до будь-якого з наведених варіантів за винаходом, з одного боку, і GM-CSF приматів, з іншого боку, він дисоціює досить важко або щонайменше повільно. У випадку молекул для зв'язування, призначених для застосування в ролі нейтралізаторів біологічної активності, такі характеристики є у високій мірі переважними, оскільки цільова нейтралізуюча дія звичайно буде тривати тільки до тих пір, поки молекула, біологічна активність якої повинна бути нейтралізована (в даному випадку GM-CSF приматів) залишається зв'язаною з нейтралізуючою молекулою для зв'язування. Отже, нейтралізуюча молекула, яка зберігає зв'язування з передбаченою мішенню протягом тривалого часу, буде здійснювати свою нейтралізуючу дію протягом відповідним чином тривалого часу. Висока спорідненість зв'язування людських моноклональних антитіл або їх фрагментів з GMCSF приматів надає додаткову перевагу. В нормі, антитіла або їх фрагменти будуть виведені з кровотіку пацієнта залежним від розміру чином, причому екскреція та елімінація молекул меншого розміру здійснюється швидше, ніж більшого. Оскільки комплекс двох поліпептидів - антитіла або фрагменту антитіла і зв'язаного GM-CSF - очевидно є більшим, ніж антитіло окремо, згадане вище низьке значення koff означає, що екскреція та елімінація терапевтичного нейтралізатора з організму пацієнта відбувається повільніше, ніж у випадку, коли антитіло або його фрагмент не зв'язане з GM-CSF. Таким чином, збільшується не тільки активність нейтралізації in vivo, але і її тривалість. Кінець кінцем, визначена для засобів для зв'язування у відповідності до зазначених особливо переважних варіантів активність нейтралізації є несподівано високою. Як буде описано більш детально нижче, нейтралізуючу активність вимірювали in vitro з використанням аналізу інгібування росту TF-1 (Kitamura, Т. et al. (1989). J Cell Physiol 140, 323-34). Як показник потенціалу нейтралізації, вимірювали значення ІС5о, причому ІС5о представляє концентрацію людського моноклонального антитіла або його фрагмента у відповідності до будь-якого з наведених варіантів за винаходом, повинен спричиняти інгібування проліферації клітин TF-1 на рівні половини від максимального. Для людських моноклональних антитіл або їх фрагментів у відповідності до будь-якого з вказаних варіантів за винаходом було визначено значення ІС50 -10 приблизно 3×10 М або приблизно 0,3 нМ. Таким чином, молекули для зв'язування у відповідності до будь-якого із зазначених варіантів за винаходом володіють потужною нейтралізуючою активністю по відношенню до GM-CSF приматів. Якщо коротко, людське моноклональне антитіло або його фрагмент у відповідності до будьякого з наведених вище варіантів за винаходом демонструє більш високий ступінь розрізнення по відношенню до цільового антигену, надзвичайно міцно і на тривалий час зв'язується з даним антигеном та демонструє високо потужну нейтралізуючу активність протягом тривалого часу, поки збері 94403 22 гається зв'язування. В той же час, тривала стійкість комплексу "антиген-засіб для зв'язування" уповільнює елімінацію даного засобу для зв'язування з організму, таким чином, подовжуючи тривалість бажаного терапевтичного впливу in vivo. В іншому аспекті винаходу пропонується людське моноклональне антитіло або його фрагмент, який містить амінокислотну послідовність, що має як мінімум 70 % гомологію з амінокислотною послідовністю, наведеною в будь-якій з SEQ ID NO: 148 та/або 52-56. Гомологія може бути визначена за стандартними програмами вирівнювання послідовностей, такими як Vector NTI (InforMax™, Maryland, США). Такі програми порівнюють вирівняні послідовності на базі "амінокислота за амінокислотою", і можуть бути встановлені різні рівні суворості для порівняння (наприклад, ідентична амінокислота, консервативна заміна амінокислоти і т. п.). В даному описі дві цільові амінокислоти розглядаються як такі, що виступають "консервативними замінами" одна одної, якщо вони обидві належать до одного і того ж хімічного класу, тобто, кислі, неполярні, полярні незаряджені та основні. Як необмежуючий приклад, дві різні амінокислоти, що належать до класу неполярних амінокислот, вважалися "консервативними замінами" одна одної, навіть якщо ці дві амінокислоти не були ідентичними, тоді як неполярна амінокислота з одного боку та основна амінокислота з іншого не можуть вважатися "консервативними замінами" одна одth ної. Панель 3.1 "Molecular Biology of the Cell", 4 Edition (2002), by Alberts, Johnson, Lewis, Raff, Roberts and Walter поділяє амінокислоти на чотири основні групи: кислотні, неполярні, незаряджені полярні та основні. Таке групування може бути використане для цілей визначення за винаходом того, чи являє собою конкретна амінокислота консервативну заміну для іншої цільової амінокислоти. В іншому аспекті винаходу пропонується молекула полінуклеотиду, що містить нуклеотидну послідовність, яка кодує амінокислотну послідовність, наведену в будь-якій з SEQ ID NO: 1-48 та/або 52-56, або нуклеотидну послідовність, що демонструє як мінімум 70 % гомологію з нею, де гомологія може бути визначена шляхом порівняння нуклеотидної послідовності, яка кодує амінокислотну послідовність у відповідності до будь-якої з SEQ ID NO: 1-48 та/або 52-56, з цільовою нуклеотидною послідовністю шляхом вирівнювання послідовності (як викладено вище для амінокислотних послідовностей), причому цільова нуклеотидна послідовність вважається гомологічною, якщо вона є ідентичною відповідному нуклеотиду в нуклеотидній послідовності, що кодує відповідну амінокислотну послідовність у відповідності до будь-якої з SEQ ID NO: 1-48 та/або 52-56, або якщо існує відмінність одного або більше нуклеотидів в цільовій послідовності від відповідного одного або більше нуклеотид(ів) в нуклеотидній послідовності, яка кодує амінокислотну послідовність у відповідності до будь-якої з SEQ ID NO: 1-48 та/або 52-56, результатом чого є нуклеотидний триплет, який при трансляції дає амінокислоту, що є ідентичною (за рахунок виродження триплету) або являє собою 23 консервативну заміну відповідної амінокислоти у відповідній амінокислотній послідовності будь-якої з SEQ ID NO: 1-48 та/або 52-56. В такому випадку термін "консервативна заміна" слід розуміти в значенні, наведеному вище. В іншому аспекті винаходу пропонується фармацевтична композиція, що містить людське моноклональне антитіло або його фрагмент або молекулу полінуклеотиду, що містить нуклеотидну послідовність, яка кодує амінокислотну послідовність, наведену в будь-якій з SEQ ID NO: 1-48 та/або 52-56, або кодує амінокислотну послідовність, що містить амінокислотну послідовність, яка демонструє як мінімум 70 % гомологію до будьякої з SEQ ID NO: 1-48 та/або 52-56, де термін "гомологія" слід розуміти, як пояснено вище. У відповідності до винаходу термін "фармацевтична композиція" стосується композиції для введення пацієнту, переважно пацієнту-людині. В переважному варіанті, фармацевтична композиція включає композицію для парентерального, трансдермального, інтралюмінального, внутрішньоартеріального, інтратекального та/або інтраназального введення або введення безпосередньою ін'єкцією в тканину. Зокрема, передбачається, що вказану фармацевтичну композицію вводять пацієнту шляхом інфузії або ін'єкції. Введення придатних композицій може здійснюватися різними способами, наприклад, внутрішньовенним, внутрішньо черевинним, підшкірним, внутрішньо м'язовим, місцево або внутрішньо шкірно. Фармацевтична композиція за даним винаходом може додатково включати фармацевтично прийнятний носій. Приклади придатних фармацевтичних носіїв добре відомі в даній галузі та включають буферизовані фосфатом сольові розчини, воду, емульсії, такі як емульсії масло-у-воді, різноманітні зволожувальні засоби, стерильні розчини, ліпосоми і т. п. Композиції, що містять такі носії, можуть бути введені в лікарські форми добре відомими традиційними способами. Такі фармацевтичні композиції можна вводити суб'єкту в придатній дозі. Схема лікування буде визначена лікуючим лікарем і клінічними обставинами. Як добре відомо в медичній галузі, дози для будь-якого пацієнта залежать від багатьох факторів, зокрема, розмірів пацієнта, площі поверхні тіла, віку, конкретної сполуки для введення, статі, часу і способу введення, загального стану здоров'я та супутнього введення інших лікарських засобів. Препарати для парентерального введення включають стерильні водні або неводні розчини, суспензії та емульсії. Прикладами неводних розчинників є пропіленгліколь, поліетиленгліколь, масла, такі як оливкова олія, а також ін'єкційні органічні ефіри, такі як етилолеат. Водні носії включають воду, спиртові/водні розчини, емульсії або суспензії, зокрема сольові розчини та буферизовані середовища. Розчинники для парентерального введення включають розчин натрію хлориду, розчин Рингера з глюкозою, розчин глюкози і натрію хлориду, розчин Рингера з лактатом або нелеткі масла. Розчинник для внутрішньовенного введення включає засоби для відновлення рідини та поживних речовин, засоби для відновлення електролітів (такі як розчин Рингера з глюкозою) і 94403 24 т. п. Також можуть бути присутні консерванти та інші добавки, наприклад, протимікробні засоби, антиоксиданти, хелатні агенти, інертні гази і т. п. Крім того, фармацевтична композиція за даним винаходом може включати білкові носіїв, наприклад, альбумін сироватки або імуноглобулін, переважно людського походження. Передбачається, що фармацевтична композиція за винаходом, може містити, на додаток до людського моноклонального антитіла або його фрагменту (як описано в даному винаході), інші біологічно активні агенти, в залежності від передбаченого застосування фармацевтичної композиції. Такі агенти можуть являти собою лікарські засоби, що діють на шлунковокишковий тракт, лікарські засоби цитостатичної дії, лікарські засоби для попередження гіперурикемії, лікарські засоби, що інгібують імунні реакції (наприклад, кортикостероїди), лікарські засоби, що модулюють запальну реакцію, лікарські засоби, що діють на кровоносну систему та/або відомі з рівня техніки засоби, такі як цитокіни. В іншому аспекті винаходу пропонується застосування людського моноклонального антитіла або його фрагмента, як описано вище, або молекули полінуклеотиду, що містить нуклеотидну послідовність, яка кодує амінокислотну послідовність, наведену в будь-якій з SEQ ID NO: 1-48 та/або 5256, або кодує амінокислотну послідовність, що містить амінокислотну послідовність, яка демонструє як мінімум 70 % гомологію до будь-якої з SEQ ID NO: 1-48 та/або 52-56, де термін "гомологія" слід розуміти, як пояснено вище, у виробництві лікарського засобу для лікування запальних захворювань, який необов'язково містить один або більше протизапальних агентів. Запальні захворювання переважно вибрані з групи, що складається з ревматоїдного артриту (РА) (зокрема РА, стійкого до лікування нейтралізаторами пухлинного некротичного фактора [TNF]-альфа), астми, розсіяного склерозу (PC), хронічного обструктивного захворювання легень (ХОЗЛ), синдрому гострої дихальної недостатності (ARDS), хвороби Крона, ідіопатичного фіброзу легень (ІФЛ), запального захворювання кишечнику (ЗЗК), увеїту, дегенерації жовтої плями, коліту, псоріазу, дегенерації Валлеріана, антифосфоліпідного синдрому (АФС), гострого коронарного синдрому, рестенозу, атеросклерозу, рецидивуючого поліхондриту (РП), гострого або хронічного гепатиту, безуспішної імплантації ортопедичних імплантів, гломерулонефриту, вовчаку або аутоіммунних розладів. Особливий інтерес представляє застосування людського моноклонального антитіла або його фрагмента у відповідності до винаходу для одержання лікарського засобу для лікування РА (зокрема РА, стійкого до лікування нейтралізаторами TNF-альфа), астми, PC та/або хвороби Крона. Щодо РА, астми та/або PC, існують дві популярні теорії стосовно патогенезу ревматоїдного артриту (РА). Перша стверджує, що Т-клітина, через взаємодію з антигеном (поки що не ідентифікованим), являє собою первинну клітину, відповідальну за ініціацію захворювання, а також за контроль хронічного запального процесу. Дана теорія базується на відомій асоціації РА з основ 25 ними антигенами гістосумісності класу II, великою кількістю CD4+ Т-клітин і використанням деформованого гена рецептора Т-клітини в синовіальній облонці при РА. Відомо, що GM-CSF підсилює функцію представлення антигену шляхом збільшення експресії поверхневих МНС класу II, причому GM-CSF виробляється Т-клітинами, вказуючи на передбачувану роль GM-CSF в прогресуванні захворювання у відповідності до гіпотези, що базується на Т-клітинах. Друга теорія стверджує, що, хоча Т-клітини можуть відігравати важливу роль в ініціації захворювання, хронічне запалення підтримується власне макрофагами і фібробластами незалежним від Т-клітин чином. Ця теорія базується на відносній відсутності активованих фенотипів Т-клітин при хронічному РА і переважанні активованих фенотипів макрофагів і фібробластів. GM-CSF є потужним стимулятором макрофагів і сприяє проліферації моноцитів та макрофагів. GM-CSF, який продукується, перш за все, "ефекторними" клітинами (макрофаги) і клітинами сполучної тканини (фібробласти), з надлишком експресується в синовіальній оболонці та синовіальній рідині при РА, що показано за даними ELISA або дослідження мРНК. У відповідності до "теорії макрофагів-фібробластів" Ρ А, ці два типи клітини, здається, є значною мірою відповідальними за створення стану хронічного запалення, яке самостійно підтримується, і в якому участь Т-клітини може не бути критичною. В такому сценарії активований макрофаг безперервно секретує IL-I і TNF, які підтримують синовіальні фібробласти в активованому стані. В свою чергу, фібробласт секретує великі кількості: а) цитокінів IL6, IL8 та GMCSF; b) простагландинів; і с) протеазних ферментів. GM-CSF дає зворотній зв'язок для сприяння дозрівання нещодавно рекрутованих моноцитів до макрофагів. IL-8 та IL-6 сприяють рекрутменту та/або активації інших популяцій клітини, тоді як дія простагландинів і протеаз спрямована безпосередньо на розклад навколишньої сполучної тканини, такої як кістка і хрящ. Щодо хвороби Крона, рекомбінантний людський колонієстимулювальний фактор гранулоцитів/макрофагів (rGM-CSF) з дріжджів продемонстрував ефективність в лікуванні помірної або тяжкої хвороби Крона (Dieckgraefe BK, Korzenik JR (2002). Lancet 360, 1478-80). В декількох оглядових статтях, що були опубліковані з того часу, автори розмірковують про терапевтичний вплив даного потужного прозапального цитокіна при даному захворюванні, якому приписують запальну природу. Можливі пояснення механізму дії rGM-CSF включають компонент імунодефіциту в хворобі Крона, викривлення Th 2 та експансію дендритних клітин, що сприяють диференціації регулювальних Т-клітин (Wilk NJ, Viney JL (2002). Curr Opin Invest Drugs 3, 1291-6; Folwaczny С et al. (2003). Eur J Gastroenterol Hepatol 15, 621-6). Винахідники вважають, що може бути запропонований більш простий механізм дії, який водночас більшою мірою узгоджується з відомою роллю GM-CSF при інших прозапальних захворюваннях. 94403 26 GM-CSF являє собою один з найбільш потужних серед відомих ад'ювантів, і саме тому цитокін вводиться сумісно з основним препаратом в численних випробуваннях вакцинації, що тривають. В той же час, GM-CSF володіє високою імуногенністю (Ragnhammar Ρ et al. (1994). Blood 84, 4078-87). Нещодавнє дослідження (Rini В et al. (2005) Cytokine 29, 56-66) показало, що щоденне лікування підшкірним введенням rGM-CSF із дріжджів, яке було здійснено в дослідженні хвороби Крона (Dieckgraefe BK, Korzenik JR (2002). Lancet 360, 1478-80), в межах трьох місяців призводить у 87% (13/15) пацієнтів з раком передміхурової залози до утворення антитіл проти цитокіну. У 60 % пацієнтів (9/15) утворювалися нейтралізуючі GM-CSF (поліклональні) антитіла. Можливість реакції нейтралізації GM-CSF не досліджувалася в дослідженні хвороби Крона, та рівні GM-CSF в сироватці в ході лікування не визначалися. В межах контексту даного варіанту винаходу передбачається, що пацієнти з хворобою Крона, які одержували лікування rGM-CSF, не реагували безпосередньо тільки на імуностимулюючу активність цитокіну, але і, як мінімум частково, клінічно реагували на реакцію у вигляді нейтралізуючих антитіл, по відношенню до введеного, а також ендогенного GM-CSF, який надмірно продукується при хворобі Крона (Agnholt J et al. (2004) Eur J Gastroenterol Hepatol 16, 64955). Крім того, нейтралізуючі анти-GM-CSF антитіла можуть володіти подібною до rGM-CSF терапевтичною активністю при хворобі Крона, і повинні розглядатися як альтернативний терапевтичний підхід, як обговорювалося вище. В іншому аспекті винаходу пропонується застосування людського моноклонального антитіла або його фрагмента, як описано вище, або молекули полінуклеотиду, що містить нуклеотидну послідовність, яка кодує амінокислотну послідовність, наведену в будь-якій з SEQ ID NO: 1-48 та/або 5256, або кодує амінокислотну послідовність, що містить амінокислотну послідовність, яка демонструє як мінімум 70 % гомологію до будь-якої з SEQ ID NO: 1-48 та/або 52-56, де термін "гомологія" слід розуміти, як пояснено вище, у виробництві лікарського засобу для лікування пухлинного захворювання або іншого стану із затримкою апоптоза клітин, збільшеною виживаністю або проліферацією клітин, що необов'язково містить один або більше додаткових протиракових агентів. Переважним пухлинним захворюванням є рак, причому особливо переважними є лейкемія, множинна мієлома, карцинома шлунку або карцинома шкіри. Olver et al. ((2002) Cancer Chemother Pharmacol. 50, 171-8) вводили підшкірно антагоніст GM-CSF E21R пацієнтам з твердими пухлинами, у яких доведено експресуються GM-CSF рецептори, що приводило тільки до тимчасового зменшення рівнів простато-специфічного антигену (ПСА) в сироватці. Крім того, застосування даного антагоністу GM-CSF при гострій мієлоїдній лейкемії ("ГМЛ") не виявляло клінічної активності (Jakupovic et al. (2004) Blood 103, 3230-2.). Додатково, застосування моноклональних анти-GM-CSF антитіл у пацієнтів з ГМЛ не виявляло анти-лейкемічного 27 впливу незважаючи на достатні рівні в сироватці і біологічну активність антитіла in vivo (Bouabdallah et al. (1998) Leuk Lymphoma 30, 539-49). Таким чином, автори зробили висновок про те, що лікування анти-GM-CSF антитілами є неефективним у пацієнтів з ГМЛ. Далі винахід буде більш детально описаний в наступних не обмежуючих прикладах і фігурах, короткий опис яких наведено нижче: Фіг. 1. Інтенсивність абсорбції (прямо пропорційна до сили зв'язування) для різноманітних антиrhGM-CSF молекул scFv, одержаних після чотирьох або п'яти циклів фагового дисплею, за даними ELISA. Фіг. 2. Середні значення інтенсивності флуоресценції (зворотно пропорційні потужності нейтралізації) для різноманітних анти-rhGM-CSF scFv та інших досліджуваних молекул, за даними аналізу на базі цитофлоуметрії. Фіг. 3. Результати аналізу інгібування проліферації TF-1 з використанням анти-rhGM-CSF scFv молекули 5-306. Фіг. 4. Інтенсивність абсорбції (прямо пропорційна міцності зв'язування) для різноманітних анти-rhGM-CSF молекул scFv, одержаних після чотирьох або п'яти циклів пенінгу фагового дисплею, за даними ELISA. Фіг. 5. Результати аналізу інгібування проліферації TF-1 з використанням різноманітних репрезентативних успішних анти-rhGM-CSF scFv. Фіг. 6. Специфічність зв'язування людських моноклональних антитіл по відношенню до людського GM-CSF та інших колонієстимулювальних факторів людини. Фіг. 7. Вимірювання резонансу поверхневого плазмону, що характеризують кінетику зв'язування людських моноклональних анти-GM-CSF антитіл та їх фрагментів. Фіг. 8. Вирівнювання послідовностей GM-CSF негуманоїдних приматів та GM-CSF людини. Фіг. 9. точкова радіограма пептиду, що демонструє зв'язування фрагмента людського моноклонального анти-GM-CSF з людським GM-CSF. Фіг. 10. Якісні результати аналізу інгібування проліферації TF-1 із застосуванням різноманітних показових фрагментів анти-rhGM-CSF антитіл scFv. Фіг. 11. Кількісні результати аналізу інгібування проліферації TF-1 із застосуванням різноманітних показових фрагментів людських анти-rhGMCSF IgG та відповідних scFv. Фіг. 12. Кількісні результати аналізу продукування IL8 із застосуванням різноманітних показових фрагментів людських анти-rhGM-CSF антитіл scFv. Фіг. 13. Кількісні результати аналізу інгібування проліферації TF-1 із застосуванням різноманітних показових фрагментів людських анти-macGMCSF IgG та відповідних scFv. Фіг. 14. Результати порівняльного досліджування зв'язування, що демонструють селективність зв'язування анти-GM-CSF антитіла IgG В з рекомбінантним людським GM-CSF та GM-CSF різних видів, що не належать до приматів. 94403 28 Фіг. 15. Результати дослідження залежності нейтралізуючого потенціалу анти-GM-CSF антитіла IgG В від глікозилювання GM-CSF. Фіг. 16. Результати дослідження впливу антиGM-CSF антитіла IgG В на опосередковане GMCSF виживання еозинофілів. Фіг. 17. Результати дослідження впливу антиGM-CSF антитіла IgG В на опосередковану GMCSF активацію еозинофілів. Фіг. 18. Результати токсикологічного дослідження ex vivo із застосуванням анти-GM-CSF антитіла IgG В, вимірювання на базі фагоцитозу (А-С) та окиснювального спалаху (D-F) гранулоцитів. Фіг. 19. Результати токсикологічного дослідження ex vivo із застосуванням анти-GM-CSF антитіла IgG В, вимірювання на базі фагоцитозу (А-С) та окиснювального спалаху (D-F) моноцитів. ПРИКЛАДИ Приклад 1: Одержання рекомбінантного людського ("rh") GM-CSF антигену, який використовують для створення нейтралізуючих людських антитіл та їх фрагментів Приклад 1.1: Клонування, експресія та очищення rhGM-CSF антигену Ген, що кодує людський GM-CSF антиген, субклонують у вектор pET22b(+) (Novagene, США) з вектора експресії pORF-hGM-CSF (Novagen, США) через введені за допомогою ПЛР сайти розпізнавання рестрикційного ферменту Ndel та Xhol. hGM-CSF-κοдуючий ген в рЕТ22b(+) злитий з лідерною послідовністю реlВ і є придатним для експресії в периплазмі Е. соlі. Продукування і очищення білка здійснюють, як описано виробником. Якщо коротко, BL21DE3 Е. соlі перетворюють за допомогою експресійної плазміди та культивують при температурі 37 °С в селекційному середовищі до оптичної густини 0,5-0,8 на довжині хвилі 600 нм. Продукування білка індукують додаванням IPTG до 1 мМ і зменшенням температури до 25 °С. Периплазму одержують за допомогою осмотичного шоку з використанням 20 % розчину сахарози для вибіркового руйнування клітинної стінки, що підтримує інтактний стан клітинної мембрани. Природний hGM-CSF містить два дисульфідні містки, і експресія в окиснювальній периплазмі Е. соlі дозволяє утворення цих важливих з функціональної точки зору дисульфідних містків. Рекомбінантний людський GM-CSF ("rhGMCSF") очищають за допомогою двостадійного способу очищення шляхом афінної хроматографії на імобілізованому металі (ІМАС) і гель-фільтрації. Для хроматографії використовують систему Akta® FPLC (Pharmacia) та програмне забезпечення Unicom®. Використовують реагенти категорії "для досліджень", придбані у Sigma (Deisenhofen) або Merck (Darmstadt). ІМАС здійснюють з використанням колонки Qiagen Ni-NTA Superflow у відповідності до протоколу, наданого виробником. Колонку врівноважують буфером А2 (20 мМ розчин натрію фосфату, рН 7,2, 0,4 Μ NaCl) та препарат периплазми ("РРР") (100 мл) наносять на колонку (2 мл) при швидкості потоку 2 мл/хв. Колонку промивають 5 29 об'ємами колонки 5 % буферу В2 (20 мМ натрію фосфату, рН 7,2, 0,4 Μ NaCl, 0,5 Μ імідазолу) для видалення незв'язаного зразка. Зв'язаний білок елююють з використанням 100 % буфера В2 в 5 об'ємах колонки. Елюйовані фракції білка об'єднують для подальшого очищення. Гель-фільтраційну хроматографію здійснюють на колонці Superdex 200 Prep Grade (Pharmacia), врівноваженій фосфатним буферним розчином (Gibco). Елюйовані зразки білка (швидкість потоку 1 мл/хв) піддають стандартним аналізам SDSPAGE і Вестерн-блотингу для детектування. Перед очищенням колонку калібрують для визначення молекулярної маси (набір маркерів молекулярної маси, Sigma MW GF-200). Концентрацію білка визначають, вимірюючи оптичну густину на довжині хвилі 280 нм, та обчислюють із застосуванням специфічного для послідовності коефіцієнта молекулярної екстинції. Приклад 1.2: Біотинілювання rhGM-CSF антигену Для вибору бібліотеки фага rhGM-CSF антиген, продукований в Е. соlі (див. вище) біотинілюють. Біотинілювання здійснюють у фосфатному буферному розчині, що містить 5 % ДМСО (Sigma) з п'ятиразовим молярним надлишком EZ-Link Sulfo NHS-LC-LC-біотину (Pierce) протягом 1 години при кімнатній температурі в міксері для зразків (Dynal). Для відокремлення вільного біотину від біотинільованого rhGM-CSF антигену застосовують аніонообмінну хроматографію (Resource Q, Amersham Biosciences) у відповідності до стандартних протоколів. Хроматографія дає обидва підходи (позначені А та В, як описано нижче) в двох піках елюації. У випадку А пік, що елююється першим, знову фракціонують за допомогою другої стадії аніонообмінної хроматографії (такі ж умови, як вказано вище) на два піки елюації. Згодом одержані частинки серійно розбавляють (розведення 1:2; початкову концентрацію 6 мкг/мл визначають на базі висоти піку), наносять на 96-лункові планшети ELISA та здійснюють детектування. Детектування здійснюють з використанням А) антитіла проти GM-CSF людини М500-А (Sigma, 2,5 мкг в ФБР/1 % БСА), яке виявляють за допомогою кон'югованого з пероксидазою хріну козиного анти-мишачого Fаb2-специфічного поліклонального антитіла (Dianova, 1 мкг ФБР/1 % БСА), та В) материнського антитіла (1 мкг ФБР/1 % БСА), яке виявляють за допомогою кон'югованого з пероксидазою хріну анти-щурячого поліклонального антитіла (Dianova, 1 мкг/мл ФБР/1 % БСА). Успішне біотинілювання продемонстроване в подібному експерименті ELISA, який здійснюють з використанням кон'югованого з пероксидазою хріну стрептавідину (Dako, 1 мкг/мл ФБР/1 % БСА). Сигнал індукують, додаючи розчин субстрату о-фенілендіаміну (Sigma) та детектують на довжині хвилі 492 нм (довжина хвилі порівняння 620 нм). Для оцінки ступеня біотинілювання вищезгаданий аналіз ELISA здійснюють з використанням аніонообмінних фракцій безпосередньо або після стадії інкубації з 6,7 × 10ехр7 магнітними гранулами стрептавідину (Dynabeads М-280-Streptavidin, Dynal), обережно перемішуючи протягом 30 хвилин. Одержаним супернатантом 94403 30 вкривають лунки 96-лункових планшетів ELISA і детектують, як описано вище. Результати ELISA демонструють, що пік, який елююється другим, містить біотинільований rhGM-CSF, і що приблизно 95 % елюйованого rhGM-CSF є кон'югованим. Концентрацію оцінюють із застосуванням початкового матеріалу як стандарту, і виявлено, що вона становить приблизно 20 мкг/мл. Збереження біологічної активності міченого біотином rhGM-CSF підтверджують за допомогою аналізу проліферації TF-1 у відповідності до протоколів, описаних нижче в розділі опису одноланцюгових антитіл (scFv). Приклад 1.3: Введення флуоресцеїнової мітки антигену rhGM-CSF Для дослідження зв'язування на клітинах TF-1 рекомбінантний антиген людського GM-CSF, продукований з використанням Е. соlі (див. Приклад 1.2 вище) кон'югують з флуоресцеїн-5(6)-карбоксамідокапронової кислоти Nсукцинімідиловим естером (Fluka, флуоресцеїнNHS). Стадію кон'югації здійснюють в боратному буфері (борна кислота 0,05 М, 0,1 Μ NaCl, pH 8,5), що містить 17,5 % ДМСО з п'ятиразовим молярним надлишком флуоресцеїну-NHS протягом 1 години при кімнатній температурі в міксері для зразків. Далі здійснюють гель-фільтрацію (Sephadex G25, Amersham Biosciences) для дисоціації міченого флуоресцеїном rhGM-CSF антигену від вільного флуоресцеїну-NHS. Гель-фільтрація давала два піки, виміряні на довжині хвилі 485 нм (довжина хвилі порівняння 535 нм), тоді як перший пік представляє мічений FITC rhGM-CSF. Ступінь мічення визначають за співвідношенням F/P кон'югату ([мг/мл] = (A280 - 0,35 × Α493) × 1,08; F/P=(A493/73,000) × (15,000/([мг/мл])). Визначена концентрація становить 0,041 мг/мл із співвідношенням F/P 1,2. Приклад 2: Генерація та селекція нейтралізауючих "анти-GM-CSF людини" антитіл та їх фрагментів Приклад 2.1: Клонування материнського VH з гібридоми НВ-9569 У вищевикладених прикладах термін "материнська" V-ділянка означає, що цільова V-ділянка походить з повної молекули імуноглобуліну. У вищевикладених прикладах термін "успішний" означає молекулу, яка доведено зв'язується з цільовим антигеном, але зв'язування якої не було оцінено кількісно. "Успішний" означає молекулу на ранній стадії вивчення, для якої могло здійснюватися продукування в невеликих масштабах. Така молекула знаходиться в стадії валідації опису. У вищевикладених прикладах термін "досліджувана" молекула означає молекулу, для якої потенціали зв'язування та нейтралізації були визначені кількісно. Продукування "досліджуваної" молекули вже мало місце у великих масштабах. У наступних прикладах описаний один з можливих шляхів створення нейтралізатора у вигляді повністю людського моноклонального антитіла проти GM-CSF людини та створення його фрагментів. Мета даного експерименту полягає у виділенні та субклонуванні гена, що кодує VH в материнському mAb, продукованому лінією клітини гібридоми 31 НВ-9569. Гібридому НВ-9569 одержували від АТСС (США). Клітини гібридоми культивували в повному середовищі для культивування АТСС: Середовище RPMI 1640 з 2 мМ L-глутаміну, скоректоване до вмісту діоксиду вуглецю 1,5 г/л натрію, 4,5 г/л глюкози, 10 мМ HEPES та 1,0 мМ натрію пірувату з додаванням 0,05 мМ 2меркаптоетанолу, бичачої ембріональної сироватки 10 % при температурі 37 °С з 5 % СО2. Для одержання загальної РНК використовують 1 × 10ехр7 клітин, та РНК одержують, як описано в інструкції продукту Qiagen Omni-Skript Kit (Qiagen, Німеччина). кДНК синтезують у відповідності до стандартних способів (Sambrook, Cold Spring Harbor Laboratory Press 1989, Second Edition). Для виділення ДНК V-ділянки важкого ланцюга здійснюють ПЛР із зворотною транскрипцією з використанням MHALT1R.V: GCC GAA ТТС САС CAT GGR ATG SAG CTG KGT MAT SCT CTT і Race GSP rIgG2a/b: набір праймерів САС ACC GCT GGA CAG GGC TCC AGA GTT CC. Для ампліфікації застосовують наступну програму ПЛР: денатурацію при температурі 94 °С протягом 15 секунд, відпалювання праймера при температурі 52 °С протягом 50 секунд і подовження праймера при температурі 72 °С протягом 90 секунд здійснюють протягом 40 циклів, з наступним кінцевим подовженням при температурі 72 °С протягом 10 хвилин. Далі ДНК V-фрагментів важкого ланцюга виділяють у відповідності до стандартних протоколів. ДНК V-фрагментів важкого ланцюга клонують в ПЛР скрипт-САМ (Stratagene), як описано виробником. Послідовності ідентифікують секвенуванням. Приклад 2.2: Виділення людського VL Мета даного експерименту полягає у селекції людського VL, який може паруватися з материнським VH, клонованим, як описано вище. Приклад 2.2.1: Виділення РНК з відібраних IgD-позитивних В-клітин 100 мл крові відбирають у п'яти здорових донорів-людей. Моноядерні клітини периферичної крові (МКПК) виділяють за допомогою фіколл-градієнту у відповідності до стандартних способів. Для відбору IgD-позитивних клітин, 1 мл анти-мишачих IgG-гранул (CELLection™ Pan Mouse IgG Kit; DYNAL) вкривають 20 мкг мишачого анти-IgD людини антитіла (PharMingen). Приблизно 2,5 × 10ехр7 МКПК додають до гранул та інкубують при температурі 4 °С протягом 15 хвилин. Після чотириразового промивання 1 мл середовища RPMI (BioChrom) IgD-позитивні клітини вивільняють гранул додаванням 8 мкл буферу для вивільнення (DNase) та переносять в свіжу пробірку. За допомогою даного способу можуть бути одержані від 0,9 × 10ехр5 до 3,7 × Юехрб IgDпозитивних клітин. Загальну РНК виділяють з IgDпозитивних клітин із застосуванням RNeasy® Midi Kit (QIAGEN) у відповідності до інструкцій виробника. кДНК синтезують у відповідності до стандартним способів (Sambrook, Cold Spring Harbor Laboratory Press 1989, Second Edition). Приклад 2.2.2: ПЛР-ампліфікація варіабельних ділянок легкого ланцюга (VL-ділянки) 94403 32 Для виділення ДНК V-ділянки легкого ланцюга здійснюють ПЛР із зворотною транскрипцією з використанням наборів праймерів V-kappa-(5'huVK1-SacI-2001 (5'-GAGCCGCACG AGCCCGAGCT CCAGATGACC CAGTCTCC-3'), 5'hiiVK2/4-SacI-2001 (5'-GAGCCGCACG AGCCCGAGCT CGTGATGACY CAGTCTCC-3'), 5'huVK3-SacI-2001 (5'-GAGCCGCACG AGCCCGAGCT CGTGWTGACR CAGTCTCC-3'), 5'huVK5-SacI-2001 (5'-GAGCCGCACG AGCCCGAGCT CACACTCACG CAGTCTCC-3'), 5'huVK6-SacI-2001 (5'-GAGCCGCACG AGCCCGAGCT CGTGCTGACT CAGTCTCC-3'), 3'hu-Vk-J1-SpeI-BsiWI (5'-GACGACACTA GTTGCAGCCA CCGTACGTTT GATTTCCACC TTGGTCC-3'), 3'-hu-Vk-J2/4-SpeI-BsiWI (5'GACGACACTA GTTGCAGCCA CCGTACGTTT GATCTCCASC TTGGTCC-3'), 3'-hu-Vk-J3-SpelBsiWI (5'-GACGACACTA GTTGCAGCCA CCGTACGTTT GATATCCACT TTGGTCC-3'), 3'-huVk-J5-SpeI-BsiWI (5'-GACGACACTA GTTGCAGCCA CCGTACGTTT AATCTCCAGT CGTGTCC-3'). РНК з IgD-позитивних В-клітин транскрибують в кДНК (як описано вище) і застосовують як шаблон ДНК в і реакціях ПЛР. В одній реакції ПЛР один 5 -праймер об'єднують з одним З'-праймером. Кількість різних реакцій ПЛР визначають за кількістю можливих комбінацій 5'- і 3'-праймерів. Для ампліфікації застосовують наступну програму ПЛР: денатурацію при температурі 94 °С протягом 15 секунд, відпалювання прайм ера при температурі 52 °С протягом 50 секунд і подовження праймера при температурі 72 °С протягом 90 секунд здійснюють протягом 40 циклів, з наступним кінцевим подовженням при температурі 72 °С протягом 10 хвилин. Далі ДНК V-фрагментів легкого ланцюга виділяють у відповідності до стандартних протоколів. Приклад 2.2.3: Конструюваня бібліотеки - клонування пулу людських YL Бібліотеку фагового дисплею загалом конструюють на базі стандартних методик, наприклад, розкритих в "Phage Display: A Laboratory Manual"; Ed. Barbas, Burton, Scott & Silverman; Cold Spring Harbor Laboratory Press, 2001. Праймери, вибрані для ПЛР-ампліфікації, обумовлюють сайти розпізнавання 5'-SacI і 3'-Spel для V-фрагментів легкого ланцюга. Встановлюють дві реакції лігування, кожна з 400 нг фрагментів капа легкого ланцюга (Sacl-Spel, ферментований) і 1400 нг плазмідного pBluescript KS+ (Sacl-Spel, ферментований; великий фрагмент). Кожен з двох утворених пулів V-легких ланців антитіла далі перетворюють на 300 мкл електрокомпетентної Escherichia coli XL1 Blue електропорацією (2,5 кВ, кювета проміжку 0,2 см, 25 мФ, 200 Ом, генератор генних імульсів Biorad) з одержанням бібліотеки розміром 5,8 × 10ехр8 незалежних клонів. Фрагменти ДІЖ капа (легкий ланцюг) з різних ПЛР-ампліфікацій навантажують для кожного лігування, як вказано нижче: Кожен 5'-праймер визначає конкретну групу. В межах цих груп 3'-праймери визначають підгрупи. Підгрупи навантажують 1:2:1:1 у відповідності до праймерів 3'-hu-Vk-J1Spel-BsiWI : 3'-hu-Vk-J2/4-SpeI-BsiWI : 3'-hu-Vk-J3SpeI-BsiW : 3'-hu-Vk-J5-SpeI-BsiWI. Групи наван 33 тажують у відповідності до їх розповсюдженню в зародковій лінії 1:1:1:0,2:0,2, у відповідності до праймерів 5'-huVK1-Sac-2001 : 5'-huVK3-Sac-2001 : 5'-huVK2/4-Sac-2001 : 5'-huVK5-Sac-2001 : 5'huVK6-Sac-2001. Після електропорації реакційну суміш інкубують в бульйоні SOC (Fluka) для експресії фенотипу. Далі кожну культуру інкубують в 500 мл селекційного середовища SB, що містить 50 мкг/мл карбеніциліну і 2 % глюкози (мас/об.) протягом ночі. Наступного дня клітини збирають центрифугуванням і одержують плазміди з використанням комерційно доступного набору для одержання плазмід (Qiagen). Приклад 2.2.4: Конструювання бібліотеки антитіл - людський VL - материнський VH Здійснюють ПЛР для ампліфікації материнського VH з вектора, що містить материнський VH, описаного в Прикладі 2,1 вище. Для ампліфікації дотримуються протоколу ПЛР у відповідності до стандартних процедур із застосуванням 5'праймера MVH8 (5'-GAG GTT CAG СТС GAG CAG ТСТ GGA GCT-3') і 3'-праймера 3'-MuVHBstEII (5'TGA GGA GAC GGT GAC CGT GGT ССС TTG GCC CCA G-3')· Після очищення продукту ампліфікації розміром приблизно 350 пар основ з гелю агарози для аналізу, фрагмент ДНК нарізають за допомогою рестрикційних ферментів BstEII і Xhol. Фагеміду pComb3H5BHis (даний вектор описаний в дисертації д-ра Ральфа Люттербюзе [Ralf Lutterbuse]) відповідним чином розщеплюють ферментами, і великий фрагмент лігують з вищевказаним. Після перетворення на Е. coli XL1 Blue єдиний клон культивують в 100 мл середовища SB (з вмістом 50 мкг карбеніциліну) і плазміду одержують у відповідності до стандартних протоколів. Успішність клонування підтверджують секвенуванням вставки (Sequiserve, Мюнхен). Даний вектор рСоmb3Н5ВНіs/материнський VH обмежують за допомогою рестрикційних ферментів Sad та Spel. Виділяють великий фрагмент вектора. Плазміду-ДНК, що містить VK-бібліотеку з Прикладу 2.2.3, обмежують за допомогою рестрикційних ферментів, Sad та Spel. Виділяють стрічку невеликого фрагмента VK (приблизно 350 пар основ). 1200 нг фрагмента вектора лігують з 400 нг фрагментів VK і перетворюють на 300 мкл електрокомпетентної Escherichia coli XL1 Blue електропорацією (2,5 кВ, кювета проміжку 0,2 см, 25 мФ, 200 Ом) з одержанням бібліотеки загального scFv розміром 2,8 × 10ехр8 незалежних клонів. Після експресії фенотипу і повільної адаптації до карбеніциліну бібліотеку антитіл переносять в селекційне середовище SB-карбеніцилін (50 мкг). Далі бібліотеку антитіл інфікують дозою 1 × 10ехр12 частинок хелперного фага VCSM13, що приводять до продукування і секреції волоконного фага МІ3, де кожна частинка фага містить одноланцюгову рСоmb3Н5ВНіs-ДНК, що кодує напівлюдський scFv-фрагмент і показує відповідний scFvбілок як трансляційне злиття з протеїном III покриття фага. 94403 34 Приклад 2.2.5: Відбір фагового дисплею для людського VL Частинки фага, що містять scFv-репертуар, збирають з супернатанту культури шляхом осадження PEG8000/NaCl і центрифугування. Далі від приблизно 1 × 10ехр11 до 1 × 10ехр12 частинок scFv фага ресуспендують в 0,4 мл ФБР/0,1 % БСА та інкубують з рекомбінантним біотинільованим розчинним rhGM-CSF (продукований в Е. соlі, як описано вище в прикладі 1) протягом 2 год при обережному перемішуванні в загальному об'ємі 0,5 мл (концентрація антигену круг 1-3: 100 нМ; круг 4: 10 нМ; круг 5: 1 нМ). Далі додають 6,7 × 10ехр7 магнітних гранули стрептавідину (Dynabeads M-280-Streptavidin, Dynal), після чого інкубують при обережному перемішуванні протягом 30 хвилин. Фаг scFv, який неспецифічно зв'язується з цільовим антигеном, був виключений за допомогою стадій промивання ФБР/0,1 % БСА. Для цієї мети комплекси біотинільований антиген/гранули стрептавідину (з потенційними агентами для зв'язування scFv) збирають магнітом і ресуспендують в 1 мл розчину для промивання (одна стадія промивання). Вказану процедуру промивання повторюють чотири рази в подальших циклах. Після промивання агенти для зв'язування елююють із застосуванням НСІ-гліцину, рН 2,2. Після нейтралізації за допомогою 2 Μ Трис, рН 12, елюат використовують для інфікування культури свіжої неінфікованої Е. coli XL1 Blue. Для елюації решти агентів з високою активністю зв'язування цю стадія повторюють із застосуванням НСІгліцину, рН 1,0. Одержаний другий елюат знову нейтралізують і використовують для інфікування культури свіжої неінфікованої Е. coli XL1 Blue. Обидві інфіковані культури Е. соlі далі змішують, після чого здійснюють селекцію клітин, які були успішно перетворені за допомогою копії фагеміди, яка кодує людський scFv-фрагмент, щодо резистентності до карбеніциліну, після чого їх інфікують хелперним фагом VCSM13, щоб розпочати другий круг дисплею антитіл та селекцію in vitro. Плазмідну ДНК, що відповідає 4 і 5 кругам пеннінгу, виділяють з культур Е. соlі. Для продукування розчинного scFv-білка, фрагменти VL-ДНК вирізають з плазмід (Sacl-Spel) і клонують через такі ж рестрикційні сайти в плазміду pComb3H5BFlag/His з материнським VH, відмінним від початкового рСоmb3Н5ВНіs/материнський VH в тому, що конструкт експресії (наприклад, scFv) включає мітку Flag (TGDYKDDDDK) між scFv і міткою His6 та додаткові білки фага видалені. Після літування кожний пул (різні круги пеннінгу) плазмідної ДНК перетворюють на 100 мкл компетентної Е. соlі XL1 Blue, обробленої тепловим шоком, та вкривають нею карбеніциліновий LBaгap. Окремі колонії переносять в 100 мкл LBкарбеніциліну (50 мкг). 10 мкл одержаної суспензії клітини звичайно інкубують в 5 мл середовища SB з додаванням карбеніциліну до концентрації 50 мкг/мл і MgC12 до кінцевої концентрації 20 мМ протягом приблизно 6 год при температурі 37 °С при перемішуванні. Далі додають ізопропілтіогалактозид (IPTG) до 35 кінцевої концентрації 1 мМ та інкубацію продовжують протягом ночі на шейкері при температурі 30 °С. Клітини центрифугують до одержання гранул, яку звичайно ресуспендують в 0,5 мл ФБР. За допомогою чотирьох циклів заморожування при температурі -70 °С і відтаювання при температурі 37 °С зовнішню мембрану бактерій руйнують за допомогою осмотичного шоку, і розчинні білки периплазми, в тому числі scFv, вивільняються в супернатант. Після видалення інтактних клітин і уламків клітин центрифугуванням (5 хвилин при 10 000 × g), збирають і досліджують супернатант (тобто, РРР), який містить scFv. Антиген rhGM-CSF (Leukine Liquid, Immunex) іммобілізують на планшетах ELISA протягом ночі при температурі 4 °С (50 мкл 1 мкг антигену/мл ФБР на лунку). Після промивання одноразового лунок ФБР і блокування ФБР 3 % БСА протягом 1 год при кімнатній температурі в лунки додають 100 мкл РРР, що містить scFv, і звичайно інкубують протягом 1 год при кімнатній температурі. Після триразового промивання ФБР/0,05 % Твін-20 здійснюють детектування scFv-фрагментів, зв'язаних з іммобілізованим антигеном, з використанням антиFlag М2 (1 мкг ФБР/1 % БСА) та детектують за допомогою кон'югованого з пероксидазою хріну козиного анти-мишачого Fab2 специфічного поліклонального антитіла (Dianova, 1 мкг ФБР/1 % БСА). Сигнал індукують додаванням розчину субстрату 2,2'-азино-ди[3-етил-бензтіазолін-6сульфонової кислоти] ("ABTS") та здійснюють визначення на довжині хвилі 405 нм у відповідності до стандартних протоколів. З 20 досліджених клонів (10 одержані після 4 кругів і 10 одержані після 5 кругів пеннінгу), п'ять лізатів показали інтенсивний сигнал в аналізі ELISA, на протилежність ФБР як негативному контролю, на рекомбінантному антигені. Результати аналізу ELISA показані на Фіг. 1, де різні досліджені молекули scFv розташовані вздовж осі абсцис, а вісь ординат демонструє виміряну інтенсивність абсорбції, причому більш висока абсорбція показує більш міцне зв'язування. ФБР негативний контроль показаний на осі абсцис (крайня ліва область). Молекули ScFv, що демонструють відчутне зв'язування, вказані над відповідним стовпчиком інтенсивності абсорбції ромбом або зірочкою. Ромб і зірочка на Фіг. 1 представляють дві різні послідовності, тобто scFv, чия колонка інтенсивності абсорбції позначена ромбом, має одну послідовність, тоді як всі scFv, чиї стовпчики інтенсивності абсорбції показані зірочками, мають однакову спільну послідовність. П'ять ELISA-позитивних клонів були піддані секвенуванню ДНК. Секвенування здійснюють в Sequiserve (Мюнхен). Загалом ідентифіковані чотири клони із спільною ДНК послідовністю, що відповідає scFv 5-306, тоді як інша послідовність (4301) була ідентифікована тільки в одному випадку. Домінуюча послідовності, що відповідає scFv 5306, а також послідовність 4-301 мали людське походження і демонстрували дуже високий ступінь гомології з послідовністю людської зародкової лінії Vk1-O12. 94403 36 Приклад 2.2.6: Характеристика успішних конструктів scFv, одержаних в результаті селекції huVL Мета наступних експериментів полягає в описанні успішних scFv, одержаних за описаними вище способами. Приклад 2.2.6.1: Експресія та очищення успішних scFv (одержаних, як описано вище) в Е. соlі в невеликих масштабах Для одержання РРР клітини культивують в середовищі SB з додаванням 20 мМ MgCl2 і карбеніциліну 50 мкг/мл та після збирання знову розчиняють в 1 мл ФБР. Зовнішню мембрану бактерій руйнують за допомогою температурного шоку (чотири цикли заморожування при температурі -70 °С і відтаювання при температурі 37 °С), в результаті чого розчинні білки периплазми, в тому числі scFv, вивільняються в супернатант. Після видалення інтактних клітин та уламків клітини центрифугуванням збирають і досліджують супернатанти, що містять scFv. Для подальшого очищення 25 мкл 20 мМ NaH2PO4, 400 мМ NaCl, 250 мМ імідазолу, рН 7,0, додають у відповідний РРР. РРР очищують за допомогою Ni-NTA Spin Columns (Qiagen), як рекомендується в інструкції. Якщо коротко, відповідний розчин РРР додають до попередньо врівноваженої колонки для зв'язування із смолою. Spin Columns двічі промивають 20 мМ NaH2PO4, 400 мМ NaCl, 20 мМ імідазолу, рН 7,0. Зв'язаний білок двічі елююють в 200 мкл 20 мМ NaH2PO4, 400 мМ NaCl, 250 мМ імідазолу рН 7,0. Очищені білки scFv далі аналізують щодо здатності до зв'язування (кінетична швидкість дисоціації) і нейтралізації (інгібування залежної від GMCSF проліферації TF-1), як описано в подальших прикладах. Незважаючи на відсутність розділення і розрізнення поміж різними можливими конформаціями scFv, таке сире очищення РРР дає 80 % чистого білка scFv, за даними Вестерн-блотингу (дані не показані). Приклад 2.2.6,2: Інгібування міченого FITC rhGM-CSF Метою даного експерименту є продемонструвати, що ідентифіковані клони scFv здатні до інгібування зв'язування rhGM-CSF з комплексом рецептора GM-CSF, показаним на поверхні клітин TF-1. Очікується, що нейтралізуючі конструкта scFv будуть конкурувати за епітоп зв'язування з рецептором на молекулі rhGM-CSF, що робить неможливим зв'язування rhGM-CSF з комплексом рецептора GM-CSF. До тієї міри, до якої зв'язування rhGM-CSF з його рецептором інгібується описаним вище чином, можна очікувати зменшення інтенсивності флуоресценції забарвлення клітин TF1 під впливом міченого флуоресцеїном rhGM-CSF (rhGM-CSF-FITC) в аналізі на базі цитофлоуметрії. Далі описано здійснення такого аналізу на базі цитофлоуметрії. Кінцеву концентрацію кон'югату 0,4 мкг/мл rhGM-CSF-FITC у ФБР інкубують з 10 мкг/мл материнського антитіла або нерозведеного периплазматичного екстракту scFv, очищеного за допомогою Ni-NTA Spin Column. Зразки білка залишають для врівноваження при температурі 25 °С на 1 год, після чого додають суспензію клітин TF-1. Клітини TF-1 культивують в середовищі RPMI 1640 (Gibco; L-глутамін, не містить фенольного червоного) з додаванням 10 % інактивованої 37 нагріванням сироватки телячих ембріонів за відсутності rhGM-CSF протягом ночі. Застосовують кінцеву концентрацію 2 × 10ехр6 клітин/мл і 150 мкл суспензії клітини на зразок. Клітини збирають центрифугуванням при 500 × g при температурі 4 °С протягом 3 хвилин і двічі промивають буфером FACS. Промиті клітини ресуспендують в 100 мкл попередньо врівноваженого зразка білка, що містить rhGM-CSF-FITC та відповідне материнське антитіло або scFv. Зразки інкубують при температурі 4 °С протягом 60 хвилин. Після двох додаткових циклів промивання клітини ресуспендують в 150 мкл льодяно холодного буферу FACS, після чого аналізують цитофлуометрією. Результати показані на Фіг. 2. Конкретно, на Фіг. 2 продемонстровано графік, де різні досліджені молекули розташовані вздовж осі абсцис, та середня інтенсивність флуоресценції ("СІФ") показана на осі ординат. Як можна побачити з даних Фіг. 2, спостерігається очевидне зниження інтенсивності флуоресценції клітин TF-1 у випадку материнського антитіла (друге зліва вздовж осі абсцис). Конкурентне зв'язування з rhGM-CSF молекули scFv, позначеної 5-306, можна контролювати за зниженням флуоресценції забарвлення клітин TF-1, тоді як scFv молекула 4-301 демонструє практичну відсутність впливу. Оскільки наведені результати свідчать про те, що молекула scFv, позначена 5-306, може бути перспективним нейтралізатором GM-CSF, подальший аналіз активності нейтралізації було обмежено scFv 5-306. Приклад 2.2.6.3: Експресія та очищення успішного scFv у великих масштабах Продукування і очищення білка у великих масштабах здійснювали, як вказано нижче. Якщо коротко, Е. coli BL21DE3 перетворюють за допомогою плазміди експресією та культивують при температурі 37 °С в 1л селекційного середовища до оптичної густини 0,5-0,8 на довжині хвилі 600 нм. Продукування білка індукують додаванням IPTG до 1 мМ і культури інкубують ще протягом 16 год при перемішуванні при температурі 25 °С. Клітини збирають центрифугуванням при 5 000 × g протягом 10 хвилин і ресуспендують в 100 мл 1 × ФБР. Периплазматичні білки екстрагують шляхом оптимального, послідовного заморожування в суміші етанол/сухий лід і відтаювання при температурі 37 °С на водяній бані протягом чотирьох циклів. Кінець кінцем, екстракт центрифугують при 10 000 × g протягом 20 хвилин. ScFv 5-306 виділяють за допомогою двостадійного процесу очищення афінною хроматографією на іммобілізованому металі (ІМАС) та гельфільтрації. Всі LTADS очищують у відповідності до даного способу. Для хроматографії застосовують систему Akta® FPLC (Pharmacia) та програмне забезпечення Unicorn®. Використовують реагенти категорії "для досліджень", придбані у Sigma (Deisenhofen) або Merck (Darmstadt). ІМІАС здійснюють з використанням колонки Qiagen Ni-NTA Superflow у відповідності до протоколу, наданого виробником. Колонку врівноважують буфером А2 (20 мМ натрію фосфату, рН 7,2, 0,4 Μ NaCl) і РРР (100 мл) наносять на колонку (2 94403 38 мл) при швидкості потоку 2 мл/хв. Колонку промивають 5 об'ємами колонки 5 % буфера В2 (20 мМ натрію фосфат, рН 7,2, 0,4 Μ NaCl, 0,5 Μ імідазолу), для видалення вільного зразка. Зв'язаний білок елююють з використанням 100 % буферу В2 в 5 об'ємах колонки. Елюйовані фракції білка об'єднують для подальшого очищення. Гель-фільтраційну хроматографію здійснюють на колонці HiLoadTM 16/60 Superdex 75 Prep Grade (Pharmacia), врівноваженій ФБР (Gibco). Елюйовані зразки білка (швидкість потоку 1 мл/хв) піддають стандартному аналізу SDS-PAGE і Вестерн-блотингу для детектування. Перед очищенням колонку калібрують для визначення молекулярної маси (набір маркерів молекулярної маси, Sigma MW GF-200). Залежне від розміру відокремлення на колонці Superdex 75 Prep Grade приводить до утворення піків фракцій мономера та асоціативного димера досліджуваних scFv, що чітко піддаються розрізненню. Концентрацію білка визначають шляхом вимірювання оптичної густини на довжині хвилі 280 нм та обчислюють із застосуванням специфічного для послідовності коефіцієнта молекулярної екстинції відповідного досліджуваного scFv. Приклад 2.2.6.4: Інгібування rhGM-CSFзалежної проліферації клітини TF-1 під дією досліджуваного scFv Метою даного експерименту є одержання якісної інформації щодо нейтралізуючої активності напівлюдського scFv 5-306 із застосуванням hGMCSF залежної лінії клітин TF-1 (DSMZ АСС 334). Клітини TF-1 культивують в середовищі RPMI 1640 (Gibco; L-глутамін, не містить фенольного червоного) з 10 % інактивованої нагріванням сироватки телячих ембріонів в присутності 2,5 нг/мл rhGMCSF, як описано дистриб'ютором (Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH, Braunschweig, Німеччина). Клітини культивують до густина 0,5х10ехр6 клітин/мл. Для аналізу проліферації клітини TF-1 збирають центрифугуванням при 300 × g протягом 4 хвилин і промивають 1 × ФБР (Dulbecco's, Gibco). Клітини ресуспендують в кінцевій концентрації 1 × 10ехр5 клітин/мл в середовищі RPMI 1640 з 10 % сироватки телячих ембріонів і використовують 90 мкл суспензії клітини на лунку з пласким дном планшету Microtest для культивування клітин (0,9х10ехр4 клітин/лунку). Використовують кінцеву концентрацію 0,3 нг/мл rhGM-CSF для стимуляції проліферації клітини TF-1. Для нейтралізації залежної від hGM-CSF проліферації додають 10 мкл очищеного scFv 100 мкл TF-1 і rhGM-CSF розчиняють в серійних розведеннях від приблизно 100 мкг/мл до 100 пг/мл. Зразки інкубують при температурі 37 °С з 5 % СО2 протягом 72 год. Після проходження 72 год визначають проліферативний статус клітин TF-1 шляхом додавання WST-1 і моніторингу колориметричних зміни за допомогою пристрою для зчитування ELISA на довжині хвилі 450 нм. Дані апроксимують на половину максимального інгібування проліферації (ІС50) із застосуванням апроксимації кривої нелінійної регресії програмного забезпечення Prism. 39 Можна спостерігати очевидний дозозалежний вплив з інгібування проліферації scFv 5-306, що є порівнянним для мономерних і димерних конформаційних форм. За допомогою апроксимації на половину максимального інгібування проліферації ІС50 одержано значення 7,3 нМ для мономерної форми і 3,5 нМ для димерної форми. Результати показані на Фіг. 3. Приклад 2.3: Конструювання бібліотек антитіл та відбір за допомогою фагового дисплею людських VH Мета наступних експериментів полягає у відборі набору людських ділянок VH, які можуть паруватися з людськими ділянками VL scFv 5-306, вибраними, як описано вище. Приклад 2.3.1: Виділення РНК з моноядер них клітин периферичної крові МКПК) 100 мл крові відбирають у п'яти здорових донорів-людей. Моноядерні клітини периферичної крові (МКПК) виділяють за допомогою фіколлградієнту у відповідності до стандартних способів. Загальну РНК виділяють з МКПК із застосуванням набору RNeasy® Midi Kit (QIAGEN) у відповідності до інструкцій виробника. кДНК синтезують у відповідності до стандартних способів (Sambrook, Cold Spring Harbor Laboratory Press 1989, Second Edition). Приклад 2.3.2: ПЛР-ампліфікація варіабельних ділянок важкого ланцюга (VH-ділянок) Конструюють бібліотеку VH і називають Lib 134-VH. Одержана VH-бібліотека складається з людського репертуару FR1-CDR2-FR2-CDR2-FR3 з ПЛР-ампліфікованих VH-ділянок вищеописаного пулу МКПК, функціонально зв'язаних з VH CDR3 материнського антитіла з наступною послідовністю зародкової лінії FR4 людини. Для виділення людських шаблонних VHділянок здійснюють ПЛР із зворотною транскрипцією з використанням набору праймерів (5'huVH1,3,5-XhoI-2001 (5'-AGG TGC AGC TGC TCG AGT CTG G-3'), 5'-huVH4-XhoI-2001 (5'-CAG GTG CAG CTG CTC GAG TCG GG-3'), 5'-huVH4B-XhoI2001 (5'-CAG GTG CAG СТА CTC GAG TGG GG3')), а також набору двох 3'-VH-специфічних праймерів (3'-hu-VH-BstEII-2001 (5'-CTG AGG AGA CGG TGA CC-3'), 3'-hu-VH-J3-BstEII-2001 (5'-CTG AAG AGA CGG TGA CC-3')). В одній реакції ПЛР один 5'-праймер об'єднують з одним 3'-праймером; кількість різних реакцій ПЛР визначають за кількістю можливих комбінацій 5'- і 3'-праймерів. МКПК кДНК (як описано вище, тільки від чотирьох донорів застосовують як джерело VH-генів). Для ампліфікації застосовують наступну програму ПЛР: денатурацію при температурі 94 °С протягом 15 секунд, відпалювання праймера при температурі 52 °С протягом 60 секунд і подовження праймера при температурі 72 °С протягом 90 секунд здійснюють протягом 40 циклів, з наступним кінцевим подовженням при температурі 72 °С протягом 10 хвилин. Продукти ампліфікації розміром приблизно 350 пар основ виділяють у відповідності до стандартних способів. Для виділення Lib 134-VH-ділянок RT-ПЛР здійснюють в дві стадії. Спершу, здійснюють ПЛРампліфікацію VH-сегментів важкого ланцюга лю 94403 40 дини (FR1-CDR1-FR2-CDR2-FR3) з ізольованих шаблонних фрагментів VH із застосуванням такого ж набору 5'-VН-специфічних праймерів, як описано вище (5'-huVH1,3,5-XhoI-2001, 5'-huVH4-XhoI-2001, 5'-huVH4B-XhoI-2001) і набору 3'-специфічних праймерів (3'-Lib 134-VH-1A-MH3 (5'-GTA АТС ААА GTA GAC TGC TAT CAG ACC CGA ТСТ YGC АСА GTA ATA CAC GGC-3'), 3'-Lib 134-VH-1B-MH3 (5'GTA АТС ААА GTA GAC TGC TAT CAG ACC CGA TCT YGC АСА GTA ATA CAY RGC-3'), 3'-Lib 134VH-3A-MH3 (5'-GTA АТС ААА GTA GAC TGC TAT CAG ACC CGA TCT NGY АСА GTA ATA CAC RGC3'), 3'-Lib 134-VH-3B-MH3 (5'-GTA АТС ААА GTA GAC TGC TAT CAG ACC CGA TCT NGC АСА GTA ATA CAA RGC-3'), 3'-Lib 134-VH-4-MH3 (5'-GTA АТС ΑΛΑ GTA GAC TGC TAT CAG ACC CGA TCT SGC АСА GTA ATA CAC RGC-3')) для людських VH підродин 1, 3 і 4, типованих у значною мірою термінальній ділянці FR3. Застосовують наступні комбінації праймера: a) 5'-huVH1,3,5-XhoI-2001 × 3'-Lib 134-VH-1AMH3 b) 5'-huVH1,3,5-XhoI-2001 × 3'-Lib 134-VH-1BMH3 c) 5'-huVH1,3,5-XhoI-2001 × 3'-Lib 134-VH-3AMH3 d) 5'-huVH1,3,5-XhoI-2001 × 3'-Lib 134-VH-3BMH3 e) 5'-huVH4-XhoI-2001 × 3'-Lib 134-VH-4-MH3 f) 5'-huVH4B-XhoI-2001 × 3'-Lib 134-VH-4-MH3 В одній реакції ПЛР один 5'-праймер об'єднують з одним 3'-праймером, кількість різних реакцій ПЛР визначають за кількістю можливих комбінацій 5'- і 3'-праймерів. Для ампліфікації застосовують наступну програму ПЛР: денатурацію при температурі 94 °С протягом 15 секунд, відпалювання праймера при температурі 52 °С протягом 50 секунд і подовження праймера при температурі 72 °С протягом 90 секунд здійснюють протягом 40 циклів, з наступним кінцевим подовженням при температурі 72 °С протягом 10 хвилин. За допомогою такої стадії ПЛР і відповідної послідовності 3'праймера людські сегменти VH подовжуються для частини материнського VH CDR3, який далі, в свою чергу, стає сайтом праймування для 3'праймера на другій стадії ПЛР. Зазначені фрагменти ДНК VH-(FR1-CDR1FR2-CDR2-FR3) далі використовують як шаблони в другій реакції ПЛР, знову з використанням відповідного 5'УН-специфічного праймера та універсального 3' праймера, сумісного з універсальним 3'кінцем ампліфікованих фрагментів ДНК (3'-Lib 134JH3-BstE2, 5'-AGA GAC GGT GAC CAT TGT CCC TTG GCC CCA GTA АТС AAA GTA GAC TGC-3'). Для ампліфікації застосовують наступну програму ПЛР: денатурацію при температурі 94 °С протягом 15 секунд, відпалювання праймера при температурі 52 °С протягом 50 секунд і подовження праймера при температурі 72 °С протягом 60 секунд здійснюють протягом 40 циклів, з наступним кінцевим подовженням при температурі 72 °С протягом 10 хвилин. ДНК V-фрагментів виділяють у відповідності до стандартних протоколів. Приклад 2.3.3: Конструювання бібліотеки клонування пулу людських VH 41 В другому крузі описаного вище способу вибирають людський VL scFv 5-306, ідентифікований в ході першого, попереднього відбору, і далі поєднують з бібліотекою людських VH фрагментів, описаною в Прикладі 2.3.2 з метою створення людських scFv. Бібліотеку фагового дисплею загалом конструюють на базі стандартних процедур, наприклад, розкритих в "Phage Display: A Laboratory Manual"; Ed. Barbas, Burton, Scott & Silverman; Cold Spring Harbor laboratory Press, 2001. Фрагменти ДНК важких ланцюгів з різних ПЛРампліфікацій навантажують для кожного лігування, як вказано нижче: a:b:c:d:e:f = 3:1:3:1:1:1, де a-f мають наступні значення: a) 5'-huVH1,3,5-XhoI-2001 × 3'-Lib 134-VH-1AMH3 × 3'-Lib 134-JH3-BstE2 b) 5'-huVH1,3,5-XhoI-2001 × 3'-Lib 134-VH-1BMH3 × 3'-Lib 134-JH3-BstE2 c) 5'-huVH1,3,5-XhoI-2001 × 3'-Lib 134-VH-3AMH3 × 3'-Lib 134-JH3-BstE2 d) 5'-huVH1,3,5-XhoI-2001 × 3'-Lib 134-VH-3BMH3 × 3'-Lib 134-JH3-BstE2 e) 5'-huVH4-XhoI-2001 × 3'-Lib 134-VH-4-MH3 × 3'-Lib 134-JH3-BstE2 f) 5'-huVH4B-XhoI-2001 × 3'-Lib 134-VH-4-MH3 × 3'-Lib 134-JH3-BstE2 Одну реакцію лігування встановлюють для 400 нг пулу людського фрагмента Lib 134-VH (XhoIBstEII, ферментований) і 1200 нг плазмідного pComb3H5BHis/5-306 VL (ДНК, що кодує ділянку VL scFv 5-306, клонувють через рестрикційні сайти, Sad та і Spel в pComb3H5BHis у відповідності до стандартних процедур). Одержаний пул VH людських антитіл далі перетворюють на 300 мкл електрокомпетентної Escherichia coli XL1 Blue електропорацією (2,5 кВ, кювета проміжку 0,2 см, 25 мФ, 200 Ом, генератор генних імпульсів Biorad) з одержанням бібліотеки загальним розміром 1,6 × 10ехр8 незалежних клонів. Після електропорації реакційну суміш інкубують в бульйоні SOC (Fluka) для експресії фенотипу. Далі кожну культуру інкубують в 500 мл селекційного середовища SB, що містить 50 мкг карбеніциліну і 2 % глюкози (мас/об.) протягом ночі. Наступного дня клітини збирають центрифугуванням і одержують плазміди з використанням комерційно доступного набору для одержання плазмід (Qiagen) для збереження бібліотеки ДНК. 1,5 мкг даного пулу плазмід, що кодує відповідний пул scFv, електропорують в Е. соlі XL1 Blue (2,5 кВ, кювета проміжку 0,2 см, 25 мФ, 200 Ом, генератор генних імпульсів Biorad) з одержанням в підсумку бібліотеки розміром 2,4 × 10ехр9 незалежних клонів. Після експресії фенотипу і повільної адаптації до карбеніциліну бібліотеку антитіл переносять в селекційне середовище SBкарбеніцилін (50 мкг/мл). Далі бібліотеку антитіл інфікують дозою 1 × 10ехр12 частинок хелперного фага VCSM13, що приводять до продукування і секреції волоконного фага МІ3, де кожна частинка фага містить одноланцюгову рСоmb3Н5ВНіs-ДНК, що кодує людський scFv-фрагмент і показує відпо 94403 42 відний scFv-білок як трансляційне злиття з протеїном III покриття фага. Приклад 2.3.4: Вибір фагового дисплею людського VH Одержану бібліотеку фага, що містить клонований scFv-репертуар, збирають з супернатанту культури шляхом осадження PEG8000/NaCl і центрифугування. Від приблизно 1 × 10exp11 до 1 × 10ехр12 scFv частинок фага ресуспендують в 0,4 мл ФБР/0,1 % БСА та інкубують з рекомбінантним біотинільованим розчинним rhGM-CSF (матеріал Е. соlі, як описано вище в прикладі 1) протягом 2 год при обережному перемішуванні в загальному об'ємі 0,5 мл. Далі додають 6,7 × 10ехр7 магнітних гранули стрептавідину (Dynabeads M-280Streptavidin, Dynal), після чого інкубують при обережному перемішуванні протягом 30 хвилин. Фаг scFv, який неспецифічно зв'язується з цільовим антигеном, був виключений за допомогою стадій промивання ФБР/0,1 % БСА. Для цієї мети комплекси біотинільований антиген/гранули стрептавідину (з потенційними агентами для зв'язування scFv) збирають магнітом і ресуспендують в 1 мл розчину для промивання (одна стадія промивання). Вказану процедуру промивання повторюють чотири рази в подальших циклах. Після промивання агенти для зв'язування елююють із застосуванням НСІ-гліцину, рН 2,2. Після нейтралізації за допомогою 2 Μ Трис, рН 12, елюат використовують для інфікування культури свіжої неінфікованої Е. coli XL1 Blue. Для елюації решти агентів з високою активністю зв'язування гранули ресуспендують безпосередньо в 200 мкл свіжої культури Е. coli XL1 Blue (OD600 ≥ 0,5) та інкубують протягом 10 хвилин при обережному перемішуванні. Обидві інфіковані культури Е. coli далі змішують, після чого здійснюють селекцію клітин, які були успішно перетворені за допомогою копії фагеміди, яка кодує людський scFv-фрагмент, щодо резистентності до карбеніциліну, після чого їх інфікують хелперним фагом VCSM13, щоб розпочати другий круг дисплею антитіл та селекцію in vitro. Загалом здійснюють 4 круги селекції для двох антитіл. Концентрацію антигену зменшують протягом селекції до наступної кінцевої концентрації: 1. круг 100 нМ 2. круг 10 нМ 3. круг 10 нМ 4. круг 10 нМ Плазмідну ДНК з культури Е. coli виділяють у відповідності до кругів 3 і 4 пеннінгу. Для продукування розчинного scFv-білка фрагменти VH-VL-ДНК вирізають з плазмід (Sacl-Spel) і клонують через такі ж рестрикційні сайти в плазміду pComb3H5BFlag/His (без додаткових білків фага, необхідних для інфікування фагом). Після лігування кожний пул (різні круги пеннінгу) плазмідної ДНК перетворюють на 100 мкл компетентної Е. coli XL1 Blue, обробленої тепловим шоком, та вкривають нею карбеніциліновий LB-aгap. Окремі колонії переносять в 120 мкл LB-карбеніциліну (50 мкг/мл), 1 % глюкози в 96-лункових планшетах (Greiner). Лунку запечатують напівпроникною мембраною (Greiner) і планшети інкубують протягом ночі при температурі 37 °С в шейкерному інкуба 43 94403 торі (головний планшет). Далі по 10 мкл культур головного планшета переносять в другий 96лунковий планшет (робочий планшет), що містить 90 мкл LB-карбеніциліну (50 мкг/мл) та 0,1 % глюкози на лунку. Після інкубації протягом 4 год при температурі 37 °С в шейкерному інкубаторі індукують продукування scFv, додаючи 20 мкл LBкарбеніциліну 6 мМ PTG в кожну лунку. Після іншої стадії інкубації протягом ночі при температурі 30 °С та струшуванні, клітини піддають лізису, інкубуючи протягом 1 год при кімнатній температурі з 40 мкл лізисного буферу (400 мМ борної кислоти, 320 мМ NaCl, 4 мМ ЕДТА, рН 8, 2,5 мг/мл лізоциму). Решту клітин і уламки клітини відокремлюють центрифугуванням протягом 12 хвилин при 1900 × g (Hettich). Супернатанти, що містять молекули scFv, далі досліджують щодо зв'язування в аналізах ELISA. Детектування scFv-фрагментів, зв'язаних з іммобілізованим rhGM-CSF антигеном (Leukine) здійснюють з використанням анти-flag M2 (1 мкг/мл ФБР/1 % БСА), який детектують за допомогою кон'югованого з пероксидазою хріну специфічного поліклонального козиного анти-мишачого Fab2 антитіла (Dianova, 1 мкг ФБР/1 % БСА). Сигнал індукують додаванням розчину субстрату ABTS і детектують на довжині хвилі 405 нм. 12 із приблизно 100 клонів, досліджених після третього круга селекції, продемонстрували міцне зв'язування з rhGM-CSF. Приблизно із 160 клонів, перевірених після четвертого круга селекції понад 80 % лізатів продемонстрували інтенсивний сигнал в пробі ELISA в порівнянні з ФБР в ролі негативного контролю на рекомбінантному антигені. Результати для показових клонів наведені на Фіг. 4, де такі показові клони розташовані вздовж осі абсцис, та інтенсивність поглинання вказана на осі ординат. Як можна побачити з Фіг. 4, негативний контроль ФБР (другий справа на осі абсцис) не продемонстрував відчутного зв'язування, тоді як показові scFv клони scFv A, scFv 3035, scFv 3039, scFv 3080 і scFv 5-306 продемонстрували різні ступені потужності зв'язування в аналізі ELISA. Всі лізати досліджували без rhGM-CSF в паралельних експериментах щодо неспецифічного зв'язування з блокуючим агентом. Ніякий значний 44 сигнал, що піддається виявленню, не спостерігалося, вказуючи на специфічність зв'язування з rhGM-CSF. Була визначена послідовність ДНК для більш ніж 13 ELISA-позитивних клонів scFv. У підсумку, ідентифіковані шість різних послідовностей. Всі послідовності мали людське походження і були тісно пов'язані з послідовністю зародкової лінії людини VH-1 1-02. Приклад 2.3.5: Характеристика людських scFv конструктів, що містять людські ділянки VL та VH Приклад 2.3.5.1: Продукування та очищення у великих масштабах конструктів досліджуваних scFv, продукованих за способом, описаним в Прикладі 3 Досліджувані scFv виділяють та очищають, як описано в Прикладі 2.2.6.3. Приклад 2.3,5,2: Аналіз кінетики зв'язування досліджуваного scFv за допомогою резонансу поверхневого плазмону (SPR) Метою експерименту є поглиблений опис досліджуваного scFv. Кінетику зв'язування (kd і kа) для досліджуваних scFv вимірюють шляхом ін'єкції 10 мкл очищеного білка в серію розведень від 10 мкг/мл до 1 пг/мл очищеного scFv і контролю дисоціації при температурі 25 °С протягом 100 сек. Білок буферизують в HBS-EP (0,01 Μ HEPES, рН 7,4, 0,15 Μ NaCl, 3 мМ ЕДТА, 0,005 % поверхневоактивної речовини Р20). Дані апроксимують із застосуванням програмного забезпечення BIAevalution™ для визначення константи швидкості дисоціації та параметрів кінетики асоціації за допомогою рівняння зв'язуванні Ленгмюра 1:1 (Формули 1 і 2), де А являє собою концентрацію аналізованої речовини, яку вводять ін'єкційним способом, і В являє собою концентрацію ліганду. dB/dt = -(kа*[А]*[В] - kd*[AB]) (1) dAB/dt = -(ka*[A]*[В]-kd*[AB]) (2) Кінетичні криві зв'язування були визначені із застосуванням до 8 концентрацій кожного з досліджуваних scFv. Незалежна апроксимація первинних даних давала константи швидкості дисоціації та асоціації, які використовують для обчислення рівноважної константи дисоціації (KD, результати наведені в табл. 1). Таблиця 1 3035 3039 scFvA 3080 Kа [1/Mc] 5 5 1,6 × 10 ± 1,1 × 10 4 4 0,6 × 10 ± 0,4 × 10 6 6 1,7 × 10 ± 1,1 × 10 5 5 1,0 × 10 ± 0,5 × 10 kd [1/c] -3 -3 1,5 × 10 ± 0,4 × 10 -4 -4 0,9 × 10 ± 0,1 × 10 -3 -3 1,6 × 10 ± 0,2 × 10 -3 -3 3,5 × 10 ± 0,2 × 10 Приклад 2.3.5.3: Інгібування залежної від rhGM-CSF проліферації клітини TF-1 досліджуваними scFv Після підтвердження того, що потужність специфічного зв'язування зберігається у досліджуваних scFv, даний експеримент має на меті оцінити специфічність взаємодії досліджуваного scFv з антигеном rhGM-CSF. Інгібування біологічної функції антигену rhGM-CSF шляхом зв'язування з scFv KD [M] -8 0,9 × 10 -6 1,7 × 10 -9 1,2 × 10 -8 3,5 × 10 IC50 [нМ] 3,2 130,5 2,6 19,1 досліджуваои в експерименті з інгібування проліферації TF-1. Експерименти з інгібування проліферації TF-1 здійснюють, як описано вище. Клітини ресуспендують в кінцевій концентрації 1 × 10ехр5 клітин/мл в RPMI 1640, 10 % сироватки телячих ембріонів і 90 мкл суспензії клітини на лунку (0,9 × 10ехр4 клітин/лунку). Застосовують кінцеву концентрацію 0,3 нг/мл rhGM-CSF для стимуляції проліферації клітини TF-1. Для нейтралізації залежної від rhGM 45 CSF проліферації додають очищений scFv в 1 × ФБР в серійні розведення з кінцевою концентрацією білка в інтервалі від 100 мкг до 10 пг/мл. 10 мкл діалізованого та обробленого стерильною фільтрацією розчину білка (фільтр з розміром отворів 0,22 мкм) додають до 100 мкл розчину, що містить TF-1 і rhGM-CSF. Зразки інкубують при температурі 37 °С з 5 % СО2 протягом 72 год. Після проходження 72 год проліферативний статус клітини TF1 визначають шляхом додавання WST-1 і контролю колориметричних змін за допомогою пристрою для зчитування ELISA на довжині хвилі 450 нм (Фіг. 5). Як можна побачити на Фіг. 5, чітко продемонстрована нейтралізуюча активність по відношенню до людського GM-CSF. ScFv А продемонстрував найвищу нейтралізуючу активність. Приклад 2.4: Оптимізація характеристик зв'язування відібраних scFv Передбачається, що біологічна активність нейтралізуючого агента для мономерного ліганду може бути покращена або навіть оптимізована шляхом збільшення міцності зв'язування між нейтралізатором і лігандом, зокрема, збільшенням швидкості дисоціації нейтралізатора. Це переважно може бути досягнуте шляхом мутації послідовності відповідної ділянки VH та VL випадковим чином, шляхом (і) вставки однієї або більше мутацій випадковим чином у всій послідовності або (іі) вставки однієї мутації або множинних суміжних мутації (наприклад, ділянки довжиною п'ять, шість, сім, вісім, дев'ять або десять амінокислот) в ділянки scFv, які мають високу ймовірність взаємодії з антигеном. Відповідні мутанти далі повинні бути описані щодо за будь-якою зростання активності або, до опису, повинні бути збагачені переважними якостями (наприклад, більш міцне зв'язування) за допомогою придатних способів селекції (тобто, фагового дисплею). Приклад 2.4.1: Збільшення спорідненості за допомогою мутації VH CDR3 в одному або більше положеннях Для покращення характеристик зв'язування фрагмента антитіла, наприклад, молекули scFv, за допомогою одиничних точкових мутацій або коротких фрагментів секвенування амінокислот, мішенню повинні служити амінокислотні залишки, які мають найвищу ймовірність взаємодії з відповідним антигеном. При такому підході немає необхідності в скринінгу більш ніж обмеженої кількості мутантів без зменшення ймовірності успіху. Важкий ланцюг CDR3 антитіла або його фрагмент звичайно високою мірою сприяє загальному зв'язуванню антигену даним антитілом або фрагментом антитіла. Таким чином, передбачається, що перспективним шляхом збільшення спорідненості зв'язування антитіла або фрагмента антитіла може бути мутація нуклеотидної послідовності, що кодує VH CDR3. Існують різноманітні методології здійснення такого цілеспрямованого випадкового мутагенезу, деякі з них описані нижче з точки зору того, яким чином може бути збільшена спорідненість зв'язування вищеописаних молекул scFv: A) Для досягнення VH CDR3 придатний рестрикційний сайт повинен бути введений в нуклео 94403 46 тидну послідовність в межах VH CDR3, переважно синтезом гена повної ділянки VH із зміненою нуклеотидної послідовністю CDR3, зберігаючи оригінальну амінокислотну послідовність (Entelechon, Німеччина). За допомогою розщеплення відповідним рестрикційним ферментом і додавання S1 нуклеази/ДНК полімерази І Klenow і dGTP та далі мутантного дуплексного олігомеру, цілеспрямований випадковий мутагенез в одному або більше положеннях амінокислот може бути здійснений у відповідності до Matteucci and Heyneker, Nucleic Acids Research 11: 3113 ff (1983). Мутантні VH далі об'єднують з відповідним VL (за допомогою придатного лінкера) в придатному векторі експресії scFv і трансформують в клітини Е. соlі. Далі можуть бути відібрані одиничні колонії, що експресують варіанти scFv, і здійснений скринінг щодо покращених scFv, як описано для скринінгу та опису успішних і досліджуваних scFv в попередніх прикладах. B) Альтернативний спосіб являє собою опосередкований олігонуклеотидом мутагенез по методи подвійного праймера, як детально описано в Sambrook, Fritsch, Maniatis (1989) "A laboratory manual". По суті, ділянку VH клонують у вектор на базі МІ3 та виділяють одноланцюгову плазміду. Праймер, здатний до гібридизації з одноланцюговим шаблоном плазміди, що містить рандомізовану послідовність, відпалюють та подовжують. Після розповсюдження відповідного пулу плазмід в Е. соlі, мутантні VH можуть бути зібрані з пулу плазмід та поєднані з оригінальним VL (за допомогою придатного лінкера) в придатному векторі експресії scFv і трансформовані у клітини Е. соlі. Далі можуть бути відібрані одиничні колонії, що експресують варіанти scFv, і здійснений скринінг щодо покращених scFv, як описано для скринінгу та опису успішних і досліджуваних scFv в попередніх прикладах. С) Інша альтернатива полягає в мутації суміжних амінокислот в кількості до шести або навіть більше поспіль. Для цього може бути сконструйований делеційний варіант нуклеотидної послідовності VH, де CDR3 і FR4 видалені. Таку конструкцію використовують як шаблон для одно-або двохстадійної ПЛР ампліфікації, де придатний 5'праймер (що гібридизується з 5'-кінцем послідовності VH і додає придатний сайт клонування) об'єднують з набором 3'-праймерів, які відпалюють на 3' кінці ділянки FR3 як шаблон і додають ділянку CDR3 і FR4 (з придатним рестрикційним сайтом) до фрагмента ампліфікації. Такий набір 3'праймерів містить послідовність одного або більше триплетів для вставки випадкових ко донів в послідовність CDR3. Даний пул ділянок VH, що містить рандомізовані ділянки CDR3, в подальшому може бути поєднаний з відповідним VL (за допомогою придатного лінкера) в придатному векторі експресії scFv і трансформований у клітини Е. соlі. Далі можуть бути відібрані одиничні колонії, що експресують варіанти scFv, і здійснений скринінг щодо покращених scFv, як описано для скринінгу та опису успішних і досліджуваних scFv в попередніх прикладах. 47 Відповідні пули мутантних scFv, яким притаманна більш висока міра різноманітності (що може бути легко виявлено за допомогою скринінгу), можуть бути клоновані в придатний вектор фагового дисплею і далі покращені scFv можуть бути відібрані за допомогою фагового дисплею на цільовому антигені, переважно за умов зменшення концентрацій антигену для селекції більш високої спорідненості. Селекцію за допомогою фагового дисплею здійснюють у відповідності до стандартних протоколів, як описано будь-де в даному описі. Будь-який із згаданих вище способів А-С може бути поєднаний або здійснений у вигляді повторних циклів для подальшого удосконалення та оптимізації вже модифікованих scFv. Приклад 2.4.2: Збільшення спорідненості шляхом мутації У-ділянки випадковим чином по всій послідовності Замість мутації специфічних сайтів scFv, які мають високу ймовірність взаємодії з відповідним антигеном, більш догматичний підхід може бути здійснений шляхом введення точкових мутацій по всій послідовності VH та/або VL з подальшим скринінгом щодо оптимізованих scFv або селекцією і скринінгом щодо оптимізованих scFv. Наприклад, може бути здійснена мутація послідовності VH та/або VL із застосуванням мутаторних штамів Е. соlі (як описано в Low et al. 260: 359 ff J Мої Biol (1996)) або неправильної інкорпорації нуклеотидів за допомогою ДНК полімераз, як детально описано в Sambrook, Fritsch, Maniatis (1989) "A laboratory manual". Клонування, експресія та селекція оптимізованих варіантів молекул scFv можуть бути здійснені за допомогою фагового дисплею або розповсюдженої технології дисплею рибосоми (як описано в ЕР 0 975 748 А1). Оптимізовані версії експресують в придатних системах вектор/Е, соїі для скринінгу щодо покращених кандидатів scFv. Придатна методологія, як описано вище в Прикладі 2.4, буде застосована для оптимізації показового успішного scFv (scFv), що привело до класу фрагментів моноклонального, людського нейтралізуючого анти-GM-CSF антитіла, представлених scFv молекулами B-N. Характеристики цих молекул scFv будуть пояснені і додатково описані в наступних прикладах. Генерація моноклональних молекул IgG з відібраних молекул scFv описана в наступному прикладі. Приклад 3: Клонування та експресія в еукаріотних клітинах моноклональних антитіл з відібраними scFv Хоча відомо, що бактерії експресують функціональні Fab фрагменти, вони звичайно нездатні до продукування повністю функціональних імуноглобулінів. Для продукування повністю функціональних антитіл необхідно використовувати клітини ссваців, і, таким чином, ділянка VL scFv 5-306 та різні ділянки VH молекул scFv, відібраних в попередніх прикладах, субклонують у вектори експресії ссавців (особливо VH ділянки scFv А таscFv В). Приклад 3.1: Клонування людського легкого ланцюга на базі scFv 5-306 Для створення придатних термінальних рестрикційних сайтів, фрагмент ДНК, що кодує ділянку VL scFv 5-306, повторно ампліфікують за допомо 94403 48 гою ПЛР з одержанням фрагментів Vkappa з сайтом Bsu36I на 5'-кінці та сайтом Xhol на 3'-кінці. Даний фрагмент далі субклонують в плазміду BSPOLL в Bsu36I і Xhol з використанням 5'праймера (5'ACGTCACCTTAGGTGTCCACT CCGATATCCAGATGACCCAGTCTCCATCTTC CGTGTCTGC-3') і 3'-праймера (5'CATGCACTCGAGCTTGGTCCCTCCGCCGAAAG3'), таким чином додаючи лідерну послідовність ссавців і постійну ділянку Скарра людина, що перевіряють секвенуванням. З використанням EcoRI і Sail, ДНК 5-306 VL-Ckappa вирізають з BSPOLL та субклонують в еукаріотний вектор експресії pEFADA, що походить з вектора експресії pEF-DHFR (Mack et al. (1995) Proc. Natl. Acad. Sci. USA. 92, 7021-5), замінюючи кДНК, що кодує мишачу дигідрофолатредуктазу (DHFR), на ДНК, що кодує мишачу аденозиндезаміназу (ADA). Приклад 3.2: Клонування варіабельних ділянок важкого ланцюга людини Варіабельні ділянки з різних людських ділянок VH, відібраних в попередніх прикладах (особливо VH ділянки scFv А та scFv В), повторно ампліфікують за допомогою ПЛР, створюючи рестрикційні сайти Bsu36I на обох кінцях. Для всіх конструктів використовують комбінацію двох праймерів: 5'праймер VH-Bsu36I (5'ACGTCACCTTAGGTGTCCACTCCCAGGT?GCAGCTGGT CCAGTCTGGGGCT GAGGTGAAGAAGC-3') і 3'-праймер (5'ACGTCACCTGAGGAGACGGTGACCATTGTC CCTTG-3'). Одержані фрагменти ДНК далі субклонують з використанням таких рестрикційних сайтів в еукаріотний вектор експресії pEF-DHFR, що вже містить еукаріотну лідерну послідовність і фрагмент ДНК, який кодує постійну ділянку важкого ланцюга IgG1 людини. Таким чином, варіабельні ділянки важкого ланцюга були вставлені між лідерною послідовністю і постійною ділянкою важкого ланцюга. Правильність послідовностей варіабельних ділянок підтверджено секвену ванням. Приклад 3.3: Перетворення фрагментів scFv на повні людські IgG Плазміду, що кодує легкий ланцюг (VL 5-306/Скарра), і плазміду, що кодує один важкий ланцюг (постійна ділянка VH/людського IgG1), співтрансфікують в клітини НЕК у відповідності до стандартних протоколів для тимчасової експресії білка і клітини культивують, щоб дозволити експресію і продукування імуноглобулінів в середовище для культивування. У такий спосіб продукують IgG А, що базується на scFv А, та IgG В, що базується на scFv В. Після відповідного періоду продукування супернатанти збирають і людські імуноглобуліни виділяють за допомогою хроматографії з використанням протеїну А у відповідності до стандартних протоколів очищення імуноглобулінів. Очищені імуноглобуліни використовують для подальших експериментів з метою опису. Приклад 3.4: Повторне перетворення вибіркових IgG на фрагменти scFv Ділянки VH з конструктів IgG (IgG А та IgG В, як описано вище) повторно клонують в придатний вектор експресії scFv у від 49 повідності до стандартних протоколів та функціонально зв'язують за допомогою гнучкого лінкера з ділянкою VL, що походить з людського легкого ланцюга у відповідності до Прикладу 3.1. Такі конструкти продукують розчинними в периплазмі Е. соlі, як описано вище. Опис зазначених scFv (scFv О, що походить з IgG, та scFv Ρ, що походить з IgG В) описаний в наступних прикладах. Приклад 4: Оцінка специфічності зв'язування людського моноклонального анти-GM-CSF антитіла з GM-CSF людини і приматів Мета даного експерименту є продемонструвати, що антитіло, одержане описаним вище чином, специфічно зв'язується з GM-CSF. Таким чином, зв'язування такого антитіла з різними рекомбінантними людськими ("rh") колонієстимулюючими факторами (rhGM-CSF і rhM-CSF, Strathmann) порівнюють із зв'язуванням такого ж антитіла з rhGMCSF за методом ELISA. 50 мкл конкретного антигену (1 мкг/мл у ФБР) вкривають планшет ELISA (Nunc, Maxisorp) протягом 1 год. при кімнатній температурі. Після триразового промивання ФБР/0,05 % Твіну 20 лунку блокують з використанням 200 мкл ФБР/3 % порошку нежирного сухого молока на лунку протягом 1,5 год. при кімнатній температурі, з наступним триразовим промиванням ФБР/0,05 % Твіну 20. 50 мкл/лунку серій людських антитіл (наприклад, IgG А та IgG В), кожен з ідентичними легкими ланцюгами послідовності у відповідності до SEQ ID NO. 34, але з різними важкими ланцюгами у відповідності до SEQ ID NO. 35-48 додають в серії розведень в інтервалі від 1 мкг/мл до 0,5 нг/мл (у ФБР/0,05 % Твіну 20/3 % порошку нежирного сухого молока) та інкубують протягом 1 гол. Після триразового промивання ФБР/0,05 % Твіну 20, зв'язане антитіло виявляють із застосуванням 50 мкл кон'югованого з пероксидазою хріну козиного антилюдського антитіла IgG (Dianova; розведене 1:1000 розбавлений в ФБР/0,05 % Твіну 20/3 % порошку нежирного сухого молока). Сигнал індукують додаванням 50 мкл/лунку розчину ABTS (Roche) і абсорбцію вимірюють на довжині хвилі 405 нм з використанням довжини хвилі 450 нм для порівняння. Комерційно доступні кролячі антитіла (Strathmann Biotech AG), специфічні по відношенню до rHM-CSF і rHG-CSF, відповідно, застосовують як засоби позитивного контролю для зв'язування із зазначеними антигенами, причому таке зв'язування виявляють за допомогою кон'югованого з лужною фосфатазою козиного анти-кролячого антитіла. Сигнал індукують за допомогою 50 мкл/лунку pNpp-розчину (Sigma) та оптичну густину вимірюють на довжині хвилі 405 нм з використанням для порівняння довжини хвилі 450 нм. Результати показані на Фіг. 6, 7 і 8 для двох показових людських антитіл, IgG А та IgG В. Як можна побачити на Фіг. 6, збільшення концентрації титрованого антитіла приводить до збільшення абсорбції та вказує на добре зв'язування з rhGM-CSF обох показових IgG А та В. Фіг. 7 демонструє результати зв'язування з rHM-CSF тих же двох показових антитіл. Як можна побачити з даних фігури, підвищення концентрації кролячого 94403 50 анти-rНМ-CSF антитіла веде до збільшення абсорбції, тобто збільшення зв'язування з даним контрольним антитілом (суцільні точки), тоді як два показові антитіла, описані вище (суцільні квадрати і суцільні трикутники)), накладені, оскільки безперервна базова абсорбція не збільшується з підвищенням концентрації досліджуваного антитіла. Повністю аналогічний результат спостерігається як для контрольного антитіла, так і для показових досліджуваних IgG А та В на Фіг. 8, демонструючи результати зв'язування rHG-CSF. Взяті разом, наведені на Фіг. 6, 7 і 8 дані показують, що два показових досліджуваних антитіла IgG А та В специфічно пов'язуються з rhGM-CSF, але не з іншими колонієстимулюючими факторами, такими як M-CSF і G-CSF. Така специфічність зв'язування з антигеном є важливою для перспективного терапевтичного агента-антитіла. Приклад 5: Характеристика даних зв'язування для людських моноклональних анти-GM-CSF антитіл та їх фрагментів Бажаним було створити якісну класифікацію різних членів, ідентифікованих як позитивні агенти для зв'язування rhGM-CSF за допомогою аналізу ELISA, як описано вище в Прикладі 2. Класифікація мала на меті відображати параметри кінетики (швидкість дисоціації) і рівноваги (спорідненість) різних показових агентів для зв'язування антитіла, ідентифікованих таким чином. Для цього здійснювали резонанс поверхневого плазмону (SPR) на приладі ВІАсоrе™ 2000, Biacore AB (Uppsala, Швеція) з швидкістю потоку 5 мкл/хв та HBS-EP (0,01 Μ HEPES, рН 7,4, 0,15 Μ NaCl, 3 мМ ЕДТА, 0,005 % поверхнево-активної речовини Р20) як буферу аналізу при температурі 25 °С. Рекомбінантний людський GM-CSF (Leukine, Berlex, в подальшому має назву "антиген" або "rhGM-CSF") продукований дріжджами, іммобілізують на протокових кюветах 2-4 на сенсорній мікроплаті СМ5. Поверхню мікроплати активують шляхом ін'єкції 80 мкл 0,1 Μ натрій-гідроксисукциніміду, 0,4 Μ К-етил-]Ч'(3диметиламінопропіл)-карбодіміду (NHS/EDC). Антиген сполучають шляхом ін'єкції вручну 10 мкг rhGM-CSF в 0,01 Μ натрію ацетаті, рН 4,7. Антиген іммобілізують на протокових кюветах 2-4 з різною щільністю, здійснюючи корекцію за допомогою ін'єкцій вручну. Протокову кювету 1 залишають у незміненому вигляді, тоді як кювету 2 вкривають rhGM-CSF з найвищою можливою щільністю (800 умовних одиниць). Кювету 3 вкривають 50 % кількості антигену, іммобілізованого на кюветі 2, і кювету 4 вкривають rhGM-CSF з найменшою щільністю (звичайно 10 %). Активізовану поверхню сенсорної мікроплати блокують шляхом ін'єкції 85 мкл 1 Μ етаноламіну і уламок залишають врівноважуватися протягом ночі при постійній швидкості потоку 5 мкл/хв HBS-EP. Приклад 5.1: Якісне визначення кінетичних параметрів зв'язування (швидкість дисоціації) для фрагментів scFv людських моноклональних антиGM-CSF антитіл Експерименти Віасоrе здійснюють, як описано в попередньому параграфі. Перед експериментом здійснюють діаліз білкових елюатів периплазматичного препарату ("РРР") проти ФБР при темпера 51 турі 25 °С протягом 2 год і розводять 1:1 в HBSEP. Параметри кінетики зв'язування членів заявленого класу вимірюють шляхом ін'єкції 10 мкл розчину очищеного периплазматичного білка при температурі 25 °С над сенсорною мікроплатою. Неспецифічну фонову адсорбцію білка до незміненої поверхні (FC1) сенсорної мікроплати віднімають від сигналу реакції в протокових кюветах з іммобілізованим rhGM-CSF (FC2, FC3, FC4). Визначають відносний сигнал реакції (FC2-1, FC3-1, FC4-1) і контролюють питому швидкість дисоціації протягом 100 сек. Результати цих експериментів показані на Фіг. 9 для серій показових фрагментів scFv, які наперед були попередньо ідентифіковані позитивним чином як агенти для зв'язування rhGM-CSF в експериментах ELISA. Показові фрагменти антитіла scFv, для яких дані Віасоrе показані на Фіг. 9, є такими, як вказано нижче: scFv A, scFv В, scFv С, scFv D, scFv Ε, scFv F, scFv G, scFv H, scFv I, scFv J, scFv K, scFv L, scFv Μ та scFv N. Загалом, при інтерпретації результатів Віасоrе, амплітуда піку зв'язування (RUmax) безпосередньо корелює з концентрацією білка в ін'єкційно введеному зразку. Кінетична швидкість асоціації (ка) залежить від концентрації і, внаслідок варіабельності концентрацій білка в РРР, не може бути використана для якісної класифікації членів заявленого класу. Кінетична швидкість дисоціації (kd) не залежить від концентрації білка і є показовою для міцності зв'язування відповідних членів заявленого класу. Всі ідентифіковані члени заявленого класу демонструють специфічне зв'язування з іммобілізованим rhGM-CSF. Ідентифіковані члени заявленого класу з найкращою очевидною швидкістю дисоціації і, після подальшого співставлення даних SPR з даними інгібування, представлені для визначення спорідненості через експерименти рівноваги зв'язування на ВІАсоrе. На Фіг. 9 можна побачити чіткі окремі піки для кожного з показових фрагментів scFv антитіла A-N, кожна з верхніх частин яких показує характерну кривизна, яка може бути апроксимована для одержання швидкості дисоціації для цільового фрагмента scFv. Далі можна зробити якісний висновок про те, що кожний з показових фрагментів scFv добре зв'язується з людським GM-CSF. Приклад 5.2: Кількісне визначення параметрів рівноваги зв'язування (спорідненість) для деяких людських анти-GM-CSF антитіл та їх scFv фрагментів В Прикладі 5.1 було якісно встановлено, що цілий ряд фрагментів scFv анти-GM-CSF антитіл, які попередньо давали позитивний результат в 94403 52 дослідженні зв'язування з GM-CSF за допомогою аналізу ELISA, демонструють розумні кінетичні швидкості дисоціації при зв'язуванні з людським GM-CSF. Далі було бажаним одержати кількісне представлення такого зв'язування для антитіл та їх фрагментів, зосереджуючись на характеристиках рівноваги зв'язування з рекомбінантним людським GM-CSF. Як показано вище в Прикладі 4, специфічне зв'язування з антигеном - в даному випадку rhGM-CSF - є однією з показових і специфічних властивостей класу анти-GM-CSF антитіл та їх фрагментів, як заявлено в даному описі. Кінетику зв'язування (швидкість дисоціації, kd, та швидкість асоціації, ка) деяких показових членів класу людських анти-GM-CSF антитіл та їх фрагментів вимірюють шляхом ін'єкційного введення 10 мкл очищеного білка (тобто антитіла або його фрагменту) в серійні розведення в інтервалі від 10 мкг/мл до 1 пг/мл очищеного білка та контролю дисоціації при температурі 25 °С протягом 100 сек. Очищений білок буферизують в HBS-EP. Дані апроксимують із застосуванням програмного забезпечення BIAevalution™ для визначення константи швидкості дисоціації та параметрів кінетики асоціації за допомогою рівняння зв'язуванні 1:1 зв'язування Langmuir (див. формули 1 і 2 нижче), де А являє собою концентрацію аналізованої речовини, яку вводять ін'єкційним способом, і В[0] являє собою Rmax: dB/dt = -(kа*[А]*[В] - kd*[AB]) (формула 1) dAB/dt =-(kа*[А]*[В] - kd*[АВ]) (формула 2) Кінетичні криві зв'язування визначають на серії до 8 концентрацій кожного досліджуваного показового людського анти-GM-CSF антитіла або його фрагмента. Незалежна апроксимація первинних даних давала константи швидкості дисоціації та асоціації, які використовують для обчислення рівноважної константи дисоціації (KD). Результати, одержані для кожного показового людського антиGM-CSF антитіла або його фрагмента наведені на Фіг. 10 - 17. Конкретно, Фіг. 10 демонструє дані зв'язування, одержані для показового IgG В; Фіг. 11 демонструє дані зв'язування, одержані для показового IgG А; Фіг. 12 демонструє дані зв'язування, одержані для показового scFv С; Фіг. 13 демонструє дані зв'язування, одержані для показового scFv І; Фіг. 14 демонструє дані зв'язування, одержані для показового scFv В, Фіг. 15 демонструє дані зв'язування, одержані для показового scFvA; Фіг. 16 демонструє дані зв'язування, одержані для показового scFv E; і Фіг. 17 демонструє дані зв'язування, одержані для показового scFv D. Дані підсумовані в табл. 2 нижче. 53 94403 54 Таблиця 2 Кількісні дані спорідненості зв'язування для деяких показових людських анти-GM-CSF антитіл та їх фрагментів Антитіло / його фрагмент ScFv A scFv B ScFv E scFv C scFv D ScFv I IgG A IgG B -1 -1 -1 На фігурі ka (с М ) kd (с ) KD(M) 7G 7F 7H 7D 71 7E 7C 7B 4,41 exp5 ± 3,00 exp5 1,01ехр6 ± 4,08 exp5 1,26 exp5 ± 5,57 exp4 1,73 exp5 ± 8,23 exp4 7,60 exp5 ± 6,70 exp5 2,32 ехр6 ±2,13 exp5 2,09 ехр6 ± 1,32 ехр6 3,63 exp5 ± 2,40 exp5 1,84 exp-3 ± 6,55 exp-4 8,07 exp-4 ± 3,73 exp-5 2,55 exp-4 ± 8,12 exp-5 4,77 exp-4 ± 1,91 exp-4 8,66 exp-4 ± 2,13 exp-4 3,47 exp-4 ± 8,78 exp-5 1,81 exp-4 ± 8,77 exp-5 1,68 exp-5 ± 5,74 exp-6 4,17 exp-9 7,98 exp-10 2,03 exp-9 2,76 exp-9 1,14 exp-9 1,50 exp-9 8,70 exp-11 4,64 exp-11 Приклад 6: Мінімальні вимоги до епітопу для показового фрагмента антитіла проти GM-CSF людини Було бажаним визначити епітоп, з яким зв'язується людське анти-GM-CSF антитіло і його фрагменти, описані і заявлені в даному описі. Для цього здійснюють аналіз пептидного споттингу ("пепспот") із застосуванням scFv як показового члена даного класу молекул, і людського GM-CSF як антигену. Загалом, експеримент пепспот здійснюють, як вказано нижче. 13mer пептиди, що частково перекриваються і походять з амінокислотної послідовності hGM-CSF (інформацію щодо послідовності GM-CSF людини і деяких інших приматів див. вище, а також див. Фіг. 18 і SEQ ID NO: 49-51), були ковалентно зв'язані з целюлозною мембраною Ватман 50 за С-кінцем, тоді як ацетильований Nкінець залишався вільним. Окремі утворені 13mer пептиди (JPT Peptide Technologies GmbH)) показані в табл. 3 нижче. Довжина послідовності, що частково перекривається, для будь-яких двох відповідних пептидів була встановлена на рівні 11 амінокислот. У відповідності до протоколу виробника мембрану промивають абсолютним EtOH протягом 1 хвилин з наступним промиванням TBS і блокуванням за допомогою TBS/3 % БСА протягом ночі. Як і у випадку подальшої інкубації та промивання блокування здійснюють при кімнатній температурі. Після триразового промивання TBS/0,05 % Твіну 20 протягом 10 хвилин мембрану інкубують з 1 мкг/мл scFv в TBS/3 % БСА протягом 2,5 год з подальшим промиванням, як описано нижче. Визначення scFv здійснюють з використанням анти-Penta-His антитіла (Qiagen, 0,2 мкг/мл в TBS/3 % БСА) з наступною інкубацією кон'югованого з пероксидазою хріну козиного анти-мишачого IgG (Fc-гамма-специфічного) антитіла (Dianova, 1:10,000 в TBS/3% БСА) з кожним із відповідних вказаних антитіл протягом 1 год. Після триразового промивання TBS/0,05 % Твіну 20 протягом 10 хвилин з'являється сигнал у вигляді підвищеної хемілюмінесценції (SuperS ignal West Pico Luminol/Enhancer Solution та SuperSignalWest Pico StablePeroxide Solution; Pierce) і експозиція плівки ВіоМах (Кодак). Інтенсивні сигнали зв'язування scFv з фрагментів секвенування людського GM-CSF були виявлені на точках фрагментів секвенування пептиду між точками А та В, а також на точці С (див. табл. З нижче та Фіг. 19). Як можна побачити на Фіг. 19, зв'язування з іншими точками здається, має меншу міцність. Точки фрагментів пеннінгу А та В відповідають амінокислотним залишкам 15-35. Всі 13mer пептиди, з яких складається дана ділянка, містять один мінімальний фрагмент секвенування амінокислот 23-27 (RRLLN). Точка С відповідає залишкам амінокислот 65-72 (GLRGSLTKLKGPL) людського GM-CSF. Одержані дані свідчать про те, що scFv А, ймовірно, розпізнає безперервний епітоп. У вторинній структурі людського GM-CSF амінокислоти 15-35 розташовані в спіралі А, тоді як залишки, що відповідають точці С, являють собою частину петльової структури, розміщеної між спіралями С і D. Тривимірна модель згортання молекули виявляє стеричну близькість цих сайтів по відношенню один до одного. Мінімальний мотив амінокислотної послідовності в пептидах точок А-В відповідає залишкам 23-27 людського GM-CSF (RRLLN). Підвищена інтенсивність сигналу з точок А до В може бути пояснена кращою доступністю епітопу RRLLN у пептиді, що відповідає точці В, ніж в пептиді, що відповідає точці А. В пептиді А епітоп розміщений безпосередньо на С-кінці, що зв'язаний з мембраною, тоді як в пептиді В він розміщений на більш доступному N-кінці пептиду. 55 94403 56 Таблиця 3 Послідовності пептидів 13mer, що частково перекриваються, іммобілізованих на целюлозній мембрані Приклад 7: Потужність нейтралізації для деяких людських "анти-GM-CSF людини" антитіл/фрагментів антитіл Приклад 7.1: Якісна оцінка потенціалу нейтралізації деяких показових людських "анти-GM-CSF людини" антитіл та їх фрагментів Мета даного експерименту полягає в одержанні якісної інформації щодо нейтралізуючої активності показових людських нейтралізуючих антиGM-CSF антитіл та їх фрагментів. Для цього використовують лінію GM-CSF-залежних клітин людини TF-1 (DSMZ, АСС 334). Швидкість проліферації даної лінії клітин залежить від присутності людського GM-CSF, таким чином, що вимірювання росту клітин після інкубації клітин з людським GM-CSF з антитілом або без антитіла, для якого припускається наявність GM-CSF-нейтралізуючої активності, може бути використане для визначення фактичної наявності такої нейтралізуючої активності. Клітини TF-1 культивують в середовищі RPMI 1640 (Gibco; L-глутамін, не містить фенольного червоного) з 10 % інактивованої нагріванням FCS в присутності 2,5 нг/мл rhGM-CSF, як описано дистриб'ютором (Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH, Braunschweig, Німеччина). Клітини культивують до щільності клітин 0,5 × 10ехр6 клітин/мл. Для аналізу проліферації клітини TF-1 збирають центрифу гуванням при 300 × g протягом 4 хвилин і промивають 1 × ФБР (Dulbecco's, Gibco). Клітини ресуспендують до кінцевої концентрації 1 × 10ехр5 клітин/мл в RPMI 1640, та вносять 10 % сироватки телячих ембріонів і 90 мкл суспензії клітин в кожну лунку з пласким дном планшету для культивування клітин Microtest (0,9 × 10ехр4 клітин/лунку). Використовують кінцеву концентрацію 0,3 нг/мл rhGM-CSF для стимуляції проліферації клітин TF1. Для нейтралізації GM-CSF залежної проліферації очищений РРР показових фрагментів людського анти-GM-CSF антитіла піддають діалізу проти 1 × ФБР при температурі 25 °С протягом 2 год. Діалізат стерилізують фільтрацією (фільтр з розміром отворів 0,22 мкм) та 10 мкл одержаного розчину білка додають до 100 мкл розчину що містить TF-1 і rhGM-CSF. Після інкубації протягом 72 год при температурі 37 °С з 5 % СО2 визначають проліферативний статус клітин TF-1 за допомогою колориметричного аналізу, що базується на розщепленні солей тетразолію (WST-1, Roche) мітохондріальною дегідрогеназою в життєздатних клітинах. Кількісне визначення формазанового барвника, що утворюється метаболічно активними клітинами, визначають шляхом вимірювання його поглинання за допомогою пристрою для зчитування ELISA на довжині хвилі 450 нм. 57 Потужність інгібування залежної від людського GM-CSF проліферації клітини TF-1 досліджуваними показовими фрагментами людського антитіла проти GM-CSF людини варіювала (Фіг. 20,21). Хоча два таких фрагменти не здійснювали нейтралізуючої дії (scFv F і scFv L); п'ять конструктів (scFv J, scFv K, scFv M, scFv N і scFv H) демонструють проміжний рівень інгібування, та сім конструктів (scFv В, scFv I, scFv Ε, scFv D, scFv G, scFv C, scFv A) демонструють виражене інгібування залежної від GM-CSF проліферації клітини TF-1. Відсутність або нижчий рівень нейтралізуючої дії може бути результатом нижчого рівня експресії конкретного показового scFv або менш стійкого комплексу, що утворюється між конкретним показовим scFv і rhGM-CSF протягом періоду інкубації 72 год при температурі 37 °С. Приклад 7.2: Кількісна оцінка нейтралізуючого потенціалу деяких показових людських "анти-GMCSF людини" антитіл та їх фрагментів за даними вимірювання клітинної проліферації Відібрані показові молекули scFv, описані вище, які продемонстрували виражене інгібування проліферації TF-1, далі піддають кількісному аналізу нейтралізуючого ефекту. Для цього застосовують таку ж лінію залежних від GM-CSF клітин людини TF-1 (DSMZ АСС 334). Клітини TF-1 культивують і готують для аналізу проліферації, як детально описано в Прикладі 7.1 вище. Для стимуляції проліферації клітини TF-1 використовують кінцеву концентрацію rhGM-CSF 0,3 нг/мл. Для нейтралізації GM-CSF-залежної проліферації 10 мкл очищених зразків показових людських "антиGM-CSF людини" нейтралізуючих моноклональних антитіл або їх фрагментів додають до розчину, що містить 100 мкл TF-1 і rhGM-CSF в серіях розведення. Кінцеві концентрації білка знаходяться в інтервалі від 10 мкг/мл до 10 пг/мл. Зразки інкубують при температурі 37 °С з 5 % СO2 протягом 72 год. Після проходження 72 год визначають проліферативний статус клітин TF-1, як описано в Прикладі 7.1 вище. Дані апроксимують для половини максимального інгібування проліферації (ІС50) із застосуванням апроксимації нелінійної кривої регресії програмного забезпечення Prism. Очевидна нейтралізуюча дія на GM-CSF, яка спостерігається в якісному експерименті проліферації-інгібування, описаному в Прикладі 7.1 вище, може бути підтверджена і визначена кількісно. Всі досліджені фрагменти scFv людських антилюдських GM-CSF моноклональних нейтралізуючих антитіл в даному експерименті проліфераціїінгібування продемонстрували константи половини максимального інгібування (ІС50) в наномолярному інтервалі. Може бути встановлена чітка класифікація за ефективністю нейтралізації, як показано на Фіг. 22. Досліджені людські "анти-GМ-СSF-людини" моноклональні нейтралізуючі антитіла IgG показують значно вищу ефективність нейтралізації, ніж їх двійники scFv. Константа половини максимального інгібування для молекул IgG, створених в даному експерименті, знаходилася в субнаномолярному інтервалі. Як можна побачити на Фіг. 23, ІС50 для 94403 58 IgG A становить 0,9 нМ та для IgG В ІС50 становить 0,3 нМ. Для того, щоб перевірити, чи потенціал нейтралізації фрагментів антитіла scFv, утворених з IgG А та В (scFv О і Р, відповідно) кількісно відповідає потенціалу scFv А та В, аналогічні аналізи нейтралізації TF-1 здійснюють, як описано вище, за винятком використання scFv О і Ρ в ролі досліджуваних молекул. Результати показані на Фіг. 24 і 25 для scFv Ρ і О, відповідно. Як можна побачити з Фіг. 25, scFv О володіє таким же потенціалом нейтралізації, як scFvA, демонструючи, що зворотне перетворення IgG назад до формату scFv є можливим без втрати біологічної активності. Приклад 7.3: Кількісна оцінка потенціалу нейтралізації людських анти-rhGM-CSF антитіл та їх фрагментів за даними зменшення продукування IL-8 Даний експеримент здійснюють для кількісного визначення нейтралізуючої активності показових людських "анти-GM-CSF людини" антитіл та їх фрагментів шляхом вимірювання GM-CSFзалежного продукування IL-8 клітинами U-937. Антиген GM-CSF, який використовують у вищевикладених експериментах, являв собою rhGM-CSF. Моноцитарні клітини U-937 культивують в середовищі RPMI 1640 Gibco (L-глутамін, не містить фенольного червоного) з додаванням 10 % інактивованої нагріванням сироватки телячих ембріонів, як описано дистриб'ютором (Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH, Braunschweig, Німеччина). Клітини культивують до щільності клітини 1 × 10ехр6 клітин/мл. Для здійснення аналізу інгібування на базі вимірювання продукування IL-8 клітини збирають центрифугуванням при 300 × g протягом 4 хвилин і ресуспендують до кінцевої концентрації 1 × 10ехр6 клітин/мл в RPMI 1640, 10 % сироватки телячих ембріонів. 1,8 × 10ехр5 клітин/лунку (180 мкл суспензії клітини) висівають в кожну лунку з пласким дном планшета для культивування клітини Microtest добре. Кінцеву концентрацію 1 нг/мл rhGM-CSF застосовують для стимуляції продукування IL-8 клітинами U-937. 20 мкл очищеного scFv або IgG додають до 180 мкл клітин U937 і розчину rhGM-CSF в серіях розведення з одержанням в кінцевих концентрацій білка в інтервалі від 10 мкг/мл до 10 пг/мл. Після інкубації протягом 18 год при температурі 37 °С з 5% СО2 клітини осаджують центрифугуванням планшетів для культивування протягом 2 хвилин при 600 × g. Супернатанти культури збирають за допомогою піпетки на новий планшет та здійснюють аналіз для визначення концентрації IL8 з використанням набору OptEIA людського IL-8 ELISA (Becton Dickenson and Company). Визначення ELISA здійснюють у відповідності до інструкцій виробника. Якщо коротко, 50 мкл фіксованих антитіл, розведених в 0,1 Μ розчині карбонату натрію, рН 9,5, викривають планшет для мікроаналізу протягом ночі при температурі 4 °С. Після триразового промивання ФБР/0,05 % Твіну 20 лунки блокують за допомогою 200 мкл ФБР/10 % сироватки телячих ембріонів на лунку протягом 1 год при кімнатній температурі, після 59 чого тричі промивають ФБР/0,05 % Твіну 20. Далі в лунки додають по 50 мкл зразків супернатантів культур та інкубують протягом 2 год при кімнатній температурі. Для одержаних сумішей здійснюють визначення концентрації IL-8 для серійного розведення стандарту IL-8, наданого виробником, у відповідності до методики. Після п'ятиразового промивання ФБР/0,05 % Твіну 20 здійснюють визначення з використанням 50 мкл робочого детектора (визначення Аb + ΑνHRP), що міститься в наборі OptEIA людського IL-8 ELISA. Після інкубації протягом 1 год при кімнатній температурі лунки промивають ще 7 разів. Сигнал індукують додаванням розчину субстрату OPD (Sigma) і визначають на довжині хвилі 490 нм (з використанням для порівняння довжини хвилі 620 нм). Стандартну криву IL-8 наносять для калібрування, і концентрації IL-8 в зразках супернатантів культур обчислюють у відповідності до одержаної калібраційної кривої. Дані апроксимують для половини максимального інгібування продукування IL-8 (ІС50) із застосуванням апроксимації нелінійної кривої регресії програмного забезпечення Prism. Всі показові фрагменти досліджених людських анти-rhGM-CSF моноклональних нейтралізуючих антитіл продемонстрували чітке інгібування GMCSF-залежного продукування IL-8 клітинами U937, як можна чітко побачити із зменшення концентрації IL-8 при збільшенні концентрації scFv на Фіг. 26. Класифікація нейтралізуючої ефективності, що спостерігалася в даному експерименті, узгоджується з класифікацією, одержаною при дослідженні таких же молекул щодо їх нейтралізуючого впливу в експерименті проліферації-інгібування TF-1, описаному вище. Слід відзначити, що значення ІС50, визначені в даному експерименті, є більш високими в порівнянні з одержаними для таких же молекул в попередньому експерименті з проліферації TF-1. Це є результатом більш високої концентрації GM-CSF, необхідної для стимуляції продукування IL-8 клітинами U-937, в порівнянні з концентрацією, необхідною для стимуляції TF-1. Приклад 7.4: Кількісна оцінка потенціалу нейтралізації показових людських «анти-GM-CSF людини» антитіл та їх фрагментів рекомбінантного GM-CSF макаки за даними вимірювання проліферації клітин Метою даного експерименту є продемонструвати потужність нейтралізації показових людських «анти-GM-CSF людини» антитіл та їх фрагментів по відношенню до GM-CSF негуманоїдних приматівсімейства Масаса ("macGM-CSF"). Для демонстрації нейтралізуючого впливу відібраних молекул scFv та IgG на macGM-CSF здійснюють експеримент проліферації-інгібування у відповідності до протоколу, описаного в Прикладах 7.1 і 7.2 із застосуванням macGM-CSF замість hGM-CSF. Як hGM-CSF, так і macGM-CSF стимулюють проліферацію клітин TF-1 з однаковою половиною максимальної ефективності (ЕС50). Для стимуляції проліферації клітини TF-1 в експерименті з дослідження молекул scFv використовують кінцеву концентрацію macGM-CSF 3 нг/мл та в 94403 60 експерименті з дослідження IgG В як показового людського «анти-GM-CSF людини» антитіла використовують 0,3 нг/мл rhGM-CSF клітини. З метою нейтралізації проліферації клітини TF-1 10 мкл очищеного людського «анти-GM-CSF людини» антитіла або його фрагменту додають до 100 мкл TF-1 і розчину macGM-CSF в серіях розведення. Кінцеві концентрації білка знаходяться в інтервалі від 10 мкг/мл до 10 пг/мл. Зразки інкубують при температурі 37 °С з 5 % СО2 протягом 72 год. Після проходження 72 год проліферативний статус клітин TF-1 визначають, як описано в Прикладах 7.1 і 7.2. Дані апроксимують на половину максимального інгібування проліферації (ІС50) із застосуванням апроксимації кривої нелінійної регресії програмного забезпечення Prism. Як можна побачити з Фіг. 27, деякі показові фрагменти людських «анти-GM-CSF людини» моноклональних антитіл також демонструють чіткий потенціал нейтралізації macGM-CSF (scFv В, scFv E, scFv C, scFv I, scFv A). Крім того, як можна побачити з Фіг. 28, збільшення концентрацій показового людського "анти-GM-CSF людини" моноклонального антитіла IgG В очевидно приводить до зменшення проліферації TF-1, демонструючи нейтралізуючий потенціал даного антитіла. Цікаво, що значення ІС50, одержані для IgG В в даному експерименті (0,3 нм) із застосуванням macGM-CSF для індукування проліферації клітин TF-1, дорівнює тому, що генерується в експерименті із застосуванням hGM-CSF, демонструючи чітку перехресну реактивність IgG В GM-CSF в даних видах. Приклад 8: Перехресна реактивність IgG В з GM-CSF з різних видів Перехресна реактивність IgG В з GM-CSF різних негуманоїдних видів досліджують з метою ідентифікації види, придатні для подальших досліджень in vivo. В першому наборі експериментів досліджували зв'язування IgG В з комерційно доступним рекомбінантним GM-CSF людини (Leukine®, Berlex), свині, собаки, щура (R&D Systems, Wiesbaden, Німеччина ) і миші (Strathmann Biotech, Hamburg, Німеччина) в експериментах ELISA. Конкретно, планшет ELISA вкривають 1 мкг/мл GM-CSF з наведених вище видів. Додають IgG В у вигляді серійних розведень та здійснюють визначення із застосуванням кон'югованого з пероксидазою хріну антитіла проти IgG1 людини. ELISA індукують шляхом додавання розчину субстрату OPD о-фенілендіаміну ("OPD", жовто-оранжевий при реакції з пероксидазою) (Roche, Німеччина) і виміряний на довжині хвилі 490 нм. Як можна побачити з Фіг. 29, IgG В продемонстрував міцне зв'язування з рекомбінантним людським GM-CSF, тоді як досліджені GM-CSF з інших видів не розпізнавалися. Таким чином, свиня, собака, щур або миша можуть бути непридатними видами для дослідження in vivo. Однак, як можна побачити вище в Прикладі 7.4, IgG В демонструє позначену перехресну реактивність з macGM-CSF (з яванської мавпи, Масаса fascicularis), вказуючи на придатність як мінімум одного виду мавп з сімейства макак для досліджень IgG В in vivo.
ДивитисяДодаткова інформація
Назва патенту англійськоюHuman monoclonal antibody neutralizing granulocyte macrophage colony stimulating factor
Автори англійськоюRaum Tobias, Hepp (Nee Henckel) Julia, Vieser Eva, Petsch (Nee Mittelstrass) Silke, Zeman Steven, Wolf Andreas, Bruckmaier Sandra
Назва патенту російськоюЧеловеческое моноклональное антитело, которое нейтрализует gm-csf
Автори російськоюРаум Тобиас, Хепп (Нее Хенкель) Юлия, Фисер Ева, Петш (Нее Миттельстрасс) Силке, Земан Стивен, Вольф Андреас, Брукмайер Сандра
МПК / Мітки
МПК: A61P 35/00, C12N 15/13, A61P 37/00, A61K 39/395, C07K 16/22
Мітки: людське, gm-csf, нейтралізує, антитіло, моноклональне, яке
Код посилання
<a href="https://ua.patents.su/85-94403-lyudske-monoklonalne-antitilo-yake-nejjtralizueh-gm-csf.html" target="_blank" rel="follow" title="База патентів України">Людське моноклональне антитіло, яке нейтралізує gm-csf</a>
Попередній патент: Керування перешкодою у системі безпровідного зв’язку
Наступний патент: Нові композиції вакцин
Випадковий патент: Спосіб санації внутрішньої поверхні вулика, рамок та бджолосім`ї