Спосіб лікування ран
Номер патенту: 116072
Опубліковано: 25.01.2018
Автори: Буряк Ірина Алімівна, Марценюк Валентина Пилипівна, Висеканцев Ігор Павлович, Абрафікова Лілія Геннадіївна
Формула / Реферат
1. Спосіб лікування ран, що включає використання ранового покриття, що містить гелеві мікрогранули з наповнювачем, який відрізняється тим, що як наповнювач використовують суміш, що включає антибіотик, полівалентний препарат бактеріофагів та імуномодулятор, а гелеві мікрогранули із наповнювачем перед використанням змішують з метилцелюлозним гелем, який містить фібробласти.
2. Спосіб лікування ран за п. 1, який відрізняється тим, що мікрогранули змішують з метилцелюлозним гелем з розрахунку 100±10 мікрогранул на 3-5 мл гелю.
3. Спосіб лікування ран за п. 1, який відрізняється тим, що концентрація фібробластів в метилцелюлозному гелі складає 5×103 - 1×106 кл/мл.
Текст
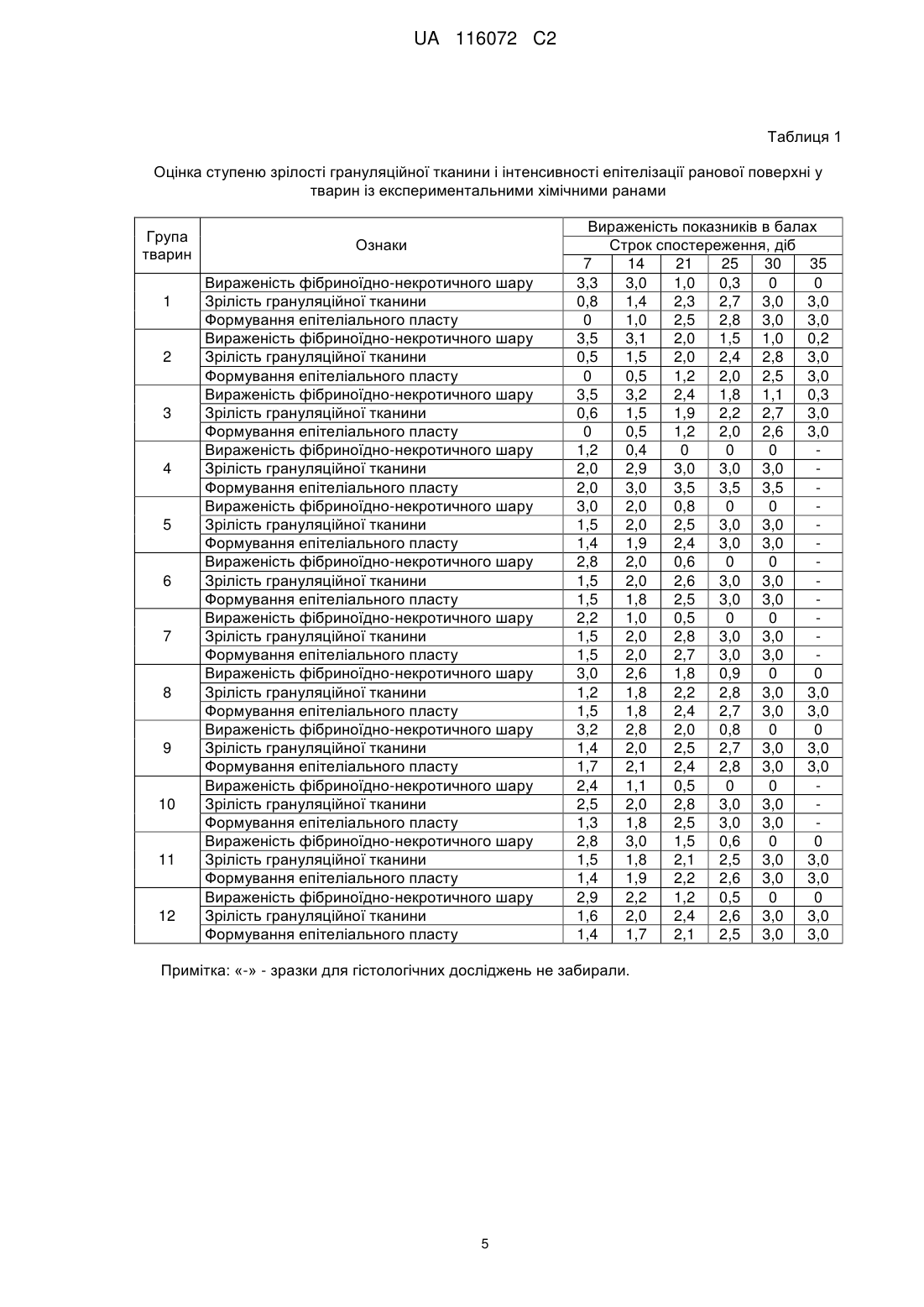
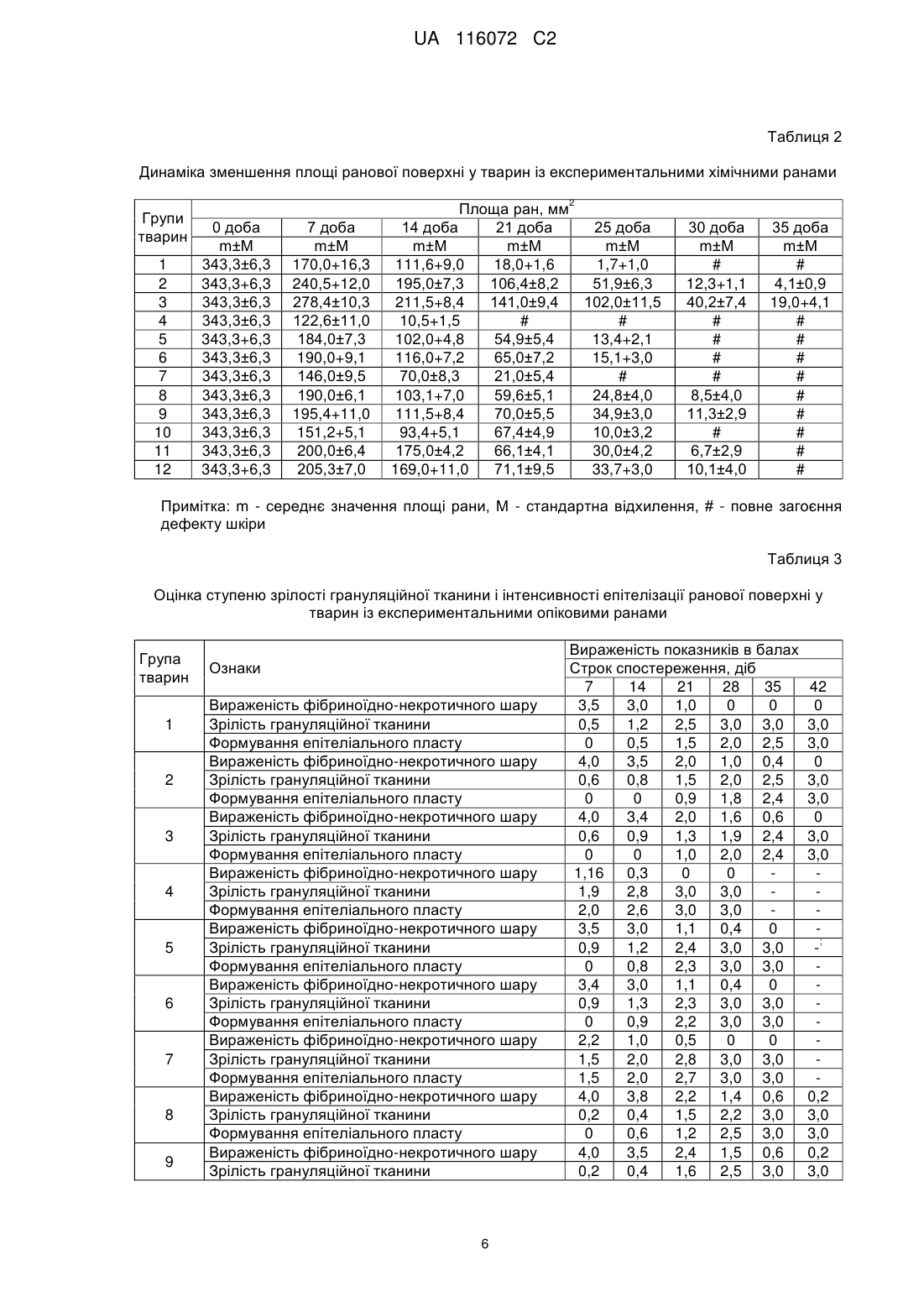
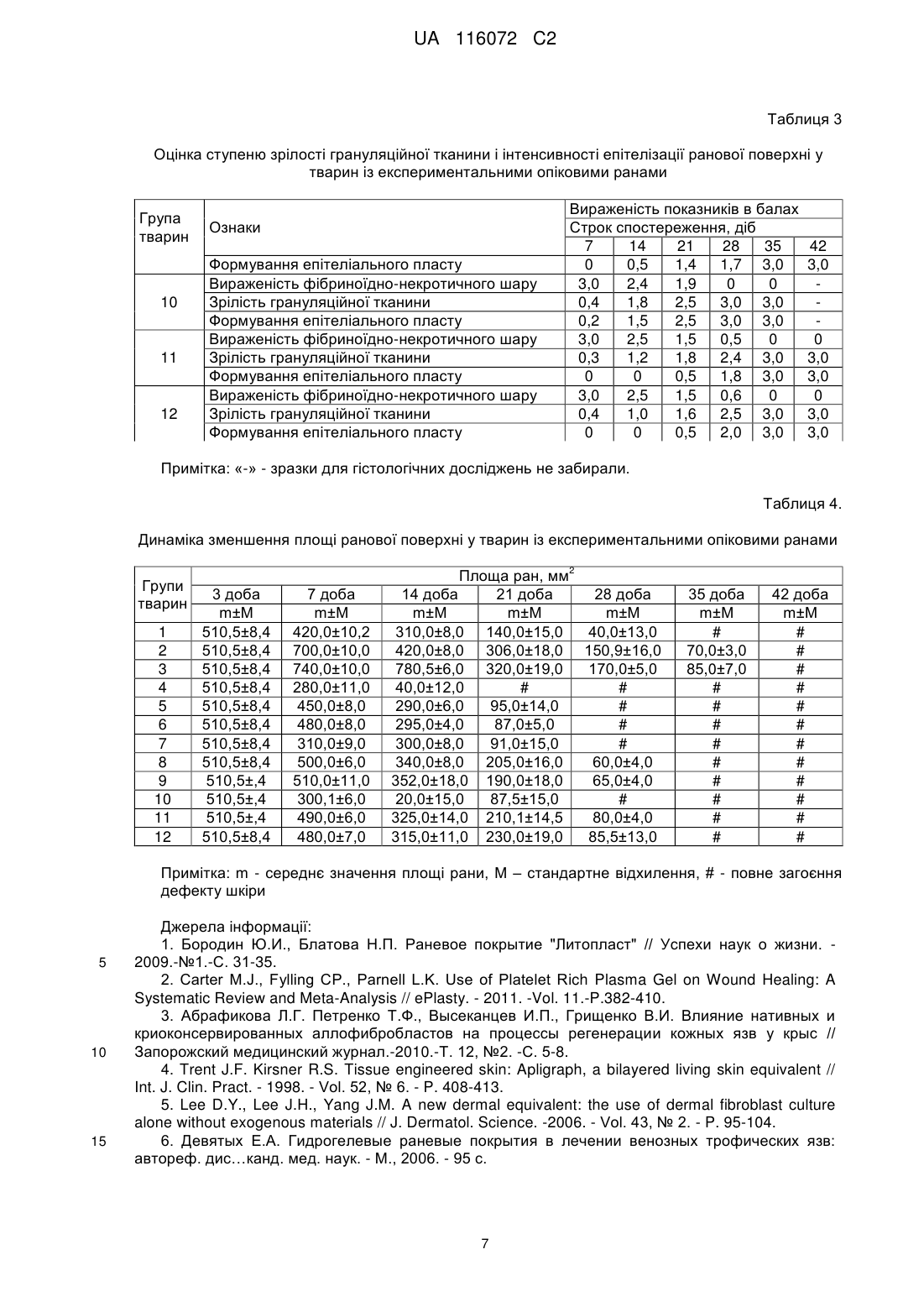
Реферат: Винахід належить до способу лікування ран, який передбачає використання ранового покриття, яке включає гелеві мікрогранули з наповнювачем. Як наповнювач використовують суміш, що включає антибіотик, полівалентний препарат бактеріофагів та імуномодулятор. Гелеві мікрогранули із наповнювачем перед використанням змішують з метилцелюлозним гелем, який містить фібробласти. Мікрогранули змішують з метилцелюлозним гелем з розрахунку 100±10 мікрогранул на 3-5 мл гелю. Концентрація фібробластів в метилцелюлозному гелі складає 5 6 5×10 - 1×10 кл/мл. UA 116072 C2 5 10 15 20 25 30 35 40 45 50 55 Винахід належить до експериментальної медицини і може бути використаний в комплексному лікуванні ран. Відомий спосіб лікування експериментальних опікових ран у лабораторних тварин за допомогою ранового покриття "Літопласт", яке складається із суміші природного мінерального сорбенту "Ціоліту" із біофільними мікроелементами [1]. Відомий спосіб лікування ран за допомогою PRP гелю (Platelet Rich Plasma Gel) - плазми крові, збагаченої аутологічними тромбоцитами [2]. Відомий спосіб лікування експериментальних ран шляхом нанесення на ранову поверхню фібробластів, іммобілізованих на колагеновій губці "Геласпон" або у метилцелюлозному гелі [3]. Відомий спосіб лікування ран за допомогою двошарового штучного еквівалента шкіри на основі матриці з бичачого колагену І типу [4]. Відомий спосіб лікування аутологічними трансплантатами [5]. Згідно зі способом, фібробласти людини культивують протягом 3-х тижнів у ростовому середовищі, яке містить п'ять ростових факторів. Потім на поверхню сформованого клітинного пласту засівають кератиноцити. Трансплантат культивують ще 16 діб, після чого наносять на ранову поверхню. Загальним недоліком вказаних способів є порушення перебігу ранового процесу, зокрема фази регенерації та фази реорганізації рубця і епітелізації, у разі інфікування ран і розвитку ранової інфекції, що пов'язано з відсутністю у складі ранових покриттів антимікробних препаратів. Внаслідок цього в рані розвиваються гнійно-запальні ускладнення. Відомий спосіб лікування ран за допомогою гідрогелевого ранового покриття "Гелепран" [6]. До складу покриття входить гель із кремнезолк (гідрозолю оксиду кремнію) з полідоном, пропіленгліколь, антисептик "Мірамістин" та анестетик "Лідокаін". Відомий спосіб лікування ран за допомогою біологічно активних гелевих пов'язок "АПОЛЛОПАК", "АПОЛЛО-ПАА" [7]. Ці гелеві пов'язки являють собою сітчасту основу із співполімеру акриламіду і акрилової кислоти. На основу нанесено полімерний гідрогель, анестетик "Амілокаїн" та антисептики "Йодовідан" або "Мірамістин". Загальним недоліком вказаних способів є недостатньо активний перебіг ранового процесу, особливо в фазі регенерації та в фазі реорганізації рубця і епітелізації, що пов'язано із відсутністю в складі ранових покриттів факторів, які стимулюють розвиток грануляційної тканини і формування рубцьової сполучної тканини з наступною епітелізацією рани. Найбільш близьким до заявленого є спосіб лікування ран з використанням ранового покриття, що являє собою мікрогранули з наповнювачами [8]. Мікрогранули сформовані із гелю (альгінат натрію, желатин, пектин, карагінан, агар-агар, натрієва сіль карбоксиметилцелюлози, сополімер акрилової кислоти і бутил акрилату). Наповнювачами є гіперосмолярні, антисептичні, антиоксидантні речовини та анестетики. Відповідно до способу, мікрогранули поміщають у рану, яку дренують і закривають асептичною пов'язкою. Пов'язку і мікрогранули замінюють один раз на добу. Недоліком цього способу лікування є недостатньо активний процес загоєння ран, особливо в фазах регенерації та реорганізації рубця і епітелізації. Це пов'язано з відсутністю в складі ранових покриттів факторів, які стимулюють розвиток грануляційної тканини і формування рубцьової сполучної тканини з наступною епітелізацією. Регулярна (1 раз на добу) заміна пов'язки та мікрогранул із наповнювачами додатково травмує ранову поверхню, що також негативно впливає на активність процесу загоєння ран. В основу винаходу поставлена задача створити спосіб лікування, який би забезпечив можливість стимуляції процесу загоєння ран, зокрема в фазах регенерації та реорганізації рубця і епітелізації. Поставлена задача вирішується тим, що в способі лікування ран, який передбачає використання ранового покриття, яке включає гелеві мікрогранули з наповнювачем, згідно з винаходом, як наповнювач використовують суміш, що включає антибіотик, полівалентний препарат бактеріофагів та імуномодулятор, а гелеві мікрогранули із наповнювачем перед використанням змішують з метилцелюлозним гелем, який містить фібробласти. Мікрогранули змішують з метилцелюлозним гелем з розрахунку 100±10 мікрогранул на 3-5 мл гелю. 5 6 Концентрація фібробластів в метилцелюлозному гелі складає 5 × 10 -1 × 10 кл/мл. Фібробласти, які входять до складу ранового покриття, додатково до власних фібробластів хворого синтезують компоненти міжклітинного матрикса сполучної тканини (білки глікопротеїни колаген, гіалуронову кислоту, протеоглікани, еластин, фібрин та ін.) та фактори клітинного росту (трансформуючий, епідермальний, основний, тінацин, фактор росту кератиноцитів та ін.), що відіграють значну роль в фазах регенерації та реорганізації рубця і епітелізації. 1 UA 116072 C2 5 10 15 20 25 30 35 40 45 50 55 Імуномодулятор, який входить до складу ранового покриття, прискорює процеси регенерації клітин за рахунок анаболічної та антикатаболічної активності, стимулює клітинні та гуморальні фактори імунітету, чинить протизапальну дію. Антибіотик та бактеріофаги, вірулентні по відношенню до збудників госпітальних інфекцій, дифундують із мікрогранул в ранову поверхню і запобігають розвитку ранової інфекції, яка ускладнює перебіг ранового процесу та уповільнює загоєння ран. Метилцелюлозний гель, на основі якого готують ранове покриття, захищає поверхню рани від висихання і забезпечує дренаж рани. Завдяки цьому немає потреби в накладанні та зміні пов'язок і мікрогранул з наповнювачами, що виключає додаткову травматизацію ранової поверхні. Таким чином заявлений спосіб дозволяє активувати процеси загоєння ран за рахунок вказаних вище факторів і прискоротити повне загоєння експериментальних хімічних неінфікованих ран на 3 доби, хімічних інфікованих ран на 5-6 діб, опікових ран - на 7 діб у порівнянні з прототипом. В процесі лікування за заявленим способом терміни перебігу фаз регенерації та реорганізації рубця і епітелізації в експериментальних хімічних ранах скорочуються на 5 діб, в опікових ранах - на 7 діб. Спосіб здійснюють таким чином. Із біоптатів шкіри стандартним методом культивування отримують фібробласти. В разі необхідності фібробласти можна зберігати ь кріоконсервованому стані. Виготовляють і стерилізують метилцелюлозний гель та вносять в нього фібробласти. Концентрація 5 6 фібробластів в метилцелюлозному гелі становить 5 × 10 -5 × 10 кл/мл. Окремо виготовлюють гелеві мікрогранули із наповнювачем. Для мікрогранул використовують полімерні гелі за прототипом. Зовнішній шар мікрогранул зміцнений катіонами 2+ Са . В якості наповнювача в гелеві мікрогранули вносять суміш, що містить антибіотик, препарат полівалентного бактеріофагу і імуномодулятор. Кожен препарат наповнювача беруть із розрахунку 1 терапевтична доза на 1 мл полімерного гелю. Із 1 мл гелю із наповнювачем отримують 10010 мікрогранул. Мікрогранули із наповнювачем можна зберігати при температурах від -80 до -196 °C. Перед обробкою ран 100±10 мікрогранул з наповнювачем змішують із 3-5 мл метилцелюлозного гелю з фібробластами. Отримане покриття наносять тонким шаром на поверхню рани. Спосіб пояснюється прикладами. Приклад 1. Фібробласти отримували з біоптатів шкіри щурів стандартним методом культивування [9]. Для отримання фібробластів внутрішню поверхню стегон тварин голили і обробляли 70 % 2 розчином етилового спирту. Ножицями висікали біоптати шкіри розміром 1 см , захоплюючи сосочковий шар дерми. Біоптати поміщали у пеніцилінові флакони з розчином Хенкса із додаванням антибіотика "Канаміцина". Через 2-3 години біоптати подрібнювали на фрагменти площею 1-2 мм. Ці фрагменти поміщали на дно культуральних флаконів дермальною площиною вниз. Флакони витримували протягом 30-40 хв. у СО2-інкубаторі при температурі 37 °C для адгезії фрагментів де поверхні флаконів. Потім у флакони додавали культуральне середовище (середовище 199 з додатковим вмістом 5 % ембріональної сироватки великої рогатої худоби (ВРХ)). Зразки культивували у СО 2-інкубаторі. Культуральне середовище змінювали кожні 5 діб. Виселення фібробластів із експлантатів відбувалося на 7-11 добу. Ще через 5-7 діб формувався моношар із фібробластів. Після формування моношару фібробласти знімали з поверхні культуральних флаконів сумішшю 0,02 % розчину Версена і 0,25 % розчину трипсина. Клітини осаджували центрифугуванням, відмивали розчином Хенкса і суспендували у середовищі консервування - ембріональній сироватці ВРХ із додаванням 10 % диметилсульфоксида. Клітини у середовищі консервування вносили у кріопробірки. Зразки охолоджували до -70 °C зі швидкістю 1 град/хв. і потім занурювали у рідкий азот. Перед обробкою ран кріопробірки відігрівали на водяній бані при 37 °C. Фібробласти відмивали від 6 середовища консервування і суспендували у розчині Хенкса до концентрації 10 клітин/мл. Для виготовлення метилцелюлозного гелю готували 3 % розчин метилцелюлози на фізіологічному розчині. Цей розчин витримували протягом 12 годин у холодильнику (4-8 °C) з періодичним перемішуванням та стерилізували в автоклаві (112 °C протягом 15 хв). Суспензію фібробластів у розчині Хенкса змішували у відношенні 1:1 із 3 % метилцелюлозним гелем і отримували основу для ранового покриття -1,5 % метилцелюлозний 5 гель із фібробластами (5 × 10 клітин/мл). 2 UA 116072 C2 5 10 15 20 25 30 35 40 45 50 55 60 Для приготування гелевих мікрогранул з наповнювачем в стерильний 1 % гель альгінату натрію вносили антибіотик з широким спектром дії (Ципрофлоксацин), препарат полівалентного бактеріофагу (Секстафаг Піобактеріофаг), який містить лізати бактеріофагів, вірулентних для збудників внутрішньолікарняних інфекцій, і імуномодулятор (Метилурацил-Дарниця) для прискорення загоєння ран. Концентрація кожного компоненту наповнювача - 1 терапевтична доза на 1 мл 1 % гелю альгінату натрію. Гель альгінату натрію з наповнювачем набирали у шприц і крапали у стерильний 0,2М розчин СаСl2. Отримані мікрогранули витримували протягом + 2+ 15-20 хв для зміцнення гелю за рахунок заміщення катіонів Na на катіони Са . Мікрогранули промивали стерильним фізіологічним розчином та підсушували на фільтрувальному папері. Із 1 мл 1 % гелю альгінату натрію із наповнювачем отримували 100±10 мікрогранул. Дослідження проводили на білих рандомбрендних щурах віком 4 міс. та масою 165-175 г. Запалення шкіри з утворенням ран у тварин викликали шляхом підшкірного введення 0,5 мл 9 % розчину оцтової кислоти [10]. На 7-му добу у тварин формувалися глибокі, обширні рани. Середня площа ран складала 343,3±6,3 мм (табл. 2). Сформований дефект захоплював епідерміс, дерму і м'язовий шар. Всі тварини були розділені на 12 груп: група 1 - загоєння неінфікованих ран без лікування; група 2 - загоєння ран, інфікованих S. aureus, без лікування; група 3 - загоєння ран, інфікованих P. aeruginosa, без лікування; група 4 - лікування неінфікованих ран за заявленим способом; група 5 - лікування ран, інфікованих S. aureus, за заявленим способом; група 6 - лікування ран, інфікованих P. aeruginosa, за заявленим способом; група 7-лікування неінфікованих ран за прототипом (варіант 1 - мікрогранули альгінату натрію із наповнювачем: магнію хлоридом, нітазолом, піромекаіну гідрохлоридом); група 8 - лікування ран, інфікованих S. aureus, за прототипом (варіант 1); група 9 - лікування ран, інфікованих P. aeruginosa (варіант 1); група 10 лікування неінфікованих ран за прототипом (варіант 2 - мікрогранули альгінату натрію із наповнювачем: натрію хлоридом, діоксидином, піромекаіну гідрохлоридом, карназимом); група 11 - лікування ран, інфікованих S. aureus, за прототипом (варіант 2); група 12 - лікування ран, інфікованих P. aeruginosa, за прототипом (варіант 2). Інфікування ран проводили нанесенням на рани культур S. aureus або P. aeruginosa. Лікування ран розпочинали через 5 годин після інфікування. Для лікування ран за заявленим способом до 3 мл метилцелюлозного гелю із фібробластами вносили 100±10 мікрогранул гелю альгінату натрію із наповнювачем. Після перемішування отриману суміш наносили на поверхню ран із розрахунку 0,3-0,5 мл/см. Для лікування ран за прототипом готували два види мікрогранул (варіант 1, варіант 2). Через 5 годин після інфікування на рани в групах 4, 5, 6 наносили покриття за заявленим способом. На рани в групах 7, 8, 9 та 10, 11, 12 наносили мікрогранули, відповідно за прототипом (2 варіанти). Рани в групах 7-12 покривали пов'язками. Пов'язки і мікрогранули замінювали 1 раз на добу. Тварин утримували окремо, по одній, у спеціальних клітках. На тулуб тварин одягали спеціальний сітчастий еластичний чохол для захисту ранової поверхні та пов'язок. Площу некрозу ран вимірювали за методом А.Н. Попової [11]. Отримані за цим методом площі сканували і обчислювали за допомогою комп'ютерної програми AxioVision Rel 4.7. Для дослідження перебігу процесу загоєння проводили забір шкіри з рани та прилеглих тканин. Відбирали зразки для гістологічних досліджень на 7, 14, 21, 25, ЗО, 35 добу. Зразки фіксували в 10 % нейтральному парафіні і заливали целоїдин-парафіновою сумішшю. Зрізи тканин товщиною 6-8 мкм готували на мікротомі і фарбували гематоксиліном і еозином [12]. Гістологічні зрізи аналізували за допомогою світлового мікроскопа. Ступінь зрілості грануляційної тканини і інтенсивність епітелізації ранової поверхні оцінювали за п'ятибальною шкалою: 0 - ознака відсутня; 1 - слабко виражена ознака; 2 - помірно виражена ознака; 3 - яскраво виражена ознака; 4 - різко виражена ознака. Результати оцінки перебігу місцевих реакцій ранового процесу приведено в таблицях 1 і 2. Із таблиці 1 видно, що фаза регенерації ран (дозрівання грануляційної тканини) в неінфікованих ранах без лікування (група 1) завершилися на 30 добу, в інфікованих ранах без лікування (групи 2, 3) - на 35 добу, в неінфікованих ранах, які лікували за заявленим способом (група 4) - на 21 добу, в інфікованих ранах, які лікували за заявленим способом (групи 5,6) - на 25 добу, в неінфікованих ранах, які лікували за прототипом (групи 7,10) - на 25 добу, в інфікованих ранах, які лікували за прототипом (групи 8,9,11,12) - на 30 добу. 3 UA 116072 C2 5 10 15 20 25 30 35 40 45 Формування епітеліального пласту в фазі реорганізації рубця і епітелізації в неінфікованих ранах без лікування (група 1) було вираженим на 30 добу, в інфікованих ранах без лікування (групи 2,3) - на 35 добу, в неінфікованих ранах, які лікували за заявленим способом (група 4) на 21 добу, в інфікованих ранах, які лікували за заявленим способом (групи 5,6) - на 25 добу, в неінфікованих ранах, які лікували за прототипом (групи 7,10) - на 25 добу, в інфікованих ранах, які лікували за прототипом (групи 8,9,11,12) - на 30 добу. Із таблиці 2 видно, що в групі 1 (загоєння неінфікованих ран без лікування) повне загоєння ран із формуванням волокнистого рубця, вкритого потовщеним епітеліальним пластом із чітким диференціюванням шарів та волосяним покровом відбулося на 30 добу. В групах 2 і 3 тварин (загоєння інфікованих ран без лікування) - після 35 доби. В групах 4 (лікування неінфікованих ран за заявленим способом) та 7, 10 (лікування неінфікованих ран за прототипом) - на 21 та 25 і 30 добу, відповідно. Лікування експериментальних хімічних ран заявленим способом забезпечує в порівнянні із прототипом зменшення термінів фаз регенерації та реорганізації рубця і епітелізації на 5 діб. У зв'язку з цим терміни повного загоєння неінфікованих ран скорочуються на 3 доби, інфікованих ран на 5-6 діб. Приклад 2. Дослідження проводили на білих рандомбредних щурах віком 4 міс. та масою 165-175 г. У тварин викликали експериментальні опікові рани. Для цього використовували мідний аплікатор діаметром 10 мм, який нагрівали до 100±2 °C. У тварин епілювали шерсть і після дачі наркозу до епільованої шкіри прикладали нагрітий аплікатор. Термін експозиції був 60 сек. Усі тварини були поділені на 12 груп, аналогічно Прикладу 1. Відкриті опікові рани формувалися у тварин на 3 добу після опіку. В цей день проводили інфікування і розпочинали лікування ран. Місцеве лікування опіків та контроль за перебігом ранового процесу здійснювали так, як і в Прикладі 1. Результати оцінки перебігу місцевих реакцій ранового процесу приведено в таблицях 3 і 4. Із таблиці 3 видно, що фаза регенерації ран (дозрівання грануляційної тканини) в неінфікованих ранах без лікування (група 1) завершилися на 28 добу, в інфікованих ранах без лікування (групи 2,3) - на 42 добу, в неінфікованих ранах, які лікували за заявленим способом (група 4) - на 21 добу, в інфікованих ранах, які лікували за заявленим способом (групи 5,6) - на 28 добу, в неінфікованих ранах, які лікували за прототипом (групи 7,10) - на 28 добу, в інфікованих ранах, які лікували за прототипом (групи 8,9,11,12) - на35 добу. Формування епітеліального пласту в фазі реорганізації рубця і епітелізації в неінфікованих ранах без лікування (група 1) було вираженим на 35 добу, в інфікованих ранах без лікування (групи 2,3) - на 42 добу, в неінфікованих ранах, які лікували за заявленим способом (група 4) на 21 добу, в інфікованих ранах, які лікували за заявленим способом (групи 5,6) - на 28 добу, в неінфікованих ранах, які лікували за прототипом (групи 7,10) - на 28 добу, в інфікованих ранах, які лікували за прототипом (групи 8,9,11,12) - на 35 добу. Із таблиці 4 видно, що в групі 1 (загоєння неінфікованих ран без лікування) повне загоєння ран із формуванням волокнистого рубця, вкритого потовщеним епітеліальним пластом із чітким диференціюванням шарів та волосяним покровом відбулося на 35 добу. В групах 2 і 3 (загоєння інфікованих ран без лікування) - на 42 добу. В групі 4 (лікування неінфікованих ран за заявленим способом) - на 21 добу, а в групах 7, 10 (лікування неінфікованих ран за прототипом) -на 28 добу. В групах 5,6 (лікування інфікованих ран за заявленим способом) - на 28 добу. В групах 8,9,11,12 (лікування інфікованих ран за прототипом) - на 35 добу. Лікування експериментальних опікових ран заявленим способом забезпечує в порівнянні із прототипом зменшення термінів фаз регенерації та реорганізації рубця і епітелізації на 7 діб. Терміни повного загоєння ран також скорочуються на 7 діб. 4 UA 116072 C2 Таблиця 1 Оцінка ступеню зрілості грануляційної тканини і інтенсивності епітелізації ранової поверхні у тварин із експериментальними хімічними ранами Група тварин 1 2 3 4 5 6 7 8 9 10 11 12 Ознаки Вираженість фібриноїдно-некротичного шару Зрілість грануляційної тканини Формування епітеліального пласту Вираженість фібриноїдно-некротичного шару Зрілість грануляційної тканини Формування епітеліального пласту Вираженість фібриноїдно-некротичного шару Зрілість грануляційної тканини Формування епітеліального пласту Вираженість фібриноїдно-некротичного шару Зрілість грануляційної тканини Формування епітеліального пласту Вираженість фібриноїдно-некротичного шару Зрілість грануляційної тканини Формування епітеліального пласту Вираженість фібриноїдно-некротичного шару Зрілість грануляційної тканини Формування епітеліального пласту Вираженість фібриноїдно-некротичного шару Зрілість грануляційної тканини Формування епітеліального пласту Вираженість фібриноїдно-некротичного шару Зрілість грануляційної тканини Формування епітеліального пласту Вираженість фібриноїдно-некротичного шару Зрілість грануляційної тканини Формування епітеліального пласту Вираженість фібриноїдно-некротичного шару Зрілість грануляційної тканини Формування епітеліального пласту Вираженість фібриноїдно-некротичного шару Зрілість грануляційної тканини Формування епітеліального пласту Вираженість фібриноїдно-некротичного шару Зрілість грануляційної тканини Формування епітеліального пласту Вираженість показників в балах Строк спостереження, діб 7 14 21 25 30 35 3,3 3,0 1,0 0,3 0 0 0,8 1,4 2,3 2,7 3,0 3,0 0 1,0 2,5 2,8 3,0 3,0 3,5 3,1 2,0 1,5 1,0 0,2 0,5 1,5 2,0 2,4 2,8 3,0 0 0,5 1,2 2,0 2,5 3,0 3,5 3,2 2,4 1,8 1,1 0,3 0,6 1,5 1,9 2,2 2,7 3,0 0 0,5 1,2 2,0 2,6 3,0 1,2 0,4 0 0 0 2,0 2,9 3,0 3,0 3,0 2,0 3,0 3,5 3,5 3,5 3,0 2,0 0,8 0 0 1,5 2,0 2,5 3,0 3,0 1,4 1,9 2,4 3,0 3,0 2,8 2,0 0,6 0 0 1,5 2,0 2,6 3,0 3,0 1,5 1,8 2,5 3,0 3,0 2,2 1,0 0,5 0 0 1,5 2,0 2,8 3,0 3,0 1,5 2,0 2,7 3,0 3,0 3,0 2,6 1,8 0,9 0 0 1,2 1,8 2,2 2,8 3,0 3,0 1,5 1,8 2,4 2,7 3,0 3,0 3,2 2,8 2,0 0,8 0 0 1,4 2,0 2,5 2,7 3,0 3,0 1,7 2,1 2,4 2,8 3,0 3,0 2,4 1,1 0,5 0 0 2,5 2,0 2,8 3,0 3,0 1,3 1,8 2,5 3,0 3,0 2,8 3,0 1,5 0,6 0 0 1,5 1,8 2,1 2,5 3,0 3,0 1,4 1,9 2,2 2,6 3,0 3,0 2,9 2,2 1,2 0,5 0 0 1,6 2,0 2,4 2,6 3,0 3,0 1,4 1,7 2,1 2,5 3,0 3,0 Примітка: «-» - зразки для гістологічних досліджень не забирали. 5 UA 116072 C2 Таблиця 2 Динаміка зменшення площі ранової поверхні у тварин із експериментальними хімічними ранами 2 Групи тварин 1 2 3 4 5 6 7 8 9 10 11 12 0 доба m±М 343,3±6,3 343,3+6,3 343,3±6,3 343,3±6,3 343,3+6,3 343,3±6,3 343,3±6,3 343,3±6,3 343,3±6,3 343,3±6,3 343,3±6,3 343,3+6,3 7 доба m±М 170,0+16,3 240,5+12,0 278,4±10,3 122,6±11,0 184,0±7,3 190,0+9,1 146,0±9,5 190,0±6,1 195,4+11,0 151,2+5,1 200,0±6,4 205,3±7,0 Площа ран, мм 14 доба 21 доба 25 доба m±М m±М m±М 111,6+9,0 18,0+1,6 1,7+1,0 195,0±7,3 106,4±8,2 51,9±6,3 211,5+8,4 141,0±9,4 102,0±11,5 10,5+1,5 # # 102,0+4,8 54,9±5,4 13,4+2,1 116,0+7,2 65,0±7,2 15,1+3,0 70,0±8,3 21,0±5,4 # 103,1+7,0 59,6±5,1 24,8±4,0 111,5+8,4 70,0±5,5 34,9±3,0 93,4+5,1 67,4±4,9 10,0±3,2 175,0±4,2 66,1±4,1 30,0±4,2 169,0+11,0 71,1±9,5 33,7+3,0 30 доба m±М # 12,3+1,1 40,2±7,4 # # # # 8,5±4,0 11,3±2,9 # 6,7±2,9 10,1±4,0 35 доба m±М # 4,1±0,9 19,0+4,1 # # # # # # # # # Примітка: m - середнє значення площі рани, М - стандартна відхилення, # - повне загоєння дефекту шкіри Таблиця 3 Оцінка ступеню зрілості грануляційної тканини і інтенсивності епітелізації ранової поверхні у тварин із експериментальними опіковими ранами Група тварин 1 2 3 4 5 6 7 8 9 Ознаки Вираженість фібриноїдно-некротичного шару Зрілість грануляційної тканини Формування епітеліального пласту Вираженість фібриноїдно-некротичного шару Зрілість грануляційної тканини Формування епітеліального пласту Вираженість фібриноїдно-некротичного шару Зрілість грануляційної тканини Формування епітеліального пласту Вираженість фібриноїдно-некротичного шару Зрілість грануляційної тканини Формування епітеліального пласту Вираженість фібриноїдно-некротичного шару Зрілість грануляційної тканини Формування епітеліального пласту Вираженість фібриноїдно-некротичного шару Зрілість грануляційної тканини Формування епітеліального пласту Вираженість фібриноїдно-некротичного шару Зрілість грануляційної тканини Формування епітеліального пласту Вираженість фібриноїдно-некротичного шару Зрілість грануляційної тканини Формування епітеліального пласту Вираженість фібриноїдно-некротичного шару Зрілість грануляційної тканини 6 Вираженість показників в балах Строк спостереження, діб 7 14 21 28 35 3,5 3,0 1,0 0 0 0,5 1,2 2,5 3,0 3,0 0 0,5 1,5 2,0 2,5 4,0 3,5 2,0 1,0 0,4 0,6 0,8 1,5 2,0 2,5 0 0 0,9 1,8 2,4 4,0 3,4 2,0 1,6 0,6 0,6 0,9 1,3 1,9 2,4 0 0 1,0 2,0 2,4 1,16 0,3 0 0 1,9 2,8 3,0 3,0 2,0 2,6 3,0 3,0 3,5 3,0 1,1 0,4 0 0,9 1,2 2,4 3,0 3,0 0 0,8 2,3 3,0 3,0 3,4 3,0 1,1 0,4 0 0,9 1,3 2,3 3,0 3,0 0 0,9 2,2 3,0 3,0 2,2 1,0 0,5 0 0 1,5 2,0 2,8 3,0 3,0 1,5 2,0 2,7 3,0 3,0 4,0 3,8 2,2 1,4 0,6 0,2 0,4 1,5 2,2 3,0 0 0,6 1,2 2,5 3,0 4,0 3,5 2,4 1,5 0,6 0,2 0,4 1,6 2,5 3,0 42 0 3,0 3,0 0 3,0 3,0 0 3,0 3,0 ; 0,2 3,0 3,0 0,2 3,0 UA 116072 C2 Таблиця 3 Оцінка ступеню зрілості грануляційної тканини і інтенсивності епітелізації ранової поверхні у тварин із експериментальними опіковими ранами Група тварин 10 11 12 Ознаки Формування епітеліального пласту Вираженість фібриноїдно-некротичного шару Зрілість грануляційної тканини Формування епітеліального пласту Вираженість фібриноїдно-некротичного шару Зрілість грануляційної тканини Формування епітеліального пласту Вираженість фібриноїдно-некротичного шару Зрілість грануляційної тканини Формування епітеліального пласту Вираженість показників в балах Строк спостереження, діб 7 14 21 28 35 0 0,5 1,4 1,7 3,0 3,0 2,4 1,9 0 0 0,4 1,8 2,5 3,0 3,0 0,2 1,5 2,5 3,0 3,0 3,0 2,5 1,5 0,5 0 0,3 1,2 1,8 2,4 3,0 0 0 0,5 1,8 3,0 3,0 2,5 1,5 0,6 0 0,4 1,0 1,6 2,5 3,0 0 0 0,5 2,0 3,0 42 3,0 0 3,0 3,0 0 3,0 3,0 Примітка: «-» - зразки для гістологічних досліджень не забирали. Таблиця 4. Динаміка зменшення площі ранової поверхні у тварин із експериментальними опіковими ранами 2 Групи тварин 1 2 3 4 5 6 7 8 9 10 11 12 3 доба m±М 510,5±8,4 510,5±8,4 510,5±8,4 510,5±8,4 510,5±8,4 510,5±8,4 510,5±8,4 510,5±8,4 510,5±,4 510,5±,4 510,5±,4 510,5±8,4 7 доба m±М 420,0±10,2 700,0±10,0 740,0±10,0 280,0±11,0 450,0±8,0 480,0±8,0 310,0±9,0 500,0±6,0 510,0±11,0 300,1±6,0 490,0±6,0 480,0±7,0 Площа ран, мм 14 доба 21 доба 28 доба m±М m±М m±М 310,0±8,0 140,0±15,0 40,0±13,0 420,0±8,0 306,0±18,0 150,9±16,0 780,5±6,0 320,0±19,0 170,0±5,0 40,0±12,0 # # 290,0±6,0 95,0±14,0 # 295,0±4,0 87,0±5,0 # 300,0±8,0 91,0±15,0 # 340,0±8,0 205,0±16,0 60,0±4,0 352,0±18,0 190,0±18,0 65,0±4,0 20,0±15,0 87,5±15,0 # 325,0±14,0 210,1±14,5 80,0±4,0 315,0±11,0 230,0±19,0 85,5±13,0 35 доба m±М # 70,0±3,0 85,0±7,0 # # # # # # # # # 42 доба m±М # # # # # # # # # # # # Примітка: m - середнє значення площі рани, М – стандартне відхилення, # - повне загоєння дефекту шкіри 5 10 15 Джерела інформації: 1. Бородин Ю.И., Блатова Н.П. Раневое покрытие "Литопласт" // Успехи наук о жизни. 2009.-№1.-С. 31-35. 2. Carter M.J., Fylling СР., Parnell L.K. Use of Platelet Rich Plasma Gel on Wound Healing: A Systematic Review and Meta-Analysis // ePlasty. - 2011. -Vol. 11.-P.382-410. 3. Абрафикова Л.Г. Петренко Т.Ф., Высеканцев И.П., Грищенко В.И. Влияние нативных и криоконсервированных аллофибробластов на процессы регенерации кожных язв у крыс // Запорожский медицинский журнал.-2010.-Т. 12, №2. -С. 5-8. 4. Trent J.F. Kirsner R.S. Tissue engineered skin: Apligraph, a bilayered living skin equivalent // Int. J. Clin. Pract. - 1998. - Vol. 52, № 6. - P. 408-413. 5. Lee D.Y., Lee J.H., Yang J.M. A new dermal equivalent: the use of dermal fibroblast culture alone without exogenous materials // J. Dermatol. Science. -2006. - Vol. 43, № 2. - P. 95-104. 6. Девятых Е.А. Гидрогелевые раневые покрытия в лечении венозных трофических язв: автореф. дис…канд. мед. наук. - М., 2006. - 95 с. 7 UA 116072 C2 5 10 15 7. Шандуренко И.Н. Опыт клинического применения биологически активных гелевых повязок // Материалы 4-й Международной конференции "Современные подходы к разработке и клиническому применению эффективных перевязочных средств, шовных материалов и полимерных имплантатов", 2011, Москва, РФ. - С. 82-85. 7 8. Патент РФ 2245723. МПК A61L15/44, А61Р31/02. Опубл. 10.02.2005. Средство и способ лечения гнойно-воспалительных заболеваний мягких тканей (прототип). 9. Попандопуло А.Г., Сліпченко І.О., Зубов Д.О та ін. Методика виготовлення дермального еквівалента для закриття ранових дефектів // Трансплантологія. - 2003. - Т.4, №1. - С. 264-266. 10. Малоштан Л.М., Башура О.Г., Ковальова Т.М. Вивчення регенеруючої та противиразкової активности настойки листя горіха волоського // Клінічна фармація. - 1999. - Т.З, №2. -С. 153-156. П.Попова Л.П., Камаев М.Ф. Как изменяются границы вновь образующегося епидермиса при заживлении раны / Инфицированная рана и ее лечение: (учеб. пособие) - [2-е изд. перераб. и доп.]. - М.: Медицина, 1970.-С. 67. 12. Волкова О.В., Елецкий Ю.К. Основы гистологии с гистологическое техникой.-М.: Медицина, 1982. - С. 184-234. ФОРМУЛА ВИНАХОДУ 20 25 1. Спосіб лікування ран, що включає використання ранового покриття, що містить гелеві мікрогранули з наповнювачем, який відрізняється тим, що як наповнювач використовують суміш, що включає антибіотик, полівалентний препарат бактеріофагів та імуномодулятор, а гелеві мікрогранули із наповнювачем перед використанням змішують з метилцелюлозним гелем, який містить фібробласти. 2. Спосіб лікування ран за п. 1, який відрізняється тим, що мікрогранули змішують з метилцелюлозним гелем з розрахунку 100±10 мікрогранул на 3-5 мл гелю. 3. Спосіб лікування ран за п. 1, який відрізняється тим, що концентрація фібробластів в 3 6 метилцелюлозному гелі складає 5×10 -1×10 кл/мл. Комп’ютерна верстка О. Рябко Міністерство економічного розвитку і торгівлі України, вул. М. Грушевського, 12/2, м. Київ, 01008, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 8
ДивитисяДодаткова інформація
МПК / Мітки
МПК: A61K 35/12, A61K 35/76, A61L 15/44
Код посилання
<a href="https://ua.patents.su/10-116072-sposib-likuvannya-ran.html" target="_blank" rel="follow" title="База патентів України">Спосіб лікування ран</a>
Попередній патент: Спосіб комплексного лікування стабільного вітиліго
Наступний патент: Спосіб сепарації з додатковим очищенням зернового матеріалу та аеродинамічний сепаратор “сад” для його реалізації
Випадковий патент: Спосіб формування низькоомних контактів в субмікронних к-мон-структурах великих інтегральних схем