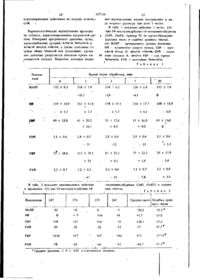
Спосіб одержання похідних оксіаміноебурнану або їх солей або оптично активних ізомерів
Номер патенту: 3539
Опубліковано: 27.12.1994
Автори: Чаба Сантаі, Лайош Сабо, Дьордь Калауш, Марія Газдаг, Янош Шапі, Лайош Данчі, Тібор Кеве
Формула / Реферат
1. Способ получения производных оксиаминоэбурнана формулы I
где R1 и R2, С1-С4- алкил, или их солей, или их оптически активных изомеров, отличающийся тем, что соединение гексагидроиндолохинолизина общей формулы II
где R2 имеет указанные значения; Х - кислотный остаток, подвергают взаимодействию с ди-эфиром метиленмалоновой кислоты общей формулы III
где R1 имеет указанные значення, в среде инертного растворителя в присутствии основного катализатора, полученный гексагидроиндолохинолизиновый эфир общих формул IVа и/или IVb
где R1, R2 и Х имеют указанные значения, каталитически гидрируют и полученные при этом окта-гидроиндолохинолизиновые эфиры общих формул IVа и/или IVb
где R1 и R2 имеют указанные значения, подвергают обработке неорганическим основанием в среде этанола и воды, причем в случае эфира формулы (Vb) обработку повторяют и полученный октагидроиндолохинояизиновый моноэфир общей формулы VI
где R1 и R2 имеют указанные значения, подвергают взаимодействию с нитритом щелочного металла в уксуснокислой среде и целевые продукты выделяют, причем при желании в ходе процесса из соединений формулы (IVа) и (IVb) выделяют основания, соединения формул (Vа), (Vb), (VI) и целевые продукты выделяют в виде солей и/или разделяют их на оптические изомеры.
2. Способ по п. 1, отличающийся тем, что в качестве основного катализатора используют триэтвламин или каталитическое количество трегбутилата калия.
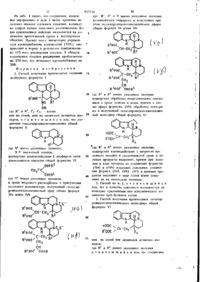
3. Способ получения производных октагидроиндолохинолизинового моноэфира общей формулы VI
или их солей или оптически активных изомеров, где R1 и R2 имеют указанные значения, отличающийся тем, что соединение гексагидроиндолохинолизина общей формулы (II), где R2 имеет указанные значения, а Х - кислотный остаток, подвергают взаимодействию с диэфиром метиленмалоновой кислоты общей формулы (III), где R1 имеет указанные значения, в среде инертного растворителя в присутствии основного катализатора, полученные гексагидроиндолохинолизиновые эфиры общих формул (IVа) и/или (IVb), где R1 и R2 имеют указанные значения, каталитически гидрируют и полученные при этом октагидроиндолохинолизиновые эфиры общих формул (Vа) и/или (Vb), где R1 и R2 имеют указанные значения, подвергают щелочной обработке с помощью неорганического основания в среде этанола и воды с последующим выделением целевого продукта в свободном виде, в виде солей или в виде оптически активных изомеров, причем при желании в ходе процесса из полученных соединений формул (IVа) и (IVb) выделяют основания, соединения общих формул (Vа) и (Vb) выделяют в виде солей и/или разделяют на оптические антиподы.
Текст
Союз Советски» Социалистических „Республик (И) К ПАТЕНТУ (61) Дополнительный к патенту (22)3аявлено 300580 СССР (23) Приоритет (32)31.05.79 (31) RI-71J Го с уд а рст ВЕННЫЙ комитет (21)2927202/23-04 (33) ВНР по делам изобретений Опубликовано 07.05.82. и открытий (51) М. Кл, С 07 D 46 І/00// А 61 К 31/475 Бюллетень № 17 (53) УДК 547.94. .07(088.8) Дата опубликования описания 07.05.82 (72) Авторы изобретения Иностранцы Чдба Сантаи. Лайош Сабо, Дъёрдь Кала>ш, Янош Шапи, Лайош Даичи, Тибор Кене и Мария Газдаг (ВНР) . Иностранное предприятие . I »Рихтер Гедеон Всдьесети Дьяр РТ" ' ) fBHP) (71) Заявитель (54) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ОКСИАМИНОЭЬУРНАНА ИЛИ ИХ СОЛЕЙ ИЛИ ОПТИЧЕСКИ АКТИВНЫХ ИЗОМЕРОВ, і И з о б р е т е н и е ОТНОСИТСЯ К СИНтеЗу НОІЇІ.ІХ ПрО изводных оксиаминоэбурнана общей формулы I Цель изобретения - расширение арсенала средств воздействия на живой организм. Цель достшается способом получения оксиаминоэбурнана обшей формулы (1), заключа5 ющимся в том, что соединение гексагидроиидолохинолиэина общей формулы II 2 т в • 1 •" О Н (И) 10 2 где R и R — алкильная ipynru с 1-4 атомами углерода или их солей, или их оптически активных изомеров, -обладающих ценными фармакологическими свойствами — сосудорасширяющим действием на сосуды конечностей. 15 Производные оксиамияоэбурнана общей формулы ї в литературе не описаны. Использование известного способа нитрозирования алифатических соединений с помощью 20 нитрита щелочного металла в кислой среде позволяет получать новые производные оксиаминоэбурнана формулы (1). обладающих фармакологической активностью [1]. где R2 имеет вышеуказанные значения; X — кислотный остаток, подверіают взаимодействию с диэфиром метиленмалоновой кислоты общей формулы 111 1 лы VI ноос (VI) где R1 и R2 имеют указанные значения, подверіают взаимодействию с нитритом щелочною металла в ук с усно кислой среде и целевые продукты выделяют, причем при желании в ходе процесса из соединений формулы (IVe) и (IV • выделяют основания, соединения формул (Va), (Vb) (VII и целевые"про дукты выделяют в пиле солей и/или их на оптические изомеры 40 или их солеи или оптически активных изомеров, 1 2 где R и R имеют указанные значения, соединение гексагидроиндолохинолизина общей 2 формулы (II), где R имеет указанные значения, а X — кислотный остаток* подвергают взаимодействию с диэфиром метилен мал оно1 вой кислоты общей формулы fill), где R имеет указанные значения, в среде инертного растворителя в присутствии основного катализатора, полученные гекигидроиндолохинолизиновые эфиры общих формул (IVa) и/или (IVb), где R1 и R2 имеют указанные значения, каталитически гидрируют и полученные при этом октагидроиндолохинолизиновые эфи ры общих формул (V9) и/или ( V B ) , где R1 и R2 имеют указанные .значения, подвергают щелочной обработке с помощью неорганическог о основания в среде этанола и воды с последующим выделением целевого продукта в свободном виде, в виде солей или в виде оптически активных изомеров, причем при желании в ходе процесса из полученных соединений формул (IVa) и (IVb) выделяют основания, соединения общих формул (Va) и (Vb) выделяют в виде солей и/или разделяют на оптические антиподы известными приемами П р и м е р 1 (±)-1а-Этил-1(Н2\ 2'-диэтоксикарбонил-этил) 1,2,3,4,6,7 12,12Ь а-октагидро-индоло (23-а) хинолизин и (±)-1а-этил-10-(2', 2\ 4', 4'-тетраэтоксикарбонил-бутил)1,2,3,4,6,7,12,12b а-октагидро-индоло (2,3-а) хинолизин Суспензию из 10,00 г (28,4 ммоль) 1-этил-1,2,3,4,6,7-гексагидро-12Н-индоло (2,3-а) хинолизин- S-иум-перхлората в 60 мл дихлорме50 тана и 3,6 мл (2,60 г; 2^,7 ммоль) триэтиламина при перемешивании смешивают с раствором 8,0 мл (8,4 г; 48,8 ммоль) диэтилового эфира метиленмалоновой кислоты в 10 мл дихлормегана Реакционную емгеь остав55 ляют стоять при комнатной температуре в течение 2 дней Растворитель отгоняют в вакууме и оставшееся после испарения окрашенное в оранже 5 9271 16 6 вый цвет масло растирают с 30 мл эфира и после отюнки растворяют в 30 мл дихлорметрижды - с 30 мл петролейною эфира. тана. Раствор встряхивают с 20 мл 5%-иою Таким образом, получают в виде масла водного раствора карбоната натрия, оріаничессмесь из 1-ЭТИЛ-1- (2',2*-диэтоксикарбонил-этил)кую фазу отделяют, высушивают над твердым - 1,2,3,4,6,7-і ексагидро-12Н-индоло (2,3-а) хи5 сульфатом маїния и затем испаряют в вакууме. Остаток растворяют в 10 мл этилового нолизин-5-иум-перхлората и 1-этил-1,2 (2\2\ спирта, раствор подкисляют этанольным рас4',4'-тетраэтоксикарбонил-бутил )-1,2,3,4,6,7-1 ектвором соляной кислоты до рН 5, и затем сагидро-І2Н-индоло (2,3-а) хшюлизин-5-иум)осаждают гидрохлорид добавлением 10 мл -перхлората, которую без очистки можно применять в последующих стадиях реакции. to эфира. Продукт отфильтровывают, промывают 1 эфиром и затем высушивают. ИК (в КВЧ), с м " : 3260 (индол-NH); 1735, 1715 (СО); 1615; 1520 (C-N). Получают 4 г (±)-1 а-этил-1 /3- (2',2*-диэток18 г маслянистой смеси растворяют в смесикарбонил- этил (1,2,3,4.6,7,12,12Ь а-октаї идроси, состоящей из 200 мл этанола и 50 мл -индоло (2.3-а) -хинолизин-гидрохлорида, что rf дихлорметана и гидрируют в присутствии 8 г 15 соответствует выходу 30,4%. считая на 1-этилпредварительно прогидрированного 10%-ного -1,2.3,4,6,7-гсксаіидро-12Н-шщоло (2.3-а)-хинопалладия на угле в качестве катализатора. лизин-5-нум-псрхлорат. Г п л 2О2-2О4°С (эфир). 1 После поглощения теоретического количества ИК (КВЧ), с м " : 3300 (индол №), 1720 водорода катализатор отфильтровывают и про(СО). мывают сначала трижды этанолом порциями п Масс-спектр (м/е,%). 426 (М+ 15); 425 (12); 2 по 3 мл. затем трижды дихлорметаном пор411 (1); 397 (1); 381 (8); 365 (0,5); 353 циями по 30 мл. Фильтрат соединяют с про(2); 307 (0,6); 267 (100); 253 (2); 237 мывной жидкостью и испаряют в вакууме до(4); 197 (12); 185 (8); 184 (7); 170 (10); суха. Остаток после испарения кристаллизуют 169 (12); 156 (5); 145 (0,6); ^44 (5); 143 на 50 мл этанола. Продукт промывают эта25 (3); 127 (1); 124 (3). нолом и затем высушивают. Таким образом (±)-1 а-Этил-1 0- (2'.21-диэтоксикарбонилполучают 9,0 г (±)-1а-этил-10- (2'.2\4',4'-тегря-эгил)-1,2,3,4.6,7,12.12Ь а-октагидро-индоло этоксикарбонил-бутил)-1,2,3,4.6,7,12,12Ь а-окта(2.3-а) хинолизиновое основание получают гидро-индоло (2,3-а) хинолизин-перхлората, тем, что гидрохлорид растворяют в дихлорчто соответствует выходу 453%, считая на 3 0 метане, раствор встряхивают с 59?-ным водным раствором карбоната натрия, органическую фа1-этил-1,2,3,4,6,7-гексагидро- 12Н-индоло (2,3-а) зу отделяют, высушивают над твердым сульхинолизин-5-иум-перхлорат. Т пл. 216-218°С фатом маїния, фильтруют и затем испаряют '(этанол). досуха. Элементный анализ. о С 3 зН 4 бМ2О 8 НСбЭ4(Моль.в. 699.18). 35 Найдено.%: С 57,00; Н 6,55; N 4,10. 1Н-ПМР (CDCfe, 5 ) ; 7,82 (1Н. индол-NH); Вычислено,%: С 56,68; Н 6,63; N 4,01. 7.2-6,85 (4Н. а р о м ) ; 3,90 ( 4 Н , д ^ = 7.3 ср S, О С Н 2 ) , 1.2-0.8 (9Н, - С Н 3 ) . Гидрохлорид соединения плавится при 211 Полученное описанным способом (±)-1 а212°С (этанол). Масс-спектр, (м/е,%): 426 (М + 172; 6); 0 -этил-1 f?- (2\2'-диэтоксикарбонил-эгил)-1,2,3, 4 4,6,7,12,12Ь а-октагидро-индоло (2,3-а) хиноли425 (3.); 411 (0,3); 397 (0.3); 381 (2); зиновое основание обрабатывают тонкослой353 (1); 267 (100); 253 (3); 197 (8); 185 ной хроматографией (KG 60. PF 254-366, бен(6); 184 (6); 170 (10); 169 (10); 1S6 (6); зол : метанол 14 : 3), элюируют ацетоном. По144 (5); 127 (10); 99 ( 1 0 ) . сле элюирования и испарения элюируюшей жид(±)-1-а-Этил-10- (2',2',4',4'-тетраэтоксикарб4 5 кости остаток после испарения перекристаллионил-бутил)-1,2,3,4,6,7,12,12Ьа-октаі идро-инэовывают из этанола. Продукт с большим знадоло (2,3-а) хинолизиновое основание получением рефракции Rf является (±)-1 а-этилчают тем, что перхлорат или гидрохлорид рас-1 ^-этил- 1 0- (2',2'-диэтоксикарбонил-этил)-1,2, творяют в дихлорметане, раствор встряхивают 3.4.6.7,12.12Ь а-октагидро-индоло (2.3 а) хинос 5%-ным раствором карбоната натрия, органилизином. ческую фазу отделяют, высушивают над тверВыход составляет 0,25 г, т.е. 27с, считая на дым сульфатом магния и испаряют в вакууме. 1-зтил-1,2.3,4.6.7-гексаіидро-12Н-индоло (2.3-а) 'H-IlMPtCDCk, 6) ;7,86(1Н, индол-NH); хинолизин-5-иум-перхлорат. 4,30 - 3,85 (8Н, О - С Н 2 ) ; 1,45 - 1.0(15Н. Т. пл. 127 128°С (этанол). I СН2 - С Н 3 ) . ИК (КВч) см"1. 3280 (индол-NH); 1730, Из этанольного маточника (±)-1 а-этил-10- 55 1705 (СО). -(2',2\4\4*-тетраэтоксикарбонил-бутил)-1.2.3.4. м 425 (7.1) 6,7,12,12Ь а-октагидро-индоло (2,3-а)-хинолизинМасс-спектр (м/с. 9S)" ( + 411 (0.8); 397 (0.8); 381 (4.2); 366 (0.0); -перхлората отіоняют этиловый спирт. Остаток 8 927116 расі пора карбоната натрия. Органическую фазу 353 (1,8); 337 (0.8); 335 (0,5); 307 (0,6); отделяют, высушивают над твердым сульфатом 267 (100). магния, отфильтровывают и фильтрат испаряют П р и м е р 2. (±)-1 а-Этил-1 0-(2\2'-див вакууме досуха- Остаток после испарения этоксикарбонил-этил)-1,2,3,4,6.7.12,12Ь а-октагидро-индоло (2,3-а)-хинолизин и (±)-1а-этил- 5 разделяют с помощью тонкослойной хромато> графии (окись алюминия тип Т, текущая жид-1 |3(2',2 ,4',4'-тетраэтоксикарбонил-бутил)-1,2, кость дихлорметан : бензол в соотношении 3,4,6,7,12,12b а-октагидро-индоло (2,3-а) хино20 . 1, элюирующая жидкость дихлорметан : лизин. метанол 20:1) на его составные части. 5,00 г (14,2 моль) 1-этил-г,2,3,4,6,7-гексагидро-12Н-нндоло- (2,3-а) -хинолизин-иум-пер10 Соединение с большим значением рефракхлората суспендируют ,в смеси, состоящей из ции Rf растворяют в 1,2 мл этилового спирта 30 мл дихлорметана и 0,080 г (0,715 ммоль) и раствор подкисляют спиртовым раствором трет-бутилата калия. К суспензии при переме(этанольным) соляной кислоты до рН 5. Гидшивании добавляют раствор 0,03 мл (3,12 г; рохлорид осаждают добавлением 1,2 мл эфира. 18,4 ммоль) диэтилового эфира метиленмало15 отфильтровывают, промывают эфиром и затем новой кислоты в 5 мл дихлорметана. Реаквысушивают. Получают 0,46 г (±)-1 а-этил-1 /3ционную смесь оставляют стоять при комнат-, - (2',2'-диэтоксикарбонил-этил) -1,2,3,4,6,7 Л 2, ной температуре в течение одного дня. 12Ьа-октагидро-иНдоло (2,3-а) хинолизин-тидроЗатем растворитель отгоняют в вакууме и хлорида, который плавится при 202—204° С оставшееся после испарения органическое мас- 20 (этиловый спирт, эфир). Выход 70,5%. ло растирают трижды с 5 мл петролейного Из соединения с меньшим значением рефракэфира. Получают 9 г смеси, состоящей из ции Rf получают с 70%-ной водной перхлор1-этил-1-(2',2'-диэтоксикарбонил-этил)-1,2,3, ной кислотой перхлорат и затем перекристал4,6,7-гексагидро-ПН-индоло- (2,3-а) хинолизинлизовывают из этанола. Получают 0,26 і (26%) -5-иум-перхлората и 1-этил-1- (2',2',4',4'-тетра25 (і) • 1 а-этил-1 j3- (2\2',4\4'-тетраэтоксикарбонилэтоксикарбонил- бутил) -1,2,3,4,6,7-гексагидро-бутил)-1,2,3,4,6,7,12,12Ь а-октагидро-индоло . -1211-индоло (2,3-а) хинолизин-5-иум-перхлората (2,3-а) хинолизин-перхлората, который плавитв виде масла. Ее без дополнительной очистки ся при 216—218°С (этиловый спирт). можно применять в последующей стадии реакП р и м е р З - (±)-1 а-Этил-1 0-(2\2*-диции. этоксикарбонил-этил) -1,2,3.4,6,7Л2,12Ь а-окта30 ИК (КВч), см" 1 3260 (индол-NH); 1735; гидро-индоло (2,3-а) хинолизин. 1715 (СО); 1615; 1520 (C-N). 600 мл (1 ммоль) полученного по приме9 г полученного масла растворяют в смеси р а м 1 и 2 (±)-1 а-этил-1 0-(2\2',4',4'-тетраэтиз 10 г этанола и 25 мл дихлорметана и гидоксикарбонил-бутил)-1,2,3>4,6,7,12,12Ь а-октарируют в присутствии 6 г предварительно п-рогидро-индоло (2,3-а) хинолизина растворяют , гидрированного 10%-ного палладия на угле. По- 35 в 8 мл этанола. К раствору добавляют раствор сле поглощения желаемого количества водоро120 мг гидроокиси калия в смеси, состоящей да катализатор отфильтровывают из раствора из 1 мл этанола. Реакцию проводят с помощью и промывают сначала трижды этанолом порцитонкослойной хроматографии (окись алюминия ями по 3 мл, затем трижды дихлорметаном тип Т, текущая жидкость дихлорметана .бен40 зол 3:1, Rf — значение диэтоксикарбонилэтильпорциями по 10 мл. Фильтрат объединяют с промывной жидкостью, испаряют в вакууме доного производного больше, чем у тетраэтоксисуха и остаток после испарения кристаллизуют карбонилбутильного производного) и осущестиз 30 мл этанола. Продукт отфильтровывают, вляют ее в течение 20 мин. Реакционную смесь промывают этанолом и затем высушивают. подкисляют уксусной кислотой до рН 6 и 45 отгоняют растворитель в вакууме. Остаток поТаким образом получают смесь (8 г) из сле испарения растворяют в 8 мл воды, рас(±)-1 а-этил-1 Д- (2\2\4',6'-тетраэтоксикарбонилтвор подщелачивают 5%-ным водным раство- бутил) - 1,2,3,4.6,7,12,12b а-октагидро- индолором соды до рН 9 и затем трижды экстраги- (2,3-а) хинолизин-псрхлората и (±)-1 а-этилруют 5 мл дихлорметана. Органические фазы -I fi- (2',2'-диэтоксикарбонил-э1Ил)-1,2,3,4,6,7, 5 0 12,12Ь а-октагидро-индоло (2,3-а) хинолизинобъединяют, высушивают над безводным суль-перхлората, которая плавится при 181 -І85 С. ,- фатом магния, отфильтровывают и раствори° тель отгоняют в вакууме из раствора. ПолуСмесь солей без выделения и разделения ченное в качестве остатка после испарения можно применять в послецующей стадии реакмасло растворяют в 3 мл этанола и раствор ции в виде раствора, полученного после огфильтровывания катализатора. 55 смешивают с солянокислым этанолом. ПолуЧтобы установить состав смеси перхлоратов, ченный гидрохлорид осаждают эфиром. 0,8 г смеси растворяют в 6 мл дихлорме'тана Получают 0,25 г (53%) (±)-1 а-этил-1 0-$ .2'-диэтоксикарбонил-этил)-1,2,3,4.6.7,1 2,12Ь а-октаи встряхивают раствор с 4 мл 5%-нот водного ID 927116 гидро-индоло (2,3-а) хинолизин-гидрохлорида, стал л ы отфильтровывают, промывают 5 мл который плавится при 201 -204° С. поды и 737ем пмсушивают. ИК (КВч), см"1*. 3300 (индол-NH), 1720 Получают 0.24 і (74%) (±)-1 а-этил-1 0- (2'(СО). -карбокси- 2'- этоксикарбонил-этил) -J .2,3,4,6,7,12, П р и м е р 4. (±)-1 а-Этил-1 0-(2'-карбок12Ь а-октагидро-индоло (2,3-а)-хинолизина, ко5 си-2'-этоксикарбонил-этил)-1,2,3,4,6,7,12,12b торый плавится при П2-114°С. а-октагидро-индоло (2,3-а) хинолизин. П р и м е р 6. (±)-1 а-Этил-1 0- (2*-карбок0,46 г (1,08 ммоль) полученного по примеси-2'-этоксикарбонил-этил)-1,2,3,4,6,7,12,12Ь &• рам 1 или 2 (±)-1 а-этил-1 0-(2',2'-диэтокси-октагидро-индоло (2,3-а) хинолизин. карбонил-этил)-1,2,3,4,6,7,12,12Ь а-октагидрою Исходя из фильтрата, который получают по -индоло (2,3-а) хинолизина растворяют в примеру 2, после отфильтровывания катализа3 мл этанола и к раствору добавляют растора. Этот фильтрат содержит растворенный твор 0,067 г (1,2 ммоль) гидроокиси калия в смеси этанола и дихлорэтана (±)-1 а-этилв смеси, соєтоящей из 0,3 мл воды и 0,9 мл 1 0- (2\2'-диэтоксикарбонил-этил) -1,2,3,4,6,7, этанола. Реакционную смесь кипятят в течение is 12,І2Ь а-октаїидро-индоло (2.3-а) хинолизин90 мин на водяной бане. Затем растворитель -перхлорат и (±)-1 а-этил-1 0- (2',2\4',4'-тетраотфильтровывают. Полученное в качестве осзтоксикарбопил-бутил)-1.2,3,4,6,7,12,12b а-октататка масло растворяют в 3 мл воды и расгидро-индоло (2,3-а) хинолизин-перхлорат притвор дважды экстрен ируют 2 мл эфира. Водблизительно в весовом соотношении 3:1. ную фазу подкисляют уксусной кислотой до jo Из фильтрата растворитель отгоняют в варН 6- Выпавшие белые кристаллы отфильтрокууме. В качестве остатка получают смесь вывают, промывают водой (5 мл) и затем перхлоратов маслообразной консистенции- Ее высушивают. > растворяют в 50 мл дихлормстана, раствор встряхивают с 30 мл Ь% -ного видного рас25 твора карбоната натрия, затем органическую фазу отделяют, высушивают над твердым сульфатом маї ния, фильтруют и фильтрат испаряют в вакууме. Полученный в виде масла остаДы). ток (1,54 г. 2,34 ммоль диэтокси-и 0.90 ммоль Значение рефракции Rf (+)-l а-этил-10- (2',2'тетраэтоксиоснования. всего 3.24 ммоль) рас-диэтоксикарбонил-этил)-1,2,3,4,6,7,12.12Ьа30 творяют в 16 мл этанола. К раствору добав-октагидро-индоло (2,3-а) хинолизина больше, ляют 0.24 г (4,28 ммоль) гидроокиси1 калия чем у (±)-1 а-этил-1 0-(2'-карбокси-2'-эгоксив 2 мл воды. Реакционную смесь кипятят в карбонил-этил)-1,2,3,4,6,7,12.12Ь а-октагидротечение 1-1.5 ч на водяной бане. Затем рас-индоло (2,3-а) хинолизина (на сшшкагеле G, творитель испаряют в вакууме, остаток раствобензол : метанол : концентрированный аммиак 35 ряют в 10 мл воды и щелочной раствор триж15 мл : 5 мл : 2 капли). ды экстрагируют 10 мл эфира. Органическую ИК (КВч), см" 1 3360 (индол-NH); 1715 фазу высушивают над безводным сульфатом (СО); 1600 (карбоксилат). + магния, фильтруют и фильтрат испаряют. МасМасс-спектр (м/е,%); 354 (М 44.58); 353 лянистый остаток в количестве 0,4 г пред(58); 339 ( 8 ) ; 325 (8,3); 309 (12); 281 (2); 40 ставляет собой в основном смесь исходных 267 (100) 44 (1000). соединений. Получают 0,23 г (74%) (±)-1 а-этил-1 (3-(21-карбокси-2'-этоксикарбонил-этил)-1,2,3Ч4,6.7, 12,12Ь а-октагидро-индоло (2,3-а) хинолизина, который плавится при 113-115° Г (из во П р и м е р 5. (±)-1 а-Этил-1 0-(21-карбокси-2'-этоксикарбонил-этил)-1,2,3,4,6,7,12,12Ь а-октагидро-индоло (2,3-а) хинолизин. 0,428 г (0,715 ммоль) полученною по примерам 1 или 2 (±)-1 а-этил-1 0-(2\2',4',4'-теграэтоксик&рбонил-бутил)-1,2,3,4,6,7,12,12Ь а-октагидро-индоло (2,3-а) хинолизина растворяют в 3 мл этанола. К раствору добавляют 50 раствор 0,092 г (1,64 ммоль) гидроокиси калия в смеси, состоящей из 0,3 мл воды и 0,9 мл этанола. Реакционную смесь кипятят в течение 45 мин на водяной бане, затем растворитель отгоняют в вакууме. Полученное в- качестве остатка масло растворяют в 3 мл 55 воды и раствор дважды экстрагируют 2 мл эфира. Водную фазу подкисляют уксусной кислотой до значения рН 6, Выпавшие кри Значение рН экстрагированной эфиром водной фазы добавлением уксусной кислоты устанавливают равным 6 и выпавшее органическое вещество четыре разз экстрагируют 15 мл дихлорметана. Объединенные органические фазы высушивают над безводным сульфатом магния и после фильтрования испаряют в вакууме. Оставшееся в качестве остатка масло растирают с 10 мл эфира, выпавшее вещество отфильтровывают, промывают 5 мл эфира и затем высушивают. Получают 0.76 і (597г) (±)-1 а-этил-1 0-(2*•карбокси- 2"- этоксикарбонил- этил)-1.2.3,4.6,7, 12Т12Ь а-октагидро-индоло (2.3-а) хинолизина. который плавится при 1 0 8 - Ш ° С с разложением. 927116 и И р и м є р 7. (+)-цис-14-Этоксикарбониллоты. Полученное соединение плавится при • 14-оксиаминоэбурнан (ЗаН. 16aEt). 179 С (из метанола). 1 0,75 (1,885 ммоль) полученного по примеру ИК (КВч), см" 3420 (NH. ОН); 1710 6 (±)-1 а-этил-1 j3- (2'-карбокси-2'-этоксикарбо(СО а СН 3 ). нил-этил)-1,23,4,6,7,W2,12b а-октагидро-иидоло 'Н-ПМР (CDCE3.5) : 8, О ппм ( Ш , NH); (2.3-а) хинолизина растворяют в 15 мл ледя7,6 - 7,0 (4Н. М , аром, протоны); 3,5 ной уксусной кислоты. К раствору добавляют (ЗН, М . СО а СН 3 ), 1,1 (ЗН, t, СН 2 СН 3 ). + раствор 0,39 г (5,65 ммоль) нитрита натрия Масс-спектр, м/е: 70 eV, M 369. в 5 мл воды. Реакция протекает при комнатНайдено,%: С 68,58; Н 7,29; N 11,28. ной температуре в течение 1 ч. Затем реакциВычислено,%- С 68,27; Н 7,36; N 11,38; 10 онную смесь при очень интенсивном охлаждеЭлементный анализ. нии (лед) подщелачивают 30%-ным водным C 2 1 H 2 7 N 3 O 3 ( C 369,44). раствором едкого натра до рН 11 и выделившеП р и м е р 10. (±)-цис-14-Этоксикарбокилеся оріаническое вещество четыре раза экстра-14-оксиамино-эбурнан (ЗаН, 16aEt). гируют 40 мл дихлорметана. Объединенные ор8 г смеси, полученной аналогично примеру 15 ганические фазы встряхивают с 10 мл воды, 2, состоящей из (±)-1 а-этил-1 Д-(2\2'-диэтоквысушивают над безводным сульфатом маг- . сикарбонил-этил)-1,2,3,4,6,7,12,12Ьа-октагидрония и фильтруют. Из фильтрата в вакууме -индоло (2,3-а) хинолизина и (і)-1 а-этил-1 отгоняют растворитель. Получают 0,60 г твер/3- (2',2\4\4'-тетраэтоксикарбонил-бутил) -1,2,3, дого остатка, который растирают с 5 мл ди4,6,7,12,12b a-окгаіидро-индоло (2,3-а) хинохлорметана. Осаждающееся вещество отфильт- • 20 лизина, растворяют в 80 мл дихлорметана. ровывают, промывают 3 мл дихлорметана и Раствор встряхивают с 40 мл 5%-ного водного затем высушивают. раствора карбоната натрия, орі эпическую фазу отделяют, высушивают над безводным сульПолучают 0,52 (72%) (±')-цис-14-этоксикарбонил-14-оксиаминоэбурнана (ЗаН, 16aEt), ко- 25 фатом маї ния, фильтруют и фильтрат испаряют в вакууме досуха. Оставшееся масло расторый плавится при 156—158°С (дихлорметан). творяют в 80 мл, к раствору добавляют растЗначение рефракции Rf этого соединения больвор 1,00 г гидроокиси калия в 4 мл воды ше, чем у соединения (±)-1 а-этил-1 (3-(2'-карби реакционную смесь оставляют стоять при окси-2'-этоксикарбонил-этил)-1,2,3,4,6,7,12,12Ь комнатной температуре в" течение 3,5 ч. а-октзгидро-индоло (2,3-а) хинолизин (силика30 іель G, бензол : метанол 14 : 3 ) . Затем растворитель отгоняют в вакууме, Полученное таким образом предлагаемое сополученное в качестве остатка масло раствоединение не дает с известным соединением *ряют в 16 мл воды и дважды экстрагируют депрессии точки плавления. 8 мл бензола. ИК в (КВч), с м " 1 ' 3 4 0 0 (NH, ОН), 1700 К водной фазе добавляют 32 мл ледяной 35 (ГО). * ' уксусной кислоты, а затем при охлаждении 1Н-ПМР (CDCf3 6 ) : 8,3 ( Ш , NH); 4,0 (2Н, извне льдом в течение 10 мин по каплям до5, М - 7,3 c p S , СООСН2 - С Н 3 ) ; 1,18 ппм бавляют 2,00 г нитрита натрия в 4 мл воды. (ЗН, t, J = 7,3, cpS, СООСН 2 СН 3 ). Смесь оставляют стоять при комнатной температуре в течение часа и затем при -интенсивМасс-спектр (м/е, % ) : 383 (М + 98); 382 40 ном внешнем охлаждении льдом подщелачи(58); 366 (100); 354 (10); 338 (7,7); 310 вают 30%-ным раствором едкого натра до рН (31); 292 (29); 278 (8,5); 267 (40); 253 9. Смесь экстрагируют трижды 50 мл этилаце(92); 237 (15); 211 (18). тата. Объединенные органические фазы встряП р и м е р 8. (±)-3aS. 16aS-14-3TOKCHкарбонил- 14-эбурная. хивают в 20 мл воды, затем отделяют, высу45 шивают над твердым сульфатом магния, фильЭто соединение получают, если полученный аналогично примеру 7 (±)-цис-14-этоксикарботруют и из фильтрата отгоняют растворитель. Оставшееся твердое вещество в количестве нил-14-эбурная (ЗаН, 16aEt) 1-дибензоилвин4 г перекристаллизовывают из 20 мл дихлорной кислотой разлаїают на его оптические анметана. Получают 3,44 г продукта, который типоды. Соединение, перекристаллизованное из 50 по своим химическим и физическим свойствам дихлорметгна, плавится при 169—171°С. совпадает с продуктом, полученным аналогич[ а ] 1 0 = - 56, Г С (с 1,05 диметилформ10 примеру 7. амид)? П р и м е р 9. (±)-цис-14-МетоксикарбонилРассчитывая на исходное соединение, кото•Н-оксиамино-эбурнан (ЗаН, 16«Et). рое составляет 5.00 г 1-этил-1,2,3,4,6.7-іекса55 гидро-12Н-индоло (2,3-а) хинолизин-5-иумАналоїично примерам 2. 6 и 7, однако ис-перхлората (пример 2). выход составляет 65%. ходят не из диэтилового эфира мет ил енмал о новой кислоты, а из эквивалентных количеств Соединения общей формулы (1) обладают циметилового эфира метилен малоновой киссосудорасширяющим действием, особенно сосу 927116 13 дорасширяющим действием на сосуды конечностей. жат исследованию, вводят внутривенно в виде водного раствора при дозе 1 мг/кг. В табл. ! показано действие 1 мі /кг (±)Фармакологические исследования проводят •цис- 14-метоксикарбоннл-14-окснаминоэбурнана нз собаках, нэркотизировянных хлоралозой уре(ЗаН, 16aEt; пример 9) нэ кровообращение тана. Измеряют артериальное давление, пульс, (среднее число и ошибка среднего числа), кровоснабжение артерии Arteria femora Ms и где МАВР — артериальное среднее давление, Arteria carotis niterna, а также состояние соHR - количество ударов пульса, CBF - кросудов обеих областей вен (состояние, кровявянпй поток A. carotis niterna, CYR - состоное давление разделяется потоком крови ка10 яние сосудов A. carotis FBF - ток крови сающегося сосуда). Вещества, которые подлеfemoralis, FYR — состояние ferrtoraJis. Т а б л и ц а Показатели 0 МАВР 132 + 9,3 Время после обработки. иин I 1 з 1 20 124 * 6,2 126 + 6.8 132 ± 7,8 •5,8 -4,1 0 161 ± 15.8 ИВ ± 15,5 156 + 17.7 148 + 13,< 118 ± 7,9 149 ± 10,9 ± 7,7 + 7,7 ± 5,7 + 4,1 - 0,9 49 ± 13,0 61 і 20,2 55 + 17.6 55 ± 16,0 49 + 13,0 '•• «• CBF 1 -10. 2 Н и ± 20,5 CVR + 9,0 2,4 ± 0.5 3,1 ± 0,6 + 8,9 2,8 ± 0,6 2.8 ± 0.6 - 2% FBF 1 72° ± 18,8 3,1 ± 0,6 о ' - 11 -12 81 + 25,1 117 ± 29,1 0 77 ± 22.2 + 1,3 70 ± 17,9 - 3,4 + 71 + 5,8 1,2 ± 0,2 2,3 + 0,7 FVR + 9,5 2.0 ± 0,6 2,1 ± 0.7 2,5 ± 0,8 - 7,8 + 3,9 - 45 - 13 -оксиаминоэбурнана (ЗаН, 16aEt) в отдельных опытах. Т а (і л и ц а 2 і В табл. 2 показано максимальное действие в процентах ±)-цис-14-метокси-карбонил-14 1 Показатели МАВР HR 247 Среднее число Ошибка сред него числа 256 -11 0 259 263 -15 0 -5 -10,2 +2.3* + 9 + 14 +8 +7,7 ±3,0 +20,5 ±7,3 CBF +38 +25 + 14 +5 CVR -34 -32 -71 •13 •2% ±5,5* FBF + 116 +57 +67 +44 +71 + 1S.9 FVR -58 •43 -46 -32 -44.7 Среднее значение < Р < 0.05 статистически значимо. 16 15 927П6 Из габл ) видно, что соединение, введенгде R1, R2 и X имеют указанные значения, ное внутривенно в дозе 1 мі/кі временно некаталитически іидрируют и полеченные при сколько снижает кровяное давление, количестэтом OR таї идрошщплокинолизнновьге эфиры во ударов пульса несколько увеличивается. Бообщих формул Va и/или Vb лее существенное действие оказывается на количество протекающей крови в исследуемых областях Прежде всею значительно укрепляется кровоснабжение конечностей (71%); оно приходит в норму в результате приблизительно 45%-ного расширения сосудов. В области 10 каронарных сосудов расширение приблизительно 25%-ное, что повышает кровоснабжение на 20%. Ф о р м у л а и з о б р е т е н и я 1. Способ получения производных оксиаминоэбурнана формулы 1 15 20 іде R1 и В : , С ! - С 4 - алкил. или их сопей, или их оптически активных изо- 25 меров, о т л и ч а ю щ и й с я тем, чго соединение гексагидро индол охин олизина общей формулы II (Vi) \ Л. где R1 и R2 имеюі указанные значения подвергают обработке неорганическим основанием в среде этанола и воды, причем в случае эфира формулы (Vb) обработку повторяют и полученный октагидроиндолохинолизиновый моноэфир общей формулы VI 30 где R им'ет указанные значения; X *- кислотный остаток, Подвергают взаимодействию "t диэфиром метиленм.шоновои кислоты общей формулы III 35 COOK1 1 COOR где ГЇ имеет указанные значения. О среде инертного растворителя в присутстиии основного катализатора, полученный іексліидроиндолохднолизиновый эфир общих формул IVa и/иля !Vb 1 40 где R1 и R2 имеют указанные значения, подвергают взаимодействию с нитритом щелочного металла в уксуснокислой среде и целевые продукты выделяют, причем при желании в ходе процесса из соединений формулы (IVa) и (IVb) выделяют основания, соединения формул (Va), (Vb) (VI) и целевые продукты выделяют в виде солей и/или разделяют их на оптические изомеры. 2. Способ по п. ^ о т л и ч а ю щ и й с я тем, что в качестве основного катализатора используют триэтиламин или каталитическое количество трет-бутилата калия 3. Способ получения производных октагидро индо лохино л изицового моно^ирл общей формулы VI 50 55 или их солеи или оптически активных изомеров, где R1 и R2 имеют указанные знлчения о т л и ч а ю щ и й с я тем, что соединение 17 927116 гексагидро нндол о хинол иэин а обшей формулы де этанола и ноды с последующим выделением 3 (II), где R имеет указанные значения, а X целевою продукта в свободном виде, в пидс кислотный остаток, подверіают взаимодейсолей или в виде оптически активных изомествию с диэфиром метиленмалоновой кислоты ров, причем при желании в ходе процесса 1 общей формулы (III), где R имеет указаниз полученных соединений формул (IVa) и 5 иые значения, в среде инертного растворителя (IVb) выделяют основания, соединения обв присутствии основного катализатора, полученщих формул (Ve) и (Vb) выделяют в виде ные гексагидроиндолохинолизиновые эфиры солей и/или разделяют на оптические анти1 общих формул (IVa) и/или (IVb), где R и поды. 3 R имеют указанные значения, каталитически \Q Источники информации, гидрируют и полученные при этом октагидропринятые во внимание при экспертизе индолохинолизиновые эфиры общих формул 1 2 1. Вейганд - Хильгетаг. Методы экспери(Vo) и/или (Vb), где R и R имеют указанмента в органической химии. М., "Химия", ные значения, подвергают щелочной обработке с помощью неорганического основания в ере^ 5 1968, с. 393 -394. Редактор Н. Гунько Составитель И. Федосеева Техред 3. Фанта Корректор И. Муска Заказ 3012/49 Тираж 448 Подписное ВНИИПИ Государственного комитета СССР по делам изобретений и открытий 113035, Москва, Ж-,35, Раушская наб., д. 4/5 Филиал ППП "Патент", F. Ужгород, ул. Проектная, 4
ДивитисяДодаткова інформація
Автори англійськоюCsaba Szantay, Szabo Lajos, Kalaus Gyoergy, Sapi Janos, Danchi Lojosh, Keve Tibor, Gazdag Maria
Автори російськоюЧаба Сантаи, Лайош Сабо, Дёрдь Калауш, Янош Шапи, Лайош Данчи, Тибор Кеве, Мария Газдаг
МПК / Мітки
МПК: A61K 31/475, C07D 461/00, A61K 31/435, A61P 9/08, C07D 471/14
Мітки: спосіб, ізомерів, оптично, оксіаміноебурнану, похідних, солей, одержання, активних
Код посилання
<a href="https://ua.patents.su/10-3539-sposib-oderzhannya-pokhidnikh-oksiaminoeburnanu-abo-kh-solejj-abo-optichno-aktivnikh-izomeriv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання похідних оксіаміноебурнану або їх солей або оптично активних ізомерів</a>
Попередній патент: Спосіб одержання водних розчинів вінкрістіну або вінбластіну
Наступний патент: Суха градирня
Випадковий патент: Пневмотранспортна система збору і транспортування радіоактивного пилу і активного укриття реакторного блока атомної електростанції