Застосування заміщених 2-амінотетралінів для випереджувального лікування хвороби паркінсона
Формула / Реферат
1. Застосування сполуки загальної формули І
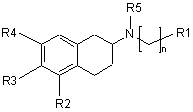 ,
,
де:
n = 1-5;
R1 вибрано з групи:
![]() ,
,![]() ,
,
де X - S, О або NH;
R2 означає ОА; з А, вибраним з групи: Н, C1-12 алкіл, алкоксиметил або група
![]() ,
,![]() ,
,![]() ,
,![]() ,
,
де R6 та R7 є незалежно С1-20 алкіл, феніл або метоксифеніл;
R3 та R4 кожний означає водень;
R5 означає C1-3 алкіл;
причому сполука формули І є рацематом або чистим (R)- або (S)-енантіомером;
а також фізіологічно прийнятних солей цих сполук як медикаменту для випереджувального лікування хвороби Паркінсона.
2. Застосування за п. 1, де випереджувальне лікування проводять на індивідах, яких вибрано з групи:
(a) індивіди без симптомів хвороби Паркінсона, але зі збільшеним ризиком розвитку хвороби Паркінсона, або
(b) індивіди з ранніми симптомами хвороби Паркінсона, у яких є відсутніми або тільки частково присутніми принаймні три з чотирьох кардинальних симптомів хвороби Паркінсона (ригідність, тремор в спокійному стані, брадикінезія, нестабільність осанки).
3. Застосування за п. 2, де індивіди, описані у п. (b) виявляють кілька з наступних клінічних симптомів: розлади нюху, депресія, розлади швидкого сну типу "REM-поведінковий розлад", обстипація та короткотермінові аномалії руху.
4. Застосування за п. 2, де індивіди виявляють мутацію у ПАРК-гені та/або модифікації у альфа-синуклеїновій або нейромеланіновій системі.
5. Застосування за будь-яким з попередніх пунктів, де А є атомом гідрогену або є вибраним з групи:
![]() ,
,![]() ,
,![]() ,
,![]() ,
,
де R6 - С1-12 алкіл, феніл або метоксифеніл.
6. Застосування за будь-яким з попередніх пунктів, де n = 1-3.
7. Застосування за будь-яким з попередніх пунктів, де X є атомом сульфуру.
8. Застосування за будь-яким з попередніх пунктів, де R5 є С3 алкілом.
9. Застосування за будь-яким з попередніх пунктів, де R1 означає 2-тієніл, R5 означає С3 алкіл, а n = 2.
10. Застосування за будь-яким з попередніх пунктів, де сполукою є 5,6,7,8-тетрагідро-6-[пропіл[2-(2-тієніл)етил]аміно]-1-нафтол.
11. Застосування за п. 10, де сполукою є чистий S-енантіомер (ротиготин).
12. Застосування за будь-яким з попередніх пунктів, де перед початком застосування медикаменту індивіди виявляють втрату допамінергічних клітин у чорній субстанції менше 60%.
13. Застосування за будь-яким з попередніх пунктів, де індивіди мають перед початком застосування медикаменту показник за шкалою UPDRS менше 10.
14. Застосування за будь-яким з попередніх пунктів, де індивіди мають показник за Ноеhn-Yahr 0 або 1.
15. Застосування за будь-яким з попередніх пунктів, де медикамент призначений для парентерального, трансдермального введення або ведення через слизову оболонку.
16. Застосування за будь-яким з попередніх пунктів, де сполуку загальної формули І вводять у дозі 0,05-50 мг на добу.
17. Комплект для превентивного лікування хвороби Паркінсона, який включає:
(a) засіб, що здатний діагностувати схильність до розвитку хвороби Паркінсона на ранній або асимптоматичній стадії, та
(b) фармацевтичну композицію, що містить заміщені 2-амінотетраліни загальної формули І за будь-яким з пп. 1-11.
18. Комплект за п. 17, де діагностичний засіб (а) вибрано з групи:
(і) засіб або діагностичний комплект для визначення нейромеланіну,
(іі) засіб або діагностичний комплект для визначення семафорину 3,
(ііі) засіб або діагностичний комплект для визначення альфа-синуклеїну та/або його агрегатів,
або
(iv) засіб або діагностичний комплект для генетичного визначення мутації, асоційованої з виявом хвороби Паркінсона, та/або алелі, асоційованої з більш частими виявами хвороби Паркінсона.
Текст
1. Застосування сполуки загальної формули І R5 C2 2 (19) 1 3 83691 4 12. Застосування за будь-яким з попередніх пунктів, де перед початком застосування медикаменту індивіди виявляють втрату допамінергічних клітин у чорній субстанції менше 60%. 13. Застосування за будь-яким з попередніх пунктів, де індивіди мають перед початком застосування медикаменту показник за шкалою UPDRS менше 10. 14. Застосування за будь-яким з попередніх пунктів, де індивіди мають показник за Ноеhn-Yahr 0 або 1. 15. Застосування за будь-яким з попередніх пунктів, де медикамент призначений для парентерального, трансдермального введення або ведення через слизову оболонку. 16. Застосування за будь-яким з попередніх пунктів, де сполуку загальної формули І вводять у дозі 0,05-50 мг на добу. 17. Комплект для превентивного лікування хвороби Паркінсона, який включає: (a) засіб, що здатний діагностувати схильність до розвитку хвороби Паркінсона на ранній або асимптоматичній стадії, та (b) фармацевтичну композицію, що містить заміщені 2-амінотетраліни загальної формули І за будь-яким з пп. 1-11. 18. Комплект за п. 17, де діагностичний засіб (а) вибрано з групи: (і) засіб або діагностичний комплект для визначення нейромеланіну, (іі) засіб або діагностичний комплект для визначення семафорину 3, (ііі) засіб або діагностичний комплект для визначення альфа-синуклеїну та/або його агрегатів, або (iv) засіб або діагностичний комплект для генетичного визначення мутації, асоційованої з виявом хвороби Паркінсона, та/або алелі, асоційованої з більш частими виявами хвороби Паркінсона. Хвороба Паркінсона відбувається як результат хронічної, прогресивної дегенерації нейронів, причина котрої ще не ясна. Вона клінічно виражається у формі кардинальних симптомів тремору в спокійному стані, ригідності, брадикінезії та нестабільності осанки. Первинно застосовуваними як медикаменти для полегшення моторних симптомів є леводоп, агоністи допаміну, як-то, наприклад, ротиготин, прамірекзол, бромкриптин, ропінірол, каберголін, перголід, апоморфін та лузирид, антихолінергічні засоби, антагоністи NMDA, (3-блокатори а також інгібітор MAO-B селегелін та інгібітор COMT ентакапон. Більшість цих активних речовин втручається у допамінергічний та/або холінергічний сигнальний каскад та симптоматично впливає таким чином на моторні порушення, що є звичайною хворобою Паркінсона. Терапія хвороби Паркінсона на сьогодні починається з появи кардинальних симптомів. Хвороба Паркінсона, як загалом вважають, клінічно підтверджена, якщо можна визначити принаймні два з чотирьох кардинальних симптомів (брадикінезія, тремор в спокійному стані, ригідність та нестабільність осанки) та має дію L-Допа [Hughes, J Neural Neurosurg Psychiatry 55, 1992, 181]. На жаль, однак, пацієнти з хворобою Паркінсона тільки виявляють моторне порушення тоді, коли приблизно 70 - 80% допамінергічних нейронів у чорній субстанції (SN) необоротно пошкоджені [Becker et al, J Neural 249, 2002, Suppl 3: III, 40; Homykiewicz, Encyclopaedia of Life Science 2001, 1]. Шанси терапії з тривалою дією є мінімальними у цей час. Отже потрібно починати терапію так рано, як можливо. Сучасні клінічні спостереження, а також анатомічні та генетичні дослідження зараз показали, що можливо діагнозувати пацієнтів з хворобою Паркінсона на ранній стадії та для ідентифікації пацієнтів зі збільшеним ризиком. Наступне, наприклад, можна, таким чином, застосовувати як діагностичні маркери: - Біохімічні маркери, як-то нейромеланін [Gerlach, Neurotox Res 5, 2003, 35; WO 02/31499], S100 бета [Muramatsu, Glia 42, 2003, 307], альфа синуклеїн [WO 03/069332; WO 00/02053] або паркін-білок [Sharma, Neural Clin N Am 20, 2002, 759] та семафорин [WO 03/007803]. - Генетичні маркери, як-то парк-гени 1-8 [Guttman, CMAJ 4, 2003, 168]; CYP2D6-B [WO 03/012137], хромосома 2q 36-37 [Pankratz, Am J Hum Gen 72, 2003, e-pub], α-синуклеїн [Polimeropoulos, Science. 276, 1997, 2045] або мутації у делеції CYP2D6-B та GSTM1 [WO03/012137]T* - Способи відображення, як-то ультразвукове обстеження розміру SN, можливо у комбінаці з іншими способами [Becker et al, J Neural 249,2002, Suppl 3: III, 40] або MRI (відображення магнітного резонансу) [Hutchinson M, Raff U., J Neural Neurosurg Psychiatry. 1999 Dec; 67(6): 815-8]. - Способи відображення, як-то PET (позитронна емісійна томографія) або SPECT (емісійна комп'ютерна томографія) [Prunier C, Bezard E et al, Neuroimage. 2003 July; 19(3): 810-6]. - Сенсорні розлади або анормальності поведінки, як-то розлади сну та нюху, зокрема, розлади швидкого сну типу "REM-поведінковий розлад"(поведінковий розлад при швидкому сні), [Henderson, J Neural Neurosurg Psychiatry 74, 2003, 956] або когнітивні анормальності [Rammsayer, lnt J Neurosci. 91, 1997, 45]. - Органічні проблеми, як-то обстипація [Krygowska-Wajs, Funct Neural 15, 2000, 41]. - Депресія [Camicioli R. Prodrugs Today (Bare). 2002 Oct; 38(10): 677-86]. - Короткотермінові аномалії руху, як-то хорея або ортостатичніанормальності. - Комбінації вищезазначених маркерів [Stern, Annals of Neurol 56, 2004,169]. 5 83691 Це отже створює сприятливу можливість впливу на процес хвороби у час, коли більше нейронів ще є присутніми, ніж це є у випадку появи кількох кардинальних моторних симптомів хвороби Паркінсона, а тому для захисту кількісно більшого числа нейронів. Можна очікувати, що застосування ефективного нейропротективного засобу на ранній стадії значно затримуватиме процес хвороби: Більш ранню терапію можна починати, отримуючи більші шанси довготривалого попередження появи симптомів, що знижують якість життя. Існує потреба у медикаментах, що не тільки здатні впливати на допамінергічну передачу та полегшення симптомів хвороби Паркінсона на передових стадіях, але також здатні до реверсування, попередження або принаймні значного уповільнення прогресивної деструкції допамінергічних нейронів у ранніх, значною мірою моторноасимптоматичних стадіях хвороби Паркінсона [Dawson, Nature Neuroscience Supplement 5, 2002, 1058]. Заміщені 2-амінотетраліни відомі з [US 4,564,628, US 4,885,308, US 4,722,933 та WO 01/38321]. Це речовини, що мають допамінергічну дію, котрі відомі як придатні для симптоматичного лікування хвороби Паркінсона. У клінічних дослідженнях ротиготин [(-)-5,6,7,8-тетрагідро-6[пропіл[2-(2-тієніл)етил]аміно]-1-нафтол] зокрема досліджено як ефективні трансдермально придатні проліки проти хвороби Паркінсона. [WO 02/089777] описує, наприклад, трансдермальне застосування ротиготину до пацієнтів з хворобою Паркінсона та асоційоване поліпшення показнику за шкалою UPDRS (уніфікована шкала оцінок хвороби Паркінсона). Шкала UPDRS є важливим інструментом для діагностики та моніторингу прогресування та/або терапії пацієнтів з хворобою Паркінсона [Fahn S, Elton RL, Members of UPDRS Development Committee (1987) Unified Parkinson's Disease Rating Scale (уніфікована шкала оцінок хвороби Паркінсона). У: Fahn, S, CD Marsden, DB Calne, M Goldstein (eds) Recent Developments in Parkinson's Disease. Vol.II. Macmillan Healthcare Information, Florham Park (NT), pages 153-163, 293304]. Однак, шкала UPDRS тільки реєструє дію активної речовини на симптоми хвороби Паркінсона. Це не дозволяє робити будь-яких заяв, стосовно того чи має активна речовина вплив на деструкцію допамінергічних клітин, котрі лежать в основі симптомів. Metman et al [Clin Neuropharmacol 24, 2001, 163] також описують дію ротиготину на моторні порушення, асоційовані з хворобою Паркінсона. Ліковані пацієнти вже мали чітку дискінезію, котру поліпшували застосуванням ротиготину. Отже, заміщені 2-амінотетраліни, зокрема, ротиготин, відомі у рівні техніки як агоніст допаміну для симптоматичного лікування хвороби Паркінсона. Однак, медикаменти для цього, що мають тільки дію на симптоми не обіцяють будь-яких переваг стосовно випереджувального лікування хвороби Паркінсона, оскільки вони не мають будь-якого впливу на деструкцію допамінергічних клітин або на прогресування та/або появу хвороби. 6 Експериментальні тести зараз несподівано показали, що заміщені 2-амінотетраліни загальної формули І де n=1 - 5; R2 - OA; R3 та R4, кожний незалежно, вибрані з групи: H та OA; з А, вибраним з групи: H, алкіл, алкоксиметил або група де R6 та R7, кожний незалежно, - алкіл, зокрема, С1-20алкіл, а особливо краще С1-6алкіл, або арил, зокрема, як варіант, заміщений феніл; R5 - С1-3алкіл; R1 вибрано з групи: гідроген, 3-піридил, 4піридил, як варіант, заміщений феніл, де X вибрано з групи: S, O або NH; де сполука формули І може бути рацематом або чистим (R)- або (S)-енантіомером, а також фізіологічно прийнятними солями цих сполук, котрі до цього часу тільки застосовували для симптоматичної терапії хвороби Паркінсона, мають нейропротективні властивості та їх можна отже застосовувати як медикамент та/або профілактичний засіб для попередження втрати допамінергічних клітин зокрема, у дуже ранніх стадіях хвороби Паркінсона або у пацієнтів зі збільшеним ризиком. Фіг.1 показує репрезентативні приклади нейропротективної дії ротиготину, виміряної на базі густини транспортерів допаміну як показання густини того, нервових закінчень, що залишилися у стріатумі. Групи 1 - 7 лікували так: Група 1: нелікована контрольна група; Група 2: контрольна група, лікована носієм для ротиготину та MPTP; Група 3: лікування MPTP; Група 4: лікування MPTP плюс ротиготин 0,3мг/кг; Група 5: лікування MPTP плюс ротиготин 1,0мг/кг; Група 6: лікування MPTP плюс ротиготин 3,0мг/кг; Група 7: лікування виключно ротиготином (3,0мг/кг). Фіг.2 показує зв'язування транспортеру допаміну (DAT) у дорсальній та вентральній частині стріатуму у різних групах виміром густини DAT згідно з експериментом, показаним у Фіг.1. Гістограми 1 - 7 відповідають групам 1 - 7, показаним у Фіг.1. Групи, помічені *, показували значне падіння зв'язування DAT у порівнянні з контрольною групою 2. Групи, помічені #, показували значний виграш зв'язування DAT у порівнянні з МРТРлікованою групою 3. Процеси апоптозу, як припускають, грають важливу роль у деструкції допамінергічних нейронів у патогенезі хвороби Паркінсона [Barzilai, Cell Моl 7 83691 Neurobiol 21, 2001, 215]. Нейропротективні речовини, що можуть зупинити або навіть реверсувати деструкцію допамінергічних клітин є тому потрібними. МРТР-модель таким чином, можна вважати, є прогнозувальною стосовно необхідних нейропротективних характеристик [Dawson, Nature Neuroscience Supplement 5, 2002, 1058]. Ротиготин несподівано показує потрібний фармакологічний профіль як у гострій, так і підгострій МРТР-моделі. Тест-результати свідчать, що процеси апоптозу попереджуються ротиготином. 2-амінотетраліни згідно з винаходом, зокрема, ротиготин, таким чином виявляють нейропротективну дію у мишачій моделі хвороби Паркінсона: 8 Після гострого застосування MPTP, котре викликає синдром Паркінсона у людей та мавп, число дегенеруючих нейронів у гострій фазі вимірювали з одного боку (Таблиця 1), а функціональну цілісність стріатуму у підгострій фазі оцінювали з іншого визначенням густин транспортеру допаміну у термінальних нервових закінченнях (Фіг.Фіг.1 та 2). Це можна було б продемонструвати в обох випадках, що ротиготин мав нейропротективну дію: 3 одного боку, число дегенеруючих нейронів у мезенцефалоні зменшувалося після застосування ротиготину та з іншого боку, допамінергічна іннервація стріатуму була майже повністю відновленою або збереженою. Таблиця 1 Число дегенеруючих нейронів у миші, показане фарбуванням флуор-зеленим Група 1: Лікована носієм контрольна група 2: MPTP інтоксикація 3: MPTP інтоксикація +ротиготин 0,3мг/кг 4: MPTP інтоксикація +ротиготин 1,0мг/кг 5: MPTP інтоксикація +ротиготин 3,0мг/кг 5: MPTP -носій +ротиготин 3,0мг/кг Число дегенеруючих нейронів 2.0 73,5 66,7 76,8 34.9 3,8 У пілотному дослідженні нейропротективну дію ротиготину на мавп визначали також. У застосовуваній моделі, котра відбиває прогресивний курс хвороби Паркінсона у приматів, мавп (макак) ін'єктували підпороговими токсичними дозами MPTP протягом кількох діб. Симптоми Паркінсона виявлялися у моделі протягом приблизно 2 тижнів. Як тільки було досягнуто певний рівень пошкодження, ротиготин щодобово ін'єктували у композиції, що дало постійний рівень у плазмі протягом 24 годин. Ін'єкції MPTP припиняли як тільки моторна активність зменшилася до певного ступеню (приблизно 5 діб пізніше). Поведінку тварин визначали на добовій основі. Шість тижні після початку MPTP застосування, ротиготин ін'єкції припиняли та тварин спостерігали протягом наступних двох тижнів без лікування. Спостерігали, що моторна активність тварин чітко поліпшувалася протягом лікування та також у наступній фазі кліренсу. Групу тварин вбивали у кінці застосування ротиготину та фази кліренсу, та стан базальних ганглій визначали гістологічно та біохімічно. Густина нервових закінчень у стріатумі значно збільшилася у порівнянні з нелікованими тваринами. Вміст препроенкефаліну, котрий є індикатором непошкодженого внутрішньоклітинного каркасу у "непрямому шляху обміну" базальних ганглій, показав тенденцію у напрямі нормалізації після лікування та фази кліренсу. Результати показали, що нейропротективний потенціал ротиготину може також бути доказаним у приматній моделі хвороби Паркінсона. Нейропротективну дію можна тому також очікувати у людей. Отже, з ротиготином та структурно спорідненими заміщеними 2-амінотетралінами загальної формули І, активні речовини були запропоновані Стандартне відхилення 2.4 34,0 30,5 41,6 31.9 4,3 для терапії, котра є ідеально придатною для виробництва медикаментів та/або профілактичних засобів для попередження втрати допамінергічних нейронів. Об'єктом цієї заявки є тому застосування заміщених 2-амінотетралінів загальної формули І, котру надано нижче, а також, зокрема, ротиготину, для вироблення медикаменту для лікування або попередження втрати допамінергічних нейронів у пацієнтів, які страждають від нейродегенеративних хвороб, що асоційовані зі збільшеною деструкцією допамінергічних клітин або у пацієнтів, що мають збільшений ризик посиленої деструкції допамінергічних клітин. Збільшена втрата допамінергічних нейронів постійно відбувається у пацієнтів з хворобою Паркінсона, однак, це також часто спостерігають у інших нейродегенеративних хворобах, наприклад, у альфа-синуклеопатіях або у хворобі Гентингтона а також у порушеннях швидкого сну та розладах нюху. У порівнянні з сучасним застосуванням амінотетралінів формули І, зокрема, ротиготину, котре було обмежено виключно симптоматичним лікуванням пацієнтів з симптомами Паркінсона з моторними порушеннями, профілактичне лікування індивідів, виявляючих менше двох кардинальних симптомів хвороби Паркінсона, хто отже потребує нейропротективної профілактичної терапії скоріше, ніж симптоматичної терапії, виявлено як нова область застосування. Як вже описано вище, такі індивіди мають користь, зокрема, від нейропротективної дії ротиготину, оскільки завдяки застосуванню ротиготину припиняється втрата допамінергічних клітин, коли ще є присутнім вище число допамінергічних нейронів, ніж у випадку пацієнтів, вже виявляючих моторні симптоми. 9 83691 Об'єктом винаходу є тому застосування заміщених 2-амінотетралінів загальної формули І де n=1 - 5; R2 - OA; R3 та R4, кожний незалежно, вибрані з групи: H та OA; з А, вибраним з групи: H, алкіл, алкоксиметил або група де R6 та R7, кожний незалежно, - алкіл, зокрема, С1-20алкіл, а особливо краще С1-6алкіл, або арил, зокрема, як варіант, заміщений феніл; R5 - С1-3алкіл; R1 вибрано з групи: гідроген, 3-піридил, 4піридил, як варіант, заміщений феніл, де X вибрано з групи: S, O або NH; де сполука формули І може бути рацематом або чистим (R)- або (S)-енантіомером, а також фізіологічно прийнятних солей цих сполук, для випереджувального лікування хвороби Паркінсона, зокрема, для попередження втрати допамінергічних клітин у індивідів, у яких перед початком випереджувального лікування, принаймні три з чотирьох кардинальних симптомів з групи: брадикінезія, ригідність, тремор в спокійному стані та нестабільність осанки ще відсутні або є тільки зародковими або частково присутніми. Сполуки, що особливо придатні для вироблення нейропротективного засобу або профілактичного засобу для хвороби Паркінсона є сполуками, у котрих R2 - група OA, a R3 та R4, незалежно, - H або група OA, особливо краще, коли А - атом гідрогену або група у котрій R6 - С1-20алкіл, зокрема, С1-12алкіл або С1-6алкіл, феніл або метоксифеніл. У ще одному кращому втіленні винаходу R4 H. У ще одному кращому втіленні винаходу R3 H. У ще одному кращому втіленні винаходу R3 та R4 - H. У ще одному кращому втіленні винаходу n=1, 2 або 3, зокрема, n= 2 або 3. R1 переважно вибрано з групи: H де X вибрано з групи: S, O та NH, а особливо краще, коли X - а том сульфур у. Особливо краще, коли R1 - 2-тієніл. У наступному кращому втіленні винаходу, R5 С3-алкіл, зокрема, н-пропіл. 10 У наступному кращому втіленні винаходу, R1 2-тієніл, R3 та R4 – H, R5 – С3алкіл, а n=2. В особливо кращому втіленні винаходу, рацемат (+/-)-5,6,7,8-тетрагідро-6-[пропіл[2-(2тієніл)етил]аміно]-1 -нафтолу, а особливо краще чистий S-енантіомер цієї сполуки (ротиготин), застосовують для вироблення профілактичного засобу для хвороби Паркінсона. Терміни "С1-20алкіл", "С1-12алкіл" та "С13алкіл", кожний, слід розуміти як алкіли з лінійним чи розгалуженим ланцюгом з відповідним числом атомів C. Наприклад, "С1-20 алкіл" охоплює усі алкіли з 1 - 20 атомів C. Алкіли можуть бути, як варіант, заміщеними, наприклад, галогеном. Алкіли переважно присутні у незаміщеній формі. Термін "алкоксиметил" слід розуміти як групу СН2-О-алкіл. Кращий алкіл - С1-12алкіл, С1-6алкіл або С1-3алкіл. Індивіди, яких слід профілактично лікувати заміщеними 2-амінотетралінами, можуть бути припустимо здоровими індивідами, чия генетична або епідемічна схильність може не показувати збільшеного ризику розвитку хвороби Паркінсона. Зокрема, індивідів зі збільшеним ризиком або пацієнти, у яких можна визначати ранні клінічні, клінічні/хімічні або клінічні/фізичні симптоми, але які, однак, не виявляють ще дво х або більше кардинальних симптомів хвороби Паркінсона, беруть до уваги для лікування заміщеними 2амінотетралінами, зокрема, ротиготином. Під кінець, 2-амінотетраліни, зокрема, ротиготин, можуть також бути застосовуваними як нейропротективний засіб якщо діагноз не є чітким, але можна очікувати розвитку симптомів у напрямі Паркінсоно-подібної нейродегенерації. Попередження втрати нейронних клітин є необхідним зокрема, для (a) індивідів зі збільшеним ризиком хвороби Паркінсона або (b) індивідів з ранніми симптомами хвороби Паркінсона. Термін "хвороба Паркінсона" у цій патентній заявці охоплює ідіопатичну та генетичну хворобу Паркінсона. Так званий синдром Паркінсон-Плюс а також вторинний паркінсонізм є диференційованим звідси. Термін "кардинальні симптоми" хвороби Паркінсона спід розуміти у цій патентній заявці як один або більше симптомів брадикінезії, ригідності, тремору в спокійному стані та нестабільності осанки. "Індивідів зі збільшеним ризиком хвороби Паркінсона" слід розуміти у цій патентній заявці зокрема, як індивідів, які ще не виявляють будь-яких визначуваних симптомів хвороби Паркінсона, але мають певні фактори ризику. Такими факторами ризику можуть бути генетичні мутації [Nussbaum NEJM 348, 2003, 25]. Наприклад, паркінген на хромосомі 6q25,2-27 (PARK2) асоційований з ювенільним паркінсонізмом та відбувається більше часто у родинах з автосомною рецесивною спадковістю до паркінсонізму [Matsumine, Am. J. Hum. Genet., 60, 1997, 588; Kitada, Nature 392, 1998, 605; Abbas, Hum. Моl. 11 83691 12 Genet. 8, 1999, 567; Tassin, Am. J. Hum. Genet., 63,1998, 88 und Lucking, N. Engl. J. Med. 342, 2000, 1560-7]. Інші генні локуси, наприклад, PARK6 та PARK7, були також виявлені зі збільшеною частотою у родинах з ювенільною, рецесивноспадковою хворобою Паркінсона [Valente, Am. J. Hum. Genet. 68, 2001, 895; van Dujin, Am. J. Hum. Genet. 69, 2001, 629]. Мутації у альфасинуклеїновому гені (PARK1) визначали у родинах з ювенільною, автосомною домінантно-спадковою хворобою Паркінсона [Polimeropoulos, Science 276, 1997, 2045]. На додаток до генетичної схильності, впливи зовнішнього середовища, як-то високий вплив, наприклад, інсектицидів [Vanacore, Neurol ScL, Sep; 23 Suppl 2, 2002, page 119] може також бути фактори ризику. У цій патентній заявці, "індивідів з ранніми симптомами хвороби Паркінсона" слід розуміти, зокрема, як індивідів, у яких принаймні три з чотирьох кардинальних симптомів (ригідність, тремор в спокійному стані, брадикінезія та нестабільність осанки) відсутні або є тільки зародковими або частково присутніми, але які виявляють діагностично придатні ранні клінічні, клінічні/біохімічні та/або клінічні/фізичні симптоми. Клінічні/біохімічні маркери можуть бути модифікаціями у альфа синуклеїновій або нейромеланіновій системі. Такі модифікації можуть бути обумовленими, наприклад, експресією генетичних варіантів, наприклад, альфа синуклеїну, розвитком агрегатів чи волокон, наприклад, альфа синуклеїну, або збільшеним вивільненням з целюлярних резервів, наприклад, з цитоплазми клітин, що р уйнуються, як у випадку з нейромеланіном. Ранні клінічні/фізичні симптоми можуть бути структурними або функціональними змінами мозку, котрі можна фізично визначати, наприклад, засобами PET та SPECT, досліджень засобами транскраніальної сонографії [Becker, J Neurol 249, Suppl 3, 2002,111/40; Prunier C, et al, Neuroimage. 2003 JuI; 19(3): 810-6] або визначенням біохімічних маркерів, як-то нейромеланіну [WO 02/31499]. Ранніми клінічними симптомами можуть бути розлади нюху, депресія, порушення візуальних та когнітивних функцій або розлади сну, завдяки чому комбінацію відмінних тестів можна також застосовувати для раннього діагнозу [Becker, J Neurol 249, Suppl 3, 2002,111/40; Stern, Annals of Neurol 56, 2004,169]. Як вже обговорено вище, приблизно 70 - 80% допамінергічних нейронів чорної субстанції вже зруйновані на час, коли принаймні два з чотирьох кардинальних симптомів самі виражені вперше. Для ефективного застосування несподіваного нейропротек-тивного потенціалу амінотетралінів формули І, зокрема, ротиготину, профілактичне лікування пацієнтів тому переважно починають на стадії, коли пацієнти мають нижчу втрату допамінергічних клітин чорної субстанції (SN). Індивіди, виявляючі один або не виявляючі жодного з кардинальних симптомів хвороби Паркінсона у чіткій формі є тому лікованими переважно. Індивіди, виявляючі втрату допамінергічних клітин у SN менше 70%, 60%, 50% та особливо краще менше 40%, 30%, 20% або 10% є лікованими переважно. Два показника можна застосовувати як допоміжні засоби для діагностики та контролю терапії пацієнтів, вже виявляючих помітні моторні порушення, тобто шкала UPDRS та шкала Hoehn та Yahr. Згідно з кращим аспектом винаходу, гр упа пацієнтів профілактично лікованих амінотетралінами формули І, зокрема, ротиготином, крім того має модифікований показник Hoehn та Yahr 0-2, особливо краще 0-1 та найкраще 0. Пацієнтів з показником за шкалою UPDRS, частина III (дивись втілення 5), принаймні 10 звичайно класифікують як пацієнтів, яких можна піддавати допамінергічній терапії. Однак, група пацієнтів, придатних для отримання користі від нейропротективної дії заміщених 2-амінотетралінів формули І, зокрема, ротиготину, переважно має дуже низький або невизначуваний моторний показник UPDRS (частин III). B межах сенсу заявленого винаходу, випереджувальне лікування заміщеними 2амінотетралінами формули І, зокрема, ротиготином, слід тому переважно проводити на пацієнтах, 13 83691 що мають моторний показник UPDRS менше 10, 9, 8, 7, 6, 5, 4, 3, 2 або 1. Особливо краще, коли пацієнти досі не виявляли будь-яких моторних порушень. Терміни "попередження", "профілактика" та "випереджувальне лікування" застосовано як синоніми у цій патентній заявці. Вони охоплюють, зокрема, застосування медикаменту до індивідів, у яких принаймні три з чотирьох кардинальних симптомів хвороби Паркінсона (ригідність, тремор в спокійному стані, брадикінезія, нестабільність осанки), відсутні або є тільки зародковими або частково присутніми, для попередження або затримки вияву або значного розвитку моторних симптомів хвороби Паркінсона та/або наступної втрати допамінергічних нейронів, особливо у чорній субстанції. Індивіди, яких слід профілактично лікувати, переважно ще не виявляють будь-яких кардинальних симптомів у чіткій формі. Сполуки формули І є оптично активними та можуть бути рацематами або як чистими (R)- або (S)-енантіомерами. У цій патентній заявці, термін "чистий енантіомер" означає, що речовина переважно присутня принаймні на 90мол.% у формі одного енан-тіомеру, наприклад, у (S) формі, вміст відповідного іншого енантіомер, наприклад, (R) форми, є відповідно низьким. Якщо, наприклад, ротиготин [(-)-5,6,7,8-тетрагідро-6-[пропіл[2-(2тієніл)етил]аміно]-1-нафтол] застосовують для виробництва медикаментів згідно з винаходом, вміст (R)-(+)-енантіомеру переважно менше 10мол.%, особливо краще менше 2мол.% та найкраще менше 1%, на основі загально кількості ротиготину у профілактичному засобі для хвороби Паркінсона. Сполуки формули І можуть бути присутні у медикаменті як вільні основи або у формі фізіологічно прийнятних солей, наприклад, у формі ротиготин гідрохлориду. "Фізіологічно прийнятні солі" охоплюють нетоксичні адитивні солі сполуки формули (І) у формі вільної основи, з органічними або неорганічними кислотами. Приклади неорганічних кислот охоплюють HCI. Є багато способів, придатних для застосування заміщених 2-амінотетралінів формули І, зокрема, ротиготину, котрі фахівець може вибирати та пристосовувати залежно від потреби, стану та віку пацієнта, необхідного дозування та потрібного інтервалу застосування. Кращим режимом застосування заміщених 2амінотетралінів формули І, зокрема, ротиготину, є трансдермальне застосування. Форму застосування можна вибрати, наприклад, з мазей паст, спреїв, плівок, пластирів або пристроїв для іонофорезу. Заміщені 2-амінотетраліни формули І, зокрема, ротиготин, переважно наносять на шкіру пацієнта у формі пластиру, з активною речовиною переважно у матриці клейкого полімеру, наприклад напів-клейкого полісилоксану. Приклади придатних трансдермальних композицій можуть бути виявленими у [WO 99/49852, WO 02/89777 та WO 02/89778]. Така форма застосування дає змогу підтримувати постійний рівень у плазмі, а тому 14 підтримувати постійну допамінергічну стимуляцію протягом усього інтервалу застосування [WO 02/89778; Metman, Clinical Neuropharmacol. 24, 2001, 163]. Якщо, з іншого боку, є потрібним медикамент у формі підшкірного або внутрішньом'язового депо, заміщені 2-амінотетраліни формули І, зокрема, ротиготин, можна суспендувати, наприклад, як кристали солі, наприклад як кристалічний ротиготин гідрохлорид, у гідрофобному безводному середовищі та ін'єктувати, як описано у [WO 02/15903], або застосовувати у формі мікрокапсул, мікрочастинок або імплантатів на основі біорозщеплюваних полімерів, як-то описаних, наприклад, у [WO 02/38646]. Інші можливі форми застосування заміщених 2-амінотетралінів формули І, зокрема, ротиготину, охоплюють транслизові композиції, наприклад, під'язичні спреї, ректальні композиції або аерозолі для застосування до легень. Придатне дозування заміщених 2амінотетралінів формули І, зокрема, ротиготину, є між 0,05 та приблизно 50мг/доб, з добовими дозами переважно між 0,1 та 40мг, а зокрема, застосовуваними між 0,2 та 20мг/доб. Дозування може таким чином мати місце з поступовим збільшенням дози, тобто лікування можна, як варіант, починати з низької дози, котру тоді збільшують до досягнення потрібної дози. Фахівцям зрозуміло, що інтервал дозування може бути різним залежно від застосовуваної кількості, режиму застосування та добової потреби пацієнта. Отже, трансдермальна форма застосування може бути призначена, наприклад, для застосування тоді, раз на добу, кожні три доби або кожні сім діб, а підшкірне внутрішньом'язове депо може дати можливість застосування ін'єкції, наприклад, в однотижневому, двотижневому або чотиритижневому циклах. Інші активні речовини, котрі попереджують прогресування втрати допамінергічних клітин можуть також бути присутні у нейропротективному медикаменті на додаток до заміщених 2амінотетралінів формули І, зокрема, на додаток до ротиготину. Прикладами є речовини з дією проти апоптозу (міноциклін, FK-506, циклоспорин А, zVAD) а також нейротропіни, як-то, наприклад, похідний від гліальних клітин нейротропний фактор (GDNF). У комбінованому препараті послідовного застосування можна досягти, наприклад, у такій формі застосування як, наприклад, пероральна таблетка, що має два відмінні шари з відмінними профілями вивільнення для відмінних фармацевтично активних інгредієнтів. Фахівцям зрозуміло, що відмінні форми застосування та режими застосування є можливими в межах контексту заявленого винаходу, усі ці форми утворюють об'єкт винаходу. Наступним об'єктом є комплект для раннього діагнозу та лікування хвороби Паркінсона. Такий комплект містить (а) діагностичний засіб, що робить можливим діагноз хвороби Паркінсона та/або схильність, для виявлення хвороби Паркінсона на ранньому або асимптематичному етапі, а також (b) 15 83691 фармацевтичну композицію, що містить заміщені 2-амінотетраліни загальної формули І, зокрема, ротиготин. Такий комплект може містити, наприклад,: (a) засіб або діагностичний комплект для визначення нейромеланіну, (b) фармацевтичну композицію, що містить заміщені 2-амінотетраліни загальної формули І, зокрема, ротиготин. У ще одному втіленні винаходу, комплект може містити: (a) засіб або діагностичний комплект для визначення семафорину З, (b) фармацевтичну композицію, що містить заміщені 2-амінотетраліни загальної формули І, зокрема, ротиготин. У ще одному втіленні винаходу, комплект може містити: (c) засіб або діагностичний комплект для визначення альфа-синукпеїну та/або його агрегатів, (d) фармацевтичну композицію, що містить заміщені 2-амінотетраліни загальної формули І, зокрема, ротиготин. У наступному втіленні винаходу, комплект може містити: (a) засіб або діагностичний комплект для генетичного визначення мутації, асоційованої з виявом хвороби Паркінсона та/або алелі, асоційованої з більше частими виявами хвороби Паркінсона, зокрема, з групи ПАРК-генів 1, 2, 3,4, 5, 6, 7 або 8 а також генних локусів C YP2D6-B та GSTM1, (b) фармацевтичну композицію, що містить заміщені 2-амінотетраліни загальної формули І, зокрема, ротиготин. Втілення: Втілення 1: Пластир з ротиготином 1,8г ротиготину (вільну основу) розчиняли у 2,4г етанолу та додавали до 0,4г Kollidon 90F (розчиненого у 1г етанолу). Це суміш додавали до 74% розчину силіконових полімерів (8,9г BioPSA 74201+8,9г BIO-PSA 7-4301 [Dow Corning]) у гептані. Після додавання 2,65г петролейного етеру, суміш перемішували протягом 1 години при 700об./хв. для отримання гомогенної дисперсії. Після ламінування на поліестер, це сушили при 50°C. Кінцева маса пластиру була 50г/см 2. Втілення 2: Суспензії депо ротиготину (a) 1411,2г Miglyol 812 зважували у колбі Дюрана. 14,4г Imwitor 312 додавали до Miglyol та тоді нагрівали протягом 30 хвилин до 80°C при перемішуванні. Прозорий розчин охолоджували до кімнатної температури та фільтрували. (b) 1188г розчину, отриманого у (а), переносили у скляний лабораторний реактор, додавали 12г N-0923 та гомогенізували протягом 10 хвилин під азотом з Ultraturrax при 10000об./хв. Суспензію декантували у коричневі скляні флакони з обробкою на Ultraturrax (2000об./хв.). Втілення 3: Підгостра МРТР-модель Для інтоксикації 80мг/кг нейротоксину 1-метил4-феніл-1,2,3,6-тетрагідро-піридин (MPTP) застосовували до мишей (у дозах 20мг/кг з інтервалами 2 години, групам 3 - 6 у Фіг.Фіг.1 та 2), що призводило до дегенерації приблизно 50 - 60% нейронів чорної субстанції (максимум дегенерації у групі 3 у 16 Фіг.Фіг.1 та 2). Ротиготин застосовували щодобово протягом 7 діб у дозах 0,3,1 або 3мг/кг відповідно як так звану "композицію з уповільненим вивільненням" (дивись втілення 2) (групи 4 - 6 у Фіг.Фіг.1 та 2). Групі оброблених MPTP тварин (група 3) давали носій ротиготину (дивись втілення 2 без ротиготину HCI) для контролю. Групи 1, 2 та 7 теж були контрольними, завдяки чому група 1 не одержувала будь-якої обробки, групу 2 обробляли носієм для MPTP та ротиготином, а група 7 одержувала виключно ротиготин. Тварин вбивали на добу 8 та їх мозки видаляли та заморожували. Заморожені зрізи інкубували з 100пм [125 I] РЕ2І ([125I]-(E)-N(3-йодпроп-2-еніл)-2β-карбоксиметил3β-(4'-метилфеніл)-нортропан) у фосфатному буфері з рН7,4, для визначення кількості транспортерів допаміну ще присутніх у стріатумі, що показує чисельність функціонування нервових закінчень. Ротиготин поліпшував виживання нейронів та їх нервових закінчень залежно від дозування. Це є чітким показання нейропротективних властивостей речовини (Фіг.Фіг.1 та 2). Втілення 4: Гостра МРТР-модель (охоплюючи апоптоз) Для інтоксикації 80мг/кг нейротоксину 1-метил4-феніл-1,2,3,6-тетрагідро-піридин (MPTP) застосовували до мишей (у дозах 20мг/кг з інтервалами 2 години), що призводило до дегенерації приблизно 50 - 60% нейронів чорної субстанції. Приблизно за 16 годин застосовували ротиготин у дозах 0,3, 1 або 3мг/кг відповідно, як так звану "композицію з уповільненим вивільненням". Затримка дифузії та поглинання призводила до оптимальної придатності ротиготину тоді, коли застосовували MPTP. Тварин вбивали після 24 годин та їх мозки фіксували. Зрізи мозку фарбували флуор-зеленим для ідентифікації дегенеруючих клітини. Імуногістохімічні показники тирозин-гідроксилази допомагали ідентифікації допамінергічних нейронів. Фарбування тирозин-гідроксилазою не виявляло будь-яких відмінностей між лікованими та нелікованими тваринами; фарбовані флуор-зеленим показали велике число дегенеруючих нейронів; нейрони, однак, не були повністю видаленими; це свідчить, що деструкція клітин відбувається за механізмом апоптозу. Число дегенеруючих нейронів було приблизно на 50% менше після застосування ротиготину, що далі демонструє нейропротективні властивості речовини (Таблиця 1). Втілення 5: Визначення моторного показнику UPDRS Моторний показник UPDRS (частина III шкали UPDRS) визначають дослідженням пацієнта, застосовуючи критерії 18 - 31, які надано нижче у Таблиці 2, з показниками для кожного з критеріїв доданих відповідно разом. Таблиця 2: III. Моторне обстеження 18. Мовна діяльність: 0 - Нормальна. 1 - Слабка втрата виразу, дикції та/або голосності. 2 - Монотонна, невиразна але ясна; помірно порушена. 3 - Помітно порушена, важка для розуміння. 17 83691 4 - незрозуміла. 19. Вираз обличчя: 0 - Нормальний. 1 - Мінімальна гіпомімія, могла б бути нормальною" безпристрасною". 2 - Слабке але явно анормальне зниження виразу обличчя. 3 - Помірна гіпомімія; губи розділені деякий час. 4 - Фіксоване обличчя з суворою або повною втратою виразу; губи розділені на 7мм. 20. Тремор при відпочинку: (F= обличчя, RH= права рука, LH= ліва рука, RF= права нога, LF= ліва нога) F RH LH RF LF 0 - відсутні. 1 - Слабкі та рідко наявні. 2 - М'які за амплітудою та стійкі; або помірні за амплітудою, але тільки періодично присутні. 3 - Помірні за амплітудою та присутні більшість часу. 4 - Помітні за амплітудою та присутні більшість часу. 21. Дія або постуральний тремор рук: (R= права, L= ліва) RL 0 - відсутні. 1 - Слабкі; наявні з дією. 2 - Помірні за амплітудою, наявні з дією. 3 - Помірні за амплітудою, наявні з утриманням пози а також дією. 4 - Помітні за амплітудою; перешкоджають харчуванню. 22. Ригідність: (Оцінено за пасивним рухом головних суглобів пацієнта у позиції сидячи. Симптом зубчатого колеса можна ігнорувати). (N= шия, RUE= права верхня кінцівка, LUE= ліва верхня кінцівка, RLE= права нижча кінцівка, LLE= ліва нижча кінцівка). N RUE LUE RLE LLE 0 - відсутня. 1 - Слабка або визначувана тільки, при активації дзеркально відображеним або іншими рухами. 2 - Вид м'якої до помірної. 3 - Помітна, але повні межі рухомості ще доступні. 4 - Сувора, важкість здійснення усіх рухів. 23. Поплескування пальцями: (Пацієнт поплескує великим пальцем проти вказівного пальця у швидкій послідовності з максимумом можливої амплітуди та окремо кожною рукою). (R= права, L= ліва). RL 0 - Нормальне. 1 - Слабке уповільнення та/або зменшення амплітуди. 2 - Помірно обмежене. Виразна та передчасна втома. Рух може іноді бути переривчастим. 3 - Суворо обмежене. Затриманий початок рухів або переривчастість постійних рухів. 4 - Може лише виконувати завдання. 18 24. Рухи рук: (Пацієнт відкриває та закриває руки у швидкій послідовності з найбільш можливою амплітудою та окремо з кожною рукою). (R= права, L= ліва). RL 0 - Нормальні. 1 - Слабке уповільнення та/або зменшення амплітуди. 2 - Помірно обмежені. Виразна та передчасна втома. Рух може іноді бути переривчастим. 3 - С уворо обмежені. Затриманий початок рухів або переривчастість постійних рухів. 4 - Може лише виконувати завдання. 25. Швидке чергування рухів р ук: (пронація/супінація рухів р ук, вертикально або горизонтально, з найбільшою можливою амплітудою , обома руками одночасно). RL 0 - Нормальне. 1 - Слабке уповільнення та/або зменшення амплітуди. 2 - Помірно обмежене. Виразна та передчасна втома. Рух може іноді бути переривчастим. 3 - Суворо обмежене. Затриманий початок рухів або переривчастість постійних рухів. 4 - Може лише виконувати завдання. 26. Рухомість ніг: (Пацієнт поплескує п'ятою по землі у швидкій послідовності, таким чином піднімаючи усю ногу. Амплітуда повинна бути принаймні 7,5см). RL 0 - Нормальна. 1 - Слабке уповільнення та/або зменшення амплітуди. 2 - Помірно обмежена. Виразна та передчасна втома. Рух може іноді бути переривчастим. 3 - Суворо обмежена. Затриманий початок рухів або переривчастість постійних рухів 4 - Може лише виконувати завдання. 27. Уставання з крісла: (Пацієнт намагається піднятися з дерев'яного або металевого крісла з прямою спинкою з руками упоперек грудної клітини). 0 - Нормальне. 1 - Повільне; може потребувати більше одної спроби. 2 - Штовхається самостійно, застосовуючи руки до сидіння. 3 - Має тенденцію падати назад та може можливо робити кілька спроб, але може піднятися без допомоги. 4 - Нездатність піднятися без допомоги. 28. Осанка: 0 - Нормальна вертикальна. 1 - Не зовсім вертикальна, слабко згорблена осанка; могла б бути нормальною для старих осіб. 2 - Помірно згорблена осанка, явно ненормальна; може бути слабко схиленою до одного боку. 3 - Суворо згорблена осанка з кифозом; може бути помірно схиленою до одного боку. 4 - Помітна зігнутість з надзвичайно ненормальною осанкою. 19 83691 29. Хода: 0 - Нормальна. 1 - Ходить повільно, може човгати протягом коротких етапів, але не дрібочуча або пропульсивна. 2 - Ходить з трудом, але невеликої допомоги чи не потребує; можливо слабка дрібочуча або пропульсивна, протягом коротких етапів, або пропульсивна. 3 - Суворе порушення ходи, потребує допомоги. 4 - Не може ходити зовсім, навіть з допомогою. 30. Стабільність осанки: (Реакція на несподіване зворотне переміщення, викликане штовханням плечей пацієнта, коли пацієнт є вертикальним та має очі відкритими та ноги слабко розведені. Пацієнта підготовлено.) 0 - Нормальна. 1 - Ретропульсія, але повертає без сторонньої допомоги. 2 - Нема постуральної реакції; міг би впасти якщо не впійманий дослідником. 3 - Дуже нестабільна, має тенденцію до спонтанної втрати балансу. 4 - Нездатність до стояння без допомоги. 31. Брадикінезія та гіпокінезія тіла: (Комбінація повільності, нерішучості, зниженого змаху рук, малої амплітуди р уху та убогості руху взагалі.) Комп’ютерна в ерстка Т. Чепелев а 20 0 - Нема. 1 - Мінімальне уповільнення, рух є навмисним; міг би бути нормальним для деяких осіб. Можлива зменшена амплітуда. 2- Слабке уповільнення та убогість руху, котрий є чітко ненормальним. Альтернативно також зменшена амплітуд. 3 - Помірне уповільнення та убогість р уху або зменшення амплітуди. 4 - Помітне уповільнення та убогість руху або зменшення амплітуди. Втілення 6: In vitro перетворення пролінів в активну речовину Фракцію мікросом, що містить основні метаболізуючі ферменти, отримують з гомогенатів клітин печінки людини, мавпи, собаки, щура або миші засобами диференційного центрифугування; цитоплазматичну фракцію можна альтернативно отримувати також. Субцелюлярну фракцію суспендують з буфером так, щоб отримати розчин для визначення вмісту білку. Після додавання 1мкМ проліків, що тестують, інкубацію проводять при 370C протягом 60 хвилин. Ротиготин тоді визначають засобами ВЕРХ/УФ або також засобами ВЕРХ/МС та співвідносять із застосовуваними кількостями. Концентрацію або часові серії визначають для детальних аналізів. Підписне Тираж 28 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюUse of substituted 2-aminotetralines for the preventative treatment of parkinson's disease
Автори англійськоюScheller Dieter, Dressen Frank
Назва патенту російськоюПрименение замещенных 2-аминотетралинов для упреждающего лечения болезни паркинсона
Автори російськоюШеллер Дитер, Дрессен Франк
МПК / Мітки
МПК: A61K 31/381, A61P 25/16
Мітки: паркінсона, 2-амінотетралінів, лікування, хвороби, заміщених, застосування, випереджувального
Код посилання
<a href="https://ua.patents.su/10-83691-zastosuvannya-zamishhenikh-2-aminotetraliniv-dlya-viperedzhuvalnogo-likuvannya-khvorobi-parkinsona.html" target="_blank" rel="follow" title="База патентів України">Застосування заміщених 2-амінотетралінів для випереджувального лікування хвороби паркінсона</a>
Попередній патент: Контейнерний пристрій для зберігання небезпечного матеріалу та спосіб його виготовлення
Наступний патент: Карданний вал
Випадковий патент: Карбофункціональні борвмісні олігоестероспирти як пластифікатори епоксидних композицій












